PATOLOJİ
“Pathos=hastalık” ve “logos=bilim”
Patolojiye göre sağlık; hücre veya
organizmanın ortam şartlarına göre
yapısal ve fonksiyonel değişime
uğrayabilmesi
Hastalık;
Konjenital veya akkiz
Nedeni bilinen ya da bilinmeyen
Bir ya da birçok etkenle oluşan
Organ, doku, hücre düzeyinde normal yapıyı
bozan
Makroskopik ve mikroskopik değişiklikler
Şifa ya da ölümle sonuçlanabilen
Patoloji:
A- Genel (patolojik stimuluslara karşı oluşan
temel hücresel ve doku cevaplarını)
B- Özel (sistemik, özelleşmiş organların özel
cevaplarını)
Hastalıkların seyrinde izlenen 4 yol var:
1- Nedenleri(etyoloji)
2- Gelişme mekanizmaları(patogenez)
3- Hücre ve organlarda yapısal
değişiklikler(morfoloji)
4- Morfolojik değişikliklerin fonksiyonel sonuçları
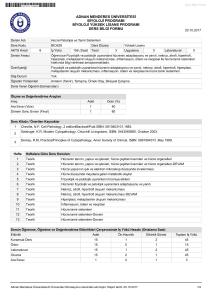
PATOLOJİ LABORATUARI
Prof.Dr. Handan AKER
Patoloji laboratuarlarında
sert ve yumuşak dokuların hazırlanmasında
genel prensipler
1. Dokuların tespiti
2. Sert dokulardan inorganik maddelerin
uzaklaştırılması
3. Dokuların mikrotomda kesilebilecek hale
getirilmesi
4. Kesilen dokuların boyanması
FİKZASYON
(Tespit)
Canlıdan alınan dokunun canlıdaki halini
koruyan yöntem
En çok kullanılan fikzatifler:
Formaldehit (% 10)
Etil alkol (% 80)
FİKZASYON
(Tespit)
İyi bir fikzatif:
Dokuyu büzmemeli
Dokuyu şişirmemeli
Dokuyu eritmemeli
FİKZASYON PRENSİPLERİ
Fikzatif hacmi doku hacminin en az 10
katı olmalı
Doku kalınlığı 4-5 mm’yi geçmemeli
Fikzatif her yanda doku ile temas etmeli
FİKZASYON PRENSİPLERİ
Oda ısısı (20-25 C) tercih edilmeli
0
Tespit süresi 24-48 saat olmalı
Doku sertleştiğinden dar kaplara konmamalı
FORMALİN
Formaldehit gazının sudaki % 40’lık çözeltisi
Ucuz, dokuları uzun süre koruyabilme
Histokimya ve immünohistokimya
uygulanabilme
FORMALİN
% 10’luk formalin
1 hacim formalin
9 hacim distile su
Asit nitelik kalsiyum veya magnezyum
karbonat eklenerek nötralize edilebilir
FORMALİN
Fikzasyon hızı saatte 1 mm
Fikzasyon hızı ısıya ve konsantrasyona bağlı
% 10’luk formalinle yeterli fikzasyon:
Oda ısısında (20-25 0C) 48 saat
35 0C de 24 saat
FORMALİN
Tespit süresini kısaltmak için:
60 0C etüv ya da mikrodalga fırınlar
Sert dokular uzun süre tesbit edilmemeli
Organik bileşenler şişer
Sert ve yumuşak dokular birbirinden
ayrılır
DEKALSİFİKASYON
(Demineralizasyon)
Diş ve kemik gibi mineral içeren dokuların
yumuşatılması
Prensip:
Asitlerle kalsiyumun metalik tuz
oluşturması
Dokudaki kristalin eriyik haline
geçmesi
DEKALSİFİKASYON
(Demineralizasyon)
Önce tespit !
Kemik testeresi ile dilimlenme
Dekalsifikasyon maddeleri ile reaksiyon:
Kemik, dentin ve sement benzer
yapıda
Enamel erir ! (Boş alan !)
DEKALSİFİKASYON SIVISI
Genellikle asit solüsyonlar kullanılır
İdeal solüsyon:
Kalsiyum tuzlarını tamamen uzaklaştırmalı
Hücrelere ve organik maddelere zarar
vermemeli
Boyama reaksiyonlarını bozmamalı
DEKALSİFİKASYON
Süre:
Boyut ile doğru orantılı
Isı ile ters orantılı
Yüksek ısı süreyi kısaltır
Doku şişmesi ve erimesi !
DEKALSİFİKASYON
Asitin özelliklerine bağlı
Yüksek konsantrasyonda hızlı etki !
Düşük konsantrasyon uzun etki
4N nitrik asitte, 200C’de tamamen
erir
Karıştırma süreyi azaltır
DEKALSİFİKASYON SIVILARI
İnorganik asitlerin % 1-40’lık solüsyonları
Asitler su ya da alkol ile sulandırılır
Alkol dokuyu korur, süreyi uzatır
En çok kullanılanlar:
Nitrik asit, formik asit, hidroklorik asit,
triklorasetik asit
DEKALSİFİKASYON PRENSİPLERİ
Solüsyon doku hacminin 50-100 katı olmalı
Sıvılar taze hazırlanmalı
Sıvılar her gün değiştirilmeli
DEKALSİFİKASYON PRENSİPLERİ
Yumuşama her gün kontrol edilmeli
Yumuşayan doku hemen çıkarılmalı
Yumuşayan dokunun asidi giderilmeli
% 5’lik sodyum sulfatta 12-24
saat
Akar suda 12-24 saat
% 70’lik alkol !
NİTRİK ASİT
Hidroklorik asit ile karışımı hızlı etkili
Dokuda hasar !
% 10’luk nitrik asit:
Küçük parçaların hızlı dekalsifikasyonu
Süre 48 saati aşmamalı
Dokular direkt % 70 alkole aktarılmalı
FORMİK ASİT
Nitrik aside göre daha yavaş etkili, daha az
zararlı
% 5 veya % 10’luk solüsyonları iyi
Triklorasetik asit kombinasyonları
Özellikle % 5’lik solüsyonu diş
dekalsifikasyonunda tercih edilir
Diş içeren alveol kemik dekalsifikasyonu
4N sodyum asetat-hidroklorik asit tampon
çözeltisi (pH 3.5)
Süre: dentin ve kemik demineralize
oluncaya kadar
Enamel genellikle korunur
Dentin ve enamel genellikle
ayrılır
Mikrotomda önce enamel
kesilirse ayrılma daha az
DEHİDRATASYON
Dokudaki suyun uzaklaştırılması
Dokunun sertleşip kesilebilmesi için
parafinin dokuya infiltre olması
gerekir
Parafin suda erimediğinden
dokudaki su uzaklaştırılmalıdır
Genellikle etil alkol kullanılır
Aseton, izopropil alkol
DEHİDRATASYON
% 80, 90, 96, absolü alkol
Kademeli dehidratasyon dokuya daha
az zararlı
Absolü alkolde fazla kalırsa doku çok
sertleşir
Sıcaklık arttırılarak süre kısaltılabilir
Ksilole geçildiğinde bulanıklık olmazsa su
alınmıştır
ŞEFFAFLANDIRMA
(De-alkolizasyon)
Dokudaki alkolün uzaklaştırılması
Dokunun sertleşip kesilebilmesi
için parafinin dokuya infiltre
olması gerekir
Alkolle parafin karışmadığından
dokudaki alkol uzaklaştırılmalıdır
Bu amaçla kullanılan maddeler dokuyu
saydamlaştırır
ŞEFFAFLANDIRMA
(De-alkolizasyon)
Ksilol en çok kullanılanıdır
Toluen, benzen, kloroform
Suyu alınmış doku cam gibi olur
Su tam alınmamışsa doku beyazımtırak
görünür, tekrar dehidrate edilmelidir
SERTLEŞTİRME
(İnklüzyon)
Dokunun gömme maddesi (Parafin) ile
tamamen infiltre edilmesi gerekli
Doku ile gömme maddesi aynı yoğunlukla
olmalı
Yetersiz demineralizasyon,
parçalanma !
Fikze edilmeyen taze dokuların hızla
dondurulması (Frozen)
Sert dokulara uygulanamaz
SERTLEŞTİRME
Genellikle parafin kullanılır
Jelatin, selloidin, plastik
Parafin ısı ile erir, soğukla sertleşir
Ksilol-parafin karışımında 560C etüvde bir
saat
Saf parafinde iki saat
Etüv ısısı 600C geçmemeli
OTOMATİK DOKU TAKİBİ
% 70 etil alkol
1 saat
% 70 etil alkol
1 saat
% 80 etil alkol
1 saat
% 90 etil alkol
1 saat
% 96 etil alkol
1 saat
Absolü alkol
1 saat
Absolü alkol
1 saat
Ksilol
1 saat
Ksilol
1 saat
Ksilol
1 saat
Parafin
1 saat
Parafin
1 saat
Parafin
1 saat
Paratin
1 saat
Toplam
14 saat
BLOKLAMA
Parafinle infiltre edilen dokuların kesilmesi ve
saklanabilmesi için parafin içine gömülerek
bloklanması
Doku kalıp içine ısıtılmış pensetle alınmalı
Doku kabın alt kenarına paralel yerleştirilmeli
BLOKLAMA
Blok önce kendi halinde soğutulmalı
Ani soğutma blokta kırılmaya yol
açar
Soğuk suda soğutmaya devam edilmeli
Buz, buzluk kullanılabilir
KESİT
Mikrotom
Rotari, kızaklı
Kullanım deneyim gerektirir
4 kalınlıkta parafin kesit
35-400C de su havuzu
KESİT
Lam üzerine montaj
Etüv:
Lamdaki suyun kurutulması
Deparafinizasyon
Parafinden kurtarılamayan kesitler boya
almaz
KESİTLERİN BOYANMASI
Deparafinizasyon
Ksilollerde üç kez onar dakika
Saydamlaşmama: Kesitte su ve parafin
varlığı
Hidrasyon
Ksilolden kurtarmak ve boyanmasını
sağlamak
% 96, 90, 80, 70 etil alkolde üçer
dakika
Boyanma
Hematoksilen-Eozin
KESİTLERİN BOYANMASI
Dehidrasyon
Boyadan sonra suyun alınması
% 70, 80, 90, 96, absolü alkolde üçer
dakika
Şeffaflandırma
Ksilolde 15-30 dakika
Montaj
Kanada balsamı, entellan
BOYAMA
Amaç doku elemanlarının görünür hale gelmesi
Boya doku elemanlarının tümünü boyuyorsa
GENEL BOYA
Boya doku elemanlarının özel yapılarını
boyuyorsa SEÇİCİ BOYA
Bazik boyalarla farklı boyuyorsa
METAKROMATİK BOYA
BOYALAR
Asit boyalar:
Dokuların bazik bileşenlerini boyar
Asit boyalara afinitesi olan yapılar:
asidofilik
• Eozin
• Sitoplazma
Bazik boyalar:
Dokuların asit bileşenlerini boyar
Bazik boyalara afinitesi olan yapılar:
bazofilik
• Hematoksilen
• Nükleus
Rutin boyalar (HE)
Histokimyasal boyalar(hücresel ürünleri gösterir,
PAS, Alcien –Blue, Retikülin, Masson Trichrom,
Van- Gieson, Mason fontana, Oil red, toluidin
Blue, MGP...)
İmmünhistokimyasal boyalar (doku ve hücrelerin
immünoloji ve enzim histokimyası temellerine
dayanarak boyanması)
İmmünhistokimyasal Boya Yöntemi
Patolojide ki kullanım alanları
1- Farklı tümör tiplerinin ayırıcı tanısında
2- İmmünopatolojik hastalıkların
tanınmasında (Böbrek ve deri )
3- Östrojen ve progesteron reseptörlerinin
tespitinde
4- Enfeksiyonlara yol açan m.o ların
tanınmasın da ( CMV, hepatit B virüsü ...)
FROZEN SECTİON YÖNTEMİ
Dokuların fiksatife konulmadan , vucuttan çıkarılır
çıkarılmaz dondurulup kesilmesi işlemidir.
15-20 dakika süren bir işlemdir
Cryostat isimli aletle yapılır (-40 derece)
Likit nitrojen ( -190 derece soğutur ve kas
biyopsilerinde), isopentan soğutmalı likit nitrojen
ve aerosol spreylerle de yapılmıştır.
Amaçları;
Malign tümörlerde operasyonun şeklini
belirlemek
Floresan inceleme
Kas enzim reaksiyonları
SİTOPATOLOJİ
Sitoloji; hücrenin normal görünüşü dışında ki
sapmaları inceler
İlk kez 1928 de ABD de Dr George Papanicalaou
ve Romanya da Dr Aurel Babes tarafından serviks
eksfolyatif sitolojisinde
Dr Papanicalaou, PAP tarama testini ilk kez
kullanmış va 1947 yılında dünya çapında 70
patoloğun katıldığı kursu düzenlemiş
Türkiye den bu kursa Prof Dr Osman Nuri AKER
katılmış
1980 li yıllardan beri sitoloji yerine
sitopatoloji terimi tercih edilir
1960 lı yıllarda anatomik patolojiden farklı
olarak özelleşmiş eğitim gerektirdiği
AMACI, hasta için minimal morbibite,
güvenilir, hızlı, ekonomik tanı vermek
Uygulama Alanları
Neoplazi tanısı ve taramasında
Tümör tipinin tanınması ve tedavinin
yönlendirilmesi
Rezidüel lezyon ve inkomplet eksizyon tanısı
Prognoz tayini ve takip
İnflamatuvar lezyon tanısı ve etken m.o tanısı
Jinekolojik sitolojik hormonal değerlendirme
Baş-boyun(tiroid, meme…) bölgesi kistik
lezyonların tedavisi
Sitolojik Materyal Tipleri
1- Eksfolyasyon( dış ortamla bağlantısı olan hhb organ kavitesinden
kendiliğinden dökülme)
2- Ulaşılabilen yüzeylerden mekanik bası ile örnekleme
Lavaj (yıkama, aspirasyon, parasentez)
Fırçalama ( gis, akciğer, üriner trakt)
3- Ulaşılabilen kitlelerden direkt,derinde ki organlardan
görüntüleme yöntemleri ile İnce İğne Aspirasyon Sitolojisi
(İİAS) ve stereotaksik biyopsi ve sürüntü
4- İntraoperatif konsültasyon için İİAS (kc ve pankreas
gibi organlarda kanama ve fistülizasyonu önlemek için)
Eksfolyatif Sitoloji
1- Kadın-Genital Sistem
2- Solunum Sistemi
3- Vücut boşlukları sitolojisi
Kadın Genital Sistem, 1943 yılında Papanicalou e
Traut tarafından tanımlanmıştır
PAP testi serviks CA nın erken tanısında tarama
testi olarak kullanılır
Sıklıkla uterus serviksi ve vajen, daha az sıklıkla
tuba ve overlere ait, serviks posterior forniksine
dökülmüş hücrelerin lam üzerine yayılması
Temel görev, preinvaziv ve invaziv serviks CA
nun tanısında tarama testi olarak
Bunun dışında
Benign atipi çeşitleri
İnflamatuvar değişiklik
Enfeksiyöz m.o
Endokrin durum
Neoplazm
1940 larda Papanicalou Class 1 -5
1970 lerde deskriptiv
1988 de Bethesta rapor sistemi
1991 ve 2001 de Bethesda yeniden düzenlenmiş
Yeterlilik tanımlamaları
ASCUS ve AGUS kavramları
HPV analizi
Endometrial hücreler ve hormonal değerler
LGSIL/HGSIL ayrımı
Yeterlilik, iyi korunmuş ve iyi görüntülenen
skuamoz hücrelerin lam üzerindeki
hücrelererin %10 nundan fazlası
Yeterli endoservikal/transformasyon zon
komponenti (herbiri en az 5 adet
endoservikal hücre veya skuamoz
metaplastik hücre içeren 2 hücre grubu
Solunum Sistemi
3 farklı materyal
(balgam, bronşial yıkama/fırçalama ve BAL)
Tek bir balgamla tanı %61, 3 balgamda %89
Santral yerleşimli ve büyük çaplı kitlelerin
tanısında yardımcı
Derin öksürtülerek alınan ve alt solunum yollarına
ait hücreler içeren balgam yeterlidir
Vücut Boşlukları Sitolojisi
Seröz membranları nemli tutan sıvı miktarının
artışına EFFÜZYON denir.
Seröz boşlukların efüzyon sitolojisi
BOS
İdrar
Eklem sıvısı
Primer amaç, malignitenin saptanması
Yetersizliğin nedeni, hücresel komponentin azlığı
ve hücrelerin kan-artıklar ile maskelenmesi
Effüzyon;
Transuda (fizyolojik-mekanik)
Eksuda (iltihap-tümör)
Malign plevral effüzyon;
AKC/MEME/GİS//MEZOTELYOMA/ LENFOMA
Malign Peritoneal effüzyon
OVER/ MEME/ GİS
Malign perikardial effüzyon
AKC/ MEME/ LENFOMA/ SARKOM/
MEZOTELYOMA
****Etyolojisi bilinmeyen effüzyonlarda kadında genital
sistem, erkekte GİS malignitesi düşünülmeli
İnce İğne Aspirasyon Sitolojisi
Enjektör ucuna ortalama 22 guage iğneler
takılarak, bir dokudan iğnenin keskin ucu ve
emme-basma hreketlerinin oluşturduğu negatif
basınç ile hücre kopartma ve bu hücreleri lama
yayarak değerlendirme işlemi
İlk kez 1883 de Leyden akciğer dokusunda m.o
ları görüntülemek için
1886 da Menetrier AKC CA tanısı için
1970 de güncelleşmiş
1980 de core biyopsisi alternatif olarak çıkmış
2 koşul sağlandığında İİAS ile doğruluk oranı
%90-95
1- doğru yerden yeterli sayıda hücre alma
2- Örneklenen hücrelerden hazırlanan preparatın
kalitesi
Raporda;
Benign
Şüpheli, muhtemelen benign
Şüpheli, muhtemelen malign
Malign
Sitolojik Materyallerin
Fiksasyonu
1- Eksfolyatif sitoloji materyalleri,
A- Vajinal sitoloji preparatları,
İdeali hemen laboratuvara gönderilmesi
Bu sağlanamıyor ise en az %70 lik, ideali
%95’lik etil alkol de 30 dakika tutup,
havada kurutmak
Özel fiksatif spreyi püskürtmek
Hiçbirşey yok ise saç spreyi ve kolonya ile
B- Seröz boşluklar, balgam, bronş, idrar
İdeali alındıktan hemen sonra 1-2 saat
içerisinde lab. Göndermek
Hemen gönderilemiyor ise eşit miktarda
%50 lik alkol ilave edilmeli
Her iki şartta sağlanamıyor ise , buzdolabı
kapağının iç rafında, yarım günü
geçmeyecek şekilde bekletilebilinir
Boya Yöntemleri
Alkol fiksayonlu preparatlarda
PAP
Hematoksilen-eozin
Sitokimyasal
İmmünohistokimyasal
Havada kurutulan preparatlarda
Giemza türevleri ( MGG, Wright, DiffQuick)
Nükleer özellikleri en iyi gösteren boya
PAP
Sitoplazmik özellikler, zemin özellikleri ve
sekresyonları en iyi şekilde gösteren boya
ise Giemza türevleridir
İdeal olanı, PAP ve Giemza türevi boyaları
birlikte kullanılmalı ve değerlendirilmelidir
Sitolojik tanıda etken olan özellikler
1- Nükleus morfolojisi
2- Sitoplazmik özellikler
3- Yapısal patern
Normal/ Reaktif/ Dejenere/ Displastik/
Neoplastik
Sitolojide Malignite Kriterleri
1- Nükleer özellikler
Kromatin paterni
Nükleer membran
Nükleol
Mitotik aktivite
2- Sitoplazmik özellikler
Sitoplazma miktarının azalması (N/S oranını ↑)
Anormal matürasyon ve differensiasyon
3- Nükleus-sitoplazma ilişkisi
N/S oranı
Nükleus organizasyon polarizasyonu
4- Hücreler arası ilişkiler
Pleomorfizm
Molding (hücrelerin birbirine bakan yüzlerinin
düzleşmesi)
Kalabalıklaşma ve üst üste binme
Yapısal patern (asini, papilla, rozet, morul)
5- Zemin özellikleri
Temiz zemin (intraepitelyal lezyon ve metastatik CA)
Kirli zemin (nekroz, inflamasyon ve eski kanama ie
oluşur ve invaziv CA bulgusu)
HÜCRE PATOLOJİSİ
Hücrenin zedelenmeye verdiği cevaplar:
A- Hücre adaptasyonları
B- Reversibl(geri dönüşümlü) zedelenme
C- İrreversibl (geri dönüşümsüz)
– Nekroz (programsız)
– Apopitozis (programlı)
Adaptasyon; yaşamını sürdürebilen hücrede yeni
bir denge kurulmasıdır
Zedelenme; uyaranla adaptasyon sınırının aşılmış
olmasıdır
Zedelenmeye karşı hücreda mg değişiklikler
Etkenin cinsine/ etkime süresine ve şiddetine
Hücrenin cinsine, fonksiyonel durumuna,
adaptasyon kabiliyetine bağlıdır
HÜCRE ZEDELENMESİNİN
NEDENLERİ
1- İskemi ve hipoksi
2- Fiziksel etkenler (travma, ısı, basınç,
elektrik, radyasyon)
3- Kimyasal zedelenmeler
4- Mikrobiyolojik nedenler
5- İmmünolojik nedenler
6- Yaşlanma
I- İskemi veya hipoksi
Hipoksi= Oksijen yetersizliği
İskemi= Kanlanmanın kaybı
arteryal akımın engellenmesi veya
venöz drenajın azalmasına bağlı
Hipoksi nedenleri
A- Kan akımında azalma veya durma
Damar duvarında
Damar lumenini tıkayan ekzojen veya
endojen nedenlerle
Arteryal vazokonstrüksiyon( Raynaud
hastalığı)
B- Kanın oksijen taşıma kapasitesinde
azalma
Anemi
CO zehirlenmesi
Solunum ve dolaşım yetmezlikler
C- Hücredeki oksidatif enzimlerin azalması
ya da inaktivasyonu
Siyanür zehirlenmesi
II-Fiziksel etkenler
A- TRAVMA
Abrasion (sıyrık)
Contusion (ezik, çürük)
Laceratıon (yırtılma)
Incition (kesi)
Penetration (delici)
Fracture (kırık)
B- ISI
Düşük ısı: Hipotermi tüm vücudu etkiler ise
hücrelerde nekrotik değişiklikler olmaksızın ölüm
mg
a-Lokal reaksiyonlar; zedelenme iki nedenle
o.ç
• İntrasellüler suyun kristalizasyonu(direkt)
• Mikrodolaşımda ki değişiklikler(indirekt)
– Siper ayağı / Gangren
b-Sistemik reaksiyonlar
Deri damarlarında vk
Kan periferden çekildiği için Vücud ısısı
düşer ve deri soluklaşır
Periferik vd nedeniyle hiperemi
Periferik kanın soğumasıyla vital
organlarda metabolizma yavaşlar
Dolaşım yetmezliğine bağlı ölüm mg
Fiziksel etkenler
Yüksek ısı:
Aşırı terleme sonucu tuz ve su kaybı
Sıcak apopleksisi(beyinde ısı regülasyon merkezleri
bozulur –şok-kanamalar-ölüm)
a-Lokal reaksiyonlar
Kapillerlerde vd ve permeabite artışı
Ödem-deride veziküller
Hücre düzeyinde metabolizma artışı, h. Zarı ve
damar endotelinde hasar, enzim inaktivasyonu ve h.
Koagülasyonu, kömürleşme
I. Derece yanık---ERİTEM
II. Derece yanık---VEZİKÜL (dermiste
irreversibl zedelenme olmaksızın
epidermiste zedelenme vardır)
III. Derece yanık---SKAR. Dermis ve deri
eklerinde zedelenme vardır
Sistemik reaksiyonlar:
Yanığın derinliği kadar , yanan yüzeylerin yüzdesi
önemlidir
Vücut yüzeyinin %50 sini tutuyorsa coğu kez,
%70 ni tutuyorsa genellikle fatal seyreder
Sonuçta; 1- Ağrının oluşturduğu nörojenik
mekanizmalar
2- Hipovolemik şok
3- Enfeksiyon, sebsis, endotoksik şok
4- Hemokonsantrasyon, hipotansiyon,
sekonder şokun geliştirdiği sistemik anoksi
sonmucu DİCmg
5- İntravasküler hemolize bağlı “aşağı
nefron sendromu”
6- GIS de stress ülserler(Curling’s Ü.)
6- Sıcak ve zararlı gazların solunması
sonucu akc parankiminde nekroz,
eksüdasyon, ödem, atelektazi,
bronkopnömoni, solunum yetersizliği ve
ölüm mg
7- Yanık skarlarında deri kanserleri
8- Vücud ısısının 40 derece üzerine çıkması
sonucu periferik vd ve göllenmeye bağlı DIC
ve organ yetmezlikleri ve ölüm mg
Fiziksel etkenler
C-BASINÇ: 3 yoldan birisi ile zedelenme
yapar
Patlama
Gaz embolisi
Sistemik hipoksi
a-Patlama: Hücrede mekanik zedelenme
yapar
Hava ile iletim(basınç yönünde ki vücut
yüzeyinde max. etki)
Su ile iletim( immersiyon patlaması)
Katı maddelerle iletim
b- Gaz embolisi:
Ani basınç düşmesi sonucu kanda ve dokularda
oluşan gazların yaptığı etkilere bağlıdır
Yüksek basınç kanda ve vücud sıvılarında
bulunan 02, CO2 ve N gazlarının erimesine
neden olur
Normal basınca çıkıldığında eriyik haldeki
gazlar kabarcıklar halini alıp damarlarda,
interstisyel ve yağ dokusunda azot gaz kitleleri
oluşturur.
Azot gazı emboluslarının sebep olduğu hastalığa
Dekompresyon (CAİSSON) hastalığı= vurgun
denir.
• Akut formunda;(küçük damarların akut obstr.
bağlı) kas eklem ağrıları, akc yetmezliğii
ve koma mg
Kronik formunda(gaz embolusları sonucu oluşan
iskemik nekrozlara bağlı) kemikler de aseptik
nekrozlar ile serebral ve spinal felçler
c- Sistemik hipoksi.
Yüksek yerlerde parsiyel O2 basıncının
düşüklüğü sonucu o.ç
Uzun süre yaşayanlarda hipoksiye
adaptasyon sonucu, polistemi, kemik ilği
hiperplazileri, parmak uçlarında
osteoartropati o.ç
Fiziksel etkenler
D- ELEKTRİK:
Akımın özelliği (alternatif ve düz akım),
Alternatif akım daha tehlikeli
Amper ve voltajı ( 200 volt üzeri öldürücü)
Organizmada ki geçiş yolu ile süresi (normal nöral
impulsları bozarak, özellikle beyin sapı veya kalpte)
Dokuların (kalınlığı ve nem oranı) rezistansına bağlı etkiler
o.ç (deri, kemik ve yağ dokusu dirençli)
Etkilediği yüzeyin büyüklüğü
Elektriği ileten aracıların durumu
a- Lokal reaksiyonlar.
Yüksek voltajlı akımlarda vücuda giriş ve çıkış yerinde
nekrozlar
Giriş yerinde deride hiperemi, ödem, yanıklar, çıkış
lezyonları genellikle ayakta toprağa değen yerlerdedir
Çıkış yerinde maden parçacıkları,
Şiddetli akımlarda, deri altındaki damarlarda
trombüsler ve mumifikasyon nekrozları, kaslarda
yırtılma, kemiklerde kırık ve oftalmik bozukluklar o.ç
b- Sistemik reaksiyonlar:
Akımın geçiş yolu üzerinde kalp ya da sinir
sisteminin bulunmasına bağlı ölümler, kalpte
fibrilasyona ve sinirlerde myelin ve ganglion
ganglion hücrelerinde dejenerasyona sebep olur
Damar değişikliklerine bağlı MI ve kanamalar
Nekroza bağlı parmak otoamputasyonları
Kas lezyonlarına bağlı üriner semptomlar
Fiziksel etkenler
D- RADYASYON:
Bir taraftan tedavi amaçlı, diğer yandan hücre
ölümü ve dejenerasyonları, mutasyonlar ve tümör
oluşumuna neden olur
Direkt etki (hedef teorisi, yüklü partiküller )
İndirekt etki (X ve gama ışınları ile o.ç hücre
suyunun hidrolizi ve serbest O2 radikallerinin
oluşumu sonucudur)
Radyasyonun hücreler üzerindeki etkisi;
Radyasyonun dozuna/ çizgisel enerji
transferine/ salınma oranına/ ortamdaki O2
miktarına
Hücrelerin onarım kabiliyetine
ve radyosyona duyarlılığına bağlıdır
Radyasyona duyarlılık mitotik aktiviteleri ile
doğru,
diferansiasyon dereceleri ile ters orantılıdır
A- RADYASYONUN HÜCRE VE
DOKULAR ÜZERİNE ETKİSİ
En hassas yapı nükleer DNA, en hassas
evre ise DNA sentezini yapıldığı
interfazdır (G2 mitozdan hemen önce, M
mitotik faz, S sentez, G1 postmitotik faz)
İnterfaz devresinde oluşturduğu
değişiklikler:
Mitoz gecikmesi
Mitotik ölüm
Kromozom ve kromatit lezyonları
Ani hücre ölümü
Radyorezistan ve radyosensibl özelliklerine göre
hücreler 5 gruba ayrılır
1- Vejetatif intermitotik hücre:
Radyosensibilitesi çok yüksek ve sık mitoz
gösteren primitif hücrelerdir.
Primitif germ hücreleri/ overlerdeki follikül
hücreleri, blastik hemopoetik hücreler,
epidermisin bazal tabakası, intestinal epitel
Lenfositler matür hücre olmalarına rağmen
bu gruptadır
2- Diferansiye intermitotik hücre:
1. Grup hücrelerden mg ve her bölünme
ile daha diferansiye olan hücreler
Promyelosit, myelosit, metamyelosit,
primer ve sekonder spermosit ve
spermatid
3- Multipotent bağ dokusu hücreleri:
Düzensiz olarak bölünen hücrelerdir
Fibroblast, glial hücreler endotel h.
İmmatür kemik ve kıkırdak h.
4- Reversibl postmitotik hücreler:
Mitoz potansiyeline sahip, ancak rejenerasyon
hallerinde çoğalabilen, özel fonksiyon bakımından
ileri derecede diferansiye olmuş, radyorezistan
hücreler.
Matür kıkırdak ve kemik
Kc, böbrek, pankreas, endokrin bezler
5- İrreversibl postmitotik hücreler:
Diferansiasyonu tam olmakla beraber mitoz
kabiliyetini yitirmiş hücreler
Kas, ganglion, lökosit, eritrosit, spermatozoa
gibi radyorezistan hücrelerdir
Radyasyon hücrelerde reversibl/ irreversibl
değişiklikler, anaplastik hücrelere benzer
görünüm
Damarlarda vd, endotel nekrozu ve
proliferasyonu, trombüs, mediada
hyalinizasyon
B- RADYASYONUN ORGAN VE
SİSTEMLER ÜZEİNE ETKİSİ
En çok etkilenenler;
deri, hemopoetik ve lenfoid sistemler,
gonadlar, akciğerler, gis ve beyin
DERİ: Kronik radyodermatit, bazal ve
yassı hücreli Ca, malign melanom, gözde
katarakt
HEMOPOETİK VE LENFOİD SİSTEM:
Lenfopeni
Erken dönemde lökositoz, geç dönemde
lökopeni ve trombositopeni
Eritrositler radyorezistan olmakla
beraber 3 hafta sonra anemi
GONADLAR:
Genellikle sterilite o.ç
Sertoli hücreleri ve interstisyel hücreler
radyorezistanttır
Overlerde germ h. ve granüloza h.
sensitiv, uterus ve serviks radyorezistant
AKCİĞERLER:
Alveoler kapillerlerde hasara bağlı ödem, fibrin
eksüdasyonu, hyalen membran
İleri evrede alveol duvarında fibrozis ve damar
duvar kalınlaşmaları
GASTROİNTESTİNAL SİSTEM:
Özofagus ve rektum kısmen radyorezistan
BEYİN:
Nöronlarda ve astrositlerde hasar m.g
C- RADYASYONUN GENEL VÜCUT
REAKSİYONU:
100-300 rad lık radyant enerji “Akut radyasyon
sendromu”
Letal değişiklikler 200 rad civarında başlar, 700
rad da o.ç
200-500 rad: hemopoetik sendrom
500-1000 rad: gastrointestinal sendrom
5000 rad üzeri: serebral sendrom
Geçikmiş etkileri, mutasyonlar, fötal
anomaliler ve kanser gelişimleri
III- Kimyasal Zedelenmeler
İki farklı mekanizma ile zedelenme oluşur
CCl 4 gibi hedef hücrede serbest radikal
HgCl gibi Hg nın hücre membranında ki
sülfidril gruplarına bağlanması ve
geçirgenliğin artışı
IV- Mikrobiyolojik etkenler
M.o ların lökositler tarafından fagositozu
ve özellikle lökositlerden salınan reaktif
türevlerle oluşturulan zedelenme
V- İmmünolojik reaksiyonlar
İmmün sistem vücudun savunmasına
yardım etmekle birlikte
İmmün reaksiyonlar hücre
zedelenmesine sebep o.b
• Anaflaktik reaksiyon
• Otoimmün hastalıklar
VI-Yaşlanma
İki yolla zedelenme oluşturur
1- Yaşlılarda serbest radikal oluşumu
fazladır
Kc ve kalpte oluşan lipofussin pigmenti
2- Toksik serbest radikallerin
inaktivasyonunu sağlayan maddelerin
aktivitesinde azalma ve serbest
radikallerde rölatif artış
HÜCRE ZEDELENME
MEKANİZMALARI
Zedeleyici uyarana hücresel cevap; zedelenmenin
tipine, süresine ve şiddetine bağlıdır
Zedeleyici uyaranların sonucu zedelenen hücrenin
tipine, durumuna, uyum yeteneğine ve genetik
yapısına bağlıdır
Hücresel fonksiyon hücre ölümünden daha önce
kaybolur, hücre zedelenmesinin morfolojik
değişiklikleri sonra gelişir
Hücrede zedelenmeye duyarlı 4 h.i sistem
Aerobik solunum (oksidatif fosf. ve ATP)
Enzimlerin ve yapısal proteinlerin
sentezi
Membran bütünlüğünün (iyonik ve
osmotik dengenin) korunması
Hücrenin genetik yapısının korunması
Zedelenmede Genel Biyokimyasal
Mekanizmalar
1- ATP azalması ( hücre osmoloritesinin sürdürülmesi,
taşıma işlemleri, protein sentezi ve temel metabolik
olaylar)
2- Oksijen yokluğu veya reaktif oksijen
türevlerinin oluşumu
3- Kalsiyum homeostazının kaybı (iskemi veya
toksinler hd Ca un hi ne girmesine, hi stoklardan Ca un
serbesteşmesine neden olur, sonuçta fosfolipazlar,
proteazlat, ATPaz ve endonükleazlar aktive olur)
4- Plazma membran permeabilitesinde
yetersizlikler
(ATP sentezini kaybı veya Ca-aracılı fosfolipazlar ile olur
ve normal metabolik aktiviteler için gerekli metabolitlerin
konsantrsayon gradyentlerinin bozulmasına yol açar)
5- Mitekondrial hasar
(sitoplazmik Ca un, hi oksidatif stresin ve lipit yıkım
ürünlerinin artması iç membranda ki mitekondrial
geçirgenlik yeri olarak bilinin “yüksek iletimli kanallar”ın
oluşumu ile sonlanır, ATP oluşumu önlenir ve sitokrom C
sitozole sızarak apopitozisi başlatır)
Hücre zedelenmesi başlıca 3 yoldan biri
üzerinden gerçekleşir
1- İskemik ve hipoksik zedelenme
2- Serbest radikalle oluşan hücre zedelenmesi
3- Kimyasal zedelenme
İskemik ve Hipoksik Zedelenme
İskemi, hücre zedelenmesinin en sık nedenidir
Hipokside glikolitik enerji üretimi devam eder
iken, iskemi glikoliz için gerekli maddelerin
salınmasına olanak sağlar.
Sonuçta; iskemi dokuları hipoksinin
zedelediğinden daha çabuk zedeler.
Hipoksinin ilk etkisi hücrenin aerobik solunumu,
yani mitekondrilerde ki oksidatif fosforilasyon
üzerinedir ve ATP üretimi belirgin olarak azalır
Hi de ATP azalması sonucu:
1- Hücre membranında ki Na pompası bozulur,
Hi de Na birikir ve bunu takiben suyun
izoosmotik artışı sonucu “akut hücresel şişme”
mg. Anaerobik solunuma bağlı olarak oluşan
inorganik fosfatlar, laktik asit ve pürin
nükleozitlerinin birikimi ile osmolorite daha da
artar ve “ mikrovillüslerde kayıp”, “EPR de
şişme” ve “hücre yüzeyinde kabarcıklar” mg
2- Adenozin monofosfatta artma ve buna bağlı
fosfofruktokinaz aktivitesindeki artış sonucu
anaerobik glikoliz artar. Glikojenden ATP üretimi
başlayacağından “hi glikojen depoları azalır”
Artan glikolizde , fosfat esterlerinin hidrolizi ile
laktik asit ve inorganik fosfatların birikimi sonucu
“hi ph asidik” olur ve kromatin kümeleşmesi oç.
3- Azalan pH ve ATP seviyeleri nedeniyle
ribozomlar granüllü EPR dan ayrılır, polizomlar
monozomlara dönüşür ve “hi protein sentezi
azalır” ve hücrede yağlanma o.ç.
Hipoksi düzelmez ise, mitekondriyal
fonksiyonların daha kötüleşmesi ve membran
permeabilitesinin artması daha fazla morfolojik
bozulmaya neden olur
Hücre iskeleti dağılır, mikrovillüsler kaybolur ve
hücre yüzeyinde kabarcıklar oluşur.
İskemi/Reperfüzyon Zedelenmesi
Kan akımının yeniden temini ile zedelenmiş olan hücreler
henüz kendi iyonik çevrelerini düzeltmemiş iken yüksek
konsantrasyonda ki Ca ile karşılaşır, artan hi Ca u hücre
bütünlüğünün kaybına
Yeniden kanlanma iltihabi hücrelerin lokal olarak yeniden
gelmesine ve bunlardan salgılanan serbest radikaller
aracılığıyla membran hasarı ve mitekondrial permeabilite
geçişine
Hasarlanmış, ancak henüz yaşayan hücrede serbest radikal
oluşumu artar, aynı zamanda antioksidan mekanizmalar da
olumsuz etkilenir.
Serbest Radikalle Oluşan Hücre
Hasarı
Serbest radikallere bağlı hücre hasarının
görüldüğü yerler:
İskemi/reperfüzyon zedelenmesinde,
Kimyasal ve radyasyon zedelenmesinde,
O2 ve diğer gaz zehirlenmelerinde,
Hücresel yaşlanma,
Fagositik hücrelerle mikropların öldürülmesi,
İltihabi hücre hasarı,
Makrofajlar ile tümörün yok edilmesi
Serbest radikal, en dış yörüngesinde tek sayıda
elektron içeren, son derece reaktif ve stabil
olmayan kimyasal maddelerdir.
Bunlar kolayca hücrede ki organik ve inorganik
bileşenler ile tepkimeye girer, nükleik asitler ve
çeşitli membran molekülleri ile etkileşerek
onları parçalar.
Otokatalitik reaksiyonları başlatırlar
Serbest radikaller ile reaksiyona giren
moleküller sıra ile serbest radikallere dönüşerek
hasar zincirini ilerletirler
Serbest Radikallerin Hi Oluşma
Yolları
Başlıca sebest radikaller O2 türevleri ( süper oksit,
hidrojen peroksit, hidroksil iyonu) ve karbon tetra klorür
(CCl 4) gibi dış kaynaklı kimyasallardır
1- Fizyolojik oksidasyon- redüksiyon mekanizmaları
sırasında
A- Normal solunum esnasında, mitekondrilerde su
oluşturmak üzere O2 nin dört kez elektron alarak
indirgenmesi
B- Hi ksantin oksidaz gibi bazı oksidazların etkisi ile
süperoksit radikalleri
C- Bakır ve demir gibi değişimli metallerde hi
reaksiyonlarda serbest elektron alıp vererek Fenton
reaksiyonunda olduğu gibi serbest radikal oluşturur
2- Çeşitli hücre tiplerinde normal olarak
sentezlenen ve önemli bir kimyasal mediyatör olan
nitrik oksit (NO) nitrit türevlerine dönüşerek
serbest radikal olarak etki eder
3- İyonize radyasyonun suyun hidrolizi sonucu
oluşan OH ve H iyonları
4- Ekzojen kimyasal maddelerin enzimatik
metabolizması
Serbest radikaller aracılığıyla gelişen hücre
hasarında 3 temel reaksiyon önemlidir
1- Membranların lipit peroksidasyonu
Hücre ve orgonel membranlarındaki fosfolipitlerin
doymamış yağ asitleri ile O2 türevi radikallerin
etkileşimi sonucu lipid peroksidasyonu başlar,
meydana gelen organik asitten yoksun radikaller
ortamda ki O2 ile reaksiyona girerek peroksitleri
oluşturur, bunlarda otokatalitik reaksiyonları
başlatarak daha fazla doymamış yağ asidi kaybına
neden olur.
2- DNA parçalanması
Serbest radikaller DNA da tek iplik kırılmaları
oluşturur bunlar hücrede tümör oluşumu veya
hücre ölümüne neden olur
3- Proteinlerin çapraz bağlanmasına
Serbest radikaller sülfidril aracılı protein çapraz
bağları oluşturarak parçalanmanın artmasına veya
enzimatik aktivitenin kaybına neden olur.
Bu reaksiyonları sonlandıran veya inaktive eden sistemler
2 grupta incelenir
1- Endojen veya ekzojen antioksidanlar
Vitamin E, sistein, glutatyon ve D-penisilamin gibi
sülfidril içeren bileşikler
Seruloplazmin ve transferrin gibi serum proteinleri
2- Enzimler
Süperoksit dismutaz
Katalaz
Glutatyon Peroksidaz
Kimyasal Zedelenme
1- Bazı kimyasal maddeler önemli moleküler
elemanlar veya hücresel organeller ile birleşerek
direkt olarak etki ederler
Civa klorür, kemoterapötikler ve bazı
antibiyotikler hücre membran proteinlerinin
sülfidril gruplarına bağlanarak ATP az bağımlı
taşımanın engellenmesine ve membran
geçirgenliğinin artmasına neden olurlar
2- Aslında biyolojik olarak aktif olmayan, reaktif
toksik metabolitlere çevrildikten sonra hedef hücreleri
etkilerler (CCl 4 ve asetaminofen)
Bu değişiklik kc ve diğer organların granülsüz EPR da
P-450 fonksiyonlu oksidazlar ile gerçekleşir.
Metabolitler protein ve lipitler ile direkt kovalen
bağlantı kurarak membran hasarı ve hücre
zedelenmesi yaparsa da asıl etki serbest radikaller
üzerindendir
CCL 4 serbest radikali olan CCl 3 e kc de dönüşür, bu
otokatalitik membran fosfolipid peroksidasyonunu
başlatarak EPR un hızla yıkımına neden olur,
30 dakika içinde kc de protein sentezinde azalma
olur, 2 saat sonra hücrelerde lipoprotein
sentezleyememesine bağlı lipit birikimi ve yağlı
değişme olur
Bu olayları hücre membranında ki permeabilite
artışına bağlı “hücresel şişme”, “hi ne yoğun Ca
girişi” ve “mitekondri içinde fazla Ca varlığı”
progressiv olarak hücre hasarı ve hücre ölümü ile
sonlanır
HÜCRESEL ADAPTASYONLAR
1-Fizyolojik adaptasyonlar
2- Patolojik adaptasyonlar
Patogenezinde:
Spesifik hücresel reseptörlerin artması veya
azalmasına
Hedef hücre tarafından yeni protein sentezinin
başlatılması (Isı şok proteinleri gibi bu proteinler
hücreleri bazı zedelenme şekillerinden korur
Hücresel adaptasyonlarda
1- Hücrelerin siklusu ve buna bağlı olarak
kendilerini yenileyebilme güçleri cevaplar
2- Reseptör bağlama
3- Sinyal transdüksiyonu veya
4- Protein transkripsiyonu, translasyonu
veya atılımı sonucu gerçekleşir
Başlıca adaptasyonlar:
1- Hücre sayısının artması veya hücrenin
büyümesi ( HİPERPLAZİ/HİPERTROFİ)
2- Hücre sayısının azalması ve/veya
hücrenin küçülmesi (ATROFİ)
3- Hücrenin değişmesi veya farklılaşması
(METAPLAZİ) ile karakterli değişiklikler.
Her hücre ;
Çoğalma (proliferasyon)
Farklılaşma (differansiasyon)
Yaşlanma (senescence)
Ölüm (apopitozis)
Bu süreçlerde rol oynayan farklı proteinler
vardır
Hücrelerin bölünme programlarını
ayarlayan gen grubu aşağıda ki proteinleri
sentezler:
A- Siklinler
B- Siklin bağlı kinaz enzimleri (cdk)
C- Siklin bağlı kinaz enzimi engelleyicileri
(cdki)
Organizmada ki hücreler yenilenebilme
güçlerine ve hücre siklusu ile ilişkilerine
göre 3 gruba ayrılır
1- Sürekli bölünen hücreler (labil, deri,ağız
boşluğu, sindirim kanalı, tükrük bezleri, pankreas, safra
kanalı gibi salgı kanallarını döşeyen mukaza, serviks,
vajen,uterus ve fallopian tüpleri ve üriner kanalı döşeyen
epitel, dalak, lenfoid ve hematopoetik doku hücreleri)
2- Sessiz hücreler (stabil, kc, böbrek ve
pankreas gibi parankimatöz organlar, damar
endotel hücreleri, düz kas ve fibroblast gibi
mezankimal hücreler)
3- Bölünmeyen (permanant, sinir hücreleri,
iskelet ve kalp kası)
Hücre büyümesi, hücre çoğalması veya inhibisyonunu
sağlayan çevresel kimyasal faktörler ile kontrol altında
tutulmaktadır.
Bu faktörlerin başında hücreler tarafından yapılan ve
serumda bulunan polipeptid büyüme faktörleri gelir
Bu faktörler hücre yüzeyi veya nükleusunda bulunan
reseptörlere bağlanır, bunlarda dimerizasyon oç ve
kinazların aktivasyonu sonucu çok sayıda madde
fosforilize edilir ve ras proteinleri, fosfolipaz –C ve raf-1
gibi sinyallerin nükleusa iletilmesini sağlayan ikinci mesaj
taşıyıcıları oluşur ve sonuçta nükleusta transkripsiyon
faktörleri DNA yapımını başlatır
Hücre büyümesi hücre inhibisyonu ile
kontrol edilir
Tümör supresör genlerin bazı kanserlerde
kaybolması ????
İnhibisyon faktörleri:
Transforme edici büyüme inhibitör faktörüβ (TGF- β), tümör nekroz faktör (TNF) ve
sitokin interferon- β
HİPERPLAZİ VE HİPERTROFİ
Gelişmesini tamamlamış ve normal büyüklüğe
ulaşmış bir organ veya dokunun, normal gelişme
dışında büyümesidir
Organ büyümesi kendisini oluşturan hücrelerin
sayısının artışına bağlı oluşursa HİPERPLAZİ,
hücrelerin hacimlerinin artması sonucu oluşur ise
HİPERTROFİ adını alır.
Hipertrofi, hücresel şişmeye bağlı değil, hi de
yapısal elemanların sentezinin artmasına bağlı
gerçek bir büyümedir
Hipertrofi yada hiperplazinin gelişimi, o organda
ki hücrelerin yenilenebilme özelliklerine ve hücre
sikluslarına bağlıdır
Permanant hücrelerde doku büyümesi saf
hipertrofi şeklinde olur iken, labil hücrelerde
organ büyümelerinde hiperplazi önemli rol oynar
Organ büyümesi yağ ve bağ dokusu artışına bağlı
olur ise “pseudohipertrofi” denir.
Hiperplazi veya hipertrofi, dengeleyici veya hormonal
nedenlere bağlı ob ve fizyolojik veya patolojik olabilir
1- Dengeleyici nedenler: Bir organda ki yapısal veya
fonksiyonel bir eksikliğin, organın sağlam kısımlarının
hipertrofi veya hiperfonksiyonu ile karşılanarak, mevcut
yetersizliğin dengeye getirilmesi sağlanmaya çalışılır
Genellikle bir organ veya doku üzerine yüklenen işin
artması sonucu oç. En sık
Kalp kası
Sindirim sistemi düz kası
Çift organlardan birinin çıkartılması
Yara iyileşmesi
HPV e bağlı siğillerde büyüme faktörlerinin etkisi ile
hücre çoğalmaları görülür
2- Hormonal nedenler ( sitoplazmadi ki reseptörler
ile hormon tutulur, sinyaller nükleusa taşınarak
protein sentezi ile ilgili genleri uyarır ve protein
sentezi başlar)
Normal gelişmesi ve fonksiyonu için hormonal
stimulusa gerek duyan hedef organlarda ve içsalgı
bezlerinde görülür
Gebelik ve laktasyonda meme hiperplazisi
Yüksek östrojen düzeyine bağlı endometrium
hiperplazisi
Aşırı ACTH uyarısına bağlı sürrenal
hiperplazisi,İyot eksikliğinde tiroksin noksanlığına
bağlı TSH salgılanmasında ki artışa bağlı tiroid
hiperplazisi
Hiperplazi ve hipertrofi bir sınırdan sonra
artan yükü dengeleyemez ve yetersizlik
oluşur
Hücre büyümesi hüce inhibisyonunu
sağlayan faktörler ile dengede tutulur, bu da
bunları tümörden ayıran önemli bir
özelliktir
Atrofi
Önceden normal yapıda olan hücre ya da
dokuların hacminin azalması sonucu küçülmesidir
Hücre hacminde veya hücre sayısında ya da her
ikisindeki azalma sonucu oç
Agenezi ( organ ya da dokunun konjenital bozukluk
nedeni ile taslak halinde dahi oluşmaması)
Aplazi ( taslağın normal organı oluşturacak biçimde
gelişeşmemesi, tüme yakın yokluğu)
Hipoplazi ( Esas yapı aynı kalmakla birlikte, normal
büyüklüğe erişememesi)
Genel sebebi bir çok nedenle oluşabilen
hücre beslenme yetersizliği,
anabolik ve katabolik olaylar arasında
negatif denge oluşumu
hücrede progressif yıkım ve hücre
kitlesinde azalma
Hücrenin apopitozisle ortadan kalkışı
Atrofiye yol açan sebepler
1- İş yükü ve kan temininde azalma
2- Yetersiz beslenme
3- Endokrin stimülasyonun azalması
4- İnnervasyon kaybı
5- Yaşlanma
Atrofiye uğramış hücrelerin yerini yağ ve bağ
dokusu alarak hacmi sabit tutulmaya çalışılır
Bazı organlarda özellikle kc ve kalp kasında
sarımsı kahverengi pigment birikir (lipofussin) ve
makroskopik görünümü nedeniyle kahverengi
atrofiden bahsedilir
Makroskopik olarak atrofik organlarda damarlar
belirginleşir
Atrofi uzun sürmüş ise parankimin yerini fibrozis
alır ve fonksiyon kaybı ile sonlanır.
I- Fizyolojik Atrofi
Puberte timus, menapoz sırasında uterus, over ve
meme atrofisi
İleri yaşlarda ki senil atrofinin fizyolojik veya
patolojik atrofi olduğu bilinmemektedir. Burada
arteriosklerozun yol açtığı iskemiye bağlı atrofi oç
Mikroskobik olarak atrofiye uğrayan hücrede
otofajik vakuollerde artış olur
Otofajik vakuol içerisinde ki bazı hücre yıkıntıları
(lipofussin) sindirilemez ve membrana bağlı artık
cisimler olarak kalır.
II- Patolojik Atrofi:
Genel ya da lokal ob
Lokal atrofi nedenleri
A- Fonksiyonel aktivitenin azalması (tembellik atrofisi)
B- İskemik veya vasküler atrofi
C- Basınç atrofisi
D- Endokrin atrofi (Simmond hastalığı)
E- Nörotrofik atrofi ( hem beslenme bozukluğu hem de
inaktivite sonucu)
F- Hiperaktivite-yorgunluk-tüketim atrofisi
G- Toksik atrofi (uzun süreli enfeksiyöz veya tümöral
olgularda)
Genel atrofi nedenleri,
açlık,
özofagusta tıkayıcı tümör,
kronik ishal
“anorexia nervoza”
Metaplazi
Diferansiye bir hücrenin yerini başka
differansiye bir hücrenin almasıdır
Epitelyal veya mezenşimal ob
Metaplazi reversibl bir değişikliktir
Epitelyal Metaplazi
1- Epiteli mekanik travma ve iltihap gibi uzun süreli kronik
irritasyonların etkilemesi sonucu oluşur
En sık rastlanan şekil, silindirik, pseudostratifiye silindirik
ve değişici epitelin, dış etkilere daha dayanıklı çok katlı
yassı epitele dönüşmesidir
2- A avitaminozu (üsy, bronşlar ve ürüner traktta ÇKYE
metaplazisi)
3- Barret’s özofajitinde ÇKYE silindirik epitele dönüşür
4- Bronşial asthma da bronşial silyalı epitelin goblet
hücrelerine değişmesi sonucu gelişen müköz metaplazi
Metaplazi genelde reversibl bir olaydır, vücudun
korunma reaksiyonlarından biri olarak bilinir, dış
tesirlere karşı dayanıksız hücrelerin yerini
dayanıklı hücreler alır
ANCAK, bakterilerin ve diğer zararlı cisimlerin
tutulmasını sağlayan mukus ve titrek tüylerin
ortadan kalkmasına yol açarak zararlı olduğu gibi,
ileride gelişebilecek kanserlere de zemin hazırlar
Önce hücrelerde proliferasyon, sonra değişik
yönde differansiasyon olur
Mezanşimal metaplazi
Fibröz bağ dokusu hücreleri osteoblast veya
kondroblastlara dönüşebilir
En sık görülen kemik dokusu metaplazisidir
Kalsifikasyona uğrayan nekrotik dokularda,
zedelene çizgili kasta
Metaplazinin stem hücrelerin yeniden genetik
programlanmasından oluştuğu düşünülmektedir
Mezanşimal metaplazide proliferasyon sonucu
oluşan hücrelerin başka yöne differansiasyonu
yanı sıra hücrelerin direkt olarak değişmesi de
ob.
ZEDELENMEYE ORGANEL
DÜZEYİNDE CEVAPLAR
Lizozomal Katobolizma
Primer lizozomlar ( hidrolitik enzimler içeren
membranlı orgoneller)
Sekonder lizozomlar= fagolizozom
(Primer lizozom ile sindirilecek materyalin
birleştirilmesi sonucu oluşur)
Lizozomal katobolizma 2 yolla gerçekleşir
Heterofaji
Otofaji
Heterofaji
Dış çevreden maddelerin alınma olayına
endositoz,
daha büyük taneciklerin alınmasına fagositoz,
daha büyük eriyebilen makromoleküllerin
alınmasına pinositoz denir
Endositik vakuoller primer lizozomlar ile
birleşerek sindirilir, bu olay her hücrede
olabilmekle birlikte en sık fagositik özelliği olan
hücrelerde görülür
Otofaji
Hasarlanmış veya yaşlanmış organellerin ortadan
kaldırılmasında ve hücresel diferansiasyonla
birlikte olan hücresel yeniden yapılanmada sık
görülen bir olaydır.
Bunlar canlılığını kaybederek, sağlam
sitoplazmadan ayrılan sitoplazma parçaları ve
hücre içi organeller ER’ mun ribozomsuz
bölgelerinden oluşturulan otofajik vakuoller içinde
yer alır (otofagolizozom)
Özellikle atrofik hücrelerde belirgindir.
Lizozomlarda ki enzimler kh ve proteinleri
tamamen sindirdiği halde, lipitleri parçalayamaz
(rezidüel cisim)
Lipofussin granülleri hi lipit peroksidasyonundan
kaynaklanan sindirilemeyen maddeleri temsil
eder.
Karbon partikülleri ve dövme pigmentleri de
makrofajların fagolizozomlarında dekatlarca
kalabilir
Lizozomlar aynı zamanda hücrelerin
tamamen metabolize edemedikleri
maddeleri sakladıkları depolardır
Lizozomal depo hastalıkları, herediter
enzim defektlerine bağlı olarak ara
metabolitlerin lizozomlarda birikmesi
Granülsüz EPR uyarılması
(Hipertrofi)
Barbütüratlar ve diğer bazı maddeler kc de ganülsüz ER de
ki p-450 sistemi ile metabolize edilir,
Bir süre sonra bu maddeler daha fazla enzim ve daha fazla
granülsüz ER sentezini uyarır ve hücrenin ilaç
detoksifikasyonuna katılımı daha etkili olur
Bunu bir maddeyi detoksifiye etmeye adepte olmuş
hücrenin, diğerlerinide metabolize etmede daha etkil
olması izler
(Alkol alan hastada fenobarbütal etkisini artırmak için
fenobarbütürat dozunu artırmak gibi)
Mitekondrial değişiklikler
Mitekondrial fonksiyon bozukluğunun akut hücre
zedelenmesi ve ölümünde önemli rolü vardır
Letal olmayan bazı patolojik durumlarda ise
mitekondrilerin sayısında, boyutunda, şeklinde ve
fonksiyonlarında değişiklik olur.
Hücresel hipertrofide mitekondri sayısında artış,
atrofide ise azalma vardır Beslenme yetersizlikleri
ve alkolik kc de hepatositlerde ki mitekondrilerde
aşırı büyüme ve anormal şekiller
(megalomitekondriler)
Mitekondrial myopatiler( kalıtsal
mitekondri metabolizma kusurları)
Böbrek, tiroid, tükrük bezi gibi organalarda
görülen “onkositoma” olarak adlandırılan
benign tümörlerde hümöral hücrelerde
sayıca artmış ve büyümüş mitekondriler
vardır
Hücre iskelet anormallikleri
Aktin ve myozin flamentleri
Mikrotübüller
İntermediyet flamentler
Kontraktil proteinler
Hücre iskeleti;
1- Orgonellerin ve moleküllerin hi nakilleri
2- Temel hücre yapısının korunması
3- Hücre-hücre ve hücre-ekstrrasellüler matriks
sinyallerinin nükleusa taşınması
4- Doku bütünlüğü için mekanik destek
5- Hücre hareketliliği
6- Fagositoz
Hücre iskeletinin anormallikleri :
Anormal hücresel görünüm ve fonksiyon
Hi organellerin aberan hareketleri
Kusurlu hücre hareketi
Hi de fibriler materyalin birikintileri
Düzensizlikler;
Mikrotübül organizasyonu (Kartagener Sendromu
ve immotil silya sendromu)
Mikrotübüller lökosit göçü ve fagositoz için
gereklidir ve mitotik ipliklern oluşumunu
sağladığından mitoz da rol oynarlar
(antikanser tedavisinde mikrotübüle bağlanan
ilaçlar)
İntermediate filamentlerin birikimi bazı
hücre zedelenmelerinde önemlidir ( Mallory
cisimcikleri)
Alzheimer hastalığında beyinde bulunan
nörofibriler yumaklar bozulan nöronal hücre
iskeletinin yansımasıdır ve mikrotübül
birlikteli proteinleri ve nöroflamentleri
içerir.
Isı şok proteinleri (HSPs)
Protein kıvrılması,
Protein-protein komplekslerinin dağılması
Proteinlerin hi organellere taşınmasında rol
oynarlar
Bu nedenle bunlar Şaperonlar olarak ta
bilinir
1- Yapısal olarak meydana gelebilir (Hsp 60 ve 90)
VEYA
2- Protein birikimi ve denatürasyonuna yol açan hücresel
streslerden sonra artabilirler
Zedeleyici uyarandan sonra oluşturulanlar
fonksiyonların tamiri amacıyla yeniden kıvrılmalara
neden olurlar (Hsp 70)
Yeniden kıvrılma başarısız olursa, düzeltilemeyecek
şekilde denatüre olan proteinler UBİQUİTİN
molekülünün bağlanmasıyla ile etiketlenir ve lizozomal
olmayan proteosomlar ile sitoplazmik yıkımlar için
hedef olur
Isı şok protein şaperonları MI ve nöronal iskemik
zedelenmede oluşur
Aynı anda her yerde bulunmaları ve öldürücü
olmayan hücresel stress ortamında oldukça fazla
bulunmaları zedelenmeye karşı hücresel
adaptasyonda önemli olduklarını düşündürür.
Ayrıca yanlış sarılmış veya yanlış tanzim edilmiş
proteinlerin amiloidoz, Creutzfeldt-Jacob hastalığı
ve Alzheimer hastalığının patogenizinde önemli ob
düşünülmektedir
HÜCRE İÇİ MADDE
BİRİKİMLERİ
Hi anormal birikimlerin meydana geldiği 3 genel yer vardır
1- Normal bir madde normal veya artan oranda mg fakat
metabolizmanın hızı maddeyi ortadan kaldırmak için
yeterli değildir (Kc de yağlı değişme)
2- Normal veya anormal endojen madde,
metabolizmasında, bağlanmasında, naklinde veya
sekresyonunda ki genetik veya edinsel bozukluktan dolayı
birikir (depo hastalıkları, alfa-1 antitripsin yetmezliği)
3-Ekzojen maddeyi parçalayacak enzimatik mekanizması
veya taşıma yeteneği yoktur (Anormal ekzojen madde
birikir )
Yağlı değişme
Yağ metamorfozu=yağ dejenerasyonu= steatozis=
parankimal yağ infiltrasyonu
Parankim hücrelerinde lipidin anormal birikimidir
Dejenerasyon ya da infiltrasyondan farklı olarak
hücrenin yağ kapsamının görünür hale
gelmesinden ziyade, yağ dokusu dışındaki
dokularda parankim hücreleri içerisinde nötral
yağın birikimidir
Reversibl bir zedelenmenin göstergesi ise de
nekrotik hücrelerin komşuluğunda da görülür
Kc, kalp, kas ve böbrekte sıktır
Kc e lipitler yağ dokusu ve diyetten gelir
Lipitler yağ dokusundan yalnızca serbest yağ
asitleri olarak, diyetten ise hem şilomikron hemde
serbest yağ asitleri olarak gelir
Kc de serbest yağ asitleri esterleşerek trigliseritleri
mg, kolesterol oluşur, fosfolipidlerle birleşir veya
mitekondride oksitleşerek keton cisimciklerini mg
Kc de asetatlardan da bazı yağ asitleri sentezlenir
Kc den lipitlerin salgılanması “lipit tutucu
proteinler= spesifik apoprotein molekülleri”
ile birleşip lipoproteinleri oluşturmaları ile
mümkündür
Kc de lipidlerin birikimi yağ asidi
girişinden lipoprotein çıkışına kadar hhb
basamaka ki hatadan ob.
Trigliseritlerin aşırı birikimi:
1- Serbest yağ asitlerinin hücreye aşırı miktarlarda
girmesi ( açlık, kortikosteroid)
2- Yağ asiti sentezinin artması
3- Yağ asiti oksidasyonunun azalması
4- Apoprotein sentezinin azalması (CCl 4, fosfor
zehirlenmesi ve protein malnütrisyonu)
5- Lipoprotein salgılanmasında bozukluk
Yağlı kc in en sık sebebi
A- Alkol
Mitekondrial ve mikrozomal fonksiyonları bozar
B- Protein malnütrisyonu ve CCl 4
Protein sentezini azaltır
C- DM ve şişmanlık
D- Anemi ve starvasyon
Periferik depolardan yağ asidi hareketini arttırır.
E- Hipoksi yada anoksi
Yağ asidi oksidayonunu engeller
Lipitler hücrede NŞA gösterilemediğinden
“maskelenmiş yağ” olarak tanımlanır
Hhb hücrede ki yağ birikimi parankimal
hücreler içinde berrak vakuoller olarak
görülür
Hücrede ki berrak vakuollerin, su, glikojen,
yağ olup olmadığına kara vermek için
histokimyasal boyalar gereklidir.
Hi de ki yağ, frozen kesitler yapılarak Sudan IV,
Oil-Red gibi histokimyasal boyalar ile gösterilir
Glikojende suda eridiği için alkol tespitinden
sonra boya almaz ve ancak PAS boyası ile
gösterilir
Hi vakuollerinin yağ ya da glikojen olmadığı
gösterilirse, içeriğin su olduğuna karar verilir
KARACİĞER:
Makroskopik; Ağır yağlanmada organ büyük, sarı
renkli, yumuşak ve kenarları küntleşmiştir
Mikroskopik; sitoplazmada farklı büyüklüklerde,
erken dönemde nükleus çevresinde küçük berrak
vakuoller şeklinde daha sonra birleşerek büyüyen
vakuoller nukleusu kenara iter.
Bazen komşu hücreler parçalanır ve yağ
globüllerinin birleşmesi üzerine yağ kistleri mg.
Kc lobüllerinde yağlanma farklı alanlarda olur
Santral ( anemi, lösemi, CO zehirlenmesi, ağır
enfeksiyonlar, kalp yetmezliğine bağlı pasif
hiperemi ve anoksi)
Periferal (alkolizm veya besinsel)
Diffüz (mantar, fosfor, kloroform, CCl4, ilaç
toksisiteleri)
KALP: Yağlanma 2 şekilde o.ç
1- Tekirleşme veya kaplan derisi şeklinde
Uzun süren orta derecede ki hipokside o.ç
Ağır anemilerde, endokart altında ve özellikle
papiller kaslarda ki myofibrillerde
2- Diffüz yağlanma
Daha ağır hipoksik durumlarda ve Difteri
myokarditinde (bakterinin ekzotoksini
oksidasyon için kofaktör olan karnitinin
metabolizmasını engeller)
BÖBREK:
Hipoksik nedenler, civa, fosfor ve CCl 4
zehirlenmelerinde Tübüli kontirti
hücrelerinde
Daha ciddi olgularda Bowman kapsülü ve
glomerül kapiller endotelinde
Organ soluk grimtrak esmer renkten,
parlak sarı renge döner
Hücrede zedelenme dışında da yağlı değişiklik o.b
Köpük hücreleri (bazı iltihaplarda)
Atherosklerozda (damar intimasında ki
makrofajlarda ve düz kaslarda kolesterol
esterleri ve yarıkları)
Kolesterol yarıkları (esterlerin kristalleşerek
doku takiplerinde erimesi)
Ksantomlar (subepitelyal bağ dokusu ve
tendonlarda)
Obezite (vücuttaki tüm yağ dokusunda nötral
yağların birikerek vücut ağırlığının artması)
Adipozite ( yağ dokusunda lokal olarak yağın
birikimi)
Yağ infiltrasyonu (parankimatöz organların
stromasında yağ infiltrasyonudur, parankim
hücrelerinde basıya bağlı atrofi ve dejenerasyon
vardır)
Proteinler
Hücreye fazla protein alınması
Hücrelerin aşırı miktarlarda protein
sentezlenmesinden olur
Nefrotik sendromda prox. Tübüllerde
Russel cisimleri (plazma hücrelerinde)
Mallory cisimleri (alkolik kc de)
Alzheimer hastalığında beyinde nörofibriler
düğümler
Glikojen
Glikojenin hi de aşırı depolanması glikoliz veya
glikojen metabolizmasında ki anormallikler
sonucu oç.
DM da böbrek tüp epitelide, kardiyak miyozitler
ve Langerhans hücrelerinin beta hücrelerinde hi de
glikojen birikir.
Glikojen sentezi veya yıkımında ki enzim
kusurlarına bağlı olan glikojen depo hastalıkları ve
glikojenazlar da yoğun depolanmaya sekonder
olarak hücre zedelenmesi ve hücre ölümüne neden
olur
Pigmentler
Ekzojen veya endojen kaynaklı ob.
En sık görülen ekzojen pigment karbondur
ve lenf bezleri ve akciğer parankiminde
antrakozis mg ağır şeklinde akc de
fibroblastik reaksiyon ve amfizem oç ve
kömür işçileri pnömokonyozu oç.
Endojen Pigmentler
Lipofussin
Melanin
Hemoglobin türevleri
Lipofussin (yıpranma pigment), sıvı içinde
çözülmeyen, kahverengimsi sarı, granüler,
hi maddedir
Kalp, kc ve beyin başta olmak üzere çeşitli
dokularda yaş ve atrofi gereği birikir.
Serbest radikaller aracılığıyla olan zedelenmelerde, organel
membranlarında ki doymamış lipidlerinin peroksidasyona
uğraması sonucu oluşan ve lizozamlarca sindirilemeyen
lipit ve protein bileşiklerini temsil eder ve sindirilememiş
organel artıkları olarak membrana asılı veziküller
şeklindedir
Makroskopik olarak organa kahverengi görünüm verdiği
için “Brown atrofi” denir
Mikroskopik olarak hücre için zedeleyici değildir, ancak
daha önce oluşan serbest radikal zedelenmesinin
belirleyicisi olduğu için önemlidir.
Melanin
Melanositlerde tirozinin
dihidroksifenilalanine oksidasyonu
sırasında oluşan kahverengi-siyah endojen
bir pigmenttdir.
Tek kaynağı melanositler ise de deride
bulunan bitişik keratinositlerde veya dermal
makrofajlarda da toplanabilir.
UV ışınlarından koruyucudur
Hemosiderin
Hemoglobin türevi sarı-kahverengi pigmenttir
Lokal veya sistemik demir fazlalığında dokularda
birikirler
Demir+apoferritin= ferritin miçelleri
Hemosiderin bu ferritin miçellerinin büyük
kümeleridir.
Bu pigment varlığı temelde patolojik bir süreci
göstermekle birlikte, k.i, dalak, kc gibi yaygın
eritrosit yıkımının olduğu organlarda
makrofajlarda az miktarda bulunması normaldir.
Lokal demir ve hemosiderin birikimi, küçük
kanama sonucu mg (çürük, kontüzyon)
kanama→eritrosit yıkımı→artıkların
fagositozu→hemoglobinin lizozomlar ile
katabolize edilmesi→hemosiderinde ki
HEM demiri birikir
Hemoglobin (kırmızı-mavi)
→biliverdin,biluribin ( yeşil-mavi)
Demirin sistemik fazla yüklenmesi= Hemosiderozis
Öncelikle kc, ki, dalak ve lenf bezlerinde fagositlerde
İkincil olarak kc, kalp, pankreas ve endokrin organlarda
birikir
Hemosiderozis;
1- Diyetteki demirin artan emilimi
2- Demir kullanımının bozulması
3- Hemolitik anemiler
4- Transfüzyonlar
Hemosiderosizde organ fonksiyonları
bozulmamasına rağmen, daha ağır formu
olan hemokromatozis te kc de fibrozis, kalp
yetmezliği ve DM u kapsayan doku
zedelenmeleri görülür
Doku da demiri göstermek için “Prusya
Mavisi” boyası kullanılır
Patolojik Kalsifikasyonlar
Fe, Mg ve diğer minerallerle birlikte kalsiyum
tuzlarının anormal depolanmasıdır
1- Distrofik kalsifikasyon: Kalsiyum
metabolizmasının ve kan kalsiyum seviyesinin
normal olduğu durumlarda; ölmüş veya
zedelenmiş dokularda ki kalsifikasyon
2- Metastatik kalsifikasyon: Kalsiyum metabolizma
bozukluğunda (hiperkalsemi), normal dokularda
görülen kalsifikasyon
Distrofik kalsifikasyon
Her tip nekroz alanında görülebilir
Aort ve büyük arterlerde lipit birikimi ile
karakterli intimal zedelenme alanları olan ilerlemiş
aterosklerozun ateromlarında
Bu kalsifikasyon önceki bir hücre zedelenmesinin
göstergesi ise de kendisi de fonksiyon
bozukluğuna neden olur
Aort kapaklarının distrofik kalsifikasyonu
yaşlılarda kalsifiye aort darlığının önemli bir
nedenidir
Morfolojik, kalsiyum tuzları makraskopik
olarak ince, beyaz, granül veya yığınlar
halinde görülür ve kumlu birikintiler
şeklinde hissedilir
Mikroskopik olarak hi ve/veya hd bazofilik
depolanmalar şeklindedir
Zamanla kalsifikasyon odağında heterotopik
kemik dokusu gelişebilir.
Patogenezinde, herbiri hi veya hd olabilen
çekirdek ve ilerleme dönemlerini kapsar,
son ürün kalsiyum fosfat kristallerinin
oluşumudur.
Başlangıçta hd da membrana bağlı
veziküller şeklindedir ve bunların kaynağı
dejenere hücrelerdir( kıkırdak ve kemikte
matriks vezikülleri)
Hi de kalsifikasyon, hi Ca u düzenleme yeteneğini
kaybetmeden ölmüş veya ölmekte olan hücrelerin
mitekondrilerinde başlar, sonra kristal şekilleri oluşur
Başlangıçta membrana bitişik veziküller iken daha sonra
kristal şekileri oluşur
( bu hd da Ca ve fosfat yoğunluğuna, mineral
inhibitörlerin varlığına v e kollejenizasyonun derecesine
bağımlıdır)
Kollojen ve osteopontin kristal oluşum hızını artırır
Metastatik kalsifikasyon
Hiperkalsemide oç ve bu 4 nedenle oluşur
1- Primer paratiroid tümörleri veya PTH
sentezleyen başka tümör varlığında
2- Kemik yıkımının fazla olduğu durumlarda
( Paget’s hasatlığı, multipl myelom, lösemi ve
diffüz kemik metastazları varlığında
3- Vitamin D –bağımlı hastalıklar ve sarkoidoz
4- Fosfat birikiminin sekonder hiperparatiroidizme
neden olduğu böbrek yetmezliği
Morfolojik olarak, distrofik kalsifikasyona benzer
Kalsifikasyon vücutta yaygın olarak
gelişebilmekle birlikte başlıca damarlar, böbrekler,
akciğerler ve mide mukazasının interstisyel
dokuları etkilenir
Klinik bozukluklara neden olmamakla birlikte
bazen solunum yetersizliği ve nefrokalsinozise
neden ob
HYALEN DEĞİŞİM
Hyalen, HE boyalı kesitlerde hi veya hd da
görülen, homojen pembe renk dğişimine
verilen isimdir
Birçok nedenle ob, her durumda biriken
madde farklı ob, fakat mikroskopik
görünüm aynıdır
Hi hyalenler; Mallory alkolik hyalen, Russel cisimleri,
hyalen damlacıklar
Hd hyalen, hi hyalende olduğu gibi farklı patogenetik
mekanizmalar ve biriken farklı proteinler vardır.
Amiloid
Kronik hipertansiyon ve diyabette arteriol duvarında
hyalinizasyon
Alveol boşluklarında proteinöz madde (hyalen
membran)
Skar dokularında hyalinizasyon
REVERSİBL VE İRREVERSİBL
ZEDELENME
Hücre zedelenmesinin moleküler
mekanizmasında:
1- Hücreyi zedeleyen ve ölümcül olmayan yollar
2- Hücre içerisinde birçok makromolekül, enzim
ve organeller arasında sıkı ilişki olduğundan
primer bir zedelenmeyi sekonderden ayırt etmek
güçtür
3- İrreversibl hasarın meydana geldiği “geri
dönüşü olmayan nokta” bilinmemektedir
Zedelenmeyi oluşturan ilk neden ne olursa
olsun hücrede 4 sistem incinebilir
1- Membran bütünlüğü
2- Mitekondride aerobik solunum
3- Protein sentezi
4- Genetik yapı bütünlüğü
N.ş.a da hücre bunlardan hhb nin
bozukluğunu tolere edebilir ve zedeleyici
uyarı hafiflerse normale dönebilir.
Kalıcı ve aşırı zedelenme varlığın da
hücrenin eşiği aşılarak irreversibl
zedelenme oç.
Reversibl Zedelenme Morfolojisi
Ultrastrüktürel değişiklikler
1- Plazma membran değişiklikleri
Mikrovillüsların kabarcıklanms, küntleşmesi veya
bozulması ve hücreler arası bağların gevşemesi
2- Mitekondrial değişiklikler
Mitekondrilerde şişme ve fosfolipitten zengin şekilsiz
yoğunlukların belirmesi
3- EPR un genişlemesi
Polizomların ve ribozomların ayrılması
4- Nükleer değişiklikler
Granüler ve fibriler elemanların dağılması
Reversibl zedelenme= dejenerasyon”
Öldürücü olmayan hücre zedelenmeleri
sonucunda mg morfolojik değişikliklerdir
Işık mikroskobu seviyesinde 2 farklı şekilde
o.ç
Hücresel şişme
Yağlı değişme
Hücresel şişme
En sık , en hafif zedelenme
1858 de virchow “bulanık şişme”, “Parankimatöz
dejenerasyon” denmiş
“Albüminöz dejenerasyon” sitoplazmanın bulanık,
granüler, vakuollü görünümü nedeniyle
“Hidropik veya vakuoler dejenerasyon”
Temel olay hücre metabolizmasının bozulması
sonucu hücrenin osmotik basıncının artması ve
sıvı abs ile şişmesidir
Enfeksiyonlar,otoentoksikasyonlar,ısı farklılıkları ve anoksiye
neden olan etkenler sonucu o.ç
Makroskopik; organ büyür (hücrelerde sıvı
toplanasından), kapsülü gerilir, kesit yüzeyi
bombeleşir, rengi solar (kapillerlerin basınç
altında kalmasından)
Suda haşlanmış görünümü
Mikroskopik; hücrelerin büyüdüğü,sitoplazmanın
bulanık, granüler (albüminöz dejenerasyon) ve
vakuollü bir hal aldığı görülür
Eğer etkileyen olay daha şiddetli ise hi de
Vakuoller (bunlar şişen ,parçalanan EPR
parçalarıdır) o.ç
Vakuoller arasındaki sitoplazma retiküler
manzarada ve hafif eozinofiliktir
Buna “hidropik veya vakuoler
dejenerasyon” denir
İrreversibl zedelenme;
Tüm membranlarda yaygın hasar
Lizozomların şişmesi
Mitekondrilerde vakuolizasyon ile birlikte olup
ATP oluşum kapasitesinde azalma ile birliktedir
Hd Ca u hi ne girer, hi Ca depoları serbest kalarak
membranları, proteinleri, nükleik asitleri ve ATP
yi parçalayan enzimlerin aktivasyonuna yol açar
İrreversibl zedelenmenin en erken
ultrastrüktürel işaretlerinden birisi;
Mitekondrial matrikste şekilsiz, Ca dan
zengin yoğunlukların birikmesidir.
Bundan sonra aşırı geçirgen
membranlardan proteinlerin, esansiyel
koenzimlerin ve ribonükleik asitlerin
kaybı devam eder
Hücrelerden ATP için gerekli metabolitlerin
sızması ile hi yüksek enerjili fosfatlar daha
azalır.
Lizozomal membranların zedelenmesi
enzimlerin sitoplazma içine sızmasına yol
açar, asit hidrolazlar hi de oluşmuş asidik
pH da aktifleşerek sitoplazmik ve nükleer
elemanları parçalar.
Hücre ölümünden sonra hücresel elemanlar
lizozomal enzimlerin etkisiyle sindirilmeye
devam eder, potansiyel yıkıcı hücresel
enzimler hd na yaygın olarak sızar
Ölü hücreler sonun da myelin şekiller
olarak tanımlanan helezon şeklinde
fosfolipid kitlelerine dönüşebilir.
Bu fosfolipid kitleleri daha sonra ya diğer hücreler
tarafından fagosite edilir, ya da yağ asitlerine
parçalanır , bu yağ asitlerinin kalsifikasyonu Ca
sabunlarının oluşumuna neden olur.
Hi proteinlerinin parçalanmış hücre mebranından
geçerek periferik dolaşıma sızması, kan serum
örneklerinde dokuya özgül hücre zedelenmesi ve
ölümünü göstermeyi sağladığından önemlidir
Örneğin kalp kası “kreatin kinaz”, kc ve
safra yolları “alkalen fosfataz”,
“SGOT(serum glutamik oksaloasetik
transaminaz), LDH” kc , akc, pankreas ve
böbrekteki irreversibl hasarı göstermesi
açısından önemlidir
Sonuç olarak;
1- İrreversibl zedelenme en sonunda
oksidatif fosforilasyonu ve dolayısıyla
hayati ATP sentezini etkiler,
2- Membran hasarı letal zedelenmede kritik
bir noktadır
3- Ca hücre ölümünde ki nihai morfolojik
değişikliklerin potansiyel bir aracıdır.
İRREVERSİBL HÜCRE
ZEDELENMESİ
A- Mitekondrial fonksiyon bozukluğunun geri
döndürülmesindeki yetersizlik
1- Özellikle mitekondrilerde membrana bağlı
Ca’un mitekondri içine girmesi önemlidir
ÇÜNKÜ; Ca oksidatif fosforilasyonun önemli
bir inhibitörüdür
2- Mitekondrilerde kristalarda dahil
vakuolizasyon ve matriksde şekilsiz, Ca dan
zengin amorf yoğunlaşmalar vardır
B- Hücre membranlarının geniş hasarı
(proteinlerin, RNA ve koenzimlerin, yüksek enerjil
fosfatların hücre dışına kaçması)
C- Lizozomların aşırı şişmesi ve geçirgenliği
artmış membranlardan enzimlerin (RNA az, DNA
az, proteaz, fosfotaz, ..) sitoplazmaya geçmesi ve
aktive olması ile başta RNA, DNA ve glikojen
olmak üzere hücreyi enzimatik sindirime uğratır
2 olay irreversibiliteden sorumludur
1- Membran fonksiyonlarında ağır hasar
2- Mitekondirilerdeki fonksiyon bozukluğunun
düzelememesi
Hücre membranında ki en önemli değişiklik
fosfolipidlerin kaybıdır
Hem sentezinin azalması (membran fosfolipidlerinin OH
radikalleri ile reaksiyona girmesi, mg organik asitten yoksun radikallerin
ortamda ki O2 ile peroksitleri oluşturması ve oluşan peroksitlerin
otokatalitik reaksiyonları başlatarak daha fazla doymamış yağ asidi
kaybına sebep olması)
Ca’a bağlı olarak aktive olan fosfolipazlar ile
parçalanmanın artışı
İrreversibl zedelenmenin patogenezinde
hücre membran hasarı ana faktördür
Hacım regülasyonunun kaybı
Hücre dışı moleküllere karşı permeabilite
artımı
Ultrastrüktürel olarak göserilebilen plazma
membran defektleri
Membran hasarının nedenleri zedelenmenin
bazı şekillerinde rol oynar:
1- Membran fosfolipidlerinin ilerleyici
kaybı
İskemiye bağlı sitoplazmik Ca artışı
(fosfolipaz aktivasyonu)
ATP bağımlı reaçilasyonun veya
fosfolipit sentezinin azalmasına sekonder
2- Hücre iskelet anormallikleri
Hi Ca seviyesinin artmasıyla aktive olan
proteazlar hücre çatısına zarar verir
Bazı zedeleyiciler hücre membranının hücre
iskeletinden ayrılmasına neden olarak
membranı gerilmeye ve yırtılmaya hassas
hale getirirler
3- Serbest oksijen radikalleri
Hücre membranı ve diğer hücre
elemanlarına zarar verir
Bu radikaller özellikle
“iskemi/reperfüzyon” zedelenme modelinde
ortama dolaşımla gelen lökositler ile
ortamda Ca seviyesinin artımı ile ilgilidir
4- Lipit yıkım ürünleri
Fosfolipit parçalanması sonucu iskemik
hücrelerde biriken bu katabolik ürünler
membranlar üzerinde deterjan etkisi yapar.
***Membran hasarının mekanizması ne olursa olsun
sonuçta;
Hi materyallerin yoğun sızıntısı ve Ca un bol miktarda hi
ne girmesi ile sonlanır.
Hücre ölümünden sonra, hücre ilerleyici bir şekilde
enzimler tarafından parçalanmaya başlar ve sonunda
hücrenin yerinde myelin şekiller halinde fosfolipit kitlesi
kalır
Bu kitle ya fagositik hücrelerce fagosite edilir, ya da yağ
asitlerine ayrılır
Y.a lerinin de kalsifikasyonu ile kalsiyum sabunları mg.
İRREVERSİBL HÜCRE
ZEDELENMESİ VE NEKROZ
NEKROBİOZ: nekroz yapan etkenin hücreye etki
yapmasından başlayarak nekroz oluşumuna kadar
geçen süre içerisinde oluşan morfolojik
değişikliklerdir
NEKROZ: genellikle öldürücü zedelenmeye
uğramış hücrelerde, enzimlerin progressif etkisi ile
oluşmuş morfolojik değişikliktir
(Fiksatife konulan doku ölü, fakat nekrotik
değildir)
OTOLİZ: Hücre ölümü sonunda, hücreden açığa
çıkan enzimlerle hücrenin kendi kendini
sindirmesidir.
Nekroz; aynı zamanda canlıda gelişen otolizdir
HETEROLİZ: Nekroz alanına gelen lökositlerin
lizozomlarından kaynaklanan enzimlerin etkisi ile
sindirim olması
POSTMORTEM DEĞİŞİKLİK: Ölü bir
organizmada meydana gelen otolizdir.
Bu olayların gelişmesi için saatler gereklidir.
Ani ölüme neden olan MI de hücrelerde ki
değişiklikler ortaya çıkarılamaz
Myokardial hücre ölümünden 20-40 dakika sonra
ultrastrüktürel değişiklikler oç
Hasarlı miyokarddan salına enzimlerin kanda
tespiti 2 saat sonra mümkündür
İrreversibl zedelenme oluştuktan 4-12 saat sonra
nekrozun klasik histolojik özellikleri oç.
Nekroz;
Yaşayan organizmanın ancak bir
parçasında görülebilir
Çevresinde iltihabi reaksiyon gelişir
Mide, pankreas gibi organlarda
lizozomlar fazla olduğu için otoliz hızlı,
kc, kalp, böbrekte daha yavaş gelişir
Fizyolojik ölüm; canlıda meydana gelen,
ancak nekroz olarak adlandırılmayan hücre
ölümleridir.( epidermisin yenilenmesi, kan
hücreleri)
APOPİTOZİS: canlıda hücrelerin tek ya da
gruplar halinde, kendi kendilerini programlı
şekilde yok ederek ortadan kalktıkları
fizyolojik bir ölüm şeklidir.
NEKROZ
Nekrozda iki temel olay vardır
1- Hücrenin enzimatik sindirimi:
Enzimler ölü hücrenin lizozomlarından
kaynaklanıyorsa buna otoliz, o bölgede
bulunan veya göç eden lökositlerin
lizozomlarından kaynaklanıyorsa heteroliz
denir
2- Proteinlerin özelliklerinin değişmesi
( denatürasyonu).
Nekrozun genel morfolijik
özellikleri
Makroskopik: Canlı dokunun saydamlığı kaybolur,
opaklaşır, beyazımsı veya sarımsı renk alır.
Mikroskopik: öncelikle sitoplazmada, sonra nükleusta
değişiklikler m.g. Sitoplazmik olarak:
1- Sitoplazmada HE ile eozinofili artar
Ölü hücrede kısmen sitoplazma içinde ki niteliği
bozulan proteinlere eozinle bağlanmanın artması,
kısmen de bazik boyalar ile boyanmanın kaybına
bağlı
Bazofili normalde sitoplazmada ki RNA ile sağlanır
2- Glikojen kaybına bağlı olarak daha camsı,
homojen görünümdedir
3- Sitoplazmada beliren vakuoller nedeniyle
güve yeniği manzasarı
4- Sonuçta kısmen erimiş, granüllü,
pıhtılaşmış, asidofilik sitoplazma o.ç. ve ölü
hücrelerde Ca tuzlarının birikimine bağlı
olarak doku sertleşebilir.
Nekrozda nükleusta ki morfolojik
değişiklikler
Herbiri DNA nın spesifik olmayan yıkımı sonucudur
1- En erken bulgu kromatinin nükleus membranı ve
nükleolus etrafında kümelenmesi (reversibl)
2- Piknoz (irreversibl, apopitozis de de görülür, nükller
büzülme ve bazofilide artma, koagülasyon )
3- Karyolizis (lizozomal kaynaklı DNA az etkisi
(likefaksiyon)
4- Karyoreksis ( piknotik nükleusun parçalanmasıdır, bir
iki gün içinde ölü hücrde ki nükleus tamaman kaybolur)
Nekroz tek hücrede ise normal hücrelerden ayrılır
yuvarlak görünüm alır
Birkaç hücreyi ilgilendiriyorsa değişik büyüklükte
kitleler
Nükleusun erimesi ve parçalanması ile kitleler
diffüz olarak eozin ile boyalı asidofilik hal alır
Ca tuzları çökerse yer yer bazofilik boyanma olur
NEKROZ ÇEŞİTLERİ
1- Koagülasyon (pıhtılaşma)
2- Kollikuasyon (likefaksiyon)
3- Özel nekroz tipleri
Kazeifikasyon
Gangrenöz
Yağ nekrozu
Fibrinoid
Gom
Balmumu
Koagülasyon Nekrozu
En sık görülen nekroz çeşididir.
Yapısal ve enzimatik proteinlerin koagülasyonu ile
karakterlidir
Enzimatik proteinlerde denatüre olduğu için
hücresel proteoliz gecikir.
Makroskopik olarak doku haşlanmış et
görünümlü, kuru ve donuktur
Nekrozun yaşına bağlı olarak görünüm değişir
Erken dönemde soluk, sert ve şişkin, ileri
dönemde sarımsı ve yumaşak görünümlü
Mikroskopik olarak, hücre sınırı ve doku
yapısının tanınmasına imkan sağlayacak
şekilde hücrenin ana şekli korunur (buzlu
camın arkasından bakar gibi)
Ancak nukleus ortadan kalkmış, hücre
asidofilik ve opak bir hal almıştır
Hücre proteolizi gerçekleşemediği için ölü
doku ancak heteroliz ile ortadan kalkar
Bu nekroz:
1- Kan akımının ani olarak kesilmesi
durumlarında
Kalp, böbrek, dalak enfarktüsleri gibi
hipoksik/anoksik zedelenme
2- Tümörlerde
3- Formaldehit, civa ve asit toksisiteleri ve
bazı bakteri toksinleri
Likefaksiyon Nekrozu
(Kollikuasyon veya Erime)
Proteinlerin denatürasyonundan önce hidrolitik
enzimlerin etkisi ile dokuda erimenin ön planda
olduğu nekroz çeşidi
Erimeyi sağlayan enzimler dokudan,
makrofajlardan veya parazitler ve
mikroorganizmalardan kaynaklanabilir.
Erime primer veya önceden oluşan koagülasyon
alanının proteolizine bağlı sekonder ob
Nekroz alanının bakteriler tarafından
enfekte olması veya abseleşmesi halinde
gerek bakterilere gerekse ortamda ki
lökositlerin litik etkisine bağlı oç
(Tüberkülozda kavernler bu yolla oluşur)
Likefaksiyon Nekrozunun görüldüğü olaylar
1- SSS de iskemik zedelenme dahi olsa
likefaksiyon nekrozu oç
2- Pyojenik mo ların etkisiyle ortaya çıkan
bakteriyal enfeksiyonlarda
3- Mide mukozası ve pankreas gibi enzimlerden
zengin dokularda
4- Amiplerin içerdikleri kuvvetli hidrolitil
enzimler sayesinde barsakta
5- Alkalilerle zehirlenmede
Makroskopik olarak; ortası hücresel artıklar
ve lökosiler içeren sıvı ile dolu olan nekroz
alanı yumuşaktır
Zamanla sıvı rezorbe olarak kistik görünüm
oç
Kist duvarında kapiller proliferasyon ve
fagositik hücreler içeren gevşek bağ dokusu
Kazeifikasyon Nekrozu
(peynirleşme)
Koagülasyon nekrozunun özel şeklidir
Koagülasyon ve likefaksiyon biraradadır
Tüberküloz için karakteristik olmakla birlikte,
brucella, tularemi, ve mantar enfeksiyonları,
sarkoidoz da görülebilir
Nekroz gelişiminde tbc basilinde ki yüksek
moleküllü lipoi maddelerin toksik etkisi rol oynar
Makroskopik olarak yumuşak, kolay
parçalanabilen ve dokudan kolaylıkla ayrılabilen,
sarımtırak-gri beyaz renkli
Mikroskopik olarak, hücrelerin sınırları
belirsiz ancak tam olarak eriyememesi
sonucu amorf, granüler kitle şeklinde olup
nekroz alanı granülomatöz bir reaksiyonla
çevrilidir.
Kazeöz materyalin uzun süre dokuda kalması, tbc
basilinde ki kh ve fosfatit reaksiyonlarının, hücre
sitoplazmasında ki hidrolitik enzimleri inh etmesi
ya da parçalaması sonucu otolitik olayların kolay
gelişmememsne bağlı
Ayrıca nekroz çevresi normal dokuda damaralrın
sınırlı gelişimi ve nekrozun fibrozis ile
çevrelenmesi de nekrozun uzun süre dokuda
kalmasını sağlar
Gangrenöz Nekroz
Özellikle alt ekstremitelerde görülen, iskemik
nedenlerle oluşan koagülasyon nekrozodur
Yaşlılarda ateroskleroza bağlı “senil gangren”
Diyabetik kişilerde
Çavdar mahmuzu zehirlenmelerinde
Donmalarda
Burger hastalığı(Tromboanjitis obliterans)
Reynaud hastalığı
Gangrende koagülatif olaylar baskınsa doku
su kaybederek kurur, buruşur, koyu kahve
ya da siyah renge dönüşerek mumyaya
benzer görünüm alır (Kuru gangrenmumyalaşma nekrozu)
Komşu dokuda gelişen iltihabi reaksiyon sonucu
ölü ve canlı dokunun kesin olarak ayrıldığı
demarkasyon hattı oluşur.
Yaş Gangren: Kuru gangrene bakteriyal
enfeksiyon eklendiğinde dokuya likefaksiyon
hakim olur. Saprofit m.o’ ların etkisi ile dokuda
sulanma ve pütrefaksiyon sonucu kokuşma oluşur.
Gazlı Gangren: Ölü dokuya Clostridium Welchii
gibi anerobik m.o’ların bulaşmasıyla oluşur.
Yağ Nekrozu
İki şekilde olur:
1- Enzimatik yağ nekrozu:
Yağlar üzerine etkili enzimlerin açığa çıkması
sonucu oluşur.
Akut pankreatitte görülür. Pankreas ve çevre yağ
dokusunda özellikle karın içerisinde yağ
dokularında nekroz oluşur.
Açığa çıkan aktifleşmiş lipazın kana karışması
sonucu karın boşluğu dışında cilt altı gibi uzak
bölgelerdeki yağ dokusunda da nekroz oluşabilir.
Zedelenen hücreden açığa çıkan lipazın
trigliseritleri hidrolize etmesi sonucu yağ asitleri
ve gliserol meydana gelir.
Yağ asitleri kalsiyumun etkisiyle sabunlaşır.
Böylece yağ dokusunda tebeşir gibi sert beyaz,
küçük nodüller belirir.
Mikroskobik olarak yağ hücrelerinin sınırlarının
kısmen seçilebildiği soluk, bazofilik, amorf madde
içeren düzensiz alanlar ve çevrede iltihabi
reaksiyon görülür.
2- Travmatik Yağ Nekrozu:
Meme dokusunda, karın ve ekstremitelerde deri
altı yağ dokusunda görülür.
Travma sonucu hücrelerden açığa çıkan yağlar
iltihabi reaksiyona yol açar.
Lipo granülom olarak adlandırılan yabancı cisim
dev hücreleriyle karakterli granülasyon dokusu
oluşur.
Nekroz alanının sert nodüller şeklinde
hissedilmesi nedeniyle tümörle karışır.
Fibrinoid Nekroz
Gerçek anlamda hücre ölümü olmayan
ancak nekrotik hücreye ve fibrine benzer
madde varlığında kullanılır.
Özellikle immünolojik olaylar sonucu
damar duvarlarında görülür.
Gom Nekrozu
Sifilisin 3. döneminde görülen gomlarda gelişen
kazeifikasyon ve koagülasyon nekrozlarının
özelliklerini yansıtır.
Nekroz alanı yuvarlak, içerdiği zengin damar
ağına bağlı olarak elastik kıvamdadır.
Mikroskobik olarak nekroz alanı içindeki damar
siluetleri ve çevre dokuda granülasyon dokusu
karakteristiktir.
Balmumu Nekrozu
Kaslarda ağrı, kanama ve yırtılmalara yol açan
Zenker ya da hiyalen nekroz olarak ta tanımlanır.
Difteri, tifo, tifüs, çiçek, pnömoni ve kızıl gibi
bazı enfeksiyonlarda görülür.
Özellikle rectus abdominis, diyafragma, kol, bacak
ve omuz kaslarında, kalp kasında ve bazen larinks
kaslarında görülür.
Kaslar balmumunu andırır. Sarkoplasmik
çizgilenme ve nükleuslar kaybolmuştur.
Nekrozun Sonuçları
Nekrozun geliştiği parankim hücrelerinin
rejenerasyon kabiliyetine, nekroz alanının
büyüklüğüne ve organizmanın direncine
bağlı olarak;
1- Tamamen kaybolabilir.
2- Kist ya da ülser gelişebilir.
3- Fibröz doku oluşur.
4- Distrofik kalsifikasyonlar oluşabilir.
APOPİTOZİS (programlı hücre ölümü)
Nekrotik hücre ölümünde oluşan hücresel “cinayet” den ziyade
hücresel bir “intihardır”
Apopitozisn tarihçesi, ilk kez 1885 yılında Flemming’in
kromatolizisi tanımlaması ile başlamış, 1950 lerde lizozomların ve
1960 lı yıllarda serbest radikallerin keşfi ile hücre intiharı kavramı
ortaya çıkmış
1970 li yıllarda ise programlı hücre ölümü kavramı oç
Apopitozis ile ilgili ilk önmeli çalışma 1972 yılında Kerr
tarafından, atrofiye giden kc dokusunda hücrelerin farklı bir
morfoloji oluşturduktan sonra ortadan kalktığını tanımlamış
1984 yılında Wyllie, apopitoziste görülen DNA
kırıklarının karakteristik “merdiven paterni”
gösterdiğini jel elektroforezinde tanımlamış
1990 ların ikinci yarısında ise, apopitosiz
mekanizmaların da ki “caspase” aktivasyonu ve
apopitotik hücrelerin fagositozu ile ilgili
mekanizmalar ve mitekondrial membran
geçirgenliğinde ki değişiklikler
Apopitozisin görüldüğü patolojik ve
fizyolojik olaylar
1- İmplantasyon, orgonogenezis ve gelişimsel involüsyonu
kapsayan Embriyogenezis ve metamorfozis (başkalaşım)
süresince
2- Yetişkinlerde hormona bağımlı involüsyonlar (menepozda
over follikülerinde atrezi, laktasyon sonrası meme regresyonu)
3- Sürekli çoğalan aktif hücrelerde hücre sayısının
azaltılması (fizyolojik ölüm) (barsak kript epiteli, hematolojik
hücreler)
4- Tümörlerde hücre ölümü (özellikle regresyon veya aktif
çoğalma sırsında bulunan tümörlerde)
5- Sitokin tükenmesinden sonra B ve T lenfositleri ile
birlikte gelişen timusta otoreaktif T hücrelerinin ortadan
kalkması gibi bazı immün hücrelerin ölümü
6- Hormona bağımlı dokularda patolojik atrofi
( orşiektomi sonrası prostat atrofisi, glukokortikoid kullanımı sonucu timusta
lenfosit kaybı)
7- Parankimal organlarda duktus obstrüksiyonlarını
takiben oluşan patolojik atrofiler (pankreas, parotis, böbrek)
8- Sitotoksik T lenfositlerin yol açtığı hücre ölümü
(graft-versus host)
9- Bazı viral hastalıklarda ki hücre zedelenmesi
(Councilman cisimleri)
10- Nekroz oluşturabilecek düşük dozda etkili hafif
ısı, radyasyon, sitotoksik antikanser ilaçlar ve hipoksi
gibi bazı zedeleyici etkenlerin oluşturduğu hücre
ölümü gibi olaylar
Apopitozisin Morfolojik Özellikleri
Işık mikroskobunda HE boyalı kesitlerde
tek veya gruplar halinde
yuvarlak veya oval,
nükleer parçalar içerebilen,
yoğun eozinofilik sitoplazma kitleleri şeklindedir.
Pekçok yönden nekroza benzemekle birlikte bazı
farklılıklar vardır.(Nekrozun aksine iltihabi hücre
içermediği için ışık mikroskobunda tespiti güçtür)
****Hücrelerin fizyolojik apopitozise
girmelerinde ki yetersizlik ;
Aberan gelişime
Tümör proliferasyonunun engellenememesine
Otoimmün hastalıklara neden olur.
Apopitozis en iyi elektron mikroskop ile izlenir ve
burada ki bulguları:
1- Hücre büzüşmesi: Hücre normal boyutuna göre
küçülür, sitoplazma yoğunlaşır, organeller normal
olup birbirine yaklaşır
2- Kromatin yoğunlaşması: Apopitozisin en
karakteristik bulgusudur. Kromatin en periferde,
nükleer membran altında , iyi sınırlı, değişik
büyüklükte ve şekilde yoğunlaşmış kitleler halinde
kümeleşir. Nükleus iki veya daha fazla parçaya
ayrılmış ob
3- Sitoplazmik kabarcıklar ve apopitotik cisimlerin
oluşumu: Apopitotik hücrelerin yüzeyinde önce
kabarcıklar oluşur, sonra bunlar sitoplazma ve
organeller içeren, membranla cevrili parçalara
ayrılır, bu parçalarda nükleer parçalar da ob
4- Apopitotik hücre veya cisimlerin fagositozu: Bu ya
komşu parankimal hücre veya makrofajlar tarafından
olur. Apopitotik cisimlerin içinde bulunan lizozomlarla
hızla parçalanarak yeri komşu hücrenin migrasyonu
ya da proliferasyonu ile doldurulur
Apopitoz Mekanizmaları
1- Sinyalleşme:
İç kaynaklı programlanmış olaylardan, büyüme
faktörlerini yokluğu, özgül reseptör(Fas)-ligand
etkileşimleri, sitotoksik T hücrelerinden enzimlerin
salınması veya radyasyon gibi zedeleyici ajanlar gibi
pekçok mekanizma ile tetiklenebilir
Zardan geçen sinyaller, ya daha önce var olan ölüm
programlarını önleyebilir veya ölüm dizisini
başlatabilir ki bunlardan en önemlisi TNF-alfa
familyasına aittir. Bunlar Fas yüzey moleküllerini
kapsar
Bu plazma membran reseptörleri bir hücre içi “ölüm
bölgesi” protein dizisini paylaşır ki bunlar
oligomerize olduğu zaman başlatıcı kaspazların
aktivasyonu ve ölümle sonlanan enzim dizilerinin
aktivasyonuna yol açar
2- Kontrol ve integrasyon:
Orijinal ölüm sinyalleri özgül proteinlerle
gerçekleştirilir
Bu proteinler, etkilerinin ya “kesinleşmesi” ya da
“başarısızlıkla” sonlanması nedeniyle önemlidir
Bu safha da 2 ana yol vardır.
A- Ölüm sinyallerinin özgül adoptör proteinler ile
infaz mekanizmalarına direkt iletilmesi
B- Mitekondrial permeabilitenin BCL-2 protein
familyasının üyeleri ile düzenlenmesi
Mitekondrial membranın iç kısmında ki delikler
membran potansiyelinin azalması ve organelde
şişmeye, dıştaki membran permeabilitesinin artması
apopitozisi tetikleyen sitokrom C nin sitoplazmaya
salınımına neden olur.
Serbestleşen sitokrom C nin bazı sitoplazmik
proteinleri (Apaf-1, proapopitotik proteaz aktivatörü)
aktive ettiği , hücreyi öldüren infazcı kaspaz
aktivasyonunu tetiklediği ve proteolitik olayları
başlattığı
BCL-2 ;
mitekondriyal permeabilite artışını engelleyerek ve
Apaf-1 gibi proteinleri sabitleyerek kaspaz
aktivasyonu inhibe etmek suretiyle apopitozisi inhibe
eder
BCL-2 ailesinin diğer üyeleri buna bağlanarak bunun
antiapopitotik aktivitesini hafifletir
Böylece BCL-XL apopitozisi inh ederken, BAX ve
BAD apopitozisi artırıcı etki yapar
3- İnfaz:
Bu final yol birtakım sitoplazmik enzimlerin sentezi
ve/veya aktivasyonu sonucu oluşan biyokimyasal
olaylar dizisidir
Kaspaz yeni tanımlanmış bir proteaz sınıfı ile protein
yarıklanmasıdır.Kaspazların hhb nin aşırı varlığı
apopitozise neden olur . Bu gibi bir veya daha fazla
enzim aktivasyonunun hücre intiharı ile sonlanacak
diğer proteazları aktive ettiği
Transglutaminaz aktivasyonu ile yaygın protein
çapraz bağlanmasının hücre iskelet proteinlerini kolay
parçalanabilir şekle çevirir
Ca ve Mg bağımlı endonükleaz aktivasyonu ile DNA
yıkımı gerçekleşir
Bu parçalanma apopitozis de “merdiven” bulgusu
denilen 180-200 baz çifti katlarında gerçekleşirken,
nekroz da gelişigüzel parçalanma şeklindedir.
Merdiven bulgusu nekrozun erken döneminde de
görülebileceğinden apopitozis için tanısal değildir
4- Ölü hücrelerin ortadan kaldırılması:
Apopitotik hücreler veya cisimciklerin komşu hücreler
veya fagositler tarafından ortadan kaldırılmasını
kolaylaştıran yüzey reseptörleri vardır
Bu reseptörler apopitotik hücrenin iç sitoplazmik
yüzünden dış yüze doğru fosfatidilserinin
çevrilmesiyle olur
Bu ve diğer değişiklikler iltihabi öncül mediyatörler
salınmaksızın apopitotik hücrelerin erken tanınması ve
fagositozunu sağlar
Özet olarak apopitozis,
Hücre ölümünün özel bir şeklidir
Karakteristik kromatin kümelenmesi ve DNA
parçalanması vardır
Normal gelişim, organogenezis, immün fonksiyonlar
ve doku gelişiminde ve patolojik olaylarda etkilidir
Sitoplazmik Ca artışı ile endonükleaz aktivasyonunun
DNA parçalanmasını sağlaması, transglutaminaz
aktivasyonun volüm ve şekil değişikliklerine yol
açması
Apopitotik cisimlerin yüzeylerinde ki reseptörler ile
fagositozu
Bazen apopitozisin oluşumu için gen
transkripsiyonları ve protein sentezi gereklidir
Normalde BCL-2 onkogeni sitokinler ve hormonların
neden olduğu apopitozisi inh ederek hücre yaşamını
uzatır
C-myc onkogeninin protein ürünleri hem apopitozisi
hem de BCL-2 ile birlikte hücre büyümesini stimüle
eder
P-53 apopitozisi stimüle eder ancak bazı tümörlerde
bunun mutasyonu veya yokluğunda apopitozis inh
olur
APOPİTOTİK İNDEKS. 10 Büyük büyütme alanında
ki apopitotik hücrelerin diğer hücrelere oranıdır
İndeksin azalması hücre çoğalmasını gösterir.
Apopitozisde inflamatuvar cevabın olmamasının
nedenleri:
1- Burada memran hasarı olmadığı için hücre
dışına çıkarak kemotaktik rolü oynayan madde
salınımı yok
2- Apopitotik cisimleri fagosite eden hücrelerden
salınan sitokinler inflamatuvar yanıtın
gerçekleşmesini inhibe ederler
3- Apopitotik cisimlerin fagositozunun hızlı
yapılması
Apopitozisin gösterilmesinde
kullanılan yöntemler
1- Işık mikroskopik seviyede apopitotik indeks
hesaplanması( ancak apopitozisin erken safhalarında ki hücreleri,
nekrozun karyorektik hücrelerinden ayırmak güçtür, ayrıca apopitozisle
lumene dökülen hücreleri morfolojileri değişeceği için tespit etmek güç ob)
2- TUNEL ( tdt- mediated nick end labeling technique) ya da ISEL ( in
sutu end labeling) gibi enzimatik in sutu işaretleme yöntemleri
3- Monoklonal antikorların kullanılmasıyla uygulanan
immünhistokimyasal boyama
( duyarlılığı diğer yöntemlere göre daha fazladır)
4- Flow-cytometri
5- Elektron mikroskopik inceleme