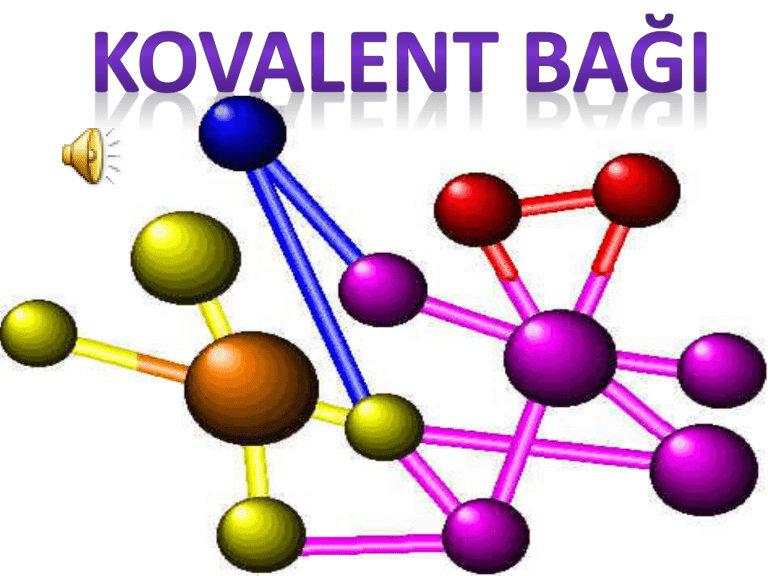
Kovalent bağ,iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen
kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim
gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında
dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü
bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır.
Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir. Bu tür bağlar,
moleküller arası hidrojen bağından daima daha güçlü,iyonik bağ ile ise ya aynı güçte ya da daha
güçlüdür.
Bazı inorganik maddelerin hidrojen(H), amonyak(NH3),klor(Cl), su(H2O) ve azot(N) molekülleri ile
tüm organik maddelerin molekülleri kovalent bağ ile bir arada tutulmaktadır.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde
etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle
oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup,
bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle
ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden
oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir
elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile
birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir…
•
Moleküler bulut, yoğunluğu
ve
boyutu özellikle
moleküler hidrojen (H2) olmak
üzere, moleküllerin oluşumuna
olanak tanıyan bir
çeşit yıldızlararası buluttur….
• Moleküler hidrojeni kızılötesi
ve radyo dalgası gözlemleriyle
farketmek zordur ancak H2'nin
varlığını anlamak için aranan
CO'dur (karbon monoksit).
• CO parlaklığı ile H2 kütlesi
arasındaki oranın sabit olduğu
düşünülür ancak diğer
galaksilerin gözlemlenmesinde
bu varsayımın doğruluğundan
şüphelenilecek bulugulara
rastlanmıştır.[1]
Birkaç milyon yıl içinde parlak yıldızların ışığı gaz
ve tozdan oluşan bu moleküler bulutu
kaynatacaktır. Bulut Karina Bulutsusu 'ndan
ayrılmıştır. Yakınlarda yeni oluşmuş olan yıldızlar
görünmektedir. Tozun saçtığı mavi ışık ile
görüntüleri kızıllaşmıştır. Bu görsel iki ışık yılı
uzaklığı kapsar ve 1999 yılında Hubble Uzay
Teleskobu tarafından çekilmiştir.
Moleküller, Orion (Avcı) bulutsusu yakınlarındaki karmaşık
yıldız oluşum bölgelerinde bulundu. Oksijen atomlarının (O),
özellikle büyük kütleli yıldızların etrafında yaygın olarak
bulunduğu zaten biliniyor.
Ancak soluduğumuz havanın yaklaşık olarak yüzde 20 kadarını
oluşturan oksijen çiftleri (O2) astronomlar tarafından
Dünya’nın dışında ilk kez keşfedildi.
Keşfin başaraştırmacı bilim adamı Paul Goldsmith,
Astrophysical Journal dergisinde bulguları açıklayan
makalesinde “Oksijen gazı 1770’de keşfedildi ama moleküler
halde uzayda bulunduğunu kesin olarak söylemek
insanoğlunun 230 yıldan fazla zamanını aldı.” diye belirtti.
Azot gazı, sıvı azotun ısınarak buharlaşmaya bırakılmasıyla kolayca elde edilebilir. Çok
geniş kullanım alanları olup, oksidasyonun istenmediği ortamlarda hava yerine
kullanılabilir: paketlenmiş gıdaların tazeliğini korumak için, güvenlik amacıyla sıvı
patlayıcıların üzerini örtmek için, geçirgeç (transistör), diyot ve tümleşik
devre gibi elektronik bileşenlerin üretiminde, paslanmaz çelik üretiminde, inert,
nemsiz ve oksitleyici olmayan özelliklerinden dolayı otomobil ve uçak tekerleklerinin
dolumunda. Sıvı azot endüstriyel anlamda ve büyük miktarlarda sıvılaştırılmış
havadan distilasyon yoluyla üretilir ve LN2 şeklinde tanımlanırsa da doğru yazılış
şekli N2(l) dir. Dondurucu bir sıvı olup canlı dokuyla temas etmesi halinde ani
donmaya neden olur. Ortam sıcaklığından uygun şekilde izole edilmesi durumunda,
basınç uygulaması gerektirmeyen bir azot gazı kaynağı oluşturur. Suyun donma
noktasının çok altındaki sıcaklıklarda kalabilme özelliği (77 K, -196°C veya -320°F), sıvı
azotun çok değişik alanlarda kullanımını mümkün kılar: gıda ürünlerinin daldırılarak
dondurulması ve taşınımı,bilim eğitimindeki görsel deneylerde, yüksek
hassasiyetteki algılayıcılar ve düşük gürültü seviyeli amplifikatörlerde soğutucu
olarak, dermatolojide . nahoş görünümlü siğil veya potansiyel kanser riski taşıyan
cilt yaralarının alınmasında, CPU veya GPU gibi bilgisayar donanımlarının soğutma
sistemlerinde soğutucu olarak