|97
İmmün Sistemin Tanıtımı
| Nurşen DÜZGÜN
İmmünite, yabancı ve zararlı olan her türlü maddeye (mikroorganizma, protein ve polisakkarid gibi) karşı
organizmanın verdiği reaksiyonu tanımlayan bir kavramdır.
İmmün yanıt yabancı madde ile karşılaşmada immün sistem hücre ve moleküllerinin karşılıklı ve düzenli
etkileşimleriyle ortaya çıkan savunmadır. İmmün yanıtı başlatan yabancı maddeler antijen veya immünojen olabilir.
İmmunojen terimi, sadece immün yanıt oluşturma yeteneğindeki herhangi bir madde için kullanılır. Antijen ise
daha ziyade bir molekülün, spesifik immünitenin ürünleri ile reaksiyona girebilme yeteneğini tanımlar, her zaman
spesifik immüniteyi oluşturması beklenmez. Bütün immünojenlerin antijen olduğu ifade edilir, ancak bunun aksi
her zaman geçerli olmayabilir. Yeryüzünde yaklaşık 109 sayıda antijenin var olduğu kabul edilmektedir. Hastalık
yapan mikroorganizmaların çoğu iyi bir antijen yapısındadır.
İmmün yanıt normalde bireyi infeksiyonlardan ve yabancı olan maddelerden korur. İmmün sistem vücudun
hemen her yerinde karşılaştığı sayısız yabancı antijene karşı savunma yapmak zorundadır. Bu nedenle immün
sistem hücrelerinin kan, lenf ve dokular arasında dolaşabilme ve gerekli bölgelerde yerleşebilme özellikleri
savunmada dinamik bir ağ oluşturur. Antijenin vücuda giriş yeri,oluşacak immün yanıtı etkiler. Deri yoluyla alınan
antijenler, bu dokudaki makrofajlar (Langerhans hücre) ile tanınır ve lenfatik yoldan bölgesel lenf düğümlerine
taşınır ve immün yanıt hem antijenin giriş yerinde hemde ilişkili lenf bezinde başlar. Kan dolaşımı ile giren antijenler
dalaktaki makrofajlarca tanınır. Solunum yolu, gastrointestinal kanal mukozasından girenler ise bölgedeki mukoza
ilişkili lenfoid doku ile temas eder ve burada gerekli immün yanıt gelişir. İmmün yanıt nerede başlamış olursa
olsun kan ve lenf yolu ile diğer bölgelere ulaşır.
I. Antijen
Organizmaya girdiklerinde immün yanıt oluşturan ve sonucunda ortaya çıkan antikor ve hücre yüzey molekülleri
ile birleşme özelliği gösteren, organizmanın yapısına yabancı olan maddelerdir. Antijenin özgüllüğünü belirleyen
ve kendisine özgül olan antikorları ile birleşmesini sağlayan kimyasal grup/gruplara, epitop/epitoplar adı verilir.
Bir antijen molekülünün birden fazla epitopu bulunur. Antijenin immünojenitesini belirleyen pekçok özellik vardır.
Antijene ait olanlar; kimyasal yapı ve heterojenite, konak için yabancı olma, konakta kalıcı olma, moleküler ağırlık,
elektriki yük, antijenin dozu ve giriş yolu. Konakçıya ait özellikler; genetik ve yaş olarak ifade edilir. Antijenler,
protein, karbonhidrat, lipid, nükleik asit yapısında olabilir. Timus (T lenfosit) bağımlı antijenler protein yapısındadır.
Timus bağımsız olanlar lipid, polisakkarid yapısındadır. Mikroorganizma antijenleri dışında, izoantijenler (kan grubu
antijenleri ve doku uygunluğu antijenleri) aynı türdeki canlılarda bulunan ancak farklı yapıdaki antijenlerdir. Normal
şartlarda vücudun kendine ait antijenlere (otoantijenler) immün cevap oluşmaz. Bazı patolojik durumlarda
otoantijenlerin fiziksel ve kimyasal özelliklerinde değişiklikler sonucunda immün cevap oluştuğunda otoimmmün
hastalıklar gelişebilir. Hapten tek başına antikor yanıtı oluşturmayan, taşıyıcı (carrier) ile birlikte olduğunda immün
yanıta yol açabilen kimyasal moleküllerdir.
II. İmmün Yanıtın Özellikleri
Spesifite: Antijenlerin lenfositler tarafından spesifik olarak tanınan kısımlarına “antijenik determinant” ya da epitop
adı verilir. Henüz spesifik antijen ile karşılaşmamış bir konakçıda her türlü antijeni tanıyıp reaksiyon verebilecek,
antijen spesifik lenfosit klonları bulunur. Yabancı antijen organizmaya girdiğinde kendine özgü yüzey reseptörünü
taşıyan lenfosit klonunu seçer ve aktive olur, çoğalır bir kısmı bellek hücresi, bir kısmı hafıza hücresi olarak
farklılaşır. Bu olaya “primer immün yanıt” denir. Aynı antijen ile tekrar karşılaşmada; önceki karşılaşmada
gerçekleşen immünizasyon sonucu, antijen spesifik lenfositlerin klonal olarak genişlemesi ile immün yanıt daha
erken ve daha kuvvetli gelişir. Buna “sekonder immün yanıt” adı verilir.
98|
Çeşitlilik(Diversity): Memelilerde immün sistemin 109 farklı antijeni tanıma kapasitesi bulunduğu düşünülmektedir.
Bu özellik “Lenfosit Repertuarı” olarak bilinir. Bir klondaki lenfositlerin antijeni tanıyan reseptörleri aynıdır. Her
lenfosit klonunun antijen reseptöründe antijen bağlanma yerinin farklı olması repertuarın ne kadar geniş olabileceğini
göstermektedir.
Hafıza (Bellek): İmmün sistemin bir antijenle tekrar karşılaşmasında daha kuvvetli ve hızlı immün yanıtını sağlar.
Bu özelliğe immünolojik bellek veya immunolojik hafıza denilir. Antijene her maruziyet o antijen için spesifik olan
klonun veya klonların artmasına yol açar. Antijenik uyarı ile oluşan bellek hücreleri uzun ömürlüdür.
Otoregülasyon: Antijenik uyarıyı takiben normal immün yanıt kendi kendini sınırlar. İmmün yanıtın amacı zararlı
olanı ve onu taşıyan hücreyi yok etmektir. Amacına ulaştığında antijenik uyarı ortadan kalkmış olacağından
immün yanıt tamamlanmış olur.
Kendini (self’i) yabancı olandan ayırt etme (self-non self ayrımı). İmmün sistem kendine ait olan antijenleri
yabancılardan ayırt etme özelliğini lenfositlerin gelişme sürecinde primer lenfoid organlarda kazanır. Kendine ait
yapılara karşı immün yanıt vermez. Bu duruma self tolerans veya immün tolerans denir. Self toleransın bozulması
ile otoimmün hastalıklar gelişebilir.
III. İmmün Tolerans
İmmün yanıtı tetikleyen antijenlere immunojen, tolerans sağlayan antijenlere tolerojen adı verilir. Başlıca tolerans
gösterilen antijenler self antijenler, besin maddeleri, kommensal bakterilerdir. İmmün yetenekli konakçının kendi
(self) antijenlerine karşı immün yanıt oluşturmaması,’self tolerans’olarak ifade edilir. İki şekilde gelişir.
1. Santral tolerans; T lenfositlerin timusta olgunlaşma sürecinde self antijenlerle reaksiyona giren immatür
lenfositler yok edilir (klonal delesyon). Kemik iliğinde ise immatür B lenfositlerin delesyonu ve reseptör editing
(kurgulama) ile santral B hücre toleransı sağlanır.
2. Periferik tolerans; timusta delesyondan kaçan self reaktif lenfositler, periferik lenfoid organlarda klonal anerji,
klonal ignorance, regülatör T hücreleri ve süpresör sitokinler gibi bazı mekanizmalarla kontrol altında tutulurlar.
Periferik lenfoid organlarda self reaktif olan matür B lenfositler anerji, delesyon ve folliküler dışlama gibi
mekanizmalarla periferik B hücre toleransı gerçekleşir.
İmmün sistem ile hiç karşılaşmamış olan self antijenler (sekestre antijenler), bulundukları dokularda travma,
infeksiyon, inflamasyon veya iskemi gibi nedenlerle ortaya çıkabilir. Bu self antijenlerin ilk kez immün sistem ile
karşılaşması spesifik immün yanıtı oluşturur ve klinik patolojiler ortaya çıkar. Örneğin sempatik oftalmi, orşit ve
deneysel ensefalit.
Tolerans mekanizmalarındaki bozukluklar sonucu vücudun kendi yapılarına karşı kontrol edilemeyen yanıtı,
otoimmün reaksiyonlar ve doku/organ hasarı ile sistemik veya organa özgü ‘otoimmün hastalıklar’ ortaya çıkabilir.
IV. İmmün Sistemin Organları ve Hücreleri
İmmün sistemin organ ve dokuları başlıca iki grupta toplanır.1- Santral lenfoid organlar: kemik iliği ve timus,lenfositlerin
tüm özelliklerini kazanarak olgunlaştığı organlardır. 2- Periferik lenfoid organlar: dalak, lenf bezi, mukozal lenfoid
doku (mucosa associated lymphoid tissue, MALT), edinsel immün yanıtın başladığı organlardır. İmmün hücreler
santral organlarda olgunlaşır, periferik organlarda görevlerini yaparlar.
İmmün sistemin tüm hücreleri tek bir kök hücreden gelişir. Kemik iliğinde pluripotent hemotopoetik kök hücreden
daha özelleşmiş iki farklı öncül hücre oluşmaktadır. Bunlar myeloid progenitör hücre ve lenfoid progenitör hücredir.
Myeloid progenitor hücreden eritrosit, trombosit, granülosit, monositler ve mast hücreleri gelişmektedir. Lenfoid
progenitor hücreden lenfositler (T ve B) gelişmektedir. (Tablo 1)
|99
Tablo 1: İmmün Sistem Hücreleri
Hematopoetik
kök hücre
Myeloid progenitör hücre
Lenfoid progenitör hücre
Eritrosit
Trombosit
Lenfosit
• T lenfosit
• B lenfosit
Granülosit
• Nötrofil
• Eozinofil
• Bazofil
Monosit/Makrofaj
• Kupffer hücresi (karaciğer)
• Alveolar makrofajlar (akciğer)
• Mikroglial hücreler (santral sinir sistemi)
• Osteoklast (kemik)
• Langerhans hücreler (epidermis)
Mast hücresi
Nötrofil
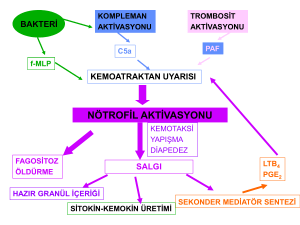
Lökositler içinde kanda en yüksek oranda (%60-70) bulunan granüllü hücrelerdir. Profesyonel olarak fagositoz
yeteneğine sahip olan bu hücreler fagozite ettikleri maddeleri granüllerinde bulunan lizozim, laktoferrin, hidrolaz,
miyeloperoksidaz gibi enzimlerle parçalama veya öldürme işlemini gerçekleştirirler. Nötrofil yüzeyinde bulunan
C3b reseptörü ile komplemana, Fc reseptörü ile immünglobuline bağlanabilir. Fagosite edilecek hedefin,
kompleman ya da antikor ile kaplanmış olması (opsonizasyon) nötrofil içine alınmalarını kolaylaştırmaktadır.
Yaşam süreleri kısadır (birkaç saat - birkaç gün). İnflamasyon sırasında sayıları 2-3 kat artar. İnflamasyon bölgesine
ilk ulaşan hücrelerdir.
Monosit/Makrofaj
Periferik kanda kısa ömürlü hücrelerdir. Kandan dokulara göç eden monositler, farklılaşarak makrofajları oluştururlar.
Makrofajlar tüm vücut dokularına yayılmış olup, yerleştiği yerde özel isimleri ile anılmaktadır; karaciğerde ‘kupffer’,
deride “Langerhans” hücreleri, alveollerde “alveolar makrofajlar”, beyinde “mikroglial hücreler”, böbrekte
“mezenşimal hücreler” ve kemikte “osteoklastlar” olarak bilinirler. Monosit ve makrofajlar profesyonel fagositik
hücreler olup doğal immünitede önemli rol oynarlar, antikor ile kaplı bakteri ve tümör hücresinin yıkımı ve
parçalanması gibi effektör görevleri vardır. Yabancı ve zararlı olan maddeler, reseptör ve ligand bağlanmasından
sonra aktine bağlı motilite ile makrofaj içine alınır,fagozom oluşumu ve lizozom ile füzyon oluşumu sonucunda
fagolizozom içinde parçalanır ve zararsız duruma getirilir. TNF-α ve IL-1 gibi sitokinler aracılığıyla monositmakrofajlar antikora bağlı olmayan litik aktivite gösterirler.
Makrofajların patojenleri tanıması, patojen ilişkili moleküler motifler (PAMP: Pathogen Associated Molecular
Pattern, PRR: Pattern Recognition Receptors), Toll like reseptörler (TLR), Mannoz reseptörleri (MR) gibi bazı
yüzey molekülleri ile olur. Makrofajların yabancı ajan ile temasında IgG’nin Fc parçasına karşı (CD16, CD32)
reseptörler, kompleman reseptörleri (CR) surfaktan proteini, CD14(LPS reseptörü) ve sitokin reseptörleri rol
oynar. Monosit-makrofajlar dokularda çeşitli hidrolitik enzimler, oksidatif metabolizma ürünleri ve kemoatraktan
çeşitli sitokin (TNF-α, IL-1, IL-6, IL-12, IL-15 gibi) ve kemokinler aracılığı ile proinflamatuar ve anti-inflamatuar
görevlerde bulunurlar. Makrofajlar sitokin üretimi ile hem doğal, hemde edinsel immünitede önemli görev yaparlar.
Proinflamatuar sitokinlerin (IL-1,IL-6, IL-8,TNF) üretimi ile inflamasyonda, IL-1 ve IL-6 gibi sitokinler aracılığıyla
T ve B hücrelerin antijene bağlı aktivasyonunda temel rol alırlar. IL-12 ile hücresel immün yanıtta rol oynarlar.
IFN-α salınımı ile antiviral etki sağlarlar.
Makrofajlar antijen sunan hücreler (ASH)’dir. Fagosite ettikleri yabancı antijenleri küçük parçalara ayrılmış peptidler
halinde MHC (Major Histocompatibility Complex) klas II antijenleri ile kompleks oluşturarak Th hücrelerine sunarlar.
Böylece edinsel immünitenin başlamasında anahtar rol oynarlar.
100|
Dendritik/Langerhans Hücreler
Kemik iliğinden köken alan, yüzeyinde yüksek düzeyde HLA klas II ve adezyon moleküllerine sahip olan ve
antijen sunumu yapan bir hücre grubudur. Antijen sunan hücreler içinde yer alırlar. Epitelde bulunan immatür
dendritik hücrelerce alınan antijen afferent lenf yolu ile periferik lenfoid organlara (dalak ,lenf bezi, mukozal lenfoid
doku) taşınır ve buradaki T lenfositlere sunulur. Matür dendritik hücreler,antijeni naif T hücrelerine sunarlar ve
aktive ederler. Dendritik hücreler kanda çok az miktarlarda bulunur. Ciltte ve mukoza yüzeylerin altında bulunanlar
Langerhans hücresi adı ile bilinirler.Bazı sitokinlerin varlığında (IL-1,IL-4,TNF-α, GM-CSF) kültürlerde çoğalabilirler.
Foliküler dendritik hücreler, B hücrelerine antijen sunumu yaparlar ve bellek B hücre oluşumunda rol oynadıkları
düşünülür. Periferik lenfoid organların germinal merkezlerine veya foliküllerine ulaşan antijenleri tanırlar.
Makrofajlar ve dendritik/Langerhans hücreler dışında, B lenfositleri de antijen sunumu yaparlar. ASH’lerin ortak
özelliği yüzeylerinde yoğun MHC II molekülü bulunmasıdır. B lenfositler antijeni Th hücrelere ve bellek T hücrelere
sunarlar. Endotel ve epitel hücreleri sitokinlerle uyarıldıklarında antijen sunabilirler. Timusta bulunan interdigitating
hücreler de antijen sunumu yaparlar. Bu hücreler self antijen ve MHC klas II antijenden zengin olup, timus içinde
self antijenlerle reaksiyona giren lenfositlerin negatif seleksiyon ile yok edilmelerinde belirleyici rol oynarlar.
Mast Hücresi ve Bazofil
Yüzeylerinde IgE reseptörü taşırlar, IgE ile sensitize olurlar ve allerjik inflamatuar reaksiyonlarda rol oynarlar.
Eozinofil
Parazitik infestasyonlarda ve allerjik inflamasyonda görev alan hücrelerdir. Fagositoz yeteneğinden ziyade, hasar
verici granül içeriğini dış ortama salgılayarak parazitleri yok ederler.
Trombosit
IgG için Fc reseptörüne sahiptirler. İmmünkomplekslere bağlandıklarında vazoaktif aminleri ve diğer mediatörleri
salgılarlar.
Doğal Öldürücü Hücre (NK, Natural Killer)
Doğal immün sistemde görev alan hücre grubudur, kesin olmamakla birlikte lenfoid kök hücresinden geliştiğini
bildiren kaynaklar vardır. Periferik kandaki lenfositlerin %10-15 kadarını oluşturur, lenfositlere benzerdir, onlara
göre daha büyük ve granüllüdür, büyük granüler lenfosit (LGL) olarak da anılırlar. Granüllerde bulunan granzim
ve perforin ile hedef hücre öldürülür. T ve B hücrelerde bulunan antijen spesifik reseptörler, NK hücrelerinde
bulunmaz. NK hücrelerinin çoğu, CD16, CD56 ve CD57 yüzey molekülleri taşırlar. Yüzey molekülleri ile hedef
hücreyi (virus ile enfekte hücre ve tümör hücresi gibi) tanır ve öldürücü aktivite(sitotoksisite) göstererek onları
yok ederler. Ayrıca antikor ile kaplanmış hücreleri de öldürme özelliği vardır. NK hücre yüzeyindeki Fc reseptör
ile “antikor bağımlı hücre aracılı sitotoksite”de (ADCC) önemli rol oynar.
Endotel Hücreler
İmmün yanıta doğrudan katılmazlar, ancak inflamatuar reaksiyonlarda rol oynarlar. Endotel hücreleri, intersellüler,
vasküler ve mukozal adezyon moleküllerini eksprese ederler. Lökositlerin dolaşımdan dokulara geçişini, damar
endoteli üzerinde bulunan adezyon molekülleri ile birlikte sağlarlar. Çeşitli sitokinlerle aktive olduklarında, MHC
sınıf II moleküllerini eksprese ederek antijen sunan hücre gibi davranabilirler.
Lenfositler
Morfolojik olarak tüm lenfositler birbirine benzerdir, ayırt edilemez, ancak fonksiyonları ve fenotipik karakteristikleri
ile birbirlerinden ayrılan üç büyük lenfosit popülasyonu vardır: T lenfosit (hücresel immünite), B lenfosit (humoral
immünite) ve doğal öldürücü hücre (NK) (doğal immünite).
|101
Lenfositler (B ve T), kemik iliğinde hematopoetik kök hücrenin bir alt kolu olan lenfoid progenitör hücrelerden
köken alırlar ve santral lenfoid organ olan kemik iliğinde; B lenfosit, timusta ise T lenfosit, lenfositlerin tüm
özelliklerini kazanırlar.
T Lenfosit
Kemik iliğinden timusa gelen timositler gelişme sürecinde; antijen reseptörünü (T hücre reseptörü,TCR), kazanır.
Pozitif ve negatif seleksiyon (self antijenleri yabancı olandan ayırt etme yeteneği) safhalarını geçirdikten sonra
olgun T hücreler (CD4+T lenfosit ve CD8+T lenfosit) olarak periferik dolaşıma geçerler. Periferik kanda total kan
lenfositlerinin yaklaşık %70 kadarı CD4+T yardımcı (Th, T helper), %25 kadarı ise CD8+T sitotoksik (Tc)
bulunmaktadır. Tüm T lenfositler yüzeylerinde CD3 molekülü taşırlar. T lenfositler hücresel immün yanıtta anahtar
rol oynarlar.
T Hücre Reseptörü (TCR)
T hücrelerin immün yanıt verebilmeleri için uygun şekilde sunulan antijeni tanıması gereklidir. T lenfositler antijeni
TCR ile tanırlar. Bu reseptörler belli bir antijene özgü yanıt gelişmesini sağlar. Antijen tanımayı sağlayan TCR’ler
polipeptid zincirlerine göre iki tiptir. Periferik kandaki T hücrelerinin %90-95’i TCRαβ taşır ve antijen ile etkileşimi,
MHC molekülüne bağımlıdır. TCRαβ hücreler CD4+ ve CD8+ hücrelerdir ve immün yanıttan doğrudan
sorumludurlar. T hücrelerinin %10-15’i TCR γδ taşır, epidermis ve mukozal yüzeyde yoğun olarak bulunur.
Sayıca az olan TCR γδ taşıyan T hücrelerin antijen tanımaları MHC moleküllerine bağımlı değildir, kendileri antijenle
ilişki kurabilirler.
T hücrelerinin TCR, CD4, CD8 dışında birçok yüzey molekülü bulunur. Başlıcaları; CD3, CD40L, FasL, IL-2R
(CD25), CD28, CTLA-4, LFA-1 (ICAM-1’in ligandı), CD2 (LFA-3’ün ligandı), MHC sınıf I ve aktive olduklarında
MHC sınıf II.
Antijenin İşlenmesi ve Antijenin T Lenfositlere Sunumu
ASH, fagositoz veya pinositoz yolu ile içlerine aldıkları antijeni sitoplazmadaki endositik vakuol içinde parçalara
ayırır. Hücre içinde işlenmiş küçük parçalar halindeki antijenik yapılar (13-25 amino asit uzunluğunda bir peptid)
hücre içinde HLA molekülünün antijen bağlama bölgesine bağlanmış olarak hücre yüzeyine taşınır ve T hücrelerine
sunulur. Böylece HLA molekülleri immün sistemin efektör hücrelerinden T lenfositlerine antijen sunumu yaparak
immün yanıtın başlaması için ilk uyarıyı gerçekleştirir.
Antijen hücre sitoplazmasında serbest bir şekilde bulunuyorsa, antijenin işlenmesi ve sunumu farklıdır. Bu
durumda antijen, proteozomlar tarafında parçalanır, 8-9 amino asit uzunluğundaki peptidler halinde TAP (Transport
Antigen Processing) molekülleri ile endoplazmik retikülüme taşınır ve MHC sınıf I moleküllerine bağlanarak
T hücrelerine sunulur.
T Lenfositin Antijeni Tanıması ve Aktivasyonu
T hücreler yalnızca protein yapısındaki antijenleri (Timus veya T lenfosit bağımlı antijen) tanıyabilir. T lenfositlerin
aktivasyonu, inflamasyona yakın lenf düğümlerinde gerçekleşir.
T hücre aktivasyonu için ilk sinyal MHC molekülü antijen bağlanma bölgesi ile TCR’nün, bir anahtar kilit modeli
oluşturarak “MHC sınıf I veya II molekülü+antijen kompleksi” ile TCR’nin etkileşmesidir (Şekil 1). Bu etkileşim
için HLA molekülünü oluşturan polipeptid zincirlerinin çeşitlilik gösteren antijen bağlama bölgelerinin kritik
noktalarındaki amino asitlerin özelliklerinin uygun olması gerekir. HLA molekülü ile antijenin bağlanması, T hücre
reseptörü ile antijen bağlanmasına göre daha az spesifik olabilir, ancak yine de seçici davranır. MHC sınıf II
molekülleri ile birlikte sunulan antijenleri, CD4+ T hücreler tanır. MHC sınıf I molekülü ile birlikte sunulan antijenler
ise CD8+T lenfositlerince tanınır. MHC moleküllerinin antijen bağlama bölgelerinde polimorfizm özelliği nedeniyle
bu bölgelerin yapıları, T hücrelerine antijen sunumunda anahtar rol oynar.
102|
Şekil 1. T hücrenin antijen tanıması
Şekil 2. Lenfosit aktivasyonu
Lenfosit Aktivasyonu
T Hücrenin Antijen Tanıması
Sinyal 2 yokluğu
Antijen
ASH
T Hücre
TCR MHC
Endositoz
Tolerans
Klonal anerji / Delesyon
CD4+
T
Sinyal 1 + Sinyal 2
ASH
CD28
T Hücre
Reseptörü
B7
ASH
T Hücre
TCR MHC
MHC II
sitokinler
Peptid
Aktivasyon
İkinci sinyal T hücre yüzeylerinde bulunan co-stimülatör(yardımcı uyarıcı) moleküllerin (CD28), ASH görevi yapan
makrofaj, dendritik hücre ve B lenfosit yüzeyindeki ligandları ile (B7-1 veya B7-2) birleşmeleridir (Şekil 2,3,4).
Böylece iki hücre arasında temas güçlenir ve plazma membranından sinyal iletimi sağlanır. Bu işlem olmaz ise
sadece TCR aracılı sinyal (ilk sinyal) ile T hücre aktive olamaz ve immün yanıt gerçekleşmez (Şekil 2). Diğer yardımcı
uyarıcı molekül ile etkileşim CD40 ligandının CD40 reseptörü ile bağlanmasıdır (Şekil 3).
Diğer taraftan T hücre yüzeyinde daima bulunan CD28 molekülü B7 ile etkileştiğinde T hücre aktivasyonu
maksimum düzeye ulaştığında CTLA-4 ekspresyonu artar, CD28 ile yarışarak aktivasyonu sınırlı tutar ve IL-2
yapımı azalır. Böylece CTLA-4 immün yanıtta inhibitör rol oynar.
Üçüncü sinyal antijenin TCR ile etkileşim sonunda hücre içine giden sinyallerle çeşitli genlerin transkripsiyonu
ve sitokin sentezinin gerçekleşmesidir. Bu etkileşimi takiben PTK (protein tirozin kinaz) aktivitesi artar. Aktive olan
PTK’lar hücre içi bazı molekülleri fosforile eder ve hücre içi sinyal iletimi sağlayan moleküllerin aktive olmasını
sağlar. Bu işlem Th hücrenin sitokin üretimi için gereklidir.
Th hücre kaynaklı sitokinlerin T hücre reseptörlerine (IL-2/IL-2R) bağlanması ile T lenfositlerde mitotik aktivite
başlar ve hücre prolifere olur. ASH tarafından üretilen IL-1,TNF-α, Th hücre aktivasyonunu arttırır (Şekil 4).
Şekil 3. Antijen sunan hücre ve T hücre yüzey molekülleri
ve etkileşimi
Şekil 4. Lenfosit aktivasyonu için 3 önemli sinyal
ASH ve T hücre yüzey reseptörleri ve etkileşimi
IL-1
IL-6
IL-12
“Sinyal 2”
CD28
B7 (CD80/86)
CTLA-4
“Sinyal 3”
↓Aktivasyon
B7
B7 (CD80/86)
CD58 (LFA-3)
↑Aktivasyon
Tanıma
TCR
MHC II
Antijen Sunumu
ASH
CD28
CD2
CD4+
T
Hücre
T hücre
Reseptör
LPS
TLR4
Adhezyon
“Sinyal 1”
−Aktivasyon
CD40
IL-12 Reseptör
CD4+
T hücre
CD40L
Peptide
MHC II
Sinyal 1: Spesifite
Sinyal 2: Aktivasyon
Sinyal 3: Diferen siyasyon
Antijen Sunan Hücre (ASH)
T Hücre İmmün Yanıtının Effektör Fazı
Antijeni ile spesifik olarak uyarılmış lenfositlerin o antijeni yok etmek için gösterdiği fonksiyondur. Birçok effektör
fonksiyonda diğer hücreler ve doğal immünitede rol alan savunma mekanizmaları da katkıda bulunur. Aktive
olan CD4+ T hücreler başlıca IL-2 olmak üzere çeşitli sitokinleri üretir ve ürettikleri sitokinlerle bir taraftan ASH’leri
aktive ederek fagositozu kuvvetlendirir ve hücre içi mikroorganizmaların yok edilmesine katkı sağlar, diğer taraftan
IL-2; Th hücrelerin, T sitotoksik hücrelerin aktivasyonunu ve proliferasyonun sağlayarak CD8+ (sitotoksik) T
hücrelerinin öldürme kapasitelerini arttırır. CD8+ T hücre başlıca virus ile enfekte hücreyi, tümör hücresini ve
konakçı ile uyumu olmayan transplante hücreleri öldürür. T sitotoksik hücreler hedeflerini; doğrudan perforinlerin
|103
hücre zarında hasar yapması veya apopitoz yolu ile öldürürler. Diğer taraftan salgıladıkları IFNγ ile sağlıklı hücrelerin
virusa karşı dirençli olmalarını sağlarlar. Th katkısının önemli olduğu bir diğer hücre B lenfositi olup B hücre
aktivasyonu ve B hücrelerinin farklılaşmasında rol oynayarak humoral immüniteyi de etkilemektedir.
Th1, Th2 ve Th17 Hücreleri
CD4+ hücrelerin salgıladıkları sitokinlere ve bununla ilişkili fonksiyonlarına göre iki alt tipi (Th1 ve Th2) bulunmaktadır
(Şekil 5). Mossman ve Coffman tarafından yaklaşık 25 yıl önce ilk olarak ifade bulan Th1 ve Th2 gruplandırılması,
edinsel immünitede birçok olayın aydınlatılmasına yardımcı olmuştur. Doğal immün yanıt sürecinde üretilen
sitokinler naif Th hücrelerinin efektör T hücrelerine farklılaşma sürecini etkiler: interferon gamma (IFN-γ), IL-12,
naif T hücrelerinin Th1 hücrelerine farklılaşmasını başlatır. Th1 hücrelerin yüksek miktarlarda ürettiği IFN γ,
interleukin-2 (IL-2) ve Tümör nekrozis faktör (TNF); makrofaj aktivasyonu, fagositoz ve bakteriyel öldürme
fonksiyonlarına etki ederek hücre içi patojenlerin temizlenmesini sağlar. Ortamda IL-4 varlığında, naif Th hücrelerinin
Th2 hücre yönünde farklılaşması gerçekleşir. Th2 hücreler IL-4, IL-5, IL-6,IL-10, IL-13 salgılar. IL-4 ve IL-13,
IgE antikor üretimini uyarırlar. IL-5 ile eozinofiller aktive edilerek parazitlerin öldürülmesi sağlanır. Böylece Th2
hücreler, hücre dışı patojenlere karşı konakçı savunmasında ve allerjik durumlarda önemli rol oynar. B lenfosite
yönelik sitokinler ise B hücrelerini aktive ederek antikor üretiminde B hücreye yardım ederler. Sonuç olarak T
helper hücreler Th1 alt tipi ile gecikmiş tip hipersensitivite yanıtı sağlarken, Th2 hücreler antikor yanıtını düzenler.
Her iki hücre grubu ürettikleri sitokinlerle karşılıklı birbirlerini kontrol altında tutarlar. Örneğin Th2 hücrelerce
salgılanan IL-10, Th1 sitokinleri ile gelişen aşırı inflamasyonun zararlı etkilerini baskılar. Bu iki hücre grubu arasında
dengenin bozulması bazı patolojilerin gelişmesine yol açar. Moleküler düzeyde Th1 ve Th2 hücrelerinin farklılaşması
için farklı transkripsiyon faktörleri gereklidir. Bunlardan Th1 hücreleri için “ T box expressed in T cells” (T-bet) ve
Th2 için “c-Maf” ve “GATA-3” en önemlileridir.
Son yıllarda IL-17 üreten ve fonksiyonu Th1 ve Th2 hücresinden farklı olan üçüncü bir efektör Th hücresi (Th17)
keşfedildi (Şekil 5). Bu hücrenin başlıca fonksiyonu Th1 ve Th2 tarafından tam olarak kontrol altına alınamamış
patojenlerin yok edilmesini sağlamaktır. Ancak Th17 hücreleri doku inflamasyonunun temel tetikleyecileridir ve
insanlarda ve çoğu deneysel çalışmalarda inflamatuar ve otoimmün hastalıkların patogenezinde rolü olduğu
saptanmıştır. Th 17 hücreleri ayrı bir Th sınıfı olarak ilk kez organ spesifik otoimmün hastalıklarda gösterilmiştir.Ayrıca
romatoid artrit, multiple skleroz, inflamatuar barsak hastalığı, psöriazis ve astımda önemli olduklarını gösterir
kanıtlar bulunmaktadır. Th17 hücreleri ilk olarak farelerde tanımlanmıştır. Th17 hücrelerinin insanlarda gelişimi
farelerinki ile büyük oranda benzerlikler gösterse de bazı farklılıklar bulunmaktadır.
Tablo 2: Treg hücre tipleri
Şekil 5. T hücre alt tipleri
Th1
IFN
Virusa karşı immünite
IL-12
Th2
IL-4
Parazite karşı immünite
Allerji
IL-17
Otoimmünite
TGFß
İmmünsüpresyon
IL-4
•
CD8+ Treg hücreler
•
Natural Treg hücreler
•
Periferik T reg hücreler
•
Tip-1 regülatör T hücreler
•
T helper 3 hücreler: Th3: Tr1
•
TGF beta +/IL-10+ CD4+ Treg
Th0
TGFß
IL-23
Th17
TGFß
Treg
İmmün düzenleyici bir sitokin olan TGF-β ile birlikte proinflamatuar bir sitokin olan IL-6, naif T hücrelerinin Th17
yönünde farklılaşmasını sağlamaktadır. Ayrı bir yardımcı T hücresi olarak kabul edilen Th17 hücrelerinin kendilerine
özgü farklılaşma ve transkripsiyon faktörleri vardır. Bunlardan ikisi, retinoid ilişkili orfan reseptörler ailesinden
ROR γ T ve ROR α isimli transkripsiyon faktörleridir. ROR a, Th17 farklılaşmasını gerçekleştirmektedir.
ROR γ T, Th17 hücrelerinden IL-17 A ve IL-17 F üretimi için gereklidir. Her iki faktörün indüksiyonu, TGF-β ve
IL-6 tarafından sinyal iletimi ve aktivatör transkripsiyon-3 bağımlı mekanizmalarla sağlanmaktadır. Th17 hücrelerinin
tipik spesifik yüzey belirleyicileri yoktur. İnsan kemokin reseptörü olan CCR4 ve CCR6 ko-ekspresyonu Th17
tanımlanmasında yardımcı olmaktadır.
104|
T Regülatör (Treg) Hücreler
İmmün sistem organizmanın kendisine karşı reaksiyon oluşturmaması için bazı kontrol mekanizmaları geliştirmiştir.
Süpresör T hücreleri olarak bilinen hücrelerin günümüzde T regülatör hücreler (Treg) olduğu anlaşılmıştır (Şekil 5).
Periferik kan CD4+ T lenfositlerin %5-10’u IL-2R (CD25) zinciri taşımaktadır ve Treg hücre olarak isimlendirilen bu
hücreler self antijenlere karşı toleransın devamlılığını sağlamaktadır. Regülatör T hücreler hem farelerde hemde
insanlarda Th ve B lenfositleri baskılamaktadır. İmmünsüpresif bir sitokin olan TGF-β’a maruz kalan naif T hücreleri
foxp3 (forkhead box P3) eksprese etmekte ve regülatör T hücrelerinin indüksiyonunu sağlamaktadır. IL-6 ise
TGF-β aracılı Foxp3+ regülatör hücre indüksiyonunu inhibe etmektedir. Günümüzde bilinen Treg hücre tipleri
Tablo 2’de gösterilmiştir.
B Lenfosit
Hematopoetik kök hücrenin bir alt kolu olan lenfoid progenitör hücreden köken alan B lenfositlerin gelişmeleri
antijenik bir uyarı olmadan kemik iliğinde başlar. Erken progenitör hücrelerden immatür B lenfositleri gelişinceye
kadar çeşitli farklılaşma (pre-B, immatür B, matür B) dönemleri vardır. Kemik iliğinde self ile reaksiyona giren
immatür lenfositler delesyon, reseptör editing (kurgulama) ve reseptör spesifitesinde değişme ile etkisizleştirilir.
İmmatür B lenfositleri kemik iliğinde iken fonksiyonel yüzey immünglobulin M molekülünü kazanırlar ve olgun
hücreler olarak periferik kana geçerler. Bu hücreler henüz antijenle karşılaşmamış ‘naif’ hücrelerdir. Periferik
dolaşımdan periferik lenfoid dokulara (lenf bezi, dalak ve mukoza ilişkili lenfoid dokular=(MALT) göç ederler ve
onlar için özel ayrılmış bölgelere yerleşirler (lenfoid folliküllerde, dalak beyaz pulpada). B lenfositler periferde self
antijenle reaktivite açısından anerji, delesyon ve folliküler dışlama ile kontrol altında tutulurlar. Ayrıca inhibitör
moleküller (CTLA-4, IL-4, IL-10) ve T regülatör hücreler self reaktiviteyi önlemede rol oynarlar. Perifer kanında
matür B lenfositler %20-30 oranında bulunur.
B Hücre Reseptörü (B Cell Receptor, BCR) ve Yüzey Molekülleri
Her bir B hücresi yüzeyinde antijene spesifik reseptör, B hücre reseptörü (BCR) taşır. BCR, antijen bağlayan
membran immünglobulinidir ve antijen için primer reseptör olup, B hücre aktivasyonunda anahtar protein olarak
rol oynar. Naif B lenfositlerin yüzey Ig’leri (IgM ve IgD), B hücre reseptörlerini oluşturur. BCR sinyal iletimini, birlikte
bulunduğu Ig-alfa (CD79a) ve Ig-beta (CD79b) adı verilen aksesuar moleküllerin sitoplazma içindeki parçaları
olan immün reseptör tirozin bazlı aktivasyon motifler (ITAM) aracılığı ile gerçekleştirir. BCR sinyal şiddetini kontrol
eden hücre içi regülatör moleküller (Lyn, Btk, Vav, protein tirozin fosfataz, SHP1 gibi) vardır. BCR sinyalini
arttıranlar; CD19, CD20, CD45, CD38, CD81 (TAPA-1), CD21 (CR2) ve Leu 13’dür. BCR aktivasyonunu inhibe
edenler; CD22, CD72, CD5, SHP-1, Fc γ RIIb’dir. CD20 molekülü, B hücre aktivasyonu ve büyüme regülasyonunda
rol oynar. Defektif BCR sinyali otoimmüniteye ya da immün yetmezliğe yol açabilir.
B hücreleri yüzeylerinde MHC sınıf I ve sınıf II moleküllerini sunarlar. B hücre yüzeyinde bulunan CD20,
CD22,CD7,CD77,CD83 ve Fc γ RII (CD32) moleküller dışında hormonlar, mitojenler ve sitokinler için reseptörler
bulunur. B lenfosit, yüzeyinde komplemanın C3d komponenti için spesifik reseptör (CR2) taşır. CD5 molekülü
malign B hücrelerde tanımlanan bir transmembran glikoproteinidir. Normal B hücrelerinin küçük bir grubu
yüzeylerinde CD5 eksprese ederler. CD5 bulunup bulunmamasına göre B hücreleri; CD5 pozitif (B1) ve CD5
negatif (B2) olarak iki alt tipte ifade edilirler. Fötal ve perinatal dönemde kanda ve doku sıvılarında bulunan B1
hücreleri oldukça uzun ömürlüdür. Yaşamları yüzey IgM ve CD19 ilişkili uyarılara bağlıdır. Yüksek miktarlarda
IgM salgılar. T hücre yardımı gerekli değildir. B1a ve B1b olarak iki alt gruba ayrılır. İmmün sistemde fonksiyonları
iyi bilinmemektedir. Plazmasitoma ve lenfomaların çoğunda CD5 pozitif B hücreleri bulunur. CD5 negatif olan
B2 hücreler yaşam boyunca dolaşımda ,dalakta ve lenf düğümlerinde bulunurlar.
B Lenfosit Antijen Tanıması ve Aktivasyonu
B lenfosit aktivasyonu için ilk sinyal, antijeni doğal haliyle tanımasıdır. B hücresi timus yada T lenfositten bağımsız
antijenleri tanır. Bunlar; polimerik antijenler olup, özellikle çok sayıda aynı epitop bulunduran solubl formdaki
polisakkarid, lipid ,glikolipid,nükleik asit ve küçük kimyasal moleküllerdir. B hücresi daha sonra sekrete edecekleri
|105
immünglobulinin membrana bağlı şekli olan yüzey immünglobulin molekülü (B cell receptor,BCR) ile antijeni
bağlar. Oluşan antijen- reseptör kompleksi hücre içine alınır (endositoz) ve B hücre aktivasyonu başlar. Antijen
tanıma ile birlikte, tirozin fosforilasyonu, çeşitli enzimlerin aktivasyonu ve transkripsiyon faktörleri (NFAT, Myc,
NFkappa B, ve AP-1) gibi hücre içi sinyaller tetiklenir. Timustan veya T lenfositten bağımsız antijenler (lipopolisakkarid,
polisakkarid,lipid) MHC moleküllerine bağlanmadığı için T hücre tarafından farkedilmez, tanınamaz ve T hücre
yardımına gereksinim göstermez. Gram negatif bakterilerin hücre duvarında bulunan endotoksin (lipopolisakkarid),
T lenfositten bağımsız antijenlerin bir örneğidir. T hücre yokluğunda gram negatif basillere karşı normal direnç
görülmesi bu şekilde açıklanabilmektedir. T bağımsız antijenler doğrudan BCR ‘e çapraz bağlanırlar. Düşük
konsantrasyonlarda spesifik B hücre uyarımı yaparlar ve antijene zayıf bağlanabilen IgM tipi antikorlar üretirler.
T lenfosit bağımlı antijenler protein yapısındadır. B hücrelerin bu antijenleri tanıyıp yanıt oluşturması için Th hücrenin
yardımına gereksinim vardır. B hücre yüzeyindeki B7 molekülleri ile (B7-1 ve B7-2), Th hücre yüzeyindeki CD28
bağlanarak uyarılır.Aktive T hücre üzerinde bulunan CD40L, B hücre yüzeyindeki CD40 molekülüne bağlanır.
B hücre çoğalması, olgunlaşması, ağır zincir izotip dönüşümü, antikor üreten hücre ve bellek hücre oluşumu
gerçekleşir. Antikor üretimi için aktive Th hücrelerin ürettiği B hücre büyüme faktörleri (IL-2, IL-4, IL-5) ile aktive
olurlar ve B lenfosit farklılaşma faktörleri (IL-4,IL-5,IL-6 IFN-gamma) ile plazma hücrelerine farklılaşırlar.
Çeşitli kemokin ve sitokinler de B hücre aktivasyonuna katılır. BAFF (B Cell Activating Factor, BlyS) ve APRIL
(A proliferation-inducing ligand) molekülleri, B hücre aktivasyonunu ve yaşamının düzenlenmesini sağlar.
B lenfositlerin farklılaşması sırasında ağır zincir izotip dönüşümü (class switching) gerçekleşir (izotip dönüşümü:
molekül spesifitesi değişmeden fonksiyonların değişmesi için hafif zincir ve ağır zincirin değişken bölgeleri korunur,
ağır zincirin sabit bölgesi değiştirilir).Bu dönüşüm ile çeşitli yabancı antijenlere karşı farklı antikor üretilir. B lenfosit
yüzeyinde CD40 ve Th yüzeyindeki CD40 ligand etkileşimi bu dönüşümde önemli rol oynar. Sitokinler üretilecek
immünglobulin ağır zincir tipini etkileyebilir (Th1 kökenli IFN γ, IgG’i; Th2 kökenli IL-4, IgE üretimini etkiler). Naif
B hücreleri antijeni lenfoid folliküllerde tanır. T hücreleri antijeni folliküllerin dışında T hücrenin zengin olduğu
bölgelerde tanır. B hücresi T hücre ile karşılaşabilmesi için folliküllerin kenarına göç ederler ve etkileşirler.
B hücresinin antikor salgılayan hücreye farklılaşması follikül dışında olur. Ağır zincir izotip dönüşümü de follikül
dışında germinal merkezlerde olur. Aktive lenfositlerin bazıları lenfoid folliküllere geçerek germinal merkezleri
oluşturur ve hızla çoğalırlar. Antijeni yüksek affinite ile tanıyan B hücreleri yaşama devam eder. B lenfositleri
spesifik antijeni ile karşılaşmazsa germinal merkezde apopitoz ile yok edilirler. Bellek hücreleri germinal merkezlerde
gelişir ve dolaşıma geçer. Antijen ile karşılaşmadığı sürece dolaşımda aylarca ve yıllarca yaşamına devam eder.
Aynı antijenle tekrar karşılaşmada hızla ve fazla miktarlarda antikor salgılanmasını sağlayan plazma hücrelerine
dönüşür.
B lenfositler de ASH görevi yaparlar işledikleri antijeni MHC sınıf II ile birlikte Th hücreler sunarak onları aktive
ederler. Makrofajlar B hücrelerine kıyas ile bazı sitokinleri (örneğin IL-1 gibi) fazla miktarlarda salgılayarak T
hücrelerini daha kolay aktive edebilirler. B lenfositlerin bellek T hücrelerini uyarabilmesi için gerekli antijen miktarı,
makrofajların uyarabilmesi için gerekli olandan daha azdır. Bu nedenle B lenfositlerin sekonder immün yanıtta
daha önemli rol oynadığı düşünülmektedir. B lenfositlerinin Th hücrelere antijen sunumunda, Th’ler de B hücre
proliferasyonu ve farklılaşması için gerekli sitokinleri salgılar. Sonuçta B lenfositleri plazma hücrelerine dönüşürek
antikor üretir. B lenfositlerin bir kısmı bellek hücresi (memory) olarak kalır ya da yok edilirler.
B Lenfosit Effektör Fonksiyonu
B lenfositler antijenle uyarıldıklarında prolifere olurlar, effektör fonksiyonlarını yapabilmek için plazma hücrelerine
dönüşerek antikor üretirler ve humoral immünitede etkin görev yaparlar:
•
Üretilen antikorlar yabancı antijenleri kaplayarak (opsoninler olarak) bunların nötrofil ve mononükleer
hücreler tarafından fagosite edilmelerini sağlar.
•
Kompleman sistemini aktive ederek mikroorganizmaların fagositozuna ve lizisine katkıda bulunur.
•
Bazı antikorlar mast hücre degranülasyonu ve mediatör salınımına yol açarak parazitlerle mücadele
eder.
106|
•
Bakteriyel toksinleri bağlar, nötralize eder .
•
Virüsları bağlar, sağlam konak hücrelerini enfekte olmaktan korur.
•
Mukoza ve yabancı yüzeylerde patojen ajanları bağlayarak kolonizasyonları önler.
•
NK hücreleri ve makrofajlardaki Fc reseptörlerine bağlanır ve hedef hücrenin yok edilmesini sağlar
(antikora bağlı sellüler sitotoksite, ADCC).
V. Antikorlar
Antijenlere karşı plazma hücrelerinde üretilen ve antijenleri ile birleşme özelliğine sahip spesifik globulinlerdir.
İmmünglobulin adı ile de anılan bir antikor molekülü 2 ağır ve 2 hafif zincirden oluşur. İki hafif zincir ayrı ayrı disülfid
bağları ile ağır zincire bağlanır (Şekil 6). Ağır zincirler de disülfid bağları ile birbirine bağlanır. Beş tip ağır zincir
(γ, α, μ, ε, δ ) sırasıyla IgG, IgA, IgM, IgE ve IgD moleküllerini temsil etmektedir, γ zincirinin alt tipleri (γ1, γ2,
γ3, γ4) ve α zincirinin alt tipleri (α1 α2) bulunmaktadır ve sırasıyla IgG1, IgG2, IgG3, IgG4 ve IgA1, IgA2’yi ifade
etmektedir. Antikorların ana tipleri ve alt tipleri izotip olarak da bilinir. Hafif zincirler yapısal özelliklere göre iki tiptir
(lambda: λ ve kappa: κ). Bir immünglobulin molekülünde iki adet ya lambda yada kappa bulunur her ikisi aynı
immünglobulin molekülünde bulunmaz. İmmünglobulinin iki adet aynı yapıya sahip antijen bağlayan bölgesi
(Fab: Fragment antigen binding) ve fagozitlere ve komplemana bağlanabilen kısmı (Fc: Fragment crystallizable)
bulunur. Antijen bağlayan bölgede hem hafif, hem ağır zincir bulunur. Değişken (variable) ve sabit (constant)
olan iki bölge içerir. Değişken bölgedeki amino asit diziliş farklılığı antijen cevabın spesifik olmasını sağlar. Fc
parçasında ise sadece ağır zincir bulunur ve immünglobulin tipini belirler.
Şekil 6. İmmünglobulin molekül yapısı
Değişken Bölge
Disüflid bağları
Ağır zincir
Hafif zincir
Sabit parça
|107
Her bir tip immünglobulinin farklı biyolojik özellikleri Tablo 3’de gösterilmiştir.
Tablo 3: İmmünglobulinlerin biyolojik özellikleri
IgG
IgA
IgM
IgE
IgD
Serumda
Oranı/
molekül şekli
%80
Monomer
%20
Monomer, Dimer
%10
Pentamer
%0.0003
Monomer
<%1
Monomer
Alt tipleri
IgG1(%68),
IgG2(%20),
IgG3(%8)
IgG4(%4)
IgA 2 >IgA1
Sekretuar tip;tükrük,
göz yaşı, idrar,süt,barsak
sekresyonunda dimer,
trimer şeklinde bulunur
-
-
-
Molekül ağırlığı
150.000
IgA2: 900.000
IgA1: 140.000
970.000
180.000
Effektör aktivite
Presipitasyon
Toksin nötralizasyonu
Sekretuar tip:aglütinasyon
Opsonizasyon nötralizasyon
Kompleks
Yapıdaki
mikroplarla
mücadele
Fc kısmı
B hücre
mast hücresini gelişmesinde
bağlar
rolü
Kompleman
aktivasyonu
Klasik yol (IgG3 en güçlü)
Alternatif yol (IgG4)
-
Klasik yol
-
-
Plasentayı
geçiş
+ (IgG2 en zayıf)
-
-
-
-
Mast
hüc./bazofil
degranülasyonu
?
-
-
+
-
Yapısal üretim bozuklukları (plazma hücre diskrazileri gibi) veya normal yapıda ancak eksik miktarlarda
bulunduklarında (immün yetmezlikler gibi) hastalıklar ortaya çıkabilir.
Antikor Reseptörleri
Antikorlar kompleman aktivasyonu, opsonizasyon gibi etkilerini, çeşitli hücre yüzeylerinde bulunan reseptörlerle
gerçekleştirirler. En iyi tanımlananlar: mononükleer hücrelerde, nötrofillerde ve NK hücrelerde bulunan Fcγ reseptörü
(Fcγ RI, Fcγ RII, Fcγ III) ve mast hücreleri ve bazoofil hücrelerde bulunan Fcε reseptörüdür. (Fcε I, Fcε II)
Fcγ reseptörleri kompleman reseptörleri (CR1 ve CR2) ile birlikte immün kompleks klirensinde önemli rol oynarlar.
Fcε reseptörler IgE ile birleşerek hücreleri duyarlı duruma geçirirler. Antijen ile IgE birleştiğinde reseptör bulunan
hücrede degranülasyon ve sonucunda allerjik reaksiyonlar gelişir.
Primer ve Sekonder İmmün Yanıt
Primer immün yanıt, bir antijene ilk maruziyeti takiben haftalar (6-10 gün) içinde gelişir. Antikor izotipi genellikle
IgM>IgG antikorudur. Düşük affinitelidir.
Sekonder immün yanıt, aynı antijen ile tekrar karşılaşmada daha hızlı (1-3 gün) ve daha güçlü gelişir. IgG, bazen
IgA veya IgE tipi antikor üretilir. Yüksek affinitelidir.
VI. İmmün Yanıt
Buraya kadar olan bölümde İmmün yanıtın oluşumunda rol oynayan antijenler, hücreler ve hücreler arası
etkileşimde görev yapan moleküller; MHC molekülleri, antijen için hücre reseptörleri, yüzey molekülleri, aktive
hücrelerden üretilen sitokinler, antikorlar ve kompleman hakkında genel bilgiler verilmiştir. Bundan sonraki
bölümde spesifik (edinsel /adaptif) ve spesifik olmayan (doğal /innate) immün yanıtın özelliklerinden söz edilecektir.
108|
İmmün yanıtı sağlayan savunma sistemi, birbirlerinden bağımsız olmayan, başlıca iki ana grupta incelenir. Bunlar
Doğal (innate) ve edinsel (adaptif) immünitedir. Başlıca özellikleri Tablo 4’de bulunmaktadır.
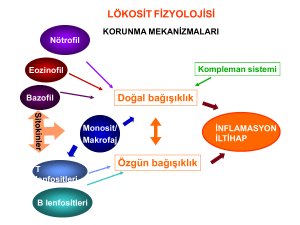
Doğal İmmünitenin Genel Özellikleri
Spesifik olmayan ilk savunmayı temsil eder ve özgül olmayan yanıt özelliği taşırlar. Deri ve müköz membranların
fiziksel bariyerleri, kan ve dokularda bulunan fagositik hücreler (makrofajlar, nötrofiller,eozinofiller, doğal öldürücü
hücreler (natural killer hücre=NK), akut faz proteinleri, sitokinler ve kompleman sistemi doğal immün sistemin
başlıca elemanlarıdır. Bunlar yabancı ve zararlı olan maddeleri ayrım yapmadan, engelleyerek ya da elimine
ederek organizmayı korurlar. Doğal immün yanıt ilk 0-4 saat içinde gelişir ve uzun süreli bir bağışıklık sağlamazlar.
Hafızaları yoktur ve yabancı ile tekrar karşılaştıklarında aynı şiddette karşılık verirler. Yabancı antijenleri edinsel
immün sistem elemanlarına tanıtım ve uyarı görevini gerçekleştirirler.
Edinsel İmmünitenin Genel Özellikleri
İki belirgin özelliğe sahiptir; 1-antijene spesifik oluşu ve 2-hafıza oluşturmasıdır. Ayrıca uzun süreli bağışıklık sağlar
(antikor ve hafıza T hücreleri ile). Yabancı bir ajan ile karşılaşmada uyarılarak spesifik yanıt veren, aynı ajanla tekrar
karşılaşmada hafızası olduğundan, tanıyıp daha kuvvetli yanıt veren bir sistemdir. Edinsel immünitenin başlıca
elemanları T ve B lenfositleri, antikorlar ve sitokinlerdir.
Spesifik immünite aktif veya pasif gelişir. Organizmanın yabancı antijene karşı hücreleri ve humoral maddeleri
ile yanıtı aktif immünitedir (enfeksiyon geçirilmesi ile oluşan immünite, aşılar ile sağlanan immünite gibi). Spesifik
olarak immünize olmuş bireyden serum veya hücrelerin,immün olmayan bireye nakli ile pasif immünite sağlanmış
olur.
Tablo 4: İmmün sistemin komponentleri: Doğal ve Edinsel immünitenin genel özellikleri
Doğal (İnnate) İmmünite
Edinsel (adaptif) İmmünite
Fizik Bariyerler
Deri ve mukoza epiteli
-
Hücreler
Nötrofil
Monosit/makrofaj
Doğal öldürücü hücre (NK)
T ve B Lenfositler
Solubl Faktörler
İmmünglobulinler
Sitokinler
Kompleman proteinleri
Akut faz proteinleri
Sitokinler
Enzimler
Gelişme Süreci
Hızlı gelişir (saatler içinde)
Yavaş gelişir (günler içinde)
Antijene Spesifik Oluşu
Antijene spesifik olmayan immünite
Antijene spesifik immünite
Hafıza
Yok
Var
|109
A. Doğal (Innate) İmmünite
Hücreler
Vücudu saran deri ve sindirim,solunum ve genitoüriner kanalları döşeyen müköz membranlar doğal
immün sistemin ilk korumayı sağlayan epitel bariyerleridir. Yüzeylerinde antimikrobiyal maddeler de vardır.
Vücudun normal florası da patojen mikroorganizmaların kolonizasyonunu engellemektedir. Yabancı
ajanlar birinci basamak olan fizyolojik bariyerleri aşmış ise doğal immün sistemin hücreleri ve humoral
faktörlerin savunması ile karşılaşırlar. Doğal immün sistemde görev alan; nötrofil, eozinofil ve bazofil gibi
granülositler ve monositler, kemik iliğindeki hematopoetik kök hücrenin bir alt kolu olan myeloid progenitor
hücreden gelişirler. Organizmada kan ve dokularda bulunan başlıca fagositoz yapan hücreler, nötrofiller,
monosit/makrofajlardır, profesyonel fagositler olarak anılırlar. Diğer fagositer hücreler; dendritik hücreler,
fibroblastlar, epitel hücreleridir. Doğal immünitenin önemli bir hücresi de NK hücresidir. Doğal immünitede
rol alan bu hücreler hakkında bilgiler immün sistemin elemanları başlığı altında verilmiştir.
T oll Benzeri Reseptörler (Toll-Like Reseptörler=TLR)
Büyük bir protein ailesidir. Mikroorganizmalara karşı innate immün cevapta, mikrobiyal ürünleri tanıma
reseptörleri olarak ve onların primer sensörleri olarak görev alırlar. Doğal immünite ile edinsel immünite
arasında ilişki sağlayan en önemli transmembran proteinleridir. TLR’ler makrofaj ve dendritik hücrelerde
bulunurlar. İmmün ve inflamatuar genlerin indüksiyonunu sağlayan sinyal yollarını aktive ederler.
Hücre dışı domain’lerinde lösin’den zengin motifler bulunur. TLR’nin sitoplazmada bulunan domaini, IL1 reseptör sinyal domaini ile homolog olup IRAK’a (IL-1 receptor associated kinase) bağlanır. IRAK, bir
transkripsiyon faktörü olan Nükleer Faktör kappa B’i (NF-κB) aktive ederek sitokin üretimini sağlar.
Günümüzde en az 10 farklı TLR bilinmektedir. Herbiri farklı mikrobiyal komponentleri tanır. TLR2’nin
peptidoglikan ve bakteriyel lipopeptidlerle, TLR4’ün gram negatif lipopolisakkaridler (LPS) ile ilişkileri iyi
bilinmektedir. TLR3, TLR7 ve TLR8 viral RNA’yı tanır. TLR9 CpG DNA tanınmasında başlıca rol alır. Doğal
immün sistem hücrelerinde TLR 2 ve TLR4 ekspresyonu bulunmaktadır. TLR sinyallerinin enfeksiyonda
ana rolleri iyi bilinmemektedir, artmış inflamatuar yanıtı yönlendirdiği düşünülmektedir.
Kompleman Sistemi
Kompleman sistemi, total serum proteinlerinin yaklaşık %10’unu oluşturan bir grup moleküllerdir. Yapım
yeri başlıca karaciğerdir, aktive makrofajlar da az miktarlarda sentezleyebilir. Bu sistemde çok sayıda
kompleman proteini bulunur. Kompleman proteinleri proenzimdirler ve aktive olmaları için daha önce
aktive olmuş enzimlerle proteolitik parçalanmaları gereklidir. Kaskad sistemine göre çalışırlar. Aktive
olmuş bir enzim daha sonraki basamakta birkaç molekülü aktive eder ve etkileşim böylece artarak
devam eder. Sistem kontrol edilemezse gittikçe güçlenerek biyolojik bir hasar oluşur. Normal durumlarda
sistemin düzeni, özellikle enzimlerin inhibisyonu ile sağlanır ve sistem kontrol altında tutulur. Kompleman
kaskadı başlıca üç yol ile aktive olur; antijene bağlanmış antikor (antijen-antikor kompleksi) klasik yolu,
karbonhidratlar lektin yolunu, çeşitli mikroroganizmalar altenatif yolu aktive eder. Her üç yolda da ortak
basamak, kompleman 3’ün (C3) daha küçük iki fragmana (C3a ve C3b) ayrılmasıdır. C3a fagositleri ve
mast hücreleri aktive eder. C3b, fagositler için reseptördür, ayrıca membran atak kompleksi olarak bilinen
ve lizis yapan kompleman proteinlerini (C5-C9) aktive eder (Şekil 7). Klasik yolda ilk basamak antijenin
antikora bağlanması (immün kompleks) ile C1q’unun uyarılmasıdır. Böylece kompleman sisteminin doğal
immünite ile edinsel immünite arasındaki ortak noktasını immün komplekslerin klasik yolu aktive etmesi
sağlamaktadır. Klasik aktivasyon yolu ve membran atak kompleks proteinleri; C1q, C1r, C1s, C4, C2,
C3, C5, C6, C7, C8, C9’dur. Alternatif yol için antikor gerekli değildir ve C3b’nin çeşitli mikroorganizmaların
yüzeyindeki hidroksil ve amin gruplarına bağlanması ile başlar.Bu şekilde nonspesifik immüniteye yani
doğal immüniteye katkıda bulunur. C3 ile başlar, C3’den sonraki diğer komponentler klasik yolda olduğu
110|
gibi aktive olur. Lektin yolu,C4 ve C2’nin aktivasyonu ile başlar, klasik yol C3 konvertaz ile devam eder.
Bu yolu tetikleyen Mannan bağlayan protein (MBP) ve MBP-associated serine proteaz (MASP)’dir.
Şekil 7. Komplemanın klasik ve alternatif aktivasyon yolları
Antijen-antikor kompleksi
C3
Klasik yol
adaptif immünite
C3a
Mikroorganizma
Alternatif yol
Doğal immünite
C3b
C5-C9
Komplemanın temel biyolojik fonksiyonları; opsonizasyon, kemotaksi ve hücre lizisidir.
Opsonizasyon: Kompleman komponentleri hedef maddeyi (bakteri ve yabancı diğer antijenler gibi)
kaplar ve sonrasında kompleman komponentleri için reseptör taşıyan fagositik hücreler bakteriyi
bağlayabilir, böylece fagositoz tetiklenmiş olur. C3b, fagositlerle bağlanma özelliği nedeniyle opsonin
olarak görev yapar, fagositozu kolaylaştırır.
Kemotaksi: Polimorf nüveli lökositler ve makrofajlar (profesyonel fagositler), kompleman aktivasyonu
sırasında aktive olan küçük kompleman fragmanları (C3a ve C5a) için spesifik reseptörler taşırlar ve bu
fragmanlar kemotaksiyi tetikleyerek fagositik hücrelerin aktivasyonunu sağlarlar. C5a’ın inflamasyonda
diğer önemli rolü; bazofil ve mast hücrelerinden degranülasyonu sağlayarak histamin ve vazoaktif
medyatörlerin salınımına yol açmasıdır, böylece arteriollerde vazodilatasyon ve kapillerlerde permeabilite
artışı olur, bu durum lökositlerin damarlardan inflamasyon bölgesine geçişini kolaylaştırır. C3a, mast
hücrelerinde degranülasyona sebep olur. C5a’a göre kemotaktik etkisi zayıftır,nötrofil kemotaksisinde,
nötrofil toplanmasında, respiratuvar burs aktivasyonunda daha az etkindir.
Hedef hücre lizisi: kompleman aktivasyonunda son basamak olan membran atak kompleksi (C5-C9),
mikroorganizma gibi hedeflerin membran lipid tabakasına nüfus ederek ozmotik parçalanmalarını sağlar.
Komplemanın diğer bir fonksiyonu immün komplekslerin klirensini sağlamasıdır. İmmün kompleksler
komplemana bağlanarak dolaşımdan temizlenir. Fagositer hücre içine aldığı zararlı maddeleri enzimlerle
parçalayarak yok eder. Doğal immün sistem zararlıyı yok etmede yetersiz olursa edinsel immün sistemi
alarma geçer.
B. Edinsel (Adaptif) İmmünite
Edinsel immünite başlıca humoral (B hücre aracılı) ve hücresel (T hücre aracılı) immunite olarak
incelenmektedir. Özellikleri Tablo 5’de gösterilmiştir.
Humoral immün yanıtta B lenfositlerin plazma hücrelerine dönüşerek ürettikleri, antijen spesifik moleküller
olan antikorlar başlıca rol oynar. B hücre aracılığı ile antijenlere karşı antikor üretimi humoral immün
sistemin en temel görevidir. Hücre dışı yerleşen mikroorganizmalar ve onların toksinlerine karşı savunmada
etkin olup bağlanarak nötralize eder ve ortadan kaldırılmalarını sağlarlar. Ancak dolaşan antikorların hücre
içi yerleşim gösteren mikroorganizmalara (viruslar, mantarlar ve bazı bakteriler gibi) etkileri yoktur.
|111
Tablo 5: Humoral ve hücresel ve immünitenin başlıca özellikleri
Humoral immünite
Hücresel İmmünite
Effektör Hücre
B lenfosit
CD4+Th1,CD4+Th2,CD8+ Tc,T reg
Aracı moleküller
Antikor, Sitokinler
Sitokinler, Kemokinler
Effektör etki
-Hücre dışı mikropların hücre duvarına
-Fagositlerin içinde yaşayan mikropları
tutunarak konakçıyı enfekte etmesini ve
hücre içi öldürmesi için fagositlerin aktive
kolonizasyonu önler.
edilmesi (CD4+Th1hücre)
-Toksinleri nötralize ve elimine eder.
-Enfekte hücreleri öldürerek hücre içi çoğalan
-Antikorlar, mikropları kaplar (opsonizasyon),
mikropların yok edilmesini sağlamak ve sağlam
fagosit yüzeyindeki Fc reseptörüne
konak hücrelerini enfekte olmaktan korumak
bağlanarak fagositozu kolaylaştırır.
(sitotoksik T hücre )
-Antikor aracılı hücresel sitotoksisite (ADCC)
-Hücre dışı helmintik parazitlerin yok
NK, lökositler, FcR aracılığı ile antikor kaplı
edilmesi (CD4+ Th2 hücre)
hücrelere bağlanır ve granülleri ile öldürür.
-Kompleman sistemini aktive eder.IgM,IgG1,
IgG3 ile klasik kompleman yolunu aktive eder
-Mukozal immün yanıtta rol oynar (sIgA)
Antikorların/Humoral İmmünitenin Effektör Etkileri:
•
Antikorlar hücre dışı mikropların hücre duvarına tutunarak konakçıyı enfekte etmesini ve kolonizasyonunu
önler. Polisakkarid yapısında olan ve kapsüllü olan mikroroganizmalara karşı savunmada hücresel immüniteden
daha kuvvetlidir.
•
Toksinlerin konak hücresine bağlanmasını önler, nötralize eder ve elimine eder.
•
Antikorlar mikroorganizmaları kaplar (opsonizasyon), fagosit yüzeyindeki Fc reseptörüne bağlanarak onların
fagositozunu kolaylaştırır.
•
Antikor aracılı hücresel sitotoksisite (ADCC): NK hücre ve lökositler,sahip oldukları FcR aracılığı ile antikor
kaplı hücrelere bağlanırlar ve oluşan sinyaller ile aktive olurlar ve hedef hücrelere granüllerini boşaltarak
öldürürler.
•
Kompleman sistemini aktive ederler: IgM,IgG1, IgG3 ile klasik kompleman yolunu aktive ederler.
•
Mukozal immün yanıtta rol oynar: Mukozal immünitenin temel mediatörü sekretuar IgA(sIgA) ve daha az
miktarda Ig M antikorudur. SIgA’nın mukozal yüzeylerde fonksiyonları; mikroroganizmanın tutunmasının
önlenmesi, virus nötralizasyonu, enzim ve toksinlerin nötralizasyonu, antijen emiliminin baskılanmasıdır.
Hücresel immünite mikroorganizmaların hücre içi ölümünde ve enfekte hücrenin lizisinde başlıca rol oynayan
bir savunma mekanizmasıdır.Bu koruyucu fonksiyonlar farklı fonksiyonları olan T hücreler ile gerçekleşir:
•
CD4+ Th1; fagositlerin fagozom içindeki mikroorganizmaları yok etmeleri için fagositleri aktive eder.
•
CD8+ T hücreler; enfekte hücreyi veya tümör hücresinin öldürülmesinden sorumludurlar.
•
CD4+ Th2 hücreler ile hücre dışı yerleşmiş helmintik parazitlere karşı savunmada; IgE sentezine, eozinofil
ve mast hücre aktivasyonuna yol açarak etkin rol oynar. Bu hücrelerin diğer bir fonksiyonu inflamatuar
reaksiyonu baskılar. Bu işlemi, makrofaj aktivitesini inhibe eden sitokinleri (IL-10 ve IL-4) salgılayarak
gerçekleştirir.
İmmün yanıtın başlıca amacı organizmanın korunmasıdır. Bazan immün yanıt patojen veya antijenden daha çok
hasara neden olabilir. Bu durumda aşırı ya da uygun olmayan biçimde gelişen immün reaksiyonlar geleneksel
olarak aşırı duyarlılık (hipersensitivite) reaksiyonları olarak adlandırılırlar, Coombs ve Gell tarafından tarif
edilmiş olan 4 tip aşırı duyarlılık reaksiyonu vardır: 1-Tip I anaflaktik reaksiyon, 2- Tip II sitotoksik veya sitolitik
112|
reaksiyon, 3- Tip III immünkompleks tip reaksiyon, 4-Tip IV hücresel tip veya gecikmiş tip reaksiyon. Bu 4 tip
içinde Tip I, Tip II, Tip III reaksiyonları antikor aracılı reaksiyonlardır. Bu reaksiyonlar her zaman tanımlanan sınırlar
içinde kalmayabilir, aralarında örtüşmeler de görülebilir.
Tip I Aşırı Duyarlılık Reaksiyonu: IgE aracılı gelişir. IgE ile duyarlanmış mast ve bazofil hücrelerinin tetiklenmesi
sonucu inflamatuar mediatörlerin salınımı ile ani gelişen bir reaksiyondur. Allerjinin klinik örneklerinden olan allerjik
rinit, astım, ilaç allerjisi ve anafilaksi ortaya çıkar.
Tip II Aşırı Duyarlılık Reaksiyonu: Hem Tip II, hemde tip III reaksiyonlar IgG ve IgM antikorlar ile gelişir.
Tip II’de hedef antijen hücre yüzeyinde veya dokuda iken Tip III’de antijen solubl olup antijen-antikor kompleksi
depolandığı yerde inflamasyona yol açar. Tip II mekanizmaları otoimmünitede ve transplantasyonda önemli rol
oynar. Yüzey antijenine bağlı antikor fagositleri harekete geçirir ve komplemanı aktive eder. Tip II reaksiyonun
başlıca klinik örnekleri; yeni doğanın hemolitik anemisi, otoimmün sitopeniler, otoimmün hastalıklar (Haşimato
tiroiditi gibi), Good Pasture sendromu ve ilaç reaksiyonlarıdır.
Tip III Aşırı Duyarlılık Reaksiyonu: Dolaşımda bulunan antijen için antikor geliştiğinde,antijen ve antikor
birleşerek solubl immün kompleksleri oluştururlar. Bu komplekslerin dolaşımdan uzaklaştırılması kompleman
aktivasyonu ile sağlanır. Dolaşan immün kompleksler kompleman reseptörü taşıyan eritrositlere bağlanarak
dolaşımdan uzaklaştırılır ve ulaştığı mononükleer fagositik sistem tarafından tutularak yok edilir. Bu işlem immün
sistemin normal bir fonksiyonu olarak karaciğer kupffer hücrelerinde, dalak sinusoidlerinde, böbreğin mezankim
hücrelerinde ve endotelde gerçekleşir. İmmün komplekslerin antijen ve antikor özellikleri, kompleksin büyüklüğü,
antikor affinitesi,lokal kan akımı ve dokuda önceden var olan inflamasyon, sürekli dolaşımda kalmaları, klirenslerinde
bozukluklar gibi faktörler onların dokularda depolanmasını belirler. Büyük çaplı immünkompleksler daha çok
kompleman ve Fc reseptör bağlantısı yapabildiklerinden daha hızlı dolaşımdan temizlenir. IgG ve IgM komplemanı
klasik yoldan aktive ederken, IgA sadece alternatif yoldan etkiler. IgE ve IgD ise komplemanı aktive etmez.
İmmün kompleksler, kompleman aktivasyonu, mast hücre degranülasyonu ve trombosit aglütinasyonunu içeren
birçok inflamatuar olayı tetikler ve bu durum nötrofil kemotaksisi, mikrotrombüs oluşumunu indükler ve doku
hasarı oluşur. Damar endoteli ve glomerül bazal membranı immünkompleks reaksiyonlarında hasar gören hedef
dokulardır. İmmünkompleks tipi reaksiyonlar ile oluşan hastalıklardan ilk tanımlanan serum hastalığıdır. Glomerülonefrit
(poststreptokokkal glomerülonefrit), çiftçi akciğer hastalığı ve otoimmün hastalıklar (lupus nefriti gibi), bazı vaskülitler
(Henoch-Schönlein purpurası, poliarteritis nodoza gibi) diğer klinik örneklerdendir.
Tip IV Aşırı Duyarlılık Reaksiyonu: Temelde T hücre ile antijen ilişkisine dayalı gecikmiş tip hipersensitivite
reaksiyonu olan lokalize inflamatuar yanıttır. Bu reaksiyonda genellikle CD4+ Th1 hücreler ve ürettikleri sitokinler
(IL-2 gibi) ve makrofajlar baş roldedirler, bazen CD8+ hücreler rol alabilir. Antikorun rolü yoktur. Gecikmiş tip aşırı
duyarlılık reaksiyonunun en tipik örneği tüberkülin (PPD, purifiye protein derivesi) reaksiyonudur. Tüberküloz
geçirmiş ve iyileşmiş veya tüberküloz aşısı yapılmış yani immünize olmuş bir bireyde bu reaksiyonun negatif
olması (anerji) T hücre fonksiyonunun yetersiz olduğunu gösterebilir.
T Hücre Aracılığı İle Oluşan ve Hasar Yapan Hücresel İmmün Yanıtlar: Gecikmiş tip aşırı duyarlılık reaksiyonu
, otoimmünite (romatoid artrit gibi), tümör hücresine karşı reaksiyon ve allograft reddidir (yabancı MHC molekülleri
taşıyan hücreler, hem CD4+, hemde CD8+ T hücrelerce tanınır ve graft rejeksiyonu gelişir).
VII. MHC Sistemi (Major Histocompatibilty Complex, MHC)
Majör histokompatibilite kompleksi (Major Histocompatibility Complex, MHC), 6 kromozomun kısa kolu üzerinde
4000 kilobaz büyüklüğündeki bir bölgede lokalize olan gen topluluğudur. MHC ile ilgili araştırmalar Gorer ve
Medawar’ ın çalışmalarıyla 1930 ve 1940 yıllarına kadar uzanmaktadır.1950’li yıllarda çok doğum yapmış
kadınların serumunda lökositlere karşı antikorların varlığı ve antijenlerin de lökositlerde gösterilmesi ile “insan
lökosit antijenleri” (Human Leucocyte Antigen, HLA) sistemi tanımlanmıştır. İnsanda yapılan transplantasyonlarda
vericinin dokusuna karşı gelişen ve doku reddine kadar giden reaksiyonlarda hedef antijenlerin HLA molekülleri
olduğu saptanmıştır.
|113
MHC gen bölgesi immün sistem fonksiyonunun %40’ı ile ilişkili 200 gen içermektedir.
MHC Gen Bölgesi ve Yapısal Özellikleri:
MHC gen bölgesinde kodlanan proteinlerin özelliklerine göre Sınıf I, II ve III olarak bölgelere ayrılır (Şekil 8).
MHC Sınıf I Bölgesi:
MHC’inin telomerik ucunda yer alır. HLA sınıf I moleküllerini kodlayan bu bölgede HLA-A, HLA-B, HLA-C “klasik”
gen lokusları, HLA-E, HLA-F, HLA-G “klasik olmayan” gen lokusları, HLA-H, -J, -K, -L, -X gibi psödogenler
bulunmaktadır. HLA sınıf I molekülleri yüksek derecede polimorfiktir. Bu bölgede bulunan genlerden en fazla
HLA-B geninde çok sayıda farklı “alel” tanımlanmıştır.
HLA sınıf I molekülleri tüm nükleuslu hücrelerde bulunan geniş bir antijen grubunu oluşturur.
İnsan MHC sınıf I bölgesinde “sınıf I ile ilişkili” (MHC class I chain-related, MIC) genlerin varlığı da bildirilmiştir.
MIC gen ürünleri klasik HLA sınıf I moleküllerinden farklıdır. MICA ve MICB genleri fonksiyonel olarak eksprese
olurlarken, MICC, MICD, MICE ve MICF psödogendir. MIC molekülleri , NK hücreler, CD8+T hücreler için ligand
görevi yaparlar. Çalışmalar MIC ekspresyonunun solid organ transplant yaşamında rol oynayabileceğini
düşündürmüştür.
MHC Sınıf II Bölgesi:
MHC sınıf II bölgesi sentromere yakın yerleşmiş olup, gen ürünleri başlıca HLA-DR, HLA-DQ ve HLA-DP
molekülleridir. HLA-DM ve HLA-DO moleküllerini kodlayan genler de bulunmaktadır. Bu bölgede yer alan DMA
ve DMB genleri hücre içi endozomal yapılarda eksprese olan DM molekülünü, DOA ve DOB genleri de hücre
içinde lokalize olan DO molekülünü kodlamaktadır. Ayrıca bu bölgede TAP1 ve TAP2 (transporters associated
with antigen processing) genleri, hücre içi transport moleküllerini; PSMB9, PSMB8 genleri hücre içi proteazom
kompleks yapılarını; ve TAPBP geni ise endoplazmik retikülumda eksprese olan tapasin molekülünü kodlamaktadır.
Sınıf II gen bölgesindeki HLA gen lokuslarının iki gen ürünü olan α ve β zincirleri bulunur. Örneğin DRA, α zincirini;
DRB, β zincirini kodlar. β zinciri DR antijenleri için dört çeşit olup DRB1, DRB3, DRB4 veya DRB5 genleri
tarafından kodlanırlar. DRB1 en polimorfik olan gendir.
MHC Sınıf III gen bölgesinde kodlanan proteinler yapısal ve fonksiyonel olarak sınıf I ve sınıf II’den farklıdır, ancak
immün yanıtın oluşumunda katkıları ile önemli rolleri olduğu açıktır. Sınıf III bölgesinde sitokinler (interferon, tümör
nekroz faktör) kompleman faktörleri (C4A, C4B, Bf ve C2), enzimler (21 hidroksilaz koenzim), ısı şoku proteinleri
gibi proteinleri kodlayan genler bulunmaktadır.
Şekil 8. MHC gen bölgesi
6.KROMOZOM
SINIF II
DPB DPA DQB DQA DRB DRA
MHC
SINIF III
C4B CYP21 C4A B1 C2 TNF HSP
SINIF I
B
E
A
G
F
HLA Sınıf I moleküllerinin yapısı: HLA sınıf I molekülleri glikoprotein yapısında hücre membran proteinleridir. Bu
moleküller, α ve β2-mikroglobulin polipeptid zincirlerinden oluşur (Şekil 9).
114|
α zinciri: MHC içinde kodlanır. Hücre dışında yer alan 3 ‘domaini’ (α1, α2 ve α3) ve hücre içine uzanan kısa
bir parçası bulunur. Bu bölgelerden α1 ve α2 domaini en çok polimorfik özellik (bireyler arasında alelik farklılık
yaratır) gösterir ve molekülün antijen bağlama bölgesini oluşturur. β2-mikroglobulin: 15.kromozomda kodlanır.
Bu zincir α3 domaini ile non-kovalan bağlarla bağlanmış olarak yer alır. Hücre içine uzantısı bulunmaz. β2mikroglobulin polipeptid zinciri polimorfizm göstermez.
HLA sınıf II moleküllerinin yapısı: Sınıf II molekülleri de hücre membran glikoproteinleridir. Bu molekülleri oluşturan
birbirine non kovalan bağlarla bağlanmış iki polipeptid zincirinin (α ve βzincirleri) hücre dışı parçası ikişer domain’den
(α1, α2 ve β1, β2) oluşur. α ve βzincirlerinin α1 ve β1 bölgeleri molekülün antijen bağlama bölgesini oluşturur.
Bu bölgede amino asit dizileri bireyler arasında çeşitlilik (polimorfizm) gösterir. Molekülün transmembran parçası
ve hücre içi uzantısı da bulunur (Şekil 10).
Şekil 9. HLA sınıf 1 molekülü
α2
α3
Şekil 10. HLA sınf II molekülü
α1
β1
β−microglobülin
β2
α1
α2
HLA Moleküllerinin Dokularda Dağılımı
Sınıf I grubu HLA molekülleri nükleuslu tüm hücrelerin membranında eksprese olur. Sınıf II grubu moleküller
fonksiyon olarak antijen sunan immün yetenekli; B lenfosit, makrofaj, dendritik hücre, langerhans hücre ve timik
epitelyum gibi hücrelerin yüzeyinde eksprese olurlar. İmmün yanıt sırasında açığa çıkan bazı sitokinler (interferon
gibi) klas II moleküllerin hücre yüzeyinde ekspresyonunu arttırır.
HLA Moleküllerinin Fonksiyonu
HLA molekülleri immün sistemin efektör hücrelerinden T lenfositlerine antijen sunumu yaparak immün yanıtın
başlaması için ilk uyarıyı gerçekleştirir. Sınıf I HLA molekülü ile kompleks yapmış endojenik proteinlerden
kaynaklanan antijeni, yüzeyinde CD8+ molekülü taşıyan T hücreler tanıyabilir. Sınıf II HLA molekülü ile birlikte
hücreye fagositoz veya endositoz yoluyla alınan proteinlerden kaynaklanan antijeni ise yüzeyinde CD4+ molekülü
bulunan T hücreleri tanır. T hücresinin antijeni tanıması için HLA ile kompleks oluşturmuş antijenin uygun (spesifik)
T hücre reseptörüne (TCR) bağlanması gerekmektedir. Hem antijen sunan hücrenin hemde antijeni tanıyan
T lenfositlerinin özelliğine bağlı gelişen bir dizi sinyal hücre içine iletilir.
MHC Genlerinin Kalıtım Özellikleri
MHC genleri Mendel kurallarına göre ebeveynden çocuklara geçiş göstermektedir. Her bireyde bir çift kromozomun
yarısı anneden yarısı babadan geçer. Böylece çocuklar ile anne-baba arasında bir haplotip uygunluğu vardır.
Bir haplotip üstünde bulunan alleller bir blok halinde geçerek jenerasyondan jenerasyona devam eder. Bir bireyde
bulunan 2 haplotip o bireyin HLA’genotipini’oluşturur. Örneğin; A1 B5 Cw1 DR6 DQ1 ve A3 B18 Cw2 DR DQ2.
Bu haplotiplerin biri anneden diğeri babadan kalıtılmıştır.
HLA alelleri, 6. kromozomda yerleşim şekline göre (HLA-DP,-DQ,-DR,-B,-C,-A) birbirlerine yakındırlar. İki ya da
daha çok alelin, rastlantısal olarak birlikte bulunma eğilimlerinin beklenen den daha sık olmasıı ‘bağlantı dengesizliği’
|115
(Linkage disequilibrium,LD) olarak tanımlanmıştır. Örneğin A1 ile B8 ve A2 ile B12 ve A3 ile B7 sıklıkla birlikte
bulunur. Bu durum linkage disequlibrium olarak ifade edilir. Sınıf II DRB genlerinde LD sık olarak saptanmıştır.
DQA1 ve DQB1genlerinde de birbirlerine yakınlık nedeniyle LD gösterilmiştir. Etnik gruplar arasında bu birliktelikler
değişiklikler gösterir.
Genetik geçiş sırasında %1-3 oranında rekombinasyon (Çapraz geçme=Crossing over) görülebilir. Homolog
kromozomlar arasında bir gen segmentinin değişmiş olması rekombinasyon olarak tanımlanır.
HLA moleküllerinin tayin yöntemleri
HLA moleküllerinin hücre yüzeyinde araştırılmasında “serolojik” yöntem kullanılır. Kısaca, HLA tayin edilecek
hücreler kandan veya dokudan izole edilir. Hücre olarak sıklıkla lenfositler kullanılır. Lenfositler HLA moleküllerini
tanıyan allo-antikorlarla kaplanmış küçük kuyucukları bulunan Terasaki plaklarına eklenir, ortama kompleman
ilave edilir. Lenfosit yüzeyindeki antijen, uygun antikoru ile karşılaştığında kompleman aracılığı ile hücre lizisi oluşur
ve eklenen boya ile canlı ve ölü hücre oranı saptanır. Her kuyucukdaki anti-HLA antikorlar bilindiğinden ölü hücre
oranının yüksek bulunduğu kuyucuklar belirlenerek, HLA tipi tayin edilir. Bu yöntem “Terasaki mikrolenfositotoksisite”
testi olarak bilinir. Bu yöntemle HLA sınıf I alttipleri, HLA sınıf II grubundan DR1-DR18 ve DR52, DR53 ile bazı
DQ (DQ1-DQ4) antijenleri saptanabilmektedir.
Transplantasyonda doku reddinin antikor aracılı rejeksiyonu önceden belirlemede yardımcı olan, anti-HLA antikor
tayini, “cross-match” (CM) testinde de mikrolenfositotoksisite yöntemi ile alıcının serumunda vericinin lenfositlerine
karşı alloantikor araştırılır. Günümüzde daha sensitif testlerle (flow sitometri, ELISA gibi), CM yapılabilmektedir.
Hücre kültürlerinde lenfositlerin aynı ortamda bulunan ikinci bir seri hücrenin antijenlerine karşı prolifere olarak
oluşturduğu yanıt “miks lenfosit reaksiyonu” olarak bilinir. HLA spesifitesi, fenotipi bilinen hücrelerle tanımlanır.
Günümüzde HLA tiplendirmesinde çok kullanılmamaktadır.
Moleküler tanı yöntemleri ile Sınıf I ve II moleküllerin alellerinin belirlenmesi sağlanmıştır. Yöntemin avantajları;
yüksek spesifite, serolojik yöntemle tayin edilemeyen alellerin tanımlanabilmesi, yeni alellerin saptanması, canlı
hücre gerektirmemesi, hastalık veya tedavi durumlarından etkilenmemesi sayılabilir.
Moleküler yöntemde çekirdekli hücreden, tercihen periferik kan lökositlerden DNA örneği kullanılır. MHC bölgesinin
polimeraz zincir reaksiyonu (PCR) ile çoğaltılması ve diziye özgü oligonükleotid problarla (Sequence Specific
Oigonucleotide, SSO) taranması ya da direkt diziye özgü primerlerle (Sequence Specific Primer, SSP) alel
düzeyinde genetik polimorfizmler gösterilebilmektedir. Genomik yöntemlerle etnik gruplar arasındaki farklılıklar
ve hastalık- HLA ilişkileri daha detaylı araştırılabilmektedir.
HLA Sistemi Nomenklatürü
HLA molekülleri ortak bir terminoloji ile ifade edilmektedir. Seroloji ile tanımlanan HLA molekülleri sırasıyla; HLA,
lokus adı, ve 1-2 basamaktan oluşan molekül ismi ile yazılır. Örnek: HLA-B5 veya HLA B27 gibi. Aleller farklı
çözünürlükteki yöntemler ile tanınır.
Kabul edilen terminolojiye göre sırasıyla; HLA, lokus adı, asteriks işareti (*), ilk 2 rakam (serolojik yöntem ile karşılığı
olan tipi tanımlar), son iki rakam (alelik farkını tanımlar) yazılır. Burada asteriks işareti moleküler çalışma olduğunu
ifade eder. Bir örnek ile görelim: HLA-DRB1*0401 örneğinde; HLA-DRB1* lokusun ismini, aleli gösteren 04
rakamı daha önce serolojik yöntemle gösterilmiş serolojik alt grubu ifade eder, 01 rakamı ise bu grubun allelik
farkını gösterir. Bu bilgi göstermektedir ki HLA-DR4 taşıyan birçok birey birbirinin aynısı değil, farklı aleller taşıyabilir.
HLA Sisteminin Klinik Önemi
Transplantasyon: Pratikte doku/organ transplantasyonunda alıcının ve vericinin HLA tiplendirilmesi yapılarak,
HLA uyumu dolayısıyla doku uyumu olup olmadığı anlaşılmaktadır. Genellikle graft ömrü HLA uyumu ile parallelik
gösterir. İkizler arasında (HLA-özdeş) yapılan transplantasyonlar, HLA uygunluğu tam olan, ancak kan bağı
116|
olmayan bireylerden yapılanlara göre daha başarılı olmaktadır. Burada MHC içinde yer alan diğer genlerin de
uyuma katkı sağladığı düşünülmektedir. Haplotipik geçiş durumunda MHC’ye yakın olan diğer lokusların da
geçişi olmaktadır. Tam uyumluluk MHC’de yer alan ve tanımlanabilen tüm genlerin uyumluluğunu ifade eder.
Özellikle kemik iliği transplantasyonu için tüm HLA lokuslarının (HLA-A, -B, -C ve -DR) uyumu çok önemli ve
gereklidir.
Pratikte HLA testinin sıklıkla başvurulduğu diğer bir konu ebeveyn tayinidir. Araştırma nitelikli HLA tayinleri ise
HLA-hastalık ilişkilerinin incelenmesinde ve antropolojik çalışmalarda yapılmaktadır.
Hastalık İlişkileri: HLA ile ilişkisi olduğu bildirilen hastalıklarda HLA molekülleri hastalığın nedeni değildir, hastalığa
yatkınlık/duyarlılık veya koruyuculuk sağladığı kabul edilir. Belirli antijenlerin varlığının hastalık riskini artırma katsayısı
“odds ratio” (OR) olarak bilinmektedir. Bu değer, (antijen pozitif hasta sayısı x antijen negatif kontrol sayısı) /
(antijen pozitif kontrol x antijen negatif hasta sayısı) formülü ile hesaplanır. OR> 1 değerler hastalık gelişme riskini
artırmaktadır. HLA ilişkisi saptanan hastalıkların çoğunluğunu otoimmmün hastalıklar oluşturmaktadır (Tablo 6).
HLA ile ilişkili romatolojik hastalıklar içinde, popülasyonlar arasında farklılıklar olmakla birlikte OR ‘nin en yüksek
olduğu hastalık ankilozan spondilittir. Otoimmün hastalıklar ile MHC arasındaki ilişkinin mekanizması çok iyi
bilinmemektedir. Bazı HLA molekülleri ile self peptidlerin sunumunun spesifik allel/ alleller ile hastalık ilişkilerinde
temel oluşturduğu düşünülür. Antijen bağlama bölgesinde aynı epitopu taşıyan HLA moleküllerinin hastalıkla
ilişkili olabileceği de bildirilmiştir. Romatoid artritte hastalığa yatkınlıkla ilişkili olduğu bulunan HLA DR1 ve DR4
moleküllerinin β zincirinin α sarmalında (helix) ortak bir dizi taşıdığı gösterilmiştir. Bazı HLA moleküllerinin hastalığa
karşı konakçıyı koruduğu da vurgulanmaktadır. Tip I diabetes mellitusta, HLA-DR2’nin hastalık için koruyucu
rol oynadığı bildirilmiştir. Ayrıca immün polimorfizm, tedaviye yanıtta da önemli rol oynayabilir. Genellikle hastalıklara
duyarlılık yaratan faktörlerden genler dışında, çevresel faktörlerin de önemli rolü olduğu hatırlanmalıdır.
Tablo 6: HLA ve İlişkili olduğu hastalıklar
Hastalık
HLA
Ankilozan Spondilit
B27
Romatoid artrit
DR4, DR1
Reaktif artropati
B27 DQA1*0501
Reiter sendromu
DR7,11, DQB1*0201
Jüvenil kronik artrit
B27, DRB1*08
Hashimato tiroiditi
DR11
Graves Hastalığı
DR3
Insuline bağlı diabetes
DR3
mellitius
DQB1*020
Idiopatik Addison hastalığı
DR3
Akut anterior üveit
B27
Sikka sendromu
DR3
Sistemik lupus eritematozus
DR3 DRB1*1501
B8 DRB5*0101
DQB1*0602
Multiple sklerosis
DR2
Myastenia gravis
DR3
DPB1*0201 B8
Coeliac hastalığı
DR3
DQB1*0201
Behçet hastalığı
B51
Akut iridosiklit
B27 DR11, DQA1*0501
B8
Pemphigus vulgaris
DR4
DR2
DRB1*1501
|117
VIII. Sitokinler
Sitokinler, hücreler arasındaki iletişimi sağlayan protein yapısında aracı moleküllerdir. Sitokin terimi, hücre ve
hormon anlamına gelen kelimelerden oluşur. İmmün sistemin hormonları gibi düşünülmüş, ancak birçok özellikleri
ile endokrin hormonlardan ayrılırlar. Sitokinler endokrin glandlardan değil, çeşitli hücrelerden salgılanırlar. Çoğu
salgılandığı mikroçevrede etkisini gösterir (otokrin veya parakrin etki). Hormonlar ise uzak dokularda etki gösterirler
(endokrin etki). Sitokinler immün sistem hücrelerinin gelişmesi, farklılaşması ve aktivasyonunda, antijen sunumu,
adezyon moleküllerinin ekspresyonu, akut faz yanıtları gibi immün yanıtın ve inflamasyonun her safhasında,
hücre ölümünde, hematopoez ve yara iyileşmesi gibi birçok biyolojik olaylarda hücreler arasındaki ilişkileri
düzenleyen yüksek düzeyde spesifik solubl proteinlerdir. Esas olarak Th hücreleri ve makrofajlar olmak üzere
hem spesifik, hem de doğal immün sistem hücrelerince salgılanırlar. Sitokinler antijen spesifik olmadıkları halde
yapımları ve salgılanmaları antijen uyarısına bağlıdır. Genel olarak önceden yapılmış moleküller olarak
depolanmazlar.Etkilerini spesifik reseptörlerine bağlandıkları zaman gösterirler. Sitokinlerin hedef hücresi, sitokini
salgılayan hücrenin kendisi olabilir veya daha sıklıkla yakınındaki bir hücre olabilir. IL-1 ve TNF ayrıca salgılanmadan,
üretildikleri hücrenin membranına bağlı durumda iken hedef hücredeki reseptöre bağlanarak etkilerini gösterebilirler.
Sitokinlerin Özellikleri:
•
Hücrelerde büyüme,farklılaşma, aktivasyon,kemotaksi, apopitoz, fibrozis gibi etkiler yapabilir.
•
Uyarı ile geçici bir süre salgılanır ve etkisi kısa sürelidir. Kendi kendini sınırlar.
•
Normal hücre fonksiyonlarının seyri sırasında salınırlar (özellikle antijen, immün kompleksler, kompleman,
enzim veya diğer sitokinlerin uyarılarına cevap sırasında ).
•
Sistemik dolaşımda inaktif durumdadır. Etkilerini yüksek konsantrasyonda spesifik yüksek affiniteli reseptörlerine
bağlandıkları zaman gösterirler.
•
Aynı hücre farklı sitokinler salgılayabilir. Farklı sitokinlerin hücre düzeyinde etkileri aynı veya benzer olabilir.
•
Bir sitokin farklı hücreleri etkileyebilir. Farklı hedef hücrelerde çok yönlü biyolojik etkileri oluşturma “Pleiotropy”
özelliğine sahiptir.
•
Bir sitokin diğer sitokinlerin ekspresyonunu uyarır veya baskılayabilir: Sitokinler sinerji etkisi gösterebilir (iki
sitokinin bir hücreye toplam etkisinin, her bir sitokinin tek başına etkilerinin toplamından daha fazla olmasıdır).
Sitokinler antagonistik etki gösterebilir (bir sitokin tarafından oluşturulan etkinin diğer bir sitokince engellenmesi
veya baskılanmasıdır).
•
Sitokinler sadece immün hücrelerde değil, tüm hücrelerde etki yapabilir.
•
Sitokinler kontrollü iletişim ağını devam ettiriler.
Sitokin Aileleri:
•
Hematopoetinler;
Eritropoetin, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, IL-13, IL-15, GM-CSF,G-CSF Koloni stimüle
edici faktörler (CSF); hematopoetik kök hücre, progenitör hücre, immatür lökositlerin büyüme ve farklılaşmasında
rol oynarlar. Granülosit koloni stimüle eden sitokin (G-CSF) nötrofilleri, monosit koloni stimüle eden sitokin
(M-CSF) monositleri uyarır. Granülosit ve monosit koloni stimüle eden sitokin (GM-CSF) her iki hücre serisini
de uyarır.
•
Tümör nekrozis faktör (TNF) ailesi ; TNF-α ve β, CD40L, CD30L, CD27L, FasL
•
IL-1 ailesi ; IL-1 -α ve β, IL-1Ra,IL-18
•
Interferon (IFN) ailesi; IFN α, β, γ
•
IL-10 ailesi; IL-10, IL-19, IL-20, IL-22,IL-24,IL-26, IL-28,IL-29
•
IL-12 ailesi; IL-12, IL-23, IL-27
•
Diğerleri; TGF- β (transforming growth factor- ), IL-16, IL-17, IL-25
118|
Sitokin reseptörleri ve sinyal iletimi: Sitokinler etkilerini hedef hücredeki spesifik reseptörlere bağlanarak
gösterirler. Sitokin reseptörlerinin hücre yüzeyinde ekspresyonu, bu reseptöre bağlanacak sitokin tarafından
veya başka bir sitokin tarafından regüle edilir. Sitokinler hedef hücre yüzeyindeki reseptörüne bağlandıktan
sonra hücre içine sinyal iletimi ile nukleusda spesifik hedef genlerin transkripsiyonu, yeni mRNA ve protein
sentezi başlar. Sentezlenen sitokin ile hücrenin aktivasyonu, farklılaşması, büyüme ve çoğalması ve diğer
effektör görevler sağlanır. Sitokinlerin yapılıp salgılanmaları birkaç saat veya gün içinde sonlanır.
Sitokin Tipleri
Proinflamatuar sitokinler: TNF-α, IL-1β, IL-2, IL-6, IL-12, IFN-α, IFN-γ’dır. TNF-α, IL-1β, IL-6 başlıca makrofajlar
ve monositlerden üretilir. C-reaktif protein, serum amyloid A, fibrinojen, kompleman, alpha 1-antitrypsin gibi
akut faz proteinlerin sentezini arttırır. Proinflamatuar sitokinler, mikro-organizmalar, mikrobiyal ürünler, antijenler,
inflamatuar ajanlar, bitkisel lektinler, lenfokinler ve bazı kimyasallar tarafından indüklenir.
Anti-inflamatuar sitokinler: Başlıcaları IL-1ra, IL-4, IL-6, IL-10, IL-11, IL-13, TGF-β ve bazı solubl sitokin
reseptörleridir (solubl TNF reseptörü, solubl IL-1 reseptör tip II). Anti-inflamatuar etkisi olan solubl sitokin
reseptörlerinden başlıcaları olan solubl TNF reseptörü, TNF’nin etkisini ve solubl IL-1 reseptörü tip II ise
IL-1β’nın etkisini engeller. IL-1 reseptör antagonisti (IL-1ra), IL-1’in doğal inhibitörü olup IL-1 reseptörüne
bağlanmak için IL-1 ile yarışır.
Th1 Hücreler ve Sitokinler
Th1 hücreler pro-inflamatuardır ve hücre içi yaşamı seçen mikroorganizmalara (virus, bakteri fungus ve bazı
parazitler gibi) yanıt verir. Th1 inhibisyonu olduğunda infeksiyona yanıt ve kanser hücrelerinin yok edilmesi
yetersiz duruma gelir. Th1 kaynaklı sitokinler: TNF, IL-1β, IL-2, IL-6, IL-12, IFN-α, IFN-γ, TGF-β. Kronik Th1
uyarısı otoimmün hastalıklara ve kronik inflamasyona yol açar. Otoimmün hastalıkların çoğunun patogenezinde
artmış Th1 tipi sitokin yanıtı rol oynamaktadır.
Th1 dominant hastalıklar: Haşimato tiroiditi, Tip 1 diabetes mellitus, multiple skleroz, Crohn hastalığı, sarkoidoz.
Th2 hücreler ve antiinflamatuar sitokinler: Th2 hücreler anti-inflamatuardır, helmintik parazitlere ve
allerjenlere yanıt verirler. Th2 hücrelerin kronik uyarılması kronik allerjik yanıta neden olur, infeksiyona ve kanser
hücrelerine yanıtı yetersiz olur. Th2 kaynaklı anti-inflamatuar veya süpresan sitokinler: IL-4, IL-5, IL-10 ve
IL-13. Th2 dominant patolojiler: Allerji / atopi, inflamasyondur (Şekil 5).
İmmün reaksiyonda ve inflamasyonda sitokinler: İmmün yanıtın aktivasyon veya süpresyon basamaklarının
spesifik kontrolü immün hücreler aracılığı ile proinflamatuar ve anti-inflamatuar sitokinlerin salınımı yoluyla
gerçekleşir. Th1 (pro-inflamatuar) ve Th2 (anti-inflamatuar) hücrelerin oranı ve onların sitokinleri ortaya çıkan
immün yanıt açısından önemlidir. Birbirlerinin fonksiyonlarını karşılıklı olarak regüle ederler. Th2 hücrelerce
yapılan IL-4 ve IL-10, Th1 hücrelerini inhibe ederken, Th1 hücrelerce üretilen IFN-β, Th2 hücrelerini inhibe
eder.
IL-4 ve IL-10 gibi bazı sitokinlerin hem Th1, hemde Th2 hücrelerce salgılandıkları da bilinmektedir. İmmün
yanıtın kontrolünde önemli görev aldıkları düşünülmektedir.
Akut inflamasyona katılan sitokinler: TNF-α, IL-1, IL-6, IL-8, IL-11 ve diğer kemokinler, G-CSF ve
GM-CSF.
Kronik inflamasyona katılan sitokinler: İki gruba ayrılır; Sitokin aracılı humoral yanıtlarda IL-4, IL-5, IL-6,
IL-7 ve IL-13 rol alır. Sitokin aracılı hücresel yanıtlarda IL-1, IL-2, IL-3, IL-4, IL-7, IL-9, IL-10, IL-12, IFN,
TGF-β, TNF-α rol oynar.
Sitokin ve anti-sitokin tedavilerin klinikte romatolojik hastalıklarda kullanımı ve etkinlikleri ilgili bilgiler hastalık
tedavi bölümlerinde anlatılmıştır.
|119
IX. Kemokinler
Lökositler için kemotaktik özelliği olan sitokin ailesidir. Hücre kemotaksisinde rolleri nedeniyle bu ismi almalarına
karşın immün yanıtın birçok safhasında etkilidirler. İnflamasyon bölgesine lökositlerin göç etmesinde önemli rol
oynarlar; integrinleri aktive ederek dolaşımdaki lökositlerin vasküler endotelyuma adezyonlarını sağlarlar, lökositleri
endotel bağlantı bölgelerine yönelterek inflamayon bölgesine ulaşmalarına yardım ederler. Genellikle hücre içinde
hazır olarak bulunmaz. LPS, IL-1,TNF, mitojenler gibi etkenlerle indüklendiklerinden başlıca monosit-makrofaj
ve endotel hücrelerince üretilirler.
Kemokinlerin fonksiyonlarına göre sınıflandırma:
•
İnflamatuar kemokinler: indüklenebilir olanlar
•
İmmün kemokinler: immün sistemin gelişmesi, devamlılığı ve fonksiyonu için gereklidirler. Homeostazda,
lenfoid fonksiyonlarda görev alırlar.
Kemokinlerin Fonksiyonları
•
Lökositlerin inflamasyon bölgesinde birikimi
•
Lökositlerin aktivasyonu
•
Monosit-makrofaj birikimi
•
T lenfosit birikimi
•
Mast hücrelerinin gelişimi ve mast hücre birikimi
•
Akut fazda mast hücresi degranülasyonunun uyarılması
•
Akut inflamasyonda mast hücrelerinde kemokin reseptörlerinin ekspresyonu
Çeşitli biyolojik olaylarda düzenleyici olarak görev alan 50’nin üzerinde kemokin üyesi ve 20’nin üzerinde reseptörü
tanımlanmıştır. Küçük moleküllü (8-14 dalton) olup, yapısal olarak birbirine benzerler. Kemokin molekülünün
N-terminalindeki sistein aminoasidinin pozisyonuna göre CXC, CC, C, CX3C olarak isimlendirilirler.
Kemokin Alt Tipleri:
C-X-C Kemokin Ailesi (iki amino ucunda sistein arasında başka bir amino asit yer alıyor)
•
IL-8
•
GRO (growth-regulated oncogenes)-α, GRO-β ve GRO-γ
•
GCP-2 (granulocyte chemotactic protein-2)
•
NAP-2 (neutrophil activating protein-2)
•
ENA-78 (epithelial cell derived,neutrophil attractant-78)
•
IP-10 (IFN-inducible protein-10)
•
CTAP III (connective tissue activating peptide III)
•
PF4 (platelet factor 4)
•
Mig (monokine induced by IFN-γ)
•
SDF1 ( stromal cell-derived factor-1)
•
Lix ( Lipopolysaccharide-induced CXC kemokine)
Bu grup kemokinler nötrofil kemotaksisi ve aktivasyonunda, akut ve kronik inflamatuar hastalıklarda önemli
görev yaparlar. B ve T lenfositler için de kemoatraktandırlar. IL-8, C-X-C ailesinin en önemli bir üyesidir Nötrofillerin
infeksiyon-inflamasyon alanına yönelmelerini sağlayan başlıca kemokindir. Nötrofiller için kemotaksi yapar, nötrofil
adezyonunu, mikrobisidal etkisini ve degranülasyonunu arttırır.
120|
CC Kemokin Ailesi (iki sistein yanyana bulunuyor)
•
MCP 1-5 (monocyte chemoattractant protein)
•
RANTES (regulated upon activation, normal T cell expressed and secreted)
•
MIP-1 (macrophage inflammatory protein)-α, -β ve -γ
•
Eotaxin -1, -2, -3
•
HCC-1 (hemofiltrate CC chemokine), HCC-2
•
LARC (liver and activation regulated chemokine)
•
TARC (thymus and activation regulated chemokine)
•
MDC (macrophage-derived chemokine)
Bu grup kemokinler monositlerin kemotaksisini ve aktivasyonunu sağlarlar. Monositler, eozinofiller, T hücresi,
NK hücresi arasındaki etkileşime aracılık ederler.Allerjik hastalıklarda da önemli rolleri vardır.
C Kemokin Ailesi
•
Lymphotactin: lenfositlerin kemotaksisinde rol oynar
CX3C Kemokin Ailesi
•
Fraktalkine/Neurotactin: CC kemokin ailesine benzer etkileri bulunur.
IL-10, IL-4 gibi antiinflamatuar sitokinler ve solubl yüzey reseptörleri kemokin yapımını azaltırlar.
Kemokin reseptörleri 7 domainli transmembran proteinleridir. C-X-C grubu kemokinler için reseptörler;
CXCR1-4, CC grubu için reseptörler; CCR1-5, C-X-3C için CX3CR1 gibi 15 kadar reseptör bulunmaktadır.
Hem Th1 ve hemde mononükleer hücreler CCR5 reseptörü eksprese ederler ve kemokinlerden MIP-1 α ve
MIP-1β’nın kemoatraktan etkisine yanıt verirler, buna karşın Th2, eozinofiller ve bazofller CCR3 eksprese ederler
ve eotaxine yanıt verirler. Kemokinlerin proinflamatuar ve antiinflamatuar T hücre alt tipleri için selektif etkileri
olduğu anlaşılmaktadır. Th1 ve Th2 hücreler CCR1 ve CCR2 eksprese ederek, makrofaj kemotaktik proteinlerin
(MCP) etki etmesini sağlarlar. Nötrofiller CXCR1 ve CXCR2 exprese ederek IL-8 ve GRO’nın kemoatraktan
etkisine yanıt verirler.
X. Hücre Adezyon Molekülleri
Hücrelerin diğer hücrelerle ve ekstrasellüler matriks ile temas ve etkileşimlerini sağlayan bazı moleküllere hücre
adezyon molekülleri adı verilir. Lökositler ve damar endoteli üzerinde bulunan bu moleküller dolaşımda ve bazı
vücut sıvılarında serbest olarak bulunabilir ve bunlar da solubl adezyon molekülleridir.
Adezyon molekülleri; embriyonal gelişim, lenfosit gelişimi,farklılaşması, proliferasyonu, normal doku yapısının
devam ettirilmesi, rejenerasyon ( yara iyileşmesi), lökosit göçü, inflamasyon ve metastaz gelişimi gibi olaylarda
rol oynarlar.
Hücre adezyon molekülleri bazı özelliklerine göre gruplandırılmaktadır. Başlıcaları; immünglobulin süper ailesi,
integrinler, selektinler, musin benzeri adezyon molekülleri olan kadherinlerdir.
İmmünglobulin Süper Ailesi
Bu ailedeki moleküllerin çoğu plazma membran proteinidir. Hücre dışı, transmembran ve sitoplazmik parçaları
vardır. İmmünglobulinler, T hücre reseptörü, CD4, CD8, sınıf I ve sınıf II MHC molekülleri bu ailenin üyeleridir.
Diğerleri; Intercellular adhesion molecule-1 (ICAM-1), ICAM-2 , ICAM-3, Vascular cell adhesion molecule-1
(VCAM-1), neural cell adhesion molecule (NCAM), platelet derived growth factor (PDGFR) ve mukozal adresin
MadCAM-1’dir.
|121
Antijen sunan hücre ile Th arasında, hedef hücre ile Tc hücre arasındaki temasta ICAM-1 ile LFA-1 arasındaki
adezyon önemlidir. İnflamatuar sitokinlerin etkisiyle endotel hücre üstünde ICAM-1 ekspresyonu artar ve 24 saat
içinde en yüksek düzeye ulaşır.
VCAM-1’de lökosit-endotel etkileşiminde önemli rolü olan bir moleküldür. VCAM-1 normalde gösterilmez, ancak
IL-1, TNF -alfa ve endotoksin ile aktive olmuş endotel üzerinde eksprese olur. Doğal ligandı lenfositler, mononükleer
hücreler ve eozinofiller üzerinde bulunan integrin ailesinden olan VLA-4 (very late activation antigen-4)’dür.
İntegrinler
Hücre-hücre ve hücre-ekstrasellüler matriks etkileşmesinde rol oynarlar. Transmembran heterodimerik reseptörlerdir.
Çok sayıda farklı hücre üzerinde bulunurlar. Yaklaşık 20 çeşit integrin bilinmektedir. Adezyon reseptörleri sinyal
molekülleri olarak da fonksiyon yaparlar. Fokal adezyon için integrin bağlayan ligandlar bazı hücre içi iskelet
sistem komponentlerinin ve sinyal moleküllerinin tirozin fosforilasyonunu indükler.
İntegrinler; LFA-1 (CD11a CD 11 b CD11c CD18), LFA-2,LFA-3, Very Late Antijen ( VLA4, alfa4). LFA-1,
lenfositlerde (T lenfosit ), monosit, makrofaj ve granülositlerde ve de diğer hücrelerde eksprese olur. İmmünglobulin
süper ailesinden olan ICAM-1 ve ICAM-2, LFA-1’in ligandıdır.
Selektinler
Selektinler lökositler,trombositler ve endotel üstünde bulunur. Başlangıçta nötrofil ve lenfositler için düşük affiniteli
adezyona aracılık ederler.Selektin ailesinin orjinal olarak keşfedildiği hücrelere göre isimlendirilen üç üyesi vardır:
L-selectin (CD62L) lökositlerde eksprese olur hedef hücreleri aktive olmuş endotel hücrelerdir. E-selectin (CD62E)
sitokin aktivasyonundan sonra endotel hücrelerince üretilir. Nötrofil, monosit ,eozinofil lenfosit ve bazı tumor
hücrelerinde reseptörleri bulunur. P-selectin (CD62P) sitokin aktivasyonundan sonra endotel hücrelerinde
eksprese olur. Trombositlerde yapılır ve granüllerinden salınır.
Kadherinler
Kadherinler, adezyon moleküllerinin büyük bir parçasıdır. Genel olarak homotipik hücre-hücre adezyonununa
aracılık ederler. Hücre-hücre birleşmesinde yapışma sağlar.
Klasik kadherinler: N-cadherin, P-cadherin, E-cadherin, R-cadherin, B-cadherin, L-CAM, U-cadherin,
EP-cadherin, X-B cadherin’dir.
Kaynaklar
1.
Abbas AK,Lichtman AH. Basic immunology: functions and disorders of the immune system. 2nd ed. Phiadelphia, PA: W.B Saunders
Co, Updated edition 2006-2007.
2.
Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity Cell 2006; 124: 783-801.
3.
Takeda K, Akira S, Toll-like receptors in innate immunity. Int Immunol 2005;17: 1-14.
4.
Kabalitz D, Medzhitov R. Innate immunity-cross-talk with adaptive immunity through pattern recognition receptors and cytokins. Curr
Opin Immunol 2007; 19:1-3.
5.
Jensen PE. Recent advances in antigen processing and presentation. Nat Immunol 2007; 8(10):1041-8.
6.
Jr Janeway CA, Travers P, Walport M,Shlomchik MJ (eds).Antigen recognition by B-cell and T-cell receptors. Immunobiology. 6th edition.
NewYork USA: Garland Science;2005, pp:103-134.
7.
Roitt I, Brostoff J (eds), Antibodies. In Immunology 6th edition, Spain Mosby , 2001,pp 65-85.
8.
Mossmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu
Rev Immunol 1985;7: 145-73.
9.
Sakaguchi S.Regulatory T cells Springer Semin immunopathol 2006; 28:1-2.
10. Sakaguchi S, Sakaguchi N, Shimizu J , Yamazaki S, Sakihama T, Itoh M, Kuniyasu Y, Nomura T, Toda M, Takahashi T. Immunolojic
tolerance maintained by CD25+CD4+ regulatory T cells: their common role in controlling autoimmunity , tumor immunity and transplantation
tolerance. Immunological Review 2001;182: 18-32.
122|
11. Abbas AK,Lichtman AH, Pober JS, eds. B cell activation and antibody production.In Cellular and Molecular Immunology.4th ed. Philadelphia,
W.B Saunders Company, 2000.pp192-207.
12. Pamer E, Cresswell P. Mechanisms of MHC class I-restricted antigen processing. Annu Rev Immunol 1998;16:323-58.
13. Parham P. Virtual reality in the MHC. Immunol Rev 1999;167, 5-15.
14. Pieters J. MHC class II restricted antigen presentation. Curr Op Immunol 1997;9:89-96.
15. Mosmann T. Cytokines and immune regulation. Rich RR, (ed.): Clinical Immunology, Principles and Practice. Mosby, Missouri, 1996,
pp.217-230.
16. Opal SM, DePalo VA. Anti-Inflammatory Cytokines. Chest 2000; 117:1162-1172.
17. Male D Cell migration and inflammation. Roitt I, Brostoff J, Male D (eds) . In Immunology 6th ed. Mosby , 2001, pp 47-49.