Slayt 1 - WordPress.com
advertisement

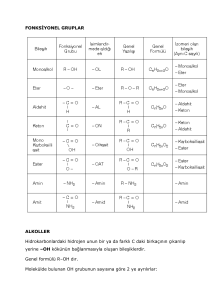
BİLEŞİKLER VE FORMÜLLERİ BİLEŞİKLER Birden fazla atomun belirli oranlarda kimyasal reaksiyon sonucu bir araya gelmesiyle oluşan yeni, saf maddeye bileşik denir. Bileşiklerin en küçük yapı taşları moleküldür. Bileşiklerin özellikleri -Saf ve homojen maddelerdir. -Kimyasal yollarla bileşenlerine ayrıştırılabilir. -Erime ve kaynama noktaları, öz kütleleri sabittir -Bileşiği oluşturan elementler sabit kütle oranlarında birleşir. -Bileşikler formüllerle gösterilir. -Bileşiğin kimyasal özellikleri kendisini oluşturan elementlerin kimyasal özelliklerinden farklıdır. Katyonun adı + Anyonun adı = Bileşiğin adı Yüklü atom veya atom gruplarına iyon denir. (+) yüklü iyonlara katyon, (-) yüklü iyonlara da anyon denir. Katyonlar +1 , +2 , +3 ve +4 yüklü olabilir. Anyonlar da -1 , -2 ve -3 yüklü olabilir. Bileşik formülleri yazılırken,önce (+) yüklü iyon, sonrada (-) yüklü iyon yazılır. Bileşiklerin İsimlendirilmesi a) İyonik bağlı bileşiklerin isimlendirilmesi: Yapısında katyon ve anyon bulunduran bileşikler iyonik yapılıdır. Dört durumda incelenir. 1. Metal-Ametal = Metalin adı+Ametalin adı+ür. NaCl(sodyum klorür) 2. Metal-kök = Metal adı+kök adı NaOH(sodyum hidroksit) 3. Kök -Ametal = Kök adı+Ametalin adı +ürNH4 Amonyum iyodür. 4. Kök-kök = Katyon kök adı+Anyon kök adı NH4NO2 Amonyumnitrit b) Kovalentbağlı bileşiklerin isimlendirilmesi: Ametal atomlarının kendi aralarında oluşturdukları bağ çeşidine kovalentbağ denir. Kovalentbağlı bileşiklerin isimlendirilmesinde atomların sayısı mono,di, tri, tetra, penta gibi Latince kelimelerle ifade edilir. İlk yazılan atom bir tane ise mono yazılmaz. Sonraki atomun sayısı her halukarda söylenir. CO: Karbon mono oksit NCl3: Azot triklorür NO: Azot mono oksit BİLEŞİKLERİN SINIFLANDIRILMASI Asitler Suda çözündüğünde ortama H+iyonu verebilen bileşiklerdir. Diğer bir tarifle OH+ iyonuyla reaksiyona giren maddelerdir. HCl, HBr, HI gibi asitler kuvvetli asitlerdir. Kuvvetli asitler tam olarak iyonlaşarak çözünürler. Tam olarak iyonlaşamayan asitlere zayıf asitler denir. Genel özellikleri şunlardır; Suda iyonlaşarak çözünürler, Çözeltileri elektiriği iletir, Turnusol kağıdını kırmızıya boyarlar, Tatları ekşidir, Soy metaller dışında bütün metallerle reaksiyona girerek tuz ve H oluştururlar, Bazlarla nötürleşerek tuz ve su oluştururlar Bazlar Suda çözündüğünde OH+iyonu verebilen bileşiklerdir. 1A gurubu metali hidroksitleri LiOH, NaOH… kuvvetli bazlardır. Diğer bütün metallerin hidroksitleri suda kötü çözündükleri için zayıf bazlardır. Bazların genel özellikleri; Suda iyi çözünürler, Turnusol kağıdını maviye boyarlar, Tatları acıdır, Çözeltileri ele kayganlık verir, Sadece anfotermetallerle reaksiyon verirler, Asitlerle tuz ve su oluştururlar