12.10.2015
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
1. Bağlar
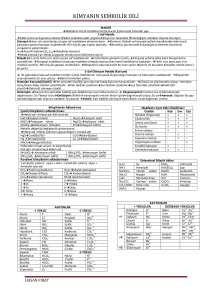
Alkali Metaller (1A Grubu)
BÖLÜM
5
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
• Periyotların ilk elementleridir.
• Elektron dizilişlerinin sonu s1 ile biter.
• Bileşiklerinde +1 değerlik alırlar. Ancak ametal özelliği fazla olan hidrojen
elementi bileşiklerinde -1 değerlik de alabilir.
• En aktif metallerdir. Yani kolaylıkla tepkimelere girerler.
• Hidroksitleri kuvvetli baz özelliği gösterir. (NaOH, KOH,....)
• İlk element hidrojen olup, bir ametaldir.
• Doğada bileşikleri halinde bulunurlar.
• Atom numarası büyüdükçe kaynama noktası azalır.
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
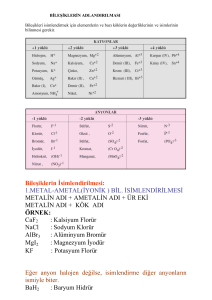
1. Bileşikler
Değişen değerlikli metallerin yaptığı bileşikler okunurken, katyonun adından sonra
değerliği parantez içine yazılır.
Birden fazla elementin belirli kütle oranlarında bir araya gelerek kendi özelliklerini
kaybedip oluşturdukları yeni saf maddeye bileşik denir.
1.1. Bileşiklerin Adlandırılması
FeO
Fe2O3
FeCl2
: Demir (II) oksit
: Demir (III) oksit
: Demir (II) klorür
Cu2O
PbO2
HgCl2
: Bakır (I) oksit
: Kurşun (IV) oksit
: Civa (II) klorür
Metal – Ametal Bileşikleri
Metal – Kök Bileşikleri
Genellikle Metal adı + Ametal adı + ÜR eki şeklinde adlandırılır. Ayrıca O, N, P, S, C gibi
ametaller kullanılmışsa adlandırma aşağıda verilen örneklerdeki gibi olmaktadır.
Yüklü atom gruplarına kök denilmektedir.. Metal-kök bileşiklerinde isimlendirme
Metal adı + Kök adı şeklinde yapılır.
Al2S3
MgBr2
Zn3N2
CaC2
ZnO
Na2O
: Alüminyum sülfür
: Magnezyum bromür
: Çinko nitrür
: Kalsiyum karbür
: Çinko oksit
: Sodyum oksit
Mg3P2
KBr
LiF
BeCl2
BaBr2
NaF
: Magnezyum Fosfür
: Potasyum bromür
: Lityum florür
: Berilyum klorür
: Baryum bromür
: Sodyum florür
NaNO3
Mg(CN)2
BaSO4
NH4NO3
: Sodyum nitrat
: Magnezyum siyanür
: Baryum sülfat
: Amonyum nitrat
Ca3(PO4)2 : Kalsiyum fosfat
FeSO4
: Demir (II) sülfat
Fe(OH)3 : Demir (III) hidroksit
(NH4)3PO4: Amonyum fosfat
İsimlendirmeleri doğru olarak yapmak için temel kök isimlerini bilmek gerekir.
1
12.10.2015
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
CO
NO2
CBr4
: Karbon monoksit
: Azot di oksit
: Karbon tetra bromür
N2O3
P2 O 5
SF6
: Di azot tri oksir
: Di fosfor penta oksit
: Kükürt hegza florür
1.2. Bileşiklerin Sınıflandırılması
Asit ve Bazlar
Sulu çözeltilerinde H+ iyonu derişimini artıran maddelere asit denir. Asitlere aşağıdaki
örnekler verilebilir.
Ametal – Ametal Bileşikleri
Bileşikteki atomların sayısı latince sayı ön ekleri ile belirtilerek isimlendirilir.
1: mono
2: di
3: tri
4: tetra
5: penta
6: hegza
7: hepta
8: okta
9 : nona
10: deka
11: undeka
12: dodeka
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
Hem asit hem de baz çözeltileri elektrik akımını iletir. Asit ile bazların reaksiyona
girmesine nötürleşme denir. Nötürleşme reaksiyonları sonucu tuz ve su oluşur.
Ancak suyun oluşmadığı durumlar vardır.
HCl, HNO3, HBr, H2SO4, CH3COOH,...
Sulu çözeltilerinde OH- iyonu derişimini artıran maddelere baz denir.
NaOH, Ca(OH)2, NH3, Al(OH)3,...
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
Oksitler
Flor haricindeki elementlerin oksijen ile yapmış oldukları bileşiklere oksit adı
verilir.
Asidik oksit: Ametallerin oksijence zengin olan oksitlerine asidik oksit denir.
Asidik oksitler su ile birleşince asitleri, baz ile birleşince tuzları oluştururlar.
Tuzlar
CO2, N2O5, SO2, SO3,...
Baz katyonu ile asit anyonundan oluşan bileşiklere tuz adı verilir. Tuzlar katı halde
elektriği iletmezler. Ancak çözelti halinde veya erimiş halde elektriği iletirler.
Bazik oksit: Metallerin oksijenle yapmış olduğu bileşikler genellikle bazik oksittir.
Bazik oksitler su ile birleşince bazları asit ile birleşince tuzları oluştururlar.
Na2O, BaO, CaO,...
2
12.10.2015
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
Nötr oksit: Ametallerin oksijence fakir ya da eşit oksitleridir. Asitlerle ve bazlarla
reaksiyon vermezler. Suda çözünmezler.
BAĞLAR, BİLEŞİK TÜRLERİ VE BİLEŞİKLERİN ADLANDIRILMASI
Örneğin, H2O2 (hidrojen peroksit), Na2O2 (sodyum peroksit), BaO2 (baryum
peroksit) gibi. Peroksitler ısıtılınca kolayca oksijen gazı verirler.
CO, N2O, NO,…
Amfoter oksitler: Asitlere karşı baz, bazlara karşı asit özelliği gösteren, başka bir
ifadeyle hem asitle hem bazla ayrı ayrı reaksiyon verebilen maddelere amfoter
maddeler denir. Zn, Al, Pb, Sn ve Cr elementleri amfoter özelliğe sahip
elementlerdir. İşte bu amfoter elementlerin oksijen ile yaptığı bileşiklere amfoter
oksitler denir. Amfoter oksitler suda çözünmezler.
Bileşik oksitler: Farklı değerlik alabilen metal elementlerin oksitlerinin
birleşmesiyle oluşan oksitlerdir.
Al2O3, ZnO, Al(OH)3, Zn(OH)2,…
Peroksit: İki tane oksijenin toplam –2 değerlikli olduğu bileşiklerdir. Burada
oksijenlerden bir tanesi yüksüz, diğeri ise –2 değerliklidir.
3