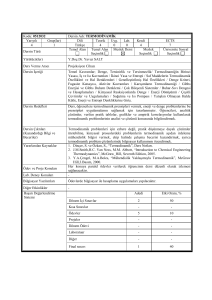
İmal Usulleri
DÖKÜM
IsıSıcaklık
Isı: Isı bir maddenin moleküllerinin hareket enerjileri ile
moleküller arasındaki bağlanma enerjilerinin toplamıdır.
Isı birimi → kalori veya joule.
1Kalori=1 gram suyun sıcaklığını +4 0C den +5 0C ye çıkarmak
için gerekli enerjidir.
1cal = 4,18 joule
Sıcaklık: Bir maddenin ortalama hızda
bulunan bir molekülünün kinetik enerjisi ile
doğru orantılı olan büyüklüğe sıcaklık denir.
Buna göre;
Isı bir enerji çeşididir. Sıcaklık ise bir
ölçümdür.
Isı kalorimetre ile ölçülür. Sıcaklık ise
termometre ile ölçülür.
Isı birimi kalori veya joule’dür. Sıcaklık ise
derecedir.
Isı alışverişi denklemi
• Q: verilen veya alınan ısı enerjisi
miktarı
Q=m.c.Δt
• m: kütle
• c: özısı
• Δt: sıcaklık farkı
Örnek : Dış yüzeyi ısıya karşı yalıtılmış ve gücü 2 kW
olan elektrikli bir su ısıtıcısın hacmi 40 litredir.
Başlangıçta 20ºC olan suyun sıcaklığını 60ºC’ye
çıkarmak için geçen zamanı dakika olarak hesaplayın.
(δsu1000 kg/m3 , Csu=4175 J/kgK)
Cevap≈56 dakika
Maddenin katı, sıvı, gaz ve plazma olmak üzere
dört hali vardır.
MADDENİN HALLERİ
KATI
SIVI
GAZ
PLAZMA
Termodinamik Kavramları
Termodinamik, en yalın ifade şekliyle, enerji ve
enerji dönüşümleri üzerine inşa edilmiş bir
disiplin. Enerji üzerine kurulu bir konuya giriş
yaptığımıza göre, öncelikle uzun uzun enerjinin ne
olduğundan
bahsedeceğimizi
düşünüyor
olabilirsiniz. İşin aslı biraz farklı. Termodinamiğin
ilgi alanı enerjinin ne olduğu değil. Enerjiyle ne
yapıldığı. Hatta biraz daha ileri giderek, enerjinin
ne olduğu termodinamiğin pek umrunda değil bile
diyebiliriz.
Termodinamik, enerjinin ne olduğunu anlamak için
pek çaba göstermeden, enerjinin nasıl işlediğini
tarif etmeye çalışır. Bu yaklaşımı yerçekimi
kanununa benzeterek anlamaya çalışabiliriz.
Yerçekimi kanunu bize havaya atılan bir elmanın
yere düşeceğini söyler. Bu kadar. Nedenini
söylemez.
Termodinamik de, yerçekimi kanununa benzeyen
kanunlar koyarak, enerjinin nasıl işlediğini tarif
eder. Enerjinin nasıl kendi tarif ettiği yollar
üzerinden işlediğiyle ise ilgilenmez.
0. Kanun
Eğer A ve B sistemleri
birbirleri ile ısıl
dengede iseler, A
sistemi ile ısıl dengede
olan bir C sistemi B
sistemi ile de ısıl
denge durumundadır.
1. Kanun
Bu yasa "enerjinin
korunumu" olarak da
bilinir. Enerji yoktan
var edilemez ve
varolan bir enerji yok
edilemez. Sadece bir
şekilden diğerine
dönüşür.
2. Kanun
İkinci kanun da, eğer bir
miktar enerjiyi başka bir forma
dönüştürmek istiyorsanız, bunu
yüzde yüz verimle yapamazsınız
der. Toplam enerji korunsa da,
bir miktarının mutlaka
istediğimizden farklı formlara
dönüşeceğini söyler.
3. Kanun
Sıcaklık mutlak sıfıra
yaklaştıkça bütün hareketler
sıfıra yaklaşır.
Termodinamik Durum
Bir termodinamik sistemin durumu, sıcaklık, hacim ya
da basınç gibi, deneysel yöntemlerle ölçülebilen bir
takım
termodinamik
değişkenler
aracılığıyla
tanımlanıyor. Örnek olarak, bir kap içerisinde duran
bir miktar ideal gazı ele alalım. Kap içindeki gazın
sahip olduğu basınç, hacim ve sıcaklık değerlerinin
birleşimi, bu sistemin termodinamik durumunu
belirtiyor.
Örnek olarak, bir kap içerisinde duran bir miktar
ideal gazı ele alalım. Kap içindeki gazın sahip
olduğu basınç, hacim ve sıcaklık değerlerinin
birleşimi, bu sistemin termodinamik durumunu
belirtiyor. Örneğin kabın hacimi 1 litre, içindeki
gazın basıncı 1 atm, gazın sıcaklığı da 25°C ise, bu
değerlerin birleşimini sistemin bir termodinamik
durumu olarak kabul ediyoruz.
Makro Durum
Bir termodinamik sistemin durumunu iki ayrı
ölçekte ele alabiliyoruz. Bir sistemin makro
durumu denildiğinde, sistemin basıncı, hacmi
ya da sıcaklığı gibi, deneysel yöntemlerle
ölçebildiğimiz değişkenlere bağlı bir tariften
bahsetmiş oluyoruz.
Mikro Durum
Sistemin mikro durumunda, gaz atomlarının bir an
içindeki konumları tanımlanıyor. Bu ifadeden tahmin
edebileceğiniz gibi, sistemin mikro durumu sürekli
olarak değişim gösteriyor.
Makro ve Mikro Durumun Özeti
Bu iki durum tarifini yanyana koyduğumuzda ortaya şöyle
bir resim çıkıyor: bir sistemin makro durumu (yani basıncı,
hacmi ve sıcaklığı) sabit kalsa bile, sistemin mikro durumu
(yani gaz atomlarının konumları ve momentumları) sürekli
olarak değişiklik gösteriyor.
Termodinamik denge, sistemin makro durumu üzerinden
tanımlanıyor..
Enerjinin Korunumu (1. kanun)
Enerji, bir sistemin iş ya da ısı
üretebilme kapasitesi olarak tanımlanır
U: Sistemin sahip olduğu bütün enerji, yani sistemin iç
enerjisi
Q: Sisteme verilen ısıyı
W: Sistemin yaptığı işi
İkinci kanunun kökeni
Birinci kanun enerji kavramı çevresinde şekillendiği
için, bu kanunun iskeletini oluşturan durum
fonksiyonunun iç enerji (U) olduğunu
söyleyebiliriz. İkinci kanun ise enerji kaybıyla ilgili.
Dolayısıyla, enerji kaybıyla ilişkilendirebileceğimiz
farklı bir değişken, farklı bir durum fonksiyonu
bulmamız gerekiyor.
Entropi
Çoğu kaynakta entropiden “düzensizliğin ölçüsü”
olarak bahsedildiğini muhtemelen görmüşsünüzdür.
Örneğin, zaman zaman dağınık bir odadan “entropisi artmış” şeklinde
bahsedildiğini belki duymuşsunuzdur. Bir odanın içindeki eşyaların
düzenli bir şekilde değil de, bizim gözümüze düzensiz görünen bir
şekilde konumlanmış olmaları, odanın entropisinin arttığı anlamına
gelmiyor; aksine bu durumdaki doğru bakış açısı entropinin değişmediği
yönünde olmalı.
Dağınık oda örneğine geri dönelim ve odayı sistem, odadaki eşyaları da
sistemin yapı taşları olarak düşünelim. Bu tarif çerçevesinde odanın
makro durumunu odanın hacmiyle, odanın mikro durumunu ise odadaki
eşyaların konumlarıyla ilişkilendirebiliriz. Entropi bir durum
fonksiyonudur, dolayısıyla da sadece sistemin makro durumundan
etkilenir. Bu açıdan değerlendirdiğimizde, bir sistemin mikro
durumundaki değişimin, yani odadaki eşyaların konumlarındaki
değişimin, sistemin entropisiyle bir ilgisi olmadığını, sadece sistemin bir
mikro durumdan diğerine geçtiğini ifade ettiğini görebiliriz. Entropinin
artması için odadaki eşyaları daha fazla sayıda düzenleyebileceğimiz
şekilde bir değişim oluşturmamız gerekiyor: odanın hacmini arttırmak,
ya da odaya daha fazla sayıda eşya koymak gibi.
Entalpi sisteme eklenen ısıyla ilgili
bir durum fonksiyonu
Entalpi, temel olarak bir sistemin toplam enerjisini
temsil ediyor. Sistemin toplam enerjisi ifadesiyle,
sisteme evrende yer açmak için harcamamız
gereken enerjiye ek olarak, sistemi oluşturmak için
harcamamız
gereken
enerjinin
toplamını
kastediyoruz
Gibbs Serbest Enerjisi
Bir termodinamik sistem durum
değiştirdiğinde, sistemde, çevrede ya da
evrende meydana gelen değişimleri
açıklamak için durum fonksiyonlarını
(P, V, T, U, S, H gibi) kullanmayı tercih
ediyoruz.
Örneğin sistemin iç enerjisini (U) ele alalım. İç
enerji, bir durum fonksiyonu olması nedeniyle,
belli bir basınç, hacim ve sıcaklık değerine
gelindiğinde daima aynı değere ulaşıyor. Bu
termodinamik duruma hangi yollardan gelirsek
gelelim, sistem denge koşullarına ulaştığında
sistemin iç enerjisi daima aynı değeri alıyor.
Benzer şekilde, sistemin iş üretmesini
sağlayacak bir çevrim yaptığımızda,
sisteme eklediğimiz ısıyı entalpi (H) adını
verdiğimiz bir durum değişkeni ile; her
çevrimde kaybolan enerjiyi ise entropi (S)
adını verdiğimiz bir başka durum değişkeni
ile ilişkilendirdiğimizi daha önce
görmüştük.
Peki ya sistemin yaptığı iş?
Gibbs serbest enerjisi, bir sistemin sabit
basınç ve sıcaklık altında üretebildiği
kullanılabilir iş miktarını temsil ediyor.
Standard koşullarda bir tepkimenin kendiliğinden
gerçekleşebilmesinin tahmini
ΔG
ΔG < 0
ΔG = 0
ΔG > 0
Kendiliğinden
gerçekleşmesi
Reaksiyon kendiliğinden
gerçekleşir (standard
koşullarda)
Reaksiyon dengededir
(standard koşullarda)
Reaksiyon kendiliğinden
gerçekleşmez (standard
koşullarda)
Katılaşma
Döküm yoluyla üretimde metal malzemelerin kullanım
özellikleri, katılaşma aşamasında oluşan iç yap ile belirlenir.
Dolaysıyla malzeme özelliklerinin kontrol edilebilmesi için
katılaşma olayının iyi bilinmesi gerekir. Katılaşma olayı
ergimiş sıvı malzemenin katı hale geçişi olarak tanımlanır.
Sıvı/katı geçişi birincil kristalleşme (katılaşma) ve bu sırada
oluşan katılaşma iç yapısı (döküm iç yapısı) birincil içyapı
olarak adlandırılır. Isıl ve termomekanik işlemler sonrasında
ortaya çıkan yapı ikincil yapı olarak adlandırılır.
Gaz
Gaz
Yoğuşma
Gizli Buharlaşma Isısı
Potansiyel Enerji
Sıvı
Sıvı
Kristalleşme
Gizli Ergime Isısı
Katı
Katı
Sıcaklık
Atomlar Arası Mesafe
Katılaşma olayı:
Sıvı halde saf bir metal veya alaşım soğutulmaya bırakılsın.
Serbest enerji =G ise,
sıvının serbest enerjisi=G1 ve katının serbest enerjisi=G2
olsun
Kristal
Serbest
Enerji (G)
ΔG
Sıvı
Aşırı
Soğuma
Sıcaklık T>T0 için
G2> G1sıvı faz hakim
T=T0 sıcaklığında ilk katılaşma
ΔG= sıvı ve katı faz arasındaki serbest
enerji farkı
ΔG=G2-G1< 0 ise katılaşma kendiliğinden
oluşur.
ΔG=G2-G1> 0 ise katı faz oluşmaz.
ΔG=0 ise katılaşma sonsuz zamanda
tamamlanır.
T0-T1 aşırı soğumayı göstermektedir.
T1
T0
Sıcaklık
Katılaşma iki safhadan oluşur:
1. Çekirdeklenme
2. Çekirdeklerin büyümesi ve tanelerin oluşumu
Çekirdekler; çok küçük katı parçacıklar olup, karalılıkları, yani
tekrar erimeden büyümeye devam etmeleri, ancak yeterli bir
büyüklüğe sahip olmalarına bağlıdır. Bu durum serbest enerji
yardımıyla açıklanabilir. Herhangi bir olayın kendiliğinden
devam edebilmesi için, bu olayla ilgili serbest enerjinin
azalması gerekir.
Faz dönüşümünün sebebi, sistemin serbest enerjisini azaltma
eğiliminden kaynaklanmaktadır.
Katılaşmada Serbest enerji iki bileşenden meydana gelir:
1. Hacimsel Serbest Enerji Değişimi (Fv)
Sistemin serbest enerjisini azaltan terimdir. Yani dönüşümün
gerçekleşmesine katkıda bulunur.
2. Arayüzey enerjisi ()
Sistemin serbest enerjisini artıran terimdir.
=Katı çekirdeğin
oluşumunda birim hacim
için dışarıya verilen, yani
sistemden salınan
enerjidir, o halde değeri
negatiftir.
=Katı-sıvı birim
arayüzeyinin oluşturulması
için harcanması gereken
enerjidir, o halde değeri
pozitiftir.
Homojen Çekirdeklenme
Oluşan çekirdekler tekrar erimeden, kristallerin tekrar büyüyebilmesi
için en az rkr yarıçapına sahip olması, veya diğer bir deyişle söz
konusu yarıçapa ulaşabilmesi için gerekli aktivasyon enerjisinin
dışardan sağlanmış olması zorunludur.
İçinde çekirdek görevi yapabilecek parçacıklar (nitrür, oksit, v.b katı
bileşikler) bulunmayan ideal ve homojen bir eriyikte kararlı
çekirdeklenmeye ilişkin aktivasyon enerjisi, eriyiğin kendi enerji
içeriğinden karşılanmalıdır. Bu durum homojen çekirdek (öz
çekirdeklenme)oluşumunu ifade etmektedir ve bunun için bir ısıl
aşırı soğuma gereklidir. Yani eriyik katılaşmaya Te erime sıcaklığında
değil, daha düşük bir
T=Te-ΔT sıcaklığında başlar.
Burada; ΔHf metalin gizli ergime ısısı, Tm ise denge katılaşma sıcaklığı ve
sıvının sıcaklığı T olduğunda ΔT=Tm-T ise alt soğumadır.
Bir yaklaşım olarak, homojen çekirdeklenme T= 0.2 Tm (K)
olduğunda meydana gelir.
Örnek