HAYEF FEN VE TEKNOLOJİ
30.05.2016
DERS PLANI
BÖLÜM I:
Dersin adı
Sınıf ve mevcudu
Ünitenin Adı/No
Konu
Önerilen Süre
8/A - 20 öğrenci
ÜNİTE I: Maddedeki Değişim ve Enerji
Atomun Yapısı
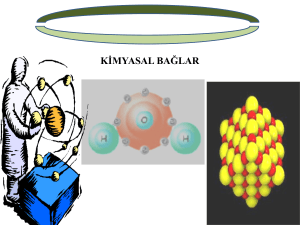
Kimyasal Bağlar: İyonik Bağ Ve Kovalent Bağ
40+40 dk.
BÖLÜM II:
Öğrenci Kazanımları/
Hedef ve Davranışlar
Ünite Kavramları ve Sembolleri/
Davranış Örüntüsü
Güvenlik Önlemleri (Varsa)
Öğretme-Öğrenme-Yöntem ve
Teknikleri
Kullanılan Eğitim TeknolojileriAraç, Gereçler ve Kaynakça
*Öğretmen
*Öğrenci
Öğretme-Öğrenme Etkinlikleri:
Dikkati Çekme
Hedeften Haberdar Etme
Kalıcı Sağlama ve Transferi
Güçlendirme
Öğrenme Rehberi Sağlama
Uyarıcıları Sağlama
Performansı Ortaya Çıkarma
Amaç: Maddenin değişimi ve bu değişimin önemini çeşitli etkinliklerle kavramaları
Kazanımlar 1: Atomların, elektronlarını birbirleriyle paylaşarak veya elektronlarını
birbirlerine aktararak oluşturduğu basit bileşiklere örnekler vererek bu bileşiklerdeki
kimyasal bağların yapısını ana hatlarıyla açıklar
Enerji düzeyi, kovalent bağ, polar kovalent bağ, apolar kovalent bağ
Anlatım ve sunu, beyin fırtınası, soru - cevap
PC, projeksiyon cihazı, ses sistemi / wordpress, powerpoint, algodoo, excel,
socrative, edmodo, moviemaker…
Öğretmenin,”Bir Film izlerken,alışveriş yaparken ve bahçe sularken gördüğünüz maddeleri
düşününüz.Çevrenizdeki maddeler neden bu kadar çeşitli olabiliyor?Bu çeşitlilik olmasa
yaşantınız nasıl etkilenirdi ?” diye sınıfa sorulması
Öğretmenin ,bu derste öğrendiklerinizle maddelerin neden bu kadar çeşitli olduğunu,
bilmeyen ve merak eden kişilere nasıl anlatacaklarını öğrenmesi.
Öğretmenin bu dersin sonunda maddelerdeki değişimlerin nasıl olduğunu,atomların
birbirleriyle nasıl bağlandığını ve maddelerin neden bu kadar çeşitli olduğunu daha iyi
anlayacaksınız demesi.
Öğrencilere dersten önce görsel materyaller sağlamaları istenir.
Power point sunumu esnasında kısa bir film izletilir.
Öğrencilerin, 2. derste kendi getirdiği görsel materyaller ve öğrendikleri arasında tartışması
ve 5 er kişilik gruplar halinde 5 er dk lık sunumlar hazırlaması istenir…
Elementlerin en dış yörüngelerini 8 elektrona tamamlama eğilimleri, atomların birbirine
bağlanmasına yol açar. Çünkü en dış yörüngesindeki elektron sayısını 8’ e tamamlamak için
elektron alan atom (-), elektron veren atom ise (+) yükle yüklenir. (+) ve (-) yüklenmiş
atomlar birbirini çekerler. Böylece bir bağ oluşur. Atomları bir arada tutan bağa “kimyasal
bağ” denir.
Özet
Elektron alışverişi sonucu atomlar arasında meydana gelen elektriksel çekim kuvvetiyle
oluşan bağa “iyonik bağ” ve bu şekilde oluşan bileşiklere “iyonik bileşik” denir.
İyonik bağ, elektron almaya yatkın atom ile elektron vermeye yatkın atom arasında
gerçekleşir. Atomun elektron almaya veya vermeye yatkınlığını elektron dağılımlarından
anlıyoruz. En dış yörüngesindeki elektron sayısı 4 ve 4’ ten büyük olan atomlar elektron
almaya, 4’ ten küçük olanlar ise elektron vermeye yatkındır.
Atomlar arasında elektronların ortaklaşa kullanılmasıyla oluşan bağa “kovalent
bağ” denir. Bu şekilde oluşan bileşiklere “kovalent bileşik” denir. Atomlar ortaklaşa
kullanılan elektronlarla, en dış yörüngelerini 8’ e tamamlarlar ve böylece kararlı yapıya
sahip olurlar.
11 p
12 n
17 p
18 n
+
(+1)
( -1 )
11 p
12 n
Na
17 p
18 n
Cl
Na atomu
11 proton
12 nötron
11 elektron
Cl atomu
17 proton
18 nötron
17 elektron
NaCl bileşiği
11 proton
17 proton
12 nötron
18 nötron
10 elektron
18 elektron
Aynı cins atomların elektronları ortaklaşa kullanmalarıyla oluşan kovalent bağa
“Apolar kovalent bağ” denir. Farklı cins atomların elektronları ortaklaşa
kullanmalarıyla oluşan bağa “Polar kovalent bağ” denir.
Apolar kovalent bağda atomlar, ortak kullanılan elektronları eşit kuvvetle çekerler.
Polar kovalent bağda ise ortak kullanılan elektronlar eşit şekilde çekilmezler. Genellikle
proton sayısı fazla olan atom diğer atomlara göre elektronları daha fazla bir kuvvetle
çeker. Böylece elektronları daha fazla çeken atom kısmen (-), diğer atom ise kısmen (+)
yüklenir.
+
O atomu
O2 molekülü (Apolar)
O atomu
(+)
(-)
+
H atomu
F atomu
HF molekülü (Polar)
BÖLÜM III
Ölçme-Değerlendirme:
Bireysel öğrenme etkinliklerine yönelik
Ölçme-Değerlendirme
Grupla öğrenme etkinliklerine yönelik
Ölçme-Değerlendirme
Öğrenme güçlüğü olan öğrenciler ve
ileri düzeyde öğrenme hızında olan
öğrenciler için ek Ölçme-Değerlendirme
etkinlikleri
Dersin Diğer Derslerle İlişkisi
1. İyonik bağ nedir? Nasıl meydana gelir?
2. Atomlar neden başka atomlarla bağ yapmak isterler?
3. Atomların elektron alma ve verme eğilimleri neye bağlıdır?
4. . 19K ile 12Mg atomları arasında iyonik bağ oluşur mu? Neden?
5. 3Li ile 9F atomları arasındaki iyonik bağ oluşumunu şekil çizerek gösteriniz
6.Polar ve apolar kovalent bağa örnek vererek, arasındaki farkı söyleyiniz.
7.Cl2, N2, H2O, NH3, HCl ve CO2 bileşiklerinde hangi tür kovalent bağ oluşur?
BÖLÜM IV
Planın Uygulanmasına
İlişkin Açıklamalar
Konu önerilen 4 ders saatinde işlenmiş ve değerlendirme etkinlikleri de tamamlanarak amacına
ulaşmıştır.
Gökhan Karakaplan
Fen ve Teknoloji Öğr.
Sevda Küçük
Okul Müdürü