MİKOBAKTERİLERİN
MİKROBİYOLOJİSİ VE HASTALIK
OLUŞTURMA MEKANİZMALARI
Prof.Dr.Zeynep SÜMER
Mikobakteriler
Gelişmekte olan ülkelerde ve gelişmemiş ülkelerde ciddi
morbidite ve mortalite nedeni
Günümüze kadar 70’den fazla mikobakteri türü
tanımlanmıştır.
Bunların çoğu insanlarda hastalığa sebep olmaktadır.
Bu tür bolluğuna rağmen birkaç tür veya grup insanlarda
ciddi hastalıklara yol açmaktadır.
Bunlar M.tuberculosis, M.leprae, M.avium kompleksi,
M.kansasii, M.fortuitum, M.cheloniae ve
M.abscessus’tur.
2000 yılı-dünya nüfusunun 1/3’ünün (1.9 milyar
insan) M.tuberculosis ile infekte.
Bu sayının 8 milyonu yeni olgular, 16 milyonu
daha önceden var olan hastalar.
1.9 milyonu ise o yıl içinde bu hastalıktan ölen
sayısı.
En yüksek hastalık insidansı güneydoğu Asya,
Afrika’nın sub-Sahara bölgesi ve doğu Avrupa’da
saptanmakta.
Mycobacterium genusu
0.2-0.6x1-10 m boyutlarında
Hareketsiz
Sporsuz
Asidorezistan boyanma gösteren
Yavaş üreme özelliği (t1/2: 12-24 saat)
Aerobik basillerdir.
Hücre duvar yapısı
Kompleks, lipidden zengin
Hidrofobik yapı
Birçok dezenfaktana ve yaygın kullanılan
laboratuvar boyalarına karşı bakterileri direnç
ARB boyanma özelliği
Yavaş üreme özellikleri
Yaygın kullanılan antibakteriyel antibiyotiklere
direnç
Antijenite
Clumping veya kord faktörü oluşumu gibi
karakteristik özelliklerin oluşmasından
sorumludur.
Hücre duvar yapısı yavaş üreme özelliklerine
katkıda bulunur.
Yavaş üreyen mikroorganizmalar M.tuberculosis,
M.avium-intracellulare, M.avium kompleksi,
M.kansasii) 3-8 hafta inkübasyon
Hızlı üreyen mikroorganizmalar (, M.fortuitum,
M.chelonae, M.abscessus) 7günden az sürede
ürerler.
Lepranın etkeni olan M.leprae ise hücre
olmayan besiyerlerinde üretilememiştir.
Mikobakteriler
İlk izolasyonda çoğu tür 37 o C’de iyi ürer.
Ancak optimal ısı bazı türlerde (M.ulcerans, M.marinum)
30-32 o C,
Bazılarında (M.xenopi) 42 o C ’dir.
Koloni morfoloji türler arasında büyük değişiklik gösterir.
S tipinde (M.avium-intracellulare),
R tipinde (M.tuberculosis)
ikisinin arasında (M.kansasii) veya
filamentöz yapıda (M.xenopi) olabilir.
Mikobakterilerin L formları da vardır ( Much granülleri).
Mycobacterium genusundaki bakterilerin
sınıflandırılması
Aside direnç durumları,
60 ila 90 karbon içeren mikolik asitlerin
varlığı
DNA’larındaki yüksek (%61-71)
guanozin+sitozin (G+C) içeriği
Hücre duvar yapısı
Gram pozitif bakteri hücre duvarı yapısıdır
En içte sitoplazmik membran,üzerinde de kalın bir peptidoglikan
tabaka
Dış membran yoktur.
Peptidoglikan iskelet polisakkaritlerle (arabinogalaktan) kovalent
bağlarla bağlanmıştır.
Peptidoglikan tabakada N-asetilglukozamin ve N-asetil muramik
asit,
Arabinogalaktan tabakada ise D-arabinoz, D-galaktoz ve mikolik asit
bulunur.
Bu polisakkaritlerin terminal uçları yüksek moleküler
ağırlıklı mikolik asitlerle esterifiye olmuştur.
Bu tabakanın üzerinde polipeptitler ve serbest lipidler,
glikolipidler ve peptidoglikolipitler içeren yüksek miktarda
antijenik mikolik asitlerin oluşturduğu hidrofobik bir
tabaka yer alır.
Yağ asitleri hücre duvar kalınlığından ve büyük oranda
aside dirençli boyanma özelliğinden sorumludur.
Bu lipidler hücre duvarının kuru ağırlığının %60’nı
oluşturmaktadır.
Serbest lipidlerden biri olan Wax D, immunoadjuvan
aktiviteye sahiptir.
Kord faktör (6’-6’ dimikolat trehaloz) bakterinin tweenalbumin besiyerinde 37oC’de 10-15 gün içinde çalı
demetine benzer görünüm almasından sorumludur.
Mikosidler ise M.leprae’de olduğu gibi basilin etrafını
kapsül gibi sarar.
Dış tabakadaki peptid zincirleri hücre duvar ağırlığının
%15’ini oluşturur.
Hücresel immün cevabı stimule ettikleri için biyolojik
olarak öneme sahiptir.
Purified Protein Derivatives= PPD M.tuberculosis’le
teması ölçmek için deri testi olarak kullanılmaktadır.
Diğer mikobakterilerden hazırlanmış benzer maddeler de
türe-spesifik test yapmak için kullanılmaktadır.
Runyon Sınıflaması
Fotokromojenler
Sınıf I
Skotokromojenler
Sınıf II
M.kansasii
M.marinum
M.simiae
M.scrofulaceum
M.szulgai
M.gordonae
M.flavescens
Nonkromojenikler
Sınıf III
Çabuk üreyenler
Sınıf IV
M.avium-intracellure
M.xenopi
M.ulcerans
M.gastri
M.terrae
M.malmoense
M.fortuitum
M.chelonea
M.smegmatis
DİRENÇLİLİK
Kuruluğa ve kimyasal dezenfaktanlara sporsuz çoğu
bakteriden daha dirençlidir.
Kültür ortamında canlılık ve infektivitelerini 12 yıl korur.
Direkt gün ışığına maruz kalınca 2 saat içinde ölürken,
balgam içinde 20-30 saat dayanabilir.
Tozların içinde 10 gün, toprak ve suda 5 ay, kurutulmuş
halde 6-8 ay veya üzerinde yaşayabilir.
DİRENÇLİLİK
Ancak ısı ve neme karşı çok hassastır.
Sütün pastörizasyonu bakteriden
kurtulmak için yeterlidir.
Malaşit yeşiline diğer birçok bakteriden
daha dirençli olduğundan izolasyon
besiyerine bu maddenin eklenmesi ile
diğer bakterilerin üremesi inhibe edilir.
ANTİJENİK YAPI
Antijenik yapı?
M.tuberculosis’in yapısında yer alan protein, lipid ve
polisakkaridlerin tümü immünojeniktir.
Old Tuberkulin(OT),
PPD(saflaştırılmış protein derivesi)
Saflaştırılmış antijenler (65kD antijeni, TB 23, TB 68 vs)
anahtar immünojen
VİRÜLANS VE PATOJENİTE
Virülansta rol oynayan kesin bir faktör ?.
Çalışmalarda bazı faktörlerin sorumlu olabileceği
öne sürülmüştür:
Polisakkaritler (arabinogalaktan ve arabinomannan)
Fosfatidil inositol mannosid (PIM)
Wax-D
Muramidilpeptit(MDP)
6’-6’ dimikolat trehaloz (Kord faktörü)
Sülfatidler
Fosfatidler
Kord faktörü:
Küme oluşturma kabiliyeti kazandırır.
Alternatif kompleman yolunu aktive eder.
PNL göçünü inhibe eder.
Granülom oluşumunda rol oynar.
Anti-tümör özelliği vardır.
Konak hücre mitokondri membranına tutunarak solunum
ve oksidatif fosforilasyonda hasar yapar.
Tüberküloz insanlarda görülen klasik
mikobakteri hastalığıdır.
Tüberküloz kompleksi:
M.tuberculosis
M.bovis
M.africanum
M.microti
Patojenite
Aerozol haline gelmiş infeksiyöz partiküllerin inhalasyonu
Bu partiküller terminal hava yollarına ulaşır.
Bu bölgelerde bakteriler aktive olmamış alveolar
makrofajlara geçerler.
Fagosite edilmiş basil fagozomun asidifikasyonu ve bunu
takip edecek olan fagozom-lizozom füzyonunu inhibe
ederek serbest bir şekilde replikasyona başlar.
Replikasyonun fagozomda mı yoksa sitoplazmada mı
olduğu henüz bilinmemektedir.
İnfekte fagositik hücreler daha sonra parçalanır.
Bunu makrofajlar tarafından fagositoz, mikobakteriyel
replikasyon ve hücre lizis siklusları takip eder.
Hücresel artıklar ve konak kemotaktik faktörleri
(örneğin, C5a) - makrofajlar ve lenfositler
Bu odağın histolojik özelliği birleşmiş
makrofajların oluşturmuş olduğu çok çekirdekli
dev hücreler (Langhans hücreleri) oluşumudur.
Primer Kompleks (Ranke kompleksi) :
Parenkim dokuda bulunan odak (Ghon odağı)
hiler lenfadenopati ve
ikisi arasında bulunan lenfanjit
İnfekte makrofajlar kan dolaşımına ve diğer
dokulara (kemik iliği, dalak, böbrek, santral sinir
sistemi) yayılabileceği gibi lokal lenf nodlarına
da yayılabilirler.
Akciğer apeksine yerleşerek Simon odaklarını
Beyin meninkslerine yerleşerek Rich odaklarını
Büyük damarların intimasına yerleşerek Weigert
odaklarını oluşturabilir.
hücresel immünitesi aktive hale geçer.
Mikobakterilerin intrasellüler replikasyonu Th hücrelerini
ve Ts hücrelerini stimüle eder.
Th hücrelerin aktivasyonu antikor üretimine yol açar,
fakat etkisiz, çünkü bakteriler intrasellüler yerleşimle
kendilerini korurlar.
T hücreleri ayrıca makrofajları aktive eden interferon-
ve diğer sitokinler salgılar.
Aktive makrofajlar bakteri içlerine alıp öldürebilirler.
Ts hücreleri de replike olan mikobakterileri içeren
fagositik hücreleri lizise uğratabilir.
Makrofajlar stimüle olduğu zaman ortamda küçük bir
antijenik yük mevcut ise, basiller minimal doku hasarı ile
yok edilirler.
Eğer ortamda çok fazla basil varsa, hücresel immün
cevap doku nekrozu ile sonuçlanır.
Bu olaylar sırasında çok sayıda konak faktörü devreye
girer:sitokin toksisitesi, kompleman kaskadının lokal
aktivasyonu, iskemi ve makrofaj kökenli hidrolitik
enzimler ile reaktif oksijen ara ürünlerine maruziyettir.
Bu doku hasarı ile ilişkili bilinen hiçbir mikobakteriyel
toksin veya enzim bulunamamıştır.
konak faktörü
sitokin toksisitesi,
kompleman kaskadının lokal aktivasyonu,
iskemi
makrofaj kökenli hidrolitik enzimler
reaktif oksijen ara ürünlerine maruziyettir.
Basillerin yok edilmesinde infeksiyon odağının büyüklüğü
Aktive makrofajların lokalize kümeleri (granulomalar)
basillerin yayılımlarını önler.
Bu makrofajlar küçük granulomların (3mm’den küçük)
içine penetre olabilir ve içindeki tüm basilleri
öldürebilirler.
Ama daha büyük nekrotik veya kazeöz granulomlar
fibrinle enkapsüle hale gelir. Bu da basilleri makrofajların
öldürmesinden korur.
Basiller bu durumda uyur halde kalabilir ve yıllar sonra
reaktive olabilir.
Bu M.tuberculosis’le karşılaşmış hastalarda hayatın ileri
dönemlerine kadar hastalık gelişebilme ihtimalinin
sebebidir.
EPİDEMİYOLOJİ
Çeşitli deney hayvanlarında tüberküloz
oluşturuluyor olsa bile insanlar tek doğal
rezervuardır.
Hastalık infekte aerozollerin inhalasyonu yolu ile
yakın kişiden kişiye temas ile bulaşır.
Büyük partiküller mukozal yüzeylerde yakalanır
ve respiratuar sistemin silier aktivitesi ile atılır.
Fakat 1-3 tuberküloz basili içeren küçük
partiküller alveolar boşluklara ulaşıp infeksiyon
yapabilirler.
KLİNİK
Her organı tutabilse de en sık rastlanılan formu akciğer
tutulumudur.
Başlangıç pulmoner odak akciğerlerin orta veya alt
loblarıdır. (havalanma fazlalığı, aerobik yapı).
Hastaların çoğunda karşılaşmadan 3-6 hafta sonrasında
bakteri replikasyonu sona erer.
Basille karşılaşan hastaların ort. %5’i 2 yıl içinde aktif
hastalığa yakalanır.
Diğer bir %5-10’u ise hayatlarının ilerleyen kısımlarından
birinde aktif hastalıkla karşılaşmaktadır.
Progresyon
İnfeksiyöz doz ve hastanın immün sistemine bağlıdır.
Mesela HIV ile infekte hastaların ort. % 10’ununda 1 yıl
içinde aktif hastalık gelişir.
HIV ile infekte olmayanlarda ise bu oran tüm yaşamları
boyunca %10’dur.
HIV ile infekte hastalarda hastalık diğer fırsatçı
hastalıklardan önce gelişir, iki kat daha fazla ekstrapulmoner bölgeleri tutar ve ölümle sonuçlanması daha
fazladır.
Klinik
Hastalığın klinik bulguları ve semptomları infeksiyon
bölgesine bağlıdır.
Primer hastalık sıklıkla alt solunum yollarına sınırlı
kalır(çocuk>).
Hastalık başlangıçta sessizdir.
Tipik olarak non-spesifik şikayetleri
Balgam az miktarda veya kanlı ve pürülan olabilir.
Hemoptizi ile birlikte balgam üretimi doku yıkımı ile
ilişkilidir (mesela kaviter hastalık).
Tabloya pnömoni, abse formasyonu ve kavitasyon eşlik
edebilir
Klinik tanı
pulmoner hastalığın
(1)radyografik görüntülenmesi,
(2)pozitif PPD testi ve
(3) mikobakterilerin mikroskopi ve kültür ile
laboratuvarda tespiti ile desteklenir.
Milier tüberküloz
Kazeöz odaktan basillerin kana karışması ile çeşitli
organlarda sayısız küçük lezyon oluşur.
Bu hastalarda pulmoner hastalıkla ilgili hiçbir kanıt
olmayabilir.
Daha çok 0-4 yaş arası çocuklar.
Çeşitli organ tutulumları (menenjit, böbrek tbc,vs)
Reinfeksiyon tbc ise endojen veya eksojen şekilde ileri
yaşlarda görülür. Daha sinsi seyir gösterir.
BAKTERİYOFAJLAR
Mikobakterileri infekte edip hücrenin lizizine neden olan
bakteriyofajlar (H37 Rv fajı,…).
Non-litik lizojeni/ pseudolizojeni
Bunun sonucunda koloni morfolojisi, üreme hızı,
enzimatik aktivite ve antijenik yapı gibi bazı özellikler
değişebilmektedir.
Faj tiplendirme tanımlamadan çok epidemiyolojik
çalışmalarda
M.tuberculosis suşlarından izole edilen bakteriyofajlar
Tip A,B ve C ve I
Bu tipler farklı coğrafik bölgelerde dominans gösterir.
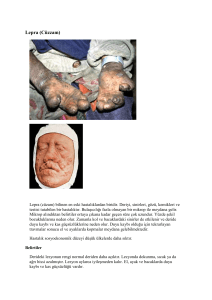
M.leprae
Patogenez ve immünite
Lepra (Hansen Hastalığı) M.leprae oluşturur.
Zayıf gram(+), kuvvetli ARB
Hücre duvarı lipidden zengin.
Bu hastalıktaki klinik tutulumlar hastanın immün
sistem reaksiyonuna bağlıdır.
Virülansta hücre içi üreyebilme yeteneği
önemlidir.
Klinik olarak tüberkuloid lepra, lepramatöz lepra
ve intermediate lepra şekilleri vardır.
Tüberküloid Lepra
Güçlü hücresel immün
reaksiyon
Zayıf humoral antikor
İnfekte dokularda çok sayıda
lenfosit ve granulomlar,
Langhans hücresi, az sayıda
basil,
Lepramatöz lepra
Defektif bir hücresel cevap
Güçlü bir antikor cevabı
Dermal makrofajlarda ve
periferik sinirlerin Schwann
hücrelerinde bol miktarda
basil, en infeksiyöz form
az lenfosit, köpüksü makrofaj
+
Az sayıda
eritematöz/hipopigmente alan Çok sayıda eritematöz makül,
papül,nodül
Tüberküloid Lepra
Lepramatöz lepra
Tam duyu kaybı ile giden
periferik sinir hasarı
Yaygın doku hasarı(nazal
kıkırdak, kemik, kulak)
Yama tarzı duyu kaybı ile
giden diffüz sinir tutulumu
Sinirlerde genişleme
Lepromin testi +
Normal Ig düzeyleri
Eritema nodosum leprosum
yok
Lepromin testi –
Hipergamaglobulinemi
Eritema nodosum leprosum
sıklıkla
Tanı
Suni besiyerlerinde (hücre içermeyen) henüz
üretilememiştir.
Klinik ile uyumlu ise
Tüberküloid formda spesifik deri testi ile
Lepramatöz formda ARB boyama ile konur.
Epidemiyoloji
Dünyada 6 milyondan fazla lepra vakası (Asya ve
Afrika’da >) bildirilmiştir.
Armadillolar doğal olarak infektedirler (ABD).
Hastalık kişiler arası yakın temas ile bulaşır.
En önemli geçiş yolu tam olarak ?
İnfeksiyöz aerozoller yolu ile veya respiratuar
sekresyonlarla ve yara eksudaları ile deri teması yolu
Lepramatöz leprada hastaların nazal sekresyonlarında
bol miktarda M.leprae bulunur.
Mycobacterium avium kompleksi
Su ve toprakta yaygın
M.avium, M.intracellulare, M.avium-intracellulare.
AIDS’ten önce geçici bir kolonizasyon
Hastalık- daha çok pulmoner fonksiyonları bozuk
hastalarda ( KOAH, kronik bronşit, daha önceden
geçirilmiş pulmoner hasar) gözlenirdi .
Kliniği pulmoner tüberküloza benzerdi.
Ama AIDS’in yaygınlaşması ile bu kompleks bu hasta
grubunda sık karşılaşılan mikobakteriyel bir hastalık
olmuştur.
Aids’li hastalarda tipik olarak dissemine formda
Özellikle immün sistemi çökmüş, CD4+ hücre sayısı
mm3’de 10 hücrenin altında olanlarda yaygındır.
Basillerin alınımı daha çok kontamine su veya gıda yolu
ile olurken, aerozol inhalasyonunun daha minör bir
öneme sahiptir.
Tanı mikroskopi ve kültür
Klinik tutulumlar daha çok bol miktarda çoğalan
mikroorganizmanın kitle oluşturarak normal organ
fonksiyonunu bozması ile oluşur.
İnsandan insana geçiş gösterilememiştir
Diğer yavaş üreyen mikobakteriler
“tüberküloz dışı mikobakteriler” (MOTT) bakterileri
İnsanlarda hastalık oluşturabilirler.
Yeni tanısal testler geliştikçe yeni türler de bildirilmeye
devam edecektir.
AIDS, malignensiler, organ transplantasyonları ve immün
supresif ilaç kullanımları, relatif olarak düşük virülansa
sahip bu organizmalara karşı duyarlı olan bir hasta grubu
oluşturmuştur
Bazı mikobakteriler akciğer tüberkülozuna benzer
hastalık oluştururlar (M.bovis, M.kansasii).
Lenfatik dokularda lokalize infeksiyonlar
(M.scrofulaceum).
Daha düşük sıcaklıklarda üreyen bir grup ise primer
olarak deri infeksiyonları (M.ulcerans, M.marinum,
M.haemophilum) oluşturur.
AIDS’li hastalarda ise dissemine formda tutulumlar
yukarıdakilere ek olarak daha az sıklıkta rastlanılan diğer
türlerle de oluşabilir (M.genavense, M.simiae).
Bu mikobakterilerin çoğu su,toprak ve infekte
hayvanlardan izole edilmektedir.
Klinik örneklerde bunların izolasyonu hastanın sindirimi
sonucu geçici bir kolonizasyon olarak yorumlanır.
M.tuberculosis ile ilişkili olan M.bovis ve diğer birkaç
mikobakteri haricindeki mikobakterilerde kişiden kişiye
geçiş olmamaktadır.
Hızlı üreyen mikobakteriler
En yaygın izolatlar M.fortuitum, M.chelonae ve
M.abcessus’dur.
Hızlı ve yavaş üreyen mikobakterilerin ayırımı önemlidir.
Çünkü :
Hızlı üreyen grup relatif olarak daha az virülans
potansiyeline sahiptir,
Klasik mikobakteriyel boyalarla düzensiz olarak
boyanırlar
Konvansiyonel antibiyotiklere diğer mikobakteriyel
tedavide kullanılan ilaçlara göre daha duyarlıdırlar.
Hızlı üreyen mikobakteriler nadiren dissemine hastalık.
Travma yada iatrojenik yolla oluşturdukları derin doku
infeksiyonları ile ilişkilidir (i.v kateter infeksiyonları,
kontamine yara bakımı, kalp kapağı, peritonyel diyaliz
veya bronkoskopi gibi prostetik cihazlarla ilişkili
infeksiyonlar).
Bu mikroorganizmalarla oluşan infeksiyonların insidansı
invaziv işlemlerin artması ve immünkomprimize
hastalarda yaşam süresinin uzamasına bağlı olarak
artmaktadır.
Mikobakterilerin Laboratuvar Tanısı
Deri testi
Mikroskopi
Kültür yöntemleri
Tanımlanmasında morfolojik özellikler, biyokimyasal
reaksiyonlar, hücre duvar lipidlerinin analizi, nükleik asit
probları, nükleik asit sekanslama yöntemleri
Tüberkülin Deri Testi (PPD)
Bu test M.tuberculosis’e karşı oluşmuş geç tip aşırı
duyarlılık reaksiyonunu göstermek için yapılan
intradermal bir deri testidir.
Bu test hastalığın kontrolünde, ayırıcı tanısında,
olguların ortaya çıkarılmasında ve hücresel immünitenin
değerlendirilmesinde kullanılır.
Daha önce basille karşılaşmış kişilere intradermal olarak
tüberkülin verilmesi, enjeksiyon yerinde , bir endurasyon
(sertlik) oluşmasına yol açar.
Endurasyonun çapı ve şiddeti injekte edilen tüberkülin
miktarına ve şahsın duyarlılığına bağlı olarak değişir
Duyarlılığın derecesi endurasyonun çapı ölçülerek tayin
edilebilir.
Ancak ciltte oluşan reaksiyonun büyüklüğü ile hastalık
derecesi arasında bir korelasyon yoktur.
Endurasyonsuz eritemin bir anlamı yoktur.
Mantoux Testi
Tüberkülin testinin yapılmasında standart yöntem.
Önerilen tüberkülin antijeni, hücre duvarının PPD’sidir
(Pürified Protein Derivatives).
Test ön kolun ön yüzünün temizlenmiş derisi içine
PPD’nin uygun konsantrasyonun 0.1cc verilmesi ile
yapılır.
Deri içine enjekte edildiğinde 6-10 mm çapında soluk
renkte bir kabarcık oluşur.
Ayırıcı tanıda ve toplum taramalarında kullanılan
standart tüberkülin dozu 5 TU(Tüberkülin Ünitesi)’dir.
Test 48-72 saat sonra okunur.
Negatif reaksiyon (0-4mm arası
endurasyon):
Anerjiye neden olabilecek durumların
bulunmadığı kişide tüberkülin duyarlılığın
bulunmadığını gösterir.
Şüpheli reaksiyon (5-9mm arasındaki
endurasyon):
BCG aşısı yapılanlarda, M.tuberculosis infeksiyonunda,
tüberküloz dışı mikobakteri türleri ile meydana gelen
infeksiyonlarda oluşabilir.
Atipik mikobakterilere ait antijenler ile deri testleri
yapılabilir.
Eğer bunlar yoksa standat PPD ile diğer koldan
tekrarlanmalı ve booster olayı kontrol edilmelidir.
Booster etkisi
Tüberküloz infeksiyonu bulunmayan bir kişiye defalarca
deri testi uygulanması, duyarlılığı pozitife dönüştürmez.
Fakat homolog veya heterolog mikobakteri antijenlerine
karşı düşük derecede duyarlılığı olan kişilerde tüberkülin
testinin tekrarlanması, reaksiyonda kuvvetlendirici bir etki
(booster) yapabilir.
Bu olay herhangi bir yaşta gözlenebilmesine rağmen
daha çok 55 yaş üstünde görülür.
O nedenle bu kişilere yapılan ilk tüberkülin testi negatif, 1
hafta-1 yıl içinde yapılan ikinci test pozitif olarak bulunur.
Pozitif reaksiyon (10mm ve üstü
endurasyon):
Bu kişinin M.tuberculosis ile karşılaştığını gösterir,
Fakat aktif tüberkülozun kanıtı değildir.
Duyarlılık M.tuberculosis ile ilk karşılaşmadan 2-10 hafta
sonra meydana gelir.
Duyarlılık bir defa kazanılınca devamlı kalma
eğilimindedir.
Çeşitli nedenlerle yanlış negatif ve yanlış pozitif
reaksiyonlar gözlenebilir
Bir toplumda tüberküloz infeksiyon insidansı azaldıkça,
PPD’nin teşhisteki değeri artar.
Türkiye’de sistematik olarak BCG aşısı.
Ülkemizdeki tüberkülin pozitifliklerinin bir kısmı BCG’nin
kazandırdığı hipersensibiliteye bağlı
BCG’ye bağlı tüberkülin pozitifliği genellikle 7-14 mm
olmakta ve zaman geçtikçe reaksiyonun şiddeti
azalmaktadır.
M.tuberculosis infeksiyonu bakımından BCG’li
çocuklarda 15mm ve üstündeki endurasyonlar
anlamlıdır.
PPD testi
Yenidoğan ve gebelere uygulanabilir. Ancak
yenidoğanlarda genelde yanıt alınmaz. Tuberkülinin
teratojenik etkisi yoktur.
2 aylıktan büyük çocuklar aşılanmadan önce PPD ile
kontrol edilmelidir.
Aşıya bağlı en sık komplikasyon aksiler lenfadenittir.
BCG aşısı immün sistemi bozuk olanlara, radyoterapi
veya kemoterapi, steroid tedavisi alanlara, ateşli
çocuklara, gebelere, deri infeksiyonu olanlara ve geniş
yanıklı kişilere yapılmamalıdır.
Lepromin deri testi
İnaktif M.leprae’dan hazırlanır.
Tüberkuloid lepranın klinik tanısında değerli bir
yöntemdir.
Antijenin intradermal uygulanmasından 3-4 hafta içinde
papüler endurasyon gelişir.
Lepramatöz leprada hastalar anerjik olduklarından bu
formda kullanılmaz.
Mikroskopi
ARB boyama (Erlich Ziehl Neelsen(EZN) veya Kinyoun
metodu) tanıda en hızlı yöntemdir.
EZN: örnekler karbol fuksin(4-5’).
asit-alkol solüsyonu ile 2 dak dekolorizasyon
Tekrar su ile yıkanıp zıt bir boyada (Löfflerin metilen
mavisi) 1-2 dak.
Havada kurutulup, incelenir.
Mikroskopi
Bu yöntemde ARB bakteriler mavi zeminde parlak
kırmızı, çalı demeti şeklinde görülürler.
Eski kültürlerde veya kronik hasta örneklerinde ise
düzensiz boyamalar, boncuk dizisi veya tesbih tanesi gibi
görülebilirler.
Fluorasan auramin-rodamin boyaları (florokrom boyama
metodu) ile de boyanabilir. Florokrom boyama yöntemi
daha duyarlıdır.
Mikobakteriler dışında ARB boyanma
özelliği gösteren diğer bakteriler:
Nocardia türleri,
Legionella micdadei,
Rhodococcus spp,
Tsukamurella,
Gordona,
Cryptosporidium ookistleri,
Echinococcus protosklokslerinin dikenleri,
Isospora ve Microsporidia türleri
Bakteri sporları
Nükleik Asit Probları
Örnekte az sayıda basil olabileceğinden çeşitli
ampilifikasyon metotları kullanılarak (PCR, LCR vs)
çoğaltıldıktan sonra,
Spesifik mikobakteriyel nükleik asit sekansları ile
mikobakteri tanımlanması yapılır.
Duyarlılığı relatif olarak düşüktür.
Kültür
Akciğer tüberkülozunda 3 gün arka arkaya sabah
balgamı
Yavaş üreme olması ve insanlarda normalde kolonize
olan hızlı-üreyen bakterilerin tabloyu değiştirmesi
olasılığı in vitro üremeyi etkilemektedir.
Negatif diyebilmek için katı besiyerlerinde 6-8 hafta
beklenmelidir.
Yumurtalı-bazlı besiyerleri (Löwenstein-Jensen besiyeri )
Agar-bazlı besiyerleri (Middlebrook) ile 3-4 haftada
üreme sağlanabilirken,
Özel olarak formülize edilmiş sıvı besiyerleri ile bu süre
10-14 güne indirilmiştir.
Yumurtalı besiyerlerinde 2-3 haftada pigmentsiz, ekmek
kırıntısı şeklinde üstü ve kenarları girintili, çıkıntılı,
kuru,sert, kirli beyaz veya deve tüyü renginde 1-2mm
çaplı koloniler oluşturur.
İçinde gliserin bulunduran sıvı besiyerlerinde ise zar
oluşturarak ürer.
Mide yıkama suyu, idrar, çeşitli vücut sıvıları (abse,
plevra, periton mayi), BOS,
GIS tbc’sinde dışkı örneklerinden(rutin değil) de kültür
yapılabilir.
BOS 1 gün oda ısısında bekletilirse fibrin ağı oluşur.
Basillerin fibrin ağında görülme ihtimali daha fazladır.
Homojenizasyon, dekontaminasyon ve
yoğunlaştırma
Normalde steril olmayan örneklerin kültür işlemlerinden
önce bu işlemlere tabii tutulmalıdır.
Amaç, örneklerde bulunan tbc basillerinin eşit dağılımını
sağlamak,
Onlara zarar vermeden diğer bakterileri öldürmek
Aside dirençli bakterileri yoğunlaştırmaktır.
Balgamda %4NaOH, idrar ve diğer örneklerde %4 sülfirik
asit veya asetil sistein ve NAOH karışımı
kullanılmaktadır.
Uzamış dekontaminasyon mikobakterilere de zarar
verebileceğinden normalde steril sayılan örnekler için bu
işlem uygulanmaz
Kesin tanımlama
Birçok teknik ile bu yapılabilir.
Biyokimyasal testler: tanımlamada kullanılan standart bir
yöntemdir, fakat 3 hafta veya üzerinde süre gerektirir.
M.tbc’de niasin testi pozitif, katalaz negatiftir. M.bovis
ise TZH’ye duyarlı tek türdür.
Bactec TB ve benzeri sitemler:tanı 8 saat-18 gün
aralığına kadar indirilebilinmiştir. Burada 14C ile
işaretlenmiş sıvı besiyerlerinde basillerin C ve enerji
kaynağı olarak bu substratı kullanmaları, oluşan CO2
veya gaz basıncının ölçülmesi esas alınır.
Ayrıca karakteristik hücre duvar lipidlerinin incelenmesi
için kromatografik inceleme yapılabilir (TBSA BOS için
özgül, fakat balgamda uygun değil).
Adenozin deaminaz(ADA) ve lizozim testi gibi
nonspesifik testler de tanıya yardımcı olması açısından
kullanılmaktadır.
Fakat türe-spesifik moleküler problar en kullanışlı yoldur.
Seroloji:
Oluşmuş antikorların tanısal değeri yoktur.
Klinik örneklerde mikobakteriyel antijenlerin gösterilmesi
daha anlamlıdır
( PPD, Ag 5, Ag 60, TB 72 vs).
KORUNMA VE KONTROL
Gelişmekte olan ülkelerde halk sağlığını tehdit eden
önemli bir hastalık olarak önemini korumaktadır.
Hastalığın erken tanı ve tedavisi kontrolde önemli rol
oynar.
Ancak daha da önemlisi bireylerin aşılanmasıdır.
BCG aşısı
Günümüzde kullanılan aşılar M.bovis BCG suşunun
Sauton besiyerinde 12-14 günlük kültüründe oluşan
zardan hazırlanmaktadır.
Aşının en önemli yararı milier tbc ve tbc menenjit gibi
ağır komplikasyon riskini en aza indirgemesidir.
En büyük dezavantajı ise tanıda kullanılan PPD testini
pozitifleştirip testin değerini azaltmasıdır.
BCG aşısı
Canlı attenüe bakteriyel bir aşıdır.
Isı ve ışığa duyarlıdır.
Etkinliği için daima buzdolabında saklanmalı ve gün
ışığından korunmalıdır.
2 aylıktan büyük çocuklar aşılanmadan önce 5 TU PPD
ile kontrol edilmeli, negatif ise aşılanmalıdır.
BCG polio ve DBT aşılarıyla birlikte yapılabilir.
En sık komplikasyonu aksiller lenfadenittir. Çoğu kez
kendiliğinden iyileşir.
BCG aşısı immün sistem bozukluğunda, radyoterapi
alanlara, antimetabolit,alkalizan ajan ve steroid tedavisi
alanlara, ateşli çocuklara, gebelere, deri infeksiyonu
olanlara ve geniş yanıklı kişilere yapılmamalıdır.
TEDAVİ
Kompleks ve uzun bir tedavidir.
1.seçenek anti-tüberküloz ilaçlar:
İzoniasid (INH), Rifampisin (RIF), Etambutol (EMB),
Pirazinamid (PZA) ve Streptomisin (STM)’dir.
EMB dışındakiler bakterisidal etkilidir.
İki veya daha çoğu bir arada kullanılır. Birbiri ile kombine
edildiklerinde etkinlikleri artar.
Bu grup ilaçların toksisiteleri daha azdır.
Haftada 2-3 günlük tedaviler şeklinde (İntermittant
tedavi) kullanılabilirler.
Klinik tabloya göre tedavi süresi 9 -18 ay arasında
değişir.
2.seçenek anti-tüberküloz ilaçlar:
Sikloserin (CS), ethionamid (ETH), kanamisin,
kapreomisin, paraaminosalisilik asit (PAS) ve
tiasetazon’dur.
Bunlar daha toksik, daha az tolere edilebilen ve daha az
etkili ilaçlardır.
Dirençli olgularda kullanılmak üzere sona saklanırlar.
PAS dışındakiler intermitant tedavide yer almaz.