8.sınıf konu anlatımı.cdr
advertisement
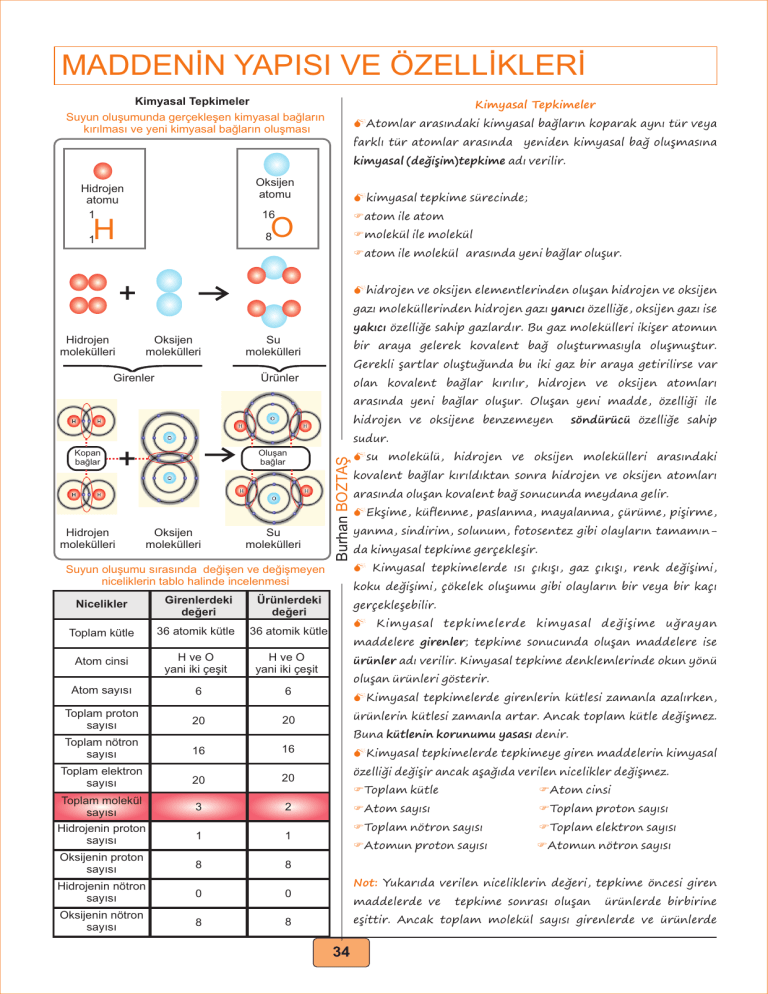
MADDENİN YAPISI VE ÖZELLİKLERİ Kimyasal Tepkimeler Suyun oluşumunda gerçekleşen kimyasal bağların kırılması ve yeni kimyasal bağların oluşması Kimyasal Tepkimeler MAtomlar arasındaki kimyasal bağların koparak aynı tür veya farklı tür atomlar arasında yeniden kimyasal bağ oluşmasına kimyasal (değişim)tepkime adı verilir. Oksijen atomu Hidrojen atomu 1 Mkimyasal tepkime sürecinde; 16 Fatom ile atom 8 Fmolekül ile molekül O H 1 Fatom ile molekül arasında yeni bağlar oluşur. + Mhidrojen ve oksijen elementlerinden oluşan hidrojen ve oksijen gazı moleküllerinden hidrojen gazı yanıcı özelliğe, oksijen gazı ise yakıcı özelliğe sahip gazlardır. Bu gaz molekülleri ikişer atomun Hidrojen molekülleri Oksijen molekülleri Su molekülleri bir araya gelerek kovalent bağ oluşturmasıyla oluşmuştur. 2 2 Girenler Gerekli şartlar oluştuğunda bu iki gaz bir araya getirilirse var Ürünler olan kovalent bağlar kırılır, hidrojen ve oksijen atomları arasında yeni bağlar oluşur. Oluşan yeni madde, özelliği ile hidrojen ve oksijene benzemeyen söndürücü özelliğe sahip + Hidrojen molekülleri Oluşan bağlar Oksijen molekülleri Su molekülleri Burhan BOZTAŞ sudur. Kopan bağlar Msu molekülü, hidrojen ve oksijen molekülleri arasındaki kovalent bağlar kırıldıktan sonra hidrojen ve oksijen atomları arasında oluşan kovalent bağ sonucunda meydana gelir. MEkşime, küflenme, paslanma, mayalanma, çürüme, pişirme, yanma, sindirim, solunum, fotosentez gibi olayların tamamında kimyasal tepkime gerçekleşir. M Kimyasal tepkimelerde ısı çıkışı, gaz çıkışı, renk değişimi, Suyun oluşumu sırasında değişen ve değişmeyen niceliklerin tablo halinde incelenmesi koku değişimi, çökelek oluşumu gibi olayların bir veya bir kaçı Nicelikler Girenlerdeki değeri Ürünlerdeki değeri Toplam kütle 36 atomik kütle 36 atomik kütle Atom cinsi H ve O yani iki çeşit H ve O yani iki çeşit Atom sayısı 6 6 Toplam proton sayısı 20 20 Toplam nötron sayısı 16 16 MKimyasal tepkimelerde tepkimeye giren maddelerin kimyasal Toplam elektron sayısı 20 20 özelliği değişir ancak aşağıda verilen nicelikler değişmez. 3 2 Toplam molekül sayısı Hidrojenin proton sayısı gerçekleşebilir. M Kimyasal tepkimelerde kimyasal değişime uğrayan maddelere girenler; tepkime sonucunda oluşan maddelere ise ürünler adı verilir. Kimyasal tepkime denklemlerinde okun yönü oluşan ürünleri gösterir. MKimyasal tepkimelerde girenlerin kütlesi zamanla azalırken, ürünlerin kütlesi zamanla artar. Ancak toplam kütle değişmez. Buna kütlenin korunumu yasası denir. FToplam kütle 1 1 Oksijenin proton sayısı 8 8 Hidrojenin nötron sayısı 0 0 Oksijenin nötron sayısı 8 8 FAtom cinsi FAtom sayısı FToplam proton sayısı FToplam nötron sayısı FToplam elektron sayısı FAtomun proton sayısı FAtomun nötron sayısı Not: Yukarıda verilen niceliklerin değeri, tepkime öncesi giren maddelerde ve tepkime sonrası oluşan ürünlerde birbirine eşittir. Ancak toplam molekül sayısı girenlerde ve ürünlerde 34 MADDENİN YAPISI VE ÖZELLİKLERİ Kimyasal Tepkime Türleri Kimyasal Tepkime Türleri 1. Yanma tepkimeleri: Her hangi bir maddenin oksijen gazı (O2) ile tepkimeye girerek yeni maddeler oluşturmasına yanma Yanma Tepkimeleri Hızlı yanma (Alevli) Yavaş yanma (Alevsiz) tepkimesi adı verilir. Yanma tepkimeleri hızlı (alevli) ve Asit-Baz Tepkimeleri yavaş(alevsiz) yanma tepkimeleri olmak üzere iki türlüdür. FKömürün yanması Nötrleşme FOdunun yanması Yanma ve yanma olmayan tepkimeler FMitokondride gerçekleşen oksijenli solunum ile besinin C3H8 + 5O2 3CO2 + 4H2O + Isı Girenler kısmında O2 var, yanma tepkimesidir. CaCO3 parçalanması CaO + O2 Fmetallerin oksitlenerek korozyona uğraması (paslanması) Girenler kısmında O2 yok, yanma tepkimesi değildir. Al2O3 + 3H2O yanma tepkimelerine örnek verilebilir. 2 Al (OH3) Girenler kısmında O2 yok, yanma tepkimesi değildir. CaO + CO2 MTüm yanma tepkimelerinde ısı açığa çıkar CaCO3 Girenler kısmında O2 yok, yanma tepkimesi değildir. Burda dikkat edilmesi gereken nokta O2 burada tek başına değil bileşik içerisinde yer almaktadır. Demirin paslanması Asit - baz tepkime örnekleri HCI + NaOH Hidroklorik Sodyum asit hidroksit (tuz ruhu) (sud-kostik) NaCl + H2O Sodyum Dihidrojen klorür monoksit (sofra tuzu) (su) HCI + KOH Hidroklorik Potasyum asit hidroksit (tuz ruhu) (potas-kostik) KCl + H2O Potasyum Dihidrojen klorür monoksit (tuz) (su) H2SO4 + Ca(OH)2 Sülfürik Kalsiyum asit hidroksit (zaç yağı) (Sönmüş kireç) CaSO4 + H2O Kalsiyum Dihidrojen sülfat monoksit ( tuz) (su) HNO3 + NH3 Nitrik Amonyak asit (susuz baz) (kezzap) NH4NO3 + H2O Amonyum Dihidrojen nitrat monoksit (tuz) (su) Burhan BOZTAŞ Kömürün yanması Not: Yanma tepkimelerinde girenler tarafında oksijen atomu (O) değil, mutlaka oksijen gazı (O2) bulunmalıdır. Ayrıca O2 gazı bileşiklerin içinde değil tek başına yer almalıdır. 2. Asit-Baz tepkimeleri: Asitler bazlarla; bazlarda asitlerle tepkimeye girerler. pH değeri 7’den küçük olan asitler, pH değeri 7’den büyük bazlarla bir araya geldiğinde pH değeri 7 olan nötr hâldeki tuz ve suya dönüştüğü için bu tepkimelere nötrleşme tepkimeleri denir. Asit pH<7 + Baz Tuz pH>7 pH=7 + Su pH=7 M Kuvvetli bir baz olan amonyağın (NH3) asitlerle tepkimesinden sadece tuz oluşur. M Nötrleşme tepkimelerindeki tuzlar, bazın katyonu ile asitin anyonunun birleşmesi sonucunda oluşur. M Nötralleşme tepkimeleri kimyasal tepkime olduğundan kimyasal denklemler ile ifade edilir. 35