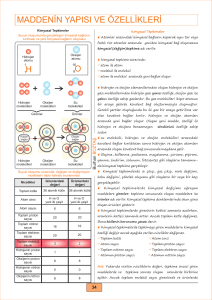
2. Asit-Baz Tepkimeleri
Suda çözündüğünde H+ iyon derişimini artıran
maddelere asit, suda çözündüğünde OH– iyon derişimini
artıran maddelere baz denir.
Asit ve bazların sulu çözeltilerinin karıştırılması
sonucunda tuz ve su oluşumu ile sonuçlanan tepkimelere
nötralleşme tepkimesi denir.
Kimyasal Tepkime Türleri
1. Yanma Tepkimeleri
Maddelerin oksijen gazı (O2) ile verdiği tepkimelerdir.
Yanma tepkimesinin gerçekleşebilmesi için ortamda;
➢ Yanıcı ve yakıcı madde olmalıdır.
➢ Yanıcı madde tutuşma sıcaklığına kadar ısıtılmalıdır.
Aşağıdaki tepkime nötralleşme değildir. Nötralleşme
tepkimelerinde su çıkmalıdır.
Yanma tepkimeleri iki türlüdür.
Hızlı Yanma: Maddelerin alev çıkararak yanmasıdır.
Organik kökenli maddelerin tamamı bu şekilde yanar.
Organik bileşikler yandıklarında CO2 ve H2O
oluştururlar.
2. Yavaş Yanma: Metallerin yanması (oksitlenmesi,
paslanması)dır. Yanma sırasında alev çıkmaz.
Yanma olayları genelde ekzotermiktir. Ancak N2
gazının yan-ması gibi endotermik olanları da vardır.
Eğer bir element atomu oksijenle yapmış olduğu
bileşikte maksimum yükseltgenme basamağına
ulaşmışsa o bileşik yanmaz. CO2 bileşiğinde karbon
atomu alabileceği maksi-mum değerliğe (+4)
ulaştığı için daha fazla yükseltgenenemez. Bu
yüzden yanmaz.
Not: Yangın söndürücü maddelerde bulunması
a) Aktif Metal - Asit Tepkimeleri
www.kimyadersim.com
1.
Aktif Metal: Elektron verme eğilimi H2’den fazla olan
metallere denir.
Aktif metaller dışında kalan metallere ise soy (pasif) metaller denir.
Bir aktif metal asitle tepkime verdiğinde alabile-ceği
pozitif değerliğin yarısı kadar H2 gazı açığa çıkarır.
Au ve Pt tam soy metaldir. Hiç bir asitle tepkime
vere-mezler
Ag, Cu, ve Hg yarı soy metaldir. Sadece kuvvetli
asit olan HNO3 ve H2SO4 ile tepkime verebilirler.
Ancak H2 gazı çıkaramazlar.
gereken özellikler;
1. Yanmamalıdırlar.
2. Havadan ağır olmalıdırlar.
3. Yanıcı madde ile yakıcı maddenin temasını kesip
yanıcı mad-deyi tutuşma sıcaklığının altına kadar
soğutabilmelidirler.
Yakıt: Yandığında ısı veren maddelere yakıt denir. Bir
mad-denin yakıt olabilmesi için yanması yetmez,
tepkime sonun-da ısı açığa çıkması da gerekir.
En iyi yakıt: 1 gramı yandığında en fazla ısı veren
maddedir.
Not:
Yanma tepkimeleri aynı zamanda redoks
tepkimesidir.
Amfoter Metal: Hem asitlerle hem de bazlarla tepkime veren
metallerdir.
Amfoter metaller kuvvetli bazlarla tepkimeye girerek H2 gazı
oluştururlar.
4. İndirgenme – Yükseltgenme (Redoks)
Tepkimeleri
Metalkarbonatları (CaCO3, Na2CO3, NaHCO3...) bazik karekterlidirler. Bu yüzden asitlerle tepkimeye girerek tuz, su ve
CO2 gazı oluştururlar.
Elektron alış verişi ile gerçekleşen tepkimelere redoks
tepkimesi denir.
İndirgenme (redüksiyon): Bir atom ya da iyonun elektron
almasına elektron vermesine denir.
Yükseltgenme (oksidasyon): Bir atom ya da iyonun
elektron almasına elektron almasına denir
3. Çözünme – Çökelme Tepkimeleri
Çözünme: En az iki farklı maddenin birbiri içerisinde gözle
görülmeyecek kadar küçük tanecikler halinde homojen
dağılmasına çözünme denir. Bu olay sonunda elde edilen
maddeye de çözelti denir.
Redoks tepkimelerinde alınan ve verilen elektron sayıları
birbirine eşittir.
Çözünme olayı iki türlüdür.
b) Moleküler Çözünme: Çözünen maddenin çözücü içerisinde molekülleri halinde çözünmesidir.
www.kimyadersim.com
a) İyonik Çözünme: Çözünen maddenin çözücü içerisinde
iyonlarına ayrışarak çözünmesidir.
Tüm yanma tepkimeleri redokstur.
Nötralleşme tepkimeleri redoks değildir.
Yukarıdaki tepkimede değerliği değişen element
bulunmamaktadır.
Homojen ve Heterojen tepkimeler
Çökelme: İki ya da daha fazla çözelti karıştırıldığında bir katı
maddenin oluşup sıvı fazdan ayrılarak çözeltinin dibine inmesine çökelme tepkimesi, oluşan katıya ise çökelek denir.
Girenlerin ve ürünlerin tamamının aynı fiziksel halde olduğu
tepkimelere homojen tepkimeler denir.
Tepkimedeki maddelerden biri bile farklı fiziksel halde ise
heterojen tepkime denir.
Bu tür tepkimelerde iki kavramdan söz edilir.
Birincisi net iyon denklemidir. Net iyon denklemi
çökelme tepkimesini gösteren denklemdir.
Endotermik ve Ekzotermik Tepkimeler
İkincisi ise seyirci iyonlardır.Seyirci iyonlar ise bu
tepkimede çökelmeye uğramayan iyonlardır.
Yani, Na+ ve NO3 – iyonlardır.
NOT: Mağaralarda sarkıt ve dikitlerin oluşumu, çamaşır ve
bulaşık makinalarının rezistanslarının kireçlenmesi,
Pamukkale tra-vertenleri, deniz suyundan çeşitli minerallerin
elde edilmesi çökelme tepkimeleri sonucunda oluşur.
Isı alarak gerçekleşen tepkimelere endotermik tepkimeler
denir. Bu tepkimelerde ısı girenler tarafına yazılır.
Isı vererek gerçekleşen tepkimelere ekzotermik tepkimeler
denir. Bu tepkimelerde ısı ürünler tarafına yazılır.
BAZI ÖNEMLİ POLİMERLER
Analiz (Ayrışma) Tepkimeleri
Bir bileşiğin ısı ya da elektrik enerjisi yardımıyla bileşenlerine
ayrıldığı tepkimelere analiz tepkimesi denir.
Sentez (Birleşme) Tepkimeleri
En az iki saf maddenin birleşerek yeni bir madde oluşturması
ile sonlanan tepkimelere sentez tepkimeleri denir.
Aktif olan bir elementin kendisinden pasif olan bir elementi
bileşiğinden çıkararak yer değiştirmesini gösteren tepkimelerdir.
tepkimesinde Zn, H2’den aktif olduğundan hidrojeni
bileşiğinden çıkararak yerine geçmiştir.
Polimerleşme Tepkimesi
En az 1000 monomerin bir araya gelerek oluşturdukları uzun
zincirli yapılara polimer, bu tepkimelere de polimerleşme
denir.
Monomer + monomer= dimer
Monomer + monomer + monomer = trimer
Monomer + monomer + monomer + monomer=
tetramer
n[monomer]= polimer (n > 1000)
Polimerleşme iki şekilde gerçekleşir.
1-
Katılma polimerleşmesi: Yapısında ikili veya üçlü
bağ bulunan moleküllerde görülür. Tekrarlanan
gruplar aynı türdür. (-A-A-A-A-A-A-A-A-A-)
2-
Kondenzasyon polimerleşmesi : Monomerlerin
birleşmesi sırasında küçük molekül ayrılması ile
sonuçlanan polimerleşme olayıdır. Genel gösterim
(-A-B-A-B-A-B-A-B-A-) şeklindedir.
Örneğin Amino asitlerin birleşmesinden Proteinlerin
oluşumu kondenzasyon polimerleşmesine örnektir.
Aşağıdaki örnekte iki amino asitten Dipeptit
oluşumu gösterilmektedir.
www.kimyadersim.com
Yer Değiştirme Tepkimeleri
Hidroliz Tepkimeleri
Bileşiklerin H2O ile tepkimeye girerek bileşenlerine
parçalanmasıdır.