3.3 KİMYASAL TEPKİMELER
Kimyasal tepkime; maddelerin belirli oranlarda bir araya gelerek yeni maddelere dönüşmesidir.
Kimyasal tepkimelerde başlangıç maddeleri, fiziksel ve kimyasal özellikleri farklı ürünler oluşturmak
üzere yeniden düzenlenirler.
Kimyasal tepkimelerde, tepkimeye giren atomların arasındaki bağlar kopar ve yeni bağlar oluşur.
Elementler sembolle, bileşikler formülle gösterilirken; kimyasal tepkimeler kimyasal denklemlerle
gösterilir.
Kimyasal tepkimeye giren maddeler kimyasal denklemin sol tarafına yazılır ve girenler olarak
adlandırılır.
Kimyasal tepkime sonucu oluşan maddeler ürün olarak adlandırılır ve kimyasal denklemin sağ
tarafına yazılır.
Kimyasal tepkimeye birden fazla madde girdiyse giren maddelerin aralarına (+) işareti konur. Aynı
durum ürünler için de söz konusudur. Tepkime sonunda birden fazla ürün oluştuysa aralarına (+)
işareti konur.
(
) işareti ise tepkimeye giren maddelerin hangi ürünleri oluşturduğunu göstermek için
kullanılır.
ETKİNLİK: Aşağıda verilen kimyasal denklemlerde tepkimeye giren maddelerle, tepkime sonunda
oluşan ürünleri yazalım.
Kimyasal Denklem
H2 + Cl2
Mg + ZnO
Tepkimeden Çıkanlar
(ÜRÜNLER)
H2 , Cl2
HCl
2HCl
C6H12O6 + 6O2
2BaO2
Tepkimeye Girenler
6CO2 + 6H2O
2BaO + O2
MgO + Zn
KİMYASAL TEPKİMELERİN DENKLEŞTİRİLMESİ
Kimyasal tepkimelere giren maddelerle çıkan maddeleri oluşturan atomların cinsleri ve sayıları
aynıdır. Dolayısıyla bir tepkime denkleminin sol ve sağ tarafında aynı cins ve aynı sayıda atom
bulunmalıdır.
Böyle tepkime denklemlerine denkleştirilmiş tepkime denklemi adı verilir.
Eğer bir tepkime denklemi denk değilse, formül ve sembollerin önüne uygun sayılar yazılarak tepkime
denkleştirilir.
Kimyasal Tepkime Denklemlerini Denkleştirirken;
Denk olmayan atom sayılarının başına kat sayıları yazılarak denkleştirilir.
Bileşiğin yapısal formülündeki rakamlar değiştirilmez!
Denkleştirmenin en basit yolu atom sayısı ve çeşidi en fazla bileşiğin katsayısını 1 vermektir.
Gerekirse onun da katsayısı değişebilir.
Hidrojen ve Oksijen atomlarına en son bakılır.
Bileşiklerin başına kesirli sayı getirilmez. (HCl, BaCl2, H2 CO3 ...)
Molekül halindeki elementlerin başına kesirli sayı getirilebilir. ( H2, N2, O2 )
ETKİNLİK: Verilen örneği inceledikten sonra tablodaki kimyasal tepkime denklemlerini
denkleştiriniz.
ÖRNEK
N2 + H2
NH3 denklemini denkleştirelim.
Yanda verilen tepkimede girenler kısmında 2 N atomu ve 2H atomu var. Oluşan ürün amonyakta ise 3H
ve 1 N atomu bulunuyor. Denklemin her iki tarafında da aynı elemente ait atomlardan eşit sayıda
bulunması gerekmektedir.
1. adım: N atom sayısını inceleyelim ve denkleştirelim: : (N2 + H2
2 NH3
2. adım: H atom sayısını inceleyelim ve denkleştirelim) N2 +3 H2
2 NH3
Sonuçta tepkimemiz denkleşmiş olur.
1)
CH4 +
O2
2)
NaOH
+
3)
C3H8 +
O2
4)
NaOH +
HCl
5)
Fe + O2
6)
K+
7)
CaC2 +
8)
Al(OH)3 + H2SO4
9)
BaCl2 +
10)
Mg(OH)2 +
N2 +3 H2
2 NH3
CO2 + H2O
H3PO4
Na3PO4 +
CO2 +
H2O
H2O
NaCl +
H2O
Fe2O3
H2SO4
K2SO4 +
H2O
C2H2 +
NaNO3
H3PO4
H2
Ca(OH)2
Al2(SO4)3 + H2O
Ba(NO3)2
+
Mg3(PO4)2 +
NaCl
H2O
KİMYASAL TEPKİMELERDE;
a)
ETKİNLİK: Verilen denklemlerde bilinmeyenleri bulunuz.
3 CH4 + 8 X
b)
Mg3N2
c)
X
3 CO2
+ 8 NO + 10 H2O denkleminde X nedir?
+ 3 H 2O
3 X + 2 NH3
+ 2 HCl
MgCl2
+ Y
denkleminde X nedir?
denkleminde X ve Y yerine ne gelmelidir?
TEPKİMELERDE KÜTLENİN KORUNUMU
Kimyasal tepkimelerde kimyasal tepkimeye giren maddelerin kütleleri toplamı, elde edilen maddelerin
toplamına eşittir. Bu durum “kütlenin korunumu kanunu” olarak adlandırılır.
Örnek: 2H2 + O2
2 H2O
(O = 16 g/mol)
( H = 1 g/mol)
4.(1) gram + 2.(16) gram
= 2.(18)gram
GİRENLERin toplam kütlesi
= ÜRÜNLERin toplam kütlesi
ETKİNLİK: Verilen denklemlerde kütlenin korunduğunu gösteriniz.
1)
CH4
?
+
2O2
CO2 + 2 H2O
25.6 g
17.6 g
Yandaki tepkimede metanın (CH4 ) başlangıçtaki
kütlesi kaç gramdır?
14.4g
2) Isıtıldığında 5.6 gram CaO ile 4.4 gram CO2 oluşturan CaCO3 en az kaç gramdır?
CaCO3 + Isı
Ca O
+
CO2
3) X ile KL arasında aşağıdaki tepkime gerçekleşmektedir.
X + 2 KL
XL2 + K2
Buna göre; tepkimede yer alan X ve K atomlarının kütle-zaman grafiği aşağıdakilerden hangisi gibidir?
a) Kütle
b) Kütle
X
c) Kütle
X
K
K
K
X
Zaman
d) Kütle
K
X
Zaman
Zaman
Zaman
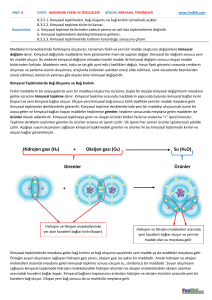
YANMA TEPKİMESİ
Bir maddenin oksijenle (O2) tepkimeye girmesine yanma denir.
Yanma tepkimeleri genelde çevreye ısı enerjisi yayar ve kendiliğinden devam eder.
Bir yanma tepkimesi için; Yanıcı madde, Oksijen (hava) ve Tutuşma Sıcaklığı gerekir.
Havasız (O2’siz) ortamda yanma olmaz. Bu nedenle yanan bir maddeyi söndürmek için önce hava
ile teması kesmek gerekir.
Tüm yanma olayları odunun veya kağıdın yanması gibi bir anda veya alev çıkararak gerçekleşmez.
Demirin veya metallerin paslanması da bir yanma olayıdır. Fakat bu olay yavaş yanma adını alır.
Aynı zamanda bu olaya oksitlenme de denir.
C6H12O6 + 6O2
6CO2 + 6H2O
(glikoz, oksijenle tepkimeye girmiştir.) (solunum denklemi, bir yavaş yanma örneğidir.)
Bir kimyasal tepkimede girenler kısmında OKSİJEN varsa, o tepkime bir yanma tepkimesidir. Yanma
tepkimeleri genelde ortama ısı verir. (Ekzotermik)
Aşağıdaki yanma tepkimesini denkleştirelim...
C3H8 +
O2
CO2 + H2O + Isı ve ışık
(propan) (oksijen) (karbondioksit) (su)
Yangın söndürücü olarak
kullanılan maddelerin
sahip olması gereken
özellikler;
-
Yanmamalı
Havadan ağır olmalı
Zehirli olmamalı
CO2 neden söndürücü
olarak kullanılır?
Yoğunluğu havadan fazladır.
Karbon +4 değerliğe
sahiptir. Bu yüzden yanmaz.