VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
IMMOBILIZE LİPAZLARLA ESTERİFİKASYON REAKSİYONLARI
10 •
•70
<
(,0
-
o
İz
50 ■
3r
S
i
'!U -
£
sC
30 20 10 *
r
u
m
0 "
0
- 50
"
■40
iE.
g
»o
20
30
40
Ayten SAĞIROĞLU *, Azmi TELEFONCU **
* Trakya Üniversitesi Fen-Edebiyat Fakîdtesi Kimya BölCımü Biyokimya Anabilim Dalı
Yr&Doç.Dr. EDİRNE
y
Hîo ; 5
.'S
*• Ege Üniversitesi Fen Fakültesi Kimya Bölümü. Prof.Dr. Bornova- İZM R
3
■«0 >6-1
isi
■o S
ESTERIFICATION REACTIONS W ITH IMMOBILIZED LIPASES
■20
H
ti
3
N
C7*
•GO .§
c
X>
|
50
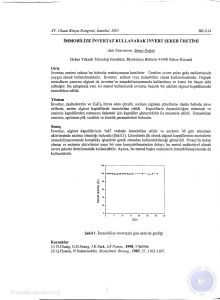
Enzim Der işi mi ( mg/L)
Şekil-3.Sabit
Ti'iolein derişîminde (%1 fıacimce), başlangıç tepkime hızı
ve arayüzeye tutunan enzim miktarının toplam enzim derişimi
İle değişimi
KAYNAKLAR
L Ekiz. H.Î.. Çağlar, A.. Uçar, T,, "A Rapid equilibrium approach to the
InterfaciaJ Kinetics of Lipid Hydrolysis by a Candidal Lipase”, Chem.
Eng. J., 38, B7-B11. 1988.
2. Uçar, TL, Ekiz, H. Î., Çağlar, A., "Surface Effects of Solvents in the
Hydrolysis o f W ater Soluble Lipids by a Candidal Lipase",
Bio tech. Bİoeng., 33, 1213-1218, 1989.
3. Ekiz, H. I,, Uçar, T., Çağlar, A., 'The Influence of Ethyl Acetate on the
Interfacial Behavior of Reaction Media During the Hydrolysis o f
Tributyrin by a Candidal Lipase", 5th European Congress on Biotech.,
244, Copanhagen, 1990.
SUMMARY
immobilization of Upases from two different sources was carried out by covalent
bonding with aqarose activated with CNBr. The product was trapped in a polimerie qel
matrix with adsorption to celite and macroporose Amberlit IRA-938 resin.
It was confirmed that immobilize lipases preparated by using the Amberlite IRA 938
are most suitable biocatalysts of esterification reactions. In this reactions izovaleric acid with
racemic and nonracemic pentanol izomerises were used as reactants. By immobilize lipases
stereo specific esters were synthesized and thus resolution of rocemic alcohols was achieved,
and also nonracemic alcohols was obtained esterification.
ÖZET;
İki çeşit lipaz enzimi; CNBr ile akiive edilmiş aqaroza kovalent bağlanarak, akril
amid ve Bis’ten hazırlanan polimer matrikse tutuklanarak Celiie ve Amberlit IRA 938
reçinesine adsorbsiyon yöntemiyle immobilize edildiler.
Bunlaıtİan esterifikasyon reaksiyon]an için en uygun olanı Amberlit II*A 938 poröz
reçinesine immobilize edilen lipaz preparation oldu. Reaksiyonlar izovalerik asit ite rasemik
ve rasemik olmayan beş çeşit pentanol izomerleri arasında gerçekleştirildi. Hazırlanan
immobilize lipazlann biyokatalizatör olarak kullanıldığı bu reaksiyonlarda stereospesifık
esterler sentezlendi ve rasemik alkoller resolusyona uğrarken rasemik olmayan alkollerde de
esterleşme gözlendi.
GİRİŞ
Esterifikasyon; karboksilli aslUe bir alkol veya türevlerinin reaktant olarak
kullanıldığı özel ve önemli esterlerin ve alkollerin senlezlendiği bir prosesür (1-5)
günümüzde diğer organik sentezlerde olduğu gibi esterifikasyon reaksiyonlarında
da enzimler bazı önemli avantajları nedeniyle sıklıkla kullanılmaktadır
(8, 10, 11 , 12). Özellikle esteraz ve lipaz enzimlerinin spesifiteleri ve
selektivitelerinden yararlanarak diğer kimyasal yöntemlerle eldesi zor ve pahalı
olan ticari öneme sahip ürünlerin elde edilmesi amacıyla uygulanmaktadır (6.9).
Serbest enzimlerin yumuşak koşullar gerektirmesi, hassas spesifıte ve
227
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
selektiviteleri yarımda, katalizlediği reaksiyonun hızım 1012 kat arttırılabilmesi
cazip avantajlarıdır. Ancak uygulamada sudaki çözünürlükleri nedeniyle reak­
siyon ortamından ayrılma güçlüğü ve denatürasyon sorunlan ortaya çıkar. Bunun
için serbest enzimler yerine inert desteklere immobilize edilmiş enzimlerin katalizatör olarak kullanımı tercih edilmektedir.
Genellikle çift fazlı ortamda yapılan çalışmalardan birinde polietilen glikole
(PEG) immobilize edilmiş Pseudomonas Fragi lipazı ile terpen alkollerinin esterleri
sentezlenirken, asitlerde karbon sayısının artışı verimi arttırmaktadır (7). İki çeşit
lipaz katalizatörlüğünde (±) sulcatol*un esterifikasyon yoluyla resolusyonunu da
Thomas ve araştırma gurubu gerçekleşÜrmiştirfl 3).
Lipazlar gliserin esterlerini hitrolizleyen enzimler olarak tanınırlar. En
önemli Özellikleri hidroliz tepkimelerini hidrofobik ara düzeylerde yüksek etkinlikle
yürütebilmesidir. Bunu ilk kez Willstatter ve çalışma gurubunca belirlenmiştir
(14). Yapılan araştırmalar sonunda îipazlann su içeriği düşük organik ortamlarda
hidrolizin tersini yani esterleşmeyi gerçekleştirdiği tespit edilmiştir. Reaksiyon
ortamı enzimin cinsine göre değişen, düşük su içerikli organik çözücüden oluşan
çift fazk sistem olup, su enzimi koruyan, reaksiyonu kolaylaştıran faktördür. Su
içeriğinin artması reaksiyonun hidroliz lehine azalması, esterifikasyonun lehin
olur(10,15). Ancak özellikle esteras aktivitesinin maksimum değerine organik
ortamın su içeriğinin önceden optlmizasyonu İle ulaşılabileceği unutmamalıdır.
Sentetik pyreöıroidler insektisit olarak kullanılmakta olup, asıl insektisit
aktiviteyi enantiomerlerden biri gösterir. Bir Japon araştırma gurubu enzimatik
hidrolizle aktif enantiomeri ayırmayı baş armış tır( 16).
Değişik
araştırma
gurupları
tarafından
immobilize
transesterîJ3kasyon(3,6), mteresteriâkasyon(17,18), esterifikasyon ve
reaksiyonlarında başanyla kuüanılmış lardır(9,19).
lipazlar
hidroliz
Biz çalışmamızda Domuz pankreatik lipazı ve Candida Cylinracea lipazını,
' Amberlit IRA 938 reçinesine immobilize ederek izovalerik asitle beş çeşit pentanol
izomeri arasındaki esterifikasyon reaksiyonlarında katalizatör olarak kullandık.
Rasemik alkollerden optikçe aktif ester ve alkollerin sentezlendiğini belirledik.
Diğer alkollerden de daha düşük oranda esterler sentezlendi.
DENEYSEL BÖLÜM,MATERYAL
İzomer pentanoller, izovalerik asit, lipazlar agaroz, gum arabik, sodyum
deoksikolat CNBr, Sigma Chem. Co.dan; siükajel 60 HF, Folin belirteci, Akril
amid, Bis, Tween 85, İzo oktan. Merk’ten; Amberlite IRA 938 AG. Rohmand
Haes'ten temin edildi.
Jena polaıimetresi, Abbe refraktometresi, Quick fit mini destilasyon takı­
mı, pH—stat, Shimatzu IR-400 spektofötometesi analizler için kullanılan aletlerdir.
228
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
yö ntem
Candida Cyİindracea lipazı (CCL) ve domuz pankreatik lipazı (PPL) dört
ayrı desteğe sırasıyla kovalest bağlanarak, tutuklanarak, ve adsorbsiyonla
immobilize edildiler. Her birinin protein içeriği, hidrolaz ve esteraz aktiviteleri
belirlendi. Sonuçlar tablo 1.l ’de görülmektedir.
Preperatlann protein içeriği Lowry yöntemi ile, hidrolaz aktivitesi,
zeytinyağı substratına karşı pH-statta 0.01 N NaOH sarfiyatından hesaplandı.
' Esteraz aktivitesi fosfat tamponuyla (0.1 M pH: 7.4) doygun izovalerik asit ve
n-butanolun (v/v) 3:2 oranındaki karışımına hazırlanan immobilize enzimler
eklenerek 37°C de 16 saat çalkalandı. Reaksiyon kanş iminin gaz kromatografik
analiz sonuçlarından hesaplandı.
Tablo 1 . i Immobilize lipazlann karakterizasyonu
Taşıyıcı
Lipaz
Protein içeriği
mg/g (enz-taş)
Hidrolaz Ak
37°C pH:9 U/mg
Esteraz Ak.
U/mg
CNBrK agaroz
PPL
224.4
2.4x1 O'4
0.0
Akrilamid
BSPolemini
CCL
57.9
0.384
__a
Celit
CCL
19.6
0.52
_b
Amberlit
IRA 938
PPL
473
3.08
0.045
"
CCL
330
0.49
0.052
1
a) Polimerin jelleş meşinden dolayı öiçülemedi.
b) Celiten enzimin kaçışı fazlalığından Öiçülemedi.
Esterifikasyon reaksiyonları 0.1M pH:7.4 lük fosfat tamponuyla
doyurulmuş izooktan içinde izovalerik asit ve 2 -pentanol, 2 -metil-l- butanol,
3-metil-2-butanol, 3-pentanol, neopentfi alkol izomerleri arasında hazırlanan
immobilize enzimler katalizatörlüğünde 35-37°C, atmosferik basınçta 82 saat
çalkalanarak gerçekleştirildi. Enzimler vakumlu filtrasyonla ayrıldı. Artan
izovalerik asit der. NaOH ile tuz yapılarak çekildi. Kalan reaksiyon kanş imlan
fraksiyonlu destilasyonla ayrıldı.
Ürünlerin çevirme açılan Jena polarimetresiyle, kırma indisleri Abbe
refraktometresiyie ölçüldü. Kaynama noktalan destilasyon sırasında belirlendi.
Ürünlerin diğer analizleri, ince tabaka kromatografîsi (TLC) ile Silikajel 60 HF
adsorbanı, petrol eteri; dietileter; G.asetik asit (3:2:1 damla) çözücü sistemi ve %
3.3’lük derişik H2SC>4-te KMnC>4 çözeltisi belirteci kullanılarak yapıldı. İnfrared
spekrofotometresiyle (IR- 400 Skimatzu) ile de ürün analizleri gerçekleştirildi.
Sonuçlar Tablo 1.2‘de gösterilmiştir.
229
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
Tablo 1,2
Immobilize Lipazîarla bifazik ortamda esteıifikasyon
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
TARTIŞMA VE SONUÇLAR
Upazlann dört ayn desteğe üç değişik yöntemle immobiİizasyonlan
sonunda elde edilen préparadardan Tablo 2.1'de görüldüğü gibi Amberlit IRA 938
immobilize edilen lipazlann her ikiside hidroiaz hemde esteraz aktiviteleri
bakımından, hidroliz, esterifikasyon, transesterifîkasyon, interesterifikasyon
reaksiyonlarında biyokatalizatör olarak başarıyla kullanılabileceği belirlendi. Celite
immobilize lipazda hem protein içeriği hemde hidroiaz aktivitesi yeterli bulunduğu
halde enzim taşıyıcı zayıf adsorbsiyon bağı nedeniyle reaksiyon ortamına
taşıyıcıdan enzim kaçış ı yüksek bulunduğundan kullanılmadı.
Esterifikasyon reaksiyonlarında immobilize CCL ve PPL’m her ikisi de
tatminkar katalitik aküvite gösterdiler. İzomer pentanollerde esterleşme oranı
bakımından önemli bir fark gözlenmedi. Neopentil alkolde her iki lipaz varlığında
esterleşme en düşük oranda bulundu. Bu sonuçlar literatür değerleriyle
uyumludur(4).
Sonuç olarak görüldü ki immobilize CCL ve PPL enzimlerinde düşük sulu
organik ortamda esterifikasyon reaksiyonlarında başanyla biyokatalizatör olarak
kullanılabilirler. Eğer optikçe aktif alkoller kullanılıyorsa bunların en antimerlerine
spesifik olarak etkileyip nssolusyona uğratır, enantiomer alkol ve sfcereospesifîk
ester sentezi gerçekleştirilebilir. Böylece gelecekte pahalı ve yetersiz kiral madde
sıkıntısına alternatif bir çare olduğu gibi çoğu ekonomik olmayan organik
sentezlerin, daha kolay koşullarda düşük maliyetle yapılması mümkündür.
KAYNAKLAR
1- G.M.Whitesides, C.H.Wong "Enzymes as Catalysts in Synthetic Organic
Chemistry" Anqew. Chem Int. Ed. in English, 24 6 (1985) 617-718
2- A.M.K3ibanov B.Cambou "Unusual Catalytic Properties of Usual
Enzymes" Ann. New York Acad. Sci.f VI (1984) 219-223
3- B.Cambou, A.M.K3ibanov "Preparative Production of Optically Active
esters and Alcohols Using Esterase Catalyzed Stereospecific Transestérification in
Organic Media" J.Am.Chem.Soc., 106 (1984) 2687-2692
4- A.ZaksAM.Klibanov "Enzymatic Catalysis in Organic Media at 100°C"
Science, 224 (1984) 1249-1251.
5- AL.Battersby "Stereospecific Synthesis Using Enzymes" Chemistry in
Britain, 20.(1984} 611-616
6- ASağıroğlu, ATelefoncu 'immobilize Lipazlarla Stereospesifik Ester
Sentezleri ve Rasemik Alkollerin Resolusyonu", (Ph D Thesis), Ege Ün. Fen
Bil.Ens. Dergisi 1992
7- T.Nishio. T.Takahashi, Y.Yoshimoto, Y.Saito, Y.înada ’Terpene Alcohols
231
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
Synthesis bv Poİyethylen Glycol Modified Lipase in Benzene" Biofcechnol Lett., 9
3 {1987) 187-190
8- G.Lazar, A.Weiss, RD.Schmind "Synthesis Easters by Lipase" Henkal
Referate, 22/int 22 (1986) 5-11
9- B.Cambou, A.M.Klibanov " Colinesteras- Catalyzed resulting D,L
carnitine" Biotechnol. Bioeng, 26(1984) 1449-1454
10- I.L.Gatfield "The Enzymatic Synthesis of Esters in.Nonaqueous
System" Ann New York Acad of Sci.B. (1987) 569-572
11- J, Hailing "lipid Modifications by lipases" Enzyme. Microb. Technol,
6.(1984)513-520
12- M.iwai, S.Okumuro " Synthesis of Terpene Alcohol Esters by Lipase"
Agric.Btol.Chem., 44 (1980) 2731-2732
13- H.M.Stokes, A.C.Oehlschlager "Enzyme Reaction in Polar Solverts: The
Resolution of (±) Sulcatol With Porcine Pancreatic Lipase" Tetrahedron Lett. 28
19(1988) 2091-294
14- RWiilstatter, L.E.Waldschmidt, F.Memmen " Properties of Lipases "
Z,Fhysiol.Chem, 125(1923) 93-100.
15- M.Iwai, Y.Tsu Jisaka "Lipases"
Elsevier New York (1984) 443-460
B.Borgström, H.L.Brockmann Ed.
16- H.Hirohara, S.Mitsuda, E.Ando, RKomaki "Enzymatic Preparation of
Optically Active Alcohols Related to Syntetic Pyreih raids Insecticides" Elsevier.
Sci. PubLB.U. Amsterdam-Printed the Nederland (1986) 119-134
17- TAydemir, ATelefoncu " immobilize Lipazlarla Yağların
İnteresteriOJkasyonu" (Ph D Thesis) Ege tfn.Fen Bil.Ens.Dergisi (1991)
18- K.Yokozeki, Y.Yamanaka, K.Takinami, Y.Hiros A.Tanaka, K.Sonomoto(
S.Fukui " interesteriiication of fats " Eur.J.AppL.Microbiol.BiotechnoL 14
(1984) 1-5
19- H.Î.Ekiz, T.Uçar, A. Çağlar "The Effects of Alcohols on the hydrolysis of
Triacetin and Tributyiin by a Candidal Lipase" The Journal of Fırat Ün. 2 ( 1)
{1987)31-38
232
KimyaKongreleri.org