Slayt 1 - WordPress.com
advertisement

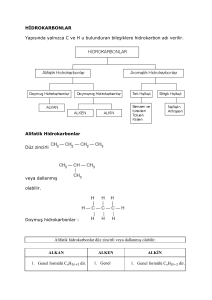
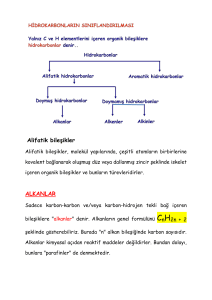
Alkanlar ve Alkenler Alkanlar Alkanlar, CnH2n+2 genel formülü ile gösterilebilen doymuş hidrokarbonlardır. 4 karbonlu butan ve daha sonraki alkanlarda dallanma izomerleri meydana gelir. Alkanların normal şartlarda (25oC sıcaklık ve 1 atmosfer basınç şartları) 1-4 karbonluları gaz, 5-17 karbonluları sıvı, 18 ve daha fazla karbonluları katı halde bulunurlar. Alkanların gaz ve katı olanları kokusuz olduğu halde sıvı olanlarında benzin kokusu belirgindir. Alkanlar yeterli miktarda oksijen içinde tam yandıklarında karbon dioksit (CO2) ve su (H2O) meydana gelir ve ısı enerjisi açığa çıkar. Alkanların yetersiz oksijen nedeniyle tam olmayan yanmaları sonucunda karbon monoksit (CO), aldehitler, ketonlar, karboksilik asitler ve is şeklinde karbon meydana gelir; bunlar da önemli hava kirletici maddelerdir. Uzun zincirli alkanların katalitik kırılmasıyla çeşitli petrol ürünleri oluşur. Alkanların Sentezi Würtz Sentezi İki alkil halojenürün sodyum metaliyle reaksiyonu sonucunda elde edilir. 2 CH3CH2Br(s) + 2Na (k) CH3CH2CH2CH3(s) + 2 NaBr Würtz sentezinde alkil grupları farklı gruplar da olabilir. Ancak bu durum ürün çeşitliliğini artıracaktır. Grignard Sentezi Alkilbromürler susuz eter çözücüsü içerisinde Mg metali ile tepkimeye girerek Grignard bileşiği adı verilen bileşikler oluşur. CH3CH2Br(s) + Mg (k) eter CH3CH2MgBr Grignard bileşiği suyla yada hidrojen halojenür ile etkileşerek alkanları verir. CH3CH2MgBr + HOH CH3CH3 + MgBrOH Alkanların Tepkimeleri Yanma: C2H6(g) + 7/2 O 2(g) 2CO 2(g) + 3H 20(g) • Bir çok alkan bu şekilde yakıt olarak kullanılır. • Metan: doğalgaz • Propan: tüpgaz • Bütan: çakmak gazı • Benzin: hidrokarbon karışımı Halojenlenme Bir yada daha fazla hidrojenin halojenle yer değiştirme tepkimesidir. CH4(g) + Cl2(g) CH3Cl(g) + HCl(g) Bir çok halohidrokarbon çözücü bu yolla elde edilir. Alkil halojenürler Bir yada birden fazla hidrojenin halojenle yer değiştirdiği alkanlardır. Genel Formül: R−X şeklindedir. R: herhangi bir alkil X: halojen (F, Cl, Br, I) Yapı ve adlandırma bakımından alkanlara benzer. Alkil halojenürlerin özellikleri Erime ve kaynama noktaları Alkanlarınkinden daha yüksektir. MA arttıkça yükselir. Çözünürlük: Suda çözünmezler Alkan gibi apolar çözücülerde ve diğer alkil halojenürlerde çözünürler. Alkil halojenürlerin sınıflandırılması Halojenin bağlı olduğu karbona bağlı alkil (R-) grubu sayısına göre: 1 halojen: birincil (primer) 2 halojen: ikincil (sekonder) 3 halojen: üçüncül (tersiyer) Bu gruplama diğer işlevsel gruplar için de geçerlidir. Alkil halojenürlerin sınıflandırılması H3C CH2 Cl primer H3C CH Cl sekonder H3C CH3 H3C C Cl CH3 tersiyer Alkil halojenürlerin önemli tepkimeleri Yerdeğiştirme tepkimesi - CH3Br + I CH3I + Br - CH3Br + OH - CH3OH + Br - Alkenlerin Fiziksel Özellikleri Fiziksel özellikleri alkanlarınkine benzer. • Çözünürlük Apolar çözücülerde çözünür Suda çözünmez Yoğunlukları, erime ve kaynama noktaları düşüktür. Fakat bu özellikler molekül boyutuna göre değişir. Birden fazla çift bağı bulunan alkenler renkli bileşiklerdir. Alkenlerin Geometrik İzomerleri H3C CH3 C H C C H H cis-2-büten Büyük gruplar aynı tarafta: -cis CH3 C H3C H trans-2-büten Büyük gruplar karşılıklı konumda: -trans Alkenlerin Elde Edilmesi 1) KOH’ın alkoldeki derişik çözeltisi, alkil halojenürlerle tepkimeye sokulursa alken oluşur. H3C H H C C Cl H H H3C CH3 + KOH C C + KCl + H2O etanol H CH3 2) Komşulu dibromürler, asetik asit içerisinde Zntozu ile tepkimeye sokulursa alken oluşur. H3C H H C C Br Br CH3 + Zn CH 3COOH CH3 H3C C H C + ZnBr 2 H 3) Alkoller, derişik sülfürik asit katalizörlüğünde ısıtılırsa alken elde edilir (dehidrasyon). H H3C H C C H OH CH3 CH3 H3C C H C + H2O H Alkenlerin Tepkimeleri • Katılma Tepkimesi Çift bağ koparak yerine birşeyler katılır. R CH CH R R CH CH R Alkenlerin Tepkimeleri • Hidrojenlenme Katalizör eşliğinde bir çift bağa 1 mol H2 katılır. Ürün bir alkandır. R CH CH alken R H2 kat. R CH CH R H H alkan Katalizör olarak Pt, Pd, Ni gibi metaller kullanılır. Bazı durumlarda yüksek basınç ve sıcaklık da gereklidir. • Hidrasyon Su katılması tepkimesidir. Bir karbon –H, diğeri –OH alır. Ürün bir alkoldür. Az miktarda asit katalizör olarak kullanılır. + R CH CH alken R + H 2O H R CH CH OH H alkol R • Markovnikov Kuralı Çift bağa su katılırken karbonlardan hidrojeni fazla olana –H, az olana –OH bağlanır. OH H C C R H + R C C R H R + H 2O H R R • Hidrohalojenlenme Alkene HF, HCl, HBr, HI katılımı Markovnikov kuralı burada da geçerlidir. R CH CH alken R + HX R CH CH H X haloalkan R