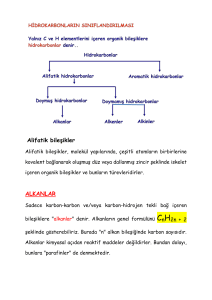
Kemoterapötikler-II
Kemoterapide kullanılan ilaçlar, kullanıldığı patojen etkenin cinsine,
taşıdığı genel yapıya veya etki mekanizmalarına göre sınıflara ayrılırlar.
Antibakteriyel ilaçlar
Sülfonamidler( = folat antagonistleri)
Antimikobakteriyel ilaçlar
β-Laktam antibiyotikler
Protein sentez inhibitörleri
Tetrasiklinler
Amfenikoller
DNA-jiraz inhibitörleri
Kinolonlar
Antifungal ilaçlar
Antiviral ilaçlar
Antikanser ilaçlar
Antibakteriyel ilaçlar
Hücre
duvarı
DNA/RNA
Hücre zarı
sitoplazma
kapsül
ribozomlar
Bakteri Hücresi
Antibakteriyel ilaçlar- Etki mekanizmaları
1- Hücre metabolizmasının inhibisyonu
(Antimetabolitler: Sülfonamidler, PAS, Dapson)
2- Bakteriyel hücre duvarı sentezinin inhibisyonu
(Penisilinler, Sefalosporinler, Sikloserin)
3- Bakteriyel protein sentezinin inhibisyonu
(Tetrasiklinler, Amfenikoller, Streptomisin)
4- Nükleik asitlerin sentezinde rol oynayan enzimlerin inhibisyonu
(Kinolonlar, Rifamisinler)
5- Hücre membranı permeabilitesinin artması
(Polimiksinler)
Antibakteriyel ilaçlar- Etki mekanizmaları
Nükleik asit sentezi
inhibisyonu
(Kinolonlar,Rifamisinler)
sitoplazma
Antimetabolitler
(Sülfonamidler,
PAS, Dapson)
Membran
permeabilite
artışı
(Polimiksinler)
Protein sentezi
inhibisyonu
(Tetrasiklinler,
amfenikoller,
Streptomisin)
Hücre duvarı
sentezi inhibisyonu
(Penisilinler,
sefalosporinler,
sikloserin)
BAKTERİYEL PROTEİN SENTEZ İNHiBİTÖRLERİ
I- TETRASİKLİNLER
II- AMFENİKOLLER
III- OKSAZOLİDİNONLAR
• Bakteri ribozomlarında protein sentezini inhibe ederler.
• Bakteri hücresi içine girdikten sonra ribozomların 30S alt- birimine
bağlanırlar ve bunun sonucu 50S alt-birimin akseptör noktasına aminoaçil
t-RNA nın bağlanmasını bloke ederler ve böylece peptit zincirine
aminoasit eklenmesini engellerler.
• Bakteriyostatik etkili antibiyotiklerdir.
I- TETRASiKLiNLER
• Streptomyces aurefaciens kültürünün sekonder metaboliti olarak elde edilmiştir.
• Bakteri ribozomlarında protein sentezini inhibe ederek bakteriyostatik etki
oluştururlar.
• Tetrasiklinler ayrıca aktif penetrasyon mekanizması ile bakteri hücresine girerek
birikim yaparlar. Bu mekanizmaları nedeniyle geniş antibakteriyel spektruma
sahiptirler. Gr(-) ve Gr(+) bakterilere etkili en geniş spektrumlu antibiyotiklerdir.
• Selektiflikleri düşüktür, bu nedenle memeli hücresindeki protein sentezini de
inhibe ederler.
• Bu bileşiklere yapılarında 4 halka içerdiklerinden tetrasiklin adı
verilmiştir. Yapılarında kısmen redüklenmiş naftasen halkası taşırlar.
6
7
5a
6a
8
9
10a
10
5
4a
12a
11a
11
12
7
4
1
6
5
4a
5a
3
8
2
9
D
H
C
4
H
H
B
A
12a
10
11
12
3
2
1
Naftasen
1,4,4a,5,5a,6,11,12a-oktahidronaftasen
(Tetrasiklinlerin Ana Зekirdeрi)
Tetrasiklin Grubu Bileюikler
H3C
7
Tetrasiklin
Klortetrasiklin
Doрal
Minosiklin
6
8
N
5
4
5a
4a
H
2
12a
11
OH
12
O
OH
OH
1
O
Tetrasiklin
Yarэsentetik
OH
3
H
10
Metasiklin
Rolitetrasiklin
OH
9
Oksitetrasiklin
Doksisiklin
H3C
CH3
CONH 2
H3C
R1
R2
7
8
D
9
C
OH
4
4a
OH
3
H
H
B
11
10
5
5a
6
N
R4
R3
CH3
12
O
A
12a
OH
Tetrasiklinler
R1
R2
Tetrasiklin
H
Klortetrasiklin
OH
2
1
CONH R 5
O
R3
R4
R5
CH3
OH
H
H
Cl
CH3
OH
H
H
Oksitetrasiklin
H
CH3
OH
OH
H
Metasiklin
H
=CH2
-
OH
H
Doksisiklin
H
CH3
H
OH
H
Rolitetrasiklin
H
CH3
OH
H
H
H
Minosiklin
N(CH3)2
H
. CH2 N
H
Tetrasiklin
CH3
H3C
7
H3C
OH
6
8
5
N
4
5a
4a
H
H
2
12a
9
11
10
OH
12
O
OH
3
OH
OH
1
CONH 2
O
4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,6,10,12,12apentahidroksi-6-metil-1,11- diokso-2-naftasenkarboksamid
Klortetrasiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,6,10,12,12apentahidroksi-6- metil-1,11- diokso-7-kloro-2-naftasenkarboksamid
Oksitetrasiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,5,6,10,12,12aheksahidroksi-6-metil-1,11-diokso-2-naftasenkarboksamid
Metasiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,5,10,12,12apentahidroksi-6- metiliden-1,11- diokso-2-naftasenkarboksamid
Doksisiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,5,10,12,12apentahidroksi-6- metil-1,11- diokso-2-naftasenkarboksamid
Rolitetrasiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,6,10,12,12apentahidroksi-6-metil-1,11-diokso-N-(1-pirolidinilmetil)-2-naftasenkarboksamid
Minosiklin=4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,10,12,12atetrahidroksi-7- dimetilamino-1,11- diokso-2-naftasenkarboksamid
Rolitetrasiklin
H3 C
7
H3C
OH
6
8
5
CH3
N
4
5a
4a
H
H
2
12a
9
11
10
OH
OH
3
12
O
OH
OH
NH
1
O
CH2
N
O
4-Dimetilamino-1,4,4a,5,5a,6,11,12a-oktahidro-3,6,10,12,12apentahidroksi-6-metil-1,11-diokso-N-(1-pirolidinilmetil)-2naftasenkarboksamid
YAPI-ETKİ İLİŞKİSİ
pKa 9
R1
7
R2
9
D
OH
4a
C
11
B
12a
4
3
OH
H
A
1
12
O
CH3
H C
H 3 N
5
5a
H
10
pKa 7
R3
6
8
R4
OH OH O
2
CONH-R 5
pKa 3
• Amfoter özellikte bileşiklerdir. Bu temel özellik, bütün tetrasiklinlerin pH’ya
bağlı farklı dağılma katsayısı göstermelerine ve biyofarmasötik açıdan ilacın
absorpsiyon kinetiğine doğrudan etkilidir.
(İzolelektrik noktası pH 5.5)
Absorpsiyon en yüksek düzeyde
R1
7
R2
9
R3
6
8
R4
4a
C
11
10
OH
B
12
O
5
5a
H
D
CH3
H C
H 3 N
12a
4
3
OH
H
A
1
2
CONH-R 5
OH OH O
*4, 4a ve 12a kiral konumlardır.
1.
2.
3.
4.
5.
6.
7.
8.
Çizgi ile işaretli kısımlar değişmemesi gereken kısımlardır.
Aktivite için 4 konumunda α-dimetil amino grubu gereklidir; fakat mono
sübstitüe türevlerde de aktivite vardır.
R3 deki OH grubunun kalkması daha stabl ilaç maddelerini oluşturur.
R1 de Cl, NO2, Br, N(CH3) bulunması durumunda aktivite korunur.
12a konumundaki OH in epimerizasyonu ya da deoksi türev aktiviteyi azaltır.
4 Konumundaki epimerizasyon da aktiviteyi azaltır.
A halkasının veya C halkasının aromatize olması halinde aktivite azalır.
Aktivite için mutlaka oktahidronaftasen halkası gereklidir. Halkalardan
herhangi birinin yarılması veya parçalanması aktiviteyi ortadan kaldırır.
Tetrasiklinlerin pH a baрlэbozunmasэ
Sorumlu 6-OH
H3C
CH3
H C
H 3 N
OH
H
OH
O
OH
OH
CONH 2
O
pH= 2-6
H3C
OH
-H2O
H 3C
N
CH3
O
HO
OH
pH > 8
H 3C
H
CH3
OH
N
CH3
OH
H
H
H
OH
OH
H
H
OH
O
CONH 2
O
epitetrasiklin (daha az aktif)
OH
O
OH OH O
isotetrasiklin (inaktif)
CONH 2
Tetrasiklinlerin pH a baрlэbozunmasэ
H 3C
H3C
OH
N
CH3
OH
H
OH
O
pH < 2
OH
O
H
CONH 2
O
-H2O
H 3C
H3C
N
CH3
OH
OH
HO
O
OH
CONH 2
O
Anhidrotetrasiklin (aktivite dьюer)
C halkasэ aromatize olur
TETRASİKLİN, KLORTETRASİKLİN, OKSİTETRASİKLİN, ROLİTETRASİKLİN
• pH a bağlı olarak mide ve barsakta bozunmaya uğrar. Bu
bozunmadan 6 konumundaki (R3) OH grupları sorumludur. Yarı sentetik
tetrasiklinlerde (rolitetrasiklin hariç) R2 ve R3 konumu modifikasyona
uğratılarak OH grubu kaldırılmış, aktivite düşmesi ve inaktivasyon
önlenmiş, aktiviteleri ve etki profili daha iyi türevlere geçilmiştir.
• Tetrasiklinler asit veya bazlarla tuz oluşturan amfoter karakterde
bileşiklerdir.
• İlaç olarak asitlerle yaptıkları tuzlar kullanılır. Asit tuzları bileşiğin 4konumundaki dimetilamin grubunun protonlanması ile oluşur. HCl
tuzları en fazla kullanılır. Kristalize haldeki bu tuzlar suda çok çözünür
ve stabildirler.
H3C
7
Tetrasiklin
H3C
OH
6
8
5
CH3
N
4
5a
4a
H
H
2
12a
9
11
10
OH
12
O
OH
3
OH
OH
1
O
CONH 2
ROLİTETRASİKLİN bir ön ilaçtır. 2- Konumundaki (R5) pirolidinometil grubu
bileşiğin asit tuzuna geçmeden çözünürlüğünü arttırmak için geliştirilmiştir.
Tetrasiklinden 1000 kez daha fazla suda çözünür. Metabolik olarak
tetrasikline dönüşerek etki eder.
7
H3C
OH
6
8
H3C
5
CH3
N
4
5a
H
H
2
12a
9
11
10
OH
12
O
OH
3
4a
OH
OH
1
O
CONH
CH2 N
• Tetrasiklinler Mg2+, Ca2+, Fe2+ gibi birçok metalle stabil şelat
kompleksleri oluşturular. Bu şelat komplekslerinde absorpsiyon azaldığı
için etki de azalır. Bu nedenle oral yoldan alınan tetrasiklinlerin besinler
içindeki bu metallerle barsak kanalında birleşip inaktive olmaması için bu
metalleri suda çözünmeyen kompleksler halinde çöktüren bazı tamponlar
(sodyum sitrat veya fosfat) tablet veya kapsül içine katılır.
R1
R2
R3
R4
H 3C
N
CH3
OH
H
H
O
O
M
O
OH
M
юelat kompleksi
CONH-R 5
O
II. AMFENİKOLLER
KLORAMFENİKOL
1
NHCOCHCl 2
H
O2N
*
C
2
2
OH
*
C
1
CH2 OH
(-) threo (1R, 2R)
H
Aktif
2,2-Dikloro-N-[(1-hidroksimetil)-2-hidroksi-2-(4-nitrofenil)etil]asetamid
• 1947’de Streptomyces venezuelae kültüründen izole edilmiştir.
• Kloramfenikolde 2 kiral merkez bir eksen üzerinde birbirine bağlıdır. Öncelikli gruplar
eksenin ters tarafında yer alırsa threo, eksenin aynı tarafında yer alırsa eritro izomerdir.
• Threo izomer polarize ışığın titreşim düzlemini sola, eritro izomer sağa çevirir.
• Aktif izomer (-) threo dur. Rasem inaktiftir. Rasem yarılması yapılarak etkili izomer
kazanılır.
KLORAMFENЭKOL
O2N
OH
NHCOCHCl 2
C
C
H
H
CH2 OH
(+) eritro
Öncelikli gruplar eksenin aynı tarafında yer alırsa eritro izomerdir.
KLORAMFENİKOL
• Bakteriyel protein sentezini inhibe ederek antibakteriyel etki
oluşturur.
• Gr(-) ve Gr(+) tüm bakterilere etkili, son derece geniş spektrumlu bir
maddedir. Bakteriyostatik, bazı bakterilere bakterisid etkilidir. Çok
toksik olduğu için rastgele kullanılmamalıdır. Tifoda ve paratifo gibi
Salmonella infeksiyonlarında kullanılır.
•Kloramfenikolün tadını düzeltmek ve çözünürlüğünü arttırmak için
esterleri hazırlanır. Bu esterler inaktiftir; fakat organizmada aktif
kloramfenikole dönüşürler. Kloramfenikolün aktif şeklinin tadı acıdır.
Oral yolla kapsül içinde kullanılır.
Ön ilaçlar-tat ve çözünürlüğün düzeltilmesi
Kloramfenikol palmitat
H
O2N
NHCOCHCl2
C
C
OH
H
CH2 O
CO(CH2)14CH3
• Kloramfenikol palmitat esteri kloramfenikolün tadını düzeltmek için
geliştirilmiştir. Oral yolla (şurup) kullanılır.
•Duedonumda lipaz enzimiyle aktif kloramfenikole dönüşür. Barsaktan
emilerek etkili olur. Lipaz enzimi ile kısmen hidroliz olduğundan
biyoyararlanımı düşüktür.
Ön ilaçlar-tat ve çözünürlüğün düzeltilmesi
Kloramfenikol sodyum süksinat
H
O2N
NHCOCHCl2
C
C
OH
H
CH2 O
CO(CH2)2COONa
• Kloramfenikolün sudaki çözünürlüğünü sağlamak ve paranteral kullanımı için
geliştirilmiştir.
• Karaciğer, böbrek ve akciğerlerde esterazlar tarafından hidroliz olur.
Esterazlarla kısmen hidroliz olduğundan biyoyararlanımı düşüktür.
Kloramfenikol’ün Biyotransformasyonu
H
O2N
NHCOCHCl 2
C
C
OH
H
CH2 OH
H
H
O2N
C
C
OH
H
CH2 O
glu
C
C
OH
H
CH2 OH
minor metabolit
% 90 major metabolit
(inaktif)
H 2N
NHCOCHCl 2
NHCOCHCl 2
H
O2N
NH2
C
C
OH
H
minцr metabolit
CH2 OH
Toksik metabolitler
bu grup sorumludur
HN
O
H
C
C
H
O2N
oksidatif
dehalojenasyon
-HCl
Cl
C
C
OH
H
.
Cl
CH2 OH
O
[O]
.
NH C
OH
C
Cl
Cl
O
O
NH C
C
Nu:
.
Cl
oksamilklorьr
doku nьkleofillerine
O
O
NH C
C
Nu
kovalan baр
(toksik)
Dikloroasetamid grubunun biyolojik deşiğimi ile toksisite oluşur
(agranülositoz, trombositopeni, Gray sendromu)
31
TİAMFENİKOL
1
NHCOCHCl 2
H
H3CO 2S
C
2
2
OH
C
1
CH2 OH
H
2,2-Dikloro-N-[(1-hidroksimetil)-2-hidroksi-2-(4-metilsülfonilfenil)etil]asetamid
• Etki spekturumu ve etki profili kloramfenikole benzemektedir.
Etkinliği kloramfenikole göre daha düşüktür.
Yapı-Etki İlişkisi
1
NHCOCHCl 2
H
O2N
*
C
2
2
OH
*
C
1
CH2 OH
H
• NO2 grubu yerine –CN, -CONH2 ve -SO2NH2 grupları getirildiği türevlerde
aktivitede düşüş gözlenmiştir. Sadece CH3SO2- grubuyla kloramfenikole yakın
etkide türevler hazırlanmıştır (Tiamfenikol).
• Dikloroasetil grubu hidroliz olduğunda aktivite kaybolur. Dikloroasetil yerine
izosteri dibromoasetil, dikloroasetil, diiyodoasetil getirilebilir. Azidoasetil
türevi (Azidamfenikol), kloramfenikole alternatif olarak düşünülmüştür.
• Propan-1,3-diol yapısı ve fenil halkasının değiştirilmesiyle aktivite
kaybolmaktadır. Sadece heteroaromatik tiyofen ile hazırlanan kloramfenikol
benzeri molekülde aktivite bulunmuş fakat farmakokinetik ve mikrobiyolojik
etkinlik açısından önemli bir üstünlük gözlenmemiştir.
III. OKSAZOLİDİNONLAR
LİNEZOLİT
O
2
1O
N
4
1
4
N
3
F
3
4
O1
NH
C
CH2
CH3
O
N-[[3-[3-Floro-4-(4-morfolinil)fenil]-2-okso-5-oksazolidinil]metil]asetamid
• Oral ve paranteral yolla kullanılan yeni sentetik bir antibiyotiktir (2003 de
tedaviye girmiştir).
• Gr(+) enfeksiyonların tedavisinde endikedir. Özellikle aneorob stafilokoklara
karşı duyarlıdır.
• Bakteriyel pnömoni, deri ve yumuşak doku enfeksiyonlarında kullanılır.
• Ayakta tedavi gören hastalarda linezolit tedavisine başlanmadan önce diğer
tedavi seçenekleri araştırılmalıdır.
KİNOLONLAR
DNA JİRAZ İNHİBİTÖRLERİ
Kinolin
•Kinolonlar DNA-jiraz enzimini inhibe ederek bakterisid etki gösterirler. DNAjiraz enzimi bakteri kromozomunun siklik ve çok komplike uzaysal
konformasyonundan sorumludur. Bu enzimin inhibe olması bakteri hücresinin
hacminin genişlemesi ve ölmesine neden olur.
•I.Kuşak kinolonların etki spektrumları dardır. Etkili konsantrasyona kanda değil
ancak idrarda ulaşılır. Bu nedenle üriner sistem infeksiyonlarında kullanılırlar.
Oksolinik asidin etkisi daha kuvvetli, etki spektrumu daha geniştir.
•II. Kuşak kinolonlar üriner infeksiyonlarda, ayrıca solunum yolları, periton, deri
ve ürogenital infeksiyonlarda da etkilidir. Fluorokinonlonlarda plazma yarılanma
ömrü belirgin bir şekilde uzundur. Kan-beyin bariyerini
ensefalitlerde de kullanım olanağı bulunmaktadır.
geçebildikleri için
DNA –primer ve sekonder yapısı
NH2
N
O
O P O
OH
N
N
CH2
o
10A
N
G C
AT
O
H
H
H
H
NH2
H
N
Major
groove
O
N
O
P
O CH2
OH
TA
T A
O
O
H
Minor
groove
H
H
H
O
H
N
O
P
O CH2
OH
N
G C
NH2
GC
GC
T A
A T
C G
H
H
H
H
O
Me
NH
O
N
O
TA
T A
O
H
P
O CH2
OH
T A
AT
AT
T A
C G
G C
NH
N
O
TA
T A
G C
G C
H
O
TA
T A
O
DNA DOUBLE HELIX
H
H
H
H
o
34A
DNA –tersiyer yapı
• Çift sarmal üç boyutlu süperbobinleşmiş şekil
alır - (DNA lineer olarak çok uzun hücre
çekirdeğine sığmalı)
(Memelide topoizomeraz I ve II bakteride
topoizomeraz II-(DNA jiraz (Gr-)) topoizomeraz
IV( Gr+)).
• Replikasyon için çift sarmalın tekrar açılması
gerekir.
• Tekrar açılma sırasında gerginlik oluşur.
• Gerginlik topoizomeraz II nin sarmalı kesmesi
ile giderilir ve enzim DNA yı onarır
• Kinolonlar enzimi inhibe ederler.
Enzimdeki tirozin artıkları DNA ile bağlanır.
Topo II
Tyr
Topo II
Tyr
5'
3'
DNA
3'
5'
5'
3'
3'
Tyr
DNA
5'
3
Topo II
Topo II
Tyr
Tyr
Tyr
Topo II
DNA
5'
3'
3'
5'
Tyr
Topo II
Kesik enzim tarafından tekrar birleştirilir.
4
Topo II
Tyr
5'
3'
3'
5'
DNA zincir kesiminde topoizomeraz II işlevi
Enzimdeki tirozin artıkları DNA ile bağlanır.
5'
5'
H
Base
O
H
H
H
HO
H
O
O P
O O
Base
O
H
H
H
O
H
3'
H
H
HO
H
H
TopoII
H
Base
O
Tyr
H
TopoII
Tyr
O
O P
O O
Base
O
H
H
H
O
H
3'
H
KİNOLONLAR-DNA jiraz inhibitörleri
OH
O
COOH
COOH
R
R
CH3
N
X
H
CH3
N
X
Enol
(4-Hidroksikinolin)
Keto
(1,4-dihidro-4-kinolon)
Aromatizasyonla
aktivite kaybolur
Klinikte kullanılan kinolononların ortak yapısı :
• 1-alkil
(sübstitüe)-1,4-piridon-3-karboksilik
asit
yapısıdır.
N-alkilasyon
aromatizasyonu önler. Bu temel yapı, jiraz inhibitörlerinin farmakofor
fonksiyonu olarak tanımlanır.
• Bütün kinolon türevi antibakteriyel bileşikler, bu kromofor yapıya 5. ve 6.
konumlardan kondanse olmuş aromatik ve heteroaromatik yapılar taşırlar.
42
KİNOLONLAR-DNA jiraz inhibitörleri
H
• Benzen kondenzasyonu yapmış yapılara
4-kinolon-3-karboksilik asitler denir.
• Temel halka 1,4-dihidrokinolin olarak adlandırılır.
43
KİNOLONLAR-DNA jiraz inhibitörleri
• Piridin kondenzasyonu yapmış yapılara
4-naftiridon-3-karboksilik asitler denir.
• Temel halka 1,8-naftiridin olarak adlandırılır.
44
KЭNOLONLAR
DNA JЭRAZ ЭNHЭBЭTЦRLERЭ
O
R1
R2
COOH
X
N
R3
Madde
I.
R1
Nalidiksik asit
II. Oksalinik asit
H
1.Kuюak
O
Florokinolonlar
(F suz)
R2
R3
X
CH3
C2H5
N
O
C2H5
CH
C2H5
CH
C2H5
CH
CH2
III. Norfloksazin
F
.
N
NH
IV. Perfloksazin
F
.
N
N
CH3
2.Kuюak
V. Siprofloksazin
VI. Enoksazin
(F lu)
F
.
N
NH
F
.
N
NH
CH
C2H5
N
I. KUŞAK KİNOLONLAR
NALİDİKSİK ASİT
O
5
5
6
4
3
6
2
7
N
3
1,8-naftiridin
COOH
7
H3C
4
N1
2
N
N
8
1
8
4
C 2H5
3
7-Metil-4-okso-1,4-dihidro-1-etil1,8-naftiridin-3-karboksilik asit
N
8
N
1
H
2
1,4-dihidro-1,8naftiridin
OKSOLİNİK ASİT
4
5
O
5
O
4
COOH
6
6
3
7
2
kinolin
O
7
4
2
N1
8
N
1
8
3
3
1,4-dihidrokinolin
C 2H5
1-Etil-6,7-metilendioksi-1,4-dihidro-4-okso
kinolin-3-karboksilik asit
3
O
e
f
4
d
3
c
b
g
2
O
1
5
N
9
4
g
2
O
1
5
N
O
8
7
2
O
3
O
1,3-dioksolo[4,5-g]kinolin
1,3-dioksal
1
O
a
N
H
1
2
4
N
5
C 2H5
6
COOH
5-Etil-8-okso-5,8-dihidro-1,3-dioksolo[4,5-g]kinolin
-7-karboksilik asit
OKSOLİNİK ASİT SENTEZİ:
O
1
O
2
O
HNO 3
PtO2
O
NO 2
H2
O
O
1,2-metilendioksibenzen
O
H
H C O
5
C
2
O
O
NH 2
C
C
OC H
2
5
O
CH
H C O
5
2
etoksimetilen malonik asit
dietilesteri
- 2 C2H5OH
NH
2
O
O
O
O
C2H5I
COOC 2H5
OH-
N
H
O
O
2. H3O+
O
O
COOH
N
C 2H 5
N
C 2H 5
O
1. NaOH / эsэ
COOC 2H5
OKSOLЭNЭK ASЭT
II. KUŞAK KİNOLONLAR (FLORO KİNOLONLAR)
O
F
4
6
3
COOH
7
N
R2
Norfloksazin
X
8
N1
N
R1= C2H5
R1
R2= H
X= CH
1-Etil-6-floro-1,4-dihidro-7-(1-piperazinil)-4-oksokinolin-3-karboksilik asit
Perfloksazin
R1= C2H5
R2= CH3
X= CH
1-Etil-6-floro-1,4-dihidro-7-(4-metil-1-piperazinil)-4-oksokinolin-3-karboksilik
asit
Siprofloksazin
R1=
R 2= H
X= CH
1-Siklopropil-6-floro-1,4-dihidro-7-(1-piperazinil)-4-oksokinolin-3-karboksilik
asit
Enoksazin
R1= C2H5
R2= H
X= N
1-Etil-6-floro-1,4-dihidro-7-(1-piperazinil)-4-okso-1,8-naftiridin-3-karboksilik
asit
Norfloksazin
O
F
5
6
4
3
1 7
N
HN
4
COOH
8
N1
2
C2H5
1-Etil-6-floro-1,4-dihidro-7-(1-piperazinil)-4-oksokinolin-3-karboksilik asit
• Diğer florokinolonlardan farklı olarak norfloksasin oral yoldan tam olarak
absorbe olmaz. Biyoyararlanımı yaklaşık %30-50 düzeyindedir. (Buna karşın,
siprofloksasin'in biyoyararlanımı %70-80 düzeyindedir.)
• Oral yoldan göreceli olarak düşük biyoyararlanımı nedeniyle klinikte sadece
üriner kanal enfeksiyonları ve komplike olmayan gonore olgularının tedavisinde
kullanılır.
NORFLOKSAZİN VE PERFLOKSAZİN SENTEZİ:
F
Cl
PtO2
NO
2
H2
F
H
H C O
5
C
2
O
+
NH
Cl
C
O
5
- 2 C2H5OH
2
malonik
asit
O
O
F
COOC 2H5
N
H
2
H C O
etoksimetilen
dietilesteri
F
OC H
CH
2
5
Cl
C
COOC 2H5
C2H5I
OH-
Cl
N
C2H5
O
1. NaOH / эsэ
F
COOH
HN
2. H3O+
NH
O
N
Cl
F
C2H5
HN
HN
N
CH3
N
COOH
N
C2H5
NORFLOKSAZЭN
O
F
H3C N
N
COOH
N
C2H5
PERFLOKSAZЭN
O
F
COOH
N
N
R2
HN
R1
CH3
Lomefloksazin
R1= C2H5
R 2= F
1-Etil-6,8-difloro-1,4-dihidro-7-(3-metil-1-piperazinil)-4-oksokinolin-3-karboksilik asit
Gatifloksazin
R 1=H3C
R2= OCH3
1-Siklopropil-6-floro-8-metoksi-1,4-dihidro-7-(3-metil-1-piperazinil)-4-oksokinolin-3-karb
oksilik asit