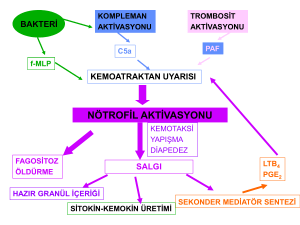
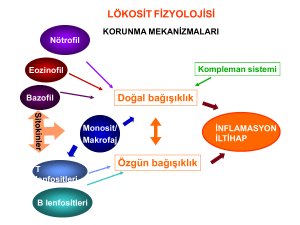
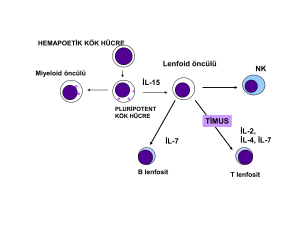
HLA Tiplendirmesinde Yeni Nesil
Dizileme
Dr. Türker DUMAN
MHC
• MHC bölgesi Kr. 6p21’de lokalize olan 4
mega baz yaklaşık 220 gen
• Genomunun en yoğun bölgesidir,
genomun büyüklük olarak yaklaşık %
0.1’ine karşılık gelirken bu bölgedeki
genler tüm genlerin % 0.6’sını oluşturur.
• Bölgedeki genlerin bir çoğu adaptif
immün cevaptan sorumludur, genlerin
yaklaşık %20’ si immünite ile ilişkilidir
• Human lökosit antijeni (HLA), bu genetik
bölgenin çekirdekli hücrelerin yüzeyinde
eksprese olan ve alloreaktiviteden
sorumlu hücre yüzey glikoproteinlerini
kodlayan bölümüdür.
• HLA genleri genomun en polimorfik
genleri
• MHC bölgesinde bulunan genler
• HLA genlerinin doku ve organ
transplantasyonunda önemli bilinmektedir
• Transplantasyonda doku reddi immün sistemin
yabancı antijene karşı normal bir yanıtıdır.
HLA Tiplendirmesi
• HLA Tiplendirmesindeki amaç bu alellerin ve kodladıkları
antijenlerin belirlenmesidir.
• HLA bölgesindeki polimorfizmleri belirlemek için çeşitli
yöntemler kullanılmıştır.
• Terasaki ve Mc Clelland tarafından bulunan hücresel
temelli serolojik yöntemler yaklaşık 50 yıldır
kullanılmaktadır
– bu yöntemlerin çeşitli teknik dezavantajları ve bu olağanüstü
çeşitliliği karşılamada yetersiz kalmaktadır
• Son 30 yılda rekombinant DNA teknolojisi, Sanger zincir
sonlanma dizileme yöntemi, Polimeraz zincir reaksiyonu
(PCR) gibi moleküler genetik yöntemlerin kullanılmasıyla
bu sıra dışı alelik çeşitlilik ortaya konulabilmiştir
• Sınıf I zar içinde sabitlenmiş bir ağır zincir ve beta-2-mikroglobulin
oluşan heterodimerdir. Ağır zincirde 2 ve 3. ex sınıf I moleküllerinde
peptid bağlama özgünlüğü sorumludur.
• Sınıf II molekülleri, Alfa ve Beta zincirlerinden oluşan bir
heterodimerdir. DR Beta zinciri peptide bağlanma özgüllüğünü veren
polimorfizmileri içerir. pp zincirin birinci domaini kodlayan 2. ekzon
alel farklılıklarının büyük kısmından sorumludur. HLA klas II
tiplendirmesinde 2. ekzona odaklanmıştır
Moleküler Yöntemler
• Yaygın
• DNA temellidir
• Serolojik olarak ayırt edilemeyen fakat fonksiyonel
olarak ayrı olan HLA alellerini tiplendirmek için
geliştirilmiştir.
• 1987 yılında Southern Blot ve RFLP yöntemiyle
başlamıştır
• PCR yönteminden sonra giderek yaygınlaşmıştır
• PCR-SSP
• PCR-SSO
• PCR-SBT
– Sanger sekanslama en yüksek çözünürlük sunar ve referans
yöntem olarak kabul edilir.
Sanger Dizileme
• Doğruluk ve uzun okuma aralığı (800-1000)
yaklaşık 30 yıldır genotiplendirme için altın
standart olarak kabul edilmektedir.
• Yüksek maliyet, düşük verimlilik, yüksek iş
gücü özellikle büyük bölgelerin
sekanslamasında sıkıntı yaratmaktadır.
HLA tiplendirmesinde Sanger
• HLA bölgesindeki
polimorfizm yüzdesi yüksek
çözünürlükteki tiplendirmeyi
zorlaştırmaktadır.
• Tiplendirme de belirsizlik
(ambiquity)
• Polimorfik bölgelerdeki
nükleotidlerin cis- trans pozisyonu
• amplifiye edilen bölge dışındaki
polimorfizmlerden
kaynaklanmaktadır
Yeni Nesil Dizileme (NGS)
• Sanger yönteminin kısıtlamaları daha ucuz ve
hızlı sekans teknolojilerine olan ihtiyacı
arttırmıştır
• Bu ihtiyaç yeni nesil dizileme yöntemlerinin
doğmasına yol açmıştır
• NGS platformları yüksek hacimde paralel
dizileme yaparak milyonlarca DNA fragmentini
eş zamanlı bir şekilde sekanslar. Bu sayede tüm
genomun bir günden kısa sürede
sekanslanması mümkündür.
HLA tiplendirmesinde NGS
NGS intronların da dahil olmak üzere büyük
bölgeleri
• Uygun maliyet
• Uygulama kolaylığı
• Hızlı dizileme
HLA için
– klonal amplifikasyon yaparak cis-trans pozisyon
bilgisini vermesiyle HLA tiplendirmesinde
avantajlar sağlamaktadır
NGS
• Farklı NGS platfomları geliştirilmiştir. Sekanslama
aşaması için günümüzde yaygın olarak kullanılan
platformlardan öne çıkan bazıları
– Roche 454
– İllumina Miseq
– İon-torrent
Pirosekanslama
• İlk yüksek verimli (high-throughput) sekanslama
teknolojisi, Roche firması tarafından 2005 yılında
piyasaya sürülen 454 prosequencing cihazıdır
(Margulieset 2005).
• Bu cihaz pirosekanslama tekniği denilen bir yöntem
ile çalışmaktadır.
• Pirosekanslama “sentezleyerek sekanslama”
prensibine dayanmaktadır. Sanger sekanslamadan
farkı, dideoksinükleotid ile zincir sonlanma tekniği
yerine nükleotid birleşmesi sonucunda salınan
pirofosfatın belirlenmesine dayanmasıdır.
•
•
•
•
•
•
•
•
DNA küçük fragmanlara ayrılır ve dizileme primerlerini taşıyan adaptörler eklenir.
Adaptörleri taşıyan DNA fragmanları mikroreaktörler içerisinde emülsiyon bazlı klonal amplifikasyon
Ardışık olarak akan nükleotitlerinin tamamlayıcı nükleotidin DNA ya bağlanması polimeraz pirofosfat (PPi) açığa
çıkmasını sağlar.
ATP sülfirilaz PPi'ı kantitatif olarak ATP'ye dönüştürür
ATP, lüsiferaz enzimi aracılığıyla lusiferinin oksilusiferine dönüşmesini sağlar. Oksilusiferin görülebilir bir ışık yaratır
Bu ışığın şiddeti ATP miktarıyla doğru orantılıdır ve bu sayede tek nükleotid tekrarları tespit edilir.
Bu ışığı yaratan kemilüminesan sinyalin hangi nükleotidin bağlanması sırasında oluştuğu tespit edilir.
Ortaya çıkan bu ışık CCD kamera tarafından kaydedilir
• Roche 454 genotiplendirmede kullanılan ilk
yeni nesil sekanstır
• Fakat sangere göre maliyet ve verim açısından
çok fazla bir ilerleme değildir.
• Daha kısa okuma uzunluğuna sahip NGS
platformlarında 454 e göre daha düşük
maliyet ve daha yüksek veri avantajı vardır.
ILLUMİNA
• Illumina platformu polimeraz temelli sentezleyerek sekanslama ve köprü
amplifikasyonu yöntemini kullanmaktadır.
• Illumina® firması tarafından piyasaya sürülen ilk cihaz Genome
Analyzer’dır. Daha sonra yüksek kapasiteli HiSeq ve ticari laboratuvarlar
için MiSeq cihazları da aynı firma tarafından piyasaya sürülmüştür.
• Illumina NGS Sistemi HLA dışı uygulmalarda kullanılan en yaygın NGS
platformudur. *
• Bu cihazlar da adaptör bağlanmış DNA kütüphanelerine ihtiyaç
duymaktadır, sekanslanacak bölgeler adaptörler yardımı ile
çoğaltılmaktadır.
• Reaksiyon, yüzeyinde oligonükleotidlerin bulunduğu “flow cell” adı verilen
özel aparatlarda gerçekleşmektedir.
• Teknik üç temel aşama içermektedir. Bunlar; hedef bölgelerin seçimi
(capture), seçilen bu bölgelerin sekanslaması ve veri analizidir
*Liu L et al. J Biomed Biotechnol 2012:2012:251364
Ion-Torrent
• DNA'nın polimerizasyonu sırasında ortaya çıkan Hidrojen
iyonlarının saptanmasına dayanır.
• Tek bir Kalıp DNA dizisini içeren mikrokuyuya tek tip
nükleotid akışı uygulanır.
• Verilen nükleotid kalıp ipliğe komplementer olduğu
durumda yeni oluşan ipliğin yapısına katılır ve hidrojen
iyonu salınımı olur.
• Hidrojen iyonlan hipersensitif iyon sensorleri tarafından
algılanır.
• Kalıp DNA'da nükleotid tekrarlarının varlığı durumunda tek
siklusta birden fazla nükleotid yeni ipliğin yapısına girer,
salınan hidrojen iyonları artar ve daha fazla elektronik sinyal
elde edilmesiyle DNA dizisi belirlenir
NGS ve Sanger temelli dizilemede çözünürlüğün
karşılaştırılması
-Lange et al. BMC Genomics 2014,15:63
Veri Analizi
• Kısa okuma uzunluklarına sahip Roche, Illumina, Iontorrent NGS platformlarının tek bir DNA küçük parçalara
ayrılarak sekanslanmaktadır
• Bu küçük baz dizileri daha sonra bilinen bir referans
genom kullanılarak yada bilinen HLA alellerinin verileri
ile kıyaslanarak birleştirilmektedir
• Elde edilen sekansların kalitesini belirleyebilmek için
doğru bir DNA referansı gereklidir
• HLA bölgesinin hiper polimorfik doğası polimorfizmleri
doğru sıralanabilmeleri için zorluk oluşturabilmektedir
HLA Database
• HLA veri bankası bugüne kadar HLA nın daha polimorfik
bölgelerine odaklanmıştır.
• NGS yaygınlaştıkça ve dizileme bölgeleri genişledikçe
veribankasına yeni alellerin girişi artacaktır
• 2010 yılında güncellenen HLA numenkülatorü yeni
bölgelerden gelebilecek dizi bombardımanını karşılamaya
uygun
• Bu güne kadar tecrübeler sınıf1 için ex 2,3 ve sınıf 2 için
ex2 bölgelerine dayanan HLA uyum algoritmaları üzerinde
büyük bir etkisi olmayacağını düşündürmektedir
• Sekans verilerindeki artışla beraber klasik ex lar dışındaki
polimorfizmlerin etkilerinin klinik olarak araştırılmasını
gerektirmektedir.