Atomun Yapısı - WordPress.com
advertisement

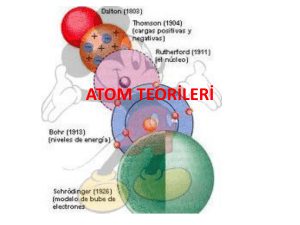
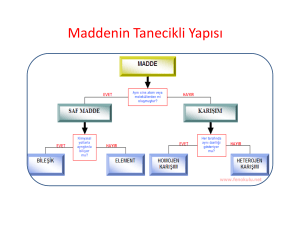
Atomun Yapısı Atom • Atomu oluşturan parçacıklar farklı yüklere sahiptir. Farklı yüklere sahip bu parçacıklar birbirini etkileyerek bir arada bulunur ve atomu oluşturur. Atomda bulunan yükler negatif ve pozitif yük olarak adlandırılır. Negatif yük elektronun, pozitif yük ise protonun yükünü temsil etmektedir. Atom • Atomu oluşturan bu parçacıklar farklı konumlarda bulunurlar. Nötron ve protonlar atomun merkezinde bulunur. Nötron ve protonların bulunduğu bu kısım çekirdek olarak adlandırılır. Proton, Nötron, Elektron • Her atomun farklı sayılarda elektron, proton ve nötronu bulunur. • Belirli sayılarda proton, nötron ve elektronlar farklı konumlarda bir arada bulunarak atomları oluşturur. Elektron • Atomun bir alt parçacığı olan elektronlar çekirdeğin etrafında sabit bir yerde durmaz. Elektronların hareketini,Lunapark’taki ahtapotun yaptığı dönme hareketine benzetebiliriz. Elektron • Elektronlar çekirdekten belirli uzaklıklarda hem kendi etraflarında hem de çekirdeğin etrafında çok hızlı hareket eder. Bu sebeple elektronlar çekirdeğe düşmezler,çekirdek tarafından çekildikleri için de dışarı fırlamazlar. Nötr Atom • Elementlere ait atomların proton ve elektron sayıları birbirine eşit olduğu için atomlar nötr yapıdadır. Atomun nötr olması atomda bulunan negatif yüklerin sayısını pozitif yüklerin sayısına eşit olması demektir.. ATOM MODELLERİ • Atom gözle veya en gelişmiş elektron mikroskopları ile bile görülemez. Maddenin kütlesi olduğu halde maddeyi oluşturan atomların tek tek kütleleri ölçülemez ve atomlar duyu organları tarafından algılanamaz. . a) Democritus Atom Modeli (Democritus–M.Ö. 400) : • Atom hakkında Democritus, Dalton, Thomson, Rutherford ve Bohr isimli bilim adamları ve filozoflar görüşlerini ortaya koymuşlar ve günümüzdeki atom modeli ortaya çıkmıştır.. b) Dalton Atom Modeli (John Dalton 1766–1844) : • Maddenin en küçük yapı taşı atomdur. (Maddeler çok küçük, bölünemez, yok edilemez taneciklerden oluşur.) Dalton Atom Modeli • Atom parçalanamaz. • Atom içi dolu küre şeklindedir. • Bütün maddeler farklı tür atomlardan oluşmuştur. Dalton Atom Modeli • Maddelerin birbirlerinden farklı olmasının nedeni maddeyi oluşturan atomların farklı özellikte olmasıdır. • Bir maddeyi oluşturan atomların tamamı birbirleriyle aynı özelliklere sahiptir. c) Thomson Atom Modeli (John Joseph Thomson 1856–1940) : Thomson atom modeli bir karpuza ya da üzümlü keke benzer. Thomson’ a göre; • Atomda (+) ve (–) yüklü tanecikler bulunur. c) Thomson Atom Modeli (John Joseph Thomson 1856–1940) : • Thomson’a göre atom; dışı tamamen pozitif yüklü bir küre olup negatif yüklü olan elektronlar kek içerisindeki gömülü üzümler gibi bu küre içerisine gömülmüş haldedir. d) Rutherford Atom Modeli (Ernest Rutherford 1871–1937) : • Atom kütlesinin tamamına yakını merkezde toplanır, bu merkeze çekirdek denir. • Atomdaki pozitif yüklere proton denir. d) Rutherford Atom Modeli (Ernest Rutherford 1871–1937) : • Elektronlar çekirdek etrafında gezegenlerin Güneş etrafında dolandığı gibi dairesel yörüngelerde sürekli dolanırlar. Çekirdekle elektronlar arasında çekim kuvveti olduğu için elektronların çekirdeğe düşmemeleri için dolanmaları gerekir. d) Rutherford Atom Modeli (Ernest Rutherford 1871–1937) : • Çekirdekteki protonların sayısı (yük miktarı) bir maddenin bütün atomlarında aynı, fakat farklı maddenin atomlarında farklıdır. e) Bohr Atom Modeli (Niels David Bohr 1875–1962) : ; • Elektronlar çekirdek etrafında belirli uzaklıklardaki katmanlarda dönerler, rasgele dolanmazlar. e) Bohr Atom Modeli (Niels David Bohr 1875–1962) : • (Yüksek enerji düzeyinde bulunan elektron, düşük enerji düzeyine geçerse fotonlar halinde ışık yayarlar). • (Kararlı hallerin tamamında elektronlar çekirdek etrafında dairesel yörünge izlerler). f) Modern Atom Teorisi • Günümüzde kullanılan atom modeli, modern atom teorisi sonucu ortaya konmuştur. Bu teoriye göre elektronlar çok hızlı hareket ettikleri için belirli bir yerleri yoktur. Yani elektronların bulunduğu kabuk kavramı yanlış bir kavramdır. Elektron Bulutu Elektronların sadece bulunma ihtimalinin olduğu bölgeler bilinebilir ve elektronların bulunma ihtimalinin olduğu bölgelere elektron bulutu denir.