Maddenin Tanecikli Yapısı
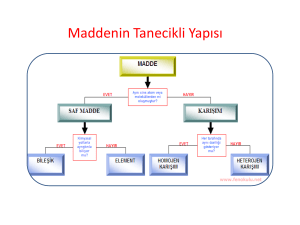
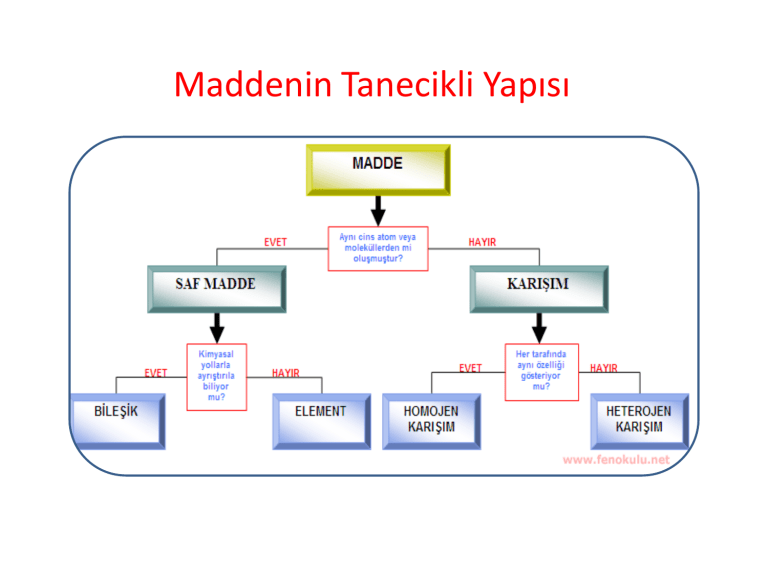
Maddenin Tanımı
• Kütlesi olan ve boşlukta yer kaplayan her şeye madde denir.
Cisim nedir?
• Maddenin şekil almış halidir.
Maddenin Halleri
Maddeler doğada 3 halde bulunur:
– Katı maddeler
– Sıvı maddeler
– Gaz maddeler
Katı Maddeler
• Belirli bir şekli olan, sıkıştırılamayan fakat genleşebilen
maddelere katı madde denir.
• Katı maddenin tanecikleri hareketsizdir.
Sıvı Maddeler
• Belirli bir şekli olmayan fakat bulunduğu kabın şeklini alan
sıkıştırılamayan ama genleşebilen akışkan maddelere sıvı
maddeler denir.
Gaz Maddeler
• Belirli bir şekli olmayan fakat bulunduğu kabın şeklini alan
sıkıştırılabilen ve genleşebilen uçucu maddelere gaz maddeler
denir. Gaz maddeler kapalı kaplarda bulundurulmalıdırlar.
Maddenin Plazma Hali
• Maddeler çok düşük veya çok yüksek sıcaklıklarda plazma
halinde olabilir. Bu hal maddenin 4. hali olarak adlandırılabilir.
Elektrik kıvılcımları, lavlar, alev, ateş ve yıldızlar plazmaya
örnek verilebilir.
Maddelerin Sıkışma Özelliği
• Tanecikleri arasında boşluk olan maddeler kuvvet etkisi ile
sıkıştırılabilir. Bu maddeler ise sadece gaz maddeleridir.
Maddelerin Genleşme Özelliği
• Katı, Sıvı ve Gaz taneciklerinin sıcaklık arttıkça hareketleri
hızlanır. Bu durumda kapladıkları yer artar.
• Genleşme ile termometre, uçan balon gibi aletler yapılmıştır.
Maddelerin Özellikleri
Madenin Hal Değişimi
Maddenin En Küçük Birimi
Maddenin en küçük yapı birimine atom denir.
Atom küre şeklindedir ve elektrikli yapıya sahiptir.
Atom, kelime anlamı olarak bölünemez, parçalanamaz
anlamındadır.
Atomlar ancak elektron mikroskobuyla görülebilirler.
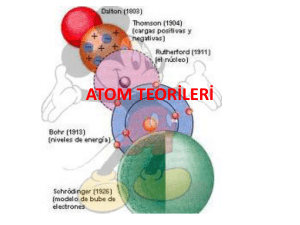
Atomun Tarihçesi
Atom hakkında Democritus, Dalton, Thomson, Rutherford,
Bohr ve De Broglie isimli bilim adamları ve filozoflar
görüşlerini ortaya koymuşlar ve günümüzdeki atom modeli
ortaya çıkmıştır.
Democritus Atom Teorisi :
• Atom hakkında ilk görüş M.Ö. 400’lü yıllarda Yunanlı filozof
Democritus tarafından ortaya konmuştur. Democritus,
maddenin taneciklerden oluştuğunu savunmuş ve bu
taneciklere atom adını vermiştir. Democritus, atom hakkındaki
görüşlerini deneylere göre değil varsayımlara göre söylemiştir.
Democritus Atom Teorisi :
• Democritus’ a göre;
Madde parçalara ayrıldığında en sonunda bölünemeyen bir
tanecik elde edilir ve bu tanecik atomdur.
Bütün maddeler aynı tür atomlardan oluşur.
Maddelerin farklı olmasının nedeni maddeyi oluşturan
atomların sayı ve dizilişi biçiminin farklı olmasıdır.
Atom görülemez.
Atom görülemediği için bölünemez.
John Dalton :
• Atom hakkında ilk bilimsel görüş 1803 – 1808 yılları arasında
İngiliz bilim adamı John Dalton tarafından ortaya atılmıştır.
John Dalton
Dalton’un Atom Modeli
John Dalton :
• Dalton’ a göre;
Maddenin en küçük yapı taşı atomdur. (Maddeler çok
küçük, bölünemez, yok edilemez taneciklerden oluşur.)
Atomlar parçalanamaz.
Atom içi dolu küre şeklindedir.
Bütün maddeler farklı tür atomlardan oluşmuştur.
Maddelerin birbirlerinden farklı olmasının nedeni maddeyi
oluşturan atomların farklı özellikte olmasıdır.
Bir maddeyi oluşturan atomların tamamı birbirleriyle aynı
özelliklere sahiptir.
John Joseph Thomson :
• Atomun yapısı hakkında ilk model 1898 yılında Thomson
tarafından ortaya konmuştur. Thomson atom modeli bir
karpuza yada üzümlü keke benzer.
• Thomson’ a göre;
– Atom küre şeklindedir. (Çapı 10–8 cm)
– Atomda (+) ve (–) yüklü tanecikler bulunur.
– Thomson’a göre atom; dışı tamamen pozitif yüklü bir küre
olup negatif yüklü olan elektronlar kek içerisindeki gömülü
üzümler gibi bu küre içerisine gömülmüş haldedir.
Ernest Rutherford:
Atomun çekirdeğini ve çekirdekle ilgili birçok özelliğin ilk defa
keşfeden bir bilim adamıdır.
– Elektronlar çekirdek etrafında dairesel yörüngelerde sürekli
dolanırlar.
– Elektronların bulunduğu hacim çekirdeğin hacminden çok
büyüktür.
– Çekirdekteki yük sayısı, elektron sayısına eşittir.
Niels David Bohr :
Bohr atom teorisi hidrojenin yayınma spektrumuna
dayanılarak açıklanır. Bohr’ a göre;
– Elektronlar çekirdek etrafında belirli enerjiye karşılık gelen
belirli uzaklıklarda bulunur.
– Yüksek enerji düzeyinde bulunan elektron, düşük enerji
düzeyine geçerse fotonlar halinde ışık yayarlar.
– Kararlı hallerin tamamında elektronlar çekirdek etrafında
dairesel yörünge izlerler.
Modern Atom Modeli:
Atomda belirli bir enerji düzeyi vardır. Elektron ancak bu
düzeyden birinde bulunabilir .
– Elektron bir enerji düzeyindeki hareketi sırasında çevreye
ışık yaymazlar.
– Atoma iki düzey arasındaki fark kadar enerji verilirse
elektron daha yüksek enerji düzeyine geçer.
– Atoma verilen enerji kesilirse elektron enerjili düzeyinde
kalamaz daha düşük enerji düzeyinden birine geçer. Bu
sırada iki düzey arasındaki fark kadar enerjiyi ışık şekline
çevreye verir.