[Pt(bpy)(dicnq)]+2 Kompleksinin Sentezi ve
DNA Etkileşimlerinin Belirlenmesi
Ufuk Yıldız, Burak Çoban, Abdurrahman Şengül
Bülent Ecevit Üniversitesi, Fen Edebiyat Fakültesi, Kimya Bölümü, Zonguldak.
Yarışmalı Floresans Çalışması:
GİRİŞ
Son yıllarda küçük moleküllerin DNA’ya bağlanmalarının incelenmesi çok ilgi çeken bir çalışma
alanı olmuştur. Spesifik DNA hedefli ilaçların sentezi için bu moleküllerin DNA’ya bağlanma
türünü belirlenmesi son derece önemlidir. Moleküller DNA’ya interkalatör, kovalent, boşluk
bağlayıcı ve elektrostatik olarak bağlanabilirler. Cis-platinin DNA etkinliğinin keşfedilmesinden
sonra birçok platin kompleksi sentezlenmiş ve DNA etkileşimleri çalışılmıştır. DICNQ ligandının
Floresans spektroskopisi moleküllerin DNA etkileşimlerinin belirlenmesinde kullanılan diğer bir
önemli metottur. DNA’ya interkalasyon yaptığı kesin olarak bilinen Etidyum bromür (EB)
molekülünün DNA baz çitlerinin arasından itilmesi takip edilerek molekülün DNA’ya interkalasyon
yapıp yapmadığı belirlenebilir.
kobalt, nikel, mangan ve rutenyum kompleksleri yoğun bir şekilde çalışılmış ancak platin
kompleksleri çalışılmamıştır [1, 2, 3].
DNA’ya interkalasyon yoluyla bağlanan moleküller genelde katyonik bir merkeze ihtiyaç duyarlar.
Bu katyonik merkez [Pt(bpy)(dicnq)]2+ (1) kompleksinde platin metali ve bunun yanında
kuaternize aminerle (2) de sağlanabilir. Her iki madde de tamamen düzlemseldir. Bu sayede her iki
kompleksin de DNA baz çiftleri arasına interkalasyon yapması beklenmektedir. Ligantda bulunan
geniş p sistemi, DNA baz çiftlerinin sahip olduğu p sistemi ile örtüşerek bağlanmayı sağlayacaktır.
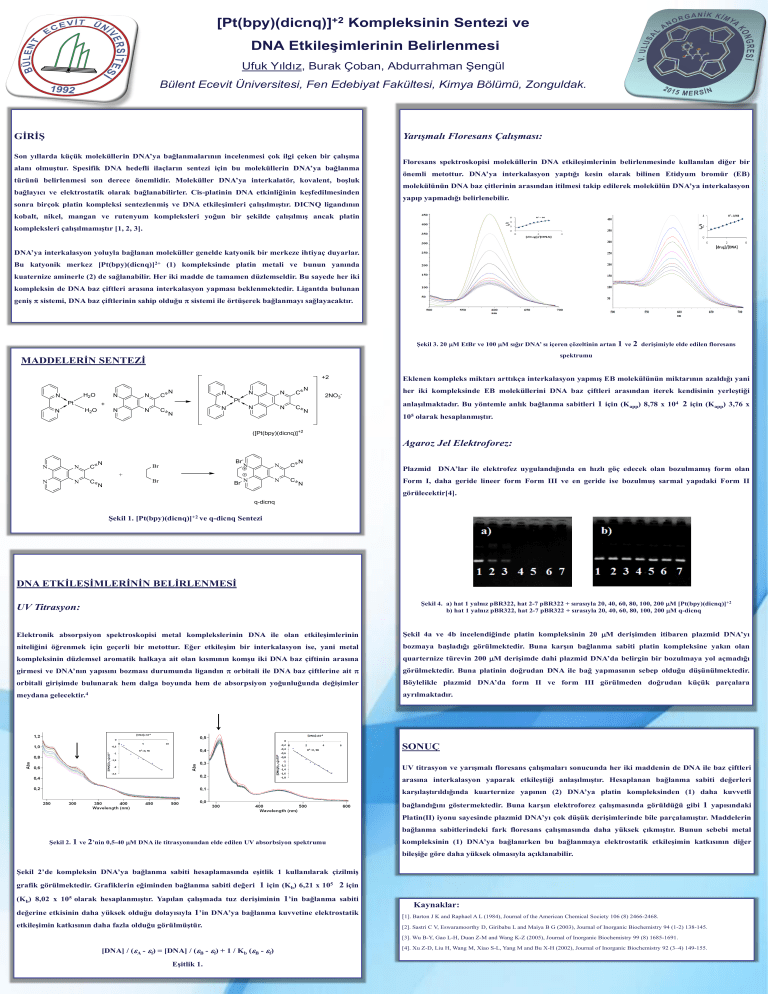
Şekil 3. 20 mM EtBr ve 100 mM sığır DNA’ sı içeren çözeltinin artan 1 ve 2 derişimiyle elde edilen floresans
spektrumu
MADDELERİN SENTEZİ
+2
H2O
N
Pt
N
N
C
N
N
H2O
N
N
C
N
N
C
N
2NO3-
Pt
+
N
N
N
C
N
N
Eklenen kompleks miktarı arttıkça interkalasyon yapmış EB molekülünün miktarının azaldığı yani
her iki kompleksinde EB moleküllerini DNA baz çiftleri arasından iterek kendisinin yerleştiği
anlaşılmaktadır. Bu yöntemle anlık bağlanma sabitleri 1 için (Kapp) 8,78 x 104 2 için (Kapp) 3,76 x
N
105 olarak hesaplanmıştır.
([Pt(bpy)(dicnq)]+2
Agaroz Jel Elektroforez:
N
N
C
N
Br
BrN
N
C
Br
Br-
N
N
C
N
Plazmid DNA’lar ile elektrofez uygulandığında en hızlı göç edecek olan bozulmamış form olan
+
N
N
C
N
N
Form I, daha geride lineer form Form III ve en geride ise bozulmuş sarmal yapıdaki Form II
görülecektir[4].
q-dicnq
Şekil 1. [Pt(bpy)(dicnq)]+2 ve q-dicnq Sentezi
DNA ETKİLEŞİMLERİNİN BELİRLENMESİ
Şekil 4. a) hat 1 yalnız pBR322, hat 2-7 pBR322 + sırasıyla 20, 40, 60, 80, 100, 200 mM [Pt(bpy)(dicnq)]+2
b) hat 1 yalnız pBR322, hat 2-7 pBR322 + sırasıyla 20, 40, 60, 80, 100, 200 mM q-dicnq
UV Titrasyon:
Elektronik absorpsiyon spektroskopisi metal komplekslerinin DNA ile olan etkileşimlerinin
Şekil 4a ve 4b incelendiğinde platin kompleksinin 20 mM derişimden itibaren plazmid DNA’yı
niteliğini öğrenmek için geçerli bir metottur. Eğer etkileşim bir interkalasyon ise, yani metal
bozmaya başladığı görülmektedir. Buna karşın bağlanma sabiti platin kompleksine yakın olan
kompleksinin düzlemsel aromatik halkaya ait olan kısmının komşu iki DNA baz çiftinin arasına
quarternize türevin 200 mM derişimde dahi plazmid DNA’da belirgin bir bozulmaya yol açmadığı
girmesi ve DNA’nın yapısını bozması durumunda ligandın p orbitali ile DNA baz çiftlerine ait p
görülmektedir. Buna platinin doğrudan DNA ile bağ yapmasının sebep olduğu düşünülmektedir.
orbitali girişimde bulunarak hem dalga boyunda hem de absorpsiyon yoğunluğunda değişimler
Böylelikle plazmid DNA’da form II ve form III görülmeden doğrudan küçük parçalara
meydana gelecektir.4
ayrılmaktadır.
SONUÇ
UV titrasyon ve yarışmalı floresans çalışmaları sonucunda her iki maddenin de DNA ile baz çiftleri
arasına interkalasyon yaparak etkileştiği anlaşılmıştır. Hesaplanan bağlanma sabiti değerleri
karşılaştırıldığında kuarternize yapının (2) DNA’ya platin kompleksinden (1) daha kuvvetli
bağlandığını göstermektedir. Buna karşın elektroforez çalışmasında görüldüğü gibi 1 yapısındaki
Platin(II) iyonu sayesinde plazmid DNA’yı çok düşük derişimlerinde bile parçalamıştır. Maddelerin
bağlanma sabitlerindeki fark floresans çalışmasında daha yüksek çıkmıştır. Bunun sebebi metal
Şekil 2. 1 ve 2’nin 0,5-40 mM DNA ile titrasyonundan elde edilen UV absorbsiyon spektrumu
kompleksinin (1) DNA’ya bağlanırken bu bağlanmaya elektrostatik etkileşimin katkısının diğer
bileşiğe göre daha yüksek olmasıyla açıklanabilir.
Şekil 2’de kompleksin DNA’ya bağlanma sabiti hesaplamasında eşitlik 1 kullanılarak çizilmiş
grafik görülmektedir. Grafiklerin eğiminden bağlanma sabiti değeri 1 için (Kb) 6,21 x 105 2 için
(Kb) 8,02 x 105 olarak hesaplanmıştır. Yapılan çalışmada tuz derişiminin 1’in bağlanma sabiti
değerine etkisinin daha yüksek olduğu dolayısıyla 1’in DNA’ya bağlanma kuvvetine elektrostatik
etkileşimin katkısının daha fazla olduğu görülmüştür.
Kaynaklar:
[1]. Barton J K and Raphael A L (1984), Journal of the American Chemical Society 106 (8) 2466-2468.
[2]. Sastri C V, Eswaramoorthy D, Giribabu L and Maiya B G (2003), Journal of Inorganic Biochemistry 94 (1-2) 138-145.
[3]. Wu B-Y, Gao L-H, Duan Z-M and Wang K-Z (2005), Journal of Inorganic Biochemistry 99 (8) 1685-1691.
[DNA] / (eA - ef) = [DNA] / (eB - ef) + 1 / Kb (eB - ef)
Eşitlik 1.
[4]. Xu Z-D, Liu H, Wang M, Xiao S-L, Yang M and Bu X-H (2002), Journal of Inorganic Biochemistry 92 (3–4) 149-155.