T.C.
SAĞLIK BAKANLIĞI
HASEKİ EĞİTİM ve ARAŞTIRMA HASTANESİ
BİYOKİMYA VE KLİNİK BİYOKİMYA LABORATUVARI
ŞEF : Uzm. Dr. NEZAKET EREN
SAĞLIKLI GEBELERDE ADENOZİN
DEAMİNAZ VE İZOENZİMLERİ’NİN
DEĞERLENDİRİLMESİ
Tıbbi Biyokimya Uzmanlık Tezi
Göksel BAHADIR
İSTANBUL
2009
ÖNSÖZ
Uzmanlık eğitimi gördüğüm S.B.Haseki Eğitim ve Araştırma Hastanesi’nin
Başhekimi Sayın Op. Dr. Haldun ERTÜRK’e, asistanlık eğitimimde bilgi ve katkılarıyla
yardımcı olan ve tez çalışmamın her aşamasında bilgi ve birikimi ile yol gösteren sayın
hocalarım S.B.Şişli Etfal Eğitim ve Araştırma Hastanesi Biyokimya Laboratuvarı Şefi Uzman
Dr .Nezaket EREN’e ve S.B.Haseki Eğitim ve Araştırma Hastanesi Biyokimya Laboratuvarı
Şef Yardımcısı Uzman Dr. Macit KOLDAŞ’a şükranlarımı sunarım.
Tez
çalışmamda
DÖVENTAŞ’a,
uzmanlık
yardımlarından
eğitimim
dolayı
süresince
Uzm.
yardım
Dr.
ve
Yasemin
ERDOĞAN
desteklerinden
ötürü
laboratuvarımızda görevli tüm uzman doktorlarımıza teşekkürlerimi sunarım.
Tez çalışmamda yardımlarından ötürü As. Dr. Rana TURKAL ve As. Hümeyra
ÖZTÜRK’e teşekkürlerimi sunarım.
Uzmanlık eğitimim süresince birlikte çalışmaktan mutluluk duyduğum tüm asistan
arkadaşlarıma ve laboratuvar çalışanlarına teşekkürlerimi sunarım.
Tez çalışmamda bana verdikleri yardım ve destekten dolayı Yedikule Göğüs
Hastalıkları ve Göğüs Cerrahisi Eğitim ve Araştırma Hastanesi Biyokimya Laboratuvarından
Uzm. Dr. Emine DUMAN ALTINKAYNAK’a teşekkürlerimi sunarım.
Bugüne kadar bana her türlü desteği gösteren sevgili aileme ve eşime sonsuz
teşekkürlerimi sunarım.
As. Göksel BAHADIR
İÇİNDEKİLER
1. GİRİŞ VE AMAÇ……………………………………………….....
1
2. GENEL BİLGİLER………………………………………………...
2
2.1. İmmün Sistemin Genel Özellileri………………………...............
2
2.1.1. İmmün Yanıtın Başlıca Özellikleri…………………......
6
2.1.2. İmmün Sistem Hücreleri………………………………..
9
2.1.3. İmmünoglobulinler ve Özellikleri……………………….
14
2.1.3.1. İmmünoglobulin Çeşitleri……………………..
14
2.1.4. Majör Histokompatibilite Kompleksi……………………
16
2.1.5. Sitokinlerin Özellikleri…………………………………..
17
2.1.6. Gebelik İmmünitesi………………………………………
18
2.1.6.1. Allograft Olarak Fetus………………………….
18
2.1.6.2. Gebelerde İmmün Sistem………………………
21
2.2. Adenozin Deaminaz (ADA)…………………………………….....
23
2.2.1. ADA’nın Yapısı……………………………………….....
23
2.2.2. ADA’nın Genel Özellikleri ve Fizyolojik Rolleri………...
24
2.2.3. ADA’nın Enzimatik Aktivitesi ve Adenozinin Etkileri......
27
2.2.3.1. Adenozin Reseptörleri………………………......
28
2.2.4. Ekto-ADA…………………………………………………
29
2.2.4.1. Ekto-ADA’nın CD26 ile Bağlanması……………
30
2.2.4.2 Ekto-ADA’nın İmmün Sistem Gelişimindeki Rolü
30
2.2.5. ADA İzoenzimleri………………………………………….
31
2.3. Gebelikte İmmün Sistem ve ADA İlişkisi……………………………
33
3. GEREÇ VE YÖNTEMLER……………………………………………
35
3.1. Gereçler………………………………………………………………
35
3.1.1. Çalışma ve Kontrol Grupları……………………………….
35
3.1.2. Kan Örnekleri………………………………………………
36
3.2. Ölçüm Metodları…………………………………………………….
36
3.2.1. Kullanılan Cihazlar…………………………………………..
36
3.2.2.Prenatal Tarama Testlerinde Kullanılan Serum Belirteçlerinin Ölçüm
Yöntemi…………………………………………………………….
36
3.2.3. Serum ADA ve İzoenzimlerinin Ölçüm Yöntemleri………...
37
3.3. İstatistiksel Analiz…………………………………………….
39
4. BULGULAR…………………………………………………………..
40
4.1. Çalışma ve Kontrol Grubunda Ölçülen Parametreler………..
40
4.2. Grupların Karşılaştırılması…………………………………..
44
4.3. Korelasyon Analizleri………………………………………..
45
5. TARTIŞMA VE SONUÇ……………………………………………...
52
6. ÖZET…………………………………………………………………..
57
7. SUMMARY……………………………………………………………
59
8. KAYNAKLAR…………………………………………………………
61
KISALTMALAR
ADA
: Adenozin Deaminaz
ADP
: Adenozin difosfat
AFP
: Alfa-fetoprotein
ASH
: Antijen Sunan Hücre
Asp
: Aspartat
CRP
: C-Reaktif Protein
Cys
: Sistein
E. coli
: Escherichia coli
EHNA : Erythro-9(2-hydroxy-3-nonyl) adenine
FE3
: Free Estriol
Gly
: Glisin
hCG
: Human Chorionic Gonadotropin
His
: Histidin
HLA
: İnsan Lökosit Antijeni
IFN
: İnterferon
Ig
: İmmünoglobülin
IL
: İnterlökin
KIR
: Killer Inhibitory Receptor
LIF
: Lösemi İnhibitör Faktör
MHC
: Majör Histokompatibilite Kompleks
NK
: Natural Killer (Doğal Öldürücü Hücre)
PAPP-A : Pregnancy-associated plasma protein-A
PGE2
: Prostoglandin E2
SCID
: Severe Combined Immunodeficiency Disease
SLE
: Sistemik lupus eritematozus
Tc (CTL): Sitotoksik T lenfositler
TGF-β
: Transforming Growth Factor-β
Th
: T helper Hücre (yardımcı T lenfosit)
THR
: T Hücre Reseptörü
TNF
: Tümör Nekrozis Faktör
1.GİRİŞ VE AMAÇ
Adenozin Deaminaz (ADA) lenfoid hücrelerin proliferasyon, olgunlaşma ve
fonksiyonu için gerekli olan bir pürin metabolizma enzimidir. Serum ADA aktivitesi hücre
aracılı immün yanıta neden olan hastalıklarda değişmektedir. Bundan dolayı ADA hücresel
immünitenin bir göstergesi olarak değerlendirilebilir. Lenfosit ve monosit-makrofaj hücre
sistemi serum ADA aktivitesindeki değişikliklere katkıda bulunmaktadır (1, 2).
Gebelik immün sistemdeki değişikliklere eşlik eden, annenin immün sisteminin baba
kaynaklı Majör Histokompatibilite Kompleksi (MHC) antijenlerini tolere etmek zorunda
olduğu ve mikroorganizmalara karşı savunmada normal immün yeterliliğin sağlandığı
immünolojik olarak bir denge durumdur. Anne ile fetus arasındaki immünolojik ilişki çift
yönlü bir iletişimdir. Bu iletişim bir taraftan fetal antijen sunumu, diğer taraftan maternal
immün sistem tarafından bu antijenlerin tanınması ve bu antijenlere reaksiyon gösterilmesi
olarak tanımlanabilir (3, 4, 5).
Gebelikte hücre aracılı immünite baskılanmıştır. Gebelikte T helper 1 (Th1) cevabı
fetus için zararlı olabileceğinden, Th1/Th2 dengesi Th2 baskınlığına kayar ve fetus ve
plasentayı rejeksiyondan koruyarak, normal gebeliğin devamlılığına yardımcı olur. Yani
normal gebelik humoral immünitenin arttığı, baskılanmış hücresel immünite ile karakterize
bir durumdur. Adenozin deaminaz da hücre-aracılı immünitenin bir göstergesi olduğundan
normal gebelikte serum ADA aktivitesi azalmaktadır (1, 6, 2).
Bu çalışmanın amacı; sağlıklı gebe kadınlarda ADA ve ADA izoenzim (ADA-1 ve
ADA-2) aktivitelerinin sağlıklı gebe olmayan kadın grubu ile karşılaştırmalı olarak
araştırılmasıdır. Ayrıca bu çalışmada, Prenatal tarama testleri (2’li ve 3’lü testler)
uygulanarak hesaplanan riskler ile ADA, ADA-1 ve ADA-2 arasındaki ilişkiyi
değerlendirmeyi amaçladık.
1
2.GENEL BİLGİLER
2.1. İMMÜN SİSTEMİN GENEL ÖZELLİKLERİ
İmmünite, organizmanın başta mikroorganizmalar olmak üzere her türlü yabancı
maddeye karşı verdiği yanıtı tanımlamak üzere kullanılır. İmmüniteden sorumlu hücre ve
moleküller "İMMÜN SİSTEM"i oluşturur. Yabancı madde ile karşılaşıldığında immün
sistemin değişik kompartmanlarının karşılıklı ve düzenli etkileşimleriyle ortaya çıkan cevaba
İMMÜN YANIT, immün yanıta yol açan yabancı maddelere de İMMÜNOJEN denir.
ANTİJEN ise lenfositler üzerinde bulunan T ve B hücre reseptörlerince tanınan moleküllere
verilen isimdir. İmmünojen ve antijen sıklıkla birbirlerinin yerine kullanılmakla beraber
aralarında hafif bir anlam farklılığı vardır, immünojen bir immün yanıt uyandırabilen
antijenlere verilen isimdir. Antijen terimi ağırlıklı olarak bir molekülün spesifik immünitenin
ürünleri ile reaksiyona girebilme yeteneğini tanımlar. Ufak, immünojenik olmayan antijenlere
HAPTEN denir. Haptenlerin immün yanıt uyandırabilmesi için "taşıyıcı (carrier)" denilen
daha büyük immünojenik moleküllere bağlanması gerekir. Bir yabancı ajan ne kadar
kompleks ise o kadar immünojeniktir. Antijenler ufak kimyasal yapılar olabildikleri gibi ileri
derecede karmaşık moleküller de olabilirler. İmmünojenler çoğunlukla protein (lipoprotein,
glikoprotein, nükleoprotein gibi) yapıdadır. Bağlandıkları antijenleri daha immünojenik hale
getiren ve antijenspesifik immüniteyi non-spesifik olarak daha da arttıran maddelere Adjuvan
denir (7, 8). Geleneksel olarak immün sistem farklı fonksiyonlara sahip 2 kompartmana
ayrılarak incelenir:
1. Doğal İmmünite (innat ya da nativ immünite olarak da isimlendirilir)
2. Spesifik İmmünite (akkiz =kazanılmış ya da adaptif immünite olarak da bilinir)
Doğal İmmunite: Bireyi, potansiyel olarak tehlikeli ajanlardan koruyan ve çoğu bu
ajanlarla karşılaşmadan önce de organizmada zaten bulunan koruyucu mekanizmalar doğal
immüniteyi oluşturur. Doğal immünite elemanları mikroorganizmalara karşı ilk basamak
savunmayı yaparlar ve bazı hallerde mikroorganizmanın ortadan kaldırılmasında tek başlarına
yeterli olabilirler. Deri ve müköz membranların oluşturduğu fiziksel engel, epitelyum
yüzeylerdeki antimikrobiyal maddeler (ör, defensinler, kriptosidinler), kan ve dokulardaki
fagositik hücreler (makrofajlar, nötrofiller), doğal öldürücü hücreler (naturel killer, NK),
2
ayrıca akut faz proteinleri (Ör, C-reaktif protein, CRP) ve kompleman sistemi gibi bazı
plazma proteinleri doğal immünitenin başlıca elemanlarını oluşturur. Bunlar aynı yabancı
madde ile her karşılaştıklarında aynı şiddet ve hızda etki gösterirler. Benzer
mikroorganizmaların iyi korunmuş ortak bazı yapıları ile uyarılırlar. Bu yapılar normal
memeli hücresinde bulunmazlar ve bazı moleküler biçimler’den oluşurlar. Bu moleküler
biçimleri tanıyan doğal immünite elemanlarına da "Biçim tanıyan ya da algılayan reseptörler"
denir. Doğal immünitenin bu reseptörlerinin neyi tanıyacağı genetik olarak önceden
belirlenmiştir; salgılananlar, endositik olanlar ve sinyal verenler olmak üzere başlıca 3 gruba
ayrılırlar. Pek çoğu makrofajlar, dendiritik hücreler ve B lenfositler gibi antijen sunan
hücreler (ASH)'in yüzeyinde bulunurlar. Özellikle dendiritik hücreler daha antijeniyle
karşılaşmamış ve naif T lenfosit denilen hücreleri aktive etmekte etkin rol oynarlar (9, 10).
Salgılananlara örnek olarak karaciğerde yapılan ve akut faz cevabının bir elemanı
olarak plazmaya salınan mannoz-bağlayıcı lektin, endositiklere örnek olarak makrofaj
mannoz reseptör ve sinyal verenlere örnek olarak Toll-like reseptörler sayılabilir. Sinyal
veren reseptörlerden olan Toll-like reseptörler tanıdıkları biçimle karşılaştıklarında ASH'in
yüzeyinde CD80 ve CD86 gibi kostimülatör molekül ekspresyonunu ve başlıca interlökin
(IL-1, IL-6 ve IL-12) olmak üzere bazı inflamatuvar sitokinleri kodlayan genler olmak üzere
bir takım immün yanıt genlerinin ekspresyonunu uyarırlar. Virüs, gram pozitif ya da negatif
bakteri gibi değişik mikroorganizmalarda hedef moleküller farklı biçimler taşımakta ve doğal
immünite sadece farklı sınıf mikroorganizmaları ayırabilmektedir, çeşitliliği sınırlıdır,
hafızası yoktur. Buna karşılık biçim tanıyan reseptörleri taşıyan hücrelerin efektör
fonksiyonlarını göstermek için çoğalmaları gerekmediğinden etkinliklerini çok çabuk
gösterirler. Doğal immün sistem, spesifik immün sistemin reseptör sayı ve çeşitliliğiyle
karşılaştırıldığında ileri derecede sınırlı sayıdaki reseptörleriyle mikroorganizmalara ait belirli
yapıları tanıyıp kostimülatörler, sitokinler ve kemokinlerin yapımını indükleyerek antijen
spesifik lenfositlerin uyarılmasını ve spesifik immün yanıtın başlamasını sağlar. Böylece
doğal immün sistem bir şekilde kendi ile kendi olmayanı tanıyarak kendi organizmasına zarar
vermediği gibi daha sonra gelişecek spesifik immün yanıt tipinde de belirleyici olabilir.
Doğal immünitenin reseptör veya moleküllerinde inaktivasyona yol açan mutasyonlar immün
yetmezliklere, bu yapıları devamlı aktif olmaya götüren mutasyonlar ise inflamatuvar
reaksiyonları uyararak allerjik ve otoimmün hastalıklara eğilim yaratabilir. Doğal
immünitenin bir diğer elemanı olan doğal öldürücü (Natural killer) hücreler, öldürücü
3
fonksiyonlarını göstermeleri için ayrıca uyarılıp farklılaşmaları gerekmediğinden bu isimle
anılırlar. Başlıca hedefleri antikorla kaplı hücreler, virüslerle ya da bazı hücre içi bakterilerle
infekte hücreler ve bazı malign hücreler ile kendi klas I majör histokompatibilite kompleksi
(MHC) molekülleri'ni taşımayan transplant hücreleridir. Doğal öldürücü hücrelerin hedef
hücreyi öldürme kapasitesi, hedef hücrenin taşıdığı self MHC klas l molekül miktarı ile ters
orantılıdır. Doğal öldürücü hücreler, klas I MHC moleküllerini tanıyan inhibitör reseptörler
taşıdıklarından klas I MHC molekülleri bulunan hücreler tarafından inhibe edilirler. Bu
inhibitör moleküllerden bir grubu "killer inhibitory receptor (KIR) ailesi" olarak bilinir.
Doğal öldürücü hücrelerin başlıca efektör fonksiyonları virusla infekte hücreler ve bazı tümör
hücrelerini yok etmek ve IFNγ salgılamaktır. IFNγ makrofajların fagosite ettikleri
mikroorganizmaları yok etmelerini kuvvetlendirir. Şimdiye kadar anlatılan doğal immünite
elemanları dışında aktif makrofajlardan salgılanan alfa ve beta interferon (sırasıyla IFNα ve
IFNβ), tümör nekrosis faktör alfa (TNFα), IL-12 ve IL-15 gibi sitokinler de doğal
immünitenin birer elemanı olarak işlev görürler (9, 10).
Doğal immünitenin erken ve lokal sonucu inflamatuvar yanıttır. Bu sayede lökositler
infeksiyon ajanının bulunduğu yere ulaşıp infeksiyonu ortadan kaldırmaya çalışır.
İnflamasyonun bir diğer etkisi de bazı sistemik değişikliklere yol açarak doğal immün
sistemin güçlenmesine katkıda bulunmaktır (9, 10).
Spesifik İmmünite: Bir yabancı ajan ile karşılaşıldığında uyarılan ve sadece o
antijene özgü olarak gelişen ve o antijenle bir kez daha karşılaşıldığında daha güçlü olarak
yanıt verilmesini sağlayan sistemdir. Spesifik immünitede çok çeşitli hücre ve molekül
birlikte çalışır. Spesifik immünitenin başlıca elemanları T ve B lenfositler antikorlar ve bazı
lenfokinlerdir. Antijen sunan hücrelerin de çok önemli rolü vardır. Spesifik immün yanıtlar
doğal immün yanıtı takip eder. Spesifik immünite, doğal immünitenin koruyucu
mekanizmalarını güçlendirir, bu mekanizmaları antijenin giriş yerine yönlendirerek yabancı
antijenin ortadan kaldırılmasını kolaylaştırır. Spesifik immünite aktif ya da pasif olarak
oluşturulabilir. Organizmanın yabancı antijene maruz kalıp aktif bir şekilde immün yanıt
vererek geliştirdiği immüniteye "aktif immünite", spesifik olarak immünize olmuş bir
bireyden serum ya da hücrelerin immün olmayan bireye nakliyle geliştirilen immüniteye ise
"pasif immünite" denir (8, 11, 12).
Spesifik immün yanıtlar, sekonder lenfoid dokular olarak adlandırılan lenf nodları,
4
dalak ve mukoza ile ilişkili lenfoid dokularda gelişir. Bu tür yanıtlar, cevabı oluşturan immün
sistem elemanlarına göre hümoral ve hücresel diye iki grupta incelenirler ve farklı
mikroorganizmaların ortadan kaldırılmasında işlev görürler (8, 11, 12).
Hümoral İmmünite: Hümoral immunite’de antijeni spesifik olarak tanıyan ve çeşitli
mekanizmalarla ortadan kaldırılmasını sağlayan moleküller olan ANTİKOR' lar başlıca rolü
oynar. Antikorlar, spesifik antijeni ile karşılaşmış B lenfositlerden farklılaşan plazma
hücreleri tarafından yapılan immünoglobülinlerdir. Antikorlar dolaşımdaki hücre dışı
mikroorganizmalar ve toksinlerine bağlanıp ortadan kaldırılmalarını yönlendirirler. Buna
karşılık dolaşan antikorlar viruslar, mantarlar ve bazı bakteriler gibi hücre içi yerleşim
gösteren mikroorganizmalara ulaşamazlar. Bunlara karşı savunmada, mikroorganizmaların
aktif makrofajlarca fagosite edilerek ortadan kaldırılmasını ya da infekte hücrenin lizisini
sağlayan hücresel immünite başlıca rolü oynar. Normal, sağlıklı bir yetişkinin serumunda
sayılamayacak kadar değişik tipte antikor molekülü bulunur. Her birisi çok küçük miktarlarda
olmasına rağmen toplamları total serum proteininin yaklaşık %20'sini oluşturur. Dolaşan bu
antikorların her birisi kendi spesifik antijenine karşı düşük düzeyde bir koruma gösterir. Bu
birey yüklü miktarda antijen ile karşılaşırsa o antijene karşı spesifik olan antikorun serum
konsantrasyonu yükselir. Antikor yanıtının bir kaç fazı vardır. Latent faz denen kısım
immünojenle ilk karşılaşmadan dolaşımda antikorların saptanmasına kadar geçen süredir ki
insanlarda yaklaşık l haftadır. Bu safhada Th ve B hücre aktivasyonu olur. Bu fazı takip eden
eksponansiyel fazda dolaşan antikor miktarı hızla artar. Bunu antikor düzeyinin sabit kaldığı
plato fazı izler. Antikor düzeyi sabit kalır çünkü antikor yapım hızı ile parçalanma hızı
nisbeten eşit düzeylerdedir. Plato fazından sonra düşme fazı gelir. Bu safhada dolaşan antikor
düzeyi giderek azalır. Artık yeni plazma hücreleri oluşmamakta ve varolan plazma hücreleri
de ölmekte ya da antikor yapımını kesmektedir. Bu olay genellikle immünojenin ortadan
kaldırıldığına işaret eder. İmmün yanıt antijenik uyarının süresi ve immün yanıta katılan
plazma hücrelerinin nisbeten kısa olan yaşam süreleri ile sınırlıdır. Aynı immünojenle daha
sonraki karşılaşmalardaki immün yanıt kalitatif olarak primer yanıta benzer ancak önemli
kantitatif farklılıklar gösterir. Sekonder ya da anamnestik immün yanıt dediğimiz bu olayda
latent period kısalır, antikor düzeyi çok daha çabuk çok daha yüksek düzeylere ulaşır ve
serumda çok daha uzun süre saptanabilir düzeyde sebat eder (8, 11, 12).
Hücresel İmmünite : Hücresel immunite’de antijeni spesifik olarak tanıyan T
5
lenfositler başlıca rolü oynarlar. T lenfositler antijeni ancak ASH'ler ya da hedef hücre
üzerindeki MHC molekülleri ile birlikte sunulduğunda tanırlar. Yüzeylerinde CD4 molekülü
taşıyan yardımcı T lenfositler (Th) klas II MHC tarafından sunulan antijenleri tanıyabildikleri
için bu olaya klas II MHC'ye bağımlı ya da klas II MHC ile sınırlı denir. Yüzeylerinde CD8
molekülü taşıyan sitotoksik T lenfositler (Tc veya CTL) ise MHC klas I'e bağımlıdır. Somatik
hücrelerin hemen hepsinde klas I MHC molekülleri mevcutken klas II MHC molekülleri
başlıca profesyonel antijen sunan hücreler (dendiritik hücreler, aktif makrofajlar ve B
lenfositler) olmak üzere nispeten kısıtlı sayıda hücrede bulunur. Dendiritik hücreler deride ve
mukozal yüzeyin altında bulunduklarından langerhans hücreleri olarak adlandırılırlar.
Karaciğerdeki Kupffer hücreleri, santral sinir sistemindeki mikrogliyal hücreler ve kemikteki
osteoklastlar belli özellikleri olan doku makrofajlardır (8, 11).
2.1.1. İMMUN YANITIN BAŞLICA ÖZELLİKLERİ
İmmün yanıtın başlıca özellikleri Tablo 1’de gösterilmiştir.
Tablo 1. İmmun yanıtın başlıca özellikleri
Spesifite
Çeşitlilik
Hafıza
Kendini Yabancıdan Ayırt Etmek
Oto-Regülasyon (Kendini Sınırlama)
Uzmanlaşma
Spesifik immün yanıtın başlıca 3 özelliği mevcuttur: tanıma, aktivasyon ve effektör
faz. Tanıma, bütün immün yanıtlar yabancı antijenin tanınmasıyla başlar. B lenfositler
çözünmüş formdaki yabancı protein, polisakkarit ya da lipit antijenleri yüzeylerinde bulunan
o antijene spesifik membran immünoglobülin molekülü ile tanırlar. T lenfositler ancak başka
bir hücrenin yüzeyinde ve kendine ait MHC molekülleriyle birlikte sunulan kısa peptid
halinde işlenmiş protein antijenleri tanırlar. T lenfosite bağımlı olmayan antijenler hariç
spesifik immün yanıtın oluşturulabilmesi için önce antijenin ASH tarafından işlenmesi
gerekir. Antijen vücuda girdikten sonra ASH'ler tarafından yakalanıp işlenir ve klas II MHC
molekülleri ile bir kompleks halinde Th'lere sunulur. B lenfositler de yüzey immünoglobülin
reseptörleri aracılığıyla spesifik antijenlerini yakalayarak klas II MHC molekülleriyle birlikte
6
T lenfositlere sunabilir. Lipopolisakkarit ya da polisakkarit yapıdaki "Timustan ya da T
lenfositten bağımsız antijenler" denen bu antijenlere karşı antikor yapımı için Th yardımı şart
değildir. Bu tür antijenler yüksek konsantrasyonlarda poliklonal B hücre uyarımı yaparlar.
Düşük konsantrasyonda ise spesifik B hücre uyarımı yaparlar. Yapılan antikorlar başlıca IgM
ve IgG3 yapısında olup sınıf değişikliğine uğramazlar ve affinite olgunluğu gösteremezler.
Bellek B hücreleri de gelişmez (13).
Aktivasyon: Bütün lenfositler antijenik uyarıya cevap olarak yeni bazı proteinler
yaparlar (sitokinler, sitokin reseptörleri, gen transkripsiyonu ve hücre bölünmesinde rolü olan
çeşitli proteinler), çoğalırlar (proliferasyon ve dolayısıyla klonal genişleme} ve yabancı
antijeni ortadan kaldırmaya yönelik effektör fonksiyonlarını yapacak yetenekte hücrelere
farklılaşırlar (diferansiyasyon). Böylece, antijenini tanıyan B lenfosit antikor oluşturan
plazma hücresine dönüşür ve antikor üretir. Bu antikor hücre dışı çözünmüş antijeni bağlar ve
onu ortadan kaldıracak mekanizmaları harekete geçirir. Benzer şekilde kimi T lenfositler de
fagositleri
aktive
ederek,
onların
intraselüler
mikroorganizmaları
öldürmelerini
kuvvetlendirecek hücrelere (Th) dönüşürken diğer bazı T lenfositler yabancı antijen taşıyan
virüsle infekte hücre veya tümör hücresi gibi hücreleri öldürebilme kapasitesi taşıyan
sitotoksik T lenfositlere (Tc) farklılaşır. Lenfosit aktivasyonunun genel bir özelliği sıklıkla iki
sinyal gerektirmesidir. Bu sinyallerden bir tanesi antijenle temas sonucunda oluşturulurken
diğeri yardımcı ya da aksesuar hücreler dediğimiz diğer hücreler tarafından sağlanır.
Aksesuar hücreler olarak adlandırılan mononükleer fagositler, dendiritik hücreler ve diğer
bazı hücreler değişik antijenler için spesifite göstermezler ancak antijen sunumu ve antijenspesifik lenfositlerin aktivasyonunda önemli rolleri vardır. Aksesuar hücrelerin sağladığı
2.sinyal mikroorganizma veya doğal immün yanıtlar tarafından uyarılır. Böylece immün
yanıtın sadece mikroorganizmalar ve diğer zararlı maddelere karşı gerektiğinde geliştirilmesi
sağlanır (13).
Effektör Faz: Antijenleriyle spesifik olarak uyarılmış lenfositlerin o antijeni yok
etmeye yönelik fonksiyonunu gösterdiği evredir. İmmün yanıtın bu safhasında rol alan
hücrelere efektör hücreler denir. Pek çok efektör fonksiyonda diğer nonlenfoid hücreler ve
doğal immünitede rol alan savunma mekanizmaları da katkıda bulunur; örneğin antikorlar
hem yabancı antijenlere bağlanarak bunların kan nötrofil ve mononükleer fagositleri
7
tarafından fagosite edilmelerini sağlar hem de kompleman sistemini aktive ederek
mikroorganizmaların lizis ve fagositozunu mümkün kılar. Yardımcı T lenfositler sitokinler
salgılayarak fagosit fonksiyonlarını güçlendirir ve inflamatuvar cevabı uyarırken, Tc'ler
sitotoksik fonksiyonlarını yürütürler. İmmün yanıtın başlıca düzenleyicisi Th'lerdir. Tc ve B
lenfositlerin aktivasyonu için Th'ler gereklidir. Thl tipi lenfositlerin ürettiği sitokinler
makrofaj aktivasyonu ve Tc aracılı fonksiyonlara yani hücresel immüniteye yardım ederken,
Th2 tipi lenfositler ürettikleri IL-4, -5, -6 ve -10 ile B lenfositlerin antikor yapmalarını
sağlarlar (13).
Bir antijene karşı oluşacak yanıtın lokalizasyonu: Antijenin vücuda giriş yoluna
bağlıdır. Kan dolaşımıyla giren antijenlere karşı immün yanıt dalakta başlar. Dokulardaki
mikroorganizmalara karşı yanıtlar lokal lenf bezlerinde oluşur. Solunum yolları ya da
gastrointestinal kanal mukozasından giren antijenler ise submukozal lenfoid dokularla
karşılaşır ki burası hem lokal hem de antijenin girdiği lümen içine yönelen immün yanıt
oluşturur. İmmün yanıt nerede başlarsa başlasın daima kan ya da lenf yoluyla başka bölgelere
lenfosit trafiği olur. Bazı ASH'in kan ve lenf yoluyla göç ederek antijenleri uzak lenfoid
dokulara taşıyabilme kapasitesi vardır (14).
İmmün yanıtın şiddetini etkileyen pek çok faktör vardır. Antijenin yapısı, miktarı,
immünojenik gücü ve organizmaya giriş yolu immün yanıtın gücü ve süresinde etkili
faktörlerdir. İmmün yanıtta kişinin genetik yapısı önemlidir. Herhangi bir antijene verilen
immün yanıtta kişiler arası farklılıklar olabilir. Genetik kontrolde hem MHC bağlantılı hem
de MHC bağlantısız genlerin rolü vardır. İmmün yanıt bir kez başladıktan sonra birbirleriyle
sıkı ilişki içinde immün yanıtı kontrol eden ve düzgün bir şekilde sönmesini sağlayan bazı
mekanizmalar vardır (12).
Negatif feedback etkiyle aynı antikordan daha fazla yapılması inhibe edilir çünkü
antikor antijeni ortadan kaldırarak immünojenik uyarıyı bitirmiş olacaktır. Antikor
moleküllerinin antijen bağlayan bölgelerindeki antijenik determinantlara "idiotip" denir.
Bunlar self-antijen olmakla beraber immün yanıt sırasında miktarları arttığı zaman
immüojenik olurlar ve bunlara karşı anti - idiotipik antikorlar gelişir. İmmün yanıtın
sonlanmasında bu idiotip - antiidiotip antikor etkileşimlerinin rolü olduğu düşünülmektedir.
Thl hücreler tarafından salgılanan IFNγ, Th2 hücrelerini dolayısıyla da antikor oluşumunu
inhibe ederken Th2 hücrelerce salgılanan IL-10, Thl lenfositleri ve hücresel immünitenin
8
çeşitli fonksiyonlarını inhibe eder. Aktif T lenfositler, mononükleer fagositler ve diğer bazı
hücreler tarafından yapılan transforming growth factor-β (TGF-β) T hücrelerinin çoğalma ve
farklılaşmalarını, makrofajların aktivasyonunu inhibe eder ve proinflamatuvar sitokinlerin
etkilerini azaltır. Ayrıca santral sinir sisteminde gelişen bazı olaylar immün fonksiyonları
etkileyebilir. Stres yaratan durumlarda immün baskılanma olabileceği bilinir. Lenfoid
organların çoğunda sempatik innervasyon vardır. Lenfositler üzerinde pek çok hormon,
nörotransmitter ve nöropeptid için reseptörler vardır. Kortikosteroidler, endorfinler ve
enkefalinler stres sırasında salınan ve in vivo immüno-supressif olan maddelerdir.
Kortikosteroidler özellikle Thl yanıtlarını ve makrofaj aktivasyonunu aşağı çekerlerken TGFβ yapımını uyararak dolaylı yoldan da immün yanıtı inhibe edebilirler (12).
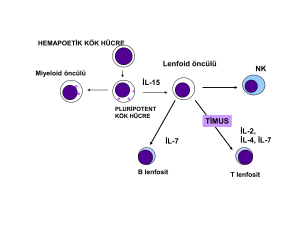
2.1.2. İMMÜN SİSTEM HÜCRELERİ
Doğal immünitede savunma antijene özgü değildir ve uyarı sonrası bellek
oluşturmayan, kısa süreli bir yanıt sistemi niteliğindedir. İnflamasyon olarak adlandırılan bu
yanıtın mediatörleri nötrofiller, eozinofiller, bazofiller, Doğal öldürücü (NK) hücreleri,
monosit ve makrofajlardır. İmmün sistemin ikinci ayağını ise hücresel ve hümoral immünite
dediğimiz spesifik immünite oluşturur. Hücresel immün yanıtın temel efektör hücreleri timus
kökenli T lenfositler, hümoral immünitenin ise kemik iliği ya da bursa kökenli B
lenfositlerdir. Hem T hem de B hücreleri ortak bir kök (stem) hücreden kaynaklanırlar.
İmmün sistemin diğer efektör ve düzenleyici hücreleri büyük granüllü lenfositler, monositmakrofajlar ve dendritik/Langerhans hücrelerdir (15).
T Hücreleri : Normal periferik lenfositlerin % 70-80'ini oluşturan T hücreleri yüzey
immünoglobülin reseptörü taşımamaları ve CD2, CD3 ve CD7 adlı reseptörleri ile diğer
lenfositlerden ayrılırlar. Kemik iliği ve fetal karaciğer kökenli olan T hücreleri fetal ve erken
postnatal dönemde timusa göç ederek orada olgunlaşırlar. Diğer immün hücrelerden önemli
bir farkları efektör T hücre havuzunun timusta hayatın ilk döneminde oluşması ve
olgunlaşmamış T hücrelerinin antijen varlığında bellek T hücrelerine dönüşerek periferik
lenfoid organlar ile kan arasında dolaşmalarıdır. T hücreleri hücresel immünitenin kaynağı
olarak direkt hücresel temas ve sitokinler yolu ile diğer T ve B hücreleri ile monosit
fonksiyonlarını düzenlerler. Ayrıca virusla enfekte ya da malign hücreleri parçalayan
öldürücü (sitotoksik) hücrelerin bir kısmı da T lenfositlerdir. T hücreleri kemik iliğinde
9
eritrosit hücre olgunlaşmasını da düzenlerler (16).
En erken T hücre öncülleri fetal karaciğer ve postnatal kemik iliğinde bulunan CD34+
pro-T hücreleridir. Bu hücrelerde T hücre reseptör (THR) genleri eksprese edilmez. Timusa
göç eden T hücreleri CD7 ve bir yapışma molekülü olan CD2 eksprese ederler,
sitoplazmalarında da T hücre reseptör kompleksi ile ilişkili moleküllerden CD3'ün sentezi
görülür. Tüm T hücrelerinde bulunan ve HLA (İnsan Lökosit Antijeni) molekülleri ile ilişkili
olarak antijenik tanımada yer alan reseptör, T hücre reseptörü (THR) olarak adlandırılır. Bu
reseptör heterodimer yapısında bulunan ikişer adet αβ ve γδ zincirinden oluşur. Bu molekül
yapısal olarak immünoglobülinlere benzer. Amino uçlarında değişken ve karboksi uçlarında
sabit bölgeler içerir ve bu nedenle immünoglobülin süper-ailesi içinde yer alır. THR αβ’sı
olan T hücreleri periferik kan, lenf bezleri ve dalaktaki T hücrelerinin çoğunu oluştururlar ve
terminal olarak CD4 ya da CD8 hücrelere olgunlaşırlar. T hücrelerinin immün uyarı sonrası
çeşitli sitokinler salgılayarak diğer T ve B hücreleri ile monosit-makrofajların uyarılma ve
olgunlaşmasını sağlayan alt-grubu yardımcı T hücreleri (T-helper, Th) olarak adlandırılır. Bu
grup yüzeyinde CD4 ve THR αβ taşır, normal bireylerde periferik T lenfositlerinin % 6065'ini oluşturur. CD4 molekülü antijenin T hücre reseptörü (THR) tarafından HLA sınıf II
molekülü ile birlikte tanınmasında yer alır. Son dönemde yardımcı T hücre grubunun da,
salgıladıkları sitokinlere göre, iki alt grubunun olduğu öne sürülmüştür. IL-2 ve IFN-γ
salgılayan Thl grubu; IL-4-5-6 ve IL-10 salgılayan Th2 grubudur. Diğer bir T hücre grubu
yabancı antijenleri HLA sınıf I molekülleri yardımı ile tanıyıp bu hücreleri yıkıma uğratan
sitotoksik T hücreleridir (Tc). Bu hücreler CD8 ve THR αβ molekülleri taşırlar. CD8+ grup
periferik lenfositlerin % 30- 35'ini oluşturur. THR γδ’sı olan T hücreleri periferik kanda
küçük bir alt gruptur ve özellikle epitel yüzeylerindeki immün korunma ile mikobakteriler ve
diğer hücre içi mikroorganizmalara karşı savunmada ilk yanıtı veren hücre grubu olarak yer
almaktadır (16).
B Hücreleri : Kan lenfosit havuzunun % 5-15'ini oluşturan B hücreleri insanda önce
fetal karaciğerde, sonra kemik iliğinde gelişirler ve yüzeylerinde antijen reseptörü olarak da
görev yapan immünoglobülin molekülleri taşırlar. Antijenik uyarı sonrası, T hücrelerinden
salınan sitokinlerin de (IL-2, IL-6) katkısıyla B hücreleri plazma hücrelerine dönüşerek
gelişimlerini tamamlarlar ve ikincil lenfoid organlara yerleşirler (lenf bezi folikülleri ve
dalak). Plazma hücreleri antikor olarak adlandırılan çözünür formdaki immünoglobülinleri
10
yaparlar (17).
B hücreleri olgunlaşmalarının en erken dönemlerinde yüzeylerinde immünoglobülin
içermezler. Ancak sitoplazmalarında IgM ağır zinciri (µ) bulunur (erken pre-B hücreleri).
Daha sonra kappa ya da lambda hafif zincir üretimi başlar (immatür pre-B hücreleri). Hafif ve
ağır zincirlerin birlikte yüzeye çıkışı ile bu hücreler yüzeylerinde önce IgM, sonra hem IgM
hem de IgD taşıyan hücrelere dönüşürler. B lenfositler CD19, CD20 ve CD21 moleküllerini
bulundururlar. B hücrelerinin daha sonraki olgunlaşmaları antijen varlığında gerçekleşir
(aktive B hücresi). Antijen ile uyarılan B hücrelerinin bir kısmı immünoglobülin salgılayan
plazma hücrelerine dönüşürken, bir kısmı da bellek hücrelerini oluştururlar. Antijen ile ikincil
karşılaşma bu hücrelerin birinciden çok daha güçlü bir yanıt vermesine yol açar. İkincil yanıt
sırasında B hücrelerin immünoglobülin yanıtlarında da (immünoglobülin izotipleri) değişiklik
görülür (IgM'den IgG, IgA ya da IgE'ye değişim=sınıf değişimi). İnsan immünoglobülin
genleri 2, 14 ve 22. kromozomlarda bulunurlar. Hafif zincirler değişken (V)-birleştirici (J) ve
sabit bölge (C) adlı 3 ayrı parçadan; ağır zincirler ise V-D-J-C (D-çeşitlilik) adlı dört
parçadan oluşurlar. Bu genlerin farklı bileşimleri, bu sırada oluşan somatik mutasyonlar ya da
eklenen yeni aminoasitler İmmünoglobülinlerin sınırsız sayıda farklı antijeni tanıyabilecek
çeşitliliğini sağlar. B hücreleri yüzeylerinde Ig reseptörleri dışında komplemanın üçüncü
parçası (C3) için reseptör ve yardımcı T hücreleri (Th) ile etkileşebilmelerini sağlayan HLA
sınıf II moleküllerini taşırlar (16).
Antijen Sunumu T hücre reseptörleri (THR) ile oluşur. THR antijeni antijen-sunucu
hücreler yüzeyinde bulunan ve 6. kromozomda yer alan majör histokompatibilite kompleksi
(MHC) tarafından sentezlenen insan lökosit antijenleri (HLA) ile ilişkili olarak tanır. HLA
sınıf I (A, B, C) ya da II (DR, DP, DQ) ile olan tanıma HLA ya da MHC ile kısıtlılık olarak
adlandırılır. CD3 kompleks molekülleri THR zincirlerinin hücre membranına yerleşmeleri
için gereklidir. THR αβ ve THR γδ molekülleri antijenik bağlanma bölgesini oluştururken
CD3 kompleksi T hücre aktivasyonu için gerekli sinyal iletisini sağlar. Bu kompleks dışında
ikincil uyarıyı sağlayan ve yüzeylerinde HLA sınıf II moleküllerini eksprese eden
makrofajlar, dendritik hücreler ve aktive olmuş B hücreleri profesyonel antijen-sunucu
hücreler olarak adlandırılırlar. Epitel hücreleri, keratinositler ve endotel hücreleri gibi bir grup
diğer hücre ise normalde HLA sınıf II molekülleri eksprese etmezken, inflamasyon ve çeşitli
sitokinler varlığında HLA sınıf II ekprese eder ve T hücrelerine ikincil uyarıyı sağlarlar. T
hücrelerini zayıf uyaran ve kemik iliği kökenli olmayan bu hücreler profesyonel olmayan
11
antijen-sunucu hücreler olarak adlandırılırlar (16, 18).
Büyük Granüllü Lenfositler (NK): Periferik kandaki mononükleer hücrelerin % 510'u yüzeylerinde T ya da B hücresi işareti taşımazlar. Bu hücrelerin yüzeylerinde IgG Fc
kısmına karşı reseptör bulunur. Bir kısmı bir T hücre göstergesi olan CD8 taşır ve IL-2 ile
çoğalır. Büyük sitoplazmik granülleri olan, ancak fagositoz yapma ve yapışma özellikleri
olmayan bu hücreler büyük granüllü lenfositler olarak adlandırılırlar. Monosit-makrofaj ve
nötrofil benzeri fonksiyonları olan bu hücreler antikora bağlı hücresel öldürme ya da doğal
öldürücü hücre (natural killer, NK) aktivitesi gösterirler. Antikora bağlı hücresel öldürme, Fc
reseptörü olan lenfositin antikor ile kaplı (opsonize) hücreye Fc yolu ile bağlanıp onu
öldürmesidir. Doğal öldürücü hücre aktivitesi ise daha önceden hedef ile karşılaşmamış
lenfositin antikor varlığı gerektirmeyen öldürücü aktivitesidir. Özellikle malign ya da virüs ile
enfekte hücreler ve transplante edilmiş yabancı hücrelerin yok edilmesinde rol alır. Lenfokin
ile aktive öldürücü hücreler ise IL-2 adlı sitokin ile uyarılarak tümör öldürücü yetenekleri
arttırılmış olan hücrelerdir. NK hücrelerinin öldürücü yeteneği hedef hücrelerin HLA sınıf I
molekül ekspresyonları ile ters orantılıdır. Virüsler ve malign dönüşüm hücrelerin HLA sınıf I
ekspresyonunu azaltır, bu durum CD8+ T hücrelerinin HLA sınıf I'e bağımlı sitotoksik
yanıtlarını etkiler. NK hücrelerinin immün sistemdeki bu boşluğu doldurmak üzere
geliştikleri düşünülmektedir (16).
Monosit-Makrofajlar : Kemik iliğindeki öncül hücrelerden kaynaklanan monositler,
periferde 1-3 günlük bir yarı ömür ile dolaşırlar. Doku makrofajları ise ya periferik kandaki
monositlerin ekstra-vasküler dokuya göçü ya da dokulardaki makrofaj öncüllerinden
gelişirler. Lenf bezleri, dalak, kemik iliği, perivasküler konnektif doku, periton, plevra gibi
seröz boşluklar, akciğer (alveolar makrofajlar), karaciğer (Kupfer hücreleri), kemik
(osteoklastlar), merkezi sinir sistemi (mikroglia) ve sinovyumda (Tip A hücreleri) doku
makrofajları bulunur. Monosit-makrofaj sistemi antijen sunucu hücreler olarak antijenin T
hücrelerine sunumu yanında, IL-1 ve IL-6 gibi sitokinler yoluyla T ve B hücrelerinin antijene
bağlı aktivasyonunda temel rol alır. Monosit-makrofajların antikor ile kaplı bakteri, tümör
hücresi ve hatta bazı normal kemik iliği hücrelerinin yıkımı (otoimmünsitopenilerde) gibi
effektör görevleri de vardır. TNF-α ve IL-1 gibi sitokinler monosit-makrofajların antikora
bağlı olmayan litik aktivite göstermesini de sağlarlar. Monosit-makrofajlar ayrıca dokularda
12
immün yanıtı şekillendiren çeşitli hidrolitik enzimler, oksidatif metabolizma ürünleri, çeşitli
sitokin ve kemokinler yoluyla pro ve anti-inflamatuvar roller üstlenirler (16).
Dendritik/Langerhans Hücreleri : Dendritik/Langerhans (D/L) hücreleri kemik iliği
kökenli, T hücreleri için antijen-sunucu bir hücre grubudur. Yüksek düzeyde HLA sınıf II ve
yapışma molekülleri eksprese eder ve iyi antijen sunarlar. Ciltte ve mukozal yüzeyler altında
bulunduklarında Langerhans hücresi adını alırlar. Dendritik hücreler kanda çok az miktarda
bulunurlar (% 0.1'den az) ve bu grup dokular arası geçiş yapan hücrelerdir. Foliküler
dendritik hücreler B hücreleri için antijen sunucu hücrelerdir. Foliküler dendritik hücrelerce B
hücrelerine sunulan bu antijenlerin B hücre belleğinin oluşumunda temel rol aldıkları
düşünülmektedir. Germinal merkezlere ulaşan CD4+ yardımcı T hücrelerin de bu uyarı ve
aktivasyon sürecinde B hücrelerine yardım ettiği gösterilmiştir (16).
Granülositler (Nötrofil, Eosinofil ve Bazofiller) : Tüm inflamasyon tiplerinde yer
alan granülositler doğal ve özgün immün yanıtların effektör hücreleridir. Granülositlerin
ömrü dolaşım kanında 4-8 saat, dokularda ise 2-3 gün kadardır ve kan lökositlerinin % 6070'ini oluştururlar. Granülositlerin kontrolsüz çoğalmaları ve dokularda birikimleri nötrofil ve
eozinofil kökenli sistemik vaskülitlerde görüldüğü gibi ağır doku hasarına yol açabilir.
Dolaşan granülositlerin % 90'ından fazlasını oluşturan nötrofiller, IgG için Fc reseptörü
(CD16) yanında aktive kompleman ürünlerine ait reseptörleri de (C3b, CD35) taşırlar.
Periferik kanda % 2-5 oranında bulunan eozinofiller IgG için Fc reseptörü (CD32) taşırlar ve
özellikle parazitik organizmalar için sitotoksik etki gösterirler. Periferik kanda düşük oranda
bulunan (% 0.1-0.2) bazofil ve doku mast hücrelerinin görevleri tam anlaşılamamıştır.
Bazofillerin allerjide ve gecikmiş tipte aşırı duyarlılık reaksiyonlarında rol aldığı
düşünülmektedir. Bazofiller vasküler permeabiliteyi arttırarak çeşitli inflamatuvar tablolarda
önem taşırlar. IgE için yüksek afiniteli yüzey reseptörü taşıyan bazofillerde bu reseptörlere
IgE bağlanması sonrası histamin, eozinofilik kemotaktik faktör ve proteazların etkisiyle ani
(anafilaktik) hipersensitivite reaksiyonları oluşur. Bazofiller C3a ve C5a gibi aktif
kompleman ürünleri için de reseptör taşırlar (16, 18).
13
2.1.3. İMMÜNOGLOBULİNLER VE ÖZELLİKLERİ
Yabancı antijenlerin spesifik immün sistem tarafından tanınmasında, B hücre yüzey
immünoglobulinleri ve T hücre reseptörleri (TCR) olmak üzere iki farklı molekül görev alır.
İmmünoglobulinler, humoral immün cevabın bütün safhalarında önemli rol oynarlar.
İstirahatteki B lenfositlerin yüzeylerinde eksprese edilen immünoglobulinler, spesifik
antijenlere yönelik reseptörler olarak fonksiyon görürler. Spesifik antijenlerin, yüzey
immünoglobulinlere bağlanması, B hücre aktivasyonuna, klonal proliferasyona ve plazma
hücre gelişimine neden olur. B lenfositlerin aktivasyonu sonucu oluşan plazma hücrelerinin
sekrete ettikleri immünoglobulinler, vücudun serum ve doku sıvılarında antikor olarak görev
yaparlar. B lenfosit prekürsörleri üzerindeki, antijen bağlayan immünoglobulinler ile plazma
hücreleri tarafından sekrete edilen antikorlar aynı antijenik spesifiteye sahiptir (19).
İmmünoglobulinler, serum ve doku sıvılarında bulunan, ağırlığının % 82 - 96' sı
polipeptid, % 4 - 18'i karbonhidrattan oluşan bir glikoprotein ailesidir. Antikorlar,
bifonksiyonel moleküllerdir; bir yandan Fab kısımları ile spesifik antijenlere bağlanırken,
diğer yandan Fc kısımları ile ilişkili olarak opsonizasyon ve kompleman aktivasyonu gibi
konak savunmasında önemli sekonder biyolojik fonksiyonları üstlenirler. Antikorlar; B
lenfositlerin yüzeylerinde, kanda ve daha az miktarlarda interstisyel sıvılarda, antikorları
sentezleyemeyen ancak antikorların bağlanabilmesi için reseptörler taşıyan mononükleer
fagositler, doğal öldürücü hücreler ve mast hücrelerinin yüzeylerinde, süt ve mukus gibi
sekretuvar sıvılarda bulunur (19).
2.1.3.1. İmmünoglobulin Çeşitleri
IgG: IgG, total immünoglobulin havuzunun % 70-75' i oluşturur. Molekül ağırlığı 146
kD'dur. IgG3'ün molekül ağırlığı diğer subtiplerinden biraz fazladır. IgG'nin subtiplerinin
yüzdeleri; IgGl % 60-70, IgG2 % 14-20, IgG3 % 4-8 ve IgG4 % 2-6 oranlarında değişir. IgG
antikorları, intra-vasküler ve ekstravasküler alanda bulunur ve sekonder immün cevapta rol
oynar. Maternal IgG, yenidoğanların immünitesinde önemli rol oynar. IgG2, diğer subtiplere
kıyasla kısmen daha az geçiş göstermekle birlikte, bütün IgG subtipleri plasentayı geçebilir ve
yenidoğanın
pasif
immünizasyonunu
sağlayabilir.
Antijen
bağlayan
IgG,
serum
komplemanını fikse (kompleman aktivasyonu) edebilir. Ancak IgG'nin subtipleri arasında bu
14
özellik açısından etki farklılıkları vardır (IgG3 >IgGl >IgG2). IgG4 klasik kompleman yolunu
aktive edemez, ancak alternatif yolu aktive edebilir. Buna karşın diğer IgG subtipleri, klasik
kompleman yolunu uyarabilir. Pekçok bakteriyel antikorlar, virüs nötralizan antikorlar,
presipitan antikorlar, hemaglutininler ve hemolizinler IgG sınıfındandır (20, 21).
IgM : İmmünoglobulin havuzunun yaklaşık %10'unu teşkil eder. IgM molekülü
pentamerler halinde bulunur ve moleküler ağırlığı 970 kD’dur. IgM'deki hafif ve ağır
zincirlerin yanısıra, molekülün subünitlerini birleştiren J (Joining) zinciri bulunur. Bu J
zinciri, 15 kD molekül ağırlığında olup, IgM sekrete eden hücreler tarafından oluşturulurlar.
IgM antikoru, pek çok antijene karşı primer immün cevapta rol oynar ve en güçlü kompleman
aktivasyonu yapabilen immunglobulindir. IgM'in yaklaşık % 80'i intravasküler ortamda
bulunur, her gün % 15-18' i katabolize edilir. Gram negatif bakteri cevabında en sık oluşan
antikor tipi IgM' dir. Wassermann antikorları, heterofil antikorlar, romatoid faktör, soğuk
aglutininler ve allohemaglutininler IgM sınıfı antikorlardır (20, 21).
Ig A: İnsan serum immünoglobulin havuzunun % 15-20' sini oluşturur. Ancak tükrük,
göz yaşı, intestinal mukus, bronşial sekresyon, süt, prostat sıvısı gibi vücut sekresyonlarında
bulunan esas antikor sınıfıdır. IgA, Peyer plaklarında, tonsiller ve submukozal lenfoid
damarlardaki B hücreleri tarafından oluşturulur. IgA; serum IgA ve sekretuvar IgA olmak
üzere ikiye ayrılır. Serum IgA'nın, IgAl ve lgA2 olmak üzere 2 subtipi vardır. Total serum
IgA'sının % 90'ını IgA1 oluşturur. Serum IgA'sının %10' u dimerik formdadır. Serum IgA'nın
kesin olarak fonksiyonu bilinmemesine rağmen antijen klirensinde ve immün regülasyonunda
rolü olabileceği düşünülür. IgA komplemanı aktive edemez. Sekretuvar IgA; IgAl veya IgA2
subtiplerinde olabilir. IgAl serumda, IgA2 ise sekresyonlarda daha fazladır (20).
IgD: Moleküler ağırlığı 180 kD’dur ve monomerik yapıdadır. Isı veya proteolitik
aktiviteye karşı labildir. Total plazma immünoglobulinlerinin %1'inden daha azını oluşturur,
B hücre yüzeyinde IgM ile birlikte bulunurlar. IgD ve IgM'i birlikte taşıyan hücrelerde, IgD
ve IgM aynı antijenik spesifiteye sahiptir. Hücre üzerindeki IgD, antijeni bağlayarak,
uyarıların hücre içine geçişini sağlar (20, 21).
15
IgE: IgE, serumda çok küçük miktarlarda bulunur. Buna karşın, klinik açıdan alerjik
hastalıkların gelişiminde son derece önemlidir. Mast hücreleri ve bazofiller IgE antikorları
için yüksek affiniteli Fc reseptörlerini taşırlar. Spesifik antijenler, mast hücre ve bazofillerin
hücre yüzeylerindeki IgE moleküllerine bağlanarak inflamatuvar maddeleri açığa çıkarıp
allerjik reaksiyonu başlatabilir. Başta helmint-parazitik infeksiyonlar olmak üzere, bazı
hastalıklarda serum IgE seviyeleri yükselebilir (20, 21).
2.1.4.
MAJÖR
HİSTOKOMPATİBİLİTE
KOMPLEKSİ
(Büyük
Doku
Uyumluluk Kompleksi) (MHC)
İnsanda 6. kromozomun kısa kolu üzerinde yer alan Majör histokompatibilite
kompleksi (MHC), kompleks yapılı bir gen grubunu oluşturur ve İnsan Lökosit Antijenlerini
(HLA) kodlar. Bu kompleks kendi içinde sınıf I, sınıf II ve sınıf III alt bölgelerine
ayrılmaktadır. İnsanda transplantasyon durumlarında, transplate olan bireylerde görülen
immün yanıtın HLA moleküllerine karşı geliştiği bulunmuştur. MHC bireyler arasında
yapılan doku naklinde kabul ya da reddi belirleyen ana genetik lokus olarak keşfedilmiştir.
Diğer bir deyişle, MHC lokusları özdeş olan bireyler arasında yapılan değişimlerde doku
kabul edilir, MHC lokusları farklı olanlarda ise doku reddi görülür. MHC sınıf I bölgesinde
HLA-A, HLA-B, HLA-C gen lokusları yer almaktadır. MHC sınıf II bölgesinde ise HLA-DR,
HLA-DQ ve HLA-DP gen lokusu bulunmaktadır. Sınıf I grubu HLA molekülleri insanda
bütün çekirdekli hücreler üzerinde, hücre membranında yer alırken (eksprese edilirken), sınıf
II grubu moleküllerin ekspresyonu sınırlıdır. Genel olarak fizyolojik koşullarda immün
sistemin antijen sunucu hücreleri olarak bilinen B hücreleri ve monosit/makrofaj serisi ve bu
serinin farklılaşmış tüm elemanlarında (dendritik hücreler ve foliküler dendritik hücreler)
eksprese olurlar. Ancak sınıf II moleküllerinin dağılım özellikleri organizmanın immün yanıtı
ile ilişkili olarak farklılık göstermekte, immün yanıtın aktivasyonu ile gelişen değişiklikler bu
moleküllerin bazı hücrelerdeki ekspresyonunu uyarmaktadır. İmmün yanıt sırasında açığa
çıkan proinflamatuvar sitokinlerden öncelikle IFNγ etkisiyle sınıf II moleküllerinin eksprese
edildiği hücre tipleri artabilmekte, aktifleşmiş T hücresi gibi hücrelerde bulunmaktadır. HLA
moleküllerinin işlevleri immün sistemin efektör hücrelerine antijen sunarak immün yanıtı
uyarmakdır. Sınıf I ile oluşan bir HLA-antijen kompleksini yüzeyinde CD8 molekülü taşıyan
T hücreleri görebilmekte, sınıf II ile oluşan bir HLA-antijen kompleksini ise yüzeyinde CD4
16
molekülü taşıyan T hücreleri görebilmektedir. HLA moleküllerinin allograft reddinde hedef
molekülleri oluşturması transplantasyonda alıcı ve vericinin lenfositlerinin karşılaştırıldığı
karışık lenfosit kültürü yönteminin geliştirilmesini sağlamış, kültürde hedef hücre olarak
HLA molekülü bilinen örnekler kullanıldığında yanıt veren hücrenin taşıdığı HLA
molekülünün belirlenmesi olanaklı olmuştur. HLA ilişkisi gösterilen hastalıklarda etyolojik
ajan saptanamamakta ve etyopatogenez açıklanamamaktadır. Çoğunluğunda immün sistem
işlevlerinin bozukluğu ile otoimmün bir mekanizmanın rolü düşünülmektedir. HLA ile ilişkili
hastalıkların tümü kronik ya da subakut seyirli olup soyun devamına ve hastalığın sürmesine
izin vermektedir (22, 23).
2.1.5. SİTOKİNLERİN ÖZELLİKLERİ
Sitokinler hem spesifik immün sistemin hem de doğal immün sistemin hücrelerince
salgılanan, immün sistem fonksiyonları üzerine hayati öneme sahip olan regülatör
proteinlerdir. Sitokinler antijen sunumu, immün sistem hücrelerinin farklılaşması,
olgunlaşması, aktivasyonu, adezyon moleküllerinin ekspresyonu ve akut faz yanıtları gibi
immün yanıtın ve inflamasyonun her safhasında rol oynarlar. Sitokinler antijen spesifik
olmadıkları halde yapımları ve salgılanmaları antijen uyarısına bağlıdır. Sitokinler genellikle
istirahat halindeki hücrelerce değil, stimüle edilen hücrelerce yapılır ve salgılanır. Önceden
yapılmış moleküller olarak depolanmazlar. Sitokinler salgılandıktan sonra etkilerini daha çok
lokal olarak gösterirler. Sitokinlerin immün yanıtın regülasyonunda oynadıkları önemli
rollerinin bir göstergesi, Th lenfositlerinin salgıladıkları sitokinlere göre Th1 ve Th2 olarak
alt gruplara ayrılmasıdır. Th1 lenfositler IL-2, IFNγ ve TNFβ (lenfokin) salgılarken IL-4 ve
IL-5 salgılamazlar. Th2 lenfositler ise IFNγ ve TNFβ salgılamazken IL-4, IL5, IL-6, IL-10,
IL-13 salgılar. Thl ve Th2 hücreler birbirlerinin fonksiyonlarını karşılıklı olarak regüle
ederler. Th2 hücrelerce yapılan IL-4 ve IL-10, TH1 hücrelerini inhibe ederken, Thl hücrelerce
yapılan IFNγ, Th2 hücrelerini inhibe eder. İnflamatuvar immün yanıtlar (gecikmiş tip
hipersensitivite) Th1 hücrelerince oluşturulurken, humoral immün yanıtlar ve allerjik yanıt
Th2 hücrelerince oluşturulur. Th1 ve Th2 farklılaşmasına genetik faktörler, antijenin
özellikleri, antijenin işlenme ve sunulma yolları ile antijen sunan hücrenin özellikleri gibi
birçok faktör etkilidir. En önemlisi antijene yanıtın verildiği ortamdaki sitokinlerdir. Ortamda
bulunan IL-12 Th1 gelişimini, IL-4 ise Th2 gelişimini sağlar (24).
17
2.1.6. GEBELİK İMMÜNİTESİ
2.1.6.1 Allograft Olarak Fetus
Fetus immünojeniktir ve gebeliğin 12. haftasında fetal HLA sınıf-II antijenleri
belirirler. Yarı antijen yapısı babaya ait (paternal) olduğu için fetusa, esas itibariyle bir yarıallograft gibi bakılabilir. Ancak aralarında yüzeyel bir organ-graft benzerliği bulunsa bile
allogenik plasenta ve uterus arasındaki ilişkiler, transplantasyon biyolojisinde geçerli
kurallara göre yönetilemez. İmplantasyon, fetustan kaynaklanan yabancı hücrelerin belli
ölçüde annenin dokularına invazyonunu gerektirir. Buna rağmen gebelik olayı Host Versus
Graft benzeri bir immün tepkiye yol açmaz. Gebeliğin oluşması ve güvenle sürmesi, aslında
fetal ve paternal antijenlere karşı immün tepkisizliği değil, tam tersine maternal bir immün
tepkinin doğmasını gerekli kılmaktadır. Nitekim anne ve babanın MHC (özellikle HLA sınıfII ve HLA-B antijenleri) yakınlığı ne kadar fazla ise implantasyon şansı o kadar azalmakta ve
tekrarlayan spontan düşüklerin sayısı artmaktadır. Bu kadınlar, babanın MHC antijenleri
(lenfositleri) ile aşılandıkları takdirde, anti-paternal antikorlar oluşmakta ve düşükler
önlenebilmektedir (25).
Gebeliği mümkün kılan ve fetusu gebelik süresince rejeksiyondan koruyan
mekanizmalar hayli karmaşıktır ve bir bakıma birbirine karşı gibi görünen bir düzen içinde
çalıştıkları anlaşılmıştır. Bu konudaki bilgiler şöyle özetlenebilir:
Gebelikte maternal bir immün tepki vardır ve bu tepki 12. haftadan itibaren artan
titrede anti-paternal HLA antikorlarının ve paternal antijenlere karşı maternal sitotoksik T
hücre cevabının gelişmesi olarak açıkça belirir. Ancak fetal/paternal antijenlere karşı otolog T
hücre cevabını modüle eden maternal baskılayıcı T hücre etkinliği de ortaya çıkar ve böylece
fetusa karşı gelişebilecek hümoral ve hücresel tepkiler baskılanır. Fare deneyleri, gebelikte 3
tip baskılayıcı hücrenin çalıştığını gösteriyor: Lenfoid dokuda bulunan ve T hücre
karakteristiği göstermeyen baskılayıcı hücreler; klasik baskılayıcı T hücreleri ve baskılayıcı
faktörler sentezleyen trofoblast hücreleri. Gebelik sırasında annede IgG sınıfı blokan
antikorlar da gelişir. Bu antikorlar paternal antijenleri bloke ederek, bunların maternal immün
sistem tarafından tanınmasını önlerler ve paternal antijenlere karşı maternal lenfosit cevabını
baskılarlar. Blokan antikorlar gebe olmayanlarda bulunmamıştır (25).
Trofoblast, ovumu uterus duvarına bağlar ve embriyonun beslenmesini sağlar; koryon
ve amniyonu oluşturur. Trofoblastın koryonik villusu örten iç tabakasına sitotrofoblast, dış
18
tabakasına sinsisyotrofoblast denir. Trofoblast hücreleri IFN-γ ile uyarılmalarına rağmen (ilk
trimesterde HLA-C ekspresyonu hariç), MHC sınıf-I ve sınıf-II moleküllerini eksprese
etmezler ve bu nedenle bir antijen sunucu hücre (ASH) gibi fonksiyon yapamazlar. Bu durum
fetusu maternal T hücre ataklarından korur. Bu hücreler yapısal olarak, sadece HLA-G
eksprese ederler. Bu molekül, düşük düzeyde olmak üzere başka dokularda da eksprese
edilebilir. HLA-G, β2 mikroglobülin ile birleşip düşük düzeyde polimorfizm gösterebilir.
CD8 molekülü, HLA-G'yi tanır ve ona bağlanır. Trofoblastlarda HLA-G ekspresyonu, ilk
trimesterde çok yüksek düzeyde olup 3. trimesterde iyice azalmış bulunur. HLA-G antijeninin
fonksiyonu tam bilinmemekle beraber, semiallogenik fetusa karşı, annenin immün
toleransında önemli bir rol oynadığı sanılıyor. Desidua hücrelerinin öldürücü hücre inhibitör
reseptörler (KIR) ve CD94/NKG2 reseptörlerini eksprese ettiği gösterilmiştir. Bu reseptörler
trofoblastlardaki HLA-G'yi tanırlar. Böylece, alloantijenlere karşı hücresel immün cevabın
komponenti olan NK hücreleri, trofoblastlarda eksprese edilen HLA-G molekülleri ile silahsız
bırakılır. MHC sınıf-I molekülleri, öldürücü hücre inhibitör reseptörleri (KIR) için
liganddırlar ve hücre yüzeyinde yer almadıklarında, normal olarak sitolitik NK hücre cevabı
tetiklenir. NK hücrelerinde muhtemelen birden fazla farklı KIR bulunmaktadır. NK
hücrelerinin, inhibitör KIR'ları aracılığı ile hücre yüzeylerindeki sınıf-I moleküllerini spesifik
olarak tanımaları, onları sitolitik aktivite göstermekten alıkoyan HLA-G ise muhtemelen
bütün NK hücre serilerinin sitolitik aktivitesini bloke etmektedir. Bu inhibisyon, anti-HLA-G
monoklonal antikorları ile ortadan kaldırılabilir. Trofoblastlarda HLA-G ekspresyonu fetusa
karşı maternal toleransın oluşmasında önemli rol oynar. NK hücreleri ise trofoblast saldırısını
sınırlamada rol oynarlar (25).
Plasentaya, gebelikteki fizyolojik aktiviteleri düzenleyen bir immün organ gibi
bakılabilir. Plasenta protein ve steroid hormonlar sentezler; fetal akciğer, böbrek, ince barsak
ve karaciğer gibi fonksiyon yapar; materno-fetal ünitte immün regülasyona katılır. Plasenta
immün süzgeç gibi çalışan güçlü bir bariyerdir ve paternal antijenlere karşı oluşmuş
antikorları dolaşımdan toplayarak, bunların fetusa ulaşmalarını engeller. Bu antikorlar
pinositoz ile alınırlar ve potent trofoblastik proteazlar ile yıkılarak zararsız hale getirilirler
(25).
Trofoblastlar, başlıca GM-CSF, IL-3, IL-10, CD4 ve CD13 molekülleri ile LIF
(lösemi inhibitör faktör) reseptörü ve Fc reseptörünü eksprese ederler; TNF-α, IL-1 ve TGFβ'ya cevap verebilirler. Bu nitelikleri ile makrofajlara benzerlik gösterirler. Plasentada
19
makrofaj fonksiyonu zayıftır. Fc reseptörlerinin plasentada varlığı, anneden fetusa IgG
geçişini kolaylaştırır. Anti-paternal antikorlar anneden fetusa geçemezken, bu yol düzenli
olarak işler. Ayrıca trofoblastlardan immünosüpresif birtakım faktörler de salınır. Prensip
olarak, gebelik boyunca materno-fetal karşılıklı yüzeyler immün cevaplardan korunmuş
durumda bulunurlar (25).
Fetal karaciğer tarafından yapılan α-fetoprotein’in proliferatif T hücre cevaplarını
baskıladığı gösterilmiştir. Amniyotik sıvıda ve fetal serumda, α -fetoprotein ilk trimesterde
yüksek düzeyde olup doğumdan sonra titresi azalarak kaybolur. Makrofajlardan derive olan
TNF-α'nın gebelik boyunca aşırı ekspresyonu spontan abortusa neden olur. Spermin,
biyojenik bir amin olup fetuin aracılığı ile mononükleer hücrelerde sentezlenen TNF- α ve
diğer proenflamatuvar sitokinleri inhibe ederek, immün cevabın kontrolüne yardımcı olur.
Fetuin ve spermin fetusta ve amnion sıvısında yüksek düzeyde bulunurlar. Gebelikte,
immünosüpresif niteliklere sahip birtakım başka glikoproteinler de ortaya çıkarlar
(ovomukoid, α2-makroglobülin, β1-glikoprotein...) Ayrıca immünojenik cevapların potent
inhibitörleri oldukları bilinen PGE2 ve TGF-β'nın, deneysel modellerde, uterusta yüksek
yoğunlukta bulunduğu bildirilmiştir (26, 27).
Seks hormonlarının (östrojen, progesteron ve β-human koryonik gonadotropin)
plasentadaki
lokal
konsantrasyonları,
sistemik
konsantrasyonlarının
5-10
katıdır.
Fetoplasental hidrokortizon yapımı da artmıştır. Bu durum, Th2 hücre gelişimini kolaylaştırır
ve lenfosit proliferasyonunu, NK hücre aktivasyonunu ve TNF yapımını baskılayan blokan
faktörlerin yapımını indükler. Bu hormonların, kemotaksisi, B hücre fonksiyonunu ve T
hücrelerinin antikora bağımlı sitotoksisitesini azalttıkları ve graft rejeksiyonunu baskıladıkları
gösterilmiştir. Koryonik gonadotropin yapımının, anne ve baba arasında ancak yeterli MHC
farklılığı varsa mümkün olduğu bildirilmiştir. Bu hormon ayrıca süpresör hücre oluşmasını da
indükler (25).
Gebelik sırasında fetusun da süpresyona etkin biçimde katıldığı gösterilmiştir. Fetusun
ve yenidoğanların lenfositleri, maternal lenfositlerin mitojenlere proliferatif cevabını
baskılarlar. Fetusta, bir immünosüpresif faktör olan serum apoprotein E konsantrasyonu
yüksektir. Ayrıca maternal T hücrelerine karşı kordon kanında lenfositotoksik antikorların
bulunduğu da gösterilmiştir. Fetusta opsonin düzeyi düşüktür. Anneden fetusa kompleman
komponentleri
geçmez.
Gebeliğin
6-14.
haftasından
itibaren,
fetus
kompleman
komponentlerini sentezleyebilir, fakat düzeyleri 3. trimestere kadar düşük kalır. İnsan dahil
20
bütün türlerde, gebelikte cereyan eden olaylar moleküler ve hücresel düzeyde hemen hemen
aynıdır. MHC sınıf-I ve MHC sınıf-II antijen-negatif trofoblastlar, maternal ve fetal
dolaşımları birbirinden ayırırlar; MHC sınıf-II bağımlı antikor yapımına izin verilir; MHC
sınıf-I kısıtlı sitotoksik T lenfosit (CTL) cevaplarına ve NK hücre aktivitesine izin verilmez.
Gebelik boyunca uterusta antijene cevap verebilen T hücreleri bulunmaz. Patojene güçlü Th1
cevabı gebeliği riske sokabilir, ilginç olarak, gebe hayvanlarda uterusta γδT hücreleri, gebe
olmayanlardakinden 100 kat fazla bulunmuştur. Gebelikte bu hücrelerin uterusta yüksek
yoğunlukta bulunmalarının nedeni bilinmemektedir (25).
2.1.6.2. Gebelerde İmmün Sistem
Gebelik immün sistemdeki değişikliklere eşlik eden, annenin immün sisteminin baba
kaynaklı MHC antijenlerine tolere kalmak zorunda olduğu ve mikroorganizmalara karşı
savunmada normal immün yeterliliğin sağlandığı immünolojik olarak dengede bir durumdur.
Anne ile fetus arasındaki immünolojik ilişki çift yönlü bir iletişimdir. Bu iletişim bir taraftan
fetal antijen sunumu, diğer taraftan maternal immün sistem tarafından bu antijenlerin
tanınması ve bu antijenlere reaksiyon gösterilmesi olarak tanımlanabilir (3, 4, 5).
Timus gebelikte dramatik olarak değişime uğrar. Korteks büzüşür, medülla büyür.
CD4+ ve CD8+ kortikal timositler kaybolurken, diğer alt gruplar kalır (Ekzojen
glükokortikoidlerin yüksek düzeylerinin CD4+ CD8+ hücrelerde apoptozu indükledikleri
gösterilmiştir). Gebeliğin sonunda, timusun ağırlığı ve timosit sayısı belirgin biçimde azalmış
bulunur. Fare deneyleri, envolüsyonun derecesini dolaşımdaki hormon seviyelerinin
belirlediğini göstermiştir. Laktasyon durunca maternal timus süratle normale döner. Timusun
gebelikteki bu envolüsyonunun paternal ve/veya fetal antijenlere potansiyel reaktif klonların
delesyonu ile ilişkili olabileceği sanılmaktadır (25).
Gebe, gebelik boyunca T hücrelerine bağımlı, bilinen mekanizmalar açısından immün
defekt göstermez ve gebelik boyunca immün kompetan kalır. Ancak gebelikte maternal
immün cevaplar yine de bazı değişikliklere uğrar. IL-2 oluşturan Th1 sitokin profili gebelik
süresince baskılanır ve profil Th2 yönüne kayar. Th1 cevabı fetus için zararlı olabilir. Çünkü
fetal allograftın rejeksiyonunu provoke eder; bu nedenle Th1 cevabı, Th2 hücre etkinliği
altında gebelik boyunca aşağıya çekilmiş olarak tutulur. Gebe kadında Th1/Th2 sitokin oranı
belirgin biçimde düşüktür ve bu, doğumdan sonra da bir süre devam eder. Desidual Th1
hücrelerinin azalması, Fas-Fas Ligand (Fas-FasL) aracılığı ile oluşan apoptozdan ileri
21
gelebilir. Th2 baskınlığı özellikle feto-plasental çevrede belirgindir. Feto-plasental ünitten
alınan süpernatantlarda, artmış IL-4, IL-5, IL-10 ve IL-3 düzeyleri saptanır. IFN-γ
ekspresyonu geçici olarak baskılanmıştır. Gebelikte nötrofil aktivitesi de belirgin olarak
azalmış bulunur. Th2 baskınlığına uygun olarak maternal immün cevap hücresel immüniteden
uzaklaşır ve antikor yapımına doğru kayar. Gebe farede immünglobülin izotipi, kompleman
fikse eden, fetal alloantijenlere reaktif olan IgG2a (insanda IgG1) izotipinden IgG1 (insanda
IgG4) izotipine yönelir (25).
Gebelerde maternofetal karşılıklı yüzeylerde Th2 sitokin yapımının artmış bulunması,
fetal yaşam bakımından önemlidir ve muhtemelen, immünolojik toleransı korumaya yönelik
bir durumu ifade eder. NK aktivitesi gebede azalmıştır. Farelerde, IFN- γ ile NK aktivitesinin
indüklenmesi fetal rezorbsiyona yol açar. Uteroplasental TNF-α yapımı gebelik süresince
artsa bile, sitokin, sinsisyotrofoblastlar tarafından sentezlenen solübl TNF-α reseptörleri ile
nötralize edilir. Gebelerde CD4+ T hücrelerinin azaldığı, baskılayıcı CD8+ T hücrelerinin
arttığı ve B hücre immünitesinin değişmediği bildirilmiştir (25).
Gebelik süresince yukarıda özetlenen bu değişmelerin, hücre-içi patojenler (bazı
viruslar, T. gondii, M. tuberculosis, L. monocytogenes...) lehine bir durum yarattığı
düşünülebilir. Gebelerde malarya ağır komplikasyonlarla seyredebilir; suçiçeği pnömonisi
öldürücü olabilir; gebeliğin özellikle son trimesterinde hepatit E virüsü enfeksiyonunda
mortalite yüksektir (% 20). Ebstein Bar Virüsü (EBV) gebelikte sıklıkla reaktive olur. Gebe
kadınlarda EBV enfeksiyonu asemptomatik seyreder, doğumdan sonra kesilir. Ancak
istisnalar dışında, gebe kadının enfeksiyon hastalıklarına daha duyarlı olduğuna dair pek az
bilimsel destek vardır. Yine lokal enfeksiyonların gebelikte sıklıkla genelleştiği de
kanıtlanmış değildir. Gebelik sırasında anne ile fetus arasında immünolojik olarak dengeli bir
etkileşim bulunmaktadır. Gebelikte, maternal lenfositlere fetal antijen sunumunun
olmayışından veya maternal lenfosit fonksiyonlarının, maksatlı olarak baskılanmış
tutulmasından dolayı annenin fetusa verdiği immün cevap baskılanmaktadır. Gebe kadın,
enfeksiyona belirgin biçimde duyarlı olmasa bile gebelik, kazanılmış (spesitik) immünitenin
aktif olarak baskılandığı dönem olarak dikkate alınmalıdır. Bununla birlikte, bu baskılanma
maternal doğal immünitenin aktivasyonu ile dengelenir. Gebelikte granülositlerin,
monosit/makrofajların sayıları ve fonksiyonları artmış bulunur. Buna karşılık NK hücrelerinin
sayısı, sitotoksik kapasiteleri ve IFN-γ sentez kapasiteleri azalmıştır. Kompleman sisteminin
komponentleri ve akut faz proteinleri de gebelik süresince artmıştır. Dolayısıyla gebelikte
22
fetusun güvenliğini sağlayan selektif immünolojik değişmelerin, bir immün yetmezlik gibi
değerlendirilmesi doğru değildir. Doğal immünitenin gebelik sırasında aşırı düzeyde aktif
olması, anne yönünden (bazı enfeksiyonların ağırlığında artış, pre-eklampsi) ve fetus
yönünden (düşük riski) zararlı olabilir. İnsanda maternal enfeksiyonlarda pro-enflamatuvar
sitokin yapımı doğum sancılarını başlatarak erken doğumu indükleyebilir (25).
2.2. ADENOZİN DEAMİNAZ (ADA) (EC 3.5.4.4)
2.2.1. ADA’NIN YAPISI
1991’de Wilson ve çalışma arkadaşları Mürin ADA genini, Escherichia coli’de
rekombinant olarak üretmişler ve ADA’nın üç boyutlu yapısını rapor etmişlerdir. ADA’nın
yapısı monomerik olarak katlanma gösterir ve bu enzim 8 santral β zincir ve 8 periferal α
heliks’li paralel α/β-fıçı motifi içermektedir. Bu yapı bilinen enzimlerin yaklaşık %10’unda
bulunmaktadır. İkincil yapı ise 5 α-heliks içermektedir, bunların üçü (H1, H2, H3) α1 ve β1
arasındaki α/β-fıçı modelinin karboksi terminal ucunda yerleşim göstermektedir. Diğer iki
heliks (H4 ve H5) fıçı yapısının uç kısmının karşısında anti-paralel loop oluşturur. Enzimin
uzun şekilli aktif derin bölgesi COOH-terminal segmentler tarafından kaplanmıştır ve β
zincirinin loop’u ile bağlantı kurmaktadır. Deaminasyon mekanizmasına doğrudan katılan
aktif bölge çinko atomu içermektedir. Çinko kofaktörü fıçı motifinin COOH-terminal ucunun
derin cep kısmında yerleşmiştir. Enzim/substrat bağlantısının stereospesifikliği çinko’nun ve
histidin ve aspartat kalıntılarının yerleşimine bağlıdır. Substrat bağlantısını ve geçiş bölgesini
sabitleyen ve kararsız duruma sokan, enzim ile substrat arasında birçok hidrojen bağı
bulunmaktadır. Hidrojen köprülerine katılan substrat atomları pürin halkasının 3. ve 7.
azotunu ve riboz halkasının 3 ׳ve 5 ׳hidroksil gruplarını içermektedir (28, 29, 30).
Chang ve arkadaşları memelilerdeki ADA’nın esas katalitik fonksiyonlarını yerine
getiren aminoasitlerin Cys262 (sistein), Asp295 (aspartat), Asp296 ve His214 (histidin)
olduğunu ileri sürmüşlerdir. Çinko kofaktörünün varlığını ve katalitik rolünü ilk kez 1991’de
Wilson ve arkadaşları kristallografik teknikler kullanarak rapor etmiştir. Çinko iyonunun
koordinasyonu His15, His17, His214 ve Asp295 kalıntıları tarafından sağlanır. Çinko iyonu
bu dört kalıntı tarafından tetrahedral bir geometri içinde düzenlenir. Çinko kofaktörü, Asp295
ligandını paylaşan su molekülünü polarize etmekte, bu su molekülüne yakın His238 su
molekülünden bir proton çıkartmakta ve böylece adenozin deaminasyonuna katılan hidroksil
23
grubu açığa çıkmaktadır. Bu hidroksil grubu Asp295, His238 ve çinko etkileşimi aracılığıyla
substratın 6. karbonuna bağlanır. Asp295 katalitik su molekülü ile hidrojen bağı kurmakta ve
katalitik su molekülü ile ligand bölgesi arasında bir çinko iyonu paylaşmaktadır. Asp296 ve
Gly184 (glisin) kalıntıları adenozinin 7. ve 9. azotu ile hidrojen bağı kurmaktadır. ADA’nın
birincil yapısı birçok türde tanımlanmıştır. Fare ve Escherichia coli (E. coli) dizileri yaklaşık
olarak % 33 benzerken, fare ve insan dizileri % 83 benzemektedir. Bu diziler substrat
bağlama ve kataliz bölgeleri için kritik öneme sahip kalıntılar içermektedir. Bu kalıntılar
kristallografik tekniklerle tespit edilir (29, 30).
ADA’nın sekiz zincirli üçüncül yapısı TİM-fıçı motifi içermektedir. Bu yapı ilk kez
triozfosfat izomeraz’da tanımlandığından dolayı bu isim verilmiştir. Bütün TİM-fıçı motifine
sahip enzimlerin β zincirlerinin C-terminal ucunda aktif bölgeleri vardır ve bu enzimleri çoğu
aktif bölgesini örten esnek βα loop yapısına sahiptir (30).
ADA’nın iki çeşit inhibitörü vardır. Bu inhibitörler enzimin substratına (adenozin
yada 2׳-deoksiadenozin) ve reaksiyonun tetrahedral geçiş formuna benzemektedir. Bu
inhibitörler sırasıyla temel durumdaki ve geçiş durumundaki inhibitörler olarak adlandırılır.
Bu inhibitörler araştırmalarda, viral enfeksiyon terapilerinde ve malign hücrelerde özellikle
bu bileşiklere hassas olan lenfoproliferatif bozuklukların bazılarında kullanışlıdır. Ayrıca bu
ilaçların insan B ve T hücre malignitelerinde immün cevabı düzenlediği bilinmektedir (28).
2.2.2. ADA’NIN GENEL ÖZELLİKLERİ VE FİZYOLOJİK ROLLERİ
Hücrelerin normal fonksiyon ve hücre çoğalması nükleotidlerin sentezine bağlıdır.
Nükleotidlerin sentezi DNA ve RNA sentezinde ve diğer metabolik yollarda kullanılmak için
de novo yada pürin kurtarma yoluyla (pürin salvage yolu) gerçekleşmektedir. ADA adenozin
ve 2׳-deoksiadenozin’in sırasıyla inozin ve 2׳-deoksiinozin’e geri dönüşümsüz hidrolitik
deaminasyonunu katalizleyen pürin metabolizma enzimidir. Bu enzim (EC 3.5.4.4) hidrolitik
mekanizmasından dolayı adenozin aminohidrolaz olarak da adlandırılır. Bu deamine olmuş
nükleozidlerin ileri metabolizmasıyla hipoksantin oluşur, hipoksantin de ksantin oksidaz
tarafından ürik aside dönüştürülebilir yada hipoksantin-guanin fosforiboziltransferaz etkisiyle
pürin kurtarma yolunda mononükleotidlere dönüşebilir. Pürin metabolizmasının son ürünü
olan ürik asid seviyesi, ADA eksikliği görülen çocukların plazma ve idrarında normal olduğu
için ADA’nın rolünün katabolik olup olmadığı açık değildir. Pürin nükleotid katabolizması
Şekil 1’de gösterilmiştir (1, 28, 29, 30).
24
Şekil 1. Pürin nükleotid katabolizması
Adenozin ve 2׳-deoksiadenozin’den başka doğal olarak değişikliğe uğramış bazı
adenin nükleozidleri bu enzimin substratı olabilir. Bunların arasında 1-metil-adenozin, N6metiladenozin ve N6, 2׳-O- dimetiladenozin yer almaktadır. Bu maddeler normal ve/veya
ADA eksikliği olan kişilerin idrarında bulunabilir. Adenozin ve 2׳-deoksiadenozin için Km
değeri sırasıyla 45 ve 34 µM’dür ve aktivite için optimum pH nötral aralık içindedir (28).
ADA’nın hücre dışı formuna Ekto-ADA denilmektedir. ADA bazı hücrelerde EktoADA formunda bulunmaktadır. Ekto-ADA bazı hücreler arasında, hücre-hücre bağlantıların
kurulmasını sağlamaktadır. Böylelikle Ekto-ADA lenfoid dokuların gelişimine ve
lenfositlerin olgunlaşmasına katkıda bulunur (28).
25
ADA lenfoid hücre farklılaşmasındaki esas rol oynayan enzimdir. İmmünitenin
değiştiği çoğu hastalığın kontrolünde kullanılmıştır. Hücresel immünitenin bir göstergesi
olarak, bu enzimin serum aktivitesi hücre aracılı immün yanıta neden olan çeşitli otoimmün
ve inflamatuar hastalıklarda değişmektedir (Tablo 2). Lenfosit ya da monosit-makrofaj hücre
sistemi ADA aktivitesindeki değişiklere katkıda bulunabilir, bununla birlikte ADA
aktivitesindeki
değişiklerin tam mekanizması
aydınlatılmamıştır.
Bu
enzim
insan
dokularında, özellikle lenfoid dokularda, yaygın dağılım göstermekte ve insan kan monosit ve
makrofajlarının olgunlaşma ve fonksiyonunda rol almaktadır. ADA aktivite düzeyi,
lenfositlerin ve monosit-makrofaj hücre sisteminin mitojenik cevabı sürecinde artar. Bu
nedenle lenfosit ve monositlerde fizyolojik ADA aktivitesi, bu hücrelerin farklılaşma ve
çoğalmasıyla ilgilidir. Bundan dolayı, ADA hücre-aracılı immünitenin önemli bir
immünoenzim belirteci olarak tanımlanmaktadır. En yüksek ADA aktivitesine lenfositler,
özellikle T lenfositler ve monositler sahiptir. ADA aktivitesi, T4 lenfositlerde T8 lenfositlere
oranla daha yüksek düzeyde bulunur. T hücrelerindeki ADA aktiviteleri B lenfositlerine göre
daha yüksektir. ADA düzeyleri, T hücre aktivasyonunun ve hücresel immünitenin spesifik
olmayan bir belirteci olarak kabul edilmektedir (1, 2, 6, 31, 32, 33).
Tablo 2. ADA aktivitesinin değiştiği hastalıklar
Romatoid artrit
Sistemik lupus eritematozus (SLE)
İnfeksiyöz mononükleoz
Tifo
Bruselloz
Akut pnömoni
Sarkoidoz
Karaciğer hastalıkları
Akut lösemi
Çeşitli maligniteler
Behçet hastalığı
Tüberküloz
26
İnsanlarda en yüksek ADA aktivitesi timus ve diğer lenfoid dokularda, en düşük
aktivite ise eritrositlerde bulunmuştur. İnsanlarda lenfoid olmayan dokular arasında, nispeten
yüksek ADA aktivitesi duodenumu kaplayan epitelyal hücre villilerinde bulunmuştur.
Gastrointestinal sistemin diğer bölgelerinde ADA aktivitesi daha düşüktür. ADA ekspresyonu
türler arasında farklılık göstermektedir. Örneğin farelerde, ADA aktivitesi proksimal sindirim
sistemindeki epitelyal hücrelerde timus’a göre 10 kat daha yüksektir (29).
ADA eksikliği hücresel immünitenin bozulduğu, B ve T lenfosit disfonksiyonu ve
immünglobulin (Ig) üretiminde azalma görülen otozomal resesif yaygın kombine immün
yetmezlik hastalığına (SCID, severe combined immunodeficiency disease) neden olur. Bu
hastalıkta ADA’yı kodlayan gende tek bir defekt (kromozom 20q13.11) görülmektedir. SCID
genellikle yaşamın ilk birkaç günü içinde ölümle sonuçlanır. İmmün yetmezlik ile ADA
eksikliği arasındaki ilişki, infant SCID’lerde kemik iliği transplantının değerlendirilmesinde,
eritrositlerdeki enzim yokluğunun bulunması ile keşfedilmiştir. SCID’de vücuttaki bütün
hücrelerde ADA enzim aktivitesi kaybolmasına rağmen sadece immün sistem anlamlı şekilde
etkilenmektedir. Yapılan çalışmalar göstermektedir ki; SCID’deki immün yetmezliğin nedeni
olgunlaşmamış lenfositlerin ADA substratlarının (adenozin ve/veya 2׳-deoksiadenozin) toksik
etkilerine çok hassas olmalarıdır. Bununla birlikte lenfotoksisitenin tam moleküler
mekanizması aydınlatılamamıştır. ADA eksikliğinde, yükselmiş adenozin hücre sinyal
mekanizmasında bozukluğa ve yükselmiş 2׳-deoksiadenozin metabolik bozukluğa neden olur
(29,30).
2.2.3. ADA’NIN ENZİMATİK AKTİVİTESİ VE ADENOZİN’İN ETKİLERİ
ADA’nın enzimatik aktivitesi adenozin seviyesini düzenlemektedir. Adenozin nükleik
asidler için metabolik bir öncüldür ve çeşitli fizyolojik mekanizmaların düzenlenmesinde
önemli bir sinyal molekülüdür. Adenozin’in fizyolojik fonksiyonlarının, adenozin’in serbest
formuyla (ekstraselüler adenozin) bağlantılı olduğu düşünülmektedir. Ekstraselüler adenozin,
adenozin reseptörleriyle etkileşerek hücre içinde bazı değişikliklere neden olur. Bu
değişiklikler Tablo 3’te gösterilmiştir. Bu etkilerin yanında, günümüzdeki çalışmalar
ekstraselüler adenozin’in hücre çoğalması ve farklılaşmasının yeni bir göstergesi olarak
tanımlanmaktadır. Bazı dokularda adenozin salınımının hipoksi ile uyarıldığı gösterilmiştir.
Reseptör bağlı adenozin aktivitesinin azalması, adenozinin hücre membranından transportuna
ve daha ileri metabolizmasına bağlıdır. Transmembran Na+ gradiyentiyle sağlanan aktif
27
transport ve kolaylaştırılmış difüzyon bu amaçla kullanılmaktadır. Bu transport sistemlerinin
inhibisyonu,
adenozinin
etkilerini
şiddetlendirmektedir.
Ekstraselüler
adenozin
konsantrasyonunun azalması (ve böylece etkilerinin azalması) ADA tarafından yapılmaktadır
(29, 30).
Tablo 3. Adenozin’in etkileri
Koroner vazodilatasyon
Kalp ritminde ve kontraktil gücünde azalma
Trombosit agregasyonunun inhibisyonu
Mast hücre degranülasyonu
Eozinofil göçünün inhibisyonu
Renal vazokonstriksiyon
Hormon salınımı
Uyku indiksiyonu
Hipoksi
İyon
kanal
aktivitesinin,
membran
potansiyelinin
ve
nörotransmitter
salınımının düzenlenmesi
2.2.3.1. Adenozin Reseptörleri
Adenozin reseptörleri diğer G protein bağlı reseptörler gibi intraselüler COOH
terminal uç ve ekstraselüler amino terminal uç ile yedi tane transmembran sarmal içerir.
Memelilerde tanımlanmış dört tip adenozin reseptörü vardır. A1 ve A3 reseptörleri Gi
proteiniyle bağlıyken, A2a ve A2b Gs proteiniyle bağlıdır. Bu reseptörler tipik olarak adenilat
siklaz-cAMP sinyal yoluyla ilişkilidir. A1 ve A3 ayrıca fosfolipaz C ve Ca+2 aracılığıyla
sinyal üretmektedir. A1 reseptörünün sinyal yolundaki adenilat siklazın inhibisyonu, ikinci
haberci olan cAMP’nin azalmasına neden olur. cAMP’de, cAMP bağımlı protein kinazı
aktive etmektedir. A1 reseptörünün başka bir sinyal mekanizması da fosfolipaz C
aktivasyonudur.
inozitoltrifosfat
Fosfolipaz
ve
C
diaçilgliserol
membran
üretimini
fosfoinozit
ve
+2
Ca
mekanizmasını
hareketliliğini
+2
sağlayarak
arttırmaktadır.
İnozitoltrifosfat ile sitozolik Ca un artması protein kinaz C, fosfolipaz A2, Ca+2-bağımlı K
kanalları ve nitrik oksit sentazı içeren bir çeşit sinyal yolunu uyarmaktadır (29).
28
A3 reseptörünün adenilat siklaz aktivitesini inhibe ettiği gösterilmiştir. A3 reseptörü
Gia2-Gia3 ve daha az miktarda Gq/11 proteiniyle bağlanır, protein kinaz C’yi aktive eder ve
inozitoltrifosfat ve intraselüler Ca+2 miktarını düşürür. A2a ve A2b reseptörleri için
tanımlanmış sinyal iletim mekanizması, adenilat siklaz aktivasyonuyla ilişkilidir (29).
Reseptöre
bağlı
adenozin’in
etkilerinin
sonlanması,
adenozinin
plazma
membranından transportuna ve daha sonra metabolize olmasına yol açar. Adenozin hidrofilik
bir moleküldür ve hücre membranındaki hareketi için gelişmiş bir transport sistemine
gereksinim vardır. İki tip nükleosid transport sistemi vardır: kolaylaştırılmış difüzyon ve
hücre içine yönlenmiş transmembran Na+ gradiyenti ile (Na+ /adenozin kotransporterleri)
gerçekleşen
aktif
transport.
Bu
transporterlerin
inhibisyonu
adenozinin
etkilerini
arttırmaktadır. İntraselüler adenozin kinazın nispeten yüksek aktivitesinden dolayı hücre içi
adenozin konsantrasyonu normalde düşüktür, bu nedenle net akış hücre içine doğrudur.
Bununla birlikte, intraselüler adenozin konsantrasyonunun yükseldiği durumlarda bu
transporterler adenozini serbestleştirebilir (29).
2.2.4. Ekto-ADA
Ekto-ADA, ADA’nın integral membran proteinleriyle hücre dışına bağlı olan bir
formudur. ADA monosit ve B lenfositlerin çoğunda ve T lenfositlerin bazılarında (%10-20)
ekto-enzim olarak bulunmaktadır. Ekto-ADA ekspresyonunun, B hücre kökenli soylarda
(SKW 6.4 hücreleri:%95+/-5) yüksek, T hücre kökenli soylarda (Jurkat hücreleri:%10-20)
düşük
olduğu
ve
kronik
miyeloid
lösemi’den
kaynaklanan
hücrelerde
(KS
62
hücreleri:%32+/-8) azaldığı gösterilmiştir. B hücrelerindeki ekto-ADA ekspresyonunun daha
yüksek olmasından başka, ekto-ADA eksprese eden B hücrelerinin plazma membranındaki
ADA molekül sayısı ekto-ADA eksprese eden T hücrelerininkinden daha yüksektir. Bunun
tersine, total enzim aktivitesi T hücrelerinde B hücrelerinden daha yüksektir. Sitozolik ADA
ve ekto-ADA arasında katalitik aktivite ya da moleküler karakteristik bakımından şu ana
kadar herhangi bir farklılık görülmemiştir (28, 29).
Ekto-ADA’nın enzimatik aktivitesinden bağımsız fonksiyonları da vardır. Bu
ekstraenzimatik fonksiyonlar ekto-ADA’nın farklı hücre yüzey moleküllerine (CD26 ve
adenozin
reseptörleri)
bağlanmasıyla
ilişkilidir.
Ekto-ADA
muhtemelen
reseptörlerinin ve/veya CD26’nın ko-stimülatörü olarak rol oynamaktadır (29).
29
adenozin
2.2.4.1. Ekto-ADA’nın CD26 ile bağlanması
ADA’ya bağlanabilen ilk hücre yüzey proteini 1993’te Kameoka ve arkadaşları
tarafından CD26 olarak tanımlanmıştır. CD26 yaklaşık olarak her biri 100 kDa olan iki tane
benzer alt birim içeren tipII membran sialoglikoproteinidir. İnsan CD26 proteini 22 amino
asitli hidrofobik transmembran bölgede ekstraselüler olarak bulunur ve ayrıca NH2
terminaline benzeyen sadece 6 aminoasid içeren bir sitoplazmik kuyruğa sahiptir. CD26
polipeptidlerin N-terminal ucundan dipeptidleri ayıran enzim aktivitesine sahiptir. Bu nedenle
CD26, dipeptidil peptidaz IV olarak da adlandırılır. Fakat CD26’nın substratı ve enzimatik
aktivitesinin kesin fizyolojik rolü bilinmemektedir (28, 29).
CD26’nın fizyolojik rolü, T hücre aktivasyonuyla (hücreler aktive olduğunda CD26
ekspresyonu belirgin şekilde artmaktadır) ilişkilidir. CD26 çoğu hücre tipinde bulunmaktadır,
hatta istirahat halindeki T hücrelerde de bulunmaktadır. CD26’ya karşı oluşmuş farklı
monoklonal antikorlar T hücre uyarısıyla sonuçlanan sinyaller üretebilir. Ekto-ADA ile
CD26’nın bağlanması ekstraenzimatik olarak gerçekleşir. Çünkü ne ADA’nın deaminaz
aktivitesi ne de CD26’nın proteaz aktivitesi bu iki molekülün bağlanması için gereklidir (29,
30).
2.2.4.2. Ekto-ADA’nın immün sistem gelişimindeki rolü
ADA’nın SCID ile ilişkisi ve T ve B lenfositler ve lenfoid dokulardaki ADA dağılımı
üzerine yapılan biyokimyasal ve immünomorfolojik çalışmalar, ADA’nın T ve B lenfosid
farklılaşmasıyla ilişkisini göstermektedir. Hücre gelişiminin farklı aşamalarında farklı enzim
aktiviteleri görülür. ADA’nın farklı hücrelerde bulunması heterojenlik gösterir (28).
Ekto-ADA’nın lenfoid dokuların gelişimi ve lenfositlerin olgunlaşması için önemli
olan hücre-hücre bağlantısında önemli rolleri vardır. Bazı hücre-hücre bağlantıları Şekil 2’de
gösterilmiştir. Birinde, ekto-ADA CD26 eksprese eden iki hücre arasında bir köprü gibi rol
oynamaktadır. Diğerinde, ekto-ADA CD26 eksprese eden hücre ile A1 reseptörü eksprese
eden diğer hücre ile spesifik bağlantıyı sağlamaktadır. T hücre yüzeyindeki serbest CD26
molekülleri ekto-ADA ile etkileşime girerek epitel hücre yüzeyine CD26 yada A1
reseptörüyle bağlantı kurmaktadır. Ekto-ADA farklı hücre tipleri arasındaki adezyon
molekülü olabilir. Ekto-ADA globüler bir protein olmasına rağmen, aktif bölgenin etrafındaki
hidrofobik alanlarda toplanmaktadır. Bu hidrofobik alanlar CD26 ve A1 reseptörüyle
etkileşime girebilir (28).
30
Ekto-ADA hücreden hücreye bilgi aktarımını kolaylaştırırsa, muhtemelen lenfoid
dokularda ekto-ADA, lenfositler (T yada B) ile lenfositler yada lenfositler ile stromal hücreler
arasında spesifik etkileşimlere aracılık edebilir. Ekto-ADA tarafından sağlanan bilginin
niteliği, iletişim kuran iki hücreden her birindeki ekto-enzim ile hangi molekülün bağlantı
kurduğuna dayanmaktadır (CD26/ADA/CD26, CD26/ADA/A1R, A1R/ADA/A1R) (Şekil 2).
Şekil 2. T hücreler ile B (yada T) hücreler arasında ve T hücreler ile stromal
hücreler arasındaki hücre-hücre etkileşimlerindeki ekto-ADA’nın rolleri
2.2.5. ADA İZOENZİMLERİ
İnsanda ADA, farklı optimal pH, substrat özgüllüğü ve moleküler ağırlıklarına sahip
üç izoenzimden oluşmaktadır. Bu izoenzimler ADA-1, ADA-1+CP ve ADA-2 olarak
adlandırılır. ADA-1 moleküler ağırlığı yaklaşık 35 kDa olan monomerik bir protein olup, gen
lokusu
20.
kromozomda
yer
almaktadır.
ADA-1+CP’nin
bağlayıcı
bir
protein
(CP:Compounding Protein) ile birleşen iki ADA-1 molekülünden oluştuğu, 2 ve 6 numaralı
kromozomlarca kontrol edildiği düşünülmektedir. ADA-1+CP’nin moleküler ağırlığı yaklaşık
280 kDa’dur. ADA-2 ise ayrı bir protein olup, hangi kromozom tarafından kontrol edildiği
bilinmemektedir (31, 34, 35).
İzoenzim aktiviteleri incelenecek olursa, normal serumda ADA-1 aktivitesine
rastlanmaz, yanlıca ADA-1+CP ve ADA-2 aktivitesi saptanır. Serumda, ADA aktivitesini
31
oluşturan baskın izoenzim ADA-2’dir. Karaciğer, pankreas ve kas dokusunda olduğu gibi
akciğer dokusunda da baskın ADA izoenzimini, ADA-1+CP’nin oluşturduğu görülmektedir.
Vücutta en yüksek oranda ADA aktivitesine sahip olan lenfosit, monosit ve nötrofillerde,
baskın izoenzim ADA-1 iken ADA-2 aktivitesine yalnızca monositlerde (total ADA
aktivitesinin % 18’i) rastlanmıştır. Bu nedenle, ADA-2’nin tek başına monosit-makrofaj
hücre sisteminden kaynaklandığı düşünülmektedir. ADA-2 monosit-makrofaj hücre sistemine
özel bir enzimdir (31, 36).
ADA-2, yalnızca monositlerde ve sadece % 18 oranında aktivite gösteriyorken,
serumdaki major izoenzim aktivitesini oluşturuyor olmasını açıklamak güç gibi
görünmektedir. Bu durum, ADA-2’nin monositler tarafından aktif olarak salgılanıyor
olabileceği veya serumda ADA-2 yarı ömrünün ADA-1’den daha uzun olabileceği teorileri
ile açıklanmaktadır. Serumda ADA-1+CP aktivitesine rastlanıyor iken, hiç ADA-1
aktivitesine rastlanmıyor olması ise, serumda bol miktarda bulunan CP nedeniyle ADA-1’in
bağlanması teorisiyle açıklanmaktadır (31).
İnsanlarda ADA-1 izoenzimi adenozin ve 2׳-deoksiadenozin seviyelerinin azalmasını
sağlamaktadır. 2׳-deoksiadenozinin düşük seviyeleri immün sistem hücrelerinin uygun
fonksiyonu için gerekli olduğundan, bu homeostasis mekanizması çok önemlidir. ADA-1
izoenzimi, 2׳-deoksiadenozini yakalayıp içine almak için etkili mekanizmalara sahip olan
eritrositlerde de bulunmaktadır. Bu nedenle, insanlarda eritrositler dolaşımdaki 2׳deoksiadenozin için bir dializ sistemi oluşturmuşlardır ve bu yolla çekirdekli hücreleri 2׳deoksiadenozinin toksik seviyelerinden korurlar. Hücrelerde ADA-1’in önemi, immün sistem
hücrelerinde 2׳-deoksiadenozin homeostazisinin yetersizliğinden dolayı konjenital ADA-1
yokluğu olan kişilerdeki immün cevabın disfonksiyonu ile gösterilmiştir (37).
ADA-1’in Km değeri 5,2x10-5 M’dır. Optimal pH’sı 7-7,5’tir ve adenozin ve 2׳deoksiadenozine aynı ilgiyi göstermektedir (2׳-deoksiadenozin/ADA-1 oranı 0,75’tir). Bu
özellikler, substrat konsantrasyonu çok düşük olsa bile ADA-1 için pH’nın optimal olduğu
biyolojik ortamlarda substratların (adenozin ve 2׳-deoksiadenozin) deaminasyonunda ADA1’i çok etkili yapmaktadır (37).
ADA-2’nin Km değeri 200x10-5 M’dır. Optimal pH’sı 6,5’tir ve 2׳-deoksiadenozine
zayıf ilgi göstermektedir (2׳-deoksiadenozin/ADA-2 oranı 0,25’tir). Bu özellikler, substrat
konsantrasyonunun çok düşük olduğu ve ADA-2 izoenziminin optimal pH’sından daha
yüksek
pH
değerine
sahip
biyolojik
ortamlarda
32
ADA-2’yi
2׳-deoksiadenozinin
deaminasyonunda yetersiz yapmaktadır. ADA-2 2׳-deoksiadenozin substratına farklı bir ilgi
(çok düşük) gösterirken, her iki izoenzim adenozin substratına benzer ilgi göstermektedir
(37).
2.3. GEBELİKTE İMMÜN SİSTEM VE ADA İLİŞKİSİ
Adenozin Deaminaz (ADA) lenfoid hücrelerin proliferasyon, olgunlaşma ve
fonksiyonu için gerekli olan bir pürin metabolizma enzimidir. Hücresel immünitenin bir
göstergesi olarak, serum ADA aktivitesi Romatoid Artrit, Sistemik Lupus Eritematozus ve
Tüberküloz gibi hücre aracılı immün yanıta neden olan hastalıklarda değişmektedir. Lenfosit
yada monosit-makrofaj hücre sistemi serum ADA aktivitesindeki değişikliklere katkıda
bulunmaktadır. Bununla birlikte serum ADA aktivitesindeki değişikliklerin tam mekanizması
aydınlatılamamıştır (1, 2).
Normal gebelik baskılanmış hücre aracılı immüniteyle karakterize olduğundan,
gebelik boyunca serum ADA aktivitesi değişir. Normal gebe kadınlardaki serum ADA
aktivitesi gebe olmayan kadınlarınkinden daha düşüktür. Normal gebelikte serum ADA
aktivitesindeki azalmaya, lenfosit sayısında azalma eşlik etmektedir. ADA aktivitesindeki
azalma normal gebelik süresince baskılanmış hücre aracılı immünite ile ilişkilidir (1).
Gebelikte serumdaki ADA’nın major kaynağı tam olarak bilinmemektedir fakat
lenfositler yada monosit-makrofaj hücre sistemi ADA’daki değişikliklere katkıda bulunur.
ADA aktivitesindeki azalma lenfosit sayısındaki azalmaya eşlik ettiğinden dolayı
lenfositlerden salınan ADA, normal gebelikteki serum ADA aktivitesinin bir kaynağı olabilir.
Yapılan
çalışmalar
monosit-makrofaj
hücre
sisteminin
serum
ADA2
aktivitesini
düzenlediğini göstermektedir. Th1 hücrelerinden salınan IFN-γ monositlerden ADA
salınımını düzenler. Normal gebelikte Th1 hücreleri ve monositlerden salınan IFN-γ azaldığı
için serum ADA2 aktivitesi normal gebelikte azalma eğilimindedir. Gebelikle ilişkili
östrodiol ve kortizol gibi hormonlar ADA aktivitesinin inhibisyonuna neden olmaktadır. Bu
hormonlar gebelikteki ADA aktivitesinin azalmasıyla ilişkili olabilir (1).
Normal
gebelikte
ADA
aktivitesinde
azalmaya
neden
olan
düzenleyici
mekanizmaların klinik önemi tam olarak aydınlatılamamıştır. Normal gebelikte azalmış ADA
aktivitesi için olası bir durum, immün modülasyonla ilişkilidir. Azalmış ADA aktivitesi
adenozinin inozine deaminasyonunu azaltır, böylelikle adenozin seviyesi normal gebelikte
artış gösterir. Bu durum immün sistemin düzenlenmesinde rol oynamaktadır. Adenozinin
33
sitokin üretimi üzerine güçlü etkileri olduğu için ve adenozin Th1/Th2 dengesini Th2 yönüne
kaydırdığı için azalmış ADA aktivitesi normal gebeliğin devamlılığına dolaylı olarak katkıda
bulunur (1).
34
3. GEREÇ VE YÖNTEMLER
3.1. GEREÇLER
3.1.1. ÇALIŞMA VE KONTROL GRUPLARI
Çalışma grubumuzu Haseki Eğitim ve Araştırma Hastanesi Kadın Doğum-Gebe
Polikliniğinde takip edilen 129 sağlıklı gebe oluşturmaktaydı. Yaşları 18-44 arasında değişen
çalışma grubundaki gebeler 1. trimester (n:38), 2. trimester (n:79) ve 3. trimester (n:12) olarak
3 gruba ayrıldı.
Tüm olgularla yüz yüze görüşülerek yaş, kilo, sigara ve alkol kullanımı, hastalık
varlığı ve daha önce abortus öyküsü olup olmadığı sorgulandı. Sigara ve alkol kullanan,
sistemik ve enfeksiyon hastalığı, gebelik komplikasyonu ve daha önce abortus öyküsü olan
olgular çalışma grubuna dahil edilmedi. Kadın doğum-gebe polikliniğine başvuran gebeler
ultrasonografi ile muayene edildi ve hasta bilgi formu dolduruldu. Bu formda gebelerden
istenen bilgiler Tablo 4’te gösterilmiştir.
Kontrol grubu, sistemik ve enfeksiyon hastalığı olmayan, sigara ve alkol kullanmayan
ve yaşları 17 - 48 arasında değişen 42 sağlıklı kişiden oluşturuldu.
Tablo 4. Prenatal tarama testi için hasta bilgi formunda yer alan bilgiler
Doğum tarihi (gün-ay-yıl)
Kilo
Serum alınış tarihi
Diyabet
Sigara kullanımı
İkiz gebelik
Anensefali
Tüp bebek
Ultrason tarihi
Crown-rump uzunluğu (CRL), Nuchal translucency (NT) (2’li test için)
Biparietal çap (BPD) (3’lü test için)
Ultrasona göre gebelik haftası
35
3.1.2. KAN ÖRNEKLERİ
Çalışma ve kontrol grubuna dahil edilen olgulardan katkısız tüplere alınan kan
örnekleri, yarım saat içinde 3000xg’de 10 dakika santrifüj edilerek serumları ayrıldı. Lipemik
ve hemolizli olan serum örnekleri çalışmaya dahil edilmedi.
Serumdaki enzim stabilitesi 25 oC’de 24 saat, 4 oC’de 7 gün ve -20 oC’de 3 aydır.
Serum örnekleri porsiyonlara ayrılarak, analiz edileceği güne kadar (3 ay içinde) -20 oC’de
saklandı.
Tüm serum örneklerinin ADA, ADA-1 ve ADA-2 aktiviteleri ölçüldü. 1. trimester
grubunun serum örneklerinden, ikili tarama testi için kullanılan Free β-hCG ve Pregnancyassociated plasma protein-A (PAPP-A) değerleri çalışıldı. 2. trimester grubunun serum
örneklerinden ise üçlü tarama testi için kullanılan Alfa-fetoprotein (AFP), Free Estriol (FE3)
ve Human Chorionic Gonadotropin (β-hCG) değerleri çalışıldı.
3.2. ÖLÇÜM METODLARI
3.2.1. Kullanılan Cihazlar
1. Immulite 2500 (Siemens Medical Solutions Diagnostics Limited Llanberis,
Gwynedd. LL55 4EL United Kingdom)
2. Konelab 60 I klinik kimya analizörü
3. Nüve RF 800 R soğutmalı santrifüj
4. pH-Meter E516 Titriskop Metrohm Herisau
3.2.2. Prenatal Tarama Testlerinde Kullanılan Serum Belirteçlerinin Ölçüm
Yöntemi:
İkili tarama testi için kullanılan serum Free β-hCG ve PAPP-A değerleri ile üçlü
tarama testi için kullanılan serum AFP, FE3 ve β-hCG değerleri Siemens firmasının ticari
kitleriyle Immulite 2500 cihazında ölçüldü. Bu parametrelerin analizi, antikor sandviç
kompleks metoduna dayanan kemiluminesans immünometrik ölçüm yöntemiyle yapılmıştır.
Prenatal tarama testleri (2’li ve 3’lü testler) Siemens firmasından sağlanan Prisca paket
progmamı (Versiyon 4.0.20.4) kullanılarak değerlendirildi.
36
3.2.3. SERUM ADENOZİN DEAMİNAZ (ADA) VE İZOENZİMLERİNİN
ÖLÇÜM YÖNTEMİ
Adenozin deaminaz (ADA) ölçümünde kullanılan kimyasal maddeler Sigma
firmasından sağlanmıştır. ADA ölçümünde kullanılan reaktifler manuel şekilde hazırlandı ve
Konelab 60 I klinik kimya analizörüne uygulanarak çalışıldı. ADA ölçümünde kullanılan
kimyasal maddeler Tablo 5’te verilmiştir.
Tablo 5. ADA ölçümünde kullanılan kimyasal maddeler
Fosfat tamponu: 50 mmol/L
Na2HPO4
KH2PO4
Adenozin: 21 mmol/L
2-Oxoglutarik asit: 2,3 mmol/L
Adenozin difosfat (ADP): 1,56 mmol/L
Glutamat dehidrogenaz (GDH): 21 kU/L
NADH: 0,28 mmol/L
Erythro-9(2-hydroxy-3-nonyl) adenine (EHNA) (ADA-1 inhibitörü): 0,1
mmol/L
Yöntemin Prensibi: Serum ADA aktivitesinin ölçümü için Ellis tarafından geliştirilen
yöntem, otomasyona uygun biçime getirilerek kullanıldı. Yöntem açığa çıkan amonyumun
NADH’a bağlı enzimatik ölçümü esasına dayanır. Bu yöntemde adenozinden ADA
aktivitesiyle
açığa
çıkarılan
amonyak,
glutamat
dehidrogenaz
enzimi aracılığı ile 2-oxoglutarata bağlanmaktadır. ADP glutamat dehidrogenazın aktivatörü
olarak görev almaktadır. Bu reaksiyonda NADH kullanılır. NADH’ın NAD+’ye oksitlenme
oranı, kullanılan amonyum iyonunun miktarı ile paralellik gösterir ve oluşan NAD+ ile
harcanan amonyum iyonunun mol sayıları eşittir.
absorbans
düşüşüyle
izlenebilmekte,
dolayısıyla
NADH’ın oksitlenmesi 340 nm’deki
ADA
aktivitesi
kinetik
olarak
ölçülebilmektedir. ADA ölçüm yönteminde kullanılan reaksiyonlar Şekil 3’te gösterilmiştir
(38).
37
Şekil 3. ADA ölçüm yönteminde kullanılan reaksiyonlar
Reaktifler:
Fosfat Tamponu: Na2HPO4
ve KH2PO4 kullanılarak 50 mmol/L fosfat
tamponu hazırlandı ve pH-metre ile tamponun pH’sı 7,1’e getirildi.
Total ADA ölçünde kullanılan reaktif:
Hazırlanmış olan fosfat tamponundan yaklaşık 80 ml alınarak bir
mezüre konuldu ve içerisine 21 mmol/L adenozin substratı eklendi.
Adenozin fosfat tamponunda çok zor çözünen bir madde olduğundan
dolayı, tamponda tamamen çözünmesi için 5-6 saat kadar beklendi.
Daha sonra bu çözeltinin içerisine 2,3 mmol/L 2-oxoglutarik asit, 1,56
mmol/L ADP, 21 kU/L glutamat dehidrogenaz enzimi ve 0,28 mmol/L
NADH eklenip karıştırıldı ve tüm maddelerin tamponda tamamen
çözünmesi sağlandı.
Daha sonra hazırlanmış olan ayıraç fosfat tamponu ile 100 ml’ye
tamamlandı.
Bu reaktif 50 ml olacak şekilde iki eşit hacime ayrıldı. Reaktifin 50
ml’si total ADA ölçümünde kullanıldı. Diğer 50 ml’lik kısım ise ADA2 ölçümünde kullanılacak olan reaktif için ayrıldı.
38
ADA-2 ölçümünde kullanılan reaktif:
Total ADA ölçümü için hazırlanan reaktifin 50 ml’si alındı ve içerisine
0,1 mmol/L EHNA ilave edildi. Daha sonra reaktif karıştırılarak
EHNA’nın tamamen çözünmesi sağlandı.
EHNA ADA-1 aktivitesini inhibe eden bir maddedir. Böylelikle ADA1 inhibe edilerek ADA-2 ölçümü yapılabilmektedir.
Serum ADA-1 aktivitesi ise total ADA aktivitesinden ADA-2
aktivitesinin çıkarılmasıyla hesaplanmıştır.
3.3. İSTATİSTİKSEL ANALİZ
Çalışma verileri değerlendirilirken tanımlayıcı istatistiksel metotlar olarak ortalama,
standart sapma, ortanca, en küçük ve en büyük değerler hesaplandı. Bütün gruplar için normal
dağılıma uygunluk testi Kolmogorov-Smirnov analizi ile yapıldı. İkili karşılaştırma için
varyansların homojenitesine bakıldı. Homojen olanlar için Student t testi, olmayanlar için
Mann Whitney U testi uygulandı. Gruplardaki niceliksel veriler normal dağılım özelliklerine
uymadıkları için çoklu varyans analizi Kruskal-Wallis testi ile ve ikili karşılaştırmalar
nonparametrik Mann-Whitney U testi ile yapıldı. Parametreler arasındaki korelasyon analizi
Spearman testi ile yapıldı.
Tüm istatistiksel analizler kurumumuzda lisanslı “SPSS for Windows versiyon 17.0”
paket programı kullanılarak yapıldı.
39
4. BULGULAR
4.1. ÇALIŞMA VE KONTROL GRUBUNDA ÖLÇÜLEN PARAMETRELER
Sağlıklı gebe grubu ile sağlıklı kontrol grubuna ait yaş ve kiloların ortalama ve
standart sapma değerleri Tablo 6’da gösterilmiştir.
Tablo 6. Çalışma ve kontrol gruplarının yaş ve kiloya göre dağılımı
Tüm Gebeler
(n=129)
1. Trimester
(n=38)
2. Trimester
(n=79)
3. Trimester
(n=12)
Kontrol
(n=42)
Ort ± SD
Ort ± SD
Ort ± SD
Ort ± SD
Ort ± SD
Yaş (yıl) 26,5 ± 5,44
25,7 ± 4,50
26,9 ± 5,96
26,5 ± 4,54
28,1 ± 6,99
Kilo (kg) 63,6 ± 11,95
59,8 ± 9,71
64,2 ± 11,66
71,3 ± 16,21
62,5 ± 11,59
ADA, ADA-1 ve ADA-2 aktivitelerinin ortalama, standart hata (Standard error of
mean, SEM), ortanca, en küçük ve en büyük (min-maks) değerlerinin gruplara göre dağılımı
Tablo 7’de verilmiştir.
Tablo 7. Kontrol ve çalışma gruplarında ölçülen parametrelerin tanımlayıcı
istatistikleri
ADA
IU/L
ADA-1
IU/L
ADA-2
IU/L
Ortalama
± SEM
Ortanca
(min-maks)
Ortalama
± SEM
Ortanca
(min-maks)
Ortalama
± SEM
Ortanca
(min-maks)
Tüm Gebeler 1.Trimester 2.Trimester 3.Trimester Kontrol
(n:129)
(n:38)
(n:79)
(n:12)
(n:42)
33,93
32,97
34,10
35,91
39
± 0,47
± 0,76
± 0,64
± 1,45
± 0,99
34
33
34
35
39
(23-51)
(25-42)
(23-51)
(26-45)
(28-55)
4,14
4,42
4
4,25
5,78
± 0,18
± 0,36
± 0,21
± 0,91
± 0,32
4
4,5
4
4
5,5
(1-12)
(1-9)
(1-11)
(1-12)
(1-11)
29,79
28,55
30,10
31,66
33,21
± 0,44
± 0,70
± 0,58
± 1,65
± 0,92
29
29
29
31
31,5
(20-44)
(20-37)
(21-44)
(25-43)
(22-45)
Tüm gebeler, 1. trimester, 2. trimester, 3. trimester ve kontrol grubunda ölçülen ADA,
ADA-1 ve ADA-2’nin ortalama ve standart sapma değerlerine ait sütun grafikler Şekil 4, 5 ve
6’da gösterilmiştir. Tüm gebeler ve kontrol grubunda ölçülen ADA, ADA-1 ve ADA-2
40
değerlerinin dağılımını, ortancaları ve uç değerleri gösteren kutu (box-plot) grafikleri Şekil 7,
8 ve 9’da gösterilmiştir.
Şekil 4. ADA değerlerinin ortalama ve standart hataları (TR: Trimester)
Şekil 5. ADA-1 değerlerinin ortalama ve standart hataları
41
Şekil 6. ADA-2 değerlerinin ortalama ve standart hataları
Şekil 7. ADA değerlerinin gebe ve kontrol gruplarına göre dağılımının kutu
(box-plot) grafiği ile gösterimi
42
Şekil 8. ADA-1 değerlerinin gebe ve kontrol gruplarına göre dağılımının kutu
(box-plot) grafiği ile gösterimi
Şekil 9. ADA-2 değerlerinin gebe ve kontrol gruplarına göre dağılımının kutu
(box-plot) grafiği ile gösterimi
43
4.2. GRUPLARIN KARŞILAŞTIRILMASI
Tüm gebe grubu ve kontrol grubunun ikili karşılaştırması için varyansların
homojenitesine Levene’s Test ile bakıldı. ADA ve ADA-1’in varyansları homojendi, ADA2’nin varyansı ise homojen değildi. Bundan dolayı ADA ve ADA-1 için Student t testi, ADA2 için Mann-Whitney U testi uygulandı.
Gebe grubunun ADA, ADA-1 ve ADA-2 değerleri kontrol grubunun değerlerine göre
ileri derecede anlamlı düşük bulundu (sırasıyla p<0,001, p<0,001, p<0,01). Bu karılaştırmanın
sonuçları Tablo 8’de verilmiştir.
Tablo 8. Gebe ve kontrol grubunun ADA, ADA-1 ve ADA-2 değerlerinin
karşılaştırılmasıyla elde edilen sonuçlar
TÜM GEBELER
(n:129)
KONTROL
(n:42)
Ort ± SEM
Ort ± SEM
ADA
33,93 ± 0,47
39 ± 0,99
<0,001
ADA-1
4,14 ± 0,18
5,78 ± 0,32
<0,001
ADA-2
29,79 ± 0,44
33,21 ± 0,92
<0,01
P
ADA, ADA-1 ve ADA-2 aktivitelerinin araştırılması için oluşturulan dört grup
(1.trimester, 2.trimester, 3.trimester ve kontrol grubu) birbirleri ile Kruskal-Wallis
nonparametrik varyans analizi yapılarak karşılaştırıldı ve gruplar arasında ADA (p<0,001),
ADA-1 (p<0,001) ve ADA-2 (p<0,01) aktiviteleri açısından fark olduğu görüldü. Bu farkın
hangi gruplar arasında olduğu Mann-Whitney U testi ile gruplar ikişerli karşılaştırılarak
yapıldı. Gruplar karşılaştırılmadan önce dört grup için anlamlılık düzeyi (p) Bonferroni
düzeltmesi uygulanarak 0,008 seçildi. Mann-Whitney U testi uygulanarak yapılan ikili
karşılaştırmaların sonuçları Tablo 9’da verilmiştir.
44
Tablo 9. Mann-Whitney U testinde elde edilen veriler (anlamlılık değeri p<0,008)
Kontrol - 1.Trimester
Kontrol - 2.Trimester
Kontrol - 3.Trimester
1.Tri - 2.Tri
1.Tri - 3.Tri
2.Tri - 3.Tri
ADA
<0,001
<0,001
0,166
0,417
0,086
0,230
ADA-1
0,016
<0,001
0,040
0,291
0,542
0,877
ADA-2
<0,001
<0,008
0,478
0,196
0,118
0,356
1. Trimester’e ait ADA ve ADA-2 değerleri kontrol grubunun değerlerinden
anlamlı olarak düşük bulundu. ADA-1 değerleri açısından kontrol grubu ile
1.trimester arasında anlamlı fark bulunamadı (Tablo 9).
2. Trimester’e ait ADA, ADA-1 ve ADA-2 değerleri kontrol grubunun
değerlerinden anlamlı olarak düşük bulundu (Tablo 9).
ADA, ADA-1 ve ADA-2 değerleri açısından kontrol grubu ile 3.trimester
arasında ve trimester’ler arasında anlamlı fark bulunamadı (Tablo 9).
4.3. KORELASYON ANALİZLERİ
Prenatal tarama testleri (2’li ve 3’lü testler) için risk değerleri Prisca programı
kullanılarak hesaplandı. 63 gebe kadına 2’li test uygulanarak Kombine trizomi 21 riski,
Biyokimyasal trizomi 21 riski, yaş riski ve trizomi 18 + NT riski hesaplandı. 52 gebe kadına
ise 3’lü test uygulanarak trizomi 21 riski, yaş riski ve trizomi 18 riski hesaplandı.
2’li ve 3’lü test uygulanarak hesaplanan riskler ile ADA, ADA-1 ve ADA-2 arasındaki
ilişkiler Spearman Korelasyon Analizi yapılarak değerlendilirdi. 2’li ve 3’lü teste ait
korelasyon analizi sonuçları Tablo 10 ve Tablo 11’de verilmiştir. 2’li test riskleri ile ADA,
ADA-1 ve ADA-2 arasında bir ilişki bulunamadı. 3’lü teste ait yaş riski (r=-0,314) ve trizomi
18 riski (r=-0,314) ile ADA-1 arasında negatif yönde zayıf ilişki tespit edildi. 3’lü teste ait
diğer riskler ile ADA, ADA-1 ve ADA-2 arasında bir ilişki bulunamadı.
45
Tablo 10. 2’li test riskleri ile ADA, ADA-1 ve ADA-2 arasındaki ilişkiyi gösteren
korelasyon analizi sonuçları
ADA - Kombine Trizomi 21 Riski
ADA - Biyokimyasal Tri. 21 Riski
ADA - Yaş Riski
ADA - Trizomi 18 + NT Riski
r
-0,045
-0,044
0,076
-0,159
p
0,72
0,724
0,546
0,204
ADA 1 - Kombine Trizomi 21 Riski
ADA 1 - Biyokimyasal Tri. 21 Riski
ADA 1 - Yaş Riski
ADA 1 - Trizomi 18 + NT Riski
-0,012
0,097
-0,043
-0,161
0,921
0,438
0,734
0,197
ADA 2 - Kombine Trizomi 21 Riski
ADA 2 - Biyokimyasal Tri. 21 Riski
ADA 2 - Yaş Riski
ADA 2 – Trizomi 18 + NT Riski
-0,022
-0,09
0,136
-0,094
0,863
0,471
0,276
0,451
Tablo 11. 3’lü test riskleri ile ADA, ADA-1 ve ADA-2 arasındaki ilişkiyi
gösteren korelasyon analizi sonuçları
r
0,01
-0,028
-0,028
p
0,942
0,844
0,844
ADA 1 - Trizomi 21 Riski -0,228
ADA 1 - Yaş Riski
-0,314
ADA 1 - Trizomi 18 Riski -0,314
0,101
0,022
0,022
ADA 2 - Trizomi 21 Riski 0,07
ADA 2 - Yaş Riski
0,058
ADA 2 - Trizomi 18 Riski 0,058
0,618
0,68
0,68
ADA - Trizomi 21 Riski
ADA - Yaş Riski
ADA - Trizomi 18 Riski
Gebelere ait gestasyonel hafta yaşı ile ADA, ADA-1 ve ADA-2 arasındaki ilişkiyi
değerlendirmek için Spearman Korelasyon Analizi yapıldı. Elde edilen sonuçlar tablo 12’de
verilmiştir. Gestasyonel hafta ile ADA (r=0,201) ve ADA-2 (r=0,195) arasında zayıf bir ilişki
tespit edildi. Gestasyonel hafta ile ADA-1 arasında bir ilişki tespit edilmedi.
46
Tablo 12. Gestasyonel hafta yaşı ile ADA, ADA-1 ve ADA-2 arasındaki ilişkiyi
gösteren korelasyon analizi sonuçları
ADA
- Gestasyonel Hafta
ADA 1 - Gestasyonel Hafta
ADA 2 - Gestasyonel Hafta
r
0,201
-0,025
0,195
p
0,023
0,781
0,027
Çalışma grupları ile kontrol grubunun demografik bilgileri ve biyokimyasal değerleri
Tablo 13’de verilmiştir.
47
Tablo 13. Çalışma grupları ile kontrol grubunun demografik bilgileri ve biyokimyasal
değerler
örnek
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
ADA
27
27
33
33
36
36
51
32
30
32
29
33
36
39
35
32
25
27
29
39
31
42
48
29
37
34
35
38
34
28
41
29
29
29
49
34
29
28
41
32
33
38
32
33
23
27
40
39
30
36
ADA-1
2
2
3
4
6
6
8
5
4
3
2
2
2
2
9
7
2
3
4
4
4
7
8
4
2
8
5
8
7
2
7
3
6
4
5
5
1
3
5
3
4
1
2
5
2
2
6
4
1
5
ADA-2
25
25
30
29
30
30
43
27
26
29
27
31
34
37
26
25
23
24
25
35
27
35
40
25
35
26
30
30
27
26
34
26
23
25
44
29
28
25
36
29
29
37
30
28
21
25
34
35
29
31
Yaş
21
32
26
28
22
26
38
32
19
21
24
26
40
27
21
30
26
26
25
24
25
31
29
26
32
30
40
27
28
20
26
29
31
27
20
21
27
30
25
33
20
29
28
21
21
27
25
30
27
27
Kilo
62
84
53
50
67
50
60
61
52
70
65
54
76
44
54
55
72
61
78
61
58
54
59
81
85
64
64
47
70
65
68
46
57
50
67
76
58
66
49
65
66
61
63
55
51
60
58
98
64
62
Tri
2
2
2
1
1
2
2
2
2
2
2
2
2
1
1
1
1
2
2
2
1
1
2
2
2
2
1
2
2
1
1
2
1
2
2
1
2
1
1
2
1
1
1
1
2
1
1
1
1
2
Kom.
Tr 21
Riski
1:10000
1:50
1:10000
1:10000
1:10000
1:10000
1:2434
1:10000
1:10000
1:10000
1:10000
1:3118
1:1554
1:2642
1:10000
1:10000
1:10000
1:10000
1:2670
1:10000
1:705
1:738
1:6010
1:695
1:9214
1:10000
1:1515
1:2282
1:3219
1:10000
1:10000
1:10000
1:161
1:214
1:10000
1:10000
1:374
1:594
1:10000
1:8277
1:1973
1:10000
1:10000
1:10000
1:10000
1:9215
1:10000
1:10000
1:10000
1:10000
Biyo. Tr
21 Riski
1:10000
1:2500
1:10000
1:5938
1:8068
1:10000
1:835
1:7339
1:7424
1:10000
1:2468
1:875
1:1554
1:542
1:3898
1:3110
1:3569
1:8382
1:596
1:10000
1:156
1:148
1:1547
1:1684
1:2884
1:10000
1:906
1:412
1:820
1:10000
1:10000
1:9959
1:50
1:169
1:10000
1:10000
1:5381
1:95
1:3046
1:6718
1:343
1:5222
1:7026
1:8020
1:3203
1:2922
1:2593
1:10000
1:10000
1:10000
48
İkili
Yaş
Riski
1:1089
1:466
1:971
1:766
1:1055
1:914
1:122
1:1061
1:1139
1:1112
1:996
1:903
1:78
1:852
1:1080
1:591
1:867
1:919
1:960
1:1002
1:943
1:589
1:730
1:930
1:461
1:629
1:76
1:854
1:802
1:1077
1:927
1:709
1:538
1:881
1:1108
1:1062
1:869
1:639
1:972
1:414
1:1080
1:676
1:744
1:1064
1:1081
1:856
1:929
1:597
1:846
1:889
Tr 18 +
Tr 21
NT Riski Riski
1:10000
1:50
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:383
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
Üçlü
Yaş
Riski
Tr 18
Riski
örnek
51
52
53
54
55
56
ADA
38
29
33
30
32
27
ADA-1
6
2
1
2
8
2
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
30
25
31
34
27
35
27
28
29
34
35
28
36
33
42
30
29
40
35
25
33
29
47
38
30
32
38
46
35
35
36
41
27
27
35
39
35
33
30
28
31
33
36
31
35
34
37
37
5
4
2
5
4
7
7
2
2
3
7
4
4
6
3
5
2
3
4
4
4
4
7
6
5
6
11
4
4
5
4
4
4
4
4
2
3
6
5
3
2
5
3
2
2
4
3
1
ADA-2
32
27
32
28
24
25
25
21
29
29
23
28
20
26
27
31
28
24
32
27
39
25
27
37
31
21
29
25
40
32
25
26
27
42
31
30
32
37
23
23
31
37
32
27
25
25
29
28
33
29
33
30
34
36
Yaş
25
22
26
23
20
20
Kilo
55
43
56
57
58
49
Tri
1
1
1
1
1
1
26
28
33
24
28
21
32
28
44
37
33
23
23
24
20
23
20
34
20
25
25
35
33
18
30
24
33
30
28
19
27
23
28
28
22
33
29
19
29
18
28
25
18
28
28
20
35
39
52
60
66
47
61
65
60
63
69
82
85
49
69
64
56
52
56
63
73
77
70
66
59
57
87
43
64
65
59
49
76
46
58
83
58
84
80
65
62
62
62
55
54
66
68
60
60
68
1
1
1
1
1
1
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
Kom.
Tr 21
Riski
1:5747
1:2272
1:7410
1:10000
1:3962
1:10000
Biyo. Tr
21 Riski
1:941
1:413
1:1470
1:2923
1:660
1:5414
İkili
Yaş
Riski
1:941
1:1039
1:869
1:999
1:1087
1:1083
Tr 18 +
Tr 21
NT Riski Riski
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:670
1:2419
1:10000
1:10000
1:2935
1:9252
1:3184
1:587
1:1135
1:4597
1:8622
1:507
1:906
1:792
1:379
1:970
1:754
1:1067
1:422
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:3214
1:167
1:677
1:3723
1:3711
1:1405
1:10000
1:3779
1:9925
1:7887
1:2941
1:3357
1:1555
1:10000
1:715
1:1155
1:3457
1:415
1:3579
1:2446
1:1590
1:1845
1:1317
1:5151
1:1609
1:2636
1:1946
1:8906
1:1752
1:2937
1:2007
1:1721
1:5293
1:5916
1:7117
1:3079
1:1928
1:2256
1:3466
1:3849
1:1337
49
Üçlü
Yaş
Riski
Tr 18
Riski
1:905
1:30
1:205
1:433
1:1158
1:1183
1:1155
1:1235
1:1160
1:1233
1:413
1:1276
1:1053
1:1091
1:332
1:456
1:1273
1:706
1:1125
1:475
1:788
1:909
1:1276
1:918
1:1173
1:926
1:928
1:1232
1:489
1:786
1:1237
1:785
1:1274
1:914
1:1073
1:1233
1:918
1:273
1:1218
1:313
1:101
1:10000
1:53
1:10000
1:10000
1:10000
1:10000
1:1396
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:4864
1:10000
1:2168
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:602
örnek
105
106
107
108
109
110
111
112
113
114
115
116
117
118
119
120
121
122
123
124
125
126
127
128
129
K1
K2
K3
K4
K5
K6
K7
K8
K9
K10
K11
K12
K13
K14
K15
K16
K17
K18
K19
K20
K21
K22
K23
K24
K25
K26
K27
K28
K29
ADA
36
39
41
38
44
34
26
31
40
29
36
34
26
38
38
35
34
37
37
45
36
35
33
33
44
41
33
30
33
29
36
39
28
48
32
42
41
47
49
40
32
39
36
42
41
37
30
55
47
44
47
35
31
36
ADA-1
2
5
2
8
5
1
2
3
4
3
7
3
1
7
5
6
1
12
5
2
5
7
5
2
2
6
8
6
6
5
7
9
6
9
4
6
2
4
5
1
5
7
6
5
6
5
4
10
5
3
7
5
2
8
ADA-2
34
34
39
30
39
33
24
28
36
26
29
31
25
31
33
29
33
25
32
43
31
28
28
31
42
35
25
24
27
24
29
30
22
39
28
36
39
43
44
39
27
32
30
37
35
32
26
45
42
41
40
30
29
28
Yaş
39
20
22
21
20
29
33
25
38
21
20
28
19
22
30
28
27
27
25
34
21
19
30
29
22
20
17
19
48
33
32
18
32
34
29
23
30
29
34
30
34
32
36
26
32
19
24
19
31
35
36
28
33
35
Kilo
78
51
50
75
40
55
84
73
66
89
64
70
44
58
78
86
75
64
63
75
80
60
74
109
58
50
53
86
58
72
72
55
80
79
64
57
73
61
60
65
65
76
68
66
63
48
50
48
75
60
79
60
70
61
Tri
2
2
2
2
2
2
2
2
2
2
2
3
3
1
3
3
3
3
3
3
2
3
3
3
3
Kom.
Tr 21
Riski
İkili
Biyo. Tr Yaş
21 Riski Riski
50
Tr 18 +
Tr 21
NT Riski Riski
1:386
1:10000
2951
1:2957
1:4522
1:2243
1:620
1:1416
1:2466
1:10000
1:8996
Üçlü
Yaş
Riski
1:125
1:1268
1:1162
1:1233
1:1210
1:786
1:473
1:1090
1:134
1:1247
1:1279
Tr 18
Riski
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:10000
1:3113
1:10000
1:10000
örnek
K30
K31
K32
K33
K34
K35
K36
K37
K38
K39
K40
K41
K42
ADA
42
45
33
49
42
36
35
44
35
36
47
35
39
ADA-1
11
8
4
10
7
5
4
6
5
5
5
5
6
ADA-2
31
37
29
39
35
31
31
38
30
31
42
30
33
Yaş
19
17
27
35
31
25
18
26
18
28
30
37
25
Kilo
50
58
58
80
50
63
47
83
42
60
45
70
45
Tri
Kom.
Tr 21
Riski
İkili
Biyo. Tr Yaş
21 Riski Riski
51
Tr 18 +
Tr 21
NT Riski Riski
Üçlü
Yaş
Riski
Tr 18
Riski
5. TARTIŞMA VE SONUÇ
Adenozin deaminaz (ADA), adenozinin inozine ve 2׳-deoksiadenozinin 2׳deoksiinozine hidrolitik deaminasyonunu katalizleyen bir pürin metabolizma enzimidir. ADA
insan dokularında, özellikle lenfoid dokularda, yaygın dağılım göstermekte ve lenfoid
hücrelerin proliferasyon, olgunlaşma ve fonksiyonu için gerekli bir enzimdir. ADA aktivitesi
lenfositik hücrelerde, eritrositlere oranla 10 kat daha fazla bulunmaktadır. T lenfositler B
lenfositlere göre daha yüksek oranda ADA aktivitesine sahiptir ve ayrıca T hücre
farklılaşması esnasında belirgin ADA artışı görülür. Romatoid artrit, SLE ve tüberküloz gibi
hücre-aracılı immünite değişimi ile karakterize hastalıklarda ADA aktivitesi değişmektedir.
Bu
nedenle
ADA
hücre-aracılı
immünitenin
nonspesifik
bir
belirteci
olarak
değerlendirilmektedir (1, 2, 39).
Gebelik, immün sistemin değiştiği, annenin fetal antijenleri tolere ettiği ve
mikroorganizmalara karşı savunmada başarılı olduğu immünolojik olarak dengeli bir
durumdur. Anne ile fetus arasındaki immünolojik olarak çift yönlü iletişim, fetal antijen
sunumunu ve maternal immün sistem tarafından bu antijenlerin tanınmasını kapsamaktadır (3,
4, 5).
Sitokin salgılayan T hücreler immün cevapta merkezi bir rol oynamaktadırlar ve
sitokin üretim tiplerine göre alt gruplar şeklinde sınıflandırılmışlardır. Th1 hücreler başlıca
hücresel immüniteye neden olan IL-2 ve IFN-γ sentezlerler. Th2 hücreler ise baskın olarak
humoral immüniteye yardım eden IL-4, 5, 6 ve 10’u üretirler. Sağlıklı gebe olmayan
kadınlarda Th1/Th2 oranı belli bir dengede olmasına rağmen normal gebelikte Th1 cevabı
fetus için zararlı olabileceğinden Th1/Th2 dengesi Th2 baskınlığına kayar ve fetus ve
plasentayı rejeksiyondan koruyarak, normal gebeliğin devamlılığına yardımcı olur. Yani
normal gebelik humoral immünitenin arttığı, baskılanmış hücresel immünite ile karakterize
bir durumdur. Adenozin deaminaz da hücre-aracılı immünitenin bir göstergesi olduğundan,
gebelikte serum ADA aktivitesi azalmaktadır. Bu durum serum ADA aktivitesindeki
değişikliklerin
gebelik
boyunca
görülen
immünolojik
değişiklikleri
yansıttığını
göstermektedir (2, 6).
Bu çalışmada sağlıklı gebeler ile gebe olmayan sağlıklı kadınların total ADA
aktiviteleri ile ADA izoenzimleri olan ADA-1 ve ADA-2’nin aktiviteleri ölçüldü. Gebe grubu
1.trimester, 2.trimester ve 3.trimester olacak şekilde üç gruba ayrılarak tüm grupların ADA,
52
ADA-1 ve ADA-2 aktiviteleri istatiksel olarak karşılaştırıldı. Gebe grubunun ADA, ADA-1
ve ADA-2 değerleri kontrol grubunun değerlerine göre ileri derecede anlamlı düşük bulundu
(ADA ve ADA-1 için p<0,001, ADA-2 için p<0,01) (Tablo 8). Gebe grubunda yer alan
olguları trimester’lere göre ayırarak yaptığımız karşılaştırmalarda şu sonuçları bulduk:
1.Trimester’e ait ADA (p<0,001) ve ADA-2 (p<0,001) değerleri kontrol grubunun
değerlerinden anlamlı olarak düşük bulundu. ADA-1 değerleri açısından kontrol grubu ile
1.trimester arasında anlamlı fark bulunamadı (p=0,016). 2.Trimester’e ait ADA (p<0,001),
ADA-1 (p<0,001) ve ADA-2 (p<0,008) değerleri kontrol grubunun değerlerinden anlamlı
olarak düşük bulundu. ADA, ADA-1 ve ADA-2 değerleri açısından kontrol grubu ile
3.trimester arasında ve trimester’ler arasında anlamlı fark bulunamadı (Tablo 9).
Jaqueti ve arkadaşları yapmış oldukları çalışmada tüm gebe grubunun, 1. trimester, 2.
trimester ve 3. trimester’in ADA aktivitelerini, kontrol grubunun ADA aktivitelerinden
anlamlı olarak düşük bulmuşlar fakat trimesterler arasında anlamlı bir farklılık
bulamamışlardır (40). Bu sonuçlar bizim bulduğumuz sonuçlara benzemekle birlikte,
yaptığımız çalışmada kontrol grubu ile 3. trimester’in ADA değerleri arasında anlamlı bir fark
bulunamadı. Bunun sebebini de, 3. trimester grubundaki olgu sayımızın az olmasına bağladık.
Yoneyama ve arkadaşları yapmış oldukları çalışmada 3. trimester normal gebeler ile
yaşça uyumlu sağlıklı gebe olmayan kadınların ADA ve ADA izoenzim aktivitelerini
ölçmüşlerdir (1). Bu çalışmada; 3. trimester sağlıklı gebelerde serum total ADA ve ADA-2
aktivitesini gebe olmayan kadınlarınkinden anlamlı olarak düşük bulmuşlar fakat ADA-1
aktivitesi açısından gruplar arasında anlamlı bir farklılık bulamamışlardır. Bizim
çalışmamızda da kontrol grubu ile 3. trimester’in ADA-1 aktiviteleri arasında anlamlı fark
bulunamadı. Fakat bu çalışmadan farklı olarak bizim çalışmamızda, ADA ve ADA-2
aktiviteleri bakımından da kontrol grubu ile 3. trimester arasında anlamlı bir fark bulunamadı.
Yoneyama ve arkadaşları, yapmış oldukları başka bir çalışmada, ADA aktivitesini
plazmada ölçtüklerinde de aynı sonucu bulmuşlardır (6). Yapılan bu çalışmada, sağlıklı gebe
kadınların plazma total ADA aktivitesini, gebe olmayan kadınlarınkinden anlamlı olarak daha
düşük bulmuşlardır. Plazma ADA aktivitesi ile sitokin salgılayan T hücreler arasındaki
ilişkiyi değerlendirdikleri bu çalışmada, ayrıca IFN-γ (Th1’den oluşur) ve IL-4 (Th2’den
oluşur) salgılayan CD4+ T hücre miktarını flow sitometri ile analiz etmişlerdir. IFN-γ
salgılayan hücrenin IL-4 salgılayan hücreye oranı Th1/Th2 oranı olarak verilmiştir. Th1/Th2
oranını, sağlıklı gebelerde gebe olmayanlarınkinden anlamlı olarak düşük bulmuşlardır.
53
Ayrıca sağlıklı gebelerin plazma ADA aktivitesi ile IFN-γ salgılayan hücre miktarı arasında
anlamlı bir korelasyon bulmuşlardır. Bu da bize, gebelikte Th1/Th2 oranının Th2 baskınlığına
kaydığını, Th1 hücrelerinin baskılanmasından dolayı gebelikte ADA aktivitesinin azaldığını
ve böylelikle fetusun rejeksiyondan korunduğunu göstermektedir. Ayrıca bu çalışma,
gebeliğin baskılanmış hücre-aracılı immünite ile karakterize olduğunu ifade etmektedir.
Lee ve arkadaşlarının 202 sağlıklı gebe kadında yapmış oldukları çalışmada (2),
olguları gestasyonel hafta yaşına göre dört gruba (Grup I: 5-9. hafta, Grup II: 15-20. hafta,
Grup III: 24-30. hafta ve Grup IV: 30-39. hafta) ayırarak, bu grupların serum ADA
aktivitelerini karşılaştırmışlardır. Grup III’e (24-30. hafta) ait serum ADA aktivitelerini diğer
üç grubun ADA aktivitelerinden anlamlı olarak daha yüksek bulmuşlardır. Gestasyonel hafta
yaşı ile ADA arasında anlamlı bir korelasyon bulamamışlardır. Yapmış olduğumuz çalışmada
ise gestasyonel hafta yaşı ile ADA (r=0,201) ve ADA-2 (r=0,195) arasında zayıf bir ilişki
tespit ettik fakat ADA-1 ile gestasyonel yaş arasında anlamlı bir ilişki tespit edemedik (r=0,025) (Tablo 12). Lee ve arkadaşlarının çalışmasından farklı olarak, bizim yaptığımız
çalışmada trimesterler arasında ADA, ADA-1 ve ADA-2 bakımından anlamlı bir fark
bulunamadı. Jaqueti ve arkadaşları da (40) trimesterler arasında anlamlı bir fark
bulamamışlardır ve bu çalışma, bizim çalışmamızı destekler niteliktedir. Lee ve arkadaşlarının
çalışması
ile
bizim
çalışmamız
arasındaki
farklılıklar,
olguların
farklı
şekilde
gruplandırılmasından ve çalışma grubunda kullanılan olgu sayılarının farklı olmasından
kaynaklanabilir. Lee ve arkadaşları çalışmalarında 24 ile 30. gestasyonel hafta arasında ADA
aktivitelerindeki artışın, 2. trimester sonu ile 3. trimester başı arasında maternal kardiyak output’un pik noktasına ulaşması ile ilişkili olabileceğini ve gebelik sonunda ADA’nın tekrar
azalacağını ifade etmişlerdir. Maternal kan volümü 2. trimester sonunda hızlı bir şekilde artar.
Kan akımında dolaşan adenozinin asıl kaynağını trombositler, vasküler endotel ve eritrositler
oluşturmaktadır. Eritrosit ve vasküler endotelin 2. trimester sonundan 3. trimester başına
kadar hızlıca artması, kan akımına adenozin salınmasına ve adenozinin kan akımında
konsantrasyonunun artmasına neden olur. Böylelikle uterus ve plasentaya giden kanın artması
için vazodilatatör mekanizmalar devreye girer. Soo Jin Lee ve arkadaşları, artmış adenozini
parçalamak ve adenozinin kinetik denge seviyesinin devamlılığını sağlamak için ADA
aktivitesinin artabileceğini fakat 24 ile 30. gestasyonel hafta arasında serum ADA
aktivitesindeki klinik olarak anlamlı artışın mekanizmasının anlaşılamadığını ifade etmişlerdir
(2).
54
Hayvanlar üzerinde yapılan çalışmalarda da, insan çalışmalarındakine benzer sonuçlar
elde edilmiştir. Chaudhry ve arkadaşları bufololar üzerinde yapmış oldukları çalışmada (41),
gebe bufoloların total serum ADA ve ADA-2 aktivitelerini, gebe olmayan kontrol grubunun
değerlerinden anlamlı olarak daha düşük bulmuşlardır. Fakat ADA-1 aktivitesi bakımından
gebe ve gebe olmayan bufololar arasında anlamlı bir fark bulamamışlardır. Ayrıca total ADA,
ADA-1 ve ADA-2 aktiviteleri açısından trimesterler arasında anlamlı bir farklılık
gösterememişlerdir. Azalmış total serum ADA aktivitesi, ADA-2 aktivitesindeki azalmayı
yansıtmaktadır. Bu da gebelik boyunca baskılanmış hücre-aracılı immünite ile ilişkilidir. Bu
çalışmadaki sonuçlar, bizim sonuçlarımızla benzerlik göstermekte ve çalışmamızı destekler
niteliktedir.
Alan ve arkadaşları koyunlar üzerinde yaptıkları çalışmada (42), ADA düzeylerinin
gebelikte düştüğünü izlemişler ve gebeliğin çeşitli dönemlerinde elde edilen değerler arasında
önemli farklar bulmuşlardır. Gebeliğin ilerlemesine paralel ADA aktivitelerinde bir düşüş
izlemişler ve doğuma en yakın dönemde en düşük ADA değeri elde etmişlerdir. Fakat bizim
çalışmamızda trimesterler arasında ADA aktiviteleri açısından fark bulunamadı. Bu çalışmada
gebelik ilerledikçe ADA aktivitesindeki düşmenin, fetusun büyümesi ve enerji depolaması
için adenozinin yüksek ve dolayısıyla adenozini parçalayan enzim olan ADA’nın düşük
olması ihtiyacından ileri gelebileceğini veya gebelikte hücresel immünitenin baskılanmasının
bir belirtisi olabileceğini ifade etmişlerdir. Koyunlarda gebelik dönemi ilerledikçe, serum
ADA düzeyinde önemli düşüşler olduğu ve gebeliğin ilerlemesine paralel ADA düşüşlerinin
normal bir gebeliğe işaret edebileceği, gebeliğin ve gebelik dönemlerinin klinik olarak
tanısında ve izlenmesinde yaralı olabileceği kanısına varmışlardır.
Sağlıklı gebelikte ADA aktivitesi azalmasına karşın, artmış hücresel immünite ile
karakterize pre-eklampsili gebelerde maternal serum ve fetal kord kanında ADA aktivitesi
artmaktadır (43, 44). Pre-eklampside ADA aktivitesindeki artış, adenozin seviyelerinin
kontrolü ile pre-eklampside immün cevabın devamlılığının sağlanmasına dolaylı olarak
katkıda bulunmaktadır. Yapılan bir çalışmada, lenfosit ve monosit yüksekliği görülen
Hiperemesis Gravidarum’lu gebe kadınlarda serum total ADA ve ADA-2 aktivitesinin arttığı
gösterilmiştir (45). Taşkın ve arkadaşları da yaptıkları çalışmada (46), Hiperemesis
Gravidarum’lu gebe kadınlarda serum ADA aktivitesinin arttığını göstermişlerdir. Ayrıca bu
çalışmada, β-HCG, tiroid stimulan hormon, östron, progesteron ve prolaktin seviyeleri ile
lenfosit ve monosit sayıları Hiperemesis Gravidarum’lu gebe kadınlarda, kontrol grubundan
55
daha yüksek bulunmuştur. Yapılan bir çalışmada, tekrarlayan spontan abortusu olan
kadınlardaki serum total ADA, ADA-1 ve ADA-2 aktiviteleri, gebe olmayan kadınlarınkinden
anlamlı olarak yüksek bulunmuştur (47). Hücresel immünitenin değiştiği komplike gebelerde,
artmış ADA aktivitesinin düzenleyici mekanizması ve klinik önemi tam olarak
aydınlatılamamıştır.
Uslu ve arkadaşları yapmış oldukları çalışmada (48), yüksek yaş ve Down Sendrom
riski taşıyan ikinci trimester gebelerde serum ADA aktivitelerini ölçmüşlerdir. 280 gebe
kadında gerçekleştirilen bu çalışmada, gebe grubunu Down Sendrom riski açısından düşük
riskli, yüksek riskli ve yaşa bağlı yüksek riskli olarak gruplandırılarak, tüm grupların ve
kontrol grubunun ADA aktiviteleri karşılaştırılmıştır. ADA aktivitelerini kontrol grubuna göre
düşük Down Sendrom riski taşıyanlarda, tüm gebelerde ve yüksek yaş riski taşıyan gebelerde
düşük, yüksek Down Sendrom riski taşıyan gebelerde ise yüksek bulmuşlardır. Bizim
çalışmamızda ise yüksek Down Sendrom riski taşıyan gebe sayısı çok az olduğundan dolayı
bu şekilde bir karşılaştırma yapamadık. 2’li ve 3’lü teste ait riskler ile ADA ve izoenzimleri
arasında korelasyon analizi yaptık fakat anlamlı bir ilişki tespit edemedik. Bunu da vaka
sayımızın yeterli olmamasına bağladık. Uslu ve arkadaşları yüksek Down Sendrom riski ve
düşük Down Sendrom riski taşıyan gruplarda, ADA aktivitelerinin farklı olmasından dolayı
ADA’nın bir tarama testi olarak kullanılabileceğini ifade etmişlerdir.
Sonuç olarak; gebelikteki immünolojik değişiklikler, serum ADA aktivitesindeki
değişiklikleri yansıtmaktadır. Bununla birlikte gebelikte, serum ADA aktivitesini azaltan
düzenleyici mekanizmalar tam olarak aydınlatılamamıştır. Serum ADA aktivitesinin normal
gebelikte baskılanmış hücre-aracılı immünitenin bir belirteci olabileceği ve serum ADA ve
izoenzimlerinin aktivitesini değiştiren düzenleyici mekanizmaların öneminin daha fazla
araştırılması gerektiği sonucuna vardık. Serum ADA değerleri, hücresel immünitenin
değiştiği pre-eklampsi gibi yüksek riskli gebeliklerde klinik karar verebilmek için önemli
veriler sağlayabilir. Ayrıca ADA’nın prenatal tarama testlerinde kullanılabileceğini ve bunun
için yüksek Down Sendrom riski taşıyan daha çok sayıda olgu üzerinde ileri çalışmaların
yapılması gerektiğini düşünmekteyiz.
56
6. ÖZET
Adenozin deaminaz pürin metabolizmasına katılan ve yaygın dağılım gösteren bir
enzimdir. ADA adenozin ve 2׳-deoksiadenozinin inozin ve 2׳-deoksiinozine geri dönüşümsüz
hidrolitik deaminasyonunu katalizler. ADA insan dokularında yaygın bir dağılım
göstermektedir. ADA immünolojik sistemin olgunlaşmasına, özellikle lenfoid hücrelerin
çoğalma ve farklılaşmasına, katkıda bulunur ve olgunlaşma işleminin farklı aşamalarında
kritik bir rol oynar. ADA’nın diğer bir fonksiyonu da, plazma adenozin seviyelerini
düzenlemesidir, bu durum inflamatuar cevap ve sitokin salınımı ile ilişkili olabilir.
İnsan ADA’sının üç moleküler izoformu vardır; ADA-1, ADA-2 ve ADA-1 ve ADAkompleks protein. ADA-1 hemen hemen tüm insan doku ve hücrelerinde bulunmasına ve
major ADA aktivitesinin ADA-1’den kaynaklanmasına rağmen ADA-2 serumdaki baskın
izoenzimdir. Çoğu insan hücresi küçük miktarda ADA-2 izoenzimi içerir ve ADA-2’nin doku
kaynakları lenfositler yada monosit-makrofaj hücre sistemi olabilir.
Serum ADA aktivitesi hücresel immünitenin stimüle edildiği çoğu hastalıkta
artmaktadır. Lenfosit yada monosit-makrofaj hücre sistemi serum ADA aktivitesindeki
değişikliklere katkıda bulunmaktadır. Bununla birlikte serum ADA aktivitesindeki
değişikliklerin tam mekanizması aydınlatılamamıştır.
Th1 hücreler başlıca hücresel immüniteye neden olan IL-2 ve IFN-γ sentezlerler. Th2
hücreler ise baskın olarak humoral immüniteye yardım eden IL-4, 5, 6 ve 10’u üretirler.
Sağlıklı gebe olmayan kadınlarda Th1/Th2 oranı belli bir dengede olmasına rağmen gebelikte
Th1 cevabı fetus için zararlı olabileceğinden Th1/Th2 dengesi Th2 baskınlığına kayar ve fetus
ve plasentayı rejeksiyondan koruyarak gebeliğin devamlılığına yardımcı olur. Yani sağlıklı
gebelik humoral immünitenin arttığı, baskılanmış hücresel immünite ile karakterize bir
durumdur. Bu nedenle gebelik boyunca serum ADA aktivitesi değişmektedir.
Bu çalışmada sağlıklı gebe kadınlarda serum total ADA ve ADA izoenzim (ADA-1 ve
ADA-2) aktivitelerini inceledik ve gebelik boyunca ADA aktivitesinde değişikliklere neden
olan hücre-aracılı immünitedeki değişikliklerin olası rollerini değerlendirdik. Sağlıklı gebe
kadınlarda (n=129) ve yaşça uyumlu sağlıklı gebe olmayan kadınlarda (n=42) serum total
ADA, ADA-1 ve ADA-2 aktivitelerini ölçtük. Çalışma grubunu 1.trimester, 2.trimester ve
3.trimester olmak üzere üç farklı gruba ayırdık. Gebe grubunun ADA, ADA-1 ve ADA-2
değerleri, kontrol grubunun değerlerine göre anlamlı olarak daha düşük bulundu (ADA ve
57
ADA-1 için p<0,001, ADA-2 için p<0,01). 1.Trimester’e ait ADA (p<0,001) ve ADA-2
(p<0,001) değerleri, kontrol grubunun değerlerinden anlamlı olarak düşük bulundu. Fakat
ADA-1 değerleri açısından kontrol grubu ile 1.trimester arasında anlamlı bir fark bulunamadı
(p=0,016). 2.Trimester’e ait ADA (p<0,001), ADA-1 (p<0,001) ve ADA-2 (p<0,008)
değerleri, kontrol grubunun değerlerinden anlamlı olarak düşük bulundu. ADA, ADA-1 ve
ADA-2 değerleri açısından kontrol grubu ile 3.trimester arasında ve trimesterler arasında
anlamlı fark bulunamadı.
Serum ADA aktivitesinin gebelikte değişmiş hücresel immünite belirteci olabileceği
ve serum ADA ve izoenzimlerinin aktivitesini değiştiren düzenleyici mekanizmaların
öneminin daha fazla araştırılması gerektiği sonucuna vardık. Serum ADA değerleri, hücresel
immünitenin değiştiği yüksek riskli gebeliklerde klinik olarak karar verebilmek için önemli
veriler sağlayabilir.
58
7. SUMMARY
Adenosine deaminase (ADA) is a ubiquitous enzyme involved in purine metabolism,
which catalyzes the irreversible hydrolytic deamination of adenosine and 2’-deoxyadenosine
to inosine and 2’-deoxyinosine, respectively. ADA is widely distributed in human tissues,
which may contribute to the maturation of the immunological system, especially the
proliferation and differentiation of lymphoid cells, and seems to be critical in different stages
of the maturation process. Another function of ADA could be the regulation of plasma
adenosine levels, which may be related to the inflammatory response and cytokine release.
Human ADA exists in at least three molecular isoforms, ADA1, ADA2 and ADA1
and ADA-complexing protein. Although ADA1 is present in almost all human tissues and
cells, and the majority of ADA activity is derived from ADA1, ADA2 is the predominant
isoenzyme in the serum of normal subjects. Most human cells contain very small amounts of
ADA2 and its tissue sources may be lymphocytes or the monocyte-macrophage cell system.
Serum ADA activity has been increased in several diseases where cellular immunity is
stimulated. Lymphocytes or the monocyte-macrophage cell system have been assumed to
contribute to changes in serum ADA activity, however, the exact mechanisms by which serum
ADA activity is altered has not been elucidated.
T helper 1 cells synthesize mainly interleukin-2 and interferon-γ, which induce cellular
immunity. T helper 2 cells produce predominantly interleukin-4, -5, -6, and -10, which
promote humoral immunity.5 The shift of T helper 1/T helper 2 balance to T helper 2
predominance occurs in normal pregnancy and appears to protect the fetus and placenta from
being rejected and to aid in the maintenance of normal pregnancy. Because normal pregnancy
is characterized by depressed cell-mediated immunity in conjunction with enhanced humoral
immunity, plasma adenosine deaminase activity may be altered. So serum ADA activity may
be changed in normal pregnancy.
In this study we examined changes in serum total ADA activity and the patterns of two
ADA isoenzymes, ADA-1 and ADA-2, in healthy pregnant women and evaluated the possible
role of the alteration of cell-mediated immunity during pregnancy as causes of changes in
ADA activity. We measured serum activities of total ADA, ADA-1 and ADA-2 in healthy
pregnant women (n=129) and age-matched healthy nonpregnant women (n=42). We divided
study group into three different subgroups: first trimester, second trimester and third trimester.
59
Serum ADA, ADA-1 and ADA-2 activities in healthy pregnant women were significantly
lower than that in nonpregnant women (p<0,001 for ADA and ADA-1, p<0,01 for ADA-2).
ADA (p<0,001) and ADA-2 (p<0,001) activities in first trimester were significantly lower
than that in control group. But there were not significantly difference between first trimester
and control group according to their ADA-1 activities (p=0,016). ADA (p<0,001), ADA-1
(p<0,001) and ADA-2 (p<0,008) activities in second trimester were significantly lower than
that in control group. There were not significantly difference between third trimester and
control group and between each trimester of pregnancy according to their ADA, ADA-1 and
ADA-2 activities.
We conclude that serum ADA activity may be a marker of altered cell-mediated
immunity in pregnancy and the significance of the regulatory mechanisms that alter the
activity of serum ADA and its isoenzymes need further studies. Values of serum ADA may
provide important database for making clinical decisions in high-risk pregnancies where
cellular immunity has been altered.
60
8. KAYNAKLAR
1. Yoneyama Y, Suzuki S, Sawa R, Otsubo Y, Miura A, Kuwabara Y, Ishino H,
Kiyokawa Y, Doi D, Yoneyama K, Araki T. Serum adenosine deaminase activity and
its isoenzyme pattern in women with normal pregnancies. Arch Gynecol Obstet 2003;
267:205-207.
2. Lee SJ, Hwang HS, Kim BNR, Kim MA, Lee JW, Park YW, Kim YH. Changes in
serum adenosine deaminase activity during normal pregnancy. J Korean Med Sci
2007; 22:718-21.
3. Bartho JS. Immunological relationship between the mother and the fetus. Int Rev
Immunol 2002 Nov-Dec; 21(6):471-95.
4. Riazi SH, Khansari N. Cytokine pattern of Th1 and Th2 cells in pregnancy. Acta
Medica Iranica 1998; 36 (1):47-50.
5. Weetman AP. The immunology of pregnancy. Thyroid 1999 Jul; 9(7):643-6.
6. Yoneyama Y, Sawa R, Suzuki S, Yoneyama K, Doi D, Araki T. Relationship between
adenosine deaminase activity and cytokine-secreting T cells in normal pregnancy.
Obstetrics & Gynecology 2002; 100:754-758.
7. Berzofsky JA. Immunogenecity and antigenecity. Austen KF, Frank MM, Atkinson
JP, Cantor H (eds): Samter's Immunogic Disease Lippincott, Wiliams and Wilkins,
USA, 2001:65-82.
8. Delves PJ, Roitt IM. The immune system (First part). N Engl J Med 2000; 343(l):3749.
9. Delves PJ, Roitt IM. The immune system (Second part). N Engl J Med 2000;
343(21):108-117.
10. Medzhitov R, Janeway C. Innate immunity N Engl J Med 2000; 343(5):338-344.
11. Abbas AK, Lichtman A, Pober JS (eds): Cellular and Molecular Immunology W.B.
Saunders, Philadelphia, 2000: 4-12.
12. Roitt I, Brostoff J, Male D (eds): Immunology Mosby, Spain, 2001, s.173-189.
13. Goodman JW. The immune response. Stites DP, Terr Al, Parslow TG (eds): Basic
and Clinical Immunology Lange, Lebanon, 1994: 40-49.
61
14. Von Andrian UH, Mackay CR. T cell function and migration. N Engl J Med 2000;
43(14):1020-1034.
15. Roitt I. The Basis of Immunology. Roitt (eds): Essential Immunology Blackwell
Science, London, 1997: 3-103.
16. Haynes FB, Fauci AS. Phenotype and Function of Immune cells. Fauci, Braunwald,
Isselbacber (cds): Harrison's Principles of Internal Medicine Mc-Graw-Hill, New
York, 1998: 1760-68.
17. Holladay S.D. Prenatal immunotoxicant exposure and postnatal autoimmun disease.
Environ Health Perspect 1999; 107:687-691.
18. Abbas AK, Lichtman AH. Temel immünoloji İstanbul medikal yayıncılık 2007: 5358.
19. Davies DR, Metzger H. Structural basis of antibody function. Annu Rev Immunol 1983
1: 87-117.
20. Natvig JB, Kunkel, H.G. Immunglobulins: dasses, subclasses, genetic variants, and
idiotypes. Adv Immunol 1973; 16:1.
21. Spielgelberg HL. Biologcal activitics of immunglobulins of different classes and
subclasses. Adv Immunol 1974; 19:259.
22. Germain RN. MHC-dependent antigen processing and peptidc presentation:
Providing ligands for T Iymphoeyte activation. Celi 1994; 76:287-29.
23. Middleton D, Bodmer J, Heyes J, Marsh S. Histocompatibility Testing ed: Dyer P,
Middleton D, IRL Press, Oxford 1993: 13.
24. Mosmami T. Cytokines and immune regulation. Rich RR{ed.): Clinical Immunology,
Principles and Practice Mosby, Missouri, 1996: 217-230.
25. Kılıçturgay K. İmmünoloji Güneş&Nobel 1997: 277-280.
26. Erlebaher A. Why isn't the fetus rejected? Current Open Immunol 2001; 13:590-599.
27. Wang H, Zhang M, Soda K et al. Fetuin protects the fetus from TNF.
Lancet1997;350:861-862
28. Franco R, Valenzuela A, Lluis C, Blanco J. Enzymatic and extraenzymatic role of
ecto-adenosine deaminase in lymphocytes. Immunological Reviews 1998 Vol. 161:
27-42
62
29. Dolezal T. Adenosine Deaminase. Review of physiological roles. 2001
http://www.entu.cas.cz/fyziol/seminars/ada.html
30. Evans C. Adenosine Deaminase. http://ccevans.myweb.uga.edu/bcmb8010/report.pdf
31. Ungerer JPJ, Oosthuizen HM, Bissbort SH and Vermaak WJH. Serum Adenosine
Deaminase: Isoenzymes and Diagnostic Application. Clin Chem 1992; 38/7: 13221326.
32. Baganha M.F, Pego A, Lima M.A, Gaspar E.V, Cordeiro A.R. Serum and pleural
adenosine deaminase. Correlation with lymphocytic populations.Chest. 1990 Mar;
97(3): 605-10.
33. Ateş Y, Ergün H, Tüzün A, Bağcı S, Kurt İ, İnal A, Polat Z, Karaeren N, Dağalp K.
Ailesel Akdeniz Ateşi olan hastalarda lenfosit alt grupları ve serum adenozin
deaminaz düzeyleri. Akademik Gastroenteroloji Dergisi 2005; 4(2): 112-116
34. Veena B. Adenosine Deaminase isoenzymes and Pleural Tuberculosis. J Lab Clin
Med 1996;127:326-7
35. Valdes L, San Jose E, Alvarez D, Valle J.M. Adenosine deaminase (ADA) isoenzyme
analysis in pleural effusions: diagnostic role, and relevance to the origin of increased
ADA in tuberculous pleurisy. Eur Respir J 1996 Apr; 9(4):747-51.
36. Gakis C, Calia G, Naitana A, Pirino D, Serru G. Serum adenosine deaminase activity
in HIV positive subjects. A hypothesis on the significance of ADA2. Panminerva Med
1989 Jul-Sep; 31(3):107-13. Review.
37. Gakis C. Adenosine deaminase (ADA) isoenzymes ADA-1 and ADA-2: diagnostic
and biological role. Eur Respir J 1996; 9, 632-633.
38. Erel Ö, Özdemir Y. Serum ve çeşitli vücut sıvılarında adenozin deaminaz
aktivitesinin otomatik analizör ile ölçümü. Biyokimya Dergisi Ekim-Kasım-Aralık
1997; Sayı:4, Cilt:23
39. Hatipoğlu K, Yüksekol İ, Özkan M, Balkan A, Tozkoparan E, Bedirhan İ, Bilgiç H,
Demirci N. Tüberküloz tanısında serum adenozin deaminaz ölçümünün önemi.
Gülhane Tıp Dergisi 2003; 45 (2): 165-168.
40. Jaqueti D, M-H, Hernandez-Garcia R, Navarro-Gallar F. Adenosine deaminase in
pregnancy serum. Clin Chem 1990; 36:2144.
63
41. Chaudhry SM, Naseer Z, Rabbani S and Alrokayan SA. Activity of adenosine
deaminase and its isoenzymes in serum of pregnant buffaloes. Pakistan Vet J 2007;
27(3): 152
42. Alan M, Ağaoğlu ZT, Uyar A, Altuğ N. Koyunlarda gebeliğin çeşitli dönemlerinde
serum adenozin deaminaz düzeyleri. Turk J Vet Anim Sci 2002; 26:487-490
43. Yoneyama Y, Sawa R, Suzuki S, Otsubo Y, Miura A, Kuwabara Y, Ishino H,
Kiyokawa Y, Doi D, Yoneyama K, Kobayashi H, Araki T. Serum adenosine
deaminase activity in women with preeclampsia. Gynecol Obstet Invest 2002; 54: 1647.
44. Karabulut AB, Kafkasli A, Burak F, Gozukara EM. Maternal and fetal plasma
adensine deaminase, xanthine oxidase and malondialdehyde levels in pre-eclampsia.
Cell Biochem Funct 2005; 23: 279-83.
45. Yoneyama Y, Sawa R, Suzuki S, Otsubo Y, Araki T. Serum adenosine deaminase
activity in women with hyperemesis gravidarum. Clinica Chimica Acta 2002; 324:
141-5.
46. Taşkın S, Taşkın EA, Seval MM, Atabekoğlu CS, Berker B, Söylemez F. Serum
levels of adenosine deaminase and pregnancy-related hormones in hyperemesis
gravidarum. J Perinat Med 2009; 37(1):32-5.
47. Hitoglou S, Zournatzi V, Gougoustamou D, Hatzistilianou M, Tzafettas J. Adenosine
deaminase activity and its isoenzyme pattern in women with recurrent spontaneous
abortions. Gynecol Obstet Invest 2004; 58(3): 126-9.
48. Uslu S, Sütken E, Güçlüer Z, Çolak Ö, Alataş Ö. Yüksek yaş ve Down Sendromu
riski taşıyan gebelerde, seruloplazmin ve adenozin deaminaz aktiviteleri. Türk Klinik
Biyokimya Dergisi 2004; Cilt 2, Sayı 3, Sayfa(lar) 121-126
64