T.C.
SAĞLIK BAKANLIĞI
DR. SİYAMİ ERSEK GÖĞÜS KALP
VE DAMAR CERRAHİSİ
EĞİTİM VE ARAŞTIRMA HASTANESİ
BAŞHEKİM: PROF. DR. İBRAHİM YEKELER
KARDİYOPULMONER BYPASSA GİRİLMEDEN (OFF-PUMP)
ATAN KALPTE VE KARDİYOPULMONER BYPASS KULLANILARAK
KARDİYAK ARREST İLE UYGULANAN KORONER BYPASS CERRAHİSİ
SONRASI ATRİAL FİBRİLASYON GELİŞİMİNİN KARŞILAŞTIRILMASI
Uzmanlık Tezi
Dr. Tansel TÜRKOĞLU
İstanbul – 2004
ÖNSÖZ ve TEŞEKKÜR
Başhekimimiz Prof. Dr. İbrahim Yekeler ve onun şahsında geçmişte hastanemizde görev
yapmış tüm başhekimlerimize,
Uzmanlık eğitimim boyunca bilgi ve deneyimlerini büyük bir hoşgörüyle bana aktaran
Doç. Dr. Murat Demirtaş başta olmak üzere klinik şeflerimiz Doç. Dr. Ergin Eren, Doç. Dr.
Azmi Özler, Doç. Dr. Sabri Dağsalı, Doç. Dr. Fuat Bilgen, Op. Dr. Serap Aykut Aka, Prof. Dr.
Sertaç Çiçek, Doç. Dr. Mehmet Salih Bilal ve Op. Dr. Ilgaz Doğusoy’a,
Kalp cerrahisi eğitimimde bana büyük emekleri geçen, eğitimim için gereken çaba ve
hoşgörüyü fazlasıyla gösteren, gerek insan, gerekse cerrah olarak örnek aldığım, her zaman
desteğini hissettiğim Doç.Dr. Hakan Gerçekoğlu’na,
Kliniğimizin şef muavinleri Op. Dr. Atilla Kanca, Op. Dr. Remzi Tosun, Op. Dr. Murat
Akçar, Op. Dr. Fikri Yapıcı , Op. Dr. Tamer Okay ve Doç.Dr.Muharrem Çelik’e,
Eğitimimin ve tez çalışmamın her aşamasında beni destekleyen, hiçbir zaman yardımlarını
esirgemeyen, insanlığı, bilgisi ve hekimliği ile kendime örnek aldığım, tanımış ve kendisiyle
çalışmış olmayı şans saydığım Op. Dr. Tufan Şener’e,
Kendisini tanımaktan onur duyduğum, bugünlere gelmemde çok büyük emeği olan, bilgi ve
deneyimini
aktarmak
konusunda
çok
özverili
davranan,
emeğinin
karşılığını
asla
ödeyemeyeceğim, tez çalışmamda büyük yardımları olan, Op.Dr. Naz Bige Aydın’a,
Eğitimim süresince birlikte çalışmaktan ve onu tanımış olmaktan büyük mutluluk
duyduğum değerli çalışma arkadaşım Op.Dr. İlknur Kıygıl Kehlibar’a ve diğer tüm başasistan ve
uzman büyüklerime,
Ekibimizde birlikte çalıştığımız Dr. Eren Karpuzoğlu, Dr. Timuçin Aksu ve onların
şahsında tüm asistan arkadaşlarıma,
Başta Uzm. Dr. Sevim Canik ve Prof. Dr. Zuhal Aykaç olmak üzere Anestezi ve
Reanimasyon Kliniği’nde görev yapan tüm şef muavini, başasistan, uzman ve asistanlara,
Kardiyoloji Kliniği şef, şef muavini, başasistan, uzman ve asistanlarına,
Hastanemizde hizmet veren tüm sağlık personeline,
Yaşamım boyunca hep yanımda olan, sevgilerini ve desteklerini esirgemeyen aileme,
Bu yoğun eğitim sürecim boyunca her zaman yanımda olan, hiçbir fedakarlıktan
kaçınmayan sevgili eşim Necla Türkoğlu’na,
TEŞEKKÜR EDERİM.
Dr. Tansel Türkoğlu
Ekim-2004
2
İÇİNDEKİLER
KISALTMALAR
4
GİRİŞ ve AMAÇ
6
GENEL BİLGİLER
I-
TARİHÇE
8
II-
KARDİYOPULMONER BYPASS VE VÜCUTTA MEYDANA
GETİRDİĞİ DEĞİŞİKLİKLER
III-
10
KARDİYOPULMONER BYPASS KULLANILMADAN ATAN
KALPTE YAPILAN KORONER ARTER CERRAHİSİ
IV-
19
İLETİ SİSTEMİ
21
MATERYAL – METOD
28
BULGULAR
34
TARTIŞMA
41
3
KAYNAKLAR
46
KISALTMALAR
ACT: Activating clotting time (Aktive edilmiş pıhtılaşma zamanı)
AF: Atriyal fibrilasyon
Ark: Arkadaşları
AV: Atriyoventriküler
CCS: Canadian Cardiovascular Society
CK-MB: Kreatin kinaz isoenzim fraksiyon-2
CVP: Santral venöz basınç
CX: Sirkumfleks arter
DM: Diabetes mellitus
EKG: Elektrokardiografi
GI: Gastrointestinal
GIS: Gastrointestinal sistem
HR: Kalp hızı (atım/dk)
IABP: İntraaortik balon pump kontrapulsasyonu
ICAM: Hücreler arası adezyon molekülü
Ig: İmmünglobulin
IL: İnterlökin
i.m.: intramüsküler
İMA: İnternal mammarian arter
4
i.v.: intravenöz
KABG: Koroner arter bypass greft
KOAH: Kronik obstrüktif akciğer hastalığı
KPB: Kardiyopulmoner bypass
LAD: Sol ön inen koroner arter
LİMA: Sol internal mammarian arter
MAP: Ortalama arteryel basınç
MI: Miyokard enfarktüsü
MPAP: Ortalama pulmoner arter basıncı
NE: Norepinefrin
NSR: Normal sinüs ritmi
OPCAB: Off pump koroner arter bypass
PAF: Trombosit aktive edici faktör
PAH: Periferik arter hastalığı
PCWP: Pulmoner kapiller uç basıncı
PVR: Pulmoner vasküler rezistans
RCA: Sağ koroner arter
RIA: Radioimmünoassay
SA: Sinoatrial
SVH: Serebrovasküler hastalık
SVR: Sistemik vasküler rezistans
TNF: Tümör nekrozis faktör
TXA2 : Tromboksan A2
TXB2: Tromboksan B2
VCAM: Vasküler hücre adezyon molekülü
VES: Ventriküler ekstrasistol
5
GİRİŞ ve AMAÇ
Atriyal fibrilasyon; etkili klinik kasılma olmaksızın tamamen düzensiz, dakikada
350-600 atriyal depolarizasyonla karakterize, elektrokardiyogramda küçük düzensiz ve
değişken atriyal amplitüd ve morfolojiye sahip bir aritmi çeşididir. Koroner arter cerrahisi
sonrası en sık görülen aritmidir. Koroner arter bypass cerrahisi sonrası görülen atriyal
fibrilasyon insidansı geniş serilerde %20 ile %40 arasında bildirilmektedir [1-3 ]. Bu klinik
problem halen önemli bir morbidite sebebi olmaya devam etmektedir. Cerrahi ve
anestezideki gelişmeler ile miyokard korumasındaki ilerlemelere rağmen bu aritmilerin
sıklığında önemli bir azalma sağlanamamıştır. Literatürde atriyal fibrilasyonun,
hemodinamik instabilite, artmış strok riski, uzamış hastane kalım süreleri, artmış
antiaritmik ajan ve pacemaker kullanımı ve artmış tedavi maliyetleri ile ilişkisi
gösterilmiştir [1, 4-6 ]. Ancak halen koroner arter cerrahisi sonrası görülen atriyal
fibrilasyonun etiyolojisi tam olarak bilinmemesine rağmen, literatürde pek çok risk faktörü
ve tetikleyici olaylar öne sürülmüştür. Pek çok yazar, kardiyopulmoner bypass kullanımının
rolünü suçlamıştır. Atriyal manipülasyon, kanülasyon, kardiyoplejik arrest, uzamış aortik
kros klemp zamanı, atriyum dokusunun iskemiden korunmaması, sistemik mediyatörlerin
salınımı sıkça suçlanmış faktörlerdendir [1,4,6,8]. Muhtemelen anormal atriyal dokudaki
belirli uyarı epizodlarının öncü olduğu düşünülmektedir. Bir çok hasta yaşa bağlı olarak
atriyum dokusunda dejeneratif değişiklikler göstermektedir. Post operatif periyotta elektro
fizyolojik paremetrelerde değişikliğe neden olabilecek bu öncü uyarılar atriyal fibrilasyon
gelişimine neden olabilir. Özellikle postoperatif dönemde görülen artmış katekolamin
seviyesinin anahtar rol oynadığı düşünülmektedir.
Son yıllarda kardiyopulmoner bypass kullanmadan atan kalpte koroner arter
cerrahisi giderek artan sıklıkta uygulanmaya başlanmıştır. Amaç, kardiyopulmoner bypass
ve beraberinde kullanılan vücut soğutma yöntemlerinin fizyolojik sistemler üzerine olan
olumsuz etkilerinden kaçınmaktır. Bu durum cerrahi endikasyon sınırlarını ciddi oranda
artırmıştır. Özellikle 70 yaş üstü hastalarda, ileri derecede düşük ejeksiyon fraksiyonu olan
6
vakalarda, reoperasyon durumunda, serebrovasküler hastalık, karaciğer hastalığı, kanama
bozuklukla, ileri derecede kalsifik aortası olan hasta gruplarında ya da kan ve kan ürünleri
kullanılamayan hastalarda konvansiyonel KPB kullanılarak yapılan ameliyatlara göre
üstünlük sağladığı çeşitli çalışmalarda bildirilmektedir [9,10,11,12].
Literatürde off-pump ve konvansiyonel kardiyopulmoner bypass tekniğinin atriyal
fibrilasyon üzerine etkisini kıyaslayan sınırlı sayıda çalışmalar mevcuttur. Ancak bu
çalışmaların sonuçları çelişkilidir ve kesin bir yargıya varılamamıştır. Az sayıda hasta
üzerinde yapılan çalışmalarda off-pump tekniği ile atriyal fibrilasyon görülme sıklığının
değişmediği bildirilmiştir [13-15]. Salamon ve arkadaşlarının bildirdiği 2569 hastalık
seride de atriyal fibrilasyonun off-pump tekniğinde azalmadığı bildirilmiştir [16]. Diğer
yandan kardiyopulmoner bypass kullanılmadan atan kalpte opere edilen hastalarda belirgin
şekilde atriyal fibrilasyonun azaldığını iddia eden yayınlar da mevcuttu [17,18]. Kilger ve
arkadaşları çalışmalarında kardiyopulmoner bypass prosedürünün atriyal fibrilasyon
sıklığını açıkça arttırdığını ileri sürmüşlerdir [17]. Sonuç olarak koroner arter cerrahisi
sonrası atriyal fibrilasyon önemli bir morbidite nedenidir ve sebebi net değildir.
Çalışmamızın amacı: (1) Atriyal fibrilasyon etiyolojisinde kardiyopulmoner bypass
ve kardiyak arrest prosedürlerinin etken olup olmadıklarını saptamak, (2) Atan kalpte
kardiyopulmoner bypassa girilmeden yapılan operasyon tekniğinin atriyal fibrilasyon
açısından potansiyel olumlu etkisi olup olmadığını saptamak.
Kardiyopulmoner bypassın atriyal fibrilasyon üzerine etkisi ile ilgili yol gösterici
olacağından, ayrıca atrial fibrilasyonun off-pump hastalarda düşük çıkması ihtimalinde bu
önemli morbiditenin az görülmesi açısından off-pump tekniğinin avantajlı olduğu
sonucuna varabilmemiz literatüre katkı olabilir.
7
GENEL BİLGİLER - TARİHÇE
1900’lü yıllardan önce birçok fizyolog izole bir organın perfüzyonunun sağlanması
ve bu perfüzyonun oksijenlenmiş kanla yapılabilmesi üzerine çeşitli çalışmalar
yapmışlardır. 1812’de Le Gallois tarafından ilk “yapay sirkülasyon”
tavşanda karotis
arterlerden beynin kanlanmasını sağlamakla başarılmış oldu. İlk “kan pompası”nı 1885’de
Von Frey ve Gruber geliştirmiş olup, kanın içi boş bir silindir içinde oksijene maruz
bırakılmasıyla oksijen baloncukları ile arteriyelize edilmesini sağlamışlardır. 1895’de
Jacobi izole hayvan akciğerini oksijenatör olarak kullanmıştır (28).
1916 yılında tıp fakültesi öğrencisi Jay McLean tarafından heparin bulunana dek
kanın pıhtılaşmasını önlemek amacıyla kan, defibrine olana dek çalkalanmak zorundaydı
ve kanın pıhtılaşması tüm çalışmaları etkiliyordu. Bu tarihten sonra ise hızlı gelişmeler
meydana gelmiş ve birçok bilim adamı ekstrakorporeal sirkülasyon konusunda önemli
adımlar atmıştır. 1935 yılında Alexis Carrel ve Charles Lindbergh, 18 gün boyunca bir
kedinin tiroid bezini perfüze edebildikleri bir cihaz geliştirdiler. Daha sonraki yıllarda da
birçok organı bu cihazla perfüze etmeyi başardılar (28).
John Gibbon 1930’lu yıllarda genç bir doktorken başladığı çalışmalarını yıllarca
sürdürdü. 1937 yılında üç hayvan üzerinde yeterli kardiyo-respiratuar fonksiyonları kısa bir
süre için bile olsa sağlayabildiği cihaz ile ilk başarılı demonstrasyonu gerçekleştirdi. 6
Mayıs 1953’de Gibbon genç bir bayan hastada atrial septal defekt onarımını KPB ile
başarılı bir şekilde gerçekleştirerek KPB’ın klinik kullanımına öncülük etmiştir. Aynı
tarihlerde C. Walton Lillehei ve ark. Minnesota Üniversitesi’nde “kontrollü krossirkülasyon” adıyla bir teknik geliştirdiler ve 26 Mart 1954’de ventriküler septal defekti
olan bir çocuk ve babası arasında kurdukları bu teknikle defekti başarılı bir şekilde
onardılar. 1955’de Kirklin,
Gibbon tarafından uygulanan tekniğe benzer bir teknikle
intrakardiak defekti olan 8 hastayı opere etmiştir. 1956’da DeWall ve Lillehei’ın
geliştirdikleri bubble oksijenatör Texas Heart Institute’de ilk olarak kullanılmıştır (28).
8
Bu gelişmeler sayesinde konjenital kalp cerrahisi ve kapak cerrahisinde önemli
gelişmeler kaydedilirken 1962 yılında Cleveland Clinic’de Dr. Sones ve Dr. Shirey
tarafından ilk koroner anjiografinin başarılı bir şekilde gerçekleştirilmesi ile koroner arter
hastalığının tanınmasında ve bu anlamda koroner arter cerrahisinin gelişimininde çok
önemli bir adım atılmış oldu (28).
1946 yılında Arthur Vineberg internal mammarian arteri (İMA) bir tünel şeklinde
iskemik miyokarda yönlendirerek kanlanmasını sağlamayı amaçlamıştır. Bu yöntem
iskemik miyokardın perfüzyonunu artırmaya yönelik ilk girişim olarak kabul edilmektedir.
1952’de Vladimir Demikhov İMA ile koroner arter arasındaki ilk başarılı anastomozu
köpeklerde
gerçekleştirmiştir.
1958’de
William
Longmire
sağ
koroner
artere
endarterektomi uygularken arterin yırtılması üzerine internal mammarian arteri ilk kez bir
koroner artere anastomoze etti. Otojen safen ven grefti ile ilk başarılı koroner arter bypass
greft (KABG) operasyonu 1964’de
W. Dudley Johnson tarafından gerçekleştirildi.
1967’de V. I. Kolessov, sol torakotomi ile sol ön inen koroner arter (LAD) - sol internal
mammarian arter (LİMA) anastomozu yaparak revaskülarize ettiği 6 olguyu bildirmiştir.
Bu olgular preoperatif koroner anjiografi yapılmadan ve KPB’a girmeden opere edilmiştir.
Sonraki yıllarda Bailey, Hirose ve Green ayrı ayrı koroner arterler için İMA kullandıkları
olguları bildirmişlerdir (28).
Dünyada bu gelişmeler yaşanırken ülkemizde de 1950’li yıllarda kardiyo-vasküler
cerrahi alanında önemli gelişmeler kaydedilmiş ve 1959 yılında Dr. Mehmet Tekdoğan
ülkemizde ilk kez açık kalp cerrahisini uygulamaya başlamıştır. 1962 yılında Dr. Aydın
Aytaç konjenital kalp cerrahisi ve 1965 yılında Dr. Yüksel Bozer erişkin kalp cerrahisi
alanında ülkemizde ilkleri gerçekleştirmişlerdir. 1962 yılında Dr. Siyami Ersek tarafından
kurulan ve İstanbul Göğüs Cerrahisi Merkezi adını alan, 1993 yılında ölümüyle adı Dr.
Siyami Ersek Göğüs Kalp ve Damar Cerrahisi Eğitim ve Araştırma Hastanesi olan
hastanemizde ilk açık kalp operasyonu 15 Nisan 1963 tarihinde kendisi tarafından atrial
septal defekti ve pulmoner stenozu olan bir hastaya uygulanmıştır. 23 Kasım 1972’de
hastanemizde ilk kez otojen safen ven grefti ile bir hastaya KABG operasyonu
uygulanmıştır (29).
9
KARDİYOPULMONER BYPASS VE VÜCUTTA MEYDANA GETİRDİĞİ
DEĞİŞİKLİKLER
Açık kalp cerrahisinde kardiyopulmoner bypass’ın amacı öncelikle sistemik
homeostazisi sağlamaktır. Bunu da sistemik perfüzyonu, kanın oksijenlenmesini ve aynı
zamanda da karbondioksitin elimine edilmesini sağlayarak gerçekleştirir. Ekstrakorporeal
sirkülasyon sistemi bu fonksiyonları gerçekleştirmek üzere şu bölümlerden oluşur: pompa
(yapay kalp), oksijenatör (yapay akciğerler), rezervuar, ısı değiştirici, filtre, kanüller ve
bağlantı tüpleri. KPB esnasında bu bölümlerden ve tüplerden kan akımı, gaz değişimi,
kanın içinde dolaştığı non-endotelyal yüzey ile etkileşimi ve bunun sonucunda
retiküloendotelyal sistem fonksiyonlarında meydana getirdiği etkiler sebebiyle kısmen ya
da tamamen normal insan fizyolojisinde değişikliklere sebep olan bir takım yan etkiler
görülür. Klinik uygulamada ise bu değişikliklere bağlı olarak başta nörolojik, renal,
hematolojik, gastrointestinal sistem (GIS) fonksiyonları olmak üzere birçok sistem ve
organın bu işlemden etkilendiğini söyleyebiliriz (30).
Ekstrakorporeal sirkülasyon sonrası görülen morbidite ve mortalite oranlarına
bakıldığında bunu belirleyen en önemli etkenin peroperatif meydana gelen miyokard hasarı
olduğu söylenebilir. Kardiyopulmoner bypass süresince; anormal perfüzat kompozisyonu,
persistan ventriküler fibrilasyon, yetersiz miyokard perfüzyonu, ventriküler distansiyon,
ventriküler kollaps, koroner emboli, katekolaminlerin salınımı, aortik kros-klemp,
reperfüzyon hasarının bunun başlıca nedenleri olduğu tespit edilmiştir. Yapılan çalışmalar
göstermiştir ki KPB sonrası
tüm miyokard koruma yöntemlerine rağmen hemen her
10
hastada belli bir derecede miyokard hasarı görülmektedir. Normal ventriküler
fonksiyonlara sahip hastaların bunu tolere edebilmesine karşı yetersiz ventriküler
fonksiyonlara sahip hastalarda erken ve geç dönemde miyokard hasarına ait bulgular
saptanmıştır. Ayrıca günümüzde hasta populasyonunun yaş ortalamasının giderek artması
ve bu hastalarda koroner arter hastalığı ile birlikte konkomitant başka hastalıkların
görülmesi sebebiyle normal fizyolojiyi anlamak ve miyokard hasarına karşı etkin önleyici
stratejiler geliştirmek giderek önemini arttıran bir kavram olarak karşımıza çıkmaktadır
(10,31,32).
KPB akciğerlerin fonksiyonlarında da birçok değişikliğe sebep olur. Kompleman
aktivasyonu ile aktive olan nötrofillerin pulmoner vasküler yatakta sekestrasyonu ve
pulmoner vasküler permeabilitenin artması ile pulmoner interstisyal ödem meydana gelir.
Alveoler surfaktanın kompozisyonundaki değişiklikler ile daha az etkili bir alveoler
stabilite sonucu atelektaziler gelişir ve KPB sonrası ilk 48 saat içinde etkisini sürdürür.
Fonksiyonel rezidüel volüm ve pulmoner komplians azalır. Nefes alış-veriş işi artar.
Fizyolojik şantlar ve alveolo–arteriyel oksijen farkı artar. Sonuç olarak; kompliansta
azalma, atalektazilerde artma, nefes alış-veriş işinde artma, şantlarda artma ve interstisyal
ödem tablosunun ortaya çıkardığı postoperatif pulmoner disfonksiyon tablosu gelişir.
Hastanın uzun süreli ve fazla miktarda sigara içme öyküsünün olması ve buna bağlı
amfizem tablosunun gelişmiş olması postoperatif pulmoner disfonksiyon gelişimi
açısından bilinen en önemli risk faktörleridir. Ayrıca kronik bronşit, gizli pnömoni,
preoperatif pulmoner ödem, ileri yaş ve kas gücü yetersizliği bilinen diğer risk faktörleridir.
Postoperatif dönemde insizyonel ağrı, hareketsizlik, yetersiz nefes alış-veriş, öksürme işini
yetersiz yapma ve hastanın genel anestezi almış olması bu dönemde pulmoner
fonksiyonları etkileyen diğer parametrelerdir (32).
11
Kardiyopulmoner bypass süresince bu durumdan en fazla etkilenen organların
başında beyin gelir. KPB sonrası görülen, çeşitli nörolojik ve kognitif testlerde
başarısızlıklarla kendini gösteren ve nöro-davranışsal disfonksiyon olarak adlandırılan özel
bir durum tariflenmiş olup yapılan çalışmalarda erken postoperatif dönemde hastaların %
30-61’inde saptanmıştır. Bu durum felç ve fokal nörolojik bulgulardan ayrı olarak
tutulmuştur. Oldukça yüksek bir oranda görülen bu durumun kardiyopulmoner bypass ile
ilişkisi açıkça aydınlatılmamış olmakla birlikte büyük vasküler ve torasik operasyon
geçiren hastalarda bu oranın çok düşük olduğu tespit edilmiştir. KABG operasyonları
sonrası görülen felç oranının da özellikle yaş ile bağımlı olduğu saptanmıştır. Bu oran 65
yaş altında %1’den az iken 65 yaş ve üstünde %5, 75 yaş ve üstünde %7-9’dur. Bunda en
önemli etkenler hastada var olan semptomatik karotis arter hastalığının varlığı ve asendan
aortada mevcut olan şiddetli atherosklerozdur ki bu patolojilerde de yaşla birlikte önemli
oranda artış görülmektedir. Kapak cerrahisi ile yapılan karşılaştırmalı çalışmalarda da
nörolojik komplikasyonlar KABG sonrası ortalama %11 oranında saptanırken kapak
cerrahisi sonrası %7’nin altında saptanmıştır. KPB sonrası görülen beyin hasarının altında
çeşitli nedenler olduğu saptansa da temelde hepsi iki önemli nedene dayanır: serebral
hipoperfüzyon ve serebral emboli (30,32).
Ekstrakorporeal sirkülasyon renal fizyoloji ve fonksiyonları üzerinde birçok
değişikliğe sebep olmaktadır. Bunların başında renal kan akımında ve glomerüler filtrasyon
hızında azalma, renal vasküler rezistansda artma gelir. Bu fenomen özellikle non-pulsatil
kan akımı,
katekolamin seviyelerinde artma, inflamatuar mediatörler, makro ve
mikroembolilerin böbreğe ulaşması, eritrositlerin travmaya uğraması sonucu ortaya çıkan
serbest hemoglobine bağlanmaktadır. Böbreklerde meydana gelen bu etkilerin klinik
takipte önemli sonuçları görülmektedir. Kardiyopulmoner bypass sonrası hemodiyaliz
gerektiren oligürik renal yetmezlik oranı çeşitli çalışmalarda %1-5 arasında saptanırken bu
12
hastalarda mortalite oranı ise %27-89 arasında yüksek bir oranda saptanmıştır. Özellikle
orta-ağır konjestif kalp yetmezliği, daha önce geçirilmiş KABG operasyonu, insülin
bağımlı diabetes mellitus, preoperatif hiperglisemi ve önceden var olan renal disfonksiyon
(serum kreatinin seviyelerinde yükselme)
varlığında postoperatif renal disfonksiyon
görülme oranı oldukça yüksektir (30,32).
Kardiyopulmoner bypass sonrası gastrointestinal komplikasyonların görülme oranı
yüksek olmamakla birlikte bu komplikasyonların varlığında mortalite oranlarında anlamlı
derecede artma saptanmıştır. Çeşitli çalışmalarda GIS komplikasyonları %0.6-2.1 arasında
iken bu hastalarda mortalite oranı %13.9-26 arasındadır. En önemli GIS komplikasyonları
GI kanama, intestinal obstrüksiyon ve perforasyon, biliyer kanal hastalıkları, mezenterik
iskemi ve pankreatittir. Bu komplikasyonların görülmesinde hasta yaşı, uzamış kros-klemp
ve bypass süresi, redo operasyonlar, inotropik ajanlar ya da intraaortik balon pump
kontrapulsasyonu kullanmayı gerektiren düşük kardiyak out-put önemli risk faktörleridir.
GIS komplikasyonlarının gelişiminde bağırsak kan akımındaki azalma sorumlu
tutulmaktadır. Bu da kardiyopulmoner bypass sırasındaki hipotermi ve non-pulsatil kan
akımına bağlanmaktadır (30,32).
KPB sonrası plazmada vücudun strese cevabı olarak kabul edilen çeşitli
hormonların ve vazoaktif maddelerin arttığını biliyoruz. Hipotermi, hemodilüsyon ve nonpulsatil akımın özellikle insülin, renin ve prostoglandinlerin salınımını etkilediği
bilinmektedir.
Salınan
bu
maddeler
katekolaminlerin
deşarjındaki
en
önemli
stimülatörlerdir. Yapılan çalışmalarda katekolamin seviyelerindeki artışta stimülatörler
kadar bu hormonların metabolize edilmesinde en önemli organlar olan kalp ve akciğerlerin
kısmen ya da tamamen fonksiyon dışı kalmasının da etken olduğu saptanmıştır. Ayrıca
hipoterminin
tüm enzimatik işlemleri yavaşlattığı bilinmektedir. KPB boyunca
13
hiperglisemiye sıkça rastlanır. Yükselmiş epinefrin seviyeleri sonucu glikojenolizde artma,
hipotermiye bağlı anormal insülin cevabı, glukoz transport ve ütilizasyonunda azalma,
ekstrakorporeal
sistem
elemanlarınca
insülinin bağlanması bundan sorumlu
tutulmaktadır. Fakat hipergliseminin KPB sonrası vücut için avantaj ya da dezavantaj
olup olmadığı kesinlik kazanmış değildir. KPB sonrası postoperatif ilk saatlerde özellikle
tiroid hormonlarının metabolizmasında önemli değişiklikler saptanmıştır. “Ötiroid hasta
sendromu” olarak adlandırılan bu durumda
tetraiodotironin (T4), ters-triiodotironine
dönüşür. Bu hormonun hiçbir biyolojik aktivitesi yoktur. Ayrıca triiodotironin (T3)
seviyelerinde anlamlı düşme saptanmıştır.
çalışmalarında
Bu doğrultuda yapılan çeşitli
hayvan
hipotermik KPB sonrası T3 replasman tedavisi uygulanmış ve sonuç
olarak hayvanların postiskemik ventriküler fonksiyonlarında ve kardiyak out-putlarında
artma tespit edilmiştir. Ancak insanlarda yapılan araştırmalarda KPB sonrası uygulanan
T3 replasman tedavisi ve plasebo uygulaması arasında anlamlı bir fark tespit edilmemiştir.
Bugünkü bilgilerimiz doğrultusunda KPB sonrası rutin T3 replasman tedavisi uygulaması
kabul görmemektedir (32).
KPB sırasında heparinize kan ile perfüzyon sağlanırken bu işlemden plazmada
bulunan plazma protein sistemleri ve kanın şekilli elemanlarında da vasoaktif maddeler,
enzimler ve mikroemboliler sonucu çeşitli değişiklikler saptanmıştır. KPB boyunca
trombositler aktive olurlar. Perfüzyon sistemi ve hastaya göre değişmekle birlikte bu
aktivasyonun derecesine göre trombosit sayısında ve fonksiyonlarında kanama zamanını
uzatacak ve
homeostazisi bozacak etkiler görülür. Ayrıca normal sirkülasyonda
bulunmayan jet akım alanları, akımın durağan olduğu alanlar, dik açılanmış akım hatları
gibi sayısız akım karakteristikleri de bunda etkendir. Öncelikle trombositlerin akıma karşı
dizilimleri değişir, diskoid yapıları bozulur,
agregasyona uğrarlar, sentetik yüzeylere
adezyonları artar ve içerdikleri granüllerde bulunan çeşitli maddeleri salarlar.
Alfa
14
granüller olarak adlandırılan granüller, çeşitli kemotaktik ve koagülasyona sebep olan
proteinler ve faktörler içerirler ki bunlar kapiller permeabilite artışından ve düz kas hücresi
proliferasyonundan sorumludurlar. Ayrıca güçlü vazokonstriktör etkisi olan ve trombosit
agregasyonuna sebep olan Tromboksan A2 (TXA2) sentezi ve salınımını da trombositler
gerçekleştirir. KPB sonunda trombositler, hasta ile perfüzyon sistemi arasında heterojen
olarak dağılırlar. Sonuç olarak; hemodilüsyon, adezyon, agregasyon ve destrüksiyon
sebebiyle total trombosit sayısında %30-50 oranında bir düşme görülür. Yapılan
araştırmalar trombosit sayısındaki bu düşmenin yanında KPB boyunca ve sonrasında
trombositlerin fonksiyonunda da değişiklikler olduğunu göstermiştir. Hastanın heparinize
edilmesi bunda en büyük etkendir. Ayrıca KPB boyunca C5a, C5-9, plazmin, hipotermi,
trombosit aktive edici faktör (PAF), IL-6, katepsin G, serotinin, epinefrin, eikozanoidler
başta olmak üzere birçok sitokin, trombositleri aktive etmenin yanında fonksiyon kaybına
da yol açar. Dolaşımdaki birçok trombosit KPB sonrası yapısal olarak normal gibi görünse
de hastaların kanama zamanına bakıldığında uzamış olduğu tespit edilmiştir (32).
KPB sonrasında
total lenfosit sayısında da düşme gözlenir. KPB, T hücre
fonksiyonlarını ve monositlerin antijen sunum kabiliyetlerini inhibe etmektedir. Lenfosit
sayısındaki değişiklikler yanında çeşitli sitokinlerin etkileri, kompleman aktivasyonu,
immunglobinlerin sentezindeki değişiklikler, B hücre fagositoz yeteneğindeki azalma
postoperatif erken dönemde hastayı çeşitli infeksiyonlara açık hale getirir.
KPB boyunca monositler aktive olurlar, ekstrakorporeal sirkülasyon sonrası çeşitli
sitokinleri sentezler ve salarlar. KPB boyunca IL-8 seviyeleri gittikçe artar. KPB sonrası ise
IL-1, IL-2, IL-4 ve IL-6 seviyelerinin arttığı gözlenir. KPB boyunca TNF’nin plazma
konsantrasyonundaki değişikliklerin mekanizması açıkça bilinmese de, kanda KPB
boyunca monositlerin “doku faktörü” ve Mac-1 reseptörü üzerinden bu değişikliklere sebep
15
olduğu sanılmaktadır. TNF; nötrofil, eozinofil ve diğer inflamasyonda rol alan lökositlerin
aktivasyonu, vasküler endotel yüzeyindeki adezyon moleküllerinin etkisiyle nötrofil,
monosit ve lenfositlerin lokal inflamasyonlu bölgelerde birikimi, kemotaksi, endotel hücre
iskeletini bozarak vasküler
permeabilite artışı, proinflamatuar sitokinlerin (IL-8 v.b.)
sentezlerinin indüksiyonu olarak sıralanabilecek birçok inflamasyon
mekanizmasında
etkili bir akut faz reaktanı olarak tanımlanmaktadır (1,30,32).
Endotel hücresi günümüzde “kan hücresi” olarak adlandırılmaktadır. Erişkinde 1000-5000
m2 arasındaki bir yüzeyi kaplayacak oranda endotel hücresi varlığından söz edilmektedir.
Vücutta bu oranda bulunan endotel hücrelerinin insan fizyolojisi üzerinde de çok önemli
fonksiyonları vardır. İnsan vücudunda vasküler tonus endotel hücre fonksiyonları sayesinde
ayarlanır. Ayrıca vasküler sistemin sürekliliğini ve işlerliğini sağlayan birçok işlem yine
endotel hücrelerinde gerçekleşir. Vasküler sistem fonksiyonlarının devamlılığını sağlayan
birçok vazoaktif maddenin yapımından da yine endotel hücreleri sorumludurlar. Bu kadar
aktif çalışan endotel hücreleri özellikle inflamasyon ve hipoksiye oldukça duyarlıdır. KPB
sırasında vücuttaki tüm endotel hücreleri aktive olur ve tüm endotel yüzeyinde lökosit
adezyon molekülleri oluşur. Bu moleküllerin oluşumu KPB başlar başlamaz önce
komplemanın aktivasyonu sonucu ile olurken ilerleyen saatlerde çeşitli sitokinlerin ve
endotokseminin etkisiyle endotel hücre membranında gerçekleşen ikincil mesaj sisteminin
aktiflenmesi ve bu transdüksiyonun spesifik genlere translokasyonu sonucu hücreler arası
adezyon molekülü (ICAM), vasküler hücre adezyon molekülü (VCAM), E-selektin, Pselektin gibi yeni adezyon moleküllerinin sentezi ile olur. Bu moleküller sayesinde
endotele yapışan nötrofiller salgıladıkları sitotoksik proteazlar ve burada gerçekleşen
enzimatik reaksiyonlar sonucu oluşan oksijen kaynaklı serbest radikaller
ile endotel
hasarına sebep olurlar. Endotel hücrelerinin hasarı sonucu lökositler kan-endotel bariyerini
geçerler ve böylece inflamasyon gerçekleşerek son organ hasarına neden olur. Son yıllarda
yeni lökosit adezyon molekülleri üzerine yapılan çalışmaların katkısıyla özellikle uzamış
16
aortik kros-klemp ve KPB sürelerinin postoperatif dönemde hastaların morbidite ve
mortalite oranlarını ne denli etkilediği bu mekanizma ile daha ayrıntılı olarak saptanmış
oldu (30).
KPB boyunca dilüsyona bağlı olarak nötrofil sayısında düşme gözlenir, operasyon
sonrası hücre sayısında anlamlı bir artış bunu takip eder. KPB sırasında nötrofillerden çok
sayıda enzim ve sitotoksik madde salınır: elastaz, miyeloperoksidaz, çeşitli lizozomal
enzimler, sitotoksik nötral proteazlar, hidroksil radikalleri-hidrojen peroksid-hipobromik
ve hipoklorik asit gibi reaktif kimyasal maddeler v.b. Aktive olan nötrofillerin özellikle
akciğerlere sekestrasyonu ve salgıladıkları yukarıda saydığımız maddelerin etkisi sonucu
pulmoner vasküler geçirgenlik artışı ile görülen interstisyal ödem, KPB sonrası “pompa
akciğeri” olarak tanımlanan akciğer hasarından başlıca sorumlu etkendir (16,19,30,32).
KPB sırasında özellikle oksijenatöre bağlı olarak anlamlı hemoliz görülür.
Membran oksijenatörlerin bubble oksijenatörlere oranla daha az hemolize neden olduğu
tespit edilmiştir. Hemoliz sonucu ortaya çıkan serbest hemoglobin seviyesi hasta tarafından
tolere edilebilmekte ve atılabilmektedir. 100 mg/dl seviyesini geçtiğinde hemoglobinüri
görülür.
Hemolizin
Bu düzey 300 mg/dl seviyesini geçtiğinde ciddi renal hasara sebep olur.
KPB elemanlarından tüpler ve kanüllerdeki çeşitli akım karakteristikleri
(“shear force”) sonucu olduğu bilinmektedir. Bu hemoliz sonucu eritrositlerin yaşam
süreleri kısalmakta ve perfüzyon sonrası anemi tablosu ortaya çıkmaktadır. Hemoliz KPB
sonrası ilk 24 saat devam edebilmektedir (30).
17
KARDİYOPULMONER BYPASS KULLANILMADAN ATAN KALPTE
YAPILAN KORONER ARTER CERRAHİSİ
1950’li yıllarda Murray ve Longmire atan kalpte ilk kez koroner endarterektomi ve
safen ven grefti ya da İMA kullanarak segmental eksizyon yaptıkları olguları
yayınlamışlardır (34).
İlk kez safen ven greftinin sağ koroner artere atan kalpte
anastomozu 1962 yılında Sabiston tarafından bildirilmiştir. 1964 yılında Garrett safen ven
greftini LAD’ye yine atan kalpte anastomoze ettiği olguları yayınlamıştır (34). 1967 yılında
V. I. Kolessov tarafından sol torakotomi ile LAD – LİMA anastomozu yapılan olguların
yayınlanması ile atan kalpte KPB kullanılmadan koroner revaskülarizasyonun insanda
18
gerçekleştirildiğine ait ilk makale yayınlanmış oldu (28,34,35). Ancak o dönemde çalışan
kalbin üzerinde cerrahi girişim gerçekleştirmenin güçlüğü ve bu sebeple yapılacak
anastomozun kalitesinin olumsuz etkileneceği görüşüyle bu girişim destek bulmadı. 1975
yılında Kanada’da Trapp ve Bisarya, Amerika’da Ankeney KPB kullanılmadan atan kalpte
yapılan koroner revaskülarizasyona ait ilk başarılı serileri bildirdiler (36). O tarihlerde
ekstrakorporeal sirkülasyon ve miyokardiyal koruma teknikleri ile ilgili yeni gelişmelerin
oldukça popüler olması sebebiyle atan kalpte koroner arter cerrahisi fazla destek bulmadı.
1980’li yıllarda teknolojik alandaki önemli gelişmeler sayesinde atan kalpte koroner arter
cerrahisi popülarite kazanmaya başladı. 1985 yılında Arjantin’de Buffolo ve ark. ile Benetti
ve ark. güvenli ve etkili yeni yöntemler ile OPCAB operasyonu uyguladıkları serileri
yayınladılar (34,36). Koroner arter akımını proksimal ve distaline uyguladıkları yumuşak
silikon sinerler yardımıyla kestiklerini, kalp hızı ve oksijen tüketimini çeşitli ilaçlar
uygulayarak azalttıklarını ve kalbi böylece stabilize ettiklerini bildirdiler. Bildirilen bu
serilerden sonra atan kalpte koroner arter cerrahisi operasyonlarının sıklığı artmış ve tüm
dünyada uygulanmaya başlamıştır. 1990’lı yıllarda yapılan çalışmalarda özellikle
postoperatif morbidite oranlarının atan kalpte koroner arter cerrahisi uygulanan vakalarda
daha düşük olarak tespit edilmesi ve operasyon maliyetinin daha düşük olması sebebiyle
yeni prosedürler geliştirilmiştir. Son 10 yıl içinde “port access cardiac surgery”, “OPCAB off-pump coronary artery bypass”, “MIDCAB - minimally invasive direct coronary artery
bypass”, “LAST - left anterior small thoracotomy” ile operasyon, endoskopik koroner arter
cerrahisi ve son olarak da “robotik cerrahi” metodları gelişen teknoloji ile gündeme
gelmiştir. Bu teknikler öncelikle koroner bypass cerrahisi için geliştirilmiş, ardından kapak
cerrahisi ve konjenital kalp cerrahisi alanlarında da uygulama sahası bulmuştur. Arteryel
kondüitlerin daha fazla tercih edilmeye başlanması ve buna paralel olarak gelişen video
yardımlı teknikler yanında ekonomik baskılar da kardiyovasküler cerrahi alanında daha az
invaziv yöntemlerin geliştirilmesi zorunluluğunu doğurmuştur.
OPCAB operasyonlarının tüm dünyada yaşanan teknolojik gelişmelere paralel
olarak
yaygın olarak uygulanması ile birlikte bu konuda yapılan çalışmalara da hız
verilmiştir. Özellikle postoperatif morbidite, yoğun bakımda ve hastanede kalış süreleri ve
kullanılan kan ve kan ürünleri miktarlarına bakıldığında atan kalpte yapılan operasyonlarda
anlamlı olarak bu oranların düşük olduğu saptanmıştır (13). Bu oranların anlamlı olarak
düşük tespit edilmesi hastaların KPB’ın istenmeyen yan etkilerinden korunduğu şeklinde
yorumlanmıştır. Buna ilave olarak KPB’a bağlı olarak gelişen “sistemik inflamatuar yanıt”
19
gelişiminde önemli rolleri olan birçok inflamatuar enzim, sitokin ve mediatörün (nötrofil
elastaz, IL-8, C3a ve C5a, endotoksin, TNF ) atan kalpte koroner arter cerrahisi uygulanan
olgularda daha düşük oranda saptanması da bu görüşü desteklemektedir (4,11-14,34).
İLETİ SİSTEMİ
Kalp kası "çizgili kas" yapısındadır. Ancak iskelet kasından farklı özellikleri vardır.
Kalp kasındaki hücreler arası bağlantı unsurları birbirine komşu kalp kası hücreleri
arasında düşük elektriksel dirençli bölümler oluşturarak, elektriksel uyarıların kolaylıkla
hücreden hücreye yayılmasını sağlarlar. Bu nedenle, kalp kasının birbirinden elektriksel
olarak ayrılmış ventrikül ve atriyum bölümleri kendi içlerinde bütün olarak uyarılırlar.
Kalp kasının bu özelliği "hep ya da hiç kanunu" olarak bilinir.
Kalp kası elektrofizyolojik olarak uyarılır. Bütün kalp kası hücreleri uyarıları iletir.
Ancak, ileti hızı kalp kasının değişik bölümlerinde birbirinden farklıdır.
20
Uyarılan her kasta olduğu gibi kalp kası da uyarılınca kasılır. İskelet kasında olduğu
gibi, kalp kasında da uyarılma ile kasılmanın eşlenmesi kalsiyum iyonlarıyla gerçekleşir.
Kalp kasında hücre içi kalsiyum konsantrasyonu, kalsiyumu hücre dışına taşıyan aktif
pompalar ve sekonder aktif transport mekanizması ile düşük düzeyde tutulur. Aksiyon
potansiyelinin oluşumu sırasında gerek doğrudan ekstraselüler sıvıdan, gerekse
sarkoplazmik retikulumdan hücre içine geçen kalsiyum iyonları kasılma mekanizmasını
harekete geçirir.
Şekil 1. Kalp kasının kasılmasında Ca++ ve Na’un rolü
Kalp kasının bir başka önemli özelliği kendi kendine uyarı doğurabilmesidir. Kalp
kası, dışarıdan herhangi bir uyarı almaksızın (örneğin sinirsel yolla) kendi kendisine uyarı
doğurabilir. Bütün kalp kası hücrelerinde bu yetenek vardır. Ancak, kalbin bazı
bölümlerindeki hücrelerde (SA düğüm, AV düğüm, His Purkinje sistemi) bu yetenek daha
gelişmiştir.
Kalbin fizyolojik uyarı odağı sinoatriyal nod'dur (SA nod). Bu odak, tıp
çevrelerinde sinüs düğümü diye de anılır. Kalbin bu odaktan çıkan ritmik uyarılarla
çalışmasına sinüs ritmi denir. Sinüs düğümünden çıkan uyarı (aksiyon potansiyeli) kalp
kası kitlesi içinde belirli bir yol izleyerek yayılır.
Kalbin özel ileti sisteminde yer alan bütün hücreler ritmik uyarılar doğurabilirler.
Ancak, bu ritmik uyarıların frekansı sinüs düğümünden Purkinje sistemine doğru
gidildikçe küçülür.
21
Tablo 1. Kalbin ileti sisteminde uyarı hızları
Ritmik uyarı frekansı
Sinoatriyal nod (SA nod)
60-80 /dk
Atriyoventriküler nod (AV nod)
40-60 /dk
His-Purkinje sistemi
15-40 /dk
Şekil 2. Kalbin ileti sistemi
Uyarının ulaştığı kalp kası bölümü buna kasılarak cevap verir. Aksiyon
potansiyelinin oluştuğu bölümdeki kalp kası kasılır ve normal seyrini tamamladıktan sonra
gevşer. Normal kalp çalışması, bu kasılma-gevşeme döngüsüyle ortaya çıkar. Kalp kasının
kasılması, kalp odacıklarının içindeki kanı sıkıştırarak, kan dolaşımı için itici gücü
oluşturan basıncı doğurur.
22
Kalbin çalışma döngüsü içinde uyarı çıkışında, uyarı çıkış hızında veya uyarının
iletiminde sorun olduğunda klinikte karşımıza kalp hızı değişiklikleri, ileti blokları veya
aritmiler çıkar (35).
ARİTMİLERİN FİZYOPATALOJİSİ
Kalp ritim bozukluğu 3 temel proçesle veya bunların kombinasyonu ile
oluşabilmektedir:
a-Anormal otomatisite/impuls formasyon değişiklikleri
b-İmpuls ileti değişiklikleri
c-Triggered aktivite
Aritmogenezisin iyi anlaşılabilmesi yukarda anlatılan aksiyon potansiyeli elektriki
temelinin ve ileti sistemi anatomisinin iyi bilinmesine bağlıdır.
Normal şartlarda kalbin pace-maker’ı sinatriyal noddur. Sağ atriyum-superior vena
kava birleşim yerinde subepikardial yerleşimlidir. İnsanların %55-%60’ında RCA’dan
çıkan sinüs nod arterinden ve %40-%45’inde Cx’den beslenir. Dakikada 60-100 uyarı
çıkar. İmpuls daha sonra AV kavşak bölgesine ulaşır. Bu bölge hem PDA hem de LAD’den
kan alır.AV nod dakikada 40-60 uyarı çıkarma yeteneğindedir. Görüldüğü gibi AV nod
iskemik olaylara daha az maruz kalma şansına sahiptir. İmpuls bundan sonra His
huzmesine, buradan da sağ ve sol bantlara ayrılır. İletimin son kısmını Purkinje lifleri
oluşturur. Burada impuls çıkarma hızı dakikada 30-40 kadardır.
Normal impuls oluşumu veya iletimi bozulursa hız veya ritimde çeşitli bozukluklar
oluşur. SA nod dışı diğer pace-maker’lar dominant olursa escape ritim gelişir. Kardiak
pace_maker hücreleri spontan diyastolik depolarizasyon özelliğine sahipken non pace-
23
maker’lar bu özellikte değildir. Günümüzde çoğu aritmilerin membran potansiyel kaybına
bağlı (Faz 4’de diastolik potansiyel daha az negatif alır) geliştiği düşünülür.
Normal durumda spontan depolarizasyonu en hızlı olan hücreler bütün ileti
sisteminin depolarizasyonunu kontrol eder (SA nod hücreleri). Ancak bir takım nedenlerle
bazı hücrelerin istirahat membran potansiyeli azalarak anormal otomatisiteye sebep olurlar
(SA dışı ektopik odak) işte uyarı çıkış hızı şu durumlardan etkilenir.
1-Eşik potansiyel seviyelerini değiştiren durumlar
2-Spontan depolarizasyon (Faz 4) eğimindeki değişiklikler
3-Repolarizasyon sonunda maksimal potansiyeli değiştiren durumlar
Parasempatomimetik
ajanlar
vagal
uyarı
çıkışına
sebep
olarak
Faz
4
depolarizasyonu yavaşlatır ve kalp hızı azalır. Ekstrasellüler Ca+2 artışı transmembran
potansiyelini yükseltir ve otomatik hücre depolarizasyonu yavaşlar. Hipokalsemi,
hiperkalsemi, hiperkalemi, hiperkapni, asidoz, alkaloz, miyokard lif gerilmesi, NE, dijital
otomasite de bozukluk yapabilir.
Aksiyon potansiyelinin amplitüdünü azaltan herhangi bir durum (hiperkalsemi, ileti
lifi kalsifikasyonu, iskemi fibrosis) ileti bozukluğu sebebi olabilirler. Bu durumda blok
yada re-entry oluşabilir:
1-Fonksiyonel olarak iki farklı ileti yolu bulunmalı
2-İleti yollarından birinde tek yönlü blok olmalı
3-Diğer ileti yolunda aşağı doğru ileti yavaş olmalı
24
İnisiyal depolarizasyon sırasında tek yönlü blok sebebi ile uyarılamayan bir grup
lif, eksitabilite için hazır hale geldiğinde tekrar uyarılır. Bu devamlı olursa taşikardi ile
sonuçlanır. Sonuçta kalbin yeterli pompa fonksiyonu normal elektriksel aktivasyon ile
oluşan normal kalp kontraksiyonları ile gerçekleşir. Bu uyum bozukluğu gelişimi:
a-Uygun zamanlı atriyal kontraksiyonun kaybolmasına
b-Miyokard oksijen tüketiminin artmasına
c-Ventrikül kontraksiyon yetersizliğine yol açabilir.
Bunlara ilave sirkülatuar cevap gelişirse, temelde bir kalp hastalığı bulunan ve kalp
rezervi azalmış olan, açık kalp cerrahisi geçiren hastalarda özel problemler doğabilir.
ATRİYAL FİBRİLASYON
Atriyal fibrilasyon etkili atriyal kasılma olmaksızın tamamen düzensiz dakikada
350-600 arasında atriyal depolarizasyonla karekterize, EKG’de küçük, düzensiz ve
değişken atriyal amplitüd ve morfolojiye sahip bir aritmi çeşitidir. EKG’de P dalgalarının
görülemediği düzensiz, çok hızlı fibrilatuar aktivitelerden oluşan bir atriyal ritmdir.
Atriyumun elektriksel aktivitesi
EKG’de küçük, düzensiz izoelektrik hat oynamaları
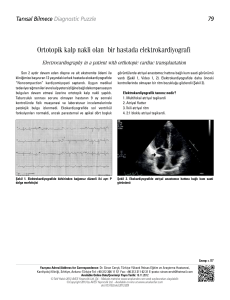
şeklindedir ve değişken amplitüd ve formda hızlı f dalgalarından oluşmaktadır (Şekil 3).
Atriyum hızı 350-500/dk arasında, ventrikül hızı ise 60-170/dk arasındadır. WPW
sendromu olan hastalarda ise ventrikül hızı 300 vuru/dk’yı aşarak VF gelişmesine neden
olabilir. Ritm ileri derecede düzensizdir. P dalgası olmadığından P:QRS ilişkisi
değerlendirilemez. QRS kompleksleri normaldir.
25
Şekil 3.Atriyal fibrilasyon
AF sık görülen bir aritmi tipidir. Sıklığı yaşın ilerlemesi ile artar. Etyolojik
faktörler, atriyal flutterda olduğu gibidir. Sık olarak ciddi kalp yetersizliği ile birliktedir.
Hemodinamik önemi de atriyal fluttera benzer. Atriyal katkının olmaması nedeniyle
kardiyak output düşebilir. Hemodinamik değişikliklere ek olarak sol atriyum kavitesi ya da
apendiksindeki trombüs oluşumu ile pulmoner ve sistemik emboli riski doğurur. Mitral
stenoz ve AF olanlarda bu risk daha yüksektir.
KORONER ARTER BYPASS CERRAHİSİ SONRASI ATRİYAL FİBRİLASYON
Atriyal fibrilasyon kalp cerrahisi sonrasında sık görülen bir aritmi olup, mortalite ve
morbiditeyi
arttırmaktadır.
Cerrahi
ve
anestezideki
gelişmeler
ile
miyokard
korunmasındaki ilerlemelere rağmen bu aritmilerin sıklığında önemli bir azalma
sağlanamamıştır. Post operatif dönemde atriyal fibrilasyon gelişen hastalarda perioperatif
MI, konjestif kalp yetmezliği, solunum yetmezliği gelişme sıklığı artmıştır (38). Post
operatif atriyal fibrilasyon uzamış yoğun bakım süresi, uzamış hastanede kalış süresi ve
artmış maliyete neden olmaktadır (39). Kardiyak cerrahi sonrası gelişen atriyal
fibrilasyonun kesin insidansı bilinmemekle birlikte değişik yayınlarda %10 ile %65
arasında değiştiği rapor edilmiştir (40,41). Bu rapor edilen insidans aralığının geniş
olmasının sebebi, çalışmalarda değerlendirilmiş olan hasta paterni, cerrahinin türü ile
atriyal fibrilasyonun tanım ve tespitinin çok farklı olmasından kaynaklanmaktadır. İzole
KABG sonrasında görülen atriyal fibrilasyon insidansı, izole kapak cerrahisi yada kombine
KABG+kapak operasyonlarına göre daha azdır. Postop atriyal fibrilasyon sıklıkla ilk 5
günde ortaya çıkar. Post op 2. ve 3. günlerde görülme sıklığı maksimumdur(39,41).Klasik
bilgi olarak atriyal fibrilasyon bir veya birkaç hızlı depolarizan odaktaki artmış
otomatisiteye ve bir veya daha fazla döngü içeren re-entran akımlara bağlanmıştır (42,43).
KABG sonrası atriyal fibrilasyon görülmesinin patogenezi net olmamakla birlikte
multifaktöriyel olduğu düşünülmektedir. Muhtemelen anormal atriyal dokudaki belirli
uyarı epizodlarının öncü olduğu düşünülmektedir. Birçok hasta yaşa bağlı olarak atrium
26
dokusunda dejeneratif değişiklikler göstermektedir. Postoperatif periyotta elektro fizyolojik
paremetrelerde değişikliğe neden olabilecek bu öncü uyarılar atriyal fibrilasyon gelişimine
neden olabilir (44). Özellikle post operatif dönemde görülen artmış katekolamin
seviyesinin anahtar rol oynadığı düşünülmektedir (45). KABG sonrasındaki atriyal
fibrilasyon yüksek oranda spontan olarak normale dönmesi nedeni ile çok spesifiktir. Çoğu
hasta ilk 24 saatte, %90’dan fazlası ise 6-8 hafta içinde normal sinüs ritmine döner(46).
Kalp cerrahisi ile ilişkili olmayan atriyal fibrilasyonun normal sinüs ritmine dönme
olasılığı çok düşüktür. Kalp cerrahisi sonrasında atriyal fibrilasyonun gelişiminde rol
oynayan risk faktörleri çeşitli çalışmalarda değerlendirilmiştir. En belirgin bulunan risk
faktörleri ileri taş, kapak hastalığı, atriyal genişleme, preop dönemde atriyal aritmi olması,
kronik akciğer hastalığıdır (40, 41, 43). Ayrıca fonksiyonel ileti bloklarının varlığı, atriyum
duvarındaki cerrahi travmaya bağlı steril inflamasyon, koroner arter hastalığının yaygınlığı,
sinoatriyal ve A-V nod arterlerinin tutulumu ve yapılan bypass sayısıda risk faktörleridir
(36).
Postoperatif Atriyal Fibrilasyon Riskini Arttıran Faktörler
İleri Yaş Grubu
Kronik Akciğer Hastalık Grubu
-Kapak hastalığı
-Artmış postoperatif adrenerjik tonus
-Sol atriyal genişleme
-Beta blokerlerin kesilmesi
-Preop. atriyal taşiaritmi
-Perikardit
-Geçirilmiş kardiak cerrahi
-Hipokalemi
-Preop digoksin kullanımı
-Hipomagnezemi
Postoperatif Atriyal Fibrilasyonun Önlenmesindeki Öneriler
(ACC/AHA/ESC Practice Guidelines)
Class 1 Öneriler:
1-Kontrendike değil ise beta bloker kullanılması
27
2-Postoperatif atriyal fibrilasyonda hız kontrolünün A-V nodu bloke eden
ajanlarla sağlanması
Class 2a Öneriler:
1-Riskli hastalarda profilaktik sotalol ve amiodarone kullanımı
2-Sinüs ritmine döndükten sonra sinüs ritminin korunması amacıyla ibutilide
kullanılması yada kardioversiyon
3-Rekürren yada refrakter postoperatif atriyal fibrilasyonda, koroner arter
hastalığında atriyal fibrilasyon gelişmiş gibi tedavi
4-Antitrombotik tedavi mutlaka eklenmeli (37).
MATERYAL METOD
Hastalar ve metod
Bu çalışmada aynı cerrahi ekip tarafından 1.12.2002 - 15.09.2004 tarihleri arasında
opere edilen,
koroner arter cerrahisi uygulanmış 281 hasta prospektif olarak izlendi.
Hastalar iki gruba ayrıldı. Grup 1 (n=174) kardiyopulmoner bypassa girilmeden, atan
kalpte opere edilmiş hastalardan, grup 2 (n=107) konvansiyonel kardiyopulmoner bypass
ile opere edilmiş hastalardan oluşturuldu. Koroner arter cerrahisi dışında ilave
operasyonları (kapak girişimi, ventrikülotomi gibi) olan hastalar, normal sinüs ritmi
üzerine etki etme potansiyeli olan endokrin hastalıkları olan, preoperatif atriyal
fibrilasyonu olan, preoperatif dönemde beta blokör veya kalsiyum kanal blökörü dışında
antiaritmik ilaç kullanan hastalar çalışma dışı bırakılmıştır. Bu iki grubun prospektif olarak
kaydedilmiş preoperatif, intraoperatif ve postoperatif değişkenleri ve atriyal fibrilasyon
gelişiminin istatistiksel olarak karşılaştırıldı.
Preoperatif değerlendirme
Hastaların anamnezleri alındıktan sonra rutin fizik muayeneleri yapıldı. Aynı
zamanda laboratuar tetkikleri değerlendirildi.
Her hasta için; aşağıdaki preoperatif değişkenleri kaydedildi:
·Yaş
28
·Cinsiyet
·Vücut Kütle İndeksi(kg/m²): Kilo/BoyunKaresi.
≥30:Obesite
25 - 29.9:Aşırı Kilolu
24.9 - 18.5:Normal
≤18.5:Zayıf
·Preoperatif
Angina
Klas:
Kardiovasküler
durum
sınıflaması.
(I)
Kısıtlanmamış, (II) Hafif Kısıtlanmış, (III) Orta Derecede Kısıtlanmış, (IV) Ciddi
Kısıtlanmış, Canadian Cardiovascular Society (Campeau,1975) tarafından belirlenenlere
göre;
·Ejeksiyon Fraksiyonu: Anjiografi veya iki boyutlu ekokardiografi ile
değerlendirilmiş sol ventrikül ejeksiyon fraksiyonu
·Hipertansiyon: Preoperatif dönemde antihipertansif tedavi gören hastalar
·Diabetes Mellitus:(En az iki ölçümde açlık kan şekeri >140 mg/dl veya
antidiabetik ilaç kullanımı)
·Kronik Obstrüktif Akciğer Hastalığı: Uzun süreli inhalasyon veya oral
bronkodilatatör veya steroid kullanımı
·Kronik Böbrek Yetmezliği: Serum kreatinin düzeyi>1.8mg/dl
·Periferik Arter Hastalığı: Aşağıdakilerden bir yada daha fazlası: (Karotis
tıkanıklığı veya stenozu > %50, geçirilmiş veya planlanmış abdominal aorta, ekstremite
arterleri veya karotislere yönelik girişim
·Son 90 Gün İçinde Miyokard Enfarktüsü
·Acil Operasyon
·Euroscore:
-Cinsiyet kadınsa 1 puan
-KOAH varsa 1 puan
-Ekstrakardiak arteriyopati varsa 2 puan
-Nörolojik disfonksiyon varsa 2 puan
29
-Geçirilmiş kardiak operasyon varsa 3 puan
-Preoperatif serum kreatinin değeri>200micromol/lt ise 2 puan
-Aktif endokardit varsa 3 puan
-Kritik preoperatif durum varsa 3 puan
-Unstable anjina/İV nitrat kullanımı varsa 2 puan
-Ejeksiyon fraksiyonu <%30 ise 3 puan,%30-50 ise 1 puan
-Son 90 gün içinde Mİ varsa 2 puan
-Acil operasyon ise 2 puan
-Eşlik eden kardiak operasyon varsa 2 puan
-Torasik aorta cerrahisi varsa 3 puan
-Post Mİ VSD varsa 4 puan
-Preoperatif Beta Bloker Ajan Kullanımı
-Preoperatif Kalsiyum Kanal Bloker Ajan Kullanımı
Anjiyografik değerlendirme
Hastaların anjiografileri değerlendirilerek aşağıdaki değişkenler kaydedildi.
·Sol ana koroner arterde lezyon varlığı
·Sağ koroner arter veya sirkumfleks arter dominans durumu
·Sağ koroner arterde lezyon olmaması
·Sağ koroner arterde kritik lezyon (>%50) varlığı
·Sağ koroner arterin total tıkalı olması
·Sağ koroner arterin yaygın plaklı, hasta olması
· Sol ön inen arterin total tıkalı olması
·Sol ana koroner arterde lezyon varlığı ile birlikte sağ koroner arterin total tıkalı
olması
·Anjiyografide toplam hasta damar sayısı
·1-2 (+) mitral yetersizlik
30
Premedikasyon ve anestezi
Tüm hastalara operasyondan 12 saat önce 10 mg diazepam oral ve operasyondan
30 dakika önce ameliyathaneye gelmeden 0.07 mg/kg midazolam ve 0.5 mg atropin sülfat
i.m. uygulanarak premedikasyon yapıldı.
Hastalar ameliyathaneye alındıktan sonra elektrokardiyografi elektrodları takılarak
V5 göğüs derivasyonu ve D II standart derivasyonu izlenecek şekilde monitörize edildi.
Ardından arteryel oksijen satürasyonunun izlenmesi amacıyla pulse oksimetre probu sol el
işaret parmağa takıldı. Sol sefalik veya brakial vene 16 -18 gauge kanül ile venöz, sağ
radial artere 20 gauge kanül ile arteryel kateterizasyon yapıldı. Steril şartlar altında lokal
anestezi ile sağ internal juguler vene Seldinger metoduyla boyun yolu takıldı. Anestezi
indüksiyonunda propofol 2 - 3 mg/kg, fentanil sitrat 10 -15 mcg/kg, panküronyum bromid
0.1 mg/kg olarak i.v. yoldan verildi. Hastalar daha sonra entübe edildi ( 7.5 – 8 - 8.5
endotrakeal tüp ile). Anestezi idamesi için propofol 2 - 5 mg/kg/saat, fentanil sitrat 5 - 10
mcg/kg/saat i.v. infüzyon olarak ve panküronyum bromid 0.03 mg/kg/saat i.v. olarak
yapıldı. İnhaler anestezik olarak gereğinde sevofluran kullanıldı. Hastanın ısı takibini
yapmak üzere rektal ve özofageal ısı probları yerleştirildi.
Atan Kalpte Kardiyopulmoner Bypassa Girmeden Operasyon Tekniği
Medyan sternotomi yapmadan önce tüm hastalar activated clotting time (ACT) 250
saniyenin üzerinde olacak şekilde heparinize edildi (100 - 200 U/Kg). Distal anastomozlar
yapılırken miyokard yüzeyinin kısmi hareketsizleştirilmesi için Octopus IV (Medtronic,
İnc., Minneapolis, MN, USA) veya Eustech (Estech – Least İnvasive Cardiac Surgery,
Danville, California, USA) stabilizatörler kullanıldı. Anastomoz yapılacak damarın
proksimaline derin geçilerek 4.0 prolen sütür ile askı konularak saha kansızlaştırıldı.Askı
sırasında elektrokardiyografi (EKG) takibi yapılarak ST , T değişikliği olduğu durumlarda
intrakoroner şant kullanımına geçildi, ancak sağ sistem dominant olgularda, eğer sağ
koroner damara bypass yapılacaksa rutin olarak intrakoroner şant kullanıldı. Kalbe
pozisyon derin perikard askı sütürleri ve apeks tutucuların {[ Starfish(Medtronic, İnc.,
Minneapolis, MN, USA)] veya [Estech Pyramid Positioner (Estech – Least İnvasive
Cardiac Surgery, Danville, California, USA)]} yardımı ile verildi. Revaskülarizasyona sol
anterior desandan artere (LAD), sol internal mammaryan arter (LİMA) anastomozu ile
31
başlandı, sağ internal mammaryan arter (RİMA) kullanılan olgularda RİMA LAD’ye ve
LİMA sirkumfleks artere anastomoze edildi ve takiben sırasıyla sol taraf damarlarına önce
proksimal sonra distal anastomozları yapılarak devam edildi. Sağ koroner arter lezyonu
olan hastalarda aynı işlem en son bu damara da uygulandı
Kardiyopulmoner Bypassa Girilerek Operasyon Tekniği
Hastalar ACT 400 saniyenin üzerinde olacak şekilde (300 - 400 U/kg) heparinize
edildi. Aort ve sağ atriyum kanülasyonunu takiben kardiyopulmoner bypassa girildi.Roller
pump(Sarns 9000 perfusion system, 3 M, Ann Arbor, Michigan USA) ve membran
oksijenatörler (Sechrist 3500/3500 HL Series, Anaheim, USA) kullanıldı. Pompa prime
içeriği; 1500 mL Laktatlı Ringer solüsyonu, 150mL %20 mannitol, ve 60 mL %8.4 sodyum
bikarbonattan oluşuyordu. Pompa flowu 2.2 - 2.4 L/m2/dakika idi. Hastalar 28°C’ye
soğutuldu. Miyokard koruması için potasyumlu kan kardiyopleji yirmi dakikada bir
uygulandı. Ve ilave olarak aynı aralıklarla topikal soğuk (4°C) Ringer solüsyonu kalbin
üzerine uygulandı.
İntraoperatif değerlendirme
Operasyon sırasında aşağıdaki değişkenler kaydedilerek değerlendirildi.
·Bilateral internal mammarian arter kullanımı
·Toplam greft sayısı
·Sağ koroner arterin bypass a uygun olmaması
·Operasyon sırasında inotropik ajan kullanımı
·Kardiopulmoner bypass zamanı(dakika)
·Kross klemp zamanı(dakika)
Postoperatif izlem
Hastalar ameliyathaneden yoğun bakıma alınmışlardır. Klinik olarak uygun
kriterlere geldiklerinde ekstübe edilmişlerdir. Hastalara yoğun bakım ünitesinde, 5 leadli
monitör ile standart D-II derivasyonlarıyla sürekli EKG takibi yapıldı. Yoğun bakım
32
süresince kan gazı kontrollerine göre gerekli elektrolit replasmanları yapıldı. Klinik seyri
normal olan hastalar postoperatif birinci gün drenleri alınarak servise çıkarıldı.
Hastalara postoperatif 1.gün rutin 50 mg oral metoprolol başlandı. Servise alınan
hastalara ilk 5 gün iki kez ritim EKG izlemi yapıldı ve maksimum 6 saatlik aralıklarla
nabız ve arteriyel tansiyon takibi yapıldı. Postooperatif dönemde monitörden veya rutin
takip sırasında aritmi saptanan veya çarpıntı şikayeti olan hastalara standart 12
derivasyonlu EKG çekildi. Hastada klinik olarak atriyal fibrilasyonun saptandığı gün,
atriyal fibrilasyonun başlangıç saati olarak esas alındı. Atriyal fibrilasyon saptanan
hastalara dijitalizasyon(yükleme 0.5 mg-ml(2 ml)lık ampullerden 4 saat ara ile iki ampul,
idamesi günde 0.125-0.75 mg = ½-3 tb) veya amiadaron tedavi protokolü (Yüklemesi 250
ml dextroz içinde kilo başına 5 mg,20 dk ile 2 saat içinde verilir.Günlük maximal doz 2200
mg olacak şekilde 24 saatlik infüzyona geçilir.İnfüzyonun ilk günü cordarone tb 3x1
geçilir.) uygulandı.
Hastaların klinik sonuçlarına ilişkin değişkenler kaydedildi.
Postoperatif değerlendirme
Operasyon sonrası aşağıdaki değişkenler kaydedilerek değerlendirildi.
·Kreatinin kinaz-myokard bandı (CK-MB) 1.saat değeri (IU/Lt): Antikor inhibisyon
yöntemi ile Hitachi 704 Automatic Analyzer cihazi ile bakıldı.
·Operasyon sonrası inotropik ajan kullanımı
· Operasyon sonrası intra aortik balon pompası kullanımı
·Total drenaj miktarı (mLt)
·Mekanik ventilasyon süresi (saat)
·Yoğun bakım kalış süresi (saat)
·Kanama revizyonu
·Operasyon sonrası inme
·Gastrointestinal sistem komplikasyonu
·Sternal detaşman
·Sternal yara yeri enfeksiyonu
33
·Mediastinit
·Operasyon sonrası Beta bloker kullanımı
·Operasyon sonrası kalsiyum kanal bloker kullanımı
·Hastanede kalış süresi (gün)
·Atriyal fibrilasyon gelişimi
·Atriyal fibrilasyon gelişme günü
BULGULAR
Off-pump grubu ve KBP grubunda yer alan hastaların demografik karakteristikleri
Tablo -1’de görülmektedir. KPB kullanılarak koroner revaskülarizasyon yapılan hastaların
yer aldığı grupta 90 erkek,17 kadın olmak üzere toplam 107 hasta bulunmaktadır. Atan
kalpte KPB kullanılmadan koroner revaskülarizasyon yapılan hastaların yer aldığı grupta
153 erkek, 21 kadın olmak üzere toplam 174 hasta bulunmaktadır. Çalışmada yer alan her
iki grup cinsiyet, vucut kütle indexi, Canadian Cardiovascular Society anjina sınıfı,
preoperatif beta bloker kullanımı, preoperatif kalsiyum kanal bloker kullanımı, preoperatif
risk faktörlerinden KOAH, renal yetmezlik, periferik arter hastalığı, ejeksiyon fraksiyonu,
son 90 gün içinde geçirilmiş MI, acil operasyon, euroscore, DM, hipertansiyon açısından
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır. Off-pump grubu
hastaların yaşı açısından KPB grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark
bulunmuştur (p= 0.0022).
Tablo-2’ de hastaların anjiografik özellikleri görülmektedir.Off-Pump grubu ve
KPB grubu sol ana koroner arterde lezyon varlığı, sağ koroner arter veya sirkumfleks arter
dominansı, sağ koroner arterin total tıkalı olması, sağ koroner arterin yaygın plaklı hasta
olması,sol ön inen arterin total tıkalı olması, sol ana koroner arterde lezyon varlığı ile
birlikte sağ koroner arterin total tıkalı olması, 1-2(+) mitral yetersizlik olması açısından
karşılaştırıldığında anlamlı bir fark saptanmamıştır. Off-Pump grubu sağ koroner arterde
lezyon olmaması (p=0.0004), sağ koroner arterde kritik lezyon varlığı (p=0.0002) ve
34
anjiografide toplam hasta damar sayısı (p<0.0001) açısından KPB grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark bulunmuştur.
Tablo – 3 de hastaların intraoperatif değişkenleri verilmiştir. Off-Pump grubu ve
KPB grubu bilateral internal mammarian arter kullanımı, sağ koroner arterin bypass’a
uygun
olmaması,
operasyon
sırasında
inotropik
ajan
kullanımı
açısından
karşılaştırıldığında istatistiksel olarak anlamlı bir fark bulunmamıştır. Off-Pump grubu
toplam greft sayısı açısından KPB grubu ile karşılaştırıldığında istatistiksel olarak anlamlı
bir fark bulunmuştur (p<0.0001). Tablo – 3 de ayrıca KPB grubunun ortalama
kardiyopulmoner bypass zamanı ve kross klemp zamanı belirtilmiştir.
Tablo -4 de hastaların postoperatif değişkenleri belirtilmiştir. Off-Pump grubu ve
KPB grubu operasyon sonrası inotropik ajan kullanımı, operasyon sonrası İABP kullanımı,
operasyon sonrası kanama revizyonu, operasyon sonrası inme, operasyon sonrası GIS
komplikasyonu, operasyon sonrası sternal detaşman, operasyon sonrası sternal yara yeri
enfeksiyonu, operasyon sonrası Beta- blokör kullanımı, operasyon sonrası kalsiyum kanal
blokör kullanımı açısından karşılaştırıldığında istatistiksel olarak anlamlı bir fark
bulunmamıştır. Off- Pump grubu hastalar 1. saatteki CK-MB ( IU/Lt) ( p<0.0001) değeri ,
operasyon sonrası total drenaj miktarı (mlt) (p=0.0001), operasyon sonrası mekanik
ventilasyon süresi (saat) (p=0.0089), operasyon sonrası yoğun bakım kalış süresi (saat)
(p=0.0018), hastanede kalış süresi ( gün) (p<0.0001) açısından KPB grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark bulunmuştur. Her iki grup hastada da
mediastinit görülmemiştir. Off-Pump grubunda bir hastada GİS komplikasyonu olarak GİS
kanaması görülmüştür. KPB grubunda da bir hastada GİS komplikasyonu olarak pankreatit
görülmüştür.
Tablo – 5’de hastalarda atrial fibrilasyon gelişimi ve gelişme günü belirtilmiştir.
Off-Pump grubu ve KPB grubu arasında atrial fibrilasyon gelişimi açısından istatistiksel
olarak fark bulunmamıştır. Off-Pump grubu hastalar atrial fibrilasyon gelişme günü
açısından KPB grubu ile karşılaştırıldığında istatistiksel olarak anlamlı bir fark
bulunmuştur (p= 0.0032).
35
Tablo – 6’ da Off-Pump grubu hastalar sağ koroner arterlerinin normal veya kritik
(>%50) lezyonlu olmasına göre ikiye gruplandırılıp, AF sıklığı açısından grup içi
karşılaştırılması belirtilmiştir. İstatistiksel olarak anlamlı fark bulunmamıştır (p= 0.8321).
Tablo – 7’ de KPB grubu hastalar sağ koroner arterlerinin normal veya kritik (>%
50) lezyonlu olmasına göre ikiye gruplandırılıp, AF sıklığı açısından grup içi
karşılaştırılması belirtilmiştir. İstatistiksel olarak anlamlı fark bulunmamıştır (p= 0.7760).
AF gelişen hastaların tamamına magnezyum perfüzyonu uygulanmıştır. Off-Pump
grubunda 10 hastaya doğrudan amiadarone tedavisi uygulanmış ve yanıt alınmıştır. OffPump grubunda diğer 15 hasta dijitalize edilmiştir. Dijitalizasyon tedavisine cevap
vermeyen 8 hastada amiadarone tedavisine geçilmiştir. Amiadarone tedavisinede cevap
vermeyen 1 hastaya GAA kardiyoversiyon uygulanmış ve cevap alınmıştır. Diğer 10
hastada sadece digoksin+Beta bloker tedavisi ile ritim NSR’ye dönmüştür. KPB grubunda
12 hastaya doğrudan amiadarone uygulanmış ve yanıt alınmıştır. Diğer 7 hasta dijitalize
edilmiştir. Dijitalizasyon tedavisine cevap vermeyen 3 hastada amiadarone tedavisine
geçilmiştir ve cevap alınmıştır. Diğer 7 hastada sadece digoksin+Beta bloker tedavisi ile
ritim NSR’ye dönmüştür.
İstatistiksel analiz
Data ortalama ± standart sapma olarak ifade edilmiştir. Gruplar arasındaki
farklılığın istatistiksel anlamı data dağılımına göre uygun olarak Student t test, Mann
Whitney-U test, Ki kare veya Fischer’s exact test ile değerlendirilmiştir. 0.05’den küçük
olan p değeri istatistiksel anlamlı olarak kabul edilmiştir.
36
Tablo 1. Hastaların demografik karakteristikleri
Değişken
Yaş
Erkek Cinsiyet
Kadın Cinsiyet
Vucut Kütle İndeksi(kg/m²)
Canadian Cardiovascular
Society Klas I-II
Canadian Cardiovascular
Society Klas III-IV
Kronik Obtrüktif Akciğer
Hastalığı
Renal Yetmezlik
Periferik arter hastalığı
Ejeksiyon Fraksiyonu >%50
Ejeksiyon Fraksiyonu %30-50
Ejeksiyon Fraksiyonu <%30
Son 90 Gün İçinde Miyokard
Enfarktüsü
Off-Pump
Grubu (n=174)
61.03±11.24
153(%87.9)
21(%12)
26.59± 3.53
72(%41.3)
KPB Grubu
(n=107)
57.27± 9.56
90(%84.1)
17(%15.8)
26.61 ±3.58
42(%39.2)
P Değeri
102(%58.6)
65(%60.7)
0.8026
21(%12)
8(%7.4)
0.3125
5(%2.8)
12(%6.9)
115(%66)
41(%23.5)
18(%10.3)
32(%18.3)
0
6(%5.6)
75(%70)
24(%22.4)
8(%7.4)
25(%23.3)
0.1603
0.8040
0.5139
0.8847
0.5266
0.3599
0.0022
0.3742
0.3742
0.9648
0.8026
37
Acil Operasyon
Euroscore
Diabetes Mellitus
Hipertansiyon
Preoperatif Beta-Bloker
Kullanımı
Preoperatif Kalsiyum Kanal
Bloker Kullanımı
11(%6.3)
2.11± 2.77
23(%13.2)
96(%55.1)
80(%45.9)
14(%13)
2.06± 2.06
17(%15.8)
66(%61.6)
50(%46.7)
0.0823
0.8601
0.5988
0.3206
0.9027
8(%4.5)
9(%8.4)
0.2066
Tablo 2. Hastaların anjiyografik özellikleri
Değişken
Sol Ana Koroner Arterde
Lezyon Varlığı
Sağ Koroner Arter Dominans
Varlığı
Sirkumfleks Arter Dominans
Varlığı
Sağ Koroner Arterde Lezyon
Olmaması
Sağ Koroner Arterde Kritik
Lezyon Varlığı
Sağ Koroner Arterin Total
Tıkalı Olması
Sağ Koroner Arterin Yaygın
Plaklı Hasta Olması
Sol Ön İnen Arterin Total
Tıkalı Olması
Sol Ana Koroner Arterde
Lezyon Varlığı+Sağ Koroner
Arterin Total Tıkalı Olması
Anjiografide Toplam Hasta
Damar Sayısı
Off-Pump
Grubu(n=174)
19(%10.9)
KPBGrubu
(n=107)
17(%15.8)
P Değeri
0.2705
139(%79.8)
88(%82.2)
0.7554
26(%14.9)
16(%14.9)
1.0000
80(%45.9)
26(%24.2)
0.0004
70(%40.2)
68(%63.5)
0.0002
20(%11.5)
10(%9.3)
0.6919
4(%2.3)
3(%2.8)
1.0000
19(%10.9)
12(%11.2)
1.0000
8(%4.6)
5(%4.6)
1.0000
2.35± 0.86
2.77± 0.83
<0.0001
38
1-2 (+) Mitral Yetersizlik
11(%6.3)
7(%6.5)
1.0000
Tablo 3. Hastaların intraoperatif değişkenleri
Değişken
Off-Pump Grubu
(n=174)
Bilateral İnternal Mammarian
65(%37.3)
Arter Kullanımı
Toplam Greft Sayısı
1.90± 0.62
Sağ koroner Arterin By
44(%25.2)
pass’a Uygun Olmaması
Operasyon Sırasında
8(%4.6)
İnotropik Ajan Kullanımı
Kardiopulmoner By pass
Zamanı(Dakika)
Kross Klemp Zamanı
(Dakika)
KPB Grubu
(n=107)
34(%31.7)
P Değeri
0.3698
2.44± 0.74
23(%21.4)
<0.0001
0.5644
7(%6.5)
0.5865
91.15 ±28.87
-
49.72 ±14.71
-
Tablo 4. Hastaların postoperatif değişkenleri
Değişken
Kreatinin Kinaz-Miyokard
Bandı 1.saat (IU/Lt)
Operasyon Sonrası
İnotropik Ajan Kullanımı
Operasyon Sonrası İntra
Aortik Balon Pompası
Kullanımı
Operasyon Sonrası Total
Drenaj Miktarları(mlt)
Operasyon Sonrası
Mekanik Ventilasyon
Süresi(saat)
Operasyon Sonrası Yoğun
Bakım Kalış Süresi(saat)
Operasyon Sonrası Kanama
Revizyonu
Operasyon Sonrası İnme
Off-Pump Grubu
(n=174)
22.7± 8.06
KPB Grubu
(n=107)
41.36± 13.06
P Değeri
<0.0001
16(%9.2)
5(%4.6)
0.2421
7(%4)
2(%1.8)
0.4901
808.39± 323.11
998.69± 485.50
0.0001
8.51± 2.206
9.69± 3.55
0.0089
21.3± 3.6
22.6± 3.3
0.0018
6(%3.4)
2(%1.8)
0.7145
4(%2.3)
0
0.3012
39
Operasyon Sonrası
Gastrointestinal Sistem
Komplikasyonu
Operasyon Sonrası Sternal
Detaşman
Operasyon Sonrası Sternal
Yara Yeri Enfeksiyonu
Operasyon Sonrası
Mediastinit
Operasyon Sonrası Beta
Bloker Kullanımı
Operasyon Sonrası
Kalsiyum Kanal Blokeri
Kullanımı
Hastanede Kalış Süresi
(gün)
1(%0.5)
1(%0.9)
1.0000
3(%1.7)
3(%2.8)
0.6772
9(%5.1)
4(%3.7)
0.7720
0
0
-
142(%81.6)
80(%74.7)
0.1780
9(%5.1)
7(%6.5)
0.7949
6.02± 1.63
7 ±1.69
<0.0001
Tablo 5. Hastalarda atriyal fibrilasyon gelişimi
Değişken
Atriyal Fibrilasyon Gelişimi
Atriyal Fibrilasyonun
Geliştiği Gün
Off.Pump Grubu
(n=174)
25(%14.3)
1.48±0.87
KPB Grubu
(n=107)
19(%17.7)
2.32± 0.89
P Değeri
0.5000
0.0032
Tablo 6. Off-Pump grubu içerisindeki hastaların sağ koroner arterlerinin normal
veya kritik (>%50) lezyonlu olarak ikiye gruplandırılıp, AF sıklığı açısından grup içi
karşılaştırılması
Değişken
Sağ Koroner Arterde
Lezyon Olmayanlar
(n=80)
Sağ Koroner
Arterde Kritik
Lezyon Olanlar
(n=94)
P Değeri
40
Atriyal Fibrilasyon
Gelişimi
12(%15)
13(%15.4)
0.8321
Tablo 7. KPB grubu içerisindeki hastaların sağ koroner arterlerinin normal veya
kritik (>%50) lezyonlu olarak ikiye gruplandırılıp, AF sıklığı açısından grup içi
karşılaştırılması
Değişken
Sağ Koroner Arterde
Lezyon Olmayanlar
(n=26)
Atriyal Fibrilasyon
Gelişimi
5(%19.2)
Sağ Koroner
Arterde Kritik
Lezyon Olanlar
(n=81)
14(%17.2)
P Değeri
0.7760
TARTIŞMA
1980’li yıllarda Buffolo ve ark. (32,34) ile Benetti ve ark. (32,34) sundukları
serilerin ardından OPCAB operasyonların sıklığında anlamlı bir artış oldu. 1990’lı yıllara
gelindiğinde daha fazla hasta sayılarını içeren seriler yayınlanmaya başladı. Cartier ve ark.,
KPB kullanarak
konvansiyonel metodla opere ettikleri 1870 hasta ile OPCAB
prosedürüyle opere ettikleri 300 hastayı karşılaştırdıkları çalışmalarında OPCAB
operasyonu uygulanan hastaların kullanılan kan ve kan ürünü miktarlarında, intraaortik
balon pump kontrapulsasyonu ihtiyacında ve postoperatif CK-MB değerlerinde anlamlı bir
fark
olduğunu
tespit
etmişlerdir
(32).
Postoperatif
komplikasyonlar
açısından
değerlendirildiğinde, Calafiore ve ark. 1843 hastalık serilerinde OPCAB operasyon
oranının %49.9 (919 hasta) olduğunu ve bu hasta grubunda hastane mortalitesi, peroperatif
miyokard infaktüsü ve postoperatif erken dönemde görülen komplikasyonların daha düşük
oranda saptandığını bildirmişlerdir (32). Hernandez ve ark. tarafından yapılan benzer bir
çalışmada da KPB kullanılarak opere edilen 6126 hasta ile OPCAB operasyonu uygulanan
1741 hasta karşılaştırılmış, hastane mortalitesi ve majör komplikasyon (mediastinit, felç,
kanama revizyonu v.b.) oranları benzer bulunmuş, fakat intraaortik balon pump
kontrapulsasyonu ihtiyacı ve postoperatif atrial fibrilasyon görülme oranının OPCAB
grubunda anlamlı olarak daha düşük olduğu tespit edilmiştir (32). Beating Heart Against
41
Cardioplegic Arrest Studies 1 ve 2 isimli çalışmalarda da 401 hastadan 200’üne OPCAB
operasyonu uygulanmış ve hastane mortaliteleri arasında anlamlı bir fark olmamakla
birlikte sternal yara infeksiyonu, inotrop kullanım ihtiyacı, aritmi sıklığı, total drenaj
miktarı, kan ve kan ürünü transfüzyon oranı, yoğun bakımda kalış süresi ve hastanede kalış
süresi oranının OPCAB grubunda anlamlı olarak daha düşük olduğu saptanmıştır (32). Van
Dijk ve ark. tarafından yapılan ve 281 hastayı içeren çalışmada 142 hastaya OPCAB
operasyonu uygulanmış olup bu hasta grubunda total entübasyon sürelerinin ve hastanede
kalış sürelerinin daha kısa olduğu görülmüştür (32).
Bu çalışmalarda da görüldüğü gibi OPCAB operasyonu uygulanan olgularda
postoperatif morbidite ve organ disfonksiyonu oranlarının konvansiyonel metodla KPB ve
kardiyoplejik arrest uygulanarak opere edilen hastalara göre anlamlı bir şekilde düşük tespit
edilmiş olması özellikle yüksek risk grubundaki hastaların OPCAB operasyonlarına daha
uygun olduğu görüşünü gündeme getirmiştir. Mohr ve ark., 1 hafta içinde akut miyokard
infartüsü geçirmiş olan 57 hastaya OPCAB operasyonu uygulamış, operatif mortalite
oranını %1.7 ve 5 yıllık survi oranını %82 olarak saptamıştır (32). Chamberlain ve ark.,
yüksek risk grubunda bulunan 1570 hastadan 332’sine (%21.1) OPCAB operasyonu
uygulamış, bu hastalarda toplam drenaj miktarını, transfüzyon ihtiyacını, yoğun bakımda
ve serviste kalış sürelerini diğer gruba oranla daha düşük olduğunu tespit etmiştir (32). Bu
çalışmaya dahil edilen yüksek risk grubunda yer alan hastalar; 75 yaşın üstünde, sol
ventrikül fonksiyonları düşük (EF değerleri %30’un altında), 1 ay içinde geçirilmiş
miyokard infarktüsü öyküsü olan, serum kreatinin değerleri 1.5 mg/dl’nin üstünde olan,
solunum fonksiyonları bozuk olan ve periferik arter hastalığı öyküsü olan hastalardır.
Burada da görüldüğü gibi bu çalışmalar OPCAB operasyonlarının özellikle geçirilmiş
miyokard infarktüsü öyküsü olan ve buna bağlı sol ventrikül fonksiyonları düşük olan
hastalar için önemli bir avantaj olabileceğini göstermektedir. Bunun yanında renal
fonksiyonları, solunum fonksiyonları ve nörolojik fonksiyonları açısından KPB
kullanılarak konvansiyonel metodla opere olması halinde postoperatif dönemde çeşitli
organ disfonksiyonları gelişme oranı ihtimali yüksek olan hasta grubu açısından da
OPCAB prosedürü, önemli bir çığır aşmıştır. Birçok çalışmanın sonuçlarına göre KABG
operasyonu geçiren hastaların %20-40’ında AF ortaya çıkması ameliyat sonrası dönemde
morbidite açısından önemli bir etken olup, herhangi bir etiyolojik faktörle AF ortaya
çıkması arasında kesin bir ilişki ve tam bir birlik sağlanamamıştır ( 47,48,49,50). Bu
çalışmaların birçoğunda sol ventrikül performansı, ileri yaş, hipertansiyon, geçirilmiş MI,
42
operatif iskemi süresi, inkomplet revaskülarizasyon, önceden geçirilmiş kardiak cerrahi,
koroner lezyonların miktarı, atrial korumanın yetersizliğinin AF sıklığını arttırdığı rapor
edilmektedir (50,51,52,53,54,55). Literatürde off-pump ve konvansiyonel kardiyopulmoner
bypass tekniğinin atriyal fibrilasyon üzerine etkisini kıyaslayan sınırlı sayıda çalışmalar
mevcuttur. Ancak bu çalışmaların sonuçları çelişkilidir ve kesin bir yargıya varılamamıştır.
Az sayıda hasta üzerinde yapılan çalışmalarda off-pump tekniği ile atriyal fibrilasyon
görülme sıklığının değişmediği bildirilmiştir [13-15]. Salamon ve arkadaşlarının bildirdiği
2569 hastalık seride de atriyal fibrilasyonun off-pump tekniğinde azalmadığı bildirilmiştir
[16]. Diğer yandan kardiyopulmoner bypass kullanılmadan atan kalpte opere edilen
hastalarda belirgin şekilde atriyal fibrilasyonun azaldığını iddia eden yayınlar da vardır.
Miyokard koruma yöntemlerininde supraventriküler taşiaritmi üzerine etkilerini
araştıran çalışmalar vardır.Soğuk kardiyopleji tekniklerinin kullanılmaya başlandığı 1970’li
yıllardan sonra postoperatif atryial fibrilasyon insidansında artma gözlenmiştir.Bu durum,
büyük miktarlardaki potasyumun kalbin içine girmesine ve miyokardın çok hipotermik
kalışına bağlanmıştır [44].
Yine bazı çalışmalarda derin myokard hipotermisinin ve elektromekanik arrestin,
genellikle ventriküler miyokardiyumu etkilediği, ancak kardiyoplejik arrest sırasında
atriyum dokusunun iskemik zararlanmadan korunup korunamadığının bilinmediği ve bu
durumun gözden kaçtığı vurgulanmıştır.
Smith ve ark. Atriyal ve ventriküler miyokard ısılarını karşılaştırmışlar , atriyum
dokusunun daha geç soğuyup daha erken ısındığını ortaya koymuşlardır [55].
Gerçekoğlu ve ark. nın koroner arter cerrahisi sonrası supraventriküler
taşiaritmilerde üç farklı miyokard koruma yöntemininin (ventriküler fibrilasyon ve
intermittant aortik kros klemp, soğuk kan kardiyoplejisi ve soğuk kristaloid kardiyopleji)
etkilerinin karşılaştırıldığı çalışmalarında kristaloid kardiyopleji kullanılan hastalarda
supraventriküler taşiaritmi sıklığı anlamlı olarak diğer yöntemlere göre anlamlı yüksek
saptanmıştır [56].
Tüm bu çalışmalar gözönüne alındığında birçok kardiyovasküler cerrah, OPCAB
operasyonu uygulanan hastaların KPB’ın yan etkilerinden korunduğu görüşünde
43
birleşmektedir. Özellikle KPB sırasında uygulanan hemodilüsyon, hipotermi ve iskemireperfüzyonun meydana gelen yan etkilerin büyük kısmından sorumlu tutulması sebebiyle
bu görüş oldukça fazla destek bulmaktadır.
Literatürde KPB’ın AF oluşumu üzerine etkisi konusundaki veriler birbiriyle
çelişmektedir. Önceki çalışmalarda düşük hasta sayıları ile KPB ve AF sıklığı arasında
ilişki saptanmamıştır. Diğer bazı çalışmalar KPB’ın kullanılmadığı operasyonlarda AF’un
azaldığını göstermişlerdir. Kilger ve arkadaşları KPB kullanımının artmış AF ile ilişkisini
göstermişlerdir (17).
Bizim çalışmamızda Off-Pump grubu ve KPB grubu arasında AF sıklığı açısından
fark görülmemiştir. İki grubun anjiyografik incelemelerinin karşılaştırılmasında sağ
koroner arterde kritik lezyon varlığı açısından istatistiksel anlamlı fark olmasının AF
sıklığını etkileyebileceği düşünülmüş ve ileri istatistiksel analizle her iki grup içinde sağ
koroner arterde kritik lezyon varlığı ve yokluğuna göre hastalar ikiye ayrılmış ve bu
grupların AF gelişim frekansı istatistiksel olarak karşılaştırılmıştır. Her iki grup içinde de
sağ koroner arterde kritik lezyon varlığı AF üzerine istatistiksel anlamlı fark
yaratmamaktadır. Bu sonuç, çalışmamızda iki grup arasında saptanan bu farkın, sonucu
anlamlı şekilde etkilemediğini düşündürmektedir.
Atriyal fibrilasyon koroner arter cerrahisi sonrası en sık görülen aritmidir. Koroner
arter bypass cerrahisi sonrası görülen atriyal fibrilasyon insidansı geniş serilerde %20 ile %
40 arasında bildirilmektedir[1-3]. Bu klinik problem halen önemli bir morbidite sebebi
olmaya devam etmektedir. Cerrahi ve anestezideki gelişmeler ile myokard korumasındaki
ilerlemelere rağmen bu aritmilerin sıklığında önemli bir azalma sağlanamamıştır.
Literatürde atriyal fibrilasyonun, hemodinamik instabilite, artmış strok riski, uzamış
hastane kalım süreleri, artmış antiaritmik ajan ve pacemaker kullanımı ve artmış tedavi
maliyetleri ile ilişkisi gösterilmiştir [1,4-6] Ancak halen koroner arter cerrahisi sonrası
görülen atriyal fibrilasyonun etiyolojisi tam olarak bilinmemesine rağmen, literatürde pek
çok risk faktörü ve tetikleyici olaylar öne sürülmüştür. Pek çok yazar, kardiyopulmoner
bypass kullanımının rolünü suçlamıştır.
Son yıllarda kardiyopulmoner bypass kullanmadan atan kalpte koroner arter
cerrahisi giderek artan sıklıkta uygulanmaya başlanmıştır. Amaç, kardiyopulmoner bypass
ve beraberinde kullanılan vücut soğutma yöntemlerinin fizyolojik sistemler üzerine olan
olumsuz etkilerinden kaçınmaktır. Bu durum cerrahi endikasyon sınırlarını ciddi oranda
44
artırmıştır. Özellikle 70 yaş üstü hastalarda, ileri derecede düşük ejeksiyon fraksiyonu olan
vakalarda, reoperasyon durumunda, serebrovasküler hastalık, karaciğer hastalığı, kanama
bozuklukla, ileri derecede kalsifik aortası olan hasta gruplarında ya da kan ve kan ürünleri
kullanılamayan hastalarda konvansiyonel KPB kullanılarak yapılan ameliyatlara göre
üstünlük sağladığı çeşitli çalışmalarda bildirilmektedir (9,10,11,12).
Literatürde off-pump ve konvansiyonel kardiyopulmoner bypass tekniğinin atriyal
fibrilasyon üzerine etkisini kıyaslayan sınırlı sayıda çalışmalar mevcuttur. Ancak bu
çalışmaların sonuçları çelişkilidir ve kesin bir yargıya varılamamıştır. Az sayıda hasta
üzerinde yapılan çalışmalarda off-pump tekniği ile atriyal fibrilasyon görülme sıklığının
değişmediği bildirilmiştir (13-15). Salamon ve arkadaşlarının bildirdiği 2569 hastalık
seride de atriyal fibrilasyonun off-pump tekniğinde azalmadığı bildirilmiştir (16). Diğer
yandan kardiyopulmoner bypass kullanılmadan atan kalpte opere edilen hastalarda belirgin
şekilde atriyal fibrilasyonun azaldığını iddia eden yayınlar da mevcuttu (17,18). Kilger ve
arkadaşları çalışmalarında kardiyopulmoner bypass prosedürünün atriyal fibrilasyon
sıklığını açıkça arttırdığını ileri sürmüşlerdir (17).
Çalışmamızda atrial fibrilasyon takibinde sürekli monitorizayon yapılmadığından
kısa süreli atriyal fibrilasyon atakları atlanmış olabilir. Holter monitorizayonu kullanılarak
yapılan bir çalışmada Af insidansı %41.3 iken, aralıklı EKG çekilerek yapılan takipte bu
oran %19.9’a düşebilmektedir [57]. Ancak sonuç olarak, koroner arter cerrahisi sonrası
klinik olarak önemli kabul edilebilecek, tedavi gerektiren AF olguları çalışmaya tamamıyla
dahil edilmiştir.
Sonuç olarak, çalışmamızda AF sıklığı açısından Off-pump ve KPB grupları
arasında fark saptanmamıştır. Bu sonuç; kardiyopulmoner bypass prosedürünün AF
gelişimi üzerine önemli etkisi olmadığını düşündürmektedir. Koroner arter cerrahisi
sonrası gelişen AF’nun etiyolojisinde kardiyopulmoner bypass prosedürüne, hipotermiye
ve kardiyoplejik arreste bağlı etiyolojik araştırmalardan uzaklaşılarak, her iki operasyon
tekniğinde (KPB’a girilerek arrest kalpte ve KBP’a girilmeden atan kalpte) ortak olması
mümkün olan etiyolojik sebeplerin (revaskülarizasyona bağlı reperfüzyon hasarı, kardiyak
cerrahi girişime bağlı kalbin çeşitli bölgelerinin manipülasyonu, postoperatif perikardiyal
effüzyon, elektrolit imbalansı, perioperatif katekolamin deşarjı, yaşa bağlı atrium
45
dokusundaki
dejeneratif
değişiklikler,
postoperatif
periyotta
elektro
fizyolojik
parametrelerdeki değişiklikler vb) araştırılmasına yönelmenin uygun olacağı görüşündeyiz.
KAYNAKLAR
1.
Cresswell LL, Schuessler RB, Rosenblom M, Cox JL. Hazards of postoperative
atrial arrhythmias. Ann Thorac Surg 1993; 56: 539-59.
2.
Ommen SR, Odell JA, Stanton MS. Atrial arrhythmias after cardiothoracic
surgery. NEJM 1997; 336:1429-34.
3.
Creswell LL. Postoperative atrial arrhythmias: Risk factors and associated
outcomes. Semin Thorac and Cardiovasc Surg 19999; 11:303-7.
4.
Sibert J, Anisimowitz L, Lango R ve ark. Atrial fibrillation after coronary
artery surgery bypass grafting: Does the type of procedure influence the early
postoperative incidence? Eur J Cardiothorac Surg 2001; 19(4): 455-59.
5.
Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after
coronary artery graft surgery: Current trends and impacts on hospital resources.
Circulation 1996;94:390-7.
6.
Almassi GH, Schowalter T, Nicolosi AC, Aggarwald A. Atrial fibrillation after
cardiac surgery: A major morbid event? Ann Surg 1997; 226:501-13.
46
7.
Dixon FE, Genton E, Vacek JL, Moore CB, Landry J. Factors predisposing to
supraventricular arrhythmias after coronary artery bypass grafting. Am J Cardiol
1986; 58:476-8.
8.
Ad N, Snir E, Vidne BA, Golomb E. Potential preoperative markers for the risk
of developing atrial fibrillation after cardiac surgery. Semin Thorac and
Cardiovasc Surg 1999; 117:298-301.
9.
Stamou SC, Corso PJ: Coronary revascularization without cardiopulmonary
bypass in high-risk patients: A route to the future. Ann Thorac Surg
2001;71:1056.
10. Ricci M, Karamanukian HL, Abraham R, et al: Stroke in octogenarians
undergoing coronary artery surgery with and without cardiopulmonary bypass.
Ann Thorac Surg 2000;69:1471.
11. Koutlas TC, Elbeery JR, Williams JM, et al: Myocardial revascularization in
the elderly using beating heart coronary artery bypass surgery. Ann Thorac Surg
2000;69:1042.
12. Pasini E, Ferrari G, Cremona G, et al: Revascularization of severe hibernating
myocardium in the beating heart: Early hemodynamic and metabolic features.
Ann Thorac Surg 2001;71:176.
13. Cohn WE, Sirois CA, Johnson RG. Atrial fibrillation after minimally invasive
coronary artery bypass grafting: A retrospective, matched study. J Thorac
Cardiovasc Surg 1999;117:298-301.
14. Puskas JD, Wright CE, Ronson RS, Brown WM, Gott JP, Guyton RA. Offpump multivessel coronary bypass via sternotomy is safe and effective. Ann
Thorac Surg 1998;66:1068-72.
15. Staatvedt K, Fiane AE, Sellevold O, Nordstrand K. Is atrial fibrillation caused
by extracorporeal circulation? Ann Thorac Surg 1999;68:931-3.
16. Salamon T, Michler RE, Knott KM, Brown DA. Off-pump coronary artery
bypass grafting does not decrease the incidence of atrial fibrillation. Ann Thorac
Surg 2003;75:505-7.
17. Kilger E, Weis FC, Goetz AE, Frey L ve ark. Intensive care after minimally
invasive and conventional coronary surgery: A prospective comparison. Inten
Care Med 2001;27:534-9.
18. Stamou SC, Dangas G, Hill PC ve ark. Atrial fibrillation after beating heart
surgery. Am J Cardiol 2000;86:64-7.
47
19. Frering B, Philip I, Dehoux M, Rolland C, Langlois JM, Desmonts JM.
Circulating cytokines in patients undergoing normothermic cardiopulmonary
bypass. J Thorac Cardiovasc Surg 1994;108:636-41.
20. Aydın NB, Gerçekoğlu H, Aksu B, Özkul V, Şener T, Kıyğıl İ, Türkoğlu T,
Çimen S, Babacan F, Demirtaş M. Endotoxemia in coronary artery bypass surgery: A
comparison of the off-pump tecnique and conventional cardiopulmonary bypass. J Thorac
Cardiovasc Surg 2003;125:843-8.
21. Ascione R, Lloyd CT, Underwood MJ, Lotto AA, Pitsis AA, Angelini GD.
Inflammatory response after coronary revascularization with or without cardiopulmonary
bypass. Ann Thorac Surg 2000;69:1198-204.
22. Fransen E, Maessen J, Dentener M, Senden
N, Geskes G, Buurman W.
Systemic inflammation present in patients undergoing KABG without exracorporeal
circulation. Chest 1998;113:1290-5.
23. Taggart DP, Sundaram S, McCartney C, Bowman A, McIntyre H, Courtney JM,
Wheartley DJ. Endotoxemia, complement and white blood cell activation in cardiac
surgery: A randomized trial of laxatives and pulsatile perfusion. Ann Thorac Surg
1994;57:376-82.
24. Faymonville ME, Pincemail J, Duchateau J, Paulus JM, Adam A, DebyDupont G, et al. Myeloperoxidase and elastase as markers of leukocyte activation during
cardiopulmonary bypass in humans. J Thorac Cardiovasc Surg 1991;102:309-17.
25. Hennein HA, Ebba H, Rodriguez JL, Merrick SH, Keith FM, Bronstein MH et
al. Relationship of the proinflammatory cytokines to myocardial ischemia and dysfunction
after uncomplicated coronary revascularization. J Thorac Cardiovasc Surg 1994;108:626-3
26. Gu YJ, Mariani MA, van Oeveren W, Grandjean JG, Boonstra PW. Reduction
of the inflammatory response in patients undergoing minimally invasive coronary artery
bypass grafting. Ann Thorac Surg 1998;65:420-4.
27. Stephenson LW. History of cardiac surgery. In: Edmunds LH Jr, Cohn LH ed.
Cardiac surgery in the adult. New York, McGraw-Hill Companies, 2003:3-29.
28. Demirtaş MM, Dr. Siyami Ersek Göğüs Kalp ve Damar Cerrahisi Eğitim ve
Araştırma Hastanesi arşiv kayıtları.
29. Edmunds LH Jr, Hessel EA, Colman RW, Menasche P, Hammon JW Jr.
Extracorporeal circulation. In: Edmunds LH Jr, Cohn LH ed. Cardiac surgery in the adult.
New York, McGraw-Hill Companies, 2003:315-87.
48
30. Dignan RJ, Kadletz M, Dyke CM, Lutz HA, Yeh T, Wechsler AS.
Microvascular
dysfunction after myocardial ischemia. J Thorac Cardiovasc Surg
1995;109:892-898.
31. Mangano CM, Hill L, Cartwright CR, Hindman BJ. Cardiopulmonary bypass
and the anesthesiologist. In: Kaplan JA ed. Cardiac anesthesia. Philadelphia, WB Saunders
Company, 1999:1061-110.
32. Ascione R, Caputo M, Angelini GD. Off-pump coronary artery bypass grafting:
Not a flash pan. Ann Thorac Surg 2003;75:306-13.
33. Metin K, Oto Ö. Minimal invaziv kalp cerrahisi. Türkiye Klinikleri Kardiyoloji
Dergisi. 2003;16(4):361-8.
34. Buffolo E, Gerola LR. The evolution of coronary artery grafting on the beating
heart. In: Salerno TA, Ricci M, Karamanoukian HL, D’Ancona G, Bergsland J ed. Beating
heart coronary artery surgery. New York, Futura Publishing Company, 2001:3-8.
35. Doç.Dr.Tayfun Güler, Aritmi ve Elektrokardiyografi, 16.12.2002
36. Suat Canbaz. Kororoner arter cerrahisi sonrası AF gelişimindeki belirleyicilerin
irdelenmesi. TKDC Dergisi; Ekim, 2000, cilt 8, sayı 4,767-770.
37. L. Erik PausJenssen MD; FRCP(C), Cardiology Resident, Division of
Cardiology, University of Saskatchewan. Atrial Fibrillation Following Coronary Artery
Bypass Grafting.
38.
Almassi GH, Schowalter T, Nicolosi AC, Aggarwal A, Moritz TE, Henderson
WG, et al. Atrial fibrillation after cardiac surgery: A major morbid event? Ann Surg
1997;226:501-11.
39. Aranski SF, ShawDP, Adams DH, Rizzo RJ, Couper GS, VanderVliet M.
Predictors of atrial fibrillation after coronary artery surgery. Current trends and impact on
hospital resources. Circulation 1996;94:390-7.
40. Creswell LL, Schuessler RB, Rosenbloom M, Cox JL. Hazards of postoperative
atrial arrhythmias. Ann Thorac Surg 1993;56:539-49.
41. Maisel WH, Rawn J, Stevenson WG. Atrial fibrillation after cardiac surgery.
Ann Intern Med 2001;135:1061-73.
42. Braunwald, E. (2001). Heart Disease: A textbook of cardiovascular medicine
(6th edition). Philadelphia: W.B. Saunders Company.
43. Fuster V, Ryden LE. ACC/AHA/ESC Guidelines for the Management of
patients with atrial fibrillation. J Am Coll Cardiol 2001;38(4):1-69.
49
44. Cox, JL. A perspective of postoperative atrial fibrillation in cardiac operations.
Ann Thorac Surg 1993;56:405.
45. Thompson AE, Hirsch GM, Pearson GJ. Assessment of new onset postcoronary
artery bypass surgery atrial fibrillation: Current practice pattern review and the
development of treatment guidelines. J Clin Pharm Ther 2002;27:21-37.
46. Stebbins D, Igidbashian L, Goldman SM, et al. Clinical outcome of patients
who develop atrial fibrillation after coronary artery bypass graft surgery. PACE
1995;18:798.
47. Rubin DA, Hieminski KE, Reed GE, Herman MY. Predictors, prevention and
longterm prognosis of atrial fibrillation after coronary arter surgery. J Thorac
Cardiovascular Surgery. 1987:94:331-335
48. Dimerod OJM, McGregor CGA,Stone DE. Arrhytmias after coronary bypass
surgery. Br.Heart j. 1984:51:618-621
49. Vecht RJ, Nicolaide EP, Ikwenka JK, Liassider CH. Incidence and prevention
of supraventricular
tachyarrhytmia after coronary arter surgery. Int J Cardiolaogy
1986:13:125-134
50. Groves PH,Hall RJC.Atrial tachyarrhytmia after cardiac surgery. European
Heart J. 1991:12:458-463
51. Tyras DH, Stotheart JC. Supraventricular tachyarrhytmias after myocardial
revascularisation. A randomized trial of prophylactic digitalisation. J Thorac Cardiovasc
Surgery. 1979:77:310-31
52. Laitch JQ, Thomson D. The importance coronary artery bypass grafting. J
Thorac Cardiovasc Surgery. 1990:100:338-342
53. Muller JC, Khan N. Atrial activity during cardioplegia and postop arrhytmias. J
Thorac Cardiovasc Surgery. 1987:94:558-565
54. Cameron A, Schwotz MJ. Prevalence and significance of atrial fibrillation in
coronary disease. Am J Cardiology. 1988:61:714-717
55. Smith PK, Buhrman WC. Supraventricular condition abnormalities following
cardiac operations. A comparison of inadequate atrial preservation. J Cardiovasc Surgery.
1983:85:105-115
56.Gerçekoğlu H, Evrenkaya S, Aydın B, Şener T, Karabulut H, Türek O. Koroner
Arter Cerrahisi Sonrası Supraventriküler Taşiaritmiler: Üç Farklı Miyokard Koruma
Yönteminde Karşılaştırmalı Klinik Çalışma.Kardiyoloji.Cilt :7 Sayı:3 2000
50
57.Aranski SF,Shaw DP,Adams DH ,et al.Predictors of atrial fibrillation after
coronary artery surgery: Current trent and impact on hospital resources. Circulation 1996;
94: 390 – 7.
51