T.C.
ÇUKUROVA ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ BİYOKİMYA ANABİLİM DALI
Anne Kanında Fetal Nükleik Asitlerle Prenatal Tanı Uygulaması
Ebru DÜNDAR YENİLMEZ
DOKTORA TEZİ
TEZ YÖNETİCİSİ
Prof. Dr. Abdullah TULİ
ADANA-2010
KABUL VE ONAY
Doktora Programı Çerçevesinde yürütülmüş olan
“Anne Kanında Fetal Nükleik Asitlerle Prenatal Tanı Uygulaması”
adlı çalışma, aşağıdaki jüri tarafından Doktora Tezi olarak kabul edilmiştir.
Tarihi: 04/11/2010
TEZ SINAV JÜRİSİ
Prof. Dr. Abdullah TULİ
Çukurova Üniversitesi
Başkan
Prof. Dr. Kıymet AKSOY
Çukurova Üniversitesi
Üye
Prof. Dr. Cüneyt Evrüke
Çukurova Üniversitesi
Üye
Prof. Dr. Nuray ULUSU
Hacettepe Üniversitesi
Üye
Yukarıdaki Tez, Yönetim Kurulunun
Prof. Dr. Nurten DİKMEN
Çukurova Üniversitesi
Üye
/
/
tarih ve
Prof. Dr. Halil Kasap
Sağlık Bilimleri Enstitü Müdürü
i
sayılı kararı ile kabul edilmiştir.
TEŞEKKÜR
Doktora eğitimim süresince tez konusunun belirlenmesi, tezin şekillenmesi ve
tez sürecinin organizasyonunda bilimsel çalışmaya yönlendiren ve destekleyen başta
hocam sayın Prof. Dr. Abdullah TULİ’ye, manevi desteğini hiçbir zaman esirgemeyen
Prof. Dr. Nurten Dikmen ve Prof. Dr. Levent Kayrın hocalarıma teşekkür ederim.
Tezim süresince fikirleri ve katkılarından dolayı izleme komitesi hocalarımdan
Prof. Dr. Kıymet Aksoy’a ve Prof. Dr. Cüneyt Evrüke’ye teşekkür ederim.
Örnek temininde yardımlarını esirgemeyen Kadın Doğum Anabilim Dalı
asistanları ve hocalarıma, Biyoistatistik ve Tıbbi Bilişim Anabilim Dalı Arş. Gör. İlker
Ünal’a teşekkür ederim.
Lisansüstü eğitimim boyunca bana en büyük destek olan başta öğretim görevlisi
eşim Emrah Yenilmez’e, kendisine ayırmam gereken zamanların bir bölümünü aldığım
biricik oğlum Tuna JANDAR’a ve diğer tüm aile bireylerime teşekkür ederim.
Tez çalışmamı TF2005D2 no’lu proje ile destekleyen Çukurova Üniversitesi
Bilimsel Araştırma Projeleri Birimine teşekkür ederim.
ii
İÇİNDEKİLER
Kabul ve Onay .............................................................................................................................. i
ÇİZELGELER DİZİNİ ...............................................................................................................viii
SİMGELER VE KISALTMALAR DİZİNİ ................................................................................. ix
ÖZET ............................................................................................................................................ xi
ABSTRACT ................................................................................................................................xii
1. GİRİŞ ......................................................................................................................................... 1
2. GENEL BİLGİ .......................................................................................................................... 3
2.1. Prenatal Tanı Tanımı, Amacı ve Başlangıcı ....................................................................... 3
2.2. Prenatal Tanı Yöntemleri.................................................................................................... 3
2.2.1. Girişimsel Prenatal Tanı Yöntemleri ........................................................................... 4
2.2.2. Girişimsel Olmayan Prenatal Tanı Yöntemleri ve Gelişmeler .................................... 8
2.3. Klinik Tanıda Günümüzde Kullanılan Prenatal Tanı Yöntemleri .................................... 10
2.3.1. Doğrudan Mutasyon Saptama Yöntemleri ................................................................ 11
2.3.2. Dolaylı Mutasyon Saptama Yöntemleri .................................................................... 13
2.3.3. Gelişmekte Olan Yöntemler ...................................................................................... 16
2.4. Maternal Dolaşımdaki Serbest Nükleik Asitler ................................................................ 21
2.4.1. Maternal Plazmadaki Serbest Fetal DNA Kaynağı ................................................... 21
2.4.2. Fetal DNA Serbestleşme Mekanizmaları .................................................................. 21
2.4.3. Maternal Plazmadaki Fetal DNA’nın Zenginleştirilmesi ve Saptanması .................. 22
2.4.4. Fetal DNA’nın Saptanmasında Seçeneksel Yöntemler ............................................. 24
2.4.5. Maternal Plazmadan Fetal DNA’nın Temizlenmesi .................................................. 24
2.5. Anne Kanında Fetüse Ait Hücreler................................................................................... 25
2.5.1. Maternal Dolaşımda Fetüse Ait Hücrelerin Sıklığı ................................................... 26
2.6. Klinik Tanıda Fetal DNA’nın Kullanım Alanları ............................................................. 27
2.6.1. Fetal Cinsiyet Tayini.................................................................................................. 27
2.6.2. Fetal RhD Genotiplemesi .......................................................................................... 27
iii
2.6.3. Fetal DNA ile Tek Gen Bozukluklarının Saptanması ............................................... 28
2.6.4. Plazma DNA Kimerizmi............................................................................................ 30
2.7. Fetal DNA Derişimlerini Arttıran Hastalıkların Saptanması ............................................ 31
2.7.1. Pre-Eklampsi ............................................................................................................. 31
2.7.2. Anöploidiler ............................................................................................................... 31
3. GEREÇ VE YÖNTEM ............................................................................................................ 34
3.1. Gereç ve Kimyasal Maddeler ........................................................................................... 34
3.1.1. Gereçler ..................................................................................................................... 34
3.1.2. Kimyasal Maddeler.................................................................................................... 34
3.2. Örnek Toplanması ve İş Akış Şeması ............................................................................... 35
3.3. Maternal Plazmanın Ayrımı ve DNA İzolasyonu............................................................. 36
3.3.1. Maternal Plazmanın Ayrımı ...................................................................................... 36
3.3.2. Ebeveyn ve Fetal DNA izolasyonu............................................................................ 36
3.4. “Nested” PCR ................................................................................................................... 41
3.4.1. “Nested” PCR ile Fetal Y Kromozom Tayini............................................................ 41
3.4.2. Multipleks “Nested” PCR ile Fetal X ve Y Kromozom Tayini ................................. 44
3.5. RT-PCR ile Fetal DNA Kantitasyonu .............................................................................. 46
3.6. Fetal DNA Derişimi Hesaplanması .................................................................................. 48
3.7. Mutasyonların HRM ile Analizi; Beta globin genotiplemesi ....................................... 49
3.8. Hb S Mutasyonunun HRM Analizi ile Genotiplenmesi ............................................... 51
3.9. Dizi Analizi ile Fetal DNA Mutasyonu Saptanması......................................................... 52
3.10. İstatistik Analiz ............................................................................................................... 55
4. BULGULAR ........................................................................................................................... 56
4.1. “Nested” PCR ile Maternal Fetal Y Kromozomu Tayini ................................................. 58
4.2. Multipleks “Nested” PCR ile Fetal X ve Y Kromozom Tayini ........................................ 59
4.3. Niceleyici RT-PCR ........................................................................................................... 60
4.3.1. RT-PCR ile Cinsiyet Tayini....................................................................................... 60
iv
4.3.2. RT-PCR ile Maternal Fetal DNA Kantitasyonu ........................................................ 61
4.4. Gebelik Haftası ile Fetal ve Total DNA Düzeyleri Arasındaki İlişki ............................... 64
4.5. RT-PCR ile HbS Genotiplemesi ....................................................................................... 68
4.6. Beta Talasemilerde HRM Analizi .................................................................................... 69
5. TARTIŞMA ............................................................................................................................. 76
6. SONUÇLAR VE ÖNERİLER................................................................................................. 84
7. KAYNAKLAR ........................................................................................................................ 86
v
ŞEKİLLER DİZİNİ
Şekil 1. Fetüs, uterus ve plasentanın gösterimi………………………………………………… 4
Şekil 2. Amniyosentez işlemi………………………………………………………………….
5
Şekil 3. CVS’nin uygulanması………………………………………………………………… 7
Şekil 4. Plasentanın değişik yerleşiminde kordosentez uygulaması. Solda posteriyor plasenta ve
sağda anteriyor plasenta görülmektedir……………………………………………………….. 8
Şekil 5. PGD uygulanmasının gösterimi………………………………………………………. 9
Şekil 6. Doğrudan mutasyon saptama yöntemleri……………………………………………. 12
Şekil 7. Heterodubleks oluşumu……………………………………………………………… 13
Şekil 8. DGGE yöntemi………………………………………………………………………. 14
Şekil 9. dHPLC şematik gösterimi…………………………………………………………… 15
Şekil 10. CE-SSCP yöntemi………………………………………………………………….. 16
Şekil 11. TaqMan RT-PCR yöntemi………………………………………………………….. 17
Şekil 12. HRM analizi………………………………………………………………………..
18
Şekil 13. MLPA yöntemi…………………………………………………………………….. 19
Şekil 14. Dolaşımdaki fetal DNA’nın tek gen bozukluklarının prenatal tanısında kullanımı. (A)
Fetal DNA’nın maternal dolaşıma salınımı. (B) Maternal plazmada fetal DNA……………... 28
Şekil 15. PLAC4 geni için serbest fetal RNA’nın trizomi 21’de analizi…………………….. 32
Şekil 16. Trizomi 18’de Maspin geni çalışması……………………………………………… 33
Şekil 17. MagNa Pure LC kısımlarının görünümü…………………………………………… 37
Şekil 18. MagNA Pure LC yöntem basamakları……………………………………………... 38
Şekil 19. DNA izolasyon yöntem basamaklarının şematize edilmesi………………………... 40
Şekil 20. “Nested” PCR basamaklarının gösterimi…………………………………………..
41
Şekil 21. “Nested” PCR ile fetal Y kromozomu belirlenmesi. B Belirteç, 1, 2, 3, 4, 6, 7 erkek
cinsiyet, 5 ve 8 dişi cinsiyet plazma örnekleri, 9 Negatif kontrol, 10 Pozitif kontrol………….. 58
Şekil 22. Multipleks “nested” PCR ile X ve Y kromozomu belirlenmesi. (A) 1, 2, 3 plazma
DNA, 4 genomik erkek DNA. (B) 1, 2 plazma DNA, 3 dişi genomik DNA…………………. 59
Şekil 23. Total ve Fetal DNA için standart eğrilerin gösterimi. (A) beta globin-total DNA için
standart eğri (B) DYS14-fetal DNA için standart eğri………………………………………… 61
vi
Şekil 24. RT-PCR’de CP değeri ve amplifikasyonun ekran görüntüsü………………………... 62
Şekil 25. Kontrol, orak hücreli ve talasemik fetüs gruplarında gebelik haftası ile fetal DNA
düzeyleri arasındaki ilişki……………………………………………………………………….66
Şekil 26. Kontrol, orak hücreli ve talasemik fetüs gruplarında gebelik haftası ile total DNA
düzeyleri arasındaki ilişki……………………………………………………………………… 66
Şekil 27. Erken ve geç gebelik gruplarına göre HbS taşıyıcısı, talasemi taşıyıcısı ve kontrol
grubu gebelerde fetal ve total DNA miktarları artışının grafikle gösterimi. (A) Gebelik
dönemlerine göre iki grupta fetal DNA oranları. (B) Gebelik dönemlerine göre total DNA
oranları…………………………………………………………………………………………. 68
Şekil 28. HbS taşıyıcı bir örneğin HRM analiz grafiği………………………………………… 68
Şekil 29. Normal ve HbS taşıyıcısı fetüslerin HRM analizi pik görüntüleri. (A) Genotipi AA
belirlenen fetüsün normal kontrol örneği ile HRM analizi görüntüsü. (B) Talasemi taşıyıcısı
anne ve HbS taşıyıcısı fetüsün HRM analizi grafiği…………………………………………… 69
Şekil 30. Promotor ve ekson 1 bölgesinde Cap+22 kontrol ve plazma fetal DNA’da aynı
mutasyonun gösterilmesi. (A) HRM eğrisinin normalize edilmiş halinin görünümü. (B) HRM
eğrilerinin görünümü…………………………………………………………………………… 70
Şekil 31. (A) Baba ve fetüste saptanan IVSI-1 mutasyonunun HRM analizi ile görüntülenmesi.
(B) Anne ile fetüsün IVS1-110 taşıdıkları HRM analizi………………………………………. 70
Şekil 32. Maternal Fetal DNA’da Cd 15 ve IVSI-110 mutasyonlarının sekansla gösterimi…... 71
Şekil 33. IVSII-1 genotipi taşıyan baba ve fetal DNA’nın HRM eğrisi……………………….. 72
Şekil 34. IVS2-3′ UTR bölgesinde saptanan baba ve plazma fetal DNA’sında IVSII-848
mutasyonu HRM eğrisi……………………………………………………................................ 72
vii
ÇİZELGELER DİZİNİ
Çizelge 1. “Nested” PCR’de kullanılan primer dizileri ............................................................. 422
Çizelge 2. Multipleks “Nested” PCR’de kullanılan primer dizileri........................................... 444
Çizelge 3. RT-PCR DYS14 ve Beta globin için kullanılan primer ve prob dizileri .................. 488
Çizelge 4. HRM primer dizileri ................................................................................................. 511
Çizelge 5. Dizi analizinde kullanılan beta geni primerleri ……………………………………..53
Çizelge 6. HbS Taşıyıcı ve talasemi taşıyıcısı gebelerin yaş ve gebelik haftası değişkenleri ..... 56
Çizelge 7. Çalışma gruplarının eritrosit indeksleri ...................................................................... 57
Çizelge 8. Multipleks “Nested” PCR ile saptanan cinsiyetler ..................................................... 60
Çizelge 9. Fetüslerin “Nested” PCR ve RT-PCR sonucunda belirlenen cinsiyetleri .................. 60
Çizelge 10. HbS taşıyıcı ve talasemi taşıyıcı gebelerin maternal plazmadaki fetal DNA düzeyleri
..................................................................................................................................................... 63
Çizelge 11. Beta globin ile maternal plazmadaki total DNA düzeyleri..................................... 633
Çizelge 12. Gebelik dönemine göre “Nested” PCR ve RT-PCR yöntemleriyle plazmada Y
kromozomunun saptanması ......................................................................................................... 64
Çizelge 13. Erken ve geç gebelik haftalarına göre fetal ve total DNA düzeyi medyan değerleri64
Çizelge 14. Erken ve geç gebelik dönemlerine göre gruplarda fetal ve total DNA arasındaki
ilişki……………………………………………………………………………………………..67
Çizelge 15. Maternal Fetal DNA ve CVS örneklerinde fetüs genotiplendirilmesinin
karşılaştırılması............................................................................................................................ 73
viii
SİMGELER VE KISALTMALAR DİZİNİ
ADAM12
A Disintegrin and Metalloproteaz 12
AFP
Alfa Feto Protein
APEX
Arrayed Primer Extension
ARMS
Amplification Refractory Mutation System
ASO
Allele Specific Oligonucleotide
β–hCG
Beta human Chorionic Gonadotropin
CE-SSCP
Capillary
Electrophoresis-Single
Conformational Polymorphism
CVS
Chorionic Villus Sampling
DAZ
Deleted in Azospermia
dHPLC
Denaturing
High
Chromatography
DGGE
Denaturing Gradient Gel Electrophoresis
DYS14
Y Chromosome Specific Sequence
EDTA
Ethylenediaminetetraacetic Acid
FACS
Flourescence Activated Cell Sorting
FMR1
Fragile X Mental Retardation 1
FISH
Floresan In Situ Hibridization
GE
Genom Equivalent
HPLC
High Preformance Liquid Chromatography
HRM
High Resolution Melting
HbS
Hemoglobin S
IEF
Isoelectric Focusing
KAH
Konjenital Adrenal Hiperplazi
LC
Light Cycler
MACS
Magnetic Activated Cell Sorting
ix
Performance
Strand
Liquid
MALDI-TOF MS
Matrix-Assisted Laser Desorption
Time-of-Flight Mass Spectrometry
Ionization-
MLPA
Multiplex Ligation-dependent Probe Amplification
MoM
Multiple of Median
MS
Mass Spectrometry
PAPP-A
Pregnancy Associated Plasma Protein A
PGD
Preimplantation Genetic Diagnosis
PLAC4
Placenta Specific 4
QMPSF
Quantitative Multiplex PCR of Short Flourescent
Fragments
RT-PCR
Real Time-Polymerase Chain Reaction
rpm
revolution per minute
PCR
Polymerase Chain Reaction
SABER
Single Allele Base Extension Reaction
SNP
Single Nucleotide Polimorphism
SRY
Single Copy Sex Determining Region Y
TGCE
Thermal Gradiant Capillary Elecrtophoresis
uE3
Unconjuge Estriol
x
ÖZET
Anne Kanında Fetal Nükleik Asitlerle Prenatal Tanı Uygulaması
Maternal dolaşımda serbest fetal DNA’nın bulunması ile geçtiğimiz on yılda
girişimsel olmayan prenatal tanıda gelişmeler kaydedilmiştir. Fetüste paternal
alellerin serbest fetal DNA’da tanımlanmasına yönelik çalışmalar artık
kullanılmaya başlanmıştır. Maternal plazmada fetal DNA analizinde HRM eğrisi
analizi girişimsel olmayan prenatal tanı için büyük bir potansiyel oluşturmaktadır.
Elli yedisi orak hücre, 32’si beta talasemi taşıyıcısı ve 15’i sağlıklı kontrol
olmak üzere toplam 104 primigravidanın maternal plazma örneğini çalıştık. Fetal
DNA, 1 mL plazma örneğinden elde edildi; erkek fetüsleri saptamak için Y
kromozomuna özgül SRY ve DYS14 belirteçleri “nested” PCR ve RT-PCR ile
analiz edildi. Fetal ve total DNA kantitasyonu sırasıyla DYS14 ve beta globin
genleriyle yapıldı. Girişimsel prenatal tanıdaki geleneksel yöntemlere seçenek
olarak hemoglobinopatilerde HRM analizi ile fetal DNA genotiplendirilmesi
yapıldı.
Maternal plazmada gebeliğin erken döneminde fetal DNA (DYS14), RT-PCR
ile % 100 oranında erkek taşıyan gebede saptandı; SRY dizisi kullanarak “nested”
PCR ile bu oran % 93,7 olarak bulundu. Maternal plazma total (beta globin) ve
fetal DNA düzeyleri gebelik haftası ile artış gösterdi. Orak hücre taşıyıcısı
gebelerde fetal DNA düzeyi, kontrol ve talasemi grubuna göre artan MoM
değerleri gösterdi. Talasemi taşıyıcısı gebelerde total DNA miktarında, kontrol ve
orak hücre taşıyıcısı gruba göre azalan MoM değeri gözlendi (p<0,001). Gebeliğin
geç döneminde, orak hücre taşıyıcısı, talasemi taşıyıcısı ve kontrol grupları
arasında beta globin düzeylerinin anlamlı olarak arttığını saptadık. Fetal DNA’nın
HRM ile genotiplemesi paternal alellerin maternal DNA’dan ayrımı ile yapıldı.
Fetüsün anneyle aynı genotipi taşıdığı durumlarda kısmen de olsa sorunlar
yaşandı.
Sonuçlarımız hemoglobinopatili gebeliklerin erken döneminde, fetal ve total
DNA düzeylerine bakmanın anlamlı olmadığını gösterdi. Hemoglobinopatilerin
prenatal tanısında girişimsel yöntemlere seçenek olarak fetal DNA’nın
genotiplendirilmesinde fetüsün anneden farklı paternal aleller taşıdığı durumlarda
HRM analizinin kullanışlı olabileceğini göstermektedir.
Anahtar Sözcükler: Girişimsel olmayan prenatal tanı, HRM analizi, serbest
fetal DNA, total DNA
xi
ABSTRACT
Application of Prenatal Diagnosis with Fetal Nucleic Acids in Maternal Blood
The discovery of cell free fetal DNA in the maternal circulation has driven
developments in noninvasive prenatal diagnosis in the past decade. Detection of
paternally derived alleles in cell free fetal DNA is becoming well established.
Analysis of fetal DNA from maternal plasma by new techniques such HRM
analysis offers great potential for noninvasive prenatal diagnosis.
We examined 104 maternal plasma samples from 57 pregnant women carrier
of sickle cell anemia, 32 pregnant women carrier of beta thalassemia and 15
healthy control subjects. Fetal DNA was extracted from 1 mL plasma samples. To
detect male fetuses SRY and DYS14 markers specific to the Y chromosome
analyzed by nested PCR and RT-PCR. DYS14 and beta globin were used for
quantitation of fetal and total DNA levels respectively. Alternative to traditional
methods in invasive prenatal diagnosis, we used HRM analysis for genotyping of
fetal DNA in hemoglobinopathies.
We detected Y chromosome specific DYS14 in maternal plasma of 100%
women bearing male fetuses in early pregnancy. The value was 93.7% with SRY
by nested PCR. The levels of total and fetal DNA increased with gestational age.
We observed greater MoM values of fetal DNA in sickle cell anemia pregnancies
compared to thalassemia and healthy groups. The MoM values were smaller in
thalassemia pregnancies compared to other groups (p<0.001). In late period of
pregnancy, we observed significantly increased levels of beta globin between sickle
cell anemia, thalassemia and control groups. Genotyping by HRM we were able to
distinguish paternal alleles of fetal DNA from maternal DNA. Problems were
encountered when the fetus carries the same allele with mother.
Our results show that investigation of the fetal and total DNA in early
pregnancies with hemoglobinopathies is not found to be useful. HRM is an
alternative method for invasive prenatal diagnosis to genotyping of fetal DNA
when the fetus carries the paternal allele different from the mother’s.
Key Words: Noninvasive prenatal diagnosis, HRM analysis, cell-free fetal
DNA, total DNA
xii
1. GİRİŞ
Tedavisi olmayan genetik hastalıklarda prenatal tanı uygulaması, genetik
alanında yüzyılımızda yaşanan en önemli gelişmelerden biridir. Teknolojik gelişmeler;
tanının güvenirliliğinin artmasına, daha fazla hastalığa tanı konulabilmesine, hastalığın
daha erken dönemde ve daha hızlı tanımlanabilmesinin yanı sıra tarama testlerinin
gelişmesi ile yaygınlaşmasına da olanak sağlamıştır1. Prenatal tanıda erken tanı koymak
ve sonuca göre gerekli kararı verebilmek çok önemlidir. Esas olan, kullanılan
yöntemleri, gebeliğin sonlandırılması için bir araç olarak görmek değil; fetüsün durumu
hakkında doğru bilgi edinmek, aileye kendi kararlarını kişisel, sosyal ve etik ilkeler
çerçevesinde vermesini sağlamaktır2.
Kalıtsal geçiş gösteren hemoglobinopatilerin prenatal tanısı, 1970’lerde yapılan
uygulamalardan bu yana, yaklaşık 30 yıllık deneyim ile pek çok ülkede rutin olarak
uygulanmaktadır. Hemoglobin sentez bozukluklarının moleküler düzeyde tanımlanan
ilk tek gen bozukluklarından olması, mutasyon saptamada ve sonuçta globin gen
mutasyonlarının prenatal tanısında kullanılan literatürde polimeraz zincir reaksiyonuna
(PCR) dayalı pek çok tekniğin geliştirilmesi için bir prototip oluşturmuştur3.
Günümüzde ağır seyreden hemoglobinopatilerin henüz kesin tedavisi olmaması
nedeniyle prenatal tanı, bu bozuklukların bir anlamda koruyucu hekimliğini
sağlamaktadır. Prenatal tanı, gebeliğin olası en erken evresinde doğru ve hızlı sonuç
bulmayı amaçlamaktadır. Prenatal tanı için sağlanması istenen önkoşullar şunları
içermelidir:
1- Risk altında olan çiftlerin uygun zamanda belirlenmesi,
2- Hastalığa neden olan mutasyonların tanımlanması,
3- Fetal materyalin gecikmeden, güvenli şekilde alınması,
4- Ebeveynlerin
mutasyonlarına
bakılarak
fetal
DNA’nın
genotipinin
araştırılmasıdır.
Prenatal tanıdaki yeni gelişmeler, süreçlerin hem güvenlik hem de zamanlama
konusunda iyileştirme çalışmalarına doğru yönlenmektedir. Aynı zamanda fetal genetik
1
materyalin seçeneksel kaynaklarını içeren yeni moleküler teknolojilerin uygulanmasını
içermektedir.
Günümüzde prenatal
tanı
süreçlerinin
temel
dezavantajı,
fetal
örneklemede girişimsel yöntemlerin kullanılmasıdır. Kullanılan bu girişimsel fetal
örnekleme yöntemlerinde fetal kayıp riski bulunmaktadır4,5. Bu nedenle geçtiğimiz 10
yıldan bu yana, girişimsel olmayan yöntemlerle prenatal analiz çalışmaları devam
etmektedir. Bu çalışmalar anne kanında dolaşımdaki fetal hücreler ve serbest fetal
DNA’yı kullanarak yapılmaktadır3. 1997 yılında Lo ve arkadaşları, gebelerde
plazmadaki serbest fetal DNA’nın varlığını Y kromozom dizilerinin saptanmasıyla
ortaya koymuşlardır. Niceliksel analizler maternal plazmadaki fetal DNA derişiminin,
hücre içinde bulunan fetal DNA’dan daha fazla olduğunu göstermiştir. Bu bulgu,
maternal plazmadaki fetal DNA’nın girişimsel olmayan prenatal tanı için değerli bir
materyal olabileceği sonucunu ortaya koymuştur6.
Bu
çalışmada,
rutinde
kullanılan
geleneksel
girişimsel
prenatal
tanı
yöntemlerinden koriyonik vilüs örneklemesine seçenek olarak, girişimsel olmayan bir
yöntemle maternal kandaki serbest fetal DNA’nın yeni teknolojik yöntemlerin kullanımı
ile genetik özelliğinin ortaya konması ve sonuçların geleneksel yöntemlerle
karşılaştırılması amaçlanmıştır.
2
2. GENEL BİLGİ
2.1. Prenatal Tanı Tanımı, Amacı ve Başlangıcı
Prenatal tanı, ailede bir genetik kusurun varlığı veya bulunabilme riskine ilişkin
yapılan işlemler bütünüdür1. Başka bir tanımla, gebeliğin erken dönemlerinde farklı
yöntemlerle alınan fetal örneklerin, biyokimyasal ve moleküler yöntemlerle kalıtsal
geçiş gösteren hastalıkların tanısının konularak gebelik sırasında gerekli yasal süre
içinde gebeliğin sonlandırılmasına olanak sağlamaktadır7.
Prenatal tanının amacı, gebeliğin etik açıdan terminasyona uygun olduğu dönem
içinde, risk altındaki fetüste, söz konusu genetik hastalığın bulunup bulunmadığını
ortaya koymaktır1. Bunun sonucu olarak da genetik hastalıkların ve doğumsal sekellerin
perinatal mortalite oranlarını azaltmak ve ciddi klinik sorunlar olarak ön planda yer
almalarını engellemektir1.
Prenatal tanının başlangıcı, 1966'da Steele ve Breg'in6 bir fetüsün kromozom
yapısının,
amniyotik
sıvıdan
alınan
kültür
yapılmış
hücrelerin
analizi
ile
belirlenebileceğini göstermesiyle başlamıştır. Bu sürecin başlamasıyla birlikte koriyonik
vilüs örneklemesi ve perkütan umbilikal örnekleme 1970’lerde ve 1980’lerde kullanıma
girmiştir. Gerçekte prenatal tanının tarihçesinin daha eskilere dayandığı ve karmaşık bir
süreç olduğu bildirilmektedir. İlk prenatal tanı bir sekel için 1916’da rapor edilmiştir.
1895’te Willhelm Röntgen ve W. Williams Keen’in8 X-ışınlarının keşfi ve X ışınlarının
gebelik sürecinde fetüsün duruş biçimini tanımlayarak ve herhangi bir anomali
saptayabilmek için kullanılabileceğini ileri sürmüşlerdir. Aynı yıl Edward Davis Parker8
gebe bir kadavranın röntgenini çekerek fetüs iskeletinin görüntülenmesini başarmıştır.
Günümüzde kullanılan prenatal tanı yöntemleri geleneksel olarak doğrudan ve dolaylı
yöntemler olmak üzere iki kısımda tanımlanmıştır.
2.2. Prenatal Tanı Yöntemleri
Fetal tıbbın en önemli özelliği doktorun hasta yani fetüs ile doğrudan temas
edememesidir. Bu nedenle özel görüntüleme tekniklerine ihtiyaç vardır. Diğer önemli
3
bir konu ise fetüse yapılacak müdahalelerin anne üzerinden yapılması gerekliliğidir,
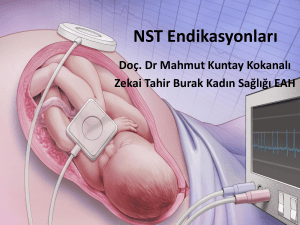
çünkü fetüse başka bir erişim şekli yoktur (Şekil 1)9. Anne üzerinden yapılacak
müdahaleler veya yaklaşımlar anneyi doğrudan etkileyecektir. Prenatal tanıda
kullanılacak yöntemin olabildiğince girişimsel olmaması tercih edilmelidir. Prenatal tanı
merkezlerinde girişimsel ve girişimsel olmayan yöntemler uygulanmaktadır1,10.
Şekil 1. Fetüs, uterus ve plasentanın gösterimi9.
2.2.1. Girişimsel Prenatal Tanı Yöntemleri
Fetüs ve eklerine yapılan doğrudan müdahele tekniklerini kapsamaktadır. Bu
teknikler:
1. Amniyosentez,
2. Koriyon vilüs örneklemesi,
3. Fetal kan örneklemesi (Kordosentez) dir.
Amniyosentez ve CVS en yaygın uygulanan doğum öncesi tanı yöntemleridir10.
4
2.2.1.1. Amniyosentez
Amniyosentez, girişimsel prenatal tanı yöntemleri arasında en sık kullanılan
yöntemdir. Önceleri; körlemesine uygulanan tekniğin ultrasonografinin gelişmesiyle
güvenirliği artmıştır. Amniyon sıvısı bebeğin doğmadan önceki yaşam ortamıdır ve tüm
salgıları bu ortama olmaktadır2. Amniyon sıvısındaki fetal deri, gastrointestinal ve
solunum sistemlerinden dökülen hücrelerin kültür edilmesinden sonra karyotiplemenin
yapılması esasına dayanmaktadır. 15-17. gebelik haftalarında amniyotik sıvı hacmi
yaklaşık 150-200 mL olduğundan 15 mL kadar amniyon sıvısı alınması fetüse herhangi
bir etki yapmamaktadır. İşleme bağlı fetal kayıp oranı geniş serili çalışmalarda % 0,22,1 olarak bildirilmektedir10. Alınmasındaki kolaylık ve yansıttığı metabolik durumların
önemi, amniyon sıvısını vazgeçilmez tanı aracı haline getirmiştir2 (Şekil 2)11.
Şekil 2. Amniyosentez işlemi11.
2.2.1.2. Koriyonik Vilüs Örneklemesi
Trofoblastik doku ve fetüs aynı embriyolojik kökene sahiptir; bu yüzden vilüs
örneklemesinin fetal anormallikleri yansıtacağı gerçeğinden yola çıkılarak bu yöntem
kullanılmaya başlanmıştır. Bir doku örnekleme tekniği olan CVS, erken dönemde
uygulanması nedeniyle 1980’li yıllarda sık kullanılmaya başlanmış bir yöntemdir2.
Amniyosenteze göre uygulanması zordur; alınan hücreler doğrudan fetal kaynaklı
5
değildir. Elde edilen materyalde mozaisizm, amniyosenteze göre daha sık karşılaşılan
bir sorundur. Tüm bunlara ek olarak, fetüs üzerinde muhtemel olumsuz etkileri vardır.
CVS yapılma endikasyonundaki genel görüş, rutin amniyosentez endikasyonlarıyla aynı
olduğu şeklindedir. Ancak, tek gen hastalıkları açısından pozitif aile öyküsünün
bulunduğu durumlarda özellikle tercih edilebilir. Çünkü elde edilen dokuda kültür
yapılmaksızın moleküler inceleme için DNA eldesi mümkündür. CVS’nin avantajı daha
erken dönemde uygulanabilmesidir; koriyon fetal kaynaklı bir dokudur, genetik olarak
fetüsü yansıtır ve 1. trimestirde kolaylıkla ulaşılabilir. Kullanımını kısıtlayan başlıca
faktör ise komplikasyonlarıdır2:
1. Amniyon ve koriyon zarlarının zedelenmesi (% 0,1),
2. Retro/intraplasental hematom, vajinal kanama (% 10),
3. Uterus hasarı (% 2,5),
4. Açıklanamayan oligohidramniyoz gelişimi (% 0,5),
5. Fetal kayıp (% 1,5-3,5).
Yöntemin dezavantajları ise amniyosenteze göre teknik olarak daha zor olması,
elde edilen hücrelerin doğrudan fetal hücreler olmaması ve sitogenetik incelemede
yalancı mozaisizm gibi durumların daha sık görülmesidir.
Onuncu gebelik haftasından önce yapılan koriyonik vilüs biyopsisi sonrasında
fetal ekstremite anomalilerinin 10-20 kat daha sıklıkta görülmesi, yönteme karşı endişe
doğmasına neden olmuştur. Bu anomalilerin oluşumunda muhtemel mekanizmalar
ekstremitelerde perfüzyon azalması, vazoaktif bazı maddelerin salgılanması, emboli
oluşumu ve doğrudan travmatik etki düşünülebilir. Daha sonra yapılan çalışmalarda 11.
ve daha sonraki haftalarda yapılan CVS’lerde görülen ekstremite sekellerinin oranının
beklenen düzeylerde olduğu ifade edilmektedir. Bu nedenle, koriyon vilüs biyopsisinin
11. gebelik haftasından sonra ve deneyimli obstetrisyenler tarafından yapılmasının
uygun olacağı söylenebilir10 (Şekil 3)12.
6
Şekil 3. CVS’nin uygulanması12.
2.2.1.3. Kordosentez
Umblikal arter veya venden iğne ile girilerek kan alınmasıdır. Kordosentez için en
uygun dönem ortalama 18-22. gebelik haftasıdır13. Geç dönemde uygulanabilirliği bir
dezavantaj olmasına rağmen, kısa sürede sonuç alınması nedeniyle özellikle gecikmiş
olgularda tercih edilmektedir. Daha erken haftalarda umblikal damarların yapısı
nedeniyle kanama riski yüksektir; teknik olarak plasentanın yerleşimi çok önemlidir ve
bu dönemde yapılan uygulamalar sonrası fetal kayıp oranı % 1-2 olarak bildirilmiştir
(Şekil 4)2,14.
Kordosentez işlemi ile alınan materyal doğrudan fetal hücreleri içerdiğinden tanı
değeri diğer yöntemlerden daha fazladır. Ayrıca alınan materyalden hücre kültürü
yapılmaksızın doğrudan kromozom analizi yapılabilmekte ve karyotipleme işlemi çok
daha kısa sürede tamamlanabilmektedir. Oysa amniyosentezde karyotipleme 3-5 hafta
kadar sürebilmektedir. Özellikle 19. gebelik haftasından sonra prenatal tanıda kısa
sürede sonuç alınabildiği için amniyosentez yerine kordosentez düşünülebilir.
Kordosentez uygulaması, prenatal tanı dışında bazı durumlarda fetal tedavide de
kullanılabilmektedir. Rh izoimmunizasyonunda aneminin kan transfüzyonu ile tedavisi
buna örnektir10.
7
Şekil 4. Plasentanın değişik yerleşiminde kordosentez uygulaması. Solda posteriyor plasenta ve sağda
anteriyor plasenta görülmektedir14.
2.2.2. Girişimsel Olmayan Prenatal Tanı Yöntemleri ve Gelişmeler
2.2.2.1. Fetal Ultrasonografi
Neredeyse tıbbın her alanında kullanılan ultrasonografi obstetrikte en fazla
kullanılan yöntemlerden biri haline gelmiştir. Bugüne kadar bilinen bir zararının
gösterilememesi nedeniyle prenatal tanı yöntemleri içinde, fetal risk ve annenin rahatlığı
açısından en uygun olarak kullanılan yöntemdir. Ultra ses dalgalarını kullanan bir alet
yardımıyla fetusun incelenmesi ve varsa anomalilerin saptanması esasına dayanır10.
2.2.2.2. Maternal Kanda Bakılabilen Belirteçler
Anomaliler açısından yüksek risk bulunan gebelikleri belirlemek için yapılan
tarama testleri, genetik ve doğum hekimlerinin her zaman ilgisini çekmiştir. Maternal
kanda bakılan tarama testleri, 1. trimesterde serbest β-hCG ve PAPP-A, 2. trimesterde
üçlü tarama testi (AFP, serbest β-hCG ve uE3) ve maternal serum AFP'dir10. Son
dönemlerde bir metallo proteaz olan ADAM12’nin de gebelikte 1. trimestir tarama
testlerinde bir belirteç olarak kullanılabileceği belirtilmektedir15.
8
2.2.2.3. İmplantasyon Öncesi Genetik Tanı
Yardımcı üreme tekniklerinin gelişmesine paralel olarak, genetik yapının
saptanmasına olanak tanıyan yöntemlerin implantasyon öncesi dönemde uygulanması
ile implantasyon öncesi genetik tanı (PGD) gündeme gelmiştir. İmplantasyon öncesi
tanının temel avantajı, 2. ve 3. trimestrede gebeliğin sonlanmasının yaratacağı
psikolojik yükün olmaması olarak kabul edilebilir2.
İlk PGD, Handyside ve ark.16 tarafından cinsiyete bağlı hastalıklar için risk taşıyan
embriyoların implantasyon öncesinde cinsiyet belirlenmesinde kullanılmıştır. Birkaç yıl
sonra floresan in situ hibridizasyon (FISH) yönteminin tanımlanması, embriyoların
cinsiyet belirlenmesi ve anöploidi taramasına olanak sağlamıştır. Tek gen mutasyonları,
PCR ile tanımlanmakta ve DNA analizi, biyopsi yapılan blastomerde ya da 1ci ve 2nci
polar cisimlerde uygulanmaktadır16.
PGD’yi tercih eden çiftler over stimülasyonunu içeren in vitro fertilizasyon
tedavisi görmekte ve 3ncü günde embriyolara biyopsi yapılmaktadır. Genetik analizle
sağlıklı embriyolar seçilmekte ve bu embriyolar uterusa aktarılmaktadır17 (Şekil 5)18.
Şekil 5. PGD uygulanmasının gösterimi18.
2.2.2.4. Maternal Plazmadaki Nükleik Asitler
1948’lerde Mendel ve Matais6 hem hasta hem de sağlıklı bireylerde plazmadaki
nükleik asitlerin varlığını ortaya koydular. Sistemik lupus eritematozus, romatoid artrit
ve kanserli hastaların serumlarında yüksek düzeylerde DNA olduğu bildirildi. 1969’da
9
Walknowska ve ark.19 maternal periferal kanda ilk kez fetal lenfositlerin varlığını
bildirmişlerdir4. Aradan geçen 10 yılda araştırmalar, maternal dolaşımda bozulmadan
kalan fetal hücreler üzerine yoğunlaşmış ve girişimsel olmayan prenatal tanıda
kullanımı için çalışmalar devam etmiştir. Bunun yanında fetal hücrelerin maternal
kanda çok az sayıda bulunması, onların sağlıklı bir şekilde saptanmasına engel
olmuştur20. Amerika’da İnsan Gelişimi ve Çocuk Sağlığı Ulusal Enstitüsü tarafından
desteklenen 10 yıl süren (1994-2003) çok merkezli bir çalışma ile maternal kanda erkek
fetal hücrelerin % 41 gebede saptanabildiği ve bunun yanlış pozitif oranının % 11
olduğu sonucuna varılmıştır21. Girişimsel olmayan prenatal tanı için yeni gelişmeler,
1997’de serbest fetal DNA’nın tanımlanması ile ortaya çıkmıştır22. Bu fetal DNA’nın %
10’luk kısmının da maternal plazmadaki total DNA olduğu tahmin edilmektedir4,7,23.
Maternal plazma ve serumda serbest haldeki fetal DNA’nın bulunmasının ardından bu
alanda yeni çalışmalar ortaya çıkmış ve pek çok uygulama hızla takip edilip bir kısmı
klinik kullanıma sokulmuştur4,24.
2.3. Klinik Tanıda Günümüzde Kullanılan Prenatal Tanı Yöntemleri
Günümüzde bilinen birçok talasemi mutasyonu ve anormal hemoglobin
varyantları gibi tek gen bozuklukları PCR’ye dayalı teknikler ile belirlenebilmektedir.
Taşıyıcı çiftlerde mutasyon belirlenmesinde kullanılan yöntemler, geleneksel olarak
doğrudan ve dolaylı olmak üzere iki gruba ayrılmaktadır. Doğrudan mutasyon
yöntemleri, popülasyon grubunda var olduğu bilinen adaya özgül mutasyonların,
varlığı/yokluğunu sorgulamak üzere tasarlanmaktadır. Bu yöntemler alele özgü
oligonükleotit prob hibridizasyonu (ASO) ve nokta mutasyonlar için Amplifikasyona
Dayanıklı Mutasyon Sistemi (ARMS) ve özgül delesyonlar için multipleks PCR olarak
sayılabilir. Dolaylı yöntemler gen bölgelerini tarayarak, her bölge için dizi değişimlerini
tanımlar. Bu yöntemler içinde Termal Gradiyent Kapiller Elektroforez (TGCE),
Denatüre Gradiyent Jel Elektroforezi (DGGE) ve Denatüre Edici Yüksek Preformans
Sıvı Kromatografisi (dHPLC) sayılabilir3.
10
2.3.1. Doğrudan Mutasyon Saptama Yöntemleri
2.3.1.1. “Allele Specific Oligonucleotide” Yöntemi
ASO hibridizasyon yöntemi, özellikle beta genlerindeki nokta mutasyonlarını
saptamak için PCR’ye dayalı yöntemler içerisinde ilkini oluşturmaktadır. Her mutasyon
için iki oligonükleotit probu kullanılmaktadır. Bunlardan birisi normal diziyle
eşleşmekte ve diğeri de mutasyonla eşleşmektedir. Bu yöntem, “dot-blot” veya “reverse
dot-blot” hibridizasyon ile heterozigotu, homozigottan ve normalden ayırt etmektedir.
“Reverse dot-blot” hibridizasyonu, prenatal tanıda özellikle sınırlı sayıda yaygın
mutasyon taşıyan toplumlarda başarıyla kullanılmıştır (Şekil 6-A)25. Bunun yanı sıra,
ASO’nun prensibini kullanan, çeşitli yeni gelişen mikro-array teknolojileri de mevcut
bulunmaktadır3.
2.3.1.2. “Amplification Refractory Mutation System” Yöntemi
Bilinen mutasyonların saptanmasında kullanılan ARMS yöntemi, ilk kez Newton
ve ark tarafından ortaya konmuştur. Bu yöntem yaygın gözlenen beta talasemi
mutasyonlarının tanısı için geliştirilmiştir26. Hedef mutasyona eşleşen bir primer ile
ortak bir PCR primeri kullanılmaktadır. Aynı tepkimede normal diziye özgü eşleşebilen
bir primer kullanılmakta ve mutasyon varsa, mutasyona özgü primer diziyi çoğaltmakta,
yoksa normal dizi amplifiye olmaktadır (Şekil 6-B)25. ARMS için pek çok primer
tasarlanmış olup, bu yöntem hızlı ve tek aşamalı bir yöntemdir. PCR sonrası agaroz jel
elektroforezi uygulanır. Dezavantajı, her primer seti için ayrı optimizasyon ve
standardizasyon gerekli olmasıdır. Yanlış negatif ve yanlış pozitif sonuçlara, iyi
optimizasyon yapılmazsa rastlanabilmektedir. Prenatal tanı yapılacak çiftlerin
mutasyonları biliniyorsa, ARMS yöntemi mutasyonları göstermek için uygun
olmaktadır. Çiftlerin mutasyonları bilinmiyorsa, geniş mutasyon spektrumu olan
toplumlarda, gebelik süresince mutasyon tanımlanması için ARMS uygun bir yöntem
değildir3.
11
2.3.1.3. “Multiplex PCR” Yöntemi
DNA’nın sens ve antisens ipliğine eşleşen iki primer kullanarak yapılan PCR ile
delesyonlar saptanabilmektedir. Bir kilobazdan küçük delesyonlar için primer çifti iki
ürün oluşturmaktadır. Küçük olan parça delesyon alelinden meydana gelmektedir.
Büyük delesyonlar için iki primer arasındaki uzaklık, normal aleli amplifiye etmek için
çok uzundur ve ürün sadece delesyon alelinden oluşmaktadır. Bu olgularda normal alel
delesyonel diziye eşleşen primer kullanılarak amplifiye edilmektedir26. Delesyonları
saptamada kırılma noktasının yeri biliniyorsa multipleks PCR kullanılmaktadır. 5′ ve 3′
kırılma bölgeleriyle eşleşebilen primerler, delesyon varlığında delesyonu içeren özgül
bir parça şeklinde amplifiye ederler (Şekil 6-C)25. En sık rastlanan alfa ve beta globin
gen kümesi delesyonları için tek basamaklı çoklu PCR protokolü, zahmetli ve zaman
alıcı (genelde radyoaktif) “Southern blot” yöntemi yerine kullanılmaktadır. Prenatal tanı
için alfa ve beta gen kümelerinde görülen en yaygın delesyonların saptanmasında,
multipleks PCR kullanışlı bir yöntemdir. Beta talasemiye neden olan delesyonlar, Hb
Lepore, delta-beta talasemiler ve gama-delta-beta talasemiler veya herediter persistan
fetal hemoglobin belirlenmesinde bu PCR yöntemi kullanılmaktadır. Bununla beraber
multipleks PCR ile bulunan sonuçların diğer bir seçenek yöntemle (MLPA veya
QMPSF gibi) doğrulanması önerilmektedir3.
A
B
C
Şekil 6. Doğrudan mutasyon saptama yöntemleri25.
(A) Alele özgü oligonükleotit hibridizasyonu (ASO),
(B) Amplifikasyona dayanıklı mutasyon sistemi (ARMS),
(C) Multipleks PCR.
12
2.3.2. Dolaylı Mutasyon Saptama Yöntemleri
2.3.2.1. Heterodubleks Analizler
Kapiller elektroforez ile kullanılan ilk mutasyon saptama yöntemlerinden birisi
olan heterodubleks analizler, diploid DNA’da dizi değişimlerini taramak için popüler
bir tekniktir27,28. Poliakrilamit jel kullanan basit mutasyon saptama yöntemleri arasında
en çok kullanılan heterodubleks analizlerdir28. Yöntem, çift iplik DNA’nın yüksek ısı ile
erime ısısında tekrar bir araya gelmek üzere tek ipliklerine ayrılması esasına
dayanmaktadır. DNA iplikleri tekrar bir araya gelme esnasında, heterozigot olgularda 2
farklı alel birleşirken heterodubleks yapı oluşmaktadır. Heterodubleks, homodubleksten
farklı bir 3 boyutlu yapı meydana getirmektedir (Şekil 7)29. Bu durum da örneğin
denatüre olmayan jelde hareketini değiştirmektedir30. PCR sonrası heterodubleksler,
geleneksel jel elektroforezi, dHPLC ve TGCE gibi ayırma teknikleri ile analiz
edilmektedirler31.
Şekil 7. Heterodubleks oluşumu29.
13
2.3.2.2. “Thermal Gradient Capillary Electrophoresis” Yöntemi
Kapiller Jel Elektroforezi, moleküllerin uzun bir jel üzerinde tek hat boyunca
ayrıştırılması temeline dayanır. 1980’lerin başında kapiller elektroforez, çeşitli
moleküllerin ayrımında kullanılmaya başlanmıştır. Örneğe bağlı olarak pek çok ayrım
yöntemi geliştirilmiştir32. TGCE, göreceli yeni bir mutasyon tarama tekniği olup
denatürasyon etkisini ve kapiller elektroforezin yüksek çözünürlük kapasitesinden
yararlanarak, gen dizisinin yabanıl tip ve mutant tipi arasında oluşan heterodubleksleri
saptamaktadır33.
TGCE’de kullanılan sıcaklık gradiyenti kapiller boyunca değişmez, fakat zamana
göre değişim gösterir. Sıcaklık gradiyenti ile çift sarmal DNA, heterodubleks ve
homodubleks parçalara ayrılır. Kapiller sonunda program yazılımı ile sonuçlar
bilgisayar ekranına aktarılır34.
2.3.2.3. “Denaturating Gradient Gel Electrophoresis” Yöntemi
İlk kez 1987 yılında Myers28 tarafından tanımlanan yöntem, birkaç yüz baz çifte
kadar olan DNA moleküllerinin ayrışması ve belirlenmesine olanak vermektedir.
DGGE’nin prensibinde, denatüre olan DNA molekülü, jelde doğal 3 boyutlu yapısına
göre daha yavaş göç etme esasına dayanmaktadır35. Elektroforetik ayrım çift sarmal
DNA molekülünün erime özelliklerine göre artan ısı ya da poliakrilamit jeldeki denatüre
ajanın artan gradiyent koşullarına bağlı olarak değişmektedir3 (Şekil 8)28. PCR
primerlerinden birinin 5′ ucunda GC-kıskacı kullanımı ile DNA parçalarında oluşan
yüksek ve düşük erime noktaları tespit edilebilmektedir28, 35.
Şekil 8. DGGE yöntemi28.
14
2.3.2.4. “Denaturating High Performance Liquid Chromatogaphy” Yöntemi
dHPLC, mutasyon tarama yöntemleri içerisinde kapiller elektroforeze seçenek
oluşturan en çok tercih edilen teknolojilerden birisidir36. Bilinen bilinmeyen
mutasyonların tespitinde kullanılan bu yöntem, tek baz değişimlerini, küçük
insersiyonları
ve
delesyonları
yüksek
özgüllük
ve
duyarlılıkla
saptamada
kullanılmaktadır37 (Şekil 9)36. Genlerin ya da gen bölgelerinin hızlı, güvenilir ve ucuz
bir şekilde taranmasına olanak sağlar. Yüksek hassasiyeti, jel bazlı veya kapiler
elektroforez bazlı sistemlerin yakalayamadığı mutasyonları ya da sekans sistemlerinin
tespit edemediği somatik mutasyonları tespit edebilir. Sekanslama işlemi öncesi dHPLC
sistemiyle yapılan ön mutasyon taraması, maliyet ve zamandan ciddi ölçüde tasarruf
edilmesine olanak sağladığından dHPLC’nin dünya çapında ideal bir “sekans öncesi
tarama’’ olarak kabul görmesini sağlamıştır37.
Şekil 9. dHPLC şematik gösterimi36.
2.3.2.5.
“Capillary
Electrophoresis-Single
Strand
Conformational
Polymorphism” Yöntemi
CE-SSCP; 1,2 kilobaza kadar olan PCR parçalarında nokta mutasyon tespitinde
yüksek duyarlılıkta başarıyla kullanılmaktadır28. Yöntemde, çift sarmal PCR ürünü ısı
15
ve kimyasal ajan yardımıyla ayrıştırılır ve tek iplik DNA’lar dizilerine bağlı olarak şekil
alırlar. Katlanan DNA parçaları denatüre olmayan poliakrilamit jel elektroforezinde üç
boyutlu düzenlenmelerine göre ayrılırlar (Şekil 10)28. Tek iplik DNA parçalarının iki ve
üç boyutlu yapılar oluşturması, ısıya bağlıdır ve elektroforez esnasında jelin ısısındaki
herhangi bir değişim, geleneksel SSCP’de yanlış pozitif veya yanlış negatif sonuçlara
neden olabilmektedir. Fakat CE-SSCP’de kullanılan ayırıcı matriksin hacminin
nanolitre düzeyinde olması ısı kontrolünde çok etkili olmaktadır. Otomatize edilmiş
sistemlerde her örneğin çeşitli ısı aralıklarında programlanarak analiz edilmesi mümkün
olmaktadır. SSCP’nin kapiller elektroforeze uygulanmasında kullanılan jel kimyasal
madde içermekte, UV absorbsiyon veya lazerle uyarılmış floresan ile tespit
yapılmaktadır28.
Şekil 10. CE-SSCP yöntemi28.
2.3.3. Gelişmekte Olan Yöntemler
2.3.3.1. “Real Time PCR” Yöntemi
RT-PCR, floresan tekniklerinin kullanıma girmesiyle bir devrim yaşamıştır.
Bilinen PCR teknolojisinin geliştirilmiş bir biçimidir. Bu yöntem sayesinde artık gen
kopya ürünlerinin düzeylerini sayısal değerlere dönüştürerek ölçmek mümkün
olmaktadır. RT-PCR’de tepkime “eş zamanlı” olarak ekranda izlenebilmektedir38.
RT-PCR “TaqMan probe” yöntemi, çoğaltılmak istenilen DNA’ya komplementer
olan ve floresan işaretlenmiş tek zincirli bir prob içerir. Floresan işaretli probun 5'
16
ucunda “fluorophore” (6-karboksifloresin= 6-FAM) ve 3′ ucunda “quencher” (6karboksitetrametil-rodamin= TAMRA) bulunur. 3′ uçtaki basılayıcı TAMRA boyası, 5'
uçtaki FAM boyasının sinyal oluşturmasını engellemektedir. Çoğaltılma sırasında hedef
nükleik asit dizisi üzerinde primerlerin bağlanma bölgeleri arasında “Taq Man” problar
bağlanır ve primerlerin bağlanmasıyla yeni zincir oluşmaya başlar. Probun bağlı olduğu
bölgeye gelindiğinde Taq DNA polimeraz enzimi 5'→3′ nükleaz aktivitesi ile FAM’ı
probdan ayırır. Serbest hale geçen FAM sinyal oluşturur39 (Şekil 11)40.
Şekil 11. TaqMan RT-PCR yöntemi40.
Hemoglobinlerde görülen yaygın beta globin mutasyonlarının farklı problar
kullanılarak, tek tepkime tüpü içerisinde saptanabilmektedir. RT-PCR rutinde kullanılan
Yüksek Performans Sıvı Kromatografisi (HPLC) ve İzoelektrik fokuslama (İEF)
yöntemlerine seçenek oluşturan bir uygulamadır41.
2.3.3.2. “High Resolution Melting” Yöntemi (HRM Analizi)
DNA’nın HRM analizi 2002’de üniversite ve endüstrinin işbirliği ile ortaya
konmuştur. DGGE prensibine benzer olan bu yöntemde PCR ürününün erime özelliği,
GC içeriğine, uzunluk ve dizi bileşimine bağlı olmaktadır. Erime özelliğindeki
değişiklik, mutasyon varlığında ve heterodubleksler oluştuğunda meydana gelmektedir.
Isının artması, çift sarmal DNA’yı tek sarmal DNA’ya dönüştürmekte ve floresanın
azalması, çift sarmal kalıp DNA’nın erime ısısına bağlı olmaktadır. LC Green gibi
17
kullanılan yeni kuşak boyar maddelerin geliştirilmesiyle yönteme yüksek özgüllük,
yüksek çözünürlük ve erime özelliği katmıştır3.
HRM analizi için öncelikle ilgilenilen mutasyon bölgesini kapsayan kısmın RTPCR ile amplifikasyonu yapılır. HRM sürecinde amplikon DNA ısısı yaklaşık 50°C’den
başlayarak 95°C’ye kadar yükselir. Bu süre içerisinde amplikonun erime sıcaklığında
DNA iki ipliği birbirinden ayrılır (Şekil 12)42. Çift iplik DNA, yapısal özelliği ve erime
sıcaklığındaki (Tm) değişimlerine göre floresan boyalar yardımıyla tanımlanır43.
Şekil 12. HRM analizi42.
2.3.3.3. “Multiple Ligand Prob Amplification” Yöntemi
MLPA, delesyon ve duplikasyonların sık olarak gözlendiği genetik hastalıkların
tanısında kullanılabilen yeni, basit ve hızlı bir yöntemdir44. En fazla 45 değişik DNA
dizisinin PCR tabanlı tek bir tepkime yardımı ile incelenmesidir. Bunun için sadece 20
ng DNA kullanmak yeterlidir. MPLA nükleik asit primerleri yerine prob içerir. Problar
hedef dizi ile hibridize olduktan sonra ligasyon tepkimesi gerçekleşir, örnekteki hedef
dizinin bir kopyası oluşturulur. Ligasyonlu problar multipleks PCR yöntemi ile
çoğaltılır. MPLA yönteminde tüm özgül diziler eş zamanlı olarak amplifiye edilir (Şekil
13)45. Ürünler dizileme tipi elektroforez cihazında analiz edilirler46. Son dönemlerde
kullanılmaya başlanan MLPA, hedef bölgede yer alan genomik varyantların kopya
sayısını tespit ederek, “Southern Blot”, FISH veya multipleks PCR’ye yardımcı değişik
seçeneksel bir yöntem olarak, bilinen ve bilinmeyen delesyonların saptanmasında
18
kullanılmaktadır. MLPA’da, çoklu prob çiftlerinin ilgilenilen bölgenin karşısına
hibridize olması sonrasında, evrensel-etiketli PCR primerleri kullanarak tüm bağlanan
prob çiftleri niceleyici PCR ile amplifiye olmaktadır. Sonuçta PCR ürünlerinin parça
analizi yapılmaktadır. MLPA günümüzde artan sayıda tanı laboratuarlarında
kullanılmaktadır3.
Şekil 13. MLPA yöntemi45.
2.3.3.4. “Quantitative Multiplex PCR of Short Flourescent Fragments”
Yöntemi
Çoklu PCR temeline dayalı yarı niceleyici bir yöntem olan QMPSF, Charbonnier
ve ark.3 tarafından herediter kolorektal kanser sendromundaki duplikasyonları ve
delesyonları saptamak için geliştirilmiştir. Boya ile işaretli primer kullanılarak, kısa
ekzon parçaların (300 bç’den az) sınırlı döngü sayısındaki amplifikasyonu, farklı
örnekler arasında üssel fazda DNA kantitasyonuna izin vermektedir. Bunun yanında 5′
uçta özgül etiketlerin kullanımı, fragmanlar arasındaki amplifikasyondaki farklılıkları
19
azaltmaktadır. QMPSF, hızlı, göreceli olarak ucuz ve 15-20 hedef içeren kopya sayısı
değişimlerini saptayabilen tek basamaklı otomatize bir yöntemdir3.
2.3.3.5. “Arrayed Primer Extension” Yöntemi
Diğer bir girişimsel olmayan prenatal tanı yöntemi ise “arrayed primer extension
(APEX) microchip assay”dir. Bu yöntemle geniş bir aralıkta mutasyon taraması yüksek
işlem hızı ile yapılmaktadır. APEX yöntemi, 5′ ucundan cam yüzeye sabitlenmiş ve 3′
ucu enzimatik uzama için serbest olan 20-25 bç uzunluğunda oligonükleotitler
kullanılarak iki boyutlu mikroçip üzerinde gerçekleştirilmektedir. Tek nükleotit
tepkimesi olan bu yöntem, bilinen mutasyonların belirlenmesi için kullanılmaktadır.
Problar mutasyon bölgesinin başlama yerinden sadece bir nükleotit öncesinde
sonlanırlar. Hibridize olmuş tek iplik PCR hedef dizisinin varlığında probun 3′ ucunun
tek nükleotit uzaması, hedef DNA’nın bir sonraki bazıyla eşleşebilen floresan işaretli
tek dideoksinükleotitlerin (ddNTP) eklenmesini kolaylaştırmaktadır. Bu da mutant ve
normal alellerin ayrımını sağlamaktadır. Her mutasyon için çip üzerine iki
oligonükleotit prob sabitlenmektedir. Yapılan bir çalışmada, beta lokusunda 11 SNP
bölgesinin haplotip analizi bu yöntemle bakılmıştır. Çalışılan çiftler aynı tip beta
talasemi mutasyonuna sahip olup, babadan kalıtılan mutant alelin yanı sıra nornal alelin
varlığı da yedi maternal plazma örneğinin altısında tespit edilmiştir47.
2.3.3.6. “PNA Nucleic Acid Clamp” Yöntemi
Günümüze kadar yapılan çeşitli çalışmalardan birisi peptit nükleik asit kıskacı
(peptide nucleic acid clamp-PNA) deneyidir. Beta talasemide yapılan bir çalışmada
normal maternal alelin amplifikasyonu baskılanması için nükleik asit kıskaçları
kullanılmış ve mutant amplifikasyonu artıracak bir optimizasyon yapılmıştır48.
2.3.3.7. “MALDI-TOF” Kütle Spektrometresi
Son dönemlerde “MALDI-TOF MS” yüksek üretim teknolojisi kullanılarak
nükleik asitlerin analizi niteleyici ve niceleyici olarak yapılabilmektedir. Gebelerin
dolaşımındaki fetal DNA ve bunun yanında kanser hastalarındaki tümör DNA ve
20
RNA’ların analizinde kullanışlı bir teknoloji olarak kabul edilmektedir. Bu sistemle
nükleik asitlerin moleküler ağrılıkları doğrudan ve doğru bir şekilde ölçülebilmektedir.
Son dönemlerde bu yöntem Trizomi 21 gibi anöploidilerde SNP’lerin analizleri ile
karyotiplemeye seçenek bir teknik olarak kabul edilmektedir49.
2.4. Maternal Dolaşımdaki Serbest Nükleik Asitler
Dolaşımdaki DNA’nın varlığı artık bilinen bir durum olmasına rağmen, moleküler
ve biyolojik yönü halen araştırmaların erken safhalarında bulunmaktadır. Araştırmalar,
dolaşımdaki nükleik asitlerin doğasıyla ilgili pek çok temel soruların cevabının
bulunması için önemlidir.
2.4.1. Maternal Plazmadaki Serbest Fetal DNA Kaynağı
Serbest fetal DNA’nın maternal plazmadaki sürpriz keşfinden sonra, bu DNA
hakkında pek çok bilgi edinilmiştir22. Serbest fetal DNA’nın dolaşıma verilmesinin
kaynakları hakkında çeşitli düşünceler mevcuttur. Plasenta, fetal hematopoetik hücreler
ve fetüsün kendisi plazmadaki fetal DNA’nın kaynakları olarak düşünülmektedir20.
Maternal dolaşımdaki en baskın fetal DNA kaynağının plasenta olduğu pek çok
araştırmacı tarafından kabul edilmektedir. Konsepsiyon sonrası 28-30 günden önce fetomaternal dolaşımın belirlenememesi, fetal DNA’nın trofoblastlardan köken aldığını
düşündürmektedir. Serbest fetal DNA’nın plasentadan köken aldığı yapılan çalışmalarla
gösterilmiştir50. Serbest fetal DNA’nın plasentada çok fazla miktarda bulunmasının
yanında, tek kaynağın plasenta olmadığı düşünülmektedir. Fetal hematopoetik hücreler
de fetal DNA havuzuna bir miktar katkı sağlamaktadır. Fetal eritroit hücrelerin
gebelerin plasmasında bulunduğu gösterilmiştir51-53. Fetal eritroit hücrelerin maternal
dolaşımdaki varlığı, az olsa bile maternal plazmaya serbest fetal DNA verme
potansiyelinin bir göstergesi olduğu öne sürülmektedir54.
2.4.2. Fetal DNA Serbestleşme Mekanizmaları
Serbest fetal DNA’nın dolaşıma verilmesi ile ilişkili mekanizmalar nekroz,
ve/veya fetal/plasental hücrelerin apopitozu, fetal DNA’nın aktif sekresyonu veya
terminal farklılaşması olarak bildirilmektedir55. Bu üçlü içerisinde apopitoz, en olası
aday olarak görülmektedir. Apopitoz, genomik DNA’nın parçalara ayrılması ile
karakterize edilmektedir. Bu rasgele gerçekleşen bir süreç değildir ve DNA’nın çeşitli
21
boyutlarda parçalara ayrılması ile sonuçlanmaktadır. Çeşitli yöntemlerle maternal
dolaşımdaki sağlam fetal hücrelerin aktif apopitoza gittikleri gösterilmiştir56,57.
Fetal DNA’nın apopitoz yolu ile plasentadan köken aldığının başka bir kanıtı da
oksidatif stressin trofoblastik doku üzerine etkilerini gösteren bir in vitro model
çalışmasıdır. Tjoa ve ark.58 yaptıkları çalışmada hipoksi-reoksijenasyon durumunda
dokuda serbest total DNA miktarının arttığını gözlemişlerdir. Bu durum Kaspaz-3’ün
artan aktivasyonu ile hücre apopitozunun artışı sonucu ortaya çıkmıştır. Hücreden
serbest fetal DNA’nın ortama verilmesi ve apopitozun azalması, ortama antioksidan
vitaminlerin konulması ile gözlenmiştir. Fetal DNA’nın büyük çoğunluğunun apopitotik
cisimcikler olarak bilinen membrana bağlı veziküllerde dolaşımda olduğuna
inanılmaktadır. Fetal DNA’ların maternal dolaşımda bu durumda kısa süreli kararlı
olarak bulunduğu açıklanmıştır54,55.
2.4.3. Maternal Plazmadaki Fetal DNA’nın Zenginleştirilmesi ve Saptanması
Serbest fetal DNA’nın doğru ölçümü, maternal örneklerin ilk toplama işleminden
başlayarak, en son ölçüm basamağına kadar pek çok etmenlere dayanmaktadır. Bu
etmenlerden birisi kanın alındığı tüpün içeriği, bekleme süresi ve zenginleştirme
işlemidir.
Fetal DNA’nın zenginleştirme işlemi 2 temel biçimde yapılabilmektedir; birisi
serbest fetal DNA’nın zenginleştirilmesi, ikincisi de maternal kandaki fetal hücrelerin
zenginleştirilmesidir. Fetal DNA’nın zenginleştirme işleminde boyut fraksiyonlama
yöntemi kullanılmaktadır. Bu yöntemle maternal kontaminasyonu önlemek ve maternal
plazmadaki fetal DNA miktarını artırmak amaçlanmaktadır. Uygulanan boyut
fraksiyonlama işlemi ile 500 bç’den büyük boyutlarda bulunan serbest maternal DNA,
ortamdan uzaklaştırılmaktadır. Böylece 300 bç’den küçük boyutlardaki serbest fetal
DNA, ortamda fazla bulunmaktadır. Bu yöntemle gebeliğin ilk evrelerinden (4. hafta)
itibaren, dolaşımdaki serbest fetal DNA derişimlerinin zenginleştirilmesi, paternal gen
mutasyonlarının tanımlanmasındaki duyarlılığı arttırdığı gösterilmiştir6.
Yüz bin anneye ait hücre (1 mL kan) başına, en fazla fetüse ait 1 hücre düştüğünü
kabul eden fikir birliği göz önüne alındığında; fetüse ait kromozom anomalilerinin
22
tespitine yönelik FISH analizi yapabilmek için kaçınılmaz olarak, birtakım hücresel
zenginleştirme yöntemlerine ihtiyaç duyulmaktadır. Zenginleştirmenin altında yatan
genel strateji, sadece fetüse ait hücreleri içeren saf bir örnek elde etmekten çok,
çoğunluğunu
fetüse
ait
hücrelerin
oluşturduğu
bir
örnek
elde
etmektir.
Zenginleştirmeden sonra dahi çoğu hücreler anne kaynaklıdır. Ancak % 0,1’lik fetüse
ait hücre sıklığı bile, kromozom özgül problarla yapılan FISH yöntemiyle fetüse ait
anöploidilerin etkin analizine izin vermektedir59.
Zenginleştirme, genellikle ilk olarak yoğunluk farkı (dansite gradiyenti) ya da
protein ayırma teknikleriyle yapılır. Bazı gruplar, sadece tekli fikol dansite gradiyenti
ile nispeten basit zenginleştirmeden sonra fetüse ait tanının mümkün olduğunu
savunurken; diğer grupların çoğu, daha ileri zenginleştirme yöntemlerinin gerekli
olduğuna inanmaktadırlar. Başlangıç yaklaşımı olarak flow sitometri ya da Manyetik
etkinlikli Hücre Ayrıştırma Yöntemi (MACS) kullanılabilir. Her iki teknik de pozitif
ayıklama ya da negatif ayıklama kapasitesine sahiptirler. Flow sitometrinin birçok
çalışmada faydası ispatlanmıştır, fakat bu teknoloji MACS’ye göre daha pahalıdır ve
kullanımı daha zordur. MACS’nin seçeneksel bir kullanımında ise 50 nm’lik manyetik
bilyeler ile birleştirilmiş antikorlar, zenginleştirilmek istenen hücrelere doğru yöneltilir.
Çözeltideki hücreler bu manyetik alandaki bilyeler tarafından alıkonur (pozitif
ayıklama). Sorgulanan antijenden yoksun olan hücreler ise bilyelere bağlanmazlar;
manyetik alanda tutulmazlar ve engelsiz geçip atılırlar. Manyetik alanın serbest
bırakılmasından sonra bilyelere bağlı hücreler, artık bir sonraki analiz için toplanabilir.
Ayrıca bunun tersi de yapılabilir; istenen hücrelerin serbest geçişine izin verilip,
istenmeyen hücrelerin manyetik alanda tutulması sağlanabilir. MACS’nin avantajı,
Floresan Etkinlikli Hücre Ayrıştırma Yöntemi (FACS) ile karşılaştırıldığında daha ucuz
olması ve kullanımının kolaylığıdır. Bahsedildiği gibi, MACS fetüse ve anneye ait
hücreler arasındaki fiziksel farklılık temeline dayanır. Diğer bir zenginleştirme
yaklaşımı ise MACS ile birlikte yapılan zıt akım teknolojisidir (yüklü akımla ayrıştırma
tekniği).
Bununla
birlikte,
en
uygun
belirlenememiştir59.
23
zenginleştirme
yaklaşımı
henüz
2.4.4. Fetal DNA’nın Saptanmasında Seçeneksel Yöntemler
Bugüne kadar yapılan pek çok dolaşımdaki fetal DNA çalışmalarında fetal
belirleyici olarak Y-komozomuna özgü diziler kullanılmıştır. Klinik deneylerin geneline
uygulanabilmesi için cinsiyet fenotipte değişim oluşturmaktadır60. Fetüs veya plasenta
ve annenin DNA metilasyonu farklılıklarını tanımlayarak, maternal plazmada hem
maternal hem de paternal fetal aleller tespit edilebilmektedir. Bu teknikle kalıtılan farklı
paternal ve maternal metilasyona sahip lokuslara bakılmaktadır61.
Maternal plazmadaki ilk fetal DNA belirteci olarak kromozom 18 üzerinde
bulunan maspin geni tanımlanmıştır62. Maspin, maternal lökositlerde metilenmiş ama
plazmada hipometilasyona uğramıştır. Bu çalışmada maternal kanda saptanan
hipometilasyona uğramış plasental maspin geni, üç aylık dönemlerdeki cinsiyeti
belirleyen bölge dizisi (SRY) derişimleriyle orantılı bulunmuştur. Yapılan tekli
nükleotit polimorfizmi (SNP) çalışmalarıyla hipometillenmiş maspin geni kaynağının
plasenta olduğu kanıtlanmıştır. Diğer gen dizilerinde de anne ve bebek arasındaki
epigenetik düzenlenmelerin farklılığına bakılabileceği düşünülmektedir.
Girişimsel olmayan fetal DNA tanımlanmasında diğer bir seçeneksel yöntem de
tekli alel baz uzama tepkimesi (SABER) ve bunu takip eden kütle spektrometresidir
(MS). Bu yöntemle maternal serumdaki babadan fetüse kalıtılan alellerdeki tek nokta
mutasyonları saptanabilmektedir63. Teorik olarak bu şekilde bir teknik, anneyi fetüsten
ayıran tek bir nokta mutasyonuna da genetik bozukluklara da geniş bir spektrumda
bakabilmektedir54.
2.4.5. Maternal Plazmadan Fetal DNA’nın Temizlenmesi
Doğumdan hemen sonra sağlıklı gebelerde maternal plazmadaki serbest fetal
DNA’nın temizlenmesinin çok hızlı gerçekleştiği, hatta fetal hücrelerin plazmadan
temizlenmesinden daha hızlı olduğu yarı ömrünün 17 dakika. (aralık 4-30 dakika.)
olduğu gösterilmiştir64-66. Yapılan çalışmada, pek çok kadında doğumdan sonraki iki
saat içinde dolaşımdaki fetal DNA saptanamamaktadır. Dolaşımdaki, fetal DNA’nın
temizlenmesinde rol alan potansiyel mekanizmalar arasında plazma nükleazı, hepatik
24
temizlenme, renal temizlenme ve maternal hücrelerle etkileşim sonucunda fetal
DNA’nın degrade olması yer almaktadır.
Fetal DNA’nın maternal plazmadan temizlenmesinde plazma nükleazının rolü
üzerine yapılan çalışmada, maternal kan örneklerine 37ºC’de 2 saat süreyle plazma
nükleazı ile işlem yapılmıştır. Sonuçlara bakıldığında üç örneğin plazma fetal DNA
derişim değerleri başlangıç değerlerinden % 90’dan büyük bulunmuştur. Yedi örneğin
inkübasyondan önceki değerlerinin % 31-74 derişimlerde olduğunu belirtmişlerdir. Bu
veriler, bize plazma nükleazının dolaşımdaki fetal DNA’nın uzaklaştırılmasında kısmen
bir rol aldığını göstermektedir. Bunun yanında bu çalışma in vitro bir çalışma olduğu
için, in vivo durumu açıklayamamaktadır66.
Dolaşımdaki fetal DNA’nın temizlenmesinde diğer bir olası mekanizma da
karaciğer tarafından dolaşımdaki fetal DNA’nın temizlenmesidir67. Karaciğerin
temizleme işlevini açıklayan diğer bir çalışmada da Gauthier ve ark.68 farelerde
mononükleozomların dolaşımdan temizlenmesini çalışmışlar ve dolaşımdan temizlenen
% 71,0-84,7 nükleozomun karaciğerde konumlandığını göstermişlerdir.
Diğer bir seçeneksel temizleme mekanizmasının da, dolaşımdaki serbest fetal
DNA’yı yabancı bir cisim olarak algılayan ve ortadan kaldıran dalak ve maternal
dolaşımdaki lenfositler gibi maternal kaynaklı immünolojik sistemler olduğu
düşünülmektedir6.
2.5. Anne Kanında Fetüse Ait Hücreler
Çeşitli dokulardan kaynaklanan fetüse ait hücreler, çoğunlukla plasentanın
intervillöz boşluğunda görülmekte ve embriyon/fetüse ait hücreler anne kanına
geçmektedir. Fetüse ait kan hücrelerinin anne dolaşımına geçişinin fetüsten anneye
kanama sonucunda olduğu düşünülmektedir. Ancak bunun mekanizması henüz
açıklanmamıştır. Bu kanamaların plasentanın normal gelişiminin bir parçası mı ya da
travmadan kaynaklanan bir olay mı olduğu bilinmemektedir59.
Gebelik esnasında, maternal dolaşımda var oldukları gösterilen fetüse ait hücreleri
kullanarak girişimsel olmayan doğum öncesi tanı yürütülmek isteniyorsa bu hücrelerin
zenginleştirilmesi, tanısı ve analizi mutlaka gereklidir. Kromozom kaynaklı ve
Mendelian anomalilerin tanısı için fetüse ait çekirdekli hücreler elde edilip, kromozom
25
özgül problar kullanılarak FISH yöntemiyle interfaz hücre analizi yapılabilmektedir.
Tanıya yönelik yeterli sayıda hücre elde etmek için özgül bir hücre tipi hedeflenip az
miktardaki fetüse ait hücrenin zenginleştirilmesi sağlanmalıdır.
Çalışılmış ve halen çalışılmakta olan hücre tipleri arasında trofoblastlar, beyaz
kan hücreleri (lenfoblastlar, granülositler), eritroblastlar, hematopoetik kök hücreler yer
almaktadır. Anne kanındaki fetüse ait hücrelerin rutin doğum öncesi genetik tanıda
kullanılabilmesi için bazı ölçütler sağlamalıdır. Bunlar; tüm gebe kadınların kanında
gebeliğin erken dönemlerinde, yeterli miktarda bulunmaları, bir sonraki gebelikte anne
kanındaki
varlıklarını
devam
ettirmemeleri,
maternal
hücrelerden
ayrımlarını
sağlayacak kendilerine özgül belirteçleri olmasıdır24,59.
2.5.1. Maternal Dolaşımda Fetüse Ait Hücrelerin Sıklığı
Fetüse ait hücrelerin annenin periferik kanındaki sıklığı hakkında farklı veriler
vardır. Literatürde geniş bir aralık rapor edilmiştir; bu aralık 5000’de 1 çekirdekli
hücreden 108’de 1’e kadar uzanır. Bu sıklığı etkileyebilen faktörler şunları içerir: Analiz
edilen hücre tipi, kan örneğinin alındığı gebelik yaşı ve fetüse ait hücre topluluğunu
zenginleştirme, tanıma ve rakamlarla belirtmede kullanılan yöntemlerin doğruluğudur.
Anne kanındaki fetüse ait hücre sayısının arttığı bildirilen durumlar; gebeliğin
ilerlemesi, toksemi, düşük, sezaryen, amniyosentez, fetüs ve plasenta karyotipinin
anormal olduğu gebelikleri içerir. Anne kanında nispeten az miktarda fetüse ait hücre
bulunmaktadır. En sık tespit edilen değer, anne kanının mililitresine 1 hücre düştüğü
yönündedir. Fetüse ait çekirdekli hücrelerin anne kaynaklı hücrelere oranının tespiti,
öncelikli olarak PCR ya da FISH kullanılarak Y kromozomu için DNA analizine
dayanmaktadır.
Fetüse
ait
hücrelerin
anne
hücrelerine
oranı,
1/50.000’den
1/10.000.000’a uzanmaktadır. Kesin bir sayı henüz belirlenmemiş olsa da çoğu
araştırmacı yaklaşık 100.000 anne hücresi başına 1 fetüs hücresi düştüğü fikrine
katılmaktadır. Birçok araştırmacı kimyasal temele dayanan veya cinsiyet belirleyici
özgül dizileri içeren çeşitli floresan teknikler kullanarak fetüse ait çekirdekli hücrelerin
annenin çekirdekli hücrelerine oranlarını hesaplamışlardır. Bir grup araştırmacı
ölçümsel PCR kullanarak 16 mL anne kanı örneğinin 19 fetüse ait DNA zinciri
içerdiğini öne sürmüşlerdir59.
26
2.6. Klinik Tanıda Fetal DNA’nın Kullanım Alanları
2.6.1. Fetal Cinsiyet Tayini
Prenatal fetal cinsiyet tayini, belirli bir cinsi etkileyen ciddi genetik bozukluk riski
taşıyan gebelere uygulanmaktadır. Günümüzde geleneksel girişimsel testlerden en çok
kullanılan amniyosentez ve koriyonik vilüs örneklemesinin % 0,5-1 kadar düşük riski
taşımaktadırlar5. Maternal dolaşımdaki serbest fetal DNA, girişimsel olmayan prenatal
tanı testlerinin gelişmesine yol açmış olup, fetal cinsiyet tayininde gebelik için herhangi
bir risk bulunmamaktadır69.
Erken fetal cinsiyet tayini, konjenital adrenal hiperplazi gibi çeşitli X’e bağlı geçiş
gösteren hastalıkların prenatal tanısı için önemlidir23,70-73. Dushene musküler distrofi ve
hemofili gibi diğerleri için de maternal kandan cinsiyet tayini kullanışlı ve doğru bir
yöntem olarak kabul görmektedir24. Kabul görme nedenleri arasında girişimsel
yöntemlerin risklerini taşımaması ve klinik koruyuculuğu arttırması yer almaktadır54.
Fetal cinsiyetin doğru olarak tanımlanmasında en erken gebelik yaşı, farklı
çalışmalarda değişim göstermiştir. Değişik varyasyonlar olmasına rağmen raporlar SRY
geni için RT-PCR amplifikasyonu ile fetal cinsiyetin 7. haftada % 80 doğrulukta ve 9.
haftada ise % 100 doğrulukta saptanabildiğini göstermektedir54,70,74.
Fetal DNA cinsiyet tayininde Y-kormozomuna özgül dizilerin belirlenmesi,
fetüsün erkek; bu dizilerin bulunmaması fetüsün dişi olduğu anlamına gelmektedir.
SRY, DYS14 ve DAZ gibi Y-kromozomuna özgü diziler cinsiyet tayininde yaygın
olarak kullanılmaktadır. Kuru maternal kan ile fetal Y dizilerini saptayan bir tanımlama
yöntemi de 2003’te fetal cinsiyet tayini çoklu kopya DYS14 belirteç dizisini tanıyan Ykromozom kaynaklı TSYP (Testise özgü protein Y) geni kullanılmasıdır54,69,75.
2.6.2. Fetal RhD Genotiplemesi
Yeni doğanda maternal alloimmünizasyon ve sonradan gelişen hemolitik hastalık
için anne ve bebeği arasında RhD kan uyuşmazlığı potansiyel bir problem
oluşturmaktadır. Rh (–) kan grubu beyaz ırkta % 15, siyahi Afrikalılarda % 3-5 sıklıkta,
Asya popülasyonunda ise nadir olarak gözlenmektedir24,76. Bu nedenle Rh (–) gebe
kadınlar prenatal çalışmalar için önemli bir grup oluşturmaktadır.
27
Rh (–) gebelerde fetal RhD tanımlanmasında maternal plazmadaki fetüs
DNA’sının kullanımı yeni ufuklar açmıştır24,76. Geleneksel yöntemlerden (amniyosentez
ve CVS gibi) farklı olarak girişimsel olmayan yöntem kullanıldığında feto-maternal
kanama ve daha fazla sensitizasyon riski ortadan kalkmaktadır. Bu sayede sadece Rh
(+) fetusa sahip gebelerde koruma amacıyla verilen anti-D immünglobulin, Rh (–) fetüse
sahip gebelerin gereksiz yere anti-D immünglobulin alımını engellenmektedir. Geniş
sayıdaki hasta serileriyle yapılan pek çok çalışma ile girişimsel olmayan prenatal RhD
genotiplemesinin doğruluğu kabul edilmiştir. İnvaziv olmayan fetal RhD genotiplemesi
rutin prenatal tanıda günümüzde İngiltere, Fransa ve Hollanda’da kullanılmaktadır24.
2.6.3. Fetal DNA ile Tek Gen Bozukluklarının Saptanması
Maternal plazmadaki serbest fetal DNA’nın analizi; tek gen bozukluklarının
prenatal tanısına zaman, doğruluk, güvenirlilik sağlaması yanında maddi yönden uygun
olmasıyla da önemli fırsatlar sunmaktadır24,77. Geleneksel moleküler yöntemlerin
kullanımıyla fetal DNA genotipinin belirlenebilmesi, gebeliğin erken evrelerinde
mümkün olmaktadır. Günümüzde, ilk üç aydaki girişimsel olmayan analiz yöntemleri
arka plandaki maternal DNA nedeniyle fetal DNA’nın belirlenmesindeki duyarlılık ve
özgüllüğü sınırlamaktadır (Şekil 14)7. Buna rağmen maternal plazmadaki fetal DNA’nın
zenginleştirilmesi, testlerin gücünü arttırılabilmekte ve yarı niceleyici analizlere izin
vermektedir. Akondroplazi, hemoglobinopatiler, konjenital adrenal hiperplazi, kistik
fibroz, Huntington hastalığı, Miyotonik distrofi gibi giderek genişleyen bir çeşitlilikte
kalıtsal hastalıkların test edilmesine olanak sağlamaktadır77.
A
B
Şekil 14. Dolaşımdaki fetal DNA’nın tek gen bozukluklarının prenatal tanısında kullanımı. (A) Fetal
DNA’nın maternal dolaşıma salınımı. (B) Maternal plazmada fetal DNA7.
28
Fetal DNA’nın maternal dolaşıma salınımı öncesinde babadan (kırmızı) ve
anneden (yeşil) kalıtılan DNA molekülleri eşittir (Şekil 14A)7. Maternal plazmada fetal
DNA molekülleri arka planda maternal DNA dizilerinin bulunduğu bir ortamda
dolaşırlar. Fetüsün anneden aldığı fetal DNA alelleri (yeşil) arka plandaki maternal dizi
ile aynı genetik özelliktedir. Fetüsün babadan aldığı alel (kırmızı) ise maternal
plazmada fetüsün plazmada ayırt edilebilecek bir özgüllük kazandırmaktadır (Şekil
14B)7.
2.6.3.1. Hemoglobinopatiler
Günümüzde pek çok grup hemoglobinopatilerin girişimsel olmayan prenatal
tanısını geliştirebilmek için çalışmalar yapmaktadır3. Bilindiği üzere genellikle beta
talasemilerde olduğu gibi bazı mutasyonlar belirli etnik gruplarda bulunmakta ve risk
altında bulunan birçok çift aynı mutasyonu taşımaktadırlar. Bu durumda babadan
kalıtılan mutasyonun girişimsel olmayan yöntemle saptanmasının bir anlamı
olmamaktadır. Maternal plazmada babadan kalıtılan tekli nükleotit polimorfizmlerinin
(SNP) varlığının araştırılması, başka bir seçenek oluşturmakta ise de plazmada maternal
DNA’nın çok fazla miktarda olması, bu tür yöntemlerde özgüllük ve duyarlılığın çok
yüksek olmasını gerektirmektedir3.
İnsanoğlunda en sık görülen ve büyük bir halk sağlığı problemi oluşturan tekli
gen bozuklukları arasında talasemi gelmektedir. Talasemi kuşağı özellikle Akdeniz
bölgeleri, Orta Doğu, Hindistan’ın bazı kesimleri, Afrika ve Güney Çin’in Tayland’a
uzanan bölgelerini de içine almaktadır. Bu ülkelerden göç alan ülkelerde de bu hastalığa
yoğun olarak rastlanmaktadır6. Bugüne kadar hemoglobin geninde beta talasemiye
neden olan 400’e yakın mutasyon tanımlanmıştır78.
Beta globin geni, kromozom 11’in kısa kolu üzerinde beta benzer gen aile
kümesinde yer alan yapısal bir gendir. Beta talasemiye neden olan çoğu nokta
mutasyonu olup, beta geninin işlevsel olarak önemli bölgelerinde yer almaktadır.
Diğerleri delesyon veya nükleotit eklenmesi şeklindedir79. Beta globin genindeki
anormaliler hemoglobinin yapısındaki globin zincirlerinden biri veya daha fazlasının
29
sentezinin eksikliğine neden olmaktadır. Sonuçta, eritrositlerin hücre içi hemoglobin
miktarları azalmakta (hipokromi) ve boyutları küçülmektedir (mikrositoz)6.
Gelişmiş Batı ülkelerinde sıklığın az olmasına rağmen gelişmekte olan ülkelerde
endemik olan bu hastalık, ülkelere önemli ölçüde maddi yük getirmektedir.
Hemoglobinopatiler için korunmada uygulanan bir önemli basamak, homozigot ve çifte
heterozigot
gebeliklerin
saptanarak
gebeliğin
sonlandırılmasını
sağlamaktır.
Günümüzde beta talaseminin kesin tanısı moleküler yöntemlere dayanmaktadır. DNA
temeline dayalı yöntemler; DNA kaynağı olarak amniyon sıvısı, koriyonik vilüs örneği
veya fetal kan örneği kullanmaktadır. Prenatal tanının yapılamsında fetal DNA eldesi
için kullanılan yöntemlerin girişimsel olması ve bu yöntemlerin % 0,5-1 oranında
komplikasyon riski oluşturması nedeniyle bu yöntemlerin girişimsel olmayanlarla yer
değiştirmesi gerektiği fikrini öne çıkarmıştır. Bu yaklaşımdan dolayı fetal hücrelerle
yapılan çalışmalardan ilki Cheung ve ark.51 1996’da beta talasemilerde “Alele Drop
Out” yöntemi ile maternal kandan izole edilmiş fetal eritroblastlarla yaptığı çalışmadır.
Talasemide fetal hücrelerle yapılan ikinci çalışma da maternal kandan izole edilmiş fetal
eritroblastlarla tek hücre PCR yöntemi kullanılan çalışmadır80,81.
2.6.4. Plazma DNA Kimerizmi
Plazma DNA kimerizmi, tümör kaynaklı DNA veya fetal kaynaklı DNA gibi
yabancı genetik materyallerin, bazı insanların dolaşımındaki keşfinden bu yana, yeni bir
kavram olarak görülmektedir. DNA kimerizmi kavramı, mesane kanseri ve böbrek
transplant hastalarının idrarındaki DNA’yı saptama sırasında geliştirilmiş ve kişide
genetik olarak farklılık taşıyan hücrelerin bulunmasıyla tanımlanmıştır82,83. Günümüze
dek, insan dolaşımında çok çeşitli plazma DNA kimerizmleri bulunmuştur. Bu
kimerizmlerin kökeni tümör ve fetal kaynaklı olup ayrıca 1998’de bildirilen karaciğer
ve böbrek transplant hastalarının plazmalarında bulunan verici kaynaklı DNA’lardır23.
Plazma DNA kimerizmindeki bulgular, tanıda, görüntülemede ve hastalığın takibinde
belirteç olarak kullanıldığından beri, klinik uygulamalarda ayrıca bir önem kazanmıştır.
30
2.7. Fetal DNA Derişimlerini Arttıran Hastalıkların Saptanması
Fetal DNA derişimleri gebeliğin değişken şartlarından etkilenmektedir. Bazı
araştırmacılar fetal DNA derişimlerindeki değişimlere bakarak bunun gebelik
komplikasyonundan mı yoksa fetal anöploidi kaynaklı mı olduğunu araştırmışlardır24.
2.7.1. Pre-Eklampsi
Preeklampsi, gebeliğe bağlı hipertansiyon (gebeliğin 20nci haftasından sonra en
az iki kez sistolik basınç >140 mm Hg veya diastolik basınç >90 mm Hg olması) ile
birlikte proteinüri (>3 g/gün) bulgusu ile tanımlanmaktadır. Preeklampsili gebelerin
plazma DNA derişimlerindeki artışı ve bu durumun tanısında dolaşımdaki DNA
düzeylerinin kullanılabilir bir belirteç olabileceği bildirilmiştir24. Benzer başka bir
çalışmada preeklampsili gebelerde plazma DNA düzeyinin artışı gösterilmiş fakat
gelişme
geriliği
gösterilememiştir.
olan,
preeklampsi
Preeklampsinin
olmayan
patogenezi
gebe plazmalarında
halen
bu
durum
anlaşılamamıştır.
Uterus
damarlarındaki bozulma ile vilüs trofoblastları zarar görmekte ve sonuçta hücre hasarı
veya apopitoz oluşarak DNA’nın maternal dolaşıma geçtiği düşünülmektedir. Maternal
plazmadaki fetal DNA’nın plasental hasarın bir belirteci olarak preeklampsi şiddetiyle
fetal DNA düzeyleri arasındaki ilişkisinin incelenmesi sonucunda fetal DNA düzeyi ile
proteinüri ve hipertansiyon arasında güçlü bir ilişki ortaya konmuştur24.
2.7.2. Anöploidiler
Fetal anöploidilerin girişimsel olmayan prenatal tanı ile saptanması, özellikle
Trizomi 21 için çözümlenmesi gereken bir konu olarak görülmektedir. Fetal DNA’nın
maternal plazmada dolaşımdaki total DNA’nın sadece % 3-5’ini oluşturması, fetal
DNA’nın fetal anöploidileri saptamak için kullanılabilecek kısa ardışık tekrarların
(STR)
analizi
veya
tek
nükleotit
polimorfizmlerinin
(SNP)
uygulanmasını
güçleştirmektedir. Bu sınırlamalar seçenek olarak başka yöntemlere ihtiyaç olduğunu
göstermektedir. Günümüzde en iyi seçeneğin maternal plazmadaki plasentadan köken
alan serbest fetal mRNA’nın varlığı olarak görülmektedir. Hong-Kong’taki araştırma
grubu tarafından ortaya konan bu yöntemde temel avantaj, herhangi bir maternal
31
dokuda sentezlenmeyen plasentaya özgü mRNA türlerinin seçiminin mümkün
olmasıdır7.
Şekil 15. PLAC4 geni için serbest fetal RNA’nın trizomi 21’de analizi84.
Kromozom 21 üzerinde bulunan plasentaya özgül gen (PLAC4) ile bu genin
konumu itibarı ile Trizomi 21 tanısında önemli olabileceği düşüncesiyle pek çok
çalışmalar yapılmıştır7. PLAC4 geni mRNA’sı ile yapılan niceleyici çalışmalar, yeterli
bilgi vermediğinden, MS’nin kullanımı ile fetal nokta mutasyonlarının saptanmasında
başarı gösterilmiştir. Kromozom 21 düzeylerini belirtmek için PLAC4 geni üzerindeki
SNP bölgeleri kullanılmıştır. Fetüsün SNP için heterozigot olduğu olgularda PLAC4
mRNA kopyaları her bir alelden eşit oranda gelmekte (1:1 oranı) ve normal ploidi
göstermektedirler. Anöploidi varlığında ise bu oran 2:1 olmaktadır (Şekil 15)84.
Fetal DNA’da kromozom 21 kaynaklı DNA dizilerinin kantitasyonu kromozom
dozaj yöntemi olarak tanımlanan fetal DNA’daki referans bir dizi ile karşılaştırılarak
yapılmaktadır. Normal gebeliklerde kromozom 21 oranı 2:2 iken trizomi 21 olgularında
bu oran 3:2 olarak saptanmaktadır85.
Epigenetik düzenlenmeler, DNA’daki somatik değişimler olup genetik diziyi
değiştirmemekte, fakat gen ifadesine etki etmektedir. Bu bilgi çerçevesinde serbest fetal
DNA epigenetik düzenlemelerinin saptanması fetal anöploidilerin tanısında bir araç
olarak kullanılmaya başlanmıştır. Epigenetik düzenlemeler içerisinde en çok açıklanan
düzenlenmeler,
CpG
adacıklarındaki
sitozin
metilasyonudur.
Genetik
dizinin
hipermetilasyona uğraması genetik olarak ifade edilememesine neden olmaktadır. İkinci
32
X kromozomunun epigenetik mekanizmalarla gen ifadesinin susturulması buna bir
örnektir.
Şekil 16. Trizomi 18’de Maspin geni çalışması84.
Maternal ve fetal DNA arasında metilasyondan kaynaklanan epigenetik
farklılıklar bulunmaktadır. Bu farklılık, aynı nükleotid dizisine sahip serbest fetal DNA
ve maternal DNA parçaları arasında ayrımı sağlamaktadır. Bu özellikten yararlanılarak
kromozom 18 üzerinde yer alan Maspin genindeki fetal ve maternal metilasyon
durumları arasındaki farklılık araştırılmıştır. Bu genin promotor bölgesi plasentada
metillenmediği halde, maternal kanda hipermetilasyona uğradığı belirlenmiştir. Fetal
DNA dizileri sitozinlerin metillenmesindeki farklılığa bağlı olarak maternal DNA
dizisinden MS ile kolayca ayrılabilmektedir. Maspin geni kromozom 18 üzerinde
olduğundan araştırmacılar Trizomi 18 saptanmasında bu genin kullanılabileceğini
düşünmüşlerdir. Trizomi 21 için belirlenen yöntemde olduğu gibi gen üzerinde bulunan
SNP’lere göre benzer tanımlama kullanılmaktadır. Normal olgularda 1:1 oran ve
anöploidi olgular için de 2:1 oranı belirlemişlerdir (Şekil 16)84. Analizlerde bu genin
promotor bölgesinde A/C değişimi kullanılmıştır84.
33
3. GEREÇ VE YÖNTEM
3.1. Gereç ve Kimyasal Maddeler
3.1.1. Gereçler
·
Santrifüj
(Eppendorf 5403)
·
Vorteks
(Nüve NM 110)
·
Mikro Santrifüj
(Beckman Microfuge E)
·
Otomatik Pipet
(Gilson P-2, P-10, P-20, P-100, P-200, P-1000)
·
Deney tüpleri
(0,2 mL ve 1 mL’lik Axigen)
Elektroforez Güç Kaynağı
(Bio-Rad
Power
PAC
300,
Pharmacia
Electrophoresis Power Supply EPS 500/400)
· Elektroforez Tankı
(Bio-Rad Mini Protean II Cell, Bio-Rad Sub-Cell)
·
Isı Döngüleyici
(Eppendorf, Perkin Elmer GeneAmp PCR 9600)
·
Light Cycler LC 480
(Roche Diagnostic)
·
Otomatik MagNa Pure LC
(Roche Diagnostic)
·
Saf Su Cihazı
(Millipore)
3.1.2. Kimyasal Maddeler
·
Primer (Oligonükleotitler)
(METİS Biyoteknoloji, Ankara)
·
Floresan İşretli Prob
(TIB-MOLIBIOL, Almanya)
·
LightCycler HRM kiti
(Roche)
·
QIAamp DNA Mini Blood Kit
(Qiagen)
·
Magna Pure Large Volume Kit
(Roche)
·
TaqMan prob master kit
(Roche)
·
Taq Polimeraz
(Sigma)
·
dNTP’ler
(Roche)
34
Diğer kullanılan kimyasal maddeler analitik saflıkta olup Merck, Roche,
firmalarından
sağlanmıştır.
Çözeltiler steril saf su
cihazından alınan
suyla
hazırlanmıştır.
3.2. Örnek Toplanması ve İş Akış Şeması
Koriyonik vilüs işlemi öncesi prenatal tanı amacıyla Tıbbi Biyokimya Anabilim
Dalı’na gelen çiftlerden rızaları alınıp onam formu doldurulduktan sonra 5 mL’lik
EDTA’lı tüplere 10 mL tam kan alınmıştır. Fetüslerin fenotipik cinsiyeti doğumdan
sonra aileler telefonla aranarak doğrulanmıştır. Fetal DNA kantitasyonu yapılan gebeler,
gebelik haftasına göre erken (6-21. haftalar) ve geç gebelik (18-38. haftalar) dönemi
olmak üzere iki grupta incelenmiştir23. Ailelerin birimimize başvurmasından test
sonuçlarının aileye aktarılmasına kadar geçen süreç şu sırayı izlemektedir;
35
3.3. Maternal Plazmanın Ayrımı ve DNA İzolasyonu
3.3.1. Maternal Plazmanın Ayrımı
EDTA’lı tam kanlar 1-2 saat içerisinde 5500 rpm ve 9200 rpm’de 10 dakika iki
aşamalı santrifüj işlemi ile plazmaları ayrılmıştır. Ependorf tüplerine 1 mL’lik paylar
halinde bir kısmı DNA izolasyonu için -20°C’de, geri kalanı da -70°C’de saklanmıştır.
3.3.2. Ebeveyn ve Fetal DNA izolasyonu
Maternal plazmanın 1 mL’si ile fetal DNA eldesi yapılmış, geriye kalan plazma
-70ºC’de saklanmıştır. DNA izolasyonu iki farklı yöntemle yapılmıştır. QIAamp DNA
Blood Mini Kit ve MagNA Pure otomatik DNA izolasyon cihazında MagNA Pure
Large Volume DNA izolasyon kiti kullanılarak yapılmıştır. Anne ve babanın tam
kandan MagNA Pure Large Volume DNA izolasyon kiti ile DNA izolasyonları
yapılmıştır.
3.3.2.1. MagNa Pure LC Otomatik Fetal DNA İzolasyonu;
Prensip: İzolasyon yöntemi manyetik boncuk teknolojisine dayanmaktadır.
Örnekler kaotropik tuz ve Proteinaz K içeren özel bir tampon ile inkübe edilip
parçalanmaktadır. Ortama manyetik cam parçacıklar eklenir ve örnekte bulunan total
nükleik asitler bu parçacıkların yüzeyine bağlanırlar. Bağlanmayan kısımlar çeşitli
yıkama basamakları ile ortamdan uzaklaştırılırlar ve saflaştırılan nükleik asitler düşük
derişimli tuz tamponu ile ayrıştırılır. MagNA Pure LC ile DNA izolasyonu basamakları
aşağıda şematik olarak gösterilmektedir:
MagNA Pure LC Sistemi
Sistem Şekil 17’deki kısımları içermektedir;86
-
MagNA Pure LC Cihazı
-
Bilgisayar
36
Şekil 17. MagNa Pure LC kısımlarının görünümü86.
Ayıraçlar
· Proteinaz K
· Parçalayıcı Tampon
· Manyetik cam parçacıklar
· İzopropanol
· Yıkama Çözeltileri
· Elüsyon Tamponu
Yöntem
MagNA Pure LC yöntemi aşağıdaki basamaklardan oluşmaktadır (Şekil 18)87,
1. İzole edilecek örnekler (tam kan veya plazma) 500 µL örnek kartuşuna
yerleştirilir (Şekil 18-A).
2. Lizis/Bağlanma tamponu ilavesiyle hücreler parçalanarak DNA açığa çıkar,
proteinler denatüre olur (Şekil 18-B).
37
3. Örneklere Proteinaz K ilavesiyle hücresel proteinlerin parçalanması gerçekleşir
(Şekil 18-C)
4. Yüksek iyonik güçteki lizis/bağlanma tamponu, çeşitli tuz derişimleri ve
izopropanol varlığında DNA, eklenen manyetik parçacıkların silika yüzeylerine
bağlanır (Şekil 18-D).
5. Manyetik parçacıklara bağlanan DNA manytetik olarak lize uğramış diğer
kısımdan ayrılır (Şekil 18-E).
6. Manyetik parçacığa bağlanmış DNA yıkama tamponlarıyla tekrar tekrar
yıkanarak protein (nükleazlar), hücre membranları, heparin veya hemoglobin
gibi PCR inhibitörlerinden uzaklaştırılır. Böylece tuz derişimi düşer (Şekil
18-F).
7. DNA ile bağlı manyetik parçacıklar yıkama tamponundan manyetik olarak
uzaklaştırılırlar (Şekil 18-G).
8. Saflaştırılan DNA elüsyon kartuşunda 70ºC’de 100 µL elde edilir (Şekil 18-H).
Şekil 18. MagNA Pure LC yöntem basamakları87.
38
3.3.2.2. QIAamp DNA Blood Mini Kit ile Fetal DNA İzolasyonu;
Prensip: QIAamp DNA Kiti, kandan ve diğer vücut sıvılarından DNA
izolasyonunu hızlı spin kolon veya vakum yöntemleriyle kolaylaştırmaktadır. Bu
yöntemde fenol-kloroform ekstraksiyonu gerekmemektedir. DNA özgül olarak QIAamp
silika-jel membrana bağlanırken DNA dışında istenmeyen bulaşı maddeler kolondan
süzülmektedir. İki değerlikli katyonlar ve proteinler gibi PCR inhibitörleri, iki etkili
yıkama basamağı ile uzaklaştırılır ve sadece saf olarak elde edilecek nükleik asitin
ortamda kalması sağlanır. Nükleik asit, membrandan su veya kitle gelen tamponla
ayrılır. QIAamp DNA kan teknoloji genomik, mitokondrial veya viral DNA’yı kandan
ve ilişkili vücut sıvılarından elde ederek PCR’de ve blotlama yöntemlerinde kullanıma
hazır hale getirmektedir88.
Ayıraçlar
· Proteaz Stok Çözeltisi
· Tampon AL
· Tampon AW1
· Tampon AW2
· Tampon AE
Yöntem
Yöntem aşağıdaki basamaklar doğrultusunda uygulanır (Şekil 19)88,
1. Su banyosu 54°C’ye ayarlanır.
2. 20 µL Qiagen Proteaz (Proteinaz K) 1,5 mL’lik ependorf tüpüne konur ve
üzerine 200 µL örnek (tam kan, plazma, serum) pipetlenir.
3. Ependorf tüpüne 200 µL tampon AL eklenir, 15 saniye karıştırıp vortekslenir.
4. 56°C’de 10 dakika inkübe edilir.
39
5. Kısa santrifüj işleminden sonra 200 µL etanol (% 96-100) örnek üzerine ilave
edilir, 15 saniye karıştırılır ve kısa santrifüj edilir.
6. Karışım QIAamp spin kolona aktarılır ve 8000 rpm’de 1 dakika santrifüj edilir.
7. Santrifüj sonrası kolonun altındaki toplama tüpü yenilenir ve eskisi atılır.
8. Kolona 500 µL tampon AW1 eklenir ve 8000 rpm’de 1 dakika santrifüj edilir.
9. Toplama tüpü değiştirilir ve kolona AW2 tamponu ileve edilerek 14000 rpm’de
3 dakika santrifüj edilir. Toplama tüpü değiştirilerek tekrar aynı devirde 1
dakika santrifüj edilir.
10. Kolon yeni bir santrifüj tüpüne konur ve 50 µL AE tamponu veya saf su ilave
edilerek oda ısısında 1 dakika inkübasyona bırakılır. İnkübasyon sonrasında
8000 rpm’de 1 dakika santrifüj ile DNA kullanıma hazır hale gelmektedir.
Şekil 19. DNA izolasyon yöntem basamaklarının şematize edilmesi88.
40
3.4. “Nested” PCR
“Nested” PCR, tek bölge için iki çift PCR primeri kullanımı ile gerçekleşen bir
yöntemdir (Şekil 20)89. İlk çift primer, ilgili bölgeyi amplifiye etmektedir. İkinci çift
primer (iç içe geçmiş), ilk PCR ürününe bağlanarak ikinci bir ürünü oluşturur ki bu, ilk
üründen daha kısadır. Bu stratejinin ardındaki mantık, az miktarda DNA ile etkin bir
şekilde PCR yapmak ve yanlışlıkla başka bir bölge amplifiye olmuşsa ikinci kez diğer
çift primerle de amplifikasyon yapmaktadır89.
Şekil 20. “Nested” PCR basamaklarının gösterimi89.
3.4.1. “Nested” PCR ile Fetal Y Kromozom Tayini
Prensip: Denatüre edilmiş maternal plazmada Y kromozomunun belirli bir
bölgesine özgün primerler kullanılarak az miktardaki fetal DNA ile iki aşamalı PCR
yapılmaktadır90.
Ayıraçlar: Kullanlan ayıraçlar aşağıda belirtilmiştir. Primer dizileri Tablo 1’de
gösterilmiştir.
41
· 10 x PCR Tamponu (10 mL)
KCl
5 mmol/10 mL
Tris-HCl pH 8,3
1 mmol/10 mL
MgCl2
0,15 mmol/10 mL
Jelatin
0,01 g/ 10 mL
· 6 mM dNTP
· Primer dizileri
· Yükleme boyası (15 g Ficoll, 50 mg Bromfenol Mavisi, 10 mL Gliserol, 90 mL
1xTBE hepsinin bir arada ısıyla çözünmesi sağlanır. Çözünme işleminden sonra
1xTBE ile 100 mL’ye tamamlanır.
· 10xTBE pH 8,25 (1 M Tris Baz; 121 g/L, 1 M Borik asit; 61,8 g/L, 0,2 M NaEDTA; 7,4 g/L)
Çizelge 1. “Nested” PCR’de kullanılan primer dizileri.
Birinci aşama Primerler
Y1.5
5′-CTAGACCGCAGAGGCGCCAT -3′
Y1.6
5′-TAGTACCCACGCCTGCTCCGG-3′
İkinci aşama Primerler
Y1.7
5′-CATCCAGAGCGTCCCTGGCTT-3′
Y1.8
5′-CTTTCCACAGCCACATTTGTC-3′
42
Yöntem:
Plazma Denatürasyonu: 200 µL maternal plazma 99°C’de 5 dakika denatüre
edilmektedir. 10 dakika santrifüj işleminin ardından süpernatan alınıp temiz tüpe
aktarılır ve PCR işleminde kullanılır.
Protokol
Günlük PCR Karışımı*
22,5 µL
Primerler (10 pmol/ µL)
0,5 µL
Taq polimeraz (0,25 Ü)
0,5 µL
dNTP (6 mM)
0,5 μL
Denatüre plazma
1 µL
Toplam
25 μL
*Günlük PCR Karışımı; 125 μL 10x PCR tamponu, 1 μL spermidin ve 874 μL
saf su içermektedir.
· İkinci aşamada, 1. PCR ürününden 1 µL kalıp olarak kullanılır. Çizelge 1’de
görüldüğü gibi ikinci aşamada da kullanılan primerler farklıdır.
· Birinci ve ikinci aşama için aynı PCR programı kullanıır;
95°C denatürasyon
15 saniye
60°C primer yapışması
30 saniye
72°C zincir uzaması
45 saniye
25 döngü amplifikasyon
Görüntüleme: PCR işleminden sonra % 2’lik agaroz jel elektroforezi ile
amplifikasyon kontrolü yapılmıştır. 5 μL PCR ürünü 5 μL yükleme boyası ile
karıştırılarak 150 volt akımda 30 dakika yürütülmüştür. Agaroz jel etidyum bromid ile
boyanarak UV translüminatörde incelenmiştir.
43
3.4.2. Multipleks “Nested” PCR ile Fetal X ve Y Kromozom Tayini
Prensip. Fetal cinsiyet tayini multipleks PCR ile X kromozomuna özgün ATL1
geni ve Y kromozomuna özgün SRY dizileri kullanılarak uygulanmıştır91.
Ayıraçlar: Kullanlan ayıraçlar aşağıda belirtilmiştir. Primer dizileri Çizelge 2’de
gösterilmiştir.
· 10 x PCR Tamponu
(50 mmol/L KCl; 10 mmol/L Tris-HCl pH 8,3; 2,5 mmol/L MgCl2; % 0,01
jelatin)
· dNTP karışımı (2 mM)
· Primer dizileri
· Taq polimeraz (1 Ü/L)
Çizelge 2. Multipleks “Nested” PCR’de kullanılan primer dizileri.
İlk aşama Primerler
X1
5′-CCCTGATGAAGAACTTGTATCTC-3′
X3
5′-GAAATTACACACATAGGTGGCACT-3′
Y1.5
5′-CTAGACCGCAGAGGCGCCCAT-3′
Y1.6
5′-TAGTACCCACGCCTGCTCCGG-3′
İkinci aşama Primerler
X2
5′-TCGCCTTTCTCAAATTCCAAG-3′
X3
5′-GAAATTACACACATAGGTGGCACT-3′
Y1.7
5′-CATCCAGAGCGTCCCTGGCTT-3′
Y1.8
5′-CTTTCCACAGCCACATTTGTC-3′
44
Yöntem:
Her iki aşamada da aynı protokol kullanılmıştır. İkinci aşama PCR’de 2 µL ilk
aşama PCR ürünü kalıp olarak kullanılmıştır.
Protokol
Günlük PCR Karışımı*
10 µL
Primerler (7,5 pmol/µL)
1 µL
dNTP (2 mM)
1 µL
Taq polimeraz (0,25 Ü)
0,4 µL
MgCl2 (2,5 mM)
4 µL
Plazma fetal DNA
10 µL
Saf su
70,6 µL
Toplam
100 µL
*Günlük PCR Karışımı; 125 μL 10x PCR tamponu, 1 μL spermidin ve 874 μL saf su
içermektedir.
Her iki aşamada kullanılan PCR programı;
· 94°C’de 3 dakika başlangıç denatürasyonu
· 94°C’de 1 dakika
55°C’de 1 dakika
40 döngü amplifikasyon
72°C’de 1 dakika
Görüntüleme işlemi bir önceki aşamadaki gibi uygulanmıştır.
45
3.5. RT-PCR ile Fetal DNA Kantitasyonu
Prensip: Gerçek zamanlı polimeraz zincir reaksiyonu, DNA amplifikasyonu ile eş
zamanlı artış gösteren floresans sinyalin ölçülmesi ile niceleyici sonuç verme esasına
dayanmaktadır. Yöntemde fetal DNA kantitasyonu için Y kromozomuna özgü DYS14
geni ile total DNA kantitasyonu için beta globin geni kullanılmıştır92.
Ayıraçlar
· TaqMan Master karışımı (2x)
· Saf su
· 25 mM MgCl2
· Primer ve problar
Yöntem: DYS14 ve beta globin için uygulanan süreçler aşağıdaki gibidir.
Kullanılan primer ve prob dizileri Çizelge 3’te gösterilmiştir.
DYS14
TaqMan Master karışımı (2x)
6 µL
MgCl2 (25 mM)
4 µL
Primer F (10 pmol/µL)
0,75 µL
Primer R (10 pmol/µL)
0,75 µL
Prob (5 pmol/µL)
1 µL
Plazma fetal DNA
5 µL
Saf su
2,5 µL
Toplam
20 μL
46
DYS14 için PCR koşulları aşağıdaki gibi uygulanmıştır.
95ºC’de 10 dakika başlangıç denatürasyonu (1 döngü)
95ºC’de 10 saniye
57ºC’de 20 saniye
40 döngü amlifikasyon
72ºC’de 20 saniye
40ºC’de 30 saniye soğutma (1 döngü)
Beta Globin
Taqman karışımı (2x)
6 µL
Primer F (10 pmol/µL)
0,75 µL
Primer R (10 pmol/µL)
0,75 µL
Prob1 (5 pmol/µL)
1 µL
Prob 2 (5 pmol/µL)
1 µL
Plazma fetal DNA
5 µL
Saf su
5,5 µL
Toplam
20 μL
47
Beta globin için PCR koşulları aşağıdaki gibi uygulanmıştır
95ºC’de 10 dakika başlangıç denatürasyonu (1 döngü)
95ºC’de 15 saniye
57ºC’de 10 saniye
40 döngü amplifikasyon
72ºC’de 10 saniye
40ºC’de 30 saniye soğutma (1 döngü)
Çizelge 3. RT-PCR DYS14 ve Beta globin için kullanılan primer ve prob dizileri.
DYS14 Primerler
F-
5´-CAT CCA GAG CGT CCC TGG-3´
R-
5´-TTC CCC TTT GTT CCC CAA A-3´
Prob
5´-FAM-CGA AGC CGA GCT GCC CAT CA-TAMRA-3´
Beta globin Primerler
F - 5´-ACA CAA CTG TGT TCA CTA GC-3´
R - 5´-CAA CTT CAT CCA CGT TCA CC-3´
Prob
1-
5´-LC Red-GAA GTC TGC CGT TAC TGC CCT G-P-3´
2-
5´-CAT GGT GCA TCT GAC TCC TGA GG-FITC-3´
Görüntüleme: RT-PCR’de sonuçlar bilgisayarda yazılım programı ile analiz
edilerek değerlendirilir. Ayrıca PCR sonrası bir jel aşamasına gerek olmamaktadır.
3.6. Fetal DNA Derişimi Hesaplanması
Derişim, plazma örneklerinde tespit edilen erkek fetüs DNA’sının genom
ekivalen* sayısının erkek genomik DNA ile elde edilen standart sulandırma eğrisinin
karşılaştırılması ile belirlenmiştir. Birim hücre başına 6,6 pg DNA, sonuçların kopya
sayısı
olarak
ifade
edilmesinde
dönüşüm
faktörü
olarak
kullanılmaktadır23.
Amplifikasyon verileri, DYS14 ve beta globin amplifikasyonları sonucunda elde edilen
derişimleri, Light Cycler (Roche LC 480) yazılım programı kullanılarak hesaplanmıştır.
48
*Genom Ekivalen (GE): Tüm genom içerisinde olduğu kesin olan, saflaştırılmış
örnekte olması gerekli DNA miktarıdır. Bu sayı bir organizmanın toplam genom
büyüklüğü ile artmakta ve hesaplanırken DNA’nın mikrogram birimi için, genom
büyüklüğü baz çiftine dönüştürülmektedir93.
· Her mililitrede ifade edilen kopya fetal DNA derişimi aşağıdaki eşitlikle
hesaplanmaktadır:
C = plazma/serumdaki hedef derişim (her mililitredeki kopya miktarı)
Q = PCR’deki hedef miktar (kopya)
VDNA= Ekstraksiyon sonrası total DNA hacmi (100 µL)
VPCR= PCR’de kullanılan DNA hacmi (5 µL)
Vext= Ekstrakte edilen plazma veya serum hacmi (500 µL)
3.7. Mutasyonların HRM ile Analizi; Beta globin genotiplemesi
Prensip: DNA ikili ipliğinin ısı ile açılması sırasında herhangi bir baz değişimi
varlığında, ortamdaki iki farklı floresan boyar maddenin de yardımıyla bu bölgelerde
yaydıkları ışınımın anlık izlenmesiyle normalden farklı pikler oluşmaktadır. Bu pikler
erime eğrisi olarak adlandırılmaktadır94.
Ayıraçlar
· HRM karışımı (2x)
-Fast Start Taq DNA Polimeraz, tampon, dNTP karışımı, floresan boyar madde
· 25 mM MgCl2
· Saf su
· Primerler
49
Yöntem: Aşağıdaki protokol kullanılarak PCR tepkimesi uygulanmıştır. Primer
dizileri Çizelge 4’te gösterilmiştir.
Primer F (10 pmol/µL)
0,5 µL
Primer R (10 pmol/µL)
0,5 µL
Prob1 (5 pmol/µL)
0,15 µL
Prob 2 (5 pmol/µL)
0,15 µL
TaqMan karışımı (2x)
10 µL
Plazma fetal DNA
5 µL
Saf su
3,7 µL
Toplam
20 μL
PCR döngüsü;
95ºC’de 30 saniye denatürasyon 1 döngü
95ºC’de 3 saniye
58ºC’de 5 saniye
35 döngü amplifkasyon
72ºC’de 20 saniye
40ºC’de 30 saniye
soğuma 1 döngü
95°C’de 60 saniye
35°C’de 20 saniye
erime eğrisi analizi
80°C’de sürekli okuma
50
Görüntüleme: Sonuçlar için PCR sonrası jel gerekmemektedir. Program yazılımı ile
değerlendirme yapılır ve çıktı alınır.
Çizelge 4. HRM primer dizileri.
HRM Primerler
1. bölge; Promotor-Ekson 1 (351bç)
F5′-CAATTTGTACTGATGGTATGG-3′
R5′-CTTCATCCACGTTCACCTTGC-3′
2. bölge; 5′UTR- Ekson 2 (425bç)
F5′- CACTAGCAACCTCAAACAGAC-3′
R5′- CACTCAGTGTGGCAAAGGTG-3′
3. bölge; Ekson 2-IVS 2 (318 bç)
F5′- TTTGAGTCCTTTGGGGATCTG-3′
R5′- CCACACTGATGCAATCATTCG-3′
4. bölge; IVS 2- 3′ UTR (354 bç)
F5′- GGTTAAGGCAATAGCAATATTTCT-3′
R5′- TGGACAGCAAGAAAGCGAGC-3′
3.8. Hb S Mutasyonunun HRM Analizi ile Genotiplenmesi
Prensip: HbS varyantı için insan beta globin geni ekson 1 bölgesinde 214 bç’lik
kısmın amplifikasyonuna özgül primer çiftleri ve floresanla saptanan probları kapsayan
HRM kiti ile LightCycler PCR’de erime eğrisi analizi uygulanmıştır.
Ayıraç:
· Çözücü HbS (kontrol probu sulandırmak için kullanılır)
· Mutant ve normale özgü primer/problar (HbS)
· Kontrol (HbS heterozigot DNA)
· MgCl2 (25 mM)
· 10 x Master Hibridizasyon probları
51
Yöntem:
Primer/ prob karışımı
2,8 µL
Çözücü
9,6 µL
MgCl2
1,6 µL
10 x Hibridizasyon probları 2 µL
Toplam 16 µL + 4 µL plazma fetal DNA
Hazırlanan tepkime karışımı RT-PCR tabağında aşağıdaki protokolde çalışılır.
95°C’de 60 saniye başlangıç denatürasyonu
95°C 1 saniye
63°C’de 30 saniye
35 döngü amplifikasyon
75°C’de 1 saniye
95°C’de 60 saniye
35°C’de 20 saniye
erime eğrisi analizi
80°C’de sürekli okuma
Görüntüleme: Sonuçlar için PCR sonrası jel gerekmemektedir. Program yazılımı ile
değerlendirme yapılır ve çıktı alınır.
3.9. Dizi Analizi ile Fetal DNA Mutasyonu Saptanması
Prensip: Otomatik DNA dizi analizde Sanger’in enzimatik DNA sentezine dayanan
zincir sonlanma yöntemi kullanılmaktadır. DNA örneğindeki nükleotitlerin tam
dizisinin belirlendiği bir yöntemdir. DNA, dört çeşit deoksinükleotit trifosfatla
sentezlenir. Her bir nükleotit 3′-OH ucundan bir sonraki nükleotide bağlanır. Dideoksi
52
yöntemiyle sentetik oligonükleotit sentezinde 3′-OH molekülü kritik rol oynar. Sentez
sırasında zincire bir dideoksinükleotit eklenmesi zincir uzamasını sonlandırır. Çünkü 3.
karbon atomundaki 3′-OH molekülünün oksijen atomu bulundurmaması zincirin
uzamasına izin vermez3.
Ayıraçlar
PCR tepkimesi için;
· Primerler
· “Master miks” (Applied Biosystem)
“Cycle Sequencing” tepkimesi için;
· “ReadyReaction Mix V3.1” (Applied Biosystem)
· 5 x Sekans Tampon (Applied Biosystem)
· Saf Su
· Primer (F veya R)
Çizelge 5. Dizi analizinde kullanılan beta geni primerleri.
Primer Forward
5′-aga tcc atc tac ata tcc caa agc-3′
Primer Reverse
5′-ccc ttc cta tga cat gaa ctt aac cat-3′
Yöntem:
Beta globin geni dizi analizi için ilk aşama PCR tepkimesidir. İlk aşama sonrasında
sefadeks ile saflaştırma işlemi yapıldıktan sonra cycle sequencing tepkimesi uygulanır.
Kullanılan protokoller aşağıdaki gibi izlenir;
53
PCR tepkimesi protokol:
Primer F (5 pmol/µL)
5 µL
Primer R (5 pmol/µL)
5 µL
“Taqman Gold Master miks”
12,5 µL
“Cycle sequencing” ürünlerinin Sefadeks kolonları ile temizlenmesi;
1. Hazır olan Sefadeks kolonlarının içerisine 600 µL saf su konur vortekslenip 30
dakika bekletilir.
2. 2000 g, 5400 rpm’de 2 dakika santrifüj edilir.
3. Santrifüj sonrası Sefadeksli kolonların alt kısmı çıkarılır ve süzüntüler dökülür,
diplerine 5 er µL distile su konur.
4. 10 µL. “Cycle Sequencing” ürünü Sephadeks üzerine (kolona temas etmeden)
bırakılır.
5. 2000 g, 5400 rpm’de 1 dakika santrifüj edilir.
Sekans Protokolü;
Saf su
5 µL
“BigDye ReadyReaction Mix”
2 µL
5x Sekans tamponu
1 µL
F Primer (veya R) (5 pmol/ µL)
1 µL
PCR Ürünü*
1 µL
Toplam
10 µL
PCR Koşulları;
96oC
1 dakika denatürasyon
96oC
10 dakika
50oC
5 saniye
60oC
4 dakika
x30 döngü
54
+4oC
Bekleme
Sekans Protokolü ardından örnekler otomatik dizi analizi cihazı tabağına
konularak yürütme başlatılır. Yürütme sonrası okuma işlemi sekans yazılım programı
ile yapılır.
3.10. İstatistik Analiz
İstatistik analizler SPSS 15.0 program sürümü kullanılarak yapılmıştır. Gebelerin
eritrosit indeksleri, yaş ve gebelik haftaları gibi özelliklerde ortalama, medyan, standart
sapma ve minimum-maksimum değişkenleri kullanılmıştır. Orak hücre taşıyıcı ve
talasemi taşıyıcı grupların fetal ve total DNA düzeyleri arasındaki ilişkiye nonparametrik Mann-Whitney testiyle bakılmıştır. Fetal ve total DNA derişimleri
arasındaki ilişki için non-parametrik Spearman’s korelasyonu uygulanmıştır. Grupların
MoM değerleri Ki-kare testi ile değerlendirilmiştir.
55
4. BULGULAR
Çalışma grubu, iki yıllık bir süreç içinde Çukurova Üniversitesi Tıp Fakültesi
Kadın Hastalıkları ve Doğum polikliniğine ve Tıbbi Biyokimya Anabilim Dalı’na
prenatal tanı için başvuran 104 gebeden oluşmaktadır.
İlk gebeliği olan bireyler genotiplerine göre 2 grupta incelenmiştir. Orak hücre
(HbS) taşıyıcısı 57 gebe (42 erkek, 15 dişi fetüs), beta talasemi taşıyıcısı 32 gebe (23
erkek, 9 dişi fetüs) ve 15 (15 erkek fetüs) kişilik sağlıklı gebelerden oluşan kontrol
grubu çalışmaya alınmıştır. Çizelge 6’da grupların yaş ve gebelik haftası değişkenleri,
çalışmaya katılan gebelerin ortalama eritrosit indeksleri de Çizelge 7’de verilmiştir.
Çizelge 6. HbS Taşıyıcı ve talasemi taşıyıcısı gebelerin yaş ve gebelik haftası değişkenleri.
HbS Taşıyıcı
(n=57)
Talasemi taşıyıcı
(n=32)
Kontrol
(n=15)
Χ ± SD
Χ ± SD
Χ ± SD
Aralık
Aralık
Aralık
24,8 ± 4,3
25,0 ± 4,9
31,3± 3,3
17-35
16-38
26-36
11,8 ± 4,1
11,3 ± 3,1
12,3±1,1
7-29
6-21
10-15
Χ ± SD
25,8 ± 4,9
Yaş (Yıl)
Gebelik
Haftası
Toplam
11,8 ± 3,5
Yukarıdaki çizelgede yaş ve gebelik haftası ortalama değerleri ve bu değerlerin alt
ve üst sınırları görülmektedir. Bilgileri verilen gebelerin hepsi prenatal tanı isteği ile
birimimize ilk kez başvuru yapmış olup, ilk gebeliği olan bireylerden oluşmaktadır.
56
Çizelge 7. Çalışma gruplarının eritrosit indeksleri.
HbS taşıyıcı
(n=57)
Talasemi taşıyıcı
(n=32)
Kontrol
(n=15)
Χ ± SD
Χ ± SD
Χ ± SD
RBC
(106/mm3)
4,14 ± 0,3
4,83 ± 0,4
4,0 ± 0,5
0,000
Hb
(g/dL)
11,4 ± 0,8
10,2 ± 1,1
11,1 ± 0,7
0,000
Hct
(%)
34,8 ± 2,5
32,6 ± 2,8
32,6 ± 2,6
0,000
MCV
(fL)
84,3 ±4,8
68,6 ± 7,4
86,5 ± 2,7
0,000
MCH
(pg/hücre)
27,8 ± 2,0
21,2 ± 2,7
30,3 ± 2,4
0,000
MCHC
(g/dL)
33,0 ± 1,4
30,9 ± 1,4
32,4 ± 1,4
0,000
p
Çizelge 7’de görüldüğü gibi çalışmaya alınan gebelerden 57 tanesi HbS
taşıyıcısı ve 32 tanesi talasemi taşıyıcısı ve 15 tanesi mutasyon taşımayan gebelerden
oluşan kontrol grubudur. Çizelgede çalışma gruplarının eritrosit indekslerinin ortalama
ve standart sapma değerleri gösterilmiştir. Orak hücre ve talasemi grupları arasındaki
değişkenler istatistiksel olarak anlamlı bulunmuştur.
57
4.1. “Nested” PCR ile Maternal Fetal Y Kromozomu Tayini
Maternal kandan serbest plazma fetal DNA’sının varlığı “nested” PCR ile analiz
edilmiştir. Bu analizde, SRY olarak adlandırılan cinsiyeti belirleme gen dizileri
kullanılarak Y kromozomu taşıyan fetal DNA örnekleri saptanmıştır. Denatüre edilmiş
plazma örneklerinde yapılan PCR işleminde saptanan Y kromozomuna özgül 198 bç’lik
bantlar dolaşımdaki serbest fetal kökeni göstermektedir. Erkek cinsiyete özgül 198
bç’lik bant 104 gebe plazmasında % 93,7 oranında (75 örnek) saptanmıştır. Bant
görülmeyen 29 örnek dişi cinsiyet olarak adlandırılmıştır. Yetişkin erkek ve dişi tam
kan lökositlerinden elde edilen genomik DNA’lar pozitif ve negatif kontrol olarak
kullanılmıştır.
B
1
2
3
4
5
6
7
8
9
10
500 bç →
← 198 bç (Y)
Şekil 21. “Nested” PCR ile fetal Y kromozomu belirlenmesi. B Belirteç, 1, 2, 3, 4, 6, 7 erkek cinsiyet,
5 ve 8 dişi cinsiyet plazma örnekleri, 9 Negatif kontrol, 10 Pozitif kontrol.
Şekil 21’deki agaroz jel görüntüsünde 1, 2, 3, 4, 6 ve 7 numaralı plazma
örneklerinde
gözlenen
bantlar
198
bç
uzunluğunda
olup
erkek
cinsiyeti
göstermektedirler. Kullanılan belirteç ve 10 numarada kontrol olarak kullanılmış
genomik erkek DNA’sı bu bantların doğru bantlar olduğunu göstermektedir. 5 ve 8
numaralı plazma örnekleri ise 9 numaradaki negatif kontrol gibi amplifiye olmadıkları
için dişi olarak adlandırılmaktadırlar.
58
4.2. Multipleks “Nested” PCR ile Fetal X ve Y Kromozom Tayini
Erkek fetüslerin Y kromozomuna özgül dizilerle (SRY) saptanması yanında, X
kromozomuna özgül FMR1 geninde bulunan ATL1 dizisi kullanılarak aynı deneyde multipleks
PCR uygulanmıştır. “Nested” PCR ile özgül SRY dizisinin amplifiye olmamasıyla bant
gözlenmeyen maternal fetal DNA örnekleri dişi olarak tanımlanmakta iken bu yöntemle 261
bç’lik bantlar gözlenen fetal örnekler dişi olarak adlandırılmıştır. Erkek fetüs ve kontrol erkek
genomik DNA örneklerinde 261 bç’lik bant ile birlikte 198 bç’lik bant görülmektedir. Sonuçlar
şekil 22’de gösterilmektedir.
1
2
3
4
B
B
1
2
3
←500 bç
←261 bç (X)
(X) 261 bç→
(Y) 198 bç→
A
B
Şekil 22. Multipleks “nested” PCR ile X ve Y kromozomu belirlenmesi. (A) 1, 2, 3 plazma DNA, 4
genomik erkek DNA. (B) 1, 2 plazma DNA, 3 dişi genomik DNA.
Şekil 22A’da görüldüğü gibi ilk 3 örnek plazma DNA’sı olup hem 261 bç’lik
X’e özgül bant, hem de 198 bç’lik Y’ye özgül bant görülmektedir. 4 numaralı örnek
kontrol olarak kullanılan genomik erkek DNA’sıdır. Şekil 22B’de 1 ve 2 numaralı
örnekler plazma DNA’sı olup X kromozomuna özgül 261 bç’lik bant görülmektedir.
Aynı tek bant 3 numarada kontrol olarak kullanılan genomik dişi DNA’sında da
izlenmektedir. Fakat bant yoğunluklarının farklı olduğu görülmektedir. Şekil 22A ve
22B’de 261 bç’lik ATL1’e özgül bant tüm örneklerde görülmektedir, 198 bç’lik bant ise
sadece şekil 22A’daki plazma örneklerinde bulunmaktadır. Bu da şekil 22A’daki
örneklerin erkek ve B’deki örneklerin dişi olduklarını göstermektedir.
59
Çizelge 8. Multipleks “Nested” PCR ile saptanan cinsiyetler.
Multipleks “Nested” PCR
Cinsiyet
Sayı (n)
Dişi (ATL1)
29
Erkek (SRY)
75
Çizelge 8’de multipleks “nested” PCR’de ATL1’e özgül primer ile 29 plazma örneği
dişi olarak belirlenmiştir. 75 örnekte 198 bç’lik Y’ye özgül bant görülmüş ve erkek
fetüs olarak adlandırılmıştır.
4.3. Niceleyici RT-PCR
Maternal plazmadaki erkek fetüsleri saptamak amacıyla sadece Y kromozomuna
özgül çok kopyalı DYS14 lokusu kullanılmıştır. Daha sonraki aşamada erkek olarak
saptadığımız örneklerde gruplar arasındaki maternal fetal DNA düzeyindeki değişimleri
izlemek amacıyla DYS14 lokusuyla kantitasyon yapılmıştır.
4.3.1. RT-PCR ile Cinsiyet Tayini
Fetüslerin erkek cinsiyetinin belirlenmesi için RT-PCR ile Y kromozomuna özgül
çok kopyalı DYS14 lokusuna ve “nested” PCR ile de tek kopya SRY lokusuna
bakılmıştır. Erkek fetüslerin her iki yöntemle saptanan olgu sayısının karşılaştırılması
Çizelge 9’da görülmektedir. Olguların fenotipik cinsiyetleri doğum sonrasında aileler
telefonla aranarak doğrulanmıştır.
Çizelge 9. Fetüslerin “nested” PCR ve RT-PCR sonucunda belirlenen cinsiyetleri.
“Nested” PCR (SRY)
Cinsiyet
Olgu (n)
RT-PCR (DYS14)
Pozitif (n)
Pozitif (%)
Pozitif (n)
Pozitif (%)
Fenotipik cins.
Dişi
24
29
20,8
24
100
Erkek
80
75
93,7
80
100
Çizelge 9’da, iki farklı yöntemle Y kromozomuna özgül iki farklı lokus (SRY,
DYS14) kullanılarak belirlenen cinsiyetler görülmektedir. “Nested” PCR yönteminde 5
60
örnek dişi olmasına rağmen SRY ile amplifiye olmuş ve pozitif gibi sonuç vermiştir.
“Nested” PCR ile % 93,7 olgunun erkek fetüs taşıdığı bulunmuştur. RT-PCR’de ise bu
oran % 100 olarak belirlenmiştir. Dişi fetüslerde “nested” PCR ile 5 örnek erkek gibi
sonuç vermiştir. RT-PCR’de ise 24 dişi fetüsün hiçbirinde DYS14 ile amplifikasyon
olmamıştır.
4.3.2. RT-PCR ile Maternal Fetal DNA Kantitasyonu
Maternal fetal DNA düzeylerinin çalışma gruplarımızda kontrol grubuna göre bir
farklılık olup olmadığını görmek için RT-PCR ile DYS14 lokusu ve beta globin geni
kullanılarak kantitasyon yapılmıştır. Bu nedenle kantitasyon sadece erkek olarak
saptadığımız fetüslere yapılabilmektedir.
Maternal plazmadaki serbest fetal DNA, plazmada annenin DNA’sı ile birlikte
bulunduğundan her iki DNA’yı ifade eden “total DNA” miktarına hem anne hem fetüste
bulunan beta globin geni ile bakılmıştır. Kantitasyon ile derişim hesaplayabilmek için
hem DYS14 hem de beta globin için standart eğri çalışılmıştır.
A
B
Şekil 23. Total ve Fetal DNA için standart eğrilerin gösterimi. (A) beta globin-total DNA için standart eğri (B)
DYS14-fetal DNA için standart eğri.
Fetal ve total DNA’nın derişimini RT-PCR’de niceleyici olarak saptayabilmek
için derişimi bilinen bir erkek genomik DNA’sından seri seyreltmeler hazırlanarak fetal
ve total DNA için, DYS14 ve beta globinle birer standart eğri elde edilmiştir (Şekil 23).
61
Derişimini bilmediğimiz fetal DNA’ların kantitasyonu bu seri sulandırmalara göre
hesaplanmaktadır. Yukarıdaki şekilde görüldüğü üzere tepkime sırasında hedef miktar
azaldıkça amplifikasyon eğrilerinde sağa doğru kayma görülmektedir. Eğrilerde
tepkimelerdeki hedef miktara karşılık eşik döngüler “crossing point” (CP-eşiği aşma
noktası) olarak adlandırılmaktadır (Bazı araştırmalarda bu değer “cycle threshold (CT)”
(eşik döngüsü) olarak da belirtilmektedir23 (Şekil 24)).
Şekil 24. RT-PCR’de CP değeri ve amplifikasyonun ekran görüntüsü.
Şekil 24’de RT-PCR sonucundaki ekran görüntüsünde analiz programında
amplifiye olan örneklerin CP değerleri (siyah okla işaretlenmiş) görülmektedir. Kırmızı
okla işaret edilen nokta örneğin amplifiye olmaya başladığı döngüyü (yaklaşık 25.
döngü), yani eşik değeri olan CP değerini belirtmektedir. Her örnek 2 kez çalışılarak iki
değerin ortalaması kullanılmıştır.
Aşağıdaki çizelgede HbS taşıyıcısı ve talasemi taşıyıcısı ve kontrol grubundaki
gebelerin plazma DNA’larında bakılan DYS14 düzeyleri ortalama, medyan değerleri
GE/mL cinsinden verilmiştir.
62
Çizelge 10. HbS taşıyıcı ve talasemi taşıyıcı gebelerin maternal plazmadaki fetal DNA düzeyleri.
DYS14
Grup
Ortalama
Medyan
(GE/mL)
(GE/mL)
HbS Taşıyıcı (n=42)
47,2
44,0
Talasemi taşıyıcı (n=23)
44,2
Kontrol (n= 15)
50,7
Aralık
MoM (n, %)*
>1
=1
20-98
39 (% 92,9)
3 (% 7,1)
42,0
20-94
0 (% 0)
23 (% 100)
50,4
45-53
0 (% 0)
15 (% 100)
* p<0,001
Çizelge 10’da erkek cinsiyetin belirteci olan DYS14 ile fetal DNA düzeylerine
bakılmıştır. HbS taşıyıcısı 42 gebenin ortalama DYS14 değeri 47,2 GE/mL, talasemi
taşıyıcısı 23 gebenin ortalama DYS14 değeri 44,2 GE/mL ve kontrol grubunun ortalama
DYS14 değeri 50,7 GE/mL olarak bulunmuştur. DYS14 için gruplar arası MoM
değerleri karşılaştırması Çizelge 10’da görülmektedir. Talasemi taşıyıcısı ve kontrol
grubunda bir değişime rastlanmazken, HbS taşıyıcılarında bu değerde anlamlı bir artış
gözlenmiştir (p<0,001). DYS14 düzeyleri tek başına bakıldığında çok anlamlı
olmamaktadır. Maternal plazma içerisindeki total DNA miktarı (anne ve fetüs
DNA’ları) ile birlikte değerlendirmek gerekmektedir. Bu nedenle plazmadaki total
DNA miktarı için beta globin geni kantitasyonu yapılmaktadır.
Çizelge 11. Beta globin ile maternal plazmadaki total DNA düzeyleri.
Beta globin
Grup
Ortalama
Medyan
(GE/mL)
(GE/mL)
HbS taşıyıcı (n=57)
884,1
864,0
Talasemi taşıyıcı (n=32)
842,8
872,5
Kontrol (n= 15)
812,6
816,0
Aralık
MoM (n, %)*
<1
=1
0 (% 0)
57 (% 100)
368-1416
26 (% 81,3)
6 (% 18,7)
799-823
0 (% 0)
15 (% 100)
447-1584
* p< 0,001
Beta globin geni kantitasyonu, maternal plazmada bulunan hem anneye hem
fetüse ait serbest DNA’ların miktarını ölçmek için kullanılmıştır. 104 gebenin
plazmasından elde edilen fetal DNA’lar beta globin ile analiz edilmiş ve total DNA
miktarı GE/mL cinsinden hesaplanmıştır (Çizelge 11). Gruplar arası beta glonin için
63
MoM değerleri incelendiğinde sadece talasemi taşıyıcılarında diğer gruplara göre
anlamlı bie azalma görülmüştür (p<0,001).
4.4. Gebelik Haftası ile Fetal ve Total DNA Düzeyleri Arasındaki İlişki
Gebeliğin ilerlemesi ile birlikte maternal plazmadaki serbest fetal DNA ve total
DNA artışını gösteren bulgular bulunmaktadır24. Çalışmada yer alan gebelerden 6-17.
Hafta evresinde olanlar “erken gebelik örnekleri” olarak adlandırılmıştır. 18-38. hafta
evresinde olanlar ise “geç gebelik örnekleri” olarak adlandırılmıştır. Cinsiyetin
belirlenmesinde kullanılan yönteme göre gebeliğin erken ve geç döneminde verilerin
değerlendirilmesi Çizelge12’de verilmiştir.
Çizelge 12. Gebelik dönemine göre “nested” PCR ve RT-PCR yöntemleriyle plazmada Y kromozomunun
saptanması.
“Nested” PCR (SRY)
RT-PCR (DYS14)
Olgu (n)
Pozitif (n)
Pozitif (%)
Pozitif (n)
Pozitif (%)
Erken (6-17)
64
59
92,1
64
100
Geç (18-38)
16
16
100
16
100
Gebelik Haftası
RT-PCR ile erken ve geç dönemde maternal plazmada erkek bebek taşıyan gebe
oranı % 100 iken “nested” PCR ile bu oran erken dönemde % 92,1 ve geç dönemde %
100 olarak saptanmıştır (Çizelge 12). Maternal plazmada bakılan serbest fetal ve total
DNA derişimlerinin gebelik dönemine göre karşılaştırılması GE/mL cinsinden Çizelge
13’de verilmiştir.
Çizelge 13. Erken ve geç gebelik haftalarına göre fetal ve total DNA düzeyi medyan değerleri.
Kontrol
Gebelik
Haftası
Erken
Geç
p
Talasemi taşıyıcısı
HbS taşıyıcısı
Fetal DNA
Total DNA
Fetal DNA
Total DNA
Fetal DNA
Total DNA
GE/mL
GE/mL
GE/mL
GE/mL
GE/mL (med)
GE/mL
(med)
(med)
(med)
(med)
50,4
816
41
810
42
820
(n= 8)
(n= 8)
(n=21)
(n=28)
(n=35)
(n=44)
50
814
76,5
1128
85
990
(n= 7)
(n= 7)
(n=2)
(n=4)
(n=7)
(n=13)
0,727
0,602
0,064
0,024
0,001
0,000
64
(med)
Çizelge 13’de orak hücreli ve talasemik fetüs taşıyan gebelerde fetal DNA ve total
DNA miktarları erken ve geç gebelik dönemlerine göre değerlendirilmiştir. HbS
taşıyıcılarında erken ve geç gebelik döneminde fetal DNA düzeyleri ve her iki dönem
total DNA düzeylerinin anlamlı bir şekilde arttığı görülmektedir (p= 0,001 ve p=0,000).
Talasemi taşıyıcıları grubunda fetal ve total DNA düzeyleri erken ve geç gebelik
döneminde artan bir değişim göstermiş, fakat bu değişim fetal DNA düzeylerinde
istatistiksel olarak anlamlı bulunmamıştır. Kontrol grubunda erken ve geç gebelik
dönemleri fetal ve total DNA düzeyleri arasında istatistiksel olarak anlamlı bir fark
gözlenmemiştir. Gebelik haftasının artması ile maternal plazmadaki fetal DNA
düzeyleri (DYS14) artış göstermiştir. Bu iki değişken arasındaki ilişki aşağıda
belirtilmiştir. Şekil 25’te HbS ve talasemi taşıyıcısı gebelerde fetal DNA düzeylerinin
gebelik haftasıyla artığını gösteren grafik verilmiştir. Bu değişkenler arasında pozitif
korelasyon görülmektedir (r = 0,991 ve r = 0,998, p<0,001).
A Kontrol fetüs grubu
B Orak hücreli fetüs grubu
r = -0,044, p = 0,878
C Talasemik fetüs grubu
r = 0,991, p<0,001
r = 0,998, p<0,001
Şekil 25. Kontrol, orak hücreli ve talasemik fetüs gruplarında gebelik haftası ile fetal DNA düzeyleri
arasındaki ilişki.
65
Aşağıdaki şekilde HbS taşıyıcı ve talasemi gruplarında gebelik haftası ve total
DNA düzeyleri arasındaki pozitif korelasyon grafik üzerinde görülmektedir. Gebelik
haftası artışına bağlı olarak, total DNA miktarının anlamlı olarak arttığı saptanmıştır (r
= 0,991 ve r = 0,993; p<0,001). Kontrol grubunda buna benzer anlamlı bir artışa
rastlanmamıştır.
A Kontrol fetüs grubu
B
Orak hücreli fetüs grubu
r = 0,991, p <0,001
r = 0,236, p = 0,396
C Talasemik fetüs grubu
r = 0,993, p <0,001
Şekil 26. Kontrol, orak hücreli ve talasemik fetüs gruplarında gebelik haftası ile total DNA düzeyleri
arasındaki ilişki.
66
Çizelge 14. Erken ve geç gebelik dönemlerine göre gruplarda fetal ve total DNA miktarları arasındaki
ilişki.
Erken Dönem
Grup
DYS14
(GE/mL)
Geç Dönem
Ortalama
HbS (n=35)
40,9
Talasemi (n=21)
41,1
Kontrol (n=8)
p
Grup
Ortalama
HbS (n=7)
78,5
Talasemi (n=2)
76,5
51,0
Kontrol (n=7)
50,3
HbS (n=44)
809,1
HbS (n=13)
1138,0
Talasemi (n=28)
800,3
Talasemi (n=4)
1140,7
Kontrol (n=8)
812,2
Kontrol (n=7)
813,1
0,115
p
0,107
Beta
Globin
0,995
0,001
(GE/mL)
Çizelge 14’de izlendiği gibi DYS14 düzeyleri gebeliğin erken ve geç
dönemlerinde HbS, Talasemi ve kontrol grupları arasında farklı bulunmamıştır. Beta
globin düzeyleri erken dönemde gruplar arasında önemli bir fark gözlenmezken, geç
dönem gebelerde bu gruplar arasındaki beta globin düzeyleri istatistiksel olarak anlamlı
bulunmuştur (p<0,001). Bulguların grafik üzerinde gösterimi Şekil 27’de görülmektedir.
67
Şekil 27. Erken ve geç gebelik gruplarına göre HbS taşıyıcısı, talasemi taşıyıcısı ve kontrol grubu
gebelerde fetal ve total DNA miktarları artışının grafikle gösterimi. (A) Gebelik dönemlerine göre iki
grupta fetal DNA oranları. (B) Gebelik dönemlerine göre total DNA oranları.
4.5. RT-PCR ile HbS Genotiplemesi
Beta geni kodon 6’da yer alan HbS için RT-PCR’de yüksek çözünürlüklü HRM
analizi çalışılmıştır. HbS taşıyıcılarında RT-PCR çıktısında HbS aleli Tm 63°C’de ve
HbA aleli Tm 56°C’de pik vermektedir (Şekil 28).
Şekil 28. HbS taşıyıcı bir örneğin HRM analiz grafiği.
Şekil 28’de kırmızı ile görülen pik HbA alelini ve mavi ile görülen pik HbS
alelini göstermektedir.
68
A
B
Talasemi
taşıyıcı anne
AA Kontrol
Şekil 29. Normal ve HbS taşıyıcısı fetüslerin HRM analizi pik görüntüleri. (A) Genotipi AA belirlenen
fetüsün normal kontrol örneği ile HRM analizi görüntüsü. (B) Talasemi taşıyıcısı anne ve HbS taşıyıcısı
fetüsün HRM analizi grafiği.
Şekil 29A’da fetüsün HRM eğrisi yaklaşık 56°C’de izlenmektedir. Kontrol
örneğinin de (AA genotipi) aynı sıcaklıkta pik yaptığı görülmektedir. Şekil 29B’de ise
talasemi taşıyıcısı olan annenin HRM piki normal kontrolle aynı yerde gelmektedir.
HbS taşıyıcısı fetüsünde ise hem 56°C’de normal piki hem de 63°C’de gelen S piki
görülmektedir.
4.6. Beta Talasemilerde HRM Analizi
Her alele özgül amplikon için farklı sıcaklıklarda belirgin HRM eğrileri
belirlenmiştir. Genotipi bilinen beta talasemi taşıyıcılarının genomik DNA’ları kontrol
olarak kullanılmıştır. Örneklerin sonuçları ARMS, RFLP ve dizi analizi ile
doğrulanmıştır. Mutasyonların taranması için kullanılan primerlerle beta geni 4 bölge
olarak çalışılmıştır.
1. Promotor ve ekson 1 Bölgesinin Mutasyonlarının Taranması;
Bu bölge için kullanılan primerler şu mutasyonları içermektedir; -101 (C→T), -87
(C→T), -30 (T →C), Cap+22 (G→A).
69
A
B
Şekil 30. Promotor ve ekson 1 bölgesinde Cap+22 kontrol ve plazma fetal DNA’da aynı mutasyonun
gösterilmesi. (A) HRM eğrisinin normalize edilmiş halinin görünümü. (B) HRM eğrilerinin görünümü.
Şekil 30’da yeşil ve mavi renkli eğriler Cap+22 mutasyonunu göstermektedir.
Kırmızı eğri ise normal kontrol örneğidir. Cap+22 mutasyonu heterozigot olduğunda,
erime sıcaklıklarında normal alel (86-87°C arasında) ve mutant alelde (88-89°C
arasında) olmak üzere iki farklı noktada değişim gözlenmektedir.
2. 5′UTR-Ekson2 Bölgesinin Mutasyonlarının Taranması;
Bu bölge için kullanılan primerler şu mutasyonları içermektedir; IVSI-1 (G→A),
IVSI-5 (G→A), IVSI-6 (T→C), IVSI-110 (G→A), Cd 15 (G→A), Cd 39 (C→T), Cd
44 (delC).
A
B
Baba
Fetüs
Anne
Fetüs
Şekil 31. (A) Baba ve fetüste saptanan IVSI-1 mutasyonunun HRM analizi ile görüntülenmesi. (B) Anne
ile fetüsün IVS1-110 taşıdıkları HRM analizi.
Yukarıdaki şekil 31A’da plazmada fetüsün babanın mutasyonunu (IVSI-1)
taşıdığı HRM analizi ile belirlenmiştir. Şekil 31B’de anne ve fetüs aynı mutasyonu
70
(IVS1-110) taşımakta olup aynı grup içerisinde tanımlanmıştır. Şekil 31B’deki fetal
örneğin babadan Cd 15 mutasyonunu aldığı da maternal fetal DNA materyalinin sekans
analizi yapılarak gösterilmiştir (Şekil 31). Kontrol olarak ilgili mutasyonları taşıyan
genomik DNA’lar kullanılmıştır. Bu bölgede saptanılan mutasyonlar Çizelge 15’te
görülmektedir.
Cd 15 (G>A)
IVSI-110(G>A)
Şekil 32. Maternal Fetal DNA’da Cd 15 ve IVSI-110 mutasyonlarının sekansla gösterimi.
3. Ekson 2-IVS2 Bölgesinin Mutasyonunun Taranması;
Bu bölge için kullanılan primerler şu mutasyonları içermektedir; IVSII-1 (G→A).
Bu bölgede maternal fetal DNA ve babanın DNA’sıyla yapılan HRM analizinde fetüsün
IVSII-1 mutasyonunu aldığı saptanmıştır (Şekil 33, Çizelge 15). Mavi ile gösterilen pik
baba, pembe ile gösterilen pik fetal DNA’nın erime eğrisidir.
71
Şekil 33. IVSII-1 genotipi taşıyan baba ve fetal DNA’nın HRM eğrisi.
4. IVS2-3’UTR Bölgesinin Mutasyonunun Taranması;
Bu bölge için kullanılan primerler şu mutasyonları içermektedir; IVSII-745
(C→G), IVSII-848 (C→A).
Baba
Fetal DNA
Şekil 34. IVS2-3′ UTR bölgesinde saptanan baba ve plazma fetal DNA’da IVSII-848 mutasyonu HRM
eğrisi.
Bu bölgede saptanan IVSII-848 mutasyonu baba ve fetal DNA’da HRM analizi
ile belirlenmiştir (Şekil 34). Yapılan CVS analizinde sonucun aynı olduğu görülmüştür
(Çizelge 15).
72
Çizelge 15. Maternal fetal DNA ve CVS örneklerinde fetüs genotiplendirilmesinin karşılaştırılması.
Olgu
Anne
Baba
CVS
Fetal DNA
1
HbAS
HbAS
HbAS
HbAS
2
HbAS
HbAS
HbAS
HbAS
3
HbAS
HbAS
HbAS
HbAS
4
HbAS
HbAS
HbAS
HbAS
5
HbAS
HbAS
HbAS
HbAS
6
HbAS
HbAS
HbAS
HbAS
7
HbAS
HbAS
HbAS
HbAS
8
HbAS
HbAS
HbAS
HbAS
9
HbAS
HbAS
HbAS
HbAS
10
HbAS
HbAS
HbAS
HbAS
11
HbAS
HbAS
HbAS
HbAS
12
HbAS
HbAS
HbAS
HbAS
13
HbAS
HbAS
HbAS
HbAS
14
HbAS
HbAS
HbAS
HbAS
15
HbAS
HbAS
HbAS
HbAS
16
HbAS
HbAS
HbAS
HbAS
17
HbAS
HbAS
HbAS
HbAS
18
HbAS
HbAS
HbAS
HbAS
19
HbAS
HbAS
HbAS
HbAS
20
HbAS
HbAS
HbAS
HbAS
21
HbAS
HbAS
HbAS
HbAS
22
HbAS
HbAS
HbAS
HbAS
23
HbAS
HbAS
HbAS
HbAS
24
HbAS
HbAS
AA
AA
25
HbAS
HbAS
AA
AA
26
HbAS
HbAS
AA
AA
27
HbAS
HbAS
AA
AA
28
HbAS
HbAS
AA
AA
29
HbAS
HbAS
AA
AA
30
HbAS
HbAS
AA
AA
31
HbAS
HbAS
AA
AA
32
HbAS
HbAS
AA
AA
Sayısı
73
Olgu
Anne
Baba
CVS
Fetal DNA
33
HbAS
HbAS
SS
HbAS
34
HbAS
HbAS
SS
HbAS
35
HbAS
HbAS
SS
HbAS
36
HbAS
HbAS
SS
HbAS
37
HbAS
HbAS
SS
HbAS
38
HbAS
HbAS
SS
HbAS
39
HbAS
HbAS
SS
HbAS
40
HbAS
Cd 8/ A
S/ Cd 8
S/ Cd 8
41
HbAS
IVS1-6/A
HbAS
HbAS
42
HbAS
IVSI-110/A
S/ IVSI-110
S/ IVSI-110
43
HbAS
IVSI-110/A
S/ IVSI-110
S/ IVSI-110
44
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
45
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
46
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
47
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
48
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
49
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
50
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
51
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
52
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
53
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
54
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
55
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
56
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
57
HbAS
IVSI-110/A
IVSI-110/A
IVSI-110/A
58
Cap +22/A
IVSII-848/A
Cap +22/ IVSII-848
Cap +22/ IVSII-848
59
IVSI-110/A
Cd 15/A
IVSI-110 / Cd 15
IVSI-110 / Cd 15
60
-30/A
-30/A
-30/A
-30/A
61
-30/A
-30/A
-30/A
-30/A
62
Cd39/A
IVS1-6/A
IVS1-6/A
IVS1-6 /A
63
Cd 8/ A
Cd 8/ A
Cd 8/ A
Cd 8/ A
64
IVSI-110/A
IVSII-1/A
IVSI-110/ IVSII-1
IVSI-110/ IVSII-1
65
IVSI-110/A
IVSI-110/A
IVSI-110/ IVSI-110
IVSI-110/ IVSI-110
66
IVSII-745/A
IVSII-745/A
AA
AA
67
FSC 22-24/A
FSC 22-24/A
FSC 22-24/A
FSC 22-24/A
Sayısı
74
Olgu
Anne
Baba
CVS
Fetal DNA
68
Cd 9-10/A
Cd 9-10/A
Cd 9-10/A
Cd 9-10/A
69
IVSII-1/A
IVSII-1/A
IVSII-1/A
IVSII-1/A
70
IVSII-1/A
IVSII-1/A
IVSII-1/A
IVSII-1/A
71
IVSII-1/A
IVSII-1/A
IVSII-1/A
IVSII-1/A
72
Cd39/A
Cd39/A
Cd39/A
Cd39/A
73
Cd39/A
Cd39/A
Cd39/A
Cd39/A
74
Cd39/A
Cd39/A
Cd39/A
Cd39/A
75
Cd39/A
Cd39/A
Cd39/A
Cd39/A
76
Cd39/A
Cd39/A
Cd39/A
Cd39/A
77
IVSI-110/A
Cd 8/ A
IVSI-110/A
IVSI-110/A
78
IVSI-110/A
IVSI-110/A
AA
AA
79
IVSI-110/A
IVSI-110/A
AA
AA
80
IVSI-110/A
Cd 8/ A
AA
AA
81
IVSI-110/A
Cd 8/ A
AA
AA
82
IVSI-110/A
Cd 8/ A
AA
AA
83
Cd 8/ A
Cd 8/ A
AA
AA
84
Cd 8/ A
Cd 8/ A
AA
AA
85
Cd 8/ A
Cd 8/ A
AA
AA
86
Cd 8/ A
Cd 8/ A
AA
AA
87
Cd 8/ A
Cd 8/ A
AA
AA
88
IVS1-1/A
IVS1-1/A
IVS1-1/A
IVS1-1/A
89
IVS1-1/A
IVS1-1/A
IVS1-1/A
IVS1-1/A
Sayısı
Talasemi taşıyıcısı 32 annenin HRM analizinde plazma DNA analizinde 17 fetüs
talasemi taşıyıcısı bulunmuş ve bu sonuçlar CVS ile kontrol edilmiştir. Üç fetüs S/beta
talasemi bulunmuştur. Anne ile babanın aynı talasemi mutasyonunu taşıdıkları durumda
fetüs normal veya mutant ise ayrım yapılabilmiştir. Fetüsün taşıyıcı olduğu durumda
anne ve babadan ayırt edilememiştir (Çizelge 15).
.
75
5. TARTIŞMA
Girişimsel olmayan prenatal tanı, medikal genetiğin uzun araştırmalar
sonrasında ulaştığı hedeflerinden birisi olmuştur4. Maternal kanda fetal hücrelerin
keşfinden bu yana fetal genetikte, bunların bir tanı aracı olarak kullanılabilmesi
amacıyla çalışmalar çok büyük bir ilgiyle sürdürülmektedir95. Bu çalışmalar daha
uygulamaya geçmeden, maternal dolaşımda önemli düzeyde serbest nükleik asitlerin
varlığının bulunması, girişimsel olmayan yeni prenatal genetik testlerin gelişmesine
büyük bir ivme kazandırmıştır22,95. Bu gelişmeler içerisinde çeşitli uygulamalar, hızla
kliniğe uygulanmaya başlanmıştır. Bunlar arasında; cinsiyete bağlı hastalıklarda fetal
cinsiyet tayini, RhD (-) gebelerde fetal RhD durumunun incelenmesi sayılabilir96,97.
Günümüzde fetal genetik hastalıkların tanısında fetal örnekleme, amniyosentez
ve koriyonik vilüs dokusundan yapılmaktadır. Bu yöntemlerin anne ve fetüs üzerinde
küçük, ama önemli riskleri bulunmaktadır95,98. Maternal dolaşımda bulunan serbest fetal
genetik materyallerle yapılan işlemlerde risklerin bulunmaması, çalışmaların bu yöne
kaymasına neden olmuştur. Çalışmamızda, girişimsel prenatal tanıda kullanılan
yöntemlerden birisi olan koriyonik vilüs örneklemesine seçenek oluşturabilecek,
girişimsel olmayan bir yöntem olan maternal plazmadaki serbest fetal DNA kullanarak
yapılan çalışmaların sonuçları, geleneksel yöntemlerle karşılaştırılmıştır.
Plazma veya serumdan elde edilen DNA’nın moleküler tanıda kullanımı 1996’da
pek çok araştırmacı tarafından ilgi uyandırmıştır99. Kanser hastalarında serbest dolaşan
tümör DNA’larının varlığının ortaya çıkarılmasının ardından, ilk kez Lo ve ark.
tarafından 1997’de, gebelerde annede var olmayan Y kromozomuna özgül dizileri,
maternal plazma/serumdaki serbest fetal DNA ve eritroblastlarda tanımlanmıştır22.
Maternal plazmada bulunan serbest fetal DNA, Rh faktörü, miyotonik distrofi,
akondroplazi, beta talasemi, konjenital adrenal hiperplazi gibi çeşitli kalıtsal
hastalıklarda, annede bulunmayan fetal lokusların, girişimsel olmayan yöntemle
saptanabilmesine olanak sağlamaktadır. Fetal DNA’nın maternal plazmadaki toplam
DNA miktarı içerisinde az bulunması, özellikle bahsedilen tek gen bozukluklarının
prenatal tanısının uygulanmasını güçleştirmektedir99. Bu nedenle bu genetik materyalin
76
anne kanında miktarını arttırmaya yönelik veya farklı hastalıklar için değişik
belirteçlerin bulunmasına yönelik geniş çaplı çok merkezli çalışmalar yürütülmektedir84.
Maternal plazma, prenatal genetik analizler için kolay ulaşılabilir ve yararlı bir
kaynak oluşturmaktadır23. Lo ve ark. 1997’de yaptıkları çalışmada Y kromozomuna
duyarlı PCR yöntemi ile 12-40 haftalar arasındaki 30 gebenin plazma örneğinde Y
kromozomunu saptama oranını % 80 bulmuşlardır22. Al-yatama ve ark. 2001’de
“nested” PCR yöntemi ile 80 gebede Y kromozomuna özgü dizileri % 96 oranında
saptamışlardır90. Bizim çalışmamızda, “nested” PCR ile gebelik haftaları 6-29 arasında
olan 104 gebe plazmasında Y kromozomu SRY lokusu saptama oranı % 93,7 olarak
belirlenmiştir. Bu oran doğum sonrasında aileler telefonla aranarak cinsiyetler
doğrulandıktan sonra hesaplanmıştır. “Nested” PCR ve Multipleks PCR ile SRY
lokuslarına bakılarak yapılan cinsiyet belirlemesinde 5 olgunun yanlış negatif olarak
belirlendiği gözlenmiştir (Çizelge 12). Yanlış negatif olgular erkek yerine dişi cinsiyet
olarak adlandırılmıştır. Bu yöntemlerle gebeliğin erken dönemlerinde fetal cinsiyet
saptanabilmesine rağmen erken dönemlerde, diğer dönemlere göre yanlış negatif sonuç
çıkabildiği bildirilmiştir22,23,90. Bunun nedenleri arasında, gebeliğin ilk üç aylık
dönemlerinde plazmada fetal DNA miktarının ileri dönemlere göre düşük derişimlerde
ve boyutunun küçük olması sayılabilir6. Bunun yanı sıra, yanlış negatif sonuçlar plazma
fetal DNA’sının gebeliğin çok erken devrelerinde çok az miktarlarda bulunması
nedeniyle fetal DNA’nın duyarlı olarak saptanamamasından kaynaklanabilmektedir.
Bizim çalışmamızdaki yanlış negatif olguların, 7nci ve 8nci gebelik haftasındaki olgular
olması, bu nedenleri doğrular niteliktedir.
Cinsiyet belirlenmesinde kullanılan diğer bir yöntem de RT-PCR’dir. Bu
yöntemle Y kromozomuna özgül diğer bir lokus olan DYS14 ile cinsiyetler belirlenmiş
ve sonuçların doğum sonrası öğrenilen sonuçlarla tam olarak örtüştüğü görülmüştür.
Cinsiyet belirlemede RT-PCR yönteminin ve çoklu DYS14 lokusunun Y kromozomunu
saptamada daha duyarlı olduğu düşünülmektedir. Diğer yöntemlerin PCR sonrası
işlemlerinin, zaman alıcı olması, sonucun daha uzun sürede alınmasına da neden
olmaktadır. Bu noktada, RT-PCR daha kullanışlı bir yöntem olarak öne çıkmaktadır.
77
Bazı araştırmacılar fetal DNA derişimlerindeki değişimlere bakarak bunun
gebelik komplikasyonundan mı yoksa genetik bir bozukluğa mı bağlı olduğunu
araştırmışlardır. Maternal plazma ve serumda bulunan fetal DNA’nın, maternal plazma
derişimi değişimlerini gözlemek ve moleküler tanıda bunun nedeninin araştırılması için
çeşitli belirteçler kullanılarak miktar tayini yapılmaktadır3,24,100. Lo ve ark. 1998’de
maternal plazma ve serumda fetal DNA’nın kopya sayılarını ölçebilecek RT-PCR
yöntemini kullanmışlardır. Bu yöntemde SRY gen dizisini kullanılarak fetal DNA
miktar tayini ve beta globin gen dizisi kullanarak da plazmadaki anne ve fetüsün total
DNA miktar tayinini yapılmıştır23. 2006’da Zhong ve ark. RT-PCR yöntemi ile fetal
DNA ölçümünü, DYS14 ve SRY genlerinin her ikisini de kullanarak yapmışlardır84.
SRY ve DYS14 lokuslarını değerlendirdiklerinde, DYS14 lokusunun duyarlılığının
SRY lokusuna göre daha fazla olduğunu ortaya koymuşlardır. Gerovassili ve ark.
2006’daki çalışmalarında orak hücre anemili ve normal gebelerde fetal DNA
düzeylerini arasında bir fark gözlememişlerdir107.Çalışmamızda RT-PCR yöntemi ile
fetal DNA miktarı için DYS14 gen dizisi, total DNA miktarı için de beta globin geni
belirteç olarak kullanılmıştır. Talasemi ve orak hücre taşıyıcısı olan, erkek fetüs
taşıdıkları saptanan gebelerin fetal (DYS14) ve total DNA (beta globin) düzeylerine
bakıldığında, her iki değişkenin de düzeylerindeki artışın gebelik ilerledikçe bariz
olarak arttığı görülmektedir. Orak hücre taşıyıcısı 42 gebede, DYS14 düzeyleri 47,2
GE/mL olarak bulunurken, beta globin düzeyleri 884,1 GE/mL bulunmuştur. Kontrol
grubuna göre beta globin düzeyinde bir artış izlenmektedir. Talasemi taşıyıcısı 23
gebede DYS14 düzeyi 44,2 GE/mL iken beta globin düzeyi 843,8 GE/mL bulunmuştur.
Kontrol grubunda DYS14 düzeyi 50,7 ve beta globin düzeyi 812,6 GE/mL bulunmuştur
(Çizelge 10-11). Grupların kendi içinde fetal ve total DNA düzeyleri karşılaştırıldığında
orak hücre anemisi taşıyıcılarında erken ve geç gebelik dönemlerindeki artış bariz
olarak göze çarpmaktadır. Talasemi ve kontrol grubundaki artışlar anlamlı
bulunmamıştır (Çizelge 13). Talasemi taşıyıcısı grupta, sayısal artış varken, istatistik
anlam ifade etmemesi örnek sayısının az olması ile açıklanabilir. Kontrol grubunda bu
değişkenler arasında bir fark göze çarpmamaktadır.
Gruplar arasında MoM değerleri irdelendiğinde, DYS14 için orak hücreli 39 ( %
92,9) fetüsün kontrol grubuna göre 1’in üzerinde MoM değerine sahip olduğu
78
gözlenirken, talasemik gen taşıyan 23 (% 100) fetüsün MoM değerleri 1’in altında
izlenmiştir (Çizelge 10). DYS14 MoM değeri gebeliğin ilk iki trimestirinde izlendiğinde
bize özellikle orak hücre anemisi açısından fetüsün etkilenmesi konusunda aydınlatıcı
bir ön bilgi verebileceği düşünülmektedir. Beta globin için MoM değerlerine
bakıldığında, talasemik gen taşıyan 26 fetüsün (% 81,3) beta globin MoM değerlerinin
1’in altında olduğu gözlenmiştir (Çizelge 11). Beta talasemik gen taşıyan fetüslerde
MoM değerinin azalması, beta genindeki sentez azlığı veya yokluğu sonucuyla
örtüşmektedir. Orak hücreden etkilenen fetüslerde beta globin MoM değerleri kontrol
grubu ile aynı bulunmuştur.
Gebeliğin ilerlemesi ile maternal kanda fetal DNA düzeylerinin de arttığı
bilinmektedir. Bu artışta fetal ve total DNA arasında önemli bir korelasyon olduğu
gösterilmiştir23,75,100. Bazı araştırıcılar bu korelasyonu, total DNA ile değil sadece fetal
DNA ile göstermişlerdir101. Bauer ve ark. fetal ve total DNA’nın korelasyon
gösterdikleri, fakat bunların gebelik haftasıyla korelasyon göstermediğini ifade
etmişlerdir69,75. Wataganara ve ark. 2004’te ilk trimestirde haftalık fetal DNA artışını
normal gebeliklerde göstermiştir102. Tjoa ve ark. 2006’da ilk trimestirde bu artışı her
hafta arttığını belirtmişlerdir58. Stanghellini ve ark. 2006’da sadece fetal DNA düzeyleri
artışında gebeliğin erken ve geç dönemlerinde korelasyon olduğu fakat total DNA’da
böyle bir ilişki olmadığını açıklamışlardır101,103. Yin ve ark. 2007 yılında gebelik
haftasının ilerlemesiyle fetal ve total DNA düzeyleri arasında önemli bir korelasyon
gözlemişlerdir100. Bizim çalışmamızda erken dönem (6-17. hafta) ve geç dönem (18-38.
hafta) fetal DNA düzeylerinde kontrol grubu dışındaki diğer gruplarda kendi içerisinde
sayısal artışa bağlı bir korelasyon gözlenmesine karşılık bu artış istatistiksel olarak
anlamlı bulunmamıştır (Çizelge 13, Şekil 25 A-C). Fetal DNA düzeyi DYS14 lokusu ile
sadece erkek cinsiyette değerlendirildiği için dişi cinsiyetler değerlendirme dışı
kalmakta ve bu nedenle de gruplarda bulunan örnek sayısı istatistik değerlendirmede
yetersiz olmaktadır (Çizelge 14, Şekil 27A). Erkek cinsiyet sayısının artırılması ile
anlamlı bir fark gözleneceği düşünülmektedir. Erken ve geç gebelik dönemleri beta
globin düzeylerine bakıldığında kontrol grubu dışında diğer gruplarda artan bir
korelasyona rastlanmaktadır (Çizelge 13, Şekil 26 A-C). Gruplar arasındaki ilişkiye
bakıldığında geç dönem beta globin düzeylerinde istatistiksel olarak anlamlı bir fark
79
göze çarpmaktadır (Şekil 27B). Fetal yaşamda gebeliğin 6. haftasından itibaren beta
zincir sentezinde artma gözlenmektedir104. Bu bilgi kapsamında beta zincir sentezinde
oluşan bozukluk veya nokta mutasyonu sonucunda, dolaşımda serbest kalan fetal DNA
miktarında artışın meydana gelebileceği ve bu nedenle de kontrol grubuna göre orak
hücreli ve talasemik fetüslerde beta globin düzeylerinin artışının bu hastalıktan
etkilenme açısından fikir verici bir değişken olabileceği düşünülmektedir.
Değişik çalışmalarda bildirilen fetal ve total DNA düzeyleriyle ilgili farklı
sonuçların çeşitli açıklamaları olabilir. Bunlardan birisi, örneklerin toplandığı
dönemdeki annenin gebelik haftasına bağlı olarak değişenlik gösteren fetal ve total
DNA derişimleridir23. Ayrıca, kanın alınmasında kullanılan tüpler ve fetal DNA
izolasyon yöntemleri de farklılık yaratmaktadır72,105. Kan örneklerinin EDTA, heparin
veya sitrat gibi total DNA ölçülmesinde bir belirteç olarak kullanılan antikoagülan
içeren tüplere alınması beta globin DNA derişimi ölçümünde 24 saat içinde bir sorun
yaratmadığı gözlenmiştir. 24 saatten fazla zaman sürecinde EDTA’lı tüplere alınan
kanda, sitrat ve heparine nazaran en az değişim gözlenmiştir106. Bu nedenle
antikoagülan olarak EDTA tercih edilmektedir. Bizim çalışmamızda EDTA’lı tüpler
tercih edilmiş ve tam kandan plazmalar 1 saat içerisinde ayrılmıştır. Tam kandan
plazma ayrılırken kullanılan santrifügasyon işlemlerinin değişimi de özellikle, total
DNA miktarları üzerinde değişim meydana getirdiği gözlenmiştir100,105. Farklı
santrifükasyon
yöntem
protokolleri
dahi
fetal
DNA
ölçümlerini
etkileyebilmektedirler105. Bunun yanında Percoll ayırma gradienti gibi seçenek
yöntemlerle
plazmadaki
105
artırılabilmektedir
hücreler
zenginleştirerek
total
DNA
derişimi
. Bizim çalışmamızda plazma ayrımı 5500 rpm ve ardından 9200
rpm olmak üzere iki aşamalı santrifüj işlemi yapılarak sorun kısmen çözülmüştür.
Maternal fetal DNA’nın varlığını ortaya koymada kullanılan belirtecin ve yöntemin
fetal DNA sonuçlarını etkilediği düşünülmektedir. Çalışmamızda “nested” PCR,
multipleks PCR yöntemleri kullanılmıştır. Bununla birlikte, küçük miktarlardaki
maternal fetal DNA miktarını saptamada, yöntemin duyarlılığı da önem kazanmaktadır.
Bu noktada RT-PCR, “nested” ve multipleks PCR yöntemlerinin’ye göre az miktardaki
örnekleri saptamadaki duyarlılığı ve diğer iki yönteme göre kontaminasyon riskinin
düşük olması, maternal fetal DNA analizlerinde tercih edilme nedenleri arasında
80
sayılabilir. Bu nedenle, çalışmamızda ayrıca RT-PCR yöntemi de örneklerin
çalışılmasında tercih nedeni olmuştur.
Çalışmamızda fetal DNA genotiplemesi için uyguladığımız yöntem, HRM
analizidir. Bu analiz bir çeşit tarama tekniği olup genotiplemede kullanılabilmektedir110.
HRM analiziyle orak hücre ve beta talasemi taşıyıcısı gebelerde, uygulaması kolay ve
girişimsel olmayan bir yöntemle maternal kandaki fetal DNA’nın genotipi belirlenmeye
çalışılmıştır. HRM analizinde RT-PCR tekniği kullanılmış ve fetal DNA HRM analizi
yapılmıştır. Orak hücre anemisinde beta geninin sadece mutasyonu kapsayan bölgedeki
amplifikasyonu ile HRM analizi yapılmış; beta talasemilerde beta geni dört bölge
halinde gruplandırılarak mutasyonları belirlenmiştir. Çalışmamızda, ebeveynlerinden
birisinin orak hücre taşıyıcı olduğu olgularda, fetüsün baba veya anneden aldığı diğer
mutasyon veya normal alel, kontrol örnekleriyle karşılaştırılarak HRM analizi ile ortaya
konmuştur. Fetüsün anne ile aynı genotipi taşıdığı ve ayrım yapılamamış olgularda,
fetüsün babadan aldığı anneden farklı mutasyonlar fetal DNA’da gösterilmiştir. Fetal
DNA’nın anneden farklı olarak babadan aldığı mutasyonlar, ilgili mutasyonun kontrol
örnekleriyle karşılaştırılarak başarıyla belirlenmiştir. Anne ve babanın farklı mutasyon
taşıdığı olgularda her iki mutasyon da fetal DNA’da belirlenmiştir. Ayrıca sonuçlar dizi
analizi ve geleneksel yöntemler ile de karşılaştırılmış ve sonuçlar doğrulanmıştır. HRM
analizi, RT-PCR teknolojisine sahip laboratuvarların özellikle babadan kalıtılan
mutasyonların saptanmasında, belirli mutasyonlara göre yörelere özgül problar
tasarlayarak
kolaylıkla
kullanabilecekleri
uygulanabilir
bir
yöntem
olduğu
düşünülmektedir. Bu çıkarım, bu hastalıkların doğum öncesi tanısında girişimsel
yöntemlerin daha az kullanılabileceğini öngörebilir. Talasemilerle ilgili maternal
plazma fetal DNA ile girişimsel olmayan prenatal tanı çalışmalarının ilki Chiu ve ark.
tarafından uygulanmıştır81. Maternal plazma fetal DNA örnekleri 8 gebe kadında
mutasyona özgü RT-PCR kullanılarak çalışılmıştır. Sonuçlar geleneksel prenatal tanı
yöntemleriyle karşılaştırılmıştır. Paternal kalıtılan kodon 41/42 (-CTTT) mutasyonu 8
örnekten 6’sında saptanabilmiştir. Ding ve ark. 2004’te MS analizini kullanmışlardır63.
Li ve ark. 2005 yılında fetal DNA’yı boyut fraksiyonlama yöntemi ile analiz
etmişlerdir6. Diğer bir çalışma, eşleri HbE taşıyan gebe kadınların plazma DNA’sında
HbE’nin saptanmasıyla gerçekleştirilmiştir. Fakat bu yöntem sadece farklı mutasyon
81
taşıyan eşlerle sınırlı kalmaktadır91. Benzer bir çalışmada beta talasemi ve HbE
maternal plazma DNA’sında RT alele özgü PCR yöntemi ile 2007’de Tungwiwat ve
ark. tarafından uygulanmıştır99. Çalışmamızda 57 HbS taşıyıcısı annenin HRM
analizinde plazma DNA’ları analiz edildiğinde aynı genotipe sahip 30 fetüs
saptanmıştır. CVS kullanılarak geleneksel yöntemlerle yapılan karşılastırmada, 23 fetüs
HbS taşıyıcı bulunmuştur. HRM anlizi ile 7 fetüs HbS heterozigot bulunurken,
geleneksel yöntemle bu fetüsler HbS homozigot olarak belirlenmesindeki temel neden;
RT-PCR’nin çok hassas bir yöntem olmasıdır. Bu nedenle arka planda daha fazla
miktarda var olan maternal DNA’nın bu gibi yanlış negatif sonuçlar verebileceği göz
ardı edilmemelidir. Anne ile babanın HbS mutasyonu taşıdığı çiftlerin fetüslerinde
normal genotip taşıyan 9 fetüs HRM ile tespit edilmiş ve geleneksel yöntemlerle bu
sonuçlar doğrulanmıştır. Talasemi taşıyıcısı 32 annenin HRM analizine bakıldığında,
plazma DNA’sında 17 fetüs talasemi taşıyıcısı bulunmuştur. Bu 17 fetüsün 16’sı
anneyle aynı mutasyonu taşımaktadır. Saptanan mutasyonlar arasında 3 fetüs Hb S/beta
talasemi bulunmuştur. Geleneksel yöntemlerle de bu sonuçlar doğrulanmıştır. Anne ile
babanın aynı talasemi mutasyonunu taşıdıkları durumda, fetüs normal veya mutant ise
ayrım yapılabilmiştir. Anne ile babanın farklı mutasyon taşıdıkları durumda fetüsün
babadan aldığı mutasyon HRM ile belirlenmiştir (Çizelge 15).
Maternal plazma fetal DNA analizlerinin, girişimsel olmayan prenatal tanı için
avantajları ve dezavantajları bulunmaktadır. Avantajlarına bakıldığında, paternal
kalıtılan fetal mutasyonların çalışılması ile çift heterozigot gebelik riski ortadan
kalkabilmektedir. Özellikle beta talasemi gibi tek gen bozukluklarında girişimsel
olmayan prenatal tanı için maternal plazma DNA’sının kullanımı gelecekte büyük
umutlar vaat etmektedir6. Paternal kalıtılan ve annede bulunmayan fetal aleller,
maternal plazmada fetüse özgü ayrımı sağlamaktadır4. Maternal plazmada paternal
kalıtılan mutasyonların varlığı veya yokluğunun saptanabilmesi nedeniyle paternal
kalıtılan tek gen bozukluklarının, girişimsel olmayan prenatal tanısı hızlıca uygulamaya
girmeye hazır durumdadır. Bildirilen ilk örnekler arasında akondroplaziler, Hungtinton
hastalığı ve miyotonik distrofilerin girişimsel olmayan prenatal tanısı gelmektedir108,109.
Bu tür kullanılabilirliğini arttıran avantajları yanında, bu uygulamaları kısıtlayan bazı
durumları da göz ardı etmemek gerekmektedir. Farklı merkezlerde yapılan pek çok
82
çalışmada, sonuçlar arasında meydana gelen değişimler, fetal DNA’nın doğru
ölçümünde eksiklikler olduğunu göstermekte; bu da girişimsel olmayan prenatal tanının
fetal DNA saptanmasında uygulanabilirliğini kısıtlamaktadır54. Örnekler çalışılırken
dikkat edilmesi gereken noktalardan birisi, her aşamada birden fazla sayıda çalışılması
gerekliliğidir84. Bu uygulamayla, yanlış pozitif ve yanlış negatif sonuçların azaltılması
için Avrupa Birliği projeleri kapsamında, geniş ölçüde klinik deneyler üzerinde
çalışmalar yapılmıştır24. Bunun yanında, maternal kalıtılan fetal aleller, genotip olarak
maternal DNA ile benzer arka plan oluşturduklarından, maternal plazmada fetal
mutasyonların saptanması mümkün olamamaktadır22. Benzer olarak otozomal resesif
hastalıklarda aynı mutasyonu taşıyan çiftlerde de fetüsün plazmadan genotipi
belirlenememektedir. Maternal plazmadaki toplam DNA içerisindeki fetal DNA’nın az
miktarda olması da, tek gen bozuklukları için uygulamayı kısıtlamaktadır99.
Günümüzde bazı fetal genetik özellikler girişimsel olmayan yöntemlerle
saptanabilmesine rağmen diğer Mendel bozuklukları veya fetal anöploidileri belirleme
için daha pek çok çalışma yapmak gerektiği düşünülmektedir. Üretilen yeni
teknolojilerle gelecekte fetal DNA çalışmaları gittikçe artan bir önem kazanmaktadır.
Son dönemlerde fetal anöploidilerin tanısında serbest fetal RNA kullanımının, önemli
bir belirteç olabileceği ileri sürülmektedir. Çalışmalarda kullanılan olgu sayısı az
olmasına
karşın
bu
durumun
çok
merkezli
çalışmalarla
geliştirilebileceği
düşünülmektedir (SAFE ve NIFTY çalışma grupları gibi)84.
Gelecekte varmak istenen hedefler arasında cinsiyetten bağımsız olarak fetal
DNA’yı saptamaya özgü herkes tarafından kabul gören belirteçlerin bulunması ve
böylelikle dişi fetüslerin de analizinin gerçekleştirilmesi yer almaktadır69. Bunun
yanında maternal plazmada çok az miktarlarda bulunan fetal DNA’nın zenginleştirme
çalışmaları da tanıda doğruluğu artırması açısından önem arz etmektedir.
83
6. SONUÇLAR VE ÖNERİLER
1. Çalışmamız, prenatal tanı amacıyla birimimize başvuran orak hücre ve beta
talasemi taşıyıcısı 89 gebe ve 15 kontrol grubu gebeden oluşmaktadır. Koriyonik vilüs
örneklemesine bir seçenek olarak girişimsel olmayan prenatal tanı tekniklerinden anne
kanından elde edilen fetal DNA ile erkek fetüsler belirlenmiş, fetüsün babadan ve
anneden almış olduğu aleller HRM analizi yanında geleneksel moleküler yöntemler ile
de incelenmiştir.
2. Maternal kandan fetal DNA eldesi sonrasında erkek fetüsler Y kromozomuna
özgül iki farklı belirteç olan SRY ve DYS14 ile belirlenmiş ve bu iki belirteçten
DYS14’ün RT-PCR ile cinsiyet belirlenmesinde daha duyarlı olduğu gözlenmiştir.
3. Gebeliğin ilerlemesiyle birlikte maternal kandaki fetal DNA miktarının da arttığı
görülmüştür. Komplikasyonlu gebeliklerde, fetal DNA miktarının maternal plazmadaki
artışının bilinmesi orak hücre ve talasemi taşıyıcılarında da bir değişim olup olmadığını
düşündürmüştür. Orak hücreli fetüslerde DYS14 ile bakılan fetal DNA miktarı, kontrol
ve talasemi grubuna göre artan MoM değerleri göstermiştir. Talasemik fetüslerde beta
globin düzeyi bakılarak, total DNA miktarının kontrol ve orak hücre taşıyıcısı grubuna
göre azalan MoM değeri gözlenmiştir. Gruplar arasında gebeliğin geç dönemlerinde
beta globin düzeylerinin anlamlı olarak arttığı saptanmıştır. Fetal DNA düzeylerinin de
geç gebelik döneminde sayısal artışı gösterilmiş; fakat erkek cinsiyete sahip örnek sayısı
az olduğundan istatistik anlamlılık gösterilememiştir. Örnek sayısı artırılarak bu farkın
istatistiksel öneminin irdelenmesi gerekmektedir.
4. Fetüsün anneden farklı mutasyon taşıdığı olgularda, maternal fetal DNA’nın
HRM analiziyle fetüsün babadan aldığı mutasyonlar saptanabilmekle beraber, anneyle
aynı aleli taşıyan orak hücreli olgularda ayrım sağlanamamıştır.
5. Maternal fetal DNA, girişimsel olmayan prenatal tanı için kolay elde edilebilir bir
materyal olmasına karşın, erkek fetüs yanında dişi fetüslerin de analiz edilebilmesi için
özgül belirteçlerin bulunması gerekmektedir. Son dönemlerde çalışmalar maternal
kanda fetal RNA yönüne doğru kaymakta ve metilasyon gibi fetüs ve maternal
84
DNA’nın ayrımını sağlayan özelliklerin bulunması bu alandaki çalışmalar için umut
verici gelişmeler olarak görülmektedir.
85
7. KAYNAKLAR
1.
Sürmeliler E. Prenatal tanı amaçlı kromozom analizi gerektiren amniyosentez endikasyonları ve
sonuçlarının değerlendirilmesi. Uzmanlık Tezi, Çukurova Üniversitesi Tıp Fakültesi Kadın
Hastalıkları ve Doğum Anabilim Dalı, Adana, 2005.
2.
Yararbaş K, Ilgın-Ruhi H. Prenatal Tanı. Türkiye Klinikleri Journal of Medical Science, 2006; 26:
666-674.
3.
Harteveld CL, Kleanthous M, Traeger-Synodinos J. Prenatal diagnosis of hemoglobin disorders:
Present and future strategies. Clinical Biochemistry, 2009; 42: 1767-1779.
4.
Chiu RWK, Cantor CR, Lo YMD. Non-invasiveprenatal diagnosis by single molecule counting
technologies. Trends in Genetics, 2009; 25: 324-331.
5.
Wataganara T, Chan AY, Le sHane ES, Sullivan LM, Borgatial L, Bianchi DW, Johnson KL.
Cell-free fetal DNA levels in maternal plasma after elective first-trimester termination of pregnancy.
Fertility and Sterility, 2004; 81: 638-44.
6.
Li Y. Biochemical and Clinical Diagnostic Aspects of Circulating Nucleic Acids. PhD
Thesis,University of Basel, The Sweden, 2005.
7.
Lo YMD, Chiu RWK. Prenatal diagnosis: progress trough plasma nucleic acids. Nature Reviews
Genetics, 2007; 8: 71-77.
8.
Resta RG. The historical perspective: The first prenatal diagnosis of a fetal abnormality. Journal of
Genetic Counseling, 1997; 6: 81.
9.
Chorionic villi of the placenta
Erişim: (http://64.143.176.9/library/healthguide/en-us/support/topic.asp?hwid=tp12660),
Erişim tarihi: 02.04.2010.
2010.
10. Uğurlu T. Fetal kromozomal anomalilerin QF-PCR (Kantitatif floresan polimeraz zincir
reaksiyonu) ile tespiti ve etkinliğinin aminoasit kültürleri ile karşılaştırılması. Uzmanlık Tezi, Ege
Doğumevi ve Kadın Hastalıkları Eğitim ve Araştırma Hastanesi, İzmir, 2007.
11. Amniosentez nedir nasıl yapılır, amniyosentesin riskleri nelerdir?
Erişim: (http://www.gebelikbelirtileri.com/amniosentez.html), 2010.
Erişim tarihi: 12.04.10
12. Koryonik Villus Biyopsi (CVS) Testi: Hastalar ve Aileler İçin Bilgiler
Erişim: (http://www.eurogentest.org/CVSTurkish.xhtml), 2010.
Erişim tarihi: 12.04.10
86
13. Tongprasert F. Cordocentesis of multifetal pregnancies. Prenatal Diagnosis, 2007; 27: 1100–1103.
14. Amniosentez, kordosentez, korion villus biopsisi.
Erişim: (http://annevebebekleri.blogcu.com/amniosentez-kordosentez-korion-villus-biopsisi/4012862), 2010
Erişim tarihi:12.04.10
15. Laigaard J, Sorensen T, Placing S, Holck P, Fröhlich C, Wojdemann KR, et al. Reduction of
the disintegrin and metalloprotease ADAM12 in preeclapsia. Obstetrics and Gynecology 2005;
106:144-149.
16. Traeger-Synodinos J. An evaluation of PGD in clinical genetic services through 3 years application
for prevention of ß-thalassaemia major and sickle cell thalassaemia. Molecular Human
Reproduction, 2003; 9: 301-307.
17. Velde H. Georgiou I, Rycke MDe, Schots R, Sermon K, Lissens W, Devroey1 P, Steirteghem
AV, Liebaers I. Novel universal approach for preimplantation genetic diagnosis of b-thalassaemia
in combination with HLA matching of embryos. Human Reproduction, 2004; 19: 700-708.
18. Preimplantasyon Genetik Tanı
Erişim: (http://www.mikrogenlab.com/Preimplantasyon GenetikTani.aspx),2010.
Erişim tarihi: 12.04.10
19. Walknowska J. Practical and theoretical implications of fetal-maternal lymphocyte transfer. Lancet,
1969; 1: 1119-1122.
20. Bianchi DW. Ciravlating Fetal DNA: Its origin and Diagnostic Potential-A Review. Placenta,
2004; 18: 93-101.
21. Bianchi DW. Fetal gender and aneuploidy detection using fetal cells in maternal blood: analysis of
NIFTY I data. National Institute of Child Health and Development Fetal Cell Isolation Study.
Prenaal Diagnosis, 2002; 22: 609-615.
22. Lo YMD. Presence o ffetal DNA in maternal plasma and serum. Lancet, 1997; 350: 485-487.
23. Lo YMD. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for
noninvasive prenatal diagnosis. American Journal of Human Genetics, 1998; 62: 768-775.
24. Sekizawa A, Purwosunu Y, Matsuoka R, Koide K, Okazaki S, Farina A, Saito H, Okai T.
Recent advances in non-invasive prenatal DNA diagnosis through analysis of maternal blood.
Journal of Obstetrics and Gynaecology Research, 2007; 33: 747-464.
25. Aksoy K, Kayrın L, Tuli A. Mutasyonların tanısında izlenecek yollar. Tanıda Moleküler Genetik
Yöntemler IX. Biyokimya Yaz Okulu Kitabı, 2006: 51-55.
87
26. Old J, Traeger-Synodinos J, Petrou M, Galanello R, Angastiniotis M. (2005) Prevention of
Thalassemias and other haemoglobin disorders. Vol 2: Laboratory Methods. Published by
Thalassemia International Federation (TIF). Nicosia, Cyprus.
27. Cheng J, Kasuga T, Mitchelson KR, Lightly ER, Watson ND, Martin WJ, Atkinson D.
Polymerase chain reaction heterodublex polymorphism analysis by entangled solution capillary
electrophoresis. Journal of Chromatographic Science. 1994, 677: 169-177.
28. Larsen LA, Christiansen M, Vuust J, Andersen PS. High Throughput Mutation Screening by
Automated Capillary Electrophoresis. Combinatorial Chemistry & High Throughput Screening,
2000; 3: 393-409.
29. Huber CG, Premstaller A, Xiao W, Oberacher H, Bonn GK, Oefner PJ. Mutation Detection by
Capillary Denaturing high-performance liquid chormatography using monolithic columns. Journal
of Biochemical and Biophysical Methods. 2001; 47: 5-19.
30. Delwart EL, Shpaer EG, Louwagie J, McCutchan F, Grez M, Waigmann HR, Mullins JI.
Genetic relationships determined by a heteroduplex mobility assay: analysis of HIV env genes.
Science, 1993; 262:1257-1261.
31. Palais RA, Liew MA, Witwer CT. Quantitative heteroduplex analysis for single nucleotide
polymorphism genotyping. Analytical Biochemistry, 2005; 346:167–175.
32. Kozlowski P, Olejniczak, Krzyzosiak WJ. Rapid Heterodublex Analysis by Capillary
Electrophoresis. Clinica Chimica Acta. 2005; 353: 209-214.
33. Murphy KM, Hafez MJ, Philipis J, Yarnell K, Gutshall KR, Berg KD. Evaluotion of
Temperature Gradient Capillary Electrophoresis for Detection of Factor V Leiden Mutation. Journal
of Molecular Diagnostics. 2003; 7(11): 335-340.
34. Murphy K, Berg KD. Mutation and single nucleotide polymorphism detection using temperature
gradient capillary electrophoresis. Expert Review of Molecular Diagnostics. 3(6); 2003: 811-818.
35. Fodde R, Losekoot M. Mutation detection by denaturing gradient gel electrophoresis (DGGE).
Human Mutation. 1994; 3:83-94.
36. Oefner PJ, Underhill PA. DNA mutation detection using denaturing high performance liquid
chromatography (DHPLC). In Current protocols in human genetics; Dracopoli NC. et al., Ed.; John
Wiley & Sons, Inc.: New York, 1998; 7.10.1-7.10.12.
37. Hung CC, Chien SC, Su YN, Chern JPS, Lın KH, Lin WL. Denaturing high-performance lıquid
chromatography: An efficient screening approach in the genetic diagnosis of hemoglobin
Hammersmith. Biomedical Engineering Applications Basis & Communications, 2006; 18: 343-347.
38. Savlı H, Hatırnaz Ö. Sayımsal. Gerçek zamanlı-polimeraz zincir reaksiyonu ve hematolojik gen
anlatım analizleri. Türkiye Klinikleri Journal of Medical Science, 2004; 24: 653-660.
88
39. Günel T, Gen anlatımının kantitatif analizi Real-time PCR, Türkiye klinikleri, Journal of Medical
Science, 2007;27:763-767.
40. Real-Time PCR: from theory to practice.
Erişim: (http://tools.invitrogen.com), 2009.
Erişim tarihi: 10.07.2009
41. Sayitoğlu MA. Hematolojide Real Time PCR. İst. Üniv. Deneysel Tıp Araş. Enst. Temel moleküler
hematoloji kursu, İstanbul-Türkiye.
Erişim: (http://www.thd.org.tr/doc/kurs_pdf/mugeaydinsayitoglu.pdf), 2010.
Erişim Tarihi: 07.01.2010.
42. Reed GH, Kent JO, Wittwer CT. High-resolution DNA melting analysis for simple and efficient
molecular diagnosis. Pharmacogenomics, 2007; 8(6): 597-608.
43. Luming Z, Wang L, Palais R, Pryor R, Wittwer CT. HighResolution melting analysis
forsimultaneus mutation scanning and genotyping in solution. Clinical Chemistry 2005; 51:10
1770–1777.
44. Onay H, Beta-Talasemi Hastalarında MLPA Yöntemi ile HBA Mutasyonlarının Saptanması.
Gaziantep Tıp Dergisi, 2009: 15(1):1-4
45. MLPA – an introduction.
Erişim: (http://www.mrc-holland.com), 2010.
Erişim tarihi: 03.04.2010
46. Erçal D, Prenatal tanıda genetik. Güncel Pediatri, 2008; 6 (1): 47-50.
47. Kurg A, Tonisson N, Georgiou I, Shumaker J, Tollett J, Metspalu A. Arrayed primer extension:
solid-phase four-color DNA resequencing and mutation detection technology. Genetic Testing,
2000;4:1–7.
48. Galbiati S, Foglieni B, Travi M, Curcio C, Restagno G, Sbaiz L. Peptide-nucleic acid-mediated
enriched polymerase chain reaction as a key point for non-invasive prenatal diagnosis of {beta}thalassemia. Haematologica, 2008; 93: 610–4.
49. Huang DJ, Nelson MR, Zimmermann B, Dudarewicz L, Wenzel F, Spiegel R, Nagy B,
Holzgreve W. Reliable detection of Trisomy 21 using MALDI-TOF mass spectrometry. Genetics
In Medicine, 2006; 8 (11): 728-734.
50. Masuzaki H, Miura K, Yoshiura K, Yoshimura S,Niikawa N, Ishimaru T. Detection of cell free
placental DNA in maternal plasma: Direct evidence from three cases of confined placental
mosaicism. Journal of Medical Genetics, 2004; 41: 289–292.
89
51. Cheung MC, Goldberg JD, Kan YW. Prenatal diagnosis of sickle cell anaemia and thalassaemia
by analysis of fetal cells in maternal blood. Nature Genetics, 1996; 145:264– 268.
52. Bianchi DW, Williams JM, Sullivan LM, Hanson FW, Klinger KW, Shuber AP. PCR
quantitation of fetal cells in maternal blood in normal and aneuploid pregnancies. American Journal
of Human Genetics, 1997; 61: 822–829.
53. Al-Mufti R, Hambley H, Albaiges G, Lees C, Nicolaides KH. Increased fetal erythroblasts in
women who subsequently develop pre-eclampsia. Human Reproduction, 2000; 15: 1624–1628.
54. Maron JL, Bianchi DW. Prenatal diagnosis using cell free nucleic acids in maternal body fluits: A
decade of process. American Journal of Medical Genetics Part C (Seminars in Medical Genetics).
2007; 145C: 5–17.
55. Bischoff FZ, Lewis DE, Simpson JL. Cellfree fetal DNA in maternal blood: Kinetics, source and
structure. Human Reproduction Update, 2005; 11: 59–67.
56. Sekizawa A, Samura O, Zhen DK, Falco V, Farina A, Bianchi DW. Apoptosis in fetal nucleated
erythrocytes circulating in maternal blood. Prenatal Diagnosis, 2000; 20: 886–889.
57. Hristoskova S, HolzgreveW, Hahn S. More than one-half of the erythroblasts in the fetal
circulation and cord blood are TUNEL positive. Clinical Chemistry, 2001; 47: 1870–1871.
58. Tjoa ML, Cindrova-Davies T, Spasic-Boskovic O, Bianchi DW, Burton GJ. Trophoblastic
oxidative stress and the release of cell free feto-placental DNA. American Journal of Pathology,
2006; 169: 400–404,
59. Göksu AY, Anne kanında fetüse ait hücreler; Girişimsel olmayan doğum öncesi tanıda kullanımı?
Türkiye Klinikleri Journal of Medical Science,2005; 25: 238-252.
60. Herman JC, Graff JR, Myohanen S, Nelkin BD,Baylin SB.. Methylation-specific PCR: A novel
PCR assay for methylation status of CpG islands. Proceedings of the National Academy of Sciences
of the Unated States of America, 1996; 93: 821–826.
61. Poon LLM, Leung TN, Lau TK, Chow KCK, Lo YMD. Differential DNA methylation between
fetus and mother as a strategy for detecting fetal DNA in maternal plasma. Clinical Chemistry 2002;
48: 35–41.
62. Chim SSC, Tong YK, Chiu RWK, Lau TK, Leung TN, Chan LYS, Oudejans CBM, Ding C,
Lo YMD. Detection of the placental epigenetic signature of the maspin gene in maternal plasma.
Proceedings of the National Academy of Sciences of the Unated States of America 2005;
102:14753–14758.
63. Ding C, Chiu RWK, Lau TK, Leung TN, Chan LC, Chan AYY, Charoenkwan P, Ng ISL, Law
HY, Ma ESK, Xu X, Wanapirak C, Sanguansermsri T, Liao C, Ai MATJ, Chiu DHK, Cantor
CR, Lo YMD. MS analysis of single-nucelotide differences in circulating nucleic acids: Application
90
to noninvasive prenatal diagnosis. Proceedings of the National Academy of Sciences of the Unated
States of America 2004;101:10762–10767.
64. Hamada H, Arinami T, Hamaguchi H, Kubo T. Fetal nucleated cells in maternal peripheral blood
after delivery. American Journal of Obstetrics and Gynecology, 1994;170:1188-93.
65. Kolialexi A, Tsangaris GT, Antsaklis A, Mavroua A. Rapid clearance of fetal cells from maternal
circulation after delivery. Annals of the New York Academy of Science, 2004;1022:113-8.
66. Lo YM, Zhang J, Leung TN, Lau TK, Chang AM, Hjelm NM. Rapid clearance of fetal DNA
from maternal plasma. American Journal of Human Genetics, 1999;64: 218-24.
67. Emlen W, Burdick G. Clearance and organ localization of small DNA anti-DNA immune
complexes in mice. Journal of Immunology, 1988;140:1816-22.
68. Gauthier VJ, Tyler LN, Mannik M. Blood clearance kinetics and liver uptake of
mononucleosomes in mice. Journal of Immunology 1996;156:1151-6.
69. Finning KM, Chitty LS. Non-invasive fetal sex determination: Impact on clinical practice.
Seminars in Fetal and Neonatal Medicine, 2008; 13: 69-75.
70. Costa JM, Benachi A, Gautier E, Jouamnic JM, Ernault P, Dumez Y.. First-trimester fetal sex
determination in maternal serum using real-time PCR. Prenatal Diagonosis, 2001; 21: 1070–1074.
71. Sekizawa A, Tetsuro K, Iwasaki M, Watanabe A, Jimbo M, Saito H, Okai T. Accuracy of fetal
gender determination by analysis of DNA in maternal plasma. Clinical Chemistry, 2001a; 47: 856–
1858.
72. Honda H, Miharu N, Ohashi Y, Samura O, Kinutani M, Hara T, Ohama K.. Fetal gender
determination in early pregnancy through qualitative and quantitative analysis of fetal DNA in
maternal serum. Human Genetics, 2002; 110: 75–79.
73. Hromadnikova I, Houbova B, Hridelova D, Voslarova S, Calda P, Nekolarova K, Kofer J,
Stejskal D, Doucha J, Cinek O, Vavrirec J. Quantitative analysis of DNA levels in maternal
plasma in normal and Down syndrome pregnancies. BMC Pregnancy and Childbirth, 2002; 2: 1-5.
74. Rijnders RJP, van der Luijt RB, Peters EDJ, Goeree JK, van der Schoot CE, Ploos van Amstel
JK, Chistiaens GCML.. Earliest gestational age for fetal sexing in cell-free maternal plasma.
Prenatal Diagnosis, 2003; 23: 1042–1044.
75. Bauer M, Hutterer G, Eder M, Majer S, LeShane E, Johnson KL, Peter I, Bianchi DW, Pertl
B. A prospective analysis of cell-free fetal DNA concentration in maternal plasma as an indicator for
adverse pregnancy outcome. Prenatal Diagnosis, 2006; 26: 831-836.
76. Van der Schoot CE, Hahn S, Chitty LS. Non-invasive prenatal diagnosis and determination of
fetal Rh Status. Seminars in Fetal and Neonatal Medicine, 2008; 13: 63-68.
91
77. Norbury G, Norbury CJ. Non-invasive prenatal diagnosi,s of single gene disorders: How close are
we? Seminars in Fetal and Neonatal Medicine, 2008; 13: 76-83.
78. HbVar: A database of Human Hemoglobin Variants and Thalassemias.
Erişim: (http://globin.bx.psu.edu/cgi-bin/hbvar/counter) 2010.
Erişim tarihi: 22.03.2010.
79. May C, Sadelain MA. Promising genetic approach to the treatment of beta-thallasemia. Trends In
Cardiovascular Medicine, 2001; 11: 276-80.
80. Naro DE, Ghezzi F, Vitucci A, Tannoia N, Campanale D, D’Addario V, Holzgreve W, Hahn S.
Prenatal diagnosis of β-thalassemia using fetal erithroblasts enriched from maternal blood by a novel
gradient. Molecular Human Reproduction, 2000; 6: 571-574.
81. Chiu RWK, Lau TK, Leung TN, Chow KK, Chui DHK, Lo YMD. Prenatal exdusion of β
Thalassemia major by examination of maternal plasma. Lancet, 2002; 360: 998-1000.
82. Li Y, Naro ED, Vitucci A, Zimmermann B, Holzgreve W, Hahn S. Detection of Paternally
Inherited Fetal Point Mutations for β-Thalassemia Using Size-Fractionated Cell-Free DNA in
Maternal Plasma. Journal of the American Medical Association, 2005;293:843-849.
83. Dulaimi E, Uzzo RG, Greenberg RE, Al Saleem T, Cairns P. Detection of bladder cancer in urine
by a tumor suppressor gene hypermethylation panel. Clinical Cancer Research, 2004;10: 1887-93.
84. Hahn S, Zhong XY, Holzgreve W. Recent progress in non-invasive prenatal diagnosis. Seminars in
Fetal and Neonatal Medicine, 2008; 13: 57-62.
85. Puszyk WM, Crea F, Old RW. Noninvasive prenatal diagnosis of aneuploidy using cell free
nucleic acids in maternal blood: promises and unanswered questions. Prenatal Diagnosis, 2008; 28:
1-6.
86. MagNA Pure LC Operator’s Manuel, True Walk-Away Automation for nucleic acid purification.
Roche Applied Science. Mannheim, Germany 2008.
87. Roche MagNA Pure LC, Overview of nucleic acid isolation and purification with the MagNA Pure LC
System
Erişim:(http://www.bsk-bio.co.kr/bbs/view.php?id=recommend_product&page), 2008.
Erişim tarihi: 10.04.2008.
88. Qiagen Product catalog, QIAamp DNA Blood Mini Kit.
Erişim:(http://www1.qiagen.com/Products/GenomicDnaStabilizationPurification/QIAampSystem/Q
IAampDNABloodMiniKit.aspx), 2009.
Erişim tarihi: 12.07.2009
92
89. Detection of HHV-6, EBV and HTLV-2 Genomic DNAs by “Nested PCR”
Erişim: (http://www.ivpresearch.org/nested_pcr.htm), 2009.
Erişim tarihi: 29.09.2009
90. Al-Yatama MK, Mustafa AS, Ali S, Abraham S, Khan Z, Khaja N. Detection of Y
chromosome-specific DNA in the plasma and urine of pregnant women using nested polymerase
chain reaction. Prenatal Diagnosis, 2001; 21: 399-402.
91. Tungwiwat W, Funchopoen G, Ratanasiri T, Scnchaisuriya K, Fucharoen S. Non-invasire fetal
sex determination using conventional nested PCR analysis of fetal DNA in maternal plasma. Clinica
Chimica Acta, 2003; 334: 173-77.
92. Sekizawa A, Jimbo M, Saito H, Iwasaki M, Matsuoka R, Okai T, Farina A. Cell-free fetal DNA
in the plasma of pregnant women with severe fetal growth restriction. American Journal of
Obstetrics Gynecology, 2003; 188:480-484.
93. Glossary of Biochemistry and Molecular Biology.
Erişim:(http://www.genscript.com/product_003/molecular_biology_glossary/id/11941/category/glos
sary/genomic_equivalent.html), 2010.
Erişim tarihi: 01.04.2010.
94. Wittwer CT, Reed GH, Gundry CN, Vandersteen JG, Pryor RJ. High-Resolution genotyping by
amplicon melting analysis using LCGreen. Clinical Chemistry, 2003; 49:6 853–860.
95. Fan HC, Blumenfeld YJ, Chitkara U, Hudgins L, Quake SR. Noninvasive diagnosis of fetal
aneuploidy by shotgun sequencing DNA from maternal blood. Proceedings of the National
Academy of Sciences of the Unated States of America, 2008; 105: 16266-16271.
96. Costa JM, Ernault P. Automated assay for fetal DNA analysis in maternal serum. Clinical
Chemistry, 2002; 48: 679–680.
97. Van der Schoot CE, Soussan AA, Koelewijn J, Bonsel G, Paget-Christiaens LG, de Haas M.
Non-invasive antenatal RHD typing. Transfussion of Clinical Biology, 2006; 13 (1-2): 53-57.
98. ACOG Practice Bulletin. Invasive prenatal testing for aneuploidy. Obstetrics and Gynecology,
2007; 110: 1459-1467.
99. Tungwiwat W, Fucharoen GFucharoen S, Ratansiri T, Sanchaisuriya K, Sae-Ung N.
Appliation of maternal plasma DNA analysis for noninvasive prenatal diagnosis of Hb E-βtahalassemia. Translational Research, 2007; 150: 319-325.
100. Yin A, Ng EHY, Zhang X, He Y, Wu J, Leung KY. Correlation of plasma total cell-free DNA
and fetal DNA levels with short term outcome of first-trimester vaginal bleeding. Human
Reproduction, 2007; 22 (6): 1736-1743.
93
101. Chan LY, Leung TN, Chan KC et al. Serial analysis of fetal DNA concentrations in maternal
plasma in late pregnancy. Clinical Chemistry, 2003; 49: 678-680.
102. Wataganara T, Chen AY, LeShane ES et al. Cell-free fetal DNA levels in maternal plasma after
elective first-trimester termination of pregnancy. Fertility and Sterilility, 2004; 81: 638-644.
103. Stanghellini I, Bertorelli R, Capone L. Quantitation of fetal DNA in maternal serum during the
first trimester of pregnancy by the use of a DAZ repetitive probe. Molecular Journal of Human
Reproduction, 2006; 12: 587-591.
104. Jorgez CJ, Dang DD, Wapner R, Farina A, Simpson JL, Bischoff FZ. Elevated levels of total
(maternal and fetal) b-globin DNA in maternal blood from first trimester pregnancies with trisomy
21. Human Reproduction 2007; 22: 2267-72.
105. Chiu RWK, Pool LLM, Lau TK, Leung TN, Wong EMC, Lo YMD. Effects of blood-processing
protocols on fetal and total DNA quantification in maternal plasma. Clinical Chemistry, 2001; 47:
1607–1613.
106. Lam NYL, Rainer TH, Chiu RWK, Lo YMD. EDTA is a better anticoagulant than heparin or
citrate for delayed blood processing for plasma DNA analysis. Clinical Chemistry, 2004; 50: 256–
257.
107. Gerovassili A, Nicolaides KH, Thein SL, Rees DC. Cell-free DNA levels in pregnancies at risk of
sickle-cell disease and significant ethnic variation. British Journal of Haematology, 2006; 135: 738–
741.
108. Wright CF, Burton H. The use of cell-free fetal nucleic acids in maternal blood for non-invasive
prenatal diagnosis. Human Reproduction, 2009; 15: 139-151.
109. Papasavva T, Kalakoutis G, Kalikas I, Neokli E, Papacharalambous S, Kyrri A, Kleanthous
M. Noninvasive prenatal diagnostic assay for detection of β-thalassemia. Annals of New York
Academy of Science, 2006; 1075: 148-153.
110. Taylor CF, Mutation scanning using high-resolution melting. Biochemical Society Transactions,
2009; 37: 433-437.
94
8. ÖZGEÇMİŞ
1976 yılında Almanya’da dünyaya gelen Ebru Dündar Yenilmez, Almanya’da
başlayan ilköğrenimini Adana’da tamamlamıştır. Orta ve lise öğrenimini Adana’da
tamamladıktan sonra 1996 yılında Ç.Ü. Fen Edebiyat Fakültesi Biyoloji bölümünde
üniversite hayatına başlamıştır. 2000 yılında mezun olduktan sonra aynı yıl Çukurova
Üniversitesi Sağlık Bilimleri Enstitüsü Tıbbi Biyokimya Anabilim Dalı’nda Yüksek
Lisansa başlamış ve 2002 yılı eylül ayında aynı bölümde Araştırma Görevlisi olarak
çalışmaya başlamıştır. 2003 Eylül ayında doktora öğrenimine başlamış, doktora eğitimi
sırasında, 2009 Eylül-Kasım ayları arasında Erasmus staj eğitim programı ile İtalyaBologna Üniversitesi Tıp Fakültesi Hastanesi’ne bağlı bir araştırma laboratuvarında
hücre kültürü ve proteomiks konularıyla ilgili bilgi ve görgü artırıcı çalışmalar
yapmıştır. Evli ve bir çocuk sahibidir.
95