Yaşlıda Sepsis
Gülistan BAHAT ÖZTÜRK
İstanbul Üniversitesi İstanbul Tıp Fakültesi, İç Hastalıkları Anabilim Dalı Geriatri Bilim Dalı
Dünya nüfusu içinde hızla artan yaşlı popülasyonu oranı, klinisyenlerin yaşlı fonksiyonelliği ve/veya mortalitesinde önemli etkisi olan sağlık problemleri ile daha fazla
ilgilenmelerini ve bilgi sahibi olmalarını gerektirmektedir. Bu yazıda, söz konusu sağlık problemlerinden hem
mortalite hem de fonksiyonellikte önemli etkisi olan
“sepsis” gözden geçirilecek, yaşlılardaki sepsis ve ilişkili
kavramların tanımı, risk faktörleri, epidemiyolojisi, patofizyolojik özellikleri, prognostik faktörleri, farklı klinik
özellikleri ve terapötik seçenekleri özetlenecektir.
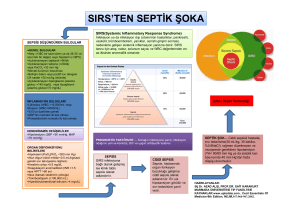
Lökosit > 12,000 /mm3, < 4000 /mm3, veya > %10 çomak
Sepsis: İnfeksiyon sonucundaki disregüle immün cevaba bağlı gelişen klinik sendrom: SIRS’a eşlik eden kültür
ile kanıtlanmış veya görsel olarak saptanmış infeksiyon
varlığıdır.
Ciddi Sepsis: Sepsis’e en az bir adet hipoperfüzyon veya
organ disfonksiyonu bulgusunun eşlik etmesi.
Bu bulgular şunlardır:
Tanım
Sistemik inflamatuvar yanıt sendromu, infeksiyon, bakteremi, sepsis, çoklu-organ disfonksiyonu sendromu ve
septik şok, kavramları birbirleriyle yakın ilişkili kavramlardır. Bu kavramlardan hiçbirinin tanımı yaşlı ve genç
erişkin arasında farlılık göstermemektedir. Sistemik
İnflamatuvar Cevap Sendromu [Systemic inflammatory
response syndrome (SIRS)], sepsis, ciddi sepsis ve septik şok, ilk olarak 1991’de Amerikan Göğüs Hekimleri
Koleji [American College of Chest Physicians (ACCP)]
ve Yoğun Bakım Tıbbı Derneği [Society of Critical Care
Medicine (SCCM)] tarafından düzenlenen bir konsensus
panelinde tanımlanmışlardır.1 Söz konusu tanımlamalar
2001’de ACCP, SCCM, Amerikan Toraks Derneği [American Thoracic Society (ATS)], Avrupa Yoğun Bakım Tıbbı Derneği [European Society of Intensive Care Medicine
(ESICM)] ve Cerrahi İnfeksiyon Derneği [Surgical Infection Society (SIS)]’nin temsilcilerini barındıran “Uluslararası Sepsis Tanımlamaları Konferansı” ile gözden
geçirilmiştir.2 Bu tanımlamaların pratik bir modifikasyonu yayınlanmış olup septik şok için tam hemodinamik
tanımlamalar sağlamaktadır.3 Bunlara göre:
İnfeksiyon: Normalde steril olan dokunun organizmalarca invazyonu.
Bakteremi: Kanda canlı bakteri varlığı.
Sistemik İnflamatuvar Cevap Sendromu (SIRS):
İnfeksiyöz olmayan bir müdahale (örneğin otoimmün
hastalık, pankreatit, vaskülit, tromboemboli, yanıklar,
cerrahi vb.) sonucundaki disregüle immün cevaba bağlı
gelişen klinik sendrom SIRS tanısı aşağıdaki anomalilerden iki veya daha fazlasının olmasını gerektirir:3
Vücut ısısı > 38,5ºC veya <35ºC
Kalp hızı > 90 /dak
Solunum hızı > 20 /dk veya PaCO2 <32 mm Hg
Klinik Gelişim
• Alacalı deri bölgeleri
• Kapiller dolumun >3 saniye olması
• En az 1 saattir idrar çıkışının <0,5 mL/kg olması veya
renal replasman tedavisi altında olunması
• Laktat >2 mmol/L
• Mental durumda ani değişiklik
• Anormal elektroensefalografi (EEG) bulguları
• Platelet <100,000 /mL
• Dissemine İntravasküler Koagülasyon
• Akut Akciğer Hasarı veya Akut Respiratuvar Distres
Sendromu (ARDS)
• Kardiyak disfonksiyon (örn. sol ventrikül sistolik
disfonksiyonu) (ekokardiyografi ile veya doğrudan
kardiyak indeks ölçümü ile)
Septik şok: “Ciddi sepsis”e eşlik eden aşağıdakilerden
bir veya daha fazlasının varlığı:
• Yeterli sıvı resusitasyonuna rağmen sistemik ortalama
kan basıncının<60 mm Hg (bazalde hipertansiyonu
olan bir hastada<80 mm Hg) olması
• Yeterli sıvı resusitasyonuna rağmen sistemik ortalama kan basıncının>60 mmHg (bazalde hipertansiyonu olan bir hastada>80 mmHg) olması için dopamin
>5 mcg/kg/dakika, norepinefrin <0.25 mcg/kg/dak
veya epinefrin <0.25 mcg/kg/dak verilme ihtiyacının
olması
Yeterli sıvı resusitasyonu: 20-30 ml/kg starch, 40-60 mL/
kg salin solüsyonu infüzyonu veya ölçülen pulmoner
kapiller kama basıncı’nın (pulmonary capillary wedge
pressure: PCWP: pulmoner arter oklüzyon basıncı) 1220 mmHg olması olarak tanımlanır. Pulmoner arteriyel
kateter yerine santral venöz kateteri olan olgularda, santral venöz basınç (central venous pressure: CVP) kabul
edilebilir bir alternatif parametredir.
71
2012; 25: 71-81
Septik şok bir tür vazodilatör veya dağılımsal şok tipidir.
Sıklıkla sistemik vasküler dirençteki belirgin düşüş ve
kardiyak debi artışı ile birliktedir.
Refrakter Septik Şok: Sistemik ortalama kan basıncını >60
mm Hg (hastanın önceden bilinen hipertansiyonu varsa >80
mmHg) tutmak için, yeterli sıvı resusitasyonuna rağmen,
dopamin >15 mcg/kg/dakika, norepinefrin>0.25 mcg/kg/
dakika veya epinefrin: >0.25 mcg/kg/dakika vermek gerekiyorsa “refrakter septik şok” varlığından bahsedilir.
Çoklu Organ Disfonksiyonu Sendromu [Multiple organ dysfunction syndrome (MODS)]: Akut olarak hasta olmuş bir kişide ilerleyici organ disfonksiyonu oluşması olup, bu durumda homeostaz, gerekli girişimler
yapılmazsa idame ettirilemez. Hem sepsis hem de SIRS
spektrumunun ciddi düzeyini yansıtır. MODS primer ve
sekonder olarak sınıflandırılır:
Primer MODS: Organ disfonksiyonu erken dönemde
olur ve disfonksiyon oluşan organa olan iyi tanımlanmış
bir müdahale sonucunda oluşur. Disfonksiyon, doğrudan söz konusu müdahalenin sonucudur (örneğin rabdomyolize bağlı böbrek yetersizliği oluşması)
Sekonder MODS: organ yetersizliği, müdahalenin doğrudan sonucu değil, konağın cevabının bir sonucudur
(örneğin pankreatitli hastalarda akut respiratuvar distresin oluşması)
MODS’ta ayrı ayrı organ disfonksiyonlarının genel kabul
gören bir kriteri mevcut değildir. Ancak, PO2 /FiO2 oranı, serum kreatinin düzeyi, platelet sayısı, Glasgow koma
skoru, serum bilirubin düzeyi, basınca göre ayarlanmış
kalp hızı [kalp hızının (CVP/ortama arteriyel basınç) ile
çarpımı olarak tanımlanır] gibi organ spesifik parametrelerdeki ilerleyici anomaliler MODS tanısında sıklıkla
kullanılmaktadır.4
Risk Faktörleri
Sepsis için “risk faktörleri”ne sahip geniş bir popülasyon
vardır. İleri yaş (≥65) bu faktörlerin en önemlilerinden
biridir. Sepsis hastalarının ortalama yaşı 65 civarındadır5 ve sepsis insidansı yaşlılarda orantısız olarak artar.
İlerleyen yaş, ciddi sepsis insidansını ve mortalitesini de
artırmaktadır.5 Yani ileri yaş, sepsise bağlı mortalitede
bağımsız bir prediktördür. Dahası, takipte eks olan yaşlı
sepsis hastaları, hospitalizasyonun daha erken döneminde eks olurlar. Eks olmayan yaşlı sepsis hastaları ise
hastane çıkışında nitelikli hemşirelik ve rehabilitasyon
hizmetlerine daha sık ihtiyaç duyarlar.6
Diğer sepsis risk faktörleri şöyledir:7-11
Yoğun bakım ünitesi (YBÜ) hastası olmak ve nozokomiyal infeksiyon varlığı: Herhangi bir zamanda YBÜ
olgularının %50’sinde nozokomiyal infeksiyon vardır ve
bu nedenle sepsis için yüksek risk altındadırlar.12
Bakteremi: Bakteremi olan hastalarda sıklıkla infeksiyonun sistemik sonuçları gelişir.
İmmünsüpresyon: Konak savunmasını baskılayan
komorbiditeler (örn. neoplaziler, böbrek yetersizliği,
72
karaciğer yetersizliği, AIDS) ve immünsüpresan ilaç
kullanımı sepsis, ciddi sepsis ve septik şok olan olgular
arasında yaygındır. Söz konusu komorbiditeler özellikle
yaşlılarda daha yaygındır ve yaşlılarda sepsisin daha sık
olmasının sebeplerinden birini teşkil etmektedir. Benzer
şekilde yaşlanma ile immün sistemde olan değişiklikler:
immünsenesans görece bir immünsüpresyon durumudur ve yaşlılarda infeksiyonların daha kolay oluşması ve
ilerlemesine sebep olabilir.
Toplumdan kazanılmış pnömoni: Toplumdan kazanılmış pnömoni olgularının sırasıyla %48 ve %5’inde ciddi
sepsis ve septik şok gelişir.13
Genetik Faktörler: Gerek deneysel gerekse klinik çalışmalar, genetik faktörlerin infeksiyon riskini artırdığını
göstermiştir. Söz konusu genetik faktörler tipik olarak
genetik polimorfizmlerdir.14
Epidemiyoloji
İnsidans: Sepsis insidansı yıllar içinde dramatik olarak
artış göstermiştir.15-17 Bu artışta rol alan etmenlerin en
önemlilerinden biri ortalama yaşam süresinin uzamasıdır. ABD’de ≥65 yaş hastalar ciddi sepsis epizodlarının
yaklaşık %60’ından sorumludur ve bu trendin önümüzdeki 20 yıl içinde daha da artış göstereceği öngörülmektedir.15,16,18 Öte yandan yaşlanma dışı sebeplere bağlı
immünsüpresyon olgularının artması ve çoklu-ilaca
dirençli infeksiyonların artmasının da sepsis insidansını
artırdığı düşünülmektedir.19 İnsidans özellikle kış mevsiminde, muhtemelen solunum kaynaklı infeksiyonların
artışı nedeniyle, daha fazladır.20
Patojenler: Sepsis’te rol alan patojenler zaman içinde
değişmektedirler. ABD’de Gram pozitif patojenler en sık
izole edilenlerdir ancak Gram negatif sepsis sayısı da az
değildir. Fungal sepsis sıklığı da artış göstermektedir.15
Martin ve ark., yaşlılarda Gram negatif organizma infeksiyon riskinin arttığını ve yine pulmoner ve genitoüriner
infeksiyon insidansının arttığını saptamışlardır.21
Sepsis ciddiyet düzeyi: Zaman içinde artış göstermektedir. Bir çalışmada 10 yıllık zaman içinde en az 1
organ disfonksiyonunun eşlik ettiği sepsis: Ciddi sepsis
insidansının %26’dan %44’e yükseldiği bildirilmiştir.22,23
Ciddi organ disfonksiyonunun en sık bulguları akut respiratuvar distres sendromu, akut böbrek yetersizliği ve
dissemine intravasküler koagülasyon (DİK)’tir.24
Mortalite: Sepsis hastane içi ölümlerin yaklaşık %20’si
için bir faktördür.5 Sepsis mortalitesi yüksek olan bir
durumdur (%20-50).15,22-28 Bununla birlikte 1970’lerin
sonlarından itibaren mortalite oranları düşmekte gibi
görünmektedir.15,22,23 Beklendiği üzere, mortalite sepsis
ciddiyeti ile koroledir. Ölümlerin çoğu ilk 6 ay içinde
olur ancak sepsis sonrası ilk 1 yıl içinde de artmıştır.29,30
Çok sayıdaki prospektif ve retrospektif çalışmada sepsis
ilişkili mortalitenin yaşlılarda daha yüksek olduğu (%20
-40) gösterilmiştir.31,32 Yaşlılar içinde belki daha önemli
olan bir diğer nokta sepsis sonrası yaşayan olgularda,
hayat kalitesi indekslerinde kalıcı azalma olmasıdır.28 Ely
ve ark. tarafından yapılan bir çalışmada sepsis sonrası yaKlinik Gelişim
G. BAHAT ÖZTÜRK
şayan olgulardan >75 yaş olanların %45’inin bakımevine
yerleştirildiği, %11’inin ise bir başka hastaneye transfer
edildiği saptanmıştır.33
Sepsis Patofizyolojisi
Sepsis infeksiyona karşı gelişen ve hayatı tehdit eden immün cevaptır. Yaşlanma ile immün fonksiyonlarda olan
değişiklikler, bir immün cevap sendromu olan sepsisin
patofizyolojisinde etkilenme ve değişiklikler ile sonuçlanır. Bu aşamada öncelikle yaşlanma ile immün sistemde
olan değişiklikler gözden geçirilecek, sonra bu değişiklikler nedeniyle sepsis patofizyolojisinde yaşlanma ile
olan değişiklikler vurgulanacaktır.
Yaşlanma İle İmmün Sistemin Spesifik
Komponentlerinde Olan Değişiklikler
Tüm immün sistem hücreleri kemik iliğindeki hematopoietik kök hücreler’den (hematopoietic stem cells:
HSC) köken alır ve yaşlanma ile total kemik iliği hematopoietik dokusunda genel bir azalma olur.34 Diğer
hücreler gibi takip eden bölünmeler sırasında HSC’lerde
de progresif bir telomerik DNA kaybı olur. Her bir hücre
bölünmesi ile yaklaşık 50-200 baz çitlik telomerik DNA
kaybı olduğu tahmin edilmektedir.35 Yaşlanma ile telomerik DNA’daki ardışık kayıp ve kısalma, apoptozda
(inflamatuvar olmayan, programlanmış hücre ölümü)
artışa sebep olur. Telomerdeki kısalmaya ek olarak genomik veya mitokondriyal DNA’daki akkiz defektler,
HSC’lerdeki azalmaya katkıda bulunabilir. Toplamda
yaşlılardaki HSC’lerin proliferatif kapasitesi gençlerden
2-3 kat daha azdır.34 Rejenerasyon kapasitesindeki,
farklılıklar özellikle hastalık veya diğer fizyolojik stres
durumlarında önem kazanır.
Yaşlanma ile pro-B hücrelerinin üretimi anlamlı olarak
azalır. Böylelikle kemik iliğini daha az sayıda B hücresi terk eder. T hücre prekürsörleri daha az etkilenir.36
Ancak yaş-ilişkili değişiklikler eritroid ve myeloid progenitör hücreleri etkilemez, hatta myelopoezde artış
gözlenir.37
İmmün sistem kalıtsal (doğumsal) ve akkiz immünite
olarak ikiye ayrılır. Kalıtsal immünite doğumdan itibaren
olan ve mikroorganizma-antijenlere maruziyet sonrası
öğrenilmeyen, adapte edilmeyen veya yeniden organize
edilmeyen immün sistem bileşenidir. Buna karşın adaptif immünite T ve B lenfositlerin cevabından oluşur ve
bireyin antijen maruziyeti ile oluşur ve takiben yeniden
organize edilir. Yaşlanma ile kalıtsal immün sistem genel
olarak daha iyi korunsa da hem kalıtsal hem de adaptif
immün sistem etkilenir.
Kalıtsal İmmün Sistem
Kalıtsal immün sistem epitelyal bariyerler (deri, gastrointestinal ve respiratuvar mukoza), C-reaktif protein,
serum amiloid protein, mannoz-bağlayıcı protein, ve
kompleman proteinleri gibi recognition: tanıma moleküllerinden, makrofajlar, nötrofiller, doğal öldürücü
(natural killer: NK) hücreler ve dendritik hücreler
Klinik Gelişim
(DC)’den oluşur.38 Özgün olmayan savunma mekanizmaları, örneğin mukusun yeterli miktarda ve viskozitede
üretilmesi, lokal antimikrobiyal peptidler ve normal silyer fonksiyon, normal savunma sisteminin bileşenlerindendir. Kalıtsal immün sistemin komponentlerinde çok
sayıda yaş-ilişkili değişiklik olur.
Toplamda, bazı kalıtsal immün sistem mekanizmaları azalsa da, diğer mekanizmalar yaşlılarda daha aktif
durumda görünmektedir. Bu gibi değişiklikler yaşlılarda kronik inflamatuvar bir durum oluşmasına eğilim
oluşturur. Sonuç olarak, yaşlanma ile kalıtsal immün
sistemde oluşan değişikliklerin sonucu “düşük düzeyde
kronik inflamatuvar durum ile sonuçlanan bir immün
disregülasyon durumu” olarak özetlenebilir.39 Kronik viral infeksiyonlar, örneğin CMV infeksiyonu, bu duruma
katkıda bulunabilir.
Normal şartlar altında mikroorganizma ile temas sonrasında kalıtsal immün sistemde olan gelişmeler şöyle
özetlenebilir: Genetik olarak tanımlanmış reseptörler,
mikroorganizmaların çoğunda yüksek oranda korunmuş olan yapılar: “patojen ilişkili moleküler paternler”i
(örneğin lipopolisakkarid, peptidoglikan, lipoteikoik
asitler, mananlar, bakteriyel DNA, çift sarmallı RNA ve
glukanlar) tanırlar.40 Bu moleküllerin soluble: çözünmüş
reseptörleri (örneğin manan bağlayan leptin vb.) kompleman kaskadını başlatırlar.40
Öte yandan “patojen ilişkili paternler”in tanınması için
makrofajlarda ve DC’lerde “patern tanıyıcı reseptörler” olarak adlandırılan başka reseptörler vardır.5 Bu
reseptörler “endositik” ve “sinyalleyici” olarak sınıflandırılırlar. Endositik tipteki patern tanıyıcı reseptörler,
mikroorganizmaların fagositozuna ve lizozoma ulaştırılmalarına aracılık ederler.38 Lizozomlarda mikroorganizmalara ait proteinler, peptidlere degrade edilir. Söz
konusu degrade edilmiş mikroorganizma peptidleri, antijen prezente eden hücre’lerin (antigen presenting cell:
APC) yüzeyinde, majör histokompatibilite kompleksi-II
(majör histocompatibility complex: MHC- II) ile prezente edilirler. “Sinyalleyici tip tanıma reseptörleri” ise
toll-benzeri reseptörler’i (toll-like receptors: TLR) içerir
ve mitojen tarafından aktive edilen protein kinaz aracılığıyla sinyal transdüksiyonu yolaklarını aktive eder.
Mitojen tarafından aktive edilen protein kinazlar yoluyla
nükleer faktör NF-kB aktivasyonu ve sitokinleri kodlayan genleri de içeren çok sayıda genin transkripsiyonu
sağlanır.40,41 İnsanlarda ilk çalışılan TLR, TLR-4’tür ve
lipopolisakkarid: LPS’lerin tanınmasında görev alır.
LPS’nin serumdaki LPS-bağlayıcı protein ile interaksiyonundan sonra, LPS ile LPS-bağlayıcı protein kompleksi
CD14’e bağlanır. CD14, APC’lerin yüzeyinde bulunan
bir reseptördür. Ancak LPS’nin TLR-4 ile interaksiyonu
için başka bir yüzey proteini olan “MD-2” gereklidir.40
“LPS-CD14-MD2 –TLR4” kompleksi, APC’lerdeki sitokin ve CD80, CD86 ekspresyonunu uyarır.40 CD80 ve
CD86 ise T-hücrelerinin aktivasyonu için gerekli olan
yüzey molekülleridir. T hücrelerinde lizozomlarda işlenmiş olan ve MHC-II ile prezente edilen mikroorganizma peptidlerini tanıyan reseptörler vardır. CD80 ve
73
2012; 25: 71-81
CD86 olmadan (yani onu stimüle eden LPS stimulusu
olmadan) tek başına T hücre yüzeyinde olan antijen reseptörünün peptid-MHC kompleksi ile interaksiyonu, T
hücre aktivasyonu için yeterli değildir ve hatta T hücrelerinin kalıcı inaktivasyonu ve apoptozu ile sonuçlanabilir.
Yakın dönemde, insanlarda 10 adet TLR tanımlanmıştır
ve söz konusu TLR’lerin her biri spesifik patojen ilişkili
moleküler paternleri ve bazı insan kaynaklı proteinleri
(pankreatik elastaz gibi) tanır.42 TLR-1, TLR-2 ve TLR-4
sinyallemelerinin regülasyonunda rol oynuyor olabilir.
TLR-2 peptidoglikan (gram pozitif bakteri duvarının
bir bileşeni), lipopeptidler ve lipoproteinlerin reseptörüdür.43 TLR-3 viral çift sarmal RNA’sını, TLR-4 Gram
negatif bakterilerin LPS’sinin ve muhtemelen pankreatik
elastazın reseptörüdür, TLR-9 cPg içeren spesifik bakteriyel DNA paternlerinin reseptörü olup, TLR-6,7,8 ve
10’un görevleri bilinmemektedir.44,45,46
TLR aktivasyonu makrofajlarca çok sayıda proinflamatuvar mediatörün salınmasını tetikler. Bu mediatörler araşidonik asit derivelerini (PG) ve sitokinleri içerir. TNF-alfa
Gram negatif bakteriye karşı oluşan cevaptaki ana mediatördür.47 Neredeyse tüm insan hücrelerinde TNF-alfa
için reseptör vardır. Düşük dozlarda TNF-alfa sitokini
lokal olarak, özellikle lökositler ve endotelyal hücrelere
etki eder ve bakterilerin öldürülmesini ve endotelyal permeabiliteyi artırır. TNF-alfa aynı zamanda IL-1 ve IL-6
salınımını indükler ve faktör VII üretimi yoluyla koagülasyon kaskadını aktive eder. Yüksek konsantrasyonlarda
TNF-alfa, hipotalamus üzerine etki ederek ateş cevabını
indükleyebilir ve hepatositlere etki ederek akut faz serum
proteinlerinin salınımına yol açabilir. TNF-alfa’nın daha
fazla artması miyokard depresyonu ve vazodilatasyon
ile sonuçlanabilir.40,41 TNF-alfa’nın metabolik etkileri
lipoprotein lipaz’ın inhibisyonu ve glukoneogenez’in aktivasyonunu içerir. IL-1 de aktive olmuş makrofajlar ve
endotel hücrelerince üretilir ve TNF-alfaya benzer etkiler
için lenfositler ve endotel hücrelerine etki eder.40 IL-6
ise, TNF-alfa ve IL-1’e cevap olarak makrofajlar, endotel
hücreleri ve diğer hücrelerce üretilir. IL-6 akut faz serum
proteinlerinin sentezini indükler; B hücreleri için bir
büyüme faktörü ve T hücreleri için ko-stimülatördür.40
IL-2 ise sadece makrofajlar ve B-lenfositlerce üretilir.
IL-2, NK hücreleri aktive eder, CD8+ lenfositleri stimüle
eder ve T hepler 1 lenfositlerinden CD4+ T lenfositlerinin diferansiasyonuna yardım eder.40
Aktive olan makrofajlar lenf noduna ulaştığında lenfositlerle interaksiyona girer ve lenfositlere işlenmiş antijenleri sunarlar. CD8+ lenfositler aktive olduğunda sitotoksik
hücreler olurlar; CD4+ lenfositler ise T helper 1 veya 2
lenfositlerine diferensiye olurlar.41 T helper 1 hücreleri,
IL-2, TNF-alfa ve interferon üreten immün modülatör
hücrelerdir. IL-2, T hücreleri için bir büyüme faktörüdür. T helper 2, IL-4 ve IL-10 salınımı üzerinden, allerjik
reaksiyonlarda ve immünsüpresyonda görev alır. IL-2,
makrofajlarca da üretilir ve yine makrofajların TNF, IL-1
ve IL-12 üretmesini inhibe eder. Dahası, IL-2, MHC-II ve
ko-stimülatuvar moleküllerin ekspresyonunu azaltır. IL10 aynı zamanda T-hücrelerinin pek çok fonksiyonunu
inhibe eder.41
74
İşte septik sendromda genellikle önce TNF, IL-1 ve IL-2
tarafından tetiklenen yoğun immün sistem stimülasyonu
olur ve bu da SIRS ile sonuçlanır. SIRS’i takiben IL-10 tarafından idame ettirilen immün sistem inhibisyonu olur
ve “kompansatuvar anti-inflamatuvar cevap sendromu:
compensator anti-inflammatory response syndrome:
CARS” olarak adlandırılır.40 İnflamasyon sistemik hale
geldiğinde endotel hücrelerine yapışmış olan nötrofillerin
diffüz aktivasyonu endotel hasarına ve disfonksiyonuna
sebep olarak fibrin depozisyonuna, permeabilite artışına,
interstisyel ödeme ve dolayısıyla dokulara oksijen sunumunda azalmaya sebep olur. Ek olarak septik hastaların
mitokondrisinde oksijen metabolizması bozulmuştur ve
bu da hücresel enerji eksikliği ile sonuçlanır. Eğer uygun
şekilde müdahale edilmezse, multi-organ yetersizliği
sendromu gelişir ve çok mortaldir.
Eskiden kalıtsal immünitenin yaşlılarda iyi korunmuş
olduğu düşünülse de son dönemdeki çalışmalar anlamlı
değişiklikler olduğunu göstermiştir.47
Kalıtsal immünitenin soluble elemanlarında sorun olmaz.47 Ancak hücresel elemanlarında sayıca değişiklik
olmasa da çok sayıda fonksiyonel bozukluk oluşur.
Makrofajlar: Özellikle makrofaj fonksiyonunda yaşlanma ile ciddi azalmalar olur. Makrofajlar mikroorganizma
saldırısına karşı önemli ilk basamak savunma araçlarıdır.
Makrofajlar, organizmaları tanıyarak, içine alarak, öldürerek, işlenmiş antijenleri T hücrelerine sunarak ve diğer
inflamatuvar hücreleri aktive eden mediatörler salgılayarak fonksiyon görürler.
Yaşlanma ile Kİ makrofaj prekürsörlerinde anlamlı azalma
olur.48 Ek olarak yaşlı rat ve farelerin makrofajlarında, öldürücü aktiviteleri için gerekli olan nitrik oksit ve reaktif
oksijen ürünlerinin üretiminde azalma gösterilmiştir.49
Yaşlılarda makrofaj aktivitesindeki azalma hücre dışı bakteri infeksiyonlarının daha uzun sürmesi ve yara iyileşmesinde gecikme ile sonuçlanabilir. Deri makrofajlarınca
TNF- alfanın yetersiz üretiminin yaşlanma ile DTH testine
cevapta bozulmanın sebebi olduğu bulunmuştur. TLR
ekspresyonu yaşlı farelerde azalmıştır ve daha az cevabi
sitokin salgılarlar.50 Bu da T helper’lardan Th1 cevabının
oluşmasına sebep olabilir.5 Yakın dönemde yaşlı farelerde
azalmış proinflamatuvar sitokin üretimi ve artmış IL-10
üretimi gösterilmiştir.51 Yaşlanma ile olan makrofaj sinyalleme değişimleri TLR’lerde olur ve TLR’ler için mitojen
tarafından aktive edilen protein kinaz seviyesinde bozulmuştur.52 İnsanlarda TLR 1/2 aktivasyonuna bağlı oluşan
monositer sitokin üretiminin azaldığı gösterilmiştir.53
Nötrofiller: Nötrofiller akut inflamasyonda ve bakteriyel
ve fungal organizmalara karşı defansta önemli yeri olan
kısa-ömürlü hücrelerdir. Yaşlanma ile ne kemik iliğindeki nötrofil prekürsörlerinin toplam sayısında ne de
dolaşan perifer kandaki toplam nötrofil sayısında değişiklik olmaz. Ancak, geç erişkinlere göre yaşlı insanlarda
nötrofillerin fagositik yetenekleri azalmıştır. Yaşlılarda
nötrofillerdeki superoksit üretimi konusunda çelişkili
sonuçlar vardır.54 Süperoksit üretiminde defekt ve nötrofil apoptozunda artış gösterilmiştir.55
Klinik Gelişim
G. BAHAT ÖZTÜRK
NK Hücreler: NK hücreler büyük granüler lenfositler
olup sitokin salgılarlar ve tümör hücrelerini ve virüs ile
infekte hücreleri öldürme yetenekleri vardır. CD 56+ ve
CD3-‘lerdir. Periferik kan NK hücreleri %10 oranında
CD56 bright: parlak ve %90 CD56dim: sönük alt gruplarından oluşmaktadır.
azalması olduğu, yaşlılardaki dendritik hücrelerin TLR
fonksiyonunun azalabildiği ve bu azalmanın yaşlıların
influenza aşılanmasına cevabında belirleyici olabileceği
öne sürülmektedir.69,70
CD56parlakCD16sönük NK hücreler primer olarak
IFN-gamma ve kemokinler gibi sitokin üreterek fonksiyon gösterirler ve minimal sitotoksik aktiviteleri vardır.
Adaptif immünite sırasıyla humoral ve hücresel immüniteye aracılık eden B ve T lenfositlerden oluşmaktadır.
CD 56sönükCA16parlak NK hücreler büyük oranda sitotoksiktir ve daha düşük seviyede sitokin üretirler.
Diğer lenfositlerden farklı olarak, NK hücre yüzdesi ve
sayısı yaşlanma ile artış eğilimindendir.56 İki çalışmada
CD56parlakNK hücre sayısının yaşlanma ile azaldığını,
CD56sönük NK hücrelerinin ise yaşlanma ile arttığını
bildirmiştir.57,58 Bunun bir sonucu olarak yaşlı olguların
NK hücrelerinde orta düzeyde IFN-gamma üretim yeteneğinde azalma görülürken NK hücre sitolitik aktivitesinde (antikor bağımlı hücresel sitotoksisite gibi) bir
azalma görülmemiştir.59 Bununla birlikte NK hücrelerinin sitolitik aktivitesinde yaşlanma ile azalma olduğunu
öne süren çalışmalar da vardır.60 Bir başka çalışmada 100
yaşından yaşlı bireylerde NK hücre aktivitesi korunmuş
veya artmış olarak bulunmuştur. Bu veri, NK hücrelerinin başarılı yaşlanma için önemli olduğunu düşündürmektedir.61
NK hücreler yaşlı bireylerdeki infeksiyonun kontrolünde
önemli rol oynayabilirler. Bakımevinde kalan 108 yaşlı
olguyu içeren bir çalışmada düşük NK hücre aktivitesi
ile hem infeksiyon oranında hem de infeksiyonlara bağlı
ölüm oranında artış arasında korelasyon bulunmuştur.62
NK T hücreleri: Doğal öldürücü (NK) T hücreleri
(NKT), T hücrelerinin bir alt grubu olup (CD3+), NK
hücrelerinin bazı özelliklerini paylaşırlar.63 NKT hücreleri heterojen olmakla birlikte çoğunda, Va24/JaQ gen
segmentleri tarafından kodlanan değişmeyen T hücre
reseptörü (T cell receptor: TCR) alfa zincirini eksprese
ederler (-bu hücreler değişmeyen(invariant) NKT hücreleri: iNKT olarak adlandırılırlar).64 NKT hücreleri IFNgama ve IL-4 için önemli kaynaklar olabilir ve bu nedenle
adaptif immün cevabın ayarlanmasında etkili olabilirler.
Yaşlı bireylerdeki lenfositlerin iNKT %sinin daha düşük
olduğu ve var olan iNKT hücrelerinin IFN-gamma’dan
ziyade IL-4 salgıladıkları bildirilmiştir.65-67
Dendritik Hücreler: Dendritik hücreler en potent antijen sunan hücredir. Antijenlerin yakalanması, işlenmesi
ve işlenmiş antijenlerin diğer immün hücrelere sunumu
ile immün cevabın başlatılmasında kritik rol oynarlar.
Aynı zamanda çok sayıda sitokin salgılayarak immün sistemi stimüle ederler ve böylelikle kalıtsal ve adaptif immünite arasında önemli bir iletişim noktası oluştururlar.
Dendritik hücre sayısı (hem myeloid hem de plazmasitoid dendritik hücre subgrupları) yaşlanma ile değişmez.56 İnsan dendritik hücrelerinin immünsenesansı
henüz netleştirilmemiştir.68 Bununla birlikte, yaşlanma
ile plazmasitoid dendritik hücrelerde sayı ve fonksiyon
Klinik Gelişim
Adaptif İmmün Sistem
Hücresel İmmünite
T hücreleri: Yaşlanma ile T hücrelerinde çok sayıda
anahtar değişiklikler olur. İmmünsenesansın en önemli
değişikliklerinden biri timus bezinin involüsyonudur.
Timik İnvolüsyon: Naiv T hücreleri, kemik iliğini terk
eden ve matürasyon için timusa göç eden prekürsörlerden yapılır.
Timus bezi hayatın erken döneminde en aktif düzeyde
olup hayatın ilk yılında maksimum boyutuna ulaşır.
Takiben yaş ile birlikte sürekli geriler. 7 yaş itibarıyla,
aktif hücre replikasyonu olan timus kısmı (timopoietik
alan) toplam timus alanının %10’undan azını kapsar.
Fonksiyonel timik korteks ve medulla progresif olarak
yağ dokusu ile yer değiştirir.71 Bu değişimler yaklaşık
40-50 yaş civarında tamamlanır.71 Timik involüsyonun
bir sonucu olarak timusu terk eden naiv T hücre sayısı
anlamlı olarak azalır ve 40-54, 55-69 ve 70-90 yaş grupları boyunca giderek azalmaya devam eder.72
Yaşlılarda T hücre repertuvarında, naiv T hücrelerinden
memory-T hücrelerine bir kayış vardır47 ve timus atrofisi
ile ilişkilidir. Yaşlılarda, yeni antijenlere karşı koyabilecek naiv T hücre üretimi azaldığından yeni infeksiyonlara karşı koymada azalma vardır.73 Hafıza T hücrelerinin
proliferasyon kapasitesi, naiv T hücrelerine kıyasla daha
azdır ve daha az ko-stimulatuvar molekül eksprese ederler. Dahası yaşlılardaki T hücreleri daha az IL-2 sentezlediğinden, yaşlılardaki T hücrelerinin antijenlere cevaben
daha az proliferatif kapasiteleri vardır ve T hücrelerinin
intraselüler sinyal yolakları da bozulmuştur.74 Çalışmalar
yaşlanan T hücrelerince üretilen sitokin tipleri hakkında
çelişkili sonuçlar vermiştir. Bir çalışmada 90 yaş civarındaki yaşlılarda hem TH1 hem de TH2 sayılarında hem de
TH2/TH1 oranında artış saptanmıştır.75 Diğer çalışmalarda yaşlılarda TH2 sitokinlerinde artış ve TH1 sitokinlerinde artış öne sürülmüştür.76,77 Çok sayıda çalışmada,
yaşlılarda, tip1 sitokin cevabından (IL-2, IFN-gamma,
TNF), tip2 sitokin cevabına (IL-4, IL-10) kayma olduğu
bildirilmiştir.78,79
T hücre alt gruplarındaki değişiklikler: Yaşlanma ile T
hücre fonksiyonunda genel olarak azalma olması aşikardır. T hücre sayısı ve çeşitliliği azalır ve T hücre ekspansiyonu, diferansiasyonu ve sinyalleme gücü (intansitesi)
azalır. Özgün değişiklikler şunlardır:
T hücre reseptör çeşitliliği 65 yaşından sonra dramatik
olarak azalır ve böylelikler repertuvarda anlamlı azalma
oluşur.72 Çeşitliliği olan bir repertuvar özellikle viral
infeksiyonlar olmak üzere çok sayıda yeni infeksiyondan korunmada kritik öneme sahiptir. Sonuç olarak, T
75
2012; 25: 71-81
hücrelerinin yeni antijenlere karşı immün cevap oluşturma yeteneği, yaşlanmayla azalır. 100 yaşından yaşlı
44 olgunun incelendiği bir çalışmada %84’ünde T hücre
reseptör excision circle’ları saptanamamış (TREC’ler de
novo T hücre sentezinin biyomarker’larıdır) olup bu
olgularda düşük sayıda naiv T hücreleri bulunmuştur.80
Buna karşın, terminal olarak farklılaşmış hücrelerin sayısı bu olgularda gençlerden farklı bulunmamıştır. Bu
bulgular, çok yaşlılarda yeni üretilen T hücre sayısında
azalma olduğunu ve T hücre popülasyonunun büyük
oranda persistan ve uzun yaşayan lenfositlerden oluştuğunu düşündürmektedir.
ma ise T helper hücrelerindeki bozulmalar ile ilişkilidir.
Özellikle T helper’lardaki co-stimulatuvar moleküllerin
ekspresyonundaki azalmanın B2 hücre fonksiyonundaki
azalma ile ilişkili olduğu düşünülmektedir.86 Bununla
birlikte önceden B hücrelerine sunulmuş olan antijenlere
karşı B hücre antikor cevabı korunmuştur.47 Buna göre
spesifik antikor seviyeleri (infeksiyon veya aşılanmaya
cevaben üretilen) yaşlanma ile azalır.87 Bazı çalışmalarda,
T hücrelerine benzer olarak, B hücre repertuar çeşitliliğinin yaşlanma ile azaldığı ve bu azalmış repertuarın
“kötü sağlık durumu” veya “kırılganlık” ile ilişkili olduğu
bildirilmiştir.88
Yaşlanmayla CD4 T hücre sayısında azalma ve CD8 T
hücre sayısında artış ve ko-stimulatuvar molekül olan
CD28’de azalma olur. CD28’deki azalma T hücrelerinin
proliferasyon yeteneği ve IL-2 sekresyonunda azalma ile
sonuçlanır.81 CD4 T hücreleri B hücrelerinin stimülasyonunda önemli olduğundan, T hücrelerinin B hücrelerinin
proliferasyonu ve antikor üretimine yardım yetenekleri
yaşlanma ile azalır.82
Hafıza B ve T Hücreleri: Uzun süreli koruyucu hafızanın oluşumu, adaptif immün sistemin en özgün ve
önemli özelliklerinden biridir. Hafıza, bireylerin daha
önce maruz kaldıkları infeksiyonlardan kendilerini korumaları için elzemdir. Timik çıktı azaldıkça, bireyler
infeksiyonlara karşı korunmada daha çok hafıza hücrelerine bağımlı olurlar.
T regülatuvar hücreler (Treg’ler), homeostazın idamesi,
otoimmün cevapların sınırlandırılması ve infeksiyöz
ajanlara ve tümörlere karşı inflamatuvar cevabın modülasyonu ile immün sistemi “kontrol altında “ tutar. 50
yaştan sonra Treg fonksiyonunda azalma olur. Bu, yaşlılarda otoimmünite ve malignitelerdeki artışa katkıda
bulunan bir faktör olabilir.
Humoral İmmünite
B-Hücreleri: B hücreleri kendi yüzey membran Ig’lerini
oluştururlar ve plazma hücrelerine farklılaşırlar. Böylelikle kan ve diğer sekresyonlardaki Ig’leri sentezlerler. Bu
Ig’ler humoral immünitenin mediatörleridir. B hücreleri
antijene maruziyete (örneğin infeksiyon veya aşılanma ile)
antikor oluşturarak yanıt verirler. Söz konusu antikorlar
mevcut infeksiyona karşı savunma ve ilerideki infeksiyonları önlemek üzere antijenlere bağlanır. Naiv B hücreleri
primer olarak IgM üretirler; antijen ile stimüle olduktan
sonra B hücreleri IgG, IgA veya IgE üretimine geçerler. B
hücrelerinin antijenlere cevabı ve antikor üretimi yetenekleri fonksiyonel kapasitelerinin temel ölçütüdür.
Yaşlanma ile adaptif T hücrelerinde oluşan anlamlı değişimler pek tabi ki yeni antijenlere karşı oluşacak olan
humoral immün cevap ile ilişkilidir.5
Kemik iliğindeki B hücre prekürsör sayıları (pre-B hücreleri) ve periferik B hücrelerinin ve plazma hücrelerinin
sayısı yaşlanma ile azalır.5,47,83,84 Bununla birlikte Ig seviyeleri yaşlanma ile değişmez, hatta artabilir.85 Bu artış,
özellikle B1 hücrelerince üretilen Ig’leri kapsar; B2 hücrelerince üretilen Ig’ler ise anlamlı olarak azalmıştır.86 B1
hücreleri antijenlere düşük afinitesi olan Ig’leri ve hatta
otoantikorları (örneğin RF) sentezler ve T hücrelerinden
bağımsızdır.86 Aksine B2 hücreleri ise T hücreleriyle interaksiyona geçerler ve antijenlere yüksek oranda spesifik
olan antikorlar üretirler.86 B1 hücrelerinin baskın hale
geçmesi kısmen yaşlanmanın karakteristiği olan IL-6 seviyesindeki artış ile ilişkilidir ve B2 hücrelerindeki azal76
Naiv B hücreleri ve T hücrelerine kıyasla antijenle yeniden karşılaşma sonrası hafıza cevabı yaşlanma ile görece
olarak iyi korunmuştur.89 Veriler, gençlikte bir antijene
maruz kalınmasından sonra hafıza B ve T hücrelerinin,
immünsenesansın etkilerine oldukça dirençli olduğunu
düşündürmektedir.90,91 Bu fenomene bir örnek yakın
geçmişte 2009’da H1N1 İnfluenza pandemisinde, yaşlıların 1957’deki H1N1 virüsüne cevaben oluşturmuş
oldukları hafıza lenfositlerince ürettikleri nötralize eden
çapraz-reaktif antikorları sayesinde orta yaşlı erişkinlerden daha iyi korunmuş olmalarıdır.92 Yaşlılarda antikorantijen bağlanma derecesi 2009H1 virüsü için orta yaşlı
erişkinlerden daha iyi saptanmıştır.93 Öte yandan, hayvan çalışmaları yaşlı hayvanlarda ilk kez üretilen T hücre
hafızasının kusurlu olduğunu düşündürmektedir.94
Yaşlanmanın Sepsis İlişkili
Apoptoz Üzerine Etkileri
Apoptoz programlanmış hücre ölümünü kapsayan aktif
bir proses olup, apoptoza sebep olan hücresel yolaklar
kaspaz kaskadı ve stres ile aktive olan protein kinaz
yolaklarıdır.95 Kaspazlar proteaz yapısındadır ve aktivasyonları hücre yüzeyinden veya mitokondri’den gerçekleşir.95 TNF, hücre yüzeyinden kaspaz aktivasyonuna
sebep olabilir.96 Mitokondriyel hasar ise mitokondri
ilişkili kaspaz aktivasyonuna sebep olur. Stres ile aktive
olan protein kinaz aracılı apoptoz ise IL-1 ve TNF gibi
çok sayıdaki proinflamatuvar sitokinin hücre içindeki
transdüksiyonunda rolü olan mitofen tarafından aktive
edilen protein kinazların uzamış aktivasyonu ile başlar.97
Yaşlanma ile sepsis’in sebep olduğu apoptoz arasında sinerjizm vardır.98,99 Apoptoza sebep olabilen faktörlerden
biri olan mitokondriyel disfonksiyon, hem sepsisin hem
de yaşlanmanın önemli özelliklerindendir. Hem sepsis
hem de yaşlanma, mitokondride NO ve serbest radikallerin üretimini artırarak mitokondriye hasar verir.99
Yaşlanmanın sepsis ilişkili apoptozu artırması, yaşlılarda
sepsis ilişkili multi-organ yetersizliği ve mortalitenin
daha fazla olmasını açıklamada yardımcıdır.99
Klinik Gelişim
G. BAHAT ÖZTÜRK
Yaşlanma ve Sepsis İlişkili
Koagülasyon Anomalileri
Ciddi sepsis tüm mikro-sirkülasyonda koagülasyon
sisteminin diffüz aktivasyonu ile ilişkilidir.47 Koagülasyon ve inflamasyon sistemleri birbirleriyle etkileşimi
olan ağlardır.47 Proinflamatuvar sitokinler doku faktörü
ekspresyonunu artırarak koagülasyon kaskadını tetiklerler100,101 ve fibrin degradasyonunu bozarlar. Sonuç
olarak tüm mikrosirkülasyonda pıhtılar oluşarak ciddi
sepsiste dokularda hipoperfüzyon oluşur. Öte yandan,
trombin, faktör Xa ve doku faktörü-faktör VII kompleksi
üretimi inflamatuvar cevabı artırır. Çünkü söz konusu
koagülasyon faktörleri lökositler, plateletler ve endotel
hücrelerindeki spesifik proteaz tarafından aktive edilen
reseptörler ile etkileşir ve IL-6 ve IL-8 üretimini indükler.102,103 Dahası, fibrinojen, direkt olarak TLR-4’ü aktive
edebilir.
Öte yandan yaşlanmanın kendisi prokoagülan durum ile
ilişkilidir.104 Sentenerianlarda aktive faktör VII, protrombin, faktör IX, faktör X ve trombin-antitrombin kompleksinin plazma düzeyi genç erişkinlerden daha fazladır.5
Yine fibrin degradasyonunu azaltan plazminojen aktivatör inhibitör 1 düzeyi yaşlılarda daha yüksektir.105 Tüm
bunlar yaşlılarda neden tromboz riskinin arttığını açıklayabilir.106 Yaşlanma ile sepsis’in koagülasyon kaskadı
üzerine olan kombine etkisi yaşlılarda aktive protein C
tedavisinin daha fazla etkili olmasını açıklayabilir.33
Yaşlanma ve Sepsis İlişkili
Kardiyovasküler Tutulum
Yaşlanma sepsis sırasında daha ciddi vazodilatör şok ile
ilişkilidir. Bunun sebebi mitokondriyel disfonksiyondaki
ve nitrik oksit üretimindeki artış olabilir.99 Sepsis ilişkili
miyokard depresyonu TNF, NO ve muhtemelen IL-1 ve
IL-6 gibi diğer inflamatuvar sitokin sebebiyle olur.107-109
Prognostik Faktörler
Sepsis ciddiyetini belirleyen faktörler, pek tabi ki sepsis
prognozunu da belirlemektedir. Bu faktörler infeksiyona
konak cevabı, infeksiyonun bölgesi ve tipi ve antimikrobiyal tedavinin zamanlaması ve tipidir. İleri yaşın kendisi de sepsis mortalitesi için bir risk faktörüdür. Yaşın
mortalite için risk faktörü olması multifaktöriyel olup bu
faktörler eşlik eden komorbid hastalıklar, immünolojik
cevaplardaki bozulma, malnütrisyon, bakımevlerinde
potansiyel olarak dirençli patojenlere maruziyet ve kateter, santral venöz yollar gibi tıbbi gereçlerin sık kullanımıdır.15,16,110 Ek olarak yaşlılarda apoptotik yolaklarda
bir artış söz konusudur ve bu da yaşlılardaki artmış
sepsis mortalitesinin bir sebebi olabilir.5 Yaşlılardaki
sepsisin özgün patofizyolojik ve klinik özellikleri, bu
yaş grubundaki artmış mortalitenin altında yatan sebebi
oluşturmakta ve özellikle bu yaş grubunda yararı olabilecek terapötik stratejiler için olan araştırmaları teşvik
etmektedir.5
Konak Cevabı: Konağın inflamatuvar cevabındaki anomaliler, ciddi hastalığa ve mortaliteye artmış duyarlılığı
Klinik Gelişim
gösterebilirler. Örneğin, ateş cevabının olmaması (vücut
ısısı<35.5C) ve lökopeni (<4000/mm3) sepsisten eks
olanlarda daha sık görülmektedir.111-113
Hastanın komorbiditeleri ve fonksiyonel sağlık durumu
da sepsis prognozunu belirleyen önemli belirteçlerdir.111
Mortalite için risk faktörleri yaş>40 yaş, AIDS; karaciğer
yetersizliği, siroz, kanser, alkol bağımlılığı, ve/veya immünsüpresyondur ve tüm bu faktörler konak cevabını
etkilemektedir.15,16,111,114-117
İnfeksiyon Bölgesi: Sepsisin kaynağı olan infeksiyon
bölgesi de prognozun önemli belirteçlerindendir. Ürosepsiste mortalite genellikle düşüktür.111,118 Bir çalışmada
kaynağı bilinmeyen infeksiyon, GİS infeksiyonu ve pulmoner infeksiyona bağlı sepsiste mortalite oranı %50-55
arasında iken üriner traktus infeksiyonuna bağlı sepsiste
%30 bildirilmiştir.118
Bakteremi oranı sepsis ciddiyeti ile korelasyon gösterir.119 Ancak, pozitif kan kültürünün, sepsis ciddiyeti
üzerine etkisi dışında prognoz üzerine etkisi bulunmamıştır.119 Bu nedenle prognozun altta yatan infeksiyonun
değil toplamda sepsisin ciddiyeti ile ilişkili olduğu öne
sürülmektedir.119
İnfeksiyonun Tipi: Nozokomiyal patojenlere bağlı sepsiste mortalite toplumdan kazanılmış patojenlerden daha
fazladır.120 Kan kaynaklı MRSA, kandida-dışı fungus,
kandida, MSSA ve pseudomonas ilişkili ve polimikrobiyal infeksiyonlarda mortalite daha fazladır.120 Ancak tablo ağırlaştığında (ciddi sepsis veya septik şok), prognoz
Gram negatif ve pozitif bakterilerde benzerdir.7,121
Antimikrobiyal Tedavi: Uygun antibiyotik (AB) kullanımı bakteriemik sepsislerde prognoz üzerine olumlu
etkilidir. Erken-etkili AB kullanımı dirençli AB kullanımına göre mortalitede %50 azalma ile sonuçlanmıştır.113
Ek olarak perfüzyonun erken dönemde agresif olarak
düzeltilememesi mortaliteyi artırabilir.122
Yaşlılarda Sepsisin Farklı
Klinik Özellikleri
Yaşlılardaki sepsisin ilk dönemdeki kliniği oldukça silik olabilir. Bu nedenle bakımevindeki yaşlılar için ateş
eşik değerinin daha düşük olması gerektiği öne sürülmüştür.123 Yaşlılarda dört parametre: “infeksiyonun hızlı
başlaması, ateş, genel durum değişikliği ve infeksiyon
kaynağına ait klinik endikasyon varlığı”nın bağımsız
olarak bakteremi ile ilişkili olduğu saptanmıştır.124 Diğer
bazı otörler infeksiyonun özgün olmayan belirtilerinin
(deliryum, güçsüzlük, anoreksi, halsizlik, düşmeler,
idrar inkontinansı) yaşlılarda sık olduğunu belirtmişlerdir.31,125 Yaşlanma ile olan özgün patofizyolojik değişiklikler, yaşlılarda ciddi sepsis şeklinde hızlı kötüleşme ve
ciddi kardiyovasküler disfonksiyon riskini artırmaktadır.31,47,124 Yaşlanan dokuların karakteristik özeliği olan
“azalmış stres toleransı”, yaşlılardaki çoklu organ yetersizliğin yüksek insidansını açıklamaktadır.5 Yaşlılardaki
ciddi sepsis olgularında daha belirgin vazodilatör hipotansiyon olur.47
77
2012; 25: 71-81
Terapi
Ciddi sepsisi olan yaşlıları uluslararası rehberlere göre
tedavi edilmelidir ancak yaşlılardaki sepsisin farklı patofizyolojisi de göz önünde bulundurulmalıdır.5,126 Sepsis tedavisinde farmakolojik tedaviye ek olarak kaynak
kontrolü ve sıvı terapisi, mekanik ventilasyon ve yapay
beslenme gibi destek tedaviler de uygulanmalıdır. Kaynak kontrolü, infekte yabancı cisimlerin çıkarılması (intravasküler kateter gibi), abse ve sıvı koleksiyonlarının
drenajı gibi girişimleri içermektedir.
Öte yandan yaşlılarda ciddi sepsis ve septik şokun tedavisinde spesifik yönler göz önünde bulundurulmalıdır:
Hedefe Yönelik Tedavi
Ciddi sepsis tanısı konar konmaz CVP: 8-12 mmHg,
ortalama arter basıncı: >65 mmHg, idrar çıkışı> 0.5 ml/
kg/saat ve santral venöz oksijen saturasyonu>%70 olacak şekilde erken resusitasyon yapıldığında mortalitenin
daha düşük olduğu gösterilmiştir ve muhtemelen söz
konusu hedefler yaşlıda da aynıdır.5,127 Bununla birlikte yaşlılarda bu hususta bazı faktörler göz önünde bulundurulmalıdır. Sepsis sırasında gerekli olan kardiyak
output yükselmesi yaşlılarda başlıca sistolik output’un
yükseltilmesiyle elde edilebilir çünkü yaşlılarda kalp hızı
gençlere göre daha az artar. Taşikardi, yaşlanmaya eşlik
eden diastolik disfonksiyon nedeniyle kardiyak output’ta
anlamlı artışı sağlayamayabilir.128 Aşırı sıvı resusitasyonundan da kaçınılmalı ancak yetersiz resusitasyondan da
söz konusu nedenlerle önemle kaçınılmalı ve yaşlıların
sıklıkla dehidrate olduğu unutulmamalıdır. Öte yandan
yaşlılarda sessiz koroner arter hastalığı riski gençlerden
daha fazla olduğundan, dobutamin kullanımında daha
dikkatli olunmalıdır.21 Yaşlılarda kalp hızı artışının daha
zor olduğu (beta reseptör stimülasyonuna direnç nedeniyle) ve söz konusu aminlerin etkinliğinin yaşlılarda
daha az olduğu unutulmamalıdır.5,129 Hedef Hb düzeyi,
doku hipoperfüzyonu, aktif kanama ve koroner arter
hastalığı yok ise 7-9 gr/dL olmalıdır.130 Miyokard infarktüsü varsa Hb: 10-11 gr/dL tutulmalıdır.5,131 Doku hipoperfüzyonu oluşmaktaysa Hb: 10 g/dL tutulmalıdır.127
Antibiyotik Tedavisi
Sepsis tanısını takip eden ilk 1 saat içinde, uygun kültürler alındıktan sonra ampirik antibiyotik (AB) tedavisi başlanmalıdır. Erken dönemde yetersiz AB tedavisi
yüksek mortalite ile tüm yaşlarda ilişkili olduğundan
erken dönemde, muhtemel patojenlere karşı etkili geniş
spektrumlu AB başlanmalıdır.132 Sepsis sıklıkla yaşlıda
çoğu dirençli mikroorganizmalara bağlı gelişir.31 Bu nedenle ilk dönemdeki ampirik AB tedavisi kombinasyon
tedavisi olmalıdır. Yaşlılarda genellikle gram negatif infeksiyonlar olmakla birlikte çoğul dirençli Gram pozitif
infeksiyonlar da yüksek sıklıktadır. Bu nedenle ampirik
AB tedavisi hem Gram (-) hem de Gram (+) mikroorganizmalara karşı olmalıdır.31
Yaşlılarda AB’lerin farmakokinetiği ve dinamiği değişebildiğinden AB ilişkili yan etki riskinin arttığı bilinmelidir.5
78
Zaman bağımlı AB (beta laktamlar, glikopeptidler, linezolid) konsantrasyonlarının idamesi için devamlı infüzyon
tercih edilmeli, konsantrasyon ilişkili AB’ler ise yüksek
bolus doz ile verilmelidir. Aminoglikozidler ise konsantrasyon bağımlı AB’ler olup, renal ve koklear yetersizlik
riskini azaltmak için günde 1 kez olarak uygulanmalıdır.
Aktive Protein C
Uluslar arası rehberlerde, ölüm riski yüksek olan sepsis
olgularının (APACHE skoru25), septik şok olgularının,
en az 2 organda disfonksiyon olan olguların ve sepsis
ilişkili ARDS olan olguların aktive protein C ile tedavi
edilmesini tavsiye etmektedir.126 Aktive protein C’nin
farmakodinamik özellikleri antikoagülan, profibrinolitik, anti-inflamatuvar ve anti-apoptotik etkileri içerir.
Etkinliği yaşlı sepsislerinde daha fazladır.
Steroidler
Görece adrenal yetersizlik olan olgularda düşük doz
hidrokortizon kullanımı uygun olabilir.133 Yaş ilişkili
immün değişiklikler nedeniyle glukokortikoidler konusunda dikkatli olunmalı ve doz ayarlaması yapılmalıdır.31 Yüksek dozda steroid kullanımı immündepresyon,
kötü glukoz kontrolü, miyonöropatiye sebep olur ve bu
nedenle yaşlılarda kontrendikedir.5
Glukoz Kontrolü
Uluslar arası rehberler kan glukoz düzeyinin, devamlı
insülin ve glukoz infüzyonuyla <150 mg/dL tutulmasını
önermektedir.126 Kan şekeri yüksekliği immünolojik cevabı bozabilir ve sepsis-ilişkili koagülopatiyi artırabilir. Yaşlılarda insülin infüzyonuyla hipoglisemi riski nedeniyle
dikkatli olunmalı ve 150 mg/dL düzeyi hedeflenmelidir.5
Sedatifler ve Analjezikler
Yaşlılarda sepsis sırasında sıklıkla anksiyete, ağrı ve deliryum gelişir ve sedatiflere ve analjeziklere ihtiyaç olur.
Ancak söz konusu ilaçların uygunsuz kullanımı, mekanik
ventilasyondan ayrılmayı geciktirebilir.134,135 Sedatifler ve
analjezikler sedasyon skalası monitorizasyonuyla verilmeli ve devamlı infüzyon yerine aralıklı kesilerek veya
aralıklı bolus şeklinde uygulanmalıdır.126 Benzodiyazepinler yaşlılarda anksiyete ve psikomotor ajitasyon gibi
paradoksik reaksiyonlara sebep olabilir. Nöroleptikler,
yaşlı sepsis hastasında deliryum varlığında kullanılabilir.
Kaynaklar
1.
American College of Chest Physicians/Society of Critical Care
Medicine Consensus Conference: definitions for sepsis and organ
failure and guidelines for the use of innovative therapies in sepsis.
Crit Care Med 1992; 20: 864-874.
2.
Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/
ACCP/ATS/SIS International Sepsis Definitions Conference. Crit
Care Med 2003; 31: 1250-1256.
3.
Annane D, Bellissant E, Cavaillon JM. Septic shock. Lancet 2005;
365: 63-78.
4.
Marshall JC, Cook DJ, Christou NV, et al. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome.
Crit Care Med 1995; 23: 1638-1652.
Klinik Gelişim
G. BAHAT ÖZTÜRK
5.
De Gaudio AR, Rinaldi S, Chelazzi C, Borracci T. Pathophysiology
of sepsis in the elderly: clinical impact and therapeutic considerations. Curr Drug Targets 2009; 10: 60-70.
6.
Martin GS, Mannino DM, Moss M. The effect of age on the
development and outcome of adult sepsis. Crit Care Med 2006;
34: 15-21.
7.
Sands KE, Bates DW, Lanken PN, et al. Epidemiology of sepsis
syndrome in 8 academic medical centers. JAMA 1997; 278: 234240.
8.
Bone RC, Fisher CJ Jr, Clemmer TP, et al. A controlled clinical
trial of high-dose methylprednisolone in the treatment of severe
sepsis and septic shock. N Engl J Med 1987; 317: 653-658.
9.
Ziegler EJ, Fisher CJ Jr, Sprung CL, et al. Treatment of gramnegative bacteremia and septic shock with HA-1A human monoclonal antibody against endotoxin. A randomized, double-blind,
placebo-controlled trial. The HA-1A Sepsis Study Group. N Engl
J Med 1991; 324: 429-436.
10. Abraham E, Wunderink R, Silverman H, et al. Efficacy and safety
of monoclonal antibody to human tumor necrosis factor alpha
in patients with sepsis syndrome. A randomized, controlled,
double-blind, multicenter clinical trial. TNF-alpha MAb Sepsis
Study Group. JAMA 1995; 273: 934-941.
11. Dhainaut JF, Vincent JL, Richard C, et al. CDP571, a humanized
antibody to human tumor necrosis factor-alpha: safety, pharmacokinetics, immune response, and influence of the antibody on
cytokine concentrations in patients with septic shock. CPD571
Sepsis Study Group. Crit Care Med 1995; 23: 1461-1469.
12. Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the
European Prevalence of Infection in Intensive Care (EPIC) Study.
EPIC International Advisory Committee. JAMA 1995; 274: 639644.
13. Dremsizov T, Clermont G, Kellum JA, et al. Severe sepsis in
community-acquired pneumonia: when does it happen, and do
systemic inflammatory response syndrome criteria help predict
course? Chest 2006; 129: 968-978.
14. Netea MG, van der Meer JW. Immunodeficiency and genetic
defects of pattern-recognition receptors. N Engl J Med 2011; 364:
60-70.
15. Martin GS, Mannino DM, Eaton S, Moss M. The epidemiology
of sepsis in the United States from 1979 through 2000. N Engl J
Med 2003; 348: 1546-1554.
16. Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of
severe sepsis in the United States: analysis of incidence, outcome,
and associated costs of care. Crit Care Med 2001; 29: 1303-1310.
17. Neviere R. Sepsis and the systemic inflammatory response
syndrome: Definitions, epidemiology, and prognosis. Prognosis.
UpToDate; last updated October 2011.
18. Angus DC, Kelley MA, Schmitz RJ, et al. Caring for the critically
ill patient. Current and projected workforce requirements for care
of the critically ill and patients with pulmonary disease: can we
meet the requirements of an aging population? JAMA 2000; 284:
2762-2770.
25. Padkin A, Goldfrad C, Brady AR, et al. Epidemiology of severe
sepsis occurring in the first 24 hrs in intensive care units in
England, Wales, and Northern Ireland. Crit Care Med 2003; 31:
2332-2338.
26. Vincent JL, Sakr Y, Sprung CL, et al. Sepsis in European intensive
care units: results of the SOAP study. Crit Care Med 2006; 34:
344-353.
27. Dombrovskiy VY, Martin AA, Sunderram J, Paz HL. Facing the
challenge: decreasing case fatality rates in severe sepsis despite
increasing hospitalizations. Crit Care Med 2005; 33: 2555-2562.
28. Winters BD, Eberlein M, Leung J, et al. Long-term mortality and
quality of life in sepsis: a systematic review. Crit Care Med 2010;
38: 1276-1283.
29. Perl TM, Dvorak L, Hwang T, Wenzel RP. Long-term survival
and function after suspected gram-negative sepsis. JAMA 1995;
274: 338-345.
30. Sasse KC, Nauenberg E, Long A, et al. Long-term survival after
intensive care unit admission with sepsis. Crit Care Med 1995;
23: 1040-1047.
31. Girard TD, Opal SM, Ely EW. Insights into severe sepsis in older
patients: from epidemiology to evidence-based management.
Clin. Infect Dis 2005; 40,719-727.
32. Knaus WA, Harrell FE, Fisher C.J Jr, et al. The clinical evaluation
of new drugs for sepsis. A prospective study design based on
survival analysis. JAMA 1993; 270, 1233-1241
33. Ely EW, Angus DC, Williams MD, et al. Drotrecogin alfa (activated) treatment of older patients with severe sepsis. Clin Infect Dis
2003; 37, 187-195.
34. Geiger H, Rudolph KL. Aging in the lympho-hematopoietic stem
cell compartment. Trends Immunol 2009; 30: 360-365.
35. Vaziri H, Dragowska W, Allsopp RC, et al. Evidence for a mitotic
clock in human hematopoietic stem cells: loss of telomeric DNA
with age. Proc Natl Acad Sci U S A 1994; 91: 9857-9860.
36. Cancro MP, Hao Y, Scholz JL, et al. B cells and aging: molecules
and mechanisms. Trends Immunol 2009; 30: 313-318.
37. Chambers SM, Goodell MA. Hematopoietic stem cell aging:
wrinkles in stem cell potential. Stem Cell Rev 2007; 3: 201-211.
38. Castle SC. Clinical Relevance of Age-Related Immune Dysfunction: 2000; 31: 578-85.
39. Shaw AC, Joshi S, Greenwood H, et al. Aging of the innate immune system. Curr Opin Immunol 2010; 22: 507-513.
40. Medzhitov R, Janeway C. New Engl J Med Innate immunity.
2002; 343, 338-344.
41. Tetta C, Fonsato V, Ronco C, Camussi G. Recent insights into the
pathogenesis of severe sepsis. Crit Care Resusc 2005; 7, 32-39.
42. Matsuda N, Hattori Y. J Pharmacol Sci Systemic inflammatory
response syndrome (SIRS): molecular pathophysiology and gene
therapy. 2006; 101, 189-198.
43. Schwandner R, Dziarski R, Wesche Het al. Peptidoglycan- and
lipoteichoic acid-induced cell activation is mediated by toll-like
receptor 2. J Biol Chem 1999; 274, 17406-17409.
19. Esper AM, Martin GS. Extending international sepsis epidemiology: the impact of organ dysfunction. Crit Care 2009; 13: 120.
44. Alexopoulou L,Holt AC, Medzhitov R, Flavall RA. Recognition of
double-stranded RNA and activation of NF-kappaB by Toll-like
receptor 3. Nature 2001; 413, 732-738.
20. Danai PA, Sinha S, Moss M, et al. Seasonal variation in the epidemiology of sepsis. Crit Care Med 2007; 35: 410-415.
45. Beutler B. Curr. Opin. Immunol Tlr4: central component of the
sole mammalian LPS sensor.2002; 12, 20-26.
21. Martin, GS, Mannino DM, Eaton S, Moss, M. N. Engl. J. Med. The
epidemiology of sepsis in the United States from 1979 through
2000. 2003; 348: 1546-54.
46. Hemmi H, Kaisho T, Takeuchi O, et al. Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent
signaling pathway. Nat Immunol 2002; 3, 196-20.
22. Dombrovskiy VY, Martin AA, Sunderram J, Paz HL. Rapid increase in hospitalization and mortality rates for severe sepsis in the
United States: a trend analysis from 1993 to 2003. Crit Care Med
2007; 35: 1244-1250.
47. Opal SO, Girard DT, Ely EW. The immunopathogenesis of sepsis
in elderly patients. Clin Inf Dis 2005; 41, S504-S512.
23. Esper A, Martin GS. Is severe sepsis increasing in incidence AND
severity? Crit Care Med 2007; 35: 1414-1415.
48. Ogawa T, Kitagawa M, Hirokawa K. Age-related changes of human bone marrow: a histometric estimation of proliferative cells,
apoptotic cells, T cells, B cells and macrophages. Mech Ageing
Dev 2000; 117: 57-68.
24. Rangel-Frausto MS, Pittet D, Costigan M, et al. The natural history of the systemic inflammatory response syndrome (SIRS). A
prospective study. JAMA 1995; 273: 117-123.
49. Plowden J, Renshaw-Hoelscher M, Engleman C, et al. Innate
immunity in aging: impact on macrophage function. Aging Cell
2004; 3: 161-167.
Klinik Gelişim
79
2012; 25: 71-81
50. Renshaw M, Rockwell J, Engleman C et al. Cutting edge: impaired
Toll-like receptor expression and function in aging. J Immnol
2002; 169, 4697-4701.
51. Chelvarajan RL, Liu Y, Popa Det al. Molecular basis of age-associated cytokine dysregulation in LPS-stimulated macrophages. J
Leukoc Biol 2006; 79, 1314-1327.
52. Boehmer ED, Meehan MJ, Cutro BT, Kovacs EJ. Aging negatively
skews macrophage TLR2- and TLR4-mediated pro-inflammatory
responses without affecting the IL-2-stimulated pathway. Mech
Ageing Dev 2005; 126, 1305-1313.
53. van Duin D, Mohanty S, Thomas V, et al. Age-associated defect in
human TLR-1/2 function. J Immunol 2007; 178: 970-975.
54. Azar A, Ballas ZK. Immune function in older adults. UpToDate;
last updated May 2011.
55. Plackett TP, Boehmer ED, Faunce DE, Kovacs EJ. Aging and
innate immune cells. J Leukoc Biol 2004; 76, 291-299.
56. Panda A, Arjona A, Sapey E, et al. Human innate immunosenescence: causes and consequences for immunity in old age. Trends
Immunol 2009; 30: 325-333.
57. Borrego F, Alonso MC, Galiani MD, et al. NK phenotypic markers
and IL2 response in NK cells from elderly people. Exp Gerontol
1999; 34: 253-265.
58. Hayhoe RP, Henson SM, Akbar AN, Palmer DB. Variation of
human natural killer cell phenotypes with age: identification
of a unique KLRG1-negative subset. Hum Immunol 2010; 71:
676-681.
59. Le Garff-Tavernier M, Béziat V, Decocq J, et al. Human NK cells
display major phenotypic and functional changes over the life
span. Aging Cell 2010; 9: 527-535.
60. Solana R, Mariani E. NK and NK/T cells in human senescence.
Vaccine 2002; 18, 1613-1620.
61. Sansoni P, Cossarizza A, Brianti V, et al. Lymphocyte subsets and
natural killer cell activity in healthy old people and centenarians.
Blood 1993; 82: 2767-2773.
62. Ogata K, An E, Shioi Y, et al. Association between natural killer
cell activity and infection in immunologically normal elderly
people. Clin Exp Immunol 2001; 124: 392-397.
63. Berzins SP, Smyth MJ, Baxter AG. Presumed guilty: natural killer
T cell defects and human disease. Nat Rev Immunol 2011; 11:
131-142.
64. Zajonc DM, Kronenberg M. Carbohydrate specificity of the recognition of diverse glycolipids by natural killer T cells. Immunol
Rev 2009; 230: 188-200.
65. DelaRosa O, Tarazona R, Casado JG, et al. Valpha24+ NKT cells
are decreased in elderly humans. Exp Gerontol 2002; 37: 213217.
66. Jing Y, Gravenstein S, Chaganty NR, et al. Aging is associated with
a rapid decline in frequency, alterations in subset composition,
and enhanced Th2 response in CD1d-restricted NKT cells from
human peripheral blood. Exp Gerontol 2007; 42: 719-732.
67. Peralbo E, DelaRosa O, Gayoso I, et al. Decreased frequency
and proliferative response of invariant Valpha24Vbeta11 natural
killer T (iNKT) cells in healthy elderly. Biogerontology 2006; 7:
483-492.
68. Agrawal A, Agrawal S, Gupta S. Dendritic cells in human aging.
Exp Gerontol 2007; 42: 421.-426
69. Jing Y, Shaheen E, Drake RR, et al. Aging is associated with a
numerical and functional decline in plasmacytoid dendritic cells,
whereas myeloid dendritic cells are relatively unaltered in human
peripheral blood. Hum Immunol 2009; 70: 777-784.
70. Panda A, Qian F, Mohanty S, et al. Age-associated decrease in
TLR function in primary human dendritic cells predicts influenza
vaccine response. J Immunol 2010; 184: 2518-2527.
71. Flores KG, Li J, Sempowski GD, et al. Analysis of the human
thymic perivascular space during aging. J Clin Invest 1999; 104:
1031-1039.
72. Naylor K, Li G, Vallejo AN, et al. The influence of age on T cell
generation and TCR diversity. J Immunol 2005; 174: 7446-7452.
80
73. Douek DC, Koup RA. Evidence for thymic function in the elderly.
Vaccine 2002; 18, 1638-1641.
74. Sandmand M, Bruunsgaard H, Kemp, Ket al. Is ageing associated
with a shift in the balance between Type 1 and Type 2 cytokines
in humans? Clin Exp Immunol 2002; 127, 107-14
75. Uciechowski P, Kahmann L, Plümäkers B, et al. TH1 and TH2
cell polarization increases with aging and is modulated by zinc
supplementation. Exp Gerontol 2008; 43: 493-498.
76. Cakman I, Rohwer J, Schütz RM, et al. Dysregulation between
TH1 and TH2 T cell subpopulations in the elderly. Mech Ageing
Dev 1996; 87: 197-209.
77. Sakata-Kaneko S, Wakatsuki Y, Matsunaga Y, et al. Altered Th1/
Th2 commitment in human CD4+ T cells with ageing. Clin Exp
Immunol 2000; 120: 267-273.
78. Plackett P, Schilling EM, Faunce DE, et al. Aging enhances
lymphocyte cytokine defects after injury. FASEB J 2003; 17,
688-689.
79. Mascarucci P, Taub D, Saccani S, et al. Age-related changes in
cytokine production by leukocytes in rhesus monkeys. Aging
2001; 13, 85-94.
80. Nasi M, Troiano L, Lugli E, et al. Thymic output and functionality
of the IL-7/IL-7 receptor system in centenarians: implications for
the neolymphogenesis at the limit of human life. Aging Cell 2006;
5: 167-175.
81. Kaltoft K. Cytokine-driven immortalization of in vitro activated
human T lymphocytes. CD28 expression correlates inversely
with cell population doublings. Exp Clin Immunogenet 1998;
15: 84-89.
82. Haynes L, Maue AC. Effects of aging on T cell function. Curr
Opin Immunol 2009; 21: 414-417.
83. Frasca D, Blomberg BB. Effects of aging on B cell function. Curr
Opin Immunol 2009; 21: 425-430.
84. Weksler ME, Goodhardt M, Szabo P. The effect of age on B cell
development and humoral immunity. Springer Semin Immunopathol 2002; 24, 35-52.
85. Frasca D, Landin AM, Lechner SC, et al. Aging down-regulates
the transcription factor E2A, activation-induced cytidine deaminase, and Ig class switch in human B cells. J Immunol 2008; 180:
5283-5290.
86. Weksler ME. Changes in the B-cell repertoire with age. Vaccine,
2002; 18, 1624-1628.
87. Lazuardi L, Jenewein B, Wolf AM, et al. Age-related loss of naïve
T cells and dysregulation of T-cell/B-cell interactions in human
lymph nodes. Immunology 2005; 114: 37-43.
88. Gibson KL, Wu YC, Barnett Y, et al. B-cell diversity decreases
in old age and is correlated with poor health status. Aging Cell
2009; 8: 18-25.
89. Henson SM, Akbar AN. Memory T-cell homeostasis and senescence during aging. Adv Exp Med Biol 2010; 684: 189-197.
90. Stacy S, Krolick KA, Infante AJ, Kraig E. Immunological memory
and late onset autoimmunity. Mech Ageing Dev 2002; 123: 975985.
91. Kovaiou RD, Weiskirchner I, Keller M, et al. Age-related differences in phenotype and function of CD4+ T cells are due to a
phenotypic shift from naive to memory effector CD4+ T cells. Int
Immunol 2005; 17: 1359-1366.
92. Hancock K, Veguilla V, Lu X, et al. Cross-reactive antibody
responses to the 2009 pandemic H1N1 influenza virus. N Engl J
Med 2009; 361: 1945-1952.
93. Monsalvo AC, Batalle JP, Lopez MF, et al. Severe pandemic 2009
H1N1 influenza disease due to pathogenic immune complexes.
Nat Med 2011; 17: 195-199.
94. Haynes L, Eaton SM, Burns EM, et al. Newly generated CD4 T
cells in aged animals do not exhibit age-related defects in response to antigen. J Exp Med 2005; 201: 845-851.
95. Cho SG, Choi EJ. Apoptotic signaling pathways: caspases and
stress-activated protein kinases. J Biochem Mol Biol 2002; 35,
24-27.
Klinik Gelişim
G. BAHAT ÖZTÜRK
97. Chang L, Karin M. Mammalian MAP kinase signalling cascades.
Nature, 2001; 410, 37-40.
117.O'Brien JM Jr, Lu B, Ali NA, et al. Alcohol dependence is independently associated with sepsis, septic shock, and hospital mortality
among adult intensive care unit patients. Crit Care Med 2007;
35: 345-350.
98. Turnbull IR, Buchman TG, Javadi P, Woolsey CA, et al. Age disproportionately increases sepsis-induced apoptosis in the spleen
and gut epithelium. Shock 2006; 22, 364-368.
118.Krieger JN, Kaiser DL, Wenzel RP. Urinary tract etiology of
bloodstream infections in hospitalized patients. J Infect Dis 1983;
148: 57-62.
99. Escames G, León J, Macías M,et al. Melatonin counteracts lipopolysaccharide-induced expression and activity of mitochondrial
nitric oxide synthase in rats FASEB J. Published online March
28, 2003.
119.Brun-Buisson C, Doyon F, Carlet J. Bacteremia and severe sepsis
in adults: a multicenter prospective survey in ICUs and wards of
24 hospitals. French Bacteremia-Sepsis Study Group. Am J Respir
Crit Care Med 1996; 154: 617-624.
100.Mavrommatis AC, Theodoris T, Orfanidou Aet al. Coagulation
system and platelets are fully activated in uncomplicated sepsis.
Crit Care Med 2000; 28, 451-457.
120.Shorr AF, Tabak YP, Killian AD, et al. Healthcare-associated
bloodstream infection: A distinct entity? Insights from a large U.S.
database. Crit Care Med 2006; 34: 2588-2595.
101.Esmon CT. Introduction: are natural anticoagulants candidates
for modulating the inflammatory response to endotoxin? Blood
2000; 95, 1113-1116.
121.Effect of high-dose glucocorticoid therapy on mortality in patients
with clinical signs of systemic sepsis. The Veterans Administration
Systemic Sepsis Cooperative Study Group. N Engl J Med 1987;
317: 659-665.
96. Kaufmann SH, Hengartner MO. Programmed cell death: alive and
well in the new millennium. Trends Cell Biol 2001; 11, 526-534.
102.Aird WC. Vascular bed-specific hemostasis: role of endothelium
in sepsis pathogenesis. Crit Care Med, 2001; 29, S28-S35.
103.Opal SM, Esmon C. Bench-to-bedside review: functional relationships between coagulation and the innate immune response
and their respective roles in the pathogenesis of sepsis. Crit Care
2003; 7, 23-38.
104.Cohen HJ, Harris T, Pieper CF. Coagulation and activation of
inflammatory pathways in the development of functional decline
and mortality in the elderly. Am. J Med 2003; 114, 180-187.
105.Mari D, Mannucci PM, Coppola R, et al. Hypercoagulability in
centenarians: the paradox of successful aging. Blood 1995; 85,
3144-3149.
106.Yamamoto K, Shimokawa T, Yi H, et al. Aging accelerates endotoxin-induced thrombosis: increased responses of plasminogen
activator inhibitor-1 and lipopolysaccharide signaling with aging.
AJP 2002; 161, 1805-1814.
107.Kumar A, Thota V, Dee L, et al. Tumor necrosis factor alpha
and interleukin 1beta are responsible for in vitro myocardial cell
depression induced by human septic shock serum. J Exp Med
1996; 183, 949-958.
108.Finkel MS, Oddis CV, Jacob TD, et al. Negative inotropic effects
of cytokines on the heart mediated by nitric oxide. Science 1992;
257, 387-389.
109.Finkel MS, Hoffman RA, Shen L, et al. Interleukin-6 (IL-6) as
a mediator of stunned myocardium. Am J Cardiol 1993Ü; 71,
1231-1232
110.Girard TD, Opal SM, Ely EW. Insights into severe sepsis in older
patients: from epidemiology to evidence-based management. Clin
Infect Dis 2005; 40: 719-727.
111.Knaus WA, Sun X, Nystrom O, Wagner DP. Evaluation of definitions for sepsis. Chest 1992; 101: 1656.-1662
112.Peres Bota D, Lopes Ferreira F, Mélot C, Vincent JL. Body temperature alterations in the critically ill. Intensive Care Med 2004;
30: 811-816.
122.Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy
in the treatment of severe sepsis and septic shock. N Engl J Med
2001; 345: 1368-1377.
123.Castle SC, Norman DC, Yeh M., et al. Fever response in elderly
nursing home residents: are the older truly colder? J Am Geriatr
Soc 1991; 39, 853–857.
124.Chassagne P, Perol MB, Doucet J,et al. Is presentation of bacteremia in the elderly the same as in younger patients? Am J Med
1996; 100, 65-70.
125.Rajagopalan S, Yoshikawa TT. Antimicrobial therapy in the
elderly. Med Clin North Am 2001; 85,133–147.
126.Dellinger RP, Carlet JM, Masur H, et al. Crit Care Med Surviving
Sepsis Campaign guidelines for management of severe sepsis and
septic shock. 2004; 32, 858-873.
127.Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy
in the treatment of severe sepsis and septic shock. N Engl J Med.
2001; 345: 1368-77.
128.Port S, Cobb FR, Coleman RE, Jones RH. Effect of age on the
response of the left ventricular ejection fraction to exercise. N
Engl J Med 1980; 303, 1133.
129.Rosas GO, Zieman SJ, Donabedian M,et al. Augmented age-associated innate immune responses contribute to negative inotropic
and lusitropic effects of lipopolysaccharide and interferon gamma. J Mol Cell Cardiol 2001; 33, 1849-1859.
130.Hebert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in
critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med 1999;
340, 409-417.
131.Wu WC, Rathore SS, Wang Yet al. Blood transfusion in elderly
patients with acute myocardial infarction. N Engl J Med 2001;
345, 1230-1236.
113.Kreger BE, Craven DE, McCabe WR. Gram-negative bacteremia.
IV. Re-evaluation of clinical features and treatment in 612 patients. Am J Med 1980; 68: 344-355.
132.Harbarth S, Garbino J, Pugin J, et al. Inappropriate initial antimicrobial therapy and its effect on survival in a clinical trial of
immunomodulating therapy for severe sepsis. Am J Med 2003;
115, 529-535.
114.Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II:
a severity of disease classification system. Crit Care Med 1985;
13: 818-829.
133.Annane D, Sebille V, Charpentier C, et al. Effect of treatment with
low doses of hydrocortisone and fludrocortisone on mortality in
patients with septic shock.JAMA 2002; 288, 862- 871.
115.Knaus WA, Wagner DP, Draper EA, et al. The APACHE III prognostic system. Risk prediction of hospital mortality for critically ill
hospitalized adults. Chest 1991; 100: 1619-1636.
134.Kress JP, Pohlman AS, O’Connor MF, Hall JB. Daily interruption
of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med 2003; 342, 1471-1477.
116.Danai PA, Moss M, Mannino DM, Martin GS. The epidemiology
of sepsis in patients with malignancy. Chest 2006; 129: 14321440.
135.Ely EW, Truman B, Shintani A,et al. Monitoring sedation status
over time in ICU patients: reliability and validity of the Richmond
Agitation-Sedation Scale (RASS). JAMA 2003; 289, 2983- 2991.
Klinik Gelişim
81