ATOMLAR MOLEKÜLLER ve
İYONLAR
DEMOKRITOS
(ΔHMOKPITOΣ)
M.Ö 5.yy
“ATOMOS”
Milattan önce 5. yy da yaşamış olan Democritus (460-370
BC) maddenin defalarca bölünmesi sonucu artık daha
fazla bölünemeyen nihai bir parçacığın varlığını ileri
sürmüştür ve bu parçacığı tanımlamak için Yunanca
“parçalanamayan - görünmeyen” anlamına gelen
“atomos” sözcüğünü kullamıştır.
ARISTOTELES
(Aristoteles)
Platon (Πλάτων)
Democritus’un Atomik teorisi çağdaşları
olan Plato ve Aristo (384-322 BC)
tarafından kabul görmemiştir. Aristo
dünya üzerindeki tüm maddelerin
atomlardan değil “dört element” ten:
toprak, hava, su, ateş ten oluştuğunu
iddia
etmiştir.
Varoluş ile ilgili çok kesin bir görüş ortaya koymuştur. Evren'deki
oluşuma, kesin bir zorunluluk egemendir. Bütün olup bitenleri bir
raslantı ile izâha çalışmak saçmalıktır. "Yaratılmamış, yok olmayan,
değişmeyen varlık, özdeksel atomdur. Öz, maddeyi temsil eder ve
onunla her nesne yapılabilir." şeklinde özetlenebilecek bir görüşle,
materyalist doğa biliminin ilk temellerini atmıştır.
The School of Athens (Scuola di Atene)
Artist: Raphael , 1509-15010
Rönesans ressamı Raphael ‘e ait freskte ortadaki iki filozof
Plato ve genç öğrencisi Aristo olarak resmedilmiştir.
MODERN KİMYANIN TEMELLERİ
Dalton’un Atom Teorisi (1803)
Elementler atom denilen çok küçük
partiküllerden oluşur. Verilen elementin bütün
atomları özdeş, aynı büyüklüğe kütleye ve
kimyasal özelliklere sahiptir, diğer bütün
elementlerinkinden farklıdır.
●
(1776-1844)
● Bileşikler birden fazla element atomundan oluşur. Herhangi
bir bileşikte bulunan herhangi iki elementin atom sayılarının
oranı tam sayı veya basit kesirdir.
● Bir kimyasal reaksiyon atomların sadece ayrılma, birleşme
veya yeniden düzenlenmesiyle gerçekleşir; kimyasal
reaksiyonlar atomların yeniden yaratılması veya yokedilmesi
sonucu ortaya çıkmaz.
BELİRLİ ORANLAR KANUNU (1799)
Aynı bileşiğin farklı örneklerinin içerdiği
elementler daima kütlece aynı orandadır.
Joseph Proust (1754-1826)
KATLI ORANLAR KANUNU
“Eğer bir element bir başka element ile birden fazla bileşik
oluşturabiliyorsa elementlerden birinin sabit miktarı ile diğer
elementtin değişen miktarları arasında basit ve tam sayılarla
ifade edilebilen bir oran vardır.“
Örneğin 44 g karbondioksitte 12 g C ve 32 g O vardır.
Karbonmonoksidin 28 gramında ise 12 g C ve 16 g O vardır.
Her iki bileşikteki karbon miktarı 12 gramı için birinde 32
diğerinde 16 gram oksijen vardır. Birinci bileşikteki oksijen
kütlesinin ikinci bileşiktekine oranı 32/16=2 dir. Bu Dalton'a
kendi adıyla anılan Dalton Atom Teorisi fikrini verdi.
"http://tr.wikipedia.org/wiki/Katl%C4%B1_oranlar_yasas%C4
%B1
KÜTLENİN KORUNUMU
LAVOSIER (1743-1794)
Yaşamında iki devrim görmüş bir kişidir.
Devrimlerden biri, yüzyıllar boyunca "simya" adı
altında sürdürülen çalışmaların, bugünkü
anlamda, kimya bilimine dönüşmesidir. Lavoisier
bu devrimin kahramanıdır.
İkinci devrim, "1789 Fransız
ihtilali" diye bilinir. Lavoisier bu
devrimin getirdiği terörün
kurbanıdır. 1794 yılında 51
yaşında iken giyotinle idam edilir.
Bilimin Öncüleri (Cemal Yıldırım), TÜBİTAK
Popüler Bilim Kitapları
KÜTLENİN KORUNUMU YASASI
Kütlenin durumu yeniden düzenlenebilir fakat kütle
yaratılamaz veya yok edilemez. Böylece, kapalı bir sistem
dahilindeki her türlü kimyasal tepkime ve proseste
tepkenlerin (yani reaktantların) kütlesi, ürünlerin kütlesine
eşit olmalıdır.
Kütlenin korunumu kanunun ilk kez net bir şekilde
tanımlanması
1789
tarihinde
Lavoisier
tarfından
başarılabilmiştir. Nitekim bu sebepten ötürü bazen
kendisinin modern kimyanın babası olduğu da söylenir.
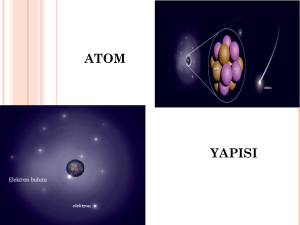
ATOMUN YAPISI
Atom nedir?
Dalton Teorisine dayanarak, atom kimyasal birleşmelere
girebilen elementin temel birimidir.
Atom nasıldır?
ATOM ALTI PARÇACIKLARI
Atomdan küçük, atomu da oluşturan maddeler. En çok
bilinenleri
● Elektron
● Proton
● Nötron
Proton, nötron ve elektronlar aslında alt
parçacıklardan (kuarklardan) oluşmuştur. Yapısı
tamamen keşfedilmemiş olanlara örnek foton (ışık),
bozon, mezon, fermiyon, baryon, graviton.
● Lepton
● Kuark
● Nötrino
● Baryon
● Mezon
● Nötrino
● Fermiyon
● Bozon
TEMEL ATOM ALTI PARÇACIKLARININ KEŞFİ
ELEKTRONLAR
Thomson’a göre atom, maddenin temel yapıtaşı değildi;
atomun kendisi de küçük temel öğelerden oluşuyordu.
Thomson, katot ışınlarının, atomların bu çok küçük
parçacıklarının akışı gibi düşünülebileceğini iddia ediyordu.
Joseph John Thompson’ın “Katod ışını tüpü” denemesi
ve elektronun keşfi.
Katod ışını tüpü
Televizyon tüpünün de atası olan katod
ışını tüpü havası boşaltılmış bir cam
tüptür. İki metal plaka yüksek voltaj
kaynağına bağlandığında katod denilen
(-) yüklenmiş plaka görünmez bir ışın
yayar.
Katod ışını anod denilen (+) yüklü plakaya doğru çekilip
ortasındaki delikten geçerek tüpün diğer ucunda sürekli olarak
hareket eder. Işın özel olarak kaplanmış yüzeye çarptığında
kuvvetli floresans veya parlaklık oluşturur.
Bu ışınlar ne olabilir ?
1890 radyasyon çalışmalarının sonucuna göre enerjinin
boşlukta emisyonu (yayımı) ve transmisyonu (geçişi) boşlukta
dalga şeklindedir.
Bu ışınlar ışık dalgalarıyla benzerdir dolayısıyla dalga olabilir
Diğer olasılık ise bunlar ışık gibi dalga değil, parçacıktır.
Rutherford shot alpha () particles at gold foil.
Zinc sulfide screen
Thin gold foil
Lead block
Radioactive path of invisible
substance
-particles
Most particles passed through.
So, atoms are mostly empty.
Some positive -particles
deflected or bounced back!
Thus, a “nucleus” is positive &
holds most of an atom’s mass.
Ernest Rutherford
Joseph John Thompson’ın “Katod ışını tüpü” denemesi
Katot ışınları ile ilgili tüm çalışmaları dikkatle izleyen Thomson
bazı eski deneyleri daha dikkatli olarak tekrar yaptı
Katot tüpünün dışına
elektrikle yüklü iki plaka
ve mıknatıs eklendiğinde;
(i) yalnızca magnetik alan
açık ise katod ışını A
noktasına çarpar.
(ii) Yalnızca elektrik alan açık ise ışın C noktasına çarpar.
(iii) Magnetik alan ve elektrik alanın her ikisi de kapalı veya
birbirinin etkisini yok edecek şekilde kapalı ise ışın B
noktasına çarpar
Elektromagnetik teoriye göre hareket eden yüklü bir cisim
mıknatıs gibi davranır ve geçtiği yerde elektrik ve magnetik
alanla etkileşimde bulunabilir. Katod ışını (+) yüklü tabaka
tarafından çekildiğine göre (-) yüklüdür.
Thompsona göre katot ışınları yalnızca sıradan parçacıklar
değil, aslında o zamana dek bölünemez olduğu düşünülen
atomun yapı taşlarıydı.
Bugün bu negatif yüklü parçacıkların elektron olduğunu
biliyoruz.
Thompson daha sonra katod ışını tüpü
ve elektromagnetik teori bilgilerini
kullanarak tek bir elektronun
YÜK/KÜTLE oranını hesaplamıştır.
Bu sayı = -1.76x108 Coulomb / g dır.
R.A. Millikan’ın elektronun yükünün 1,60x10-19 C olarak hesaplanmasının
ardından elektronun kütlesi de 9,09x10-28
g olarak bulunmuştur.
Joseph John Thomson
RADYOAKTİVİTE
● 1895 Wilhelm Röntgen katod
ışınları ile cam ve metallerden sıra
dışı ışınların yayıldığını farketti.
● Bu ışın maddeye etki etmektedir
ve yüksek enerjilidir.
● Fotoğraf plağını karartır, çeşitli
cisimlerde floresansa neden olur.
● Mıknatıs tarafından saptırılmaz o
halde yüklü parçacıklar içermez.
● Yapıları aydınlatılamadığından X
ışınları olarak adlandırılmışlardır.
● Antoine Becquerel Fluoresans özelliği ile ilgili çalışırken
rastlantısal olarak bir uranyum bileşiğinin kendiliğinden
yüksek enerjili, mıknatıs tarafından saptırılamayan ışınlar
yaydığını belirledi.
● Becquerel!in öğrencilerinden biri olan Marie Curie
“partiküllerin kendiliğinden emisyonunu ve/veya
radyasyonuna” radyoaktivite adını vermeyi önerdi. Bu
özelliği taşıyan elementlere ise radyoaktif adı verilir.
● Radyoaktif elementlerin bozunma ve yarılanmasıyla üç tür
ışın ortaya çıkar.
(i) Αlfa (α) ışınları/partikülleri (+) yüklü
(ii) Beta (β) ışınları/partikülleri (-) yüklü, elektronlar
(iii) Gama (γ) ışınları/partikülleri, yüksüz
● β ışınları (-) yüklü olup (+) plaka
tarafından çekilirler
● α ışınları (+) yüklü olup (-) plaka
tarafından çekilirler
● γ ışınları yüksüz olup dış elektriksel
alandan etkilenmez.
PROTON ve ÇEKİRDEK
1900 yılı başlarında atomların (-) yüklü elektronlar içerdiği ve
kendilerinin yüksüz olduğu biliniyordu. Bu durumu açıklamak
için Thompson bu durumu açıklamak için “Üzümlü kek” olarak
bilinen atom modelini ileri sürdü.
Ernst Rutherford
1910 yılında Rutherford atomun yapısını
aydınlatmak için α taneciklerini
kullanmaya karar verdi.
Altın folyo ve diğer metal yaprakları üzerine radyoaktif bir
kaynaktan elde edilen α partiküllerini gönderdi:
Plakaya nufuz eden partiküllerin büyük kısmı hiç sapmadı
yada kısmen sapma gösterdi.
Partiküllerin bir kısmı geniş açıda saçıldı.
Bazı durumada α partikülleri geldiği yönde geri döndü.
Gold Foil Experiment
Rutherford α Saçılma Deneyi Sonuçları
● Rutherford, atomun pozitif
yüklerinin atomun merkezinde
yoğunlaşan çekirdekte toplandığını
ileri sürmüştür.
● Çekirdekte (+) yükle yüklenmiş
partiküllere proton denir.
● Protonlar elektronlar ile aynı
miktarda yük taşır ve kütleleri
1,67252x10-24 g yani elektronun
kütlesinin yaklaşık 1840 katıdır.
Rutheford’a göre atom çekirdeği
atomun kütlesinin büyük bir kısmını
oluşturur hacmi ise atom hacminin
1/10-13 ü kadardır.
Atom çekirdeğinin çapı 5x10-3 pm dir.
(1 pm = 10-12 m)
NÖTRON
H (1p) , He (2p) dir.
m He / m H = 2 olması beklenirken 4 tür.
Bu çelişki başka bir atom altı parçacığı
olaması gerektiğini düşündürür. Bu parçacık
nötron dur.
James Chadwick ince berilyum levhayı α
partikülleri ile bombardıman ettiğinde metal
tarafından γışınlarına benzeryüksek enerjili
radyasyon yayınlanmıştır.
James Chadwick
Sonraki deneyler bunların nötron denilen 3.
temel atom altı parçacığı olduğunu
göstermiştir.
Nötronların kütlesi protonlardan biraz daha büyüktür ve
yüksüz taneciklerdir.
Atom altı partiküllerinin kütle ve yükleri
YÜK
Partikül
Kütle
Coulomb
Yük Birimi
Elektron
9,1095x10-28
-1,6022x10-19
-1
Proton
1,67252x10-24
+1,6022x10-19
+1
Nötron
1,67295x10-24
0
0
ATOM NUMARASI, KÜTLE NUMARASI ve
İZOTOPLAR
ATOM NUMARASI (Z): Bir elementin atom çekirdeğindeki
proton sayısıdır.
KÜTLE NUMARASI (A): Bir elementin atom çekirdeğindeki
proton ve nötronların toplam sayısıdır.
Kütle numarası= proton sayısı + nötron sayısı
= atom sayısı + nötron sayısı
İZOTOP: Atom numaraları aynı, kütle nymaraları farklı
atomlardır.
Örnek: H (Z=1, A=1); Döteryum (Z=1, A=2);
Trityum (Tritoryum) = (Z=1 , A=3)
U (Z=92, A=235) (uranyum-235; nükleer santrallerde ve
atom bombasında kullanılır)
U (Z=92 ; A=238) (uranyum-238, uranyum-235’in
özelliklerini taşımaz)
PERİYODİK TABLO
Dimitri Mendeleev
Periyodik Tablo: Benzer fiziksel ve kimyasal özellik
gösteren elementlerin birarada gösterildiği çizelgedir.
Yatay sıralar: PERİYOT
Düşey kolonlara: GRUP adı verilir.
Moleküller: Kimyasal bağlar olarak da adlandırılan
kuvvetlerle birarada tutulan en az iki atomun biraraya
gelmesiyle oluşur.
İyon: Anyon, katyon
Kimyasal Formüller: Bir maddenin en küçük biriminde
bulunan her elementin atomlarının tam sayısını gösterir.
Allotrop: Bir elementin iki veya daha fazla farklı şeklidir.
Örnek, elmas ve grafit karbonun allotropudur.
Deneysel (ampirik) formül: Bir bileşikte hangi atomların
bulunduğunu ve aralarındaki en basit oranı gösterir.
Örnek: C6H12O6 (glikoz) için deneysel formül CH2O dur.
ASİTLER ve BAZLAR
Oksi asitler: Hidrojen ve oksijen içeren asitlerdir.
Per .... İk asit
Per......at; HClO4 perklorik asit; perklorat
+O
.....ik asit
........it; HClO3 Klorik asit, klorat
-O
.......oz asit
.....it;
HClO2 Kloroz asit; klorit
-O
Hipo....oz asit
hipo....it; HClO hipokloroz asit, hipoklorit