DNA Tamir Sistemleri
Yrd. Doç. Dr. Pınar Tulay, Ph.D.
Tıbbi Biyoloji AD
Tıp Fakültesi, Ofis 402
DNA Hasarı
• Hücre endojen metobolitlere ve ekzojen ajanlara
maruz kaldığında DNA hasarına yol açıyor
• Bunun haricinde, her hücrede gerçekleşen normal
metabolizma reaksiyonların sonucunda, günde ~ 2
104 değişikliğe uğrar
Hasar nerden oluşur?
• DNA’yı etkileyen kimyasal ajanlar
– DNA bazlarına eklenen metil ve etil grupları
– Reaktif oksijen türleri (ROS):
– normal okzidatif metabolizmanın yan ürünleri
olarak bir çok hiper-reaktif oksijen türleri (tekli
oksijen, peroksit radikalleri, hidrojen peroksit ve
hidroksil radikalleri) oluşur.
– Bunun yanı sıra ROS iyonizan radyasyon (X-rays,
gamma rays) sonucu da ROS oluşur.
– ROS DNA bazlarını değiştirir: örneğin, timin
oksitlenerek timin glikola dönüşür
Hasar nerden oluşur?
• UV ışını DNA’ya enerji verir
– UV ışını DNA’yı oluşturan bazlar tarafından emilir
ve kimyasal değişikliğe yol açar. En çok rastlanan
foto-ürünler: T-T, T-C or C-T, C-C
• DNA’daki spontan değişiklikler
– Spontan baz kayıpları: günde her haploid genomda
binlerce purin ve pirimidin kaybı gerçekleşir
– Spontan deaminasyon: memelilerde, günde her haploid
genomda yaklaşık 100 sitozin, urasile deamine olur
– Spontaneous depurinizasyon: guaninin depurinizasyonu
(guanin kaybı)
Hasar nerden oluşur?
• DNA replikasyon hataları
– Çok düşük seviyededir
– DNA polimeraz neredeyse tüm hataları hemen
hemen düzeltir. Ancak replikasyon mekanizması
mükemmel değildir.
– Çoğu hata ve hasar tamir edilir (sadece 10-9 ’da 1
hata kalır)
– DNA replikasyonu sırasında yanlış eşleşme veya
kısa insersiyon veya delesyonlar hataları meydana
gelir.
Hasar nerden oluşur?
• DNA iplikciği arası çapraz bağ
– Çapraz bağlar, DNA zincirine bağlanan bazlar ile oluşur.
– Çapraz bağlar, UV ve iyonizan radyasyon ile de oluşabilir.
Hasar nerden oluşur?
• DNA-protein çapraz bağı
– DNA topoizomerazlar DNA ile kovalent bağ
oluştururlar.
– Genellikle çapraz bağlar geçicidir ve bu bağlar
ortadan kaldırılabilir.
– Bazı durumlarda da bu bağlar sabit kalır.
Hasar nerden oluşur?
• DNA zincir kırıkları
– Tek zincir ve çift zincir kırıklarının oluşması
normal metabolizmada düşük seviyededir.
• Bu kırıklar topoizomerazlar, nüleazlar, replikasyon
çatalı çöküşü ve tamir işlemi esnasında oluşur.
– Kırıklar iyonizan radyasyonun etkisi ile de
oluşabilir.
• Buna ek olarak, iyonizan radyasyonundan oluşan
hatalar tamir edilmediğinde, mutasyonlara sebep
olur
Hasar nerden oluşur?
• DNA’da metabolizma sonucu olarak
gerçekleşen tüm değişikliklere ve hasara karşı,
bunların sadece bir kaçı mutasyon olarak
karşımıza çıkar
• DNA’da 1’de 1000’den daha az baz değişiklikleri
mutasyona sebep olur
• Bu kadar DNA hasarı var madem, nasıl hayatta
kalabiliyoruz?
DNA Tamir Sistemleri
• Etkin DNA tamir sistemleri ile!
• DNA tamir sistemlerinin doğru çalışmadığı
durumlarda, mutasyon oranı artıyor
DNA Tamir Sistemleri
• DNA hasarının tesbit edilmesinde ve gerekli
müdahalenin yapılması için atılacak olan adımın
yapılmasıda komplike sistemler görev alır
• Yıllar içinde DNA tamir enzimleri değişkenlik
göstermemiş bu da DNA tamir enzimlerinin ve
tamir sistemlerinin doğru foksiyonun yaşam için
önemini gösterir.
• İnsanda, ~ 150 DNA tamir geni tesbit edilip
dizilenmiştir.
– Günümüzde halen daha bunların hepsinin görevlerini
bilmiyoruz.
DNA Tamir Sistemleri
• DNA tamir genlerini iki ana gruba ayırabiliriz:
–
Sinyalleme ve regülasyonda görev alan genler
–
Belirli tamir sistemlerinde görev alan genler
–
DNA tamir sistemlerini indirek olarak etkileyen
genler (örneğin, hücre siklus kontrol genleri)
• Bir çok protein farklı DNA hasarlarını tanımada
ve tamirinde bir arada hareket eder.
DNA Hasarına Cevap
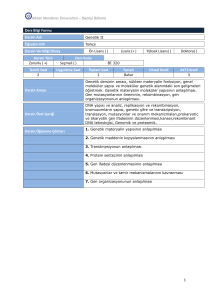
• DNA hasarına karşı hücre 3 yol takip edebilir :
–
–
–
genomdan lezyonu çıkartabilir
hasara rağmen fonksiyona devam edebilir
(hücresel metabolizmayı etkiler ve kanser
veya hücre ölümüne yol açar)
hücre siklusunu teşvik eder veya apoptoz
yolağını aktive ederek hücre ölümüne yol
açar
DNA Hasarına Cevap
DNA tamir
mekanizmasının
aktivasyonu
Lezyon tamiri
Normal hücre
çoğalması ve
diferensiyonu
Normal gelişim
Hücre siklusu kontrol
durdurulması
Tamir aktivasyonu
eksikliği
Hücre siklusu kontrol
ünün eksikliği
Daha fazla hasar
oluşumu
Lezyonun
devamı
Apoptoz
Anormal hücre
çoğalması ve
diferensiyonu
Anormal gelişim
Hücre Siklusu
Yüksek metabolizma DNA sentezi
• Bir hücre bölünmeye başladığı
Hücre büyümesi
ve bölünmeyi tamamladığı ana kadar
geçen zamana hücre siklusu (döngüsü) denir.
• İnterfaz- hücrenin bölünmeye hazırlandığı
evre:
• G1 evresi: ATP sentezi, protein sentezi
• S evresi: DNA replikasyonu
• G2 evresi: hücre bölünmesinden önceki son evre
• Mitotik faz- çekirdek ve sitoplazma bölünmesi
Hücre Siklusu
• Hücrenin DNA hasarına yanıt verebilmesi için
hücre siklusunun doğru kordinasyonu büyük
önem taşır.
• Tüm DNA tamir sistemleri ve stres sensörleri
hücre siklusu ile yakın iletişim halindedir.
• Bazı DNA hasarı sensörleri hücre siklusu
kontrol mekanizmasını ve apoptotik hücre
ölümünü aktive edebilir.
Hücre siklusu kontrol mekanizması
• Hücre siklusu G1/S veya G2/M kontrol noktalarında
DNA sentezi ve hücre bölünmesi gerçekleşmeden önce,
DNA tamir mekanizmalarının devreye girerek hasarı
tamir etmesine izin verir.
Mitosis
M
G2
S
DNA
Synthesis
G1
G0
Resting
Kimya alanında Nobel Ödülü
Kimya alanında Nobel Ödülü
• Tomas Lindahl– Genoma her gün binlerce hasar olduğunu farketti
– Bu sıklık normal insan yaşamına göre uygun
olmadığını öne sürdü
– Dolayısıyla DNA hatalarının tamiri için moleküler
sistemlerin olması gerektiğini öne sürdü
• 35 yıllık başarılı çalışmanın sonucu
• Lindahl, baz eksizyon tamirinin moleküler
mekanizmasını tanımladı
Kimya alanında Nobel Ödülü
• Aziz Sancar– Nükleotid eksizyon tamir sisteminde görev alan
uvrA, uvrB ve uvrC genlerini tanıplayıp karakterize
etti.
– Bu enzimler UV’nin yol açtığı hasarların
tanımlanmasında ve DNA’nın tamirinde görev alır.
Kimya alanında Nobel Ödülü
• Paul Modrich– Yanlış eşleşme tamir sistemi
– Yanlış eşleşmenin hangi DNA ipliğinde
gerçekleştiğini metilasyon düzeyi ile anlayarak
tamir edildiğini tanımladı.
DNR Tamir Sistemleri
• Hasarın direk tersine çevrilmesi
– Fotoreaksiyon (bakteri, maya, bazı
omurgalılarda – insanlarda değil)
• Eksizyon Tamiri – hasarlı DNA’nın
çıkarılması.
• Üç ana metod:
• 1) baz eksizyon tamiri
• 2) nükleotid eksizyon tamiri
• 3) yanlış eşleşme tamiri
• Çift zincir kırıklarının tamiri
DNR Tamir Sistemleri
Genellikle DNA tamir sistemleri üç ana adımı takip eder:
1) Eksizyon: DNA’nın hasarlı bölgesinin DNA tamir nükleazları ile
tanımlanması
fosfodiester bağların hidrolizi ve hasarlı bazların atılması
DNA sarmalında kısa boşluklar)
2)
Sentezleme: DNA polimerazı DNA’nın 3’-OH ucuna bağlanarak
DNA sentezler (templat/ hasarsız DNA ipliğini tamamlayan
kopya)
3)
Bağlama (ligasyon): Polimerazın oluşturduğu boşluk DNA ligaz
ile kapatılıyor
5’
3’
3’
5’
DNA ipliğinde hasar oluşması
5’
3’
3’
5’
1. basamak
DNA ipliğinde oluşan
hasarın eksizyonu
5’
3’
3’
5’
2. basamak
DNA polimeraz ile
yeniden sentezlenme
5’
3’
3’
5’
3. basamak
5’
3’
DNA Ligaz ile oluşan
boşluğun sentezlenmesi
3’
5’
Baz Eksizyon Tamiri (BER)
• Baz eksizyon tamiri ne tür hasarların tamirinde
görev alır?
• Genellikle küçük lezyonların tamiri
• Substratları:
– Deamine olmuş C’ler
– Deamine olmuş A’ler
– Alkillenmiş veya oksitlenmiş baz
Baz Eksizyon Tamiri (BER)
• DNA tamiri nasıl gerçekleşir?
• Bir çok DNA glikozilaz
• Her biri belirli substratları hedefler
• İki yolak vardır:
– Kısa patch : bir nükleotid tamiri
– Uzun patch: 2-12 nükleotid tamiri
• BER’in % 25’i uzun BER ile tamir olur
• İki yolağın da ilk aşamaları aynidir
BER: Escherichia coli (E. Coli)
•DNA’daki hasarlı baz glikozilaz
ile DNA’dan alınır AP
(apurinik/apirimidinik
bölge site) bölgesi oluşur
•AP endonükleaz DNA ipliğini
keser
•DNA pol I DNA sentezler
•DNA ligaz oluşan boş DNA
ipliğini bağlar
Hasarlı baz
Hasarı
tanımlanma
Glikozilaz
APE1
OGG1
NTH1
Kısa patch
Glikozilaz
UNG
AAG
Uzun patch
Kesme
Pol δ/
ε
FEN1
Pol β
Pol β
Bağlama (Ligasyon)
APTX
Pol β
Lig 3
XRCC1
Pol δ/
ε
FEN1
PCNA
Pol β
Lig 1
XRCC1
BER Sistemi ve Anomaliler
• Farede glikozilazların delesyonu belirgin fenotip
değişikliği göstermemiştir
• DNA pol β’nın somatik mutasyonları kanser ile
ilişkilendirilmiştir.
• Oksitlenmeyi engellemekte rol alan MYH genindeki
mutasyonlar kalın bağırsak kanseri ile ilişkilendirildi
• DNA polimeraz β, Apex, DNA ligaz 1 ve Fen 1’deki
mutasyonlar embriyonik letal
Nükleotid Eksizyon Tamiri (NER)
• Multi-protein tamir sistemi
– 20 -30 protein beraber çalışıyor
• Farklı tiplerde DNA hasarı tamir etmektedir
– UV radyasyon sonucunda oluşan hasar
– büyük lezyonlar
• BER’den farklı olarak, baz değişikliklerinden dolayı
oluşan hasarı aramak yerine, DNA sarmalında olan
hataları araştırır
• Genellikle hücre siklusunun G1 aşamasında görev
alır.
NER
• İlk olarak E. Coli’da UV hasarına karşı yapılan
tamir ile belirlenmiştir.
• UV direnci için görev alan genler tesbit
edilmiştir: UvrA, UvrB and UvrC.
• Ekstarktlar kullanılarak bu genlerin görev aldığı
mekanizmalar tanımlanmıştır.
NER: E. Coli
uvrAB - ATP-helikaz DNA’da
hasar taraması yapar.
DNA hasarı tesbit edildiğinde,
uvrAB - ATP-helikaz bölgede
sabitlenir ve DNA’nın
katlanmasına sebep verir
uvrA kompleksten ayrılarak, uvrC
işleme dahil olur
NER: E. Coli
NER
• 2 yolağı vardır:
–
–
•
Global genom tamiri (GGR)- genomdaki hasarların tamiri
Transkripsiyona kenetlenmiş tamir (TCR): transkripsiyon
olan DNA ipliğindeki DNA hasarının tamiri
Bu iki yolak arasındaki fark
–
–
Hasarın transkripsiyon olan bölgesinde olup
olmadığıdır
Hasarı tanımlamada kullanılan proteinlerin farklı
olmasıdır
DNA sarmalındaki hataların tanımlanması için multi protein kompleksi DNA’yı tarar
(tek tek baz değişikliklerini taramaz)
Hasarlı bazlar
İlk aşamada hasarın
transkripsiyon olan
DNA ipliğinde olup
olmadığı tesbit edilir Global genom tamiri
(GGR)
Hasar tanımlanması
Transkripsiyona
kenetlenmiş tamir
(TCR)
DDB2
DDB1
XPC
HR23B
Hasarlı bölgeye
bağlanma
RNA
pol II
RPA
XPF
ERCC2
ERCC3
XPA
XPG
RNA pol II
ERCC1
Helikaz aktivitesi
ERCC2
ERCC3
DNA sentezi ve
ligazyon
Pol
δ/ ε
RPA
RFC
Lig 1
Hasarlı bölgede 24-32 bazlık
bir dizi kesilir
GGR
Hasar aktif transkripsiyon bölgesinde değilse XPC ve
HR23B proteinleri tarafından tanımlanır
Farklı proteinlerde bu bölgeye bağlanarak DNA
ipliğini stabil tutar
RPA-DNA ipliğine bağlanarak koruma görevi yapar
Transkripsiyona kenetlenmiş tamir (TCR)
Transkripsiyon olan DNA ipliğindeki hasar genellikle
daha hızlı tamir olur
Hasar daha az yapısal bozukluğa sebep olur
TFIIH’nin hasarlı bölgeye entegre olmasına CSA ve
CSB görev aldığı düşünülüyor.
TFIIH hasarlı bölgede DNA sarmalının 20-30 bazlık
bölgesinin açılmasını sağlıyor
XPB ve XPD helikaz ve XPG nükleaz RNA
polimerazının hasarlı bölgeden ayrılmasında görev
aldığı düşünülüyor
NER’in son aşamaları (GGR ve TCR)
XPG, 3’ tarafından hasarlı bölgeden
yaklaşık2-8 baz keser
ERCC1/XPF, 5’ tarafından hasarlı bölgeden 1524 baz keser
DNA sentezi bir çok protein ve ligaz ile
gerçekleşir
NER Sistemi ve Anomaliler
• NER genlerindeki mutasyonlar DNA tamir
sistemlerindeki hastalıklarla ilişkilendirilmiştir
• Xeroderma pigmentosum (XP):
– multigenik, otomozal resesif hastalık
– Foto duyarlılığı- deri kanserleri
– NER’de görev alan farklı genlerin mutasyonu sebep
olabilir
NER Sistemi ve Anomaliteler
• Cockayne sendromu (CS):
– otomozal resesif hastalık
– Fiziksel ve mental gerilik, mikrosefali, nöral
defektler, ve uzun kollar bacaklar.
– CS hastalarıda XP gibi ışığa duyarlıdırlar ancak bu
hastalarda kanser oluşmaz
– mutasyonlar - CSA ve CSB
NER Sistemi ve Anomaliteler
• Trichothio distrofi (TTD):
– otomozal resesif hastalık
– Kırılgan saç ve ihtiyosis (derinin pul pul olması).
– Kısa boy, mental retardasyon ve farklı yüz
özellikleri
– XP genlerindeki mutasyonlar (XPB veya XPD
TFIIH’i kompleksi komponentleri)
NER Sistemi ve Anomaliler
• Embriyonik gelişim
• Ercc1 (DNA çift zincir kırığı onarımında da görev alır)
eksikliği, dişi ve erkek farelerde infertiliteye sebep olur
ve bu genin doğru fonksiyonu gametogenezde büyük rol
oynar
• Ercc1’in yokluğunda, oosit matürasyonunda primer
folikülleri oluşmaz ve dejenere olurlar.
• Ercc1 ve Xpf genlerindeki yanlış ifadeler yuvarlak
spermatidlerin oluşumuna sebep olur
NER Sistemi ve Anomaliteler
• Embriyonik gelişim
• Defektif NER- (çift mutant Csb ve Xpa veya Xpc)
fareler hayatta kalıyor, ancak gelişim retardasyonu,
ataksia & motor disfonksiyonu
• Farelerde Xpd yokluğu embriyonik lethal
(preimplantasyon)
• Farelerde Xpg yokluğu postnatal defektleri
ölüm
Yanlış Eşleşme Tamiri (MMR)
• Yanlış eşleşme (mismatch) tamiri- replikasyon hataları
• Yanlış eşleşme- sitozinin deamine olması T oluşturarak G
ile yanlış eşlenmesine yol
• Neleri tamir eder?
• baz-baz yanlış eşleşme
• insersiyon/delesyon döngüleri
• Yanlış eşleşmeler 100’den başlayarak 1000’den fazla bazı
içerebiliyor
Yanlış Eşleşme Tamiri
• Yanlış Eşleşme Tamiri çift yönlüdür – DNA’nın 3’ veya
5’ yönünden başlayarak yanlış eşleşmeyi tamir edebilir
• Yanlış eşleşen bazlar, DNA glikozilaz bulunan ortamda
baz eksizyon tamir sistemi ile de tamir edilebilir
Yanlış Eşleşme Tamiri
• DNA replikasyonundan sonra aktiftir
• Yanlış eşleşme tamir sistemi G2 hücre siklusu kontrolünde
görev alıyor.
• Yanlış eşleşme tamiri hücre siklusu kontrolünde iki şekilde
görev alabilir:
– Yanlış eşleşme tamir proteinleri direk olarak hücre siklusu
kontrolü proteinleri ile ilişkili olup hücre siklusunu durdurur
– Yanlış eşleşme tamiri, DNA hasarını işleyerek hücre siklusu
kontrolünün aktivasyonunu sağlar
Yanlış Eşleşme Tamiri
• Tamir üç ana aşama ile gerçekleşir;
– Tanımlama
– Eksizyon
– DNA sentezi
Yanlış Eşleşme Tamiri: E.Coli
İnsanlarda Yanlış Eşleşme Tamiri
• Yanlış eşleşmenin tanımlanma mekanizması tam
olarak bilinmiyor
• Hücre ekstraktlarında yapılan çalışmalarda
tanımlamanın replikasyon çatalının yapısından
olabileceğini öne sürüyor
• İnsanlarda bakterilerden farklı olarak farklı protein
kompleksleri yanlış eşlenen baza bağlanır (MutSα:
MSH2/MSH6 and MutSβ: MSH2/MSH3)
Yanlış Eşleşme Tamiri
Yanlış eşleşme ve halkaların tanımlanması farklı proteinleri içerir
MutSb
MutSa
5’
3’
MSH2
MLH1
G MSH6
3’
5’
T
5’
3’
PMS2
MutLa
MSH2
MLH1
MSH3
PMS2
3’
5’
MutLa
5’
G
3’
5’
3’
3’
C
5’
3’
5’
Yanlış Eşleşme Tamiri
• Eksizyon işleminin mekanizması da tam olarak
bilinmiyor.
– ATP’ye bağlı olduğu düşünülüyor
– Ekzonükleazlar yanlış eşlenen bazın her iki
tarafından da keserek eksizyon işlemini
gerçekleştirdiği düşünülüyor
– Bazı çalışmalar ise eksizyonun başlayabilmesi için
DNA zincirinde önceden kesik olması gerektiğini
savunuyor
Yanlış Eşleşme Tamiri: Hangi DNA zinciri hatalı?
• Replikasyon esnasında olan bir kesikten ötürü memeliler
hangi DNA zincirinde yanlış eşleşme olduğunu ayırt
edebildiği öne sürülüyor
• Bazı çalışmalar ise PCNA proteinin kesiti tanımlamada ve
tamiri başlatmada rol oynadığını raporluyor.
Yanlış Eşleşme Tamiri
Yanlış eşleşme tamirinde görev alan genlerin farklı
türlerde de homologları vardır
Yanlış Eşleşme Tamiri ve Anomaliler
• Yanlış eşleşme tamirinde görev alan genlerdeki
mutasyonlar Lynch sendromu (kalın bağırsak
kanserine ve farklı kanserlere yatkınlık)
• MSH2 veya MLH1 olmadığında Lynch sendromu +
farklı tümörler gelişiyor
• MSH3 veya MSH6 olmadığında endometriyel
kanser + kansere yatkınlık
• MLH3 veya PMS2 olmadığında trinükleotid tekrar
instabilitesi (Fragile X)
Yanlış Eşleşme Tamiri ve Anomaliler
• Embriyonik gelişim:
• Yanlış Eşleşme Tamir genlerindeki anomaliler anormal
spermatid fenotipine yol açıyor
• Msh2, Msh3 ve Pms2 genleri uzamış fare spermatidlerinde daha
az ve hatta hiç bulmaz
• Pms2, Mlh1 ve Mlh3 genleri farelerde yok edildiğinde
dişi ve erkek fareler infertil olur
• Mlh3 geni fare oositlerinde yok edildiğinde mayoz
bölünme tamamlanamaz
• Msh4 ve Msh5 inaktive edildiğinde, mayoz bölünme hem
oositte hem de spermde durur
Yanlış Eşleşme Tamiri ve
mikrosatellit instabilitesi (MSI)
Mikrosatellitler insan genomu boyunca dağılmış olan basit
ve kısa nükleotid tekrarlarıdır.
•Tekrarlayan birimlerin delesyonu veya insersiyonu
sonucunda segment uzunluğunun değişmesine
mikrosatellit instabilite (MSİ) denilmektedir.
•MSİ, genom üzerindeki mutasyonların ve DNA tamir
yetersizliğinin bir öncüsü olarak tanımlanır ve bu yüzden
yüksek mutasyon hızı ile bağlantılıdır.
•MSİ kalın bağırsak tanısında biyomarker olarak
kullanılır
Çift Zincir Kırıkları
• Çift zincir kırıkları yapısal değişikliğe sebep
olurlar
• Oluşum sebepleri:
• Egzojen: radyasyon ve kimyasallar
• Endojen: gen değişiklikleri, mayoz bölünme, ROS
hasarı, replikasyon çatalı hataları
Çift Zincir Kırığı Tamiri
• Tamir edilmeyen çift zincir kırıkları hasara ve
apoptoz ile hücre ölümüne sebep olur
– Translokasyonlar (bir kromozomdan kopan bir
parçanın başka bir kromozoma yapışması)
• İki çeşit çift zincir kırığı tamir mekanizması vardır:
– homolog rekombinasyon (HR)
– non-homolog uç birleştirme (NHEJ)
Çift Zincir Kırığı Tamiri
• Diğer tamir mekanizmalarında bir çok organizma ayni
yolağı izler (örneğin E.coli ve memeliler), ancak çift
zincir kırığı tamirinde organizmalar farklı yolak
izlerler.
• Örneğin, Deinococcus radiurans bir çeşit bakteridir ve
yüksek radyasyona maruz kalmasına karşın hayatta
kalır
– Bunun sebebi de genomunun bir çok kopyası olması ve
homolog rekombinasyonu kullanarak DNA’yı tamir
edebilmesidir.
• Mayalarda da genellikle homolog rekombinasyon
tamiri kullanılır.
• Bunlardan farklı olarak ise memeliler çoğunlukla nonhomolog uç birleştirme tamir sistemi kullanılır.
Bakterilerde Non-homolog uç birleştirme
• Non-homolog uç birleştirme
sisteminde homolog kromozoma
ihtiyaç yoktur.
• Ku proteini tarafından kırık
belirlenir
•DNA ligaz ile kırık bölge
birleştirilir
Non-homolog uç birleştirme
• Hücre siklusunun G1 aşamasında aktifdir.
• İki yolağı vardır;
– Klasik non-homolog uç birleştirme
– PARP1 proteine bağlı non-homolog uç birleştirme
Non-homolog Uç Birleştirme
(A) Ku70/80 kırık DNA’ya bağanır DNA-PKcs
de bağlanır.
DNA-PKcs kırığının DNA’yı degrede
etmesinden korur.
(B) DNA şekil değiştirir ve farklı proteinlerde
bölgeye entegre olur.
(C) İki yolaktaki fark, değişik proteinlerin kırığı
onarmasında rol almasındandır.
(D) DNA sentezi ligase IV/XRCC4 ile gerçekleşir.
Non-homolog Uç Birleştirme ve
Anomaliler
• Ataksi telenjiektazi (AT):multisistem hastalıkmental retardasyon, serebellar ataksi, immün
yetmezliği ve artmış kanser riski
• ATM geninde mutasyon
Non-homolog Uç Birleştirme ve Anomaliler
• DNA-PKcs- hücre siklusunda önemli rolü var
• B ve T hücrelerinin gelişimini non-homolog uç birleştirme
sistemine bağlıdır
– Bu sistemdeki hatalara bağlı olarak bağışıklık sistemi ile ilişkili
hastalıklar gelişiyor.
• Non-homolog uç birleştirme sisteminde görev alan
genlerdeki mutasyonlar immün yetmezliğine yol açıyor:
– Ağır kombine immün yetersizliği (SCID)- B ve T hücrelerinin
gelişiminde bozukluklar (DNA-PKcs)
– LIG4 Sendromu- multipl miylom, SCID (Ligaz IV)
– SCID (Artemis)
– SCID- mikrosefali (Cernunnos)
Non-homolog Uç Birleştirme ve
Anomaliler
• Embriyonik gelişim:
• ATM ve DNA-PKcs eksikliği farelerde
embriyonik lethal
• Ku70, Ku80 veya DNA-PKcs mutantları
bağışıklık sistemi bozuklukları, gelişim geriliği
ve infertilite
Homolog Rekombinasyon Tamiri
• Homolog rekombinasyon tamir sisteminin
hata oranı yok sayılabilir
• Hücre siklusunun S (sentez) ve G2/M
fazlarında aktiftir.
• Homolog rekombinasyon tamir sistemi
homolog kromozomun dizisini kullanarak
hasarlı bölgeyi sentezler
Bakteride homolog rekombinasyon
tamir sistemi
• Ekzonükleaz ile kırık bölge kesilir.
•Protein yardımı ile homolog kromozomu
kullanarak DNA polymerase (POL) ile
sentezlemeye başlar.
•DNA ligaz ile geriye kalan kesikler
sentezlenir.
Memelilerde homolog rekombinasyon tamir sistemi
•Protein kompleksi tarafından
tanımlanır
•RAD51, RAD52 gibi proteinlerle
homolog kromozom kullanılarak DNA
sentezi yapılır.
BRCA1
BRCA2
Homolog rekombinasyon tamir sistemi
ve Anomaliler
• Farelerde Parp1 delesyonu veya inaktivasyonu
homolog rekombinasyon.
• HeLa kanser hücrelerinde RAD51’in inaktivasyonu hücre
siklusunda hatalara sebep olur.
• HeLa kanser hücrelerinde RAD51’in inaktivasyonu hücre
siklusunun G2/M fazında durmasına sebep olur
• XRCC3 yokluğunda hücre bölünmesinde hatalara yol
açar sayısal kromozom anomalileri
Homolog rekombinasyon tamir
sistemi ve Anomaliler
• Nijmegen breakage sendromu (NBS):mikrosefali,
bağışıklık sistemi yetmezliği & kanser riski
• NBS1 geninde mutasyon
• HR tamir sisteminde görev alan genlerdeki
mutasyonlar HR tamirinde hatalara yol açar
– RAD51, RAD51C/D, BRCA1/2 ve XRCC2/3
genlerindeki hatalar kanser riskini artırır:
• lösemi
• Göğüs ve over kanserleri
Homolog rekombinasyon tamir
sistemi ve Anomaliler
• Embriyonik gelişim
• Mre11, Rad50, Nbs1, Brca1, Brca2, ligase
IV, Xrcc1 veya Xrcc4 genlerinde
mutasyonlar fare embriyolarında lethal
• 53BP1 ve RAD52 embriyonik genomun
aktivasyonunda görev aldığı düşünülüyor
Çift zincir kırıklarında hangi sistem kullanılır:
HR veya non-homolog uç birleştirme
• İki sistemin birbiri ile yarış içerisinde olduğu
düşünüyor.
• HR sisteminde çift zincir kırığını tanımlayan
proteinler non-homolog uç birleştirme
sisteminde görev alan proteinleri baskılayarak
tamir işlemini gerçekleştirmeye çalıştığı
düşünülüyor
Çift zincir kırıklarında hangi sistem kullanılır:
HR veya non-homolog uç birleştirme
• Hücre siklusu:
– HR tamiri için homolog kromozom şarttır, dolayısı
ile hücre siklusunun S ve G2 fazlarında aktiftir
• Hasar tipi:
– Replikasyon çatalı hataları basitce uç birleştirme
ile gerçekleşemez
HR ve non-homolog uç birleştirme
tamir sistemleri ve anomaliteler
• Göğüs & over kanseri (BRCA1 & BRCA2)
• Her iki sistemde defektler yaşam riski, az dozda
radyasyona karşı bile sensitivite
• Her iki sistemde defektler kromozom instabilitesine
yol açar (kromozom kayıpları, translokasyonları)
• RAD50 genindeki defektler Fanconi anemiye yol açar
(gelişim geriliği, mikrosefali, deri pigmentasyon
anomalileri, kardiyak, renal ve gastrointestinal
anomaliler)
• Dolayısı ile çift zincir kırıklarının tamiri normal gelişim
için çok önemlidir.
DNA İpliği Arası Çapraz Bağlar
• DNA ipliği arası çapraz bağlara
• Çevresel mutajenlere maruz kalma ve
•Toksinlere maruz kalma sebep olur
• Bu çapraz bağlar DNA ipliklerini ayrılmasını engelleyerek
transkripsiyonu ve replikasyonu durdurur.
• Çapraz bağların tamirinde görev alan genlerin hepsi henüz
tanımlanmadı ancak bir çok farkı tamir sisteminin bir arada
çalışması ile tamir gerçekleşiyor:
•nükleotid eksizyon tamiri, homolog rekombinasyon tamiri,
translezyon sentez tamiri
DNA İpliği Arası Çapraz Bağlar
HR tamiri
Nükleotid eksizyon
tamiri ve HR tamiri
•Kompleks sistem!
•Bir çok protein
Özet
• Egzojen metabolitler, kimyasal ve radyasyon
gibi, veya endojen metabolitler, kimyasal
modifikasyonlar gibi, DNA hasarına sebep olur.
• Genomda farklı lezyonlar gözlemlenir.
– Yanlış eşleşme
– DNA kırıkları
– Çapraz bağ oluşumu
Özet
• DNA tamir sistemleri komlike mekanizmalardan
oluşur.
• Bir çok farklı protein bir arada görev alır ve bunların
birbirleri ile iletişimi çok önemlidir.
• Son yıllarda yapılan çalışmalar ile
– DNA tamir sistemlerinde görev alan proteinlerin yapısı,
– DNA-protein arasındaki iletişim
– proteinler arasındaki iletişim daha iyi anlaşılmıştır
Özet
• DNA tamiri gerçekleşemediğinde, hasarlı bazların ve
kırıkların tamiri gerçekleşemez bu da genomdaki
mutasyonlara ve kromozom bozukluklarına sebep olur.
• Memelilerde DNA tamir sistemleri çalışmadığında,
doğuştan defektlere, kansere ve hatta yaşam süresinde
kısalmaya sebep olur.
• Hayvanlarda ve insanlarda DNA tamir genlerinin
eksikliğinin hastalıklara sebep olduğu biliniyor, bu da
DNA tamir mekanizmalarının önemini vurguluyor.
Özet
• DNA hasarı ve tamiri arasındaki denge hücrenin ve
organizmanın gelişip gelişemeyeceğini, yaşayıp
yaşayamayacağını belirleyen etkenlerden biridir.
• Gelişim döneminde farklı DNA tamir genlerinin ve
proteinlerinin görev alması, DNA tamir sistemlerinin
farklı gelişim dönemlerinde farklı görevleri olduğunu
gösteriyor.
• DNA tamir mekanizmasında görev alan bir çok protein ve
enzim farklı hücresel yolaklarda da görev alır (örneğin
replikasyon ve transkripsiyon).
Özet : DNA tamir sistemleri
• Memelilerde 4 ana tamir mekanizması vardır:
• Baz eksizyon tamiri → hasarlı
bazlar (alkilasyon & oxidasyon hasarlarının
tamiri)
• Nükleotid eksizyon tamiri → hasarlı
nükleotidlerin tamirinde görev alır
• Yanlış eşleşme tamiri → Bazlar hasar görmez
•
→ DNA replikasyon hatalarının tamirinde
kullanılır (G2/M
hücre siklusu kontrolünde
kullanılır)
Özet: DNA tamir sistemleri
• Çift zincir kırıklarının tamiri → çift zincir
kırıkları (kromozom kayıpları veya
translokasyonları)
• Homolog rekombinasyon tamiri → hata oranı
yok sayılabilir, homolog kromozomu sentez
için kullanır (S/G2 hücre siklusu)
• Non-homolog uç birleştirme→ hata oranı daha
yüksek (G0/G1 hücre siklusunda aktiftir)
Özet : Baz Eksizyon Tamiri
• Baz eksizyon tamiri reaktif oksijen türlerinin veya egzojen
ajanların sebep olduğu hasarlı bazların tamirinde kullanılır
• İki yolağı vardır:
– kısa-patch- bir nükleotid tamir eder
– uzun-patch- 2-12 nükleotid tamir eder
• Memelilerde bu iki yolağın ilk aşamaları aynidir
– Hasarlı baz eksizyon ile kesilip atılır
– bir çok protein beraber çalışarak DNA sentezini yapar.
– İki yolak arasındaki fark en son aşamadır. Bu aşamada farklı
proteinler görev alarak DNA kesiğini sentezler.
Özet : Nükleotid Eksizyon Tamiri
• Bu tamir sistemi bir çok proteinin beraber çalışması ile
gerçekleşir.
• UV radyasyon, çevresek karsinojenler, kimyasallar ve
endojen metabolitlerin yarattığı hasarı tamir eder
• İki yolagi vardır: global genomik tamir ve transkripsiyona
kenetlenmiş tamir sistemleri
• Bu iki yolak arasındaki fark tanımlama aşamasında kullanıan
proteinlerdir
• İnsanlarda global genomik tamir sistemi aktif transkripsiyon
olan bölgelerin dışındaki bölgelerdeki hasarı tamir ederken,
transkripsiyona kenetlenmiş tamir sistemi transkripsiyon
aktif bölgedeki DNA hasarını tamir eder.
Özet: Yanlış eşleşme tamir sistemi
• Yanlış eşleşme tamir sistemi DNA replikasyonu
esnasında oluşan hataları tamir eder.
• Diğer tamir sistemlerinden farkı, bazlar hasarlı
değildir.
• Tamir yanlış eşlenen bazlar veya halkaların oluşması
veya delesyonunu tamir eder
• Bu tamir sistemi de eksizyon, sentez ve ligasyondan
oluşur. Bir çok proteinin beraber çalışması ile tamir
gerçekleşir.
Özet: Çift zincir kırıkları- homolog
rekombinasyon tamiri
• Homolog rekombinasyon tamir sistemi çift
zincir kırıklarını homolog kromozom kullanarak
tamir eder.
• DNA templatı kullanılarak sentez yapılır ve ligaz ile
kırık DNA iplikleri birbirne bağlanır.
• Bu tamir sisteminin hata oranı daha düşütür
Özet: Çift zincir kırıklarınon-homolog uç birleştirme tamir sistemi
• HR tamir sistemine göre hataya daha açıktır
• Bu sistem kırık uçları proses ederek birbirlerine
bağlanabilmesi için uyumlu hale getirir
• Daha sonra DNA birbirlerine ligaz ile bağlanırlar
Ofis: 402, Tıp Fakültesi