1.
Dr. Bülent Mustafa Yenigün
Ankara Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı İbn-i Sina Hastanesi
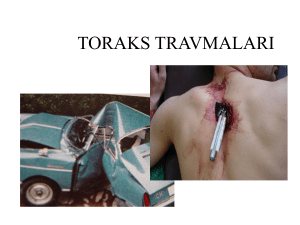
TORAKSIN CERRAHİ ANATOMİSİ
Tüm meslekler için çalışacakları sahayı çok iyi bilmek yaptıkları işin en önemli
ayrıntısıdır. Cerrahlar için ise anatomiye hakim olmak ön koşuldur. Göğüs cerrahları,
riskli ve en küçük hatada dahi telafisi zor hatta kimi zaman imkansız bir anatomik
bölgede çalışır. Çünkü bu bölge de aort, innominate, karotis, subklavyen, vena kava
süperior ve inferior, azygos, pulmoner arter ve venler gibi büyük vasküler yapılar,
kalp, özofagus, trakea gibi yaralanmaları hayatı tehdit eden organlar vardır.
Bu yazıda toraksın cerrahi anatomisi ana başlığı altında göğüs duvarı, sternum ve
kostalar, trakeobronşial sistem, akciğerler, pulmoner vasküler sistemi, özofagus,
diyafragma, duktus torasikus alt başlıkları ile anlatılacaktır.
Göğüs Duvarı
Toraks; önde sternum ve kıkırdak kostalar, arkada torakal (Th) vertebra korpusları
ve yanlarda kostalar ile çevrili kafes olarak tanımlanabilir. Apertura torasika süperior
(ATS), önde manibrum sterni, arkada Th1. vertebra, ve yanlarda 1. kostanın iç
yüzlerinin çevrelemesi ile oluşur. ATS’nin ön-arka çapı 5 cm, transvers çapı 11
cm’dir. Torasik inlet adı da verilen bu üst açıklıktan özofagus, trakea, mediastenin
üst sınırını oluşturan, plevra kupulası, büyük vasküler yapılar, nervus vagus, duktus
torasikus geçer. Toraksın alt girişi ise apertura torasika inferior (ATİ), önde
sinkondrosis ksifosternalis, arkada Th12 vertebra, yanlarda arkus kostalis ve ile
sınırlıdır ve diyafragma tabanını oluşturur.
Sternum ve Kostalar
Sternum yaklaşık 15-17 cm uzunluğunda insanda en fazla eklem yüzeyi bulunan
kemik yapıdır. Manibrum, korpus ve ksifoideus olmak üzere 3 bölümden oluşur.
Manubriumun üst kısmı iki taraftan klavikula ile eklem yapar. İlk 7 kosta bilateral
sternum üzerinde ayrı ayrı eklem yüzeyi vardır. Bunlardan 1. kosta manubrium
1
üzerinde, 2. kostanın ise manubrium ile korpus sterni arasında yarı hareketli eklem
olan ve angulus sterni (Louis açısı) ismi ile anılan bölgede eklem yüzeyi varken diğer
kostalar korpus sterni üzerinde eklem yaparlar. Louis açısı fizik muayene ile palpe
edilebilir, bu nedenle Louis açısının topografik anatomisinin iyi bilinmesi gereklidir
çünkü;
T4 korpusunun alt kenarı hizasından geçer
Mediastinumu süperior ve inferior şeklinde ikiye ayırır
Oskültasyon yapılırken akciğer üst lobu ve alt lobu arasındaki sınırı oluşturur
Arkus aortanın başlangıç ve bitişini belirler (çıkan aortanın bitişini,
inen
aortanın başlangıcını belirler)
Bifurkasyo trakeadan geçer (Resim 1.1)
Resim 1.1:Louis açısının topografik anatomisi
Kostalar kaput, kollum, tüberkül ve korpus olmak üzere 4 kısımdan oluşur. Her
kostanın alt kenarında sulkus kosta denilen oluk bulunur. Bu oluk içerisinde
v.interkostalis, a.interkostalis ve n.interkostalis bulunur. Bu yapıların kostaların
altında seyretmesi nedeni ile yapılara zarar vermemek için torasentez kostanın üst
kenarından, interkostal blokaj ise kostanın alt kenarından yapılır. Toraks iskeletinde
12 çift kosta bulunur. İlk 7 kosta doğrudan, 8,9,10. kostalar ise ortak bir kıkırdak kosta
ile 7. kostaya tutunarak dolaylı olarak sternum ile eklem yapar. Onbirinci ve 12.
kostalar ise serbest kostalardır. Yedinci kosta ve bu kostaya eklem yapan diğer
kostaların kıkırdakları arkus kostayı, iki arkus kosta arasındaki açı da angulus
infrasternalisi oluşturur. Kosta yayı ile ksifoid arasında sağ ve sol tarafta iki tane açı
2
kalır. Bunlardan angulus infrasternalis sinistra adı verilen sol taraftaki, perikarda
perikardiyosentez için pnömotoraks oluşturmadan direkt giriş noktası olması nedeni
ile önemlidir.
Tanımlanan kostanın üzerindeki aralık kot yatağı iken, altındaki aralık ise interkostal
aralık (İKA) olarak tanımlanır. Örneğin standart posterolateral torakotomi kesisi 6. kot
yatağından bir başka deyişle 5. interkostal aralıktan yapılır. Torakotomi kesisi
sırasında cilt, ciltaltı yağ dokusu, latissimus dorsi ve serratus anterior kası ile arkada
bu
kasların
fasyası,
interkostal
kas
katmanları
(m.interkostalis
eksternus,
m.interkostalis internus,m.interkostalis intimi) geçilerek toraks boşluğuna ulaşılır
(Resim 1.2).
Resim 1.2: Cilt-cilaltı yağ dokusu ve latissimus dorsi kası-serratus anterior kası-toraks
boşluğuna kosta üzerinden giriş yeri (A.Ü.T.F-Göğüs Cerrahisi A.D, Doç.Dr.Ayten Kayı
Cangır arşivinden alınmıştır)
Trakeobronşial sistem
Trakea, vokal kordların 1,5-2 cm altından ve krikoid kartilajdan sonra başlar. Arkaya
aşağıya uzanarak Th4 vertebra seviyesinde karinada sonlanır. Karinada, sağ ve sol
ana bronşa ayrılır. Uzunluğu yaklaşık 10-14 cm olup, 18- 22 adet kıkırdak halkadan
oluşur ve her iki kıkırdak yakşalık 1 cm’dir. Kadınlarda daha kısadır. Troid istmusu
trakeayı önden ikinci ve üçüncü kıkırdak halka hizasında çaprazlar. Bunun altında
innominate (brakiosefalik) arter trakeanın anterior duvarı boyunca oblik olarak geçer.
Arka duvarı özofagus ve vertebra ile komşudur. Arkus aorta distal trakeanın
anterolateral yüzeyinin üzerine doğru uzanır ve sol ana bronş üzerinden geçer.
Azygos veni sağ ana bronş üzerinde trakeobronşial açıda kavislenir. Trakea
komşuluklarının cerrahi olarak çok iyi bilinmesi trakea rezeksiyonu sonrası
oluşabilecek fistül komplikasyonlarının (trakeovasküler-trakeoözofageal) önceden
önlemini almada ve greft tercihinin uygun lokalizasyonlara yerleştirilmesinde
3
önemlidir. Trakea gençlerde biraz daha esneyebilir iken yaşlılarda daha rijittir, bazen
kalsifikasyon bile olabilir (Tablo 1.1).
Resim 1.3: Trakeobronşial sistem 3 boyutlu radyolojik görünüm. Sağ ve sol ana bronş ile
segment bronşları.(A.Ü.T.F Radyoloji A.D, Prof.Dr. Çetin Atasoy’un arşivinden)
Tablo 1.1: Trakeobronşial
Ağacın Topografik Anatomisinde Trakeobronkoplasti
ile İlgili
Önemli Noktalar
-Trakea, gençlerde yaşlılara göre daha esnektir
-Sağda ara bronş olması nedeniyle, sleeve rezeksiyon teknik olarak daha kolaydır
-Sol ana bronşun daha uzun olması sleeve sol üst lobektomi olma olasılığını/şansını arttırır
ama aorta
ile olan yakın komşuluğu anastomoz için uygun görüşü engeller
-Aorta, karinoplasti yapılırken sol ana bronşun etkin / yeterli mobilizasyonunu engeller
-Sol rekürren sinir, solda bronkoplasti girişimleri yapılırken hasarlanabilir
-Ana ve lob bronşlarının anastomozunda çap farklılıkları önemli sorunlara neden olabilir
Sağ ana bronş trakeadan direk bir çizgi olarak çıkar ve uzunluğu 1,2 – 1,5 cm’dir.
Sağ üst lob bronşunu verdikten sonra sağ ara bronş (intermediate bronş) adını alır.
Ara bronş yaklaşık 2 cm uzunluğundadır. Sağda ara bronşun varlığı en sık yapılan
sleeve lobektominin nedenini açıklar. Orta lob bronşu ara bronşun ön duvarından düz
4
bir hat olarak çıkar. Orta lob bronşu ile aynı seviyede ama ara bronşun arka
bölümünden alt lob superior segment bronşu çıkar daha sonra bronş dört bazal
segment bronşuna ayrılır (Resim 1.3).
Tablo
1.2:
Distal
Trakeanın
ve
Bronşların
Kanlanması
ve
İnnervasyonunda
Trakeobronkoplasti ile İlgili Önemli Noktalar
-Trakeobronkoplastik girişimlerden sonra en sık anastomotik komplikasyonlar sistemik
mukozal kan akımının bozulmasına sekonderdir
-Genellikle, bronşial arter solda iki, sağda bir tanedir
-Trakeanın kanlanması lateral duvar boyunca birbiri ile ilişkili longitudinal pediküllerle olur
-Lober ve segmental bronş düzeyinde, bronşial ve pulmoner dolaşım arasında zengin bir
anastomoz ağı vardır
Sol ana bronş karinadan sağ ana bronşa göre daha oblik bir açı ile ayrılır. Uzunluğu
4-6 cm’dir. Arkus aortanın altından, sol hilusun arkasından geçer, daha sonra üst ve
alt lob bronşlarına ayrılır. Sol ana bronşun daha uzun olması sol üst sleeve lobektomi
olasılığını arttırır ama yakın komşulukta olduğu aorta, anastomoz için uygun görüşü
engeller. Sol üst lob bronşu sol ana bronştan ayrıldıktan hemen sonra superior
trunkusa ve lingular bronşuna ayrılır. Sol alt lob bronşu, üst lobdan ayrıldıktan 0,5 cm
sonra ilk olarak süperior segment daha sonrada bazal segment bronşlarını verir.
Solda ara bronş olmaması, solda sağa göre sleeve rezeksiyonları daha güçleştirir
(Resim 1.3).
Sol rekürren sinir, vagusla birlikte subklavyen arterin üzerinde toraksa girer ve arkus
aorta seviyesinde n.vagustan ayrılarak ligamentum arteriozumun lateralinden yukarı
döner ve trakeoözofageal yarıkta yukarıya boyuna uzanır. Sleeve rezeksiyon
sırasında; mediastinal plevranın açılması, aortikopulmoner bölgenin diseksiyonu,
ligamentum arteriozumun kesilmesi sırasında sol n.rekürren kolaylıkla hasarlanabilir
(Tablo 1.2).
Sağ bronşial sistem; Üst lobbronşu: 1-Apikal segment ve bronşu, 2-Anterior segment
ve bronşu, 3-Posterior segment ve bronşu, Orta lob bronşu: 4-Lateral segment ve
bronşu, 5-Medial segment ve bronşu, Alt lob bronşu: 6-Alt lob süperior segment ve
bronşu, 7-Mediobazal segment ve bronşu, 8-Laterobazal segment ve bronşu, 9Anterobazal segment ve bronşu, 10-Posterobazal segment ve bronşu
5
Sol bronşial sistem; Üst lob bronşu: 1-3-Apikoposterior segment ve bronşu, 2Anterior segment bronşu, 4-Lingula süperior segment ve bronşu, 5-Lingula inferior
segment ve bronşu, Alt lob bronşu: 6-Alt lob süperior segment ve bronşu, 7-8Anteromedial segment ve bronşu, 9-Laterobazal segment ve bronşu, 10Posterobazal segment ve bronşu
Trakea ve Bronşların Kanlanması ve İnnervasyonu
Trakeobronşial girişimlerden sonra meydana gelen anastomoz komplikasyonlarının
çoğu anastomoz düzeyinde sistemik mukozal kan akımının bozulması ile doğrudan
ilişkilidir. Göğüs cerrahı, hem trakea ve bronşun kanlanmasının topografik
anatomisini bilmeli hem de sistemik bronşial dolaşım ve pulmoner arteryel sistem
arasındaki bağlantıları ve anastomoz ağını da bilmelidir. Bu nedenle cerrah;
-Aşırı peribronşial diseksiyonun
-Radikal lenfadenektominin ya da
-Yüksek doz preoperatif RT’nin potansiyel risk etkenleri olduğunu bilmeli ve
anlamalıdır.
Trakeobronşial dolaşımın etkin olarak devam etmesi anastomoz iyileşmesini
kolaylaştırır. Trakeanın kanlanması özofagus ve ana bronşlar ile ortak sağlanır. Üst
trakeanın kanlanması inferior troid arterden ve daha az ölçüde subklavyen, en üst
interkostal, internal torasik, brakiosefalik ve süperior ile orta bronşial arterlerden
sağlanır. Pek çok küçük lateral longitudinal anastomotik damarlar da vardır. Bunlar
içerisinde lateral anastomotik damarlar, transvers damarlar kartilajların arasında
seyreder ve submukoza ile kıkırdakları beslerler. Trakeanın kanlanması öncelikli
olarak uç damarlardan ve segmentlerden olur. Bu nedenle trakeayı 1-2 cm’nin
üzerinde çevresel olarak devaskülarize etmek önemli hale gelir. Bu damarlar,
trakeaya lateral olarak girdiklerinden, tüm paratrakeal düzlem boyunca diseksiyon
emniyetlidir.
Bu arterler, trakeanın kartilaj halkaları arasındaki yumuşak dokuda uzanan transvers
segmental arterleri tüm trakea boyunca kanlandırır. Bronşial arterlerin; çıkış seviyesi
sayısı ve dağılımı oldukça değişken olmasına karşın çoğu kere ayrı ayrı inen aortanın
anterolateral yüzünden ya da interkostal arterlerden çıkar.
Söz konusu interkostaller subklavyen arterin 2-3 cm distalinde lokalize olan
arterlerdir. Genellikle iki solda, bir sağda olmak üzere toplam 3 adet bronşial arter
6
vardır. Bronşial arterin bu anatomik özelliği yani sağda tek bronşial arter olması
nedeni ile sağ ana bronşta sola göre daha sık anastomoz iyileşme sorunu yaşanması
nedenlerinden biridir.
Bronşial arterler hava yollarının posterior duvarları boyunca uzanır. Sağda tek olan
bronşial arter, vena azigosa paralel olarak onun üzerinde uzanır. Bronşial dolaşımın
ilginç yönlerinden biride arteryel pulmoner dolaşım ile zengin anastomik bir ağa sahip
olmasıdır (Resim 10). Bu ağ karina ve ana bronş seviyesinde anlamlı katkıda
bulunmasada lober yada segmental bronş düzeyinde ki kanlanmanın %75-90’ı
pulmoner dolaşımdandır. Bu özellik sleeve rezeksiyonlarda distal bronkotomi
kenarının yerinin belirlenmesinde çok önemlidir. Eğer distal bronkotomi kenarı çok
uzun olursa beslenme sorunlarına neden olabilir. Bu nedenle sleeve rezeksiyonlarda
distal bronşial sınır köken aldığı loba olabildiğince yakın olmalıdır.
Bronşial arterlerin venöz dönüşleri büyük çoğunluğu pulmoner venleredir. Segment
ve subsegment düzeyindeki bronşial venler ise azigos ya da hemiazigos sistemine
dökülür.
Bronşlar ve akciğerler n.vagus ve sempatik sistemden innerve olur. Hilusta bu sinirler
pulmoner arter etrafında çok da belirgin olmayan anterior pleksusu ve bronş
çevresinde ise iyi gelişmiş posterior pleksusu oluşturur.
Bronkoplasti sırasında bu pleksusların kesilmesi bronşial glandların ve kasların nöral
kontrolünü ortadan kaldırır, bunun sleeve rezeksiyonlarda minimal klinik önemi vardır.
Bunun yanında KOAH’lı hastalarda bronşial denervasyon, pulmoner fonksiyonları ve
dispneyi kısmen düzeltebilir.
Akciğerler
Akciğerler solunum sisteminin distal ve en önemli kısmını oluştururlar. Erkeklerde
yaklaşık olarak vücudun 1/37’sini, kadınlar da ise 1/43’ünü oluştururlar. Sağ akciğer
yaklaşık 625 gr, sol akciğer 567 gr’dır. Sol akciğer kalbin büyük kısmının sol tarafta
bulunması ve itmesi nedeni ile sağ akciğerden daha küçüktür.
Akciğerin giriş kısmına hilus pulmonis adı verilir, a.ve v. pulmonalisler, ana bronşlar,
lenf damarları, a.bronşialisler ve sinirlerden oluşur. Pulmoner hiluslarda yukarıdan
aşağıya, sağda; üstte bronş, ortada a.pulmonalis ve altta v.pulmonalis bulunurken,
solda üstte a.pulmonalis, ortada bronş ve altta v.pulmonalis bulunur. Plevra hilusu
kılıf şeklinde sarar, bu kılıf mediastinal plevrayı visseral plevraya bağlar.
7
Sağ akciğer üst, orta ve alt olmak üzere üç lob bulunurken, solda ise üst ve alt olmak
üzere iki lob bulunur. Bu loblar arasında sağda oblik (majör) ve transversalis (minör)
fissürler olmasına karşın solda sadece oblik fissür bulunur. Oblik (major) fissür
posterior 5. kostanın arka ucundan ya da 5.İKA’dan başlar, 6. kostayla beraber öne
ve aşağıya doğru devam ederek 6 kostokondral bileşkede diyafragmada sonlanır
Horizantal (minör) fissür 6 kot orta aksiller hattaki oblik fissürden başlayarak 4 kotun
kostokondral bileşkesinden ve önünden devam eder
Sol akciğerde ise sadece oblik (major) fissür bulunur Bu fissür posteriorda daha
yüksek düzeyde 3-5 kottan başlar 6-7 kostokondral bileşke bölgesinde sonlanmak
üzere aşağıya ve öne doğru devam eder.
Fissür varyasyonları olabilir Sıklıkla bir kısmı ya da tamamı gelişmemiştir İncelenen
akciğerlerin %50'den fazlasında bu görünüm orta lob ile üst lobun anterior kısmının
komplet füzyonu şeklindedir Aksesuar fissürlerde olabilir ve akciğerlerin belirli
kısımları sınırlandırılmış olur ve buna da aksesuar lob denir Bazende bu tarz
fissürler PA akciğer grafisinde lineer gölgelenme şeklinde izlenebilir ve aksesuar lobu
çevreleyen akciğer dokusundan daha az radyolusen olarak izlenir
Sıklıkla
karşılaşılan aksesuar loblar: Sol akciğerin posterior,inferior,orta ve (azigos lobu)
şeklinde olabilir
Sağ akciğerde on, sol akciğerde sekiz olmak üzere toplam onsekiz adet segment
yapısına ayrılır. Her bir segment, yapı ve fonksiyon açısından ayrı, bağımsız bir birim
olup, akciğerin anatomik, fonksiyonel ve cerrahi bir ünitesidir. Piramit şeklinde olan
segmentlerin tabanı akciğerin dış yüzüne, tepesi ise akciğer hilusuna yönelmiştir.
Bağ dokusu ile çevrili her segmentin kendisine ait damarları, bronşu ve sinirleri
vardır. Arter ve bronşlar diğer segmentlerin aynı yapıları ile anastomoz yapmazlar.
Bu nedenle cerrahi ile segmentektomi uygulandığında sadece kendisine ait vasküler
yapılar bağlandığı için diğer bölümler etkilenmez.
Pulmoner arter sisteminin topografik anatomisi
Ana pulmoner arter, arkus aortanın altında sağ ve sol pulmoner artere ayrılır. Sağ
pulmoner arter soldakine göre daha uzun ve kalındır. Sağ pulmoner arter; çıkan aorta
ve VKS’un arkasından, karinanın altından sağa doğru yatay olarak uzanır Sağ
pulmoner arterin uzunluğunun ¾‘ü intraperikardiyaldir. Perikarttan çıktıktan sonra sağ
ana bronşun önünde uzanır ve bu alan sleeve rezeksiyonlardan sonra olan
bronkovasküler fistülün en sık olduğu seviyedir. Anastomoz hattının canlı doku flebi ki
8
genellikle parietal plevra kullanılır sarılması pulmoner arter ile anastomoz hattı
arasında mekanik bir yastık görevi yapacağından bu tip komplikasyonları anlamlı
oranda azaltır. Sağ pulmoner arter ilk dalı olan trunkus anterior verdikten hemen
sonra arkada ara bronş, önde superior ven bulunan aralıktan kavis oluşturarak aşağı
uzanır. Daha sonra interlober arter orta lob bronşunun çıkış yerinin arkasından
uzanır. Sağ pulmoner arter orta lob ve superior segmental arteri verdikten sonra
bazal segment arter (common basal trunk) adını alır.
Resim 1.4: Sağ akciğerde fissür diseksiyonu sonrası pulmoner arterin seyri, intraoperatif
görünüm (A.Ü.T.F Göğüs Cerrahisi A.D, Doç.Dr. Ayten Kayı Cangır Arşivinden)
Sol pulmoner arter arkus aortanın altından perikarttan çıkar. Sol ana bronş üstünden
geçerken, sol üst lob bronşunun çevresinin ¾ oranında sararak aşağı doğru uzanır.
Sol pulmoner arter interlober fissürde anteromediale doğru lingula, posterolaterale
doğru superior segmental arteri verdikten sonra sonlanır ve bazal segment arter adını
alır. Perikardtan çıktıktan sonra ilk dalını verinceye kadar uzun bir sol pulmoner arter
segmenti söz konusudur. Sol pulmoner arterin bu anatomik özelliği akciğer kanseri
rezeksiyonlarında pulmoner arter rekonstrüksiyonu için onu daha ideal hale getirir.
Ayrıca sol pulmoner arterin üst lob bronşunun çevresinin %60-75’ini sarıyor olması
nedeni ile sol üst lob kanserlerinde daha sıklıkla pulmoner arter rezeksiyonu /
arterioplastisi gerekir (Resim 1.5), (Tablo 1.3).
9
Resim 1.5:Sol akciğerin fissür diseksiyonu sonrası pulmoner arterin seyri, intraoperatif
görünüm (A.Ü.T.F Göğüs Cerrahisi A.D, Doç.Dr. Ayten Kayı Cangır Arşivinden)
Tablo 1.3: Pulmoner arteryel sistemin topografik anatomisinde trakeobronkoplastiler için
önemli noktalar
-Perikardtan çıktıktan sonra sağ ana pulmoner arter sağ ana bronşun önünde uzanır
-Sağ ana pulmoner arterin proksimal kontrolü intra ya da ekstraperikardiyal klemp koyularak
yapılabilir
-Sol pulmoner arter sol ana bronşun üstünden geçerken sol üst lob bronşunun çevresinin ¾’
ünü sarar
- Sol pulmoner arterin ekstraperikardiyal bölümünün uzun olması nedeni ile sağ pulmoner
artere göre arterioplastiler için daha uygundur
-Sleeve sol üst lobektomi ile birlikte pulmoner arter rezeksiyonu en sık yapılan
bronkovasküloplastidir
Özofagus
Resim 1.6: Özofagus lümen kesiti ve seyri
Özofagus, yaklaşık 25-30 cm uzunluğunda ve krikoid kartilajın alt kenarından C6
seviyesinde
m.krikofaringeus
başlar,
Th11
vertebra
seviyesinde
sonlanır,
apendiksten sonra gastrointestinal sistemin en dar yeridir. Üst diş kavsinden (ÜDK)
mideye kadar olan aralık ise 40-45 cm’dir. Özofagus servikal, torasik ve abdominal
10
olmak üzere 3 bölümden oluşur. Servikal özofagus; C6-Th1 vertebra seviyeleri
arasında, krikoid kartilajın alt kenarı ile sternumun insisura jugularisi arasında,
torasik özofagus
Th1-Th10 vertebra seviyeleri arasında, sternumun insisura
jugularisi ile hiatus özofagei arasında, abdominal özofagus ise Th10-Th11 vertebra
seviyeleri arasında olup, özofageal hiatustan geçerek mide kardiasında sonlanır
(Resim 1.6).
Özofagus vertebra korpusları ile yakın ilişkidedir, bu nedenle vertebra açıklığına
uyarak açıklığı öne bakan bir eğri çizer. Özofagus hafif yan eğrilikler gösterir, 7.
torakal vertebraya kadar orta hatta iken bu düzeyde hafif sola deviye olarak aortanın
önüne geçer ve diyafragmanın solunda bulunan hiatus özofagustan geçer. Genişliği
boş ve dolu olmasına göre değişir ve her düzeyde aynı değildir. Boşken genişliği 11,5 cm iken basınç artışı ile 2,5-3 cm genişliğe ulaşabilir. Özofagus üç yerde darlık
gösterir:
1- Farenks ile birleşim yeri, en dar yerdir ve 14-15 mm kadar genişleyebilir,
kartilago krikoideanın hemen altında.
2- Sol ana bronş çaprazlaştığı nokta
3- Diyafragmayı geçtiği, kardiadan 2-3 cm yükseklikte olan bölümdür(Th10)
ÜDK’dan itibaren birinci darlık 15-18 cm, 2. darlık 27 cm, 3. darlık 38-40 cm
uzaklıktadır. Sağlıklı özofagusta mekanik yaralanmalar en çok bu üç darlıkta olur.
Altta yatan peptik striktür/stenoz ya da malignite gibi bir hastalık varsa hem iatrojenik
hem de spontan perforasyonlar bu hastalığın seviyesine uygun olan yerden olur.
Özofagusun en geniş yeri 2. ve 3. darlık arasındaki bölümdür. Ayrıca vena azygos
seviyesi ÜDK 25. cm, inferior pulmoner ven seviyesi ise ÜDK 33-35 cm’dir. Bu
seviyelerin iyi bilinmesi cerrah için tümör cerrahisinde hem preoperatif endoskopik
incelemeler ve yardımcı görüntüleme yöntemleri sonrası yapılacak operasyonun
planlanması hem de rezeksiyon sonrası uygulanacak özofagogastrik anastomoz için
belirleyici klavuz noktalar olacaktır.
Özofagus, tunika mukoza, tela submukoza ve tunika muskularisten oluşur. Tunika
mukoza, çok katlı yassı epitel, distal 2-3 cm’de kolumnar epitel ile örtülüdür. Bu
mukoza, 8-10 tane kalın mukoza plikası yapar ve kesit yüzeyinde yıldız gibi görünür.
Tunika submukoza, gevşek bağ dokusudur, vasküler yapılar, sinir ağı ve ganglionlar
burada bulunur. Tunika muskularis dışta longitudinal, içte sirküler kas tabakası
11
bulunur. Özofagusun adventisiyası ince gevşek bir bağ dokusundadır. Serozası ve
mesenteri yoktur.
Özofagus
a.thyroid inferior, a.torasika interna, torasik aortadan çıkan dallar, a.
bronşialisin özofageal dalları, a.gastrika sinistranın a. gastrika breves dalları ve sol
a.frenika inferiordan kanlanır. Kendi adını taşıyan bir arteri yoktur yani iyi kanlanmaz
bu özelliği de yaralanmalarında iyileşme sorunlarına neden olur. Venöz drenajı ise
v.tiroidea inferior, v.azigos ve v.hemiazigos aracılığı ile v.kava superiora, v.gastirika
sinistra aracılığı ile v.kava inferiora’dır.
Özofagusta lenfatik drenaj, lamina propria ve submukozadaki zengin lenfatik damar
ağı ile bunların birleştiği musküler ve adventisial lenfatik damarlarla olur. Musküler
tabakadaki lenfatikler longitudinal şekilde uzanırlar. Bu nedenle karsinomların
çevrelerindeki alanlara intramukozal ve submukozal yayılımı sıklıkla bulunur.
Servikal segment lenfatikleri internal juguler ve üst trakeal lenf bezi gruplarına, torasik
özofagus lenfatikleri üst, orta ve alt mediastinal lenf bezi gruplarına drene olur.
Abdominal segmentin lenfatik drenajı ise superior gastrik, çöliak aks, ana hepatik
arter, splenik arter çevresi lenf bezlerinedir. Bütün farklı drenaj bölgelerine karşın tüm
lenfatik ağ arasında çok yoğun bir ilişki vardır.
Sinirleri boyun bölümü n.rekürrenslerden, torasik ve abdominal bölümü n.vagus ve
turunkus sempatikustan oluşan pleksus özofagustan alır.
Diyafragma (m.torakoabdominalis)
Toraksin alt çıkışını tamamen kapatan muskuloaponörotik bir yapıdır. Diyafragma;
sternum, kaburgalar, vertebra noktaları ile çevresel tutunma gösterir. Sternumdan
kaynaklanan kısım, ksifoidin her iki yanındaniki kısa adale parçası şeklinde uzanım
göstererek merkezi tendona yapışır. Kostalardan kaynaklanan kısım alt altı kostanın
kıkırdak yapısının iç yüzünden kas demetleri şeklinde oluşur. Bu demetler
transversus abdominis kası ile birleşerek merkezi tendonun ön ve yan kısımlarına
yapışırlar. Diyafragma arka kısmı ise medial ve lateral arkuat ligamanlardan oluşur.
Medial ligaman L1ve L2 vertebraya uzanan psoas fasyasının kalınlaşmış ön
parçasıdır. Lateral ligaman ise L1 vertebra ve 12. kosta alt kenarından uzanım
gösterir, kuadratus lumborum kasının anterior fasyasının kalınlaşmasından oluşur.
Diyafragmatik krural parçalar, vertebralar arası diskler ve lumbar vertebraların alt
kısımlarından başlayan kas demetleridir. Sağ krus L1 ve L3, sol krus L1 ve L2
vertebralardan doğar, kas lifleri inen aorta üzerinde çaprazlaşır.
12
İki hiatus ve bir foramen yapısına sahiptir. Foramen vena kava inferioris Th 8
vertebra seviyesinde, v.kava inferior ile birlikte sağ frenik sinirin geçtiği anatomik
yapıdır. Forameni çevreleyen kas lifleri venöz dönüşü engellemeyecek şekilde
düzenlenmişlerdir. Özofageal hiatus Th10 vertebra seviyesinde, özofagusla birlikte n.
vagusun ön ve arka trunkusları ile vena gastrika sinistranın özofagusun alt kısmını
drene eden dalları geçer. Bu yapıyı özellikle sağ krus çevreler ve intraabdominal
basınca karşı mideden özofagusa reflüyü engelleyecek şekilde düzenlenmişlerdir.
Hiatus aortikus Th 12 vertebra seviyesinde, aortla birlikte azygos ven ve duktus
torasikus geçer. Diyafragmanın önde sternokostal bileşkedeki zayıf ve sadece fasya
ile örtülü kısım Larey aralığı ismini alır. Bu bölgede oluşan ve daha nadir görülen
patoloji Morgagni hernisi, lumbal vertebra ile kostal bölüm arasında kalan arkadaki
zayıf örtülü kısımdan oluşan herni ise Bochdalek hernisi olarak tanımlanır.
Resim 1.7: Frenik sinirin perikard üzerinde seyri (A.Ü.T.F Göğüs Cerrahisi A.D, Doç.Dr.
Ayten Kayı Cangır Arşivinden)
Diyafragmanın beslenmesi abdominal aortadan çıkan sağ ve sol frenik arterlerle
sağlanır. Ayrıca interkostal arterler ve internal mammarial arter beslenmede katkıda
bulunurlar. Venöz drenajı arterin yanındaki sağ ve sol inferior frenik venlerle vena
kava inferioradır. Vasküler yapılar diyafragmanın abdominal yüzünde dallandığı için
torakstan kesi yapılırken görülemediğinden planlanara uyarak insizyon yapılır.
Diyafragma innervasyonu hem duyusal hemde motor fonksiyonları bulunan sağ ve
sol frenik sinirlerle sağlanır. Anterolateral, posterolateral, sternal ve krural dal olmak
üzere 4 ana dala ayrılırlar (Resim 1.7).
13
Diyafragma Cerrahi Kesileri
Göğüs cerrahisinde kongenital, akkiz ya da travmatik diyafragma hernileri,
diyafragma
evantrasyonu,
distal
özofagus-mide
kardia
tümörlerinin
cerrahi
rezeksiyonu ve bazen karaciğer üst kutbu hidatik kistlerine uygulanan kistotomi
operasyonları için diyafragmaya kesi yapmak gerekebilir.
Vasküler yapıların ve frenik sinirin diyafragma üzerindeki seyrinin iyi bilinmesi
uygulanacak kesi için yol gösterici olacaktır. Diyafragmaya uygulanacak en güvenli
kesi kasın kenardaki yapıştığı yerden yaklaşık 2 cm uzağından yapılan sirküler
kesidir. Bu bölgede frenik arter ve sinirin yaralanma riski çok azdır. Ayrıca santral
tendona kısa kesilerde yapılabilir. Küçük diyafragmatik arterler kesilip sütürlerle
kontrol altına alınabilir. Bu kesiler sırasında frenik sinirin arka dalını kesmemek için
mediale doğru fazla uzatılmamalıdır. Orta hat kesisi sırasında, bu bölgede sol inferior
frenik ven geçtiği için sadece bunun bağlanması gerekir.
Duktus Torasikus
Vücuttaki en büyük lenfatik drenaj sistemidir. Dolaşıma vücudun en büyük lenfatik
sıvısını taşır. İnsanların yarısından fazlasında duktus torasikus anomalisi olmasına
rağmen genelde duktus L1-L2 vertebra korpusunun önünde yer alan sisterna şiliden
ortaya çıkar. Sisterna şiliden çıkan duktus, aortanın sağ yanından yukarı yönelir ve
Th12 seviyesinden aortik hiatustan toraksa girer. Vena azygosun medialinde,
özofagus arkasından sağ hemitoraksta yukarı çıkar. Th4 ve Th5 vertebra seviyesinde
vertebra korpusunun önünden, özofagus arkasından sola, arkus aortanın arkasına
geçer. Torasik inletin arka bölümünden çıkar ve özofagus solunda, klavikulanın 3-4
cm üstünde C6-C7 vertebra korpusu seviyesinde arkus oluşturarak subklavyen arter
ve tiroservikal trunkusun önünden laterale yönelir. Sol subklavyen ven ve juguler
venin birleşim yeri, angulus venosus sinistere (Piragow açısı) dökülür (Resim 20).
Genel anatomi seyri bu şekilde iken cerrahi önem bakımından çok çeşitli
varyasyonlar vardır. En yaygın görülen anatomik varyasyon toraksın altında veya
daha çok servikal bölgede olan çift duktustur. Ayrıca duktusun vertebrayı
çaprazladığı seviyede de farklılıklar olabilir. En az görülen varyasyon ise duktusun
vena azygosa dökülmesidir.
14
Şilotoraks
Plevral boşlukta lenfatik sıvının toplanması olarak tanımlanır. Lenfatik sıvının
çoğunluğu bağırsaklardan olmasına rağmen akciğer, karaciğer, karın duvarı ve
ekstremitelerden gelir. Ekstremitelerden gelen şilöz sıvı miktarı normal şartlarda
ihmal edilir. Sağ hemitoraksta şilöz sıvı birikmesi duktus torasikusun çaprazlandığı
Th4-Th5 seviyesinin altındaki patoloji durumunda, sol hemitorakstaki şilöz sıvı birikimi
ise çaprazlanan yerin proksimalindeki duktus hasarlanmasında ortaya çıkar. Tek
taraflı şilotorakslı hastalarda torakotomi aynı taraftan, bilateral şilotoraks için ise
öncelikle sağ torakotomi tercih edilir. Posterolateral torakotomi ile girişim uygulanır ve
7. veya 8. İKA dan toraksa girilir. Kliniğimizde primer veya sekonder kaynaklı
şilotoraks nedeni ile opere edilen hastalara uygulanan torakotomi sonrası mediastinal
plevra açılarak torasik aorta ile özofagus arasından duktus torasikus saptanır. Duktus
torasikusun çok ince olması nedeni ile saptanması ya da diseksiyonu zor olacağı
düşünülen hastalara operasyondan önce yağlı krema diyeti ile drenajın artışı
sağlanır. Kaçak proksimalinden emilmeyen sütürler ile bağlanır ve/veya sütüre edilir.
Ayrıca iki bileşenli fibrin doku yapıştırıcısı destek ile güçlendirilebilir. Ayrıca bir başka
yöntemde posterior mediastinal plevra bu bölgede göğüs duvarından künt
diseksiyonla ayrılması ve azygos veninin medialinde duktus ortaya konarak
bağlanmasının belirtildiği prosedürlerde bildirilmiştir.
Sonuç
Cerrahın başarısında en büyük katkı cerrahi beceri kadar ve hatta daha çok anatomi
bilgisi sağlamaktadır. Göğüs cerrahisi açısından preoperatif değerlendirmede
endikasyonun belirlenmesi için bilinen faktörler değerlendirildikten sonra topografik
anatomi bilgisi ile radyolojik değerlendirme çoğu zaman hayat kurtarıcı olmaktadır.
Tümör cerrahisinde cerrahi tedavi birinci tedavi şeklidir. Ülkemizde tanı alan akciğer
kanserli hastalar genellikle inoperable olmakla birlikte operable olan hastaların da
çoğu sınırda rezeksiyon şansı yakalayanlardır. Hekimin önüne gelen bu şanslı
hastalarda topografik anatomiye hakim olunamaması ve kesitsel radyolojik
değerlendirme yapılamaması sonucu cerrahi şansı kaçırabilir. Ayrıca gerek
preoperatif gerek intraoperatif değerlendirme sonucunda komplet rezeksiyon
yapılabileceği göze alınabilirse cerrahi planlanmalıdır. Bunun için de yine topografik
anatomi hakimiyeti gerekir. Göğüs cerrahlarının anatomiyi çok iyi bilmesinin yanı sıra
uygulayacak kesilerin de hastaya en az zarar veren lokalizasyondan yapılması
15
önemlidir. Cerrahi işleme başlarken yapılan cilt kesisi de dahil olmak üzere tüm
işlemlerin dikkatli ve cerrahi sahanın iyi bilinerek operasyonun tamamlanması hem
intraoperatif hem de postoperatif nekahat döneminin sorunsuz geçmesi açısından
önemlidir.
Sonuç olarak bir doktorun öncelikli amacı hastaya zarar vermeme yönünde olmalıdır.
KAYNAKLAR
1- Şakul BU. Baş Boyun Topografik Anatomisi. Ankara, A.Ü. Basımevi, 1999
2- Şakul BU. Anatomi. Ankara A.Ü Basımevi, 2001
3- Arıncı K, Elhan A. Anatomi 1. Cilt. Ankara, Güneş Kitabevi Ltd. Şti 2001
4- Arıncı K, Elhan A. Anatomi 2. Cilt. Ankara, Güneş Kitabevi Ltd. Şti 2001
5- Tortora GJ. Principles of Human Anatomy, 4. ed. New York, Harper&Row
Publishers, 1986
6- Lau L.C, Meyers B.Diaphragma, Mastery of Cardiothoracic Surgery, Kaiser
L.R, 2. ed. Lippincott Williams&Wilkins, 2006; 228-244
7- Dean M, Mathisen D.Tracheal Resection and Reconstruction, Mastery of
Cardiothoracic Surgery, Kaiser L.R, 2. ed. Lippincott Williams&Wilkins, 2006;
228-244.
8- Fréchette Ė, Deslauriers J, Surgical Anatomy of the Bronchial Tree and
Pulmonary Artery, Semin Thoracic and Cardiovasc Surg,18:77-84,2006
9- Plott E, Dis Esoph 2007;20:279
10-Shields TW. Surgical anatomy of the lungs. In Shields, ed. General Thoracic
Surgery. 5th edition. Philadelphia: Lea and Febinger, 2000:63-75.
11-Gray’s Anatomy for Students, Thorax, Regional anatomy
16
2.
Yrd. Doç. Dr. Ali Kılıçgün
Abant İzzet Baysal Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞER LENFATİKLERİNİN ÖNEMİ, TANIMLARI VE SINIFLAMALARI
Akciğerler peribronşiyal vasküler kılıfların ve interlobüler septaların konnektif dokusunda
ve visseral plevranın altında yer alan yaygın bir lenfatik damar sistemine sahiptir. Bunlar
hiler bölgeye doğru gidildikçe genişlemekte ve juxtaalveoler lenfatikler olarak
tanımlanmaktadırlar (1). Extraalveolar interstisyel ödem varlığında bunların bazıları
radyografik olarak görünür hale gelir ve Kerley B çizgileri olarak adlandırılır (2).
Subplevral yerleşimli yoğun lenfatik ağ başlıca interlobüler septaların içindeki kanallar
vasıtasıyla hiler bölgeye doğru drene olur. (3,4). Lobüler septaların içinde yer alan
kanallar bronkovasküler kılıfların içindeki kanallarla birçok bağlantıya sahiptir. Eğer bu
kanallardaki genişlemeler radyografik olarak Kerley A çizgileri olarak tariflenir.
Akciğer lenfatikleri genel olarak pulmoner lenf nodları ve mediastinal lenf nodları olmak
üzere ikiye ayrılır (1).
1. Pulmoner lenf nodları
İntrapulmoner ve bronkopulmoner olmak üzere iki gruba ayrılmaktadır.
İntrapulmoner lenf nodları:
Genellikle visseral plevranın tam altında bulunmaktadırlar. Nadiren bu periferik lenf
nodları soliter periferik nodül tarzında tespit edilebilirler (5) Radyografik olarak
intrapulmoner lenf nodlarının tespit edilmesiyle ilgili yapılan otopsi çalışmasında
subplevral lenfatiklerin içine enjekte edilen radyoopak maddeler ve sonrasında yapılan
seri radyolojik değerlendirmelerle intrapulmoner lenf nodları görüntülenmiştir ve
insidansı %18 olarak bulunmuştur(6). Bu lenf nodlarının antrakotik ve kapsülsüz
olduğunu bildirilmiştir (7). Bu lenf nodlarının çoğunun çapı 0,5–1 cm arasında
değişmektedir ve büyük çoğunluğu 50 yaş üzerindeki yetişkinlerde bulunmaktadır. Bu
nodların yüksek çözünülürlüklü bilgisayarlı tomografi tetkiki ile elde edilen görünümleri
keskin sınırlı, oval şekilli, sıkılıkla akciğerlerin alt kısımlarında yerleşmiş, subplevral
lokalizasyonda, yüksek dansiteli ve homojen yapıdadırlar. Bunların hiçbirisi kavite veya
17
kalsifikasyon içermemektedir ve özellikle küçük malign nodüllerden ayırt edilmeleri klinik
olarak önem taşımaktadır.
Bronkopulmoner lenf nodları
Bronkopulmoner lenf nodları hiler, interlober, lober, segmental ve subsegmental lenf
nodları olarak sınıflandırılır.
Hiler lenf nodları ana bronşların alt parçaları ya da sırasıyla pulmoner arter ve venler
boyunca yerleşmişlerdir. İnterlober lenf nodları lober bronşlar arasında kalan lenf
nodlarıdır. Lober- bronkopulmoner lenf nodları farklı lob bronşlarının başlangıçları
tarafından oluşturulan bifurkasyonlarda bulunur ve bronş ve komşu pulmoner damarlar
ile yan yana yer alırlar (1). Segmental lenf nodları segmental bronşların bifurkasyonları
ile irtibat halinde ya da eşlik eden pulmoner arterlerin dallarının bifurkasyonları boyunca
yer alırlar (8). Subsegmental lenf nodları subsegment bronşuna bitişik lenf nodlarıdır.
Bu lenf nodlarının sayısı değişkendir ve sıklıkla çocuklarda daha fazla sayıdadırlar. Bu
lenf nodları gelişimini hayatın ilk dekadının sonunda tamamlarlar. Sonrasında bu lenf
nodları atrofiye olup adult dönemde kaybolmaktadırlar. Pulmoner enfeksiyon ya da
malignensi varlığında bu lenf nodları çoğunlukla etkilenmekte ve tespit edilebilir hale
gelmektedirler (9).
Sağ lenfatik birikim yeri: İntermedier bronşun komşuluğunda yer almaktadır. İntermedier
bronş ve üst lob bronşu arasındaki açıda majör fissürün üst-arka bölümünde sabit bir
lenf nodu bulunmaktadır(10).
Sol lenfatik birikim yeri: Üst ve alt lob arasındaki oblik fissürde yer almaktadırlar. Sabit
nod üst ve alt lob bronş bifurkasyonu çevresinde bulunmaktadır.
Akciğerin loblarının bronkopulmoner lenf nodlarına doğru olan lenfatik drenajı
Akciğer loblarına ait lenfatik drenaj başlıca bronkopulmoner nodlara doğru olmaktadır.
Buna rağmen direkt olarak mediastinal lenf nodlarına olan bir drenaj da görülmektedir
(11,12).
Sağ üst lob lenfatik drenajı genel olarak intermedier bronşun dış kısmındaki süperior
interlober lenf nodlarından sağ üst lob bronşunun üstünde yer alan nodlara doğru
olmakta ve azigos veya subkarinal lenf nodlarına doğru devam etmektedir.
Orta lob lenfatikleri süperior birikim bölgesindeki lenf nodlarına drene olmaktadır. Sağ alt
lobun drenajı alt interlober noddan süperior birikim bölgesindeki noda doğru
olmaktadır.(13).
18
Sol üst lobun bütün segmentlerinin drenajı sol birikim bölgesindeki noda doğrudur. Alt
lobun lenfatik drenajı peribronşiyal nodlardan interlober birikim bölgesindeki nodlara
doğru olmaktadır.
Sağ alt ve orta loblardan olan lenfatik drenaj ve sol alt lobdan olan lenfatik drenaj aynı
zamanda pulmoner ligament komşuluğundaki nodlara doğru olmaktadır.
2. Mediastinal lenf nodları
Mediastinal lenf nodları akciğerin lenfatik drenajı açısından oldukça önemlidir ve dört
farklı ancak birbiriyle irtibat halinde bulunan gruba bölünmektedir: Anterior (prevasküler),
trakeobronşiyal, paratrakeal ve posterior lenf nodları olarak sınıflandırılırlar (1).
I. Anterior mediastinal lenf nodları: Mediastinumun prevasküler kompartmanı içinde yer
almakta ve büyük damarların ve perikardın üst parçasının üzerinde bulunmaktadırlar.
Sağ tarafta nodlar paralel olarak uzanmakta ve sağ frenik sinirin ön tarafında yer
almaktadır. Bunlar yukarı doğru uzanmakta ve sağ innominate venin altında ve süperior
vena cava komşuluğunda bulunmaktadırlar. Solda ise pulmoner arterin ve ligamentum
arteriosumun başlangıcının oldukça yakınında yer alırlar. Bu lenf nodları sol frenik sinir
boyunca yukarı doğru uzanmakta ve sol süperior interkostal ven ile sol innominate venin
birleştiği kısmın alt tarafına kadar gelmektedirler.
II. Posterior mediastinal lenf nodları: Paraözofageal ve pulmoner ligament bölgesindeki
nodlar olarak iki gruba ayrılırlar. Bir paraözofageal lenf nodu nadiren azigos venin arka
seviyesinde retrotrakeal olarak bulunabilir. Paraözofageal nodlar mediastinumun inferior
bölümünde daha fazla sayıdadırlar ve sol tarafta sağa nazaran daha sık bulunurlar.
İnferior yerleşimli nodlar diyafragmanın altındaki paraaortik nodlarla bağlantıya
sahiptirler.
III. Trakeobronşiyal lenf nodları: Trakeanın bifurkasyonu çevresinde 3 grup şeklinde
yerleşmişlerdir. Sağ ve sol süperior trakeobronşiyal nodlar trakea ve komşu ana bronşa
ait geniş açının olduğu bölgede bulunurlar. Sağ süperior trakeobronşiyal lenf nodu grubu
sağ pulmoner arterin üstünde ve azigos ven medialinde yer alır. Sol tarafta süperior
trakeobronşiyal nodlar aortik arkın konkav yüzünün derinliğinde yer almaktadırlar.
Bunların bazıları sol rekürren laringeal sinir ile yakın komşuluktadır. İnferior
trakeobronşiyal nodlar sıklıkla subkarinal nodlarla ilgilidirler ve trakea bifurkasyon
açısında yer almaktadır.
IV. Paratrakeal lenf nodları: Trakeanın sağ ve sol yanında yer alırlar ve superior
trakeobronşiyal nodların üzerinde trakea boyunca yukarı doğru uzanırlar. Sağ
19
paratrakeal lenf nodları innominate arterin sağında ve trakeanın anterolateralinde
bulunmaktadırlar. Daha üst kısımda trakea orta kısmının sağ tarafında ve innominate
arterin üst ve arkasında bulunurlar. Yukarıya çıkıldıkça trakeanın orta kısmının sağında
ve innominate arterin üst-arka kısmında yer almaktadırlar ve toraks girişine kadar
uzanırlar. İnferiorda sol paratrakeal nodlar aortik arkın arkasında trakeanın orta kısmının
sol tarafında ve trakeobronşiyal açılanmanın üstünde bulunmaktadırlar. Sol paratrakeal
lenf nodları sağa nazaran daha küçük boyutta ve sayıdadırlar.
Klinik
olarak
mediastinal
lenf
nodları
(N2)
1-9
arasında
numaralandırılırken
bronkopulmoner lenf nodları (N1) 10-14 arasında numaralandırılmaktadır. (Tablo 2.1)
Tablo 2.1: Bölgesel lenf nodlarının klinik sınıflandırılması
mediastinal lenf nodları(N2)
bronkopulmoner lenf nodları (N1)
superior mediastinal nodlar
1.yüksek mediastinal
2.üst paratrakeal
3.pretrakeal ve retrotrakeal
4.alt paratrakeal
aortik nodlar
5.subaortik
6.paraaortik
inferior mediastinal nodlar
7.subkarinal
8.paraözofageal
9.pulmoner ligamant
10.hiler
11.interlober
12.lober
13.segmental
14.subsegmental
Lenf nodu haritaları ve klinik önemi
Lenf nodu haritası geliştirmenin önemi malign akciğer tümörlerinin evrelemesinde tüm
dünyada geçerliliği olan standart bir düzen oluşturulmaya çalışılması ve böylelikle
hastaların tüm dünyada standart bir şekilde evrelenerek çalışmaların sağlıklı şekilde
karşılaştırılabilmesini sağlamaktır. Naruke ve arkadaşları 1978 yılında akciğer kanser
hastalarında çeşitli lenf nodu istasyonlarının aynı şekilde kaydedilmesi amacıyla
geleneksel lenf nodu istasyonlarından oluşan bir anatomik harita kullanımını
önermişlerdir (14). Mountain ve Dresler 1997 yılında mediastinal lenf nod haritasında
zaman içerisinde oluşan karışıklıkları gidermek amacıyla yeni bir düzenlemeye
gitmişlerdir (Tablo2.2, Şekil 2.1a ve b) (15). Metastaz yapmamış küçük hücreli dışı
akciğer kanserlerinin başlangıç tedavisinde yapılacak olan lenf nodu tutulumunun doğru
20
bir evrelemesi kritik bir öneme sahiptir. Ayrıca hastaların sağ kalımını belirlemede de
kullanılmaktadır. Uluslararası Akciğer Kanseri Çalışma Birliği akciğer kanserinin yeni
evreleme siteminde (7. evreleme) lenf nodu istasyonlarını 6 bölgeye ayırmıştır. Bu
bölgeler bronkopulmoner (N1) için periferal veya hiler, mediastinal (N2) için üst ve alt
mediastinal, aortopulmoner ve subkarinal bölgeler olarak adlandırılmıştır (16).
Akciğer kanseri evrelemesinde bölgesel lenf bezlerini tanımlayan N kriteri primer
tümörün lenfatik drenajı ile bağlantılı olarak lenf bezlerinin invazyonuna göre NX,
N0,N1,N2 ve N3 olarak sınıflandırılmaktadır. Bu kısaltmaların karşılıkları aşağıda
belirtilmiştir.
NX: Bölgesel lenf bezlerinin değerlendirilmediği tümörler
N0: Lenf nodu metastazı bulunmayan tümörler
N1: Tümörün bulunduğu akciğerde direkt yayılım ile oluşan peribronşiyal ve/veya hiler
lenf bezi metastazı
N2: Aynı taraf mediastinal lenf bezleri ile subkarinal lenf bezleri metastazı
N3: Karşı taraf mediastinal lenf bezleri, karşı taraf hiler lenf bezleri, aynı taraf ve karşı
taraf skalen veya supraklavikular lenf bezi metastazı (17)
21
Tablo2.2: Lenf nodlarının klinik kullanımda sınıflandırılması ve anatomik lokalizasyonları
Nodal
istasyon
1
(sol/sağ)
2
(sol/sağ)
Adlandırma
Tanımlama
Alt
servikal,supraklavikular,
sternal çentik nodları
Üst paratrakeal nodlar
üst sınırını krikoid kartilajın alt sınırı alt sınırını bilateral
klavikulalar ve orta hatta manibrumun üst sınırı oluşturur
3
Prevasküler ve
retrotrakeal nodlar
4
(sağ R/sol L)
Alt paratrakeal nodlar
5
Subaortik
(aortikopulmoner
Pencere)
Para-aortik nodlar (inen
aort yada frenik)
6
7
Subkarinal nodlar
8
(sol/sağ)
Paraözofageal
nodlar(karinanın
altında)
9
(sol/sağ)
Pulmoner ligament
nodları
10
(sol/sağ)
Hiler nodlar
11
İnterlober nodlar
12
13
14
Lober nodlar
Segmental nodlar
Subsegmental nodlar
2R;üst sınır; akciğer ve plevral boşluğun üst sınırı, orta hat
manibrumun üst sınırı
alt sınır:trakea ile innominate venin kesişimi
2L;üst sınır akciğer ve plevral boşluğun üst sınırı, orta hat
manibrumun üst sınırı
alt sınır arkus aortanın üst sınırı
3a;(prevasküler)
Sağda; Üstte toraksın üst kısmı, altta karina seviyesi,önde
sternumun arkası,arkada vena kava superiorun önü sınırları
oluşturur.
Solda; Üstte toraksın üst kısmı, altta karina seviyesi,önde
sternumun arkası, arkada sol karotis arter sınırları oluşturur.
3p;(retrotrakeal)
Üst sınırını toraksın üst kısmı,alt sınırını karina oluşturur
4R trakeanın sol lateral sınırının sağında kalan paratrakeal nodları
içerir
Üst sınır: trakea ile innominate venin kesişimi
Alt sınır: azigos venin alt sınırı
4L trakeanın sol lateral sınırının solunda kalan ve ligamentum
arteriosumun medialindeki lenf nodlarını içerir
Üst sınır:arkus aortanın üst sınırı
Alt sınır.sol ana pulmoner arterin üst kenarı
Ligamentum arteriosumun lateralindeki subaortik lenf nodları
Üst sınır:arkus aortanın alt sınırı
Alt sınır: sol ana pulmoner arterin üst kenarı
Arkus aorta ve inen aortun lateralinde ve önündeki lenf nodları
Üst sınır: arkus aortanın üstünden teğet geçen çizgi
Alt sınır:arkus aortanın alt sınırı
Üst sınır: karina
Alt sınır:sol alt lob bronşunun üst sınırı ile sağ intermedier
bronşun alt sınırı
Özofagus orta hattının sağında ve solunda özofagus duvarına
bitişik lenf nodlarıdır, subkarinal lenf nodlarını içermez
Üst sınır: sol alt lob bronşunun üst sınırı ile sağ intermedier
bronşun alt sınırı
Alt sınır:diafragma
Pulmoner ligamen boyunca uzanan len nodlarıdır.
Üst sınır: inferior pulmoner ven
Alt sınır:diafragma
Ana bronşlar ile ana pulmoner arter ve venin proksimal kısmını
içeren hiler damarlara bitişik lenf nodları
Üst sınır: sağda azigos venin üst kenarı solda pulmoner arterin üst
kenarı
Alt sınır.her iki tarafta interlober bölge
Lober bronşlar arasında kalan lenf nodları
11s(superior):sağda üst lob bronşu ile intermedier bronş arasında
11i(inferior):sağda alt lob bronşu ile orta lob bronşu arasında
Lober bronşa bitişik lenf nodları
Segment bronşuna bitişik lenf nodları
Subsegment bronşuna bitişik lenf nodları
22
Şekil 2.1a: Lenf nodu haritası
Şekil 2.1b: Lenf nodu haritası
23
Akciğerlerin lenfatik drenajı
Akciğerlerin mediastinal nodlarına doğru olan lenfatik drenajı yıllar içerisinde otopsi ve
canlılar üzerinde çok sayıda çalışmaya konu olmuştur (3,4,12).
Sağ akciğer
Sağ üst lob apikal ve posterior segmentlerden olan lenfatik drenaj hiler nodlar boyunca
ilerleyerek sağ superior trakeobronşiyal nodlara ve paratrakeal nodlara doğru
olmaktadır. Ayrıca aynı taraftaki üst paratrakeal nodlar boyunca boyundaki sağ skalen
nodlara da bu lenf sıvısı ulaşmaktadır. Üst lobun anterior segmentinden olan lenfatik
drenajın yaklaşık olarak yarısı aynı rotayı takip eder. Diğer yarısı ise subkarinal nodlara
veya sağ anterior mediastinal nodlara doğru olur. Subkarinal nodlar boyunca ilerleyen
lenf pretrakeal ve aynı taraftaki paratrakeal nodlar yoluyla sağ skalen noda kadar
gelebilir. Sağ anterior mediastinal nodlara gelen lenf sıvısı sol brakiosefalik ven boyunca
ilerleyerek sol anterior mediastinal nodlara ve sol skalen nodlara akabilir.
Sağ alt lobun superior segmenti ve orta lobdan olan lenfatik drenajın rotası benzerdir.
Bu segmentlerden oluşan lenfatik drenaj subkarinal ya da sağ superior trakeobronşiyal
nodlara ve oradan sağ üst paratrakeal nodlara doğru olmaktadır. Sağ alt lob bazal
segmentlerinin lenfatik drenajının büyük kısmı bronkopulmoner nodlar boyunca
ilerleyerek subkarinal nodlara kadar ulaşır. Sonrasında lenf sıvısı aynı taraftaki alt ve üst
paratrakeal nodlara ve sağ skalen nodlara yönelmektedir (1).
Sol akciğer
Sol akciğerin lenfatik drenajı için dört rota tarif edilmiştir. İlk yol subaortik nodlar
vasıtasıyla olur. İkinci rota paraaortik nodlar boyunca sol frenik siniri izleyerek anterior
mediastinal nodlar ve sol skalen nodlara ulaşır. Üçüncü rota sol ana bronş boyunca
ilerleyerek sol superior trakeobronşiyal nodlara ve paratrakeal nodlara ulaşır. Dördüncü
rota sol ana bronşun altında ilerleyerek subkarinal nodlara kadar gelir. Subkarinal
nodları geçtikten sonra bu rota sağ superior trakeobronşiyal nodlara ya da sağ üst
paratrakeal nodlara doğru ilerler (19). Sonuç olarak sol akciğerin lenfatik drenajı
değişken yapıdadır.
Lenfatik drenajın önemi
Sağ akciğerden olan lenfatik drenaj başlıca tek taraflıdır ve kontrlateral mediastinumdaki
lenf nodlarına çapraz geçiş çok nadirdir. Sağ bazal segmentlerden sol pulmoner
24
ligamente doğru direkt drenajı sağlayan bir yol tespit edilmiştir(4). Sağ üst lob
tümörlerinden mediastinal lenf nodlarına olan kontrlateral metastaz araştırmacılar
tarafından %5 ile %9 olarak tespit edilmiştir. Sağ alt lob metastatik mediastinal lenf
nodu tutulumu olan tümörlerde kontrlateral tutulum insidansı %7 ve %5’ tir (20,21).
Sağ akciğerin aksine sol akciğerden kontrlateral mediastinal drenaj nispeten daha
yaygındır ve sıklıkla subkarinal nodlar yoluyla olur. Bazen sol alt lobdan olan drenaj alt
pretrakeal nodlar vasıtasıyla çapraz geçişe neden olabilir. Sol ve sağ paratrakeal nodlar
arasında direkt bir kanal tespit edilmiştir (4). Yapılan mediastinoskopi çalışmalarında sol
üst lob tümörlerinden mediastinumun sağ yarısına olan kontrlateral tutulum oranı
sırasıyla %22 ve %21 olarak tespit edilmiştir (20,21). Sol alt lob için bu oran sırasıyla
%40 ve %33’dür.
Her iki taraftaki alt loblardan aynı taraftaki süperior mediastinal lenf nodlarına olan
drenaj sık olarak görülmektedir. Sağ üst lobdan subkarinal lenf nodlarını yoluyla inferior
mediastinuma doğru olan drenaj oluşabilmektedir. Sol üst lobun üst parçasının superior
divizyonunun subkarinal alana olan drenajı nadirdir. Ancak bu lobun alt yarısının –
lingula- bu tip bir yayılımı sık görülür. Bazal segmental tümörlerin primer olarak
subkarinal istasyonlara metastaz yaptıklarını, ancak süperior segment tümörlerinin ise
sıklıkla superior mediastinal lenf nodu istasyonlarından birine direkt olarak metastaz
yaptıkları bildirilmiştir (22).
Her iki akciğerden oluşan lenfatik drenaj popülasyonun önemli bir kısmında
bronkopulmoner nodları bypass eden direkt lenfatik kanalar yoluyla doğrudan
mediastinal lenf nodlarına doğru olmaktadır. Bu fenomen akciğer kanser olguları için
skip metastaz olarak adlandırılır(23,24,25).
KAYNAKLAR
1.Shields TW. Lymphatics of the lungs. In Shields TW, LoCicero J, Reed CE, Feins RH,
ed. General Thoracic Surgery, vol 1, 7th ed. Philadelphia: Lippincott Williams and
Wilkins; 2009: 87-101
2. Steiner RE. The radiology of the pulmonary circulation. In Shanks CS, Kerley P, eds.
A Textbook of X-ray Diagnosis. London: Lewis, 1973:121
3. Riquet M. Anatomic basis of lymphatic spread from carcinoma of the lung to the
mediastinum: surgical and prognostic implications. Surg Radiol Anat 1993; 15: 271
25
4. Riquet M, Hidden G, Debesse B. Direct lymphatic draniage of lung segments to the
mediastinal nodes. An anatomic study of 260 adults. J Thorac Cardiovasc Surg 1989;
97: 623
5. Greenberg HB. Benign subpleural lymph node appearing as a pulmonary “coin”
lesion. Radiology 1961; 77: 97
6. Trapnell DH. The peripheral lymphatics of the lung. Br J Radiol 1963; 36: 660
7. Kradin RI, Spirn PW, Mark EJ. Intrapulmonary lymph nodes. Clinical, radiologic and
pathologic features. Chest 1985; 87: 662
8. Nagaishi C. Functional Anatomy and Histology of Lung. Baltimore :University Park
Press, 1972
9. Borrie J. Lung Cancer: Surgery and Survival. New York: Appleton-Century-Crofts,
1965
10. Nohl-oser HC. Lymphatics of the lung. In Shields TW, ed. General Thoracic Surgery,
3rd ed. Philadelphia: Lea&Febiger, 1989.
11. Rouviere H. Anatomie des Lymphatics de le Homme. Paris: Mason, 1932.
12. Cordier G. Les lymphatiques des bronches et des segments pulmonaries. Bronches
1958; 8: 8.
13. Okada Y, Ito M, Nagaishi C. Anatomical study of the pulmonary lymphatics.
Lymphology 1979; 12: 118.
14. Naruke T, Suemasu K, Ishikawa S. Lymph node mapping and curability at various
levels of metastasis in resected lung cancer. J Thorac Cardiovasc Surg 1978; 76: 832839.
15. Mountain CF, Dresler CM. Regional lymph node classification for lung cancer
staging. Chest 1997; 111: 1718.
16. Rusch VW, Crowley J, Giroux DJ et al. The IASLC Lung Cancer Staging Project:
proposals for the revision of the N descriptors in the fortcoming seventh edition of the
TNM classification for lung cancer.
J Thorac Oncol 2007; 2: 603-612.
17. Işıtmangil T,Balkanlı K. Akciğer kanserinin evrelendirilmesi.In Yüksel M, Kalaycı G.
Ed. Göğüs Cerrahisi; 2001: 161-202.
18. PG
19. Hata E.
Rationale for extended lymphadenectomy for lung cancer. Theor Surg
1990; 5: 19.
26
20. Nohl-Oser HC. An investigation of the anatomy of the lymphatic drainage of the
lungs as shown by the lymphatic spread of bronchial carcinoma. Ann R Coll Surg Engl
1972; 51: 157.
21
Greschuchna
D,
Maassen
W:
Die
lymphogenen
Absiedlungswege
des
Bronchialkarzinoms. Stuttgart: Thieme, 1973.
22. . Watanabe S, Suziki K, Asamura H. Superior and basal segment lung cancers in
the lower lobes have different lymph node metastatic pathways and prognosis. Ann
Thorac Surg 2008; 3:599.
23. Ishida T, Yano T, Maeda K, et al. Strategy for lymphadenectomy in lung cancer
three centimeters or less in diameter. Ann Thorac Surg 1990; 50: 708.
24. Libshitz HI, McKenna RJ, Mountain CF. Patterns of mediastinal metastases in
bronchogenic carcinoma. Chest 1986; 90: 69.
25. Martini N, Flehinger BJ. The role of surgery in N2 lung cancer. Surg Clin North Am
1987:67: 1037.
27
3.
Prof. Dr Ahmet Ilgazlı
Kocaeli Üniversitesi Tıp Fakültesi Göğüs Hastalıkları Anabilim Dalı
KANDA GAZLARIN TAŞINMASI
Akciğerlerin en önemli görevi pulmoner arterler ile gelen venöz özellikli kanın
oksijenlenmesini ve karbondioksidin atılımını sağlamaktır. Normal bir erişkinin bazal
koşullarda
minimum
10.000
litre/dakika
hava
alıp
vermesi
sonucu
bu
işlev
yapılabilmektedir. Solunum yolları gerekli havanın alveollere kadar girip çıkmasını
sağlamakla kalmayıp havadaki zararlı etkenlerin de (toz, bakteri, virus, polen vb)
alveollere ulaşmasını önlemektedir.
Atmosfer ile kan arasında gaz değişiminin (difüzyon) sağlanabilmesi için atmosfer
havasının alveollere kadar girip çıkması (ventilasyon) ve alveollerin kapillerlerle uygun
şekilde kanlanması (perfüzyon) gerekir. Alveoller ile kapiller kan arasında gaz değişimi
“dış solunum”, kapiller kan ile dokular arasında gerçekleşen gaz değişimi ise “ iç
solunum” olarak tanımlanır. Terminal bronşiyolden alveol sonuna kadar olan görünüm
Şekil 3.1’de gösterilmiştir.
Şekil 3.1: Terminal bronşiyolden alveol sonuna kadar olan ayrıntılı görünüm.
28
Oksijenizasyon İşleminde;
1-Akciğerlerce oksijenin alınması
2-Oksijenin kana geçişi
3-Kanda oksijenin taşınması
4-Dokulara oksijenin getirilmesi
5-Dokulara oksijenin geçişi
olaylarının başarılı gerçekleşmesi gerekir. Her hangi bir basamaktaki bozukluk dokunun
oksijenlenmesini bozar ve hipoksiye neden olur. Oksijen atmosferden kana, ve kandan
dokulara parsiyel basınç farkı ile geçer.
Alveoler Ventilasyon
Ventilasyon ile akciğere gelen havanın (500 ml) ölü boşluk (150 ml) haricindeki bölümü
alveollerdeki gaz değişimini sağlar, buna alveoler ventilasyon denir. Ventilasyonun
hızının ve derinliğinin azaldığı durumlarda (hipoventilasyon) alveollere ulaşan oksijen
miktarı gerekenden daha az hale gelir ve bu da arteryel kanda oksijen parsiyel basıncını
(PaO2)’ yi azaltır. Eğer solunan havanın oksijen konsantrasyonu (FiO2) artırılırsa bu
durum
kompanse
edilebilir.
Ancak
ventilasyon
azalmaya
devam
ederse
bu
kompansasyon sürdürülemez.
Oksijenin Kana Geçişi
Alveolde gaz ve kan 0.5 mikronluk bir membranla ayrılır. Oksijen parsiyel basınç farkı ile
alveolden kana basit difüzyon ile geçer. Toplam difüzyon alanı 100 m 2 kadardır. Gazın
çözünürlüğü de önemli bir faktördür. Bir eritrosit akciğerden yaklaşık 0.75 sn’ de geçer
bu esnada üç alveol kateder. Oksijenin pulmoner kapillere maksimum oranda geçişi ise
0.25 sn’ de tamamlanır. Bu nedenle oldukça büyük bir difüzyon rezervi vardır. Oksijenin
kana geçişi Şekil 3.2 ‘de şematize edilmiştir.
29
Şekil 3.2: Oksijenin kana geçişinin şematik görünümü
Kanda Oksijenin Taşınması
Oksijenin alveollerden pulmoner kana geçişi difüzyonla olmaktadır. Doku kapillerlerinde
taşınması ise iki yolla olmaktadır dolayısıyla oksijen kanda iki şekilde bulunur.
1-Çözünmüş oksijen halinde (%3)
2-Eritrosit içinde hemoglobin (Hb) ile kimyasal bileşik halinde (%97)
Kanda çözünmüş oksijenin taşınmada rolü az olmakla birlikte bazı durumlarda önemli
hale gelir. Hastaya %100 oksijen solutulduğu durumda akciğerler normal ise PO2 600
mmHg’ye çıkar. Böylece normalde kanda 0.3 ml olan çozünmüş oksijen miktarı 2 ml’ye
yükselir. Bu durumda normaldeki arterio-venöz oksijen konsantrasyonu farkının önemli
bir komponenti haline gelir.
1 gr Hemoglobin (Hb) 1.34 ml oksijen ile bağlanır. Buna hemoglobinin “oksijen taşıma
kapasitesi” denir. Hb tarafından taşınan oksijen volümü
30
-Kandaki Hb konsantrasyonu
-Hb’in oksijen taşıma kapasitesi
-Hb’in oksijen satürasyonu (SaO2) na bağlıdır.
Hemoglobinin
oksijen
bağlama
oranı
kanın
“oksijen
saturasyonu”
olarak
tanımlanmaktadır. Ortalama olarak 100 ml kanda 15 gr hemoglobin vardır ve her bir
gram Hb 1.34 ml oksijen taşıyacağından 100 ml kanda 1.34 X 15 = 20.1 ml oksijen
hemoglobine bağlı olarak taşınır (SaO2=%100 olduğunda). Hemoglobinin oksijenle
bağlanıp satüre hale gelmesi 0.01 sn’ den daha kısa sürede gerçekleşir. Buna
assosiasyon (birleşme) denir. Oksijenin Hb’ne bağlanması PaO2’ ye bağlıdır. Ancak ilişki
lineer değildir. SaO2’ nin %100 olması için PaO2’nin 250 mmHg civarında olması gerekir.
PaO2’nin 100 mmHg civarında olduğu bir durumda SaO2 % 97’dir.
Hemoglobinin oksijenle bağlanması reversibl bir olaydır.
Hb +O2 HbO2
Akciğerlerde hemoglobin ve oksijen birleşerek oksihemoglobini oluştururlar. Dokularda
ise oksijen oksihemoglobinden ayrılarak (oksijenini vermiş Hb=redükte Hb) dokulara
geçer. Bu olaya “oksijen dissosiyasyonu”denir.
PaO2 ile Hb satürasyonu arasında grafiksel olarak “S” harfi şeklinde bir ilişki vardır. Bu
eğriye ‘Oksihemoglobin Dissosyasyon Eğrisi’ adı verilir (Şekil 3.3).
Eğrinin “S” şeklindeki özelliği önemli avantajlar içerir. Üst kısmın düz olması, oksijen
parsiyel basıncındaki 20-30 ml’lik düşmeye karşın yani alveol içindeki önemli oksijen
basınç azalmasına rağmen kanın oksijenle bileşik oluşturma yeteneğinin devam ettiğini
ve dolayısıyla arteryel oksijen konsantrasyonunda az miktarda düşme olduğunu gösterir.
Alt bölümdeki dikey düzlük doku düzeyindeki çok az oksijen basıncı düşüklüğünde dahi
dokulara hızla oksijen verildiğini ifade eder.
Oksihemoglobin dissosyasyon eğrisini etkileyen faktörler;
Eğriyi sağa kaydıran etkenler (Şekil -3-4)
- pH düşmesi
- Vücut ısısının artması
- PCO2 ‘ nin 40 mm Hg üzerine çıkması
- Eritrositte 2,3 difosfogliserat artışı
31
Şekil 3.3: Oksihemoglobin Dissosyasyon Eğrisi
Şekil 3.4: pH ve Isı’nın Oksihemoglobin dissosyasyon eğrisi üzerine etkisi
Şekil 3.3 ve 3.4’te görüldüğü gibi PCO2 artışı, ısının artışı, pH düşmesi, Eritrositlerdeki
2,3 DPG artışı eğriyi sağa kaydırır ve bu sayede dokulara daha fazla oksijen taşınır. Bu
olayın tersi akciğerlerde olur. Akciğer kapillerlerinden kan geçerken CO2 ‘in dışarı atılımı
ile PCO2 düşer ve eğri sola kayarak kanın daha fazla oksijen bağlaması sağlanmış olur.
32
CO2 parsiyel basıncının oksihemoglobin disosiasyon eğrisi üzerine olan etkisine “Bohr
etkisi” denir. Yani asit ortamda ve PCO2 artınca eğri sağa kayar böylece asit ortamda
hemoglobinin O2’ye afinitesi azalır ve dokulara O2 verimi kolaylaşır.
Oksihemoglobin disosyasyon eğrisininin sola kaydıran etkenlerde yukarda sözü
geçenlerin tersi durumlardır. Yani ısı azaldığında, pH>7.4 olduğunda, ortamdaki PCO2
azaldığında ve eritrosit 2,3 DPG azaldığında ise eğri sola kayar. Fetüste ve yüksek
irtifada da eğri sola kaymıştır.
Satürasyonun %90’ın üzerinde olması oksijenasyonun yeterli olduğunun gösterir. PO2
60 mmHg’dan daha yüksek iken geçerlidir. PaO2 55mmHg’ın altında olduğunda ise
oksijenasyon yetersiz hale gelir ve “doku hipoksisi” başlar.
HİPOKSEMİ
Arter kanında oksijen parsiyel basıncının azalmasına “hipoksemi” denir. Hipoksemide
PaO2 80mmHg’nın altındadır. 60-80 mmHg hafif, 40-60 mmHg orta, 40 mmHg’nın altı
ise ileri derecede hipoksemi olarak tanımlanır. Hipoksemi oluşumu;
1-Ventilasyon/Perfüzyon dengesizliği
2-Alveoler hipoventilasyon (aynı zamanda hiperkapni de gelişir)
3-Diffüzyon defekti
4- Şant
durumunda karşımıza çıkmaktadır. Siyanoz (cildin mavi oluşu, Hb’nin desatürasyonu)
hipokseminin güvenilir bir bulgusu değildir. Eğer siyanozun hipoksemiye bağlı olduğu
düşünülüyorsa arter PO2’si ölçülmelidir. Polisitemik hastalarda belirgin olan ve redükte
Hb miktarı ile orantılı olan siyanoz, anemik olgularda görülmez.
Kanda Karbondioksit’in Taşınması
Doku metabolizmasının artık ürünü olan karbondioksit venöz kanla akciğer kapillerlerine
taşınır. Burada alveollere geçip vücuttan atılır. Karbondioksit sıvılarda eriyebilme özelliği
oksijene göre daha fazla olan bir gazdır.
33
Karbondioksit 3 formda taşınmaktadır.
1-Çözünmüş olarak (%5)
2- Bikarbonat bileşiği şeklinde (HCO3-) (%90)
3- Karbamino bileşiği şeklinde (%5)
Çözünmüş
olarak
taşınan
CO2
ile
PCO2
arasında
korelasyon
vardır
(%5).
Karbondioksitin büyük kısmı kanda bikarbonat halinde taşınır (~ %90). Hücrelerde
oluşan CO2 eritrosit içinde karbonik anhidraz enziminin yardımı ile H20 ile birleşir. H2C03
oluşur. Bu asit hemen H+ ve HCO3- şeklinde iyonlarına ayrılır. H+ iyonları Hb molekülüne
bağlanır, bikarbonat iyonları ise eritrositlerden plazmaya çıkar ve akciğerlere plazmada
gelir. Kan akciğerlere gelince bikarbonat iyonlarının eritrositler içine girmesi ile reaksiyon
tersine döner, sonuçta su ve karbondioksit oluşur ve CO2 solunum yolu ile dışarı atılır.
H2O + CO2 HCO3--+ H+
Oksijenlenmiş kanın CO2 bağlama kapasitesi indirgenmiş (redükte) kana göre daha
düşüktür. Buna “Haldone etkisi” denir. Bu etkiyle alveollerde CO 2 verimi, dokularda ise
CO2 alımı kolaylaşır.
Hemoglobinde oksijenin bağlanmadığı alfa ve beta zincirlerinin terminal uçlarına
karbondioksit reversibl olarak bağlanarak karbamino bileşiği oluşturur (%5).
R—NH3 + CO2 R—COO + H+.
CO2 nin birleştiği proteinlerden en önemlisi Hb’nin globinidir. Redükte Hb oksiHb’den
daha fazla CO2’ye bağlanır. Böylece periferde O2’ nini kaybeden Hb’ nin CO2 bağlaması
artmıştır. Şekil 3.5’te CO2 kanda taşınması şematik olarak gösterilmiştir.
34
Şekil 3.5: Karbondioksitin kanda taşınması
Alveolo-arteryel oksijen gradienti P(A-a)O2
PAO2 (Alveoler oksijen parsiyel basıncı) ve PaO2 (arteryel oksijen parsiyel basıncı)
arasındaki farktır. Akciğerin gaz alışveriş fonksiyonu hakkında bilgi verir. Ventilasyon
perfüzyon dengesizliğini en iyi değerlendirme kriteridir.
Normalde 5-15 mmHg olup yaş ve FiO2 ile artar. 10-20 yaş arasında 4 mmHg
seviyesinde olan alveolo-arteriyel gradient yaklaşık her on yılda 4-5 mmHg artar. 70-80'li
yaşlarda 30 mmHg'ya kadar yükselebilir
Gradyentin normalin üzerinde olması ventilasyon/perfüzyon eşitsizliğinin göstergesi olur.
Solunum yetmezliği durumunda gradientin normal bulunması problemin akciğer dışı
nedenli olduğunu (solunum kasları, santral sinir sistemi, göğüs duvarı gibi) gösterir.
Difüzyon bozukluğu ve şantta gradient artar. Alveoler hipoventilasyonda hipoksemi ve
hiperkapniye karşılık gradient normal sınırlardadır.
Hasta başında hızlı ve kabaca alveolo-arteryel gradient hesaplanmak istendiğinde deniz
seviyesinde atmosferik basınç 760 mm Hg) trakea havasında PO2 149 mm Hg kabul
edilirse ve bu değerden arteryel oksijen ve karbondioksid basınçlarının toplamı
çıkartıldığında alveolo-arteryel gradienti bulunur.
Deniz seviyesinde sağlıklı bir bireyde formül uygulanacak olursa;
P[A-a]O2={[(Patm-PH2O)xFiO2]–[PaCO2/R]}–PaO2
( Deniz seviyesinde barometrik basınç 760 mmHg, PH2O=parsiyel su basıncı(47 mmHg,
370’de), Patm= Atmosferik basınç mmHg,)
PAO2=( (760-47)x0.21)-40/0.8
PAO 2 = (713 x 0.21) - 50= 149.7-50= ~ 100 mmHg
Yaşa göre değişim: P(A-a)O2= 2.5 +(O.21 x yaş(yıl) )
35
Dokularda Gaz Değişimi
Solunan atmosfer havasındaki PO2 yaklaşık olarak 150 mm Hg dir. Alveollerde 100
mmHg ve oksijenin kullanıldığı mitokondride 1 mmHg düzeyine kadar inmektedir. Bunun
nedenlerinden birincisi havanın solunum yollarında nemlendirilerek 47 mm Hg lik su
buharı basıncı oluşması, ikinci neden alveoler havanın içeriğinin kan gaz bariyeri içinde
gazların difüzyonları sonucu belirlenmesidir.
Oksijen
ve
karbondioksitin
kapillerler
ve
doku
hücreleri
arasındaki
değişimi
akciğerlerdeki pulmoner kapiller ve alveoller arasındaki değişime benzer şekildeki “Fick”
yasalarına göre gerçekleşir. Difüzyon yasalarına göre bir doku tabakasından transer
olan gaz miktarı gazın difüzyon membranının iki tarafı arasındaki basınç ( P) farkı,
membranın yüzey alanı (A) ve difüzyon sabiti (D) ile doğru, membran kalınlığı (T) ile
ters orantılıdır (Şekil -6). Yani Vgaz= (P1-P2) x A x D/ T dir. Yine gaz kütlesi içinde
gazların hareketi ise ”Graham yasası”’na göre; Bir gazın, gaz karışımı içindeki relatif
difüzyon hızı (Dgaz) gazın moleküler ağırlığının karekökü ile ters orantılıdır. D gas = 1/
√GMW (GMW=Gazın molekül ağırlığı). Buna göre CO2‘nin molekül ağırlığı O2’den pek
farklı olmasa da çözünürlüğünün O2’ den çok fazla olması nedeniyle CO2 doku
tabakaları içinde O2’ den 20 kez daha hızlı difüze olur (Şekil 3.6).
Şekil 3.6: Doku tabakası içinden difüzyon. Transfer olan gaz miktarı, difüzyon sabiti, parsiyel
basınç farkı ile doğru orantılı, kalınlıkla ters orantılıdır.
36
KAYNAKLAR
1- Akkaynak S. Solunum Hastalıkları.. 3.baskı. Ankara. Taş Kitabevleri Ankara 1980:
52-63
2- Saygı A. Solunum
Fizyolojisi. Ilgazlı A, Çağlar T (Eds). Solunum Fonksiyon
Testleri ve Klinik Kullanımı. Nobel Tıp Kitabevleri İstanbul 1994:1-25
3- Akciğer Fonksiyon Testleri. Eds. Yıldırım N, Umut S. Yenel F. Cerrahpaşa Tıp
Fak. Yayını No:196
Dilek Matbaası. İstanbul 1996: 4-23 Solunum Fizyolojisi Umut S.
4- Hancox B, Whyte K. Çeviri Ed. Dursun AN. Akciğer Fonksiyon Testleri Elkitabı.
McGraw-Hill’s. Düzey Matbaacılık İstanbul 2004:49-60
5- West JB. (Çeviri Çelikoğlu S ). Akciğer Fizyolojisi. 2.baskı. İİ.Ü. Cerrahpaşa Tıp
Fak. Yayınları 118 Temel Matbaası İstanbul 1982:75-86
6- Erelel M, Arseven O . Solunum Fizyolojisi. Akciğer Hastalıkları. Arseven O (E).
Nobel Tıp Kitabevleri Ltd. Şti. İstanbul 2002:31-42
7- Karabıyıkoğlu G. Özşahin S, Akkoca Ö. Solunum Fizyolojisi Solunum Sistemi ve
Hastalıkları. Numanoğlu N (Ed). Ankara Ü. Tıp Fak. Antıp AŞ. Yayınları 1997. 932
8- http://www.toraks.org.tr/mse11-ppt-pdf/T_Acican%201.pdf
9- http://tip.uludag.edu.tr/fizyoloji/dosya/kanda-oksijen-ve-karbondioksittasinmasi.pdf
10-http://www.aof.anadolu.edu.tr/kitap/EHSM/1211/unite07.pdf
11-http://www.baskent.edu.tr/~scanan/dersler2008/solunum2008.pdf
37
4.
Yrd. Doç. Dr. Cansel Atinkaya
Pamukkale Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
SOLUNUM MEKANİĞİNİN TEMEL PRENSİPLERİ
Eskiden beri cerrahi sonrası en sık saptanan komplikasyonların solunum sistemine
ait olduğu bilinmektedir. Bu nedenle özellikle cerrahi sonrası gelişebilecek
komplikasyonların değerlendirilebilmesi için solunum mekaniğinin temel prensiplerinin
iyi bilinmesi gerekmektedir.
Solunum, birçok sistemin düzen içinde birlikte çalışması ile gerçekleşen karmaşık bir
fonksiyondur. Solunum sisteminin temel fonksiyonu olan gaz alışverişinin yeterli
düzeyde olabilmesi için solunumsal hareketleri sağlayan solunum pompasının da
etkin olması gerekir. Solunum mekaniği akciğer ve göğüs duvarının mekanik
özelliklerinin bir bileşimidir. Bu fonksiyonlardan herhangi birindeki bozukluk solunum
yetmezliğinin (SY) bir nedeni olarak karşımıza çıkabilir (1).
Ventilasyon basitçe, havanın akciğerin içine ve dışına doğru olan hareketidir.
Ventilasyonda temel amaç, oksijenden zengin havanın akciğerlere alınması ve
yüksek oranda karbondioksit içeren havanın dışarı atılmasıdır.
Respirasyon (solunum) ise inhale edilen gazın membrandan geçiş hareketidir.
Oksijen ve karbondioksitin değişimini sağlar. Respirasyon, Eksternal ve internal
respirasyon olmak üzere ikiye ayrılır:. Eksternal respirasyon, oksijenin akciğerlerden
kan dolaşımına, karbondioksitin ise dolaşımdan alveollere hareketidir. İnternal
respirasyon ise hücresel düzeyde oksijenin kandan hücre içine, karbondioksitin ise
hücre dışına ve dolaşıma geçişidir. Bu konu detaylı bir şekilde Bölüm 2’de
anlatılmıştır.
Ventilasyonun amacı, atmosfer havasını akciğerlere ulaştırmak ve venöz kandan
alveollere geçen karbondioksiti de akciğerlerden uzaklaştırmaktır. Ventilasyon tidal
solunum adı verilen bir solunum biçimi ile yürütülür. Tidal solunum inspirasyon ve
ekspirasyondan oluşur. İnspiryum, solunum kasları ile oluşturulan aktif bir işlemdir.
İnspiryumun en önemli kası diafragmadır ve solunum pompa işinin 2/3’ünü
gerçekleştirir. İnspiryumun başlangıcında diafragma kontraksiyonu ile göğüs duvarı
genişler, plevra ve alveol basınçları negatifleşir, alveol basıncının ağız içi basınçtan
düşük olmasından dolayı atmosferik hava alveollere dolar (2). Ekspiryum ise göğüs
38
duvarı ve akciğerlerin elastik geri dönüş kapasitesi sayesinde gerçekleşen pasif bir
işlemdir, ancak eksternal interkostal ve abdominal kaslar da ekspiryuma yardımcı
olabilir. Bu durum ise zorlu ekspirasyon olarak adlandırılır (3).
Ventilasyon sırasındaki basınç değişikliklerinin değerlendirilmesinde birim olarak
genellikle "santimetre su (cm H2O)" kullanılır. Boyle yasasına göre; bir kaptaki sabit
sayıdaki gaz molekülü varsa, kabın hacmindeki bir artış gaz basıncını düşürür, kabın
hacmindeki bir azalma ise basıncı artırır. Solunum sistemindeki bütün basınç
hesaplamaları vücut çevresindeki hava basıncını oluşturan (deniz seviyesinde 760
mmHg) atmosferik basınç esas alınarak yapılır (1 atm =760 mmHg; 1 mmHg = 13,6
cmH2O).
Solunum mekaniğinde başlıca 4 basınç ve bunların birbirleri ile etkileşimleri önem
taşır (Şekil 4.1).
Şekil 4.1: Solunum mekaniğinde gaz akımını sağlayan basınçlar ve basınç gradiyentleri.
Havayolu açıklığı basıncı (Pawo : Airway Opening Pressure)
Bu değer üst havayolu yada proksimal havayollarına ait basınç olarak değerlendirilir
ve üst havayoluna pozitif basınç uygulanmadığı sürece Pawo değeri sıfırdır.
Vücut yüzeyi basıncı (Pbs : Body Surface Pressure)
Hasta hiperbarik oda gibi basınçlı bir odada bulunmadığı veya negatif basınçlı
ventilasyon uygulanmadığı sürece bu değer de atmosferik basınca eşittir ve sıfır
kabul edilir.
39
Alveoler basınç (PA)
"İntrapulmoner basınç" olarak da adlandırılır. Alveol yüzeyine yansıyan basınç
değerini ifade eder. Glottis açık, akciğerlerden içeri ve dışarı hava akımının olmadığı
durumlarda tüm solunum yollarında basınç 0 cm H2O’dur. İnspirasyonda yaklaşık -1
cm H2O olur. Ekspirasyonda +1 cm H2O’dur.
İntraplevral basınç (Ppl)
Parietal ve visseral plevra arasındaki potansiyel boşluğun basıncıdır. Atmosferik
basınçla kıyaslandığında negatiftir ve değeri normal solunum sırasında -5 ve -9 cm
H2O arasında değişir. İntraplevral basıncın negatif olması, toraks duvarının dışarı
doğru ekspanse olma, akciğerlerin ise elastik kuvvetlere bağlı olarak kollabe olma
eğiliminden kaynaklanmaktadır; zıt yönlerde etki eden bu iki kuvvet intraplevral
basıncın negatif olmasına yol açar. Zorlu ekspirasyon ve inspirasyon manevraları
sırasında daha büyük basınç değişimi olur (Şekil 4.2). Plevral basınç akciğerlerin
tepesinden tabanına doğru dereceli olarak artar ve böylelikle akciğerin tepesi ile
tabanı arasında yaklaşık 7-8 cm H2O basınç farkı oluşur. Bu fark bölgesel ventilasyon
ve perfüzyonda önemli etkiye sahiptir (4,5).
Şekil 4.2: İntraplevral basınç değişimleri
Akciğer volümlerinin oluşması basınç farkları sonucunda oluşan gaz akımları ile
mümkündür yani ventilasyonun gerçekleşmesi basınç farklarına (gradientlerine)
bağlıdır. Buna göre solunum mekaniğinden başlıca 4 temel basınç farkı sorumludur:
40
1)Transtorasik basınç (Pw) Pw = PA - Pbs.
Alveolar boşluk ve vücut yüzeyi arasındaki basınç farkıdır. Bu değer akciğerler ve
göğüs duvarının aynı anda ekspanse olması için gerekli basıncı gösterir.
2)Transhavayolu basıncı (PTA) PTA = Pawo - PA.
Havayolu ve alveoller arasındaki basınç farkıdır. Bu formülde Pawo genellikle
havayolu açıkken ölçülen değerdir. PTA havanın havayollarında alveollere doğru
iletiminden sorumludur.
3)Transrespiratuar basınç (PTR) Pawo - Pbs.
Havayolu açıklığı basıncı ve yüzey basıncı arasındaki basınç farkıdır. Bu değer
özellikle pozitif basınçlı ventilasyonda inflasyon için gerekli basınç değerini gösterir.
Buna göre "Pbs" atmosferik basınçdır ve genellikle sıfır kabul edilir. Pawo ise
mekanik ventilasyon sırasında ventilatör göstergesinde okunan pozitif basınç
değeridir.
4)Transpulmoner basınç (PL veya PTP)
Alveol (PA) ve plevra boşluğu (Ppl) arasındaki basınç farkı olarak tanımlanabilir.
PTP olarak da kısaltılan transpulmoner basınç, PTP = PL = PA - Ppl olarak formüle
edilebilir. PL alveolar insuflasyonu sürdürmekten sorumludur ve bu nedenle “alveolar
distansiyon basıncı” olarak da adlandırılır (Şekil 4.3). Bu basınç akciğerleri kollapsa
yönlendiren elastik kuvvetlerin bir ölçüsüdür (6).
Şekil 4.3: Transpulmoner basıncın şematik olarak gösterimi
41
Spontan solunum sırasında oluşan hava hareketi şu şekilde özetlenebilir (Şekil 4.4).
Spontan inspirasyon sırasında, torasik volüm artarken, intraplevral basınç atmosferik
basınca göre daha negatif hale gelmektedir. Yani negatif intraplevral basınç
ekspiryum sonunda yaklaşık -5 cm H2O iken inspirasyon sonunda -10 cm H2O’ ya
yaklaşır. Bu negatif basınç akciğerleri ekspanse olmaya zorlar ve alveolar boşluğa
yansır ve intraalveolar basınç (PA) atmosferik basınca göre daha negatif hale geçer.
Bu durumda transpulmoner basınç farkı (PL) artar; oysa ağız veya vücut yüzeyindeki
basınçlar hala atmosferiktir. Böylece ağız ve alveol arasında bir basınç gradiyenti
oluşur ve ağızdan alveole doğru hava akımı başlar. Alveollerin hava ile dolması
sonucu intraalveoler basınç negatif değerden yine “0” değerine ulaşır. Bu esnada
alveol
basıncı
atmosferik
basınca
eşitlenir
ve
akciğere
daha
fazla
akım
oluşturulamaz. Bu durum inspiryum sonunu işaret eder.
Ekspirasyon süresince solunum kasları gevşer, torasik volüm azalır ve intraplevral
basınç istirahat değeri olan -5 cmH2O değerine geri döner. Alveol basıncı da elastik
akciğer dokusunun büzüşmesi, diyafragma ve kostaların normal pozisyona gelmesi
ile artar ve hafifçe pozitif hale geçer. Bu anda ağız basıncı intraalveoler basınçtan
daha düşüktür. Oluşan transhavayolu basınç farkı havanın akciğer dışına hareketini
sağlar. Alveol ve ağız basınçları sıfıra eşitlendiği anda ekspirasyon son bulur (5,7).
Şekil 4.4: Spontan ventilasyon mekaniği
Kompliyans
Her bir birim basınç değişmesiyle oluşan volüm değişmesine kompliyans denir.
Akciğer kompliansı akciğer dokusunun elastik özellikleri ve terminal respiratuar
ünitelerinin yüzeyini döşeyen surfaktan ile ilişkilidir.
Kompliyans, akciğerlerde kan veya sıvı biriktiğinde, akciğer fibrozisine neden olan
hastalıklarda azalır, şahsın yaşının ilerlemesi ve amfizemde artar.
42
Kompliyans yüksek olunca akciğerler belli bir basınçla daha kolay genişlerler.
Kompliyans düşük olduğunda ise akciğer katılaşır ve basınç karşısında ekspansiyonu
daha az bir hale gelir.
Akciğerin birim volümüne düşen kompliyansa spesifik kompliyans denir ve akciğer
dokusunun elastik özellikleri hakkında en iyi bilgiyi verir. Yüzey gerilimi akciğer
volümleri arttıkça yükselir azaldıkça düşer.
Eğrinin dik olması yüksek kompliyansı, yatık olması düşük kompliyansı gösterir.
Dolayısıyla
AC
kompliyansı
yüksek
volümlerde
en
düşük,
rezidüel
volüm
seviyelerinde en yüksek noktasındadır (Şekil 4.5).
Şekil 4.5: Kompliyansla akciğer volümü arasındaki ilişki
Surfaktan
Akciğerlerin kompliansı aynı zamanda surfaktan ile yakından ilgilidir çünkü yüzey
gerilimini belirleyen esas madde surfaktandır. Surfaktan, tip II alveol hücreleri
tarafından
üretilir;
böylelikle
alveollerde
yüzey
gerilimini
azaltarak
akciğer
kompliyansını arttırır ve her solukta genişleme işini azaltır; alveollerin stabilitesini
arttırarak küçük alveollerin büyük alveollere boşalma eğilimini azaltır ve atelektaziyi
önler; yüzey gerilimini azaltarak alveolün içine sıvı sızmasını önler ve alveolü kuru
tutar (Şekil 4.6).
43
a
ir
a
ir
a
ir
Şekil 4.6: Su molekülleri hava ile temas ettiklerinde aralarında kimyasal bir çekim gücü
meydana gelir (ör = yağmur damlasının oluşumu). Epitel üzerindeki su moleküllerinin
oluşturduğu yüzey gerimi, alveollere büzüşmeye (kollabe olmaya) meyilli bir balon niteliği
kazandırır. Akciğerlerde yüzey gerim elastik kuvveti denilen elastik kasılma kuvveti oluşur.
Statik Akciğer Volümleri
Ventilasyon parametreleri (Şekil 4.7)
Tidal volüm (TV): Her respiratuar siklusta akciğere girip çıkan gaz miktarıdır. Normali
400-800 ml'dir.
Rezidüel volüm (RV): Maksimal ekspirasyondan sonra akciğerde kalan hava
volümüdür. Total akciğer kapasitesinin %25-30'unu oluşturur.
İnspiratuar rezerv volüm (IRV): Normal bir inspirasyon dan sonra alınabilen maksimal
hava volümüdür. Vital kapasitenin %45-50'sini oluşturur.
Ekspiratuar rezerv volüm (ERV): İstirahat düzeyinden itibaren dışarı atılabilen
maksimal hava volümüdür. Vital kapasitenin %25'ini oluşturur.
Vital kapasite (VC) : Maksimal inspirasyondan sonra yavaş ve zorlamadan yapılan
maksimal ekspirasyonla dışarı atılabilen hava volümüdür. TV+IRV+ERV içerir.
İnspiratuar kapasite (IC): İstirahat seviyesinden itibaren akciğerlere alınabilen
maksimal hava volümüdür. TV+IRV içerir. VC nin %75'ini oluşturur,
Fonksiyonel rezidüel kapasite (FRC): İstirahat seviyesinde akciğerde bulunan total
hava volümüdür. RV+ERV içerir.
Total akciğer kapasitesi (TLC): Maksimum inspirasyon düzeyinde akciğerde bulunan
total hava volümüdür. VC+RV içerir. Normal değeri 4-6 lt'dir.
44
Şekil 4.7: Ventilasyon parametreleri
Statik volümlerin değerlendirilmesi
Her bir akciğer volümü için beklenen değerin %80-120 arası normal kabul
edilmektedir.
Restriksiyon, akciğer volüm ve kapasitelerinin beklenen değerin %80'inin altında
olması olarak tanımlanır.
Overinflasyon ise, rezidüel volüm ve total akciğer kapasitesinde artış olmasıdır. Hava
hapsi yani inspirasyon ile alınan havanın ekspirasyonla tamamen dışarı atılamaması
olarak da tanımlanabilir (Şekil 8).
Şekil 4.8: Statik akciğer volümleri
Dinamik Akciğer Volümleri
Dinamik akciğer testleri zorlu vital kapasite ölçümü ve volüm-zaman eğrisi, akımvolüm eğrisi, maksimal istemli ventilasyon ve hava yolu direnç ölçümü olmak üzere 4
bölümde incelenebilir.
FVC (Forced vital capacity) derin bir inspirasyondan sonra zorlu ve hızlı bir
ekspirasyonla dışarı atılan hava hacmidir, L veya ml olarak ifade edilir. Sağlıklı
kişilerde FVC, vital kapasiteye eşittir fakat obstrüktif hastalıklarda daha düşük
45
bulunur. Restriktif akciğer hastalıklarında da FVC azalmış olarak saptanır. Hem
volüm-zaman hem de akım-volüm eğrileri ile ölçülebilir. FVC (Forced vital capacity)
ölçümü, hem inspirasyon hem de ekspirasyon sırasında yapılabilirse de genellikle
ekspiratuar kapasiteyi tanımlamak için kullanılır. FVC manevrası için, testi yapacak
olan bireyin burnu yumuşak bir mandalla kapatılır ve spirometre ağızlığına yavaşça
soluması söylenir. İstirahat düzeyinden sonra bireyden derin bir nefes alması ve
zorlu, derin ve hızlı bir ekspirasyonla tüm havayı dışarı boşaltması istenir. Bu esnada
ekspirasyon ile atılan volüm y eksenine, zaman ise x eksenine yerleştirilerek volümzaman eğrisi elde edilir. FVC manevrası en az üç kez tekrarlanmalı ve en iyi değer
kabul edilmelidir. Bu manevra ile elde edilen ölçümler; FVC, FEV1, FEV1/FVC oranı,
FEV3, FEV3/FVC ve FEF 25-75 oranlarıdır.
FEV1: Zorlu ekspirasyonun birinci saniyesinde atılan volümdür, L veya mL olarak
ifade edilir. Normalde ekspirasyonun birinci saniyesinde akciğer volümünün %75-80'i
dışarı atılmış olmalıdır. FEV1deki azalma, büyük hava yolu obstrüksiyonunu
düşündürür.
%FEV1/FVC (Tiffeneau indeksi): Solunumsal bozukluğun tipini belirlemede önemlidir.
FVC ve FEV1 düşük iken, bu oranın beklenen değere yakın veya bu değerden
yüksek oluşu restriktif bir bozukluğu, beklenen değerden düşük oluşu ise obstrüktif
bozukluğu gösterir.
FEV3: Zorlu ekspirasyonun üçüncü saniyesinde atılan volümdür, L veya mL olarak
ifade edilir. Büyük hava yollarının değerlendirilmesin de önemlidir.
%FEV3/FVC: 3. saniyede atılan hava volümünün zorlu vital kapasiteye oranıdır.
FEV1/FVC değeri gibi restriktif hastalıklarda normal veya artmış, obstrüktif
hastalıklarda ise azalmıştır.
%FEF 25-75: Zorlu ekspirasyon ortası akım hızı olarak tanımlanır. Zorlu
ekspirasyonun ilk ve son 1/4'lük kısımları arasında kalan akım hızıdır. Diğer bir
deyişle zorlu ekspirasyonda, havanın ilk %25'i atıldıktan sonraki %50'lik volüm
atılırken saptanan akım hızıdır, L/sn olarak ifade edilir. Zorlu ekspirasyonun efora
bağımlı olmayan segmentidir. Hava yollarındaki obstrüksiyonu erken dönemde
gösterir. Beklenen değerin altında bulunması, orta ve küçük hava yolları
obstrüksiyonunu gösterir (8).
46
Akım- Volüm Eğrisi
Özellikle
çapı
2
mm'den
küçük
periferik
hava
yollarının
fonksiyonlarının
değerlendirilmesinde önem taşır. Bireye FVC manevrası yaptırılır, bu esnada hava
akımı y eksenine, volüm ise x eksenine yerleştirilerek akım-volüm eğrisi elde edilir
(Şekil 4.9).
Şekil 4.9: Akım- volüm eğrisi
Solunum Fonksiyon Testlerinin Yorumlanması (Tablo 4.1)
Obstrüktif görünüm
Hava yollarının herhangi bir bölümünde hava akımı kısıtlanması olduğunda saptanır.
KOAH, bronşiyal astım, kistik fibrozis, küçük hava yolu hastalıkları ve yukarı hava
yolları obstrüksiyonu bu görünüme neden olur.
Küçük hava yollarında sınırlı hastalıklar dışında obstrüktif hastalıkların en iyi
göstergesi FEV1/FVC değerindeki azalmadır. FEV1 değeri de azalmıştır. Genellikle
VC normaldir. FVC ise düşük bulunabilir. FVC değerindeki azalma hava hapsinin
bulgusudur. Akciğer volümleri ise artmış olarak bulunur. RV, FRC ve TLC artmıştır.
Restriktif görünüm
Akciğer parankim hastalıkları (pnömoni, atelektazi, fibrozis), cerrahi rezeksiyon
(lobektomi), plevra ve göğüs duvarı hastalıkları (plevral sıvı, kifoskolyoz, obesite) ve
nöromüsküler hastalıklar (spinal kord, nöromüsküler kavşak ve kas hastalıkları)
restriktif tipte bozukluğuna neden olurlar.
Restriktif görünümün en önemli özelliği VC azalmasıdır. FEV1 değeri de VC
azalmasına paralel olarak azalabilir fakat FEV1/FVC değeri normal olarak kalır. RV,
FRC ve TLC azalmış olarak bulunur. Farklı olarak nöromüsküler hastalıklarda FRC
47
genellikle korunurken, solunum kas gücü kaybı nedeniyle ERV azalır. Bu nedenle RV
artmış bulunabilir.
Obstrüktif ve restriktif görünümün birlikte olması
Hem obstrüktif hem de restriktif görünüm özelliklerini taşıyan SFT, sarkoidozis,
idiyopatik akciğer fibrozisi gibi hastalıklarda görülür. Ayrıca obstrüktif görünüme
neden olan astım gibi hava yolu hastalıklarında hava hapsi ve hiperinflasyon
bulgularının görülmesi karışık tipte SFT bozukluğuna yol açabilir. KOAH'lı bir hastada
pnömoni veya masif plevral efüzyon gibi restriktif görünüm oluşturacak hastalıkların
ortaya çıkması da obstrüktif + restriktif SFT değişikliğine neden olur.
Tablo 4.1: Solunum Fonksiyon Testlerinin Yorumlanması
PARAMETRE
OBSTRÜKSİYON
RESTRİKSİYON
KOMBİNE
VC
↓ veya N
↓
↓
FVC
↓ veya N
↓
↓
RV
↑ (amfizem)
↓
↓
TLC
↑ (amfizem)
↓
↓
FEV1
↓
↓
↓
FEV1 /FVC
↓
N
↓
FEF 25-75%
↓
N
↓
FEF %50
↓
N
↓
MVV
↓
N
↓
KAYNAKLAR
1. Uçgun İ. Solunum yetmezliği, fizyopatoloji, ayırıcı tanı. Ucgun İ. Solunum
desteği gereken hastalarda mekanik ventilasyon uygulamaları, ASD Toraks
yayınları; 2005:3-17
2. Saryal BS. Solunum mekaniği. Solunum 2;2000:11-125
3. Altose MD. Pulmonary mechanics. In: Fishman AP, Elias JA, Fishman JA,
Grippi MA, Kaiser LR, Senior RM, eds. Fishman’s pulmonary diseases and
disorders 3rd ed. NewYork, McGrawHill 1998;Vol 1,149-162
4. Morgan WC, Seaton D. Akciğer havalandırması ve kan gaz değişimi.
Sodeman’s pathologic physiology, mechanisms of disease. 1991; 487-512
48
5. Rossi A, Gottfried SB, Zocchi L, et al: Measurement of static compliance of the
total respiratory system in patients with acute respiratory failure during
mechanical ventilation. The effect of intrinsic positive end-expiratory pressure.
Am Rev Resp Dis 131: 672,1985
6. Pilbeam SP. Mechanical ventilation. Physiological and clinical applications. 3rd
ed. Mosby;1998
7. Perel A, Stock MC: Handbook of mechanical ventilatory support. 1st Ed.
Williams and Wilkins, Philadelphia,1992;7
8. Sexauer WP, Glassroth J. Mechanics of breathing. In Shields TW, LoCicero J,
Ponn RB, Rusch VW, ed. General Thoracic Surgery, vol 1, 5th ed.
Philadelphia: Lippincott Williams and Wilkins; 2000:93-103
49
5.
Prof. Dr. Melih Kaptanoğlu ve Doç. Dr. Aydın Nadir
Cumhuriyet Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞER KANSERİNDE KLİNİK BULGULAR
Akciğer kanseri erkek ve kadınlarda önde gelen ölüm nedenlerinden biridir. Yaşam
süresi hastalığın teşhis edildiği andaki evresi ile yakından ilişkilidir. Bu yüzden erken
tanı ve tedavi yaşam süresini arttırmada önemli rol oynar. Maalesef pek çok olgu
erken evrede asemptomatiktir. Semtomatik hale gelen olgular çoğu zaman ileri
evrededirler ve cerrahi tedavi şansını kaybetmişlerdir.
Akciğer kanserlerinde belirtiler oldukça değişkendir ve tümörün lokalizasyonuna ve
metastazın olup olmamasına göre değişmektedir. Yapılan çalışmalarda akciğer
kanserli olguların %80-90’ı sigara içicisidir. Diğer nedenler arasında KOAH ve
uranyum, altın, asbest, nikel gibi maddelere maruz kalmak sayılmaktadır. Yaş
ilerledikçe akciğer kanseri riski artmaktadır. Çalışmalarda 40 yaş altında akciğer
kanserine nadiren rastlanırken, sigara içen 40 yaş üstündeki hastalarda risk
artmaktadır(1,2) .
Tüm akciğer kanserli hastaların %5-20’si tanı anında asemptomatiktir. Yapılan
tarama çalışmalarında teşhis edilen olguların ise %60’ı asemptomatik olarak
bulunmuştur (2,3).
Akciğer kanserine bağlı klinik belirtileri 4 ana başlık altında
toplamak mümkündür (1-5).
1- Bronkopulmoner semptomlar
2- Ekstrapulmoner intratorasik semptomlar
3- Metastaza bağlı semptomlar
4- Paraneoplastik sendromlar
Bronkopulmoner semptomlar
Lokal ya da bronkopulmoner semptomlar arasında öksürük, hemoptizi, wheezing,
stridor, göğüs ağrısı ve nefes darlığı yer alır.
50
Öksürük:
Akciğer kanserlerinin en sık görülen başlangıç belirtilerinden biridir. Hastaların
%74’ünde mevcuttur. Bronş içinde bulunan tümörün irritasyonu ya da bronş duvarına
dışardan bası sonucu oluşur. Yeni başlaması, var olan öksürüğün karakter
değiştirmesi akciğer kanseri yönünden irdelenmelidir.
Hemoptizi:
Balgamla bulaş şeklinden masif hemoptiziye kadar değişen şiddetlerde karşımıza
çıkabilir. Hastaların %30’unda görülür.
Wheezing-Stridor:
Tümörün ana bronşu, trakeayı tıkaması yada dışardan bası ile daraltması sonucu
oluşur. Küçük hava yollarındaki daralma sonucu weezing, trakea ve ana bronş
daralması (lümen çapının %75den fazla daralması gerekir) sonucu ise stridor gelişir.
Stridor çoğu zaman trakea darlığında karşımıza çıkar. Bazen ana bronş tıkanıklığı
sonucu da oluşur.
Göğüs Ağrısı:
Hastaların %50’ye yakınında görülür. Santral tümörlerde sternum arkasında
hissedilir. Periferik tümörlerde ise plöretik ağrı şeklinde görülür. Göğüs duvarı
tutulmuşsa iyi lokalize edilen ve interkostal sinir boyunca hissedilen ağrı meydana
gelir.
Nefes Darlığı:
Akciğer kanserli hastaların %60’ında görülür. Lober bronşun ya da ana bronşun
tümör ile tıkanması sonucu nefes darlığı gelişir. Ayrıca ana pulmoner arterin
tıkanması, yaygın plevral efüzyon ve diyafragma tutulumunda da nefes darlığı şiddetli
olabilir.
Ekstrapulmoner İntratorasik Belirtiler
Göğüs içindeki tümörün bazı oluşumları tutması sonucu oluşan ses kısıklığı, vena
kava superior sendromu, diyafragma felci, Horner sendromu, üst ekstremite ağrısı,
yutma güçlüğü gibi belirtilerdir.
Ses kısıklığı
N.rekürrensin göğüs içinde tümör ya da lenf bezi metastazı tarafından invaze
edilmesi sonucu meydana gelir. Sinirin anatomik olarak daha uzun yol kat etmesi ve
hilusa yakın seyri nedeniyle daha çok sol tarafta görülür (Şekil 5.1).
51
Şekil 5.1: Her iki N. Rekürrensin toraks ve servikal bölgedeki seyirleri. Sol tarafta daha uzun
seyreden sinirin tümör tarafından tutulma ihtimali daha fazladır.
Vena Kava Superior Sendromu
Akciğer kanserli hastaların %4-10’unda görülür. Hastaların göz çevresinden
başlayarak yüz, boyun gövdenin üst kısmında ve kollarda şişlik ile birlikte artan kafa
içi basıncına bağlı olarak baş ağrısı, kulak çınlaması gelişir. İnspeksiyon ile tanısı
kolayca konulur. Yapılacak ilk iş nedene yönelik incelemelere başlamak olmalıdır.
Özellikle sağ akciğer üst lob tümörlerinde karşımıza çıkar.
Diyafragma Felci
N. Frenikusun göğüs boşluğunda seyri esnasında tümör tarafından tutulması
nedeniyle gelişir.
Horner Sendromu:
Stellar ganglionun tutulduğunu gösteren belirtidir. Pancoast tümörünün belirtisidir.
Tutulan tarafta gözde pitozis, myozis, enoftalmi ve anhidrozis görülür.
Üst ekstremite ağrısı
Ön kol ve omuzda nedeni açıklanamayan ağrı Pancoast tümörünün pleksus
brakiyalisi tutması sonucu ortaya çıkar.
Yutma Güçlüğü
Tümörün veya metastatik lenf bezinin özofagusu göğüs boşluğu içinde tutması
sonucu görülür.
52
Metastaza Bağlı Semptomlar
Akciğer kanserinin metastazına bağlı gelişen semptomlar oldukça değişkendir.
Akciğer kanseri sıklıkla lenf bezlerine, plevraya, akciğere, beyine, vertebralara,
karaciğer, adrenal bezler ve kemiklere metastaz yapar. Metastaz yapma sıklığı göz
önüne alındığında küçük hücreli kanser tipi ilk sırada yer alır. Diğerleri sırasıyla büyük
hücreli, adenokanser ve yassı hücreli kanserlerdir.
Nörolojik Semptomlar
Yeni teşhisi konulan akciğer kanserlerinin yaklaşık %10’unda beyin metastazı
saptanmaktadır. Bunların çoğunluğu klinik belirti vermektedir. Bu oran küçük hücreli
kanserlerde %23’dür (2,3). Bu semptomların nedeni tümöre bağlı intrakraniyal basınç
artışıdır. Baş ağrısı, bulantı, kusma, çift görme, bulanık görme, mental değişiklik sık
görülen semptomlardır.
Vertebra metastazları spinal korda bası yaparak nörolojik belirti verebilirler.
Metastazların 2/3’ünden fazlası torasik vertebralarda saptanır (2-4) ve küçük hücreli
kanserlerde daha çok gözlenir. Nadiren tümör direkt invazyon yaparak vertebraya ve
spinal korda ulaşır. Hastaların %95’inde sırt ağrısı vardır. İnvazyon seviyesinin alt
bölgelerinde motor ve duyu kaybı oluşabilir.
Kemik Metastazları
En sık kemik metastaz yerleri vertebralar, pelvis, femur ve kostalardır. Ağrı belirgin
semptomdur. Eklem ağrılarına da neden olabilir.
Karaciğer
Karaciğer metastazı nadiren semtomatik olur. Metastaz taramalarında tespit edilir.
Abdominal ağrı, iştahsızlık, asit ve sarılık görülebilir.
Adrenal Bezler
Nadiren semptom verirler. Bezin %90’dan fazlasını işgal etmedikçe semptom
oluşturmazlar (2). Bezlerin medullasına metastaz yapma eğiliminden dolayı
hastalarda Addison Hastalığı gelişebilir.
Bu bölgeler dışında akciğer kanseri cilde, ciltaltı dokusuna, yumuşak dokulara, kalp
ve mide gibi organlara da nadiren metastazlar yapabilir.
Paraneoplastik sendromlar
Akciğer kanserinin doğrudan invazyon veya metastazlarına bağlı olmadan tümörün
etkisine bağlı olarak gelişen klinik belirtiler paraneoplastik sendromlar olarak ifade
edilir. Akciğer kanserli hastaların %10-20’sinde görülür. Küçük hücreli akciğer
53
kanserlerinde diğerlerine göre daha fazla görülür. Bazı paraneolastik sendromlar
tümörün biyolojik olarak aktif peptitlerine ya da antikorlarına bağlı olarak gelişirken,
diğerlerinin oluş mekanizması açıklanamamıştır. Akciğer kanserlerinde görülen
paraneoplastik sendromlar endokrin-metabolik, nörolojik, hematolojik, dermatolojik ve
diğerleri olarak sınıflandırılabilir (2,4,5).
Endokrin-metabolik sendromlar arasında uygunsuz antidiüretik hormon (ADH)
sendromu, hiperkalsemi, ektopik adrenokortikotropin hormon (ACTH) salınımına
bağlı gelişen Cushing sendromu, Ektopik gonodotropin hormon salınımına bağlı
gelişen jinekomasti sayılabilir. Jinekomastiye çoğu zaman hipertrofik pulmoner
osteartropati de eşlik eder.
Hipertrofik
pulmoner
osteartropati
(HPO)
adenokarsinomlarda
daha
sık
görülmektedir. Eklemlerde ve kemiklerde ağrı şikayeti ön plandadır. Daha çok tibia,
radius, fibula ve ulna etkilenir. Uzun kemiklerin distalinde simetrik proliferatif
periostitis gelişir. Çomak parmak ise siyanotik kalp hastalıklarında ve KOAH’da da
geliştiğinden akciğer kanseri için patognomonik değildir (2).
Nöromusküler sendromlar en yaygın görülen paraneoplastik sendromlardır. Fakat
çoğu
zaman
oftalmopleji,
teşhis
retinopati,
edilmezler.
periferik
Kortikal
nöropati,
serebellar
dejenerasyon,
dermatomyozit
ve
demans,
Lambert-Eaton
Sendromu nöromusküler sendromlar arasında sayılabilir.
Sideroplastik anemi, hemolitik anemi, kırmızı hücre aplazisi, eritrositoz, eozinofili,
trombositopeni, lökomoid reaksiyonlar gibi hematolojik bozukluklar da akciğer
kanserli hastalarda görülebilir.
KAYNAKLAR
1- Kalemkerian GP, Pass HI. Lung Cancer. Present concepts in the molecular
biology of lung cancer. In Shields TW, LoCicero J, Ponn RB, ed. General Thoracic
Surgery, vol 1, 5th ed. Philadelphia: Lippincott Williams and Wilkins; 2002:12351268.
2- Darling G, Dresler CM. Lung Cancer. Clinical presentation of lung cancer. In
Shields TW, LoCicero J, Ponn RB, ed. General Thoracic Surgery, vol 1, 5th ed.
Philadelphia: Lippincott Williams and Wilkins; 2000:1269-1282.
3- Kalaycı NG. Akciğer kanserinde tanı ve evreleme. In Yüksel M, Kalaycı NG. ed.
Göğüs Cerrahisi. 2001:233-262.
4- Emri SA, Akciğer kanseri ve soliter pulmoner nodül. In Barış İ. Solunum
54
Hastalıkları temel yaklaşım. 1995:307-350.
5- Özyardımcı N. Primer bronş kanserinde semptom ve bulgular. In Engin K,
Özyardımcı N. Akciğer kanserleri. Tanı ve tedavide temel ilkeler ve uygulamalar.
2001:66-69.
55
6.
Yrd. Doç.Dr. Bengi Gürses ve Prof. Dr. Sina Ercan
Yeditepe Üniveritesi Tıp Fakültesi Radyoloji ve Göğüs Cerrahisi Anabilim Dalları
BAŞLICA TORAKS PATOLOJİLERİNDE RADYOLOJİK BULGULAR
Normal Toraks Radyolojisi
Bu bölümde göğüs cerrahisi branşı ile ilgili karşılaşılabilecek başlıca patolojiler
hakkında görseller eşiliğinde genel bir bilgi aktarımı planlanmıştır. Her hekimin belli
bir aşinalığı olması gereken genel tetkiklerin önde gelenlerinden birisi de hiç şüphesiz
akciğer grafisidir. Resim 1a ve 1b’de posteroanterior (PA) ve sol lateral normal
akciğer grafileri görülmektedir. Göğüs cerrahisinde karşılaşılan diğer patolojilere
geçmeden önce bugün artık en az düz akciğer grafisi kadar sık karşılaşılan toraks
bilgisayarlı tomografisinde (BT) yer alan ana yapılar da Resim 6.2-7’de özetlenmiştir.
Bunlardan ilk üçü toraksın, akciğerler dışındaki kemik kas ve yağ gibi diğer
dokularının detaylarının görülebildiği mediasten penceresinde, sonraki üçü de diğer
detayların silinerek sadece akciğerlerin detaylarının görülebildiği akciğer parenkim
penceresindeki kesitlerdir.
Resim 6.1 a ve b:Normal PA ve lateral
akciğer grafisi görüntüleri
Resim 6.2, 6.3 ve 6.4: Normal toraks BT görüntüleri ve önemli oluşumlar (Mediasten
penceresi)
56
Resim 6.5, 6.6 ve 6.7: Normal toraks BT görüntüleri ve önemli oluşumlar (Mediasten
penceresi)
Akciğer Kanserinde Radyolojik Bulgular
Akciğer kanserlerinde tanı, evreleme, takip ve tedaviye cevabın değerlendirilmesi
aşamalarında radyolojik görüntüleme yöntemleri kritik role sahiptir. Akciğer
tümörlerinin değerlendirilmesinde kullanılan başlıca görüntüleme yöntemleri; akciğer
radyogramları, BT ve bazı özel endikasyonlarda başvurulan manyetik rezonans
görüntüleme
(MRG)
teknikleridir.
Tanı
ve
takipte
kullanılacak
görüntüleme
algoritmasının belirlenmesi aşamasında klinisyen ve radyoloğun işbirliği büyük
öneme sahiptir.
Akciğer kanserlerinin ilk tanısı çoğunlukla radyogramlar aracılığıyla olduğundan
(Resim 6.8), herhangi bir şikayeti olmasa da akciğer kanseri açısından risk
grubundaki hastalarda son bir yıl içerisinde akciğere yönelik herhangi bir inceleme
yapılmamış ise, postero-anterior (PA) akciğer grafisi çekilmesi önerilmektedir (1).
Resim 6.8: PA akciğer grafisinde sağ akciğer üst zonda kitlesel lezyon görülüyor.
57
Akciğer kanserlerinin değerlendirilmesinde ilk aşamada başvurulacak görüntüleme
yöntemi akciğer grafileridir. Akciğer grafileri tercihan postero-anterior ve lateral olmak
üzere iki pozisyonda istenmelidir. PA grafide diafragma ve kalbin süperpozisyonu
nedeni ile gözden kaçabilecek bazı lezyonlar lateral grafi sayesinde tesbit
edebilmektedir. BT ise, grafilerden sonraki aşamada başvurulacak, hem primer tanı
hem de evrelemede kullanılan altın standart radyolojik yöntemdir. MRG ise bazı özel
endikasyonlarda problem çözücü modalite olarak kullanılmaktadır (1,2).
Akciğer kanserleri lokalizasyonlarına göre radyolojik açıdan iki ana grupta
değerlendirilmektedir.
1) Santral yerleşimli (hiler) kitleler
2) Periferik akciğer kanserleri
Histolojik tip gözönünde bulundurulduğunda, küçük hücreli kanser ve skuamöz
hücreli kanserler sıklıkla santral kitle şeklinde, adenokanser ve büyük hücreli
kanserler ise genellikle periferik lokalizasyondadır (1,2).
Santral (hiler) kitleler
Santral yerleşimli akciğer kanserleri bronş içerisinde veya perihiler lokalizasyonda
olabilirler. Akciğer grafisinde ilk bulgu hiler dolgunluk (Resim 6.9) olabildiği gibi,
bronşta sebep olduğu hava yolu obstrüksiyonu nedeni ile yol açtığı sekonder
bulgularla da (atelektazi,pnömonik konsolidasyon, çek-valv mekanizmasına bağlı
hava hapsi vs.) tanı alabilirler. Akciğer grafilerinde hilustaki kitlenin oluşturduğu
konveks görünüm ve kitlenin sebep olduğu atelektazi veya obstrüktif pnömoni
“Golden’ın S belirtisi” adı verilen tipik görünüme yol açar (2).
Resim 6.9: PA akciğer grasinde sol hiler dolgunluk-kitle saptanmış olan santral yerleşimli
akciğer kanseri olgusu
58
TNM evreleme sisteminde T; primer kitlenin boyutu ve yayılımı N; bölgesel lenf nodu
tutulumu M; uzak metastaz ile ilişkilidir. BT ile kitlelerin lokalizasyonu, iç yapı
özellikleri, ana vasküler yapılar, mediasten ile olan ilişkileri genellikle ayrıntılı bir
şekilde gösterilebilmektedir. BT yöntemi bir çok olguda evrelemede ve operabilitenin
kararında belirleyici rol oynamaktadır. BT’de intravenöz yoldan kontrast madde
uygulanması sayesinde vasküler yapılar kontrast ile dolar ve böylece daha düşük
dansite değerinde olan tümoral yumuşak doku kitlesi ve eşlik edebilecek mediastinal
ve hiler lenfadenopatiler rahatlıkla ayırdedilebilir hale gelir (Resim 6.10) Tümoral kitle
ile mediasten arasında 3cm’den daha fazla temas olması, aradaki yağlı planların
silinmesi, mediastinal plevral veya perikardda kalınlaşma, aorta veya perikardium ile
90 derecenin üzerinde temas gibi kriterler tümörün mediastene invaze olduğu
şüphesini uyandıran göstergeleridir (T4) ve inoperabilite açısından hassasiyetle
değerlendirilmeleri gerekir. Perikard invazyonun değerlendirilmesinde BT ile karar
verilemeyen olgularda MRG istenebilir (2,3).
Resim 6.10: Sol hiler bölgede sol pulmoner artere invaze görünümde, pulmoner arterin
lümeninde
intravenöz
kontrast
madde
bulunması
sayesinde
konturları
damardan
ayrıtedilebilen santral tipte akciğer kanseri
Santral kitlelerde BT değerlendirilmesi esnasında primer kitlenin özeliklerine ek
olarak kitlenin bronşlarda oluşturduğu tıkanıklık nedeniyle ortaya çıkabilecek
sekonder bulgular da (Resim 6.11) (atelektazi, pnömonik konsolidasyon-infiltrasyon,
hava hapsi vs.) belirlenir. Örneğin, skuamöz hücreli kanserler kavitasyon gösterme
eğilimindedirler ve ayırıcı tanıda abse ile karışabilirler (Resim 6.12).
BT ile lenf nodlarının değerlendirilmesi boyut kriterine dayanmaktadır. Çapı 1cm’nin
üzerinde olan lenf nodları patolojik olarak kabul edilmektedir (Resim 6.13) (2,3).
59
Resim 6.11: Toraks BT parankim penceresinde sol akciğer alt lob süperiordaki kitleye
sekonder oluşmuş olan post-obstrüktif konsolidasyon ve infiltrasyon izleniyor.
Resim 6.12: Toraks BT’de sağ akciğer alt lobda kaviter lezyon ve ön duvarında nodüler
oluşumlar izleniyor (skuamöz tipte akciğer karsinomu)
Resim 6.13: Sağ akciğer alt lobda
posteriorda göğüs duvarı kosta ve
vertebral kemiğe invazyon gösteren kitle
ve sağ alt paratrakeal mesafede kitleye
bağlı lenfadenomegali izleniyor
60
Periferik akciğer kanserleri
Periferik akciğer kanserleri tüm akciğer kanserleri içerisinde yaklaşık olarak % 42
oranında görülmektedir. Periferik yerleşimli akciğer kanserleri parankimal nodül, kitle
veya infiltrasyon şeklinde karşımıza çıkabilirler. Periferik yerleşimli akciğer kanserleri
çoğunlukla yerleşim itibarı ile bronşa bası oluşturmadıklarından semptom vermezler,
bu durum geç tanı almalarına yol açar ve tanı aldıklarında büyük boyutlara ulaşmış
olabilirler (1).
Radyolojik olarak 3 cm’nin altındaki parankimal lezyonlar için nodül, 3 cm’nin
üzerindekiler için ise kitle terimi kullanılmaktadır. Akciğer grafisinde bir nodül
saptandığında boyutu ve kontur özellikleri değerlendirilmeli, mevcut ise önceki
akciğer grafileri ile karşılaştırılıp bu nodülün yeni mi gelişmiş yoksa eskiden var olan
ve değişiklik göstermeyen bir lezyon mu olduğu ortaya konulmaldır. Nodüllerin
boyutu, iç yapısı çevre parankim ile olan ilişkisi BT ile ayrıntılı olarak
değerlendirilebilmektedir (Resim 6.14). Akciğer kanserlerinin yaklaşık % 30’unda ilk
bulgunun parankimal nodül olması nedeniyle, nodüllere radyolojik yaklaşım
algoritması titizlikle yürütülmelidir.
Resim 6.14: Sağ akciğer alt lobda 3.5 cm çapında parenkimal nodül izleniyor.
Parankimal nodüllerin etraf parankime doğru spiküler uzanımlar göstermesi malignite
bulgusudur ve en doğru bir şekilde BT ile değerlendirilir. Adenokarsinomlar ve
adenokarsinomların bir alt tipi olarak kabul edilen bronşioloalveoler karsinomlar
radyolojik olarak içerisinde hava bronkogramı içeren konsolidasyon veya parankimal
infiltrasyon şeklinde görülebilirler. Ayırıcı tanıda pnömoniye bağlı konsolidasyonlar
61
bulunmaktadır.
Takip
grafilerinde
antibiyotik
tedavisine
cevap
olmamaması
bronşioloalveoler karsinomu akla getirmelidir. Ayrıca tanı ve evreleme esnasında
akciğer adenokarsinomlarının yaklaşık % 22 oranında multipl odaklı olabildiği de göz
önünde bulundurulmalıdır (1,3).
Superior sulkus (pancoast) tümörleri
Klinik prezentasyon, lokalizasyon ve prognoz açısından diğer akciğer kanserlerinden
farklı olmaları nedeniyle, çoğunlukla ayrı bir grupta değerlendirilmektedirler.Akciğerin
en üst kesiminde (kupula, apeks) yerleşirler. Göğüs duvarı, komşu yumuşak dokular
ve sinir pleksusuna invaze olma eğilimindedirler. Akciğer grafisinde bilateral apikal
zonlar dikkatlice ve karşılaştımalı olarak değerlendirilmeli, tek taraflı apikal plevral
kalınlaşma izlenmesi durumunda ileri tetkik yapılması gündeme gelmelidir. Superior
sulkus
tümörlerinin
kosta,
göğüs
duvarı
ve
brakial
plekus
invazyonunun
değerlendirilmesinde BT ile emin olunamayan olgularda MRG tercih edilebilmektedir
(1,2).
Göğüs Cerrahisinde Karşilaşilan Muhtelif Patoloji Görselleri
Resim 15 a-b. Düz akciğer grafileri değerlendirilirken özellikle elde toraks BT’si olmadığı ya
da elde edilmesi mümkün olmayan durumlarda akciğer grafisinden maksimum bilgiye
ulaşılmaya çalışılmalıdır. Siluet bulgusu da bu noktada akciğer grafisinde görülen patolojinin
diğer çevre anatomik yapılardan ayırılması konusunda önemli bir ipucudur. Süperpoze olan
yapıların birbiri ile kesişen sınırlarını örtüp örtmemesi, hangisinin önde hangisinin arkada
olduğunun anlaşılmasında yardımcı olur. Şekildeki PA akciğer grafisinde kalbin sol lateral
sınırının sol akciğer alt zondaki kitlenin önünde takip edilebilir olması (siyah oklar) bu kitlenin
62
kalbin
arkasında
yani
posterior
mediastende olduğuna işaret etmektedir.
Nitekim lateral grafiye bakıldığında da
kitlenin sol alt lobda kalbin arkasında
yerleştiği görülmektedir.
Resim 6.16: Plevral efüzyonlar oluşma nedenlerindeki çeşitliliğin yanında yol açtıkları nefes
darlığı, mediastinal itilme gibi bulgularda benzerlik gösterirler. Göğüs cerrahisinde
parapnömonik efüzyonlar, ampiyem, ve malign plevral efüzyonlar en sık rastlanılan tipleridir.
Tedavileri sebeplerine göre farklılık gösterir.
Resim 6.17: Akciğer absesi. Sağ akciğer orta zonda hava sıvı seviyesi gösteren abse dolu
dev kavite dikkat çekiyor.
63
Resim 6.18: Akciğer tüberkülozu çok farklı şekillerde kendisini gösterebilir. Birçok farklı
patolojiyi taklid etmesi ile bilinir. Bu nedenle özellikle ilk tanı ve tedaviye cevap alınamayan
olgularda tüberkülozun da akla getirilmesi gerekmektedir. Klasik olarak akciğer tüberkülozu
her iki akciğerin üst lob apikal bölgelerinde yerleşir. Özellikle de kavitasyon gösteren üst lob
lezyonlarında tüberküloz ön planda düşünülmelidir. Bu filmde de sağ akciğerin apikal
bölgesinde kaviter tüberküloz lezyonu dikkati çekmektedir.
Resim 6.19: Sarkoidoz ağırlıklı olarak mediastinal ve hiler yaygın lenfadenopati ile kendini
gösteren, daha ileri evrelerinde pulmoner parenkimde de tutulum gösteren etiyoloji ve
64
patogenezi tam olarak bilinmeyen, non-kazeifiye granülomlarla karakterize inflamatuar bir
hastalıktır. Nadir de olsa toraks dışında da birçok organda benzer tutulumlara neden olabilir.
Tedavisi medikal olmakla birlikte bronkoskopi, transbronşiyal biyopsi gibi yöntemlerle tanısı
konulamayan hastalarda göğüs cerrahisi uzmanları doku örneği sağlamak suretiyle yardımcı
olabilmektedir. Bu film bilateral hiler lenfadenopati ve yaygın parenkimal retikülonodüler
tutulum gösteren bir sarkoidoz olgusuna aittir.
Resim 6.20: Pnömotoraks göğüs cerrahisinde en sık karşılaşılan patolojilerden birisidir.
Özellikle primer sağlık hizmeti veren hekimlerin bu patolojiyi tanıyıp hastayı uygun
merkezlere yönlendirmesi önem taşımaktadır. Genellikle viseral plevrada bir bül ya da blebin
açılması sonucunda ortaya çıkan primer spontan pnömotoraksın yanında, travmaya bağlı
gelişen pnömotoraksların hızlı teşhis ve tedavisi de hayat kurtarıcı olabilmektedir. Şekilde
sağ akciğerde pnömotoraks sonrası akciğerin sınırı küçük oklarla belirtilmiştir. Büyük ok ise
pnömotoraksın
tedavisi
için
takılmış
olan
65
plevral
kateteri
göstermektedir.
Resim 6.21: Trakea ve ana bronşlarda ortaya çıkan gerek malign gerekse iyi huylu
patolojilere bağlı darlıkların teşhisi çoğunlukla geç yapılmakta ve bu arada hastalar yanlışlıkla
astım ya da KOAH tedavisi alabilmektedir. Özellikle entübasyon tüpleri ve trakeostomi
kanüllerinin yol açtığı lokal travmaya bağlı gelişen postentübasyon darlıkları doğru teşhis
edilip uygun şekilde tedavi edildiklerinde hastaların yaşam kalitelerinde ciddi iyileşme
sağlanmaktadır. Bu filmde 1 günlük entübasyon sonrası gelişmiş olan postentübasyon
stenozu görülmektedir (okla işaretli seviye).
Resim 6.22: Amfizemli hastalarda akciğer filminde kalıcı değişiklikler ortaya çıkar. Bunlar
arasında anteroposterior çapın artması, diyaframın düzleşmesi, daha horizontal pozisyona
gelmelerine bağlı olarak kostalar arasındaki açıklıklarda genişleme
ve akciğerin
yoğunluğunun azalarak vasküler işaretlerin azalmasının yanında bu filmde de görüldüğü gibi
bögesel ya da yaygın büller sayılabilir.
Resim 23 a-b: Abdomen basıncının pozitif, toraks basıncının ise negatif olmasına bağlı
olarak ortaya çıkan basınç farkı, zaman zaman abdominal organların toraks içine
66
fıtıklaşmasına neden olabilmektedir. Bu, özefagusun diyaframı geçtiği hiyatus bölgesindeki
zayıflama ya da diyaframdaki konjenital defektlerden olabileceği gibi, travma sonrası oluşan
diyafram yırtıklarından da gerçekleşebilmektedir. Şekildeki PA grafide kalp gölgesi ile
süperpoze olan posteriordan toraksa herniye olmuş mide gölgesi görülmektedir. Bu fıtık tipik
bir hiyatal hernidir. Yine lateral grafide aynı herninin posterior yerleşimi görülmektedir.
Resim 6.24: Daha önce bahsedilen normal mediastenin BT kesitleri ile karşılaştırıldığında,
bu filmde anterior mediasteni işgal eden ve majör vasküler yapılar ile trakeayı çevreleyerek
baskı altında tutan heterojen kitlesel lezyon görülmektedir. Bu görüntü anterior mediasten
kitleleri arasında sıklıkla karşılaşılan lenfomaya aittir. Böyle bir görüntü ile karşılaşıldığında
ön mediastende sık görülen timus, teratom ya da tiroid kitleleri gibi diğer patolojiler de ayırıcı
tanıda düşünülmelidir.
67
Resim 6.25: Primer akciğer tümörlerinin ileri evrelerinde ya da ekstratorasik malignitelerin
intratorasik yayılımlarında sıklıkla metastatik lezyonlar görülebilmektedir. Yukarıdaki filmde
bilateral yaygın melanom metastazları görülmektedir.
Resim
6.26:
İnterstisyel
akciğer hastalıkları etiyoloji ve
patogenezine bakıldığında çok
geniş bir liste oluşturmaktadır.
Diğer taraftan bu hastalıkların
büyük
çoğunluğu
benzer
radyolojik görüntüleri paylaşır.
Bunların başında yer yer kistik
harabiyet ve skar dokusu da
içerebilen,
diffüz
retikülonodüler ya da buzlu cam şeklinde infiltrasyonlar gelmektedir. Resimdeki akciğer BT
kesitinde de her iki tarafta yer yer nodüler ve infiltratif tutulum göze çarpmaktadır.
68
Resim 6.27: Sternum ve kostaların asimetrik gelişim gösterdiği, zaman zaman kemik şekil ve
sayı anormallikleri içerebilen, kifoz ve skolyozun da birlikte görülebildiği, göğüs duvarı şekil
bozuklukları bir diğer toraks patolojisi grubudur. Kunduracı göğsü ya da Pektus Ekskavatum
bunların başta gelenidir. Resimde vertebra kolonuna doğru deprese olmuş sternum ve kosta
kıkırdakları görülmektedir.
Resim 6.28: Bronşektazi akciğer parenkimi içerisindeki hava yollarında geri dönüşümsüz
dilatasyon şeklinde tanımlanabilir. Bronş duvarında kalınlaşma da bronşektaziye eşlik eder.
Silindirik, variköz, ve kistik (sakküler) bronşektaziler tanımlanmıştır. Bronşektazi sık
tekrarlayan enfeksiyonlar, inflamasyon ve destrüksiyona yol açan çeşitli proseslerden sonra
gelişebilir. Şekilde sağ üst lob içerisinde yerleşmiş sakküler bronşektazi görülmektedir.
69
Resim 6.29: Torasik malignitelerde akciğer tümörleri kadar özefagus tümörleri de teşhis ve
tedavi açısından ağırlıklı bir hastalık grubudur. Özellikle ülkemizin doğu bölgelerinde daha
yaygın olarak görülen özefagus tümörleri, batı ülkelerinde daha sık görülen, obezite ve reflü
ile ilişkili Barrett mukozası zemininde gelişen adenokarsinomlardan ziyade daha ağırlıklı
olarak skuamöz hücreli kanserler şeklinde karşımıza çıkmaktadır. Resimde özefagus alt
1/3‘ünde çevresel duvar kalınlaşması şeklinde kendisini gösteren özefagus tümörü
mevcuttur.
KAYNAKLAR
1.Osma E. Solunum Sistemi Radyolojisi. İzmir. Çağdaş Ofset; 2000. 243-277.
2.Balcı P.Akciğer Kanserine Radyolojik Görüntüleme Yöntemleri. Türkiye Klinikleri
Göğüs Hastalıkları Dergisi 2.Cilt 3. Sayı-Akciğer Tümörleri Özel Sayısı
3.Radiologic evaluation in lung cancer: diagnosis and staging. Shaffer K. Chest.
1997;112:235-238.
70
7.
Doç Dr. Akif Turna
İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
GÖĞÜS CERRAHİSİNDE İNVAZİF TANI YÖNTEMLERİ
Genel bir tıbbi kural olarak, akciğerin tüm hastalıklarında mümkün olduğunca invazif
olmayan ve daha az komplikasyona sahip tanı yöntemlerinin kullanılması gereklidir.
Bu nedenle, örneğin balgam incelemesi hem hücresel tanı gerektiren, akciğer kanseri
gibi hastalıklarda, hem mikrobiyolojik tanı gerektiren akciğer tüberkülozu, pnömoni
gibi patolojilerde tercih edilmesi gereken bir yöntemdir. Balgam sitolojisi, bronşlara
invazyonu olan akciğer kanseri olduğu şüphelenilen hastalarda ilk istenmesi gereken
tanı yöntemidir. Ancak, ilerleyen invazif tanı teknikleri ve gelişen cerrahi metodoloji,
hastalarda, invazif tanı yöntemlerini daha ön plana getirmektedir. Bu bölümde, göğüs
cerrahisini ilgilendiren hastalarda yapılan invazif tanı yöntemlerinden bahsedilecektir.
Skalen Lenf Nodu Biopsisi
Skalen bölge, her iki tarafta da juguler ven, sternokleidomadtoid kas ve posteriorda
da anterior skalen kas arasında kalan bölgedir ve bu bölge, yağ dokusu içinde
gömülü bir çok lenf nodu içerir. Sağlılı bireylerde, bu lenf nodları palpa edilemez ve
hepsi 0.5 cm’nin altındadır. Supraklavikuler ve skalen lenf nodları, akciğer kanserli
hastalarda, tüberküloz, lenfoma, sarkoidoz gibi hastalalıklarda tutulabilir ve
büyüyerek palpe edilebilir hale gelirler. Akciğer kanserli hastalarda ipsilateral ya da
kontralateral supraklaviküler lenf nodu tutulumu N3 olarak sınıflandırılır ve
inoperabiliteyi işaret eder. Eğer, skalen lenf nodları sağda ya da solda palpe
ediliyorsa, ya da multipl mediastinal lenf nodu olup ta skalen lenf nodlarının palpe
edilmediği durumlarda sağ skalen lenf nodları çıkarılabilir.
Kesi ve metod:
Sternokleidomastoid kas üzerinden 3-4 cm uzunluğunda ve klavikulaya paralel bir
insizyon ile başlanır. Kasın klavikula ve sternal kenarı çekilerek ekarte edilir. Bu
bölgede, anterior skalen kas üzerinde kalan tüm gangliyonlar, yağlı doku ile birlikte
çıkarılır (Şekil 7.1).
71
Şekil7.1: Bu bölgeyi ve yağlı dokuyu invaze eden bir kitle ya da lenf nodu var ise, insizyonel
biopsi ile yetinilmek zorunda kalınabilinir.
Endobronşial Ultrasonografi (EBUS):
Bronkoskopi, trakea, ana bronşlar ve segment bronşlarını görüntülemek için gerekli
olan vazgeçilmez bir endoskopik işlemdir. Bronkoskopinin ucunda bir ‘radyal’
ultrasonografi probu taşıyan bronkoskopla yapılması ise ‘endobronşial ultrasonografi’
olarak adlandırılmaktadır.
Şekil 7.2: Gerçek Zamanlı Endobronşial Ultrasonografi Probu .
Bu prob, trakea ve bronş kenarındaki damarları ve lenf nodlarını ayırarak, tam olarak
istenen lenf nodundan ya da paratrakeal veya parabronşial lezyonlardan (tümör, kist
vb)
72
transbronşial olarak biopsi alınabilmesini (TBİA) sağlamaktadır. İşlem önce lenf
nodunun ultrasonografi ile yerinin saptanması sonra bu bölgeye iğne batırılarak
örnek alınması veya lenf nodu ultrasonografi ile görüntülenirken aynı anda iğne
batırılması (daha özel bir cihazla gerçek zamanlı EBUS) şeklinde uygulanabilir (Şekil
7.2). Bu yolla alınan biopsi şekline EBUS-TBİA denilmektedir. EBUS-TBİA ile yapılan
lenf nodu biopsilerinde doğruluk oranı %80 ila %95 arasında değişebilmektedir. Eğer
lenf nodlarında yaygın metastaz yoksa yanlış negatiflik oranları %40’a kadar
çıkabilmektedir (1,2).
Servikal mediastinoskopi
Mediastinoskopi, en sık olarak da “standart servikal mediastinoskopi” mediastinal lenf
nodları ve anterior –superior mediyastende yerleşimli kitlelerin tanısını ve akciğer
kanserli hastalarda mediastinal lenfatik tutulumu saptamada en sık kullanılan invazif
yöntemdir. İlk olarak Carlens tarafından 1959 yılında tanımlanmıştır (3).
Endikasyonlar
Mediastinoskopinin en sık endikasyonu akciğer kanserinde evrelemedir. Diğer
mediastinal hastalıkların tanısı için daha az kullanılmaktadır. Akciğer kanserinde
kullanımının sık olmasının en önemli nedeni, akciğer kanserinde mediastinal lenf
noduna ipsilateral (N2) ya da kontralateral (N3)
metastaz varlığında hastalarda
sağkalımın çok düşük olması ve bu lenf nodlarındaki muhtemel metastazı saptamak
için kullanılan diğer metotların (iğne aspirasyonu vb) yukarıda da belirtildiği gibi tanı
değerinin düşük olmasıdır. Mediastinoskopi, nadiren görülen paratrakeal kist veya
lenfanjioma
gibi
lezyonların
mediastinoskopi).
genişletilmiş
tedavisinde
Mediastinoskopinin,
mediastinoskopi
de
standart
(İng;
kullanılabilir
servikal
‘extended’
(tedavi
edici
mediastinoskopi,
mediastinoskopi),
videomediastinoskopi ve video yardımlı mediastinoskopik lenfadenektomi (VAMLA)
gibi çeşitleri bulunur.
a.Standart servikal mediastinoskopi
Jugular çentiğin 1-2 cm kadar üzerinden, trakeaya dik, yaklaşık 3 cm’ lik bir insizyon
yapılır. Pretrakeal fasyaya ulaşılır.
Pretrakeal fasya künt parmak diseksiyonu ile
73
açılır;
bu
esnada
paratrakeal
lenf
nodları
hissedilebilir.
Açılan
boşluğa
mediastinoskop yerleştirilir. Lenf bezleri örneklenir (Şekil 7.3).
Şekil 7.3: Mediastinoskopi ile sağ ve sol üst paratrakeal gangliyonlar (1, 2R ve 2L), sağ ve
sol alt paratrakealler (3, 4R ve 4L) ve subkarinal (No:7) gangliyonlardan ve 2010 yılından
itibaren geçerli olan evrelemeye göre
10 no’lu (hiler) gangliyondan biyopsi almak
mümkündür.
Akciğer
kanserinde
mediastinoskopinin
yapılma
endikasyonları,
toraks
tomografisinde saptanan lenf nodlarının çaplarına göre belirlenmektedir. Zaman
içinde patolojik kabul edilen lenf nodunun eşik çapı azalarak 1 cm.’e inmiştir. Toraks
tomografisinde 1 cm’nin altında saptanan lenf nodlarının pozitif negatif çıkma oranı
%10 olarak bildirildiği gibi (4), %25 civarında da rapor edilmiştir (5). Tomografisinde
1 cm’den büyük lenf gangliyonları olan veya hiler tümörü bulunan olgularda ya da N1
tutulumu bulunan hastalarda mediastinal lenf nodlarında PET/BT’de lenf nodu
aktivitesi saptanmasa bile mediastinoskopi yapılması önerilmektedir (6,7).
b. Genişletilmiş (‘Extended’) Mediastinoskopi:
74
Sol hemitoraksta lokalize olan anterior mediastinal (No:6) ve aortikopulmoner
pencere (No:5) lenf nodlarına anterior mediastinotomi ile ulaşılabileceği gibi, standart
servikal mediastinoskopi insizyonu yolu ile substernal ya da perivasküler yolla da
ulaşılabilir. Bu yönteme,
genişletilmiş (‘ing; extended’) mediastinoskopi adı
verilmektedir. Prevasküler ya da substernal olmak üzere iki ayrı yoldan yapılabilir
(8,9). Ayrıca işlem anterior mediastinotomiye göre daha az invaziftir daha kısa süre
de yapılır ve sadece servikal insizyonun uzatılması ile yapılabildiğinden kozmetik
olarak
daha
uygundur.
Genişletilmiş
mediastinoskopi
ile
anterior-superior
mediastinde bulunan timoma, lenfoma, teratoma gibi tümörlere ulaşılarak tanı için
biopsi alınabilir(10) (Şekil 7.4).
Şekil 7.4: Genişletilmiş (‘Extended’) Mediastinoskopi
c. Videomediastinoskopi
Mediastinoskopinin, mediastioskopun ucuna yerleştirilmiş bir video kamera ile
yapılması işlemidir. Ameliyat sırasında sağlanan görüntü ayrıntısı çok daha yüksektir
ve bu avantaj, komplikasyon oranının düşürülmesini sağlar. Ayrıca, tanı değeri daha
yüksek bir örnekleme sağlar.
d. Video Yardımlı Mediastinoskopik Lenfadenektomi (VAMLA)
Mediastinoskopi
ile
örneklenen
lenf
nodlarının
tama
yakın
diseksiyonudur.
Videomediastinoskop yardımı ile yapılabilir. Yanlış negatiflik olasılığını en aza
75
indirerek tanı doğruluğunu %98 civarına çıkarmayı amaçlar. Çok az merkezde
yapılmaktadır.
Mediastinoskopi sırasında komplikasyon gelişme olasılığı; %1–2 civarındadır ve
%0,1’den daha düşük bir mortalite ile yapılabilmektedir. En sık rastlanan
komplikasyon ses kısıklığı olup, pnömotoraks, orta derecede hemoraji gibi
komplikasyonlar görülebilmektedir. İnsizyon yeri enfeksiyonu, özofagus perforasyonu,
mediastinit, şilotoraks ve majör müdahale gerektiren kanama gibi komplikasyonlarla
ise çok nadir olarak karşılaşılmaktadır.
Anterior mediastinotomi
Parasternal mediastinotomi ya da ‘Chamberlain işlemi’ olarak adlandırılmaktadır (11).
Endikasyonları:
Radyolojik
olarak
aortopulmoner
pencere
(No:5)
veya
preaortik/anterior mediastinal bölgede(No:6) 1cm’den büyük lenf nodu bulunması,
bazı durumlarda, hilusa yerleşmiş, aort invazyonu ya da ana pulmoner arter
invazyonuu şüphesi olan
tümörlerde (T4 durumu) rezektabilitenin (ameliyatla
çıkarılabilirlik) değerlendirilmesi ve anterior mediastinal kitlelerde, iğne biyopsilerinin
yetersiz kaldığı durumlarda, tanı koyma amacıyla uygulanmasıdır.
Sol taraftan yapılır ve 2. interkostal aralığın üzerinden yapılan 4 cm’lik bir insizyon
ile, 2. interkostal aralıktan mediastine girilerek ya da 2. kaburganın kostosternal
eklemi oluşturan kıkırdağın çıkarılması ile oluşan açıklıktan ekstraplevral olarak,
parmak diseksiyonu ile plevra açılmadan ön mediastinuma ulaşılır. Ekartör yardımıyla
yada
oluşturulan açıklığa mediastinoskop’un ilerletilmesi ile 5 ve 6 numaralı
gangliyonlardan, ya da buraya lokalize tümörden doku örneklemesi yapılabilir.
Girişimin komplikasyon, morbidite ve mortalitesi çok düşüktür.
Ancak, benzer
örneklemenin yapılabildiği ‘genişletilmiş’ mediastinoskopiye göre, ek bir insizyon
gerektiğinden kozmetik olarak dezavantajlıdır.
Videotorakoskopi
76
Mediastinoskopi, mediastinotomi ya da ‘genişletilmiş’ mediastinoskopi ile tanı
konulamayan
mediastinal
kitlelerde
ya
da
toraks
kavitesindeki
lezyonlara
videotorakoskopi ile ulaşılıp, biopsi alınabilir.
KAYNAKLAR
1. Yasufuku K, Nakajima T, Chiyo M, Sekine Y, Shibuya K, Fujisawa T.
Endobronchial ultrasonography: current status and future directions. J Thorac
Oncol. 2007;2:970-979.
2. Sökücü SN, Cetinkaya E, Altin S, Karasulu L, Seyhan EC, Turna A.Value of
endobronchial ultrasound in staging non-small cell lung cancer.Tuberk Toraks.
2009;57(4):407-12.
3. Carlens E. Mediastinoscopy: a method for inspection and tissue biopsy in the
superior mediastinum. Dis. Chest 1959:36:343.
4. Daly BDT. ve ark. Mediastinal lymph node evaluation by computed tomography in
lung cancer. An analysis of 345 patients grouped by TNM<staging, tumor size, and
tumor location. J Thorac Cardiovasc Surg 1987;94:667
5. Webb WR, Gatsonis C, Zerhouni EA, et al. CT and MR imaging in staging nonsmall cell bronchogenic carcinoma: Report of the Radiologic Diagnostic Oncology
Group. Radiology 1991;178:705-713.
6. Gürses A, Turna A, Bedirhan MA, Özalp T, Kocatürk C, Demir A, Özcan M, Ürer N.
The Value of Medistinoscopy in Preoperative Evaluation of Mediastinal
Involvement in non-small cell lung cancer patients with clinical N0 disease. Thorac
Cardiovasc Surg. 2002;50(3):174-177.
7. De Leyn P, Lardinois D, Van Schil PE, Rami-Porta R, Passlick B, Zielinski M,
Waller DA, Lerut T, Weder W. ESTS guidelines for preoperative lymph node
staging for non-small cell lung cancer. Eur J Cardiothorac Surg 2007;32: 1—8.
8. Ginsberg RJ, Rice TW, Goldberg M, Walters PF, Schomocker BJ. Extended
cervical mediastinoscopy. A single procedure for bronchogenic carcinoma of the
left upper lobe. J Thorac Cardiovasc Surg 1987;94:673–8.
9. Lopez L, Varela A, Freixinet J, et al. Extended cervical mediastinoscopy:
prospective study of fifty cases. Ann Thorac Surg 1994;57:555–8.
10.
Metin M, Sayar A, Turna A, Gürses A. Extended cervical mediastinoscopy in
the diagnosis of anterior mediastinal masses. Ann Thorac Surg. 2002
Jan;73(1):250-2.
77
11.
McNeill TM., Chamberlain JM.: Diagnostic Anterior Mediastinotomy. Ann
Thoracic Surg 1966,2:532.
78
8.
Doç. Dr. Alpaslan Çakan
Ege Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
GÖĞÜS CERRAHİSİNDE PREOPERATİF DEĞERLENDİRMENİN TEMEL
PRENSİPLERİ
Erken evre küçük hücreli dışı akciğer karsinomlu olguların tedavisinde en uzun
sağkalımı sağlayan yöntem akciğer rezeksiyonudur. İleri yaş ve tütün kullanımının
etkisi ile kronik obstrüktif akciğer hastalığı (KOAH) ve iskemik kalp hastalığı gibi ek
patolojiler akciğer karsinomuna eşlik edebilmektedir (1). Akciğer rezeksiyonu yapılan
olgularda, ameliyat sonrası gelişen komplikasyonlar günümüzde hala önemli bir
sorundur. Bu nedenle akciğer rezeksiyonu uygulanacak hastalarda, preoperatif
dönemde kardiyopulmoner ve fonksiyonel kapasitenin doğru değerlendirilmesi büyük
önem taşımaktadır (2).
Geniş akciğer rezeksiyonlarında işleme bağlı komplikasyonlar (morbidite) %14’e;
gelişen kardiyopulmoner sorunlara bağlı hastanın yaşamını yitirmesi (mortalite) oranı
ise %50’ye ulaşabilmektedir (3,4). Göğüs duvarındaki yardımcı solunum kaslarına
uygulanan kesiler, pnömonektomiye varabilen akciğer rezeksiyonları, solunum
dinamiğinde ve akciğer volümlerinde azalma yaratmaktadır. Bunların sonucunda
akciğerin ventilasyon/perfüzyon dengesi etkilenmekte, hipoksi ve hiperkapni ortaya
çıkmaktadır (3).
Akciğer cerrahisi sonrasında izlenebilen komplikasyonlar; atelektazi, pnömoni,
akciğer embolisi, solunum yetersizliği, kardiyak ritm bozuklukları, kalp yetmezliği,
akciğer ödemi, ARDS ve miyokard enfarktüsüdür (4-9). Preoperatif değerlendirmenin
amacı, operatif - postoperatif dönemde ortaya çıkabilecek ve hastanın yaşamını
tehdit edebilecek komplikasyonların gelişebilme olasılığını önceden belirleyebilmektir
(3). Bu sorunların preoperatif dönemde belirlenmesi ve gerekli önlemlerin alınması ile
morbidite ve mortalite oranlarını azaltmak mümkündür (10).
Akciğer rezeksiyonu uygulanmayan, sadece torakotomi yapılmış olgularda bile,
interkostal kasların kesilmesi ve gelişen ağrı nedeniyle, postoperatif ilk günde vital
kapasite %25 oranında azalmakta, ancak 2-4 haftada normal düzeyine dönmektedir.
Ek
olarak
akciğer
rezeksiyonu
uygulandığında,
“wedge”
rezeksiyon
ve
segmentektomi ile %10, lobektomi ile %20, pnömonektomi ile %50 düzeyinde vital
79
kapasite azalmaları ortaya çıkmaktadır (4). Uygulanacak akciğer rezeksiyonunun
genişliği ile postoperatif morbidite ve mortalite arasında doğru orantı bulunmaktadır
(8). Operasyon öncesinde hastanın potansiyel pnömonektomi adayı olduğunun göz
önünde bulundurulması gerektiği, eğer olgunun solunum fonksiyonları pnömonektomi
için uygunsa, daha küçük rezeksiyonlar için de uygun olacağı belirtilmektedir (7).
Preoperatif kardiopulmoner rezervinin değerlendirilmesinde birçok fizyolojik test
bulunmasına karşın, postoperatif komplikasyon gelişimini belirlemek için “altın
standart” denebilecek tek bir yöntem bulunmamaktadır (8). Ameliyat öncesi
değerlendirme; anamnez, fizik muayene, rutin biyokimyasal analizler, radyolojik
incelemeler, solunum fonksiyon testleri, arter kan gazı incelemesi, kardiyopulmoner
egzersiz testi ve gerekirse pulmoner arter oklüzyon basıncı ölçümleri ile kombine
olarak yapılmalıdır (1,3,4,7,9,10).
Anamnez
Yaş
Güncel araştırmalarda ileri yaşın tek başına bir risk faktörü olmadığı belirtilmektedir
(11). Genel anestezi ve postoperatif yoğun bakım yöntemlerindeki gelişmelerle
birlikte,
günümüzde
yaşlı
hastalarda
akciğer
rezeksiyonları
başarıyla
yapılabilmektedir. Ancak artan yaşla birlikte postoperatif morbidite ve mortalitenin
artacağı akılda tutulmalıdır. Genellikle kabul edilen yaşlılık sınırı 70 yaş ise de, asıl
olan hastanın takvim yaşı değil, genel durumu ve performansını ortaya koyan
fizyolojik yaşıdır. Yaşlı olgularda ateroskleroz, azalmış fonksiyonel alveol sayısı ile
renal ve hepatik fonksiyonlardaki kayıplar artmış komplikasyonların nedenidir (4).
Tütün kullanımı
Tütün kullananların trakeobronşiyal sistemindeki silier hücrelerin işlevleri bozulmuş
ve salgı bezi fonksiyonları artmış olduğundan fazla sekresyon bulunmaktadır.
Hastalar postoperatif dönemde, solunum yollarında biriken sekresyonları çıkarmakta
güçlük çekmektedirler. Bunların üstüne eklenen torakotomi ağrısı ve yeterince
öksürememe ile, havayollarında biriken sekresyonlar atelektazi ve pnömoniye neden
olabilmektedir. Akciğer komplikasyonlarından sakınmak için ideal olan, elektif
operasyonlardan 6-8 hafta önce tütün kullanımının sonlandırılmasıdır. Ancak hasta
poliklinikte görülür görülmez tütün kullanımı sonlandırılır ve 10-15 gün süreyle bu
alışkanlığı engellenirse, bu kadarlık bir sürede bile solunum yolu sekresyonlarının
azaldığı, güvenli bir operasyon olasılığının bulunduğu bildirilmektedir (4,5,11). Tütün
80
kullananlarda akciğer komplikasyonu riski, kullanmayanlara göre 1.4-4.3 kat daha
fazladır (3).
Dispne
Yürürken ya da merdiven çıkarken nefes darlığı yakınması olan hastalar preoperatif
dönemde dikkatle incelenmelidir. Uygulanacak akciğer rezeksiyonu ile, hem
pulmoner kapiller yatak hem de ventile olan akciğer alanı azalacağından,
KOAH’lılarda postoperatif pulmoner hipertansiyon ve solunum yetmezliği ortaya
çıkabilmektedir (4).
Balgam ekspektorasyonu
Aşırı bronşial sekresyon varlığı postoperatif akciğer problemi gelişebileceğinin
habercisidir. Eğer ekspektore edilen balgam pürülan ise kültür antibiyogram yapılıp
uygun antibiyotikler verilmelidir (4,5).
Kardiyovasküler sorgulama
Hipertansiyon, angina pektoris, geçirilmiş myokard infarktüsü, kalp kapak hastalığı,
ritm bozukluğu bulunanlarda postoperatif morbidite ve mortalite daha yüksektir (4,5).
Bu olguların preoperatif dönemde ekokardiyografisi ve gerekirse koroner anjiografisi
yapılmalıdır.
Fizik Muayene
Solunum sistemi muayenesi
“Wheezing”
ve
uzamış
ekspiryum
bulunan
KOAH’lı
olgular
postoperatif
komplikasyona adaydırlar(2,6,8,11). Etkin solunumsal fizyoterapi, bronkodilatatör ve
mukolitik tedavi sonrasında cerrahi girişim planlanmalıdır (4,12).
Kilo Kaybı
Özellikle akciğer karsinomlu olgularda, prognozu belirleyen ve morbiditeyi etkileyen
önemli bir göstergedir. Son altı ayda, vücut ağırlığının %10’undan fazla kilo kaybı
gösterenler ve serum albumin düzeyi 2.5 mg/dL’nin altında bulunanlarda postoperatif
komplikasyon daha sık izlenmektedir. Bu hastalarda preoperatif nutrisyonel destek
sağlanmalıdır (4).
Obezite:
Solunum mekaniğini etkileyen ve diyafragma hareketlerinin azalmasına sebep olan
şişmanlık, postoperatif dönemde hipoventilasyon, hipoksi ve hiperkapni olasılığını
arttırmaktadır. Elektif operasyonlarda kilo verilene kadar beklenmesinin uygun
olacağı belirtilse de, “basit” obezitenin solunum fonksiyonlarına çok etkisinin
81
olmadığı, asıl sorunun “morbid” obez hastalarda ortaya çıktığı belirtilmektedir
(3,4,11).
Rutin Biyokimyasal Analizler
Kan biyokimyasal incelemelerinden, LDH, SGOT, SGPT, alkalen fosfataz yüksekliği
ile; serum albumin ve hematokrit düşüklüğü postoperatif dönemdeki olumsuzluklara
işaret edebilecek göstergelerdir. Kardiyak fonksiyonları çok yakından ilgilendiren kan
iyon düzeyleri de perioperatif dönemde dikkatle takip edilmelidir (4).
Radyolojik İncelemeler
Operasyon adayı hastalarda, akciğer grafisi ve bilgisayarlı göğüs tomografisi ile,
primer akciğer hastalığının radyolojik bulgularının yanı sıra, KOAH’a veya interstisyel
fibrozise ait bulgular saptanabilmektedir. Preoperatif dönemde bu patolojilere yönelik
tedavi
ve
önlemlerle,
perioperatif
dönemin
daha
sorunsuz
geçmesi
sağlanabilmektedir. Postoperatif komplikasyon oranının akciğer grafisinde ek patoloji
olanlarda yaklaşık 3 kat arttığı bildirilmektedir (K).
Solunum Fonksiyon Testleri
Postoperatif morbidite ve mortalitenin yanı sıra hastanın yaşam kalitesinin de bir
göstergesi olan solunum fonksiyon testi (SFT), preoperatif dönemde kolayca
uygulanabilen bir yöntemdir. SFT içinde öncelikle değerlendirilecek parametreler;
zorlu vital kapasite (FVC) ve 1.saniyedeki zorlu ekspiratuar hacim (FEV1) dir (2-5,13).
FVC; derin bir inspiryumdan sonra, zorlu bir ekspirasyon ile kişinin çıkarabildiği hava
hacmini göstermektedir. Sağlıklı kişiler güçlü bir ekspiryumla, vital kapasitelerinin
%80’ini bir saniyede (FEV1), tamamını ise üç saniyede çıkarabilirler. KOAH gibi
obstrüktif hastalıklarda FEV1 azalmaktadır. Bunların dışında; maksimum istemli
ventilasyon (MVV), zorlu ekspiratuar hacminin %25’i ile %75’i arasındaki akım hızı
(FEF25-75) ve karbonmonoksit diffüzyon kapasitesi (DLCO) gibi parametrelere de
bakılabilmektedir (3,4,10).
Preoperatif dönemde saptanan FEV1 değeri 2 L’nin (beklenenin %60’ının) üzerinde
ise, pnömonektomi dahil her türlü akciğer rezeksiyonu güvenle yapılabilmektedir (4,810). Lobektomi planlanan hastalarda ise preoperatif FEV1 değerinin 1,5 L’nin üstünde
olması arzu edilmektedir (3). Preoperatif dönemde saptanan FEV1 ile yapılacak
rezeksiyon türüne göre, postoperatif FEV1 değeri de tahmin edilebilmektedir.
82
Herhangi bir akciğer rezeksiyonu sonrasında, komplikasyonsuz ve yaşamla
bağdaşan postoperatif FEV1 değeri 0,8 L’nin üstünde olmalıdır. Bu değerin 0.8 L’den
az (beklenenin %40’ının altında) olması halinde, her türlü akciğer rezeksiyonu
kontrendikasyon söz konusudur (1,4,5). Ancak yüksek riskli olgularda, postoperatif
beklenen FEV1 değeri tek başına bir hasta seçim / eleme ölçütü olarak
kullanılmamalıdır (6).
KOAH’lı olgularda FEV1 yerine DLCO’nun kullanılması önerilmektedir (4).
DLCO
değeri mutlak değer olarak (normali 25mL/mmHg/dak) veya bu değer dikkate
alınarak bir oran olarak verilebilir. Preoperatif DLCO değeri beklenenin %60’ından
daha az olan hastalarda postoperatif komplikasyonların daha fazla olduğu
bildirilmektedir (3,13). DLCO’nun rutin olarak, her akciğer rezeksiyonu adayına
uygulanmasını savunanlar da bulunmaktadır (14). Preoperatif DLCO beklenenin %60
veya üstü değere sahipse veya postoperatif hesaplanan DLCO değeri beklenenin
%40’ından fazlaysa; pnömonektomi dahil her türlü akciğer rezeksiyonu güvenle
uygulanabilmektedir
(3,4,8,10).
DLCO
doğrudan
akciğer
hacimlerine
bağlı
olduğundan, hastadaki gaz değişimi bozuk olmadığı halde; göğüs deformitesi, yoğun
pakiplörit ve daha önce akciğer rezeksiyonu geçirmiş olgularda; sadece DLCO’ya
göre karar verilmesinin değerlendirme hatasına yol açabileceği unutulmamalıdır (4).
KOAH’lılarda ilk FEV1 değeri ölçüldükten sonra, inhale bronkodilatatör verilmesini
takiben 20 dakika sonra yeniden FEV1 ölçülmesi (reverzibilite testi) ve bu değerdeki
değişikliğin (umulan artışın) varlığı önem taşımaktadır. Reverzibilite saptanan
hastalar, bu işlemden sonra hem yeniden cerrahi tedavi adayı olabilecek hem de
uygun
bronkodilatatör tedavi sonrasında solunum fonksiyonlarını düzelterek
postoperatif morbidite oranlarını düşürebileceklerdir (4).
Ventilasyon
/
Perfüzyon
Sintigrafisi
ile
Postoperatif
FEV1
ile
DLCO
Hesaplanması
Preoperatif birinci basamak değerlendirmede FEV1 ve DLCO değerleri %60’dan az
bulunan ve akciğer rezeksiyonu planlanan olgularda, postoperatif dönemde
rezeksiyon sonrası hastada kalacak solunum hacimleri hesaplanmalıdır. Xe 133
ventilasyon ve Tc99 perfüzyon sintigrafileri yapılarak postoperatif kalacak FEV 1 değeri
tama yakın doğrulukta hesaplanabilmektedir. Genellikle daha pratik olan perfüzyon
sintigrafisi kullanılmaktadır. Yapılan kantitatif sintigrafiler ile preoperatif dönemdeki
FEV1 değerinin ne kadarının hangi akciğer tarafından sağlandığı ortaya konmakta,
83
daha sonra çıkarılacak akciğer segmenti sayısı göz önüne alınarak, hastada
postoperatif dönemde ne kadar solunum hacmi kalacağı kolaylıkla ortaya
konabilmektedir (1,3,4,9,13):
Postoperatif beklenen FEV1 kaybı (Lobektomi için)
Preop FEV1 x İlgili akciğerin % fonksiyonu x (Çıkartılacak segment sayısı /
Akciğerdeki toplam segment sayısı)
Postoperatif beklenen FEV1 (Pnömonektomi için)
Preop FEV1 x Kantitatif sintigrafiyle saptanan kalacak akciğerin % fonksiyonu
Arter Kan Gazı İncelemesi
Arter kan gazı analizinde, PaO2 60 mmHg’nın üstünde, PaCO2 45 mmHg’nın altında
ise, bu olgular akciğer rezeksiyonu açısından düşük risk grubunda yer almaktadırlar.
PaCO2’si
50
mmHg’nın
üstünde
değere
sahip
hastalar
inoperabl
olarak
değerlendirilmektedir (4,15). Hiperkapni postoperatif akciğer komplikasyon riskini
ortaya koyan önemli bir parametre olarak kabul görmesine karşın (4); arter kan
gazındaki oksijen satürasyonunun (SaO2) bundan daha değerli bir parametre olduğu
belirtilmektedir. İstirahatte SaO2 değeri %90’dan az bulunan, egzersiz ile %4’den
daha fazla desatürasyon gelişen olgular rezeksiyon açısından yüksek risklidir (3).
Kardiyopulmoner Egzersiz Testi
Kantitatif sintigrafi sonrasında, postoperatif hesaplanan FEV 1 değeri 0,8 L’nin ya da
postoperatif beklenenin %40’ının altındaysa veya postoperatif hesaplanan DLCO
değeri %40’dan düşükse; üçüncü aşama olarak, egzersiz testleri ile değerlendirme
yapılmalıdır. Merdiven çıkma, “treadmill” yürüme testi veya bisiklet ergometrisi ile,
gelişen dispnenin derecesi, oksijen satürasyonu, pulmoner vasküler direnç (Ppa) ve
maksimal olsijen tüketimi (VO2max) ölçülmektedir (2,4,10,14,16).
VO2max hastanın gerçekleştirebildiği en yüksek iş yükünde, dakikada vücut kilogramı
başına tükettiği maksimal oksijen miktarıdır (ml/kg/dak). Aerobik egzersiz kapasitesini
en iyi değerlendiren test olan VO2max’da, hem kardiyak hem de pulmoner
fonksiyonlar birlikte değerlendirilmektedir. Egzersize VO2max yanıtının azalması;
kalp, her iki akciğer, sistemik ve pulmoner dolaşıma oksijen sağlanmasındaki azalma
84
ile kasların oksijen kullanımındaki düşmeyi tanımlamaktadır (4). VO2max değeri
uygulanacak cerrahinin sonuçları açısından en iyi prognostik gösterge olarak kabul
edilmektedir (17).
VO2max değeri 20 mL/kg/dak değerinden yüksek ise postoperatif komplikasyon
riskinin oldukça az olduğu; 15 mL/kg/dak’dan düşük ise riskin oldukça arttığı
bildirilmektedir (3,8,10,13). VO2max değerinin 15 mL/kg/dak’nın üzerinde kaldığı
olgularda
pulmoner
belirtilmektedir (7).
komplikasyon
ve
oranlarının
mortalite
düşük
olduğu
Bisiklet ergometrisinde VO2max 10 mL/kg/dak ‘dan daha az
bulunan olgularda postoperatif mortalitenin %75 olduğu rapor edilmektedir.
Preoperatif solunum fonksiyon testleri uygun olsa bile, VO2max 10 mL/kg/dak ‘dan az
bulunan olgular inoperabl kabul edilmelidir (1,4,5).
Pulmoner Arter Oklüzyon Basıncı
Pnömonektomi adayı olgularda, rezeksiyon sonrası pulmoner hipertansiyon gelişme
olasılığı bulunmaktadır. Preoperatif dönemde, pnömonektomi planlanan akciğerin
ana pulmoner arteri balon kateter kullanımı ile geçici olarak oblitere edilmektedir.
Böylece hastada kalacak akciğerin sağ ventrikül “output”una etkisi ortaya
konabilmektedir. Ölçülen pulmoner arter oklüzyon basıncı (PAP) 35 mmHg’dan az ise
olgu pnömonektomi için uygun kabul edilmektedir (M). PAP değeri 50 mmHg’dan
fazla olması inoperabiliteyi işaret etmektedir (4,9).
Özet
preoperatif değerlendirmede ana prensip, cerrahi girişim planlananlarda preoperatif
dönemdeki kardiyopulmoner konforlarını postoperatif dönemde onlara aratmadan,
uygun
cerrahi
girişimi
en
aza
indirilmiş
morbidite
ile,
mortalitesiz
gerçekleştirebilmektir (Tablo 8.1). Bu amaca yönelik incelemeler sırasında, ilgili
kliniklerle (göğüs hastalıkları, kardiyoloji, vb) yapılacak konsültasyonların göz ardı
edilmemesi gereklidir. Gerekli incelemelerden sonra ortaya konan postoperatif riskin
hasta ve yakınları ile paylaşımı da gerekli bir etik ilkedir.
85
Tablo 8.1: Preoperatif Değerlendirme Özeti
Preop FEV1 > %60
Preop DLCO > %60
Arter kan gazları normal
Cerrahi tedavi uygulanabilir
Preop FEV1 < %40
Preop DLCO < %40
Cerrahi tedavi uygulanamaz
Preop FEV1 < %60
Preop DLCO < %60
Arter kan gazları anormal
Kantitatif sintigrafiye göre:
Preop FEV1 < %60
Preop DLCO < %60
Arter kan gazları anormal
Kantitatif sintigrafiye göre:
Postoperatif beklenen FEV1 > 0.8 L
Postoperatif beklenen DLCO > %40
Cerrahi tedavi uygulanabilir
Postoperatif beklenen FEV1 < 0.8 L
Postoperatif beklenen DLCO < %40 ise
Egzersiz testi
Egzersiz testi ile;
SaO2 desatürasyonu < %4
VO2max > 15 mL/kg/dak
PAP < 35 mmHg
Cerrahi tedavi uygulanabilir
Egzersiz testi ile;
SaO2 desatürasyonu > %4
VO2max < 15 mL/kg/dak
PAP > 35 mmHg
Cerrahi tedavi uygulanamaz
86
KAYNAKLAR
1. Fındıkçıoğlu A, Okay T, Sayın N ve ark. Akciğer rezeksiyonu planlanan sınırlı
solunum rezervi olan hastalarda postoperatif komplikasyon belirleyicisi olarak
egzersiz testi. Toraks Dergisi 2005;6:214-20.
2. Turhan K, Karapolat H, Eyigör S ve ark. Akciğer rezeksiyonu öncesi preoperatif
değerlendirme. Ege Tıp Dergisi 2009;48:23-8.
3. Akkoca Ö. Göğüs cerrahisinde preoperatif değerlendirme. In: Ökten İ, Güngör A,
ed. Göğüs Cerrahisi, Ankara: Sim Matbaacılık; 2003: 195-200.
4. Tabak L. Göğüs cerrahisinde preoperatif değerlendirme. In: Yüksel M, Kalaycı NG,
ed. Göğüs Cerrahisi, İstanbul: Bilmedya Grup; 2001: 95-104.
5. Yüksel M. Akciğer kanserinde operasyon öncesi değerlendirme. In: Hastürk S,
Yüksel M, ed. Akciğer Kanseri, İstanbul: Bilmedya Grup; 2000: 101-8.
6. Brunelli A, Refai M, Monteverde M, et al. Predictors of early morbidity after major
lung resection in patients with and without airflow limitation. Ann Thorac Surg
2002;74:999-1003.
7. Bayram AS, Candan T, Dülger H ve ark. Akciğer rezeksiyonları sonrası
komplikasyon tahmininde maksimal oksijen tüketim testinin önemi. Türk Göğüs Kalp
Damar Cer Derg 2004;12:30-4.
8. Akkoca Ö, Gülbay BE, Kaya A ve ark. Akciğer rezeksiyonu yapılacak hastaların
fonksiyonel değerlendirmesi için egzersiz testinin önemi. Tüberküloz ve Toraks
Dergisi 2004;52:307-14.
9. Gürkök S. Akciğer kanserinde preoperatif değerlendirme. Gülhane Tıp Dergisi
2005;47:83-7.
10. Datta D, Lahiri B. Preoperative evaluation of patients undergoing lung resection
surgery. Chest 2003;123:2096-2103.
11. Çetinkaya E. Preoperatif risk faktörleri. In: Zamani A, ed. Perioperatif pulmoner
değerlendirme (Toraks kitapları), İstanbul: Turgut Yayıncılık; 2006: 1-6.
12. Gülbay B, Çelik G. Özel durumlarda preoperatif pulmoner değerlendirme. In:
Zamani A, ed. Perioperatif pulmoner değerlendirme (Toraks kitapları), İstanbul:
Turgut Yayıncılık; 2006: 17-40.
13. Mutlu B. Akciğer rezeksiyonunda preoperatif değerlendirme. In: Zamani A, ed.
Perioperatif pulmoner değerlendirme (Toraks kitapları), İstanbul: Turgut Yayıncılık;
2006: 57-64.
87
14. Brunelli A, Salati M. Preoperative evaluation of lung cancer: predicting the impact
of surgery on physiology and quality of life. Curr Opin Pulm Med 2008;14:275-81.
15. Zamani A. Preoperatif pulmoner değerlendirme. In: Zamani A, ed. Perioperatif
pulmoner değerlendirme (Toraks kitapları), İstanbul: Turgut Yayıncılık; 2006: 7-16.
16. Brunelli A, Refai M, Xiume F, et al. Performance at symptom-limited stair-climbing
test is associated with increased cardiopulmonary complications, mortality and costs
after major lung resection. Ann Thorac Surg 2008;86:240-8.
17. Win T, Jackson A, Sharples L, et al. Cardiopulmonary exercise tests and lung
cancer surgical outcome. Chest 2005;127:1159-1165.
88
9.
Doç. Dr. Okan Solak
Afyon Kocatepe Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
GÖĞÜS CERRAHİSİNDE UYGULANAN KESİLER VE ENDİKASYONLARI
Ameliyatlarda yapılan kesilerin temel amacı cerrahi olarak tedavi edilmesi planlanan
lezyona en iyi yaklaşımı en kısa yoldan sağlamaktır. Göğüs Cerrahisinde kullanılan
kesilere
genel
olarak
“torakotomi”
adı
verilir.
Kesinin
göğüs
bölgesindeki
lokalizasyonuna göre posterolateral torakotomi, anterior torakotomi ve lateral
torakotomi olarak tanımlanır. Bu bölümde göğüs cerrahisinde en sık kullanılan genel
kesi şekilleri tanımlanacaktır. Hastalığa özel kesi şekilleri, ilgili hastalığın anlatıldığı
bölümde anlatılacaktır.
Göğüs Cerrahisinde En Sık Kullanılan Kesi Şekilleri
1. Posterolateral Torakotomi
2. Aksiller Torakotomi
3. Anterior Torakotomi
4. Sternotomi
5. Anterior mediastinotomi
6. Bilateral Transvers Torakosternotomi
7. Torakofrenolaporatomi
Posterolateral Torakotomi
Toraks patolojilerine yaklaşımda en sık kullanılan kesi şeklidir. Akciğer patolojilerinde
(Tümör, kist, bül, bronşiektazi, vs), posterior mediasten yerleşimli lezyonlarda,
özofagus ve diyafragma patolojilerinde sıklıkla kullanılır (1,2).
Hasta pozisyonu ve Kesi
Anestezi ve entubasyon işlemi tamamlanan hasta, operasyon yapılacak taraf
yukarıda kalacak şekilde lateral dekübitus pozisyona getirilir (Resim 9.1). Göğüs
altına bir yastık yerleştirilerek üstte kalan göğüs bölgesinin dışa açılanması ve
kaburgalar arasındaki açıklığın artması sağlanır. Kollar dirsekten fleksiyona getirilir.
Koltuk altına yastık konarak brakial pleksus basısı engellenir. Üstte kalan bacak tam
ekstansiyona getirilirken altta kalan bacak dizden hafifçe bükülür ve her iki bacağın
89
arasına dizler hizasında bir yastık konarak peroneal sinir hasarı önlenir. Sternum ve
kalça üzerinden destek stabilazatör ile hasta pozisyonu sabitlenir.
Cilt ve cilt altını içine alan kesi, erkeklerde meme başının yaklaşık 4–5 cm kadar
aşağısında anterior aksiler hattan, kadınlarda ise aynı hattan ancak meme dokusunu
kesmeyecek bir noktadan başlar. Orta aksiler hat hizasında bir yay çizerek kot
aralarına paralel hale gelir ve skapulanın alt ucunun yaklaşık 2 cm altından geçip bu
sefer yukarı yönlenecek şekilde bir yay çizerek vertebral sütun ile skapulanın medial
kenarı arasındaki açının açıortayından yukarı doğru devam eder. Kesi bu hat
üzerinde yapılacak torakotominin genişliğine göre uygun bir noktada sonlandırılır.
Kesi tamamlandığında kavisleri geniş bir “S” harfine benzer (Resim 1). İlk planda
ortaya çıkan latissumus dorsi kası koter yardımıyla kesilerek ayrılır. Latissumus dorsi
kesildikten sonra gözlenebilen serratus anterior kası sıklıkla korunarak fasyasından
ayrılır. Arkada oskultasyon üçgeni açılarak skapula ekarte edilir. Skapula altından
elin paraspinal ilerletilmesiyle en üst noktada palpe edilebilen 2. kot bulunur. Kot
sayımı yapılarak lezyonun lokalizasyonuna ve yapılacak ameliyatın şekline göre
uygun interkostal aralık belirlenir. İlgili interkostal aralıkta interkostal kaslar ve
paryetal plevra kesilerek toraks boşluğuna girilir. İki kosta arasına ekartör
yerleştirilerek uygun açıklık sağlanana kadar ekartör açılır (1-3).
Resim 9.1: Posterolateral torakotomi pozisyon ve kesi şekli.
90
Endikasyonlar
Göğüs cerrahisinde torasik kavitenin eksplorasyonu için en sık kullanılan kesi
posterolateral torakotomi kesisidir. Akciğer, mediasten, diyafragma, özofagus
patolojilerin birçoğunun girişimlerinde sıklıkla tercih edilir.
Akciğer rezeksiyonunda; 5. interkostal aralık, diyafragma hernisi-eventrasyonunda,
hiatus hernisi ve özofagus alt ucunu ilgilendiren patolojilerde 7.-8. interkostal aralık,
toraks içi trakea patolojilerinde ise 4.interkostal aralık en uygun seviyedir (1-3).
Komplikasyonlar
Operasyon sırasında en sık gözlenen komplikasyon, kot kırığı oluşmasıdır. Özellikle
ileri yaş osteoporotik hastalarda uygun interkostal açıklığı sağlamak için ekartör
açılırken kotta kırık oluşabilir. Ekartman sırasında oluşan kırıklarda postoperatif inatçı
ağrı oluşur. Riskli hastalarda ve ekartmanda kot kırılması oluşabilecek hastada kotun
kostotom yardımıyla düzgün kırık uçları oluşturularak kesilmesi, kırık oluşumuna göre
postoperatif daha az ağrı yakınması oluşturur (1,2 ).
Torakotomi sırasında toraks duvarına ait kasların ve interkostal kasların kesilmesi
sırasında kanama oluşabilir. Bu kanamalar koterizasyon veya ligasyon yöntemi ile
kontrol altına alınabilir. Ancak hemostazı ihmal edilen veya gözden kaçan kanama
odakları postoperatif toraks içi kanamalara neden olabilir. Postoperatif kanama
nedeniyle retorakotomi yapılan hastalarda en sık kanamanın göğüs duvarındaki
ayrılmış adhezyonlar ve interkostal aralığın köşelerindeki sızıntı tarzı kanamalar
olduğu gözlemlenmiştir (4 ).
Postoperatif torakotomi yerinde ağrı, her hastada gözlemlenen önemli bir yakınmadır.
Postoperatif erken dönem ve geç dönemde devam edebilir. Erken dönemdeki en sık
sebep ekartman sırasında oluşan interkostal aralıktaki kas, yumuşak doku hasarı ve
kot kırıklarıdır. Geç dönemde ise en sık neden interkostal sinir hasarından
kaynaklanan nöropatik ağrıdır (5,6). Tedavide erken dönem ağrıyı engellemek için en
etkin yöntem, lokal anestezik ajanlar ile interkostal blokaj yapılması ve paranteral
narkotik ve nonsteroid antienflamatuar ilaçların kullanılmasıdır. Geç dönem ağrıda
ise ağrının nüks bir patolojiye ait olmadığı ekarte edildikten sonra nöropatik ağrı
değerlendirilmesi yapılmalıdır. Çünkü ağrının nedeni interkostal sinirin hasarına bağlı
ise tek başına nonsteroid antienflamatuar ilaçların yararı olmayacaktır. Hasta
nöropatik ağrı için uygun ilaçlarla ( karbamezebin, gabapentin vs.) tedavi ve takibe
alınmalıdır (5,6).
91
Torakotomi sonrası nadir gözlenen bir diğer komplikasyon özellikle göğüs duvarı
rezeksiyonu yapılmış hastalarda gözlenen stabil olmayan toraks duvarı ve
skapulanın toraks içine herniye olmasıdır (7). Stabil olmayan toraks duvarı solunum
dinamiğinin bozulmasına neden olacaktır. Skapulanın herniyasyonu, çok nadir
komplikasyonlardan olup omuz hareket kaybına ve toraks duvarı şekil bozukluğuna
neden olur (Resim 9.2). Sıklıkla skapula alt ucu seviyesinde kot rezeksiyonu
yapılmış ise gelişir. Tedavide bu bölge revize edilerek normal anatomik lokalizasyon
sağlanmalıdır.
Resim 9.2: Torakotomi sonrası skapulanın toraks içine herniye olması
Aksiller Torakotomi
Transaksiller yaklaşımda uygulanan kesi şeklidir. Akciğerin apikal bölgesindeki ve
torasik çıkış bölgesindeki benign patolojilerde sıklıkla tercih edilir. Torakotomi kesileri
içinde az invazif ve kas koruyucu özelliği ile hasta için konforlu bir kesi şeklidir (8).
Hasta pozisyonu ve Kesi
Anestezi ve entubasyon işlemi tamamlanan hasta, lateral dekübitus pozisyona
getirilir (Resim 9.3a ve b). Göğüs altına yastık yerleştirilip üstte kalan göğüs
bölgesinin dışa açılanması sağlanarak bu bölgedeki kaburgalar arasındaki açıklığın
artması sağlanır.
Koltuk altına yastık konarak brakial pleksus basısı engellenir.
Kesinin yapılacağı bölgedeki kol hem omuzdan hem de dirsekten 90 derece
fleksiyona getirilerek sabit kalması sağlanır. Bacak pozisyonu posterolateral
torakotomideki gibidir. Sternum ve kalça üzerinden destek stabilazatör ile hasta
pozisyonu sabitlenir (1-3).
Cilt kesisi aksiler çukurda, kıllı bölgenin bittiği en alt seviyeden yapılır. Kesi orta
aksiller hatta vertikal (Ginsberg kesisi) (Resim 9.3a) veya en sık kullanılan şekliyle
92
horizantal olarak yapılabilir (Resim 9.3b). Cilt ve yağlı doku kas fasyasına kadar
kesildiğinde arkada latissimus dorsi, önde pektoralis major kası ve orta hatta serratus
anterior kasları gözlenir. Eksplorasyonda torasikus longus ve interkostabrakial sinirler
korunmalıdır. Latissumus dorsi kası arkaya ve pektoralis major kası öne
kesilmeksizin ekarte edilir. Serratus anterior kası, lifleri arasından künt disseksiyon ile
kesilmeden ayrılır. Toraks boşluğuna girilmesi planlanan 3. veya 4. interkostal aralığa
ulaşılır. İnterkostal kaslar ve altındaki pariyatel plevra eloktrokoter ile kesilerek toraks
boşluğuna girilir. Aksiller torakotomi, torasik çıkış sendromu nedeniyle yapılmış ise
1.kot ve torasik çıkış bölgesi bu kesiyle rahatlıkla eksplore edilebilir (1-3).
Aksiller torakotominin hastaya sunduğu avantajlar, koltuk altında kaldığı için kozmetik
olması, ağrının az olması, kas korunduğu için fonksiyon kayıplarının en düşük
düzeyde olması ve hızlı iyeleşme sürecidir. Cerraha sunduğu avantajları hızlı açma
ve kapama süresi ve karşılaşılabilen komplikasyonların azlığıdır (3,8).
Resim 9.3a-b: Aksiler torakotomi, hasta pozisyonu ve kesi şekilleri
Endikasyonlar
Aksiller torakotomi en sık akciğerin apikal bölgesine yerleşmiş pnömotoraksa neden
olan blep ve/veya bül rezeksiyonlarında tercih edilmektedir. İkinci sıklıkla torasik çıkış
sendromuna
neden
olan
patolojilere
yaklaşımda
kullanılmaktadır.
Diğer
endikasyonlar, akciğerin apikal bölgesinde yerleşmiş lezyonlarda tanı ve/veya tedavi
amaçlı wedge rezeksiyon ve üst torasik sempatik sinir sistemine ait girişimler olarak
sıralanabilir. Günümüzde videotorakoskopinin yaygın kullanımı ile aksiler yaklaşımla
yapılan bir çok ameliyat yerini videotorakoskopiye bırakmıştır (1,3,8).
93
Komplikasyonlar
Posterolateral torakotomiye göre komplikasyonları daha az olup çok daha konforlu
kesi şeklidir. Kesi sırasında karşılaşılan komplikasyonlar, torasikus longus ve
interkostobrakial sinirlerinin zedelenmesi, kanama, sınırlı görüntü (ing: exposure) ile
lezyona ulaşmaktaki güçlük sayılabilir. Postoperatif en sık gözlenenen komplikasyon
hastaya posizyon verilirken kolun abduksiyonunun ileri derecede ve uzun süreli
yapılmasına bağlı brakial pleksusta gerilme, omuz hareketlerinin ağrılı olması ve yara
yerinde seroma gelişmesidir. Vertikal yapılan kesilerde seroma sıklığı daha fazla
gözlenmektedir (3,8).
Anterior Torakotomi
Anterior torakotomi, kas koruyucu torakotomi kesilerindendir. Hastanın FEV1 ve FVC
değerlerinde en az kayıp ile girişim yapılmasına izin verir. Operasyon sırasında hızlı
açma ve kapama süresi, büyük kas gruplarının korunması, postoperatif ağrının az
olması
en
büyük
avantajlarıdır.
Tek
dezavantajı
ise
operasyonda
sınırlı
eksplorasyona izin vermesidir.
Hasta Pozisyonu ve Kesi
Hasta sırtüstü pozisyondayken ameliyat edilecek toraksın altına silikon destek
konarak yükseltilir. Kesi anterior aksiler hattan başlayarak sternuma doğru memenin
altından kota paralel olarak yapılır (Resim 9.4). Kesinin uzunluğu modifiye edilebilir.
Cilt ve cilt altı dokusu kesildikten sonra eğer kesi anterolateral uzanımlı ise
latissumus dorsi kası korunarak laterale retrakte edilir. Serratus anterior kası ise ya
parsiyel olarak kesilir ya da retrakte edilir. 4. veya 5. interkostal aralıktaki interkostal
kaslar kesilerek toraksa girilir. Kotlar toraks ekartörü yerleştirilerek aralanır ve
eksplorasyon sağlanır.
94
Resim 9.4: Anterior torakotomi, hasta pozisyonu ve kesi şekli
Endikasyonlar
Anterior torakotomi en sık açık akciğer biopsisinde tercih edilmektedir. Günümüzde
akciğer biopsisi için wedge rezeksiyon, risk grubu olmayan hastalarda VATS ile
yapılmaktadır. Ancak özellikle genel anestezinin yüksek riskli olduğu ve solunum
rezervleri sınırda olan selektif entubasyonun kullanılamadığı hastalarda açık akciğer
biopsisi için en uygun yaklaşım halen anterior torakotomidir (1,2). Acil torakotomi
gereken durumlarda anterolateral torakotomi tercih edilen kesi şekillerindendir. Son
zamanlarda artmakta olan
minimal invazif
kardiak cerrahi girişimlerde
de
anterolateral torakotomi kullanımı sıklığı artmaktadır.
Komplikasyonlar
Posterolateral torakotomi ile kıyaslandığında az invaziv kesi şeklidir. Ameliyat
sırasında eksplorasyonun yetersiz kalmasından dolayı kesinin büyütülmesi sık
karşılaşılan bir durumdur. Postoperatif en sık bildirilen komplikasyon %0–20 sıklıkta
seroma gelişimidir (3). Postoperatif ağrı diğer torakotomi kesilerinden daha hafif
seyirlidir.
Median Sternotomi
Median
sternotomi
en
sık
açık
kalp
cerrahisinde
kullanılmaktadır.
Göğüs
Cerrahisinde ise anterior mediasten yerleşimli kitlelerin eksplorasyonunda ve
çıkarılmasında kullanılmaktadır. Sternotominin en büyük avantajı, kas kesilmemesi
postoperatif ağrının azlığı, solunum rezervlerini çok az etkilemesi, hızlı açılıp
kapatılabilmesi, emniyetli ve hızlı iyileşen bir kesi olmasıdır.
95
Hasta Pozisyonu ve Kesi
Hasta sırtüstü pozisyonda yatırılır. Cerrahın tercihine bağlı olarak kollar açık veya
gövdeye yakın tutulabilir. Kesi, jügüler çentikten başlatılarak sternum ortasından
vertikal olarak ilerletilip ksifoidin 2cm altında bitirilir (Resim 9.5a).
Sternum orta
hattında kas bulunmadığı için cilt altı dokusundan hemen sonra anterior sternal
fasyaya ulaşılır. Juguler bölgede interklavikuler ligament kesilerek jugulumun
posteriorundan parmakla sternum altı mediastinal dokulardan serbestlenir. Ksifoid
altından
da
parmak
disseksiyonuyla
sternum
altı
mediasten
dokularından
serbestlenir. Sternum orta hattı boylu boyunca koterle işaretlenir. Entubasyon tüpü
kısa süreliğine anestezi tarafından anestezi cihazından ayrılır ve otomatik testere ile
sternum tam ortasından jugulumdan ksifoide doğru kesilir. Eğer sternum tam değil
Louis açısının altına kadar kesilirse ‘Parsiyel Sternotomi’ olarak tanımlanır (Resim 9.
5b). Otomatik testerenin olmadığı durumlarda Lebsche sternum bıçağı da
kullanılarak sternum kesilebilir (1–3,8). Ayrılan sternum, sternal korteksin hemostazı
sağlandıktan sonra ekartör yardımıyla aralanır. Sternumun kapatılmasında çelik tel
dikişler kullanılır.
Resim 9.5a-b: Median sternotomi ve parsiyel sternotomi, hasta pozisyonu ve kesi
şekli
Endikasyonlar
Kardiyak girişimler dışında, anterior mediasten yerleşimli kitleler, timoma,
timus
cerrahisi, trakea cerrahisi, sol bronş fistüllerinde karinaya anterior yaklaşımda sıklıkla
tercih edilir. Parsiyel sternotomi özellikle plonjan guatrın anterior mediasten
uzanımının eksplorasyonunda ve trakeanın orta seviyesi lezyonlarında servikal
kesiye ek olarak yapılır.
96
Komplikasyonlar
Median sternotominin ameliyat sırasında oluşabilen komplikasyonları, sternumun
otomatik testereyle tam ortadan kesilememesi, testere ile kesilirken innominate arter
ve/veya vende hasar oluşması, sternum ekarte edilirken kot fraktürleri meydana
gelmesi, mediasten eksplorasyonu sırasında plevral yaprakların açılması ile
pnömotoraks oluşması sayılabilir.
Postoperatif sıkça gözlenen komplikasyonlar arasında: yaşlı ve osteoporotik
hastalarda yaranın iyeleşmesinde geçikme ve sternal ayrılma (ing: dehiscence)
sayılabilir. Ancak en ciddi komplikasyon mediastinit gelişmesidir. Mediastinitin sıklığı
%1–5 olup, mortalite oranı %40’a ulaşabilmektedir (1-3). Bir diğer muhtemel
komplikasyon brakial pleksus hasarıdır. Brakial pleksus hasarlanmasının nedeni
sternumun ekartörle üst bölümden ve geniş açılmasıyla oluşmaktadır. Sıklığı %5
olarak bildirilmektedir (3,8). Mediasten cerrahisi sonrası etkin hemostaz yapılmadığı
veya etkin drenaj sağlanmadığı durumlarda retrosternal hematom veya hemotoraks
gelişebilir.
Anterior mediastinotomi (Chamberlain Prosedürü)
Anterior mediastende yerleşmiş kitlelerde tanı amaçlı yapılan bir girişimdir.
Günümüzde transtorasik iğne biopsisi, ekstended-mediastinoskopi ve VATS’ın
yaygın kullanılması ile yapılma sıklığı azalmıştır (9).
Hasta Pozisyonu ve Kesi
Hasta sırt üstü pozisyonda yatırılır, kolları isteğe bağlı açık veya hasta vücuduna
bitişik yerleştirilir.
Kitlenin lokalizasyonuna göre sağ veya sol 2.kot seviyesinde
sternokostal eklemden midklavikuler hatta uzanan yaklaşık 3-4cm uzunluğunda cilt
kesisi yapılır (Resim 9.6). Pektoral kas künt disseksiyonla ayrılarak, 2.kotun kıkırdak
bölümü subperiostal olarak kesilip çıkarılır. Oluşan açıklıktan ekstraplevral olarak,
parmak diseksiyonu ile plevra açılmadan ön mediastinuma ulaşılır. Bu aşamada
internal mammarian arter ve veni zedelememeye dikkat edilmelidir. Anterior
mediastinal yağlı doku ve/veya kitle eksplore edilerek tanı amaçlı biopsi alınır. Sol
tarafta uygulandığından gerekirse bu kesiden mediastinoskop’un ilerletilmesi ile 5 ve
6 numaralı gangliyonlardan örnek alınabilir.
97
Resim 9.6: Sol anterior mediastinotomi, hasta pozisyonu ve kesi şekli
Endikasyonlar
Anterior mediastinotomi, en sık anterior mediasten yerleşimli kitlelerden biopsi almak
için kullanılmaktadır. İkinci sıklıkla akciğer kanserinde paraaortik patolojik boyutta lenf
nodları varlığında lenf nodlarını evrelemek için kullanılmaktadır. Günümüzde
paraaortik
ve
aortikoplumoner
lenf
nodlarını
örneklemek
için
anterior
mediastinotominin yerine extended mediastinoskopi daha sıklıkla kullanılmaktadır
(9). Anterior mediastinotomi ile perikard içi eksplorasyon da yapılabilmektedir.
Özellikle santral lokalizasyonlu akciğer kanserinde tümörün perikard içi invazyonu
anterior mediastinotomi ile değerlendirilebilir (8).
Komplikasyonlar
Ameliyat sırasında gelişebilecek komplikasyonlar, internal mamarian arter-ven ve
interkostal arter-ven yırtılmalarına bağlı kanamalar, pariyatel plevranın açılmasına
bağlı pnömotoraks sayılabilir. Postoperatif komplikasyon, ağrı ve bu bölgede
interkostal sinir zedelenmesine bağlı hipoestezi ve hiperestezi gelişmesidir.
Transsternal Bilateral Torakotomi (Clamshell Torakotomi)
Açık kalp cerrahisinin ilk dönemlerinde kullanılan bilateral transsternal torakotomi,
günümüzde bilateral akciğer transplantasyonu ve travmalar için tercih edilmektedir.
Hasta Pozisyonu ve Kesi
Hastaya ameliyat masasında sırt üstü yatar şekilde ve kolları açık olarak pozisyon
verilir. Kesi bir taraf toraksın anterior aksiller hat 4. kot seviyesinden başlatılır,
kurvilineer bilateral submamarian hat boyunca ilerletilir ve diğer toraks anterior
98
aksiller hatta sonlandırılır (Resim 9.7). Cilt kesisi superfisyal pektoral fasyaya kadar
uzanabilir.. Pektorel kas ve serratus anterior kas lifleri arasından 4. İnterkostal aralığa
ulaşılır. İnterkostal kas koterize edilerek kesilir. Parasternal bölgede internal
mammarian damarlar bağlanıp kesilir. Bilateral torakotomiler transvers sternotomi
yapılarak birleştirilir. Geniş bir eksplorasyon sağlanmış olur.
Resim 9.7: Transsternal Bilateral Torakotomi kesi yeri ve şekli
Endikasyonlar
Transsternal bilateral torakotomi en sık bilateral akciğer transplantasyonunda tercih
edilmektedir. Transplantasyon sırasında kalp pompasına girilmeyecekse sternum
kesilmeden bilateral torakotomi ile ameliyat tamamlanabilir. Travmalarda özellikle
ateşli silah yaralanmalarında her iki hemitoraksta gelişen pulmoner veya vasküler
hasarın kontrol altına alınmasında transsternal bilateral torakotomi kullanılmaktadır
(1,2,8).
Komplikasyonlar
Hasta için en büyük ameliyat kesilerinden biridir. Ameliyat sırasında en sık
karşılaşılabilen komplikasyon internal mamarian damarların yanlışlıkla yırtılmasına
bağlı kanamadır. Bu tür büyük kesilerin en önemli komplikasyonu hastaların solunum
rezervlerini önemli derecede azaltması ve şiddetli ağrı sonucu solunum yetmezliği
geliştiği için hastaların ekstubasyonlarının gecikmesidir. Ortalama ekstübasyon süresi
2.7 gün olarak bildirilmektedir. Ekstübasyon süresinin uzamasında ağrı önemli role
sahiptir (2,3,8). Elektif şartlarda transsternal bilateral torakotomi planlanan hastalarda
ağrı kontrolu için epidural kateter uygulanmalıdır. Yara yeri enfeksiyonu ve sternal
instabilite daha az sıklıkla gözlenen komplikasyonlardandır (1,2).
99
Torakoabdominal Kesi
Torakoabdominal kesi plevra ile peritoneal boşluğu birleştiren kesi şeklidir. Toraksın
alt bölgesi ile üst abdominal bölgede eksplorasyon sağlar. Bu eksplorasyon sırasında
diyafragmanın da kesilmesiyle torakofrenolabdominal kesi adını alır.
Hasta Pozisyonu ve Kesi
Sol torakoabdominal kesi en sık uygulanan taraftır. Hastanın sol hemitoraksı 45
derece yukarıda kalacak şekilde sırt altı jel yastıklar ile desteklenir (Resim 9.8a).
Kesi 6.,7. veya 8. İnterkostal aralık seviyesinde ve arkus kostarum üzerinden
başlatılır ve kot seyrine uyacak şekilde posteriora uzatılır (Resim 9.8b). Cilt ve cilt altı
doku geçildikten sonra posteriorda latissumus kası kesilmeden laterale ekarte edilir.
Serratus kası kesilerek interkostal kaslara ulaşılır.
Sıklıkla 7. İnterkostal aralık
kullanılarak toraksa girilir ve 7.kot sternumla eklem yerinin 1-2cm lateralinden
kesilerek sternumdan ayrılır.
Kesi göbek üstü median laparotomiye tamamlanır
(Resim 9.8b). Eksternal oblik kaslar ve periton ayrıldıktan sonra üst karın boşluğuna
ulaşılır. Toraks ve karın arasındaki diayafragma kesilerek eksplorasyon alanı
genişletilir.
Resim 9.8a-b: Torakoabdominal kesi, hasta pozisyonu ve kesi şekli
Endikasyonları
Sol torakoabdominal kesi; sıklıkla özofagus alt uç, kardia tümörlerinde özofajektomi +
özofagogastrostomi ameliyatları için tercih edilmektedir. Ayrıca büyük adrenal tümör
rezeksiyonu ve aort cerrahisinde de tercih edilmektedir. Sağ torakoabdominal kesi;
bilier sistemin rekonstruktif işlemleri, karaciğerin sağ lobunun çıkarılması, portokaval
şant operasyonları, böbrek veya sağ adrenal lokalizasyonlu büyük tümörlerin
çıkarılmasında tercih edilmektedir.
100
Komplikasyonlar
Torakoabdominal kesi oldukça büyük bir kesidir. Bundan dolayı açma ve kapama
süresi uzundur. Postoperatif ağrı şiddetlidir. Ağrının kontrolu için operasyondan
hemen önce epidural kateter kullanılması önerilmektedir. Kosta uçlarının stabil
olmaması, yara yeri enfeksiyonu, alt lob pnömonisi, diafragma herniasyonu nadiren
de olsa gözlenen postoperatif komplikasyonlardır. Postoperatif erken dönemde,
torakotomi, frenotomi ve laparotomi birlikteliği solunum rezervlerini önemli ölçüde
azaltır. Torakoabdominal keside ekstübasyon süresi uzadığından postoperatif erken
dönemde hastalar mekanik ventilatörde takip edilmektedirler (2,3,8).
101
KAYNAKLAR
1. Fry WA. Thoracic Incisions. In Shields TW, LoCicero J, Ponn RB, ed. General
Thoracic Surgery, vol 1, 5th ed. Philadelphia: Lippincott Williams and Wilkins;
2000:367-374.
2. Moores DW, Foster ED, McKneally MF. Incisions. In Pearson FG, Deslauriers J,
Ginsberg RJ, Hiebert CA, McKneally MF, Urschel HC, ed. Thoracic Surgery, vol 1,
Churchill Livingstone Inc.; 1995: 113-129.
3. Enön S. Torasik İnsizyonlar. In Ökten İ, Güngör A. Ed. Göğüs Cerrahisi; 2003: 463482.
4. Metin M, Erdoğu V, Pekçolaklar A, Kanbur S ve ark. Akciğer Rezeksiyonu Sonrası
Retorakotomi Gerektiren Morbidite Nedenleri ve Sıklığı. III. Ulusal Göğüs Cerrahisi
Kongresi Gaziantep, 2005,TP-75.
5. Solak O, Turna A, Pekcolaklar A, Metin M, et al. Transcutaneous electric nerve
stimulation for the treatment of postthoracotomy pain: a randomized prospective
study. Thorac Cardiovasc Surg. 2007; 55:182-5.
6. Solak O, Metin M, Esme H, Solak Ö et al. Effectiveness of gabapentin in the
treatment of chronic post-thoracotomy pain. Eur J Cardiothorac Surg 2007; 32(1):912.
7. Solak O, Pekçolaklar A, Sayar A, Solmazer N ve ark., Skapula’nın Toraks İçine
Spontan Transpozisyonu. Kocatepe Tıp Dergisi 2005; 6 (2): 49-51.
8. Marshall MB. Thoracic Incicions. In Kaiser LR, Kron IL Spray TL ed. Mastery of
Cardiothoracic surgery, 2nd ed. Lippincott Williams &Wilkins 2007; 27-32.
9. Metin M, sayar A, Turna A, Gurses A. Extended cervical mediastinoscopy in the
diagnosis of anterior mediastinal masses. Ann Thorac Surg. 2002; 73(1): 250-2
102
10.
Doç. Dr. M. Cumhur Sivrikoz
Eskişehir Osmangazi Üniversitesi, Tıp Fakültesi Göğüs Cerrahi Anabilim Dalı
AKCİĞER REZEKSİYONLARINDA TEMEL PRENSİPLER VE ENDİKASYONLARI
Literatüre göre ilk pnömonektomi 1933 yılında Evarts Graham tarafından
gerçekleştirildi. Graham, kromik katgüt kullanarak sol pulmoner hilusu hiler
diseksiyon yapmaksızın bağladı (1). Kısa süre sonra, önce Archibald, daha sonra
Rienhoff hiler diseksiyon yaparak ilk anatomik pnömonektomi işlemini gerçekleştirdi
(2,3). Blades ve Kent 1940 yılında hiler diseksiyon ile ilk anatomik lobektomiyi
tanımladılar (3,4). Price-Tomas 1947 yılında ilk sleeve lobektomiyi gerçekleştirdi (5).
İlk karinal rezeksiyon Abbott ve ark. tarafından, ilk başarılı trakeal sleeve
pnömonektomi ise 1959 yılında Gibbon tarafından gerçekleştirildi (3,6). Bu
gelişmelerin ardından 1992 yılında Lewis ve ark. ilk video yardımlı torakoskopik
lobektomiyi tanımladı (7). Ancak video yardımlı torakoskopik rezeksiyonlar özellikle
onkolojik cerrahi açısından henüz araştırma aşamasında olduğundan kabul edilebilir
rutin bir uygulama değildir (3,8).
Tarihsel sürecinde tanımlanan bu cerrahi uygulamalar bugün ülkemizde ve
dünyadaki birçok merkezde kabul edilebilir mortalite ve morbidite oranları ile
uygulanmaktadır.
Akciğer rezeksiyonları günümüzde temel olarak akciğerin primer ve skonder
tümörlerinde uygulanmaktaysa da bronşektazi, fungal hastalıklar ve tüberküloz gibi
kronik enfeksiyonlara bağlı parankimal destrüksiyonlarda da başvurulan bir tedavi
yöntemidir (3,8).
Segmentektomi, lobektomi ve pnömonektomi gibi anatomik rezeksiyonlarda temel
prensip fissur ve hilusta yerleşmiş olan pulmoner arter, pulmoner ven ve bronkial
yapıların diseksiyonu - ligasyonu ile lob veya akciğerin tamamının mobilizasyonunun
sağlanması esasına dayanır.
Pulmoner Arter
Pulmoner arter sağ ventrikülden aldığı düşük oksijen konsantrasyonlu kanı akciğer
parankimine taşır. Düşük basınç sistemine sahiptir. Düşük basınca sahip olması
nedeniyle damar duvarı ince ve frajildir. Cerrahi uygulamalar sırasında kolaylıkla
zedelenerek büyük kanamalara neden olabilir.(3,8) Bu nedenle pulmoner arter
103
diseksiyonu sırasında gerekli özenin gösterilmesi gerekir. Pulmoner arter zayıf kas
yapısının üzerinde “prevasküler faysa” ile sarılıdır. Arterin diseksiyonu sırasında
prevasküler fasyanın damar boyunca birkaç santimetre açılması ve damar duvarı ile
fasya arasındaki planın diseksiyonu önerilir. İşlem sırasında tarif edilen bu planda
kalınması pulmoner arterin görülemeyen arka duvarının daha rahat diseke
edilmesine olanak sağlar.(Şekil 10.1a,b)
Şekil 10.1a: Prevasküler fasia diseksiyonu
Şekil 10.1b: Prevasküler fasia içinden dönülmüş pulmoner arter
Cerrahi diseksiyonu yapılan pulmoner arter damar büyüklüğüne göre absorbe
edilmeyen uygun süturlarla (sağ ve sol pulmoner arter için 0 numara, lob arterleri için
2/0 veya 3/0) bağlanır. Bağlama süturu arterin proksimali için (hasta tarafı) en az iki
adet, arterin distali için (rezeke akciğer tarafı) bir adet kullanılır ve rezeke edilen
akciğer tarafında tek sütur kalacak şekilde pulmoner arter ortadan kesilir (Şekil 10.2).
Zaman zaman bağlama süturları yerine otomatik dikişler kullanılabileceği gibi
pulmoner artere damar klempi konularak absorbe olmayan monoflaman dikişle
104
devamlı sütur tekniği kullanılarak da pulmoner arter dikilebilir. Sonrasında arter klemp
veya otomatik dikişler üzerinden kesilir.
Şekil 10.2: Bağlanmış damar yapı
Pulmoner ven
Pulmoner venler akciğerin toplardamar sistemi olup birçok dalın birleşimi ile perikard
dışında bir ana gövde oluşturur. Sağ ve sol akciğerlerden üst ve alt pulmoner venler
olarak adlandırılan bu yapılar perikard içine girdikten sonra sol atriuma dökülür.
Duvar yapısı pulmoner artere göre daha kalın olması nedeniyle diseksiyonu
pulmoner artere göre daha emniyetlidir. Pulmoner venler “0-sıfır” numara absorbe
olmayan sütur kullanılarak yukarıda anlatılan tekniğe uygun bağlanabileceği gibi
perikard dışından veya içinden bir damar klempi ile kapatıldıktan sonra 4/0
monoflaman sütur ile devamlı dikiş tekniği kullanılarak da dikilebilir. Yine perikard
içinden veya dışından otomatik damar dikişleri ile venlerin kapatılması da
mümkündür.
Bronşlar
Akciğer rezeksiyon cerrahisinin önemli aşamalarından birisi de bronş diseksiyonu ve
rezeksiyondur. Bronşiyal sistem bronşiyal arterlerden beslenir. Sol ana bronşu
besleyen iki, sağ ana bronşu besleyen bir bronşiyal arter vardır. Bu arterler kardiyak
output’un %1’ini alır (3). Bu nedenle bronş diseksiyonu sırasında bronşiyal
arterlerden kaynaklanabilecek kanamaların kontrolü iyi yapılmalıdır. Aynı zamanda
geniş bronş diseksiyonundan da kaçınarak bronşiyal ağacın beslenmesinin
bozulmamasına özen gösterilmelidir. Bronşiyal sistem üzerinde yapılan geniş ve
gereksiz
diseksiyon
sonucu
kesilip-dikilen
bronş
güdüğünün
beslenmesinin
bozulması rezeksiyon cerrahisinin önemli komplikasyonu olan “bronş fistülü” gelişme
riskini artırır.
105
Bronş diseksiyon ve rezeksiyonu esnasında önemli bir diğer nokta da bronşun
nereden dikileceği ve hangi uzunlukta kesileceğidir. Uzun bırakılan bronş güdüğü
sonucu oluşan bronşiyal kesede sekresyonların birikimi söz konusu olacak ve güdük
sütur hattında maserasyonla beraber doku iyileşmesi bozulacaktır. Bu sürecin bronş
fistülü gelişiminde önemli bir etken olduğu bilinmektedir (3,8). Sağ pnömonektomi ve
tüm lobektomi-segmentektomi işlemlerinde bronşun sıfır hattından yani ilk başlangıç
hattından süture edilip dikilmesi daha kolay olarak yapılabilir. Ancak sol
pnömonektomilerde arkus aorta ve aorta-pulmoner pencerenin anatomik yapısı
nedeniyle sol ana bronşun proksimaline yani karinadan ayrılma yerine ulaşmak zor
olabilir. Ancak burada da yapılması gereken karinaya kadar sol ana bronş
diseksiyonunu sağlamak ve sıfır hattından bronş rezeksiyonunu gerçekleştirmektir.
Sol akciğerde yapılan pnömonektomilerde güdük aorta-pulmoner pencerede
gömüleceğinden
çevre
dokular
tarafından
neovaskülarizasyon
açısından
desteklenecektir. Bu durum gerektiği gibi yapılmış sol pnömonektomilerde fistül
gelişimini azaltır. Günümüzde bronşiyal yapıların kapatılmasında genellikle absorbe
olmayan süturlar tercih edilmekte olup tek tek veya devamlı sütur tekniği ile bronkial
yapılar dikilebilir. Ayrıca bronkial yapılar için uygun otomatik sütürlerin kullanımından
da çok iyi sonuçlar alınmaktadır (Resim 10.1).
Resim 10.1: Otomatik dikiş kullanılarak
kapatılmış bronşiyal güdük
Kemo-radyoterapi
uygulanan
olgular
ve
mikobakteriyel
enfeksiyonlar
dahil
inflamatuar olaylara bağlı olarak akciğer rezeksiyonu uygulanan olgularda da
bronşiyal fistül gelişme olasılığı yüksektir. Özellikle bu olgularda bronş güdüğün
vasküler açıdan zengin bir doku ile desteklenmesi önerilir. İnterkostal kas flebi,
diafram kas flebi, ekstratorasik kas flebi, perikardial yağ flebi, plevral tabanlı flep,
omentum, azygos ven gibi çeşitli yapılar bu dokular arasında sayılabilir (Resim 10.2)
106
Resim 10. 2: İnterkostal kas flebi ile desteklenmiş bronş güdüğü
Bu bölümde sağ ve sol akciğerin farklı anatomik yapılarına vurgu yapılarak akciğer
rezeksiyon türleri, lobektomi ve pnömonektomiler için hiler diseksiyon özellikleri ve
yapılacak rezeksiyonun seçimi için endikasyonlar anlatılacaktır.
Akciğer rezeksiyon türleri
1. Sınırlı rezeksiyonlar
ı. Wedge rezeksiyon
ıı. Büllektomi
ııı. Enükleasyon
2. Anatomik rezeksiyonlar
ı. Segmentektomi
ıı. Lobektomi
a. Basit lobektomi
b. Bilobektomi (Üst-orta veya alt-orta lobektomi)
c. Bronkial sleeve lobektomi
d. Bronkovasküler sleeve lobektomi
ııı. Pnömonektomi
a. Basit pnömonektomi
b. Plöropnömonektomi
c. Trakeal sleeve pnömonektomi
107
Lobektomi
Akciğerin bir lobunun rezeke edilme işlemidir. Lobektomi işlemi bronşektazi, fungal
hastalıklar
ve
tüberküloz
gibi
kronik
enfeksiyonlara
bağlı
parankimal
destrüksiyonlarda ve benign akciğer patolojilerinde uygulanabildiği gibi günümüzde
yoğun olarak akciğer malignitelerinin tedavisinde uygulanır (3).
Sağ Üst Lobektomi
Sağ üst lob anatomik yapısı kompleks olan lobdur. Genellikle posterolateral
torakotomi insizyonunu takiben 5. interkostal aralıktan göğüse girilerek sağ üst lob
hilusuna yaklaşılır. V. kava superior lateralinde, v. azygoz inferiorunda ve sağ ana
bronş önünde uzanan pulmoner arterin üst loba giden ilk dalı “superior trunkus”tur.
Diğer önemli arteriel yapı major fissurun posteriorunda interlober pulmoner arterden
ayrılarak üst loba giden “posterior assendan arter”dir. Superior turunkus ve posterior
assendan arter arasında üst loba giden pulmoner arter dalları olabilmektedir. Üst
lobektomi için superior trunkus arteri ve posterior assendan arter distalden absorbe
olmayan süturlarla bağlanır, gerekirse monoflaman süturla dikilir ve kesilir.(Şekil
10.3, Şekil 10.4)
Sağ pulmoner arter
Şekil 10.3: Sağ üst lob superior trunkus
108
İnterlober pulmoner arter
Posterior segment
arteri
Orta lob arteri
Orta lob
Üst lob
Alt lob
Alt lob superior
segment arteri
Bazal segment
arterleri
Şekil 10.4: İnterlober pulmoner arter
Superior pulmoner ven akciğer arkaya çekilerek üst lokalizasyonda bulunur.
Mediastinal plevra açılarak ven diseke edilir. Superior pulmoner ven üst lob ve orta
lobun drenajını sağlamakta olup üst lobektomi işlemi esnasında orta lob dalları
korunmalıdır. Üst loba ait venöz yapılar distalden absorbe olmayan süturlarla
bağlanır, gerekirse monoflaman süturla dikilir veya otomatik dikişlerle kapatılarak
kesilir.
Olguların yaklaşık % 80’ninde üst lob ve orta lob arasındaki minör fissür
inkomplettir.(3)
Bu
durum
nedeniyle
üst
lobektomi
esnasında
orta
lobun
korunabilmesi için minör fissürün diseke edilerek ayrılması gerekir. Minör fissür künt
ve keskin diseksiyonla diseke edilip daha sonra orta lob yüzü süturlar kullanılarak
tamir edilebileceği gibi otomatik süturlar kullanılarakta ayrılabilir.
Hilusun posteriorunda yerleşen üst lob bronşu karinadan 1 – 1.5 cm sonra sağ ana
bronştan dik bir açı ile ayrılır. 1 – 1.5 cm’lik ana gövde sonrası üst lob segment
dallarına ayrılır. Bronşun anteriorunda bulunan pulmoner arter komşuluğu nedeniyle
bronş diseksiyonu dikkatle yapılmalıdır. Bronkial güdük el ile süture edilecekse
distale bronkial klemp yerleştirilir ve bronkial güdük 1 cm’den uzun olmayacak şekilde
bronkial süturlar yerleştirilir ve bronş süturların üzerinden kesilir. Otomatik dikiş
kullanılacak olursa stapler, bronş güdüğü 1 cm’den uzun olmayacak şekilde çalıştırılır
ve uzun güdük bırakmayacak şekilde bronş rezeke edilir (Şekil 10.5).
109
Üst lob bronşu
Orta lob
bronşu
Orta lob
Üst lob
Sağ ana bronş
Alt lob
Alt lob superior
segment bronşu
Alt lob bronşu
Şekil 10.5: Sağ akciğer bronkial sistemi
Sağ Orta Lobektomi
Posterolateral torakotomi insizyonunu takiben 5. interkostal aralıktan göğüse girilerek
orta loba yaklaşılır. İnterlober fissür diseke edilerek interlober pulmoner artere ulaşılır.
Pulmoner arterden orta loba giden bir veya iki pulmoner arter dalı vardır. Arterler
distalden absorbe olmayan sturlarla bağlanır, gerekirse monoflaman süturla dikilir ve
kesilir (Şekil 10.4).
Bu dalların bağlanıp kesilmesinin ardından intermedier bronkustan ayrılan orta lob
bronşu orta lob arterlerinin arkasından görülür. Bronkial güdük 1 cm’den uzun
olmayacak şekilde kapatılır ve rezeke edilir.
Orta lobektomi sırasında superior pulmoner venin üst lob dalları korunur. Orta loba ait
venöz yapılar distalden absorbe olmayan süturlarla bağlanır, gerekirse monoflaman
süturla dikilir veya otomatik dikişlerle kapatılarak kesilir. Aynı zamanda inkomplet
fissür varlığında üst lobdan ayırmak için minör fissürün diseksiyonu gerekir (Şekil
10.5).
110
Sağ Alt Lobektomi
Posterolateral torakotomi insizyonunu takiben 6. interkostal aralıktan göğüse girilerek
alt loba yaklaşılır. Major ve minör fissurların birleşim yerinde interlober bölgede
oldukça derin bir pozisyonda interlober pulmoner arter uzanır. İnterlober pulmoner
arter üst loba giden posterior assendan arter dalını verdikten sonra biraz daha
distalde alt lob superior segment arter dalını verir ve daha distalde bazal segmentlere
dağılır. Alt lobektomi için alt lob superior segment arteri ve interlober pulmoner arterin
kapatılıp kesilmesi gerekir (Şekil 10.4).
İnferior pulmoner ven visseral ve parietal plevraların birleşimi sonucu oluşan ve
mediastinal yüzde diafragmaya kadar uzanan inferior ligamanın serbestleştirilmesi
sonrası ortaya çıkar. İnferior pulmoner venin uygun şekilde diseksiyonundan sonra
ven distalden absorbe olmayan sturlarla bağlanır, monoflaman süturla dikilir veya
otomatik dikişlerle kapatılarak kesilir.
Sağ hilusun posteriorunda uzanan intermedier bronkusta genellikle aynı seviyeden
alt lob superior segment bronkusu ve orta lob bronkusu çıkar. Daha distalde ise alt
lobun bazal segment bronkusları dallanır. Bronkial yapıların çevre bağ dokudan
diseksiyonu sonrasında bronkial güdük 1 cm’den uzun olmayacak şekilde kapatılır ve
rezeke edilir. Alt lobektomi sırasında bronkial rezeksiyonu gerçekleştirirken orta lob
bronşunun daraltılmamasına dikkat edilmelidir (Şekil 10.5).
Sol Üst Lobektomi
Posterolateral torokotomi insizyonunu takiben 5. interkostal aralıktan göğüse girilerek
alt loba yaklaşılır. Sol pulmoner arter aortopulmoner pencereden çıkarak sol ana
bronşun arkasında inen aortaya paralel olarak uzanır ve interlober fissüre ulaşır.
İnterlober fissüre kadar olan bölümünde sol üst lob için dallarını verir. Bu dallar 3 – 7
arasında farklılık gösterebilir. İnterlober fissur bölümünde ise bir ya da iki adet linguler
arter dalı çıkar. Arterler distalden absorbe olmayan sturlarla bağlanır, gerekirse
monoflaman süturla dikilir ve kesilir (Şekil 10.6).
111
Üst lob
Üst lob arterleri
Lingual arteri
Alt lob
Sol pulmoner arter
Bazal segment
arterleri
İnterlober pulmoner arter
Superior segment
arteri
Şekil 10.6: Sol pulmoner arter sistemi
Akciğer arkaya çekildiğinde sol ana bronş ve üst lob dalının önünde superior
pulmoner ven vardır. Mediastinal plevra açılır ve superior pulmoner ven diseke edilir.
Daha sonra ven distalden absorbe olmayan sturlarla bağlanır, monoflaman süturla
dikilir veya otomatik dikişlerle kapatılarak kesilir.
Üst lob arter dalları bağlanıp kesildikten sonra pulmoner arterin yaklaşık orta
bölümünde anteriorda üst lob bronkusu lokalize olur. Bronkus çevre bağ dokudan
diseke edilerek uygun şekilde kapatılır ve kesilerek üst lobektomi tamamlanır (Şekil
10.7).
112
Üst lob bronşu
Üst lob
Alt lob bronşu
Sol ana bronş
Alt lob superior
segment bronşu
Alt lob
Şekil 10.7: Sol bronkial sistem
Sol Alt Lobektomi
Sol alt lobektomi damarsal varyasyonların az görülmesi nedeniyle en kolay
rezeksiyon tipi olarak kabul edilir. Posterolateral torokotomi insizyonunu takiben 6.
interkostal aralıktan göğüse girilerek alt loba yaklaşılır. Fissürun posteriorundan
interlober pulmoner arter interlober fissüre giriş yapar. Bu bölümde lingula arterlerinin
biraz üzerinde bir lokalizasyondan alt lob superior segment arteri ayrılır. Daha sonra
interlober pulmoner arter bazal segmentlere dallanır. Rezeksiyon için linguler arterleri
koruyarak alt lob superior segment arteri ve interlober pulmoner arterin kapatılıp
kesilmesi gerekir (Şekil 10.6).
İnferior ligaman serbestleştirilerek inferior pulmoner vene ulaşılır. İnferior pulmoner
ven diseke edilir ve distalden absorbe olmayan sturlarla bağlanır, monoflaman süturla
dikilir veya otomatik dikişlerle kapatılarak kesilir.
Alt lob bronşu interlober pulmoner arterin hemen posteriorunda uzanır. Üst lob
bronşu korunacak şekilde ve güdük uzun bırakılmayacak şekilde kapatılıp kesilerek
alt lobektomi işlemi tamamlanır (Şekil 10.7).
113
Sleeve Lobektomi
Sleeve rezeksiyonlar yukarıda anlatılan lobektomi türlerine göre daha kompleks
rezektif işlemlerdir. En sık sağ üst loba uygulanmakla beraber orta lob, sağ ve sol alt
loblarda da uygulanır (3).
Ana amaç küratif ancak sınırlı bir rezeksiyonla parankim alanlarını korumaktır. Bir
başka deyişle pnömonektomiye bir alternatif oluşturarak olgu pnömonektomi
işleminden korunur. Sleeve lobektomi işlemi sırasında küratif cerrahiye ulaşmak için
dikkat edilmesi gereken noktalar vardır;
- Kitle bir lobda sınırlı olmalı ve tam rezeksiyon sağlanmalıdır.
- Bronkial anastomoz hatlarında cerrahi sınır temiz olmalıdır.
Sleeve lobektomi işlemi temel olarak normal bronkial alanlar korunmak kaydı ile
patoloji bulunan bronkial segmentin ve bronşa bağlı akciğer dokusunun birlikte
rezeksiyonunu ifade eder. Korunmuş bronkial alanlar uç – uca veya uç – yan
anatomoz edilir. Sleeve lobektomi işlemine zaman zaman pulmoner arteriel sisteme
uygulanacak parsiyel rezeksiyonlar eşlik edebilir (Resim 10.3, 4 ve 5).
Resim 10.3:Sleeve rezeksiyon gerektirecek lober orifis tutulumları
Resim 10.4: Sağ sleeve üst lobektomide bronşial rezeksiyon
114
Resim 10.5: Sleeve sağ üst lobektomi
Sleeve lobektomi endikasyonları;
1. Lober bronş orifisi tutulumu
2. Ekstrakapsüller peribronşial lenf nodları ile lober bronşun invazyonu
Travma veya inflamatuar olaylara bağlı bronkial striktürler, benign veya malign
neoplaziler için uygulanabilecek sleeve lobektomilerin mortalite ve morbiditesi
pnömonektomiden daha düşük, uzun dönem takip sonuçları ise pnömonektomi ile
aynıdır (3).
Pnömonektomi
Pnömonektomi bir akciğerin tamamının rezeke edilmesi işlemidir. Günümüzde daha
çok santral yerleşimli lobektomi veya sleeve lobektomi ile rezeke edilemeyecek
akciğer malignitelerinin tedavisinde kullanılır. Bunun yanında bronşektazi, tüberküloz,
fungal enfeksiyonlar gibi inflamatuar olaylara bağlı gelişen harap akciğerin
tedavisinde de kullanılır. Akciğer malignitesi düşünülen olgularda histopatolojik tanı
olmaksızın pnömonektomi işlemi yapılmamalıdır (3).
Pnömonektomi sonrası hasta tek akciğerle yaşamını sürdürmek zorunda kalacağı
için cerrahi öncesinde hastanın akciğer fonksiyonları ve kardiak kapasitesi titizlikle
değerlendirilmelidir.
Sağ Pnömonektomi
Genellikle posterolateral torokotomi insizyonunu takiben 5. interkostal aralıktan
göğüse girilerek hilusa yaklaşılır. Zaman zaman sternotomi yoluyla girişimde
mümkündür. V. kava superior lateralinde, v. azygoz inferiorunda ve sağ ana bronş
önünde uzanan pulmoner arterin diseksiyonun tamamlanır. Pulmoner arter distalden
115
absorbe olmayan sturlarla bağlanır, monoflaman süturla dikilir veya otomatik
dikişlerle kapatılarak kesilir (Şekil 10.3).
Superior pulmoner ven akciğer arkaya çekilerek üst lokalizasyonda bulunur.
Mediastinal plevra açılarak ven diseke edilir. Daha sonra distalden absorbe olmayan
sturlarla bağlanır, monoflaman süturla dikilir veya otomatik dikişlerle kapatılarak
kesilir.
Akciğer yukarı çekilir ve inferior ligaman serbestleştirilerek inferior pulmoner vene
ulaşılır. İnferior pulmoner ven diseke edilir ve superior vende olduğu gibi kapatılıp
kesilir.
Son olarak mediastinal plevra bronş üzerinde açılır. Sağ ana bronş karinaya kadar
diseke edilir. Bronkial güdük el ile süture edilecekse distale bronkial klemp yerleştirilir
ve karinaya 1 cm’den uzak olmamak kaydı bronkial süturlar yerleştirilir ve bronş
sturların üzerinden kesilir. Otomatik dikiş kullanılacak olursa otomatik dikiş karina
seviyesinden çalıştırılır ve uzun güdük bırakmayacak şekilde bronş rezeke edilir.
Sol Pnömonektomi
Genellikle posterolateral torokotomi insizyonunu takiben 5. interkostal aralıktan
göğüse girilerek hilusa yaklaşılır. Zaman zaman sternotomi yoluyla girişimde
mümkündür. Akciğer aşağı çekilerek arkus aorta kavsinin altından mediastinal plevra
açılır. Çevre mediastinal ve lenfatik dokuların diseksiyonu sonrası pulmoner artere
ulaşılır. Bu diseksiyon esnasında arkus aortanın altından dönerek yukarı giden
rekürren sinir korunmalıdır. Daha sonra pulmoner arter diseke edilir. Pulmoner arter
distalden absorbe olmayan sturlarla bağlanır, monoflaman süturla dikilir veya
otomatik dikişlerle kapatılarak kesilir.
Superior ve inferior pulmoner venler sağ pnömonektomide olduğu gibi diseke edilir ve
aynı teknik kullanılarak kapatılır ve rezeke edilir.
Sol pnömonektomide önemli nokta sol ana bronşun diseksiyonudur. Arkus aorta
anatomisi nedeniyle sol ana bronşun üzerinde karinanın üst ön kısmında bulunur. Bu
anatomik yapı nedeniyle sol ana bronşun diseksiyonu önemlidir. Sol ana bronş çevre
bağ dokudan diseke edilerek karina seviyesine kadar inilir. Sağ pnömonektomide tarif
edildiği şekilde kapatılıp rezeke edilir.
116
Trakeal Sleeve Pnömonektomi
Trakea’nın distal bölümü, karina ve trakeobronkial bileşkenin genellikle santral
lokalizasyonlu malign ve benign tümörler ile tutulumu halinde uygulanan genişletilmiş
bir akciğer rezeksiyonu türüdür. Zaman zaman ekstrakapsüller hale gelmiş metastatik
lenf bezlerinin bu seviyedeki invazyonlarıda trakeal sleeve pnömonektomi için
endikasyon teşkil eder (Resim 10. 6).
Şekil 10.6: Sağ trakeal sleeve pnömonektomi gerektirecek tutulum
Bu işlemde pnömonektomiye ek olarak karina ve zaman zaman distal trakea rezeke
edilir, daha sonra karşı akciğerin ana bronş ucu ile trakeal uç anastomoz edilir (Şekil
10.7,8 ve 9).
Şekil 10.7: Sağ trakeal sleeve pnömonektomide bronşial rezeksiyon
117
Şekil 10.8: Sağ trakeal sleeve pnömonektomide bronşial rezeksiyon
Şekil 10.9: Sağ trakeal sleeve pnömonektomi
Bu işlem sırasında önemli bir nokta, karinal rezeksiyon sonrasında ve anastomoz
süresince hastanın ventilasyonunun idame ettirilmesidir. Bunun için anastomozu
yapılacak bronşa bir kateter yerleştirilir ve bu kateter ameliyat sahasından anestezi
sahasındaki anestezi cihazına ulaştırılır. Sağlanacak bu bağlantı hastanın anastomoz
işlemi boyunca havalandırılmasını mümkün hale getirecektir.
Sağ trakeal sleeve pnömonektomi için sağ posterolateral torakotomi uygun bir girişim
yoludur. Ancak sol trakeal sleeve pnömonektomi işlemini arkus aorta anatomisi
nedeniyle sol posterolateral torakotomiden yapmak oldukça güçtür. Sol hemitoraks
yerleşimli tümörlerde sternotomi üzerinden rezeksiyon ve anastomoz yapılabileceği
gibi önce sol posterolateral torakotomi ile sol pnömonektomi ardından aynı seansta
veya ikinci bir seansta sağ posterolateral torakotomi ile karinal rezeksiyon ve
anastomoz yapılabilir.
118
KAYNAKLAR
1. Graham EA, Singer JJ. Landmark article Oct 28, 1933. Successful removal of
an entire lung for carcinoma of the bronchus. By Evarts A. Graham and J.J.
Singer. JAMA 1984; 251(2):257-60
2. Ellis H. The first pneumonectomies for lung cancer. J Perioper Pract
2008;18(3):130-31
3. Kirby TJ, Fell SC. Pneumonectomy and Its Modifications. In: Shields TW,
LoCicero J, Ponn RB, Rusch VW, ed. Generel Thoracic Surgery, vol 1 6th ed.
Philadelphia: Lippincott Williams and Wilkins; 1995: 121-23
4. Kent EM, Blades B. The anatomic approach to pulmonary resection. Ann Surg
1942;116(5):782-94
5. Price-Thomas C. Conservative resection of the bronchial tree. J R Coll Surg
Edinb 1956;1:169
6. Abbott OA. Experiences with the surgical resection of the human carina,
tracheal wall and contralateral bronchial wall in cases of the right total
pneumonectomy. J Thorac Surg 1950;19(6):906-22
7. Lewis RJ, Sisler GE, Caccavale RJ. Imaged thoracic lobectomy: should it be
done? Ann Thorac Surg 1992;54(1): 80-3
8. Mason DP. Lobectomy. In: Patterson GA, Cooper JD, Desauriers J, Lerut
AEMR, Luketich JD, Rice TW, ed. Pearsons’s Thoracic and Esophageal
Surgery, vol 1 3rd ed. Philadelphia: Churchill Livingstone Elsevier;2008:879-93
119
11.
Prof. Dr. Mehmet Bilgin
Erciyes Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
TORAKS DUVARI DEFORMİTELERİ
Konjenital göğüs duvarı deformiteleri, en sık görülen konjenital anomalilerdir. Geniş
bir spekturumu vardır. Ancak, ektopya kordis ve asfiksiya torasis distrofi gibi hayati
tehdit eden deformitelerden çok pektus ekskavatum ve karinatum daha sık görülür(1).
Toraks duvarı deformiteleri 5 ana grupta görülür:
1- Pektus ekskavatum
2- Pektus karinatum
3- Poland sendromu
4- Sternal defektler (ektopya kordisi içine alır)
5- Diğer deformiteler (vertebral ve kosta anomalileri,jeunes hastalığı vb.)
PEKTUS EKSKAVATUM (Kunduracı göğsü; Funnel chest)
Üst kostal kıkırdakların ve sternumun posteriora depresyonudur. Göğüs duvarı
deformitelerinin %84’ünü kapsar. Birinci ve ikinci kotlar, manibrium genellikle
normaldir. 3. Kottan itibaren kostaların kıkırdak kısımları ve sternum posteriora doğru
çöküktür. Yetişkinlerde kemik ucları da bir miktar içe dönük olabilir.
Çöküklük
simetrik olabileceği gibi çok kez asimetriktir. Genellikle sağ taraf sol taraftan daha
fazla çöküktür ve sternum da bu tarafa doğru dönmüştür. Bu çocuklarda genellikle
astenik bir vücut yapısı vardır; zayıf postürle birlikte omuzlar da içe dönüktür.
Pektus ekskvatum genellikle doğumda ya da yaşamın ilk yılında görülür (%86). Hasta
takip edilirse deformitenin ergen yaşta daha da kötüleştiği izlenebilir. Pektus
ekskatumla birlikte diğer kas-iskelet sistemi hastalıkları deformiteye eşlik edebilir.
Waters ve arkadaşları 1988 yılında yaptıkları çalışmalarda 508 hastanın %26’sında
skolyoz tanımlamışlardır. Asimetrik pektus ekskavatumda sternumun dönük olması
ve derin sağ kenar oluğu ve sol lomber skolyoz birlikte görülebilir(1,2).
120
Normal populasyonda konjenital kalp hastalıkları %0.017 iken, pektus ekskavatumlu
hastaların %1,5’inde konjenital kalp hastalığı tespit edilmiştir. Ancak genel pediatrik
popülasyondaki astımlı vakalar ile göğüs deformiteli hastalar arasında fark
gösterilememiştir. Çocukluk yaş grubunda görülen sık ÜSYE, tonsillit, adenoid gibi
hastalıkların da göğüs deformiteleri ile ilgisi gösterilememiştir.
Etyoloji
1/300 ile 1/400 canlı doğumda görülür. Etyolojide kostal kıkırdakların fazla
büyümesine bir açıklama getirilememiştir. Diyafragmanın anormal gelişmesi (3)
kostal kıkırdaklarda aseptik osteonekroz ve inflamatuvar gelişmeler (4) gibi teoriler
vardır. Ailevi insidansının fazla olduğu tespit edilmiştir. Yediyüzdört hastalık bir seride
%37 ailevi insidans saptanmıştır. Erkeklerde kızlara oranla 6 kat fazla görülür;
zencilerde ise nadirdir. (1,2).
Tanıda herhangi bir biyokimyasal yada genetik işaret yoktur. Tanı klinik bulgularla
konur. Turner’s syndromu, prune belly syndromu ve Marfan syndromu (oküler, iskelet
ve kardiyovasküler manifestasyonları olan konnektif doku hastalığıdır) gibi genetik
geçişli hastalıklarda pektus ekskavatum sıklığı daha fazladır(1).
Semptomlar
Dar ince göğüslü, dorsal lordozu belirgin cocuklardır. Karakteristik olarak pektus
ekskavatum çocukluk ve infant yaşta iyi tolere edilir. Çocukluk yaşı solunum yolu
enfeksiyonları, bu çocuklarda normal popülasyonla aynı oranda saptanır. Solunum
yolu enfeksiyonları sık olan coçuklarda, adenoid hipertrofi ya da tonsiller hipertrofi
öncelikle düşünülmelidir. Daha ileri yaştaki çocuklarda deforme kıkırdakların olduğu
yerde ya da prekordiyal bölgede egzersiz sonrası ağrı olabilir. Çok az hastada geçici
atrial aritmi görülmüştür. Bu hastalarda mitral valf prolapsusu da normal
populasyondan daha sıktır.
Tanı
1- Pulmoner fonksiyon çalışmaları:
V/Q %59 anormal
VC olması çok kez normaldir
2- Kardiyovasküler fonksiyon çalışmaları:
a) Paroksismal supraventriküler taşıkardi, atrial fibrilasyon,
b) Mitral valv prolapsusu Wpp sendromu (%18.65)
121
3-Ekokardiyografi: Mitral valv prolapsusu ile birlikte aort kapağında anüler ektazi
varlığını tespit için kullanılır.
4-P-A ve lateral baryumlu göğüs grafileri
5-Welch indeksi: Deformitenin şiddetini ölçmede kullanılan indekstir. Operasyon için
endikasyon 5 ve üstü değerlerdir.
6-Wadanın funnel indeksi (Fİ) : Deformitenin basit ve hızlı değerlendirilmesini sağlar
Wada FI= a. b. c/A.B.C ‘dir.
a=horizental depresyon
b=transvers depresyon
c=derinlik
A=sternumun uzunluğu
B=Horizontal toraks uzunluğu
C=Luis açısı ile vertebra arasındaki mesafe
Normalde Wada’nın funnel indeksi “0-sıfır” dır. Funnel indeks 0,2’nin altında ise
deformitenin şiddeti hafif olarak değerlendirilir (Grade I). Cerrahi endikasyonu yoktur.
Funnel indeksi 0.3 ila 0.2 arasında ise orta derece deformite olarak kabul edilir
(Grade II) cerrahi endikasyonu vardır. Funnel indeksi 0,3’ün üstünde ise deformite
şiddetli olarak kabul edilir (Grade III) operasyon gereklidir.
7-Haller indeksi:(CT-İndeksi): Bilgisayarlı toraks tomogrfisinde toraksın lateral capının
sternumun en derin yerindeki ön-arka çapa bölünmesidir (Şekil 11.1). Normal
göğüsde bu oran 2,5 iken 3,2’nin üstü patolojik kabul edilir.
Şekil 11.1: Haller indeksinin hesaplanması için kullanılan çaplar
8-Kompüterize aksiyal tomografi veya magnetik rezonansı: Bu metodla kalp ve
üzerindeki kompresyonu göstermek mümkündür.
122
9- Kardiyak anjiografi: Bu hastalardaki kardiyak aritmi ve çarpıntının açıklamasında
kullanılır. Bazı serilerde pektus ekskavatumlu hastalarda sağ koroner arterin yer
değiştirdiği tespit edilmiştir. Ayrıca kalbin yer değiştirmesi ve kalp üzerindeki
kompresyon tespit edilebilir.
10- Fiber optik bronkoskopi: Sıklıkla sol ana bronşta olmak üzere bronşiyal daralma
gözlenebilir.
Operasyon
Çocuğun psikolojik sorunlarının gelişmediği, kas iskelet sisteminin kanlanmasının az
olduğu, skolyoz’un henüz oluşmadığıi, okul çağı öncesi (5-7 yaşlar) operasyon için en
uygun zamandır. Göğüs deformiteli çocuklarda okula başladıktan sonra içe dönük bir
kişilik geliştiği gözlenmiştir. Aynı zamanda bu yaşlarda yapılan düzeltme ameliyatları
sonrası intratorasik organların gelişmeleri de normal olacaktır. Deformite çocukluk
çağında düzeltilmezse ileride kardiyak ve pulmoner komplikasyon sıklığı daha da
artar. Ayrıca operasyon tekniği ve başarısı için da erken dönem düzeltme daha
uygundur.
Özel bir cerrahi kontraendikasyonu yoktur. Bazı yazarlar Marfan’s Sendromlu
hastalarda daha sık görülen pektus ekskavatumda operasyonun kontraendike
olduğunu bildirmişlerse de birçok seride bu hastalarda iyi kozmetik ve fonksiyonel
sonuçlar elde edildiği bilinmektedir. Cerrahi için en önemli endikasyon deformitenin
derecesidir.
Teknikler
Cerrahi tekniklerin temel amacı sternal depresyonun düzeltilmesi ve bu pozisyonda
kalmasını sağlamaktır. Günümüze kadar çeşitli düzeltme teknikleri uygulanmışsa da
günümüzde en sık Modifiye Ravitch tekniği ve MIRPE (minimal invaziv repair of
pectus excavatum) (Nuss operasyonu) uygulanmaktadır.
Ravitch Operasyonu: 3-7 kostal kıkırdaklar çıkartılır. Ksifoid eksize edilir. Sternal
osteotomi + pektoral kaslar rektus flebi ile ters “Y” biçiminde kapatılır.
Kardiyak patolojilerle birlikte olan pektus ekskavatumda kombine prosedürler
uygulanabilir. Aynı seansta hem kardiyak patoloji hem de pektus ekskavatum onarılır
(3,4). Operasyon sonrası yaklaşık 3 ay fiziksel aktiviteden kaçınılmalıdır. Altı aydan
sonra bütün aktiviteler serbest olarak yapılabilir.
123
Operasyon sonuçları oldukça iyidir. Nadiren komplikasyon görülür. En sık nüks,
pnömotoraks, yara yeri enfeksiyonu, seroma ve hemoperikard gibi komplikasyonlar
saptanır (5,6).
MİRPE (Nuss operasyonu) (minimal invazive repair of pectus excavatum)
İşlemde temel amac sternumun en çökük olduğu kısma altından destek olacak ve
onu dışarı doğru itecek şekilde torakoskopi ile bir metal çubuk (İng:bar)
yerleştirmektir (7-11) (Şekil 11.2 ve 11.3a,b). Teknikle ilgili detaylar Bölüm 12’de
de anlatılmıştır.
Şekil 11.2: Nuss Tekniğinin prensibi
Şekil 11.3: Nuss tekniği ile düzeltme a: öncesi ve b: sonrası
124
Pektus Karinatum (Güvercin Göğsü)
Üst kostal kıkırdakların öne doğru çıkması ile birlikte sternumun buna eşlik etmesidir.
Sonuç olarak gögüs ön duvarı ve sternum öne doğru çıkıntılı bir hal alır (Şekil 11.4).
Göğüs deformiteleri içinde %13.8 ile 2. sıradadır (12).
Dört ana tipte incelenebilir:
1- Khondrogladiolar
- Symetrik
- Asymetrik
2- Mikst tip (karinatum/ekskavatum)
3- Kondrogladiomanubrial
Etyoloji
Ailesel öykü ön sıradadır. Welch’in yaptığı 152 kişilik bir seride hastaların %26’sında
aile öyküsü mevcuttur (13).
Pektus karinatum sıklıkla erkek çocuklarında görülür. Skolyoz ve diğer kas-iskelet
sistemi anomalileri ile birlikte sıktır. Pektus karinatum ‘un %50’si 11–13 yaş
çocuklarında tespit edilmiştir. Çocukluk yaşında hafif olan bu deformite yaşla birlikte
ilerleme gösterebilir. Hastaların yaklaşık yarısında deformite 11 yaşından sonra açığa
cıkar(13).
Cerrahi Tedavi
Operasyon pektus ekskavatum için yapılan operasyon ile aynı prensiplere sahiptir.
Respiratuar ve kardiyak fonksiyonları iyileştirmekle birlikte anterior göğüs duvarının
kozmetik
düzeltilmesi
amaçlanır.
kondromanubrial deformite
1952
yılında
ilk
kez
Ravitch
tarafından
veya üst sternal deformite onarımı yapılmıştır. Daha
sonra Lester (1953), Çhin (l957), Brodin (1958) değişik teknikler uygulamışlardır
(3,14,15).Son yıllarda Abrahamson tarafından tanımlanan minimal invaziv olarak özel
bir bar ile strenum aşağı doğru çekilerek barın toraksın lateralinden sabitlenerek
kullanılan yöntem (Abrahamson yöntemi) bazı kliniklerce kullanılmakta ve başarılı
sonuçlar alınmaktadır. Göğüs ön duvarının stabil olmasından 3 yıl sonra bar
çıkarılmaktadır (16-18). Operasyondan önce retrosternal alan BT ve MRI ile dikkatli
125
bir şekilde değerlendirilmelidir. Bu ihmal edilirse operasyon sonrası kardiyak
kompresyon görülebilir.
Şekil 11.4: Pektus ekskavatum CT görüntüsü
Poland Sendromu
1841 yılında Poland tarafından pectoralis majör ve minör kaslarının yokluğu ve
sindaktili ile ilişkili bir sendrom olarak tanımlamıştır. Bu sendrom doğüştan itibaren
görülür. İnsidansı1/30000–32000 olarak belirtilmiştir(5).
Poland’s sendromu:
1- Pektoral majör kasının sternal başının hipoplazisi veya
yokluğu
2- Pektoralis minör yokluğu
3- 2-4 kotların ön kısımlarının yokluğu
4- Meme hipoplazisi, aplazisi, memenin komple yokluğu
5- Aksiller kıllanmanın yokluğu ya da normal yerinin
dışında aksiller kıllanma varlığı
6-El deformiteleri: Hipoplazi, Sindaklini, Pençe eli
Polan’s Sendromu kadınlarda %61 oranında daha sıktır. Deformite doğumdan
itibaren görülür ve otozomal dominanttır (5). Etyoloji bilinmemektedir. Bouvet lezyon
tarafındaki
subklavian
arter
hipoplazisi
internal
mamarial
arterin
sternumu
besleyememesini sebep olarak göstermektedir(19).
Poland’s Sendromu ile birlikte ;
a) Sprengel deformitesi (Skapula elevasyonu, kanatlaşma ve büyüklüğünde azalma
b) Mobius sendromu (Bilateral ve umblateral fasiyal palsi , abdüsens paralizisi
c) Çocukluk çağı lökömisi görüldüğü rapor edilmiştir.
Cerrahi Tedavi
126
Bayanlarda meme büyütme dışında pektoralis majör ve minör başının sternal
kısmının yokluğu sınırlı ise ve fonksiyonel defekt minimal ise onarım gerekli değildir.
Kostal kıkırdakların depresyonu veya yokluğunda paradoksal hareketleri gidermek,
bayanlarda meme rekonstrüksiyonu
için optimal
şartları sağlamak için cerrahi
gereklidir. Deformite latismus dorsi kasının flebi ya da kontralateral split kaburga ile
yapılır.
Sternal Yarıklar (Clefts)
Pektus ekskavatum veya karinatum ile karşılaştırıldığında nadir görülmekle birlikte
dramatik görünümü ve potansiyel ölümcül tehlikesi ile tıbbi literatürde dikkat
çekmektedir. 3 gruba ayrılır :1-Sternal kleft (ektopia kordis olmaksızın), 2-Torasik
ektopia kordis ve 3-Thorakoabdomınal ektopıa kordis. Sternal kleft’de kalp normal
pozisyonda iken diğer anomalilerde yer değiştirmiştir.
Sternal Cleft (yarık sternum)
Gestasyonun
8.
haftasında
sternal
çubukların
orta
hatta
kaynaşmasının
yetersizliğinden oluşur. Sternumun tamamını içine aldığı gibi parsiyel de olabilir.
Bütün vakalarda sternal ayrılmaya rağmen normal bir diyafragma vardır ve sağlam
perikardiumun üzerini normal deri örter. Bu hastalarda omfalosel oluşmaz. Deformite
valsalva manevrasıyla veya ağlama ile deformitenin artış gösterir.
Cerrahi Onarım
İlk kez 1949’da Mayer ve Bartoni 6 haftalık bir çocukta operasyon gerçekleştirdiler
(20). Bu onarım kardiyak basının olmadığı yeni doğanda yapılabilir. Primer
yaklaşılabildiği gibi prostatik materyallerle de bu boşluk kapatılabilir (20).
Ektopia Kordis
İzola sternal kleftin başarı ile kapatılmasına rağmen ektopia kordisin cerrahi tedavisi
yüksek mortalite oranına sahiptir.
Etyoloji
Amniyon ayrılması, koryonik katmanya da yolk kesesinin gestasyonun 3. 4.
haftasında ayrılması, kromozom anomalileri, teratojenik faktörler gibi nedenler öne
sürülmüştür. Ektopia kortise eşlik eden hafif veya ağır kardiyak lezyonlar olabilir.
127
Torako-Abdominal Ektopia Cortis (Contrell’s Pentology)
Bu anomalide kalp omfolosel benzeri bir zar ya da ince bir deri ile kaplıdır. Sternum
yarıktır ve kalp torasik ektopia kordisteki gibi anteriorda bulunmamaktadır. İlk kez
1798 ‘de Wilson tarafından tanımlanmıştır (21). Patoloji şu 5 unsurdan oluşmaktadır:
1- Yarık alt sternum (Distal sternal kleft), 2- Yarım ay şeklinde anterior diyafragma
defekti (Transvers
septumun gelişim yetersizliği), 3-Perikardiumun diyafragmatik
kısım defekti, 4-Onfalosel (Ventrial onfalosel), 5-Konjenital kalp hastalığının majör bir
formu ( VSD Sol ventrikül divertikülü)
Kalp tamamen vücut dışında geliştiğinden ve kalp için göğüs boşluğunda bir alan
oluşamadığından cerrahi tamir nadiren mümkün olabilmektedir; yapılabilirse mümkün
olan en erken zamanda yapılmalıdır, mortalitesi çok yüksektir (5).
Yenidoğan Asfiksan Torasik Distrofisi (Jeune’s Hastalığı)
1954 yılında Jeune’s ve arkadaşları tarafından tarif edilen multipl kıkırdak anomalileri
ve dar ve rijit göğüs kafesi ile karakterize bir hastalıktır. Sebep olduğu solunum
yetersizliğinden dolayı perinatal dönmede hasta kaybedilir. Otozomal resessif
geçişlidir ve kromozom anomalileri ile birliktedir (5).
Spondilo Thoracic Dsplasia (Jarcho-Levin Sendromu)
Jarcho ve Levin tarafından tanımlanmış bir çok vertebra ve kosta anomalisi ile ilişkili
deformitedir (1938). Solunum yetersizliği ve pnömoni ile sıklıkla erken dönemde
kaybedilir. Otozomal resesif geçişlidir. Kostaların posterior füzyonu ve torasik
vertebranın kısalığı nedeni ilePA Akciğer grafide yengeç benzeri görüntü
oluşturur(22).
KAYNAKLAR
1.Waters PM et al. Scoliosis in children with pectus excavatum and pectus carinatum.
J pediatr Ortop 9:551,1989
2.Robert C, Shamberger Chest wall deformites , General Thoracic Surgery , Williams
& Wilkins 1994, p 529-557.
3.Lester CW: Pigeon breast (pectus cainatum) and other protrusion deformites of the
chest of developmental origin. Ann Surg1953: 137: 482,
128
4. Hecker WC, Procher G, Dietz HG: Results of operative correction of pigeon and
funnel chest following a modified procedure of Ravitch and haller. Z Kinderchir
1981:34:320.
5Akçalı Y. Et al: Congenital deformities of the anterior chest wall Erciyes Tıp Dergisi
15: 152-159, 1993.
6.Juro Wada, MD, FACS and Wolfgong R, Ade, MDPectus excavatum, pectus
carinatum and isolated defec of the Rib Cage Pediatric Thoracic Surgery 1991 by
elsevier science publishing Co.Inc. pg 219-231.
7.Nuss D, Kelly RE Jr, Croitoru DP, Katz ME. A 10-year review of a minimally
invasive technique for the correction of pectus excavatum. J Pediatr Surg
1998;33:545–552Croitoru DP, Kelly RE Jr, Goretsky MJ,
8.Lawson ML, Swoveland B, Nuss D. Experience and modification update for the
minimally invasive Nuss technique for pectus excavatum repair in 303 patients. J
Pediatr Surg 2002;37:437–445.
9.Coln D, Gunning T, Ramsay M, Swygert T, Vera R. Early experience with the Nuss
minimally invasive correction of pectus excavatum in adults. World J Surg
2002;26:1217–1221.
10.Park HJ, Lee SY, Lee CS. Complications associated with the Nuss procedure:
analysis of risk factors and suggested measures for prevention of complications. J
Pediatr Surg 2004;39:391–395.
11.Krasopoulos G, Dusmet M, Ladas G, Goldstraw P. Nuss procedure improves the
quality of life in young male adults with pectus excavatum deformity. Eur J
Cardiothorac Surg 2006;29:1–5.
12.Howard R: Pigeon chest (protusion deformity of the sternum). Med J Aust
1958:2;664.
13.Welch KL, Vos A:Sugical correction of pectus carinatum(pigeon breast) J Pediatr
Surg 1973:8.659.
14.Chin EF:Surgery of funnel chest and congenital sternal prominence. Br. J Surg
1957:44:360.
15. Brodkin HA: Pigeon breast: Congenital chondrosternal prominence. Arch
Surg1958: 77:261
16.Coelho MS, Stori WS, Pizarro LDV. Pectus Excavatum / Pectus Carinatum:
Tratamento Cirúrgico.Rev Col Bras Cir. 2003; 30(4):249-261.
129
17.Attila K. Initial results with minimally invasive repair of pectus carinatum. J Thorac
Cardiovasc Surg 2009; Copyright 2009 by The American Association for Thoracic
Surgery.
18. Sunghoon K, Olajire I. Minimally invasive thoracoscopic repair of unilateral pectus
carinatumJPedSur200944,471–474.
19.Bouvet JP Vasculer orjin of Poland sendrom?A comprativerheographic study of
thevascularisation of the arms in egiht patients Eur j pediatr 1978:128;17.
20.Maier HC, Bartone F. Complete failure of sternal fusion with herniation of
pericardium. J Thorac surg1949:5;170.
21.Wieting:Eine operative behandelte herzmisbuilding. Dthch Z Chirg 1912:114:293
22. Jarcho S, Levin PM. Hereditary malformation of the vertebral bodies. Bull johns
Hopkins Hosp. 1938:62:216.
130
12.
Prof. Dr. Mustafa Yüksel
Marmara Üniversitesi Hastanesi Göğüs Cerrahisi Anabilim Dalı
GÖĞÜS DUVARI DEFORMİTELERİNDE FARKLI CERRAHİ YAKLAŞIMLAR ve
ENDİKASYONLARI
Doğumsal göğüs duvarı deformiteleri beş kategoriye ayrılır:
1. Pektus Ekskavatum
2. Pektus Karinatum
3. Poland Sendromu
4. Sternal Defektler
5. Diğerleri (Vertebra ve Kosta anomalileri, asfiksik torasik distrofi-Jeune
Hastalığı ve Kosta displazisi)
PEKTUS EKSKAVATUM
Sternum ve kostal kartilajların değişik derecelerde depresyonu ile karakterize bir
anterior göğüs duvarı deformitesidir ve göğüs duvarının en sık rastlanan anomalisidir.
Deformite doğuştan sonra ya da bir yıl içerisinde ortaya çıkar ve ilerlemeye eğilim
gösterir. Genellikle 7 – 9 yaşlarında stabil hale gelir. Olguların büyük çoğunluğunda
çöküntü, manubriyo-gladioler kavşaktan başlar, ksifoid seviyesinde maksimum
derinliğe ulaşır. Birinci ve ikinci kostaların çöküntüye katılmaları nadirdir. Deformite
simetrik ya da asimetrik olabilir. Asimetrik olanlarda çöküntü daha çok sağ
hemitoraksta belirgindir ve sternumun uzun ekseni etrafında sağa rotasyonu olaya
eklenir. Pektus ekskavatumlu çocukların karakteristik fizik görünüşü vardır; dar ince
göğüs, dorsal lordoz, “kanca omuz” deformitesi, dışa dönük kostalar ve zayıf postür.
Etiyoloji ve İnsidans
Canlı doğumlarda 1/400 oranında görülür. Erkeklerde daha sıktır (E/K:4/1). Her ne
kadar sternum çöküklüğü kostal kıkırdakların fazla büyümesinden oluşsa da, pektus
deformitelerinin etiyolojisi bilinmemektedir. Artmış bir ailesel insidans söz konusudur.
Göğüs duvarı deformitesi olanların %37’sinde aile öyküsü bildirilmiştir.
Semptomlar
Bebeklik ve çocuklukta iyi tolere edilir. Semptomlar deformitenin derecesi ile ilgilidir.
Hafif çöküntülerde hiçbir semptom görülmeyebilir. Orta ve şiddetli deformitelerde
eforla gelen prekordial ağrı, palpitasyon, dispne, hareket kısıtlılığı sık görülen
131
semptomlardır. Bu hastalarda mitral kapak prolapsusu (MVP) veya atrial aritmi
olabilir.
Cerrahi Düzeltme
Pektus ekskavatumda ameliyat endikasyonları iki gruba ayrılır;
1. Fonksiyonel bozukluklar
I.
Pulmoner
II.
Kardiyak
III.
Postural-ortopedik
2. Psikososyal ve estetik nedenler
Fonksiyonel bozukluğu olan olgular 5-6 yaş civarında ameliyat edilirler. Bu yaş grubu,
deformitenin progresyonunun durmuş ya da durmaya yakın olduğu ve ilkokul öncesi
çağdır. Ancak, deformite çok şiddetli, çocuğun bedensel gelişimini engelleyecek
düzeyde ise daha erken yaşta, bebeklik çağında ameliyat edilir. Deformitenin
progresyonu halinde, nüks oluştuğu zaman ikinci bir düzeltme 6-7 yaş civarında
uygulanır.
Pektus ekskavatum olgularının ikinci cerrahi endikasyonunu psikososyal ve estetik
endikasyon oluşturmaktadır.
Cerrahi düzeltmenin amacı akciğer ve kalp üzerindeki baskıyı kaldırmak, toraksın
gelişimine olanak sağlamak ve psikolojik iyileştirme sağlamaktır. Bu amaçla pek çok
ameliyat yöntemi önerilmiş ve uygulanmıştır.
Bu yöntemlerin başlıcaları;
1.Ravitch operasyonu: 1949’da Ravitch perikondriyum ile tüm deforme kıkırdakların
eksizyonu, ksifoid ve interkostal paketin sternumdan ayrıştırılması ve transvers
sternal osteotomi ile sternum’un doğru pozisyonda tutulması tekniğini bildirmiştir.
Kirschner tellerini fiksasyon amaçlı kullanmış ve daha sonra bunun yerini ipek sütür
fiksasyonu almıştır.
2.Sternal turnover metodu: Fransız cerrahlar tarafından ortaya konan bir metoddur.
Sternum mobilize edilir ve kostal kartilajlar bölünür, böylece sternum 180º döndürülür.
Bu yaklaşım radikal bir yaklaşımdır ve enfeksiyon oluştuğunda majör komplikasyonlar
ile karşılaşılır.
3.Silastik kalıpların cilt altına yerleştirilmesi (Allen ve Douglas): Bu teknik ile her ne
kadar deformite ortadan kaldırılsa da toraks hacmi arttırılamamaktadır.
4.Minimal invazif pektus cerrahisi (Nuss prosedürü): Vasküler klemp veya Lorenz
pektus introdüsürü gibi uzun bir enstrüman, pektus deformitesinde uygun bir sağ
132
interkostal boşluktan sokulur, bu yer sternumun en deprese yerine karşılık gelen hat
ile aynı çizgide olmalıdır. Videoskopik yardım ile klemp veya introdüsür sternum
altında ön mediyastinal yapıların üzerinden ilerletilir. Enstrüman sternum altından
geçtikten sonra, sol taraftaki pektus deformitesi üzerindeki interkostal aralığa yapılan
bir insizyondan dışarı çıkartılır. Klemp veya introdüsür kullanılarak; ekstrafor,
tünelden geçirilir. Daha önce hazırlanmış pektus barı ekstrafor yardımı ile tünelden
geçirilir ve daha sonra rotasyonel enstrüman ile , bar konkav yüzü arkaya
(mediyastene) ve konveks tarafı ise öne gelecek şekilde çevrilir. Barın uçları cilt
altına kas fasyasının önüne yerleştirilir (Şekil 1).
Şekil 12.1. Minimal invazif pektus cerrahisi (Nuss prosedürü)
Pektus Karinatum
Toraks ön duvarının çıkıntısı şeklindedir. Pektus ekskavatuma göre 8 defa daha az
görülür. Çeşitli serilere göre tüm toraks deformitelerinin %6-16’sını oluşturur. Pektus
karinatumun da nedeni belli değildir. Doğumdan hemen sonra ya da 10 yaşından
sonra ortaya çıkabilir. Olguların %25’inde ailevi insidans vardır. Daha çok erkek
çocuklarda görülür %75-80. Olguların %35’inde iskelet sistemine ait başka bir
anomali eşlik edebilir. Bunların ensık görüleni skolyoz ve vertebra anomalileridir.
Olguların %18’inde konjenital kalp hastalığı bulunmuştur.
Pektus karinatum üç kategoriye ayrılmıştır.
1. Kondrogladiolar
I.
Simetrik
II.
Asimetrik
133
Brodkin ilk kez tanımlamıştır. Strernum korpusunun anterior çıkıklığıdır, alt kostal
kartilajların simetrik çıkıntısı deformiteye eşlik eder. Simetrik form daha sık
görülürken, kostal kartilajların bir taraftan öne yer değiştirip, karşı tarafta normal
kıkırdakların görüldüğü asimetrik forma daha az rastlanır.
2. Mikst
Karinatum ve ekskavatum deformitelerinin birlikte görüldüğü bu tipte bir tarafta
karinatum deformitesi, diğer tarafta ise sternal rotasyon ile birlikte olan depresyon ya
da ekskavatum deformitesi bulunur.
3. Kondromanubrial
Nadir görülür, güvercin göğüs deformitesi olarak adlandırılır. Manubrium, 2. ve 3.
Kostal kartilajın çıkıntısı ile sternum korpusunun göreceli basıklığından oluşur.
Cerrahi Düzeltme
1.Ravitch operasyonu: Multipl kostal kartilaj rezeksiyonu ve çift sternal osteotomi
uygulamıştır.
2.Lester metodu: İki metod önermiştir. İlk yaklaşım, sternumun ön kısmının
rezeksiyonu fazla kan kaybı ve tatmin etmeyen sonuçları nedeni ile terk edilmiştir.
İkinci metod, tüm sternumun subperiostal rezeksiyonudur.
3.Chin ve Brodkin “ksifosternopeksi” tekniği: Ksifoid kesilip, sternumun daha üst
ucundan rektus kasına bağlanmıştır
4.Howard metodu: Bu metodu subperikondriyal kostal kartilaj rezeksiyonu ve sternal
osteotomi ile birleştirerek uygulamıştır.
5.Robicsek yöntemi: Kostal kartilajın subperikondriyal rezeksiyonu, transvers sternal
osteotomi ve ileri çıkık olan sternum alt ucunun rezeksiyonunu tanımlamıştır.
6.Minimal invazif pektus cerrahisi (Abramson prosedürü): Nuss prosedürünün tersine
burada çelik barlar sternumun önüne yerleştirilir.
Poland Sendromu
1841’de Alfred Poland pektoral majör ve minör kas yoksunluğu ve sindaktili ile
karakterize bir vaka bildirmiştir. 1962’den beri bu hastalar Poland Sendromu olarak
adlandırılmıştır.
Günümüzde Poland sendromunun majör komponentleri:
1. M.pektoralis majör agenezisi,
2. M.pektoralis minör agenezisi ya da hipogenezisi,
134
3. Meme agenezisi ya da hipogenezisi (%25-61),
4. El anomalisi (sindaktili, brakidaktili, brakisindaktili, akromeli %23-56).
Poland sendromunun minör bulguları:
1. Derialtı dokusu hipoplazisi,
2. 2 – 5. Kosta kartilaj agenezisi,
3. Göğüs ve koltukaltı kıllarında azlık,
4. Skapula deformitesi (sıklıkla skapula alata)
Poland sendromu sporadiktir ve 30-32 bin doğumda bir görülür. Etiyolojisi
bilinmemektedir. Ailesel görülüş nadirdir. Sindaktili 2000 doğumda bir görülür,
bunların %13,5’inde, aynı tarafta toraks deformitesi vardır.
Cerrahi Düzeltme
Optimal toraks rekonstrüksiyonu için çeşitli eşlik eden kas-iskelet anomalilerinin
bilinmesi gerekmektedir. Deformitede sadece sınırlı ve küçük bir fonksiyon kaybı
mevcutsa kozmetik amaçlı rekonstrüksiyon dışında cerrahi gerekli değildir.
Sternal Defektler
Sternum, fetal hayatın 5. haftasına kadar, orta hattın iki tarafında kartilaj içeren
mezodermal bant halindedir. İkinci ayda bu iki bant öne doğru hareket ederek birleşir
ve yaklaşık 5-6. ayda kemikleşerek toraksın kemik yapısında çok önemli yeri olan
sternumu oluşturur. Fetal hayatın 6. haftasından itibaren oluşacak bir gelişim
bozukluğu sternal defektlere neden olur. Bozukluğun derecesine bağlı olarak
sternum yarığı parsiyel ya da total olabilir, derinin de bulunmadığı durumlarda kalp
dışarıdadır (ektopia kordis).
Sternal Defektler:
1. Kleft sternum (Yarık sternum)
I.
Parsiyel
II.
Komplet
III.
Vasküler displazi ile birlikte
2. Ektopia kordis
I.
Servikal
II.
Torasik
3. Cantrell pentalojisi (torakoabdominal ektopia kordis)
135
Cerrahi Düzeltme
Kleft sternumda düzeltme, yenidoğan periyodunda yapılmalıdır. Derinin bozuk olduğu
olgular hemen ameliyat edilmelidir.
Ektopia kordiste cerrahi düzeltmeler yüksek mortaliteye sahiptir. Lezyonun gebelik
sırasında yapılan ultrasonografik incelemelerde tespit edilip, gebeliğe son verilmesi
en uygun yöntem gibi görünmektedir.
Cantrell pentalojisi aşağıdaki defektlerden oluşmaktadır:
1. Distal sternal kleft
2. Ventral diafragma defekti
3. Omfalosel ya da omfalosele benzeyen ve ventral abdominal defekt,
evantrasyon
4. Perikardiyal defekt ve perikardiyo-peritoneal serbest ilişki
5. Kardiyak anomali (ventriküler divertikül, VSD, Fallot gibi)
Cerrahi düzeltme tüm bu defektlere yöneliktir.
Diğerleri
Jeune hastalığı (asfiksik torasik distrofi), Jarcho-Levin sendromu (spondilo torasik
displazi) gibi diffüz iskelet sistemini tutan hastalıklarda da toraks deformiteleri görülür.
Ancak bunların cerrahi açıdan düzeltilmeleri söz konusu değildir.
KAYNAKLAR
1. Yüksel M, Yıldızeli B. Göğüs Duvarı Deformiteleri. In Yüksel M, Kalaycı G.
Göğüs Cerrahisi; 2001:559-580.
2. Yavuzer Ş. Toraks Deformiteleri. Ankara: Ankara Üniversitesi Basımevi;
2008:3-64
3. Yüksel M, Batırel HF, Yıldızeli B, Bostancı K. Congenital Deformities of Chest
Wall. In Yüksel M, Batırel HF, Yıldızeli B, Bostancı K. Lectures on General
Thoracıc Surgery, 4th ed. İstanbul: Naviga Bilimsel Yayınları; 2009:22-24
4. Donald Nuss, Robert E. Kelly, Jr, Daniel P Croitoru, Michael E. Katz. A 10 -
Year Review of a Minimally Invasive Technique for the Correction of Pectus
Excavatum. Journal of Pediatric Surgery 1988; Vol33; No 4 (April): 545-552
136
13.
Prof. Dr. Sedat Gürkök ve Prof. Dr. Onur Genç
GATA Göğüs Cerrahisi Anabilim Dalı Ankara
GÖĞÜS DUVARI TÜMÖRLERİ
Primer göğüs duvarı tümörlerinin görülme oranı %1-2’dir ve vücuttaki diğer primer
tümörlerle kıyaslandığında nadir olarak görülürler (1,2).
Göğüs duvarı anatomik yapı olarak; kas, kemik, yağ, fibröz konnektif doku, sinirler,
meme dokusu, kan ve lenfatik damarlardan oluşmaktadır (3). Bu sebepten dolayı
tümörler, sayılan bu anatomik yapılardan herhangi birinden kaynaklanabilir. Primer
göğüs duvarı tümörleri kemik ve yumuşak doku kaynaklı olurlar, histopatolojik olarak
benign ve malign karakter gösterirler.
Bunun yanında göğüs kafesi kökenli tümörlerin direk göğüs duvarına invazyonu,
diğer organ tümörlerinin uzak metastazı şeklinde sekonder tümörlerde görülür.
Göğüs duvarı primer tümörlerinin çoğu yumuşak doku kökenli tümörlerdir. Tüm göğüs
duvarı tümörleri göz önüne alındığında 2/3 kadarı yumuşak doku kökenlidir (4).
Ancak genel itibarı ile birçok yayında bu oran birbirine çok yakındır (5,6).
Primer göğüs duvarı tümörlerinin yaklaşık 2/3’ü maligndir. Malign neoplazmlar kemik
tümörlerden daha çok yumuşak doku tümörlerinden oluşur. Göğüs duvarı tümörleri
çoğunlukla yumuşak dokusu kaynaklıdır ve yumuşak doku tümörlerinde kemik
kökenli tümörler göre malignite oranları daha fazladır (1,2).
Göğüs Duvarı Tümörlerinin Sınıflandırması
A. Primer malign tümörler
Kemik ve Kıkırdak Kökenli
Kondrosarkoma
Osteosarkoma
Ewing sarkoma
Soliter plasmasitoma
Lemfoma
Askin tümör
137
Yumuşak Doku Kökenli
Malign melanoma
Malign fibröz histiyositoma
Leiomyosarkoma
Liposarkoma
Nörofibrosarkoma
Nöroblastoma
Ganglionöroblastoma
Rabdomyosarkoma
Desmoid (low-grade fibrosarkoma)
Hemanjiyoperisitoma
Lemfanjiyosarkoma
B. Primer benign tümörler
Kemik ve Kıkırdak Kökenli
Osteokondroma
Kondroma
Fibröz displazi
Eozinofilik granüloma
Anevrizmal kemik kisti
Dev hücreli tümör
Kondroblastoma
Osteoblastoma
Yumuşak Doku Kökenli
Lipoma
Fibroma
Nörofibroma
Lemfanjioma
Hemanjioma
Nörilemmoma
Ganglionöroma
Kemodektoma
Feokromasitoma
Dermatofibrosarkoma protuberens
Desmoid tümör
138
Semptomatoloji
Göğüs duvarı tümörleri genellikle yavaş büyüyen tümörlerdir. Primer göğüs duvarı
tümörleri genellikle 40 yaş üstü hastalarda malign karakterde olurken gençlerde
benign karakter gösterirler. Erkeklerde kadınlara göre iki kat daha fazla primer göğüs
duvarı tümörü saptanır. Tümörün erken dönemlerinde hastalar asemptomatiktir,
ancak tümörün lokalizasyonuna ve yayılımına göre malign tümörlerin tamamına
yakınında ve benign tümörlerin %25’inde ilerleyen zamanlarda ağrı yakınması
gözlenir. Ağrı, genellikle yumuşak doku tümörlerinde kemik ve kıkırdak kökenli
tümörlere göre daha sık rastlanır. Bunun yanında, kilo kaybı, ateş, lökositoz, eozinofili
veya brakial pleksus nöropatisi izlenebilir.
Tanı
Ayrıntılı anamnez ve fizik muayene çok önemlidir. Bazı tümörlerde sadece fizik
muayene ile tanıya gidilebilir (hemanjiom gibi), ancak çoğu tümörlerde ileri tetkikler
gereklidir. Direk grafiler ve bilgisayarlı tomografi tümörün yapısı ve çevresel yayılımı
hakkında bilgi verir. Özellikle eski grafiler lezyonun progresyonunu değerlendirmede
faydalıdır. Bilgisayarlı tomografi yumuşak dokular, plevral, mediastinal ve pulmoner
tutulumun değerlendirilmesinde yararlıdır.
Manyetik rezonans görüntüleme tetkiki damar ve sinirlerin tümörden ayrılmasında
yardımcı olur. Göğüs duvarı tümörlerinde genellikle büyük tümörlerde insizyonel,
küçük tümörlerde eksizyonel biyopsi ile tanı konulması gereklidir. Primer tedavileri
cerrahi olmayan bazı tümörlerde (Ewing sarkomu, plazmositom, embriyonel
radyomyosarkom, v.b.) amaç tanıyı koymaktır. Bu sebepten dolayı öncelik insizyonel
biyopsi olmalıdır (5). İnce iğne aspirasyon biyopsisi tanı için diğer teknik olabilir,
ancak primeri bilinen bir malignitesi olanlarda tercih edilmelidir.
Cavanaugh ve ark. göğüs duvarı tümörlerinde tanı ve tedavi planı için sınırlı
insizyonel biyopsi önermişlerdir (7). Yaptıkları çalışmada insizyonel biyopsi
uyguladıkları olguların %73’ünde lezyonun benign olduğunu ve ek cerrahi tedavi
gerekmediğini saptamışlardır. Buna karşılık birçok seride malignite oranı %50–80
olarak saptanmış ve en-bloc rezeksiyon yapılmıştır. Kemik tümörlerinde frozen kesiti
çalışılamadığından ameliyat sırasında tanı konulamamaktadır. Eğer uzun takip
sonucunda hücre tipi malign ise ve cerrahi sınırda tümör saptanırsa hasta yeniden
opere edilerek rezeksiyon sınırı genişletilir (8).
139
Göğüs duvarı ultrasonu tümörün plevra ve akciğer parankimi ile olan ilişkisinin
belirlenmesinde yardımcıdır. Malign kemik tümörlerinde kemik yapıların olası
tutulumu kemik sintigrafisi ile değerlendirilmelidir (2).
Göğüs Duvarının Yumuşak Doku Kökenli Primer Benign Tümörleri
Nörilemmoma (Schwannoma)
Sinir kılıfı tümörleri Schwann hücrelerinden köken alır ve genel populasyondaki sıklığı
0.3-0.5/100.000 şeklindedir. En sık 30 ila 50’li yaşlarda görülürler (9). Cinsiyet
farklılığı görülmemekle birlikte değişik serilerde; kadınlarda, erkeklerden biraz daha
fazla görüldüğü bildirilmiştir (11–14). %90’dan fazlası benign karakterlidir. Yavaş
büyüyen tümörlerdir. Semptomların başlaması ile tanı konması arasında iki-üç yıl
vardır.
Sinir kökenli tümörler içinde en sık rastlanan (%60) tümördür. Sinir kılıfından köken
alan benign karakterli tümördür. Bu tümörlerin büyük çoğunluğunu benign
schwannomalar ile nörofibromlar oluşturmaktadır. Nörilemmoma benign karakterde
iyi sınırlı; kapsüllü; yavaş büyüyen nörojenik tümörlerdendir (15). Perinöral Schwann
hücrelerinden köken aldığı için Schwannoma adı da kullanılır. Genellikle posterior
mediasten yerleşimli oluşurlar. Ancak toraks içinde her yerde bulunabilirler.
Nörofibromalar ise homojen, iyi sınırlı fakat kapsülsüz yapıda, periferik sinir
hücrelerinin tüm elemanlarından köken alırlar. Olguların %10’nunda jeneralize
nörofibromatosis (von Recklinghausen hastalığı) vardır. Bu olgularda malign
dejenerasyonu soliter olanlara göre 4 kat daha fazladır. Schwannomada ise malign
dejenerasyon çok nadirdir. Hem Schwannoma hem de nörofibromada prognoz çok
iyidir, yeterli cerrahi eksizyon ile tam kür sağlanabilir (16).
Ganglionöroma
Olgunlaşmış ganglion hücrelerinden köken alırlar. Genellikle solid yapıda homojen ve
kapsüllü tümörlerdir. Çoğu asemptomatik olup benign karakterlidir. Çoğunlukla büyük
çocuklarda, adolesanlarda ve genç erişkinlerde görülür. Sıklıkla paravertebral alan
yerleşimlidir, ancak vücudun her yerinde görülebilir. Prognozu çok iyidir, komplet
cerrahi eksizyonla kür sağlanabilir (17).
140
Kemodektoma / Feokromasitoma
Paraganglionik sistemin kimyasal olarak aktif veya inaktif, benign veya malign
olabilen tümörleridir. Kimyasal olarak inaktif olanlarına kemodektoma, aktif olanlarına
ise feokromositoma adı verilir. Çok nadir görülürler. Benign olanları asemptomatiktir
ve paravertebral sulkus veya visseral alanlarda yerleşir. Histolojik olarak malign ve
benign ayırımını yapmak çok zordur. Benign olanlarda malign dejenerasyon riski
vardır. Olguların ancak %10’u malign potansiyel gösterir (18). Eğer mümkünse geniş
cerrahi rezeksiyon önerilmektedir. Vaskülaritesi bol olduğu için kanama riski vardır
cerrahi sırasında dikkatli olunmalıdır.
Feokromositoma; katekolamin salınımına yol açarak paroksismal hipertansiyona
sebep olan adrenal medülla tümörüdür. Adrenal medulla dışında oluşan bu tür
kromaffin hücre tümörlerine ekstraadrenal feokromositoma veya paraganglioma
denir. Ekstraadrenal feokromositomalar karotis cisimciği tümörü, aortik cisimcik
tümörü, glomus jugulare tümörü, kemodektoma gibi özel isimler alırlar. Hem adrenal
hem de ekstraadrenal feokromositomalar (paraganglioma) aynı klinik tabloyu
gösterirler. Feokromositomaların % 90’ı sporadik olup % 10’u herediterdir. Bütün
feokromasitomaların
%
10-12’si
maligndir.
Familyal
geçiş
gösteren
feokromositomalar genellikle bilateral ve adrenal hiperplazi şeklindedir. Familyal
vakalar çok çeşitli sendromların bir komponenti olarak bulunur. Başlıcaları; Multipl
Endokrin Neoplazi (MEN) tip 2a ve 2b, von Hippel-Lindau, Sturge-Weber sendromları
ve Nörofibromatozis tip I’dir. Feokromositomalar nadir rastlanan tümörler olup bütün
hipertansiyon sebeplerinin % 0,1’ini oluşturur. Ancak tedavi ile hipertansiyonun
düzelmesi açısından önemlidir. Katekolamin salgılayan tümörler her iki cinste de aynı
sıklıkta rastlanır. Çocukluktan yetmişli yaşlara kadar görülebilen tümörlerdir, üçüncü
ve dördüncü dekatlarda daha sıktır.
Genellikle paravertebral sulkus yerleşimlidir. Değişik kombinasyon veya şekillerde
hipertansiyon, hipermetabolizma ve diyabet olabilir. Aktif feokromositoma adrenalin
ve noradrenalin salınımı yapar. İdrardaki vanil mandelik asit (VMA) miktarı ile tanı
konulabilir. Nadir olsada Cushing sendromu, polisitemi, hiperkalsemi ve diyare gibi
klinik bulgularda beraber olabilir. Eğer lezyon benign karakterde ise cerrahi
eksizyonla prognoz çok iyidir, ancak malign lezyonlarda prognoz kötüdür (19).
141
Dermatofibrosarkoma Protuberens
Genellikle bayanlarda sırt bölgesinde skapula altında sık gözlenir. Subkutan dokunun
yıllar içerisinde yavaş büyüyen, ağrısız, lokal agresivitesi yüksek, nadir fibröz bir
tümörüdür. Gövdede sert solid nodüller meydana getirirler. Lokal rekürrens sıktır
ancak metastaz nadirdir. En önemli prognostik faktör yeterli rezeksiyondur.
Desmoid Tümör
Desmoid tümör göğüs duvarının ender rastlanan fibromatöz tümörüdür. Desmoid
tümörler köken aldıkları dokuya göre yüzeyel (fasyadan kaynaklanan) ve derin
(musküloaponevrotik) olmak üzere başlıca iki gruba ayrılır. Yüzeyel olanlar yavaş
büyür, küçük boyuttadır ve derin dokulara nadiren ilerler. Derin olanlar ise hızlı büyür
ve geniş boyuta ulaşabilir. Agresif seyirlidirler ve daha sık lokal nükse yol açarlar.
Derin fibromatozisler abdominal (pelvik, mezenterik) ve abdomen dışında yerleşim
gösterirler. Abdomen dışında yerleşen desmoid tümör en sık omuz bölgesi olmak
üzere, uyluk ve toraks duvarında da sıklıkla görülür. Çok merkezli bir çalışmada
omuzda %22,1, toraks duvarı ve sırtta %17,2, uylukta %12,5, boyunda %7,6, üst
ektremitede %5,7 oranında yerleşim gösterdiği bildirilmektedir. Toraks duvarı
kaynaklı agresif fibromatozis olgularının yanı sıra, intratorasik ekstrapulmoner ve
intratorasik mediastinal yerleşimli, çok az sayıda olgu da literatürde bildirilmektedir
(20,21–24).
Patogenez net değildir, travma en önemli faktördür, ayrıca künt incinmeler,
laserasyon, cerrahi insizyon ve intramuskuler enjeksiyonlar sorumlu tutulmaktadır
(25). Torasik desmoid tümörleri mastektomi sonrasında, memeye silikon protez
implantasyonundan, koroner arter cerrahisinden, kot kırıklarından ve torakotomiden
sonra görülmektedir. Endokrin nedenlerden oluştuğu düşünülmektedir. Östrojen
desmoid tümörlerin büyümesine yol açmaktadır (26).
Etyolojide travma, ailevi yatkınlık, hormonlar sorumlu tutulsa da kanıtlanmış değildir.
Ailevi yatkınlık %1–3 olarak bildirilmektedir. Gardner Sendromu (yumuşak doku
fibromu, polipozis koli, kemik doku tümörü) ile birlikte olan olgular rapor edilmiştir
(21,24,27).
Lezyon puberte sonrası ve 40 yaşın altındaki hastalarda görülür ve 25–35 yaşlarında
doruğa ulaşır. Çocukluk çağında ve ileri yaşlarda oldukça az görülür. Klasik
kitaplarda kadın/erkek oranı 1 olsa da literatür bunu desteklemez (21). Kadınlarda
daha fazla görüldüğü savunulmaktadır.
142
Desmoid tümörler rezeksiyon sonrasında rekürens ve lokal invazyonlarla seyreder,
fakat uzak metastaz yaptığı bildirilmemiştir (28).
Desmoid tümör palbabl kitle ve ağrı ile kendini gösterir. Noninflamatuardır, etraf
oluşumlara yaptığı bası nedeniyle semptom vermektedir. Sinirlerin tutulması ile motor
ve sensoryal şikayetlere neden olur. Sinir tutulumunun artması ile ağrı şiddetinde ve
yaygınlığında artma meydana gelir (29). Sıklıkla direk akciğer grafisi ile kitlenin varlığı
tespit edilir. Kemik tutulumu direk grafide tesbit edilebilir. Toraks bilgisayarlı
tomografisi ile kitlenin büyüklüğü, lokalizasyonu daha ayrıntılı gösterilmektedir.
Manyetik rezonans görüntüleri, lokal rekürensin ve yumuşak doku infiltrasyonlarının
tespitinde daha hasssastır. En sık %47 ile anterior göğüs duvarında izlenmektedir,
posteriorda %32 ve lateral duvarda %11 oranında yerleşmektedir. Sol hemitoraks
sağa göre daha sık tutulmaktadır. İntratorasik desmoid tümörler büyük boyutlara
ulaşabilir, %22’si 10 cm’in üstündedir (30). Kesin tanı histopatolojik inceleme ile
konulmaktadır. İnce iğne aspirasyon biyopsisi yeterli olmayabilir, çünkü desmoid
tümör
relatif
hiposelülerdir.
Ayırıcı
tanıda,
nörofibromatozis,
ganglionöroma,
fibrosarkom, fibröz psödotümör, plevranın lokal fibröz tümörü ve akciğer kanseri
düşünülmelidir.
En iyi tedavi seçeneği cerrahidir. Cerrahi sınırın negatifliği ve geniş rezeksiyon sınırı,
nüks oranını azaltır. Otuz yaş altında ve 10 cm’in üstündeki kitlelerde nüks daha fazla
görülmektedir. İntratorasik desmoid tümörlerde lokalizasyon nedeni ile her zaman
komplet cerrahi mümkün olmayabilir. Komplet olmayan cerrahilerden sonra, geniş
tümörlerde, nükslerde ve inoperabl tümörlerde radyoterapi tedavi seçenekleri
arasındadır (28).
Göğüs Duvarının Yumuşak Doku Kökenli Primer Malign Tümörleri
Malign fibröz histiositoma
Yetişkinlerde en fazla görülen yumuşak doku sarkomudur. Sıklıkla göğüs duvarı
kaslarından, nadiren akciğer, mediasten ve plevradan köken alırlar (31). Tümör
genellikle ileri yaşlarda görülür, özellikle 50 ile 70 yaşlar arasında sıktır. Çocuklarda
nadirdir ve 2/3 oranında erkeklerde daha sık izlenir. Genellikle ağrısız yavaş büyüyen
kitle şeklinde ortaya çıkar. Radyolojik olarak karakteristik bir özelliği olmayan iyi
sınırlı, düzgün veya lobüle kenarlı, yumuşak doku kitleleri şeklinde görülürler. Nadiren
143
nötropeni, eozinofili, ateş veya lökositoz görülebilir. Kas lifleri arasında ve fasya
planlarında yayılma eğilimindedir.
Radyoterapi ve kemoterapiye cevap vermez. Tedavisi geniş cerrahi eksizyondur.
Lokal nüks oranı yüksektir.
Liposarkom
Yumuşak doku sarkomları arasında malign fibröz histiyositomadan sonra ikinci
sıklıkta görülen liposarkom, yumuşak doku sarkomlarının % 20’sini oluşturur (32).
Göğüs duvarı primer yumuşak doku tümörlerinin ise %15’ini oluşturur. Liposarkom,
lipoblast adı verilen yağ dokusu hücrelerinden veya daha sık olarak primitif
mezenkimal
hücrelerden
gelişir
(32,33).
En
sık
retroperitoneal
bölgede,
ekstremitelerde, intramusküler fasya ve derin dokularda, daha seyrek olarak da
inguinal, paratestiküler bölge, göğüs duvarı, meme ve omentumda yerleşirler (32).
Genellikle derin yumuşak dokulardan köken alan liposarkomlar çok nadiren torasik
yerleşim gösterirler. Yavaş gelişip, büyük kitleler oluşturabilirler. Radyolojik olarak
sınırları belirgin olmayan ve genellikle kemiği destrükte eden kitleler şeklinde
görülürler. Tedavide komplet eksizyon uygulanmalıdır. Lokal rekürrens %33 olarak
saptanmıştır. İnvazyon gözlenen ya da inkomplet eksizyon uygulanan olgularda ise
adjuvan radyoterapinin yararlı olduğu bildirilmiştir (34). Beş yıllık sağ kalımı %83
olarak saptanmıştır.
Rabdomyosarkom
Rabdomyosarkom embriyonal mezenkimden kaynaklanan ve çizgili kasa farklılaşma
potansiyeli gösteren malign bir tümördür. Rabdomiyosarkom çocuklarda en sık
görülen yumuşak doku sarkomudur; çocukluk çağı yumuşak doku sarkomlarının
yarıdan fazlasını oluşturur. Erkeklerde, kız çocuklardan biraz daha fazla görülür (35–
37). Kesin tanı tümör dokusunun histopatolojik incelenmesi ile konur.
Toraksta herhangi bir yerden kaynaklanabilir, gelişimi için çizgili kas dokusunun
varlığı şart değildir (31,38). Göğüs duvarı rabdomyosarkomları, Ewing sarkomu ve
primitif nöroektodermal tümörden farklı olarak genellikle kosta invazyonu göstermez.
Klinik olarak sessiz kalabilirler. Bu yüzden saptandıklarında göğüs duvarı kaynaklı
olanlar başta olmak üzere, büyük boyutlara ulaşabilirler (31,38). Kitle içinde nekroz
ve kistik alanlar görülebilir. Komşu damarlara ve bronşların içine doğru uzanım ve
invazyon gösterebilirler. Tedavisi cerrahidir. Cerrahi tedavide amaç tümörün tam
144
olarak çıkarılmasıdır. Ancak bu organ kaybına, kozmetik veya işlevsel bozukluğa yol
açmamalıdır. Bu durumda tümör önce kemoterapi + radyoterapi ile küçültülür, sonra
cerrahi olarak çıkarılır.
Fibrosarkom
Kollajen lifleri üreten bağdoku hücrelerinin (fibroblast) çoğalmasıyla ortaya çıkan
malign tümördür. Vücudun herhangi bir yerinde gelişebilir, ama en sık kol ve
bacakların, başın ve boynun derin dokularında oluşur. Fibrosarkom yavaş büyür ve
rezeksiyon sonrası sık nüks yapar. Uzak organlara ve özellikle akciğerlere metastaz
genellikle seyrektir.
Toraksı
oluşturan
yapılardaki
bağdokusundan
gelişir.
Çocuklarda
ve
genç
erişkinlerde daha sık görülür. Erişkinde genellikle göğüs duvarı ve akciğer
kaynaklıdır. Çocuklarda ana ya da lober bronşlarda lümen içinde kitle şeklinde gelişir
ve tıkanmaya yol açar. Bu nedenle hemen hepsi semptomatiktir (31,39). Radyolojik
bulgular, yerleşim yerine göre değişir. Göğüs duvarından kaynaklananlar büyük
kitleler şeklindedir. Bilgisayarlı tomografide (BT) kalsifikasyon ya da ossifikasyon
odağı görülebilir (31). Tedavi tümörün geniş eksizyonudur. Ancak çok sık nüks yapar.
Nörofibrosarkom
Sinir kılıfının maling tümörüdür. Sıklıkla interkostal sinir uzanımında orta yaşlarda
görülen tümördür. Tümör makroskopik olarak kapsüllüdür. Yarısı von Recklinghausen
hastalığı ile birliktedir. Tedavi geniş eksizyondur.
Leiomyosarkom
Düz kas hücrelerinden köken alan malign tümördür. Erişkin yaşlarda görülen yavaş
büyüyen, sonrasında ağrı semptomları gelişen nadir toraks duvarı sarkomudur. Uzak
organ metastazı, özellikle akciğer ve karaciğer metastazı sık görülür. Makroskopik
olarak lobule, gri beyaz renkli, hemoraji ve nekroz alanları gösteren bir yapıdadır.
Tedavisi geniş eksizyondur. Lokal ve metastatik nüksler görülebilir.
Malign melanoma
Malign melanom, cilt kanserleri arasında en nadir görüleni olmakla birlikte, en
saldırgan tipidir. Her yaşta görülebilmekle birlikte, en sık 40–60 yaşları arasında
görülür. Kadınlarda belden aşağıda, erkeklerde belden yukarıda ve her iki cinste de
145
kollarda görülme sıklığı artmaktadır. Bunun en önemli nedeni olarak güneşte uzun
süre kalma gösterilmektedir. Melanom, derideki melanosit adı verilen hücrelerden
köken alır. Melanositler deriye rengini veren melanin maddesini üretirler.
Malign
melanom
yayılmamışsa
cerrahi
olarak
alınabilir,
eğer
yayılımdan
şüpheleniliyorsa yakınındaki lenf nodlarının da alınması gerekebilir. Yayılım olan
hastalarda ilaç tedavisi ve immünoterapi uygulanabilir.
Nöroblastoma
Nöroblastoma sempatik sinir sisteminden köken alan ve sempatik sinir dokusunun
vücutta bulunduğu her yerde gelişebilen bir tümördür. Genellikle retroperitoneal
yerleşimli olmasına rağmen %10–20 oranında primer olarak mediastende de
görülebilir.
Oldukça invaziv bir tümördür, sıklıkla tanı konulmadan önce metastaz yapar.
Çoğunlukla metastaz yaptığı yerler bölgesel lenf nodları, kemik, beyin, karaciğer ve
akciğerdir. Olguların %75’i dört yaş altı çocuklardır. Hastalar genellikle öksürük,
dispne, disfaji, sırt veya göğüs ağrısı ve sık tekrarlayan akciğer enfeksiyonu
nedeniyle doktora başvururlar (40). Bunların dışında değişik paraneoplastik
sendromlar da tanımlanmıştır. Vazoaktif intestinal polipeptit salınıma bağlı diyare ve
abdominal ağrılar, muhtemel otoimmun mekanizmalara bağlı serebellar ve trunkal
ataksi, aşırı katekolamin salınımına bağlı feokromositoma sendromu bunlardan
bazılarıdır. Tedavi planlaması için evreleme yapılmaktadır.
Buna göre;
Evre I: iyi sınırlı noninvaziv tümör,
Evre II: orta hattı geçmeyen fokal invazyonlu tümör,
Evre III: orta hattın karşısına geçen tümör,
Evre IV: uzak organ metastazı.
Tedavi Evre I’de cerrahi, Evre II’de cerrahi ve radyoterapidir. Daha ileri evrelerde
cerrahi, radyoterapi ve kemoterapiyi içeren multimodal tedaviler önerilmektedir (41).
Ganglionöroblastoma
Ganglionöroblastoma, farklı differansiasyonda histolojik yapı gösteren ganglionöroma
ve nöroblastoma arası bir formdur. Matür ve immatür ganglion hücreleri beraber
bulunduğundan klasifikasyonu oldukça zordur. Karışık ve diffüz olmak üzere iki formu
tanımlanmıştır. Karışık form diffüz tipe göre daha sık metastaz yapar. Diffüz tip daha
146
çok genç hastalarda görülür. Cerrahi, kemoterapi ve radyoterapinin birlikte
kullanıldığı multimodüler yaklaşım uygun tedavi şeklidir (42).
Göğüs Duvarının Kemik Veya Kıkırdak Kökenli Primer Malign Tümörleri
Kondrosarkom
Kıkırdak dokudan köken alan primer malign tümördür. Primer göğüs duvarı tümörleri
içinde en yaygın malign tümör kondrosarkomdur; malign tümörlerin %50’sini ve
primer göğüs duvarı tümörlerinin %25’ini oluşturur (43). Bu tümörlerin %80’i kostada
%20’si sternumda yerleşir. Genellikle göğüs duvarının ön bölümünde görülür ve
%75’i kostokondral arkus veya sternumdan gelişir. Genellikle osteosarkomlara göre
yaşamın daha geç dönemlerinde meydana gelir. Pik insidansı yaşamın 4., 5. ve 6.
dekadlarıdır. Metastazları da geç dönemde ortaya çıktığından dolayı hayatta kalma
süresi daha fazladır. Klinik problem metastatik yayılımdan çok lokal rekürrenstir.
Klinik ve biolojik davranış histolojik derecesine (grade) bağlıdır, bu da anaplazi
derecesiyle orantılıdır. Grade 1 (iyi diferansiye) kondrosarkomlar, minimal anaplazi ve
minimal artmış sellülarite gösteren saf hyalin kıkırdaktan oluşur. Sellülarite ve
anaplazi, kötü diferansiye ya da grade 3 varyantlarda en fazladır. Beş yıllık yaşam
süresi grade 1’de %90, grade 2’de %81 ve grade 3’te %43’tür. Grade 1 ve 2
neoplazmlar kondrosarkomların çoğunluğunu oluşturur ve genellikle metastaz
yapmazlar. Fakat grade 3 neoplazmlar hematojen metastaza eğilim gösterirler (8).
Direkt grafide kosta veya sternumda lobüle olarak meduller kesimde izlenir ve sıklıkla
kortikal kısmı destrükte eder. BT’de tümörde kalsifikasyon izlenebilir (8). BT ile
tümörün yaygınlığı hakkında da fikir verir.
Cerrahi tedavi, tümörün bir alt ve üst kostayla birlikte ve tümörün etrafında 4 cm’lik
cerrahi sınır bırakılarak geniş lokal eksizyonu şeklindedir. Kondrosarkom sıklıkla
kemoterapi
ve
radyoterapiye
dirençlidir.
Prognostik
faktörler
tümör
çapı,
diferansiyasyonu ve lokalizasyonudur. Sternal tümör, <6 cm çap iyi prognostik
faktörlerdir (8). McAfee’nin serisinde 10 yıllık sağ kalım oranları; geniş lokal
eksizyonda %96, lokal eksizyonda %65, palyatif eksizyonda %14’tür (44).
Osteosarkom
Kemik doku kökenli olup göğüs duvarının sık görülen primer malign tümörlerindendir.
Göğüs duvarı primer malign tümörlerinin %6’sını oluşturur, 10–25 yaş arasında
147
erkeklerde sık görülür. Başlangıçta ağrısız kitle olarak başlar, ilerleyen zaman içinde
ağrı giderek artar. Osteosarkom sıklıkla uzun kemiklerin metafiz kısmından gelişir.
Radyoterapi, kemoterapi ve Paget hastalığı osteosarkom etyolojisinde yer alır (8).
Radyoterapiden ortalama 10 yıl sonra osteosarkom gelişebilir (45). Radyolojik olarak
kemik dokusunda dekstüksiyon ve kalsifikasyon izlenir.
Tümör büyük, lobüle görünümlüdür ve genellikle çevre yumuşak dokuya invazedir.
Tanıyı doğrulamak için eksizyonel biyopsi yapılabilir. Laboratuar incelemelerinde
alkalen fosfataz yüksek saptanabilir ancak bu nonspesifiktir. Raymond ve ark.nın
1987’de yaptıkları çalışmada alkalen fosfataz seviyesi ile tümörün metastaz yapma
oranı arasında doğrusal bir ilişki saptanmıştır (46).
Tedavide radyoterapi etkili değildir ve kemoterapinin etkisi tartışmalıdır. Adjuvan
tedavi yapılan ve yapılmayan olgularda rezeksiyondan sonra 5 yıllık sağ kalım oranı
%15 civarında olup, 2/3 olguda takiplerde metastaz saptanmaktadır (9).
Ewing Sarkomu
Ewing sarkomu çocukluk çağı tümörlerinin % 1’ini oluşturur. Osteosarkomdan sonra
kemiğin ikinci sıklıkta görülen kötü huylu tümörüdür. İlk kez 1921 yılında James
Ewing tarafından tanımlanmıştır (47). Osteosarkomun aksine ışına duyarlı bir
tümördür. Günümüzde nöronal kaynaklı bir tümör olduğu kabul edilmektedir. Kemiğin
farklılaşmamış tümörü olup daha farklılaşmış şekli “periferal primitif nöroektodermal
tümör (PNET)” olarak isimlendirilir. Hastaların %90’ında kemikten, %10’unda kemik
dışı dokulardan kaynaklanır. Hastaların %80’i 20 yaşın altındadır.
Ewing sarkom çocukluk çağının seyir olarak en kötü tümörlerinin başında gelmektedir
ve erişkinlerde malign göğüs duvarı tümörleri içinde %8–22 arasında görülür (48).
Ewing sarkomu çocuklarda en sık görülen malign göğüs duvarı tümörüdür.
Erkeklerde kadınlardan iki kat daha fazla görülür. Ayırıcı tanıda küçük yuvarlak
hücreli tümörler grubunda bulunan nöroblastoma, embriyonel rabdomiyosarkom,
lenfoma yer alır (49). Ağrılı, büyük kitle saptanır. Ateş, anemi, lökositoz,
sedimentasyon yüksekliği olabilir. Radyolojik olarak litik ve blastik bölgeler içeren
destrüktif yapı izlenir, soğan kabuğu görünümü karakteristik ancak patognomonik
değildir. Radyolojik görünüm osteomyelite benzemektedir (8). Tümör birçok kostaya
yayılabilir ancak genelde tek kosta ile sınırlıdır.
Tanı iğne biyopsisi ile konulur. Tedavide ilk seçenek cerrahi değildir, radyosensitif
olduğundan radyoterapi tercih edilebilir. Hayes 1983’te yaptığı çalışmada kemoterapi
148
ile hastalığın yayılımının kontrolü sağlanabildiğini belirtmiştir. Hayery ve Schei’nin
yaptıkları bir çalışmada multimodal tedavi ile 5 yıllık sağkalım %52 olarak
saptanmıştır (9). Son 20 yılda multidisipliner yaklaşımdaki gelişmelere ve çok ilaçlı
kemoterapi yaklaşımlarına rağmen aynı yerde nüks veya uzak yayılım gelişme oranı
hala %30–50 oranındadır. Ewing sarkomlu hastada uzak yayılım geliştiği zaman
ikincil tedavi girişimlerine rağmen hastalar genellikle kaybedilmektedir (47).
Plazmasitoma
Göğüs duvarı tümörlerinin %3-35’ini soliter plazmasitoma oluşturur (50). Sıklıkla
erkeklerde ve ileri yaşta olur. Görüldüğü ortalama yaş 60’dır. Göğüs duvarında en sık
kostalarda görülür; klavikula ve sternumda daha nadir yerleşir. Kemik dokudan
yumuşak dokuya invazyon olabilir. Radyolojik görünümünde osteolitik süreç çok
belirgindir ve parakostal opasite sıklıkla izlenir (8). Hastalar genellikle göğüs
duvarında ağrılı şişlik yakınmasıyla başvururlar.
Plasmasitoma tanısını doğrulamak için kemik iliği aspirasyonu, direkt grafiler ve
immünoelektoforetik incelemeler gibi birçok test yapılabilir. Anemi, sedimentasyon
hızında
yükselme,
hiperkalsemi,
idrarda
Bence
Jones
proteini,
protein
elektroforezinde değişiklik saptanabilir. Soliter olan lezyonlarda bu değerler normal
olabilir (8).
Soliter yada multiple lezyonlarda tanıyı doğrulamak için tümör lokal eksize edilir.
Soliter lezyonlarda radyoterapi, multiple lezyonlarda kemoradyoterapi önerilir. Beş
yıllık sağ kalım oranı %20’dir (9).
Göğüs Duvarının Kemik Veya Kıkırdak Kökenli Primer Benign Tümörleri
Kondroma
Göğüs duvarının en sık görülen benign tümörüdür (43). Kıkırdak orijinli benign bir
tümör olup, matür hıyalin kıkırdak formasyonu ile karekterizedir. Büyüme plağındaki
displastik
kondrositlerin
oluşturduğu
anormal
zondan
kaynaklandığı
öne
sürülmektedir. Eğer lezyon kemik içinde santral olarak yerleşmişse enkondroma,
kortex dışına yerleşmişse kondroma (periosteal veya juxtakortikal) adını alır. Her
yaşta görülebilirse de en çok 20–40 yaşlarında görülür. Cinsiyet ayırımı yoktur. Kısa
tubuler el ve ayak kemikleri (flanks ve metakarplar) en sık görüldüğü bölgelerdir.
Daha sonra femur, humerus ve kostaları, tutulabilir. Lezyonun kesin büyüklüğü ve
149
ayırımı için BT ve MR gerekebilir. Lezyon genellikle radyolusenttir. Bazen uzun
kemiklerde aşırı kalsifikasyon içinde lezyon kaybolabilir (Kalsifiye enkondroma).
Ayırıcı tanıda, bilhassa uzun kemiklerde medüller kemik infarktını düşünmek gerekir.
Fakat enkondromada lobule kenarlı bir görünüm, matrikste anuler ve benekli
kalsifikasyon vardır. Etrafta da, kemik infarktında görülen sklerotik sınır çizgisi
görülmez. Histolojik olarak değişik sellüler yapı içeren hyalin kıkırdak lobulleri ve az
oranda kollagen içeren uniform translusent intercelluler bir matriks vardır. Tümör
hücreleri lakünalar oluşturur. Genellikle kalsifikasyon vardır. En önemli ve tek
komplikasyonu malign transformasyonudur (Kondrosarkom). Bu transformasyon
daha çok uzun ve yassı kemiklerde olup, tubuler kemiklerde nadirdir. Malign
transformasyon radyolojik olarak kortekste kalınlaşma ve harabiyetle birlikte,
yumuşak dokuya kitlenin yayılmasıdır. Ağrının, daha önce yokken ortaya çıkması da
malignite işaretidir.
Tedavi edilmezse büyüyebilirler; tümör etrafında 2 cm’lik cerrahi sınır bırakılarak
geniş lokal eksizyon yapılmalıdır.
Fibröz displazi
Fibröz displazi genellikle çocukluk ya da adolesan döneminde görülen, kemiğin
benign fibroosseöz lezyonudur (51). Gelişim sürecindeki kemiklerin hastalığıdır ve
dolayısıyla en sık geç çocukluk ve adelosan çağda görülür. Sıklıkla tutulan kemikler
kosta, femur, tibia, maksilla ve mandibuladır (52,53). Fibröz displazinin üç formu
tanımlanmıştır. En sık tek odaklı form görülür ve bu olguların %70’ini oluşturur. Çok
odaklı formu ise daha genç yaşta görülme eğilimindedir ve olguların %25’ini
oluşturur. Kafa ve yüz tutulumu daha yaygındır. Endokrin hastalıkla birlikte olan çok
odaklı fibröz displazi en az görülen form olup tüm olguların %3’ünü oluşturur.
Etkilenen kişilerde tek taraflı kemik lezyonları, aynı tarafta café-au-lait (sütlü kahve)
lekeleri ve pubertas prekoks görülür. Bu klinik özelliklerin bileşimi McCune-Albright
sendromu olarak tanımlanmıştır (54). Radyolojik olarak lezyon radyolüsent ve iyi
sınırlıdır. Direkt grafilerde, tipik olgular metafiz veya diyafiz yerleşimli, litik, buzlu cam
(ground glass) dansitesinde, kemikte ekspansiyon yapan, keskin sklerotik sınırlı
lezyonlar olarak görüntülenir. Fibröz displazide malign dönüşüm ve nüks seyrek
olarak görülür. Hastalığı nedeniyle radyoterapi alan olgularda ve kraniyofasiyal
lezyonlarda malign dönüşüm daha sıktır. Fibröz displazi zemininde gelişen malignite
150
sıklıkla osteosarkomdur. Nadiren kondrosarkom ve malign fibröz histiyositom da
gelişebilmektedir (55). Tedavisi eksizyondur.
Osteokondroma
Göğüs duvarı tümörleri arasında nadir görülür ve genellikle ilk iki dekadda olur.
Radyolojik görünümü tipiktir, metafizde yerleşir ve içinde noktasal kalsifikasyonlar
vardır. Nadiren fokal radyolüsen alan çevresinde osteosklerotik doku şeklinde de
olabilir (8). Genelde >4 cm çapındadır ve tedavi edilmezse büyümeye devam eder.
Soliter osteokondroma benigndir ancak nadiren malign dejenerasyon gösterebilir.
Multiple osteokondromada malignleşme insidansı daha fazladır. Tedavisi geniş lokal
eksizyondur (8).
Eozinofilik Granüloma
Eozinofilik granüloma lenforetiküler sistem hastalığıdır ve gerçek bir tümör değildir.
Soliter yada multifokal olabilir. Letterer-Siwe ve Hand-Schuller Christian ile beraber
retiküloendotelyal sistemi ilgilendiren Histiositozis X’in alt grubudur. Eozinofilik
granülom sadece kemik tutulumu ile sınırlı olmasına rağmen diğerlerinde sistemik
belirti ve bulgular olur (56).
En sık 5–15 yaş arasında görülür. Kemiğin metafiz veya diafizinde yerleşir,
malignleşme potansiyeli yoktur. Bu tümörler osteolitik aktivite gösterirler. Ewing
sarkomu ve osteomyelit ile karışabilirler. Tedavisi rezeksiyon ya da radyoterapidir (8).
Anevrizmal Kemik Kisti
Kostalarda oldukça nadir görülür, genellikle uzun kemikler ve vertebraları tutar. Kistik
ya da solid olabilir. Tanıda klinik, radyolojik bulgu ve patoloji beraber değerlendirilir.
Osteoblastoma, kondroblastoma ve dev hücreli tümörler sıklıkla uzun kemikleri tutan
ancak kostalarda çok nadir görülen klinik durumlardır.
Tedavi
Toraks duvarı malign tümörlerinde geniş rezeksizyon yapılmalıdır. Ancak geniş
rezeksiyonun ne olduğu konusundaki görüşler farklılıklar göstermektedir (4). Bu
konuda yapılan bir çalışmada, normal dokudan 2 ve 5 cm’lik uzaklıktaki rezeksiyonlar
karşılaştırılmış ve sağkalım açısından farklılık bulunmasa da, rekürrensin ilk grupta
daha fazla olduğu saptanmıştır (4). Bu sebepten dolayı primer malign toraks duvarı
151
tümörlerinde genel kanı, rezeksiyonun tümörün görünen sınırından itibaren 4-5 cm’
lik normal dokuyu da kapsaması gerekliliğidir.
Bu nedenle primer malign toraks
duvarı tümörlerinde rezeksiyon sonucu sıklıkla kapatılması gereken geniş toraks
duvarı defektleri ortaya çıkar. Gelişen toraks duvarı defektlerinin solunum mekaniğini
bozmadan ve solunum hareketlerini engellemeyecek şekilde rekonstrüksiyonu
gerekir. Toraks duvar rekonstrüksiyonu, kemik toraksın stabilizasyonunu ve yumuşak
doku defektlerinin örtülmesini içermelidir. Kemik toraksın rekonstrüksiyonu defektin
yeri ve büyüklüğüne bağlıdır (4). Beş santimetreden küçük defektler toraksın
neresinde olursa olsun genellikle rekonstrüksiyon gerektirmez. Skapula altında kalan
posterior lokalizasyonlu 10 cm’den küçük defektlerde de skapula yeterli desteği
sağladığı için rekonstrüksiyon gerekmez. Daha büyük defektler ise rekonstrüksiyon
gerektirirler. Yumuşak doku rekonstrüksiyonu en iyi kas transpozisyonu ile
yapılmaktadır
(57).
Kemik
doku
rekonstrüksiyonunda
birçok
malzeme
kullanılmaktadır. Bu malzemeler; metil metakrilat, Goroteks, Marlex mesh, Prolen
mesh, Dual mesh, titanyum plaklar gibi suni greftler olabildiği gibi otolog kemik
gerftleri de olabilir. Çocuk veya gelişmekte olan hastalarda daha yumuşak ve elastik
greftler tercih edilmelidir.
Sonuç olarak, primer toraks duvar tümörlerinin erken tanısı ve radikal cerrahi
eksizyonu başarılı bir tedavinin kilit noktasını oluşturmaktadır. Bu işlem genellikle tek
operasyon ile ve düşük operatif mortalite ile yapılabilmektedir. Ancak klasik yaklaşım
yanında özellikle 4 cm’den büyük tümörlerde öncelikle insizyonel biopsi yapılıp,
tümörün histolojik tipine uygun adjuvan kemoterapi veya radyoterapi yapılıp daha
sonra cerrahi rezeksiyon yapılması da düşünülebilir.
Çıkarılan dokunun büyüklüğü, rekonstrüksiyon gerekip gerekmediği ve ne tür
rekonstrüksiyon malzemesi gerektiği, cerrahi uygulayan ekibin tecrübe ve bilgisine
göre değişebilir, ancak sonuçta çoğu göğüs duvarı tümörleri yeterli miktarda doku
rezeksiyonu ile başarılı şekilde tedavi edilebilmektedir.
152
KAYNAKLAR
1. Le Roux BT, Shama DM. Resection of tumors of the chest wall. Curr Prıbl Surg
1983;20(6):215-8.
2. Threlkel JB, Adkins KB Jr. Primary chest wall tumors. Ann Thorac Surg
1971;11(5):450-9.
3. Jeung MY, Gangi A, Gasser B, Vasilescu C, Massard G, Wihlm JM, et al. Imaging
of chest wall disorders. Radiographics 1999;19(3):617-37.
4. King RM, Pairolero PC, Trastek VF, Piehler JM, Payne WS, Bernatz PE. Primary
chest wall tumors: Factors affiecting survival. Ann Thorac Surg 1986;41(6):597-601.
5. Burt M. Primary malignant tumors of the chest wall. Chest Surg Clin North Am
1994;4(1):137-54.
6. Graeber GM, Snyder RJ, Fleming AW, Head HD, Lough FC, Parker JS, et al: Initial
and long term results in the management of primary chest wall neoplasms. Ann
Thorac Surg 1982;34(6):664-73.
7. Cavanaugh DG, Cabellon S Jr, Peake JB. A logical approach to chest wall
neoplasms. Ann Thorac Surgery 1986;41(4):436-44.
8. Graeber MG, Jones RD, Pairolero PC. Primer Neoplasms. In: Pearson GF,
ginsberg JR, Cooper DJ. Thoracic Surgery. 2nd ed. Philadelphia, Churchill
Livingstone; 2002. p.1417-30.
9. Akay Hadi. Göğüs duvarı tümörleri. In: Ökten İ, Güngör Adem. Göğüs Cerrahisi.
1st ed. Ankara, Sim; 2003. p.731-45.
10. Tateishi U, Gladish GW, Kusumoto M, Hasegawa T, Yokoyama R, Tsuchiya R, et
al. Chest wall tumors: radiologic findings and pathologic correlation: part 2. Malignant
tumors. Radiographics 2003;23(6):1491-508.
11. Mc.Cormick PC, Stein BM: Spinal Cord Tumors in Adults. In Youmans Julian R
(Ed) Neurosurgical Surgery. Fourty Edition .Volume 4,Ch 143 W.B.Saunders
Company. 1997 (CD Edition)
12. Zeidman SM: İntradural Intramedullary and Extramedullary tumors.Vacaro AR,
Betz RRB, Zeidman SM. Principles and practice of spine surgery, Mosby, chapter 17,
2003: 223-239
13. Hasegawa M, Fujisawa H, Hayashi Y, Tachibana O et al: Surgical pathology of
spinal schwannomas: a light and electron microscopic analysis of tumor capsules.
Neurosurgery. 2001 Dec; 49(6):1388-92.
153
14. Conti P, Pansini G, Mouchaty H et all:Spinal neuromas: Retrospective analysis
and long-term outcome of 179 consequtively operated cases and review of the
literature, Surg Neurol 2004; 61:35-44
15. Armstrong P. Mediastinal and hilar disorders. In: Armstrong P, Wilson AG, Dee P,
Hansell DM, eds. Imaging of disease of the chest. 3rd ed.Spain: Mosby; 2000. p.789892.
16. Krüger M, Uschinsky K, Engelmann C. [Surgical treatment of malignant thoracic
schwannomas]. Zentralbl Chir 2001;126(3):223-8.
17. Tanaka O, Kiryu T, Hirose Y, Iwata H, Hoshi H. Neurogenic tumors of the
mediastinum and chest wall: MR imaging appearance. J Thorac Imaging
2005;20(4):316-20.
18. Ribet ME, Cardot GR. Neurogenic tumors of the thorax. Ann Thorac Surg
1994;58(4):1091-5.
19. Adler JT, Meyer-Rochow GY, Chen H, Benn DE, Robinson BG, Sippel RS, et al.
Pheochromocytoma:
current
approaches
and
future
directions.
Oncologist
2008;13(7):779-93.
20. Piza-Katzer H, Rhombers M. Extraabdominal fibromatosis-extraabdominal
desmoid tumor.Review and personal experiences. Chirurg 2000;7(8):904-11.
21. Enzinger FM, Weiss SW. Soft Tissue Tumors. Fibromatoses. Chapter 10, Third
edition, Maple-Vail Book Mfg. Group, St Louis. 1995:201-29.
22. Kalliopi A, Georgios K, Dimitra R, et al. Primary chest wall tumors: early and longterm results of surgical treatment. Eur J Cardiothorac Surg 2001;19:589-93.
23. Iqbal M, Rossoff LJ, Kahn L, et al. Intrathoracic desmoid tumor mimicking primary
lung neoplasm. Ann Thorac Surg 2001;71(5):1698-700.
24. Greget M, Veillon F, Meyer C, et al. Desmoid tumors in Gardner Syndrome.
Apropos of a case evaluated with echography, CT, and MRI. J Radiol
1994;75(3):199-202.
25. Allen PJ, Shriver CD. Desmoid tumors of the chest wall. Semin Thorac
Cardiovasc Surg 1999;11(3):264-9.
26. Dashiell TG, Penye WS, Hepper NGG. Desmoid tumor of the chest wall. Chest
1978;74:157-62. 13.
28. Brodsky JT, Gordon MS, Hajdu SI. Desmoid tumors of the chest wall. A locally
recurrent problem. J Cardivasc Surg 1992;104(4):900-3.
154
29. Kostolny M Jr, Präuer H, Augustin N, Lange R. Extended resection a chest wall
desmoid tumour with concominant coronary artey grafting. Eur J Cardio Thorac Surg
2001;20(5):1040-1.
30. Brodsky JT, Gordon MS, Hajdu SI, Burt M. Desmoid tumor of the chest wall. A
locally recurent problem. J Thorac Cardiovasc Surg 1992;104(4):900-3.
31. Gladish GW, Sabloff BM, Munden RF, Truong MT, Erasmus JJ, Chasen MH.
Primary thoracic sarcomas. Radiographics 2002;22(3):621-37.
32. Enzinger FM., Weis SW. Soft Tissue Tumors, 2nded. The C.V. Mosby Company.
St. Louis 1988:347-382.
33. Springfield D. Liposarcoma. Clin Orthop 1993;289:50-57.
34. Standerfer RJ, Armistead SH, Paneth M. Liposarcoma of the mediastinum: report
of two cases and review of the literature. Thorax 1981;36(9):693-4.
35. Wexler LTT, Crist WM, Herman LJ. Rhabdomyosarcoma and the undifferantiated
sarcomas. In: Pizzo PA, Poplack DG (eds), Principles and Practice of Pediatric
Oncology, Lippincott Williams & Wilkins, Philadelphia, 2002, pp. 939-972.
36. Stevens MCG. Rhabdomyosarcoma. In: Voute PA, Kalifa C, Barrett A (eds) (4 th
ed) Cancer in children. Oxford University Press, New York, 1998, pp 193-213.
37. Crist WM, Arnolt A.S. Rhabdomyosarcoma. In: Behrman RE, Klegman RM,
Jenson HB (eds), Nelson Texbook of Pediatrics (16 th ed). WB Saunders,
Philadelphia, 2000,pp 1556-1558.
38. M Almberger, E Iannicelli, M Matrunola, A Schiavetti, P Capocacci a. Integrated
diagnostic imaging of thoracic rhabdomyosarcoma. Eur Radiol 2001; 11:506-508.
39. Ono N, Sato K, Yokomise H, Tamura K, Horikawa S, Suzuki Y, et al. Primary
bronchopulmonary fibrosarcoma: report of a case. Surg Today 1998;28(12):1313-5.
40. Goon HK, Cohen DH, Harvey JG. Review of thoracic neuroblastoma. Aust
Pediatr J 1984;20(1):17-21.
41. Vandenberg H, van Rijn RR, Merks JH. Management of tumors of the chest wall
in childhood: a review. J Pediatr Hematol Oncol 2008;30(3):214-21.
42. Strollo DC, Rosado-de-Christenson ML, Jett JR. Primary mediastinal tumors: part
II. Tumors of the middle and posterior mediastinum. Chest 1997;112(5):1344-57.
43. Sabanathan S, Salama FD, Morgan WE, Harvey JA. Primary chest wall tumors.
Ann Thoracic Surg 1985;39(1):4-15.
155
44. McAfee MK, Pairolero PC, Bergstralh EJ, Piehler JM, Unni KK, McLeod RA,
Bernatz PE, Payne WS. Chondrosarcoma of the chest wall: factors affecting survival.
Ann Thorac Surg. 1985 Dec;40(6):535-41.
45. Huvos AG, Woodard HQ, Cahan WG, Higinbotham NL, Stewart FW, Butler A, et
al. Postradiation osteogenic sarcoma of bone and soft tissues. A clinicopathologic
study of 66 patients. Cancer 1985;55(6):1244-55.
46. Raymond AK, Chawla SP, Carrasco CH, Ayala AG, Fanning CV, Grice B, et al.
Osteosarcoma chemotherapy effect: A prognostic factor. Semin Diagn Pathol
1987;4(3): 212-236.
47. Ginsberg JP, Woo SY, Johnson ME, et al. Ewing’s sarcoma family of tumors:
Ewing’s
sarcoma
of
bone
and
soft
tissue
and
the
peripheral
primitive
neuroectodermal tumors. In: Pizzo PA, Poplack DG (eds). Principles and Practice of
Pediatric Oncology. 4rd ed. Philadelphia: J. B. Lippincott Company, 2002; 973- 1017.
48. Shamberger RC, Grier HE, Weinstein HJ, Perez-Atay de AR, Tarbell NJ. Chest
wall tumors in infancy and childhood. Cancer 1989;63(4):774-85.
49. Stefanko J, Turnbull AD, Helson L, Lieberman P, Martini N. Primitive
neuroectodermal tumors of the chest wall. J Surg Oncol 1988;37(1):33-7.
50. Incarbone M, Pastorino U. Surgical treatment of chest wall tumors. World J Surg
2001;25:218-30.
51. Sakamoto A, Oda Y, Iwamoto Y, et al. A comperative study of fibrous dysplasia
and osteofibrous dysplasia with regard to Gs alpha mutation at the Arg201 codon:
polymerase chain reaction-restriction fragment lenght polymorphism analysis of
paraffin-embedded tissues. J Mol Diagn 2000; 2: 67–72.
52. Rosai J. Rosai and Ackerman’s Surgical Pathology. Ninth edition. London,
Mosby, 2004; 2192–4.
53. Huvos AG. Bone Tumors Diagnosis, Treatment, and Prognosis. Second edition.
London, W.B. Saunders Company, 1991; 30–48.
54. Cotran SC, Kumar V, Collins T. Robbins Pathologic Basis of Disease. Sixth
edition. Philadelphia, W.B. Saunders Company, 1999; 1242–3.
55. Huvos AG, Higinbotham NL, Miller TR. Bone sarcomas arising in fibrous
dysplasia. J Bone Joint Surg (Am) 1972; 54: 1047–56.
156
56. Park BJ, Rusch VW. Chest wall tumors. In: Shields WT, Locicero III J, Ponn BR,
Rusch VW. General Thoracic Surgery 6th ed. Philadelphia: Lippincott; 2005. p.71021.
57. Pailero PC, Arnold PC. Chest wall tumors: Experience with 100 consecutive
patients. J Thorac Cardiovasc Surg 1985;90(3):367-372.
157
14.
Doç. Dr. Serdar Onat
Dicle Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
DİYAFRAGMA KASININ EMBRİYOLOJİ VE ANATOMİSİNE AİT TEMEL BİLGİLER
DİYAFRAGMA EMBRİYOLOJİSİ
En önemli solunum kası olan diyafragma, kubbe biçimli olup göğüs ve karın
boşluğunu ayıran muskuler bir anatomik bariyerdir. Dört farklı embriyolojik oluşumdan
köken alır.
1-Septum transversum
2- Plöroperitonal membranlar
3- Özofagus dorsal mesenteri
4- Lateral vücut duvarları
Septum transversum, gestasyonun üçüncü haftasında ventral olarak bir mezoderm
kitlesi olarak görülür. Dördüncü haftada perikardiyal ve peritoneal boşlukları kısmen
ayırır. Önce oksipital ve üst servikal bölgede (C3) yerleşiktir ve frontal oryantasyonda
dorsokaudal iniş gösterir. Kaudal ve lateral olarak, başlangıçta gövde duvarına
bağlanır ve kranial kenarlar açık midgutla sonlanır.
Gebeliğin beşinci haftasında sinirler, spinal kordun dördüncü ve beşinci servikal
segmentinden
köken
alırlar.
Pleuroperikardiyal
membranı
geçerek
septum
transversuma girip frenik siniri oluştururlar. Gebeliğin altıncı haftasının başında
diyafragmanın ilk bölümleri torasik somitlerin bölgesinde yerleşir ve sekizinci haftada
L1 seviyesine iner. Bu iniş sırasında frenik sinir boylu boyunca çekilir ve nihai
uzunluğuna kavuşur. İniş sırasında karaciğer dokusu eşit olarak güçlü bir şekilde
yükseldiği için, durum önden yatay duruma döner, ventrodorsal eğilime uygun hal
alır.
Septum transversum tüm duvar boyunca uzanmaz ve sağ ve sol plevral boşluklar ve
peritoneal kaviteler açık kalır ve bu boşluklar pleuroperitoneal kanallar adını alırlar.
158
Gebeliğin yaklaşık sekizinci haftasında sağ ve sol pleuroperitoneal membranlar
plevral ve peritoneal boşluklar arasındaki bağlantıyı kapatır. İlk gelişmeye ek olarak
gövde duvarı, lateral diyafragmanın oluşmasına katkıda bulunur. Dokuzuncu
haftadan 12. haftaya kadar plevral kaviteler duvara doğru gelir ve duvara penetre
olur. Gövde duvarı iki kat halini alır; dış tabaka göğüs duvarına doğru giderken iç
tabaka diyafragmaya doğru gider. Eşzamanlı olarak torasik miyotomlardaki kas
materyalleri diyafragmaya girer. Bu durum diyafragmanın periferinin motor uyarımının
alt altı interkostal sinir tarafından innerve edildiğini açıklar. Plevral kavitenin primitif
duvarla birleşmesi kostodiyafragmatik reseslerin oluşmasına yol açar.
Tanımlanan zaman sürecinde bir gecikme ya da değişiklik, konjenital hernilere veya
evantrasyona sebep olur. Bağırsakların plöroperitoneal membranın kapanmasından
önce batına dönmeleri halinde Bochdalek hernileri meydana gelir. Morgagni hernileri,
ön tarafta oluşur, servikal myotomların içe doğru büyüme hatasına bağlıdır.
Diafragma Anatomisi
Yapısı ve fonksiyonu ile vücudun diğer kaslarından farklıdır. Kubbe şeklindeki yapısı
ile karaciğer ve dalak gibi abdominal organların, alt seviyedeki kostalar ve göğüs
duvarı ile korunmasını sağlar. Kalbin sol diyafragmayı aşağı doğru itmesine bağlı
olarak, sağ hemidiyafragma kubbesi sola göre daha yüksekte bulunur.
Diyafragma, merkezindeki düzensiz şekilli tendon bölgesinden etrafa doğru seyreden
kas liflerinden yapılmıştır. İstemli kas lifleri, ksifoidin arka yüzünden, alt altı kostanın
lateral tarafından ve üst üç lomber vertebranın dış ve iç bağlarından köken alırlar.
Bilateral kas lifleri diyafragmanın santral tendonlarına doğru ilerler. Santral tendon üç
yapraklı yonca şeklinde, fasya liflerinden sıkı örülmüş ince bir aponevrozdur. İki
lateral
yaprak
diyafragmanın
kubbesini
oluşturur
ve
üçüncüsü
perikardın
diyafragmatik yüzüyle birleşir. Diyafragmanın kostal kısmı inceyken krural kısmı daha
kalındır. Her iki kas grubu da frenik sinir tarafından uyarılmalarına rağmen, uyarılma
üzerine aktiviteleri farklıdır. Kostal bölümün kasılması diyafragmanın düzleşmesine
ve alt kostaların yukarı kalkmasına, dolayısıyla da göğüs boşluğunun genişlemesine
yol açar. Krural kısmın hareketi solunum üzerine daha az etkilidir.
Sağ diafragmatik krus birinci ve ikinci lomber vertebranın gövdesinden kaynaklanır ve
lifleri sola doğru böler. Önden ve arkadan özofageal hiatusu oluştururlar.
159
Hiatal açıklık 10. torakal vertebranın seviyesinde orta hattın hemen solunda bulunur.
Vena kava inferior sağ diyafragmanın tendinöz kısmından ve sekizinci torakal
vertebra seviyesinden geçer. Parasternal aralıktaki (Morgagni) normal açıklıktan
internal mamariyan arterler geçerler ve batında superior epigastrik arterleri
oluştururlar. Diyafragmanın torasik yüzü paryetal plevra ile kaplıyken, abdominal
yüzü doğal açıklıklar hariç periton ile kaplıdır.
Kan Akımı
Diyafragmanın başlıca arteryel beslenmesi aorta veya onun superior abdominal
dallarından olur. Venöz dönüş vena kava inferiora doğrudur. Arteryel ve venöz
yapılar diyafragma yüzeyinin altında yerleşirler. İnferior frenik arter genelde
diyafragma kubbesine yakın yerde arkaya doğru dallar verir ve dallar santral tendon
sınırına doğru uzanırlar. Daha küçük posterior dallar, dorsal ve lumbosakral
kısmından uzanıp alt beş interkostal kollateralleriyle birleşirler. Daha büyük anterior
dal santral tendonun anterosuperiorundan uzanıp perikardiyofrenik arterle birleşir.
Venöz dönüş santral tendonun arkasından vena kava inferiora doğrudur.
Diyafragmanın alt yüzündeki venler hepatik venlere dökülür.
Sinir Uyarımı
Her iki hemidiyafragma üçüncü, dördüncü ve beşinci servikal köklerden kaynaklanan
sinir lifleri ile innerve olur. Diyafragmaya yapılan insizyon yerleri için bu sinirlerin
dağılımı önemlidir. Sağ frenik sinir diyafragmaya vena kava inferiorun yanında ulaşır.
Sol frenik sinir kalbin hemen sol yarısından diyafragmaya ulaşır. Daha sonra uç
dallara ayrılırlar. Bunlar anteromedial, lateral ve posterior yerleşimli üç muskuler
daldır. Bu dallardan herhangi birinin yaralanması, innerve ettiği hemidiyafragma
parçasının felciyle sonuçlanır.
Diyafragmatik Lenf Nodları
Lenf nodları üç gruba ayrılır. Anterior grup, ksifoidin arkasında perikardın sağ ve
solunda bulunur. İkinci grup sağ ve sol frenik sinirin diyafragmayla birleştiği yerde
bulunurlar. Üçüncü grup sağ ve sol krusların arkasında bulunur.
160
Cerrahi Kesi Yerleri
Diyafragma insizyonları frenik sinirin büyük dallarını yaralamamaya özen gösterilerek
yapılmalıdır. Santral tendon üzerinden yapılan insizyonlarda diyafragma paralizisi
nadiren oluşur fakat çok küçük bir görüş alanı sağlar. Diyafragmanın periferinde
dairesel olarak yapılan insizyon, hem daha geniş görüş alanı hemde daha az frenik
sinir yaralanmasına yol açar. Sol tarafta insizyon, özofagus hiatusundan başlayıp
arkadan öne doğru göğüs duvarına 2,5–3 cm uzaklıkta, dairesel olarak yapılabilir.
Krural veya posterior dallar bu insizyonla kesilse dahi fazla bir önemi yoktur. Bu
insizyonla sol inferior frenik arterin ana dalı kesileciğinden ligasyon yapılmalıdır.
Alternatif olarak insizyon önde perikardın yanında başlayıp gerektiği kadar dairesel
olarak arkaya doğru da yapılabilir.
KAYNAKLAR
1. Shields TW Embriology and Anatomy of the Diaphragm. In Shields TW, LoCicero
J, Reed C, Feins R ed. General Thoracic Surgery, vol 1, 7th ed. Philadelphia:
Lippincott Williams and Wilkins; 2009: 689-694.
2. Schumpelick V, Steinau G, Schlüper I, Prescher A. Surgical embryology and
anatomy of the diaphragm with surgical applications. Surg Clin North Am. 2000
Feb;80(1):213-39. Review.
3. Moore KL. Development of body cavities, primative mesenteries, and the
diaphragm. In Moore KL (ed): The Developing Human: Clinically Oriented
Embryology, ed 4. Philadelphia, WB Saunders, 1988, pp 159-169.
4. O'Rahilly R, Muller F: The diaphragm. In O'Rahilly R, Muller F (eds): Human
Embryology and Teratology, ed 2. New York, Wiley-Liss, 1996.
161
15.
Prof. Dr. Ali Özdülger
Mersin Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
DİYAFRAGMA
KASI
FONKSİYONUNUN
TEMEL
PRENSİPLERİ
Diyafragma müskülotendinöz bir yapıya sahiptir ve anatomik fonksiyonu batın ve
göğüs boşluklarını birbirinden ayırmaktır. Ancak diyafragma kasının asıl işlevi
fizyolojiktir; bu işlev onun solunumun en önemli kası olmasıdır.
Bu muskulotendinöz yapı inspirasyon esnasında akciğerlere çekilen havanın %75-80
kadarından sorumludur. Bu miktar, supin pozisyonda duran bir kimsede dakika
solunum hacminin yaklaşık %60 kadarına karşılık gelmektedir.
Solunum işinin en önemli kası olan diyafragmanın kontraksiyonu sonucu oluşan vertikal
hareket sakin solunum esnasında 1-2 cm iken derin inspirasyonla bu vertikal hareket yaklaşık
6-7 cm’i bulabilir. Diayafragmanın kaudal yönde yaptığı bu hareketin her santimetresi toraks
hacminin yaklaşık 300-400 ml artmasıyla dolayısıyla akciğerler aynı miktar havanın
çekilmesi ile sonuçlanır.
Diyafragma kasının her bölgesinde makroskopik görünümü aynı değildir; kostal ve krural
parçalar yapısal ve fonksiyonel olarak birbirlerinden farklıdırlar. Bu nedenle her iki kısım da
n. phrenicus ile innerve olmasına rağmen uyarıya yanıtları da farklı olmaktadır. Kostal kısım
kasıldığında diyafragma kubbesi düzleşerek aşağı iner ve alt kaburgaların ön kısımları yukarı
doğru kalkar. Her iki hareket de toraks hacminin önemli oranda artması ile sonuçlanır. Krural
kısmın kasılması ise diayfragmada az bir oranda düzleşmeyle sonuçlanır; asıl etkisi kostal
kısma mekanik destek vermektir.
Diyafragma kasının ekspirasyonda da etkinliği vardır. Ekspirasyon başladığında diyafragma
kasılması aniden durmaz, kasılma yavaş bir şekilde ekspirasyon döngüsünün ortasında
sonlanır. Böylelikle inspirasyon-ekspirasyon-inspirasyon döngüsü sırasında havanın
akciğerlere giriş ve çıkışı daha düzenli olur.
Diyafragma kası içinde birbirinden farklı metabolik özellikler sahip üç ayrı kas lifi tipi
bulunmaktadır.
Bu kas liflerinin %55 kadarını Tip I olarak adlandırılan kas lifleri oluşturmaktadırlar. Bu lifler
yavaş kasılan ve aerobik enerji üretimine uygun metabolizmaları olan liflerdir; laktik asit
biriktirmezler ve bu yüzden de yorgunluğa karşı dirençlidirler. Mitokondrileri ve myoglobin
içerikleri diğer tiplere göre çok daha fazladır. Bu fazla myglobin, kandaki hemoglobin gibi
oksijenle birleşir ve mevcut oksijenin tüm myglobin moleküllerine optimum şekilde
dağılmasını ve kullanılmasını sağlar.
Diyafragmada bulunan kas lifi tiplerinden bir diğeri %21 oranında saptanan Tip IIA liflerdir.
Bu lifler hızlı kasılan, yüksek oranda oksidatif ve yorgunluğa orta derecede dayanıklı liflerdir.
Çapları yaklaşık iki kat daha geniştir.
162
Bu lif tipinde enerjinin hızla serbestlenmesini sağlayan enzimler daha fazla bulunduklarından
hızlı liflerde üretilen güç, yavaş liflerde üretilenin iki katı kadar olabilir.
Diyafragma kası bünyesinde bulunan diğer kas lifi tipi Tip IIB liflerdir. Bunlar çok hızlı
kasılan, yüksek oranda glikolitik metabolizmaya sahip liflerdir. Bu tür enerji üretiminde lif
içinde laktik asit birikimi fazla olduğundan, bu lif tipi yorgunluğa duyarlıdır.
Değişik özelliklere sahip farklı liflerinin bu oranda bir arada bulunmaları diyafragma kasının
rutin ve ağır solunum aktivitesinin metabolik gereklerini karşılayabilmesine imkan verir.
Normal solunum esnasında kas liflerinin ancak az bir oranı stimüle edilirler. Böylelikle
diyafragma çalışmaya devam ederken de kas liflerinin bir kısmının metabolik olarak
toparlanmaları mümkün olmaktadır.
KAYNAKLAR
1. Shields TW. Embryology and anatomy of the diaphragm. In Shields TW, Locicero III
J, Reed CE, Feins RH, eds.General Thoracic Sugery 7th edition, Philadelphia,
Wolters Kluwer, Lippincott Williams Wilkins, 2009. p 689-694.
2. Guyton, Hall : Tıbbi Fizyoloji, Çeviri Ed. Çavuşoğlu H, Yeğen T., Bölüm 15 Spor
Fizyolojisi, Yıldız SA; 1055-1066 Nobel Tıp Kitapevleri, 2007
3. Ganong WA: Çeviri Tıbbi Fizyoloji, Türk Fizyolojik Bilimler Derneği 20. Baskı;
Kurtel H.: Uyarılabilir doku kas; 62-80, Nobel Tıp Kitapevleri 2002.
163
16.
Doç.Dr. Leyla Hasdıraz ve Prof.Dr. Fahri Oğuzkaya
Erciyes Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
DİYAFRAGMA HASTALIKLARI
Bu bölümde aşağıdaki diafragma hastalıkları incelenecektir.
Diyafragma paralizisi
Diyafragma evantrasyonu
Diyafragma hernileri
Hiyatal herniler
Diyafragma tümörleri
Diyafragma Paralizileri
Tanım ve Etyoloji
Diyafragma paralizisi, frenik sinir hasarı sonucu diyafragma kasının fonksiyonunu
kaybetmesidir. Unilateral veya bilateral olabilirler. Diyafragm paralizileri enfeksiyonlar,
malign süreçler veya iyatrojenik nedenlerle oluşabilir. Ancak genellikle etyoloji
bulunamaz ve idiyopatik olarak adlandırılır. İdyopatik paraliziler genellikle tek
taraflıdır. Özellikle tek taraflı diyafragma paralizileri asemptomatik olabildiği için her
zaman
tanı koymak mümkün
olmamaktadır. Bu
nedenle
gerçek
insidansı
bilinememektedir. Ayrıca boyun ve toraks bölgesine yapılan cerrahi girişimler
sırasında iyatrojenik olarak frenik sinir hasarı oluşabilir. Özellikle kardiyak cerrahilerde
topikal hipotermi sonrası paralizi gelişebilir. Ortalama %1–2 civarında görülen bir
komplikasyondur ve bunların %20’si kalıcı karakterde olabilir. Akciğer kanseri ve
malign mediastinal tümörlerin frenik sinire invazyonu sonucu da paralizi gelişebilir.
Çocuklarda en sık sebep ise kardiyak girişim sırasındaki frenik sinir hasarıdır.
Özellikle ikinci operasyonlarda bu risk daha da artar.
Frenik sinir hasarı vaskülit ve amiyotrofik lateral skleroz gibi sinir dokusunu tutan
hastalıklarda da görülebilir. Bu durumlarda genellikle generalize kas tutulumu vardır.
Diğer tutulan kaslara ilişkin semptomlar ön plandadır. İzole diyafragma tutulumu
%3–5 civarında görülür.
164
Klinik
Erişkinlerde tek taraflı diyafragma paralizileri çoğunlukla asemptomatik seyreder.
Semptomatik olanlarda minimal solunum sıkıntısı, öksürük, göğüs ağrısı görülebilir.
Paralizinin erken döneminde total akciğer kapasitesi ve vital kapasitede %20–30
oranında azalma gözlenebilir. VC ve FEV1 azalmasına bağlı olarak progresif dispne
görülür. Ancak bu azalma bir yıl içinde normale döner. Bilateral paralizi olduğunda ise
solunum sıkıntısı vardır, özellikle yatar pozisyonda artar. Genellikle tolere edilebilir
ancak yardımcı solunum kasarlı çok çalıştığı için bu hastalar kronik solunum
yetmezliğine adaydır.
Çocuklarda ve bebeklerde ise tek taraflı paralizi bile tolere edilemeyebilir. Fizik
muayenede, paralitik diyafragma üstte kalacak şekilde yattığında alt kostalarda
paradoksal hareket gözlenebilir. Erişkinlerde bu hareket gözlenmez.
Bilateral
paralizilerde ise ciddi solunum sıkıntısı vardır ve mekanik ventilatör uygulaması
gerektirir.
Tanı
Akciğer grafisinde bir hemidiyafragmanın yüksek görülmesi önemli bir bulgu olmakla
birlikte bu durumun tanı değeri düşüktür, çünkü akciğer hacim kaybı, lober kollaps,
cerrahi rezeksiyon ve fibrozis gibi nedenlerle de diyafragm yüksek görülebilir.
Bir diğer bulgu yükselen diafragmanın basısına bağlı oluşan akciğer bazallerinde
atelektazi varlığıdır.
Koklama testi olarak da bilinen Sniff testi, ani nefes alma sırasında normal
hemidiyafragmanın aşağı doğru hareket ederken paralitik diyafragmanın yukarı doğru
hareket etmesi bulgusudur. Floroskopi ile bu hareketin gösterilmesi testin pozitif
olduğunu gösterir ve kesin tanı koydurur.
Frenik sinirin elektrofizyolojik değerlendirilmesi ise oldukça karmaşık ancak klinik
uygulamada çok sık kullanılmayan bir tekniktir.
Tedavi
Erişkinlerde ve iki yaş üzeri çocuklarda çoğunlukla konservatif tedavi yeterli
olmaktadır. Semptomatik olan hastalarda (dispne ve ortopnesi olan) plikasyon en çok
uygulanan cerrahi girişimdir. Plikasyon işeminin amacı, diyafragmanın düzleşmesini
sağlayarak paradoksal hareketi engellemektir. Bunu sağlamak için genellikle kas
dokusu rezeksiyonu yapmadan ve frenik sinire zarar vermeden santral plikasyon
165
uygulanır. Tek taraflı veya bilateral diyafragma paralizilerinden sonra plikasyonla uzun
dönem takip çalışmalarında solunum fonksiyonlarında ciddi düzelmeler görülmüştür.
Bebek ve çocuklarda semptomlar şiddetli olduğu için öncelikle mekanik ventilatör
tedavisi başlanır. Paralitik taraf altta kalacak şekilde yatırılır. Eğer iki haftalık tedaviye
rağmen solunum sıkıntısı devam ediyorsa plikasyon uygulanır.
Ayrıca frenik sinirin primer onarımı ile de başarılı sonuçlar bildirilmiştir. (brouillette
1986)
Diyafragma Evantrasyonu
Tanım ve Etyoloji
Nadir görülen bir anomalidir. Tüm diyafragma anomalilerinin %5’lik kısmını oluşturur.
Konjenital veya akkiz olabilir. Konjenital diyafragma evantrasyonu diyafragmanın bir
kısmının veya tamamının torasik kaviteye doğru yer değiştirilmesi ile oluşan bir
anomalidir.
Etyolojide
kromozom
anomalileri,
sitomegalovirus,
toksoplazma
enfeksiyonları sorumlu tutulmaktadır. İntrauterin yaşamın 8.-10. haftalarında musküler
gelişim yetersizliği nedeni ile diyafragma normalden daha yüksek konumda
kalmaktadır. Diyafragma ile birlikte gelişen ligamentlerde de gelişim bozukluğu
görülür. Dalağın yerinde sabitlenmesini sağlayan ana ligament olan splenorenal
ligamentin yetersiz gelişimi sol evantrasyonları sadece toraksı değil, batını da
etkileyen kompleks bir hastalık yapar. Evantrasyona vertebra anomalileri, akciğer
hipoplazisi, yarık damak, mikroftalmi gibi konjenital anomaliler eşlik edebilir.
Akkiz diyafragma evantrasyonu genellikle doğum travmasına sekonder veya kardiyak
cerrahi sırasında frenik sinir harabiyeti nedeni ile oluşur. Sıklıkla tek taraflıdır. Parsiyel
veya komplet evantrasyon şeklinde olabilir. Genelde sağ tarafta parsiyel, solda ise
komplet görülür. Evantrasyonlar genelde unilateraldir, bilateral nadir görülür.
Erkeklerde ve solda daha sıktır.
Klinik
Çok çeşitli klinik tablolarla ortaya çıkabilir. Solunum sıkıntısı başlıca semptomdur.
Dispne, hafif solunum sıkıntısından mekanik ventilatör gerektirecek düzeye kadar
değişen derecelerde olabilir. Takipne, bulantı görülebilir. Bazen asemptomatik de
kalabilir. Hafif formlarında sadece ağır efor sırasında ve yatarken dispne ortaya
çıkabilir. Oturur pozisyonda, istirahatta ve evantre taraf üzerine yatınca semptomlar
166
azalır. Eşlik eden KOAH varlığında daha şiddetli seyredebilir. Hastalar tekrarlayan
pnömoni atakları ile de gelebilirler.
Tanı
Konjenital diyafragma evantrasyonuna prenatal ultrasonografi ile erken tanı koymak
mümkündür. Ancak herni ile ayırımı zor olabilir. Direkt grafi kesin tanı koydurmamakla
birlikte oldukça yararlıdır. Hatta asemptomatik hastalarda, tesadüfen çekilen düz grafi
tanıya götüren ilk tetkiktir. Ayrıca floroskopi, bilgisayarlı tomografi, manyetik rezonans
incelemeri tanıya yardımcıdır. Özellikle aksiyel plandaki tomografi ile evantre segment
kolaylıkla görülür.
Erken dönemde tanı konan hastaların prognozu eşlik eden yandaş anomaliler ve
pulmoner hipoplazi derecesine bağlıdır. Pulmoner sorun ne kadar az ise, o kadar az
semptomatik olacağı için tanı konması gecikebilir. Ancak bu hastalarda zaten
konservatif kalınabilir.
Tedavi
En
etkin
tedavi
cerrahi
düzeltmedir.
Plikasyon,
duplikasyon,
umbrikasyon
uygulanabilen cerrahi prosedürlerdir. Plikasyon genel kabul görmüş ve en sık
uygulanan cerrahi işlemdir. Bu girişim şekli semptomları ve solunum fonksiyon
testlerini önemli derecede düzeltmektedir. Burada evantre olan hemidiyafragma
gergin hale getirilerek akciğer kompliyansı arttırılır, paradoks hareket engellenir ve
mediastinal şift ortadan kalkar. Progresif dispnesi olan, sık tekrarlayan enfeksiyonu
olan hastalarda başarılı bir yöntemdir. Torakotomi veya torakoskopi ile yapılabilir.
Diyafragma Hernileri
Konjenital diafragma hernileri Bochdalek, Morgagni ve özefageal (hiyatal) herniler
olmak üzere üç grupta sınıflanırlar. En sık görülen tip Bochdalek hernileridir.
Diafragma hernilerinin büyük kısmına prenatal veya yenidoğan döneminde tanı
konmaktadır. Tanı daha ileri yaşlara kaldığı zaman sıklıkla diğer hastalıklarla
karışabilmektedir.
167
Morgagni hernisi
Tanım ve etyoloji
Larey aralığı veya diğer adıyla Morgagni deliği sternumun her iki tarafında bulunan
potansiyel bir aralıktır. Morgagni hernisi ise diyafragmatik krusların sternal ve kostal
elementlerinin gelişmemesi nedeni ile oluşan konjenital bir defekttir. Sol tarafta
perikard olması sebebiyle herni oluşumu daha az görülür. Konjenital diyafragmatik
hernilerin %5’ini oluşturur. Septum transversumda geniş bir açıklık söz konusudur ve
bu durum anterolateral bir defekte neden olur. Bu anterior hernilere genellikle ilk tarif
eden hekime ithafen Morgagni hernileri dense de parasternal herni, retrosternal herni,
subkostasternal herni isimleri de kullanılabilmektedir. Bu tip herniler, %80 oranında
sağda, %8 oranında solda, %2 ise bilateral görülür ve %95 olguda herni kesesi
bulunur. Omentum ya da transvers kolon kese içindedir. Yetişkin obez kadınlarda
daha sık görülür.
Klinik
Genellikle doğumda asemptomatiktir ve erişkin yaşa kadar tanı konamayabilir. Ancak
bazı hastalar infant döneminde şiddetli solunum sıkıntısı ile gelebilir.
Semptomatik hastalarda hafif substernal ağrı ve bası hissi olabilir. İnkarserasyon
veya strangülasyon gelişirse şiddetli ağrı ile acile de başvurabilirler. Nadir olarak
abdominal içerik perikarda açılırsa kardiyak tamponad ve ölüme neden olabilir.
Tanı
İlk yöntem PA akciğer grafisidir. Perikardiyal kitle şeklinde görülebileceği gibi barsak
anslarının toraks içinde görülmeleri de mümkündür. Tanıyı kesinleştirmek için toraks
BT kullanılabilir. Özellikle sadece omentum herniasyonlarında BT tanı koydurucudur.
Omental yağlı dokunun tam değerlendirilmesi BT ile yapılamıyorsa toraks MR
çekilebilir. Herniye periton kesesini göstermek için pnömoperitoneum yapılabilir.
Videotorakoskopi de kesin tanı koyduran nisbeten noninvaziv bir yöntemdir.
Tedavi
Morgagni
hernilerinde,
ister
semptomatik
olsun,
ister
asemptomatik
olsun,
inkarserasyon ve strangülasyon riski olduğu için tanı konulduğunda cerrahi ile defekt
düzeltilmelidir. Transtorasik veya transabdominal yaklaşım kullanılabilir. Preoperatif
tanı belli ise transabdominal yaklaşım daha kolay olabilir, çünkü bu şekilde redükte
168
edilen abdominal organların beslenmesi ve fonksiyonel durumlarının değerlendirilmesi
gibi bir avantaj söz konusudur. Üstelik postoperatif ağrı daha az, hastanede kalış
süresi de daha kısadır. Abdominal girişim için epigastrik, median, sağ subkostal veya
paramedian insizyonlardan biri kullanılabilir. Herni bilateral ise median laparatomi ile
yaklaşım daha uygundur. Herniye organların redüksiyonundan sonra genellikle herni
kesesi çıkarılır. Nüksü önlemek için defekt aşırı gergin olmayacak şekilde kapatılır.
Küçük defektler absorbe olmayan sütürlerle primer kapatılırken, büyük defektlerde
sentetik materyal kullanmak gerekebilir (prolen, politetraflouroetilen gibi). Preoperatif
tanı konamamış ve kitle nedeni ile torakotomiye alınmış hastalarda da aynı işlem
başarı ile yapılabilmektedir. Son yıllarda videotorakoskopik veya videolaparaskopik
yaklaşımlar ile başarılı herni onarımları bildirilmektedir. Operasyon sonrası nüks çok
nadir olup, mortalite ve morbiditede düşüktür. Mortalitenin büyük kısmı strangülasyon
nedeni ile oluşmaktadır.
Bochdalek hernisi (Konjenital posterolateral diyafragma hernisi)
Tanım ve etyoloji
V.A. Bochdalek 1848 yılında pleuroperitoneal membranın intrauterin rüptürü sonucu
diyafragmada herniasyon oluştuğunu ileri sürmüştür. Bochdalek’in embryogenez ile
ilgili hipotezi bugün artık geçerliliğini kaybetmiş olmasına rağmen defekt halen onun
ismi ile anılmaktadır. Diğer yandan Bochdalek hernisi ile konjenital diyafragma hernisi
(KDH) eş anlamlı olmamalarına rağmen pratikte oldukça sık olarak birbirleri yerine
kullanılmaktadır. Bugün, gestasyonun 8-10. haftalarında plöroperitoneal kanalın
kapanmasında yetersizlik sonucu diyafragmanın posterolateralinde bir defekt oluştuğu
ve
bu
defektten
intraabdominal
organların
toraks
boşluğuna
geçtiği
kabul
edilmektedir. Defektin ve herniye olan organların hacmine bağlı olarak değişen
derecelerde akciğerde hipoplazi gelişmektedir. Hastaların prognozunu belirleyen en
önemli durum, akciğer hipoplazisinin derecesidir. Akciğerlerde alveollerin ve pulmoner
arteriyollerin sayısı azalırken pulmoner arteriyollerde kas hiperplazisi meydana gelir.
Her 2000–5000 canlı doğumda bir görülür. Çoğunlukla solda (%80) görülmekle birlikte
sağda veya bilateral de görülebilir. Defektin büyüklüğü 1-2cm olabileceği gibi
diyafragmanın total yokluğu da görülebilir. Farklı serilere göre hastaların %1550’sinde eşlik eden kardiyovasküler sistem, santral sinir sistemi ve kromozom
anomalileri bulunabilir.
169
Klinik
Hemen doğumdan sonra başlayan veya ilk günlerde belirginleşen şiddetli solunum
sıkıntısı görülür. Doğumhanede resüssitasyon gerekebilir. Bebeklerin çoğu miadında
doğumdur. Doğumdan hemen sonra skafoid karınlı ve kalp sesleri sağda duyulan
bebeklerde konjenital diyafragma hernisinden şüphelenmek gerekir. Dispne, taşipne,
siyanoz ile birlikte taşikardi bulunabilir.
Eğer herni küçükse asemptomatik kalabilir ve çocukluk çağında yapılan başka
muayene ve tetkikler sırasında tanı konabilir. Çocuklarda beslenme güçlükleri ve
respiratuar komplikasyonlar uyarıcı olmalıdır. Nadiren erişkin döneme kadar sessiz
kalabilir. Erişkinlerdeki sessiz herniler daha çok 4 cm den küçük olup retroperitoneal
yağlı doku hernisi şeklinde görülmektedir. Yine erişkinlerde görülen defektler
çoğunlukla sağdadır, çünkü karaciğer, defekti kısmen kapatarak asemptomatik
olmasına, dolayısıyla daha geç tanı konmasına sebep olur. Bu hastalar, göğüs
duvarında kitle, diare, mide yanması, tekrarlayan pnömoni, tekrarlayan effüzyon
nedeni ile de başvurabilir. Hernisi bilinen hastalarda öksürük nöbetleri veya künt
travma gibi basınç değişimi yaratan durumlar mide ve barsakların toraksa geçişini
sağlayarak akut obstruksiyona sebep olabilirler.
Tanı
Prenatal ultrasonografi (USG) ile herni tesbit edilebilir. Prenatal USG’de karaciğerin
göğüs içinde görülmesi kötü prognoza işaret eder. Postnatal dönemde PA grafide
barsak anslarının veya dekompresyon amacıyla yerleştirilen nazogastrik sondanın
toraks içinde görülmesi tanı için patognomonik bir bulgudur. Prenatal tanı konanlarda
%72, postnatal tanı konanlarda %36 oranında başka patolojiler tespit edilmiştir.
Bochdalek hernisi konvansiyonel radyografilerde akciğerin tabanında diafragma
komşuluğunda opak yumuşak doku dansitesinde görülmektedir. Filmler ön arka ve
lateral pozisyonda değerlendirilmelidir.
Şüpheli olgularda tanı için baryumlu mide
grafisi de çekilebilir.
Tedavi
Yeni doğanda tanı konmuşsa mümkünse vücut dışı membran oksijenasyon-açık kalp
cerrahisinde kullanılana benzeyen bir çeşit oksijenatör (Extra corporal membrane
oxygenation-ECMO) olan bir merkeze gönderilmelidir. ECMO yenidoğan solunum
170
yetmezliğinde kullanılır ve başarı oranı %35–80 arasında değişir. ECMO tedavisine
başlama kriterleri kesin olarak belirlenmemişse de stabilize edilemeyen bebeklerde
uygulanır ve ECMO ihtiyacı bittikten sonra cerrahi uygulanır.
Cerrahi öncesi en az 72 saat süreyle bebek stabilize edilmeye çalışılmalı ve elektif
cerrahi planlanmalıdır, çünkü doğumdan hemen sonra yapılan acil cerrahi girişimlerin
beklenen düzelmeyi salamadığı görülmüştür. Preoperatif sürfaktan tedavisi başarıyı
arttırır. Cerrahi girişim abdominal yoldan paramediyan kesi ile yapılır. Herniye olmuş
abdominal organlar yeniden abdomene çekilip, herni kesesi çıkarılır. Kalan açıklık
küçükse primer kapatılır, büyükse sentetik greftle kapatılır. Ancak sentetik greftle
kapatıldığında rekürren herni gelişebileceği akılda tutulmalıdır. Batın kapatılırken
fasyanın kapatılmasının solunum sıkıntısı yaratabileceği düşünülüyorsa sadece cilt
kapatılabilir. Cerrahi öncesi prognozu tahmin etmek için bazı kriterlere bakılabilir. Kan
gazında PH’nın 7’nin altında olması, PCO2’nin 100 mmHg’nın üstünde olması,
midenin toraks içinde olması, pnömotoraks gelişmesi kötü prognostik göstergelerdir.
Hiatal Herniler
Tanım ve etyoloji
Hiatal herni, diyafragma üzerinde bulunan özofageal açıklıktan batın içi organların
toraksa fıtıklaşması olarak tanımlanır. Özofageal açıklık T10 vertebra seviyesinde,
sağ krusun liflerinden oluşan 2-3cm genişliğinde müsküler bir tüneldir. Sol krus bu
yapıya genellikle hiç katılmaz. Özofagus ve bu hiyatus arasında doğrudan bir ilişki
yoktur. Ancak transvers fasia abdomenden yukarı doğru uzanıp, hiatusta 2cm kadar
yükselerek özofagusun yapısına katılır. Bu yapı frenoözofageal ligament adını alır ve
özofagusu sabitleyerek yukarı kaymasına engel olur.
Birbirinden ayrı kavramlar olmakla birlikte hiatal herniler çoğunlukla gastroözofageal
reflü (GÖR) ile birlikte görülür. GÖR; gastrik içeriğin anormal şekilde özofagusa
geçerek semptom veya doku hasarına yol açmasıdır. GÖR normalde, yemek sonrası
ve geğirme ile beraber görülebilir. Patolojik reflü demek için, mide ekşimesi, mide
içeriğinin ağıza kadar gelmesi gibi semptomlar ve özofajit veya aspirasyon
komplikasyonları gerekir. Hiatus bölgesinde normalde reflü olmasını engelleyen
mekanizmalar bulunur. Bunlar;
a- Hiatusu oluşturan sağ krus lifleri özofagusun kapanmasına yardımcı olur.
b- Özofagus mideye oblik açıyla girdiği için, intraabdominal basınç artışı fundus
aracılığıyla distal özofagusa bası yapıp kapalı kalmasına yardımcı olur.
171
c- Özofagus distal kısmında fizyolojik sfinkter rolü üstlenen 3-5cm’ lik bir yüksek
basınç alanı bulunur. Bu sfinkter normalde özefagus alt ucunu kapalı tutarken
sadece yutma sırasında açılmasını sağlar.
d- Özofagogastrik bileşkedeki mukoza normalden daha kalın ve gevşek yapıya
sahip olduğu için mekanik bir bariyer göreviyle reflüye engel olur.
Etyolojiye bakınca tek bir neden göstermek mümkün değildir. Travmatik, konjenital,
iatrojenik (çeşiltli cerrahiler sırasında) sebeplerle herni oluşabilir. Konjenital olanlar
genellikle bebeklik döneminde, ilk 6–9 ayda, regürjitasyon ve kusmaya bağlı olarak
oluşur. Sliding tipindedir ve çoğunlukla büyümeyle asemptomatik hale geçer. İleri
yaşlarda da konjenital olarak kas ve fasia zayıflığına bağlı olarak herni oluşabilir.
Obezite ve hamilelik gibi intraabdominal basıncı arttıran durumlarda gelişebilir.
Hiatal herniler anatomik olarak dört sınıfta incelenirler.
Tip I hiatal herni
En sık görülen tiptir. Sliding veya kayma hernileri de denir. Frenoözofageal ligament
uzamış, zayıflamıştır, ancak çepeçevre sağlamdır. Bu gerilme sonucu gastrik
kardiyanın bir kısmı hiatustan toraksa doğru çıkar ve gastroözofageal bileşke de
toraksa yükselir. İntraabdominal basıncı arttıran gebelik, obezite ve şiddetli kusma
gibi durumlar tip I hiatal herni sebebi olabilir. Anormal GÖR ortaya çıkmaz ve bu
nedenle hastaların çoğu asemptomatiktir. Bu nedenle gerçek insidansını bilmek
mümkün değildir.
Tip II hiatal herni
Paraözofageal herni de denir. Frenoözofageal ligament anterior ve lateralde kısmi
zayıflık gösterir ve bu zayıf bölgeden mide fundusu toraks içine girer.
Daha az
görülmesine rağmen acil cerrahi gerektirebileceği için daha önemlidir. Kardia ve distal
özofagus intraabdominal seyrettiği için reflü yoktur. Anterolateraldeki defekt peritonun
yukarı geçişine izin verdiği için herni kesesi vardır. Toraks içi negatif basınç etkisiyle
bu herni kesesi büyüme eğilimindedir. Herni kesesi içindeki midede torsiyon, volvulus,
akut dilatasyon, obstruksiyon gibi ölümcül komplikasyonlar nedeniyle acil cerrahi
girişimler gerekebilir.
172
Tip III hiyatal herni
Kombine tip olarak bilinir (tip I ve tip II). Hem gerçek bir herni kesesi vardır, hem de
kardia diyafragmanın üzerindedir. Kardia toraks içinde olduğu için gastroözofageal
reflü de vardır. Tedavi edilmeyen tip II herniler zamanla tip III herniye dönüşebilir. Tip
II hernideki komplikasyonlar burada da sözkonusu olduğu için tanı konduğunda
cerrahi tedavi düşünülmelidir.
Tip IV hiyatal herni
Paraözefageal herni kesesi içinde, mide dışında bir organ daha bulunması
durumudur. Genellikle transvers kolon, omentum bulunurken bazen, dalak ve ince
barsaklar da herni kesesinde olabilirler. Tip III’de olduğu gibi, komplikasyon olasılığı
nedeni ile tanı konulduğunda cerrahi olarak tedavi edilmelidir.
Klinik
Tip I hiatal hernilerin spesifik semptomları yoktur. GÖR’le ilişkili semptomlar
görülebilir. Substernal yanma ve epigastrik ağrı çok görülür. Özofajite bağlı
semptomlar görülebilir ama çoğunlukla subjektif bulgulardır. Eğilmek ve zorlama ile
reflü semptomları artarken ayakta dik durmakla azalır. Reflüye bağlı mural ödem,
strüktür ve bunun sonucu disfaji görülebilir. Tip II’de de çoğunlukla semptom yoktur,
yıllarca sessiz kalabilir. Ancak tip II ve III’de herni kesesine bağlı semptomlar
görülebilir. Distal özefagusa bası ile disfaji, ağrı görülebilir. Postprandiyal respiratuar
semptomlar tipiktir. Herni kesesi içine giren mide erozyonuna bağlı kronik kanama ve
anemi görülebilir. Mide perforasyonu ve buna bağlı olarak mediastinit, ampiyem
gelişebilir. Obstrüksiyon, volvulus, enfarkt görülebilir. Tip IV’de bütün bu semptomlara
ilave olarak transvers kolon ve dalak herniasyonuna ait bulgular olabilir.
Tanı
PA akciğer grafisinde hava sıvı seviyesi veren retrokardiyak hava görülebilir. Büyük
herniler sağ tarafa geçerek sağ hemitoraksda kitle veya kist gibi görünebilir. En iyi tanı
yöntemi üst gastrointestinal sistemin baryumlu grafi ile değerlendirilmesidir. Herniyi
daha iyi göstermesi için batına bası uygulanarak, valsalva yaptırılarak veya baş aşağı
pozisyonda çekilmelidir. Daha sonra alt özefageal sfinkter fonksiyonlarını ve
komplikasyonları değerlendirmek için fleksıbl fiberoptik özofagoskopi
yapılmalıdır.
Tanıda zorluk varsa özofageal fonksiyon testleri (pH monitorizasyonu, manometri, asit
perfüzyon testi) gerekebilir.
173
Tedavi
Tip I hernilerde tedavi, semptomların ve özefajitin derecesine göre belirlenir.
Asemptomatik olanlarda tedavi gereği yoktur. İleri derece özefajiti olanlarda çoğu kez
reflüyü azaltmaya yönelik cerrahi uygulanır. En yaygın kullanılan antireflü prosedürü
Nissen fundoplikasyonudur. Belsey Mark IV ve Hill posteriyor gastroplekside daha az
uygulanan cerrahi prosedürlerdir. Özofajit ileri evre ve irreversibl değişiklikler
oluşmuşsa özofagus rezeksiyonu da gerekebilir. Tip II,III ve IV’de ise herni kesesi
olduğu için cerrahi onarım gerekir; bu vakaların %25’nde kanama, nekroz,
perforasyon gelişebilir. Primer hiatus onarımı uygulanır ama, rekürrensi engellemek
için prolen greftlerle hiatusu desteklemek gerekir. Beraberinde özefajit varsa antireflü
prosedür eklemek gerekir.
Diyafragma Tümörleri
Diyafragmanın primer tümörleri ilk kez 1868’de Grancher tarafından bildirilmiştir.
Asemptomatik olan ve otopsi sırasında tespit edilen bu vakada fibrom tespit edilmiştir.
Tüm yaş gruplarında görülebilen ancak oldukça nadir tümörlerdir. Benign ve malign
olarak iki grupta incelenir. Bir çalışmada benign/malign oranı 1.6/1 olarak
bulunmuştur. Benign tümörler eğer semptomatikse veya malignleşme ihtimali varsa
rezeke edilir. Malign tümörler primer, metastatik veya komşu organlardan direk
invazyonla gelişebilir. Primer tümörleri oldukça nadir görülür. En sık görülen
rabdomyosarkomlardır. Leomyosarkomlar daha nadir görülür, asemptomatik olabilir
ve total olarak rezeke edilen durumlarda kür umulabilir. 1963 yılında yapılmış 71
olguluk bir yayında en sık malign tümör olarak fibrosarkom saptanmıştır. Metastatik
tümörleri birçok organdan olabilir, ancak az görülür. En sık komşu organlardan direk
invazyon yoluyla yayılan tümörler görülür. Akciğer, plevra, özefagus ve batın içi
organların tümörlerinde diafragma invazyonu gelişebilir. Özellikle over ve karaciğer
kanserlerinde total diyafragma rezeksiyonu gerekebilir.
Diafragmanın benign tümörleri ise lipom, mezotelyal kist, nörofibrom ve angiofibrom
olarak bildirilmiştir. Lipomlar çoğunlukla tesadüfen bulunur. Bazen öksürük, dispne,
aritmi, göğüs ağrısı hatta çok nadiren diyafragma rüptürü ve ölüm bile görülebilir.
Hastaların çoğu asemptomatiktir ve otopsi çalışmalarında veya başka nedenlerle
yapılan görüntülemelerde lezyon tesadüfen saptanabilir. Bazen de tümörün büyüyüp
yer işgal etmesine bağlı veya etraf dokuya invazyonuna bağlı semptomlar görülür.
174
Tümör göğüs duvarını invaze ederse göğüs ağrısı, hıçkırık, öksürük, dispne olabilir.
Sol hemidiyafragma tutulmuşsa kitle dışarıdan palpe edilebilir, karın ağrısı ve disfaji
olabilir.
Diyafragma tümörleri oldukça büyük boyutlara ulaşabilirler. Ancak malign olanlara
genellikle daha küçük boyutlarda iken ve bazen de uzak metastazla tanı konabilir.
Benign lezyonlarda kitle etkisi ile semptom verme olasılığı daha yüksektir.
Çocuklarda diyafragma tümörleri incelendiğinde,
kız ve erkek çocuklarda aynı
oranda olduğu tespit edilmiştir. Onsekiz yaş altı 41 hastayı içeren bir çalışmada en sık
malign tümör rabdomyosarkom, en sık benign tümör ise lenfangiom ve hemangiom
olarak bulunmuştur. Toraksla ilişkili semptomlar, abdomenle ilişkili semptomlardan
daha ön plandadır.
Tanı için genellikle USG, BT ve MR yeterlidir. Malign tümörlerde, hücrelerin
histolojisine göre kemoterapi uygulamaları veya mümkünse cerrahi rezeksiyon
uygulanabilir. Benign tümörler ise preoperatif tanı yoksa cerrahi sırasında total olarak
eksize edilirler. Ancak malign potansiyeli olmayan ve kitle etkisi yapmayan küçük
benign tümörlerde konservatif kalınılabilir. Germ hücreli tümörlerde ise kemoterapiye
oldukça iyi cevap verdikleri için genellikle cerrahiye gerek yoktur.
KAYNAKLAR
1. Başoğlu A.Konjenital posterolateral diyafragma hernisi. In Ökten İ, Güngör A. Ed.
Göğüs Cerrahisi; 2003:771-74.
2. Battista S, Bar F, Bucchi MC, et all. Primary leiomyosarcoma of the diaphragm in
a 23-year-old male:a case report. European Journal of Internal Medicine,
2000;11(5):283-285
3. Cada M, Gerstle J.T, Traubici J, et all. Approach to diagnosis and treatment of
pediatric primary tumors of the diaphragm. Journal of Pediatric Surgery,
2006;41(10): 1722-1726.
4. Clugston R.D, Greer J. Diaphragm development and congenital diaphragmatıc
hernia. Seminars in Pediatric Surgery, 2007;16(2):94-100.
5. Demircan S. Diyafragma Paralizisi. In Ökten İ, Güngör A. Ed. Göğüs Cerrahisi;
2003:765-68.
6. Downey RJ. Tumors of the Diaphragm. In Shields TW, LoCicero J, Ponn RB,
Rusch VW, ed. General Thoracic Surgery, vol 2, 6th ed. Philadelphia: Lippincott
Williams and Wilkins; 2005:777-785.
175
7. Eren S, Çiriş F. Diaphragmatic hernia: diagnostic approaches with review of the
literature. European Journal of Radiology, 2005;54(3):448-459.
8. Gürkök S, Genç O. Diyafragma paralizisi ve diyafragma uyarımı. Türkiye
Klinikleri, 2005;25:111-117.
9. Hussong R.L, Landrenaeu RJ, Cole H. Diagnosis and repair of a morgagni hernia
with
video-assisted
thoracic
surgery.
The
Annals
of
thoracic
Surgery,
1997;63(5):1474-1475.
10. Kim M. P., Hofstetter W.L. Tumors of the Diaphragm. Thoracic Surgery Clinics,
2009:19(4); 521-529.
11. Minneci P.C, Deans K.J, Kim P, et all. Foramen of Morgagni hernia: changes in
diagnosis and treatment. The Annals of Thoracic Surgery, 2004; 77(6):1956-1959.
12. Nasr A, Fecteau A. Foramen of Morgagni Hernia: Presentatıon and treatment.
Thoracic Surgery Clinics, 2009;19(4):463-468.
13. Patel HJ, Tan B, Yee J et all. A 25-year experience with open primary
transthoracic repair of paraesophageal hiatal hernia. The Journal of Thoracic and
Cardiovascular Surgery, 2004;127 (3):843-849.
14. Perch P,
Houck W.V, DeAnda A. Symptomatıc Bochdalek hernia in an
octogenarian. The Annals of Thoracic Surgery, 2002;73(4):1288-1289.
15. Reynolds M. Congenital posterolateral diaphragmatic hernias and other less
common hernias of the diaphragm in infants and children. In Shields TW, LoCicero
J, Ponn RB, Rusch VW, ed. General Thoracic Surgery, vol 2, 6th ed. Philadelphia:
Lippincott Williams and Wilkins; 2005:761-772.
16. Strauch JT, Aleksic I, Schorn B, et all. Leomyosarcoma of the diaphragm. The
Annals of thoracic Surgery, 1999;67(4):1154-1155.
17. Traubici J, Daneman A, Jordan A.H. Primary germ cell tumor of the diaphragm.
Journal of Pediatric Surgery, 2004; 39(10): 1578-1580.
18. Vagefi P.A, Morse C.R. Bochdalek Hernia in an adult. Journal of the American
Collage of Surgeons, 2009;209(4):540.
176
17.
Yrd. Doç. Dr. Sami Karapolat
Düzce Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
PLEVRANIN CERRAHİ ANATOMİSİ VE FONKSİYONU
Plevra solunum siklusu esnasında birbirlerinin üzerinde kayan iki adet seröz
membrandan oluşmuş bir yapıdır. Bunlardan visseral plevra tüm akciğerlerin dış
yüzünü ve loblar arasındaki fissürleri sarmaktadır. Parietal plevra ise kostalar ve
interkostal kasların iç yüzeyleri ile mediastenin yan kısımlarını ve diafragmanın
üzerini örtmektedir. Bu iki plevral membran birbirinin devamı niteliğindedir ve toraks
boşluğunun ön, arka ve alt kenarlarında oluk şeklinde keskin bölümler yaparak
sinüsleri oluşturmaktadır. Plevral kavite üstte klavikulanın üzerinde birinci kostanın
vertebra ile eklemleştiği seviyeye kadar yükselmektedir. Bu bölgede subklavian arter
ve ven plevra apeksinin önünde yer almaktadır (1).
Akciğerlerin dış yüzeyi ve koruyucu toraks kavitesinin iç yüzeyi plevral kaviteyi
oluşturmak için elastik, seröz ve nispeten yağlı bir membranla kaplanmıştır. Plevral
yapraklar arasındaki potansiyel boşluk plevral boşluk olarak adlandırılmaktadır ve
seröz bir sıvı içermektedir. Bu sıvı plevral yüzeyleri kayganlaştırmakta ve solunum
esnasında membranların birbirlerinin üzerinde rahatça kaymalarını sağlamaktadır.
Solunum organları ve kalbe ait hareketler plevral sıvının redistribüsyonunu
sağlamakta ve plevral yüzeyler arasındaki sürtünmeyi en alt seviyede tutmaktadır (2).
Ek olarak sıvının yüzey gerilimi akciğer yüzeylerinin toraks duvarı ile temasını sağlar.
Böylece solunumla göğüs genişledikçe akciğerler de genişlemektedir (3). Plevral
kavitedeki sıvının miktarı hidrostatik-onkotik basınç ilişkisi ve plörolenfatik drenaj
tarafından kontrol edilmektedir. Fazla miktardaki mayi, proteinler, büyük partiküller ve
hücreler stomalar ve diyafragma, subkostal bölge ve aşağı mediastinumda bulunan
lenfatik lakünalar vasıtasıyla uzaklaştırılırlar (4). Bu uzaklaştırma işlemi solunum
hareketleri ile hızlandırılır ve plevral basıncın topografik farklılıklarından kısmen
sorumludur. Stomaların bu lokalizasyonunda bulunan Kampmeier odakları, santral
kapiller ve lenfatik damarlar ile lenforetiküler ve aktive olmuş mezotelyal hücrelerle
birlikte kümeler oluşturmaktadır. Bunlar aynen tonsillalar gibi davranırlar ve plevral
kaviteden göğüs duvarı ve mediastinuma geçişi filtre ederler (5). Plevranın farklı
ultrastrüktürel yapıları plevral sıvının salınması ve geri emilmesi ve lokal inflamatuvar
177
yanıt gibi plevral membranların temel fonksiyonları ile yakın bir ilişki gösterir. Plevral
sıvı hidrostatik ve onkotik basınç gradientine göre plevral alan içine doğru
süzülmektedir. Sıvı muhtemelen viskoz akım direnci ve hidrostatik basınç tarafından
belirlenen vertikal basınç gradienti boyunca aşağı doğru akar. Ayrıca kostal
plevradan mediastinal ve interlober bölgelere doğru sıvının net bir akımı olabilir. Bu
alanlarda plevral sıvı primer olarak parietal plevral yüzeydeki lenfatik stomalar içinden
geri emilmektedir (6).
Plevral sıvı hipoonkotik (1 gr/ dl protein) vasıftadır ve miktarı oldukça azdır (ort 0.3
ml/ kg). Bu sıvının devir hızı ortalama olarak 0.15 ml/kg/saat’tir. Plevral sıvı parietal
plevrada üretilir ve reabsorbsiyonu da parietal plevra lenfatiklerince olur. Plevral
lenfatiklerin akım hızı plevral sıvı hacminin kontrol edilmesi için plevral sıvı
üretimindeki artışa cevap olarak artabilir. Bu kontrol oldukça etkilidir. Örneğin, plevral
sıvının üretim hızında oluşan 10 kat artış bile toplam sıvı hacminde sadece %15’lik
bir artışa neden olmaktadır. Ancak üretim maksimum plevral lenfatik akım miktarını
geçerse plevral efüzyon meydana gelmektedir (7).
Plevranın embriyolojisi
Plevral kavite embriyonik gelişimin 4–7. haftaları arasında oluşmaktadır. Sağ ve sol
plevral kaviteler primitif çölomik yapının intraembriyonik parçasından türemektedirler.
Primitif çölom embriyonun her iki yarısında lateral mezodermin splanknik ve somatik
tabakalarının içine doğru ayrılması ile oluşmaktadır. Bu ikiye ayrılmış kaviteler daha
sonra perikardiyal kavite, plevral kaviteler ve peritoneal kaviteyi oluştururlar. Bölünme
aşaması tek septum transversum, çift plöroperikardiyal katlantı ve çift plöroperitoneal
katlantıları meydana getirir. Septum transversumun dorsalindeki sağ ve sol çölomik
boşluklar belli bir dönem için nispeten açılmadan kalır ve bunlar plevral kanallar
olarak adlandırılır. Bu plevral kanallar mediastinumun her iki yarısında da yer
almaktadırlar. Plöroperitoneal katlantıların
gelişimi perikardiyal ve peritoneal
kavitelerden plevral kanalların ayrılması ile tamamlanır. Gelişimin 4. haftasında
farinksin zemininde oluşan laringotrakeal tomurcuklanma göze çarpmakta ve 5.
haftada her iki akciğer tomurcuğu ayrı ayrı plevral kanalların içine doğru genişlemeye
başlamaktadır. Plevral alanların akciğerlerdeki büyüme ile birlikte açılmaya başladığı
da bilinmektedir. Bu büyüme ile akciğerler ve plöroperikardiyal membranlar kalbin her
iki yanında uzanmaya başlarlar ve plöroperitoneal katlantılar diyafragmanın bir
parçası olurlar. Plevral kanalların içine doğru akciğerlerin genişlemesi olayında
178
splanknik mezoderm mezenkim ile kaplı bronşiyal ağacın üzerini örtmek için bu
bölgeye yönlenmektedir. Splanknik mezoderm plevranın mezotelyal tabakasını
oluşturmak için incelmeye başlar. Hemen sonrasında bu tabakanın altındaki
mezenkimal doku plevranın konnektif dokusunu oluşturur. Böylece splanknik
mezoderm visseral plevrayı somatik mezoderm ise parietal plevranın önemli bir
kısmını meydana getirir.
Plevranın histolojisi
Visseral ve parietal plevra yaprakları hemen hemen aynı kalınlıktadırlar (Ortalama
30-40 µm) ve benzer histolojik özelliklere sahiptirler. Bu durumun tek istisnası parietal
plevrada bulunan ancak visseral plevrada bulunmayan stomalardır. Bu yapılar
yuvarlak veya oval şekillidir ve diyafragmatik plevral yüzeyde bulunurlar. Stomaların
plevral kavite ile altta yatan lenfatik lakünalar arasında bağlantı kurduğu
bilinmektedir. Sıvı, partikül ve çeşitli hücrelerin plevral kaviteden diyafragmatik
lenfatiklerin içine doğru hızlıca uzaklaştırılmalarından sorumludurlar (8).
Plevral yaprakların histolojik katmanları şu şekildedir (9):
1. Mezotelyal hücre tabakası
2. Submezotelyal intersisiyel konnektif doku tabakası
3. İç ince elastik lif tabakası
4. Dış intersisiyel konnektif doku tabakası
5. Kalın elastik lif tabakası
Göğüs duvarındaki kas tabakaları ve parietal plevra bir yağ tabakası ile birbirinden
ayrılmaktadır. Her iki plevra yaprağındaki mezotelyal hücrelerin kalınlığı yaklaşık 1-4
µm arasında, ebatları ise 16.4±6.8 ve 41.9±9.5 µm arasında değişmektedir (10).
Bunlar genel olarak oval nükleuslu ve ince sitoplazmalı yassı hücrelerdir. Ancak bu
hücrelerin şekilleri plevral membranlardaki lokalizasyonlarına göre değişebilmektedir.
Ayrıca
mezotelyal
hücreler
fagositoz
yeteneği
kazanarak
plevral
sıvıdaki
makrofajların bir kısmını oluşturabilirler.
Mezotelyal hücrelerin apikal bölgelerinde sıkı bağlantılar ve fırça benzeri “mikrovillus”
adı verilen uzantılar bulunmaktadır. Bu mikrovilluslar visseral plevradaki hücrelerde
daha yoğun olarak bulunmakta ve toraksın alt kısmına doğru bu yoğunluk giderek
artmaktadır. Mikrovillusların üst yüzeyi hyalüronik asit ve zengin lipoprotein içeren bir
179
sıvı ile kaplanmıştır. Mikrovilluslar tuttukları bu mukopolisakkaritler ile bir yüzey
tabakası oluşturur ve plevrada sürtünme ile oluşabilecek irritasyonu engellerler,
böylelikle solumun işinin yükünü azaltırlar (1). Hücre membranının bazal kısmında ise
nadir desmozomlar ve gap junction tespit edilebilir. İmmünhistokimyasal inceleme ile
mezotelyal hücrelerde düşük ve yüksek molekül ağırlığına sahip sitokeratin içeriği
gösterilmiştir (11, 12). Normal mezotelyal hücreler; vimentin, epitelyal membran
antijeni, karsinoembriyojenik antijen ve faktör VIII ilişkili antijen ile reaksiyona
girmezler. Mezotelyal hücreler olmazsa akciğerler normal fonksiyon göremezler ve
plevral kavite fibrozis ile hızla oblitere olur. Aktif hale gelen mezotelyal hücreler
plevral kavitenin açıklığının devam etmesi için esnek yapıları ve zengin organel ve
enzim içeriği ile fibrinolizis gibi fonksiyonlara katılırlar.
Mezotelyal tabakanın bazal membranının altında gevşek bir konnektif doku tabakası
mevcuttur. Bu submezotelyal tabaka kollajen doku, elastik lifler, küçük kan damarları,
lenfatik ağ ve sinir liflerini içerir. Bu tabakadaki mezenkimal hücreler fibroblastların
karakteristik özelliklerine sahiptirler ve sitokeratin, karsinoembriyojenik antijen ve
faktör VIII ilişkili antijen ile reaksiyona girmezler.
Plevranın anatomik özellikleri
Visseral plevra akciğer yüzeyi ile kenetlenmiş pozisyondadır ve majör ve minör
fissürlerin iç kısımlarına doğru uzanmaktadır. Ayrıca visseral plevra birçok aksesuar
fissürün şeklini de belirlemektedir. Pulmoner ligament hilus bölgesinden kaudal
olarak diafragmanın yanında uzanır, visseral plevranın iki yan yana duran
tabakasından oluşur ve parietal plevra ile devamlılık gösterir. Akciğer yüzeyine
yapışık olan visseral plevra bu bölgede doğal bir klivaj oluşturulmasına izin vermez.
Eğer visseral plevra akciğer parankiminden soyularak ayrılırsa oluşan yüzeyden
sayısız hava kaçağı olan bölge ve küçük kanama odakları meydana gelir (10). Ayrıca
visseral plevra akciğerlere düz bir yüzey sağlayarak onların parietal plevra üzerinde
kolayca hareket etmesine imkân sağlar.
Parietal plevra göğüs duvarı, mediastinum ve diyafragma boyunca uzanmaktadır ve
her iki tarafta torasik inlet bölgesinde plevral kubbe veya kupulayı oluşturur. Parietal
plevra
kostal, mediastinal, diyafragmatik ve servikal olamk üzere dört kısımdan
ibarettir. Kostal plevra toraks duvarının iç yüzünü örter ve bu bölgeden endotorasik
fasya ile ayrılır. Bu endotorasik fasya diyafragma ile diyafragmatik plevra arasında
ince bir konnektif doku tabakası halindedir. Mediastinal plevra önde sternumdan
180
arkada torasik omurgaya kadar uzanır ve perikard ile mediastinal yapıları kaplar. Ön
ve arkada kostal, aşağıda diyafragmatik ve üstte servikal plevra ile devam eder.
Hilusun altında mediastinal plevra özofagusun hemen önünden dış tarafa doğru
geçer ve burada pulmoner ligamente katılır. Diyafragmatik plevra mediastinumun her
iki yanında diyafragmanın üst ve torasik bölümlerini örter, diyafragmatik yüzeye ve
organlara sıkıca yapışmıştır ve normalde bu oluşumlar arasında klivaj planı
bulunmamaktadır (bu bölgede plevra kolayca sıyrılamaz, disseke edilemez
anlamında). Benzer şekilde mediastinal plevra perikarda yoğun bir yapışıklık gösterir.
Ancak mediastinal plevranın kalan kısmı, kupula bölgesindeki plevra ve kostal plevra
altta kalan dokulardan kolayca diseke edilebilmektedir. Göğüs duvarında elde
edilecek klivaj planı zayıf konnektif doku ile yağ dokusu tabakaları arasındadır ve
endotorasik fasya altta yatan göğüs duvarına ait kemik, kas ve vasküler yapılara
yapışıktır (10). Servikal plevra torasik inletten boyun köküne kadar uzanır, akciğer
apeksinde plevral kubbeyi meydana getirir ve kostal ile mediastinal plevranın
devamıdır.
Topografik olarak diafragmatik, mediastinal ve kostal plevraların birleşme hatları
boyunca plevral sinüsler (resessuslar) meydana gelir. Plevranın keskin ön kenarı
sternumun komşuluğunda mediastinal ve kostal plevranın birleştiği hat boyunca tespit
edilebilmektedir. Plevranın alt kenarı ise kostal ve diyafragmatik plevra arasındaki
birleşme hattı tarafından oluşturulmaktadır. Posterior kenar torasik vertebraların
yanında bulunan mediastinal plevranın posterior kenarı ile kostal plevranın birleşmesi
tarafından oluşturulur. Parietal plevranın yön değiştirdiği, plevral boşluğun bir
duvarından diğerine giderken oluşan keskin hatlar plevral refleksiyon hatlarıdır.
Mediastinal ve kostal plevraların anterior refleksiyonu plevral kese içinde ince ve
keskin küçük boyuttaki kostomediastinal resessusu oluşturur. Benzer bir resessus
daha
büyük
olan
kostodiyafragmatik
resessustur.
Bu
resessus
kostal
ve
diyafragmatik plevraların refleksiyonları tarafından oluşturulan plevral kesenin
tabanındadır. Bununla beraber plevranın anterior, inferior ve posterior kenarlarının
topografik lokalizasyonları bir dereceye kadar değişebilmektedir.
Her iki plevral kesenin inferior kenarları 7. kaburganın kıkırdağı boyunca lateralde
birbirinden ayrılır ve 8, 9 ve 10. kaburgaları çaprazlar. Bunlar yaklaşık olarak ortaaksiller hatta 11. kaburganın orta kısmında en alt seviyelerine ulaşırlar. Bu noktadan
sonra hemen hemen horizontal bir rota takip ederler; 12. kaburgayı çaprazlarlar ve
12. torasik vertebranın üstünde posterior plevral kenar ile birleşirler.
181
Plevranın kan akımı
Visseral plevra bronşiyal ve pulmoner arter sisteminin her ikisinden de kan
almaktadır. Bununla beraber, Albertine ve arkadaşları koyunlarda visseral plevra kan
akımının tamamı ile bronşiyal arter sisteminden geldiğini göstermişlerdir (13).
Visseral plevra yaygın ve dilate bir kapiller ağa sahiptir. Bu kapillerler alveoler
kapillerlere nazaran 10 kat daha geniştirler. Venöz drenaj ise pulmoner venler yoluyla
sağlanmaktadır. Parietal plevranın kan akımı ise göğüs duvarı, diyafragma ve
mediastinumu besleyen farklı sistemik arteriyel damarlar ve subklavian arterlerden
gelmektedir. Kostal bölümler daha çok interkostal arterlerden, diafragmatik ve
mediastinal bölümler ise internal mammarian arterlerden kan almaktadırlar. Genel
olarak venöz drenaj uygun komşu venlere ve bazen direkt olarak Vena kava
süperiora olmaktadır.
Plevranın lenfatik drenajı
Visseral plevranın subplevral alanı geniş bir lenfatik kanal ağına sahiptir. Ancak
nadiren subplevral lenf nodu tespit edilebilmektedir. İntrapulmoner lenf nodlarının
insidansı bir çalışmada %18 olarak bulunmuştur (14). Ancak bu çalışmada subplevral
alanda lenf nodu tespit edilememiştir. Radyolojik olarak yuvarlak nodüler lezyon
(coin) lezyon olarak tariflenen ve cerrahi olarak çıkarılan bu lokalizasyona ait bir lenf
nodu vakası Greenberg tarafından bildirilmiştir (15). Subplevral lenf nodlarının tespiti
helikal tomografinin popüler hale gelmesinden sonra sıklaşmıştır. Bu lenf nodları
küçük primer veya metastatik akciğer tümörlerinden ayırt edilmelidirler. Yüksek
çözünülürlüklü
tomografiler
bu
konuda
klinisyenlere
daha
fazla
yardımcı
olmaktadırlar. Yokomise ve arkadaşları yapmış oldukları bir çalışmada bu lenf
nodlarının yaklaşık 10 mm boyutunda, oval şekilli ve homojen yapıda olduklarını
bulmuşlardır. Ayrıca burada tespit edilen subplevral lenf nodlarının %72‘si
akciğerlerin alt lob lokalizasyonlarında bulunmuştur (16).
Visseral plevranın lenfatik drenajı başlıca interlober ve peribronşiyal alanda lokalize
olmuş derin pulmoner pleksusa olmaktadır. Ancak Riquet ve arkadaşları akciğer
segmentlerinin incelendiği çalışmalarında %22–25 oranında mediastinal lenf nodları
ile doğrudan subplevral lenfatik bağlantılar olduğunu tespit etmişlerdir (17). Bu
subplevral bağlantılar alt loblara nazaran üst loblarda daha sıktırlar.
182
Parietal plevranın lenfatik drenajı parietal plevraya ait lenfatik kanalların içine doğru
olmaktadır. Bu süreçte Kampmeier odakları ve stomalar önemli görevler alırlar. Bu
yolun plevral alandaki tümör hücrelerinin ve eritrositlerin uzaklaştırılmasında rolü
olduğu düşünülmektedir. Göğüs duvarının lenfatik ağ yapısı önde internal
mammarian zincire arkada ise interkostal zincire doğru drene olmaktadır.
Diafragmatik plevranın drenajı retrosternal ve mediastinal lenf nodlarına olduğu kadar
batındaki çölyak lenf nodlarına doğruda olmaktadır.
Plevranın innervasyonu
Parietal plevra n. vagus, n. phrenicus, sempatik zincir ve interkostal sinirler yolu ile
gelen somatik, sempatik ve parasempatik liflerle innerve edilmektedir. Diafragmatik
plevranın santral bölgesi duyu liflerini frenik sinirden, periferik bölümleri ise interkostal
sinirlerden almaktadır. Dolayısıyla periferik bölümlerin irritasyonu lokal ağrı ve toraksbatın duvarlarına yansıyan ağrıya neden olur. Ancak santral diafragmatik yüzün
irritasyonu ile sırt ve omuzlarda ağrı hissedilir. Visseral plevra sinirlerini n. vagus ve
sempatik zincirden alır. Ancak somatik inervasyondan yoksundur ve ağrılı uyaranlara
karşı duyarlı değildir.
KAYNAKLAR
1. Arseven O, Tabak L. Solunum sisteminin gelişimi ve yapısal özellikleri. In Arseven
O. ed. Akciğer Hastalıkları; 2002:1-19.
2. Lai-Fook SJ. Pleural mechanics and fluid exchange. Physiol Rev. 2004;84(2):385410.
3. Arı Z. Toraks. In Şahinoğlu K. ed. Kliniğe yönelik anatomi; 2007: 59-174.
4. Wang NS. Anatomy of the pleura. Clin Chest Med. 1998;19(2):229-40.
5. Wang NS. Anatomy and physiology of the pleural space. Clin Chest Med.
1985;6(1):3-16.
6. Lee KF, Olak J. Anatomy and physiology of the pleural space. Chest Surg Clin N
Am. 1994;4(3):391-403.
7. Miserocchi G. Physiology and pathophysiology of pleural fluid turnover. Eur Respir
J. 1997;10(1):219-25.
183
8. Li J. Ultrastructural study on the pleural stomata in human. Funct Dev Morphol.
1993;3(4):277-80.
9. Antony VB, Sahn SA, Mossman B, Gail DB, et al. NHLBI workshop summaries.
Pleural cell biology in health and disease. Am Rev Respir Dis. 1992;145(5):1236-9.
10. Shields TW. Anatomy of the pleura. In: Shields TW, Locicero III J, Reed CE,
Feins RH, eds. General Thoracic Surgery, vol 1, 7th ed. Philadelphia: Lippincott
Williams and Wilkins; 2009: 729–734.
11. Bolen JW, Hammar SP, McNutt MA. Reactive and neoplastic serosal tissue. A
light-microscopic, ultrastructural, and immunocytochemical study. Am J Surg
Pathol. 1986;10(1):34-47.
12. Dervan PA, Tobin B, O'Connor M. Solitary (localized) fibrous mesothelioma:
evidence against mesothelial cell origin. Histopathology. 1986;10(8):867-75.
13. Albertine KH, Wiener-Kronish JP, Roos PJ, Staub NC. Structure, blood supply,
and lymphatic vessels of the sheep's visceral pleura. Am J Anat. 1982;165(3):27794.
14. Trapnell DH. Recognition and incidence of intrapulmonary lymph nodes. Thorax.
1964;19:44-50.
15. Greenberg HB. Benign subpleural lymph node appearing as a pulmonary "coin"
lesion. Radiology. 1961;77:97-9.
16. Yokomise H, Mizuno H, Ike O, Wada H, et al. Importance of intrapulmonary lymph
nodes in the differential diagnosis of small pulmonary nodular shadows. Chest.
1998;113(3):703-6.
17. Riquet M, Hidden G, Debesse B. Direct lymphatic drainage of lung segments to
the mediastinal nodes. An anatomic study on 260 adults. J Thorac Cardiovasc Surg.
1989;97(4):623-32.
184
18.
Doç.Dr. Tamer Altınok ve Prof.Dr. Olgun Arıbaş
Selçuk Üniversitesi Meram Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
PNÖMOTORAKS
Sınıflama, tanım ve tedavisinde uygulanan yaklaşımlar
Pnömotoraks, çeşitli nedenlerle plevral aralıkta hava bulunması olarak tanımlanır.
Plevral aralık, göğüs duvarının iç yüzünü örten paryetal plevra ile akciğerlerin
yüzeyini, fissürler dahil olmak üzere, kaplayan visseral plevra arasındaki mesafedir.
Tüm solunum siklusu boyunca intraplevral basınçlar negatifdir (1,2). Plevral aralıkta
hava bulunmasının nedenleri;
1) alveolar boşluk ile plevral aralığın bağlantısı,
2) atmosfer ve plevral boşluk arasında direkt veya indirekt bağlantı,
3) plevral boşlukta gaz üreten organizma varlığı (2).
Pnömotoraksı klinik olarak ilk kez Laennec 1819 yılında tanımlamış. Laennec
çoğunlukla tüberküloz hastalarında görülen bu klinik tablonun sağlıklı erişkinlerde de
olduğunu saptamış ve bunu “basit pnömotoraks” olarak isimlendirmiştir (3).
Pnömotorakslar klinik olarak spontan ve spontan olmayan olarak sınıflandırılır (Tablo
18.1) (2,4,5). Spontan pnömotoraks (SP), travma gibi açık bir neden olmaksızın
meydana gelir. Spontan olmayan pnömotorakslar ise travmaya veya tanı veya tedavi
amaçlı yapılan girişimler sonucu (iatrojenik) oluşabilir. SP lar da kendi içinde iki gruba
ayrılır. Sağlıklı insanlarda ve altta yatan herhangi bir akciğer hastalığı olmayan
hastalarda gelişen SP lar “primer spontan pnömotoraks (PSP)” olarak isimlendirilir.
“Sekonder spontan pnömotorakslar (SSP)” ise kronik obstruktif akciğer hastalığı
(KOAH), kistik fibrozis, pulmoner tüberkulozis veya pnömosistis jerovici (pnömosistis
carinii) pnömonisi gibi altta yatan akciğer hastalığı varlığında gelişir.
185
Tablo 18.1. Pnömotoraksın klinik sınıflandırılması (5)
I-Spontan
-
Primer: Klinik olarak akciğer hastalığı yok.
-
Sekonder: Klinik olarak neden olabilecek altta yatan
akciğer hastalığının varlığı
-
Katamenial: Menstürasyonla ilişkili
(Neonatal)
II-Travmatik
-
İatrogenik : Transtorasik ve transbronşial biopsiler,
santral venöz kateterizasyon, torasentez, plevra
biopsisi, barotravma, interkostal sinir blokajı,
akapunktur vb.
-
Non-iatrogenik : Penetran göğüs travması (açık
pnömotoraks) ve künt göğüs travması (alveol
rüptürü)
Spontan Pnömotoraks
PSP nin ve SSP nin insidansları kabaca eşittir. Erkek ve kadınlarda insidans PSP için
sırasıyla yılda 100.000 de 7.4 ve 1.2 iken SSP için ise 6.3 ve 2 dir (6).
PSP ve SSP hastalarında rekürrenslerin çoğu ilk 6 ay içinde meydana gelmektedir.
PSP li hastalarda % 31.8 ve SSP lı hastalarda altta yatan hastalığa bağlı olarak %43
(%30–83) rekurrens oranı bildirilmiştir (7,8).
Ölüm PSP de nadiren meydana gelir (erkeklerde %0.09 kadınlarda %0.06) (9).
Aksine SSP, altta yatan pulmoner rezervi azaltıcı akciğer hastalığının sonucu olarak
daha fazla hayatı tehdit edicidir. KOAH lı hastalarda SP oluşumu ile mortalite riski 3.5
kat artar (7).
I-Primer Spontan Pnömotoraks
Patofizyoloji
PSP, o anda altta yatan çok belirgin akciğer hastalığı olmayan hastalarda oluşan SP
dir. Amfizem benzeri değişiklikler (Emphysema Like Changes)(ELCs) (bleb ve büller)
ile PSP nin oluşumu arasında güçlü etyolojik bağlantılar bulunmuştur. Toraks
bilgisayarlı tomografisi (BT) ile ELC lerin sıklıkla bilateral ve çoğunlukla üst akciğer
zonlarında olduğu göstermek en iyi yoldur. ELC olası PSP oluşumunun veya
rekürrenslerin habercisi olabilir (10,11).
Amfizem benzeri değişiklikler ile ilgili teoriler ise şu şekilde sunulmaktadır;
186
1.Bül veya bleb oluşumunun nedeni özellikle sigara içenlerde distal hava yolu
enflamasyonudur. Nötrofil ve makrofaj birikimi, akciğerdeki elastik fiberlerin
bozulmasına ve proteaz-antiprotez dengesizliğine neden olur (12). Sigara içicilerinde
ilk PSP nin gelişim riski dokuz kattan fazla olmaktadır. Sigara içicilerinde respiratuar
bronşiolitis PSP nin oluşumundaki patolojik süreci başlatabilir (13) (Şekil 18.1).
Şekil 18.1. Primer Spontan Pnömotoraksın oluşumunda ileri sürülen patofizyolojiler (2).
2.Uzun boylu astenik yapılı insanlarda bül ve blep gelişmesi bir gerçektir. Neden
olarak da akciğerin bazali ile apeksi arasındaki basınç farkı gösterilmektedir.
Diyafram seviyesinden apekse doğru plevral basınç her cm’de yaklaşık 0.2 cmH 2O
kadar azalmaktadır. Apeksdeki alveollere daha fazla negatif basınç etki etmekte ve
alveol distorsiyonuna neden olmaktadır (14). Kolaylıkla rüptüre olan bu alveollerden
interstisyuma sızan hava, buradaki vasküler yapıların klavuzluğunda ya proksimale
ya da apekse yönelmektedir. Proksimale yönelen hava hilusa ve paratrakeal alana
ilerlemektedir. Sızan havanın miktarına bağlı olarak bu durum, klinik bulgu verirse
“idyopatik mediastinal amfizeme” (pnömomediastinum) neden olur. Sık tekrarlaması
ve semptomatik olması halinde tedavisi hiler vasküler yapıların diseksiyonudur Eğer
mediastinal plevrada rüptür oluşursa pnömotoraksa neden olur (15). Distale, yani
apekse ilerleyen hava burada visseral plevra altında veya yaprakları arasında
birikerek blep ve büllere neden olur.
187
3.Distal hava yollarındaki inflamasyon ve ödem burada tek yönlü kapak (check-valve)
işlevi görerek, oluşmuş apikal bleb ve büllerin içindeki hava ve basınç miktarını
artırırlar.
PSP hastaları, özellikle erken ergenlik yıllarında belirgin olmak üzere her yaşta
ortalamadan uzun boya sahiptirler. Toraksın vertikal boyutunun hızla artması akciğer
apeksindeki intratorasik basıncı ve dolayısıyla ELC oluşumunu etkiler (16). Sık
olmamakla birlikte, ailesel geçiş bildirilmektedir. Ayrıca bu hastalarda farkedilmeyen
konnektif doku hastalığı olabileceği ve otozomal dominant paternin varlığı
belirtilmekte, diğer genetik bağlantılar ile ilişkisi de bildirilmektedir (17,18).
PSP nedeninin ELC olduğuna dair güçlü kanıtlar olmasına rağmen, cerrahi girişime
giden her hastada rüptüre ELC olan bölgede hava kaçağının gözlenmemiş olması ve
nedeniyle ELC nin tek neden olmadığı da bildirilmektedir. Bu gözlem, PSP deki hava
kaçaklarında bir etken olarak “plevral porosity” kavramının ortaya çıkmasına neden
olmaktadır (19,20). Sonuç olarak ELC tek başına PSP için etyolojik faktör olmayabilir.
Ancak şu anda PSP nin en açık nedeni olarak görülmektedir.
Öykü, klinik, fizik muayene ve tanı
PSP hastaları genellikle ipsilateral plöritik göğüs ağrısı ve huzursuzluk ile başvururlar.
Nefes darlığı ikinci en sık başvuru semptomudur (6). Rutin araştırmalar veya diğer
hastalıkların incelenmesi sırasında da asemptomatik PSP li hastalar tesbit edilebilir
(21). Çoğu epizodlar hasta dinlenim sırasında iken oluşur (6,22). Bu nedenle ağır
egzersizden kaçınma gibi yaşamı kısıtlayıcı önlemler önerilmemelidir. PSP atağı ile
atmosfer basınç değişikliği arasındaki ilişki net değildir (23).
Fizik muayene büyük pnömotorakslarda bulgu verir. Taşikardi en sık görülen
bulgudur. Pnömotoraks ne kadar büyükse, etkilenen tarafta göğüs duvarı hareketinin
azalması, perküsyonda hiperrezonans, fremitusun ve solunum seslerinin azalması
gibi bulgular o kadar fazla olur. Hava açlığı çeken, taşikardisi 140/dk nın üstünde
olan ve hipotansif olgularda tansiyon pnömotorakstan şüphelenilmelidir.
Pnömotoraks ile ilişkili nonspesifik belirti ve bulgular olsa bile tanı şüphe ve bu
şüpheyi doğrulayıcı göğüs radyografisini gerektirir (24). Dikey çekilmiş bir göğüs
radyografisinde göğüs duvarından ayrılmış visseral plevral çizginin tanımlanması tanı
için gereklidir (Resim 1). Plevral aralıktaki hava miktarı ile orantılı olarak mediastinal
şift gelişebilir. Genç erişkinlerde mediastinal yapıların sabit olmaması nedeniyle
minimal pnömotrakslarda dahi trakea, kalp ve mediastinal yapıların şifti sözkonusu
188
olabilir (2). Ekspiratuar göğüs grafisi rutinde kullanılan inspiratuar grafiye çok az
tanısal duyarlılık katar (25). PA akciğer grafisi normal olmasına rağmen
pnömotorakstan şüpheleniliyorsa lateral göğüs veya lateral dekubit grafiler çekilebilir
(26).
PA akciğer grafileri normal görünen minimal pnömotorakslı olgularda, BT daha
duyarlıdır. PSP li olguların yaklaşık %89’unda BT de diffüz veya bilateral bleb (ELC)
saptanmaktadır. Bunlar genellikle üst lob apikaline lokalizedir (10) . Ayrıca
pnömotorakslı olguların yaklaşık %10-20 sinde plevral effüzyon görülebilir (2).
Tedavi yaklaşımını belirlemek için PA akciğer grafisi kullanılarak pnömotoraksın
boyutu hesaplanabilir (27). Önceleri küçük (akciğer etrafında ince bir hava varlığı),
orta (akciğerde yarı yarıya kollapsa neden olacak kadar) ve tam (tam kollaps ve
diaframanın akciğer temasının kesilmesi) olarak sınıflandırılırdı (28). Günümüzde PA
akciğer grafisinde akciğer yüzeyinin toraks duvarından ayrılma mesafesine göre
“küçük” (mesafe <2cm) ve “büyük” (mesafe >2cm) olarak sınıflandırılmaktadır (26).
PA akciğer grafisinde akciğer ve hemitoraksın hacimlerini küp hacmine benzetip
hesaplanabilir.
Pnömotoraksın oranı = (Hemitoraksın çapı3 – Akciğerin çapı3) / (Hemitoraksın
çapı3) x 100
Örneğin PA akciğer grafisinde pnömotoraks 1 cm olarak ölçülüyorsa, hemitoraksın
çapı 10 cm ise akciğerin çapı 9 cm olarak ölçülür. Formülde yerine konulursa; (10 393)/103x100 = 27. Bu durumda 1 cm ölçülen pnömotoraks %27, 2cm ölçülen
pnömotoraks %49 olarak bulunur. Bu förmül ve hesaplama tamamen ampiriktir ve
kabaca bilgi verir. Çünkü bu hesaplama için, PA akciğer grafisinde apeksten bazale
kadar tam bir hava sütunu oluşması gerekir. Ancak küçük pnömotorakslı olgularda
çoğunlukla
yalnızca
apekste
ve
nadiren
de
lateralde
sınırlı
pnömotoraks
bulunmaktadır
Gerçeğe en yakın ölçüm toraks BT ile yapılabilir. BT nin diğer avantajı da şüpheli
amfizem ve büllerin ayrımının da yapılabilmesidir. Bu tür formüllerle boyutu tahmin
etmek PSP de doğru olabilmesine rağmen, amfizemin neden olduğu SSP varlığında
akciğerin anormal kollapsı doğru hesaplamaya engel olabilir. Bu nedenle tedavinin
seçilmesi için SP nin boyutu değil hastanın klinik durumu dikkate alınmalıdır
(29,30,31,32).
Komplikasyon
189
PSP ile birlikte görülen komplikasyonlar; uzamış hava kaçağı, tansiyon pnömotoraks,
pnömomediastinum, hemopnömotoraks, bilateral pnömotoraks, pnömoperiton ve
rekürrenstir. PSP’li olgularda genellikle hava kaçağı tüp torakostomiden 48 saat
sonra kesilir. Ancak bazen hava kaçağı devam eder. Akciğer ekspanse olamaz. İkinci
ve üçüncü tüpleri takmak zorunda kalabiliriz. Bu, operasyon endikasyonlarından birini
oluşturur.
Alveoler havanın sürekli plevral mesafeye girmesi ve boşalma olasılığının olmaması
tansiyon pnömotoraks kliniğini oluşturur. Solunum sıkıntısı, taşikardi, anksiyete ve
ağrı oluşur. Hipotansiyon, periferal siyanoz, trakea deviasyonu hayati tehlikenin
varliğini gösterir. Acil dekompresyon gerektirir.
Hemopnömotoraks PSP’li olguların %10-12 sinde görülür. Erkeklerde 30 kez fazla
olduğu rapor edilmiştir (33). Visseral ve parietal plevra arasındaki yapışıklıklara
sekonder oluşan yeni damarlanmaların yırtılması sonucu oluşur. Klinik kanama
miktarına bağlıdır. Akciğer ekspanse edilince, tamponada bağlı olarak durabilir.
Senkron bilateral pnömotoraks son derece nadirdir. Ancak karşı tarafta pnömotoraks
gelişme olasılığı (metakron) yüksektir. Aynı tarafta rekürrens olasılığı ilk iki yılda %20
den fazladır. Rekürrens gelişen olgularda ikinci ve üçüncü rekürren olasılığı %50 den
fazladır (34).
II-Sekonder Spontan Pnömotoraks
Sekonder spontan pnömotoraks (SSP), daha önceden var olan akciğer hastalığına
bağlı gelişen pnömotoraksa denir. En başta KOAH olmak üzere altta yatan birçok
akciğer hastalığı ile ilgili olabilir (Tablo 18.2). Konnektif doku hastalıkları, kanser ve
torasik endometriozis (katamenial pnömotoraks) de aynı zamanda potansiyel bir SSP
nedenidir.
190
Tablo 18.2. Sekonder spontan pnömotoraksin nedenleri (6)*
Hava yolu hastalıkları
KOAH (büllöz veya diffüz amfizem
Kistik fibrozis
Akut ağır astım
Enfeksiyöz akciğer hastalıkları
Tüberküloz
Pneumocystis carini pnömonisi
Bakteriel enfeksiyonlar
Parazitik enfeksiyonlar
Mikotik enfeksiyonlar
AIDS
İnterstisyel akciğer hastalıkları
Sarkoidoz
İdyopatik Pulmoner Fibrozis
Langerhans hücreli granulomatozis
Histiyositozis X
Lenfanjiyoleiomyomatozis
Konnektif doku hastalıkları
Romatoid artrit
Ankilozan spondilit
Polimiyozit/Dermatomiyozit
Scleroderma
Marfan sendromu
Ehler- Danlos sendromu
Maligniteler
Akciğer kanseri
Sarkomlar
Diğer metastatik maligniteler
*Yeniden uyarlanmıştır
Görülme insidansı 100 000 KOAH’lı olguda 26 olgu/yıldır (35). Yüksek tbc prevalansı
olan bölgelerdeki SSP li hastalarda neden olarak tbc akla gelmelidir. Ülkemizde
SSP’nin en önemli nedenlerinden biri pulmoner tüberkülozdur (Resim
4).
Pnömotoraksla başvuran anti-tbc tedavi öncesi dönem olgularında mortalite %50’lara
kadar yükselmektedir. SSP nin geniş çeşitli nedenleri dolayısıyla travmaya bağlı
olmayan pnömotorakslarda altta yatan etiyolojik hastalık iyi araştırmalıdır.
191
Patofizyoloji
SSP’de pnömotoraksın mekanizmasını açıklamak daha kolaydır. Hava plevral
mesafeye akciğerin nekrozu sonucu oluşan alveol rüptürü ile girer. Nekroz plevraya
yakın değilse interstisyuma ve perivasküler kılıflar aracılığı ile mediastene giderek
pnömomediastinuma neden olur.
Mevcut akciğer hastalıkları nedeni ile akciğer fonksiyonları bozuk olan bu olgularda
süreç
yaşamı tehdit eder. Solunum fonksiyon
testleri düşük (FEV 1<1
L,
FEV1/FVC<0.4) olan hastalarda risk daha yüksektir. En küçük pnömotoraks bile
hastanın genel durumunu bozar. Göğüs ağrısı ve hipoksemi derhal oluşur. Arteriyel
CO2 seviyesi hızla yükselir (35,36). Zaman zaman olan akut ataklarla genel durumu
bozulan KOAH’lı olgularda pnömotoraksdan şüphelenilmeli ya da akılda tutulmalıdır.
Öykü, klinik, fizik muayene ve tanı
SSP, altta yatan çok sayıda akciğer hastalığı tarafından başlatılabilmesine rağmen,
sıklıkla şiddetli ve pnömotoraksın boyutu ile orantısız olarak dispne çok sıktır. SSP li
KOAH lı hastalarda hipoksemi ve hipotansiyon şiddetli olabilir. Pnömotoraksın
tanısında kullanılan ipsilateral solunum seslerinde ve taktil fremitusta azalma ve
hiperrezonans gibi güvenilir fizik muayene bulguları KOAH lı hastalarda zaten var
olduğu için pek güvenli olmayabilir (36,37).
En önemli ayırıcı tanı, özellikle KOAH (amfizem) a sekonder SSP li hastalarda, büyük
ince duvarlı, hava içeren kist veya dev büllerle yapılmalıdır. Bu ayırıcı tanıda en
önemli ipucu hastanın kliniğidir. Pnömotorakslı olgularda göğüs ağrısı, nefes darlığı
ve hipoksemi ile birlikte kliniğinde dramatik bir bozulma olur. Hasta göğüs ağrısından
sonra hızla kötüleştiğini belirtecektir. Dev bülü olan olgular ise bu duruma göreceli
olarak geldiğini ve son saatler ya da günlerde bile ani gelişen sıkıntılarının olmadığını
belirteceklerdir. PA akciğer grafisinde plevra sınırları tam belirgin olmayacak, bazen
körvü dışa bakan parankim izlenimi verecektir. Parankimden göğüs duvarına ışınsal
tarzda seyreden bronkovasküler bantların varlığı ayrımda yardımcıdır. Şüpheli her
durumda toraks BT kesin tanıda yardımcı olacaktır (26,38). Bu ayırım önemlidir,
çünkü semptomatik SSP’ın tedavisi için mutlak kateter veya tüp torakostomi
gerekirken, dev büllerde bül içine uygulanan tüp torakostomi süreci daha komplike
hale getirebilir.
192
Katamenial Pnömotoraks
Patogenezi tam bilinmemekle birlikte, menstürasyon gören, 25 yaşının üstündeki
kadınlarda görülür. Pnömotoraks genellikle menstürasyon başlangıcından sonraki 2472 saat içinde ortaya çıkar. Birçok hastada katamenial pnömotoraks pelvik veya
torasik endometriozisle bağlantılıdır. Rekürrensi çok sık olduğu için ilk epizodda
rekürrens koruma tedavisi uygulanmalıdır (39).
Tedavi
Pnömotoraks tedavisinde iki amaç vardır; plevral kavitedeki havanın boşaltılması ve
tekrarlama olasılığının en aza indirgenmesi (36). Oksijen desteği, basit aspirasyon ve
sklerozis olmaksızın göğüs tüpü yerleştirilmesi rekürrens riskini ortadan kaldırmaz.
Plöredezis ile birlikte göğüs tüpü ve torakotomi veya VATS gibi değişik cerahi
girişimler rekürrensi önlemede önerilmektedir (40). Tedavi pnömotoraksın boyutuna,
semptomların şiddetine, hava kaçağı durumuna ve pnömotoraksın primer veya
sekonder olup olmadığına bağlıdır (Şekil 18.2) .
193
Şekil 18.2. Primer spontan pnömotoraksta tedavi algoritmi
Pnömotoraksın boyutu, klinik stabilite, ve BT
Tedavi şeklinin seçimi, tek başına pnömotoraksın radyografik boyutu üzerine değil
hastanın klinik durumu ile birlikte değerlendirilerek yapılmalıdır. Klinik stabilite,
solunum sayısı <24/dk, kalp hızı >60/dk veya <120/dk, hasta için normal kan basıncı,
oda havasında oksijen saturasyonu >%90 ve tüm solunum evresinde tam olarak
konuşabilme olarak tariflenmekte iken, tek başına solunum sıkıntısının olmaması da
stabilite işareti olarak belirtilmektedir (26,32).
194
Toraks BT, SP ın altta yatan potansiyel patofizyolojik nedenini ortaya çıkarabilir. BT
özellikle rekurrensli SSP hastalarında, persistan hava kaçaklarının kontrolü için veya
cerrahi girişimin planlanması için kullanışlıdır (32).
Oksijen
Pnömotoraks, anatomik şant, ventilasyon-perfüzyon oranındaki değişiklikler ve ölü
boşluğa bağlı olarak arterial PaO2 ve alveolo-arterial oksijen farkını değiştirir (41). Bu
nedenlerle SP hastalarında oksijen desteğinin rolü çok önemlidir.
Oksijen desteği aynı zamanda plevral hava absorbsiyonunu arttırmaktadır. Oksijen
desteksiz hava absorbsiyon oranı tutulan hemitoraksın günde yaklaşık %1.25- 1.8 idir
(42). %25 lik bir pnömotoraks reabsorbsiyonu yaklaşık 20 gün sürer. Oksijen desteği
bu basal oranı 3-4 kat arttırır ki en büyük artış büyük pnömotorakslı hastalarda
bulunmuştur (43). Oksijen desteği ile plevral boşluktaki oksijen basıncı arttırılır.
Nitrogenin plevral basınç gradiyenti azaltılır. Böylece kavitede resorbsiyon hızı
yüksek gazların oranı artacaktır. Özellikle hiperkapniye yatkın olan KOAH lı SP li
hastalara başvurdukları anda kontrollü yüksek akım (10lt/dk) oksijen almaları
önerilmektedir(26).
Gözlem
PSP veya SSP li hastalarda gözlem bir tedavi seçeneğidir ama rekürrensden
korumaz. PSP li hastalarda düşük mortalite oranı ve plevral hava absorbsiyonu
nedeniyle seçilmiş hastalarda dikkatli gözlem yapılabilir. Ancak tercih edilen hasta
grubu küçük pnömotorakslı, klinik olarak stabil hastalar olmalıdır. Gözlemde plevral
aralıktaki havanın rezorpsiyonu beklenir. 3-6 saat kontrol ünitesinde gözlenen hasta,
göğüs grafisinde progresyon yok ise evine gönderilebilir. Gözlem süreci, hastada
kapanmış pnömotoraks olduğunu, aktif hava kaçağının olmadığından emin olmamıza
yardımcı olur (26).
Hiçbir semptomu olmayan, <1 cm veya apikal bölgede lokalize pnömotoraksı olan
PSP olgularında hastane gözlemi gerektirmezken, SSP’li olguları hastanede
gözlemek uygun olacaktır. Ancak mortal bir komplikasyon olan tansiyon pnömotoraks
riski nedeni ile tüm pnömotorakslarda hastane gözlemi gerekli olmaktadır. Hastanede
gözlenen olgulara yüksek akımlı oksijen desteği (10 L/dk) verilmelidir.
195
Basit aspirasyon
Plevral drenaj değişik birçok yaklaşım ile yapılabilir. Bunlardan biri geçici küçük bir
kateter (sıklıkla intravenöz kateter) ile ardışık basit hava aspirasyonudur. Aspirasyon
ilk tedavi basamağı olarak bütün pnömotorakslara veya gözlem tedavisi başarısız
olan küçük PSP lilere önerilmektedir (26,32). Tedavi başarı oranı PSP’lerde, SSP’lere
oranla daha iyidir. Basit aspirasyon 50 yaş altında, kronik akciğer hastalığı olmayan
olgular ve %50’nin altında pnömotoraksı olan olgularda başarı oranı yüksektir Buna
karşın PSP hastalarında basit aspirasyon ile göğüs tüpü arasında anlamlı fark
bulamayan çalışmalar da mevcuttur (40,44).
Teknik olarak arkasına üç yönlü musluk takılmış, 16G büyüklüğünde intravenöz kanül
ile toraksın ön tarafında orta klavikuler hat, ikinci interkostal aralıktan 50 cc lik
enjektörle aspirasyon yapılır. 2.5-3 L ye kadar hava aspire edilebilir. İntraplevral
kavite havasızlandırılana kadar aspire edilir. Kanülün ucuna akciğer değdiğinde veya
manüel hava alınamadığında işlem sonlandırılır.
Aspirasyon teknik nedenlerle yetersiz kalırsa (örneğin kateterin katlanması veya
tıkanması) veya hastanın semptomları düzelmemişse ikinci kez uygulanabilir. Ancak
genel eğilim tüp torakostomi uygulanmasıdır. Bu hastalarda en az 24 saat hastanede
gözlenmeli ve PA akciğer grafisi ile takip edilmelidir. Ayrıca yetersiz aspirasyon,
ikiden fazla aspirasyon geresinimi veya 3 litreyi aşan aspirasyonlarda da kateter
aspirasyon veya katater torakostomi önerilmektedir (45,46). Son yıllarda sıkça
uyguladığımız, yetersiz aspirasyon, hastanın tekrarlayan uygulamalara maruz
kalması nedeni ile 8-10 F ve üçlü musluklu kateter takarak bunu tek yönlü valv
(Heimlich valv) veya su altı drenajına bağlamayı öneriyoruz. Hava kaçağı kesildikten
ve akciğerin tam ekspansiyonu sağlandıktan 12-24 saat sonra kateteri çıkarılıyor.
Tüp Torakostomi
Semptomları belirgin, radyolojik olarak progresyon gösteren, total kollaps oluşan,
tansiyon pnömotoraks, karşı akciğer hastalığı, aspirasyon ve kateter uygulamasına
karşın ekspansiyon kusuru olan hastalarda tüp torakostomi endikasyonu vardır
.Büyük pnömotrakslı, klinik olarak stabil veya unstabil PSP li hastalarda veya ilk
aspirasyon başarısız olmuşsa tüp torakostomi önerilmektedir. Küçük SSP li klinik
stabil hastalar, hospitalize edilmişse gözlenebilir veya semptomların genişliğine ve
pnömotoraksın gidişatına göre göğüs tüpü uygulanabilir. Solunum yetmezliği
olmayan ve çok küçük (<1cm veya apikal pnömotoraks) SSP lı hastalar dışındakilere
196
göğüs tüpü mutlak önerilmektedir (26,32). Tüp torakostomi ile olguların büyük
çoğunluğunda ilk 48 saatte tam akciğer ekspansiyonu sağlanır ve tüpten hava çıkışı
kesilir.
Göğüs Tüpünün Boyutu ne olmalıdır? PSP ve SSP nin tedavisinde genellikle daha
büyük göğüs tüpleri tercih edilmekte. Ancak tüpün boyutunu belirlerken, potansiyel
büyük hava kaçakları veya büyük hava kaçaklarını provake edebilecek mekanik
ventilatör kullanımının göz önünde tutulması da gerekmektedir. Büyük pnömotorakslı
stabil bir hasta için 14-22F veya daha küçük; hasta unstabil ise ve büyük
pnömotoraks
varsa,
hastada
büyük
bir
bronkoplevral
fistül
olduğundan
şüpheleniliyorsa veya pozitif basınçlı ventilasyon riskinde ise daha büyük (24F-28F)
tüp kullanılabilir (26,32). Hava akım oranlarındaki değişiklikler ayarlanmış uygun ticari
küçük çaplı kateter setleri mevcuttur. Göğüs tüpünden geçen hava akımı primer
olarak tüpün yarıçapı ve daha az olarak uzunluğu ile saptanabilir (v=Π 2r5 P/fl, v=flow,
r=radius, l=length, P=pressure ve f=friction factor). 14F, 23 cm, pigtaillerin (16.8
L/min),
14F
(29cm,
12.8L/min)
ve
16F
(41cm,
14.8
L/min)
tüpler
ile
karşılaştırıldığında anlamlı ölçüde fazla akım hızları vadır (46,47).
Tüpe
negatif
aspirasyon
uygulamasının
re-ekspansiyonu
hızlandıracağı
belirtilmektedir (48). Ancak göğüs tüpü yerinde ve iyi çalışıyorsa, negatif
aspirasyonun katkısı tartışmalıdır. Hem PSP hem de SSP hastaları için,
su altı
drenaj sistemi akciğerin reekspansiyonunda başarısız ise veya 48 saat sonra dahi
hava
kaçağı
sürüyorsa
negatif
aspirasyon
uygulanabilir.
Genellikle
tüp
torakostomiden hemen sonra aspirasyon uygulanmaz. Yüksek hacim, düşük basınç
(-10 dan -20 cmH2O ya) aspirasyon önerilmektedir (49). Ancak unutulmalıdır ki uzun
süren ve fazla hava kaçağı olan olgularda aspirasyon hava çalınmasına, hipoksemiye
ve hava kaçağının sürekliliğine yol açar. Negatif aspirasyonun reekspansiyon
pulmoner ödemi (RPÖ) arttırma riski konusundaki veriler anektodaldir. RPÖ negatif
aspirasyon olmadan da oluşabilir ve hatta karşı akciğerde de olabilir (50,51).
Tüp torakostominin en ciddi komplikasyonları intratorasik (akciğer, kalp, büyük
damarlar) ve ekstratorasik (mide, dalak karaciğer gibi) organ yaralanmalarıdır. Ekstra
torasik tüp yerleştirme olasılığı % 3’lerdedir. Yaygın olarak kullanılan orta koltuk altı
6. interkostal aralıktan sert (PVC) toraks tüpünün yerleştirilmesi ile akciğer rahatlıkla
ekspanse olmakta, tüpe bağlı komplikasyonlar en az görülmekte ve apekse kadar
ilerletilen
tüpün
yaptığı irritasyon
ve
inflamasyon
kısmi fiziksel plöredezis
sağlamaktadır. Tüp torakostomi insizyonunun bir alt kot seviyesinden olmasının
197
avantajları; ciltten başlayan, cilt altı ve interkostal adeleye kadar uzanan tünelin
doğrultusu nedeni ile tüpün erektil durması sağlanır, herhangi bir nedenle torakotomi
gerekebilecek tüp torakostomili hastada cilt insizyonu torakotomi insizyonundan uzak
olacak, böylece postoperatif insizyon enfeksiyonu önlenecek, ayrıca özellikle zayıf
hastalarda tüp alındıktan sonra bu uzun trakt kapanarak insizyondan kaçak olmasına
engel olunacaktır. Diğer tüp yerleştirme yerleri midklavikuler hatta 2. interkostal
aralıktır. Uygulaması son derece kolaydır. Ancak PVC drenlerin kolaylıkla kıvrılması
nedeni ile az tercih edilir. Pesser gibi yumuşak kauçuk drenler bu lokalizasyon için
tercih edilir. Özellikle bayanlarda açıklanan bu iki tüp torakostomi insizyonlarının skar
görüntülerinden kaçınmak için orta koltuk altı 3. interkostal aralık tercih edilmektedir.
Uzun süreli total kollapslı pnömotorakslı ve tansiyon pnömotorakslı olgularda
reekspansiyon ödeminden kaçınmak için, ekspansiyonun hızlı olmaması istenir.
Bunun için tüp klemplenir ve aralıklı açılarak hızlı ekspansiyonun mekanik
hasarından akciğer korunur.
Tüp yerleştirilirken asepsi kurallarına tam uyulmalıdır. Ampiyem özellikle travmatik
olgularda sık görülür. Profilaktik antibiyotik uygulaması, özellikle uzun süre tüp
torakostomili takip edilen olgularda mutlak yapılmalıdır. Bu nedenle klinik
uygulamamızda tüp torakostomi sonlandırılana kadar 1. kuşak sefalosporin
profilaksisi yer almaktadır.
Tüp torakostomi esnasında pariyetal plevranın yırtılmasına bağlı havanın bir kısmı cilt
altına sızar. Uygun çapta tüp takılmaması, cilt insizyonu ve interkostal diseksiyonun
aşırı yapılması, tüpün kırılması, tıkanması veya klempe edilmesi cilt altı amfizemini
artırır. Hava kaçağı fazla olan olgularda tüpün çapının küçük kalması masif cilt altı
amfizemine neden olur. Spontan rezorpsiyon beklenebilir. Yaşamı tehdit eden
durumlarda ek cilt insizyonu, pretrakeal fasyanın açılması (servikal mediastinotomi),
ek tüp yerleştirilmesi ve tüp çapının büyütülmesi söz konusu olabilir. Erken dönemde
fark edilen cilt altı amfizeminde, tüpü cilde sabitleyen sütürlerden biri gevşetilerek
dekompresyon yapılabilir. Akciğer ekspansiyonunun elde edilememesi ve cilt altı
amfizeminin artmaya devam etmesi durumunda ikinci toraks tüpünün konulmasından
kaçınılmamalıdır. SP hastalarında su altı drenaj sistemi yerine bir Heimlich valve
benzeri aletin kullanılabilir. Ancak SSP li hastaların birçoğunda kapalı su altı drenajını
tercih edilmelidir.
198
Göğüs Tüpünün Alınması
Göğüs tüpü, pnömotoraksa bağlı hava kaçağının kesilmesi sonrası alınabilir. Hava
kesilmesini takiben 24 saat sonra tüpün 12-24 saatliğine klemplenmesi ve
sonra çıkartılması yaygın uygulamadır.
daha
Tüp uzaklaştırılmadan önce hiç hava
kaçağının olmadığından emin olunmalı ve akciğer reexpansiyonunu gösteren bir
akciğer grafisi gereklidir (24). Uygulanan negatif aspirasyonun alım sırasında da
devam ettirilmemesi önerilmektedir. Tüp alımından önce klemplenme konusunda ise
farklı görüşler vardır. Klemplemeye karşı olanlar klemplemenin akciğer kollapsı
gelişmesine neden olduğunu düşünmekteler (52,53). Destekleyenler ise, su altı
drenaj sisteminde belirgin olmayan ve göğüs tüpünün alınmasına engel olabilecek,
gözden kaçabilen küçük hava kaçaklarının klempleme ile tesbit edilebileceğini
savunmaktadırlar (54). Gözden kaçan hava kaçaklarının tüp alınmadan tesbiti ve
dolayısıyla tekrar pnömotoraks nedeniyle yeniden tüp yerleştirilmesinden korunmuş
olmak için klempleme kliniğimizde de süregelen bir uygulamadır.
Göğüs tüpü ekspirasyonda mı inspirasyonda mı çekilmeli? Genel olarak bir fark
bulunamamış. Ancak derin inspiryum sonunda akciğer tam ekspanse iken alınması
önerilmektedir (55).
Rekürensden koruma ve hava kaçağına müdahale
Son zamanlarda SP li hastalarda rekürrensi önlemek ve persiste hava kaçağını
düzeltmek için torakoskopik yaklaşım yaygındır. VATS ile hemitoraksın üst yarısında
sınırlandırılan paryetal plevra abrazyonu veya paryetal plörektomi ve büllektomi
yeterli
olmaktadır.
pnömotorakslar
için
Açık
torakotomi
saklanması
ve
plörektominin
gerekmektedir.
Minimal
zor
veya
invaziv
rekürren
yöntemler,
torakoskopi (VATS), plevral abrazyon ve cerrahi talk plöridesisin hepsi, etkili alternatif
stratejilerdir. Rekürrens oranları plörektomide %0.4 plevral abrasyonda %2.3
belirtilmesi nedeniyle plörektominin plevral abrasyona karşı hafif bir avantajı vardır
(26,32). Birçok klinisyen tarafından muhtemelen agresiv bir cerrahi girişim olarak
kabul edilmesine rağmen, SP hastalarındaki bülloz lezyonların bilateral doğasına
dayanarak tek taraflı SP de tek seansda bilateral VATS yapılması önerilmektedir (5658).
Kimyasal ajanlarla plöredezis ile rekürrens önlemede “second line” yaklaşımdır.
Cerrahi yaklaşımı kabul etmeyen veya tolere edecek kapasitesi olmayan hastalara
199
plöredezis önerilebilir. Quinacrine, otolog kan, bleomisin, tetrasiklin ve talk kullanılan
ajanlardır. Bu ajanlar göğüs tüplerinden plevral boşluğa verilmektedirler.
Tetrasiklinin parenteral formunun dünyada üretiminin durması, ülkemizde yalnızca
veteriner formunun (oksitetrasiklin, doxycycline) bulunması nedeni ile son yıllardaki
çalışmalarda pek kullanılmamaktadır. Düşük pH’sı ve irritatif etkisi nedeni ile tercih
edilmekteydi. Diğer ajanlar gibi plöretik ağrıya neden olması nedeni ile plevral kavite
lidokain veya citanest solusyonu ile irrige edildikten sonra, erişkin hastalara 1gr
tetrasiklin 50 cc izotonik NaCl solusyonu ile dilue edilip tüpten, verilerek uygulanır.
Talkın güvenilirliği hakkında süregelen tartışmaya rağmen talk ve doksisiklin tercih
edilen
plöredesis
ajanlarıdır
(59,60).
Talk,
Magnesium
Silicate
Hydroxide
(Mg3Si4O10(OH)2) içermektedir. Asbestten arındırılmışı plörodeziste kullanılmaktadır.
Plevral fibrozis ve yapışıklık oluşturur. Ciddi yan etkileri olan bir ajandır. Ateş plöretik
ağrı, ampiyem ve ARDS gibi pulmoner fonksiyon bozukluğuna neden olabilir. Son
zamanlarda yapılan çalışmalarda küçük partiküllü talkın, talk bağımlı solunum
yetmezliğini stimüle eden mekanizma olduğu doğrulanmakta ve uygun partikül
büyüklüğündeki talk önerilmektedirler (61). Ancak ciddi yapışıklık, pakiplörit ve
restriksiyon geliştirmesi nedeni ile genç erişkin olgularda diğer tedavi alternatiflerinin
öncelikle uygulanmalıdır. Erişkinlere 2-5 gr dilue lokal anestezik solusyonları ile irrige
edilmiş plevral kaviteye 50-100 cc izotonik NaCl ile sulandırılarak verilir.
Tetrasiklinden farklı olarak, tüm plevral kaviteye yayılması için hastanın farklı
pozisyonlarda durması istenir. Talkın bir diğer uygulama şekli torakoskopide tozunun
plevral yüzeye püskürtülmesidir. Sulandırılmış talk ve toz püskürme uygulamasının
her ikiside etkili bulunmuştur (26). Tetrasiklinle yapılan çalışmalarda beş yıllık takipte
ortalama %25 rekürrens saptanmıştır (62). Bu oran talkla yapılan çalışmalarda % 10
civarındadır (63).
Rekürrensden korumada zamanlama
Persiste hava kaçaklı erken müdahale gerektiren hastalar dışında PSP hastalarının
2. pnömotoraks oluşumunda, SSP li hastalarda ise ilk pnömotoraks oluşumunda
rekurrens koruma yöntemleri önerilmektedir. Ayrıca SP da bilateral pnömotoraks, ilk
epizod kontrlateral pnömotoraks ve 2. ipsilateral pnömotoraks gibi cerrahi rekurrens
koruma için geleneksel endikasyonları vurgulamaktadır (26,32).
Pnömotoraks riski olan pilot ve şöför gibi meslek sahiplerinde hemen cerrahi
rekurrens korumaya ihtiyaç vardır. Cerrahi girişim yapılmayan hastalar takip göğüs
200
grafileri ile tam pnömotoraks resolusyonu kesinleştirilene kadar rekürrens riskinin
yüksek olması nedeniyle uçuşa karşı uyarılmalıdır. SSP li hastalara kesin bir cerrahi
yöntem uygulanmamışsa 1 yıl hava yolculuğundan uzak durması önerilir. SP den
sonra, eğer cerrahi plörektomi gibi kesin koruyucu bir yöntem yapılmamışsa tehlike
devam etmektedir.
Cerrahi Tedavi
Uzamış hava kaçağı, hemotoraks, akciğerin yetersiz ekspansiyonu, bilateral
pnömotoraks, tansiyon pnömotoraks gibi komplike durumlar cerrahi tedaviyi gerektirir
(Tablo 18.3). Hastanın tüp torakostomiyi red etmesi (özellikle ilk rekürrenste) ve
mesleki özellikleri diğer endikasyonlardır (48).
Tablo 18.3. Primer spontan pnömotoraksta cerrahi tedavi endikasyonları (48).
Birinci Atak
I.Erken komplikasyonlar
Uzamış hava kaçağı
Akciğerin yetersiz ekspansiyonu
Bilateral pnömotoraks
II. Göreceli endikasyonlar
Hemotoraks
Tansiyon pnömotoraks
Komplet pnömotoraks
II. Potansiyel tehlike
Mesleki tehlike
Sağlık hizmetlerine uzaklık
Dev bülün varlığı
Psikolojik
İkinci Atak
İpsilateral rekürrens
Kontrlateral rekürrens
Uzamış hava kaçağının tanımında farklılıklar sözkonusudur. En çok kabul gören, 5
günden fazla hava kaçağının devam etmesidir (26). Radikal cerrahi girişimden önce
takip süresi 2 ile 14 gün arasında bildirilmekle birlikte ortalama 5-10 gün takip edilir
(52,64-66). Hava kaçağı 2 günden sonra bile aynı şiddette devam ediyorsa cerrahi
açıdan değerlendirimesi de önerilmektedir (26). PSP li olguların tamamının 14. günde
hava kaçağının kesildiği, ekspansiyonun sağlandığı ve mortalite gelişmediği de
gösterilmiştir (65).
Bazı yazarlar ise komplet kollabs ve tansiyon pnömotorakslı
201
olguların rekürrenslerinde de hayatı tehdit etme olasılığı nedeni ile operasyon
önermektedirler. Hemopnömotorakslı olgularda, kanama kontrolu için operatif girişim
yapılabilir. SSP de de morbiditenin varlığı ve rekürrens oranını fazla olması nedeni
ile erken cerrahi önerilmektedir (67).
Cerrahi tedavide iki amaç vardır; 1. apikal bölgeye yerleşmiş bül ve bleblerin yoğun
olduğu akciğer apeksinin rezeksiyonu veya ligasyonu, 2. rekürrensi önlemek için
plevral yapışıklığın (plörodezis) sağlanması için plevral obliterasyon tekniklerini
uygulamaktır. Plörodezis için parsiyel veya total plörektomi, kimyasal plöridezis ve
plevral abrasyon kullanılan tekniklerdir. En sık son teknik kullanılır. Özellikle genç
PSP’ li hastalarda ilk iki teknikten kaçınılmalıdır. İlerde farklı nedenle gerekecek
torakotomilerin morbiditesi ve mortalitesini arttıracaktır .
Cerrahi yaklaşım olarak tam posterolateral torakotomi genellikle gereksizdir. Bunun
yerine daha az invaziv ve daha kozmetik olan aksiller torakotomi, yukarda bahsedilen
amaçlar için genellikle yeterlidir. Oskültasyon üçgeninden yapılan minimal torakotomi
aksiler torakotomiye alternatif olarak ileri sürülmüştür. Son yıllarda aksiler
torakotomiye alternatif operatif yöntem olarak “video yardımlı torakoskopik cerrahi”
(VATS) tercih edilmektedir.
VATS, torakotomi ile karşılastırıldığında, postoperatif ağrı ve hastanede kalma
süresini
kısaltması
avantajlarıdır.
Ancak
aksiller
torakotomiye
üstünlüğü
gösterilememiştir (68). Hatta rekürens oranı aksiller toraktomiye göre iki katı olarak
saptanmıştır. VATS akciğer fonksiyonları kötü olan olgularda da tercih edilmelidir
(26,69). Ayrıca SP ye bağlı uzamış hava kaçağı takibinde bakım masrafını arttığını
ve preop gecikmeye bağlı olarak torakoskopi başarısının düştüğü savunularak SP
cerrahisinde erken dönemde VATS önerilmektedir (67).
SP’ li hastaların tanı ve tedavisinde “medikal” torakoskopik değerlendirme ve tedavi”
gündeme getirilmiş, ilk atakta dahi torakoskopik inceleme önerilmiştir (70).
Torakoskopik bulgular üç temel gruba ayrlmış; herhangi bir patolojinin olmadığı
olgular, küçük apikal bleplerin olduğu olgular ve yaygın bülloz hastalık. Son gruba
açık torakotomi önermekteler. Günümüzde radyolojik incelemelerle (örneğin
multislice tomografi) bu gruplamanın yapılabildiği ve medikal torakoskopiye gerek
olmadığı düşüncesindeyiz.
Lokal anestezi ile torakoskopi yapılan olgulara talk plörodez, bleb rezeksiyonu,
nebulize fibrin glue püskürtülmesi, elektrokoter, argon ve lazer ablasyon uygulamaları
202
ile ilgili çalışmalar yapılmaktadır (48). Ancak bu uygulamalar henüz hiçbir tedavi
kılavuzuna girememiştir.
Sekonder spontan pnömotoraksta tedavi
Kronik obstrüktif akciğer hastalığı (KOAH) olanların solunum fonksiyonları kısıtlı
oldukları için küçük pnömotorakslar bile tolere edilemez. Akciğerin damarlanması
azaldığı için bu olgularda hava kaçağı uzun sürmektedir. Enfeksiyon ve ampiyem
insidansı fazladır. Bu nedenle bu olgularda gözlem ve aspirasyon tedavilerinin başarı
olasılığı düşüktür. Asemptomatik olgularda yakın izlem ile uygulanabilir. Tüp veya
kateter torakostomi genellikle ilk basamak tedavi seçeneği olur. Sonraki tedaviler
semptomların süresi ve ağırlığı, altta yatan parankimin durumu, önceki atak sayısı,
hastanın mesleği ve cerrahi ekibin deneyimine göre değişir. Çoğu cerrah tüp
torakostomiden sonra erken cerrahi kararı savunurlar (40). Tüp torakostomi
tedavisinde rekürrens oranı yüksektir. Cerrahi sonrası rekürrens oranı düşük veya
yoktur.
Bu olgularda rekürrensi azaltmak için başta talk olmak üzere kimyasal
plörodezler ısrarla savunulur. %10 luk povidon iyod solusyonu da seyreltilerek,
plevral irrigasyon ve plörodezis için kullanılabilir. Erken cerrahide, torakotomi ve
VATS dan da yararlanılır .
Kistik fibroziste konservatif yaklaşım tercih edilir. Cerrahi karar vermeden önce
transplantasyon olasılığı düşünülmelidir.
Mycobacterium tüberculosis ve diğer enfeksiyöz ajanların neden oldukları patolojiler
sonucu oluşan pnömotorakslarda, medikal tedavi süresince yalnızca tüp torakostomi
ve su altı drenajı uygulanmalıdır. Enfeksiyon tedavi edilmeden veya yeterli
antitüberküloz tedavi verilmeden cerrahi tedavi akla getirilmemelidir.
Akciğerin primer veya sekonder tümörlerinde, iskemi sonucu, kemoterapi veya
radyoterapi sürecinde plevral rüptür oluşabilir. Tedavide tüp torakostomi ve kimyasal
plörodez dışınde tedavi nadirdir.
Katamenial pnömotoraksta, küçük ve semptomsuz olgularda gözlem veya aspirasyon
yapılabilir. Diğer olgularda ilk tedavi tüp torakostomidir. Rekürrens olasılığını
azaltmak için çeşitli yaklaşımlar öne sürülmüştür. Bunların başlıcaları; oral
kontraseptif kullanımı, kimyasal plöridezis, histerektomi ile bilateral over rezeksiyonu,
torakotomi ve cerrahi plörodezisdir. Her atakta tüp torakostomi uygulamasını
savunanlar da vardır.
203
Travmatik Pnömotoraks
Travmatik Non-iatrojenik Pnömotoraks
Künt ve penetran travmaların her ikisi de neden olur. Hava genellikle göğüs
duvarındaki defekten plevral aralığa girer. Visseral veya mediastinal plevra
yırtılmasına neden olan; kot fraktürleri, akciğer laserasyonları, bronş rüptürü ve
özefagus perforasyonlarına sekonder de gelişebilir. Künt toraks travmasında %40
oranında pnömotoraks geliştiği raporlanmıştır. Bunların yarısına hemotoraks eşlik
etmektedir. Künt toraks travmasında, kot fraktürü gibi ek patoloji olmadan da %6,7
oranında pnömotoraksa rastlanabilir (71).
Travmalı hastalardaki en büyük sorun “gizli” pnömotorakstır. Direkt akciğer grafisinde
görülmezler. Travma esnasında gelişen cilt altı amfizemi akciğer grafisini
değerlendirmeyi zorlaştırır. BT burada çok yararlıdır. Bu olgulara mekanik ventilasyon
gerekirse hızla progresyon gösterir. Gizli pnömotoraks BT ile sınıflandırılmaktadır.
Kalınlığı 1cm veya daha küçük ve dört kesitden fazla devam etmez ise “az”
(minuscule) pnömotoraks, ön tarafa lokalize, kalınlığı 1cm’den fazla, 4 den fazla
kesitte görülüyor ise “anterior” pnömotoraks, mid koronal hatta kadar uzanıyor ise
“anterolateral” pnömotoraks olarak sınıflandırılmaktadır (72) (Resim 6).
Büyük çoğunluğu tüp torakostomi ile tedavi edilir. Hemotoraksla birlikteliği tüp
torakostomiyi zorunlu kılar. Tedaviye karar vermeden önce toraks BT ile
değerlendirilmelidir. Travmatik pnömotoraksın tartışıldığı büyük serilerde, 1.5cm den
büyük, küçük fakat bilateral, mekanik ventilasyon uygulanacak veya pulmoner
fonksiyonları sınırlı pnömotorakslı olgulara tüp torakostomi önerilmektedir (73). Gizli
pnömotorakslarda, anterolateral olarak tanımlananlara tüp torakostomi, “az” ve
anterior pnömotorakslar konservatif izlem önerilmektedir (72).
Travmatik İatrojenik Pnömotoraks
Tanısal işlemlerin rutin pratikte kullanımı sık olması nedeniyle pnömotoraks iatrojenik
yaralanmalar içinde en sık görülenidir. Hemen her tanısal işlemde pnömotoraks riski
vardır. Transtorakal iğne biopsileri (%24) başta olmak üzere, tanısal ve tedavi amaçlı
yapılan santral venöz kateterizasyon (%22), torasentez (%20), mekanik ventilasyon
(%7),
plevral
biopsisi
(%8),
bronkoskobik
transbronşial
biyopsiler
(%10)
pnömotoraksa neden olurlar (Resim 7). Torasentezin major komplikasyonu
204
pnömotoraksdır. Transtorakal iğne biopsilerinden sonra gelişen pnömotorakslar
genellikle küçük hacimli olmakta ve nadiren tüp torakostomi gerektirmektedir. Ancak,
akciğerdeki amfizematöz bulgular arttıkça ve biyopsi yapılacak lezyon küçüldükce
pnömotoraks riski artar. Hedef lezyon için iğnenin kat ettiği yol da riskle doğru
orantılıdır. Ancak iğnenin büyüklüğü ve lezyonun lokalizasyonu pnömotoraks riski ile
ilişkili bulunmamıştır (74).
Girişim yapılan hastada pnömotoraks geliştiğinde, hastanın durumu bozulur.
Torasentezde hasta rahatlayacağına nefes darlığı daha da artar. Mekanik
ventilasyon esnasında ani ve ağır klinik bozulma görülür. Akciğer grafisi tanı
koydurucudur. Oturur pozisyonda çekilemeyen akciğer grafisi, yanlış tanıya neden
olacağından toraks BT ye gereksinim duyulur. İatrojenik pnömotoraks tanısı
genellikle gecikir bu nedenle klinisyen uyanık olmalıdır (75).
Tedavi hastanın kliniğine, altta yatan akciğerin durumuna göre değişir. Olabildiğince
en az invaziv yaklaşım tercih edilir. Örneğin %15 den veya <3 cm (apekste)
pnömotorakslara yakın gözlem, kateter aspirasyon veya kateter torakostomi, daha
fazla olanlarda tüp torakostomi önerilir (4). Geniş tüpler, amfizematöz hastada veya
mekanik ventilatör endikasyonu olanlarda gerekli olabilir.
Endotrakeal genel anastezi esnasında kan gazları ani bozulan ve hava yolu basıncı
artan olgularda pnömotoraks akla gelmeli. Oskultasyon, torasentez veya radyolojik
olarak pnömotoraks saptanan olgular ile mekanik ventilasyona ikincil pnömotorakslar
tüp torakostomi ile tedavi edilmeliler.
Tansiyon Pnömotoraks
Farklı bir pnömotoraks tipi değildir. Tanımlanan tüm pnömotoraks tiplerinde
gelişebilecek bir klinik durumdur. Tansiyon pnömotoraks (TP) solunum siklusu
boyunca intraplevral basıncın atmosfer basıncını aşması durumudur (4). Burada
intraplevral aralığa giren hava, trakeobronşial ağaca geri dönmeksizin, her
inspirasyonda kaviteye dolmaya devam eder. İntraplevral basınç artar ve pozitifleşir.
Plevral aralığa hava girmesine neden olan lezyon, tek yönlü valv mekanizması
oluşturmakla suçlanır (Resim 8). Zamanla intraplevral aralıktaki hava basıncı
atmosfer basıncını geçer. Akciğer kollabe olur. Süreç içerisinde mediastinal ve venöz
yapılara bası artar. Mediastinal şift gelişir. Venöz dönüş azalır. Sonuçta kardiak
dolum ve output azalır. Ventile olmayan veya hipoventile akciğer zonları nedeniyle
şant ve hipoksemi gelişir. Bu da pulmoner hipertansiyona neden olur.
205
Hasta ileri derecede hava açlığı çekmektedir. Takipneik, taşikardik, siyanotik ve
hipotansiftir. Huzursuz ve ajitedir. İlgili hemitoraks oransal olarak daha geniştir ve
solunuma katılmaz. Trakea orta hattan karşı tarafa kaymıştır. Perküsyon bulgusu
hipertimpaniktir. Solunum sesleri alınmaz. Kalp tepe atımı yer değiştirmiştir.
Klinik olarak akciğer grafisi çektirecek vakit olmayabilir. Akciğer grafisi çektirilebilirse;
akciğer total kollabe, diyafram deprese, mediasten yer değiştirmiş, hemitoraks
genişlemiş ve kot aralıkları artmıştır (Resim 9).
TP li hastalar acil girişim gerektirirler. Biran önce plevral mesafedeki hava basıncını
azaltmak için her hangi bir göğüs drenaj yöntemini kullanmak gerekir. Hatta
intraplevral basıncı atmosfer basıncına eşitleyecek diğer ucuda açık olan intraketle
drenaj dahi yapılabilir.
Sonuç
Pnömotoraks hastayı ve doktorunu sıkıntıya sokan bir klinik antidedir. Yaşamı tehdit
eder. Tanının konabilmesi için akla getirilmesi yeterlidir. Başta göğüs hastalıkları,
göğüs cerrahi uzmanları ve acil hekimleri olmak üzere, diğer cerrahi branşlar,
anestezi uzmanları ve radyologlar bu tabloyu ve geliştirilen tedavi stratejilerini iyi
bilmelidirler. Basit bir intravenöz kateter ile intraplevral aralığın aspirasyonu bile hayat
kurtarıcı olabilir.
KAYNAKLAR
1. Jantz MA, Anthony VB: Pathophysiology of the pleura. Respiration
2008;75:121-133.
2. Noppen M, Schramel F. Pneumothorax. Eur Respir Mon 2002; 22: 279-296.
3. Fry WA, Paape K. Pneumothorax. In: General Thoracic Surgery. Edited by
Shields TW, Locicero J, Ponn RB, Rusch VW. 6th ed. Philadelphia: Lippincott
Willams and Wilkins;2005.p794-805.
4. Baumann MH, Noppen M. Pneumothorax. Respirology 2004;9:157-64.
5. Noppen M, Keukeleire T. Pneumothorax. Respiration 2008;76:121-27.
6. Baumann MH. Management of Spontaneous Pneumothorax. Clin Chest Med
2006;27:369-81.
7. Videm V, Pillgram-Larsen J, Ellingsen O, et al. Spontaneous pneumothorax in
chronic
obstructive
pulmonary
disease:
complications,
recurrences. Eur J Respir Dis 1987;71:365-71.
206
treatment
and
8. Lippert H, et al. Independent risk factors for cumulative recurrence rate after
first spontaneous pneumothorax. Eur Respir J 1991;4:324-31.
9. Gupta D, Hansell A et al. Epidemiology of pneumothorax in England. Thorax
2000;55:666-71.
10. Mitlehner W, Friedrich M, Dissman W. Value of computed tomography in the
detection of bullae and blebs in patients with primary spontaneous
pneumothorax. Respiration (Herrlisheim) 1992;59:221-7.
11. Warner B, Bailey W, Shipley T. Value of computed tomography of the lung in
the management of primary spontaneous pneumothorax. Am J Surg
1991;162:39-42.
12. Fukuda Y, Haraguchi S, Tanaka S, et al. Pathogenesis of blebs and bullae of
patients
with
spontaneous
pneumothorax:
an
ultrastructural
and
immunohistochemical study. Am J Respir Crit Care Med 1994; 149: A1022.
13. Cottin V, Streichenberger N, Gamondes J-P, et al. Respiratory bronchiolitis in
smokers with spontaneous pneumothorax. Eur Respir J 1998;12:702-4.
14. Light RW. Pneumothorax. In: Light RW, ed. Pleural Diseases. Baltimore,
Williams & Wilkins, 1995; pp 242–277.
15. Macklin MT, Macklin CC. Malignant interstitial emphysema of the lungs and
mediastinum as an important occult complication in many respiratory diseases
and other conditions: an interpretation of the clinical literature in the light of
laboratory experiment. Medicine 1944; 23: 281–358.
16. Fujino S, Inoue S, Tezuka N, et al. Physical development of surgically treated
patients with primary spontaneous pneumothorax. Chest 1999;116:899-902.
17. Abolnik IZ, Lossos IS, Zlotogora J, et al. On the inheritance of primary
spontaneous pneumothorax. Am J Med Genetics 1991; 40: 155–158.
18. Morrison P, Lowry R, Nevin N. Familial primary spontaneous pneumothorax
consistent with true autosomal dominant inheritence. Thorax 1998;53:151-2.
19. Smit HJM. Wienk MATP, Schreurs AJM, et al. Do bullae indicate a
predisposition to recurrent pneumothorax? Br J Radiol 2000;73:356-9.
20. Noppen M. Do blebs cause primary spontaneous pneumothorax? Con: blebs
do not cause primary spontaneous pneumothorax. J Broncho 2002;9:319-23.
21. Maeda A, Ishioka S, Yoshihara M, et al. Primary spontaneous pneumothorax
detected during a medical checkup. Chest 1999;116:847-8.
207
22. Bense L, Wiman LG, Hedenstierna G. Onset of symptoms in spontaneous
pneumothorax:
correlation
with
physical
activity.
Eur
J
Respir
Dis
1987;71:181-6.
23. Smit HJM, Deville WL, Schramel FMNH, Schreurs AJM, et all. Atmospheric
pressure
changes and
outdoor temperature
changes in
relation
to
spontaneous pneumothorax. Chest 1999; 116: 676–81.
24. Baumann MH. Pneumothorax. Semin Respir Crit Care Med 2001;22:647-55.
25. Schramel FMNH, Golding RP, Haakman CDE, et al. Expiratory chest
radiographs do not improve visibility of small apical pneumothoraces by
enhanced contrast. Eur Respir J 1996;9:406-9.
26. Henry M, Arnold T, Harvey JE. BTS guidelines fort the management of
spontaneous pneumothorax. Thorax 2003;58(Suppl II):39-52.
27. Light RW. Pleural diseases. 4th edition. Baltimore: Williams&Wilkins;2001.
28. Miller AC, Harvey JE. Guidelines for the management of spontaneous
pneumothorax. BMJ. 1993;307:114–6.
29. Jordan KG, Kwong JS, Flint J, et al. Surgically treated pneumothorax.
Radiologic and pathologic findings. Chest 1997;111:280–5.
30. Noppen M, Alexander P, Driesen P, et al. Quantification of the size of
pneumothorax: accuracy of the Light index. Respiration (Herrlisheim)
2001;68:396-9.
31. Engdahl O, Toft T, Boe J. Chest radiograph – a poor method for determining
size of a pneumothorax. Chest 1993;103:26-9.
32. Baumann MH, Strange C, Heffner JE, et al. Management of spontaneous
pneumothorax: an American College of Chest Physicians Delphi consensus
statement. Chest 2001;119:590-602.
33. Tatabe S, Kanazawa H, Tamazaki Y et al: Spontaneus hemopneumothorax.
AnnThorac Surg 1996; 62:1011- 1015.
34. Chan P, Clarke P, Daniel FJ, Knight SR, Seevanayagam S. Efficacy study of
video-assisted
thoracoscopic
surgery
pleurodesis
for
spontaneous
pneumothorax. Ann Thorac Surg. 2001;71:452-4.
35. Dines DE, Clagett OT, Payne WS. Spontaneous pneumothorax in
emphysema. Mayo Clin Prac 1970; 45: 481–487.
36. Sahn SA, Heffner JE. Spontaneous pneumothorax. N Engl J Med
2000;342:868-74.
208
37. Light RW. Management of spontaneous pneumothorax. Am Rev Respir Dis
1993;148:245-8
38. Bourgougin P, Cousineau G, Lemire P, Herbert G. Computed tomography
used to exclude pneumothorax in bullous lung disease. J Can Assoc Radiol
1985;36:341-2.
39. Augoulea A, Lambrinoudaki I, Christodoulakos G: Thoracic endometriosis
syndrome. Respiration 2008;75:113-119.
40. Baumann MH. Strange C. Treatment of spontaneous pneumothorax: a more
agressive approach? Chest 1997;112:789-804.
41. Moran JF, Jones RH, Wolfe WG. Regional pulmonary function during
experimental unilateral pneumothorax in the awake state. J Thorac Cardiovasc
Surg 1977;74:396-402.
42. Flint
K,
Al-Hillawi
AH,
Johnson
NM.
Conservative
management
of
spontaneous pneumothorax. Lancet 1984;ii: 687–8.
43. Chadha TS, Cohn MA. Noninvasive treatment of pneumothorax with oxygen
inhalation. Respiration (Herrlisheim) 1983;44:147-52.
44. Noppen M, Alexander P, Driesen P, et al. Manual aspiration versus chest tube
drainage in first episodes of primary spontaneous pneumothorax. Am J Respir
Crit Care Med 2002;165:1240–4.
45. Harvey J, Prescott RJ. Simple aspiration versus intercostal tube drainage for
spontaneous
pneumothorax
in
patients
with
normal
lungs.
BMJ
1994;309:1338–9.
46. Baumann MH, Patel PB, Roney CW, Petrini MF. Comparison of function of
commercially
available
pleural
drainage
units
and
catheters.
Chest
2003;123:1878-86.
47. Minami H, Saka H, et al. Small caliber catheter drainage for spontaneous
pneumothorax. Am J Med Sci 1992;304:345-7.
48. Beauchamp
G,
Ouellette
D.
Spontaneus
pneumothorax
and
pneumomediastinum. In Pearson GF, Cooper JD, Deslauriers J et all,
eds.Thoracic surgery 2nd ed.New York: Churchill livingstone; 2002 ; 11951213.
49. So S, Yu D. Catheter drainage of spontaneous pneumothorax: suction or no
suction, early or late removal? Thorax 1982;37:46-8.
209
50. Mahfood S, Hix WR, Aaron BL, et al. Reexpansion pulmonary edema. Ann
Thorac Surg 1988;45:340-5.
51. Matsuura Y, Nomimura T, Murakimi H, et al. Clinical analysis of reexpansion
pulmonary edema. Chest 1991;100:1562-6.
52. Baumann MH, Strange C. The clinician’s perspective on pneumothorax
management. Chest 1997;112:822-8.
53. Miller AC. Treatment of spontaneous pneumothorax management. Chest
1998;113:1423-4.
54. Baumann MH, Strange C. Treatment of spontaneous pneumothorax: the
clinicians’ perspective on pneumothorax management. Chest 1998;113:14245.
55. Bell RL, Ovadia P, Abdullah F, et al. Chest tube removal: end-expiration? J
Trauma 2001;50:674-7.
56. Watanabe S, Sakasegawa K, Kariatsumari K, et al. Bilateral video-assisted
thoracoscopic surgery in the supine position for primary spontaneous
pneumothorax. Thorac Cardiovasc Surg 2004;52:42-4.
57. Ayed AK. Bilateral video-assisted thoracoscopic surgery for bilateral
spontaneous pneumothorax. Chest 2002;122:2234-7.
58. Ikeda M, Uno A, Yamane Y, Hagiwara N. Median sternotomy with bilateral
bullous resection for unilateral sponataneous pneumothorax, with special
reference to operative indications. J Thorac Cardiovasc Surg 1988;96:615-20.
59. Light RW. Talc should not be used for pleurodesis Am J Respi Crit Care Medc
2000;162:2024-6.
60. Sahn SA. Talc should be used for pleurodesis. Am J Respir Crit Care
2000;162:2023-4.
61. Maskell NA, Lee YCG, Gleeson FV, et al. Randomized trials describing lung
inflammation after pleurodesis with talc of varying particle size. Am J Res Crit
Care Med 2004;170:377-82.
62. Massard G, Thomas P, Wihlm J-M. Minimally invasive management for first
and recurrent pneumothorax. Ann Thorac Surg 1998;66:592–9.
63. Kennedy L, Sahn SA. Talc pleurodesis for the treatment of pneumothorax and
pleural effusion. Chest 1994;106:1215–22.
210
64. Schoenenberger RA, Haefeli WE, Weiss P, Ritz RF. Timing of invasive
procedures
in
therapy
for
primary
and
secondary
spontaneous
pneumothoraces. Arch Surg 1991;126:764-6.
65. Chee CBE, Abisheganaden J, Yeo JKS, et al. Persistent air-leak in
spontaneous pneumothorax-clinical course and outcome. Respir Med
1998;92:757-61.
66. Jain SK, Al-Kattan KM, Hamdy M. Spontaneous pneumothorax: determinants
of surgical intervention. J Cardiovasc Surg (Torino) 1998;39:107-11.
67. Waller DA, McConnell SA, Rajesh PB. Delayed referral reduces the success
of video-assisted thoracoscopic surgery for spontaneous pneumothorax.
Respir Med1998;92:246–9.
68. Cole Jr FH, Cole FH, Khandekar A, et al. Video-assisted thoracic surgery:
primary
therapy
for
spontaneous
pneumothorax?
Ann
Thorac
Surg
1995;60:931–5.
69. Waller DA, Forty J, Soni AK, et al. Videothoracoscopic operation for secondary
spontaneous pneumothorax. Ann Thorac Surg 1994;57:1612–5.
70. Verchoof GPM, Velde T, Greve LH et al. Thoracoscopic pleurodesis in the
management of spontaneous pneumothorax. Respiration 1988; 53: 197-201.
71. Liman ST, Kuzucu A, Tastepe AI, et al. Chest injury due to blunt trauma. Eur J
Cardiothorac Surg. 2003 Mar;23(3):374-8.
72. Wolfman NT, Myers WS, Glauser SJ, Meredith JW, Chen MYM. Validity of CT
classification on management of occult pneumothorax: a prospective study.
AJR Am. J. Roentgenol. 1998; 171: 1317–20
73. Johnson G. Traumatic pneumothorax: is a chest drain always necessary? J.
Accid. Emerg. Med. 1996; 13: 173–4.
74. Cox JE, Chiles C, McManus CM, Aquino SL, Choplin RH. Transthoracic
needle aspiration biopsy. variables that affect risk of pneumothorax. Radiology
1999; 212: 165–8.
75. Brown KT, Brody LA, Getrajdmann GI, Napp TE: Outpatient treatment of
iatrogenic pneumothorax after needle biopsy. Radiology 1997;205:249-252.
211
19.
Prof. Dr. Salih Topçu
Kocaeli Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
BENİNG VE MALİGN PLEVRAL EFFÜZYONLAR VE TEDAVİ PRENSİPLERİ
Tanım
Parietel ve visseral plevra arasında kalan mesafeye plevral boşluk denir. Aslında
plevral yapraklar birbiri ile temas etmektedir. Normal koşullarda fiziki bir boşluk
yoktur. Söz konusu mesafe potansiyel bir boşluktur.
Anatomi ve Fizyoloji
Visseral plevra tüm akciğeri kaplar. Parietal plevra ise mediasten, göğüs duvarı ve
mediastenin yan yüzünü kaplar. Bu iki plevra birbiri ile devamlılık halindedir.
İnspiryum ve ekspiryum süresinde birbiri üzerinden kayarlar. Herhangi bir nedenle iki
plevra yaprağı arasına hava girebilir, sıvı, kan, şilöz mayi veya püy birikebilir. O
zaman temas halinde olan plevral yapraklar birbirlerinden ayrılırlar.
Bu patolojik
duruma, plevral mesafede biriken maddeye göre sırası ile pnömotoraks, plevral
effüzyon, hemotoraks, şilotoraks veya ampiyem adı verilir.
Parietal ve visseral plevranın anatomik ve histolojik özellikleri Bölüm 18’de detaylı
şekilde açıklanmıştır.
Plevral mesafede normalde sürekli negatif basınç vardır. Derin ekspiryum ve
inspiryum ile -2 ile -40 cm H2O arasında değişse de, inspiryumda ortalama -8 cm
H2O, ekpiryumda ortalama -5 cm H2O olduğu gösterilmiştir.
Plevral effüzyon oluş mekanizmaları
Plevral mesafeye günde 5 L den fazla sıvı salınır. Salınan sıvının tamamı geri emilir.
Salınımda fazlalık ya da emilimde duraksama olur ise plevral boşlukta sıvı birikimi
meydana gelir. Buna plevral effüzyon
(PE) denir. PE’nun oluş mekanizmalarını
şunlardır (1).
1.
Mikrovaskuler dolaşımda, hidrostatik basıncın artması, (örn: Konjesif
kalp yetmezliği)
2.
Mikrovaskuler
dolaşımda
Hipoalbuminemi)
212
onkotik
basıncın
azalması
(örn:
3.
Plevral boşlukta negatif basıncın artması (örn: Atelektazi)
4.
Mikrovaskuler dolaşımda geçirgenliğin artışı (örn: Pnomoni)
5.
Plevral boşlukta lenfatik drenajın bozulması (örn: İntratorasik
maligniteler)
6.
Batındaki sıvının diafragmatik porlardan intraplevral aralığa geçmesi
(örn: Over tümörleri)
7.
Ekstravaskuler kökenli sıvının plevral boşluğa geçişi (örn: İntraspinal
veya duktus torasikustan)
Eksuda, transuda ayrımı
Salınım fazlalığı veya emilim bozukluğu ile oluşan PE’un sıvısının biyokimyasal
içeriği neden olan hastalıklara göre değişir. Ayırıcı tanıda sunduğu kolaylık nedeniyle
sıvı içeriğine göre transuda ve eksuda ayrımı yapılır. PE’lu hastadan torasentez yolu
ile alınan plevral sıvı, aynı anda alınan venöz kan serumu ile karşılaştırılır. Böylelikle
transuda ve eksuda ayrımı yapılır (Tablo 19.1).
Tablo 19.1. Transuda eksuda ayrım kriterleri (1,2,3)
Kriterler
Total Protein, Plevral sıvı/Serum
Laktik Dehidrogenaz (LDH), Plevral sıvı/Serum
Plevra sıvı LDH düzeyi serum referans değerine oranı
Plevral sıvı kolesterol seviyesi
Transuda
<0.5
<0.6
< 0,82
<45mg/dL
Eksuda
>0.5
>0.6
>0.82
>45mg/dL
Tabloda belirtilenlerin bir tanesinin olması durumunda sıvı eksuda, hiçbirinin
olmaması durumunda sıvı transuda olarak tanımlanır. Transuda varlığında hastanın
kliniği ile rahatlıkla tanı ayrımı yapılabilir. Ancak eksuda ayrımı için daha fazla tetkik
ve girişim gerekecektir (Tablo 19.2). Bu nedenle ayrım önemlidir.
213
Tablo 19.2. Plevral effüzyon nedenleri (4).
Sıklık
Sık
Daha az
Nadir
Transuda
Sol kalp yetmezliği
Siroz
Hipoalbuminemi
Hipotiroidizm
Nefrotik sendrom
Mitral stenoz
Pulmoner emboli
Konstriktif perikardit
Ürinotoraks
Vena kava süperior sendromu
Over hiperstimülasyonu
Meigs sendromu
Eksuda
Malignite
Parapnömonik effüzyonlar
Ampiyem
Akciğer enfarktüsü
Romatoid artrit
Otoimmün hastalıklar
Pankreatit
Benign asbestoz effüzyonu
Post
myokardial
enfarktüs
sendromu
Sarı tırnak sendromu
İlaç toksisitesi
Mantar enfeksiyonları
Plevral effüzyon nedenleri
Transuda
Bu özellikte effüzyona kalp yetmezliği gibi hidrostatik basıncı artıran, nefrotik
sendrom gibi onkotik basıncı azaltan klinik sorunlar neden olur.
Eksuda
Bu tip effüzyona ise pnömoni, malignite, pulmoner emboli ve tüberküloz gibi kapiller
geçirgenliği artırıp, protein, hücreler ve diğer serum içeriklerinin plevral boşluğa
sızmasına neden olan patolojiler neden olur. Sarı tırnak sendromu
(Yellow nail
syndrome) gibi lenfatik sistem akım bozukluğu gibi konjenital nedenlerde eksudatif
PE nedeni olabilir.
Şilotoraks eksudatif bir effüzyondur. Duktus torasikusdaki trigliserit açısından
zengin sıvının plevral boşluğa sızmasıyla oluşur. Süt görünümündedir. Başta
lenfomalar olmak üzere malign hastalıklar ve travma en sık nedenidir.
Psödo (yalancı) şilotoraksın görünümü şilotoraksa benzer. Ancak trigliserid
seviyesi düşüktür. Görünümüne içerdiği yüksek kolesterol neden olur.
Kolesterol eritrosit ve nötrofillerden sızar. Plevral kalınlaşma nedeniyle
absorbsiyon sorunu vardır.
Hemotoraks plevral boşlukta kan birikmesidir. En sık nedeni travma, damar
rüptürü ve koagulopatilerdir. Hemorajik malign plevral effüzyondan ayrımı
214
zorunludur. Hemotoraks durumunda sıvının hematokritinin kan hematokritine
oranı %50’den fazladır.
Hemorajik plevral effüzyonun en sık nedeni malignitelerdir. Torasentez
esnasında bir miktar kanama sıvıya kanlı görünüm verebilir. Hemotorakstan
ayrım yapılmalıdır.
Ampiyem plevral boşlukta püyün (enfekte sıvı) toplanmasıdır. En sık pnömoni
sonrası oluşur. Travma, torakotomi ve abse perforasyonu diğer sık
nedenlerdir.
Malign plevral effüzyon, tümörlerin plevral metastazı veya yayılımı ile gelişir.
Sitolojik olarak plevral sıvıda malign hücre görülür. Hemorajik olabilir.
Paramalign effüzyon, bilinen malignitesi olan hastalarda lenfatik blokaj,
atelektazi veya plevral geçirgenliğin artması sonucu gelişir. Tümörün plevral
yayılımı veya sıvıda atipik hücre mevcudiyeti söz konusu değildir. Malign
effüzyondan kesin ayrımı için üç kez torasentez veya plevra biopsisi (kapalı
veya torakoskopik) yapılmalıdır.
Tüberküloz plörezi, tüberküloz plörit veya subplevral tüberküloz kavitelerinin
plevral boşluğa açılması ile oluşur. Eksuda vasfındadır. Ülkemizde genç,
sağlıklı görünümlü olan hastalardaki kronik effüzyonların en sık nedenidir. Sıvı
mikroskobisinde ARB görülebilir. Adenozin deaminaz seviyesi yüksektir.
Gerekirse plevra biopsisi yapılarak tanı konur.
İatrojenik effüzyon santral venöz kateter, nazogastrik ve endotrakeal tüpün
yanlış yerleştirilmesi sonucu oluşur.
İdiopatik effüzyon genellikle tanısı konulamayan malignite (occult), pulmoner
emboli, tüberküloz veya viral enfeksiyon sonucu gelişir.
Semptom ve Bulgular
Plevral effüzyonlar coğunlukla nefes darlığı ve göğüs ağrısına neden olurlar. Göğüs
ağrısı, plevral inflamasyon gelişen bölgede huzursuzluk hissi, künt ağrı veya derin
inspiryumda batıcı karakterde olabilir. Ağrı; altıncı interkostal sinir ve daha alt
bölgedeki dermatomların irritasyonunda alt göğüs duvarı ve üst batında, diyafragma
irritasyonunda ise boyun ve omuz bölgesinde hissedilir.
Fizik muayenede effüzyonun olduğu tarafta taktil fremitus yokluğu, perküsyonda
matite, solunum seslerinde azalma görülür. Nadir de olsa plevral sürtünme sesi
alınabilir.
215
Tanı
Göğüs ağrısı ve nefes darlığı yakınması ile başvuran hastanın ayrıntılı öyküsü alınır.
Fizik muayenesi yapılır. Muayeneyi tamamlamak için mutlaka akciğer grafisi istenir.
(Şekil 19.1).
Şekil 19.1: Plevral effüzyonun tanı algoritmi (5).
216
Akciğer grafisi
En kolay ve en güvenilir tanı yöntemidir. Ayakta ve postero-anterior (PA) olarak
çekilir. Ortalama 175 mL effüzyon kostofrenik sinüsü kapatır. Daha azı fark
edilmeyebilir. Ortalama 500 mL effüzyon ise belirgin radyolojik değişikliğe neden olur.
Hilusa kadar olan orta miktarda sıvı varlığında açıklığı yukarı doğru bakan bir parabol
oluşur ki buna Damoiseau (okunuşu: Domuazo) hattı denir (Resim 19.1). Bu
radyolojik görünüm plevral effüzyonlar için tipiktir.
Resim 19.1: Damoiseau hattı.
Tanısal veya tedavi edici torasentez yapıldığında ya da subplevral lezyon plevraya
drene olmuşsa effüzyonla birlikte pnömotoraks da gelişebilir. Bu durumda akciğer
grafisinde hava-sıvı seviyesi görülür. Buna hidropnömotoraks adı verilir (Resim
19.2).
Resim 19.2: Hidropnömotoraksta, hava-sıvı görünümü. Beyaz ok (pnömotoraks) ve siyah
okla (plevral effüzyon seviyesi) işaretlendi.
Masif plevral effüzyonda, total atelektazi birlikteliğinde ilgili hemitoraks tamamen
opaktır (Resim 19.3).
217
Resim 19.3: Sağ hemitoraksın tamamen opaklaşmasına neden olan plevral effüzyon.
Sıvı miktarı erişkinde 4 L den fazla olursa mediastinal yapıları karşı tarafa iter. Buna
mediastinal shift diyoruz (Resim 19.4).
Resim 19.4: Mediastinal şifte neden olan sol hemitoraksta masif effüzyon.
Özellikle kalp yetmezliği olan hastalarda fissürde sıvı toplanması kitle imajı verebilir.
Buna fantom tümör (hayalet – tedavi ile hemen ve iz bırakmadan kaybolmasına
ithafen) denmektedir.
Plevral yapışıklıkların olduğu olgularda ise sıvı plevral boşluğa serbestçe dağılamaz;
yapışıklıkların arasında birikir ve plevra tabanlı kitle imajı verir ki buna ankiste plevral
sıvı denir. Bazen sıvı akciğerin alt lobu ile diafragma kubbesi arasında toplanır. Sinus
açık görünür ancak diafragma yükselmiş izlenimi verir. Buna subpulmonik sıvı denir
(Resim 19.5).
218
Resim 19.5: Subpulmonik effüzyonlu olgunun PA ve lateral grafisi.
Toraks tomografisi
Akciğer, mediasten ve torasik yapıları daha detaylı değerlendirmek için kullanılır. Sıvı
boşaltıldıktan sonra uygulanması daha anlamlıdır.
Akciğer infiltrasyonu, kitle gibi
sıvıya eşlik eden patolojilerin ayırıcı tanısında çok faydalıdır.
Torasentez
Lateral dekubit grafilerde veya ultrasonografik tetkiklerde 1cm’den daha kalın sıvı
varsa uygulanmalıdır. Aspire edilen sının öncelikle görünümü değerlendirilir. Kanlı
(malign PE, hemotoraks), şilöz (şilotoraks), pürülan (ampiyem), saydam (tüberküloz
ksantokromik rente) görülebilir. Mezotelyomada bazen koyu az akışkan (visköz)
vasıftadır. Hasta başında kolayca değerlendirilebilecek bir başka özellik de sıvının
kokusudur. Az miktarda sıvı torasentezde kullanılan enjektörden bir gazlı beze sıkılır
ve koku özelliği değerlendirilir. Sıvı kokusuz olabileceği gibi kötü kokulu, fekaloid
veya üremik olabilir.
Tanısal amaçla yapıldığında alınan sıvı örneği biyokimyasal tetkikler (total protein,
LDH, glukoz, kolesterol, trigliserit, adenozin deaminaz, interferon- γ), mikrobiyolojik
kültür (aerobik, anaerobik ve TB), Gram boyama ve ARB ve nonspesifik etkenler için
direkt mikroskopik bakı ve sitolojik tetkikler (sıvının hücre içeriği - benign, malign
ayrımı) için gönderilir. Boşaltıcı torasentez nefes darlığını gidermeye yöneliktir. Erken
veya hızlı nükslerde tüp torakostomi veya plevral mikro kanülasyon uygulanabilir.
219
Plevra biopsisi
Kapalı veya torakoskopik olarak yapılır. Klinik olarak veya torasentez sonrası tanı
konulamayan PE’da başvurulur.
Tedavi
Pnömoni, pulmoner emboli gibi nedenlere bağlı PE olgularında asıl nedenin tedavisi
ile effüzyon kendiliğinden rezorbe olabilir.
Semptomatik ve tekrarlayan effüzyonlar torasentezle boşaltılabilir. Ancak sık yapılan
torasentezlerin iatrojenik ampiyem komplikasyonuna yol açabileceği unutulmamalıdır.
Sık torasentez gereken durumlarda drenaj uygulamak gerekir. Plevral kanülasyon,
tüp torakostomi veya kalıcı plevral kateter uygulanabilir. Effüzyonun tekrarını
önlemek için, plörodezis de yapılabilir. Bunun için uygulanan drenaj tüpünden tıbbi
pudra (talk)veya tetrasiklin gibi inflamasyon yaratan ajanlar verilir.
Malign plevral effüzyonlarda ortalama sağkalım 6 aydır. Yapılan tüm tedaviler
semptomatiktir. Sıklıkla plörodezis gerekir. Tanı için torakoskopi yapılan olgularda
akciğerin ekspansiyonu tam ise talk püskürtülebilir. Ekspansiyonu engelliyorsa
visseral plevra torakoskopik olarak soyulur. Akciğer ekspanse edilemiyorsa plevra ile
periton arasına “plöroperitoneal şant-shunt” konulabilir.
Parapnömonik effüzyonlarda, pnömonini tedavisinin yetersizliği ve sıvının kontamine
olduğu
durumlarda
mutlaka
drenaj
gerekir.
Septaların
mevcudiyeti
drenajı
engellemekteyse drenden fibrinolitik ajanlar (stroptokinaz, ürokinaz) verilebilir.
Drenaja rağmen visseral plevra üzerinde kabuk geliştiğinde akciğer ekspanse olmaz.
Bu kabuğun soyulması için “dekortikasyon” ameliyatı yapılır.
KAYNAKLAR
1. Sahn SA: The pleura. Am Rev Respir Dis 138:184-234, 1988.
2. Heffner JE, Brown LK, Barbieri CA: Diagnostic value of tests that discriminate
between exudative and transudative pleural effusions: Primary Study Investigators.
Chest 111:970-980, 1997.
3.Light RW, MacGregor MI, Luchsinger PC, et al: Pleural effusion: The diagnostic
separation of transudates and exudates. Ann Intern Med 77:507-513, 1972.
220
4. Gangadharan PS. Overview—Benign Pleural Conditions, (Chapter 106), In eds:
Sugarbaker DJ, Bueno R, Krasna MJ, Mentzer SJ, Zellos L, Adult Chest
Surgery, The McGraw-Hill Companies, China, 2009.
5. Light RW: Pleural effusion:http://www.merck.com/mmpe/sec05/ch060/ch060d.html,
2008.
221
20.
Dr.Ersin Arslan ve Prof.Dr.Bülent Tunçözgür
Gaziantep Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AMPİYEM NEDENLERİ VE TEDAVİSİNDE TEMEL PRENSİPLER
Plevral boşlukta toraks içi veya dışı alanlardan kaynaklanan mikroorganizmalarla
oluşan enfeksiyon sonucu püy (piyojenik sıvı) birikmesine ampiyem adı verilir (1).
Sıklıkla pnömoni sırasında veya sonrasında görülür (2). Günümüzde torakotomi ve
akciğer rezeksiyonlarının yaygın olarak kullanılması ile birlikte cerrahi sonrası
ampiyem olgularının da sayısı artmış ve tüm ampiyemlerin %20 – 25’ini oluşturur
hale gelmiştir (3). Ampiyemin tedavisinde üç ana prensip vardır. Bunlar ampiyem
boşluğunun uygun antibiyotik tedavisi ile erken sterilizasyonu, erken ve yeterli
drenajla plevral boşluğun anatomik ve fizyolojik olarak normal fonksiyonuna
kavuşmasının sağlanması ve katabolik hastaya yeterli destek tedavisinin (hidrasyon,
beslenme gibi) verilmesidir.
Ampiyem nedenleri
Günümüzde torasik ampiyemin en sık nedeni parapnömonik efüzyonlardır.
Enfeksiyon etkenlerinin plevral boşluğa henüz ulaşmadığı durumlarda komplike
olmayan
parapnömonik
sıvılardan
bahsedilir.
Eğer
sıvı
herhangi
bir
yolla
mikroorganizmalar tarafından kontamine edilirse sıvı komplike olmaya başlar. Sıvı
içersinde lökosit konsantrasyonu artar, sıvı yoğunlaşır ve pürülan hale gelir. Bu
dönemde tedavi başarısı için sıvının drenajı gerekmektedir.
Torasentez gibi plevral aralığa yapılan girişimler komplike olmayan sıvının
kontaminasyonuna neden olabilir. Bu nedenle plevral boşluğa gereksiz invaziv
girişimlerden kaçınılmalıdır.,
Pulmoner rezeksiyonlar sonrası özellikle ekspansiyon problemi yaşayan hastalarda
oluşan potansiyel boşluk sıvı birikimine ve ampiyeme zemin hazırlar. Pulmoner
rezeksiyonların artması ile birlikte bronkoplevral fistül (BPF) oranı da artmıştır. BPF
ve operasyon sonrası uzamış tüp torakostomiler ampiyeme neden olan önemli
faktörlerdendir (Tablo 20.1).
222
Tablo 20.1: Ampiyem nedenleri
Pnömoni sırasında ve sonrasında
Postoperatif
İatrojenik ( Torasentez, plöredez )
Posttravmatik
Sepsis
Özofagus rüptürü
Hidatik kist, apse rüptürü
Diafragma altı apseleri
Uzamış tüp torakostomi
Bronkoplevral fistül
Ampiyemin Patofizyolojisi
Ampiyemin birbirinden net olarak ayırt edilemeyen ve birbirinin devamı şeklinde olan
üç evresi vardır (4,5).
1. Eksüdatif evre
Bu dönemde plevral sıvının viskozitesi düşük, berrak, hücre içeriği azdır ve nötrofiller
ön plandadır. Sıvıda pH 7,30’un üzerinde, LDH 1000 İÜ’ nin altında ve glukoz değeri
kan serum düzeyine eşit olarak ölçülür (Tablo 20.2).
Biriken sıvının miktarı ve
niteliğine göre tekrarlayan torasentez ve drenaj gerekebilir (1).
2. Fibrinopürülan evre
Özellikle tedavisiz hastalarda saatler içerisinde bu döneme geçiş olur. Plevral sıvıda
hücre miktarı ve sıvı yoğunluğu artar; pH 7,20 altına inerken glukoz değeri de giderek
düşer. Nötrofil yıkımı sonucu LDH artar. Plevral yapraklar üzerinde fibrin birikimi
oluşmaya başlar. Plevral lokülasyon alanları oluşabilir.
3. Organizasyon evresi
Fibroblast invazyonu nedeni ile fibrin tabakalar ve membranlar, elastik olmayan
kalınlaşmalara ve yapışıklıklara dönüşür. Paryetal plevra kalınlaşır, etkilenen tarafta
göğüs kafesi esnekliği azalır, kalınlaşan plevra nedeni ile diafragma yeterince işlev
göremez hale gelir. Visseral plevra üzerinde oluşan fibröz kabuk nedeni ile akciğerin
genişleyebilme yeteneği azalır (Resim 20.1). Bu evre 4–6 haftada tamamlanır.
Hastanın hangi evrede olduğunun doğru tayini tedavi planlamasında önemlidir. Genel
olarak kabul edilen prensip hastalığın evresine uygun tedavinin seçilmesidir (6).
223
Resim 20.1: Organizasyon aşamasında amiyem olgusunun toraks bilgisayarlı tomografisi.
Klinik Bulgular
Hastalarda değişen derecelerde plöritik tip göğüs ağrısı, ateş, öksürük, pürülan
balgam çıkarma, nefes darlığı, hemoptizi, kilo kaybı ve iştahsızlık bulunabilir.
Fizik muayene
bulgularında
etkilenen
hemitoraksta
solunum seslerinde
ve
hareketlerinde azalma, perküsyonda matite ve çomak parmak görülebilir (3). Ayrıca
hastalarda eşlik eden hastalığa ait bulgular da izlenebilmektedir.
Tablo 20.2: Plevral sıvının özellikleri
Normal plevral sıvı özellikleri
Makroskopik olarak sıvı berrak ve renksizdir
Ampiyemde plevral sıvı özellikleri
Makroskopik olarak sıvının pürülan
olması
pH ve glukoz değerleri kan değerleri ile Gram boyamanın pozitif olması
eşdeğerdedir
Protein konsantrasyonu < 2 gr/dl
Biyokimyasal olarak plevral sıvı:
Ortalama sıvı miktarı 0,1 – 0,2 ml/kg
pH < 7.0
Lökosit /mm3 < 1000
Protein > 3 g/dl
Sıvıda monosit hakimiyeti vardır
Glukoz < 50 mg/dl
LDH > 1000 IU/L
Lökosit/mm3 > 15000
Bakteriyoloji
Etkili tedaviler ile zamanla üretilen mikroorganizmalarda değişiklikler olmuştur.
Hastaların %36–76’sında anaerobik mikroorganizmalar üretilmiştir (7). Ayrıca
penisilin rezistans stafilokoklar ve gram negatif bakteriler diğer sık üretilen
mikroorganizmalardır.
224
Tedavi
Ampiyem tedavisinde temel prensip erken dönemde enfeksiyonu kontrol altına
almaya
çalışırken
uzaklaştırırken
etkin
akciğerin
drenaj
sağlamak,
reekspansiyonunu
piyojenik
materyali
gerçekleştirmektir
(1).
ortamdan
Tedavi
seçeneklerinin değerlendirilmesindeki en önemli etken ampiyemin evresidir (5).
Ampiyem tedavisinde dikkat edilmesi gereken noktalar (Tablo 20.3) ve ampiyem
tedavisinde uygulanabilecek metotlarla algoritma aşağıda listelenmiştir (Tablo 20.4
ve Şekil 20.1).
Komplike olmayan parapnömik sıvı tespit edilmişse altta yatan parankimal
enfeksiyona yönelik antibiyoterapi başlanır. Radyolojik ve klinik bulgulara göre
gerekirse ikinci kez torasentez yapılır. Sıvı komplike olmuş ise antibiyotik tedavisine
ek olarak mutlaka kapalı drenaj ile sıvının boşaltılması gerekir.
Komplike sıvılarda eğer lokülasyon oluşmaya başlamış ise göğüs ultrasonografisi ve
bilgisayarlı göğüs tomografisi çekilir. Bu dönemde intraplevral fibrinolitik ajanlar
yapışıklıkları ve septaları eriterek poşların birleşmesini ve uygun drenajı sağlar. Eğer
hastada bu tedaviye rağmen ampiyem poşu ortadan kalkmaz, akciğer ekspanse
olmaz ise hastada enfeksiyon kliniği devam eder. Bu hastalarda torakoskopik drenaj
ve dekortikasyon gerekebilir.
Tablo 20.3: Ampiyem olgularında tedavinin başarısı için gereklilikler
Plevral sıvının erken tespiti
Ampiyem evresinin doğru tayini
Plevral boşluğun lokülasyonlar açısından kesin anatomik tanımlanması
Uygun antibiyoterapi
Ampiyemin etkili ve tam drenajı
Komplikasyonların tedavisi
Yeterli nutrisyonel desteğin sağlanması
Medikal girişimlerin başarısızlığında cerrahi işlemlerin hızlı başlatılması
Plevrası kalın, tek poşlu, kapalı drenaja cevap alınamayan ve dekortikasyona uygun
olmayan kronik olgularda açık plevra drenajı uygulanabilir. Plevral boşluk dolana ve
drenaj kesilene kadar hasta takip edilmelidir (1).
Light ve arkadaşları ampiyemin en sık nedeni olan parapnömonik effüzyonları
tedaviye yönelik olarak 7 gruba ayırmışlardır (4).
Grup1: Klinikte önemsiz sıvıdır. Pnömoniye yönelik tedavi başlanır. Eğer sıvı miktarı
artarsa torasentez yapılır.
225
Grup2: Parapnömonik sıvı olarak tanımlanır. Gram boyama ve kültür negatiftir.
pH>7,2 ve glukoz>40 mg/dl olarak ölçülür. Sadece antibiyoterapi verilir.
Grup3: Sınırda komplike parapnömonik sıvıdır. Glukoz>40 mg/dl ve pH: 7,20–7,00
arasındadır. Gram boyama ve kültürler negatiftir. Plevral kalınlaşma ve lokülasyon
izlenmez.
Antibiyoterapi
başlanarak
hastanın
genel
durumu,
kliniği
ve
CRP/sedimantasyon bulguları ile torasentez ve drenaja karar verilmelidir.
Grup 4: Basit komplike sıvıdır. pH 7,00’nin ve glukoz 40 mg/dl’nin altındadır; Gram
boyama ya da kültür pozitifliği vardır. Plevral alanda lokülasyon izlenmez. Küçük çaplı
toraks drenleri ile hemen sıvının boşaltılması gerekmektedir.
Grup 5: Kompleks komplike sıvıdır. Grup 4‘ deki plevral sıvı özelliklerine ek olarak
plevral alanda lokülasyonlar izlenir. Bu hastalarda intraplevral fibrinolitik ajanların
uygulanması önerilir. Tekrarlayan 1–4 günlük fibrinolitik tedaviden sonra sıvının
drenajı tam olarak sağlanamaz ise lokülasyonların torakoskopik olarak ortadan
kaldırılması ve/veya diğer invaziv girişimler uygulanmalıdır.
Grup 6: Bu dönemde sıvıya basit ampiyem denir. Lokülasyon olmadığı için basit
ampiyemden söz edilir. Geniş çaplı (28–36 numara) toraks dreni uygulanmalıdır.
Eğer yeterli drenaja rağmen akciğer ekspanse olmaz ise dekortikasyon planlanır.
Grup 7: Plevral sıvı hem belirgin cerahat görünümünde hem de kalın fibrin septaları
ile multiloküle haldedir. Geniş çaplı toraks dreni ve fibrinolitik tedavi uygulanır. Bu
dönemde diğer cerrahi girişimlere sıklıkla ihtiyaç duyulur.
Torasentez
Tedavi şemasının belirlenmesinde ilk basamaktır.
1. Eğer sıvı bariz olarak ampiyem görünümünde değilse ve Gram boyama negatif
ise erken drenaja karar verebilmek için sıvının pH’sı ölçülmelidir.
a. pH < 7.00: mutlaka drenaj gerekir.
b. pH: 7.00 – 7.20 arasında: yakın klinik gözlem ve gerekirse torasentez
ile pH takibi yapılmalıdır.
c. pH > 7.20: yakın klinik gözlem gerekir.
226
Tablo 20.4:. Ampiyem tedavisinde kullanılabilecek yöntemler.
Antibiyoterapi
Torasentez
Tüp drenaj
İntraplevral fibrinolitik tedavi
Torakoskopi (VATS)
Açık drenaj
Dekortikasyon
Plörokutanöz flep
Torakoplasti
Şekil 20.1: Parapnömonik ampiyemde tedavi algoritması
*Tam cevap: Semptomların düzelmesi, akciğer grafisinde ekspansiyonun sağlanması.
**Tam olmayan cevap: Kliniğin düzelmemesi, Radyolojik olarak belirgin plevral boşluk,lokülasyon
izlenmesi
Tüp torakostomi
Ampiyem tedavisinde ilk basamak göğüs tüpü drenajıdır (3). Tüp torakostomi
başarıya ulaştığı zaman hastanın kliniği hızla düzelir (Resim 20,2a ve 20,2b).
Tedaviye klinik ve radyolojik olarak cevap alındıktan sonra sıvı renginin berrak-sarı
görünüme ulaşması, 24 saatlik drenajın 50 mililitrenin altına inmesi ve kültür
negatifliğinin sağlanması durumunda kapalı drenaja son verilir.
227
Resim 20,2a ve 20,2b: Tüp torakostomi ile yeterli şekilde tedavi edilebilen bir olgunun göğüs
radyografisi.
İntraplevral fibrinolitik tedavi
Ampiyem sıvısında fibrin septalar ve yapışıklıklar nedeni ile lokülasyonlar meydana
gelmiş ise intraplevral fibrinolitik tedavi denenir. Bu amaçla streptokinaz veya
ürokinaz kullanılabilir. Uygulamada 100 ml serum fizyolojik içine günde total olarak
250,000 Ü streptokinaz veya 100,000 Ü ürokinaz dilüe edilerek, dren yolu ile plevral
boşluğa verilir. Daha sonra dren 2–4 saat klempe edilir. Yeterli drenaj, klinik ve
radyolojik düzelme sağlanıncaya kadar işleme ortalama 5 gün devam edilir.
Tedavinin başarı oranı %60–90 arasındadır (4). Bu yöntem sayesinde birçok hastada
hastanede kalış süresi kısaldığı gibi dekortikasyon gibi diğer invaziv işlemlere
gereksinim de azalmıştır (8).
Torakoskopi (VATS)
Oluşan plevral lokülasyonların temizlenmesi, ampiyem boşluğunun ortaya konulması,
fibrinlerin temizlenebilmesi, görerek uygun dren yerleştirilebilmesi nedeni ile özellikle
fibrinopürülan evrede terapötik rolü olan bir yaklaşımdır. VATS ile sıvı boşaltılması,
debridman, fibrin membranlar içeren lokülasyonların ayrılması, akciğerin tamamen
ekspansiyonu, yeterli drenaj ve boşluk obliterasyonu sağlanabilir. Minimal invaziv
olması nedeni ile, hastalığından dolayı yüksek risk taşıyan, genel durumu kötü ve
immunitesi baskılanmış hastalarda ideal bir yöntemdir (9). Erken uygulanması başarı
şansını arttırır (4).
228
Dekortikasyon
Ampiyem eğer tüm tedavilere rağmen organize olur ve fibrotoraks gelişirse
dekortikasyon işlemi uygulanması söz konusudur.
Visseral plevra üzerinde biriken ve kalınlaşan fibrinden oluşan kabuğun akciğerin
ekspansiyonuna engel olmayacak miktarda ve visseral plevraya mümkün olduğunca
az zarar vererek soyulma işlemidir. Toraks duvarının esnekliğinin devam etmesi ve
solunum hareketlerine katılabilmesi için paryetal plevrada oluşmuş kalınlaşmalar ve
fibrotik yapılar da uzaklaştırılmalıdır.
Ampiyeme neden akciğer apsesi, obstriktif kanser veya harap olmuş akciğer ise
dekortikasyon yerine veya dekortikasyonla birlikte (kalan akciğer sahaları ve paryetal
plevraya yönelik olarak) rezeksiyon daha doğru bir seçenektir (1).
Ampiyem Bağlı Komplikasyonlar
1. Bronkoplevral fistül
2. Akciğer apsesi
3. Göğüs duvarı ve kemik enfeksiyonu
4. Ampiyema
neccessitatis
(iltihabi plevral sıvının
kendiliğinden
göğüs
duvarından dışarı drene olması)
5. Sepsis
Cerrahi sonrası ampiyemler
Tüm ampiyemler arasında ikinci sıklıkta görülür. Akciğer rezeksiyonları, akciğer dışı
intratorasik veya ekstratorasik operasyonlar sonucu görülebilir. Pnömonektomi
sonrası ampiyeme sıklıkla bronkoplevral fistül eşlik eder ve mortalite yüksektir.
Akciğer rezeksiyonu dışındaki sebeplerle oluşan ampiyemde primer patoloji tedavi
edilmelidir.
Akciğer rezeksiyonu sonrasında oluşan ampiyemlerde ise plevral boşluk problemi
vardır. Tedavi protokolü plevral drenaj, antibiyotik tedavisi ve plevral boşluğun
kapatılması üzerine kurulur (10).
229
Sonuç
Torasik ampiyemin doğru ve uygun tedavisinin amacı morbidite ve mortaliteyi
sınırlamak, komplikasyonların gelişimini engellemek, hastanede kalış süresini
kısaltmak ve pulmoner fonksiyonları normale döndürmektir. Ampiyem tespit edilirse
mutlaka drene edilmeli ve gerekirse diğer invaziv girişimlerle kavitenin obliterasyonu
sağlanmalıdır.
KAYNAKLAR
1. Tunçözgür B, Elbeyli L. Parapnömonik ampiyemlerde cerrahi tedavi. Toraks
Dergisi 2002;3(4):23-26
2. Light RW, Girard WM, Jenkinson SG, George RB. Parapneumonic effusions. Am
J Med 1980;69:507-12.
3. Arman B, Kıral H. Plevral enfeksiyon hastalıkları,ampiyemler. In Ökten, Güngör A.
ed. Göğüs cerrahisi; 2003:825-843.
4. Arseven O, Okumuş G. Parapnömonik plevral sıvı ve ampiyem. Türkiye Klinikleri
J Int Med 2005;1(32):87-95
5. Henke CA, Leatherman JW. Intrapleurally administered streptokinase in the
treatment of acute loculated nonpurulent parapneumonic effusions. Am Rev Respir
Dis 1992;145:680-4
6. Hamm H, Light RW. Parapneumonic effusions and empyema. Eur Respir J
1997;10:1150-6
7. Brook I, Frazier EH. Aerobic and anaerobic microbiology of empyema. A
retrospective review in two military hospital. Chest 1993;103:1502-7
8. Tuncozgur B, Ustunsoy H, Sıvrıkoz MC, Dıkensoy O, Topal M, Sanlı M, et all.
Intrapleural urakinase in the management of parapneumonic empyema: a
randomised controlled trial. Int J Clin Pract. 2001 55(10):658-60
9. Şanlı M, Tunçözgür B. Parapnömonik efüzyonda video-torakoskopi. TTD Plevra
bülteni. 2008;1:14-20
10. Sivrikoz MC, Elbeyli L. Cerrahi sonrası ampiyemler. Toraks dergisi 2002;3(6):1721
230
21.
Prof. Dr. Akın Eraslan Balcı
Fırat Üniversitesi Tıp Fakültesi, Göğüs Cerrahisi AD
DUKTUS TORASİKUS VE ŞİLOTORAKS
Duktus torasikus lenfatik sistemin sol ana toplayıcı damarıdır. Sağ terminal lenfatik
duktustan çok daha geniştir (Resim 21.1). Duktus, abdomende sisterna şili’den
kaynaklanır; fakat 1/50 hastada olmayabilir. Sisternal cyhli, globüler (küresel) bir yapı
olup 3-4 cm uzunluğunda ve 2-3 cm çapındadır. L2 seviyesinde omurga boyunca
bulunur. Duktus toraksa, T10-T12 düzeyinde, aort hiyatusundan girer. Aort
hiyatusundan geçerken aortanın hafif sağında bulunur. Ekstraplevral planda vertebra
cisimlerinin sağ anterior yüzeyi boyunca yükselir. Özefagusun posteriorundadır. Aorta
ve azigos veninin arasında ve sağ interkostal arterlerin anteriorunda bulunur. T5-T7
düzeyinde duktus, aorta arkasında çapraz bir seyir göstererek mediyastenin sol
posterior tarafına geçer. Özefagusun sol tarafında yükselir. Plevra refleksiyonunun
arkasında ve sol subklavya arterinin posteriorunda bulunur. Bu bölgede duktus
operasyonlar sırasında yaralanmaya çok elverişlidir. Aort kavsi, sol subklavya arteri
veya özefagus operasyonları bu açıdan önemlidir. Klavikulanın 4 cm üzerinde duktus
karotis kılıfının ve juguler venin arkasında, inferior tiroid arteri ve vertebra arterlerinin,
subklavya arterinin ve frenik sinirin önünde seyir göstererek laterale yönelir. Anterior
skalen kasının mediyal kenarında aşağıya yönelir ve subklavya ile internal juguler
venin bileşim yerinde venöz sisteme soldan katılır. Venöz sisteme katlıması sol
inominat vene, sol internal juguler vene, sol vertebral vene ve hatta sağ internal
juguler vene direkt dökülmek suretiyle de olabilir. Duktusun seyri boyunca birçok
kapağı vardır. Lenfatikovenöz bileşkesinde sabit tek bir kapağı vardır. Bu kapağın iki
yaprakçığı vardır ve kanın reflüsünü önler.
Sağ duktus kısadır (2 cm uzunluk) ve nadiren görülebilir. Baş, boyun ve göğüs
duvarının sağ tarafınaki lenfi juguler trunka drene eder. Ayrıca sağ akciğer, kalp ve
sol akciğerin alt yarısının lenfini bronkomediyastinal trunka götürür. Karaciğer
kubbesinden, sağ diyafragmadan ve sağ üst anterior göğüsün lenfi de sağ internal
mammal trunk vasıtasıyla sağ duktusa dökülür.
Bu anatomik ilişkiler duktusun T5-T6 düzeyinin altında yaralandığında neden sağ
şilotoraks ve bu düzeyin yukarısında yaralandığı zaman neden sol şilotoraks
geliştiğini açıklar. Kollateral ilişkiler de duktusun göğüste veya boyunda herhangi bir
231
noktada ligasyonunun neden santral dolaşıma lenf sağlanmasında bozulmaya yol
açmadığını ortaya koyar.
Duktus torasikus aslında bilateral bir yapıdır. Lenfatik sistem beşinci haftanın
sonunda gelişmeye başlar. Lenf keseleri komşu venlerin endotelinden çıkar. Altı adet
lenf boşluğu vardır (Resim 21.2). İki juguler kese anterior kardinal venden çıkar. İki
adet ilak kese de iliak venlerin posterior venlerle kavşak noktalarından çıkar. Tek
retroperitoneal kese posterior abdominal duvar üzerindeki mezanter kökünde
bulunur. İki lumbar lenfatik trunkun ve intestinal trunkun abdomen içinde
birleşmesiyle sisterna şili oluşur. Lenfatik tomurcuklar orijinal keselerden çıkar ve en
düşük direncin olduğu doku planlarını izlerler. Bu da perifere doğru venler
boyuncadır.
Resim 21.1: Duktus torasikusun anatomisi
232
Resim 21.2: Lenfatik kanalların embriyolojik kökeni. A. Yedi haftalık embroyonun sol
tarafında altı adet lenf kesesi, B. Dokuzuncu haftada ventral görünüş. Çift duktus
görünüyor, C. Erişkin torasik duktuusun ve sağ lenfatik duktusun oluşumunu gösteren
geç evre.
Duktus torasikus sol juguler kesenin aşağı doğru gelişmesinden ve sağ torasik
duktusun sisterna şili’den yukarı doğru gelişmesinden oluşur. Başlangıçta duktus
bilateral, simetrik lenf damarları ağı şeklindedir. Her iki taraf jügüler keseye bağlıdır
ve iki tarafın birbiriyle çeşitli anastomozları vardır. Azigos ve interkostal venler de
duktusun major kısmının oluşumuna katkı sağlar. Bu durum duktusla bu damarlar
arasındaki çoklu ilişkileri ve duktus ligatüre edildiği zaman bu damarların şili’yi kan
akımı taşımasını açıklar. Olgunlaşmayla sağ duktusun üst üçte biri ve sol duktusun
alt üçte ikisi oblitere olur. Fakat bunlar arasındaki ana ilişkiler erişkin duktus
torasikusta devam eder. Eğer sağ tarafın üst kısmında obliterasyon olmazsa, o
zaman sağ lenfatik duktus gelişir.
Etiyoloji
Şilotoraksın prevalansı %0.5’den %2’ye kadar değişmektedir. Şilotoraksın duktus
torasikusta ya bir obstrüksiyondan ya da bir laserasyondan kaynaklandığı
düşünülmektedir. En sık görülen nedenler neoplazmlar, travma, tüberküloz ve venöz
trombozdur. Şilotoraks nedenlerinin sınıflandırılması Tablo 21.1 ’de görülmektedir:
233
Yenidoğanlarda konjenital şilotoraks plevra efüzyonunun önde gelen nedenidir.
Şilotoraksla doğan yenidoğanların %50’sinde ilk 24 saat içinde semptomlar gelişir.
Sıvı başlangıçta berraktır ancak memeyle besleme başlayınca hızla bulanık hale
gelir. Zor doğum sırasında venöz basıncı artışı duktus torasikusun ince damarlarının
yırtılmasına neden olabilir.
Şilotoraks çeşitli sendromlarla birlikte görülebilir: Noonan, Down, Gorham, AdamsOliver, herediter lenfödem (Nonne-Milroy-Meige), yellow nail sendromları, Behçet
hastalığı ve trakeoözefageal fistül. Lenfatik sistem malformasyonları konjenital
şilotoraksın nadir görülen nedenleridir. Duktus torasikus hiç olmayabilir, atretik olabilir
ya da plevra ile arasında anormal bileşkeleri olan mültipl dilate lenfatik kanallar
tarzında olabilir. Duktus torasikus anomalileri polihidramniyos veya lenfödemle birlikte
olabilir.
Tablo 21.1. Şilotoraks Nedenleri
Konjenital
Duktus torasikus atrezisi
Duktus torasikus – plevra boşluğu
fistülü
Doğum travması
Travmatik
Künt
Penetran
Cerrahi
Servikal
Lenf nodlarının eksizyonu
Radikal boyun diseksiyonu
Torasik
Patent duktus arteriosus (PDA)
ligasyonu
Koroner arter bypass cerrahi
Koarktasyon eksizyonu
Özefajektomi
Torasik aort anevrizması
Mediyasten tümör rezeksiyonu
Pnömonektomi veya lobektomi
Sol subklavya arteri operasyonları
Sempatektomi
Abdominal
Sempatektomi
Radikal lenf nodu diseksiyonu
Tanısal İşlemler
Lumbar arteriyografi
Subklavya ven kateterizasyonu
Sol kalp kateterizasyonu
Neoplaziler
234
Benign
Malign
Enfeksiyonlar
Tüberküloz lenfadenit
Nonspesifik mediyastinit
Asendan lenfanjit
Filaryazis
Nadir Sebepler
Venöz tromboz
Sol subklavya veya juguler ven
Superior vena kava
Şilöz asite sekonder
Pankreatit
Spontan
Travmatik Şilotoraks
Duktus torasikusun travmatik nedenle yaralanmasına künt ya da penetran travmalar
ya da cerrahi işlemler neden olabilir. Duktusun seyri boyunca herhangi bir noktada
yaralanma olabileceğinden yaralanma yerinin anlaşılması zor olabilir. En sık görülen
non-penetran yaralanma şekli omurganın ani hiperekstansiyonudur. Bu olay
duktusun diyafragmanın hemen üzerinde rüptürüne yol açar. Yaralanma
mekanizması diyafragmanın sağ krusunun makas etkisi veya vertebra cisimleri
üzerinde aniden oluşan germe etkisi olabilir.i Özellikle yemek sonrası böyle bir
yaralanmaya duyarlık vardır.
Ateşli silahla veya delici-kesici aletlerle yaralanmalar nadirdir. Bu tarz yaralanmalar
oluştuğu zaman genellikle diğer organlarda daha yaşamsal hasarlar vardır ve bu
hasarlar duktustaki penetran yaralanmayı gölgeleyebilir. Ancak travma nedeniyle
torakotomi yapıldığı zaman duktus torasikus muayene edilmelidir.
Cerrahi işlemler sırasındaki yaralanma, en çok toraksın sol tarafının üst kısmındaki
ameliyatlar sırasında görülmektedir. Ancak bütün cerrahi prosedürler sırasında
görülebilir. Kalp, akciğerler, aort, özefagus, sempatik zincir ve subklavya damarlarının
ameliyatlarında dikkatli olunmalıdır. Duktus göğsün üst kısmında aort kavsi, sol
subklavya arteri veya özefagusun mobilizasyonu yapılırken yaralanmaya çok
müsaittir. Koroner arter bypass cerrahisi sırasında en çok sol internal mammal
arterin hazırlanması sırasında duktus torasikus yaralanması görülür.
Radikal boyun diseksiyonu ve skalen lenf nodu biyopsisi sonrasında da yaralanma
görülür. Abdomende yapılan sempatektomi ve radikal lenf nodu diseksiyonu da
duktus torasikus yaralanmasına yol açabilir. Translumbar aortografi ve juguler veya
235
subklavya damarlarına santral venöz hat yerleştirilmesi gibi tanısal işlemler de
duktusu yaralayabilir.
Neoplaziler
Benign ya da malign tümörler duktus torasikusu tutabilirler. Tümörün duktal dokuya
giriş mekanizması lenfatik permeasyon, direkt invazyon veya tümör embolisi şeklinde
olabilir. En sık görülen tümörler lenfoma, lenfosarkom ve primer akciğer kanserleridir.
Tek taraflı ya da bilateral şilotoraks şişmiş ve gerilmiş olan dalların rüptüründen
kaynaklanır.
Duktus torasikusun benign lezyonları şunlardır: lenfanjiyom, mediyasten higroması ve
lenfanjiyomiyomatozis (L). L genç kadınların akciğerlerinde görülür. Pnömotoraks ve
hemoptiziye yol açar. Peribronşiyal, perivasküler ve perilenfatik akciğer bölgelerinde
düz kas proliferasyonuyla karekterlidir. Bu düz kas proliferasyonu lenfatik kanallarda
obstrüksiyona yol açmaktadır. Dispne major semptomdur ve bu kadınlarda tanıdan
sonraki 10 yıl içerisinde pulmoner yetmezlik gelişerek ölüm görülmektedir.
Erişkinlerdeki şilotoraksların %50’den fazlası tümör nedenlidir. Tümörlerin de %75’ini
lenfomalar oluşturur. Şilöz efüzyonu olan hastalar mutlaka olası bir mediyasten veya
retroperiton malignitesi yönünden değerlendirilmelidir. Çünkü şilöz efüzyon
kuşkulanılmayan bir tümöral gelişimin ilk bulgusu olabilir.
Malign obstrüksiyon şilüsün perikardın içine kaçmasına neden olabilir. Bu nadir
görülen durumda kalp tamponadı bulguları görülür.
Enfeksiyonlar
Şilotoraksın enfeksiyöz nedenleri tüberküloz, mantar hastalıkları, lenfanjit, filaryazis
ve nonspesifik mediyastinittir. Bu son durumda lenf nodu genişlemesi ve
obstrüksiyonu vardır.
Diğer Şilotoraks Nedenleri
Kusma veya şiddetli öksürük spontan rüptüre yol açabilir. Özellikle kuvvetli bir
öğünden sonra duktus bu şekilde rüptüre olmaya daha elverişlidir. Eğer böyle bir
minör travmadan sonra rüptür görülüyorsa, altta bir malignitenin yatma olasılığı her
zaman vardır. Torasik duktusun drene olduğu büyük damarlarda gelişen tromboz da
şilöz bir efüzyona yol açabilmektedir.
Göğüsteki şilöz efüzyon şilöz asitten kaynaklanabilir. Bu durumda da malignite,
büyük olasılıkla lenfoma söz konusudur. Çocuklardaki primer fistüller ve lenfatik
236
hastalık intraperitoneal şilöz birikime neden olabilir. Eksüdatif enteropati, konjenital
intestinal lenfatik ve şilöz kaçaktan dolayı gelişir. Şilüs barsak lümenine
boşalmaktadır. Amiloidozun komplikasyonu olarak şilotoraks gelişebilir. Eğer hastalık
duktal obstrüksiyon yaparsa, bu komplikasyon ortaya çıkar. Çeşitli abdominal
operasyonlar ve pankreatit sonrasında da şilöz asit görülebilir.
Şilöz sıvının bileşimi
Duktus torasikus lenfi saf şilöz değildir. Akciğerler, barsaklar, karaciğer, karın duvarı
ve ekstremitelerden gelen lenfin karışımıdır. Şilüsün çoğu barsaklarda üretilir. Normal
durumlarda ekstremitelerden gelen lenf miktarı ihmal edilebilir düzeydedir. Şilüs
karekteristik olarak süt beyazı renkte, kokusuz ve alkalidir. Duktus lenfi açlık
sırasında berraktır ve yağlı bir öğünden sonra süt görünümü alır. Güçlü bir şekilde
bakteriyostatiktir. Lipid, protein, elektrolitler, lenfositler ve diğer farklı elemanlar içerir.
Şilüsün normal kompozisyonu Tablo 21.2’de görülmektedir.
Lipidler
Şilüsün ana komponenti yağdır; 14 to 210 μmol/L total yağ içerir. Bu yağlar nötral
yağ, serbest yağ asitleri, sfingomiyelin, fosfolipid, kolesterol ve kolesterol esterleridir.
Sindirilen yağın %60-70’i intestinal lenfatik kanallar aracılığıyla absorbe edilir ve
duktus torasikus yoluyla kan dolaşımına taşınır. Lenfin içindeki nötral yağ 0.5 mm
çapındaki şilomikronlar olarak taşınır. Yağ asitlerinin 10 C atomundan daha küçük
olanları doğrudan portal venöz sisteme absorbe edilirler. Bu nedenle, şilotoraksın
medikal tedavisinde, orta zincirli yağ asitleri oral yolla verilebilmektedir. Trigliseritler
kolesteroldan çok daha fazladır.
Tablo 21.2. Şilusun Normal Karakter ve Bileşimi
Şilüs konsantrasyonu
Karakter
Süt görünümünde, alkali veya
eterle karıştırılırsa berrak hale
gelir
pH 7.4-7.8 (alkali)
Kokusuz
Dansite 1.012-1.025
Steril ve bakteriyostatik
Sudan III ile boyanan yağ
globülleri
Lenfosit
Eritrosit
Bileşimi
Total protein
Albumin
Globulin
Fibrinojen
Antitrombin globulin
Protrombin
Fibrinojen
Total yağ
Triglycerid
Kolesterol
6
Plazma konsantrasyonu
6
400-6800 × 10 /L
9
0.050-0.6 × 10 /L
1500-4000 × 10 /L
9
4500-6500 × 10 /L
21-59 g/L
12-41.6 g/L
11-30.8 g/L
0.16-0.24 g/L
>%25 plazma
>%25 plazma
>%25 plazma
14-210 μmol/L
Plazmadan fazla
Plasmadaki gibi veya az
65-80 g/L
40-50 g/L
25-35 g/L
1.5-3.5 g/L
237
0.84-2.0 μmol/L
4.4-6.5 μmol/L
Glukoz
Ure
Elektrolitler
Pankreatik ekzokrin enzimler
Lipoprotein elektroforezi
Kolesterol/trigliserit oranı
2.7-11.1 μmol/L
1.4-3.0 μmol/L
Plazmadaki gibi
Var
Şilomikron bandı
<1
2.5-4.2 μmol/L
3.0-7.0 μmol/L
Protein
Lenfatik damarlar ekstravasküler proteinlerin vasküler aralığa dönmeleri için ana yolu
oluştururlar. Şilüsün protein içeriği plazmadakinin yarısı olup 21-59 g/L arasında
değişir. Albumin konsantrasyonu 12-41.6 g/L; globulin konsantrasyonu 11-30.8 g/L
arasında bulunur.
Elektrolitler
Şilüsün elektrolit içeriği plazmadakine benzer. Glükoz 2.7-11.1 µmol/L’dir. Başlıca
iyonları sodyum, potasyum, klor, kalsiyum ve inorganik fosfordur.
Hücre Elemanları
Duktus torasikus lenfindeki asıl hücresel elemanlar lenfositlerdir. Periferik lenfatik
kanallardan ve lenfoid organlardan doğarlar. Lenfositlerin %90’ı T lenfositlerdir ve
antijenik stimulusa kan lenfositlerinden farklı şekilde reaksiyon gösterirler. Hücrelerin
kandan lenfe doğru ve lenfatik akımdan da kana doğru devamlı bir dolaşımı vardır.
Drenajın çok uzadığı şilotorakslarda lenfositlerin tükenmesi ve immün sistemin
yetersizliği söz konusu olabilir. Berrak lenfatik sıvıda 0.05×10/L adet eritrosit varken
absorbsiyon sonrasında bu 0.6×109/L’ye yükselebilir.
Nadir Elemanlar
Şilüs sıvısında yağda eriyen vitaminler, antikorlar, üre nitrojeni ve enzimler de vardır.
Enzimler pankreas lipazı, alkali fosfataz, aspartat transaminaz ve alanin
transaminazdır.
Patofizyoloji
Şilotoraks duktus torasikustaki bir rüptür veya yırtıktan kaynaklanır. Kardiyopulmoner
anormalliklere, metabolik ve immunolojik eksikliklere neden olur. Lenf, mediyasten
plevrası yırtılıncaya kadar posterior mediyastende birikir. Genellikle birikim yeri
pulmoner ligamentin tabanında sağ taraftır. Göğüste şilüsün birikimi alttaki akciğeri
basıya uğratır ve pulmoner fonksiyonu yetmezliğe düşürür. Kısa nefes alıp-vermeye
ve solunum sıkıntısına yol açar.
238
Ampiyem şilotoraksın nadir bir komplikasyonudur. Çünkü şilüsün içinde bulunan
lesitin ve yağ asitlerinin bakteriyostatik bir etkisi vardır. Steril şilüs irritasyona neden
olmaz ve bundan dolayı plevral tipte ağrıya veya fibrotik inflamasyon reaksiyonuna
yol açmaz.
Her ne kadar yağ şilüsün en önde gelen bileşeni olsa da, protein ve vitamin kaybı
ciddi metabolik ve nutrisyonel defektler anlamında çok önemlidir. Protein, yağda
eriyen vitaminler, lenfositler ve antikorlar persistan şilöz kaçak nedeniyle
kaybedildiğinde immün yetmezlik, koagülopati, malnutrisyon ve ölüm görülebilir.
Tanı
Klinik Özellikler
Şilotoraksın başlaması genellikle sinsidir. Fakat hızla birikim, taşipne, taşikardi ve
hipotansiyon da görülebilir. Şilotoraksın klinik olarak aşikar hale gelmesinden önce
genellikle 2-10 günlük bir latent dönem vardır. Latent dönemin nedeni yaralanmış ya
da cerrahi sonrası dönemde bulunan hastalarda yapılan diyet kısıtlamasıdır.
Şilotoraksın başlangıçtaki klinik bulguları ipsilateral akciğerin ve mediyastenin
mekanik kompresyonu dolayısıyladır. Bu mekanik kompresyon dispne, yorgunluk ve
ağırlık hissine neden olur. Protein, yağda eriyen vitamin ve antikor kaybından ötürü
ortaya çıkan problemleri torasentezler veya kronik tüp drenajı ağırlaştırabilir. Sıvı
kaybı günde 2500 mL’ye ulaşabilir ve eğer yerine konmazsa kardiyovasküler
dengesizliklere yol açabilir. Eğer hastalara destek tedavisi yapılmazsa ölüm
kaçınılmazdır. Fistül ya spontan olarak iyileşir ya da cerrahi olarak kapatılmalıdır.
Duktusun travmatik yaralanmasının hemen sonrasında kanda yapılan labaratuar
çalışmaları normaldir. Kronik efüzyon ya da bebekte şilotoraks söz konusuysa
hipoproteinemi, azalmış trigliserit ve lenfositopeni doğabilir.
Şilotoraksın diğer plevral efüzyonlardan ayrımını yapabilecek radiyolojik bulgu yoktur.
Bipedal lenfanjiyogramlar, duktus torasikus laserasyonu tanısı koymada yararlı
olabilir. Bu işlem için 10 mL etiyoidize yağ, ayak dorsumundaki lenfatik damarların
içine enjekte edilir. İşlemden 1-2 saat sonra abdomen ve göğüste radyografilerle
takip edilir. Bu teknik pulmoner ödem, lenfanjit veya nadiren serebral yağ embolisi
yapabilir. Teknesyum 99m – antimon sülfit koloidinin subkutan injeksiyonu ile yapılan
radyonüklit görüntülemede 3 saat içinde görüntüler alınır. Bu teknikle obstrüksiyon
görülebilir, fakat kaçağın yerini göstermede sınırlı ölçüde yararlıdır. BT de kaçak
239
yerini göstermede sınırlıdır. Fakat mediyasten kitlesini, genişlemiş lenf nodlarını veya
primer akciğer kanserini gösterebilir.
Sıvı Analizi
Pıhtılaşmayan süt görünümünde sıvının plevra boşluğundan torasentez ya da göğüs
tüp drenajıyla alınması şilotoraksı düşündürür. Tablo 2’de şilüsün karakteristik
özellikleri görülmektedir. Tanı serbest mikroskopik yağın görülmesi, yağ içeriğinin
plazmadakinden fazla ve protein içeriğinin plazmadakinin yarısından az olduğunun
gösterilmesiyle doğrulanır. Yağ globulleri alkali veya eterle kaybolur, Sudan III
boyasıyla boyanır. Şilüs yanlışlıkla püy tanısı alabilir. Fakat şilüsün kokusu yoktur ve
kültürleri negatiftir. Gram boyaması yararlıdır, çünkü şilüs içindeki hücreler
polimorfonükleer lökositlerden ziyade lenfositlerden oluşmaktadır. Bakteri görülmez.
Şilüsün sadece barsaktan yağ transportu yaparken sütlü görünümde olduğunu
hatırlamak önemlidir. Berrak ya da kanlı sıvı şilöz kaçak olasılığını ekarte ettirmez.
Açken oluşan duktus yaralanmasında, başlangıçta şilüs kanlı bir görünüme sahip
olabilir, ardından berrak ve seröz bir görünüm alabilir. Şilüs içerisinde baskın hücre
tipi lenfositlerdir. Lenfosit oranının %90’dan fazla oluşu tanısaldır. Travmatik
efüzyonlardaysa eritrositler ve diğer kan elemanları görülür.
Paranteral beslenme alan ve nazogastrik sakşın yapılan hastalarda tanı gecikebilir.
Efüzyon aşikar hale gelmeden önce hastalarda süperior mediyastenin genişlediği
görülebilir. Bu genişlemeye şiloma (şilüsün mediyasten plevra zarfı içindeki birikimi)
neden olur. Şiloma plevra boşluğuna drene olabilir, bu durumda şilotoraks gelişir.
Lökosit sayısında lenfositlerin selektif olarak azalmasının sonucu azalma vardır.
Diğer bir yararlı işaret de sıvı birikiminin miktarıdır. Hiperekstansiyon yaralanması ya
da özefajektomi, torasik aort cerrahisi gibi cerrahi işlemler geçirmiş bir hastada
günlük 700-1200 mL drenaj varsa şilöz kaçak düşünülmeli ve araştırılmalıdır.
Şilüsün kolesterol/trigliserit oranı 1’den azdır. Buna karşın non-şilöz efüzyonlarda
1’den daha büyük bir oran vardır. Buna karşılık şilöz olmayan efüzyonlarda oran
1’den daha büyüktür. Eğer sıvıda 1.24 µmmol/L’den daha fazla trigliserit varsa, bu
sıvının şilüs olma olasılığı %99’dur. Eğer trigliserit miktarı 0.56 µmol/L’den azsa,
sıvının şilüs olma ihtimali %5’dir. Ara değerlere sahip olan hastalarda lipoprotein
elektroforezi yapılarak karar verilebilir. Şilomikronların görülmesi şilotoraks tanısına
spesifiktir. Ana tanısal işlemler ve özellikleri şunlardır:
240
Gram boyama:
kolesterol/trigliserit<1
pH:
trigliserit >1.24 µmol/L
Sudan III boyama
Elektroforezde şilomikronlar
Lenf kanalına metilen mavisi enjekte edilerek duktus torasikus ve fistül yerini cerrahi
sırasında görünür hale getirmek olanaklıdır. Duktusun görüntülenmesi preoperatif
krema yiyerek veya mideye metilen mavisi doldurularak daha da artırılabilir.
Ayırıcı Tanı
Süt görünümündeki efüzyonların ayırıcı tanısında psödoşilotoraks ve kolesterol
plevra efüzyonlarını dikkate almak gerekir. Uzun süren kronik plevra efüzyonlarında
şilöz görünüm doğabilir. Bu kolesterol efüzyonları tüberküloz veya romatoid artritte
görülürler ve sıvının yüksek kolesterol içeriğiyle ilgilidirler. Yağ globulleri görülmez ve
elektroforezde şilomikron içermezler. Yayma yapıldığında kolesterol kristallerinin
görülmesi psödoşilotoraks için tanısaldır.i
Psödoşilöz efüzyon, malign tümör veya enfeksiyonları olan plevraları kalınlaşmış ya
da kalsifikasyonlu hastalarda da görülür. İçerdikleri lesitin-globulin kompleksinden
ötürü sütlü bir görünümde olabilirler. Sudan III boyaması yapıldığında yağ globülleri
görülmez, sadece yağ çizgileri vardır. Psödoşilüs, şilüse göre daha az kolesterol ve
protein içerir.
Başka nedenlere bağlı plevra efüzyonuyla beraber şilöz kaçak da olduğu zaman,
kompleks plevra efüzyonu söz konusudur. Şilöz kaçağın da beraberinde bulunduğu
bu plevra efüzyonlarına konjestif kalp yetmezliği, enfeksiyon, tümör ve travma gibi
nedenler yol açabilir. Dilüsyondan ötürü sıvı analizi yanlış tanı konulmasına neden
olabilir.
Tedavi
Şilotoraks tedavisinde ilk adım koruyucu tedavidir. Duktus torasikusun potansiyel
yaralanması, intraoperatif olarak akılda tutulmalı ve eğer gerçekleşirse tanınmalıdır.
Özefagus veya toraks aortunda diseksiyon yaparken aort hiyatusunda, duktus
ligasyonu kolayca yapılabilir. Yaygın lenfadenektomi veya posterior mediyasten lenf
nodu diseksiyonu yapılan durumlarda duktus torasikusun rutin ligasyonu
düşünülebilir.
241
Tedavide yapılacak çeşitli işlemler vardır (Tablo 3). Tedavi iki ana kategoriye ayrılır:
konservatif (cerrahi dışı) ve cerrahi tedavi. Tedavinin 5 önemli prensibi vardır: (i)
solunum fonksiyonunu desteklemek, (ii) akciğerin re-ekspansiyonunu ve plevra
boşluğunun obliterasyonunu sağlamak, (iii) dehidratasyon ve malnutrisyondan
korunmak, (iv) şilöz sıvı üretimini azaltmak, (v) gerektiğinde alttaki hastalığı tedavi
etmek. Genellikle bu amaçlara ulaşmak için tedaviler kombine edilir.
Tablo 21.3: Şilotoraksta Tedavi Yöntemleri
Prensipler
Medikal
Girişimsel
Respiratuar Destek
Göğüs
fizyoterapisi
Efüzyonun drenajı
Mekanik
ventilasyon
Plevra boşluğunun
drenajı ve akciğer
re-ekspansiyonu
Plevra boşluğunun
obliterasyonu
Torasentez
Göğüs tüpü
torakostomisi
Pleuroperitoneal
shunt
Tüp
torakostomisiyle
kimyasal plöredez
Cerrahi Tedavi,
Minimal İnvaziv veya
Açık
VATS veya torakotomi
Akciğer
dekortikasyonu
Plevrektomi
Plöroperitoneal şant
Kimyasal plörodez
Dehidratasyon ve
malnutrisyondan
koruma
Şilüs üretiminin
azaltılması
Şilüs infusion (?)
Orta zincirli
trigliserit diyeti (?)
TPN
Oral alımın
kesilmesi
Somatostatin (?)
Duktus torasikus
embolizasyonu
Mechanical
ventilation with
PEEP (?)
Octreotide (?)
Duktus torasikusun
direkt ligasyonu
Duktus torasikusun
kütle ligasyonu
Azigos venine
duktusun
anastomozu(?)
Fibrin glue (?)
Laparotomy:
Duktus torasikusun
kütle ligasyonu
Etilefrine (?)
Nedene yönelik
tedavi
VATS veya torakotomi
Radyasyon
tedavisi
Kemoterapi
242
Konservatif Tedavi
Olguların çoğu konservatif yöntemlerle tedavi edilir. Hastaların yaklaşık %50’sinde
cevap alınır. Cerrahi tedaviye yardımcı olarak da sıklıkla konservatif tedavi şekilleri
kullanılmaktadır.
Plevra Boşluğunun Drenajı ve Obliterasyonu
Drenaj, akciğerin re-ekspansiyonu ve plevra boşluğunun obliterasyonu yöntemleri,
her plevral efüzyon için ana tedavi yöntemleridir. Drenaj torasentez, tüp torakostomisi
veya plöroperitoneal şant yöntemleriyle başarılabilir. Torasentez seçilirse sık sık
tekrarlanması gerekir. Plevra aralığının tam olarak boşalmasını nadiren sağlayabilir.
Ayrıca efüzyonun loküle hale gelmesine, hemotoraksa, pnömotoraksa ve ampiyeme
yol açabilir. Tüp torakostomisi hızlı ve sürekli drenaj sağlar. Akciğer reekspansiyonunu gerçekleştirir. En sık kullanılan yöntemdir.
Plöroperitoneal şant, daha invaziv cerrahi yöntemleri tolere edemeyen hastalarda
kullanılır. Çift kapaklı Denver şantıyla yapılan plöroperitoneal şant yüksek riskli
hastalarda ve pediyatrik şilotoraks olgularında kullanılmıştır. i, i Şantın yerleştirilmesi
nispeten kolaydır. Ayrıca eksternal drenaj yönteminde görülebilen nütrisyon, sıvı ve
hücre kayıpları daha azdır. Ancak pompalama gerektiğinden hasta uyumu şarttır.
Olguların %10’unda şant replasmanını gerektiren fibrin nedenli şant oklüzyonu
görülür. Şilöz asit anlamlı bir probleme neden olmaz. Fakat varsa şant yerleştirmesi
için kontrendikasyon oluşturur.
Torakostomi tüpünden talk, nitrojen mustard veya bleomisin vererek kimyasal
plöredez yapmak plevra boşluğunun obliterasyonuna yardım eder. Cerrahinin bir
seçenek olamadığı yüksek riski olan hastalarda diğer konservatif işlemlere yardımcı
bir yöntem olarak kullanılır. Cerrahi hastalardaysa duktus torasikus ligasyonundan
sonra uygulanabilir.
Respiratuar Destek
Uygun bir solunum fonksiyonunu desteklemek için gereken işlemler fazla
abartılmamalıdır. Hastaların çoğunda zaten riskli bir solunumsal durum vardır. Bu
solunumsal zorluğa hastalığın altında yatan temel patoloji neden olmaktadır. Örneğin
lenfoma veya toraks travması, ya da sternotomi, torakotomi veya yüksek abdominal
insizyon. Şilöz sıvının plevra boşluğunda birikmesi ve sekonder atelektazi,
solunumsal yetmezliği daha ileri götürür ve akut respiratuar yetmezliğin başlamasına
neden olabilir. Plevra boşluğunun drenajıyla akciğerin tekrar ekspansiyonu ve agresif
243
göğüs fizyoterapisi kullanılan ana işlemlerdir. Eğer bunlar yetersiz kalırsa mekanik
ventilasyonla destek yapılabilir.
Dehidratasyon ve Malnutrisyonun Önlenmesi
Şilotoraks tedavisinin en önemli yönleri dehidratasyonu önlemek, uygun bir beslenme
ve doğru sıvı elektrolit dengesini sağlamaktır. Torakostomi tüpünden sıvı kayıpları
uygun şekilde takip edilmeli ve hipovolemiyi önlemek için volüm replasmanı
yapılmalıdır.
Şilüs 40 mm kan filtresi ve volumetrik bir pompa kullanılarak geri verilebilir. i
Anafilaksiden sakınmak için küçük bir test dozu verilmesi tavsiye edilir. Her ne kadar
cazip görünse de bu tedavi yöntemi popülerlik kazanmamıştır. Teknik olarak zorluğu
ve enfeksiyon riski gibi dezavantajları vardır.
Orta zincirli yağ asitlerinden oluşan bir diyeti kullanarak beslenme desteği yapmak
veya total parenteral nutrisyon (TPN) ile hastayı beslemek sık uygulanan
yöntemlerdir. Orta zincir uzunluğuna sahip trigliseritleri içeren düşük yağ içerikli
enteral formüller önerilmiş olsalar da az kullanılır. 10 C atomundan daha fazla C
atomu içeren uzun zincirli yağ asitleri ikinci bir esterleşme süreci geçirerek lenf
akımının içine şilomikronlar olarak geçerler. Fakat orta uzunluktaki yağ asitleri
albumine bağlanmak suretiyle direkt olarak portal vene geçerler. Ancak orta zincir
uzunluğundaki trigliseritlerin tercihen direkt olarak portal dolaşıma geçmelerine
karşın, barsak trigliseritleri ekzojen olduğu kadar endojen kaynaklardan da elde
edilmektedir. Orta zincir uzunluğunda trigliseritlerden oluşan diyet almaya karşın,
şiloz trigliseritlerin %80’i orta zincirli değildir. Her ne kadar bu şekildeki bir diyet
beslenme açısından etkin olsa da, genellikle şilöz üretimi tam olarak ortadan
kaldıramaz. Herhangi bir oral alım şilüs üretimini artırmaktadır. Dolayısıyla TPN ve
oral alımın kesilmesi şilüs üretiminin azaltılması ve beslenme desteği açılarından en
etkin yöntemlerdir.
Şilüs Üretiminin Azaltılması
Şilüs oluşumunu azaltmanın en etkin yolu herhangi bir oral alımdan tam olarak
kaçınmaktır. Son yıllarda şilüsü azaltan yeni konservatif işlemler ortaya çıkmıştır.
Somatostatin, octreotide, etilefrine, PEEP destekli mekanik ventilasyon ve duktus
torasikusun perkütan embolizasyonu tanımlanmıştır.
Deneysel çalışmalarda somatostatinin şilöz kaçağı azalttığı ve fistülün erken
iyileşmesine neden olduğu gözlenmiştir. Somatostatin ve octreotide splanknik (iç
organlara ait) kan akımını azaltır, barsak motilitesini düşürür ve gastrointestinal
244
hormon ve peptidleri inhibe eder. Bu etkilerinin kombinasyonu gastrointestinal
sekresyonları, absorbsiyonu ve ardından şilöz akımı azaltır. Bu iki maddenin iv
sürekli infüzyon şeklinde kullanılmasıyla postoperatif veya konjenital şilotoraksı olan
çeşitli pediyatrik olgularda başarılı sonuçlar alınmıştır. Sürekli iv infüzyonda
octreotide için doz aralığı 1-5 µg/kg/saat veya subkutan injeksiyon için toplam 10-70
µg/kg/gün dozunun üçe bölünerek verilmesidir. Erişkinlerdeki etkisi tartışmalıdır.
Genelde subkutan olarak ve 300 µg/gün dozu üçe bölünerek verilir.
Etilefrine semptomatik bir ilaç olup postüral hipotansiyon tedavisinde kullanılmaktadır.
Duktus torasikusta düz kas kontraksiyonu yaparak şilöz akımı azalttığı düşünülür.
Ventilasyon tedavisinin şilöz drenajı azalttığı yıllardır bilinmektedir. Mekanik
ventilasyonla beraber PEEP uygulaması travmatik şilotoraks olgularında ve diğer
nedenlerden ötürü ventilatör desteği gerekenlerde kullanılabilir.
Sisterna şilinin transabdominal yolla kateterizasyonu ve duktus torasikusun
embolizasyonu lokal anestezi altında ve sedasyonla uygulanır. Sisterna şilinin
opasifikasyonunu sağlamak için iyotlu yağ unipedal veya bipedal yolla verilerek
lenfanjiyografi yapılır. Anterior abdomen duvarından perkütan yaklaşım yapılarak
sisterna şili veya diğer bir büyük (>2-3 mm) retroperitoneal lenfatik kanüle edilir.
Kanülasyon işlemi floroskopik görüş altında yapılır. Ardından embolizasyon yapılır.
Başarı oranı %70’tir.i
Alttaki Nedenin Tedavisi
Travma veya cerrahiyle ilgili olmayan şilotorakslarda neden saptanmalı ve uygun
tedavi başlatılmalıdır. Malignitelerin yarattığı obstrüksiyondan doğan şilöz fistüller,
alttaki hastalık etkin bir şekilde tedavi edilmedikçe konservatif tedaviye ve cerrahi
ligasyona kötü yanıt verirler. Lenfomalar veya diğer maligniteler için radyasyon,
kemoterapi veya her ikisi birden tedavinin ayrılmaz parçasını oluştururlar. Kontrolü
sağlayabilmek için diğer tedavi yöntemleriyle (TPN, oralin kesilmesi, cerrahi ligasyon,
plöredez) kombine edilmesi gerekir. 20 Gy radyasyon da postoperatif şilotoraksların
engellenmesinde başarılı bulunmuştur.i
Konservatif Tedavinin Sonuçları
Konservatif işlemlerin sonuçlarını birçok faktör belirler. Bu faktörler hastalığın altında
yatan neden, şilöz kaçağın şiddeti ve yapılan farklı tedavilerdir. Şilöz kaçakların %2550’si konservatif tedaviyle 2 hafta içinde spontan olarak kapanır. Eğer spontan
245
kapanmanın gerçekleştiği düşünülüyorsa, toraks dreni çekilmeden önce yüksek yağ
içerikli bir diyet vererek şilöz fistülün kapandığından emin olunmalıdır.
Cerrahi Tedavi
Cerrahi ligasyondan önce 14 gün konservatif tedavi yapmak önerilir. Bu süre
içerisinde şilöz kaçakların %25-50’sinde spontan kapanma görülür. Geri kalanlar için
cerrahi girişim gerekir. Cerrahi dışı tedavide daha kısa süreli uygulama, yenidoğan ve
debilize hastalarda önerilmektedir. Bunlarda lenfosit, antikor ve protein kaybı şiddetli
yetmezliğe neden olur. Postözefajektomi şilotoraks hastalarında drenajın
başlamasından sonra 5. günde şilöz drenaj <10 mL/kg olması non-operatif
(konservatif) tedavinin başarılı olacağının göstergesidir, daha fazla drenajı olan
hastalarda reoperasyon gerekecektir.i Operatif tedavi gerekeceğinin başka bir
belirteci de 2 gün sonra günlük drenajın >2L olmasıdır.i
Cerrahi genellikle konservatif işlemlerle desteklenir. Şilotoraks onarmada kullanılan
çeşitli cerrahi teknikler tanımlanmıştır. Hepsinde torakotomi ya da laparotomi yoluyla
açık yaklaşım söz konusudur. Duktus torasikusun direkt ligasyonu, duktusun
supradiyafragmatik olarak kütle şeklinde ligasyonu, duktusun azigos venine
anastomozu ve fibrin yapıştırıcı uygulaması gibi yöntemlerin hepsinde şilöz kaçağın
durdurulması amaçlanır. Akciğer dekortikasyonu, plevrektomi, kimyasal plöredez ve
plöroperitoneal şant; akciğer ekspansiyonunu düzeltmek, plevral boşluğu ortadan
kaldırmak ve kaçağı kontrol etmek umuduyla uygulanmıştır. Bu teknikler tipik olarak
duktusun doğrudan kontrolüne ek olarak veya kaçak yeri bulunamadığı zaman
kullanılır. Bunların hepsi hemen hemen VATS ile yapılmaktadır. Göğüs fizyoterapisi
yapılarak postoperatif pulmoner komplikasyonlar genellikle azaltılabilir. Elektrolit
dengesizliği düzeltilmeli ve sıvı durumu optimize edilmelidir. Yalnızca ilk 24 saat için
rutin koruyucu antibiyotik tedavisi önerilir. Tromboprofilaksi sağlanır. Kaçak yerini
lokalize etmek için preoperatif lenfanjiyogram yapılabilir.
Nazogastrik tüp vasıtasıyla operasyondan 2-3 saat önce 100-200 ml zeytinyağının
verilmesi önerilir. Bu işlem duktusu süt görünümünde şilüs ile doldurur ve erken
tanımaya olanak sağlar. Benzer olarak torakotomiden 30 dk önce 60 mL krema
verilmesi tavsiye edilmiştir. Ancak sindirim yoluyla alınan yağın venöz kana geçiş
süresi yaklaşık 1 saat olduğundan ve 6 saat içinde zirveye çıktığından ötürü,
cerrahiden kısa süre önce az miktarda verildiğinde, her zaman başarılı olmayabilir.
Nazogastrik tüpten veya jejunostomi tüpünden cerrahiden 6 saat önce 60-90 mL/saat
hızında krema verilmesini ve torakotomiya başlamadan önce göğüs tüpünden sütlü
246
drenajın geldiği görülünceye dek beklenmesi önerilmiştir. Lokalizasyona yardımcı
olmak için Sudan siyahıyla boyanmış krema öğünü alınması önerilmiştir. Anestezi
indüksiyonundan önce midedeki herhangi bir rezidüel yağ veya krema aspire edilerek
boşaltılır. Alternatif bir yöntem %1’lik Evans mavisinin bacağa enjeksiyonudur. Bu
boya duktusu 5 dakika içerisinde boyar ve 12 dakika süresince duktus boyalı
görünür. Bu yöntemin dezavantajı diğer dokuların da boyanabilmesidir. İntraoperatif
olarak toraksın saline doldurulması da duktustan gelen sütlü silüz kaçağının
saptanmasına yardım edebilir.
Şilöz Kaçağın Kontrolü
Torakotomi sırasında yaralanmadan kaçınmak veya yaygın mediyasten diseksiyonu
yapıldığında ya da eğer toraksın içine sürekli sulu bir sıvının birikimi dolayısıyla şilöz
kaçaktan kuşku duyuluyorsa profilaktik olarak duktus ligasyonu yapmak önemlidir.
Daha önce cerrahi geçirmemiş hastalarda veya postoperatif tanı konanlarda doku
veya keçe plejit kullanımı fiksasyon ligatürlerine yardımcı olur. Kimi cerrahlar
şilotoraks onarımında en iyi yöntemin kaçak yerini bulmak ve onu nonabsorbabl
sütürler ve Teflon plejitlerle yaklaştırmak olduğuna inanırlar. Bu yöntemle duktusun
ana kısmının açık kalmasına izin verilmiş olur. Eğer kaçak bulunamaz ise yaygın
diseksiyon yapmaktan kaçınılmalıdır. Bütün dokunun aort ve azigos veni arasında
kütle tarzında ligasyonu diyafragmanın üzerinden yapılır. Duktus T12’den T8’e kadar
hastaların %60’ında tek bir yapıdır. Hastaların %40’ında mediyasten duktus
torasikusunun kaudal kısmında duplikasyon vardır. Kütle ligasyonunun major bir
kanalı ortadan kaldırmasından sakınmak önemlidir.
Duktus ligasyonu ya sağ (tercih edilir) ya da sol torakotomiyle yapılabilir. Sol taraftan
duktusa ulaşmak inen aortun değişik pozisyonu yüzünden teknik olarak zor olabilir.
Sağ tarafta kısa bir posterolateral torakotomi insizyonu kullanılır. Plevradaki fibrin
toplantıları çıkarılır ve inferiyor pulmoner ligament serbestleştirilir. Kalın plevradan
veya genişlemiş lenf nodlarından şilotoraksa neden olabilecek malign bir prosesi
ekarte etmek için biyopsi yapılır. Özefagus yatağından kaldırılır. Özefagusun altındaki
bütün doku ve azigos veniyle aorta arasındaki dokular nonabsorbabl sütür
materyaliyle ligatüre edilir (Resim 21.3). Sol tarafta özefagusun alt 10 cm’lik kısmı
sola doğru mobilize edilir. Aortanın sağındaki doku azigos veni tanınıncaya kadar
diseke edilir. Aort ve azigos veni arasındaki bütün dokunun kütle ligasyonu ondan
sonra yapılır. Duktus ve azigos, interkostal ve lumbar venler arasındaki küçük
lenfatikovenöz anastomozlar bu yerel kesilmeyi hemen kompanse ederler. Duktus
247
bulunamasa bile kütle ligasyonu hastaların %80’inde başarılıdır. Bebeklerde günler
sürebilen bacaklarda geçici bir ödem ve asit görülebilir. Preoperatif dönemde BT ile
aortanın diyafragmanın üzerindeki kısmında ektatik olup olmadığını saptamak
önemlidir. Vertebra cisminin sağında bulunan supradiyafragmatik bir aorta duktus
torasikusa sağ torakotomiyle ulaşımı zor hale getirir. Bu durumlarda sol taraflı
yaklaşım tercih edilir.
Üst orta hat abdominal insizyonuyla yapılan bir yaklaşım da tanımlanmıştır. Duktusun
kütle ligasyonu, sisterna şilinin aortanın sağ tarafında görülmesinden sonra hiyatusun
hemen altında yapılır. Kesilen duktusun bir vene veya diğer anastomozlara
reimplantasyonu komplike bir işlemdir ve gereksizdir. Kaçak yapan duktusu
yapıştırmak için fibrin glue ile başarılı yapıştırma olabilir.
Resim 21.3: Supradiyafragmatik
duktus torasikusun kütle
ligasyonunu yaparak şilotoraks
tedavisi.
Eğer akciğer tuzaklanmış ise dekortikasyon gerekli olabilir. Plöredez sağlamak için
plevrektomi tavsiye edilmiştir. Eğer belirgin bir şilöz kaçak bulunabilirse bu tedavi en
başarılı tedavidir. Plevrektomi ayrıca duktus ligasyonuna yardımcı olması için de
kullanılabilir. Fakat interkostal lenf damarlarına hasar verme riskinden ötürü
plevrektomiden kaçınılmaldır. Kimyasal plöredez cerrahi sırasında yapılabilir.
Plöroperitoneal şant akciğer re-ekspansiyonuna izin verir ve genellikle yüksek riskli
hastalarda daha konservatif bir tedavi olarak saklanır.
VATS ile duktus fistülünün onarımı, torakoskopik duktus ligasyonu ve ultrasonik
duktus koagülasyonu yapılabilir. Ayrıca VATS ile intraplevral fibrin yapıştırıcısı
248
verilebilir, kimyasal plöredez yapılabilir. İlk cerrahi yaklaşımın VATS ile olması
önerilmektedir.
Farklı cerrahi tedavi yöntemlerinin başarısı %60-%100 arasında değişmektedir.
Cerrahi sırasında duktus bulunamasa bile kütle ligasyonuyla başarı oranı %80
olmaktadır.
Şekil 21.1’de şilotoraksta tedavi yaklaşımını özetlemektedir. Eğer göğüs tüpü drenajı
1 haftadan daha uzun süredir 500 mL/günden daha fazlaysa cerrahi girişim
gereklidir. Eğer akciğer hapsolmuş ve maligniteden kuşkulanılıyorsa veya multipl
lokülasyonlar varsa erkenden cerrahi girişim uygundur. Buna karşılık anstabil
vertebra fraktürleri olan, anrezektabl tümörleri olan veya çoklu organ yaralanmaları
olan hastalarda cerrahiden sakınılması gerekir. Her ne kadar duktus fistülünün
onarımı torakoskopiyle başarılamazsa da duktusun küçük bir sağ torakotomi
vasıtasıyla ligasyonu için yapılan açık işlem standart halde kalmaya devam
etmektedir. Bu işlem uzun süre hiperalimentasyon yapılmış hastalarda daha kolay bir
işlemdir. Santral hatları önemli morbidite nedeni olan bebek ve çocuklarda bu
özellikle doğrudur.
249
Şekil 21. 1: Şilotoraks tedavisinde algoritma.
KAYNAKLAR
i
. Birt AB, Connolly NK: Traumatic chylothorax: A report of a case and a survey of the
literature. Br J Surg 1951; 39:564.
250
i
. Coe JE, Aikawa JK: Cholesterol of pleural effusion. Arch Intern Med 1961; 108:163174.
i
. Milsom JW, Kron IL, Rheuban KS, Rodgers BM. Chylothorax: An assessment of
current surgical management. Thorac CardiovascSurg: 1985; 89:221-227.
i
. Rheuban KS, Kron IL, Carpenter MA, et al: Pleuroperitoneal shunts for refractory
chylothorax after operation for congenital heart disease. Ann Thorac
Surg 1992; 53:85-87.
i
. Thomson IA, Simms MH: Postoperative chylothorax: A case for
recycling?. Cardiovasc Surg 1993; 1:384-385.
i
. Cope C, Kaiser LR: Management of unremitting chylothorax by percutaneous
embolization and blockage of retroperitoneal lymphatic vessels in 42 patients. J
Vasc Interv Radiol 2002; 13:1139-1148.
i
. Miller JI: Discussion of postoperative chylothorax. J Thorac Cardiovasc
Surg 1996; 112:1365-1366.
i
. Dugue L, Sauvanet A, Farges O, et al: Output of chyle as an indicator of treatment
for chylothorax complicating esophagectomy. Br J Surg 1998; 85:1147-1149.
i
. Lagarde SM, Omloo JM, de Jong K, et al: Incidence and management of chyle
leakage after esophagectomy. Ann Thorac Surg 2005; 80:449-454
251
22.
Doç.Dr.Ayten Kayı Cangır
Ankara Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
MALİGN PLEVRAL MEZOTELYOMANIN TANI VE TEDAVİSİ
Epidemiyoloji Ve Etyoloji
Malign plevral mezotelyoma (MPM), sık görülmeyen, günümüzde standart bir tedavisi
bulunmayan ve prognozu da iyi olmayan bir hastalıktır. İlk kez Klemperer ve Rabin
1937’de mezotelyomaları lokal ve diffüz olmak üzere sınıflandırmışlardır. Stout ve
Murray 1942’de bu tümörleri histolojik olarak tanımlamışlardır. Wagner ve arkadaşları
tarafından 1960 yılında Güney Afrika'da, asbest ile yoğun temasın olduğu yerlerdeki
kişilerde
oluştuğunu
belirtmişlerdir.
Bu
tarihten
sonra,
asbestle
temas
ile
mezotelyoma oluşması arasındaki ilişki, çok sayıdaki çalışma ile kanıtlanmıştır.
MPM;
gelişmiş batı ülkelerinde, asbest madenleri çevresinde yaşayan veya
meslekleri nedeni ile asbest ile uzun süre temas edenlerde görülmesine karşın,
Türkiye, Yunanistan, Bulgaristan, Afganistan gibi ülkelerde asbest ile karışmış
toprağın (beyaz toprak) badana, sıva, çatı toprağı şeklinde ev içlerinde de
kullanılmasına bağlı gelişen uzun süreli temas sonucu da oluşmaktadır.
Asbest, tek bir mineral değildir. Fibröz hidroksi silikat ailesine verilen genel isimdir.
Esas olarak iki grupta incelenir;
1 - Serpentin grubu (C h r y s o l i t e - beyaz asbest) .
2 - Amphibole grubu (C r o c o d o l i t e, mavi asbest, amosite) .
Beyaz asbest, endüstride kullanılan asbesttir. Diğer asbest türlerinin çıkarılması ve
kullanımı yasaklanmıştır. MPM ile en çok ilişkili asbest türü amphibole grubu yani
“crocodolite” asbesttir.
Ülkemizdeki sorun büyük oranda çevreseldir. Özellikle, Orta ve Güneydoğu Anadolu
bölgelerimizde önemli bir halk sağlığı sorunudur. Kapadokya bölgesinde 3 köyde,
Tuzköy, Karain ve Sarıhıdır’da asbest olmayan bir mineralin MPM epidemisine yol
açtığı saptanmıştır. Bu mineral fibröz " zeolite " (erionit) olarak isimlendirilmektedir.
Erionit en güçlü karsinojen olarak kabul edilmektedir. Bu köylerde, evlerin yapıldığı
tüf kayaları ile evlerin dayandığı ve kiler olarak kullanılan mağaraların duvarlarında
bulunmuştur.
252
İnsidans
İngiltere'de, her yıl 1.000 civarında yeni olgu bildirilmektedir. İnsidans 22 olgu/ 1
milyon nüfus / yıl'dır. Asbest ile temas olmayan popülasyonda, her 1 milyon kişide 1
olması beklenen insidans, aşırı temas olanlarda, yaşam boyu
% 10'lara kadar
çıkmaktadır.
Ülkemizde, insidans hakkında kesin bilgi vermek olası değildir. Ancak, sorunun
boyutları oldukça büyüktür. Erionit saptanan köylerde, insidans veya mortalite, yılda
% 1’den fazla olarak hesaplanmaktadır. Bu durum, batı ülkelerindeki asbest teması
olmayan nüfustan 10.000 kat fazladır. Bir lif / ml hava / yıl miktarındaki temas
sonucunda, plevral mezotelyoma oluşması 996 / 100.000 kişi / yıl olarak tahmin
edilmektedir.
Etyoloji
1 - Asbest.
2 - Erionit.
3 - Radyasyon.
4 - Plevral skarlar.
5 - Spontan tümör gelişimi.
6 - Muhtemel Simian virusu 40 (SV 40) enfeksiyonu etyolojide rol oynar.
Etyolojide bir ko-faktör olarak kabul edilen SV 40 DNA dizileri, batı ülkelerinde
mezotelyomalı dokuların % 60'ında gösterilmesine karşın, ülkemizde bu virus
ekspresyonu gösterilememiştir. Neden olarak, bu virus ile kontamine polio aşılarının
Türkiye' de kullanılmaması gösterilmiştir.
Asbestle ilk temas ile kişinin ölümü arasında geçen süre yaklaşık 41 yıldır (15–67 yıl).
Bu sürenin 15 yılın altında olması nadirdir.
Klinik Bulgular
Malign plevral mezotelyomada, klinik belirtiler non-spesifiktir (Tablo 22.I). Masif bir
tümör göğüs ağrısına neden olabilir. Esasen, klinik belirtiler, tümörün lokal ilerlemesi
ile bağlantılıdır.
Hastalığın erken dönemlerinde, plevral effüzyonun da varlığı
halinde, dispne ilk belirgin semptomdur. Effüzyon drene edilir ise, hasta
253
asemptomatik hale gelir. Tümörün göğüs duvarına doğru büyümesi ve interkostal
sinirleri tutması ile göğüs ağrısı saptanır. Tümör bazen perikardiuma invaze olarak
perikardial effüzyona yol açabilir, myokarda metastaz yapabilir. MPM’da görülen
belirtiler göğüs ağrısı, nefes darlığı (plevral sıvı ve plevral kalınlaşmaya bağlı), ağrı ve
dolgunluk hissi (omuzlarda, kollarda, göğüs duvarında ve karın üst kadranlarında),
göğüs duvarında kitle, kilo kaybı, karın ağrısı, karında assit, çomak parmak ve aşırı
terlemedir (Tablo 22.2).
Tablo 22.1: Malign plevral mezotelyoma da(MPM) semptomlar
Dispne
Plöritik göğüs ağrısı
Konstitusyonel
Kilo kaybı
Ateş
Gece terlemesi
Karın ağrısı
Omuz ağrısı
Kuru öksürük
Nadir
Wheezing
Göğüs duvarında kitle
Metastatik tümöre bağlı yutma güçlüğü
Tablo 22.2:Malign plevral mezotelyomada erken dönem fizik muayene bulguları
Plevral effüzyon bulguları
Tutulan hemitoraksta volüm kaybı
Frozen chest (donmuş göğüs)
Abdominal kitle
Girişim yerlerinde tümör implantasyonu
Nadir bulgular
Horner Sendromu
V.Kava.Superior Sendromu
Çomak parmak
Hemitoraksın hipertrofisi
Spontan hemotoraks bulguları
Radyolojik Bulgular
Malign plevral mezotelyoma da (MPM) radyolojik bulgular, direkt akciğer grafileri (PA
toraks ve lateral grafiler), bilgisayarlı tomografi (BT), ultrasonografi, PET-BT ve MRI
ile değerlendirilmektedir.
PA toraks grafisinde MPM bulguları çok değişiktir ve tanı konulduğu sırada tümörün
bulunduğu evre ile bağlantılıdır (Resim 22.1). Erken evrede plevral effüzyon
254
hastalığın en sık görülen bulgusudur. Hidropnömotoraks, ilgili hemitoraksda volüm
kaybı, plevral kalınlaşma, nodüler veya lobüler plevral kitle, kalsifik plevral
diafragmatik plaklar veya fibröz plaklar, kot destrüksiyonu, yumuşak doku invazyonu,
parankimal fibrozis (asbestosis veya zeolitozis), kardiomegali, perikardial effüzyon,
lenfanjitik yayılım ile uyumlu görünüm, interlober fissür kalınlaşması veya nodüler
görünüm, mediastinal genişleme veya düzensiz mediastinal kontür gibi bulgular
izlenebilir.
Resim 22.1: MPM’lı 2 hastanın preoperatif PA akciğer grafileri
Malign plevral mezotelyomada bilgisayarlı tomografi bulguları; Plevral kalınlaşma,
irregüler plevral yüzey, mediastinal plevral kalınlaşma, interlober plevral kalınlaşma
veya kitle, ilgili hemitoraksda hacim kaybı, plevral effüzyon (massif / loküle), kalsifiye
plevral plak, çepeçevre plevral kalınlaşma, plevral nodüller, karşı hemitoraksda
plevral plak, kosta destrüksiyonu, karşı hemitoraksda fissür kalınlaşması, yuvarlak
(round) atelektazi, hemitorakal hipertrofi, vertebral korpus destrüksiyonu ve/veya
pnömotoraks şeklinde olabilir (Resim 22.2).
255
Resim 22.2: MPM’lı 2 olgunun Toraks BT mediasten ve parankim pencere görüntüleri.
Üstteki görüntülerde sağda kitleler tarzında plevrada difüz ve nodüler kalınlaşma ile effüzyon,
kontrlateral hafif plevral kalınlaşma ile birlikte ılımlı plevral effüzyon (metastaz) saptanırken
Alt BT kesitlerinde plevral effüzyonla birlikte diffüz plevral kalınlaşma ve parankimde
kompresif atelektazi dikkati çekmektedir.
MPM'lı olgularda ultrasonografinin diafragma, perikart invazyonu ve intra - abdominal
yayılımın değerlendirilmesinde, deneyimli ellerde BT'ye üstünlüğü vardır. Olası uzak
metastazların, kontrlateral ve transdiafragmatik yayılımın değerlendirilmesi ile doğru
256
mediastinal evreleme amacıyla PET-BT son yıllarda rutin olarak kullanılmaktadır
(Resim 23.3).
Resim 22.3: PET-BT kesitlerinde özellikle mediastinal plevrada patolojik artmış 18-FDG
tutulumu görülmektedir.
Patoloji
Mezotelyomalar, multipotent mezotelyal ve/veya subserozal hücrelerden kaynaklanır.
Mezotelyomalar Dünya Sağlık Örgütü sınıflamasına göre 3 temel histolojik tipte
incelenirler:
1- Epiteloid (Epitelyal ) tip,
2- Sarkomatoid
(monofazik fibroblastik, sarkomatöz, mezanşimal) tip
3- Mikst epitelial - sarkomatoid (bifazik) tip
Epitelyal ve sarkomatoid tip mezotelyomanın ayrıca bazı histolojik alt tipleri de
mevcuttur. Geniş serilerde, olguların çoğunluğunun epiteloid ve daha azının da mikst
tip ve sarkomatoid tip olduğu saptanmıştır.
Olguların yaklaşık % 90'ı plevral effüzyon ile başvurdukları için, torasentez ile alınan
sıvının sitopatolojik incelemesi, genellikle ilk tanı yöntemi olmaktadır. Bu işlemin
mümkün olduğunca tanısal olabilmesi için gönderilen materyalin yeterli miktarda
olması ve patoloji bölümüne uygun koşullarda gönderilmesi önemlidir. Tanının
257
torakotomi
ile
örnek
alınarak
konduğu
durumlarda
asbest
cisimlerinin
değerlendirilebilmesi için akciğer parankimine ait biyopsi örneğinin de alınması yararlı
olabilir.
Histolojik incelemede epiteloid tip malign mezotelyomaların,
özellikle akciğerin
adenokanserleri ile ayırıcı tanıları oldukça güçtür. Adenokarsinom ile epiteloid
mezotelioma ayrımı için, mezoteliomada
pozitif boyanması beklenen 2 immun
belirleyici ve 2 adet de negatif (ancak adenokarsinom için pozitif olan) belirleyici
olmak üzere en az 4 belirleyiciden oluşan bir panel uygulanmalıdır. Adenokarsinom
için pozitif belirteçler CEA, B72.3, Ber-EP4, MOC31, CD15, TTF–1’ dir. Mezotelioma
için ise Kalretinin, Mezotelin, Sitokeratin 5/6, WT–1, Trombomodulin ve D2–40
kullanılabilir. Mezotelyomanın farklı tiplerinin diğer tümörlerden ayırımı için farklı
immünhistokimyasal paneller kullanılabilir.
Diğer bir sorun ise biyopsilerde ne zaman epiteloid malign mezotelyoma tanısının
patolojik olarak kesin şekilde konulabileceğidir. Bu konuda öneri, tümör olması
olasılığı
kuvvetli
atipik
mezotelyal
hücre
üreyişinin
bir
anatomik
bölgeye
invazyonunun saptanması (örneğin akciğer parankimine invazyon, parietal plevrada
yağlı doku ya da çizgili kas dokusuna invazyon gibi) halinde tanının kesin
mezotelyoma olarak verilmesi şeklindedir. Ayrıca immunhistokimyasal olarak bu
hücrelerde p53 pozitifliğinin saptanması aynı hücrelerde desmin negatifleşmesi de
mezoteliyoma tanısında destekleyici olabilir.
Tanı
Plevral effüzyonlu olgularda ilk tanı yöntemi torasentez olmalıdır. Alınan intraplevral
sıvının
sitolojik
incelemesinde,
olguların
%
30-%50'sinde
malignite
saptanabilmektedir.
Perkütan plevral biopsi ile olguların 1/3'ünde pozitif sonuç elde edilebilmektedir.
Plevra biyopsisi körleme tarzında veya BT eşliğinde yapılabilir. Bu yöntemlerle sonuç
alınamaz ise açık biyopsi yöntemlerine (VATS, torakotomi) başvurulur. VATS
özellikle erken evre MPM’nın tanısında altın standarttır.
Eksploratris torakotomi ise kesin tanı konulamayan olgularda başvurulan yöntemdir.
Plevral malign mezotelyoma da bronkoskopi, endobronşial tümörü olan akciğer
kanserli olgulardan ayrılması için başvurulan bir yöntemdir.
258
Orta yaşlı, bilinen asbest veya erionit bölgesinden gelen,
göğüs ağrısı, dispne ve plevral effüzyonu veya plevral
kalınlaşması olan hastada muhtemel bir malign plevral
mezotelyomada (MPM) için tanısal yaklaşım aşağıdaki
algoritmaya göre yürütülür.
Düz ve Yan Akciğer Grafisi
Plevral Sıvı, Yan Ağrısı ve Predispozan faktör (+)
Kapalı plevra biopsisi + sıvı drenajı
Patolojik inceleme
Tanı (+)
Tanı (-)
İmmunohistokimya ile tip tayini
VATS ile biopsi+drenaj
Tanı (+)
İmmunohistokimya ile tip tayini
Malign Plevral Mezotelyomada Evreleme
Uluslararası Mezotelyoma Grubu (IMIG) tarafından 1995’de TNM esasına göre bir
evreleme sistemi önerilmiştir. TNM evreleme sisteminde temel amaç, cerrahi için
uygun hasta seçimi ve hastanın prognozunun öngörülmesidir (Tablo 22.3 ve Tablo
22.4).
259
Tablo 22.3: MPM de evreleme
EVRE I
I-a
I-b
T1a
T1b
N0
N0
M0
M0
EVRE II
EVRE III
T2
Herhangibir T3
EVRE IV
Herhangibir T4
N0
Herhangibir N 1
Herhangibir N 2
Herhangibir N 3
M0
M0
M0
M1
Tablo 22.4: MPM'da sağ kalım üzerine olumlu etkisi olan prognostik faktörler
T
Değerleri
T1-a;
Tümör, ipsilateral ve diafragmatik plevra da dahil olmak üzere, parietal plevra
ile sınırlıdır. Visseral plevra tutulumu yoktur.
T1-b;
Tümör, ipsilateral mediastinal ve diafragmatik plevrada dahil olmak üzere
parietal plevrayı tutmuş, visseral plevrada da seyrek olarak tutulumu vardır.
T2
;
Tümör, ipsilateral plevra yüzeylerinden birini tutmuştur
(Parietal, mediastinal, diafragmatik ve visseral). Ayrıca aşağıdaki özelliklerden en az biri ile
beraberdir.
* Diafragma kaslarında tutulum vardır.
* Tümör, visseral plevradan akciğere doğru uzanmıştır.
* Bir araya gelmiş, bütünleşmiş tümörler söz konusudur (Fissürler dahil).
T 3 ; Lokal ileri ancak potansiyel rezektabl tümördür. Tümör, ipsilateral plevral yüzeyleri
tutar. (Parietal, mediastinal, diafragmatik ve visseral). Aşağıdaki özelliklerden en az birisi ile
beraberdir.
* Endotorasik fasia tutulumu vardır.
* Mediastinal yağ dokusuna yayılım vardır.
* Göğüs duvarı yumuşak dokularına yayım vardır, ancak soliter tümör rezektabldır.
* Perikartda transmural olmayan tutulum vardır.
T4
;
Lokal ileri ve teknik olarak rezektabl olmayan tümördür. Tümör, ipsilateral
plevral yüzeyleri tutmuştur (parietal, mediastinal, diafragmatik ve visseral). Aşağıdaki
özelliklerden en az birisi ile beraberdir.
* Göğüs duvarına diffüz yayılım veya multifokal tümör odakları vardır (Kosta
destrüksiyonu vardır veya yoktur).
* Peritona direkt transdiafragmatik yayılım, bir veya birden fazla mediastinal
organa direkt yayılım vardır.
* Vertebral kolon'a direkt yayılım vardır.
260
*
Perikardial sıvı ile birlikte ya da sıvı olmaksızın perikardın iç yüzeyinde yayılım
1
Tümörün histolojisinin epitelial tip olması ,
2
Yaşın 50’nin altında olması,
3
Cinsiyetinin kadın olması,
4
Nefes darlığı, kilo kaybı olmaması,
5
Trombosit sayısının < 400.000 olması,
6
Asbest ve erionit teması öyküsünün olmaması,
7
Hastanın yüksek performans skoruna sahip olması,
8
Erken evrede tanı konulması ve tümörün cerrahi olarak tam rezeksiyonu
veya myokard tutulumu vardır.
N Değerleri
X ; Bölgesel lenf bezleri değerlendirilememektedir.
0 ; Bölgesel lenf bezi tutulumu yoktur.
1 ; İpsilateral bronkopulmoner veya hiler lenf bezi metastazı vardır.
2 ; Subkarinal veya ipsilateral mediastinal veya internal mammarian lenf bezi
metastazı vardır.
N 3; Kontrlateral mediastinal, internal mammarian, ipsilateral veya kontrlateral
supraklavikuler lenf bezlerine metastaz vardır.
N
N
N
N
M Değerleri
M X ; Uzak metastaz değerlendirilememektedir.
M 0 ; Uzak metastaz yoktur.
M 1 ; Uzak metastaz vardır.
Malign Plevral Mezotelyomada Tedavi Yöntemleri
Malign Plevral Mezotelyomada cerrahi tedavi, kemoterapi, radyoterapi, geliştirilmekte
olan yeni ve deneysel tedavi yöntemleri ve palyatif tedavi yöntemleri bulunmaktadır.
Bunlardan cerrahi, kemoterapi ve radyoterapi yöntemleri ayrı ayrı veya birlikte
kullanılabilmektedir. Cerrahi tedavinin amacı, olabildiği kadar tümörlü dokuyu rezeke
etmek, hastanın semptomlarını gidermek veya azaltmaktır.
MPM’lı olgularda, tedavinin planlanmasında öncelikle aşağıdaki soruların yanıtının
aranması uygundur.
- Hasta operabl mı?
- İntraplevral sıvı, plevral kalınlaşma gibi bulgular var mı?
-Torasentez yapılmalı mı? Pevra biyopsisi yapmak gerekli mi?
- Plevral biyopsi yapılmışsa, biyopsi yapılan lokalizasyon/lokalizasayonlara
261
radyoterapi yapılmalı mı?
- Hasta, pre-operatif hangi evrede? Mediastinoskopi yapılması gerekli mi?
- Yapılması planlanan operasyon radikal nitelikli mi? Palyasyon amaçlı mı?
- Hastaya neo-adjuan ve/veya adjuan kemoterapi uygulanmalı mı?
- Semptomların palyasyonu için ne yapılabilir?
Günümüzde, MPM’nın tedavisi, akciğer kanserinde olduğu gibi multidisiplinerdir.
MPM'lı olguların ancak %1-5’inde, radikal cerrahi tedavi olasıdır. Cerrahi tedaviden
önce pre-operatif değerlendirme yapılmalıdır. MPM olgu, klinik ve radyolojik olarak
(PA toraks, yan grafi,
değerlendirilmelidir.
BT/MRI ve gerekirse PET/PET-BT ile)
Patolojik
boyutta
mediastinal
lenf
bezi
olup
preoperatif
olmadığı
değerlendirilerek, mediastinoskopi yapma kararı bazı verilebilir. Klinik ve radyolojik
olarak tümör evrelendirilir. Tetkikler sonucunda operasyon planlanan bir MPM
olgusunda hastalık bir hemitoraksla sınırlı olmalı ve uzak organ metastazı
saptanmamalıdır.
Bazı kuşkulu olgularda,
periton metastazı olup olmadığının
anlaşılması için laparoskopi ile karın eksplorasyonunu savunan cerrahlar da vardır.
Yukarıda da belirtildiği şekilde, evreleme operabilitenin değerlendirilmesi ve
prognozun belirlenebilmesi için yapılır.
MPM’de Cerrahi Tedavi
Günümüzde, cerrahi tedavinin rolünü kesin olarak gösteren kontrollü randomize bir
çalışma yoktur. Cerrahi tedavi için MPM'da epitelial tip tanısı gereklidir. Cerrahi
girişimi yapacak merkezin veya cerrahi ekibin deneyim sahibi olması gereklidir.
Cerrahinin, tedavinin sadece bir kısmı olduğu, multimodal tedavi deneyimlerinin de
sınırlı olduğu bilinmelidir.
Cerrahi tedavi yöntemleri olarak;
1. Plörektomi / Dekortikasyon; Erken evrede tümörün tamamı çıkarılabilir
2. Ekstraplevral pnömonektomi ( E P P) ; Visseral plevrada tümör yaygınsa veya
plevral kavite oblitere ise yapılabilir
Bu ameliyatlar Evre I ve Evre II olgularda uygulanır. Mediastinal lenf bezlerinin
varlığı, mediastinal yayılım, diafragmanın invazyonu, sarkomatoid veya mikst
histoloji, prognozu olumsuz etkilemektedir. Plörektomi’nin mortalitesi % 5'den azdır.
Median sağkalım 9 – 21 ay arasında değişmektedir. EPP'de ise, ameliyat mortalitesi
262
% 5 – 7,5 arasında, 2 yıllık sağ kalım süresi ise, % 20 – 58 arasında değişmektedir.
Tüm hastalarda sağkalım oranları 2 yıllık %36, 5 yıllık %14 dür. Epitelyal tip
tümörlerde 2 yıllık sağkalım %52, 5 yıllık %21’dir. Sarkomatöz veya mikst tiplerde 2
yıllık sağkalım %16, 5 yıllık %0’dır.
Ekstraplevral nodal tutulum olumsuz prognostik faktördür. Nodal tutulum olmayan
hastalarda 2 yıllık sağkalım %42, 5 yıllık %17 dir. Buna karşın ekstranodal tutulum
olan hastalarda 2 yıllık sağkalım %23, 5 yıllık %0’dır. Cerrahi sınırın tümör negatif
olduğu hastalarda 2 yıllık sağkalım %44, 5 yıllık %25’dir. Buna karşın cerrahi sınır
pozitif hastalarda 2 yıllık sağkalım %33, 5 yıllık ise %9 dur. Cerrahi sınır negatif,
ekstranodal tutulum olmayan, epitelyal tip 31 hastada yapılan bir çalışmada, ortalama
sağkalım 51 ay, 2 yıllık sürvi %68, 5 yıllık %46 dır.
MPM’de Kemoterapi
Sistemik kemoterapi
Malign mezotelyoma plevra ve peritonun istisnasız ölümle sonuçlanan kanseridir.
Tüm dünyada insidans, asbest maruziyeti ile paralel olarak artmaktadır. Hemen tüm
kanser tedavi seçeneklerine dirençli bir hastalık olarak kabul edilmektedirler. Ne
cerrahi ne de radyoterpi tek başına sağkalımı uzatabilmiştir. Sistemik tedavilerin de
etkinliği sınırlıdır.
Tek ajan kemoterapiler etkinliğine göre; düşük (<%10),
Orta (%10–15), yüksek
(%20) etkinlikli olmak üzere sınıflandırılmaktadır. Tek ajanın etkinliği genelde orta
düzeyde, yanıt oranları ve medyan sağkalım düşüktür. Literatürde monoterapide en
etkili ilacın sisplatin olduğu belirtilmektedir. Kombinasyon ile yanıt oranları ve
sağkalım daha iyi, ancak intrinsik ilaç resistansı nedeniyle yanıt oranları %50’nin
altındadır. Son 3 dekadda yayınlanan 59 klinik çalışmanın analizinde; kombinasyon
ve monoterapi karşılaştırılmasında yanıt oranları kombinasyon kolunda daha yüksek
(%26 vs %8; p <0.001), medyan sağkalım kombinasyonda kısmen daha iyi (10 aya
karşılık 8.1 ay, istatistiksel anlamlı değil) bulunmuştur. Aynı analizi sisplatinli ve
sisplatinsiz rejimlerin karşılaştırılmasında ise sisplatin içeren kombinasyonlarda yanıt
oranlarının üstün, sağkalıma katkının ise orta düzeyde olduğu, ancak bu bulguların
istatistiksel olarak anlamlı olmadığı görülmüştür.
263
MPM’de 2003 yılından önce önerilen tedaviler faz II çalışmalara dayanıyordu.
Bunların önemli bir kısmının da kanıt düzeyi oldukça zayıftı. Medyan sağkalım 6–9 ay
arasında değişmekteydi. Bu çalışmalar içinde gemsitabin-sisplatin kombinasyonu en
iyi kombinasyon olduğu konusunda görüş birliğine varılmıştır.
MPM’de 2003 yılından sonra 3 major randomize faz III çalışma yapılmıştır. Bu
çalışmalar ile şu an elimizde rezeke edilemeyen malign mezotelyomalı olgularla ilgili
bazı güçlü kanıtlar oluşmaya başlamıştır. İlk ve en büyük çalışma Vogelzang ve
arkadaşlarının çalışmasıdır. Uluslararası yapılan bu Faz III çalışmada; 75 mg/m 2
Sisplatin–500
mg/m2
pemetrexed
kombinasyonu
ile
75
mg/m2
Sisplatin
karşılaştırılmıştır. Radyolojik cevap, semptom kontrolu ve daha önemlisi sağkalım
bakımından kombinasyon kolu daha üstün bulunmuştur Bu sonuçlarla SisplatinPemetrexed kombinasyonunun kayda geçmiş ilk standart tedavi olduğu kabul
edilmektedir.
İkinci büyük Faz III çalışma ise 250 hastanın çalışmaya alındığı EORTC / Kanada
NCI çalışmasıdır. Permetrexed gibi bir antifolat olan Raltitrexed’in sisplatinle kombine
edilmesiyle yapılan prospektif çalışmada, 80 mg/m2 sisplatin ile 80 mg/m2sisplatin –
3mg/m2 raltitrexed ile karşılaştırılmıştır. Bu çalışmada da yanıt oranı, genel sağkalım
ve 1 yıllık sağkalım kombinasyon kolunda daha üstün bulunmuştur.
Muers ve arkadaşlarının çalışmasında ise (A) Aktif Semptom kontrolu (ASC), (B)
Mitomisin- Vinblastin- Sisplatin- ASC ve (C) Vinorelbin-ASC kolları karşılaştırılmıştır.
Medyan sağkalım açısından her 3 kol arasında farklılık saptanmamıştır. Bu
çalışmanın sonucu olarak, diğer Faz II çalışmalarla beraber değerlendirildiğinde
vinorelbinin de gelecekte malign mezotelyomada bir tedavi seçeneği olarak
düşünülebileceği vurgulanmıştır.
Neo-adjuvan KT ve ekstra-pleural pnömonektomi kombinasyonunun etkinliği birçok
küçük çalışmada etkinliği araştırılmaktadır. Bu çalışmaların sonuçları veya meta
analizler henüz yayınlanmamıştır.
Hipertermik Perfüzyon Kemoterapisi (HİPEK)
HİPEK aslında uzun yıllardır değişik kanser türlerinde uygulanmaktadır. Özellikle
karaciğer ve peritonun hipertermik perfüzyonu çeşitli kanserlerde uygulanmıştır.
Kolon ve over kanserine bağlı peritonitis karsinomatozada cerrahi endikasyon
sınırlarını genişletmiş ve tümörün çıkarılmasını yaygınlaştırmıştır. Tanı konduğunda
264
veya takip sırasında saptanan periton tutulumu artık ameliyat için bir engel
oluşturmamaktadır. Sugarbaker, Richards, Shigomura, De Bree ve Giovanni gibi
araştırmacılar, plevral kanserlerde de (primer veya metastatik) hipertermik tedaviyi
uygulamışlar ve sonuçlarını açıklamışlardır. Uygulamanın tek ve net bir endikasyonu
yoktur. Genellikle sisplatin veya türevleri kullanılsa da başka kemoterapik ilaçlar da
tek başına veya ek olarak tedavi protokollerine girmişlerdir. Değişik çalışmalarda
sisplatinin dozu 50 mg/m2’den 400 mg/m2'ye kadar geniş bir spekturumda
uygulanmıştır. Toksik doz ve farmakokinetik araştırmalarındaki uygulamalar 250
mg/m2'yi geçmemektedir. Tıbbi yazına bakıldığında HİPEK'in uygulamasında değişik
protokoller görülmektedir. Bu da bize uygulamanın henüz emekleme aşamasında
olduğunu ve kesin bir şemaya sahip olmadığını gösterir. Zaten mezotelyomanın veya
plevral kanserlerin tedavisinde de üzerinde uzlaşma sağlamış standart bir tedavi
yöntemi yoktur. Zira kimi çalışmalarda plöropnömonektominin sağkalımı uzattığı
bildirilmişse de, azımsanmayacak sayıda çalışmada da akciğeri koruyucu cerrahinin
önemine vurgu yapılmaktadır. Bağışıklık tedavisi, gen tedavisi ve fotodinamik tedavi
gibi seçenekler ne yazık ki günlük klinik uygulamadan henüz çok uzaklardır. Oysa
HİPEK, 20 yılı aşkın süredir plevrada olmasa bile diğer bölge veya organ
kanserlerinde uygulanmaktadır. Sonuçlarının da umut verici olduğu söylenebilir.
HİPEK tedavisinin kimlere, ne zaman ve nasıl uygulanacağı sorusunun cevabı
yapılacak çalışmaların sonuçlarına göre netleşecektir. Özellikle mezotelyomada,
tedavi stratejisinin belirlenmesinde anahtar soru, akciğeri koruyup korumayacağımız
olmalıdır. Yapılan çalışmalarda da, plöropnömonektominin sağkalıma önemli bir
katkısının olmadığı bildirilmiştir. Bununla birlikte, akciğer koruyucu cerrahinin çok
daha uzun sağ kalım sağladığı saptanmıştır. Aslında bu beklenen bir sonuç değildi.
Ancak yapılan çalışmaların verileri ışığında, mezotelyomalı hastalarda primer akciğer
kanserli hastalarda olduğu gibi pnömonektominin sanıldığından daha büyük bir
travma olduğu kanısı oluşmuştur. HİPEK, plöropnömonektomi sonrasında kalmış
olması muhtemel mikroskopik veya makroskopik tümör odakları için uygulanabilir.
Akciğeri korumak ve cerrahinin de etkinliğini arttırmak amacıyla dekortikasyon,
diyafragma rezeksiyonu ve gerekirse perikard rezeksiyonunu takiben uygulanabilir
veya dekortikasyonu mümkün kılmak için preoperatif dönemde VATS ile uygulanıp
sonrasında major cerrahi işlem gerçekleştirilebilir.
265
MPM’de Radyoterapi
MPM’da tek başına veya kombine modalite tedaviler içinde radyoterapi (RT) ile
RT’nin yer almadığı tedavi modalitelerini karşılaştıran randomize çalışmalar olmadığı
için yeterince tanımlanamamıştır. Radyoterapinin MPM’da kullanım alanları şu
şekildedir:
-Küratif
Definitif
Adjuvan
Profilaktik
-Palyatif
Definitif RT: MPM radyasyona dirençli bir tümör olup 70 Gy dozda bile progresyon
gösterebilmektedir. Ayrıca genellikle hemitoraksı diffüz olarak tuttuğu için birçok kritik
normal dokunun da (karşı akciğer, kalp, medulla spinalis, özofagus, karaciğer, dalak,
böbrekler) ışınlama volümüne girmesi söz konusu olmakta ve bu durum yüksek
dozlara ulaşmayı güçleştirmektedir. Tek başına verilen definitif RT’nin sağkalımı
uzatmadığı gösterilmiştir.
Adjuvan RT:
RT’nin Plörektomi/dekortikasyon ardından adjuvan kullanımının da
etkin olmadığı görülmüştür. İleri evre hastalıkta ardında makroskobik hastalık
bırakmayan cerrahi türü olan EPP sonrası kullanıldığında adjuvan RT’nin yararı
ortaya çıkmaktadır. Rusch ve arkadaşlarının faz II çalışmasında EPP sonrası 54 Gy
hemitorasik RT uygulanan hastalarda tedavi iyi tolere edilmiş ve medyan sağkalım
Evre I ve II’de 33.8 ay, Evre III ve IV’de ise 10 ay olarak gerçekleşmiştir. EPP sonrası
adjuvan RT’nin IMRT (YART)(Yoğunluk Ayarlı RT) ile verilmesi ile % 93 yerel kontrol
ve % 55 3-yıllık hastalıksız sağkalım elde edilmiştir. EPP sonrası adjuvan YART’ın
adjuvan 3-boyutlu konformal RT’ye göre hedef volümü daha iyi kapsayabildiği ancak
karşı akciğere dozu arttırdığı (20 Gy’de % 20.5 artış) gösterilmiştir. Bu nedenle
YART’da özellikle karşı akciğerin almasına izin verilen doz ileri düzeyde
sınırlandırılmalıdır.
Profilaktik RT: Torasik girişimlerden sonra ekilme metastazlarını engellemek
amacıyla insizyon skarları ve tüp torakostomi portlarına yönelik olarak girişimden
sonraki 15 gün içinde profilaktik RT verilmesi önerilmektedir. Bu uygulamanın
dayanağı; MPM ile ilgili rehberlerde önerilmesi, yeterli teknik ve doz kullanılarak
266
yapılan ve olumlu sonuç veren bir randomize çalışmanın varlığı ve ülkemizde
hastaların izlem güçlüğüdür.
Palyatif RT: RT’nin dispne, disfaji, VCSS ve en çok da ağrıyı gidermeye yönelik etkin
bir palyasyon aracı olduğu bilinmektedir. Bu nedenle gerek primer tümör gerekse
metastazlara ilişkin semptomların palyasyonunda RT önerilir.
Sonuç olarak; EPP sonrası adjuvan RT yanı sıra KT’nin de neoadjuvan veya adjuvan
olarak eklenmesiyle uygulanan trimodalite tedavi ile MPM tedavisinde başarı
arttırılmaya çalışılmaktadır. Trimodalite tedavi ile median sağkalım 19 ile 25,5 ay
arasında değişmektedir.
MPM’de Yeni ve Deneysel Tedavi Yöntemleri
1 - İmmünoterapi ve / veya kemoterapi kombinasyonu
2 - Fotodinamik tedavi
3 - Gen tedavileri
4 - Büyüme faktörü veya reseptörlere karşı selektif antagonistik tedavi
5 - Plörektomi + intraplevral kemoterapi + post - operatif sistemik kemoterapi
+ preventif radyoterapi uygulamaları
6 –HİPEK
MPM’de Palyatif Tedavi Yöntemleri
1 -
Sık yapılan torasentezlerle veya
ince plevral kateter kullanarak intraplevral
sıvının boşaltılması,
2 - Tüp torakostomi ve plöredezis.
3- VATS ile plöredezis
4 - Denver şantı uygulanması
5 - Göğüs duvarı, Vena Kava Superior ve beyin metastazlarında radyoterapi.
6 - Ağrı tedavisinin uygulanması.
Kırsal alanlardaki barınma koşullarının düzeltilmesi ve beyaz toprağın kullanımının
önlenmesi, bu hastalıktan korunmada yapılabilecek en önemli girişimlerden birisidir.
267
KAYNAKLAR
1 - Akay H , Plevra hastalıklarında VATS’ın kullanımı . Endoskopi Cerrahi Kursları II.
17-19 Kasım 2000: 30-37.
2 -
Akay H , İnraplevral sıvılar. Klinik Bilimlere Giriş. Solunum Sistemi ve Gastro-
İntestinal Sistem Hastalıkları. AÜ Tıp Fak. Bilimsel Yayınları Serisi. No.1 Antıp AŞ
Ankara, 1996: 221-234 .
3 -
Akay H, Güngör A, Demirel T, İçöz V, Bacacı K. Dev Benign Lokalize Fibröz
Mezotelioma . A.Ü.Tıp Fak. Mec 1991 ; 44: 627 .
4 - Emri S, Malign plevral mezotelyoma. Akkoçlu A, Öztürk C, eds.Akciğer kanseri.
Multidisipliner yaklaşım.
Toraks kitapları . Sayı.1 Bilimsel Tıp Yayınevi .
Ankara,1999 : 207 - 218 .
5 -
Emri S, Akbulut H, Zorlu F, Dinçol D, Akay H, Günger Y, İçli R. Prognostic
significance of flow cytometric DNA analysis in patients with malignant pleural
mesothelioma. Lung Cancer 2001;33 (2-3): 109-114 .
6 - Emri S, Karakoca Y, Barış Y.İ, Zorlu R, Akyol K, Akay H. Preventive Irradiation
After Invasive Diagnostic and Therapeutic Procedures in Malignant Pleural
Mesothelioma. Chest 1996;109:1665.
7
- Emri S, Kocagöz T, Olut A, Güngen Y, Mutti L, Barış YI, Simian virus 40 is
no a co-factor in the pathogenesis of environmentally induced malignant pleural
mesothelioma in Turkey. Anticancer Research, 2000 ; 20 : 891 - 894.
8
– Özdemir O, Emri S, Karakoca Y, Sayınalp N, Akay H, Dündar S, Barış İ.
Fibrinolytic System in Plasma and Pleural Fluid in Malignant Pleural Mesothelioma.
Thoracic Research 84, 1996;2:121-128.
9 -
Rusch V W, Diffuse
Thoracic
Malignant Mesothelioma Shields T W , In
Surgery , fifth edt, vol.1, Lıppıncott Wıllıams & Wılkıns,
General
Philadelphia ,
2000 : Chapter 65 p:767 - 782 .
10 - Shields TW, Yeldani AV, Localized Fibrous Tumors of the Pleura . Shields T W
In General Thoracic Surgery , fifth edt, vol.1, Lıppıncott Wıllıams & Wılkıns,
Philadelphia , 2000 : Chapter 64 p :757 -766 .
11- Ung YC, Yu E, Falkson C et al. The role of radiation therapy in malignant pleural
mesothelioma:Asystematic review. Radiother Oncol 2006;80:13–18.
268
12-
Ball DL, Cruickshank DG. The treatment of malignant mesothelioma of the
pleura: review of a 5-year experience, with special reference to radiotherapy. Am J
Clin Oncol. 1990 Feb;13(1):4-9.
13-
Gupta V, Mychalczak B, Krug L et al. Hemithoracic radiation therapy after
pleurectomy/decortication for malignant pleural mesothelioma. Int J Radiat Oncol Biol
Phys 2005;63:1045–1052.
14-
Rusch VW, Rosenzweig KE, Venkatraman ES et al. A phase II trial of surgical
resection and adjuvant high-dose hemithoracic radiation for malignant pleural
mesothelioma. J Thorac Cardiovasc Surg 2001;122:788–795.
15-
Stevens C, Rice D, Forster K et al. IMRT after extrapleural pneumonectomy
prevents local recurrence of mesothelioma. Lung Cancer 2005; 49(suppl 2):29a.
16-
Allen AM, Czerminska M, Ja¨nne PA et al. Fatal pneumonitis associated
with intensity-modulated radiation therapy for mesothelioma. Int J Radiat
Oncol Biol Phys 2006;65:640–645.
17-
Rice DC. Dose-dependent pulmonary toxicity after postoperative intensity-
modulated
radiotherapy for malignant pleural mesothelioma. Int J Radiat Oncol Biol
Phys. 2007; 69 (2):350-7.
18-
Krayenbuehl J, Oertel S, Davis JB, Ciernik IF. Combined photon and electron
three-dimensional conformal versus intensity-modulated radiotherapy with integrated
boost
for
adjuvant
treatment
of
malignant
pleural
mesothelioma
after
pleuropneumonectomy. Int J Radiat Oncol Biol Phys. 2007;69(5):1593-9.
19-
Ceresoli GL, Gridelli C, Santoro A. Multidisciplinary treatment of malignant
pleural mesothelioma. The Oncologist 2007;12:850–863
20-
Boutin C, Rey F, Viallat JR. Prevention of malignant seeding after invasive
diagnostic procedures in patients with pleural mesothelioma. A randomized trial of
local radiotherapy. Chest 1995;108:754 –758.
21-
Bydder S, Phillips M, Joseph DJ et al. A randomised trial of single-dose
radiotherapy to prevent procedure tract metastasis by malignant mesothelioma. Br J
Cancer 2004;91:9 –10.
22-
O’Rourke N, Curto Garcia J, McMenemin R et al. A randomized controlled trial
of radiotherapy to mesothelioma drain sites. Lung Cancer 2005;49(suppl 2):226a.
23-
de Graaf-Strukowska L, van der Zee J, van Putten W et al. Factors influencing
the outcome of radiotherapy in malignant mesothelioma of the
269
pleura. A single institution experience with 189 patients. Int J Radiat Oncol
Biol Phys 1999;43:511–516.
24-
Chapman E, Berenstein EG, Die´guezMet al. Radiotherapy for malignant
pleural mesothelioma. Cochrane Database Syst Rev 2006;3:CD003880.
25 – De Perrot M et al. Trimodality therapy with induction chemotherapy followed by
extrapleural pneumonectomy and adjuvant high-dose hemithoracic radiation for
malignant pleural mesothelioma. J Cln Onc 2009; 27: 1413-18.
26 – Schippel PH et al. Malignant pleural mesothelioma: Surgical management of
285 patients. Ann Thorac Surg 2008; 85: 257-64.
27 – Yan TD et al. Prognostic features of long-term survivors after surgical
management of malignant pleural mesothelioma. Ann Thorac Surg 2009;87:1552-7.
28 – Borasio P et al. Malignant pleural mesothelioma: Clinicapathologic and survival
characteristics in a consecutive series of 394 patients. Eur J Cardiothorac Surg 2008;
33: 307-13.
29 – Opietz I et al. Local recurrence modal of malignant pleural mesothelioma for
invastigation of intrapleural treatment. Eur J Cardiothorac Surg 2007: 31: 772-8.
16 – Lucchi M et al. A phase II study of intrapleural immuno-chemotherapy,
pleurectomy/decortication, radiotherapy, systemic chemotherapy and long-term subcutaneous IL-2 in stage II- III malignant pleural mesothelioma. Eur J Cardiothorac
Surg 2007;31: 529-35.
30 - Rice DC et al. Extended surgical staging for potentially resectable malignant
pleural mesothelioma. Ann Thorac Surg 2005; 80: 1988-93.
31 – BTS statement on malignant mesothelioma in the UK, 2007. Thorax 2007;62:
suppl II: ii1-ii19.
32 – Robinson BWS et al. Malignant Mesothelioma. Lancet 2005; 366: 397-408.
33 – Scherpereel A et al. Guidelines of the French speaking society for chest
medicine for management of malignant pleural mesothelioma. Resp Med 2007; 101:
1265-76.
34 – Martin-Ucar AE et al. Case-control study between extrapleural pneumonectomy
and radical pleurectomy/decortication for pathological N2 malignant pleural
mesothelioma. Eur J Cardio-thorac Surg 2007;31:765-71.
35 – Schil PV et al. Malignant pleural mesothelioma: Staging systems. Lung Cancer
2005;49S1:s45-48.
270
36 – Stahel R et al. Neoadjuvant chemotherapy in malignant pleural mesothelioma.
Lung Cancer 2005;49S1:S69-70.
37 – Rice DC et al. Outcomes after extrapleural pneumonectomy and intensitymodulated radition therapy for malignant pleural mesothelioma. Ann Thorac Surg
2007;84:1685-93.
38 – Treasure T et al. The MARS trial: mesothelioma and radical surgery. Interact
Cardiovasc Thorac Surg;2006;5:58-9.
39 – Moore AJ et al. Malignant mesothelioma. Orph J Rare Dis 2008;3;3-34.
40 – Zellos L et al. A phase I study of extrapleural pneumonectomy and intracavitary
intraoperative hyperthermic cisplatin with amifostine cytoprotection for malignant
pleural mesothelioma. J Thorac Cardiovasc Surg 2009;137:453-8.
41-Fennell DA, Gaudino G, O’Byrne KJ, Mutti L, van Meerbeeck J. Advances in the systemic
therapy of malignant pleural mesothelioma. Nat Clin Pract Oncol 2008; 5: 136–47.
42-Byrne MJ, Davidson JA, Musk AW, et al. Cisplatin and gemsitabin reatment for malign
mesothelioma: a Phase II study. J Clin Oncol 1999, 17 (1); 25-30.
43-Nowak AK, Byrne MJ, Williamson R, et al. A multicentre phase II study of Cisplatin and
gemsitabin for malign mesothelioma. Br J Cancer 2002; 87 (5); 491-6.
44-Vogelzang NJ. Chemotherapy for malignant pleural mesothelioma. Lancet 2008, 371;
1640-42.
45-Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase III study of pemetrexed in
combination with cisplatin versus cisplatin alone in patients with malignant pleural
mesothelioma. J Clin Oncol 2003; 21: 2636–44.
46-van Meerbeeck JP, Gaafar R, Manegold C, et al. Randomized phase III study of cisplatin
with or without raltitrexed in patients with malignant pleural mesothelioma: an intergroup
study of the European Organisation for Research and Treatment of Cancer Lung Cancer
Group and the National Cancer Institute of Canada. J Clin Oncol 2005; 23: 6881–89.
47-Muers MF, Stephens RJ, Fisher P, et al, on behalf of the MS01 Trial Management Group.
Active symptom control with or without chemotherapy in the treatment of patients with
malignant pleural mesothelioma (MS01): a multicentre randomised trial. Lancet 2008; 371:
1685–94.
48-Steele JP, Shamash J, Evans MT, Gower NH, Tischkowitz MD, Rudd RM. Phase II study
of vinorelbine in patients with malignant pleural mesothelioma. J Clin Oncol 2000; 18: 3912–
17.
49-Karrison T, Kindler HL, Gandara DR, et al. Final analysis of a multi-center, double-blind,
placebo-controlled, randomized phase II trial of gemcitabine/cisplatin (GC) plus bevacizumab
271
(B) or placebo (P) in patients (pts) with malignant mesothelioma (MM). J Clin Oncol 2007; 25
(18S): 7526 (abstr).
50-Weder W, Kestenholz P, Taverna C, et al. Neoadjuvant Chemotherapy Followed by
Extrapleural Pneumonectomy in Malignant Pleural Mesothelioma. J Clin Oncol 2004;
22:3451-3457
272
23.
Yrd.Doç.Dr. Yekta Altemur Karamustafaoğlu, Prof. Dr. Yener Yörük
Trakya Üniversitesi Tıp Fakültesi Göğüs Cerrahi Anabilim Dalı
TORAKS TRAVMASININ FİZYOPATOLOJİSİ
Toraks travmaları ilk üç dekatta gençler arasında ölüm nedenlerinin çoğunluğunu
oluşturmaktadır. Tüm yaş gruplarında ise; kanser ve aterosklerozdan sonra üçüncü,
çocuklarda ise ölüm nedenlerinin %50’den fazlasını oluşturmaktadır. ABD’de tüm
travmalardan ölümlerin %25’ini toraks travmaları oluşturmaktadır (1). Travmaları oluş
mekanizmasına göre iki gruba ayırmak mümkündür:
1-Künt travmalar
2-Penetran (kesici-delici) travmalar
Toraks travmaları içinde künt toraks travmalarına daha fazla rastlanmaktadır.
Kanada’da yapılan bir araştırmada; acil servislere başvuran travmaların %96,3’ünün
künt, %3,7’sinin ise penetran mekanizma ile oluştuğu bildirilmiştir. Etyolojide olguların
%70’ini motorlu taşıt kazaları, %10’unu intihar, %8’ini yüksekten düşme, %7’sini
yaralama, %5’ini diğer nedenler oluşturmuştur. Bu travmaların %46’sı toraks
travmasıdır ve ölüm nedenlerinin %15.7’sini oluşturmaktadır (2). Major Trauma
Outcome Study’de (MTOS) künt toraks travması %78,9, penetran toraks travması
%21,1 olarak bildirilmiştir (3). Ülkemizde yapılan 668 toraks travmalı olgunun
irdelendiği bir çalışmada ise, olguların 399’unu (%59,7) künt, 269’unu ise (%40,2)
penetran travma oluşturmuştur. Bu seride penetran travma 173 olguda (%64,3)
kesici-delici alet yaralanmasına, 96’sında (%35,6) ise ateşli silah yaralanmasına bağlı
olarak meydana gelmiştir (4). Künt travmalı olguların 303’ünde (%75,9) ve penetran
travmalı hastaların 58’inde (%21,5) olmak üzere toplam 361 (%54) olguda göğüs
duvarı yaralanması saptanmıştır (4). Regel ve arkadaşları yaptıkları 3406 olguyu
içeren çalışmalarında; göğüs travması ile beraber en sık ekstremite kırığının ikinci
sıklıkla da kafa travmalarının görüldüğünü bildirmişlerdir (5).
Toraks travmasında iki ciddi bozukluk oluşur:
1-Solunum yetmezliği (Kapalı veya açık pnömotoraks, yelken göğüs, akciğer
kontüzyonu, aspirasyon).
2-Hemorajik şok (Hemotoraks, hemomediastinum)
273
Göğüs kafesi iki bölümden oluşmaktadır. İlki; kotlar, klaviküla, sternum ve skapulanın
oluşturduğu sert yapı, ikincisi; solunum kaslarının oluşturduğu yumuşak yapıdır.
Yeterli ventilasyonun ve oksijenizasyonun olması sağlam bir göğüs kafesine bağlıdır.
Göğüs kafesinin bütünlüğünü bozan kot fraktürleri ve kas ezilmeleri ile seyreden
şiddetli bir travma kalp, akciğer, büyük damarlar ve üst abdominal organların
yaralanmasına yol açacaktır. Ek olarak göğüs kafesinin bir kısmının paradoksik
hareketi nedeniyle (ör: yelken göğüs) solunum da bozulacaktır.
Göğüs duvarındaki geniş doku kaybı ile seyreden penetran travmalar (ör: ateşli silah
yaralanması) birden fazla kotun kırılmasına ve kemik parçalarının akciğer yüzeyine
dağılmasına yol açabilir. En sık görülen penetran travma biçimi, visseral ve paryetal
plevranın yırtılması ve negatif olan intraplevral basıncın pozitifleşmesiyle karakterize
olan pnömotorakstır. Penetran travmalar ateşli silah yaralanmalarında olduğu gibi
direkt ya da indirekt yolla oluşabilir. Özellikle, geniş doku kayıplarının olduğu
penetran travmalarda iç organ yaralanmalarının yaygınlığına doku kaybının
büyüklüğüne göre karar vermemelidir. Bazen küçük gibi görünen doku kayıplarının
altında çok ciddi organ yaralanmaları olabilir.
Künt travma farklı mekanizmalar ile oluşabilir (Tablo 23.1) (6).
1- Blast etkisi ya da direkt travma
-Basınç travması doku bütünlüğünün bozulmasına yol açar.
-Kan damarları yırtılır, alveolar doku zarar görür
-Trakeobronşiyal sistemde yırtık ve hasar oluşur
-Direkt travma etkisi ile kot, sternum ve skapula kırıkları oluşabilir, akciğer
yaralanması, miyokard kontüzyonu ve pnömotoraks gelişebilir.
2- Kompresyon (Crush) travması
-Vücudun sert yüzey veya nesneler arasında sıkışması sonucu oluşur.
-Göğüs duvarı ve iç organlara direkt travma maruziyeti vardır.
-Ön-arka yönde oluşan kompresyon travmasının indirekt etkisi ile kotların lateral ve
orta kısmında kırıklar, lateral yönde oluşan kompresyon travmasında ise,
sternoklaviküler eklem çıkıklarına ve klaviküla fraktürlerine yol açar.
-Kompresyon travması birden fazla komşu kotun ikiden fazla yerden kırılmasına yol
açarak, paradoksal solunuma yol açmak suretiyle solunumu bozabilir.
-Üst toraks organlarına ve v. kava superiora, sıkışan sağ kalpten kan akımının
artması sonucu venöz dolgunluk ve kan basıncında artma oluşur ve travmatik asfiksi
274
(Pertes Sendromu) ile sonuçlanır. Baş, boyun ve özellikle vücudun üst yarısında cilt
rengi koyu kırmızı ya da mor olur (Resim 23.1). Jugüler venöz dolgunluk artmıştır.
Konjonktival hemorajiler ve ekzoftalmi mevcuttur (Resim 23.2). Yüz ve dil şişmiştir.
Hipotansiyon, hipoksemi ve şok oluşabilir.
Resim 23.1: Travmatik asfiksi: Üst toraks ve servikal bölgede ve yüzde kızarıklık,
venlerde dolgunluk, peteşiyal kanamalar
Resim 23.2: Travmatik asfikside, konjunktival hemoraji
275
3-Hızlı deselerasyon travması:
-Yüksek hızlı motorlu araç kazaları ve yüksekten düşmeler bu tip travmalara örnektir.
-Hareket sırasında aniden sabit bir nesneye çarpma sonrası oluşabilir.
-Göğüs duvarına şiddetli künt travma sonrası iç organlar ataletleri nedeniyle harekete
devam eder (Lig arteriosum aortadan kopabilir, duktus torasikus yırtılabilir).
-Çocukluk çağında; daha çok olan kıkırdaklar şoku absorbe eder, yaşlılarda
kalsifikasyonlar ve osteoporoz nedeni ile kotlar daha fazla kırılır.
Tablo 23.1: Künt toraks Travmasının Mekanizmaları
Göğüs Duvarı
Yaralanması
Olası Torasik Organ
Yaralanması
………………………………………….Yüksek Şiddette
Yaralanma………………………..
*Göğüs duvarı sıklıkla
*Aort rüptürü
sağlam veya sternum
*Kalp kontüzyonu
fraktürü veya bilateral kot
*Majör hava yolu
fraktürleri ve anterior
yaralanması
yelken göğüs
*Diyafragma rüptürü
……………………………………..Düşük
Yaralanma…………………………………….
Lateral - Unilateral kot *Akciğer kontüzyonu
fraktürleri
Anterior - Sternum fraktürü
Sık Eşlik Eden
Yaralanmalar
*Kafa ve maksillofasyal
travma
*Servikal vertebra fraktürü
*Dalak veya karaciğer
laserasyonu
*Uzun kemik fraktürleri
Şiddette
*Eğer 6-12. Kotlarda kırık
varsa; dalak ve karaciğer
laserasyonu
*Kalp kontüzyonu
………………………………….Kompresyon
Yaralanmas………………………………...ı
Anteroposterior - bilateral *Bronş Rüptürü
kot fraktürleri ± anterior *Kalp kontüzyonu
yelken göğüs
Lateral-ipsilateral
kot *Akciğer Kontüzyonu
fraktürleri ± yelken göğüs
Olası kontralateral kot
fraktürleri
,
276
(Crush)
*Torasik vertebra fraktürü
*Karaciğer
veya
dalak
laserasyonu
*Karaciğer
veya
dalak
yırtılması
Penetran travma 2 mekanizma ile oluşabilir:
1- Düşük enerjili travma:
-Ok,bıçak,tabanca
-Direkt temas ve kavitasyon travmaya neden olur
2- Yüksek enerjili travma
- Yüksek basınç nedeni ile yaygın travma
- Askeri tüfek, av silahları
Solunum yetmezliğinden daha fazla olmak üzere toraks travması; hemorajik şok,
hemotoraks, hemopnömotoraks ve nadiren hemomediastinuma neden olabilir.
Özellikle hemotoraks hem penetran hem de künt travmalarda sık görülen bir
patolojidir. Eğer kanama ciddi ise sadece hemorajik şoka değil, aynı zamanda toraks
kavitesinde biriken kanın akciğeri sıkıştırması sonucunda vital kapasitenin de tehlikeli
şekilde azalmasına yol açacaktır. Persistan hemoraji, genellikle interkostal ya da
internal mamaryan arterden, daha az sıklıkla da majör hiler damarlardan kaynaklanır.
Hemotoraks bazen kardiyak yaralanma ya da eğer diyafragma yırtıldıysa dalak ya da
karaciğer
gibi
abdominal
organlardan
da
olabilir.
Hipovolemik
şok
ve
hemomediastinum torakstaki büyük damar yaralanmaları (dessandan torasik aorta, v
cava, pulmoner venler, innominate arter) sonucu, genelde penetran travma ya da
daha az sıklıkla künt travma sonrası oluşabilir.
Penetran travmaya eşlik eden yaralanmalar arasında en sık; kapalı pnömotoraks,
açık pnömotoraks, pnömomediastinum, hemotoraks, hemopnömotoraks, vasküler
yapılarda yırtıklar, trakeobronşiyal ağaçta yırtıklar, özofagus yırtıkları, kalbe nafiz
yaralanmalar, perikard tamponadı, spinal kord yaralanmaları, diyafragma travmaları,
eşlik eden yandaş intraabdominal yaralanmalar sayılabilir.
Bu hastalarda saptanan hayatı tehdit eden patofizyolojik değişiklikler ise majör hava
yolu obstrüksiyonu, hemopnömotoraks, akciğer kontüzyonu veya majör dolaşım
bozukluğuna bağlı hipoksi ve asidoz; göğüs ya da batında kanama, kalp tamponadı
ya da derin metabolik dengesizliğe bağlı düşük kalp debisi ve ciddi kardiyak ya da
vasküler yaralanmalardır (6).
277
Ciltaltı Amfizemi
Cilt altında ve yumuşak dokularda palpasyonla hissedilen “krepitasyon” (çıtırtı) ve
grafilerde cilt altı dokularda belirgin hava görülmesi ile karakterize klinik durumdur.
Cilt altında hava çeşitli mekanizmalarla oluşabilir (Şekil 23.1).
1)Pnömotoraks gelişen akciğerdeki hava kaçağının göğüs duvarındaki defekt yolu ile
ciltaltı dokulara kaçması
2)Küçük hava yolları ya da periferik alveol hasarı nedeniyle oluşan havanın
perivasküler dokuları disseke ederek ilerlemesi
3)Trakea
ve
büyük
bronş
rüptürüne
bağlı
havanın
mediastene
yayılımı
(pnömomediastinum)
4)Özofagus perforasyonu sonucu oluşan havanın özofagus boyunca mediastene ve
oradan servikal bölgeye yayılımı
5)Plevra veya akciğer defekti oluşturmayan yüksek hızlı travmaların (özellikle kesici
delici alet) cilt altına dışarıdan hava girişi ile oluşan yayılım (7).
Çobanoğlu ve arkadaşlarının yaptıkları çalışmalarında (4) künt travmalı hastaların
%32’sinde, penetran travmalıların ise %29’unda ciltaltı amfizemi saptamışlardır. Künt
travmalı olanların sadece %4,6’sında pnömotoraks oluşmamışken, penetran travmalı
olguların tamamında pnömotoraks geliştiği bildirmişlerdir.
Semptomlar
Travmanın lokalizasyonuna ve şekline bağlı olarak palpasyonla ciltaltında hissedilen
çıtırtı ve grafilerde yoğun gaz görünümü oluşur. Yaygın ciltaltı amfizemine dispne de
eşlik edebilir. Özellikle servikal trakea yaralanmaları ve özofagus yaralanmalarında
servikal ve pektoral bölgeye lokalize cilt altı amfizemi görülmesi tipiktir. Kesici delici
alet travmaları ve geniş tüp torakostomiler sonrasında bölgeye lokalize ciltaltı
amfizemi olabilir. Bazen yaşlı ve ciltaltı dokusu gevşek olan hastalarda kısa zamanda
yaygın cilt altı amfizemi gelişebilir. Kaçağın fazla olması durumunda, hava yeterince
drene edilemiyorsa; yüzden skrotuma kadar olan yaygın ciltaltı amfizemi oluşabilir.
278
Şekil 23. 1: Cilt altı amfizemi oluşum mekanizmaları:1)Pnömotoraks olan akciğerdeki
hava kaçağının göğüs duvarı defekti yolu cilt altı dokulara kaçması, 2)Küçük hava
yolları ya da periferik alveol hasarı nedeniyle oluşan havanın perivasküler dokuları
disseke ederek ilerlemesi, 3)Trakea ve büyük bronş rüptürüne bağlı havanın
mediastene yayılımı (pnömomediastinum), 4)Özofagus perforasyonu sonucu oluşan
havanın özofagus boyunca mediastene ve oradan servikal bölgeye yayılımı 5)Plevra
veya akciğer defekti oluşturmayan yüksek hızlı travmaların (özellikle kesici delici alet
) cilt altına dışarıdan hava girişi ile oluşan yayılım (7).
Sternum, Kot, Klaviküla ve skapula Fraktürleri
Hem pediyatrik hem de erişkin grupta künt toraks travmaları sonucunda en sık kot
fraktürleri oluşur (8,9). Künt toraks travması nedeni ile acile başvuran olguların
%67’sinde kot fraktürü mevcuttur (10). Şiddetli kompresyon sonucunda kotlar esner
ve en zayıf yerlerinden kırılırlar. Birinci, ikinci ve üçüncü kaburgaların kırılması çok
şiddetli bir travma geçirildiğini gösterir, çünkü bunlar en güçlü kaburgalardır ve buna
akciğer yaralanması, subklavyan arter ve ven yaralanması eşlik edebilir, mortalitesi
yüksektir. Dört ve dokuz arası kaburgalar en sık kırılan kaburgalardır. Dokuz ve oniki
arası kaburgalar diğerlerine oranla daha az sıklıkta kırılırlar. Travmanın enerjisini iç
organlara iletirler, eğer kırılırlarsa; dalak ve karaciğer yaralanması eşlik edebilir. Kot
fraktürlerine sıklıkla; akciğer kontüzyonu, yelken göğüs ve pnömotoraks eşlik eder.
Ağrıdan dolayı hipoventilasyon sıktır, ağrının iyi tedavi edilememesi durumunda
sekresyon birikimi ve atelektazi olabilir. Sternum fraktürü ciddi anterior künt travma
sonucu oluşur. Ağır travmalarda miyokard kontüzyonu, perikard tamponadı, kardiyak
rüptür, akciğer kontüzyonu eşlik edebilir. Dislokasyon nadirdir. Eğer posteriorda ise
trakeal depresyon yapabilir. Çobanoğlu ve arkadaşlarının çalışmasında (4) göğüs
279
duvarı yaralanmasında en sık görülen patoloji %65 ile kosta kırıklarıdır. Bunların
%61’i künt, %4,7’si penetran travmayla (tümü ateşli silah yaralanması sonucu)
gelişmiştir.
Klaviküla fraktürü özellikle şiddetli travmalarla birlikte görülür; 1. ve 2. kot fraktürleri
de eşlik edebilir, çok şiddetli travmalarda a. ve v. subclavia yırtıkları oluşabilir.
Skapula kırıkları nadirdir ve büyük travma göstergesidir. Beraberinde kot kırıkları
akciğer kontüzyonu subklavyan, aksiller veya brakial arter yaralanması olabilir (7).
Semptomlar
Sternum fraktürü; anterior göğüs ağrısı, ekimoz, kırığa bağlı krepitasyon, terleme,
göğüs deformitesi ile kendini belli eder. Kot fraktürü ise öksürük, nefes almak ve
hareketle artan ciddi ağrı, kas spazmı, beraberinde hemotoraks, pnömotoraks ve cilt
altı amfizemi gibi bulgulara yol açar.
Şekil 23.2: Künt toraks travmasına bağlı kot fraktürleri ve yelken göğüs (7)
Flail Chest (Yelken Göğüs)
Künt toraks travması sonrası görülme oranı %23,1’dir (10). Üç veya daha fazla
komşu kaburganın iki veya daha fazla yerden kırılması sonucu oluşur. Ciddi göğüs
duvarı travması ile birlikte çoğunlukla akciğer yaralanması da mevcuttur. Bu solunum
280
hacmini azaltırken, mortaliteyi artırır. Solunum sırasında paradoksal göğüs duvarı
hareketi mevcuttur. İnspirasyon sırasında göğüs duvarı şişerken, etkilenen kot
fraktürlerinin olduğu segment çöker; ekspirasyon sırasında ise intratorasik basınç
atmosfer basıncını aştığı için göğüs duvarı inerken, etkilenen segment şişer (Şekil
23.2 ve 23.3). Bu paradoksal hareket fonksiyonel rezidüel kapasitede ve vital
kapasitede azalmaya yol açar. Büyük bir yelken göğüs defekti oluşmuşsa mediastinal
shift (kayma) de buna eşlik edebilir ve kalbe dönen kan akımı azalabilir. Aslında klinik
durumun ağırlığını yelken göğüs ile birlikte olan akciğer kontüzyonu doğrudan etkiler.
Yapılan çalışmalarda sadece yelken göğüs ve sadece akciğer kontüzyonu olan
olgularda mortalite %16 iken, bu iki tip travmanın birlikteliği mortaliteyi %42’ye kadar
çıkarmaktadır (7). Sıklıkla etkilenen segment büyüklüğüne göre; ventilasyon
perfüzyon dengesizliği, hipoksemi, hiperkarbi, azalmış kompliyans, artmış hava yolu
direnci ve artmış solunum işi oluşur. Ağrı nedeni ile yetersiz öksürük ve sekresyon
birikimi sonucu atelektazi oluşabilir.
Semptomlar
Dispne, göğüs ağrısı, paradoksal göğüs hareketi, kırılan kotlara ait krepitasyonlar,
hipoksi ve siyanoz en yaygın görülen bulgulardır.
281
Şekil 23.3: İnspirasyon sırasında göğüs kafesi dışa doğru hareket ederken etkilenen
kısım içe çöker, ekspirasyonda ise göğüs kafesi içe doğru kareket ederken etkilenen
kısım dışa doğru hareket eder (7)
Akciğer Kontüzyonu
Akciğer kontüzyonunun künt toraks travması nedeni ile acile başvuran vakalarda
görülme oranı %65’dir (10). Akciğer kontüzyonu; yüksek hızlı çarpışma, yüksekten
düşme, ateşli silah yaralanmaları gibi çok şiddetli bir travma ile oluşur ve alveolar
hemoraji ve lokalize ödemle karakterize olan akciğer dokusu hasarı mevcuttur.
Primer patoloji alveollerin içinde ve intertisyel alanda anormal sıvı birikmesidir.
Akciğer parankimine ve kapiller ağa serum proteinleri ve plazma kaçağı olması,
osmotik basınç artışı ile sonuçlanır ve kapilerlerden sıvı kaybına zemin hazırlar. Kan,
ödem ve hücresel artıklar akciğere girer, bronşiyollerde ve alveolar yüzeyde
toplanarak gaz değişimini bozarlar. Pulmoner vasküler direnç ve pulmoner arter
basıncı artar. Sonuçta hipoksemi ve hiperkarbi oluşur.
282
Semptomlar
Taşipne, taşikardi, plöritik göğüs ağrısı, hipoksemi, hastanın öksürmesine rağmen
sekresyonları temizleyememesi gibi semp
Trakeobronşiyal Yaralanmalar
Trakeobronşiyal yaralanmalar nadirdir, künt toraks travmaları ile birlikte görülme
oranı %0.8 ‘dir (8). Trakea ve majör bronşlar benzer anatomik yapılar olmalarından
dolayı künt veya penetran travmalar yoluyla aynı mekanizma ile yaralanabilirler.
Genelde penetran ve kesici delici alet yaralanmalarına bağlı trakea yaralanmaları
boğazlanma vakaları sonrası servikal trakeada görülürken, künt travmalarda daha
çok karina düzeyinde ya da karina çevresindeki 2,5 cm’lik alanda kopmalar meydana
gelebilir. Yaralanma; mandibulanın, önde sternumun arkada vertebraların koruyucu
etkisi nedeni ile servikal trakeada, intratorasik trakea ve bronşlara oranla daha azdır.
Çok ciddi bir yaralanma olmakla birlikte mortalite %30 civarındadır. Klinik, rüptüre
olan trakebronşiyal ağaç ile plevra arasında bağlantı olup olmamasına göre değişir.
Eğer bağlantı varsa geniş bir pnömotoraks oluşur. Aynı zamanda boyunda ve
pektoral bölgede ciltaltı amfizemi ve mediasten amfizemi görülür. Oluşumuna ilişkin
değişik görüşler vardır. Bunlar; 1)Deselerasyon travması sonrası daha mobil olan
distal bronşlar ve akciğerin göreceli olarak daha sabit olan karina ve proksimal bronş
düzeyinden kopması ya da yırtılması, 2)Ciddi kompresyon travması sonrası
akciğerlerin yanlara kaçması sonucu karina seviyesinden kopmalar, 3)Epiglot kapalı
iken yüksek basınçlı travma sonucu artan intrabronşiyal basınca bağlı yırtıklar,
4)Trakeanın sternum ve vertebra arasında ezilmesi, 5)İyatrojenik endotrakeal tüp ve
özellikle çift lümenli entübasyonlarda stile yırtıkları 6)Servikal trakeanın künt ve kesici
yaralanmaları 7)Endotrakeal ya da trakeostomi kafı basıncına bağlı iskemi ve nekroz
sonucu yırtılmalar. 8)Her çeşit kesici delici alete bağlı penetran travmalar şeklinde
özetlenebilir (11).
Semptomlar
Dispne, hemoptizi, respiratuar distres, boyunda, yüzde ve pektoral bölgede subkutan
ve mediastinal amfizem, solunum seslerinde azalma ve alınamaması, mediastinal
amfizem nedeniyle kalp atımlarıyla aynı anda göğsün ön duvarında çıtırtı sesi
duyulmasıdır (Hamman’ın işareti, Hamman’s sign).
283
Pnömotoraks
Acile başvuran künt toraks travmalı hastalarda pnömotoraks sıklığı %30’dur (10).
Akciğer parankimi ya da trakeobronşiyal ağaç laserasyonu sonucu veya göğüs
duvarında doku defekti nedeni ile dışarıdan hava girmesi suretiyle, visseral plevra ile
paryetal plevra arasında pozitif basınç oluşmasına pnömotoraks denir. Böylece
akciğer kollabe olur, plevral basınç artar, mediastenin karşı taraf hareketi ile karşı
akciğerde kompresyona uğrayabilir. Solunuma katılmayan akciğere olan kan akımı
azalması ve ventilasyonun artması nedeni ile ventilasyon perfüzyon dengesizliği
oluşabilir.
3 Tip pnömotoraks vardır:
1- Basit (Kapalı) Pnömotoraks: Paryetal ya da visseral plevranın yırtılması ile
plevral aralığa pozitif hava girmesine basit pnömotoraks denir. Sağlıklı
insanlarda da travma olmadan subplevral blep ya da büllerin patlaması ile de
oluşabilir. Kollabe akciğerde, artmış ventilasyona rağmen perfüzyon yok ya da
çok azdır, azalmış solunum hareketi nedeniyle hipoksi oluşur (Şekil 23.4).
Şekil 23.4: Basit (kapalı) pnömotoraks
2- Açık Pnömotoraks: Travma sonucu akciğerdeki laserasyon ya da göğüs
duvarındaki açık yaradan, plevral boşluğa hava girmesiyle oluşur. Göğüs
duvarındaki yara açıklığının çapı, trakea çapının 2/3’ünden küçük ise hava
284
toraksa bu yaradan girip çıkabilir, bu durumda parsiyel pnömotoraks vardır.
Ancak göğüs duvarındaki yaranın çapı, trakea çapının 2/3’ünden büyük ise
hava bu yolu tercih edeceğinden akciğerde total kollaps ve mediastenin karşı
tarafa ciddi deplesyonu vardır. Bu mediastinal flatter hareketi büyük
damarların kıvrılmasına ve kalbe gelen kan akımının azalmasına yol açar. Bu
şekilde düşen kardiyak debi ve hipoventilasyon mortaliteyi artırabilir (Şekil
23.5)
Şekil23.5: Açık Pnömotoraks
Semptomlar
Penetran göğüs travması, toraks duvarında hava giriş çıkışı olan açık yara, göğüs
ağrısı, yaradan köpüklü kan çıkışı, ciddi dispne, hipovolemi etkilenen tarafta
solunum sesleri azalır ya da yoktur, perküsyonda hipersonorite ve hiperrezonans
vardır.
3- Tansiyon Pnömotoraks: Pnömotoraksa neden olan yaralanma tek taraflı hava
hareketine neden olur, her inspiryumda hava akciğer hasarından plevral
boşluğa girer fakat dışarı çıkamaz (tek yönlü valv mekanizması). Bu durumda
aynı taraf akciğer kollabe olur, mediasteni karşı tarafa iter. Karşı akciğer de
kısmen kollabe olur. Çok yükselen intraplevral basınç intratorasik venöz geri
dönüşü ve kardiyak dolumu engeller. Ağır derecede kardiyorespiratuar
bozulma hızla ölüme yol açar (Şekil 23.6).
285
Şekil 24.6: Tansiyon pnömotoraks
Şekil 23.6: Tansiyon Pnömotoraks
Semptomlar
Önce
taşipne,
sonra
dispne,
ilerleyici
ventilasyon/perfüzyon
dengesizliği,
yaralanmanın karşı tarafında basınç nedeni ile atelektazi, hipoksemi, yaralanma olan
tarafta göğsün aşırı şişmesi (hiperinflasyon), yaralanma olan tarafta hiperrezonans ve
hipersonorite, trakeanın karşıya deviasyonu, boyun venlerinde dolgunluk, yaralanma
olan tarafta solunum seslerinin azalması ya da alınamaması, siyanoz, aşırı terleme,
jugüler venöz dolgunlukta artış, hipotansiyon, hipovolemi, ajitasyon en sık saptanan
bulgulardır.
Masif Hemotoraks
Hemotoraks sıklığı acile başvuran travma hastalar arasında %26’dır (10). Hem künt
hem penetran travmalarda hemotoraks oluşabilir. Masif hemotoraksta 1500 ml kan
hızlı bir şekilde toraks kavitesine dolar; bu miktar total kan hacminin %30-40’ı
kadardır. Şok belirtileri 1500-2000 ml kan kaybında ortaya çıkar. Kanama nedeni;
interkostal arterler, internal mammaryan arter, torakoakromiyal arter, lateral torasik
arter, mediastinal büyük damarlar, kalp, diyafragma rüptürü olduğu zaman
diyafragma ya da abdominal organlar (öz. dalak ve karaciğer) olabilir. Oluşan kan bir
286
süre sonra defibrine olur; lizis ile osmolaritesi artar ve plevradan daha fazla sıvı
çekebilir. Uzun süre boşaltılmadığında hematomun organize olması ile plevral
aralıkta lokülasyonlar ve plevral zar kalınlaşması meydana gelebilir. Bunun
sonucunda, kanama olan tarafta akciğer kollabe olur, karşı tarafa mediastinal şift
nedeni ile karşı akciğer baskı altında kalır ve ventilasyon kapasitesi sınırlanır. Kan
kaybının devam etmesi ve artmış intratorasik basınç nedeni ile venöz dönüşün
azalması sonucunda kardiovasküler kollaps ve hipovolemik şok gelişebilir.
Semptomlar
Dispne, göğüs ağrısı, yaralanma olan tarafta solunum seslerinin azalması ya da
alınamaması, perküsyonda matite, trakeal ve mediyastinal şift ve hipovolemik şok
bulguları saptanır.
Kardiyak Tamponad
Künt ya da penetran travma sonucunda oluşabilir, ancak penetran travma sonucu
oluştuğunda klinik durum çok daha ciddi seyreder. Koroner damarların yırtılması ya
da direkt miyokarda penetran travma nedeni ile perikard içinde kan toplanır, 200-300
ml kan diastolde kalbin yeterince dolmasını önler; kalbin doluşu ve debisi azalır.
Semptomlar
Penetran göğüs yarası, anterior 3.-5. kotlarda fraktür, dispne, siyanoz, pulsus
paradoksus, Beck triadı (derinden gelen kalp sesleri, juguler venöz dolgunluk,
hipotansiyon), Kussmaul solunumu (İnspirasyon sırasında JVD azalması ya da yok
olması), pulsus paradoksus (İnspirasyon sırasında sistolik kan basıncının 10 mmHg
veya daha fazla düşmesi, EKG de P,QRS ve T anormallikleri.
Kalp Yaralanmaları
Miyokard kontüzyonu genellikle yüksek hızlı çarpma ya da yüksekten düşmelerde,
şiddetli travmaya bağlı kot ve/veya sternum fraktürü ile birlikte görülebilen ciddi bir
travmayı ifade eder. Sağ atrium ve ventrikül en sık etkilenir. Tanı genelde EKG dalga
anormallikleri ve biyokimyasal olarak kardiyak enzim yükselmeleri ile konulur. Şiddetli
kontüzyon miyokard infarktına neden olabilir bu durumda, erken ventriküler
ekstrasistoller, atrial fibrilasyon, sağ dal bloğu ve ST değişiklikleri gibi EKG
bozuklukları görülebilir. Bazen çok şiddetli kompresyon travması, yüksek hızlı mermi
yaralanması ve kesici delici alet yaralanmasına bağlı kardiyak rüptür ve ani ölüm
287
olabilir. İki yıllık bir dönem içinde acil servise başvuran 201 künt toraks travmalı
olgunun irdelendiği bir çalışmada bir adet ventriküler laserasyon olgusu görülmüştür
(12). Künt torasik travmalı hastalarda miyokard kontüzyonunun sıklığı %2,6’dır (13).
Mortalitesi yüksektir. Myokard kontüzyonunu olan olgularda intraoperatif ölümlerin
sebebi; kardiyak yaralanmadan çok hipovolemidir (12).
Semptomlar
Bulgular göğüs ağrısı, göğüs duvarı ekimozu, oskültasyonda raller ve/veya S3 gallop
ritim (kalp yetmezliği bulguları), hipotansiyon. hematom, hemoperikardiyum, miyokard
nekrozu, disritmi ve kardiyojenik şok olabilir.
Torasik Büyük Damar Yaralanmaları
Travma merkezlerine başvuran büyük damar yaralanmaların oranının %8-9 olduğu
tahmin edilmektedir. Büyük damar yaralanmaları mekanizma olarak hem künt hem
de penetran travmalar sonrasında gelişebilir. Genelde olgu hemotoraks ve solunum
zorluğu ile acile başvurur. Tüp torakostomi sonrası yüksek miktarda ve debide kan
drenajı olur. Perikard tamponadının klasik işaretleri ile saptanabilir. Radyolojik olarak;
göğüs travması sonrası hemotoraks, pnömotoraks, yabancı cisim, üst mediastenin 8
cm’den fazla genişlemesi sol ana bronşun 140o daha fazla depresyonu görülebilir.
Semptomlar
Bu hastalarda göğüs ön duvarında ekimoz, hipotansiyon, hipovolemik şok, perikard
tamponadı bulguları, dispne, hemotoraks görülebilir.
Torasik Aorta Rüptürü
Künt toraks travması geçiren olgularda görülme oranı %4.8’dir (6). Genellikle
olgulardan oluş mekanizması hakkında bilgi alınamamaktadır, çünkü bu olguların
%90’ı travma sırasında hipovolemiden ölmektedir. Acile gelebilen %10 olgu intakt
aort adventisyası olan olgulardır (14). Laserasyon genellikle duktus arteriosus
düzeyindedir. Skapula fraktürü, 1. ve 2. kot fraktürü, klavikülanın medial 1/3’ünden
kırılması gibi ciddi travma belirtilerinde aort rüptürü ihtimalini göz önünde
bulundurmak gerekir.
Semptomlar
288
Vital bulguların hızla kabı, hemodinamik instabilite, hipovolemik şok, sağ ve sol, üst
veya alt ekstremitelerde nabız azalması ve tansiyon arteryel farkı, paraskapular
bölgede murmur, radyolojik olarak PA grafide üst mediasten genişlemesi, aort
topuzunun silinmesi, nazogastrik sondanın sağa deviasyonu ve sol “apikal cap”
belirtileri görülebilir.
Diyafragma yaralanmaları
Künt toraks travması sonrası diyafragma rüptürü oranı %9,1’dir (10). Rüptür
genellikle karın içi basıncını artıran ani ve şiddetli travma sonrası oluşur. Eğer
diyafragmadaki yırtık büyükse negatif plevra içi basınç nedeni ile batın organları
kolaylıkla toraks içine geçerler ve akciğeri sıkıştırırlar; dispneye yol açarlar. Travmatik
diyafragma hernileri sağda karaciğerin diyafragmayı koruyucu etkisi olması nedeni ile
genellikle sol tarafta görülür. Şiddetli travma sonrası intraabdominal organların kliniği
maskelemesi nedeni ile gözden kaçabilir.
Özellikle önde 4. İnterkostal aralık,
lateralde 6. İnterkostal aralık ve arkada 8. İnterkostal aralık altındaki kesici delici
travmalarda (tüfek, tabanca, bıçak,şiş vb) diyafragma yaralanması göz önünde
bulundurulmalıdır. Rüptürün büyüklüğü nedeni ile batın organları travma sırasında
pozitif basınçlı abdomenden negatif basıncın olduğu toraksa geçebilir ki bu da
(karaciğerin sağda diyafragmayı koruyucu etkisi nedeni ile) genellikle solda olur.
Bazen de küçük bir ya da birkaç 1-2 cm’lik (ör: kesici delici alet yaralanması) delik
nedeni ile başta sessiz olan klinik 10 yılı dahi bulabilen bir süre sonra intraabdominal
basıncı aşırı artıran bir nedenle batın organlarının toraksa hernisi ile sonuçlanabilir.
İlk başta pnömotoraks ya da hemotoraks olması, radyolojik belirti vermeyen küçük bir
diyafragma defektinin kolaylıkla gözden kaçmasına neden olabilir.
Semptomlar
Bulgular genellikle toraksa herniye olan batın organlarına bağlıdır. Sık rastlanan klinik
belirtiler; dispne, göğüs veya omuz ağrısı ve siyanozdur.
Özofagus travması
Özofagus travması çok nadir olmakla birlikte, perforasyonu daha çok penetran
travma sonrasında görülmektedir. Seroza tabakasının olmaması nedeni ile travmanın
etkilerine daha açık olan organ, perforasyonun olması durumunda; tükrük, gastrik
içerik ve safranın mediastene girmesi ile mediastinite yol açabilir. Aynı zamanda
289
perforasyon durumunda mediastende amfizem ve hidropnömotoraks görülebilir.
İyatrojenik perforasyon daha çok özofagus girişi veya distal özofagusta görülürken,
spontan rüptür genelde diyafragmanın hemen üzerinde posterolateral duvar, genelde
sol tarafta sağa göre daha fazla oranda görülür (15).
Semptomlar
Genellikle epigastriumdan toraksa ve sırta yayılan ağrı, mediastinit olduğu durumda
ateş, dispne, siyanoz ve şok olabilir. Özellikle sol mediastende, mediasten amfizemi
ve pnömotoraks veya hidrotoraks görülebilir.
KAYNAKLAR
1.Jones KW. Thoracic Trauma. Surg Clin North Am 1980; 60: 957-81
2.Hill AB, Fleiszer DM, Brown RA. Chest trauma in a Canadian urban setting implications for trauma research in Canada. J Trauma 1991; 31: 971-73
3. Champion HR, Copes WS, Sacco WJ, Lawnick MM, Keast SL, Bain LW Jr, et al.
The Major Trauma Outcome Study: establishing national norms for trauma care. J
Trauma1990;30:1356-65
4. Çobanoğlu U, Yalçınkaya İ. Ulus Travma Acil Cerrahi Derg. 2010;16 (1):77-83
5. Regel G, Lobenhoffer P, Grotz M, Pape HC, Lehmann U, Tscherne H. Treatment
results of patients with multiple trauma: An analysis of 3406 cases treated between
1972 and 1991 at a German Level I Trauma Center. J Trauma 1995;38:70-8.
6. Westaby S, Brayley N. ABC of trauma. Thoracic trauma. BMJ 1990;300:1639-43.
7. Yoruk. Y. Göğüs Duvarı Travması. In Yüksel M, Çetin G. Toraks Travmaları. Ed.
2003 İstanbul Turgut yayıncılık S: 40-50
8. Shorr RM, Crittenden M, Indeck M, Hartunian SL, Rodriguez A. Blunt thoracic
trauma; analysis of 515 patients. Ann Surg 1987; 206: 200-5.
9. Meller JL, Little AG, Shermeta DW. Thoracic trauma in children. Pediatrics 1984;
74: 813-9.
10. Devitt JH, McLean RF, Koch J-P. Anaesthetic management of blunt thoracic
trauma. Can J Anaesth 1991; 38: 506-10
11. Genç O, Balkanlı K. Trakeobronşiyal yaralanmalar. In Yüksel M, Çetin G. Ed.
Toraks Travmaları 2003 İstanbul Turgut yayıncılık S: 105-120.
290
12. Devitt JH, McLean RF, McLellan BA. Perioperative cardiovascular complications
associated with blunt thoracic trauma. Can J. Anaesth 1993; 40: 197-200.
13. McLean RF, Devitt JH, McLellan BA, Dubbin J, Ehrlich LE, Dirkson D.
Significance of myocardial contusion following blunt chest trauma. J Trauma 1992;
33: 240-243.
14. Maggisano R, Cina C. Traumatic rupture of the thoracic aorta. in: McMurtry RY,
McLellan BA (Eds). Management of blunt trauma. Baltimore: Williams and Wilkins,
1990: 206-26.
15. İnci İ. Özofagus yaralanmaları. In Yüksel M, Çetin G. Ed. Toraks Travmaları.
2003 İstanbul Turgut yayıncılık S: 203-249
291
24.
Prof. Dr. Akın Eraslan Balcı
Fırat Üniversitesi Tıp Fakültesi, Göğüs Cerrahisi Anabilim Dalı
TORAKS TRAVMALARINDA TANI VE ACİL GİRİŞİM
Travma nedeniyle yılda 3 milyon ölüm olduğu tahmin edilmektedir. Otomobil kazaları
ve kişiler arasındaki şiddet başta gelen nedenler arasındadır. Gelişmiş ülkelerin
çoğunda 44 yaşından küçük bireylerde en sık görülen ölüm nedeni travmadır (1).
Travma ölümlerinin yaklaşık %25’i doğrudan toraks yaralanmalarıyla ilgilidir (2).
Genel travma nedeniyle başvuranların mortalite oranı %4.1 - %7.8 arasında
değişmektedir (3). Künt travmaların genel olarak mortalitesi %5,7; penetran
travmaların mortalitesi %11,5 olmaktadır. Kritik yaralanmaya en fazla maruz kalan
travma bölgesi birinci sıklıkta baş (%43), ikinci sıklıkta göğüs (%28) ve üçüncü
sıklıkta da batındır (%19) (4). Hastaneye başvurunun ilk saati içinde en başta gelen
ölüm nedeni toraks damarları ve nörolojik yapılara olan travmalardır.
Erken travma ölümleriyle ilgili üç önemli risk faktörü söz konusudur: 1.Yaralanma
şiddeti skoru (ISS, injury severity score) 4’den daha büyük olan göğüs travması,
2.Glasgow koma skoru (GCS)’nun 8’in altında olması ve 3. başvuru sırasında kan
basıncının 90 mmHg’nın altında olması.
Yaralanmaya bağlı ölümlerde ölüm üçlü bir dağılım gösterir. Erken dönem ölümü,
yaralanma yerinde görülür ve masif santral sinir sistemi yaralanması veya
kardiyovasküler rüptüre bağlıdır. Bu yaralanmalar tipik olarak kurtarılabilir türden
değildir ve yapılabilecek tek şey mümkün olduğunca bu tür yaralanmalar için önlem
alınmasıdır. Vücudu koruyucu giysiler veya otomotiv teknolojisindeki ilerlemeler
mortaliteyi anlamlı derecede düşürebilir. Yaralanmadan sonraki 6–24 saat içinde
görülen yaralanmalarda beyin ve batınla ilgili olaylar söz konusudur. Bu hasta grubu
hızlı resüsitasyondan ve yaralanmanın tedavisine yönelik işlemlerden çok yarar
görebilecek hastalardan oluşur. Son olarak geç ölümler ilk travmanın ardından gelen
günler veya haftalar sonra olur ve sepsis ya da çoklu organ yetmezliğinden dolayıdır.
Bu ölümlerin nedeni genellikle tam olmayan resüsitasyon ve yaralanmanın ilk fazı
sırasında yapılan tedavisin yetersiz kalmasıdır.
292
Yaralanmanın ilk saati içinde acil bakım gereksinimi olan hastaların aksine, toraks
travmalı çoğu hasta nonoperatif olarak başarılı bir şekilde tedavi edilirler. Toraks
travmasının %10 oranında bir mortalite oranı vardır ve tedavi genellikle nispeten basit
ve başarılı olmaktadır (5). Hastaların çoğu gecikilmeden yapılan bir resüsitasyonun
sonucu olarak hayatta kalırlar. Etkin tanısal testler ve basit terapötik manevralar çok
yararlıdır. Acil operasyon künt travması olan hastalarda %0.5 ve penetran travması
olan hastalarda %2.8 oranında gerekli olmaktadır (6). Fakat toraksın acilen
eksplorasyonu gereken hastalar için künt travmada %67, penetran travmada ise %17
oranında ölüm görülmektedir (7). Travmadan sonra çok önemli olan ilk saatler
içerisinde uygun tedavinin başlatılması ve konservatif tedavi edilecek hastalarla acil
cerrahi girişim gerekecek hastaların doğru şekilde seçilebilmesi çoğu hastanın
hayatta kalmasında önemli rol oynar.
Toraksın alt sınırını oluşturan diyafragma gövdeye yönelik olan travmalarda sıklıkla
yaralanmaktadır. Diyafragmanın deri üzerindeki izdüşümü önde umbiliculus ve meme
başı (dördüncü interkostal aralık) ve arkada skapulanın alt ucudur. Diyafragma
T8’den L1’e kadar uzanır. Ekspirasyonda diyafragma meme başı ve T5 seviyesine
kadar yükselir. Göğsün üst sınırı toraks çıkımının üst kenarına uzanır ve genellikle
boyunda zon I olarak adlandırılır. Bu zon krikotiroid membrandan sternal çentiğe kadar uzanır. Özellikle penetran travmada göğüsün her iki kenarındaki yaralanmaların
kompleks yaralanmalara yol açması olasılığı fazladır. Ayrıca hemotoraks
ekstratorasik yaralanmanın sonucu da olabilir.
Toraks ayrı vücüt boşluklarına ayrılır: plevra boşluğu, perikard ve posterior
mediyasten. Bu kaviteler yaralanmanın sonucu olarak kolayca periton ye servikal
yapılarla ilişkili hale gelebilirler. Plevra ve perikard içine hemorajiye yanıt olarak
fizyolojik cevap dramatik olarak farklıdır. Erişkinde her bir plevra boşluğu 3 L’ye kadar
kan toplayabilir. Bu fazla volüm kaybı hızla class IV hemorajik şok ve kansız kalmaya
yol açabilir (Tablo 24.1). Buna karşıt olarak perikard akut olarak venöz dönüş ve
diyastolik doluş bozulmadan sadece 100–200 mL kan toplayabilir. Bundan fazlası
kardiyak tamponat ve şoka neden olur.
Göğüs duvarının ve plevranın bütünlüğü solunum fonksiyonu için önemlidir. Negatif
intraplevral basınç, toraks kas-iskelet sisteminin koordineli fonksiyonu ve açık bir
havayolu, respirasyon için şarttır. Havayolu obstrüksiyonu veya yaralanması,
pnömotoraks, hemotoraks ve önemli bir flail chest hızlı bir şekilde tedavi edilmedikçe
293
yaşamı tehdit eden yaralanmalardır. Travmatik bir göğüs duvar defektiyle ilgili olan
açık bir pnömotoraks ciddi bir şekilde spontan respirasyonu bozar; eğer defekt trakea
kesit yüzeyinin üçte ikisinden daha büyükse hava akımı trakeadan değil göğüs
duvarındaki defektten gerçekleşir.
Bulgu
Kan kaybı (mL)
Class I
<750
Kan kaybı (%)
<15%
Nabız
Kan basıncı
Solunum hızı
İdrar çıkışı
(mL/hr)
Mental durum
Sıvı replasmanı
<100
Normal
14-20
>30
Class II
7501500
15%30%
>100
Normal
20-30
20-30
Class III
1500-2000
Class IV
>2000
Tablo
30%-40%
>40%
Kan
>120
Azalmış
30-40
5-15
>140
Azalmış
>35
Yok
24.1:
kaybının
Vital
Bulgular
a Etkisi
Huzursuz Huzursuz Konfüze
Letarjik
Kristaloid Kristaloid Kristaloid/kan Kristaloid/kan
(70 kg
erkek
hastada)
Resim 24.1: Çoklu kaburga kırığı, akciğerde kontüzyon ve mediyastende itilmesi
olan künt travma hastası
Künt travmalar motorlu araç kazaları, düşme, çatışmalar, spor, ezilme veya
patlamaya bağlı yaralanmalar neticesinde oluşur. Künt yaralanmanın şiddeti kinetik
enerjiyle doğru orantılıdır.
294
Pulmoner kontüzyon en sık görülen künt toraks travmasıdır ve alveoler hemorajinin
genişliği ve akciğer parankim hasarınının büyüklüğü doğrudan künt göğüs duvar
hasarının büyüklüğüyle orantılıdır. Künt travma iskelet kırıklarına neden olabilir bunlar
da keskin parçaları vasıtasıyla altta bulunan iç organları yaralayabilirler (Resim 24.1).
Direkt darbe olmaksızın da önemli künt yaralanma doğabilir. Patlama (“blast”) ba-sınç
dalgasından kaynaklanan hasar tercihen gaz içeren organları etkiler: barsak, kulak
zarı ve akciğer. Şok ve hipoksi patlama hasarında karakteristik klinik yanıtı oluşturur..
Akciğer özellikle duyarlıdır ve barotrama acil ve yaşamı tehdit eden akciğer ödemine
neden olur. Patlamaya bağlı dolaşım şoku yapılan bir hayvan modelinde akciğer
hemorajisi ventilasyon-perfüzyon dengesizliğine ve özel bir kardiyojenik şok tipine yol
açmıştır. Bu şok tipinde kompansatuar vazokonstrüksiyon olmaksızın miyokard
depresyonu primer patofizyolojik süreçtir.
Torsiyon ve rotasyonel güçlerin sonucu olarak ek yaralanma görülebilir.
Deselerasyon veya kuvvete yanıt olarak membranöz yapışıklıklarla yerinde tutulan
organlar mediyastendeki fiksasyon noktasından kopabilirler. Aort istmusu, ana bronş,
diyafragma veya atriumların yaralanması tipiktir. Erken sağkalım mediastinal
plevranın bütünlüğü ve kuvvetiyle ilgilidir.
Nadir bir yaralanma mekanizması künt travmadan sonra viseral rüptür veya valvüler
yırtılma olduğunda görülebilir. Künt darbeyle beraber içi boş bir organ sabit hacimde
kapalı bir boşluk halindeyse intraluminal güçler yoğunlaşır. Tahminen glottisin
kapanmasından sonra trakea veya özofagus yırtılabilir. Veya kalp damarları ve
subvalvular organlarda yırtılmalar olabilir.
Benzer travmalara yanıt kişisel değişiklilikler gösterebilir. İmmatür kemikler daha az
kalsifiyedir ve daha esnektirler. Erişkinlerle karşılaştırıldığı zaman çocukların major
künt travmadan sonra kemik yaralanması insidansı daha azdır. Çocuktaki bir kaburga
kırığı şiddetli bir hasarının belirticisidir ve künt aort yaralanması hemen daima
kaburga kırığı olmaksızın görülür. Erişkinlerde motorlu araç kazalarından sonra künt
aort yaralanması olguların yaklaşık %50’sinde kaburga kırığıyla birlikte görülmektedir.
Yaşlılarda, izole kaburga kırıkları ve görece tehlikesiz viseral yaralanmalar bile
anlamlı solunum yetmezliği ve ölüm riskine neden olabilir. Çünkü fizyolojik rezerv
azalmıştır ve komorbid hastalıklarda mevcut olabilir (örn. KOAH, kalp yetmezliği).
Ayrıca farklı solid organlar farklı mimarilerine bağlı olarak aynı şiddette künt bir
295
travmadan farklı etkilenebilirler. Kalp, dalak veya karaciğerdeki künt kuvvetin hemen
hemen iki katına dayanır.
Penetran yaralanma merminin trasesindeki anatomik yapıların laserasyonuna yol
açar. Bıçak ve mermi yaralanmaları en sık görülen yaralanmalardır. Bıçak yaralanması bıçağın uzunluğu ve yara derinliğiyle ilgilidir. Merminin sekmesi mermi yaralanmasının lokalizasyonunu değiştirebilir. Ancak toraksta mermi trasesindeki büyük
sapmalar nadirdir ve beraberinde kemik fraktürü olmaksızın da görülmez. Merminin
kinetik enerjisi ağırlığına ve hızına bağlıdır. Bu enerji dokuları parçalar ve merminin
yolu çevresinde bir kavite oluşturur. Yakın mesafe merme yaraları daha yıkıcıdır.
Çünkü ilk enerjinin az bir kısmı hava sürtünmesiyle kaybolmuştur. Yüksek hızlı askeri
mermiler (>3000ft/sn) düşük hızlı mermilere (<500 ft/sn) göre 36 kat daha fazla yıkıcı
etkiye sahiptir.
ŞOK VE RESÜSSİTASYON
Şok, dokulara oksijen sağlanmasında yetersizliğe ve organ fonksiyonunda
bozulmaya yol açan perfüzyon azalmasıdır. Travmadan sonra erken şok genellikle
hemorajinin ve sonra da hipovoleminin sonucudur. Kalp tamponadı veya tansiyon
pnömotorakstan sonra kompresif şok, kalbin perikard veya toraks sınırları içine mekanik kompresyonuyla görülebilir. Daha az görülebilen kolaylaştırıcı faktörler, sempatik tonüsün kaybı nedeniyle oluşan miyokard yetmezliği ve nörojenik şoktur.
Hemorajik şoka fizyolojik yanıt iyi bilinir. Cevabın büyüklüğü hemorajinin hacmine
bağlıdır (Tablo 24.1). Kan basıncında azalma, taşikardi ve vazokonstrüksiyonla birlikte sempatik aktivitede artışa yol açar. Dakikalar içinde nöroendokrin cevap epinefrin ve nöroepinefrin sekresyonuyla başlar. Deri, böbrekler, iç organlar ve iskelet
kasları ve akciğerdeki direnç (“capacitance”) mikrodamarlarının büzülmesi, kanın
merkezi yapılara kaymasına neden olarak etkin kan hacmini artırır. Bu artmış santral
kan hacmi, taşikardi ve artan miyokard kontraktilitesi kardiyak output artışına neden
olur ve kompanse şok durumu yapar. Ayrıca anterior hipofizden adenokortikotropik
hormondaki ani artışa yanıt olarak, dolaşımdaki kortizolde bir artış vardır. Kortizol
seviyeleri 48 saate kadar yüksek kalır ve bu doku katoblizmasından sorumludur.
Kortizol yara iyileşmesi ve glukoz ve akut faz proteinlerinin hepatik sentezi için
gereken substratları sağlar. Strese karşı nöroendokrin yanıt tuz ve su atılımını da
modifiye eder. Aldosteron ve antidiüretik hormonun her ikisi de idar volümü ve
296
sodyum reabsorbsiyonunun azalmasına yol açar, bu da sıvı ve sodyum retansiyonu
yapar. Glukagon düzeyleri artar ve insülin düzeyleri düşer, bu durum hepatik
glukoneogenezi gösterir. Eğer hastada komplikasyon yoksa, bu katabolik faz 2–6 gün
sürer ve ardından uzun süreli bir pozitif nitrojen dengesinin olduğu anabolik periyot
başlar. Beraberinde de su ve tuz normalizasyonu vardır.
Yaralanmaya hücre yanıtı hipoperfüzyon ve oksijen sağlanmasında azalmanın bir
sonucudur. Oksijen miktarı, hücresel gereksinimin altındadır. Hipoksemi anaerobik
metabolizmayı ve laktat üretimini başlatır. Devam eden tedavisiz hipoperfüzyonla
prekapiller sfinkterler yetmezliğe düşer ve hücre membran fonksiyonu bozulur.
Hücresel asidoz ve şişme görülür ve hasta resüsitasyona daha çok dirençli duruma
gelir. Eğer hızla düzeltilmezse bu durum ölüme yol açar.
Resüsitasyonun sonucu olarak perfüzyon iskemik dokuların mikrodolaşımını eski
durumuna getirir ve reperfüzyon hasarı başlar. Reperfüzyon hasarı ve lökosit
kaynaklı inflamatuar siklüsün aktivasyonunun sistemik inflamatuar yanıt sendromu
(SIRS) gelişimi ve posttravmatik organ yetmezliği için önemli olduğuna inanılır. Bu
hasar inflamatuar medyatörlerin kademeli sırasıyla yükseltilir: kompleman sitokinleri,
koagülasyon kademe proteinleri, kininler ve prostoglandinler. Serbest radikaller
normalde sağlıklı hücreler tarafından temizlenirler. Hasar durumunda iskemik
hücrelerde lipidler hücre membranını bozmaya yetecek kadar uzun süre kalırlar. Aktif
nötrofiller daha sonra hasar görmüş olan endotel hücrelerine yapışırlar. Bu da
mikrovasküler tromboz, ödem ve daha fazla iskemiye yol açar. SIRS hasar tarafından
başlatılır ve şiddetli travma için normal bir kompansatuar mekanizma olarak
düşünülmektedir. Ancak SIRS’ın yararlı etkisi özellikle acil serviste, ameliyathanede
veya cerrahi yoğun bakım ünitesinde tedavinin geç fazı sırasında ilave bir hasar
ortaya çıkarsa aşırı ve disfonksiyonel hale gelebilir.
Hemorajik şok tedavisinde hemoraji ve dolaşımdaki kan hacminin yeniden
şekillenmesi gerekir. Havayolu güvene alındıktan ve ventilasyon sağlandıktan sonra
olası hemoraji kaynaklarının araştırılması ve volüm resüsitasyonu birlikte yapılır.
Hipotansif hastalarda, 1–2 L ısıtılmış laktatlı Ringer solüsyonu infüzyonu yapılır ve
alınan yanıt gözlenir (Tablo 24.2).
Geleneksel 3:1 kuralına göre tahmin edilen kan kaybının üç katı kadar daha fazla
kristalloid verilir. Eğer kan basıncındaki düzelme minimal veya geçiciyse o zaman
hemoraji genellikle anlamlıdır ve ilave kristalloid infüzyonu verilirken kan transfüzyonu
297
düşünülür. Eğer total kan hacminin %25’inden daha fazla kan kaybı olduğu
düşünülüyorsa o zaman transfüzyon önerilir.
Vital bulgular
Tahmini kan kaybı
Daha çok kristaloid
gereği
Kan gereksinimi
Operatif girişim
gereği
Hızlı Yanıt
Geçici Yanıt
Normalleşir
Geçici düzelme
Minimal (<20%) Orta ve devam ediyor
(20%–40%)
Düşük
Yüksek
Cevap yok
Anormal kalır
Şiddetli(>40%)
Düşük
Belki
Acil
Yüksek
olasılık
Orta - yüksek
Olasılık var
Yüksek
Tablo 24.2: İlk verilen Sıvı Resüsitasyonuna Yanıtlar (Erişkinde 2000 Ml Ringer
laktat; çocuklarda 20 mL/kg Ringer Laktat bolus)
Tipik olarak bir travma protokolü 10 U kan ve beraberinde 4 U taze donmuş plazma
ve 6 U trombosit içerir. Hedef hemoglobin konsantrasyonu 7-9 g/dl arasında veya
>10 g/dL olabilir.
Aktif hemorajinin hemen kontrolünün avantajı tartışılmaz. Letal triad olarak bilinen
koagülopati, asidoz ve hipotermi hızla ölüme yol açabilir. Koagülopati taze donmuş
plazma ve banka kanı trafüzyonuyla tedavi edilir. İlaveten doku faktörüne bağlanarak
trombin oluşumunu başlatan rekombinant faktör VIIa koagülopatisinin düzeltilmesinde
yararlıdır. Acil departmanında torakotomi, pulmoner traktotomi ve nonanatomik
rezeksiyon yapılabilir.
Sağlam bir distal sirkülasyonun olması, beraberinde nabızların ve sıcak pembe renkli
ektremitelerin olması hipovolemik şoku ekarte eder. Ancak kan basıncının, nabzın ve
idrar çıkışının düzelmesi şokun geçtiğini göstermez. Buna kompanse şok denir.
Hipoperfüzyon ve hücresel asidozun klinik belirteçleri serum laktat ve baz açığıdır.
Serum laktatı hipovolemik şokta artar ve artan seviyeler artan ölüm riskiyle doğru
orantılıdır. Ayrıca laktat düzeylerini normale getirmek ne kadar uzun sürerse prognoz
da o kadar kötü olmaktadır. Arter kan gazı analiziyle hesaplanan baz açığı da
yaralanmanın şiddeti ve ölüm riskiyle paralellik gösterir. Genellikle serum laktat
seviyelerini yansıtır. Kolayca uygulanabilen, ucuz ve resüsitasyonun yeterliliği
hakkında önemli fizyolojik bilgi sağlayan bir yöntemdir.
Şokun geleneksel serum belirteçlerine ilaveten, dolaşım durumunun noninvaziv
monitörizasyonu için daha yeni teknikler yaralanmanın ilk tedavisi sırasında uygu298
lanma potansiyeline sahiptir. Kardiyak output, serum laktat ve mukoza pH ölçümü için
kullanılan torakal elektrik biyoimpedans monitörleri ve doku oksijeni ve karbon
diyoksit basıncının transkütanöz ölçümü acil serviste uygulanabilir. Bunlar geleneksel
kan basıncı, nabız hızı ve idrar çıkışı veya metabolik asidozun serum
indikatörlerinden daha duyarlı olacaklar ve bundan dolayı şok durumun saptamak ve
şoktan sakınmak için yararlı olacaklardır.
Hikaye ve Fizik Muayene
Doğru öykü ve muayene çok önemlidir. Entübe ve sargılı hastayı muayene zor
olabilir. En azından AMPLE hikayesi alınmalıdır: Allerji, sık kullanılan Medikasyonlar
(ilaçlar), Past illness/pregnancy (son hastalık/gebelik), Last meal (son öğünü) ve
Events related to injury (yaralanmayla ilgili olaylar).
Yaralanma senaryosunun yeniden canlandırılması önemli olabilir. Bazı araç kazaları
farklı yaralanma kalıpları gösterir. Önden darbeli kazalarda patognomonik olan eğik
direksiyon simidi, ağır bir künt travmanın göğüs duvarı, akciğerler, kalp ve aort
istmusuna gelmiş olabileceğini düşündürür. Yandan alınan darbelerde ve otomobille
yayaya vurulması durumunda solid üst abdomen organlarına hasar olasılığı artmıştır
ve ayrıca künt aort rüptürü olabilir. Araçtan dışarı fırlama ve araçta başka bir
yolcunun ölmüş olması hikayesi ölümcül çoklu travmayı gösterir.
Diğer sık görülen künt travma mekanizmaları yüksekten düşmeler, ezilme tarzında
yaralanmalar, saldırıya uğrama ve spor yaralanmalarıdır. Spor aktiviteleri sırasında
göğse olan künt travma commotio cordis ve ani ölüme neden olabilir. Hikaye çok
önemlidir çünkü fizik bulgular genellikle yoktur.
Penetran yaralanmanın özellikleri önemli olabilir. Bıçağın veya objenin çapı, saldırı
sırasındaki pozisyon, ateşleme veya darbe sayısı önemlidir. Bu bulgu genellikle
müphem ve güvenilmezdir. Fakat nadiren yaralanmanın anatomik kapsamı hakkında
değerli bilgiler verebilir.
Acil servise başvuru sırasında fizik bulgular alınmalı ve sahadaki bulgularla
karşılaştırılmalıdır. Başvuru sırasındaki vital bulgular kan kaybının anlaşılmasına
yardım edebilir. Kural olarak derin hipotansiyon ve deprese duyusal durum, nörolojik
hasar veya nörojenik şoktan ziyade torasik veya abdominal hemorajiyi gösterir. Kalp
hızı ve kan basıncının hemodinamik yanıtları sık aralıklarla ölçülmelidir. Sağlam
periferik nabızlar ve dolaşımı iyi ekstremiteler normovolemik durumu gösterir. Erken
299
resüsitasyon yanıtı, hemorajinin miktarının tahmin edilmesinde ve operatif girişim
gereksinmesinin saptanmasında önemli bir unsurdur.
ABC (havayolu, solunum ve dolaşım) için değerlendirme ve tedavi ilk değerlendirmeyi
oluşturur. Solunum hızını gözlerken ventilasyon muayenesi yapılır ve göğüs duvarı
ve diyafragma hareketleri değerlendirilir. Eğer stridor varsa maksillofasiyal veya
trakeal yaralanma olasıdır. Havayolunun kopması servikal penetran yaralanma veya
subkutan amfizemden havanın kaçışıyla aşikar hale gelebilir. Hemoptizi genellikle
travmadan sonra minördür ve parankimal akciğer veya trakeobronşiyal yaralanmayı
gösterir. Masif hemoptizi (>500 mL) nadiren major pulmoner vasküler yaralanmayla
görülebilir. Nadiren masif tarzdaki bir ezilmeye bağlı travmatik asfiksi görülebilir.
Travma süperior vena kavanın geçici kompresyonuna veya künt kardiyak rüptüre
neden olabilir. Çoğunlukla üst vücut pletorası, peteşi ve ödemle karakterlidir. Emici
bir göğüs yarası ve eşlik eden pnömotoraks ventilasyonu bozar.
Her iki akciğer alanı hava girişi ve solunum seslerinin varlığı açısından oskülte edilir.
Pnömotoraks veya hemotoraksın tanısı kliniktir. Kaza yerinde veya eğer hastanın
durumu anstabilse göğüs tüpü dekompresyonu sıklıkla radyolojik doğrulama
yapılmadan önce uygulanır. Oskültasyonda solunum seslerinin alınamaması anormal
plevra havası veya kanın varlığını %95 oranında gösterebilir.
Acil serviste hastanın durumu stabil hale getirilince dikkatli bir sekonder araştırma
yapılır. Flail segment, krepitans, yumuşak doku kontüzyonu veya kosta, sternum veya klavikula deformitesi açısından bütün göğüs duvarı palpasyonu yapılır. Eğer dört
veya daha fazla kaburganın en az iki yerden fraktürü veya dislokasyonu varsa veya
göğüs duvarının inspirasyon sırasında paradoks hareketi varsa flail chest düşünülür.
Sternum fraktürleri veya dislokasyonlar genellikle noktasal hassasiyet verirler.
Sternoklaviküler eklemdeki fraktürler veya dislokasyonlar için daha sık görülen
anterior dislokasyon, klavikula başının çıkıntılı olmasıyla veya posterior
dislokasyonda cep deformitesiyle torasik inlet yapılarının kompresyonuna neden olabilir.
Hematomlar özellikle torasik girişte yerleşmiş bulunanlar belirlenebilir ve ölçülebilir.
Periferik nabızlar dikkatle incelenir. Künt aort yaralanması veya diseksiyon
sonrasında bir psödokoarktasyon sendromu olabilir. Karotis pulsasyonları ve
genişlemiş boyun venlerine dikkat edilir. Kalp oskültasyonu yapılır ve bazen Beck
triadı (kalp seslerinin boğuk oluşu, boyun venlerinin distansiyonu ve hipotansiyon)
300
mevcuttur ki bu bulgular kalp tamponadını düşündürür. Pulsus paradoksusun olması
(insprasyonda sistolik arter basıncının >10 mmHg düşüşü) da kardiyak tamponadı
düşündürür. Ancak tansiyon pnömotoraks veya intratorasik basınçta artmaya neden
olabilecek herhangi bir mekanizma da benzer şekilde kendini gösterebilir. Ayrıca
aksilla ve sırt da dikkatle muayene edilmelidir. Böylece küçük bir penetran yaralanma
da gözden kaçmamış olur. Göğse nafiz penetran bir objenin ameliyathanede
çıkarılması daha uygundur.
İLK DEĞERLENDİRME
Yatakbaşı İşlemler
Havayolu güvenceye alınır ve solunum sağlanır. Eğer ventilasyon uygun değilse
orotrakeal entübasyon yapılır. Eğer önemli bir maksillofasiyal travma veya havayolu
obstrüksiyonu varsa havayolu sağlamak için krikotiroidotomi yapılabilir (Resim 24.2).
Eğer servikal trakeaya künt bir travma kuşkusu varsa, orotrakeal entübasyon fleksibl
bir bronkoskop üzerinden yapılır. Bir diğer alternatif acil perkütan trakeostomi
yapmaktır. Major bir patlama yaralanmasından sonra alveol yırtığını minimize etmek
için aşırı pozitif basınçlı ventilasyondan sakınılmalıdır.
Geniş çaplı bir kateter ile (16 gauge) damar yolu açılır. Eğer major bir venöz
yaralanmadan kuşkulanılıyorsa giriş abdominal yaralanmanın proksimalinde veya
toraks venöz yaralanmasının kontralateralinden açılmak suretiyle sıvının periton veya
plevra içine ekstravazasyonundan sakınılmalıdır. Subklavyan veya internal juguler
santral venöz kateter tercih edilir ve santral venöz basıncın arttığı durumlarda
myokardial kontüzyon düşünülür.
Kalp hızı ve ritmi sürekli elektrokardiyografik (EKG) monitörizasyonla gözlenir.
Penetran kardiyak travma durumunda normal sinüs ritmi iyi bir pronoz bulgusudur.
Künt travma bağlamında EKG anormallikleri (dal bloğu, ST segmentinde > 1 mm değişmeler, Q dalgaları, anormal QT intervali ve patolojik T dalgaları) veya aritmi (prematüre atrial veya ventriküler kontraksiyonlar) kardiyak kontüzyonu olan çoğu
hastada mevcuttur. EKG anormalliğinin şiddeti, ventriküler disfonksiyon derecesi ve
serum troponin-1 düzeyi arasında bir paralellik vardır. Ventriküler fibrilasyon ve
kardiyopulmoner arrest commotio cordis’e işaret eder. Nabızsız agonal
301
idiyoventriküler ritim veya asistoli genellike uzamış bir arrest veya onarılamaz hasarı
gösterir.
Resim 24.2: Krikotiroidotomi tekniği. Krikotiroid membran üzerinde transvers bir deri
insizyonu yapılır. Daha sonra membran bir bistüriyle insize edilir. Membrandaki
insizyon künt şekilde ayrılır ve bir trakeostomi tüpü yerleştirilir.
Foley kateteri yerleştirilir ve idrar çıkışı monitörize edilir. 1 mL/kg/saat’den daha fazla
idrar çıkışı doyurucu bir kardiyak output ve doku perfüzyonunu gösterir. Nazogastrik
bir tüple gastrik drenaj sağlanır ve pulmoner aspirasyon önlenir. Böylelikle
diyafragmanın bütünlüğü veya mediastenin durumu hakkında da bilgi edinilebilir.
Bir göğüs tüpü yerleştirilmesi tipik olarak beşinci interkostal aralık seviyesinde
toraksın lateralinde yapılır (Resim 24.3). Cilt temizliğinden sonra lokal anestezik
uygulanır ve de özellikle subdermal bölgeye, kaburganın posterioruna ve plevraya
verilir. Küçük bir cilt kesisi (2 cm) anterior aksiller hattan açılır. Erkeklerde pektoralis
major kasının hemen laterali, bayanlarda lateral meme kıvrımının laterali kullanılır.
Eğimli bir klemple interkostal aralık künt bir şekilde disseke edilir ve plevraya
kaburganın üst kısmından dikkatle girilir. Plevra boşluğuna akciğer yapışıkıklarının
olmadığını anlayabilmek için parmak sokulur ve daha sonra bir göğüs tüpü (28-32 Fr)
plevra aralığında posterior ve süperior pozisyonda yerleştirilir.. Tüp iyi
yerleştirilemezse akciğer hasarı, pnömotoraksın veya hemotoraksın iyi drene
302
edilememesi, tüp çıkarıldıktan sonra pnömotoraks veya ampiyem gibi
komplikasyonlar doğabilir. Bu komplikasyonların hepsi önemli bir morbidite ve uzamış
hastanede kalış nedenidir. Bu nedenle göğüs tüpünün yerleştirilmesinin tekniği
önemlidir.
Resim 24.3: Göğüs tüpü yerleştirme tekniği. A, Beşinci interkostal aralıkta toraks
lateral, anterior aksiller hatta ve pektoralis major ve meme lateralinde göğüs tüpü
yerleştirme. B. Deri insizyonu yapılır ve keskin, eğrı bir klemp kullanılarak interkostal
kaslar künt bir şekilde ayrılır ve plevra aralığına kaburganın üst kenarından girilir. C.
Yarayı muayene etmek için bir parmak içeri sokulur ve anlamlı plevra adhezyonları
ekarte edilir. D. Plevra aralığına bir göğüs tüpü yerleştirilir. Tüpe eğimli bir klemp
posterior ve sefalik yönde kılavuzluk eder. Göğüs tüpü deriye dikilir ve plevra drenaj
sistemine bağlanır.
İlk drene olan kan miktarı hava kaçağının miktarıyla beraber not alınır. Masif, devamlı
hava kaçağı veya önemli miktarda hemoraji torakotomi endikasyonudur. Torakotomi
öncesi plevral kan miktarıyla ölüm riski arasında direkt bir ilişki vardır. Boşaltılamayan
303
bir hemotaroks için ikinci bir göğüs tüpü yerine video yardımlı torakoskopi ve
operasyonla boşaltma tercih edilmelidir.
Tanı Testleri
Rutin arter kan gazı analizi, tam kan hücre sayımı ve kan kimyası değerlerinin hepsi
radyal veya femoral arterin kanülasyonundan önce elde edilmelidir. Özellikle
mültitravma hastalarında ve birçok tanısal test uygulanacak olan hastalarda radyal
arter kateterleri tercih edilir (Tablo 24.2).
Arter kan gazı analizi, ventilasyonun kalitesi hakkında daha ileri düzeyde bilgi
verecektir. Solunumun klinik olarak muayenesi çok önemlidir. Hipoksi veya
hiperkarbinin tanınması mekanik ventilasyonu gerektirebilir. Serum pH ve baz açığı
şokun derecesi ve resüssitasyonun kalitesiyle ilişkilidir. Derin veya persistan asidoz
(pH<7.2 veya baz açığı >112 mEq/L) veya serum laktat seviyesini normalize etmede
yetersizlik (normal laktat < 2 mmol/L) dekompanse şoku ve yüksek mortalite oranını
gösterir.
Kan crossmatch ve rutin kan analizi için gönderilir. Tam kan sayımında serum
hematokrit değeri akut kan kaybının miktarını veya resüsitasyona yanıtı tahmin
etmede sınırlı bir role sahiptir. Kimyasal analiz, eğer kalp yaralanmasından
kuşkulanılıyorsa, volüm infüzyon ve serum troponin seviyelerini saptama sırasında
elektrolit dengesini doğrulamada önemlidir. Normal serum troponin-1 değeri (<1.05
µg/L) kalp kontüzyonunu ekarte ettirir. Artmış troponin-1 düzeyi direkt olarak aritminin
şiddetiyle ilişkilididr ve ventrikül disfonksiyonunun derecesini gösterir.
Göğüs filmleri travma hastalarında çok önemli tanısal değere sahiptir. İstisnaları acil
cerrahi gereken ölmek üzere olan hastalar ve radyolojik doğrulama yapılmasına vakit
olmayan aşikar pnömotoraks, hemotoraks ve tansiyon pnömotoraksı olup da derhal
göğüs tüpüyle dekompresyon yapılmasına ihtiyaç duyan hastalardır. Göğüs filmleri
yaşamı tehdit eden durumların tanısında paha biçilmezdir (tansiyon pnömotoraks ve
hemotoraks, diyafragma rüptürü, yelken göğüs, akciğer kontüzyonu, mediastinal
hemoraji ve pnömomediasten gibi).
Göğüs filmlerinin değerlendirilmesi sistematik olmalı ve plevra, diyafragma, akciğer
parankimi, mediasten, kemik yapılar ve yerleştirilmiş tüp ve kataterler
değerlendirilmelidir.
304
Pnömotoraks başlangıçta hafif olabilir ancak travmadan saatler sonra göze çarpan
şekilde belirginleşebilir. Bazen düz filmlerde görülmezken sadece BT ile kendini
gösterebilir. Sıklıkla travmatik pnömotoraks aşikardır ve mediasten kaymasıyla
beraber tansiyon pnömotoraksa ilerleyebilir. Masif pnömotoraks söz konusuysa
trakeobronşiyal yaralanma düşünülmeli ve düşmüş akciğer bulgusu (fallen lung sign)
veya ana bronşun kesilmesi bulgusu (bronchial cut-off sign) veya her ikisi birden
radyolojik olarak saptanabilir.
Tablo 24.2: Tanısal Testler
Test
Transösofajeal
ekokardiografi
Avantajlar
Taşınabilir
BT/BT
anjiyografi
Baş ve boyun
yaralanmaları dahil
birçok mültipl
travmalı hastada
geniş görüntüleme
sağlar
Anatomik detay,
perkütan terapötik
girişim
Anjiyografi
Tanı
Perikard efüzyonu,
kapak ve duvar
hareket
anormallikleri, künt
aort yaralanması
Hastanın transportu, Medyiasten
kontrast madde
hematomu, mermi
trajesi, fraktür,
damar yaralanması
Dezavantajlar
Deneyimli doktor
gerekir, bütün aort
ve brakiyosefallik
damarlar görülemez
Hastanın transportu,
kontrast madde,
deneyimli uzman,
yavaş
Damar yaralanması
Ayakta göğüs filmi hemotoraks veya hemopnömotoraksın tanısını kolaylaştırır.
Bunlarda kostofrenik sulkus görülmez ve sıvının bir tarafı içbükey diğer tarafı dışbükey olup mercek (meniscus) tarzında bir görüntüsü vardır. Ayakta bir filmi
yorumlamak zor olabilir ve plevral opasifikasyon az miktarda ve özellikle bilateral ise
gözden kaçırılabilir. Masif bir hemotoraks söz konusuysa intraplevral kan toplanması
mediasten yakınında havanın hapsolmasına neden olabilir ve bu da meniscus bulgusu veya kabuk bağlamış hemotoraks olarak bilinir (Resim 24.4).
Diyafragmanın radyolojik değerlendirmesi zor olabilir. Persistan elevasyon genellikle
intraabdominal bir patolojiyi; diyafragmada düzleşme ya da tersine dönme ise
tansiyon pnömotoraksı düşündürür. Travmatik diyafragma yaralanması nadiren
plevra boşluğu içine akut intraabdominal evantrasyon olarak kendini gösterir. Fakat
305
genellikle diyafragma kontüründe kayıp vardır veya hastaların çoğunda plevral
efüzyon bulunur.
Resim 24.4: Göğsün sağ tarafında ateşli silah
yaralanması. Akciğer parankiminden olan
kanama masif hemotoraks ve mediasten
arasındaki
havanın
hapsineErken
nedenbir
olur (medial
Akciğer parankiminin radyolojik muayenesi
kontüzyonu
gösterebilir.
meniskusdağılım
işareti).gösterir. Fakat büyük bir
kontüzyon akciğer parankimi içinde nonanatomik
pulmoner kontüzyon söz konusu olduğunda veya akciğer hematomu varsa akciğer
alanlarında belirgin bir opasifikasyon görülebilir bu da hemotoraks ile karışabilir.
Daha az görülen travmatik psödokistler bül veya bleblerle benzerlik gösterebilir.
Mediasten içindeki hasar havanın bulunması veya kanın damar dışına çıkışıyla
kendini gösterebilir. Pnömomediasten sıklıkla kendi kendini sınırlayan radyografik bir
anormalliktir ve alveol barotravması ve bunu müteakiben mediastene doğru oluşan
havanın diseksiyonu olarak düşünülür. Pnömomediasten ayrıca trakea, bronş veya
özefagus rüptürünü de işaret edebilir. Özellikle künt travmadan sonra havayolu
hasarı özofagus hasarından daha sıktır ve endoskopik muayene yapılmalıdır.
Mediasten hematomu künt aort travmasına işaret edebilir fakat sıklıkla omurga
fraktürü veya ilgisiz bir venöz yaralanma ardından da görülebilmektedir. Mediastenin
genişlemesi, aort topuzunun konturunun kaybı veya aort arkının görünmemesi, apikal
plevral kep, sol ana bronşun depresyonu, nazogastrik tüpün veya trakeanın sağa
deviyasyonu gibi bulgular aort istmusunda künt aort hasarını gösterir. Bu radyolojik
bulguların tanısal değeri görece düşüktür ve künt aort yaralanmasını saptama
açısından duyarlık ve özgüllüğü %50’den daha azdır. Torasik damar yaralanması
olan hastaların yaklaşık %20’sinde çıkan aortada veya major brakiyosefalik dallarda
yaralanma vardır. Olguların %44’ünde major bir vasküler yaralanmaya karşın göğüs
filmi normal görülebilir.
306
Kemik yaralanması açısından ilk gelişte çekilen göğüs filmi dikkatle incelenmelidir.
Genellikle non-deplase kaburga kırıkları, kostokondral ayrılmalar ve vertebra
fraktürleri ilk filmde gözden kaçırılabilir ve daha ileri çalışmalar gerekir. Birinci
kaburga fraktürü için ihtiyaç duyulan gücün yüksek olmasına karşılık genellikle
beraberinde vasküler yaralanma olmaz. İzole birinci kaburga kırığı ve yandaş major
vasküler hasar yaklaşık %3 oranında gözlenir. Çoklu travma ve birinci kaburganın
fraktürlü dislokasyonu ve beraberinde mediasten hemotamunun radyolojik
bulgularının olması daha ileri değerlendirmeyi gerektirir.
Farklı kataterlerin radyolojik pozisyonları önemli terapötik ve tanısal öneme sahiptir.
Endotrakeal tüp trakeanın ortasında ve karinanın üzerinde olmalıdır. Nazogastrik
tüpün mediasten içinde izlediği yolun sağ tarafa kayması mediasten hematomunu
gösterir. Eğer nazogastrik tüp diyafragma üzerinde kıvrılmışsa sol diyafragma
yaprağının rüptürü tanısı konabilir.
göğüs travması olan hastalarda sıklıkta bilgisayarlı tomografi (BT) uygulanmaktadır.
Bu teknikle BT anjiyo da yapılabilir. Dezavantajı iv kontrast madde kullanılmasıdır.
Özellikle künt mültipl travması olan hastalar mümkün olduğunca kafa ve abdominal
BT çekilerek değerlendirilmelidir. Mediastinal hematomun tanınmasında ve büyük
damarlara yakın olan bir hematomun değerlendirilmesinde BT’nin paha biçilmez
değeri vardır. Göğüs BT’si künt aort yaralanması için ideal bir tarama testi olup
prediktif değeri %100, sensitivitesi %100 ve spesifitesi %83’tür. Ayrıca BT anjiyografi
standart aortografiye benzer anatomik detayları gösterebilir, tanısal doğruluğu ise
ona eşittir. Ayrıca BT iskelet yaralanmaları, akciğer kontüzyonu, pnömotoraks,
hemotoraks ve hemoperikardiyumun saptanmasında da göğüs filminden daha
değerlidir. Nadiren BT künt trakea rüptürü, diyafragma rüptürü ve kalp
yaralanmalarını da tanıyabilir.
Transmediastinal yaralanması olan penetran travmalı hastalar tanısal zorluk taşıyan
bir başka gruptur. Mediasteni kat eden ateşli silah yaralanmaları toraksın vasküler
yaralanmasıyla ilgili olarak hastaların yarısında hemodinamik bir instabilite
oluştururlar. Persistan şok geçiren anstabil hastalarda acil operatif girişim gerekir.
Buna karşılık aşikar hemorajisi olmayan ve sistolik kan basınçları 100 mmHg’nın
üzerinde olan hastalarda güvenle tanısal değerlendirme yapılabilir. Kontrastlı BT
merminin trasesini, vasküler yapılara, trakea ve özefagusa yakınlığını ve
yaralanmanın anotomik kapsamını tanımlamaya yardımcıdır. Negatif BT bulgusu
307
yaralanma olmadığını gösterebilir; fakat eğer mermi bu yapılarla yakınlık gösteriyorsa
o zaman ikincil tanısal testler yararlıdır. Ajite ve entübe hastalarda fleksibl endoskopi
veya uyanık ve koopere hastada kontrast özofagografi yapılarak özofagus
yaralanması doğrulanabilir. Benzer olarak fleksibl bronkoskopi direkt görüş sağlar ve
havayolu hasarının tanısında ileri derecede doğruluğa sahiptir. Kompleks veya
tanısal olarak uğraşı isteyen olgularda formal aortografi vasküler yaralanmayı
göstermek için atılacak son adımdır ve olasılıkla endovasküler terapötik bir girişim
sağlar.
Abdomen ve toraksın ilk ultrason muayenesi ve beraberinde transtorasik ve
transözofageal ekokardiyografinin yapılması önemli bir ilk adımdır. Ultrasonografi
muayenenin hızı ve donanımın taşınabilir olmasından dolayı avantajlıdır. Travma
değerlendirilmesi için ultrasonografik muayene deneyimli travma cerrahları tarafından
veya acil doktorları tarafından yapılır. Dört standart ultrasonografik görüntü vardır;
bunlar pelvis, sol ve sağ üst kadranlar ve plevra boşlukları ve subksifoid perikard
boşluğudur.
Transözofageal ekokardiyogram acil serviste veya operasyon odasında yapılabilir.
Aort istmusu, çıkan aort ve kalp detaylı bir şekilde görülebilir. Kuşkulanılmamış kalp
yaralanmaları saptanabilir. Ancak daha periferik vasküler yaralanmalar, brakiyosefalik
dallar gözden kaçabilir. Transözofageal ekokardiyografi künt aort yaralanmasının
şiddetini tayin etmek için kullanılabilir. Grade 1 yaralanma sınırlı bir hematom veya
intimal fleptir. Konservatif olarak tedavi edilebilir. Grade 2 yaralanma subadventisiyal
rüptür olup yaralanma sonrasında tedavi edilebilir. Grade 3 yaralan-ması aktif
kanama veya obstrüksiyon olan aort kesisidir ve acil cerrahi gerektirir. De-neyimli
ellerde transözofageal ekokardiyografiyle güvenilir şekilde künt aort yaralan-ması
tanısı konabilir. Duyarlık %95 ve özgüllük %100’dir; doğruluğu anjiyografi ve BT
anjiyografiye benzer. Geleneksel invaziv tanısal testlerden (perikard penceresi, anjiyografi veya endoskopi) gelişkin ultrason ve radyografik tekniklere geçiş sayesinde,
mediastenin hem künt hem de penetran yaralanmalarında doğru bir görüntüleme
yapılabilmektedir. Tanısal testlerin seçimi tipik olarak yaralanmanın yerine ve
hastanın stabilitesine, ayrıca muayeneyi yapanın deneyimine bağlıdır.
308
Cerrahi Tedavi
Acil serviste yapılan torakotomi tanısal ve terapötik amaçlar taşır. Travmatik arrest
veya resüsitasyon sırasında arrest olmak üzere olan hastalarda kullanılır. Acil servis
torakotomisi sol anterior torakotomi vasıtasıyla yapılır. İnsizyon meme başının hemen
altından sternumdan başlayarak orta aksiller hatta doğru uzanır ve göğse dördüncü
veya beşinci interkostal aralıktan ulaşılır. İnen aort diyafragmanın hemen üzerinde
klemplenebilir. Bu şekilde beyin, kalp ve üst ekstremitelerin perfüzyonu düzeltilebilir.
Perikard insizyonu frenik sinirin anteriorundan yapılarak kalp görülebilir. Açık kalp
masajı yapılabilir. Kalp yaralanmaları, ventriküldekiler için dijital kompresyon yapılarak; atrium veya büyük damar yaralanmalar içinse klemp koyularak kontrol altına
alınır. Ardından sütürle onarım yapılır. Akciğer yaralanması varsa tüm hilus geçici
olarak klemplenerek hemoraji veya hava kaçağının kontrolü sağlanabilir. Sağ plevra
boşluğuna künt diseksiyonla perikardın anteriorunda girilir ve eğer ihtiyaç olursa
torakotomi, sternum vasıtasıyla uzatılarak Clamshell insizyona çevrilir. Sağ atrium
büyük iv kateterlerin yerleştirilmesi için uygundur.
Penetran kardiyak yaralanmalarda acil torakotomi başarılıdır. Özellikle kesici-delici
yaralanmalarda %50 oranında sağkalım elde edilebilir. Fakat aortun klemplenmesi
gereken veya idiyoventriküler ritmi olan hastalarda prognoz kötüdür.
İlk resüsitasyon sırasında operasyon kararları travma veya toraks cerrahları
tarafından verilmelidir. Travmatik kardiyak arrest ve arrest olmak üzere olan hastalar,
acil servis torakotomisinin tek endikasyonudur. Masif hemotoraks (toraks tüpünden
1000-1500 mL kanama) veya ilk saatte > 500 ml kanama olup bunun devam ediyor
olması veya saatler boyunca > 200 mL/saat kanama olması torakotomiyi zorunlu
kılar. Servikal veya mediastinal trakea veya ana bronş yaralanması acil endoskopi ve
operatif onarım endikasyonudur (Tablo 24.3).
Tablo 24.3: Operasyon Endikasyonları
Tanı
Yorum
Penetran göğüs travmasından sonra travmatik arrest Acil servis torakotomisi
Persistat şok
Resüsitasyon başarısız
Kalp yaralanması
Masif hemotoraks (>1500 mL, göğüs tüpünden)
Persistat hemotoraks (>500 mL ilk saatte veya >200 mL/saat, saatler boyunca)
Pıhtılaşmış hemotoraks
VATS
Masif hava kaçağı veya havayolu yaralanması
Ameliyathanede endoskopi
309
KAYNAKLAR
1. Peden M, Mcgee K, Sharma G: The Injury Chart Book: A Graphical Overview of
the Global Burden of Injuries, Geneva, World Health Organization, 2002.
2. American College of “Surgeons—Subcommittee on Trauma : Advanced Trauma
life Support Program for Doctors, ed. 7. Chicago, IL, American College of Surgeons,
2004.
3. Demetriades D, Murray J, Charalambides K, et al: Trauma fatalities: Time and
location of hospital deaths. J Am Coll Surg 2004; 98:20.
4. Harken DE, et al. A simple cervicomediastinal exploration for tissue diagnosis of
intrathoracic disease. N Engl J Med 1954;251:1041.
5. Kulshrestha P, Munshi I, Wait R: Profile of chest trauma in a level 1 trauma
center. J Trauma 2004; 57:576
6. Karmy-Jones R, Jurkovich GJ, Shatz DV, et al: Management of traumatic lung
injury: A Western Trauma Association multicenter review. J. Trauma 2001; 51:1049
7. Karmy-Jones R, Jurkovich GJ, Nathens AB, et al: Timing of urgent thoracotomy
for hemorrhage after trauma. Arch Surg 2001; 136:513
8. Fabian TC, Davis KA, Gavant AL, et al: Prospective study of blunt aortic injury.
Helical CT is diagnostic and antihypertensive therapy reduces rupture. Ann Surg
1998; 227:666.
310
25.
Prof. Dr. Refik Ülkü
Dicle Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
TRAKEOBRONŞİYAL YABANCI CİSİM ASPİRASYONLARI
Tarihçe
Yabancı cisim aspirasyonunun (YCA) insanlarda morbiditeye ve mortaliteye neden
olabildiği antik dönemden beri bilinmektedir. Yazılı tarihte aspirasyona ilişkin ilk olgu
MÖ 475 yılında üzüm çekirdeği aspirasyonu sonucu ölen Yunanlı şair Anacreon’dur
Aspirasyona ilişkin ilk bilimsel deneyin John Hunter tarafından 1781’de bir sığır
üzerinde yapıldığı bilinmektedir. Anestezi sırasında oluşan aspirasyonla ilgili ilk ölüm
olayı ise 1848’de Simpson tarafından bildirilmiştir. Katı maddelerin ve asit özellikteki
mide içeriğinin aspirasyonu sonucu gelişen klinik tablolar ilk kez 1946 yılında
Mendelson tarafından tanımlamıştır.
Trakeobronşiyal sisteme yabancı cisim aspirasyonu, özellikle çocukluk döneminde
ortaya çıkan hayati tehlikeye ve ciddi solunum problemlerine neden olan önemli bir
klinik tablodur. Özellikle üç yaşından küçük çocuklarda görülür. Erken tanı ve tedavi,
ciddi komplikasyonları önlemek açısından oldukça önemlidir.
Yabancı cisim aspirasyonları, yaş, cins, meslek, kültürel hayat, sosyo-ekonomik
durum, gelenek ve göreneklerle yakından ilgilidir. Özellikle gelişmekte olan ülkelerde
eğitim yetersizliği ve ihmal gibi nedenlerle yabancı cisim aspirasyonları sık görülür
.(1,2) ABD de insidansı 29.9/100000 olarak tahmin edilmektedir (3). Korunma, ilk
yardım ve endoskopik teknolojideki gelişmeler sayesinde son 10 yılda Amerika
Birleşik Devletleri’nde yabancı cisimden ölüm oranı %20 oranında azalmıştır. Buna
rağmen
1996
yılında
Ulusal
Güvenlik
Konseyi
raporunda
yabancı
cisim
aspirasyonundan günde 8’den fazla ölüm olduğu bildirilmektedir. ABD’ de yılda
yaklaşık 500 civarında yabancı cisim aspirasyonunun sebep olduğu ölüm vakaları
bildirilmekle birlikte, 12 aylıktan büyük infantlarda kaza ile ilgili ölümlerin %40’ına
yabancı cisim aspirasyonları neden olmuştur (4,5). Bir ile üç yaş arası çocuklarda
yabancı cisim aspirasyonlarının ölümcül kazalar arasında %7 oranında olduğu
bildirilmektedir (6.7).
311
YCA’nın her yaşta görülmesine karşın yetişkinlerde çocuklara göre azdır (8,9).
Çocukluk çağında ve sıklıkla 1–3 yaş grubu arasında görülürler. Çocukluk çağındaki
vakaların yaklaşık % 85 gibi büyük bir çoğunluğu 3 yaş altında görülür. Literatürlerin
çoğu erkek çocukların daha fazla yabancı cisim aspirasyonuna maruz kaldığını
göstermektedir. Bu oranın yaklaşık olarak 2/1 olduğu bildirilmektedir. Erkek
çocuklarda YCAnın daha sık görülmesinin sebebi olarak, daha aktif davranışlar
içerisinde bulunmaları gösterilmiştir (3). Bebek ve çocuklardaki yabancı cisim
aspirasyonlarının etyolojisinde; bu yaştakilerin etraftaki objelere ilgilerinin fazlalığı,
tanımak amacıyla ağızlarına alma eğilimleri, molar dişlerinin olmaması sonucu
çiğneme fonksiyonlarının yeterli olmaması, yemek yerken bağırıp ağlayabilmeleri ve
bu esnada ağız içerisinde bulunan besinleri aspire edebilmeleri ve hava yolunun
korunması ile ilgili noromuskuler mekanizmaların yeterince gelişmemiş olması
bulunmaktadır (10,11).
Trakeobronşiyal sisteme aspire edilen yabancı cisimler, trakeobronşiyal sistemin
anatomik dallanma yapısından dolayı genellikle sağ bronşiyal sisteme lokalize olurlar.
Sağ ana bronş sola nazaran daha kısa, daha geniş ve yönü trakeanın yönüne daha
yakındır. Çocuklarda ise ana bronş açıları ve boyutları erişkinlere göre birbirine
yakındır. Bu nedenle çocuklarda YCA’ları sağ bronşa bir miktar daha fazla kaçsa da
hemen hemen her iki ana bronşta eşit olarak görülürler (3,11,12).
Trakeobronşiyal yabancı cisimlerde tanının erken konulması ve gerekli müdahalenin
yapılması önemlidir. Erken dönemde yapılan müdahale ile yabancı cisim çıkartılırsa
komplikasyon gelişmez ya da müdahale sonrası uygulanacak konservatif tedavi ile
düzelebilen pulmoner değişiklikler olabilir (5). Erken dönemde tanı konulup gerekli
müdahalenin yapılmadığı olgularda ise tekrarlayan pnömoni, akciğer absesi ve
bronşektaziye kadar farklı komplikasyonlarla karşılaşılabilir (4). Distal bronş sistemine
kaçmış yabancı cisimlerin sessiz kalabileceği ve yine bu yabancı cisimlerin organik
yabancı cisimler olması halinde ciddi mukozal enflamasyon ve granülasyon dokusu
oluşturabileceği bildirilmiştir. Deneysel çalışmalar bronşa aspire edilen fıstığın
intrabronşiyal 30 gün kalmasının kartilaj destrüksiyonu fibrozis ve bronşektazi
oluşturabileceğini göstermiştir (13).
312
Klinik Ve Tanı
Trakeobronşiyal yabancı cisim aspirasyonu düşünülen vakalarda anamnez, fizik
muayene ve radyolojik muayene ile tanı konulur.
Çocuk yaşlarda tam bir anamnez almak mümkün olmadığı için genellikle şüphe ile
tanı konulur. Ancak çocuk yaşlarda özellikle aspirasyonu gören bir ebeveyn ya da
görgü tanığı aspirasyonun varlığı açısından önemli bir bağımsız faktör olarak
değerlendirilmiştir (14-17). Bu yüzden ebeveyn ya da çocuğun yanında bulunan
kişilerin dikkatli bir şekilde sorgulanması önemlidir.
Total ya da subtotal obstrüksiyon olgularına hastane ya da sağlık kuruluşlarından
ziyade daha çok sosyal yaşamda rastlanır. Tipik olarak hastanın öne eğilerek, trakea
çapını maksimum düzeye getirmeye çalışmasıyla tanınır. Korku, ajitasyon, senkop,
boğuk seslilik ( hoarseness),ses kısıklığı (afoni) el kol hareketleri ve ilerleyici siyanoz
görülebilir. Hasta inspiryum yapamaz. Bazen yemek yerken gıda maddeleri ile üst
solunum yollarının (genellikle hipofarinks düzeyinde) tıkanması ile boğulma
gerçekleşebilir. Genellikle kalp krizi ile karışıp bir lokantada meydana geldiğinden
‘cafe coronary’ olarak adlandırılır. Bu aspirasyon orta ve ileri yaşlarda, diş sağlığının
kötü olduğu hastalarda, alkol veya diğer ilaçların alımına bağlı sedasyon
durumlarında, çiğneme veya yutma mekanizmalarındaki bozulma koşullarında
artmaktadır. Böyle akut bir subtotal veya total hipofarenks obstrüksiyonu ile
karşılaşılırsa Heimlich Manevrası uygulanacak en emniyetli metoddur. Bu manevrada
hastanın arkasına geçen kurtarıcı bir elinin başparmağı midenin üst kısmına,
sternumun ksifoid bölgesinin altına gelecek şekilde yumruk yaparak koyar. Diğer eli
ile yumruk yapılan elini kavrar, karın bölgesine arkaya ve yukarıya doğru basınç
uygular. Bu 5 – 10 kez tekrarlanabilir. Böylece diafragma yukarı yer değiştirir. Böyle
bir uygulama ile yabancı cismin dışarı atılmasını sağlayacak kadar bir havanın
akciğer dışına çıkması zorlanmaktadır (Resim 25.1).
Bebeklerde Heimlich manevrası farklı şekilde uygulanır. Bebek ilkyardımcının bir kolu
üzerine ters olarak yatırılır, Başparmak ve diğer parmakların yardımıyla bebeğin
çenesi kavranarak baş-çene pozisyonu korunur. Boynu zedelenmeden tutulur ve
yüzüstü pozisyonda öne doğru eğilir; 5 kez el bileğinin iç kısmı ile bebeğin sırtına
kürek kemiklerinin arasına hafifçe vurulur. Daha sonra diğer kolun üzerine başı elle
kavranarak sırtüstü çevrilir, yabancı cismin çıkıp çıkmadığına bakılır. Çıkmadıysa
başı gövdesinden aşağıda olarak sırtüstü şekilde tutulur, 5 kez iki parmakla göğüs
313
kemiğinin alt kısmına kalp basısı yapılan noktaya eğik bir şekilde iki parmakla baskı
uygulanır (Resim 25.2).
Resim 25.1: Heimlich manevrasının erişkinde uygulanışı (33)
Resim 25.2: Heimlich manevrasının bebeklerde uygulanışı (34)
Yabancı cisim trakeada iken inspiratuar stridor ve öksürük nöbetleri gelişir. Dinleme
bulgusu olarak bu dönemde wheezing ya da solunum seslerinin azalması veya
tamamen duyulamaması saptanabilir. Yabancı cisim daha distale, bronşlara indiğinde
ise asemptomatik bir tablo ortaya çıkar. Yabancı cisim aspirasyonunda gelişen
öksürük, yabancı cismin bizzat kendisinin bronş içerisindeki hareketi, bronş duvarına
yaptığı irritasyon ve ödem ile ilgili olduğu kadar tıkanmanın distalinde neden olduğu
sekresyon birikimi ve enfeksiyöz olaylarla da ilgilidir. Öksürük başlangıçta spazmodik,
314
kuru ve irritatiftir. Nöbetler halinde gelir. Yabancı cisim bronşa yerleştikten sonra
öksürük şiddetini ve özelliğini kaybeder. Yabancı cisimin trakea ve ana bronşlara
yaptığı obstrüksiyona bağlı olarak dispne tabloya eklenebilir (2,18,19). Öksürük,
tıkanıklık, wheezing semptomlarından biri yabancı cisim aspirasyonu olgularının
%91’inde ortaya çıkmaktadır (20,21). Geç dönemde klinik tabloya akciğer enfeksiyon
bulguları hakim olur. Hasta bronkopnomoni, tekrarlayan bronşit atakları, akciğer
absesi, hemoptizi ve ateş bulguları ile hastaneye getirilebilir. Bu durum genellikle,
yabancı cisim aspirasyonlarının özellikle aile tarafından görülmediği veya öksürüğün
şiddetli olmadığı asemptomatik dönemde doktor tarafından atlandığında ortaya çıkar.
Fizik muayenede takipne, stridor, wheezing, interkostal çekilmeler, solunum
seslerinin azalması veya tamamen alınamaması, ateş, sibilan ral/ronküs saptanabilir.
Çok
sık olmamakla birlikte
yabancı cisim
aspirasyonlarında,
pnomotoraks,
pnomomediastinum, ciltaltı amfizemi gelişebilir.
Ayırıcı tanıda akutlaringotrakeobronşit, retrofaringeal abse, özefagustaki yabancı
cisim, astım, rekürren pnomoni, retrofarengeal abse düşünülmelidir.
Yabancı Cisim Tipleri
Aspire edilen yabancı cismin türü ve oranı; yaş, cinsiyet, meslek, kültürel hayat,
sosyo-ekonomik durum, diyet, halkın gelenek ve göreneklerine göre ülkeden ülkeye
değişiklikler göstermektedir (Resim 25.3). Endüstrileşmemiş ülkelerde yabancı cisim
aspirasyonlarının çoğunluğunu organik yabancı cisimlerle, en çok kuruyemiş taneleri
ve kabukları (fındık, fıstık kabukları vb.) oluştururken, endüstrileşmiş ülkelerde plastik
yabancı
cisim
aspirasyon
insidansı
son
yıllarda
daha
fazlalaşmıştır
(22).
Ortadoğu’dan bir çalışmada aspire edilen yabancı cismin %66.3 oranında yaz
aylarında sık tüketilen karpuz çekirdeklerinin oluşturduğu bildirilmiştir. Ülkemizden
yapılan çalışmalarda en sık aspire edilen yabancı cismin kuru yemiş ve çekirdek
olduğu ortaya koyulmuştur (23, 24).
315
Resim 25.3: Çıkarılmış yabancı cisimlerden örnekler
Aspire edilen yabancı cismin niteliği klinik tabloyu etkiler. Özellikle çocukluk çağında
aspire edilen leblebi, fasulye gibi yiyecekler zaman içerisinde içlerine su çekerek
hacim olarak genişler ve daha kolay parçalanır hale gelirler. Bu özellikleri nedeniyle
başlangıçta semptomatik olmayan bu tip yabancı cisim aspirasyonları kısa süre sonra
ciddi semptomlara neden olabilirler. Ayrıca bu olgularda yabancı cismin kolay
parçalanır olması bronkoskopi esnasında yabancı cismin parçalanarak daha
distaldeki hava yollarına ilerlemesine ve ulaşılmanın daha imkansız hale gelmesine
neden
olabilirler.
Yapılan
çalışmalarla
fıstık
aspirasyonun
ciddi
mukozal
enflamasyona yol açarak saatler içerisinde granülasyon dokusu oluşturabileceği
saptanmıştır.
Başörtüsü kullanan toplumlarda türban iğnesi aspirasyonu oldukça sık görülmektedir.
Türban bağlanırken ağızda tutulan iğne ani nefes alma, öksürük, gülme gibi
reflekslerle aspire edilebilir. Ağızda tutulan türbanın genellikle topuzlu tarafı aşağıda
kalacak şekilde aspire edilir. İğne radyoopak olduğundan radyolojik olarak görülecek
ancak boncuk kısmı görülemeyecektir. Bronkoskopide iğne ile birlikte boncuk kısmı
da mutlaka çıkartılmalıdır. Bronkoskopi ile genellikle çıkartılabilen iğnelerde dikkat
edilmesi gereken husus, iğnenin forseps ile topuza yakın kısımdan tutulması az
miktarda
distale
ilerletilerek
iğne
ucunun
mukozadan
serbestleştirilmesinin
sağlanmasıdır. Bronkoskopi ile iğne çıkartılırken %2 oranında torakotomi ihtiyacı
rapor edilmişse de floroskopi ile bu ihtiyaç daha da azaltılabilir (10.25,26).
Radyolojik Değerlendirme
Trakeobronşiyal yabancı cisim aspirasyonu düşünülen tüm olgularda tanı metodu
olarak radyografi kullanılır. Yabancı cisim aspirasyonlarının tanısında radyolojik
duyarlılığın % 70.3, özgüllüğün ise % 62.5 olduğu ve yabancı cisim aspirasyonlarının
%62’sinde
de
pozitif
radyolojik
bulgular
316
saptandığını
bildirmiştir
(4,27).
Aspirasyondan sonraki ilk 24 saat içinde vakaların % 44’ünde anormal radyolojik
bulgular saptanırken, 24 saatten sonra vakaların sadece %67’sinde anormal bulgular
görülebilir.
Yabancı cisim aspirasyonu şüphesi olan hastalara posteroanterior ve lateral boyun
ve akciğer grafileri çekilmelidir. Floroskopi, inspiratuar-ekspiratuar akciğer grafileri ve
lateral dekübit grafiler diğer çalışmalarda görülmeyen radyoopak olmayan madde
aspirasyonundaki obstrüktif amfizemi göstermede yardımcı olur.
Radyolojik
bulgular;
aspire
edilen
nesnenin;
radyoopak
olup
olmamasına,
büyüklüğüne ve aspirasyonun süresine bağlı olarak değişiklikler gösterebilir.
1-Direkt Bulgular: Radyolojide cisim radyoopak maddeli veya maddesiz görülebilir
(Resim 25.4).
Resim 25.4: Radyoopak bir yabancı cismin radyolojik görüntüsü
2-İndirekt Bulgular: A-Obstrüktif Amfizem:Yabancı cismin aspire edildiği lobda ya da
akciğerde havanın hapsolarak ekspirasyonla dışarı çıkamaması, özellikle çocuklarda
inspiryumda normal görünen ve akciğer grafisinde saptanamayan hava hapsi
ekspiryumda bronş duvar ödeminden ötürü gelişen check valve mekanizmasıyla
kolaylıkla saptanabilir (Resim 25.5).
317
Resim 25.5: Sol hemitoraksta obstrüktif amfizem görüntüsü
B-Atelektazi: Aspire edilen yabancı cisim bronş çapından büyükse meydana gelir
C-Pulmoner infiltrasyon ve konsolidasyon: Bu erken radyolojik bulguyla gelen
hastalar genellikle belirli süre medikal tedavi almışlardır (Resim 25.6).
Resim 25.6: Yabancı cisim aspirasyonuna bağlı konsolidasyonun radyolojik görüntüsü
Gecikmiş bir yabancı cisim aspirasyonu: radyolojik olarak pnomonik infiltrasyon,
bronşektazi, ve akciğer absesi görünümünde saptanabilir.
Postobstrüktif değişiklikleri bulunan yabancı cisimlerde bilgisayarlı tomografi yararlıdır
(Resim 25.7).
318
Resim 25.7: Postobstrüktif değişiklikleri bulunan yabancı cisimlerde bilgisayarlı tomografi
yararlıdır.
Özellikle radyoopak olmayan cisimleri ve bu yabancı cisimleri çevreleyen
granülasyon dokusu ve fibrozisi ortaya koymada yardımcıdır.
Trakeobronşiyal
yabancı
cisimden
şüphelenilen
tüm
olgularda
radyolojik
değerlendirme yapılmalıdır, ancak negatif radyolojik değerlendirme yabancı cisim
tanısından uzaklaştırmamalıdır. Literatürde negatif radyolojik değerlendirme oranları
çok farklılık göstermektedir (%8-80) (2,28,29).
Ayrıca çocuklar çok hareketli olduklarından dolayı yapılacak bir bronkoskopik
inceleme öncesi yabancı cismin yer değiştirebileceği hesaba katılarak radyolojik
değerlendirmenin tekrarlanması gereklidir.
Tedavi
Geleneksel
olarak
rijid
bronkoskopi
trakeobronşiyal
yabancı
cisimlerin
çıkartılmasında altın standarttır. Trakeobronşiyal ağacın bronkoskopik incelenmesi
potansiyel bir risk taşımasına karşın, bronkoskopi önemli oranda tanısal ve tedavi
edici
bir
araçtır.
Bronkoskopi
ilk
defa
1897’de
Gustav
Killian
tarafından
gerçeklestirilmistir. Killian, öksürük, dispne, hemoptizi ile basvuran bir çiftçide
laringoskopla sağ ana bronşta kemik parçası saptamış ve kokain anestezisi altında
özofagoskopla yabancı cismi çıkarmayı başarmıştır. 1898’de Coolidge, üreteroskop
ile 22 yasındaki bir hastanın sağ ana bronşundan lastik bir trakeostomi kanülü
çıkarmıstır. Jackson 1904’te endoskopun distal ucuna minyatür bir ışık yerleştirerek
havayollarının görüntülenmesinde önemli bir adım atmıştır. Jackson 1936’da yeni
319
teknikler ile yabancı cisim çıkartılmasını rutine sokmuştur. Ikeda 1968 fiberoptik
bronkoskopu geliştirmiş ve 1970’lerde fiberoptik bronkoskopla yabancı cisimler
çıkartılmıştır. Teleskop, fiberoptik bronkoskop, bronkoskopik lazer, trakeobronsiyal
protez uygulamaları, biyopsi aparatları ve forsepslerin geliştirilmesi ile günümüzde
tanısal ve tedavi amaçlı bronkoskopi kullanımı yaygınlaşmıştır.
Rijid bronkoskopinin en önemli avantajı hava yolu kontrolünün sağlanması ve
yabancı cismin çıkartılmasına izin veren geniş kanal yapısına sahip olmasıdır. Ayrıca
rijid bronkoskopların geniş çaplı lümeninden bronşiyal yapıların çok daha iyi
değerlendirilmesine olanak tanıyan optik teleskopların kullanılmasını sağlaması da bu
yöntemi tercih edilir hale getirmiştir. Bronkoskopik olarak saptanan yabancı cisimlerin
çıkartılmasından sonra karşı bronşiyal sistem de dikkatlice incelenmelidir. İkinci bir
yabancı cisim veya çıkartılma esnasında parçalanan yabancı cisimlerin saptanması
açısından bronkoskopik gözlemin yenilenmesi önemlidir (3,4).
Erişkinlerde intravenöz sedasyon ile lokal anestezi altında rijit veya fiberoptik
bronkoskopi uygulanabilmesine rağmen, genellikle genel anestezi altında rijit
bronkoskopi tercih edilir. Çocuklarda ise müdahale kesinlikle genel anestezi
gerektirir. Yabancı cisim çıkartılması esnasında anestezist ve cerrah arasında mutlak
bir uyum olmalıdır. Anestezi esnasında şiddetli asiste ventilasyon uygulanması
yabancı cismin daha perifere itilmesine yol açabilir.
Yabancı cisimlerin çıkartılması esnasında nesnenin büyüklüğüne ve tabiatına,
havayolundaki lokalizasyonuna, granülasyon dokusunun miktarı ve mukozal ödeme
göre çeşitli forsepsler kullanılabilir. Özellikle etrafında granülasyon dokusu oluşmuş
yabancı cisimlerin çıkartılmasında, bronş lümeninin rüptüründen kaçınmak için
dikkatli olunmalıdır.
Bu müdahale sırasında soğuk serum fizyolojik ile irrigasyon
yabancı cismin görünmesini kolaylaştıracak ve optik forsepsler ile cisim rahatlıkla
çıkartılacaktır.
Bazı durumlarda yabancı cismi çıkartmak için rijit bronkoskopi uygulanırken ek olarak
trakeostomi yapılarak yabancı cisim trakeadan çıkartılabilir. Bu uygulama genellikle
çapı ve büyüklüğünden dolayı vokal kordlardan çıkartılamayan yabancı cisim
aspirasyonu olgularında yapılır (30,31). Bronkoskopi esnasında yabancı cisim
alligator forsepsle tutularak 2 ve 4. trakeal halkalar arasından yapılan trakeostomiden
yerinden dışarı alınır. Trakeostomi yerinin primer kapatılması hasta tarafından tolere
320
edilemiyorsa, trakeostomi kanülü yerleştirilerek işleme son verilir. Genellikle kanül bir
haftalık peryod içerisinde alınır.
Bazı seçilmiş vakalarda yabancı cisimi çıkartmak için Fogarty kateteri (vasküler
sistemdeki embolileri çıkartmak için kullanılır) kullanılabilir. Özellikle düz pürüzsüz
yabancı cisimlere standart uygulama denenip başarısız olunmuş ise uygulanmalıdır.
Bu uygulamada balon rüptürü, kateterin ucunun ayrılması, yabancı cisim kontrolünün
kaybolması ve hava yolu obstrüksiyonu gibi komplikasyonlar açısından dikkatli
olunmalıdır (Resim 25.8).
Genellikle distale kaçan ve rijit bronkoskop ile ulaşılamayan bazı radyopak cisimlerde
skopi kullanılarak yabancı cisim çıkartılabilir.
Fiberoptik bronkoskopi ile yabancı cisim çıkartılması mümkündür. Fiberoptik
bronkoskopi her ne kadar iyi görüş ve maniplasyon sağlasa da olguların sadece %
60’ında başarı sağladığını, buna karşılık rijit bronkoskopinin % 98 oranında başarı
sağladığını
bildiren
yayınlar
vardır.
Çocuklarda,
fiberoptik
bronkoskopun
kullanılmasında trake ve glottisin küçüklüğünden, aletin kontrolünün zorluğundan
(çocuklarda FOB esnasında bir süreliğine bronkoskopiye ara verme gereksinimi
duyulur) dolayı zorluklar vardır. Fiberoptik bronkospi uygulanan merkezlerde aynı
zamanda rijit bronkoskopi ekipmanlarınında bulunması gerektiği bildirilmektedir.
Resim 25.8: Bazı seçilmiş vakalarda yabancı cisimi çıkartmak için Fogarty kateteri
kullanılabilir.
Trakeobronşiyal yabancı cisim aspirasyonlarının
%2’sinde torakotomiye ihtiyaç
duyulabilir. Özellikle bronkoskopi ile çıkartılamayan subglottik veya trakeadaki büyük
cisimler, akciğer periferine kaçmış ve parankimden dışarı çıkmış yabancı cisimlerde,
321
çıkartılması sırasında bronşa hasar verecek riskli ve çift ucu keskin nesnelerde, uzun
zaman bronşta kalarak akciğerde geri dönüşümsüz hasar oluşturan yabancı
cisimlerde torakotomi yapılarak bronkotomi veya parankim insizyonu ile cisim
çıkartılır (32).
Sonuç
Trakeobronşiyal yabancı cisim aspirasyonları çocukluk çağının önemli bir mortalite ve
morbidite nedenidir. Tanıya giden en önemli yol şüphelenmektir. Tanı konulamayan
ya da geç tanı konulan vakalarda bronkopnomoni, akciğer absesi, bronşektazi gibi
önemli komplikasyonlar gelişebilir. Anamnez ve çocuk hastalarda olaya tanıklık
edenin titizlikle sorgulanması önemlidir. Kesin tanı ve tedavi için bronkoskopi
yapılmalıdır.
KAYNAKLAR
1- Elhassani NB. Trakeobronchial foreign bodies in middle east. J Thorac
Cardiovasc Surg 1988; 96:621-5
2- Barharloo F, Veyckemans F, Francis C, et al. Tracheobronchial foreign bodies.
Chest 1999;115:1357-62.
3- Shlizerman L, Mazzawi S, Rakover Y et al. Foreign body aspiration in children:
the effects of delayed diagnosis. Am J Otolaryngol 2009
4- Ludemann JP, Hughes CA, Holinger LD. Management of foreign bodies of the
airway. In: Shields TW, LoCicero J, Ponn RB, eds. General Thoracic Surgery.
Philadelphia:WB Saunders, 2000;73:853-62
5- Roh JL, Hong SJ. Lung recovery after rigid bronchoscopic removal of
tracheobronchial foreign bodiesw in children. Int J Pediatr Otorhinolaryngol 2008;
72: 635-41
6- Johnson DG, Condon VR. Foreign bodies in pediatric patients. Curr Probl
Surg
1998 ; 35; 273-79
7- Metrangelo S, Monetti C, Meneghini L, et al. Eight years’ experience with foreign
body aspiration in children: what is really important for a timely diagnosis?. J
Pediatr Surg 1999; 34:1229-1231
8- Ramos MB,Villar AF, Rivo JE, et al. Extraction of airway foreign bodies in adults:
experience from 1987-2008 Interact Cardiovasc Thorac Surg 2009;9 :402-05
322
9- Lameze R, Trechot P, Martinet Y. Bronchial necrosis and granuloma induced by
the aspiration of a tablet of ferrous sulphate. Eur Respir J 1994; : 1710-11
10- Wei JL. Holinger LD. Management of Foreign Bodies of the Airway. In Shields
TW. Locicero III J, Ponn RB, Rusch V editors. General thoracic Surgery. Sixth ed.
Philadelphia: Lippincott Williams&Wilkins 2005; 995-1005
11- Yalçınkaya İ. Trakeobronşiyal yabancı cisim aspirasyonları. In:Ökten İ, Güngör A,
eds. Göğüs Cerrahisi 1st ed. Ankara 2003; 689-98
12- Carluccio F, Romeo R. Inhalation of foreign bodies epidemiological data and
clinical considerations in the light of statistical review of 92 cases. Acta
Otorhinolaryngol Italy 1997; 17: 45-51
13- Yıldızeli B, Zonuzi F,Yüksel M et al Effect of intrabronchial foreign body
retention. Pediatr Pulmonol 2002;33:362-67
14- Zerella JT, Dimler M, McGill LC, et al. Foreign body aspiration in
children:value of radiography and complication of bronchoscopy. J Pediatr
Surg 1988; 33:1651-4
15- Tan HKK, Brown K, McGill T et al. Airway foreign bodies (FB): a ten year
review. Int J PediatrOtorhinolaryngol 2000; 56: 91-9
16- Even L, Heno N, Talmon Y, et al. Diagnostic evaluation of foreign body
aspiration in
children: a prospective study. J Pediatr Surg 2005;40:1122-7.
17- Barrios JE, Gutierrez C, Lluna J, et al. Bronchial foreign body: should
bronchoscopy be performed in all patients with a choking crisis? Pediatr Surg
Int 1997;12:118-20.
18-Yıldızeli B, Yüksel M. Trakeobronşiyal yabancı cisim aspirasyonları. In.: Yüksel
M Kalaycı NG eds. Göğüs Cerrahisi. 1 st ed. İstanbul 2002; 677-89
19- Bittencourt P,Camargos P, Foreign body aspiration. JPediatr 2002; 78: 9-18
20- Black RE, Choi KJ, Syme WC et al. Bronchoscopic removal of aspirated
foreign bodies in children. Am J Surg 1984;148:778 81
21- Soysal O, Kuzucu A, Ulutaş H Tracheobronchial foreign body aspiration: A
continuing challenge. Otolaryngol-Head and Neck Surg 2006;135:223-26
22- Limper AH, Prakash UB. Tracheobronchial foreign bodies in adults. Ann
Intern Med 1990; 112:604-09
23- Paşaoğlu İ, Doğan R, Hatipoğlu A, et al. Bronchoscopic removal of foreign
bodies in children : retrospective analysis of 822 cases. Thorac Cardiovasc
323
Surg 1991; 39:95-8
24- İnci İ, Özçelik C, Ülkü R et al. Tracheobronchial foreign body aspiration in
children: A Retrospective analysis of 980 patients. Journal of Bronchology.
1998; 5:93-109
25-Yurdakul AS, Kanbay A, Kurul C et al. An occult foreign body aspiration with
bronchial anomaly mimicking asthma and pneumonia. Dent Traumatol
2007;23:368-70
26- Demircan S, Çelik B, Başoğlu A. An unusual history of a foreign body
aspiration . Asian Cardiovasc Thorac Ann 2004; 12: 123
27- Mu L, Sun D. Inhalation of foreign bodies in Chinese children: A review of 400
cases. Laryngoscope 1991; 101:657-60
28- Svedström E, Puhakka H, Kero P. How accurate is chest radiography in the
diagnosis of the tracheobronchial foreign bodies in children ? Pediatr Radiol
1989; 19: 520
29- Friedman EM. Tracheobronchial foreign bodies. Otolaryngologic Clinics of
North America 2000; 33:179-85
30- İnci İ, Özçelik C, Ülkü R et al. Removal of tracheobronchial foreign bodies via
Fresh tracheostomy under bronchoscopic control. Journal of Bronchology
1999;6: 32-34
31- Ülkü R, Önen A, Onat S et al.The value of open surgical approaches for
pen caps J Pediatr Surg 2005; 40:1780-83.
32- Ülkü R, Onat S, Oruç M et al. Tracheobronchial pebble aspiration. J Bronchol
2008;15: 295-96
33- www. yeniumutilkyardim.com
34-www. karsiıyakadevlet.gov.tr
324
26.
Prof. Dr. Ali Özdülger
Mersin Üniversitesi Tıp Fakültesi, Göğüs Cerrahisi Anabilim Dalı
HAVAYOLU YARALANMALARI
Havayolu anatomisi
Erişkin trakeası yaklaşık 10–13 cm uzunluğunda, krikoid kıkırdaktan karinaya
kadar uzanan tüp şeklinde bir organdır. Her santimetresinde ortalama iki hyalin
kıkırdak halka içerir ki bu da toplamda 18–22 kadar kıkırdak halkaya karşılık gelir.
Kıkırdak halkalar genellikle açıklığı posteriora bakan “C veya at nalı” şeklindedirler
ve trakeanın arka duvarını bu kıkırdak halkaların kollarını birleştiren membranöz
bir yapı oluşturur. Eliptik kesite sahip bir erişkin insan trakeasının transvers çapı
2.0-2.3 cm ve anteroposterior çapı 1.4-1.8 cm arasında değişir (1,2). Trakeanın bu
membranöz parçası tüm çevresinin 1/3’ünden daha kısadır ve fibröz doku, müköz
bezler ve epitelin yanı sıra musculus trachealis’i barındırır. Bu kas özellikle
öksürük ve ıkınma esnasında kıkırdak halkaların kollarını mediale doğru çekerek
ve membranöz parçayı büzerek trakea lümenini daraltır ve öksürük sırasında hava
akımının hızlanmasını sağlar (1,2).
T4-Louis açısı hizasında trakea karinayla sağ ve sol ana bronşlara ayrılır. Sağ ana
bronş 1,5-2 cm, sol ana bronş ise 3,5-4 cm kadar bir uzunluğa sahiptir. Her iki ana
bronşun da büyük kısımları medistinal plevranın altındadırlar (1,2).
Trakea kıkırdak halkaları birbirine bağlayan fibroelastik yapılar nedeniyle sefalokaudal planda oldukça hareketli bir yapıya sahiptir. Baş normal pozisyonda iken
genç bir insanda trakeanın yaklaşık 5 cm’lik bir kısmı jügüler çentiğin yukarısında
bulunur. Baş tam fleksiyona getirildiğinde trakeanın hemen tamamı mediastene
kayarken, tam ekstansiyonda ½- 2/3 kadarı jügüler çentiğin yukarısına çıkar (1,2).
Sefalo-kaudal plandaki bu hareketliliğine karşın trakea, anteroposterior planda
hemen hemen tamamen hareketsizdir; bunun nedeni de büyük ölçüde onun
çevresini saran mediastinal vasküler oluşumlardır. Bu oluşumları kısaca
hatırlayalım:
325
1. En önemlisi sol ana bronşu, karina ve trakea alt ucunu kuşatan arcus aorta ve
truncus pulmonalis
2. Sağ ana bronşu örten v. cava superior ve v. azygos
3. Mediastinal
trakeanın
superior
kesiminde
trakeanın
önünde
yer
alan
v.brachiocephalica sinistra ve a. brachiocephalica
4. Bunların dışında mediastinal plevra ve büyük vasküler oluşumların etrafındaki
fibröz kılıflar da etkilidirler.
Krikoid kıkırdaktan, her iki ana bronşun lobar bronş dallarını verdikleri noktalar
arasında kalan trakea ve her iki ana bronştaki travmatik yaralanmalara havayolu
yaralanması adı verilmektedir. Genellikle son derece dramatik, hayatı tehdit edici
bir durumdur. Olguların %30’u ölümcül seyreder ve ölümlerin %50’si de olaydan
sonraki ilk bir saat içinde gerçekleşir. Ancak zaman zaman gözden kaçırılacak
kadar hafif bulgularla seyretmesi de nadir değildir (2,3).
Havayolu yaralanmalarında etyoloji
Sadece künt yaralanmalar dikkate alındığında havayolu yaralanmalarında genel
bir değerlendirmeyle motorlu araç kazaları %67, düşük hızlı sıkışma ve ezilme tipi
kazalar ise %27 ve yüksekten düşme, sonucu yaralanmalar da %12 oranında
saptanmaktadır. Penetran yaralanmalarında ise –hem kesici delici alet hem de
ateşli silah- tüm dünyada çok ciddi artışlar yaşanmaktadır. Hastaneye canlı
başvurular dikkate alındığında künt yaralanmaların daha ziyade mediastinal
trakeayı etkilediği, servikal trakeada ise penetran yaralanmaların daha fazla
görüldüğü anlaşılmaktadır. Bunun muhtemel nedeni mediastinal trakeanın oldukça
derinde yerleşmiş olmasıdır. Ateşli silah veya kesici-delici alet teması gibi penetran
bir yaralanma mediastinal trakeayı etkilediğinde aynı anda büyük vasküler
oluşumları da etkilemiş olmakta ve bu tip yaralanmalar büyük çoğunlukla olay
yerinde ölümle sonuçlanmaktadır. Servikal trakea oldukça yüzeysel bir organ
olduğundan penetran etkiler sonucu izole yaralanmaları daha sıklıkla
gözlenmektedir. Tüm trakea dikkate alındığında ölümle sonuçlanmayan penetran
yaralanmaların %75-80’inin servikal trakeada lokalize olduğu saptanmaktadır.
Ancak servikal trakeanın künt travmaya bağlı yaralanmaları da mevcuttur. Bunlar
326
en sık motorlu araç kazaları esnasında emniyet kemeri takılı değilse boynun
direksiyon simidine çarpması ve trakeanın vertebra ile direksiyon simidi arasında
sıkışması şeklide olmaktadır. Ayrıca kafa koruması yoksa boynun aşırı
ekstansiyonu sonucu da yaralanma meydana gelebilmektedir. Bir diğer tip
yaralanma şekli de “çamaşır ipi yaralanması” şeklinde ifade edilen yaralanmadır ki
burada da aslında çok dar bir alana konsantre olmuş künt travma söz konusudur
(1,2,6,7)
Havayolu yaralanmaları; gerçek insidanslarının belirlenmesi zor, “nadir” ve
genellikle ölümcül seyreden yaralanmalardır. Gerçek insidansın belirlenmesi iki
nedenle zordur. Öncelikle hastaların önemli bir kısmı daha ölümcül ve bariz
yaralanmalar nedeniyle ölmekte ve otopsi yapılmadığından havayolu
yaralanmaları gözden kaçabilmektedir. Ayrıca hastaların azımsanmayacak bir
bölümü uzun zaman sonra bazı komplikasyonlar sonucu başvurmakta yani ilk
anda hiç fark edilmemekte dolayısıyla hiç kayıt altına alınmamaktadırlar.
Havayolu yaralanmalarında etki mekanizmaları
Etki mekanizmaları penetran travmalarda ne kadar açıksa, künt travmalarda o
derece tartışmalıdır. İleri sürülen bazı mekanizmalar şunlardır (4,5,8)
1. Çarpma sonucu gelişen sıkışma ile trakea ve ana bronşlar içindeki hava
basıncında ani bir yükselme meydana gelebilir ve travma esnasında refleks olarak
gelişen glottis kapanmasının da etkisiyle bu ani basınç artışının havayolu ağaçta
yırtılma veya kopmalara yol açabilir. Bu mekanizmanın özellikle trakeanın
membranöz parçasındaki yırtılmalardan sorumlu olduğu düşünülmektedir.
2. Toraksın bir objeye çarparak ani şekilde sıkışması, ön-arka çapının azalmasına
ve bu esnada transvers çapın da hızla artmasına yol açar. Akciğerler pasif olarak
toraks duvarını takip ettiklerinden laterale doğru birbirlerinden uzaklaşırlar ve karina
bölgesinde trakeaya güçlü bir traksiyon uygularlar. Bu lateral güç, havayolu
elastisiteyi aşarsa kopma ya da yırtılma meydana gelebilir. Bu tür yaralanmalar
özellikle
göğüs
duvarı
elastikiyetinin
yüksek
olduğu
çocuk
ve
gençlerde
saptanmaktadır ve genellikle de başka bir vasküler veya parankimal hasar
oluşturmazlar.
327
3. Ani deselerasyon esnasında trakea ve özellikle sol ana bronş kendilerini
çevreleyen arcus aorta, conus pulmonalis ve kalp tarafından yerlerinde tutulurlarken,
her iki akciğer ataletleri nedeniyle hareketlerine devam ederler ve bu kuvvet karina
çevresinde yırtılma ve kopma şeklindeki yaralanmalarla sonuçlanabilecek düzeye
ulaşabilir. Sol ana bronş arcus aorta tarafından adeta korumaya alındığından, sağ
ana bronşun etrafındaki destek dokusu daha zayıf olduğundan ve sağ akciğer
kitlesinin sola göre daha fazla olmasından ötürü sağ ana bronş yaralanmalarının sola
oranla daha sık olduğu düşünülmektedir.
Yaralanmaların %80’i karina çevresindeki 2.5 cm’lik kesimde gerçekleşmektedir.
Trakeada %15, distal hava yollarında ise %5 oranında yaralanma görülmektedir.
Özellikle son iki mekanizma, havayolu yaralanmaların %80’inin neden karina
çevresindeki 2,5 cm’lik alanda gerçekleştiğini ve neden yaralanmaların daha
ziyade sağ ana bronşu kapsadığını açıklamaktadır.
Havayolu yaralanmalarında semptomatoloji
Havayolu yaralanmalarında semptomatolojiyi kavrayabilmek için iki nokta akılda
tutulmalıdır.
Havayolu yaralanması çoğunlukla ağır bir klinik tablo ile seyreder ancak
1.
hastaların bir kısmı akut dönemde gözden kaçabilmekte ve kronikleşebilmektedir.
Dolayısıyla havayolu yaralanmalarının erken (akut) ve bunlara hiç benzemeyen geç
dönem (kronik) bulguları vardır. Bu nedenle erken dönem semptomları ve tanı
metotlarını, geç dönem semptom ve tanı metotlarından ayırarak incelemekte fayda
vardır.
2.
Erken dönem bulgular ve sonrasındaki klinik seyir büyük ölçüde havayolu
yaralanmasına sebep olan travmanın peribronşiyal bağ dokusu ile birlikte mediastinal
plevranın da bütünlüğünü bozup bozmadığına bağlıdır (2,3,6,9).
Erken dönem bulguları fizik muayene ve radyolojik tetkik bulguları Tablo 26.1 ve
Tablo 26.2 ’de belirtilmiştir.
328
Tablo 26.1 : Havayolu yaralanmalarında erken dönemde en sık saptanan fizik muayene
bulguları ve oranları
Solunum Yetmezliği
%76-100
Ciltaltı amfizemi
%35-85
Hemoptizi
%14-25
Cilt kesisinden hava çıkışı
%27-60
Ses kısıklığı ve disfoni
%30-46
Tablo 26.2: Havayolu yaralanmalarında erken dönemde en sık saptanan radyolojik
bulgular ve oranları
Pnömotoraks
%20-70
Pnömomediastinum
%40-60
Ciltaltı+Derin servikal amfizem
%70-85
Erken dönem fizik muayene ve radyolojik bulguların sayısı ve şiddeti mediastinal
plevranın travma sonrasındaki durumuna bağlıdır. Havayolu yaralanması ile
birlikte mediastinal plevra da yırtılmışsa tidal volüm, inspirasyon esnasında
yaralanma tarafındaki akciğeri doldurmak yerine daha az dirençle karışılacağı
plevral boşluğa geçer ve pnömotoraks veya tansiyon pnömotoraksa yol açabilir.
Bu durumda sağlam akciğere de etkin bir tidal volüm akışı olmaz ve ventilasyon
bozulur; dolayısıyla dispne ve solunum yetmezliği barizleşir. Mediastinal plevranın
sağlam kaldığı durumlarda ise, trakea veya ana bronşlardan birisinde ciddi
yaralanma olsa dahi mediastinal kompartıman kapalı kaldığından dokular
arasından spontan solunum, en azından bir süre daha devam edebilir. Dolayısıyla
bu hastalarda dispne ve solunum yetmezliğinin ön planda olmaması çok şaşırtıcı
bir durum değildir (2,10,11).
Cilt altı amfizemi hemen tüm havayolu yaralanmalarında saptanmaktadır. Miktarı
ise hem mediastinal plevranın durumuna hem de havayolu yaralanmasının
boyutuna ve lokalizasyonuna bağlıdır. Mediastinal plevranın yırtıldığı durumlarda,
plevral boşluk ve yaralanmış bronş arasında serbest bir bağlantı oluştuğundan,
hava mediastende birikemez, plevral boşluğa geçer. Servikal trakeanın penetran
329
yaralanmalarında da, trakeadan kaçan hava ciltteki kesiden kolayca dışarı
çıkabildiğinden yoğun bir cilt altı amfizemi beklenmez.
Mediastinal plevranın sağlam kaldığı durumlarda ise, rüptürden kaçan hava plevral
boşluğa geçip şiddetli bir pnömotoraks oluşturamaz; daha ziyade mediastende
birikme eğilimi vardır. Bu biriken hava ilerleyen saatlerde göğüs duvarına ve
yükselerek servikal planlar arasına yayılma eğilimindedir. Özellikle eşlik eden
yaralanmalar nedeniyle entübasyon uygulanan hastalarda cilt altı amfizemi kısa
süre içinde ve çok dramatik bir şekilde gelişebilir (9,11,12).
Sonuç olarak, mediastinal plevranın bütünlüğünü koruduğu durumlarda şaşırtıcı
derecede az semptom ve bulgular ortaya çıkmaktadır. Ortaya çıkanlar da tedaviye
iyi ve hızlı cevap veren tabiattadırlar. Başlangıçta solunumun peribronşiyal bağ
dokusunun da desteğiyle sorunsuzca devam etmesi de bu tabloya eklenince,
mevcut havayolu yaralanma ilerde komplikasyonlara yol açana değin gözden
kaçabilir.
Tablo 26.3: Künt mediastinal trakea yaralanmalarında eşlik eden diğer yaralanmalar ve
oranları
Kot fraktürü+ortopedik
%57-70
Yüz travması
%22
Pulmoner kontüzyon
%33
İntraabdominal yaralanma
%20-45
Özofagus yaralanması
%3-21
Kafa travması
%4-20
Spinal kord yaralanması
%4-10
330
Havayolu yaralanmalarında tanı
Havayolu yaralanmalarında tanı zaman zaman son derece sıkıntılı olabilir.
Hastaneye canlı şekilde ulaşan havayolu yaralanmalı hastaların yaklaşık ancak
%47’sinin ilk 48 saat içinde tanınabildikleri bilinmektedir (4).
Zaman zaman son derece hafif ve şüpheli olabilen bulgular nedeniyle, havayolu
yaralanmasında tanının ilk basamağı şüphelenmektir. Hasta ilk görüldüğünde
saptanabilecek; hava giriş çıkışı olan bir açık yara, nefes darlığı, hemoptizi, cilt altı
amfizemi, konuşma güçlüğü, göğüs duvarı ve/veya boyunda yara izleri,
anamnezde travmanın oluşum şekli ve yukarıda saydığımız eşlik eden patolojiler
(Tablo 26.3), özellikle de üst kotlarda fraktürler şüphe uyandırması gereken
önemli bulgulardır. Genel durumu uygun olan tüm toraks travmalı hastalarda ilk
tanısal tetkikler iki yönlü akciğer ve servikal bölge grafileri olmalıdır. Ancak
unutulmamalıdır ki; havayolu yaralanmaların %10’u akut dönemde hiç radyolojik
bulgu vermemekte ve %30 olguda da varolan radyolojik bulgular atlanmaktadır.
Standart grafilere ek olarak genel durumu uygun hastalarda bilgisayarlı tomografi
tetkiki yukarıda sayılan radyolojik bulguların daha bariz şekilde ortaya
konulmasında çok yardımcı olacaktır. Ancak havayolu veya ek yaralanmaları
nedeniyle; acil entübasyon, acil tüp torakostomi, acil solunum desteği vs gerektiren
durumlarda tüm radyolojik tetkik metotları hasta stabil hale gelene değin
ertelenmelidir.
Havayolu yaralanmalarında kesin tanı metodu bronkoskopidir. Şüpheli fizik
muayene veya radyolojik tetkik bulguları söz konusu olduğunda hastaya mutlaka
bronkoskopi uygulanmalıdır. Bronkoskopi, hasta stabilize olur olmaz
uygulanmalıdır. Tetkik için rijid ya da fleksibl bronkoskopi kullanılabilirse de
genellikle solunum sıkıntısı içinde olan hastanın acilen entübe edilmesinden sonra
entübasyon tüpü içinden fleksible bronkoskop ile yapılması daha güvenli bir
tekniktir. Çünkü, entübasyon tüpü içinden fleksible bronkoskopi uygulamasının,
trakeanın membranöz kesimindeki basit yırtıklarda entübasyon tüpünün direkt
gözlemle lezyonun distalinde tespit edilmesi, trakeal tam kopma olgularında
entübasyon tüpünün distal trakeaya görerek ilerletilebilmesi, eşlik eden servikal
331
vertebra ve kafa travması durumunda da uygulanabilmesi ve genel anestezi
gerektirmemesi gibi çok önemli avantajları da vardır (Tablo 26.4). Sonuçta hangi
teknik kullanılırsa kullanılsın, endoskopik muayenenin mümkün olan en kısa
sürede tamamlanması ve trakeanın entübasyon tüpü altında kalan kısmını da
kapsaması çok önemlidir. İlk muayenede herhangi bir lezyon saptanmasa dahi
şüphenin devam ettiği durumlarda bronkoskopik muayenenin tekrarlanmasından
kaçınılmamalıdır, çünkü %50’den fazla olguda lezyon ilk muayenede gözden
kaçabilmektedir (2, 4-6, 14, 15).
Tablo 26.4 : Havayolu yaralanmalarında fleksible bronkoskopinin başlıca avantajları
1. Hastanın entübasyonunda rehber olarak kullanılabilir.
2. Entübasyon tüpü içinden yapılabildiğinden hastanın hemen entübe
edilmesine engel değildir.
3. Entübasyon tüpünün lezyonun distaline görerek yerleştirilebilmesine olanak
sağlar.
4. Boyun ekstansiyonu gerektirmediğinden eşlik eden servikal vertebra ve kafa
travmalarında kolaylıkla uygulanabilir.
5. Uyanık ve spontan ventilasyonu olan hastada güvenle kullanılabilir.
Havayolu yaralanmalarında mortalite.
Mortalite büyük oranda eşlik eden yaralanmalara bağlı; hastaneye gelebilenlerin
%30’u ölümcül seyreder, Bunların %50’si ilk saatte ölürler. Mortaliteyi etkileyen
faktörler; yaralanmanın lokalizasyonu (Sol ana bronş:%8, sağ ana bronş %16 ve
trakea %26), bilgi ve deneyim (1950 öncesi %36, 1970 sonrası %9) ve
yaralanmanın şeklidir (Deselerasyon yaralanmalarında %87, sıkışma
yaralanmalarında ise %73 oranında sağkalım saptanmaktadır) (3).
Havayolu yaralanma tedavisinde genel prensipler
Havayolu yaralanmanın teşhis edilmesi sonrası muhtemel ek patolojiler için ileri
tetkik ve tedaviye geçmeden önce hastanın hava yolunun emniyete alınması
mutlaka gereklidir. Bu emniyet havayolu sağlanması ve yeterli oksijenasyon olarak
332
ele alınmalıdır. Hastaların entübasyonu için solunumu baskılayıcı ilaçlardan
kaçınılmalı ve topikal anestezi teknikleri ile sedatif ajanlar tercih edilmelidir.
Yüksek frekanslı jet ventilasyon, geniş yaralanmalarında dahi yeterli oksijenasyon
sağlayabilen bir tekniktir ancak uygulanması ciddi bir tecrübe gerektirmektedir.
Hastanın hava yolu bir şekilde emniyete alındıktan ve yeterli oksijenasyon
sağlandıktan sonra öncelik derhal dolaşıma ve kardiyovasküler yaralanmalara
kayar. Subdural hematomlar, intraabdominal kanamalar ve majör kardiyovasküler
yaralanmalara ait sorunlar, havayolu yaralanmasının kalıcı tamiri öncesinde
mutlaka çözülmelidir (1,2,5,7,16,17).
Yukarıda sayılan genel prensipler çerçevesinde doğal olarak yapılması
gerekenlerin ilki, hastaya güvenilir bir hava yolu sağlamaktır. Bunun en kolay yolu
da orotrakeal entübasyondur. Servikal trakeanın kesici aletlere bağlı penetran
yaralanmalarında cilt-cilt altı kesisi önemli bir avantaj sağlamaktadır. Eğer
trakeadaki travmatik kesi veya trakeanın tamamen ayrılmış distal ucu
görülebiliyorsa entübasyon için servikal trakeadaki bu travmatik insizyon
kullanılmalı ve kesinlikle distal trakeada yeni bir insizyon yapmaktan kaçınılmalıdır.
Distal uç görülemiyorsa kesinlikle körlemesine entübasyon denenmemelidir. Distal
uç görülemiyorsa cilt kesisinden mediastene sokulacak bir parmağın rehberliğinde
trakeanın distal lümeni palpe edilip Allis forseps yardımıyla ciltteki kesiden dışarı
çıkarılabilir. Daha sonra bu distal uçtan entübasyon uygulanabilir (1).
Erken dönemde yapılması zorunlu olan bir diğer girişim özellikle penetran
yaralanmalarında eşlik eden özofageal veya farengeal yaralanmaların tamir
edilmesidir. Bunun nedeni bölgenin enfeksiyondan korunması ve kalıcı tamir
sonrası komplikasyon oluşumunu azaltmaktır.
Bölgenin konservatif debridmanını takiben trakeanın distal ucu çevre yumuşak
dokulara birkaç adet sütürle tespit edilir. Proksimal ucun drenajı sağlanır ve yara
uygun bir pansumanla kapatılarak kalıcı tamire kadar beklenebilir (1,2).
Ancak künt servikal travma sonucu oluşan yaralanmalarında böyle bir cilt kesisi
genellikle olmadığından hastanın fleksible bronkoskop rehberliğinde entübe
edilmesi denenmelidir. Bu girişim başarısız olursa acil trakeostomiye geçilerek
hastaya hava yolu sağlanmaya çalışılmalıdır.
333
Hastanın havayolu “(A)irway” ve solunum “(B)reathing” problemi çözüldükten
sonra eşlik eden diğer patolojilerin tanı ve tedavileri için ilgili ekiplere hasta bu
haliyle teslim edilebilir.
Havayolu yaralanmalarında temel prensip, hastada mevcut olabilecek hayatı tehdit
eden diğer travmatik sorunlar çözüldükten sonra mümkün olan en kısa zamanda
havayolu yaralanmanın cerrahi tamiri için hastanın operasyona alınmasıdır. Cerrahi
tamirde prensip, trakeal uçların konservatif şekilde debridmanı ve uçların
absorbable sütür materyali ile anastomozudur. Günümüzde büyük çoğunlukla 4/0
polyglactin 910 sütür materyali tercih edilmekte ve önerilmektedir. Non-absorbable
monofilament sütürler kullanıldığında granülasyon dokusu oluşumu ve dolayısıyla
darlık riski daha fazla olmaktadır (1,2).
Trakeanın kesici-delici aletlere bağlı penetran yaralanmalarında, doku kaybı fazla
olmadığından, tamir oldukça kolay olabilir. Ateşli silahlara bağlı yaralanmalarında
ise ciddi doku kaybı tamiri oldukça zorlaştırabilir. Eğer doku kaybı az ise
debridman+tamir yapılabilir ancak doku kaybının fazla olduğu durumlarda ilgili
segmentin konservatif bir yaklaşımla halka şeklinde rezeksiyonu ve uç uca
yeniden anastomozu yapılmalıdır. Eğer geniş defekte rağmen debridman+tamir
yapılırsa trakeada ciddi bir katlanma (kinking) ve dolayısıyla solunum sıkıntısı
kaçınılmaz hale gelecektir. Tamir işlemi tamamlandıktan sonra sütür hattı çevre
kaslardan sağlanan fleplerle veya boyunda tiroid bezinin lobları kullanılarak örtülür
(1).
Distal havayolu yaralanmalarında güvenli bir havayolunun sağlanması oldukça zor
olabilir. Çift lümenli tüplerin kullanımı rijid yapıları ve boyutları nedeniyle
sakıncalıdır. Bu durumda önerilen yaklaşım, uzun ama normalden biraz daha ince
tek lümenli bir endotrakeal tüpün fleksible bronkoskop rehberliğinde sağlam tarafa
yönlendirilerek tek akciğer ventilasyonu sağlanmaya çalışılmasıdır. Tamir
operasyonu hasta bu şekilde stabilize edildikten sonra yapılabilir.
Cerrahi tamir prensipleri teknik olarak mediastinal trakea ve ana bronşlarda da
aynıdır. Tek değişiklik yaralanmanın lokalizasyonuna göre cerrahi insizyonun
yerinde ve şeklinde olmaktadır.
334
Girişim tamamlandıktan sonra hasta ekstübe edilmeden tüp içinden fleksible
bronkoskop ile muayene yapılmalı ve sekresyonlar aspire edilmelidir.
Havayolu yaralanmalarında geç dönem
Bu hastaların geç dönemde hangi komplikasyonlara bağlı bulgularla karşımıza
çıkacakları primer yaralanmanın şekline ve lokalizasyonuna bağlıdır. Trakeanın
membranöz kesiminde lokalize sınırlı yaralanmalar hiçbir komplikasyona yol
açmaksızın kendiliklerinden iyileşebilirler. Bu istisnai durumu göz ardı edersek,
gelişen komplikasyonları belirleyen unsurun, havayolu yaralanmanın parsiyel ya
da komplet olması hali olduğu söylenebilir.
Parsiyel yaralanmalarında, bronş 2-6 hafta içinde fibrin, ve granülasyon dokusu ile
daralır. Zamanla bronşta tam tıkanma olmaz ama ileri derecede stenoz oluşur.
Stenoz distalinde tekrarlayan akciğer enfeksiyonları gelişmesi olasılığı yüksektir.
Sonuçta akciğer dokusunda yapısal bir harabiyet ve belirgin fonksiyon kaybı
meydana gelir.
Bu hastalarda geç dönemdeki bulgular daha ziyade öksürük, wheezing ve
tekrarlayan akciğer enfeksiyonlarına aittir. Hastalara yanlışlıkla astım tanısı
konabilir. Antibiyotik tedavisi ile hafif bir düzelme gösteren ancak tam iyileşmeyen
bu akciğer enfeksiyonları, bronşiektazi ve abse oluşumuna kadar ilerleyebilir.
Anamnezde çoğunlukla bir travma hikayesi hatırlanmaz. Bu grup hastaların
çoğunda rezeksiyon kaçınılmazdır.
Komplet yaralanmalarında, kopan distal uç 1-4cm kadar aşağı doğru retrakte olur.
Başlangıçta kısa süreli hava geçişi olabilir ama 3-7 gün içerisinde granülasyon
dokusu ve sekresyonlar bronşu tam olarak tıkarlar. Daha sonra bu zeminde bronş
güdüğü tamamen epitelize olarak iyileşir ve ilgili akciğer 6-21 gün içinde atelektatik
bir şekilde izole olur. Bu izolasyon akciğer dokusunun dış ortamdan ve
enfeksiyonlardan korunmasına yol açar; sonuç olarak akciğerde harabiyet ya da
fonksiyon kaybı, yıllar sonra dahi, ancak ihmal edilebilecek düzeylerde kalır.
Başlangıçta yüksek olan pulmoner kan akımı da zaman içinde atelektazi nedeniyle
ancak minimal bir şanta yol açabilecek düzeye kadar geriler.
335
Bu hastalar genç ya da ilave kalp-akciğer hastalığı olmayan bireylerse uzun yıllar
hiçbir yakınmaları olmayabilir. Zaman içinde hafif bir şekilde efor dispnesi
gelişmeye başlar. Daha yaşlı ve ilave kalp-akciğer sorunu olan bireylerde ise
dinlenme halinde dahi dispne ve egzersiz intoleransı görülebilir.
Bu hastalarda hiler disseksiyon sonrasında kopan bronş uçları bulunur ve debride
edildikten sonra distal uçtan birikmiş salgılar aspire edilir. Bronş aspire edilip iyice
temizlendikten sonra ilgili akciğer, anestezi cihazına bağlı ayrı bir hattan gelen
havayla solutulur ve akciğerin ekspansiyon yeteneği değerlendirilir. Akciğer
ekspanse olabiliyorsa bronşlara uç-uca anastomoz yapılır. Akciğerin yeterince
ekspanse olmadığı durumlarda pnömonektomi uygulanmalıdır (1,2,4,5,14).
Havayolu Yanıkları
Trakea ve bronş yanıkları; sıcak gaz, su buharı, yakıcı sıvıların buharları ve patlama
esnasında oluşan sıcak havanın inhalasayonu ile gelişebilir. Bu tür yaralanmalar; ev
yangınları, motorlu araç kazaları, elektrik çarpması, gaz patlaması, uçak kazaları ve
TV seti patlamaları gibi durumlarda gözlenir. Ayrıca nadiren endobronşiyal lazer
uygulamaları esnasında da meydana gelebileceği bildirilmektedir. Yaralanmaların
%97’sinde yüz yanıkları vardır ve %75’i kapalı alanlarda gelişmiştir. Kazazedelerin
%75’inde ağır solunumsal komplikasyonlar gelişir ve 1/3’ü ölürler.
Mukozal soyulmayı ağır bir trakeobronşit takip eder. Eğer bazal hücre tabakası sağlam
kalmışsa hızlı bir iyileşme gözlenir. Ancak bazal hücre tabakası da hasar görmüşse
granülasyon, skatrizasyon ve stenoz gelişebilir. Bu hastalarda tedavi için uygulanmak zorunda
kalınan entübasyon hasarı daha da arttıran bir unsurdur. Bu nedenle de sadece yanığa bağlı
komplikasyon oranını vermek çok zordur.
Bu hastalarda cerrahi tedavi yaklaşımlarının iyi sonuç vermedikleri gözlendiğinden,
hem hasta hem hekim sabır ve inatla konservatif tedavinin sonuç vermesini
beklemeliler. Bu süre 4-61 ay (ort 28 ay) olabilir. Sonuçta cilt yanıklarının
iyileşmesine paralel şekilde skatrizasyon gelişebilir ama patent bir havayolu kalır (1).
336
Entübasyona bağlı yaralanmalar
Tek ya da çift lümenli tüp yerleştirilmesi esnasında havayolu yaralanmalar meydana
gelebilir. Bir gün içinde uygulanan toplam entübasyon sayısı bilinemeyeceğinden bu
tip yaralanmalar için bir oran vermek de mümkün değildir. Ancak tek bir merkezde
yapılan çalışmada bu oranın %0.05 ile %0.37 arasında olduğu tahmin edilmektedir.
Etyolojisinde tecrübesiz kimselerin tekrarlayan entübasyon denemeleri, balonu
indirilmeden tüpün yerinin değiştirilmesi veya balonun aşırı şişirilmesi bulunmaktadır.
Yayınlarda nedeni tam olarak anlaşılamamış olmakla birlikte kısa boylu kadınlarda
riskin belirgin derecede yükseldiği ifade edilmektedir. Hasar genellikle membranöz
kısımda ve lineer şekildedir. Bulgusu ekstübasyon sonrası mediastinal, cilt altı
amfizemi ve pnömotoraks gelişimidir. Lezyonlar daha ziyade distal trakea ve ana
bronşlardadır, servikal bölgede bu tür yaralanmalar çok görülmezler (1,12,17).
KAYNAKLAR
1. Grillo HC. Tracheal and bronchial trauma. In Grillo HC ed.Surgery of the
trachea and bronchi. London B.C. Hamilton Inc, 2004:271-290
2. Hood RM:. Injury to the trachea and major bronchi. In Hood, Boyd and
Culliford
eds.
Thoracic
Trauma.
Philadelphia,
W.B.
Saunders
Company;1989:245-266
3. Bertelsen S, Howitz P. Injuries of the trachea and bronchi. Thorax,1972, 27,
188.
4. 6Roxburgh J C. Rupture of the tracheobronchial tree. Thorax 1987;42:681688.
5. 7Rossbach MM, Johnson SB, Gomez MA et al. Management of Major
Tracheobronchial
Injuries:
A
28-Year
Experience.
Ann
Thorac
Surg
1998;65:182-186
6. 4Hahn B. Tracheobronchıal Rupture. The Journal of Emergency Medicine,
2007, 33, 193–194,.
7. 5Kiser AC, O’Brien SM, Detterbeck FC. Blunt Tracheobronchial Injuries:
Treatment and Outcomes. Ann Thorac Surg 2001;71:2059–65
8. Reuter M. Trauma of the chest. Eur. Radiol. 6, 707-716 (1996)
9. Karmy-Jones R, Avansino J, Stern EJ. CT of Blunt Tracheal Rupture. AJR
2003;180:1670
337
10. Kologlu MB, Fedakar M, Yagmurlu A. Tracheobronchial Rupture due to Blunt
Chest Trauma: Report of a Case. Surg Today, 2006, 36:823–826.
11. Ishibashi H, Ohta S, Hirose M et al. Blunt tracheal transection and long tear in
posterior membranous trachea. Eur J Cardiothorac Surg 2006;30:945-947
12. Minambres E, Gonzalez-Castro A, Buron J et al. Management of
postintubation tracheobronchial rupture: our experience and a review of the
literature. European Journal of Emergency Medicine 2007, 14:177–179
13. Ketai L, Brandt MM, Shermer C. Nonaortic Mediastinal Injuries From Blunt
Chest Trauma. J Thorac Imaging ,April 2000, 15, 120-127.
14. Balci AE, Eren N, Eren S, Ulku R. Surgical treatment of post-traumatic
tracheobronchial injuries: 14-year experience. European Journal of Cardiothoracic Surgery 22, 2002 984–989.
15. W Harvey-Smith, W Bush, and C Northrop. Traumatic bronchial rupture.
American Journal of Roentgenology, 1980, 134, 1189-1193
16. Kawaguchi T, Kushibe K, Takahama M et al. Bluntly traumatic tracheal
transection:
usefulness
of
percutaneous cardiopulmonary support for
maintenance of gas Exchange. Eur J Cardiothorac Surg 2005;27:523-525
17. Naghıbı
K,
Hashemı
S
L,
Sajedı
P.
Anaesthetic
management
of
tracheobronchial rupture following blunt chest trauma. Acta Anaesthesiol
Scand 2003; 47: 901—903.
18. Gabor S, Renner H, Pinter H et al. Indications for surgery in tracheobronchial
ruptures. European Journal of Cardio-thoracic Surgery 20 (2001) 399-404
338
27.
Prof. Dr. Mehmet Bilgin
Erciyes Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞERİN ENFEKSİYON HASTALIKLARINDA CERRAHİ
YAKLAŞIMLARIN TEMEL PRENSİPLERİ
Akciğerin enfeksiyon hastalıkları yüzyıllardır bilinmektedir. Akciğer apselerinin
eksternal direnajı Hipokrat zamanından beri bilinmekte ve yaşam kurtarıcı olarak
uygulanmaktadır. Bununla birlikte iltihaplı akciğer apsesi ve bronşektazinin kesin
tanısı ve bunların tüberkülozdan ayrılması 1819’ da Laennec’in stetoskopu, 1895’de
Röntgenin x- ışınlarını, 1922’de Sicard ve frostier’in bronkografi için iyodlu yağı ve
Koch ‘un uygun bronkoskopiyi kullanması ile cağ atlamıştır (1).
Pnomoni
Pnomoni ABD de altıncı en sık ölüm sebebi ve enfeksiyon hastalıklarının başında
gelir. Bir virülan inokulum ya da konakçıda oluşan immün yetmezlik sonrası
trakeobronşiyal ağacın sterilitesini sağlayan normal anatomik ve hücresel defansın
bozulması sonucu oluşur.
Teşhis için kan, balgam ve mümkünse plevral sıvı kültürleri alınır. Trakeal
aspirasyon, bronkoskopi, fırca ve bronkoalveoler lavaj örneklemesi, ince iğne
aspirasyonu
gibi
invaziv
tanı
yöntemleri
ağır
hastalar
veya
çözülemeyen
pnomonilerde kullanılabilir (2).
Akciğer tüberkülozu
Pulmoner tbc’un günümüzdeki tedavisi medikal dır. Öncelikle Rifampisin ve
isoniyazid temel ilaçlar olup buna diğer ilaçlar da ilave edilmektedir(etambutol,
streptomisin vb). Çok ilaca dirençli Tbc (ÇİD-TB) sadece ülkemizde değil tüm
dünyada ciddi bir sağlık problemidir. Tedavisi daha uzun ve mortalite oranı yüksektir
(3). Tedavide istenen sonuçları vermeyen ÇİD-TB olgularının rezeksiyona gitmeleri
mortalite oranlarını azaltmıştır (4).
Cerrahi endikasyonlar:
Minör tedaviye başlanmasından üç ay sonra basil pozitif hastalar
339
Minör tedavi boyunca balgam da basil pozitifleşen vakalar
Balgam negatif ancak nüks riski yüksek hastalar cerrahiye aday hastalardır.
Nüks riski yüksek hastalar:
Çok sayıda ilaca dirençli olgular
Radyolojik olarak devam eden kavite
Harap olmuş lob ya da akciğeri olup basil yükü fazla
olan olgular (5)
ÇİD-TB olgularda basil yükü en fazla olan lezyonların kaviter hastalık olduğu
bilinmektedir. Bu nedenle cerrahide kavitelerin çıkarılması önemlidir.
CİD-TB ve ilaç duyarlı akciğer tbc olgularda sekel ve komplikasyonlar için de zaman
zaman cerrahi uygulanmaktadır.
Bunlar; masif hemoptizi
(600 ml/gün↑), harab
olmuş akciğer (destroyed lung), dekortikasyon gerektiren plevral kalınlaşma,
hapsolmuş akciğer (trapped lung), plevral poş ya da ampiyem, bronkoplevral fistül,
pulmoner aspergilloma, malignite şüphesi, bronkostenozdur.
Hastaların operasyon için değerlendirilmesi
Preoperatif değerlendirmelerde, akciğer grafileri, bilgisayarlı toraks tomografisi,
perfüzyon/ventilasyon sintigrafisi, solunum fonksiyon testleri, bronkoskopi ve
pulmoner
hipertansiyon
şüphesinde
sağ
kalp
kateterizasonu
önerilmektedir
(6).Operasyondan önce hastalara bronkoskopi yapılmalıdır. Böylece bronş temizliği
ve karşı taraf akciğerin malignite açısından değerlendirilmesi yapılır. Operasyondan
en az üç ay öncesine kadar kültür sonuçlarına göre antitbc tedavi başlanmalıdır. Eğer
balgamda basil pozitifliğine rağmen radyolojide gerileme varsa ve pozitiflik oranı
azalıyorsa tedaviye devam edilebilir. Operasyon esnasında balgam pozitifliği
operasyona kontrendikasyon oluşturmaz. Operasyon sırasında balgam pozitifliği
serilerde %16-50 arasında değişmektedir (7).Sigara içen hastalar en az bir ay süre ile
sigarayı bırakmalı ve preoperatif postural drenaj uygulanmalı postoperatif ortalama
24 ay kullanacağı ilaçlar temin edilmelidir.
Cerrahi Teknik
Anestezi için çift lümenli endotrakeal tüp veya endoblokerli tüp kullanılmalıdır.
Kanama, hızlı transfüzyon ve hemodinami takibi için “santral venöz kateterizasyon”
uygulanmalıdır. İnsizyon için posterolateral torakotomi insizyonu seçilmelidir.
Serratus anterior koruyucu torakotomi veya latissimus dorsi adelesi veya interkostal
340
adele flebi hazırlanarak da torakotomi yapılabilir. Üst lob apeks ve posterior, alt lob
süperior segment komşuluklarında toraks duvarına sıkı yapışıklıklar oluşur. Bu
nedenle pek çok cerrah ekstraplevral rezeksiyonu tercih ederler. Ekstraplevral
rezeksiyon tercih edilirken sağda subklavian damarlar, v. Kava süperior, azigos venin
alt süperior komşuluğu vena kavaya dökülme noktasına özofagusa dikkat edilmelidir.
Solda subklavian damarlar, rekürren sinir ve aortadan çıkan interkostal arterlere
dikkat edilmelidir. Genellikle hiluslar, azigos venin inferior parcası, arkus aorta ve
torasik aorta komşuluğunda yapışıklıklar azdır ya da yoktur. Buralara ulaşılması
cerrahi rahatlatır. Bazen hiler lenfadenopatiler ve yapışıklıklar yüzünden, pulmoner
damarlar intraperikardiyal bağlanabilir. Bazı cerrahlar harab olmuş akciğer nedeniyle
ekstraplevral
pnomonektomiyi
ve
intraperikardiyal
damar
ligasyonunu
rutin
önermektedirler (7). Pnomonektomiye tamamlanması düşünülen vakalarda önceki
operasyona ait yapışıklıkların yanı sıra hilus diseksiyonu da çok zordur. Bu olgularda
da intraperikardiyal damar ligasyonu tercih edilebilir (8).
Sağ üst lobektomi vakalarında fissürün ayrılması bazen çok zor olabilir. Bu durumda
pulmoner arterin üst lob ayrımını ve üst lob venini dönüp bağladıktan sonra, posterior
yaklaşımla bronş dönülüp, kesilir. Daha sonra fissür kesilip diğer arterler yapılar
bağlanır (posterior retrograd yaklaşım (8).
Rezeksiyon sonrası bronş güdüğü değişik sütür teknikleri ile dikilebilir ya da bronş
staplerleri kullanılabilir. Bronş güdüklerinin canlı fleplerle desteklenmesi tercih edilen
yöntemdir. Özellikle üst lobektomi veya pnomonektomilerde canlı doku fleplerinin
kullanılması tercih edilirken alt lobektomi ve orta lobektomilerde bronkoplevral fistül
olasılığı az olduğu için flep kullanılmayabilir. Burada oluşan fistüller konservatif
tedaviye yanıt verebilirler.
Postoperatif bakım
Postpnomonektomi pulmoner ödem, Bronkoplevral fistüle (BPF) bağlı solunum
yetmezliği ve enfeksiyon, kardiyak problemler ve diğer sistem yetmezlikleri erken
mortalitede önemlidir. En ciddi ve en yaygın morbidite nedeni BPF‘dür. Cerrahi
esnasında basil pozitifliği, torasik kavitenin kontaminasyonu, cerrahi teknik yetersizliği
(aşırı bronşiyal disseksiyon, uygunsuz sütür tekniği), retorakotomi, diyabet, beslenme
yetersizliği sorumlu tutulabilir. Sol pnomonektomide bronş güdüğü arkus aortanın
altında kaldığı için BPF sağa göre daha azdır.
341
BPF tedavisinde, ilgili hemitoraks drene edilmeli, enfeksiyonun kalan akciğere ve tüm
hemitoraksa yayılması engellenmelidir. Sistemik antibiyotikle birlikte Tbc tedavisi
devam etmelidir. Fiberoptik bronkoskopla bronş güdüğü ve fistül değerlendirilir,
sekresyonlar ve pürülan mayi aspire edilir. BPF erken dönemde olmuşsa genellikle
neden cerrahi yetersizliktir. Erken reoperasyon önerilir. Toraks içindeki sıvı, fibrin ve
debrisler temizlenir. Kavite povidin iyodlu serum fizyolojik ile mekanik irigasyonlarla
temizlenir. Güdük sağlam doku gelinceye kadar debride edilir. Güdük tek tek konan
non-absorbabl, monoflaman sütürlerle kapatılır. Ayrıca güdük interkostal kas flebi
veya omentum gibi vaskülarize bir doku flebi ile de desteklenir.
Kanama ve hematom diğer komplikasyonlardır. Nedeni sıkı plevral yapışıklıklardır.
Kanama; saatlik, günlük miktarı ve hastanın hemodinamisine göre tedavi edilir.
Postpnomonektomi pulmoner ödem yüksek mortaliteye sahiptir. Operasyonun ilk
günlerinde gelişir. İntraoperatif ve postoperatif sıvı kısıtlaması, hastanın aldığı ve
çıkardığının yakın takibi ile önlenir.
Uzamış hava kaçağı, plevral boşluk sorunları, şilotoraks geri kalan akciğerin
enfeksiyon sorunları atelektazi ve frenik sinir hasarı diğer komplikasyonlardır. (8).
Akciğer Apsesi
Akciğer apseleri parankim destrüksiyonu ile oluşan bir kavitede lokalize süpüratif
nekrotizan birikimin olduğu bir enfeksiyondur. Akciğer apseleri akut veya kronik
olabilir. Akut apseler altı haftadan daha az süren apseler olarak tanımlanır. Çoğu
akciğer apsesi soliterdir. Ancak hastanın immün durumu ve altta yatan hastalığın
durumuna göre multıpl de olabilir. Antibiyotiklerin kullanıma girmesi ile akciğer
apsesinin insidansı dramatik olarak azalmasına rağmen HIV, kemoterapi ve başarılı
organ nakilleri sonrası immunosuprese hasta oranının çokluğuna paralel olarak
insidansda bir artış görülmektedir.
Akciğer apselerinin tedavisinde öncelik medikal tedavidir. Cerrahi ilk tedavi
olmamalıdır (1,9). Medikal tedavide uygun ve uzun süreli (6-8 hafta) uygun antibiyotik
tedavisi, bronkoskopi, postural drenaj gibi yöntemlerle apsenin internal olarak drene
edilmesi önemlidir.
Medikal tedavi ile hastaların büyük çoğunluğu iyileşmekte ancak %10 cerrahi
gerekmektedir. Medikal tedaviye rağmen kavite çapının artması, sepsis gelişen veya
342
karşı akciğerin kontaminasyonuna neden olan apselerde cerrahi girişim endikasyonu
vardır.
Akciğer apsesinin tedavisi Hipokratın perkutan direnajına kadar ulaşır. 19. yüzyılın
sonlarında, fatal bir komplikasyon olan akciğerin kollabe olup plevral boşluğun
enfekte olması( ampiyem) durumunun önüne geçmek amacı ile plevral simfizis
yapılması değer kazanmıştır. Drenaj için Monaldi drenajı, tüp torakostomi ve sualtı
drenajı, bilgisayarlı tomografi eşliğinde kataterizasyon uygulaması yapılabilir (10
(Şekil 27.1). 20.yy’da bir İtalyan cerrah olan Monaldi bu engeli ortadan kaldıran
kavite için vakumu sağlayan iki bölümlü teknik tanımlamıştır. Monaldi bu tekniği ilk
kez 1938’de uygulamış 1947’de yayınlamıştır. Monaldi drenajı öncelikle tbc
kavitelerinde uygulanmış sonra da akciğer apselerinde denenmiştir (10). İlk etapta
radyoloji ile girilecek yer tespit edilir; buradan kostanın kısa bir bölümünün kesilerek
(3-5cm) ve içeriye subplevral iritan bir madde (gazlı bez) konarak plevral simfizis
yapılır. 4–7 gün sonra gazlı bez çıkarılır; yeni bir insizyonla tüp drenajı uygulanır.
Drenajla özellikle büyük ve bronşa açılmamış apselerde klinik başarı sağlanır. Bu
girişimin en önemli komplikasyonları kanama, subkutan amfizem, masif hava kaçağı
ve ampiyemdir. Daha önceden plevrası yapışık hastalarda tek aşamalı işlem sıklıkla
uygulamaya devam edilmiştir. Akciğer apsesinin tedavisi çok uzun olduğu için
hastalar tüp ile evlerine gönderilebilirler. Şayet hava kaçakları devam ederse tüpe
Hemlich valvi denilen tek yönlü bir valv sistemi eklenebilir. Daha sonraki yıllarda
anastezi yöntemlerinin gelişmesi ile acık torakotomi İle segmentektomi, lobektomi ve
pnomonektomi gibi anatomik rezeksiyonların yapılması mümkün olmuştur.
343
Şekil 27.1: Monaldi tekniği
Akciğer apselerinin sekonder sebepleri arasında sayısız konjenital ve edinsel lezyon
vardır. En sık sekonder sebepler bronkojenik karsinom daha az olarak da yabancı
cisimlere bağlı bronş obstroksiyonudur. Tümörler ve pulmoner enfarktüsler
kavitasyon yapabilirler enfekte olabilir ve primer akciğer apseleri gibi klinik tabloda
yer alabilirler.
Birçok akciğer apsesinin anatomik yerleşimi bronş ağacının segmental anatomisi ile
ilgilidir.
Çoğu akciğer apsesi yatar pozisyondaki hastanın aspirasyonu ile ilgili
olduğundan bu pozisyondaki segmentler, üst lobların süperior segmentleri gibi, daha
daha fazla etkilenirler.
Akciğer apseli hastalar klinik olarak öksürük, ateş, dispne ve bazen de göğüs
ağrısından yakınırlar. Semptomlar sıklıkla kesin başlama tarihi belli olmayacak
şekilde sinsi başlar. Halsizlik ve kilo kaybı kliniğe eşlik eder. Eğer apse bronşa
açılırsa hasta ani bir hemoptiziyi takiben değişik renklerde kötü kokulu ve pürülan
balgam çıkarma öyküsü verir. Nadiren masif hemoptizi ve acil cerrahi gerekir.
Apsenin plevral boşluğa açılması diğer bir acil cerrahi endikasyonudur.
Cerrahi
Perkutan drenaj yönteminin tarihi Hipokrat zamanına kadar uzanmasına rağmen son
zamanlar kullanılmaya başlanmıştır. Pozitif basınçlı ventilatörlere bağlı yoğun bakım
344
hastaları da dahil olmak üzere bir çok hastada perkutan direnaj tekniği
uygulanmaktadır. Lokalizasyonu belirlemek için lezyon-plevra yakınlığı en iyi ultrason
ile tespit edilebilir. Ayrıca floroskopi ve bilgisayarlı tomogrofi ile de bu tespit
sağlanabilir. Perkutan drenajın zamanlaması tartışılabilir ancak medikal tedaviye
yanıt alınamayan veya başka bir cerrahi endikasyon olmayan hastalarda erken
drenajın faydalı olacağı kuşkusuzdur. Mediastinal şift, diğer akciğerin kontamine
olduğu veya olma olasılığı yüksek vakalarda, 72 saatlik antibiyotik uygulamasına
rağmen sepsis bulgularının düzelmediği durumlarda, acil direnaj uygulanmalıdır.
Ayrıca akut olarak plevral boşluğa rüptüre olan pyopnomotoraks durumu da acil
cerrahi endikasyondur. Ancak bu durumda cerrahi olarak lobektomi tercih edilmelidir
(1).
Cerrahi işlemde, cerrahın işlem esnasında etkilenen akciğerin manipülasyonunu
minimal tutması gerektiğini aklında tutması gerekir. Bu mortal komplikasyon için
anestezinin operasyonun başından itibaren tedbir alması gerekir. Bunun için çift
lümenli endotrakeal tüplerin kullanılması, toraksa girildiğinde öncelikle bronşun
disseke edilerek klemplenmesi önemlidir.
Bronşektazi
Bronşların duvar destriksiyonu ile beraber kalıcı dilatasyonudur. 1819’da Laennec’in
bronşektaziyi
tanımlamasından
sonra
antibiyotiklerin
kullanılmasına
kadar
bronşektazi solunum yetmezliği ve kor pulmonale nedeniyle yüksek mortalitesi olan
bir hastalıktı (11). Spesifik antibiyotiklerin bulunması ve pulmoner enfeksiyonun
çocuklukta erken tedavisi ile bronşektazinin insidansı ve cerrahi önemi son yüzyılın
ikinci yarısında azalmıştır.
Endobronşiyal patoloji veya dıştan bası ile bronş obstrıksiyonu bronşektazi
gelişmesine sebep olan edinilmiş bir faktör olabilir. Aspire edilmiş yabancı çisimler
veya mide içeriği yada mukus tıkaçları sekresyonların lokal retansiyonuna sekonder
enfeksiyona ve bronşektaziye neden olabilir. Konak faktörleri (çoğu vakalarda immün
yetmezlik laboratuar testleri ile yeterince gösterilemezse de) de bronşektazinin nadir
sebeplerindendir (1,11).
Bronşektazili hastaların öyküsünde reküren febril episodlar tipik olmakla beraber
bronşektazi teşhisi sıklıkla akut enfeksiyöz alevlenmelerde konur. Tekrarlayan
345
alevlenmeler değişik miktarda hemoptiziye yol açabilir, ama genellikle masif veya
hayatı tehdit eden hemoptiziler değildir.
Heidenhain 1901’de bronşektazi tedavisi için başarılı bir parsiyel lobektomi yapmıştır
(12). Rezeksiyon için BT ile preoperatif dökümente edilmiş lokalize broşektazi,
rezeksiyon sonrası yetecek kardiyo-pulmoner rezerv, irreverzibl hasar mevcut olmalı
ve medikal tedavinin de başarısız kalması gereklidir.
Pulmoner rezeksiyona gidecek bütün hastalarda preoperatif olarak rezeksiyon sınırını
iyi belirlemek gerekir. Çünkü rezeksiyon sırasında hangi segmentin etkilenip
hangisinin etkilenmediğini bilmek zor olabilir (1,12). Operasyon esnasında yardımcı
olabilecek indirekt bulgular, etkilenen segment ya da lobun zayıf ekspanse olması,
ektatik bronşların palpasyonu, anormal akciğerin üzerinde antrakotik pigment
yokluğudur ve bu bölgedeki fonksiyon bozukluğudur. Operasyona gidecek tüm
hastalara en az 48 saat önce antibiyotik başlanmalı ve postural drenaj ile mümkün
olduğunca bronş temizliği yapılmalıdır(13).
Bronşektazi için her tip rezeksiyon mümkündür, cerrahinin amacı maksimum
fonksiyon koruyarak etkilenmiş tüm segmentlerin çıkarılmasıdır. Sonuçta yeterli
pulmoner fonksiyon sağlayabilmek için her iki akciğerde minimum iki lob veya altı
segment kalmalıdır. Teknik olarak intraoperatif dönemde kontralateral lobların
kontaminasyonlarını önlemek amacı ile çift lümenli tüplerin kullanılması önerilir. En
önemli zorluk visseral ve paryetal plevra arasındaki yoğun yapışıklıklardır. Bazen lob
ekstra plevral olarak mobilize edilebilir. Özellikle diyafram üzerindeki yoğun
yapışıklıkların açılmasında dikkatli olunmalıdır.
Pulmoner arter ve dallarının
etrafındaki hiperplazik ve sıkı şekilde yapışmış lenf bezleri bu damarların
serbestleştirilmesini zorlaştırır.
Hiperplastik bronşiyal arterler identifiye edilip
bağlanmazsa intra ya da postoperatif kanamaya sebep olabilirler. Bronşiyal arter
hiperplazizisi ve bronşun iyi kanlanması nedeniyle lobektomi yapılan bronşektazi
hastalarında postoperatif bronkoplevral fistül görülme insidansı kanser nedeniyle
lobektomi yapılan hastalara kıyasla düşüktür (12).
Diffüz ve multisegmental etkilenimi olan hastalarda cerrahi sonuçlar daha az tatmin
edici olabilir ve bu hastalarda operasyon endikasyonları tekrar tekrar gözden
geçirilmelidir. Cerrahi öncelik semptomatik, medikal tedaviye yanıtsız hastalarda ve
cerrahi ile tamamen rezeke edilebilecek hastalardadır. Tekrarlayan hemoptiziler
başka yollarla tedavi edilemiyorsa yine cerrahi düşünülebilir.
346
KAYNAKLAR
1. Yıldızeli B, Yüksel M,Pnomoni, Akciğer Apsesi ve Bronşektazi. Göğüs
Cerrahisi m.Yüksel, G Kalaycı, M Yüksel İstanbul 2001:659–676.
2. Meduri GU,Wanderink RG, Leeper KV, Beals DH: Management of Bacterial
Pneumonitis in ventilated patients. Chest 101:500-508, 1992.
3. Isamed MD.Treatment of Multidrug –Resistance tuberculosis. N Eng J Med
1993:329784–91.
4. Pomerants M., Madsen L, Goble M,Iseman M, Surgical management of
Resisistant
Mycobacterial
pulmonary
infections
Ann
Thorac
Surg
1991;52:1108-11.
5. Alper A. Çok ilaca dirençli tbc da Cerrahi yaklaşım. Ankara Uzmanlık tezi
2000)
6. Pomerants BJ, Cleveland JC, Olson Hk, Pomerantz M, Pulmonary resection
for multi-drug rezistant tuberculozis J thorac Cardiovasc surg 2001;121:44853.)
7. Kır A, İnci I,Torub T, et al. Adjuvant resectional surgery improves curerates in
multi-drug resistant tuberculosis. J Thorac Cardiovasc Surg. 2006;131:693-6.)
8. Salih topcu. Çok ilaca dirençli akciğer tüberkülozunda cerrahi tedavi. Türk
toraks derneği okulu kitabı. 2006.
9.Alexander jc, Wolfe WF, Lung Abcess and empyema of the thorax. Surg Clin
North Am 1980:60;835.
10.Akcalı Y, Oğuzkaya F, Kahraman C,Bilgin M.Eloeser flap or Open-Window
Thoracotomy Cerrahi Tıp Arşivi 1997:2;139-43.
11.Ashour MHemodynamic alterations in bronchiaectasis; a base for a new
subclasification of the disease. jThorac Cardiovasc Surg 1996;112:328-34.
12. Deslauriers J, Dion I. Le Treatment des bronchiectasies primitives İndications
chiururgicales et resultates Semin Hüp paris1985;18:1199–201.
13. Brooke Nicotra M,Rivera MDale AM, et al Clinical, pathophysiolgic, and
microbiologiç
characterization
of
bronchiectasis
in
aging
cohor.
Chest
1995;108:955-61
14. İnflamatuar Akciğer Hastalıklarında Pnomonektomi; David Featherstone
Blyth.Natal Üniversitesi, Durban Güney Afrika. European Journal of CardioThoracic Surgery, September 2000.
347
28.
Doç Dr. İsmail Cüneyt Kurul ve Dr. Ali Çelik
Gazi Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞERİN PARAZİTER HASTALIKLARI VE CERRAHİ TEDAVİDE TEMEL
PRENSİPLER
Toplumların gelişmişlik düzeyi ile ilişkilendirilen paraziter hastalıkların görülme
sıklığı, şehirciliğin gelişmesi, çevre sağlığı ve koruyucu hekimlik düzeyinin artması ile
azalmış gibi görülmesine rağmen, günümüzde seyahatlerin kolay ve yaygın olması,
köylerden kentlere olan göçün artması, konak direncini yıkan hastalıkların ortaya
çıkması ile artmıştır. Günümüzde paraziter hastalıklar, sağlık çalışanlarının bilmesi
ve fark etmesi gereken konulardan biri halini almıştır.
Ülkemizde bu konu ile ilgili sınırlı sayıda çalışma mevcuttur. Ciddi anlamda yapılan
ilk çalışma 2002 yılında Toraks Derneği Paraziter Akciğer Hastalıkları çalışma grubu
tarafından hazırlanan Tanı ve Tedavi Rehberi olmuştur (1). Kapsam olarak geniş bir
konu olan paraziter hastalıklardan, ülkemizde yaygın olarak rastlanan türler bu
çalışmada gözden geçirilmiş, özellikle Hipokrat zamanından günümüze önemli bir
sağlık sorunu olarak karşımıza çıkan hidatik kist hastalığı üzerinde daha ayrıntılı
durulmuştur. Bu grup özellikle cerrahlar ve dahiliyeci gruplar arasında tedavi
konusunda tartışmaların sürmekte olduğu gruptur.
Parazit, canlı bir doku içinde veya üzerinde sürekli ya da geçici olarak, besin ve
yerleşme amacı ile yaşayan, gelişip çoğalabilen ve zaman zaman bulunduğu konağa
zarar veren canlılara verilen genel ismidir.
Klinik olarak paraziter hastalıklar; Zooparazit olarak isimlendirilir ve 3 grup altına
incelenebilir.
A)
Protozoonlar;
Canlılar dünyasının en basit yapısını oluşturan tek hücreli
mikroorganizmalardır. Yaklaşık otuz tür protozoonanın insanlarda asalak olarak
bulunduğu ve bunların yarısının zararsız olduğu bilinmektedir. Bu grup içinde akciğer
için zararlı olanlar: Amebiyaz, Toksoplalazmoz, Layşmaniyaz, Kiptosporidiyaz,
Sıtma, Mikrosporodiyaz ve Tripanozomiyaz sayılır.
B)
Helmintler: Solucanlar olarak da belirtilmektedir. Bu grup kendi içinde;
Trematodlar, Nematodlar ve Sestodlar olarak 3 alt gruba ayrılır.
348
Trematodlar; Vücutları yaprak şekilde olan solucanlardır. Zararlı etken oluşturan bu
grup içinde: Şistosomiyaz, Paragonimiyaz, Opistorkiyaz, Fasyoliyaz bulunur.
Nematodlar; İpsi solucanlar olarak bilinirler. Bu grup içinde: Askariyaz, Kancalı kurt
infeksiyonları, Strongiloidiyaz, Viseral larva migrans, Kutanöz larva migrans,
Trişinelloz, Filariyaz, Dirofilariyaz, Singamiyaz bulunmaktadır.
Sestodlar; Şeritler şeklinde ’tenya’ olarak adlandırılır. Bu grup içinde: Hidatik kist
bulunmaktadır.
C)
Artropotlar; Eklem bacaklı böceklerle oluşan hastalık grubunu oluşturur. Bu
grup içinde; Pulmoner akariyaz ve Dil solucanı olarak bilinen ve solunum siteminde
yaşayan Pentostomiyaz bulunmaktadır (1–4).
Echiınococcus Granulosus (Hidatik Kist)
Hipokrat döneminden günümüze bilinen bir hastalık olan hidatik kist hastalığı,
köpekler gibi et yiyen hayvanların ince barsaklarında yaşayan Echinococcosis
granülosusun larva (metacestode) evresinin neden olduğu paraziter bir hastalıktır
(5). Hartman paraziti 1695 yılında köpeklerde tanımlanmıştır. Rudolphi 1808 yılında
echinococcosisin insanda görülen şekli için hidatik kist tanımlamasını yapmıştır (6).
Özellikle Hipokrat’ın ‘Karaciğer su ile dolarak yırtılırsa, hastanın karnı su ile dolar,
ölür’ deyişi bu hastalığa antik dönemlerden beri rastlanıldığının bir göstergesidir.
Tanısında
geçmişten
günümüze
yaklaşım
olarak
çok
fazla
bir
farklılık
bulunmamaktadır. Tedavisi konusunda anestezi tekniklerinin gelişmesi ve farklı
tecrübelerin yayınlanmasıyla uygun yaklaşım yolu seçilmeye çalışılmışsa da
cerrahlar ve dahiliyeciler arasında görüş farklılıkları bulunmaktadır.
Dünyada en çok yayılım gösteren paraziter hastalık olan Hidatik kist hastalığı tarım
ve hayvancılığın yaygın, koruyucu hekimlik hizmetlerinin yetersiz kaldığı ülkelerde
sık görülen, önemli bir parazitozisdir. Hastalığa, Ortadoğu, Asya’nın hemen her
bölgesi, Güney Amerika, Kuzey Afrika, Avustralya, tarım ve hayvancılığın yaygın
olduğu Akdeniz ülkelerinde sıklıkla rastlanılmaktadır (7,8). İnsidansı ülkelerin sağlık
politikalarına ve koruyucu sağlık hizmetlerine verdikleri öneme göre değişmektedir.
Özellikle teknolojik gelişmelerle beraber artan seyahat ve göç sorunu nedeniyle artık
her ülkede rastlanabilmektedir.
Görülme sıkılığı bakımından ülkemiz için değişik
rakamlar bildirilmektedir. Yüksel ve Kalaycı görülme insidansını yüz binde 14 olarak
bildirmişlerdir (4). Toraks Derneği tarafından 2002 yılında yayınlanan Paraziter
349
Akciğer hastalıkları Tanı ve Tedavi Rehberinde prevalansı yüz binde 50, insidansı
yüz binde 2 civarında olduğu bildirilmektedir (1,4,8).
Epidemiyolojik olarak farklı dört tür echinococ cinsi mevcuttur. Dört tür içinde en
yaygın olanı kistik echinococcosin sebebi olan; Echinococcus Granulosus’tur.
Diğerleri alveolar echinococosise neden olan; E. Multilocularis, insanlarda nadir
olarak hastalığa yol açan; E. Vogeli ve E. Oligarthus’tur (1,9).
Ana konak olan köpek, kurt, çakal gibi etoburların ince bağırsağında yaşayan ve bu
konakçılara, hastalıklı ara konak organlarının yenmesi ile bulaşan Taenia
Echinococcus, ana konakta organ hastalığına yol açmaz. 2–8 mm uzunluğunda olup
baş, boyun ve üç halkadan “proglottid” den oluşmuştur. Skoleks adı verilen baş
kısmında 3 adet vantuz ve 30 adet rostellum adı verilen çengelleri bulunur. Bunlar
aracılığıyla ana konağın bağırsaklarında tutunan skolekslerin yapısındaki son iki
halkasında,
parazitin
testis
ve
ovaryumları
ve
400–800
adet
yumurtası
bulunmaktadır. Son halka gelişimini tamamlayınca serbest kalır ve yumurtalar ana
konakçının dışkısı ile ortama atılır. Yumurtalar kuru toprakta 10 ay, suda 7 gün,
buzda iki hafta ve kaynar suda bir dakika canlılığını koruyabilmektedir (7,8).
İnsana bulaşma sıklıkla fekal-oral kontaminasyon yoluyla; enfekte köpeklerin dışkısı
ile atılan yumurtaların özellikle kirlenmiş su, pişirilmeden veya iyi yıkanmadan yenen
sebze veya meyveler yoluyla olduğu bilinmektedir. Diğer bir bulaşma yolu, kıllarına
yumurtalar yapışmış olan köpeklerle yakın temas sonucu fekal oral yolla alınmasıdır.
İleri sürülen diğer bulaşma şekli ise inhalasyon yoluyla kist hidatik oluşabileceğidir
(2,8,10). Fekal oral yolla bulaşma sonrası ara konakta larva evresi başlar. Sindirim
sistemine girerek mideyi aşabilen yumurtaların kabukları duodenumdaki safra
tuzlarıyla parçalanarak embriyon açığa çıkar. Serbest kalan embriyo (oncosphere)
duedenum ve jejunum duvarına tutunur ve mukozayı delerek kan veya lenf
dolaşımına geçerler. Boyutu 0,3 mm aşmayan embriyon, mezenter venüllerinden
portal dolaşıma sızar. Embriyonun ilk ve en sık yerleşim yeri kapiller damar ağına
sahip olan karaciğerdir (%60–80). Kan ve lenfatik yol aracılığıyla vücutta ikincil
olarak yerleşim yeri ise akciğerlerdir (%10–30). Sistemik dolaşıma katılabilen
embriyo vücudun herhangi bir organına ulaşabilir (Şekil 28.1). E. Granülosus’un
yaşam döngüsü ara konakçıların hastalıklı organlarının ana konakçılar tarafından
yenmesiyle tamamlanır (11).
350
Şekil 28.1: Kist Hidatik’in Yaşam Döngüsü
Embriyo yerleştiği organda skolekslerini kaybederek larva haline geçer. Büyümeye
başlar ve ikinci ayda 1 mm, beşinci veya 6. ayda 10 mm’lik çapa erişir. Kist hidatik
için doubling time yaklaşık 4–6 ay olarak kabul edilmektedir. Akciğer dokusunun
özelliğinden dolayı hidatik kistler pulmoner dokuda daha hızlı büyürler. Erişkinlerde
sıklıkla karaciğer yerleşimi görülmesine rağmen çocuklarda akciğer yerleşimi daha
sık olarak görülmektedir (12–15). Akciğer yerleşimi görüldüğünde sıklıkla sağ
akciğer ve her iki alt lob yerleşimi görülmektedir. %75–90 oranında soliter olarak
görüldüğü, bilateral yerleşimin ise %2–30 oranında görüldüğü bildirilmektedir
(1,5,16).
Akciğer
tutulumu;
hematojen,
lenfatik
veya
karaciğer
tutulumu
sonrası
transdiafragmatik yoldan oluşabilmektedir. Bu yüzden sağ akciğer alt lob yerleşimli
hidatik kistlerde mutlaka ultrasonografi ile karaciğer tutulumu değerlendirilmelidir.
Akciğer yerleşiminin diğer alternatif yolları; Embriyonun duktus torasikus aracılı vena
351
jugularis interna yolu ile vena cava süperiora veya vena iliaka interna yolu ile vena
cava inferiora ve daha sonra kalp ve akciğere ulaşması şeklindedir (10,17).
Echinococ kistinin yerleştiği dokuda 3 tabaka halinde oluştuğu görülür. En dışta yer
alan tabaka ara konağın kiste karşı oluşturduğu reaksiyonel bir yoğun fibröz dokudur
ve perikist (ektokist, adventisya) olarak tanımlanır.
Hidatik kistin kendisi tarafından oluşturulan; Laminer membran denilen dışta
kutikülası (Exocyst) ve içte germinatif tabakası (Endocyst) vardır (4,10,18). Dış
membranı olan kutikula mukopolisakkaritden yapılı beyaz renkte koruyucu bir
tabakadır. Kalınlığı 1–3 mm arasında değişmekte olup besin maddelerine karşı
selektif geçirgen bir dokudur. Zedelenmesi kistin rüptürüne neden olmaktadır. Kistin
iç yüzeyinde bulunan germinatif tabaka granüler yapıdadır ve üreme yeteneğine
sahiptir. Bu tabakadan protoskoleks (hidatik kum) ve kız veziküller (doughter cysts)
oluşmaktadır. Kız veziküller akciğer hidatik kistlerinde nadiren bulunmaktadır.
Protoskoleksler kaya suyu içine dökülür. Protoskoleksler geliştikçe, skoleksler kist
sıvısının içine birikir, sıvının miktarı artar ve bu kistin büyümesine neden olur (2,3,7).
Kist içini dolduran sıvıya ‘’kaya suyu’’ adı verilmektedir. Bu sıvı antijenik özelliğe
sahip, renksiz, kokusuz ve perfore olmamış kistlerde sterildir. Yoğunluğu 1007–
1015, pH’sı 6,7–7,2 arasında değişmektedir (19,20).
Klinik
Vücudumuzdaki bütün dokulara yerleşebilen kist hidatik en sık karaciğere (%60–80),
ikinci sıklıkla ise akciğere (%10–30) yerleşmektedir. Diğer organlarda ise % 10
oranında gözlendiğini söylemek mümkündür (10).
Akciğer hidatik kistleri genellikle soliter yerleşimlidir. Özellikle alt loblarda ve
karaciğer komşuluğu göz önüne alındığında, sağ akciğer alt lobda yerleşiminin daha
sık gözlendiği bildirilmektedir. Olguların %2-30’unda multiple akciğer kist hidatiği
şeklinde ve bunların da %75’inde bilateral olarak bulunmaktadır (10,16).
Hastalık genellikle semptom vermeden sinsi seyir gösterebilir. Komşu yapılara bası
yapabilecek büyüklüğe erişen kistlerde, kistin lokalizasyonuna, büyüklüğüne, yaptığı
basıya ve rüptüre olup olmamasına bağlı semptomlar görülebilir. Sıklıkla öksürük,
göğüs ağrısı ve hemoptizi görülür (4,5,10,21). Masif hemoptizi komplike olmamış
kistlerde nadiren görülür. Semptomlar birçok hastalığı taklit edebilir (22,23).
352
Akciğer hidatik kistli olgularında rüptür spontan, travma sonrası veya antihelmintik
tedavi sırasında olabilir. Hastaların ortalama %2-9’unda görülen kist içeriği olan kaya
suyu
ve
membran
ekspektorasyonu
(Hidatoptizi)
hastalığın
patognomonik
bulgusudur (4). Olgularda kist içeriğinin bronşial sisteme kaçmasına bağlı olarak,
kaya suyunun ekspektorasyonuna ve germinatif membran parçaları sebebiyle
şiddetli öksürük, dispne, bronkospasma sekonder nefes darlığı ve göğüs ağrısına
rastlanabilir. Olguların bir kısmında kist büyüklüğüne bağlı olmaksızın anaflaksi,
generalize döküntü, yüksek ateş, pulmoner konjesyon ve ciddi bronkospasm ve
ölüm gelişebilmektedir (3,24).
Perfore olmuş kist içinde membran ve bir miktar kaya suyu bulunan olgular tedavi
edilmezlerse, ileri dönemde akciğer absesine neden olabilir. Kistin bronş yerine
plevral boşluğa rüptürü daha az görülmektedir. Olguların %5’inde geliştiği
bildirilmiştir. Oluşan tablo, parankimin toraks duvarı ile yapışıklıklarına bağlı olarak
değişik derecelerde hidropnömotoraks kliniğini oluşturur (25). Tabloya şiddetli göğüs
ağrısı, sebat eden öksürük, dispne, siyanoz, şok ve anaflaktik reaksiyon eklenebilir.
Tedavide
gecikilen olgularda,
perforasyon
üzerine
enfeksiyon
eklenmesiyle
ampiyem oluşabilir (18,22).
Tanı
Hastanın yaşadığı bölge, riskli hayvanlarla temas, kaya suyu ve membran
ekspektorasyonu öyküsü kist hidatik hastalığını düşündürür. Balgam incelemesinde
skolekslerin fark edilmesi patagnomonik bulgudur. Casoni cilt testi ile Weinberg
kopleman fiksasyon testlerinin sensitivite ve spesifiteleri düşüktür. Bu nedenle
serolojik testler tanıda daha duyarlıdır. Serolojik testlerden; Antijenlerin tespiti
amacıyla indirekt hemaglutinasyon testi, IgG ELİSA ve immunelektroforez gibi
teknikler kullanılmaktadır (26). Duyarlılığı en yüksek olan test IgG ELİSA testidir;
güvenilirliği %90’dır (26,27). İndirekt hemaglutinasyon testi tanı ve özellikle tedavinin
etkinliğini izlemek amacıyla kullanılmaktadır. İndirekt hemaglutinasyon testi %66-100
oranında spesifite ve %1-2 oranında yanlış pozitifliğe sahiptir (20,26). Klinik
uygulamada her iki test birlikte kullanılmaktadır. Olguların %20-34’ünde görülen
eosinofili, diğer hastalıklarda görülebileceğinden, tanı değeri sınırlıdır (20).
353
Tanıda PA Akciğer grafisi yeterli olmaktadır. Toraks tomografisi tanıyı desteklemek
dışında kistin diğer lezyonlardan ayrımında, lokalizasyonlarının ve sayısının
tespitinde kullanılmaktadır.
PA Akciğer grafilerinde, akciğer hidatik kistleri radyolojik görünüm olarak basit
(perfore olmamış) ve komplike (perfore olmuş) olarak iki ayrı görünümde incelenirler.
Komplike olmamış intakt kistler düzgün sınırlı, oval veya sferik, homojen dansite
artışı şeklinde gözlenir. Kistin büyüklüğüne bağlı olarak komşu akciğer dokusunda
atelektatik alanlar gözlenebilir. Karaciğer kistlerinde sık görülen kalsifikasyon
akciğerde nadiren görülmektedir (28,29). Derin inspirasyonda lezyonun ekspirium
grafilerine göre sferik şekilden oval şekle geçiş görülmesi “Escudero-Nemerow
işareti” olarak adlandırılmaktadır (28). Özellikle akciğer apeksinde yerleşmiş kistler
radyolojik olarak pankost tümörünü taklit edebilir ve Horner Sendromu kliniği ile
karşımıza çıkabilir (30). Perikist ile kistin membranı arasına hava girdiğinde intakt
kistin üzerinde hilal şeklinde gölge oluşur ve “Hilal bulgusu” (Moon sign) olarak
adlandırılır. Kist komplike hale gelmiş, rüptüre olmuş ise, rüptür miktarına bağlı
olarak membran içine hava girer ve “Çift kubbe bulgusu” (Double-dome arc sign)
ortaya çıkar. Kaya suyunun bir kısmı ekspektore edildiğinde membranın kaya suyu
üzerindeki görünümü suda yüzen nilüfer çiçeği benzetmesiyle “Nilüfer bulgusu”
(Water-Lily sign, Camalote sign) olarak adlandırılmıştır (29). Kaya suyu tamamen
ekspektore edildiğinde kist boşluğunda sadece germinatif membran bulunabilir
(Resim 28.1). Ayrıca pnömotoraks kliniği ile karşımıza çıkan olgularda, tüp drenaj
sonrası PA akciğer filminde elde edilen görüntü tanı koydurucu olabilmektedir
(30,31).
354
Resim 28.1: PA Akciğer, sağ akciğer alt zonda kist ve germinatif membran görünümü.
Bilgisayarlı tomografi (BT), hidatik kistin erken tanısında, lokalizasyonların
belirlenmesinde ve rüptüre olmuş kistlerin, süpürasyonla seyreden diğer akciğer
hastalıklarıyla karışabilecek radyografik görünümler verdiği durumlarda, ayırıcı
tanıya imkan vermektedir. BT’de intakt kistlerde 3–18 HU dansite ölçülürken perfore
olan kistlerde enfeksiyon ve fibrozis sonucu 20 HU ve üstü değerler saptanabilir
(32). BT ayrıca kistin boyutları ve vital yapılara olan komşuluğuyla ilgili preoperatif
değerlendirmeyi sağlamaktadır (32,33) (Resim 28.2).
Resim 28.2: Toraks BT, kist içinde yüzer görünümde germinatif membran.
355
Magnetik Rezonans (MR) görüntülemenin akciğer hidatik kistlerinin tanısında BT’ye
bir üstünlüğü bulunmamaktadır. Kalp gibi akciğer dışı organ tutulumu düşünülen
olgularda istenebilir (34). Akciğerde hidatik kist tespit edilen olgularda, kistin
yerleşebileceği diğer dokuların araştırılması gerekir. Özellikle ultrasonografi ile
karaciğer tutulumunun olup olmadığının araştırılması önerilmektedir (35). Kalp
tutulumunun araştırılmasında ekokardiografinin yanı sıra MR kullanılmaktadır
(35,36).
Tedavi
Akciğer hidatik kistlerinde tedavi yaklaşımı, karaciğer hidatik kistlerine uygulanan
yöntemlerden
farklılıklar
göstermektedir.
Akciğer
yapılabiliyor ise öncelikle cerrahidir (37,38).
hidatik
kistlerinin
tedavisi
Hasta kliniği ve hastalığın durumu
cerrahiden uzaklaşıyor ise medikal tedavi ve diğer yöntemler önerilebilir.
Cerrahi tedavide kabul gören yaklaşım şekli posterolateral torakotomiyle beraber 5.
veya 6. interkostal aralıktan göğüs boşluğuna ulaşılmasıdır. Cerrahide prensip; kistin
total eksizyonu, maksimum parankim korunması ve kavitenin obliterasyonudur
(37,39). Bu amaçla uygulanan cerrahi teknik ise, kist içeriğinin germinatif mebranla
beraber
tamamen
boşaltılması
(kistotomi)
ve
kist
kavitesinin
kendi
içine
obilterasyonu yani kapitonajdır. Gelişebilecek nükslerin büyük oranda intraoperatif
skoleks yayılımına bağlı olduğunu bildirmektedir (40). Tekniğin uygulanması
sırasında, kist sıvısında bulunan skolekslerin yeni kist oluşturma potansiyellerinin
olduğu bilindiğinden, posterolateral torakotomi sonrası yeri belirlenen kist etrafına,
intratorasik kontaminasyonu önlemek için serum fizyolojik ve betadinle ile ıslatılmış
kompresler konur. Daha sonra kist sıvısı bir iğne yardımı ile hızla aspire edilir ve
membran çıkarılır (40). Perikistik kavite, serum fizyolojik ile sulandırılmış betadinli
solusyonlarla ve kompreslerle temizlenir. Kavite içinde açık olarak tesbit edilen bronş
ağızları absorbabl sutürlerle kapatıldıktan sonra perikistik kavite oblitere edilir
(kapitonaj).
İşlem
sırasında
sutür
materyali
olarak
Poliglactin
(Vicryl)
kullanılmaktadır. Bu teknikte tartışılan bir konu kapitonajın gerekli bir işlem olup
olmadığıdır. Bu tartışmanın nedeni, kistin oluşumu sırasında akciğerin herhangi bir
hasara uğramadan kompresyona uğraması ve akciğerde atelektazinin oluşması;
buna bağlı olarak tedavi, yani kistin boşaltılması ile bu kompresyonun kalkacağı ve
356
atelektazinin zamanla açılacağı düşüncesidir. Tedavi ile boşalan kist kavitesinin
kapitonajının gerekli olmadığını ifade eden yazarlar olsa da, genel kanı ve uygulama
kapitonajın yapılması yönündedir çünkü kapitonaj yapılmadan obliterasyonu zamana
bırakılan kavite zamanla enfekte poş halini alabilir (41,42).
Cerrahi tedavide parankim koruyucu prosedürlere öncelik verilmektedir. Günümüzde
hidatik kist cerrahi tedavisinde rezeksiyonlar tercih edilmemektedir. Rezeksiyonun
ancak bronşektazi veya destroyed lob (harap olmuş lob) oluşmuş olgularda
uygulanabileceği bildirilmektedir (13). Akciğer hidatik kist cerrahi tedavisinde
uygulandığı bilinen diğer bir yöntem Perez Fontana metodu olarak adlandırılan
perikistektomi+kapitonaj tekniğidir (15). Perez fontana tekniğinde kist içeriği olan
membranla birlikte perikistik doku rezeke edilmektedir. Günümüzde gereksiz ve
morbiditesi yüksek bir işlem olduğundan kabul görmemektedir (43). Bir diğer yöntem
periferik yerleşimli intakt kistlerde uygulanan Enükleasyon diğer bir adıyla Barrett
tekniğidir. Perikistin insizyonu ile ulaşılan hidatik membranın rüptüre edilmeden
çıkarılması işlemidir. Bu teknik kist rüptürü riski nedeniyle sık kullanılmamaktadır.
Ancak kolay ulaşılabilen, küçük çapta, rüptür riski düşük kistler için uygulanabilir.
Bilateral yerleşimli akciğer hidatik kistli olgular 2-4 hafta arayla uygulanacak ardışık
torakotomilerle tedavi edilebilir. Öncelik, intakt olan, multiple veya çapı daha büyük
kistin bulunduğu taraf olacaktır (39). Median sternotomi özellikle anterior yerleşim
gösteren perfore olmamış bilateral yerleşimli hidatik kist olgularında uygulanan
yaklaşımdır (44). Posterior yerleşimli veya hayati yapılara yapışıklık olduğu
düşünülen lezyonlarda yeterli görüş alanı sağlanamayacağından, enfeksiyon ve
gelişebilecek komplikasyonlar nedeniyle perfore hidatik kist olgularında ve
karaciğere müdahale edilmesi gereken durumlar dışında uygulanması önerilmektedir
(3,45,45).
Olguların yaklaşık %10–20’sinde akciğer ve karaciğer hidatik kisti birlikte
bulunmaktadır. Sağ akciğer ve karaciğer kubbe kistlerinin birlikte bulunduğu
olgularda en iyi yaklaşım sağ 6-7. interkostal aralıktan uygulanan posterolateral
torakotomi + transdiafragmatik yaklaşımdır (45). Bu olgularda öncelikle akciğer
kistlerine müdahale edilir. Daha sonra karaciğer kisti palpe edilerek diyafram radial
tarzda açılır. Uygun görüş sağlanıp kontaminasyon önleyici tedbirler alındıktan sonra
kaya suyu aspire edilir. Kistotomi uygulanarak germinatif membran uzaklaştırılır.
Kavite germisid bir sıvıyla irrige edildikten sonra kistin büyüklüğüne göre uygun
357
cerrahi yöntem (kapitonaj, intrafleksiyon, omentoplasti) uygulanır. Subdiyafragmatik
drenaj sağlandıktan sonra diyafram nonabsorbabl sutürlerle kapatılır (46). Perkütan
yaklaşımlar kist rüptürüne yol açabileceği, çevre dokulara yayılıma neden olabileceği
ve anafllaksi riski nedeniyle tercih edilmemektedir (24).
Akciğer hidatik kistlerinin birinci basamak tedavisi cerrahi olarak kabul edilmekle
birlikte, tıbbi tedaviyi kullanan ve olumlu sonuçlarını bildiren yayınlar da mevcuttur
(14,46,47). Medikal tedavi, cerrahiyi tolere edemeyecek, genel durumu bozuk olan
olgularda ve çok sayıda hidatik kistli olgularda uygulanmaktadır (46). Medikal tedavi
olarak Benzimidazol türevi ilaçlar (Albendazol 200mg tb, Mebendazol 100mg tb)
kullanılmaktadır. Her iki ilacın metabolitleri serum konsantrasyonuna ulaşıp hidatik
kist sıvısına geçerek etki göstermektedir. Her iki ilaç akciğer hidatik kistlerine diğer
organlardakinden daha fazla etki etmektedir. Akciğer hidatik kistlerinin medikal
tedaviye %68–70 oranında cevap verdiği bildirilmektedir. Tedaviye cevap verme
yanında medikal tedavi ile kür ise %25–34 oranında bildirilmektedir. Medikal tedavi
kist duvarını zayıflatmakta ve perforasyon riskini arttırmaktadır. Medikal tedavi ile
kist perforasyonu insidansı Wen ve ark. tarafından %77 olarak bildirilmiştir (47).
Albendazol kistin glukoz absorbsiyonunu engelleyerek, Mebendazol ise kistin
mikrotubül sistemini etkileyerek, kistin ölmesini sağlamakta, perforasyon gelişmesini
kolaylaştırmaktadır. Kist medikal tedavi ile inaktive hale gelmiş olsa bile, kalan
kaviter lezyonun sekonder enfeksiyonlara açık olduğu unutulmamalıdır (1,2,46).
Tıbbi tedavide günümüzde tercih edilen Albendazoldur. Erişkin ve çocuklarda 2x1015mg veya 2 mg/kg/gün dozunda en az 3 ay süreyle kürler arasında 10 günlük
ilaçsız dönemler bırakılarak kullanılmaktadır (14). Tedaviyle ilişkili olarak kürler
arasında karaciğer fonksiyon testleri, böbrek fonksiyonları ve tam kan sayımı
yapılmalıdır. Her iki ilacın kullanımı sırasında karın ağrısı, kusma, ateş, baş ağrısı,
baş dönmesi, allerjik belirtiler gibi yan etkiler gözlenebilmektedir (48).
Yapılan yayınlarda preoperatif dönemde kemoterapi uygulamanın protoskoleksleri
inaktive ederek nüks riskini azalttığı, kist içi basıncını düşürücü etkisi olduğu
belirtilmiş olsa da, perfore olmamış akciğer hidatik kistlerde tıbbi tedavi
uygulamanın, perforasyon riskini arttırdığı bildirilmektedir (49,50). Uygun olan
özellikle
perfore
olmamış
hidatik
kistleri
yönlendirmektir.
358
tanı
konar
konmaz
cerrahiye
Tıbbi tedavinin diğer bir uygulama yeri özellikle operasyon sırasında sızıntı olduğu
ve çevre dokuların etkilendiği düşünülüyorsa ikincil hidatik kist hastalığı riskini
azaltmak için cerrahi sonrası medikal tedavi uygulanmasının gerekliliğidir. Her iki ilaç
hayvan
deneyi
olarak
teratojenik
olarak
kabul
edildiğinden,
gebelerde
kullanılmamalıdır (51,52).
Korunma
E. Granulosus’un biyolojik çemberinin kırılması hastalığın kontrolünde en önemli
noktayı oluşturmaktadır (1). Özellikle köpekler bu hastalık için esas bulaştırıcı
kaynaktır. Çemberin diğer yarısında ise köpeklerin yiyebileceği hastalıklı etlerin
çevreye dağılmış olması bulunur. Bu iki nokta çevre sağlığı ve koruyucu hekimliğin
önemini göstermektedir.
Bunun için insanlarla bir arada bulunan köpeklerin kontrolü yanında, mezbahalar
ıslah edilmeli, veteriner kontrolünde hastalıklı organlar imha edilmelidir (53).
Echiınococcus Multılocularıs (Alveolar Echinococcosis )
Echinococcosis multilokularisin larval formunun oluşturduğu infeksiyon sonucu
alveolar echinococcosis oluşmaktadır (54). Yaşam döngüsü birkaç farklılık dışında
E. Granulosusa benzemektedir. Ana konak tilki, kedi, kurt veya köpektir. Ara
konaklar ise tarla faresi, fare, sincap, gelincik gibi küçük kemiriciler ve insandır.
Orman köylerinde ve kırsal alanlarda evcil kedi ve köpeğin enfekte olmuş
kemirgenleri yemesi sonrası insanlara bulaşma olmaktadır. Ülkemizde nadir görülür.
Batı-Orta Avrupa gibi soğuk bölgelerde, Rusya’nın büyük bir kısmında,
Asya’da,
Çin
ve
Kanada
gibi
bölgelerde
görüldüğü
bildirilmiştir
orta
(54,55).
E.granulosis’e göre çok daha agresif davranış gösteren E. Alveolaris (alveolar kist)
daha küçüktür ve yumurtaları soğuga karşı çok dirençlidir. İnsanlarda yerleştiği
organlarda etraf dokuları invaze etmesiyle maligniteyi taklit eder bir görünüm
oluşturmaktadır (56,57). İnsanlarda nadiren protoskoleksler görünebilir.
Primer lokalizasyon karaciğer olmaktadır. Lezyonun lokal yayılımı, akciğere ve
beyne yayılması görülebilir (58,59). E. alveolaris nadiren sadece akciğerde lokalize
olur.
359
Alveolar hidatik hastalığının semptomları genellikle belirgin değildir. Karaciğer
kanseri
bulgularını
taklit
edebilen
bulguları
mevcuttur
(60).
Karın
ağrısı,
hepatomegalinin eşlik ettiği epigastrik hassasiyetin yanında, olguların bir kısmında
tıkanma sarılığı görülebilir. Olgularda karaciğer yetmezliği yanında beyinde paraziter
odaklar görülebilir (61).
Serolojik testlerin yanında tanı için karaciğer biyopsisinin önerildiği bildirilmiştir (62).
Tedavide önerilen, etkilenen karaciğer lobunun çıkarılmasıdır. Yine de tanı konduğu
anda
lezyon
ileri evrede
olduğundan olgular genellikle
inoperable
olarak
değerlendirilmektedir (63). Bu olgulara uzun dönem Albendazol (15mg/kg/gün) veya
mebendazol (50 mg/kg/gün) tedavisi önerilmektedir. Medikal tedavi larvanın
büyümesine engel olacak, yayılma miktarını azaltacaktır (53,64).
Askariyaz
Ülkemizin hemen her bölgesinde görülebilen bir helmint enfeksiyondur. Etken
Ascaris lumbricoides’tir.
Enfeksiyon enfekte kişilerin dışkıları ile yayılan
yumurtaların, fekal-oral yolla veya nadiren solunum yoluyla alınması sonucu
oluşmaktadır (53,65). Sindirilen yumurtalardan larvalar serbestleşerek venöz kan
yoluyla karaciğer ve akciğere yerleşir. Akciğerlerde alveollere doğru ilerleyen larva,
sonrasında bronşial yolla orofarenkse ve yutularak yeniden barsaklara geri döner,
erişkin, formu oluşur. Bunun için geçen süre yaklaşık 8–12 haftadır (65-67).
Pulmoner belirtiler larvanın akciğere penetrasyonu ve orofarenkse ilerleyişi sırasında
ortaya çıkan pulmoner eozinofilik infiltrasyonla beraber görülen tabloya aittir. Buna
Loeffler Sendromu denir. Bu sendom farklı etkenlerle oluşabilmekteyse de Ascaris
Loeffler sendromunun en sık nedenidir (68).
Semptomlar genellikle larvanın alveol içinde olduğu dönemde görülür. Sıklıkla
astmatik tipte olan dispne, irritatif ve prodüktif bir öksürük, hışırtlı solunum,
retrosternal yanma hissi olur (66,67,69). Olguların bir kısmında balgamla karışık
hemoptizi yakınması görülebilir. Hepatomegali olguların bir kısmında rastlanabilen
bir bulgudur (65,66,68).
Tanı
Kesin tanı balgamda veya mide yıkama suyunda larvaların gösterilmesiyle konur.
Dışkı incelemesinin negatif olması tanıdan uzaklaştırmayacağı gibi dışkıda yumurta
saptanması etkenin 2–12 ay önce alınmış olduğunu gösterecektir (67,69).
360
Tedavi
Eşlik eden yakınmaların tedavisi yapılmalı, özellikle bronkospasm için uygun tedavi
verilmelidir. Eozinofilik pnömoni gelişen vakalar için kortikosteroidler tedavi
seçeneğidir. Askarisin eradikasyonu için genellikle mebendazol üç gün boyunca
2x100mg veya tek doz 11mg/kg pyrantel pamoat maximum 1gr olarak kullanılabilir
(2,67) Tedavide amaç migrasyona ve barsak obstruksiyonu gibi gelişebilecek
komplikasyonlara engel olmaktır (1,68,67).
Kancalı Kurt Enfeksiyonları
Larvaları, yerleşimi ve gelişmesi bakımından ascaris benzeri bir tablo oluşturabilen
kancalı kurt enfeksiyonları dünyanın büyük bir kısmını etkilemektedir (70).
Yurdumuzda özellikle Karadeniz ve Akdeniz bölgelerinde rastlanmaktaysa da 1950
yılından sonra bu infeksiyonun görülme sıklığında azalma bildirilmiştir (1). Etken
Ancylostoma duodenale ve Necator americanus’tur.
Dışkı yoluyla ortama çıkan yumurtalardan çıkan larvalar, perkutanöz yolla, deriyi
delerek vücuda girer ve venöz akımla akciğer ve karaciğere yerleşir. Ascariste
olduğu gibi alveol, bronşial yol sonrası orofarenkse çıkar ve yutularak bağırsaklarda
olgun halini alır (70,71).
Cilt giriş yerinde eritem, kaşıntı, ödemin eşlik ettiği çeşitli cilt reaksiyonları
oluşturabilir (71,72).
Larvalar akciğere penetre olduklarında öksürük, hırıltılı
solunum, balgamla karışık kan ekspektorasyonu görülebilir. Eozinofili gelişmesiyle
Loeffler Sendromuna neden olabilir (73). Olgun larvanın barsak yerleşimi sonrası
ishal, kilo kaybı, çocuklarda malnutrisyon gelişebilir.
Tanı
Dışkıda yumurtaların görülmesiyle konur.
Tedavi
Ascaris tedavisi ile aynıdır. Mebendazol üç gün boyunca 2x100mg veya tek doz
11mg/kg pyrantel pamoat maximum 1gr kullanılabilir (74,75).
Şistozomiyaz
Dünyada belirli bölgelerde farklı türleriyle görülebilen helmintik infeksiyonlardan
biridir. Ülkemizde kan yassı solucanı olarak bilinen Schistosoma haematobium
enfeksiyonuna özellikle güneydoğu Anadolu bölgesinde rastlanıldığı bildirilmektedir.
361
Türkiye Parazitoloji Derneğinin 1993 yılına ait bir yayında 1985–1990 yılları arasında
210 adet S. Haematabium enfeksiyonu bildirmiştir (53).
Schistosoma mansoni, S. japonicum, S. mekongi, S. intercalatum barsak
şistosomiyazis etkenleridir. Schistosoma haematobium ise üriner şistosomiyazis
etkenidir (76-78).
Dışkı yoluyla ortama yayılan yumurtalar, sularda özellikle salyangoz türlerinde
gelişmelerini tamamlar. Salyangozdan suya geçen serkarya formu insanların deri ve
mukozalarını geçerek vücuda girer. Karaciğer ve akciğer yerleşimi hematojen yol
sonrası oluşur. Son hali olan erişkin formunu mezenterik venüllerde veya vezikal
venüllerde tamamlayarak yumurta atılımı başlar (2,53,77).
Şistozomiyazis akciğer tutulumu üç aşamada gerçekleşir. Özellikle akut evrede
izlenen ‘’katayama ateşi’’ primer enfeksiyon sonucu gelişir. Olgularda öksürük, ateş,
titreme, karın ağrısı, ishal, kilo kaybı, miyalji gelişir. Öksürükle beraber bronkospazm
olabilir (76).Hastalığın 2. aşaması olan hepatosplenik hastalıkta hepatik granülomlar
ve fibrozis gelişebilir. Sonuçta portal hipertansiyon ve sistemik kollateral gelişerek
pulmoner sisteme doğru olgun yumurtalar göç ederler. Son dönemde ise
antisistosomal tedaviye rağmen yumurtalar pulmoner sisteme geçer ve kor
pulmonale gelişir (76,79).
Tanı
İdrar ve gaitada yumurta saptanmasıyla tanı konabilir. Ultrasonografi standart tanı
yöntemi olmuştur. Karaciğer tutulumu olan fibrozisin patalojik olarak gösterilmesi ile
kesin tanı konur (77,78).
Tedavi
Praziquantel tüm türlere etkindir. S. Haematobium infeksiyonlarında 2x20mg/kg, bir
günlük tedavi şeklinde kullanılır (80).
Amebiyaz
Paraziter hastalıklar içinde ölüme sebebiyet verenler arasında üçüncü sırada yer
aldığı bildirilmektedir (1,2,81). Gelişmemiş ve gelişmekte olan ülkelerde sıklıkla
rastlanır ve seyahat edenlerde görülen enfeksiyonların en önemli nedenlerinden
biridir. Ülkemizde özellikle doğu illerimizde amebiyaz insidansının yüksek olduğu
Türkiye Parazitoloji Derneği tarafından 1993 yılında bildirilmiştir (53). Etken
Entameoeba histolytica’dır.
362
Amebiyazis çoğunlukla solunum sistemini primer organdaki (sıklıkla karaciğer)
hastalığa sekonder tutar (2). Çoğunlukla diğer organlarda yerleşen parazitin neden
olduğu pulmoner komplikasyonlar solunum sistemi amebiyazisinin kliniğini oluşturur.
Başlangıçta enfeksiyon, kist formunun, hastalıklı yiyecek ve içeceklerle bulaşmasıyla
oluşmaktadır. İnce barsak son kısımlarında kist açılır ve açığa çıkan trofozoitler
kolonda yerleşerek gelişir. Parazitin aktif ve büyüyen evresi trofozoit formudur.
Amipler portal yolla karaciğere sonrasında akciğere ulaşır. Ayrıca karaciğerden
komşuluk yoluyla direkt toraksa veya lenfatik yayılımla kalp ve diğer dokulara
yayılabilir (81).
Karaciğere portal yolla ulaşması sonrası venüllerde tromboz oluşturması ile infarkt,
nekroz ve lokalize abse oluşturur. Abse gelişimi karakteristik özelliğidir (82).
Olgularda ateşli veya ateşsiz dönemler şeklinde sağ üst karın ağrısı görülebilir ve
tabloya hepatomegali eşlik edebilir (83). Pulmoner tutulum sonrası akciğer grafisinde
diyaframda elevasyon ve eşlik eden pevral effüzyon görülebilmektedir (84) BT ve
MR tanıda faydalıdır. Dokularda litik etki oluşturabilir ve karaciğerde yerleşen abse
toraks
boşluğuna
yakın
komşuluğu
nedeniyle
diyaframı
geçerek
torasik
komplikasyonlara neden olabilir (%70–97) (85). Plevral effüzyon gelişen olguların
%50-70’inde ampiyem görülür (84). Plevral kalınlaşma ampiyem süresiyle ilgili
olarak gelişmektedir. Olguların bir kısmında karaciğerden akciğer yayılım sonrasında
bronkobilier fistül gelişebileceği bildirilmiştir (86).
Tanı
Dışkı kültürü, balgamda ve bronşial lavajda parazitin görülmesi tanı koydurucudur.
Klinik ve radyolojik inceleme korelasyonu önemlidir (87). Bilgisayarlı tomografi ve
USG tanıda yardımcı olur.
Tedavi
Amebiasisin
tüm
formlarının
tedavisinde
medikal
tedavi
uygulanmaktadır.
Metranidazol tercih edilmesi gereken ilaçtır. Oral olarak 750 mg tablet veya ıv olarak
günde 3 sefer uygulanması gereken 500mg’lık dozlar kullanılmaktadır ve tedavi
süresi 14 gündür. Metranidazol ile tedavi sağlanamayan olgularda klorokinin
600mg/gün 3 gün sonrası 300mg/gün/2-3 hafta eklenmesi gerekmektedir (84).
Belirgin effüzyonu olan hastalarda medikal tedaviye ek olarak torasentez, ampiyem
gelişmiş vakalarda, tüp torakostomi uygulanır. Plevral kalınlaşma, akciğerde fistül ve
apse gibi komplikasyonların geliştiği vakalarda cerrahi yaklaşım düşünülmelidir.
363
Toksoplasmoz
Enfekte kedilerden insanlara bulaşma sonrası gelişen paraziter bir hastalıktır.
Doğada Ookist, kist ve taşizoit olarak üç formda bulunmaktadır. Enfekte kedilerde
oluşan ookistler dış ortama atılır ve bir-beş gün içinde matür hale gelip bulaşıcılığı
sağlar. Kontamine yiyecek ve içecekler ile veya yakın temas sonrası sindirim
kanalından alınmasıyla insanlara bulaşma olur (88). Etken Toxoplasma gondii’dir.
Bulaşma çoğu zaman mikroplu etlerin çiğ veya az pişmiş olarak yenmesiyle
olmaktadır. İnsanlarda enfeksiyondan sorumlu olan form taşizoit formudur ve hücre
içine yerleşerek kist formunu oluşturmaktadır. Kan transfüzyonu ve gebelikte
anneden çocuğa bulaşma dışında insandan insana bulaşma olmamaktadır.
Olguların çoğu semptom vermezler. Hastalık özellikle bağışıklık sistemi bozuk olan
olgularda ve hücresel bağışıklığı baskılayıcı tedavi alan olgularda gelişmektedir
(88,89). Sıklıkla tutulan organlar sırasıyla beyin (%76), kalp (%38), ve akciğerdir
(%23) (71,72).
Akciğer
yerleşimi
diğer
hücresel
bağışıklık
yetmezliği
sonrası
görülebilen
enfeksiyonlarla birlikte olabilir. Bulgu olarak pnömoniye özgü nonspesifik bulgularla
karşımıza çıkabilmektedir (89).
Tanı
Balgam, bronşial lavaj ve kandan T. Gondii izolasyonu ve serolojik çalışmalar ile
konur. Taşizoitlerin balgam ve lavajda görülmesi pulmoner toxoplasmosiz için tanı
koydurucudur (90).
Tedavi
Primetamin 50–100 mg’lık yükleme dozu sonrası 25mg/gün ve sülfodiyazin 4gr
yülleme dozu sonrası 4x1gr olarak kullanılmaktadır. Tedavi sırasında kemik iliği
baskılanması
olasılığı
bulunduğundan
folik
asit
desteği
10mg/gün
olarak
önerilmektedir (1,2,89).
Paragonomiyaz
Akciğerin yassı kurt hastalığı olarak bilinen paragonomiyaz hastalığı, özellikle
güneydoğu Asya, Çin’in bazı bölgelerinde, Japonya, Filipinler, Batı Afrika ve Güney
Amerika’da görülebilmektedir (91). Avrupa’da nadir olarak görülmektedir. İnsanlarda
364
enfeksiyon, beslenme alışkanlıklarına bağlıdır. Özellikle enfekte larvalar içeren
yengeç ve karides gibi deniz ürünlerinin pişirilmeden yenmesiyle bulaşır.
Etken Paragonimus westermani’dir. Sindirim sitemine giren metaserkaryalar,
intestinal duvara penetre olarak abdominal kaviteye girer ve abdomen kasları içinde
yerleşir. Parazit buradan diyaframa doğru ilerler ve pulmoner doku içine yerleşirler.
Parazit akciğer dokusu içinde uzun yıllar yaşayabilir. Pulmoner parankim dokusu
içinde parazite karşı fibröz kapsül dokusu gelişir. Kapsül içinde olgunlaşan parazit,
yassı solucanlar haline gelir ve sıklıkla bronşioyole açılır. Klinik paragonomiyaz
hastalığının yer değiştirmesine ve gelişimine bağlı olarak değişmektedir. Özellikle
pulmoner yerleşimli paragonomiyazda öksürük, hemoptizi, göğüs ağrısı ve dispne
görülmektedir (91,92).
Tanı
Akciğer grafisinde pnömotoraks, plevral effüzyon, plevral kalınlaşmalar, nodüler
görünüm, kaviter oluşumlar veya infiltrasyonlar görülebilir. BT tanıyı destekler. Kesin
tanı balgamda, bronkoalveolar lavajda veya plevral sıvıda yumurtaların gösterilmesi
ile konur (93).
Tedavi
Praziquantel ilk seçenek ilaçtır. 40mg/kg/gün dozunda iki veya üç gün kullanılır.
Pulmoner tutulumlarda medikal tedaviye yanıt alınamamışsa girişim gerekebilir (94).
Paragonimus enfeksiyonlarının pulmoner tutulumu, pnömotoraks, plevral effüzyon,
ampiyem yada perikardiyal effüzyon kliniği ile karşımıza çıkabilir. En önemli
komplikasyon ampiyemdir. Böyle durumlarda genel tedavi prensipleri geçerlidir.
Minimal effüzyon veya pnömotoraks olgularında gözlem yeterli olurken, büyük
pnömotoraks, fazla miktarda effüzyon ve ampiyem varlığında tüp torakostomi
uygulanmalıdır.
Kronik
amipem
vakalarında
kalınlaşmış
plevral
yüzeylerin
çıkarılması ve akciğerin ekspansasyonunun sağlanabilmesi için dekortikasyon
gerekebilir (95).
KAYNAKLAR
1. Köktürk O, Gürüz Y, Akay H, Akhan O ve ark. Toraks Derneği Paraziter Akciğer
Hastalıkları Tanı ve Tedavi Rehberi 2002;3 :0-10
2. Arman D. Paraziter Akciğer İnfeksiyonları. Solunum Sistemi İnfeksiyonları. Türk
Toraks Derneği Yayınları. 2001; 283-309
365
3. Aletros H, Symbos PN. Hydatid disease of the lung. In: Shields TW, Lo Cicero J
III, Poon RB eds.General Thoracic Surgery. Philadelphia: Lippincott Williams and
Williams; 2000;1113-1122
4. Yüksel M, Kalaycı G; Akciğer kist hidatiğinin cerrahi tedavisi. In: Yüksel M, Kalaycı
G, eds. Göğüs Cerrahisi. İstanbul. Bilmedya Grup; 2001: 647-58.
5. Pineyro JR. Hydatid disease of the lung. Prog Pediatr Surg. 1982;15:113-8.
6. Thompson RC. Biology and systematics of Echinococcus. In: Thompson RC and
Lymberg
AJ
ed.
Echinococcus
and
Hydatid
Disease.
London:
C.A.B
International;1995;1-37
7. WHO Informal Working Group on Echinococcus. Guidelines for treatment of cystic
and alveolar ekinokokkoz in humans. Bull World Health Organ. 1996; 74(3):231-42
8. Craig PS, Larrieu E. Control of cystic echinococcosis/hydatidosis: 1863-2002.
Adv Parasitol. 2006;61:443-508.
9. Welle PF. Parasitic pneumonias. In: Pennington JE ed. Respiratory Infections:
Diagnosis and Management, 2th ed. New York, Raven Press; 1998:583-600.
10. Yuncu G, Sevinç S. Akciğer Hidatik Kistleri. In: Ökten İ, Güngör A ed. Göğüs
Cerrahisi, Cilt 2; Ankara,Türk Göğüs Cerrahisi Derneği, 2003:1011-1024
11. Macpherson CN. An active intermediate host role for man in the life cycle of
Echinococcus granulosus in Turkana, Kenya. Am J Trop Med Hyg. 1983; 32(2): 397404.
12. Chaouachi B, Nouri A, Ben Salah S, Lakhoua R, Saied H. Hydatid cyst of the
lung in children. Apropos of 643 cases. Pediatrie. 1988;43(9):769-73.
13. Topcu S, Kurul IC, Tastepe AI et al. Surgical treatment of pulmonary hydatid
cysts in children, J Thorac Cardiovasc Surg, 2000;120:1097- 101.
14. Ben Brahim M, Nouri A, Ksia A, El Ezzi O, et al. Management of multiple
echinococcosis in childhood with albendazole and surgery. J Pediatr Surg.
2008;43(11):2024-30.
15. Doğan R, Yüksel M, Çetin G, et al. Surgical treatment of hydatid cysts of the
lung: report of 1055 patients. Thorax, 1989; 44: 192- 9.
16. Zidane A, Arsalane A, Atoini F, Kabiri EH. Extra-pulmonary thoracic hydatid
cysts Rev Pneumol Clin. 2006;62(6 Pt 1):386-9
366
17. Abounadi R, El Meziane A, El Biaze M, Bakhatar A, et al. Cardiac hydatidosis
with dissemination to the pulmonary parenchyma and the pulmonary artery. Rev
Pneumol Clin. 2006;62(4):247-51.
18. Bortoletti G, Ferretti G. Ultrastructural aspects of fertile and sterile cysts of
Echinococcus granulosus developed in hosts of different species. Int J Parasitol.
1978;8(6):421-31
19. Varela-Díaz VM, Coltorti EA, Ricardes MI, et al. The immunoelectrophoretic
characterization of sheep hydatid cyst fluid antigens. Am J Trop Med Hyg. 1974;
23(6):1092-6.
20. Biava MF, Dao A, Fortier B. Laboratory diagnosis of cystic hydatic disease.
World J Surg. 2001;25(1):10-4.
21. Thameur H, Chenik S, Abdelmoulah S, Bey M, et al. Thoracic hydatidosis. A
review of 1619 cases. Rev Pneumol Clin. 2000;56(1):7-15
22. Ekim H, Ozbay B, Kurnaz M, Tuncer M, et al. Management of complicated giant
thoracic hydatid disease. Med Sci Monit. 2009;15(12):600-5
23. Ben M'Rad S, Mathlouthi A, Merai S, Mestiri I, et al. Pulmonary embolism of
hydatic origin. Presse Med. 1998;27(5):205-7
24. Topuzlar M, Eken C, Ozkurt B, Khan F. Possible anaphylactic reaction due to
pulmonary hydatid cyst rupture following blunt chest trauma: a case report and
review of the literature. Wilderness Environ Med. 2008;19(2):119-23.
25. Chacko J, Raot S, Basawaraj K, Chatterjee S. Ruptured hydatid cyst
masquerading as tension pneumothorax. Anaesth Intensive Care. 2009;37(5):840-2.
26. Zarzosa MP, Orduña Domingo A, Gutiérrez P, Alonso P, et al. Evaluation of six
serological tests in diagnosis and postoperative control of pulmonary hydatid
disease patients. Diagn Microbiol Infect Dis. 1999;35(4):255-62.
27. Kurutepe M. Kist Hidatik Hastalığının Parazitolojisi, İmmunolojisi ve Laboratuar
Tanı Yöntemleri. Heybeliada Tıp Bülteni1996;1:7-12.
28. Von-Sinner WN. New diagnostic signs in hydatid disease: radiography,
ultrasound, CT and MRI correlated to pathology. Eur J Radiol, 1991;12(2): 150-159.
29. Erdem CZ, Erdem LO. Radiological characteristics of pulmonary hydatid disease
in children: less common radiological appearances. Eur J Radiol. 2003;45(2):123-8.
30. Ziyade S, Soysal O, Ugurlucan M, Yediyildiz S. Pancoast hydatid cyst leading to
Horner syndrome: thoracic hydatidosis. Heart Lung Circ. 2009;18(5):363-4.
367
31. Chacko J, Raot S, Basawaraj K, Chatterjee S. Ruptured hydatid cyst
masquerading as tension pneumothorax. Anaesth Intensive Care. 2009;37(5):840-2.
32. Kervancioglu R, Bayram M, Elbeyli L. CT findings in pulmonary hydatid disease.
Acta Radiol. 1999;40(5):510-4.
33. Mrad Dali K, Tlili K, Ly M, Romdhani N, Bakir D, Gharbi H, Ennabli K, Jeddi M.
Radioclinical profile of cardiopericardial hydatid: report of 17 cases. Ann Cardiol
Angeiol (Paris). 2000;49(7):414-22.
34. Ben M'Rad S, Mathlouthi A, Merai S, Ghrairi H, et al. Multiple hydatid cysts of the
thigh: the role of magnetic resonance imaging. J Radiol. 1998;79(9):877-9
35. Thameur H, Abdelmoula S, Chenik S, Bey M, et al. Cardiopericardial hydatid
cysts. World J Surg. 2001;25(1):58-67.
36. Thameur H, Abdelmoula S, Chenik S, Bey M, Ziadi M, Mestiri T, Mechmeche R,
Chaouch H. Cardiopericardial hydatid cysts. World J Surg. 2001;25(1):58-67.
37. Minas M, Biluts H, Bekele A, Alemie M. Surgical management of 234 patients
with hydatid disease: the Tikur Anbessa Hospital experience. Ethiop Med J.
2007;45(3):257-65.
38. Ulkü R, Yilmaz HG, Onat S, Ozçelik C. Surgical treatment of pulmonary hydatid
cysts: report of 139 cases. Int Surg. 2006;91(2):77-81.
39. Aghajanzadeh M, Safarpoor F, Amani H, Alavi A. One-stage procedure for lung
and liver hydatid cysts. Asian Cardiovasc Thorac Ann. 2008;16(5):392-5.
40. Dziri C, Haouet K, Fingerhut A, Zaouche A. Management of cystic
echinococcosis complications and dissemination: where is the evidence? World J
Surg. 2009;33(6):1266-73.
41. Bilgin M, Oguzkaya F, Akçali Y. Is capitonnage unnecessary in the surgery of
intact pulmonary hydatic cyst? ANZ J Surg. 2004;74(1-2):40-2.
42. Turna A, Yilmaz MA, Haciibrahimoğlu G, Kutlu CA, Bedirhan MA. Surgical
treatment of pulmonary hydatid cysts: is capitonnage necessary? Ann Thorac Surg.
2002;74(1):191-5.
43. Barret N.Surcigal treatment of hydatid cyst of the lung.Thorax.1947;2:21-57
44. Dhaliwal RS, Kalkat MS. One-stage surgical procedure for bilateral lung and liver
hydatid cysts. Ann Thorac Surg. 1997;64(2):338-41.
368
45. Kurul IC, Topcu S, Altinok T, Yazici U, et al. One-stage operation for hydatid
disease of lung and liver: principles of treatment. J Thorac Cardiovasc Surg.
2002;124(6):1212-5.
46. Utkan NZ, Cantürk NZ, Gönüllü N, Yildirir C, et al. Surgical experience of hydatid
disease of the liver: omentoplasty or capitonnage versus tube drainage.
Hepatogastroenterology. 2001;48(37):203-7.
47. Wen H, Zou PF, Yang WG, Lu J, et al. Albendazole chemotherapy for human
cystic and alveolar echinococcosis in north-western China. Trans R Soc Trop Med
Hyg. 1994;88(3):340-3
48. De Rosa F, Teggi A. Treatment of Echinococcus granulosus hydatid disease
with albendazole. Ann Trop Med Parasitol. 1990;84(5):467-72.
49. Todorov T, Vutova K, Donev S, Ivanov A, et al. The types and timing of the
degenerative changes seen in the cysts during and after benzimidazole treatment of
cystic echinococcosis. Ann Trop Med Parasitol. 2005;99(7):649-59.
50. Kilic D, Findikcioglu A, Bilen A, Koc Z, Hatipoglu A. Management of complicated
hydatid cyst of the thorax. ANZ J Surg. 2007 Sep;77(9):752-7.
51. Tertemiz KC, Gökçen B, Onen A, Akkoçlu A. Pregnancy and hydatid cyst.
Tuberk Toraks. 2008;56(1):96-9.
52. Yeh WW, Saint S, Weinberger SE. Clinical problem-solving. A growing
problem—a 36-year-old pregnant woman at 21 weeks of gestation presented with a
4-week history of a dry, nonproductive cough. N Engl J Med. 2007;5:489-94.
53. M.Ali Öncel. GAP ve Parazit Hastalıkları. İzmir. Parazitoloji Derneği Yayınları
(11);1993
54. Tarczynski S. Independence of Echinococcus multilocularis Leuckart, 1863
species. Wiad Parazytol. 1958;4(2):109-19.
55. Dyachenko V, Pantchev N, Gawlowska S, Vrhovec MG, Bauer C. Echinococcus
multilocularis infections in domestic dogs and cats from Germany and other
European countries. Vet Parasitol. 2008;157(3-4):244-53.
56. Ozkok A, Gul E, Okumus G, Yekeler E,et al. Disseminated alveolar
echinococcosis mimicking a metastatic malignancy. Intern Med. 2008;47(16):1495-7.
57. Demir MK, Kilicoğlu G, Akinci O. Alveolar hydatid disease of the liver: brief
review and spectrum of adjacent organ invasion. Australas Radiol. 2007;51(4):34650.
369
58. Asri F, Tazi I, Maaroufi K, El Moudden A, Ghannane H, Ait Benali S. Cerebral
hydatic cyst and psychiatric disorders. Two cases. Encephale. 2007;33(2):216-9.
59. Senturk S, Oguz KK, Soylemezoglu F, Inci S. Cerebral alveolar echinoccosis
mimicking primary brain tumor. AJNR Am J Neuroradiol. 2006;27(2):420-2.
60. Stefaniak J. Alveolar echinococcosis due to Echinococcus multilocularis as a
common cause of diagnostic mistakes in differential diagnosis of the liver cancer.
Pol Arch Med Wewn. 2006;116(3):896-902.
61. Llanes EG, Stibal A, Mühlethaler K, Vajtai I, et al. Echinococcosis presenting as
an otogenic brain abscess: an unusual lesion of the middle ear cleft and temporal
lobe. Auris Nasus Larynx. 2008;35(1):115-20.
62. Zorikhina VI. Studies on immuno-diagnosis of echinococcosis. I. Intradermal
tests with various antigens in alveolar and hydatid forms of echinococcosis. Med
Prom SSSR. 1961;30:86-92.
63. Uhl W, Löffler H, Zimmermann A, Tcholakov O, et al. Surgical treatment of
echinococcosis of the liver. Swiss Surg. 1999;5(3):126-32.
64. Kern P. Medical treatment of echinococcosis under the guidance of Good
Clinical Practice (GCP/ICH). Parasitol Int. 2006;55 Suppl:S273-82
65. Zamora Almeida O. Localization of Ascaris lumbricoides in the thoracic cavity.
Report of a case. Rev Cubana Med Trop. 1976;28(2):71-5.
66. Morrow DA. Pneumonia in cattle due to migrating Ascaris lumbricoides larvae. J
Am Vet Med Assoc. 1968 Jul 15;153(2):184-9.
67. Sarinas PS, Chitkara RK. Ascariasis and hookworm. Semin Respir Infect.
1997;12(2):130-7.
68. Spillmann RK. Pulmonary ascariasis in tropical communities. Am J Trop Med
Hyg.1975;24(5):791-800.
69. Murgoci G. Difficulties in the diagnosis of prolonged pulmonary eosinophilic
infiltration in a child. Pneumoftiziologia. 1993;42(4):45-8.
70. Hoagland KE, Schad GA. Necator americanus and Ancylostoma duodenale: life
history parameters and epidemiological implications of two sympatric hookworms of
humans. Exp Parasitol. 1978;44(1):36-49.
71. Fishman AP, Elias JA, Fishman JA, et al, eds. Fishman’s Pulmonary Diseases
and Disorders. New York: McGraw-Hill Book Company; 1998.
370
72. Gutierrez Y. Diagnostic pathology of Parasitic Infections with Clinical
Correlations. London: Lea& Febiger, Philadelphia; 1990.
73. Pelloux H, Moro D, Rejasse C, Ambroise-Thomas P. A case of tropical
pulmonary eosinophilia. Clin Infect Dis. 1994;19(1):217-8.
74. Oyerinde JP. Human Ancylostoma infections in Nigeria. Ann Trop Med Parasitol.
1978;72(4):363-7.
75. Georgiev VS. Necatoriasis: treatment and developmental therapeutics. Expert
Opin Investig Drugs. 2000;9(5):1065-78.
76. Bethlem EP, Schettino Gde P, Carvalho CR. Pulmonary schistosomiasis. Curr
Opin Pulm Med. 1997;3(5):361-5.
77. Chiavaroli R, Grima P, Grima P. Detection of early liver fibrosis in patients with
intestinal schistosomiasis: sonographic and histologic findings in Schistosoma
mansoni infection. Infection. 2008;36(6):585-9.
78. Nozaki Y, Inamori M, Fujita K, Yoneda M, et al. Asymptomatic hepatic
schistosomiasis detected by ultrasonograpy and confirmed by liver biopsy. Intern
Med. 2009;48(12):1109-10.
79. Schwartz E. Pulmonary schistosomiasis. Clin Chest Med. 2002;23(2):433-43.
80. Shekhar KC. Schistosomiasis drug therapy and treatment considerations. Drugs.
1991;42(3):379-405.
81. Badalamenti S, Jameson JE, Reddy KR. Amebiasis. Curr Treat Options
Gastroenterol. 1999;2(2):97-103.
82. Goessling W, Chung RT. Amebic Liver Abscess. Curr Treat Options
Gastroenterol. 2002;5(6):443-449.
83. Papavramidis TS, Sapalidis K, Pappas D, Karagianopoulou G,et al. Gigantic
hepatic amebic abscess presenting as acute abdomen: a case report. J Med Case
Reports. 2008;12(2): 325.
84. Lyche KD, Jensen WA, Kirsch CM, Yenokida GG, et al. Pleuropulmonary
manifestations of hepatic amebiasis. West J Med. 1990;153(3):275-8.
85. Horo K, N'gom A, Aké C, Kouassi BA, et al. Remarkable evolution of hepatic,
pleural and pulmonary amoebiasis: a case report. Rev Mal Respir. 2009;26(5):54751
371
86. Partrinou V, Dougenis D, Kritikos N, Polydorou A, et al. Treatment of
postoperative bronchobiliary fistula by nasobiliary drainage. Surg Endosc.
2001;15(7):758.
87. Mortelé KJ, Segatto E, Ros PR. The infected liver: radiologic-pathologic
correlation. Radiographics. 2004;24(4):937-55.
88. Elmore SA, Jones JL, Conrad PA, Patton S, et al. Toxoplasma gondii:
epidemiology, feline clinical aspects, and prevention. Trends Parasitol. 2010; 2.
89. Leal FE, Cavazzana CL, de Andrade HF Jr, Galisteo AJ Jr, et al. Toxoplasma
gondii pneumonia in immunocompetent subjects: case report and review. Clin Infect
Dis. 2007;15;44(6):e62-6
90. Contini C. Clinical and diagnostic management of toxoplasmosis in the
immunocompromised patient. Parassitologia. 2008;50(1-2):45-50.
91. Singh TN, Singh HR, Devi KhS, Singh NB, Singh YI. Pulmonary paragonimiasis.
Indian J Chest Dis Allied Sci. 2004;46(3):225-7.
92. Carré JC, Houmdaophet S. Paragonimiasis. Rev Pneumol Clin. 1998;54(6):35964.
93. Romeo DP, Pollock JJ. Pulmonary paragonimiasis: diagnostic value of pleural
fluid analysis. South Med J. 1986;79(2):241-3.
94. Pezzella AT, Yu HS, Kim JE. Surgical aspects of pulmonary paragonimiasis.
Cardiovasc Dis. 1981;8(2):187-194.
95. Mukae H, Nakamura-Uchiyama F, Nawa Y. Pulmonary Paragonimiasis and Its
Surgical Complications. In: Shields TW, Lo Cicero J III, Poon RB eds.General
Thoracic Surgery. Philadelphia: Lippincott Williams and Williams; 2000;1113-1122
372
29.
Yrd. Doç. Dr. Mertol Gökçe
Zonguldak Karaelmas Üniversitesi, Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞER TÜBERKÜLOZUNDA CERRAHİ TEDAVİ
Tüberküloz (TB), “Mycobacterium Tuberculosus” adı verilen gram negatif ve aside
dirençli boyanan (ARB +), aerob bir basilin yaptığı enfeksiyondur.
İlk olarak Robert Koch 1882’de tüberküloz basilini tespit etmiştir (1). Bu bakteriler
yavaş üreyen, aside dirençli (yani arilmetan boyalarla bir kez boyandıktan sonra asit
ve alkol ile dekolorize edilemezler), hücre duvarlarında bol miktarda lipid (mycolic
asit) içeren bakterilerdir. Mycobacterium tuberculosis dışında 70’in üzerinde tür
tanımlanmıştır. Bunlar “Mycobacterıum Tuberculosus Complex” adı altında toplanır
(2). Bunların içinde major 2 patojen Mycobacterium tuberculosis ve Mycobacterium
leprae’dır. Mycobacterium Africanum, Bovis ve Microtti nadiren hastalık nedenidir. M.
Microtti sadece kemiricilerde hastalık yapar. Diğer mikobakteriler tüberküloz dışı
(non tuberculous) olarak adlandırılır ve nadiren ama daha çok immün yetersizliği olan
veya altta respiratuar başka bir hastalığı olanlarda hastalık yapar. Tüberküloz dışı
bakteriler kişiden kişiye yayılmazlar. Dünya sağlık örgütü (WHO) 2005 yılında dünya
genelinde 8,8 milyon yeni TB vakası (bunların 7,4 milyonu Asya ve Afrika) ve 1,6
milyon TB’dan kaynaklanan ölüm olduğunu bildirmiştir (3).
M. Tuberculosis en sık akciğerde enfeksiyon oluşturur (Pulmoner TB) ancak akciğer
dışı enfeksiyona da (Non-Pulmoner TB) yol açabilmektedirler.
Akciğer dışı (Non-Pulmoner) TB hastalıkları
Akciğerde tutulum olmaksızın diğer organlarda saptanan TB ifade eder. Genel olarak
tüberküloz %80 akciğerde görülürken, %20 akciğer dışı organlarda saptanmaktadır.
TB Lenfadenit (scrofula)
En sık rastlanan ekstrapulmoner TB formudur. Hastalık primer pulmoner odaktan
hematojen yolla yayılan tüberküloz basilleriyle meydana gelmektedir. En sık tutulan
lenf nodları anterior servikal ve supraklavikuler lenf nodlarıdır.
Plevra TB
En sık ikinci ekstra pulmoner TB dur. Plevral boşlukta toplanan sıvı %98 oranında
plevral membranın alerjik reaksiyonu sonucudur (4). Sıvı eksuda vasfındadır. Sıvıda
500–2500 hücre bulunur ve hücrelerin %90’ı lenfosittir. Plevral sıvıdan ARB kültürü
%25–33 pozitiftir. Fakat plevradaki granülomlardan alınacak biyopsi ile yapılacak
kültür %75 oranında pozitif bulunur.
373
Genitoüriner sistem TB
Basilin uzak bir odaktan hematojen yayılımı ile oluşur. Genellikle her iki böbrek de
enfektedir. Noktüri, pollakiüri, hematüri ve steril piyüri görülebilir.
İskelet sistemi TB
Hematojen yayılımla vertebra korpusunun ön kısmı veya uzun kemiklerin
metafizlerine yayılım sonucu oluşur. Siyah ırkta daha sık görülür. İlk lezyonda daha
çok osteomiyelit ve artrit ile birliktedir ve %90 monoartiküler tutulum olur.
TB.Perikardit
Doğrudan yayılımla veya subkarinal lenf bezinden lenfatik drenajla yayılarak TB
perikardit meydana gelir. Ateş, öksürük, kilo kaybı, halsizlik, göğüs ağrısı, dispne ve
ortopne gelişebilir. Fizik muayenede ayak bileğinde ödem, dinlemekle perikardiyal
sürtünme sesi duyulur. Perikard sıvısı serofibrinoz veya hafif hemorajiktir. Tanı için
EKG ve ekokardiyografi yararlıdır, radyografide çadır kalp görünümü vardır; kesin
tanı için perikard sıvısında veya dokuda TB basilinin veya perikardda kazeöz
granülomların gösterilmesi gereklidir.
Tüberküloz Menenjit
TB’nin en ağır formudur. Her yaşta görülebilir ama en sık 5 yaş altında sıktır. Prİmer
enfeksiyondaki basil hematojen yolla meninkslere ulaşmaktadır.
Miliyer Tüberküloz
Primer infeksiyon sırasında ya da bundan uzun bir süre sonra tüberküloz basillerinin
yoğun hematojen yayılımına bağlı olarak oluşmaktadır. Akciğer grafisinde ve göğüs
tomografisinde yaygın milimetrik nodüler görünüm izlenir ve milier TB tanısında en
önemli tetkiktir. Balgam ARB’de %80 basil tespit edilemez. Sepsis ve hematolojik
anormallikler (trombositopeni, lökopeni, anemi, lökomoid reaksiyon, polisitemi,
miyelofibrosis) yaygındır. Pansitopeni, ateş, kilo kaybı vakalarında Milier TB mutlaka
düşünülmelidir (5).
TB ayrıca peritonit, intestinal TB, adrenal TB şeklinde ve deri, karaciğer, dalak ve çok
nadiren de diğer organlarda görülebilmektedir.
374
Resim 29.1: Postero-anterior akciğer grafide sol hemitoraks apekste TB kavitesi izleniyor.
Akciğer Tüberkülozunda Cerrahi Tedavi
Akciğer TB cerrahi tedavi anti-TB ilaçların keşfinden önce özellikle 1950 ortalarına
kadar önemli rol oynamaktaydı. Cerrahi tedavi akciğerin kollapsı esasına
dayanıyordu. Bu nedenle yapay (artifisyel) pnömotoraks, frenik sinir paralizisi,
pnömoperituan,
plombaj
torakoplasti
ve
klasik
torakoplasti
operasyonları
yapılmaktaydı. Kollaps tedavisinde ilk yapay pnömotoraksı uygulayan 1822 yılında
İskoç hekim James Carson’ dur. Bu yöntemle lokal anestezi altında iğne ile plevral
boşluğa girerek hava vermiş ve yapay pnömotoraks oluşturmuştur. Bu yöntemle
başarı elde edilmişti. Yapay pnömotoraks oluşturularak kavitenin kollapsı sayesinde
oksijenden mahrum bırakılan kavite içindeki milyonlarca organizmanın ölmeleri
sağlanmaktaydı.
Ayrıca
komprese
olan
hasta
akciğer
bölgesinin
lenfatik
kanallarından toksin absorbsiyonunun engellenmesi ile hastaların ateşlerinin 1–2 gün
sonra normale dönmesi ve kanayan kan damarlarının kompresyonu ile hemoptizinin
durdurulması amaçlanmıştı (6). Yapay pnömotoraks ile hastaların %50’sinde başarı
sağlanmaktaydı. Ancak plevral yapışıklıkların olduğu olgularda bu yöntem başarısız
kalmaktaydı. Plevral yapışıklıkları serbestleştirmek için Jacobeus 1913’de sistoskop
yardımıyla intraplevral pnömoliz uygulamış ve yapay pnömotoraksın başarı oranını
artırmıştır (7). Ancak yapay pnömotoraks oluşturulamayan aşırı fibrozisli hastalar için
375
torakoplasti tekniğini 1890’da Schede tanımlamış ve toraksın genişliğinin kot
rezeksiyonlarıyla
azaltılarak
enfekte
boşluğun
kollapsının
sağlanabileceğini
savunmuştu. Brauer ve Friedrich, 1907’de ilk torakoplasti operasyonunu 1-10 arası
kostaların tümünü çıkararak uyguladılar. Ancak bu operasyonla birkaç vakayı tedavi
edebildiler çünkü operasyonda aşırı kanamadan dolayı mortalite çok yüksekti. Daha
sonra 1911’de Wilms ve Sauerbruch bu yöntemi çok az farklılıkla, paravertebral
torakoplasti olarak uyguladılar (7). Günümüzde uygulanan torakoplasti operasyonunu
J. Alexander tanımlamış ve 1937’de bildirmiştir (8).
Frenik sinirin kesilerek diyafragma paralizisi ile akciğerin kollapsı yöntemi ilk kez
1911’de Stuertz tarafından uygulanmıştır. 1940’larda aynı amaç için pnömoperituan
yaygın olarak uygulanmıştır (7). Yine aynı yıllarda kosta rezeksiyonu yerine torasik
kaviteye parafin, plastik veya lusit toplar yerleştirilen plombaj torakoplasti yöntemini
15 vakalık serisi ile ilk Wilson 1948’de rapor etmiştir (9).
II. Dünya savaşında akciğer rezeksiyonları yapılmış ancak yüksek mortalite ile
sonuçlanmıştır.
Anti-TB ilaçların 1950’lerde keşfedilmesiyle tüberkülozda cerrahi tedavi büyük oranda
önemini yitirmiş ve bu hastalığın tedavisinin tamamen medikal olduğu düşünülmüştü.
Tüberkülozda kemoterapi streptomisin (SM) ve para-amino salisilik asitin (PAS)
1945’de uygulanmasıyla başlamış daha sonra 1952’de isoniasid (INH) ve 1966’da
rifampin (RIF) klinik olarak tedaviye eklenmiştir. Günümüzde TB medikal tedavisi
INH, RIF, pirazinamid (PZA), ETB ve SM kombinasyonu ile yapılmaktadır ve bu
ilaçlara birinci sıra (major) anti-TB ilaçlarda denilmektedir (10). Medikal tedavi
hastaların doğrudan gözlemi altında genellikle en az 6 ay kullanılmalıdır. Çünkü
gözlem altında olmayan hastaların, ilaçların uzun süreli kullanımı ve muhtemel yan
etkilerinden dolayı tedaviyi terk etme olasılığı sık olarak izlenmiştir. Bu nedenlerden
dolayı anti-TB ilaçlara direnç gelişmesi büyük risk taşımakta ve çok ilaca dirençli
tüberküloz (MDR TB) gelişmektedir. MDR TB tanısı, tekrarlayan balgam kültürleri
pozitif (ARB+) olan anti-TB ilaçlar içinde en az INH ve RIF’e karşı direnç gelişmiş
hastalara konur. Ayrıca radyometrik tetkikler (BACTEC) ve moleküler testler
kullanılarak gerçek zamanlı polimeraz zincir reaksiyonu (PCR) ve DNA mikrotetkikleri
ile MDR TB tanısı daha hızlı konulabilmektedir (11,12). BACTEC yönteminde içinde
belli konsantrasyonlarda anti-TB ilaçlar bulunduran besiyerleri kullanılarak direnç testi
yapılır (11). MDR TB tanısı alan hastalara medikal tedavi olarak ikinci sıra (minör)
376
anti-TB ilaçlar [Aminoglikozidler, Kapreomisin, Kinolonlar (ofloksasin, ciprofloksasin,
levofloksasin), Etionamid, Sikloserin, PAS, Klofazimin, Klaritromisin, Amoksisilinklavulonat, Rifabutin, Rifapentin, Linezolid] kullanılır. İdeal olarak tedaviye altı yeni
ilaçla başlamak gereklidir. MDR TB tedavisi, ilaca duyarlı TB tedavisine göre yaklaşık
100 kat pahalıdır. Tedavi rejimleri değişkenlik göstermektedir ve bir standardizasyon
yoktur. Pek çok rejim aminoglikozid veya kapreomisin ile kombine edilmis 4–5 oral
ilacı kapsamakta ve balgam kültürü negatifleştikten sonra 6–24 ay daha devam
etmektedir (13,14). Ancak MDR TB hastalarına en doğru ve titiz tedavi
uygulanmasına
rağmen
hastaların
yaklaşık %50’si basil çıkarmaya
devam
etmektedirler (15). Bunun nedeninin tüberküloz kavitelerinin dirençli organizmalar için
ilaçların ulaşmasını engellediği ve bu kavitelerin cerrahi olarak çıkartılmasının
ilaçların sterilize edici etkilerine katkıda bulunduğu belirtilmektedir. Pomerantz
kavitelerde 107-109 organizmanın bulunduğunu göstermiş ve tüm kavitelerin cerrahi
olarak çıkarılmasını önermiştir (Resim 29.1) (16). Her ne kadar etkin medikal tedavi,
cerrahi gereksinimi azaltmış olsa da, MDR TB’ un ortaya çıkmış olması dikkatleri
tekrar cerrahi üzerine çekmiştir.
Akciğer TB Cerrahi Tedavi Endikasyonları
1. Tüberküloz ampiyem
2. Abondan hemoptizi
3. MDR TB
4. Bronşial Stenoz
5. Harab olmuş akciğer (destroyed lung)
6. Tüberkülom (maligniteden den kesin ayrımı için)
7. Konstruktif perikardit
Tüberküloz Ampiyem
Ampiyem TB’un sık görülen bir komplikasyonudur. Cerrahlarla birlikte göğüs
hastalıkları hekimleri beraber tedavi etmelidirler.
1. İnterkostal tüp drenaj: Ampiyemin tedavisinde ilk olarak interkostal tüp drenaj
yapılarak pürülan enfekte materyal drene edilir ve atelektazi olan akciğer bölgesinin
reekspansiyonu sağlanır. Bu tedaviye fibrinolitik ajanlar göğüs tüpünden plevral
377
boşluğa
uygulanarak
akciğerin
daha
hızla
yeniden
ekspanse
olması
(reekspansiyonu) amaçlanır.
2. Dekortikasyon: Gecikmiş ampiyem olgularında interkostal tüp drenajına rağmen
hastaların bir kısmında akciğerin tam reekspansiyonu sağlanamaz. Sıvı yeterli
drenajla boşaltılmasına rağmen parankim üzerinde kalınlaşan plevra korteks
oluşturmuştur (pakiplörit). Bu durum akciğerin ekspansiyonunu engeller ve kapana
düşmüş akciğer (trapped lung) olarak adlandırılır. Sonuç olarak plevral boşluk sorunu
oluşur
ki,
tüberküloz
tedavisi
tamamlanan
hastalarda
da
görülmektedir.
Dekortikasyon operasyonu yapılarak akciğer parankimi üzerinde oluşan fibröz kabuk
çıkarılarak akciğerin yeniden ekspanse olması ve solunum fonksiyonlarının
düzelmesi sağlanır (Resim 29.2 a ve b). Bu vakalarda anti-TB ilaçların en az 6 hafta
kullanılarak negatif TB’lu ampiyemin sterilizasyonu sonrası cerrahi uygulamak
doğrudur (17).
Resim 29.2 a ve b: Tüberküloz ampiyem ve pakiplörit gelişen olgunun dekortikasyon
operasyonundan önce ve sonraki toraks BT görüntüleri.
3. Torakoplasti ve Torakostomi: Hastaların maalesef bir kısmında dekortikasyon
operasyonuna rağmen ekspansiyon kusuru devam eder ve intratorasik kavite kronik
enfeksiyon kaynağı olarak kalır. Hastalar toraks drenine bağlı kalmıştır. Altta yatan
TB hastalığının parankimde yarattığı harabiyete bağlı olarak veya bronkoplevral fistül
varlığında olur. Bronkoplevral fistül, TB’ un yıkıcı bir komplikasyonudur. Tüp
torakostomi ve drenaj hemen uygulanmalıdır.
378
Günümüzde torakoplasti, diğer operasyonlarla kapanmayan toraks kavitelerini
kapatmak için kullanılan son seçenektir (8). Bu durumda enfekte plevral boşluğu
ortadan kaldırmak için torakoplasti operasyonu veya açık torakostomi operasyonları
yapılmaktadır. Kozmetik olarak iç açıcı görünmemekle birlikte bu operasyonlar
enfeksiyonun kontrolünü sağlayarak hastanın genel durumunu düzeltmektedir.
Torakoplasti bilateral hastalık durumunda ve aktif TB’da uygun seçenek değildir (18).
Abondan Hemoptizi
Bu hastalar en az iki veya daha çok hemoptizi atağı ve her atakta hastane ihtiyacı
gerektiren, 24 saatte 600ml’ den fazla hemoptizisi olan hastalardır (18).
TB’a bağlı gelişen abondan hemoptizi nedenleri şunlardır:
A-Tüberküloz kavitesi: Tüberküloz kavitesine komşu pulmoner arter duvarının
zayıflamasına bağlı gelişen, kanamaya yol açan anevrizmaya “Rassmussen
anevrizması” adı verilmiştir. Kronik kaviter TB vakalarına yapılan otopsilerde %5
Rassmussen anevrizması gösterilmiştir (19).
B-Harab olmuş akciğer (destroyed lung): Kronik süpüratif akciğer enfeksiyonlarından
yıllar sonra tek taraflı akciğerin harab olmasıyla ortaya çıkar ve hemoptiziye neden
olabilir.
C-Aspergilloma: Kronik kaviter TB hastalarında %25-55 oranında aspergilloma gelişir
(20) (Resim 29.3). Yıllarca asemptomatik kalabilir ancak en sık görülen semptomu
hemoptizidir. Fungus topunun oluşmasından sonra antifungal ilaçlar etkili değildir.
Posttüberküloz aspergillomanın en iyi tedavisi cerrahi rezeksiyondur.
Figür 29.3: Ssol akciğer üst lobda kaviter lezyon içinde aspergilloma (fungus topu) izleniyor.
379
D-Tüberküloz sonrası gelişen bronşektazi: Tüberkülozla ilişkili olarak bronşial arterler
genişlemiştir ve hemoptiziye neden olabilirler. Göğüs grafileri özellikle bilgisayarlı
toraks tomografi (BT) ve bronkoskopi yapılarak hemoptizinin hangi akciğer
segmentinden kaynaklandığı tespit edilerek cerrahi rezeksiyonun yeri kesinleştirilir
(Resim 29.4).
Resim 29.4 : Sol üst lobda TB sonrası gelişen Bronşektazi
Çoklu dirençli tüberküloz (MDR TB)
Cerrahi öncesi optimum medikal tedavi (ikinci sıra anti-TB) süresi 1–8 ay, ortalama 2
aydır (16,21). Ancak en doğru ve titiz tedavi uygulanmasına rağmen hastaların
yaklaşık %50’si basil çıkarmaya devam etmektedirler (14). Leuven’in 62 hastalık
serisinde hastaların %39’u, Iseman 29 hastalık serisinde hastaların %67’si basil (+)
iken operasyon uygulanmış ve Van Leuven’in serisindeki hastaların %75’i ve
Iseman’ın serisindeki hastaların %93’ü erken postoperatif dönemde basil (-) hale
gelmişlerdir (22,23).
MDR TB’un henüz yayılmadan ve özellikle de cerrahiyi devre dışı bırakabilecek
kontralateral yayılım olmadan tedavinin sağlanması asıl amaçtır (24,25).
Preoperatif hazırlık, beslenme desteğini ve postoperatif toparlanmayı kolaylaştıracak
ve pulmoner sepsis gelişimini engelleyecek göğüs fizyoterapisini içermelidir. Çünkü
bu hastaların çoğu kilo kaybetmiş hastalardır. Serum albumin değeri 3,0 g/dl’nin
altındaysa cerrahi uygulanmamalıdır (15).
Diğer önemli unsurlar ise genel durum ve efor toleransının saptanmasıdır. Bunun için
solunum fonksiyon testi ve oda havasında alınmış arteryel kan gazı gereklidir. 70kg
ağırlığında bir insan için 1. saniye zorlu ekspiryum volümü (FEV1) rezeksiyon sonrası
en az 1 litre kalacak şekilde hesaplanmalıdır (15).
380
Hastalığın yayılımının direkt radyografiler ve yüksek rezolüsyonlu toraks tomografisi
taramalarıyla belirlenmesi gereklidir (Resim 29.5).
Resim 29.5: MDR TB sonrası sağ akciğer harab olmuş ve kavite izleniyor.
Cerrahi yaklaşım
Hastanın çift lümenli tüp veya bronş blokeri kullanılarak entübe edilmesi gerekir. (15).
En az bir geniş intravenöz damar yolu açılmalıdır. Postoperatif ağrı kontrolü içinde
epidural kataterizasyon en iyi seçenektir. İnsizyon rutin olarak posterolateral
torakotomidir. İleri derecede plevral yapışıklıklardan dolayı video yardımlı torakospik
cerrahi (VATS) uygun değildir. Disseksiyon ekstraplevral olarak ve dikkatli şekilde
yapılmalıdır. İleri derecede fibrozisden dolayı ekstraplevral diseksiyon sırasında
subklavyen damarlar, azigos ven, interkostal damarlar, rekürren laringeal sinir,
duktus thorasikus, aorta ve özefagus yaralanmaları olabilir (15). Bronş sütürle ya da
staplerle kapatılır. Bronsiyal güdüğün özellikle balgamı pozitif olan hastalarda rutin
olarak kas flebi ile takviye edilmesi önerilmektedir (15,16). Postoperatif sıvı alımı,
lobektomi için 1800ml/24 saat,
pnömonektomi için 1500ml/24 saat’i geçmeyecek
şekilde verilmelidir (15). Postoperatif MDR TB tedavinin süresi değişkendir.
Araştırmacıların bir kısmı tedavinin 18 aya kadar uzamasını savunurken, bir kısmı da
ilaç rezistansına göre süreyi belirlemektedir.
Akciğer rezeksiyonu için operatif mortalite %0 ile %3,3 arasında, majör morbidite
oranı ise %12 ve %30 arasında değişmektedir (26,27).
381
Bronşial Stenoz
Trakeobronşial duvarda olan granülomatöz değişiklikler ya da büyümüş peribronşial
lenf bezlerinin basısına bağlı olarak gelişir. TB hastaların %2-4’ünde endobronşial
tutulum izlenir (28). Lenf bezi basısına bağlı en sık orta lob atelektazisi izlenir. “Orta
lob sendromu” ilk olarak 1948’de E.A.Graham tarafından bildirilmiştir (28). Orta lob
sendromunda en iyi tedavi cerrahi rezeksiyondur. Bronşial stenozların cerrahi
tedavisinde; rezeksiyon ya da endobronşial girişimler (kriyoterapi, lazer foto
rezeksiyon ve balon dilatasyon, trakeo-bronşial stent) uygulanmaktadır.
Harab olmuş Akciğer (destroyed lung)
Pulmoner enfeksiyöz hastalıklara sekonder oluşan tek taraflı akciğer harabiyetini
tanımlar. Harab olmuş akciğer (destroyed lung); masif hemoptizi, sekonder fungal
enfeksiyonlar, sekonder amiloidoz ve pulmoner sistemik şant komplikasyonlarıyla
ilişkilidir (29). Radyolojik bir tanımlama olup tek bir büyük kavite ya da multipl kaviteli
opasiteler ve tek taraflı toraks asimetrisi saptanır (30). Radyografik olarak harab
olmuş akciğer tespit edilen her hasta pnömonektomi adayıdır. Cerrahi olarak harab
olmuş akciğer dokusu çıkarılmalıdır çünkü zayıf
kan dolaşımından dolayı
antibiyotikler etkili değildir ve çok sayıda basil akciğer dokusunu invaze etmiştir
(Resim 29.6). Operasyonun amacı komplikasyonların önlenmesi ve hastanın yaşam
kalitesinde iyileşme sağlamaktır (31).
Resim 29.6: TB sonrası harab olmuş sol akciğer görülüyor.
382
Tüberkülom
Pulmoner enfeksiyonlar tümörleri taklit edebilirler (32). Tüberkülom, etrafı fibröz bir
kapsülle çevrili, ortası kazeifiye yuvarlak bir tüberküloz lezyonudur. Genellikle primer
odağın (Ghon odağı) etrafının bir fibröz doku ile çevrilmesiyle ortaya çıkar (Resim
29.7). Radyolojik olarak çoğunlukla soliter pulmoner nodül olarak izlenir. Karakteristik
olarak 0,5-4cm. çapında düzgün kenarlı lezyonlardır. Kalsifikasyon %20–30 oranında
izlenir. Özellikle bronkojenik karsinomdan ayırt edilmelidir (32). Tanı için biyopsi
şarttır; tanı için yapılan girişimsel tetkiklerin yetersiz kalması durumunda kesin tanı
için akciğer dokusundan biyopsi uygulanmalıdır.
Resim 29.7: Sağ akciğer üst lob anterior segmentde tüberkülom lezyon.
Konstruktif Perikardit
Perikard kalınlaşmış ve skatris gelişmiştir, kalsifik olabilir (Resim 29.8). Tanı için
EKG ve ekokardiyografi yararlıdır, perikard sıvısında veya dokuda TB basilinin
gösterilmesi veya perikardda kazeöz granülomların gösterilmesi gereklidir (33).
Radyografide kalsifik perikard görülmesi konstruktif TB perikardit için kesin tanı
koydurucudur. VATS veya mini torakotomi ile perikardiektomi yapılarak drenaj
sağlanır (33,34). Hastanın hemodinamisi ve klinik semptomları hemen düzelir.
383
Resim 29.8: Radyografide kalsifik perikard izleniyor.
KAYNAKLAR
1. Koch R. Die Aetiologie der Tuberculose [The aetiology of Tuberculosis].
Berliner Klinische Wochenschrift 1882.
2. Yamamoto M, Ogura Y, Sudo K, Hibino S. Diagnostic criteria for disease
caused by atypical mycobacteria. Am Rev Respir Dis. 1967 Oct;96(4):773-8.
3. The National Health: Official Newspaper of the American Public Health
Service, May 2007.
4. Sahn SA. State of the art. The pleura. Am Rev Respir Dis. 1988
Jul;138(1):184-234. Review.
5. Haas D.W. Mycobacterium Tuberculosis, In: Gearld L Mandell, John E.
Bennett, Raphael Dolin, Editors. Principles and Practice of İnfectious Disease.
Section 2. 5ed. USA. 2000, 2597-8.
6. Fehleisen F, Rotschild M. Experience with Artificial Pneumothorax in the
Treatment of Pulmonary Tuberculosis. Cal. State J Med. 1913 sep;11(9):3434).
7. Brown AL, Truman SR. Surgery in the Treatment of Pulmonary Tuberculosis.
Cal West Med. 1934 Jan;40(1):25-33).
8. Alexander J: The Collapse Therapy of Pulmonary Tuberculosis. Springfield,
Illinois, Charles C Thomas, 1937.
9. B.G.B. Lucas and W.P.Cleland. Thoracoplasty with Plombage: a review of the
early results in 125 cases. Thorax.1950 September;5(3):248-256).
384
10. American Thoracic Society: Treatment of tuberculosis and tuberculosis
infection in adults and children. Am J Respir Crit Care Med 1994:149; 13591374.
11. Heifets, L. B: Rapid automated methods (BACTEC system) in clinical
mycobacteriology. Semin Respir Infect 1:242-249 (1986).
12. Kocagöz T, Yilmaz E, Ozkara S, Kocagöz S, Hayran M, Sachedeva M,
Chambers HF. Detection of Mycobacterium tuberculosis in sputum samples by
polymerase chain reaction using a simplified procedure. J Clin Microbiol. 1993
Jun;31(6):1435-8.
13. Salomon N, Perlman DC. Multidrug resistant tuberculosis: globally with us for
the long haul. Clin Infect Dis 1999;21:93-95.
14. Seaworth BJ. Multidrug-resistant tuberculosis. Infect Dis Clin North Am 2002;
16:73-105.
15. Pomerantz M, Mitchell D.J: Surgery for the management of mycobacterium
tuberculosis and nontuberculous mycobacterial (environmental) infections of
the lungs. In: Shields TW, Lo Cicero III J, Reed E.C, Feins H.R. General
Thoracic Surgery 7th Edition Volume I. Philadelphia: Lippincott Williams &
Wilkins, 2009;1149-58.
16. Pomerantz M, Madsen L, Goble M, Iseman M. Surgical management of
resistant mycobacterial tuberculosis and other mycobacterial pulmonary
infections. Ann Thorac Surg 1991;52:1108-1112.
17. Khaled M. Al-Kattan. Management of tuberculous empyema. European
Journal of Cardio-thoracic Surgery 17 (2000) 251-254.
18. R.K. Dewan. Surgery for pulmonary tuberculosis - a 15-year experience.
European Journal of Cardio-thoracic Surgery 37 (2010) 473—477.
19. Santelli ED, Katz DS, Goldschmidt AM, Thomas HA. Embolization of multiple
Rasmussen aneurysms as a treatment of hemoptysis. Radiology 1994;
193:396–398.
20. Fraser RS, Muller NL, Colman N, Pare PD. Diagnosis of diseases of the chest.
4th ed. Vol 2. Philadelphia, Pa: Saunders, 1999;798–873.
21. Tahaoglu K, Törün T, Sevim T, Atac G, Kir A, Karasulu L, et al. The treatment
of multi-drug resistant tuberculosis in Turkey. N Engl J Med. 2001;345:170-4.
385
22. Iseman MD, Madsen L, Goble M, et al: Surgical intervention of pulmonary
disease caused by drug-resistant Mycobacterium tuberculosis. Am Rev Respir
Dis 1990;141:623-5.
23. Leuven MV, Groot M, Shean KP, et al: Pulmonary resection as an adjunct in
the treatment of multipl drug resistant tuberculosis. Ann Thorac Surg 1997;
63:1368-73.
24. Takeda T, Maeda H, Hayakawa M, et al. Current surgical intervention for
pulmonary tuberculosis. Ann Thorac Surg 2005; 79:959-963.
25. Pomerantz BJ, Cleveland JC, Olson HK, Pomerantz M. Pulmonary resection
for multi-drug resistant tuberculosis. J Thorac Cardiovasc Surg 2001; 121:448453.
26. Kir A, Inci I, Torun T, Atasalihi A, Tahaoglu K. Adjuvant resectional surgery
improves cure rates in multidrug-resistant tuberculosis.
27. Leung AN. Pulmonary tuberculosis: the essentials. Radiology 1999; 210:307–
322.
28. Kala J, Sahay S, Shah A. Bronchial anthracofibrosis and tuberculosis
presenting as a middle lobe syndrome. Prim Care Respir J. 2008
Mar;17(1):51-5.
29. Rizzi A, Rocco G, Robustellini M, Rossi G, Della Pona C, Massera F. Results
of surgical management of tuberculosis: experience in 206 patients
undergoing operation. Ann Thorac Surg 1995;59:896–900.
30. Carette MF, Blanchon F, Milleron B, Brocard H. [Destroyed lung (author’s
transl)]. Sem Hop 55(17-18):843-53, 1979. (abstr).
31. Halezeroglu S, Keles M, Uysal A, Celik M, Senol C, Haciibrahimoglu G, Arman
B. Factors Affecting Postoperative Morbidity and Mortality in Destroyed Lung.
Ann. Thorac. Surg. Dec 1997; 64: 1635 - 1638.
32. Rolston KV, Rodriguez S, Dholakia N, Whimbey E, Raad I. Pulmonary
infections mimicking cancer: a retrospective, three-year review. Support Care
Cancer 1997; 5:90-3.
33. Strang JI, Nunn AJ, Johnson DA, Casbard A, Gibson DG, Girling DJ.
Management
of
tuberculous
constrictive
pericarditis
and
tuberculous
pericardial effusion in Transkei: results at 10 years follow-up. QJM. 2004
Aug;97(8):525-35.
386
34. Yetkin U, Kestelli M, Yilik L, Ergunes K, Kanlioglu N, Emrecan B, et al. Recent
surgical experience in chronic constrictive pericarditis. Tex Heart Inst J
2003;30(1):27–30.
387
30.
Yrd. Doç. Dr. M. Reha Çelik ve Doç. Dr. Akın Kuzucu
İnönü Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKCİĞERİN BÜL VE BLEB HASTALIKLARI
Giriş-Tanımlamalar
Akciğerin bül ve bleb hastalıkları normal bir parankimal yapı üzerinde gelişim
gösterebilirlerse de akciğerin amfizematöz hastalıkları içerisinde değerlendirilir.
Pulmoner amfizem belirgin bir fibrozis olmaksızın, terminal bronşiyollerin distalindeki
parankimal yapıda gelişen kalıcı destrüktif genişlemedir (1). Amfizem diffüz veya
lokalize bir tutulum gösterebilir. Bül ve blebler, amfizematöz akciğer zemininde veya
normal parankimde gelişim gösterebilir ve iki farklı klinik tablo oluştururlar. Bül ve
bleb lokalizasyon ve boyut olarak birbirinden ayrılır. Blebler karakteristik olarak
akciğer apekslerinde görülür. Visseral plevra altında görülen 1 cm. çaptan küçük
hava kabarcıklarıdır. Parankim santraline doğru ilerleme göstermezler. Gaz değişimi
ve pulmoner fonksiyonlar üzerinde önemli bir etkiye sahip değillerdir. Bleblerin,
alveoler rüptürler sonrası açığa çıkan havanın, intertisyel doku boyunca ilerleyerek
visseral plevra altında birikmesi sonucu geliştiği düşünülmektedir (2, 3).
Büller ise intraalveoler septaların yırtılması sonucu gelişen parankim içinde veya
parankimin dışına doğru uzanan hava kistleridir. Klasik olarak bül çapı 1 cm’den
büyük, keskin sınırlı, duvarı 1 mm’den ince, amfizematöz alan olarak tarif edilir. Bül
duvarı, visseral plevra, konnektif doku, harap olmuş akciğer dokusundan oluşmuştur
ve epitelyum içermez. Bül içerisinde çoğunlukla interlobuler septa kalıntılarının
oluşturduğu fibröz bantlar ve septasyonlar bulunur.
Sınıflandırma
Amfizem histopatolojik olarak 3 tipte sınıflandırılır.
1) Proksimal asiner amfizem (sentrilobuler): Primer patoloji respiratuvar bronşiyoller
ve çevresindeki alveoler dokuların destrüktif genişlemesidir. Çoğunlukla kronik
bronşit ile birlikte görülür.
2) Panasiner amfizem (panlobuler): Asinus içindeki tüm hava boşluklarında uniform
bir genişleme söz konusudur. Genellikle alfa–1 antitiripsin eksikliği ile beraberdir.
388
Tüm parankim boyunca düzensiz bir yayılım gösterebilir. Diğer amfizem tiplerine göre
daha agresif bir klinik tablo ile seyreder.
3) Distal asiner amfizem: Periferik alanda distal alveoler ve duktal yapılardaki
destrüksiyona sekonder gelişir. Diğer amfizemlere göre daha fazla fibrozis görülür.
Bu tip, bül formasyonu ve spontan pnömotoraks ile beraberdir. Subplevral
yerleşimlidir. Hastalık hava hapsi ve dev bül gelişimi ile sonuçlanan bir progresyon
gösterdiğinde altta yatan akciğer parankimini baskılar (4, 5).
Bu tanımlamalar doku örneklerinden yapılan histopatolojik incelemelere dayanır.
Amfizem bu histopatolojik sınıflandırma dışında, klinisyenler ve cerrahlar açısından
daha kullanışlı olan 3 klinik alt grupta değerlendirilir (1).
1) Kompansatuvar amfizem: Gerçek bir amfizematöz proçes değildir. Havayollarında
bir destrüksiyon yoktur. Herhangi bir nedenle gelişmiş atalektaziye veya cerrahi
rezeksiyona sekonder akciğer dokusunun bir kısmında gelişen havalanma artışını
ifade eder.
2) Diffüz obstrüktif amfizem: Kronik obstrüktif akciğer hastalıklarının en önemli
sebebidir. Klinik olarak amfizematöz “pink puffer” ve bronşitik “blue bloater” olarak iki
grupta değerlendirilir.
3) Büllöz amfizem: Bu tanımlama normal bir parankim ve tek bir bülün bulunduğu
durum ile diffüz obstrüktif amfizem arasında kalan amfizematöz değişiklikleri ifade
eder. Üç tip bül vardır.
Tip I bül; İnce bir pedikül ile akciğer parankimine tutunan lezyonlardır.
Tip II bül; geniş bir tabanla akciğer parankimine oturan ve tabanını akciğer
parankiminin oluşturduğu lezyonlardır.
Tip III bül; geniş tabanlı ve akciğer parankiminin derinliklerine uzanan lezyonları
tanımlar (2).
Klinik Görünüm
Hastalık
özellikle,
normal veya
normale yakın
parankime sahip
olgularda
asemptomatik olabilir ve rastlantısal olarak saptanır. Semptomatik hastalarda öne
çıkan belirti dispne veya bülün komplikasyonlarına bağlı ortaya çıkan bulgulardır.
Bazen bül büyük boyutlara ulaşabilir ve ilerleyici nefes darlığına neden olur. Nadiren,
bu tip olgularda bül içerisindeki hava basıncının ileri derecede artması, mediastinal
389
itilmeye, akciğer parankiminin ve vasküler yapıların baskılanmasına neden olur ve
tansiyon pnömotoraks tablosuna benzer akut solunum yetmezliği gelişir (1).
Büllöz hastalıklarda en sık karşılaşılan komplikasyonlar, pnömotoraks, hemoptizi,
bülün enfekte olması, göğüs ağrısı ve karsinom gelişimidir. Pnömotoraks, bül veya
bleb rüptürü ile gelişir ve çoğu olguda tüp torakostomi ve kapalı su altı drenajı ile
kontrol altına alınır. Ancak uzamış hava kaçağı, akciğerin tam ekspanse olmaması,
tekrarlayan pnömotoraks cerrahi tedavi gerektirir.
Bül içerisinde enfeksiyon çok karşılaşılan bir durum değildir. Büller içerisinde havasıvı seviyesinin görülmesi enfeksiyonu düşündürse de sıvı çoğunlukla peribüllöz
pnömonitis sonrası gelişir ve sterildir (2). Gerçek enfekte bül tedavisi balgam kültürü
ve Gram boyama sonucu elde edilen bulgular ışığında uygun antibiyotikler ile yapılır.
Yetersiz drenaj yavaş rezolüsyona yol açtığından tedavi uzayabilir. Bu durumda,
göğüs fizyoterapisi faydalı olabilir. Fazla miktarda sıvı içeren büllerde sıvının karşı
tarafa boşalma tehlikesinin bulunması, hemoptizinin gelişmesi cerrahi tedaviyi
gerektirebilirse de, olguların çoğunda tıbbi tedavi ile yanıt alınır. Cerrahi tedavi
endikasyonları akciğer absesi ile aynıdır.
Hemoptizi genellikle enfekte büllerde gelişir. Enfeksiyonun medikal tedavisi ile
düzelir. Nadiren gelişen uzamış, tekrarlayan veya masif hemoptiziler bül duvarındaki
vasküler yapıların yırtılması sonrası gelişir ve bu olgularda cerrahi tedavi gerekir.
Retrosternal alanda egzersiz sonrası gelişen angina benzeri şiddetli göğüs ağrısı
olabilir. Bu semptomun hiperventilasyon sırasında bülün aşırı distansiyonu ve
mediastinal shift gelişmesi nedeniyle ortaya çıktığı kabul edilmektedir. Bazı olgularda
göğüs ağrısı tek başına cerrahi endikasyon oluşturur (2).
Büllöz akciğer hastalığı ile primer akciğer kanseri arasındaki ilişki değişik yayınlarda
ortaya konmuştur (6). Büllöz akciğer hastalığına neden olan akciğer parankimindeki
distrofik değişikliklerin, skar dokularının ve inhale edilen potansiyel karsinomatöz
ajanların kötü ventile olan büllöz alanlar içinde birikmesinin kanser gelişiminde rol
oynayabileceği düşünülmektedir (7). Radyografik olarak bül içerisinde veya
komşuluğunda nodüler opasite, bül duvarında parsiyel veya diffüz kalınlaşmanın
olması maligniteyi düşündüren bulgulardır (6). Ancak cerrahi girişim yapılmadan bül
içerisinde neoplazm gelişiminin kesin tanısını koymak oldukça zordur.
390
Tanısal Girişimler
Tanı radyografik incelemelere dayanır. Postero-anterior akciğer grafisinde; ince
duvarlı, duvar sınırları net ve keskin olarak seçilen, damarsal yapı içermeyen içi hava
dolu kistik yapı görünümü mevcuttur. Lokalize veya generalize hiperlusensi,
diyafragmanın aşağıya doğru yer değiştirmesi, diyafragmanın düzleşmesi, kot
aralarında genişleme görülebilir. Pulmoner damarlar sayı ve boyut olarak
küçülmüştür. Bül ileri derecede genişleyerek normal akciğeri radyografik olarak
görülmeyecek derecede baskılayabilir. Bu tip olgular “vanishing lung syndromekaybolmuş akciğer sendromu” olarak adlandırılır (8). Blebler, küçük büller ve minimal
amfizemde akciğer grafisinde herhangi bir bulgu saptanmayabilir.
BT bülün lokalizasyonu, büyüklüğü, uzanımı ve altta yatan akciğerin yapısı hakkında
detaylı bilgi verir. PA akciğer grafide görülmeyen lokalizasyonlardaki büllöz
amfizematöz değişikliklerin saptanmasını, bülün akciğer parankimine yaptığı
kompresyonun değerlendirilmesini mümkün kılar. Özellikle bül ile pnömotoraks
arasında
ayrımın
yapılmasında
faydalıdır.
Ventilasyon
perfüzyon
sintigrafisi
hastalığın yaygınlığının değerlendirilmesi ve hava yolları ile vaskülarizasyon
arasındaki uyumsuzluğunun gösterilmesinde kullanılanabilecek bir tanı yöntemidir.
Altta yatan parankim hastalığının şiddetini değerlendirmede faydalı diğer bir tanı
yöntemi solunum fonksiyon testleridir. Solunum fonksiyon testleri ayrıca, tedaviye
yanıtın da takip edilmesini de sağlar.
Tedavi
Asemptomatik büllerde hasta sigara içiyorsa, sigarayı bırakması teşvik edilir ve bül
rüptürü ile sonuçlanabilecek kontakt sporları, tüp ile dalma gibi faaliyetler yasaklanır.
Birlikte bulunan amfizem, kronik bronşit, astım gibi diğer akciğer hastalıklarının takip
ve tedavisi yapılır.
Asemptomatik hastalarda cerrahi endikasyon yoktur. Bül cerrahisinin iki major
endikasyonu vardır.
1) Orta veya ağır derecede dispneye sebep olan, hemitoraksın 1/3 den daha fazla
yer kaplayan bül varlığı
2) Komplikasyonların gelişmesi
391
Obstrüktif ve fibrotik akciğer hastalığı olan hastalar cerrahiden çok fazla yarar
görmezler. Bu hastalarda mortalite ve morbidite yüksektir. Buna karşılık, lokalize yer
kaplayıcı non fonksiyone hava boşlukları bulunan, normal veya normale yakın
akciğer parankiminin baskılanmış olduğu hastalarda semptomatik rahatlama, daha iyi
egzersiz toleransı ve pulmoner fonksiyon testlerinde düzelme elde edilir. Bu nedenle
hasta seçimi çok önem taşır. Hasta seçiminde dikkat edilmesi gereken kriterler;
1) progresif olarak genişleyen non fonksiyone büllöz lezyon
2) bülün önemli oranda potansiyel fonksiyone akciğer dokusununda kompresyona
sebep olması
3) minimal inflamatuvar komponent varlığı
4) diffüz hastalığın bulunmaması
5) perfüzyon
sintigrafisinde
veya
anjiografide
azalmış
kan
akımının
gösterilebilmesidir (3).
Cerrahi yöntemler
Büllöz amfizemin cerrahi tedavisinde uygulanan birkaç yöntem vardır. Cerrahi
tedavide prensip non-fonksiyone, yer kaplayıcı bülü eksize etmek ve fonksiyone
parankimi korumaktır.
Bül Eksizyonu: Bül pediküllü ise (Tip 1 bül) pedikül klemplenir ve üstte kalan bül
eksize edilir. Geniş tabanlı büllerde ise (Tip 2 bül) bül açılır, içerisindeki septalar
kesilerek tabandaki küçük bronşiyal açıklıklar dikilir. Ortadan ikiye açılmış bül
duvarları içe doğru kendi üzerlerinde plike edilir, parankimal taban üzerinde karşı
karşıya getirilir ve dikilir. Eğer bül tüm bir lobu tutacak kadar genişse anatomik
pulmoner rezeksiyon gerekebilir (1).
Bu operasyonlar standart torakotomi, sınırlı torakotomi veya video yardımlı
torakoskopi ile gerçekleştirilir. Seçilmiş olgularda, median sternotomi iki taraflı
yaklaşıma olanak sağlar.
İntrakaviter Drenaj (Monaldi Drenajı): Bu tedavi bül içerisine kateter yerleştirilerek
bülün gerginliğini azaltılması ve kollabe olması sağlanarak altta yatan akciğer
dokusunun ekspansiyonuna fırsat verilmesi esasına dayanır (1). İlk kez Monaldi
tarafından refrakter tüberküloz kavitelerinin tedavisi için tarif edilmiş bir girişimdir.
Özellikle diğer cerrahi girişimleri tolere edemeyecek şiddetli semptomlara sahip,
genel durumu kötü hastalarda uygulanan bir tedavi yöntemidir. Bül duvarı
392
lokalizasyonundan küçük bir insizyon ile girilir. Bül duvarına “purse string” sütür atılır
ve buradan bül içerisine tercihen şişirilebilir balon ile sonlanan bir katater yerleştirilir.
Plevral boşluk ayrıca bir katater ile drene edilir. İşleme kimyasal plörideziz eklenebilir.
Katater ve plevral dren hava kaçağı sonlandıktan sonra çekilir(1, 9).
Cerrahi tedavi sonuçları
Cerrahi tedavide başarı doğru hasta seçimi ile artar. Hastanın yaşı, cor-pulmonale
bulunup bulunmaması, amfizemin yaygınlığı, cerrahi yaklaşım ve teknik, sonuçları
etkileyen faktörlerdir (2, 3). Altta yatan akciğer hastalığı olmayan hastalarda mortalite
sıfıra yakın iken, parankimal hastalığı olan hastalarda bu oran %2-11 arasında
değişmektedir (2, 3, 10-12) . Postoperatif en önemli problemler ekspansiyon kusuru,
uzamış hava kaçağı ve plöropulmoner enfeksiyonlardır. Yapılan bir çalışmada akut
solunum yetmezliği, ampiyem, kronik bronkoplevral fistül gibi ciddi komplikasyonlar
%10,5 oranında, minör komplikasyonlar ise %13,6 oranında bildirilmiştir (10).
Sonuç
Cerrahi tedavi ile en iyi sonuçlar geniş kompresif bülü olan ve hafif veya orta
derecede KOAH bulguları olan hastalarda elde edilir. Son zamanlarda VATS gibi
operatif yaklaşımların, hava kaçağını minimale indiren cerrahi tekniklerin ve epidural
aneljezi gibi postoperatif bakım uygulamalarının gelişmesi ile büllektomi için cerrahi
endikasyonlar genişlemeye başlamıştır. Ancak diffüz amfizem varlığında cerrahi için
hasta seçimi zor ve tartışmalıdır.
KAYNAKLAR
1. Moghissi K. Emphysema and surgery of bullous emphysema. In Moghissi K,
Thorpe JAC, Ciulli F, ed. Moghissi’s Essentials of Thoracic and Cardiac
Surgery. 2nd. ed. Amsterdam: Elsevier; 2003:109-111.
2. Deslauriers J, G.J., LeBlanc P. Bullous and bleb diseases of the lung. In
Shields TW, LoCicero J, Pon RB, Rusch VW, ed. General Thoracic Surgery,
Vol. 1. 6th Edition, Philadelphia: Lippincott Williams and Wilkins; 2005: 11681186.
3. Goldberg, M. Emphsema and bullous disease. In Pearson FG, Deslauriers J,
Ginsberg RJ, Hiebert CA, McKneally MF, Urschel HC, Jr. ed. Thoracic
Surgery, 1st ed., New York: Churchill Livingstone. 1995: 561-580.
393
4. Greenberg, J.A., S. Singhal, and L.R. Kaiser, Giant bullous lung disease:
evaluation, selection, techniques, and outcomes. Chest Surg Clin N Am, 2003;
13: 631-49.
5. Keller, C.A., Pathophysiology and classification of emphysema. Chest Surg
Clin N Am, 2003; 13:589-613.
6. Tsutsui, M. Araki Y, Shirakusa T, Inutsuka S. Characteristic radiographic
features of pulmonary carcinoma associated with large bulla. Ann Thorac
Surg, 1988. 46: 679-83.
7. Nickoladze GD. Bullae and lung cancer. J Thorac Cardivasc Surg 1993; 106:
186.
8. Sharma, N., A.M. Justaniah, J.P. Kanne, et al., Vanishing lung syndrome
(giant bullous emphysema): CT findings in 7 patients and a literature review. J
Thorac Imaging, 2009; 24: 227-30.
9. Venn GE, Williams PR, Goldstraw P. Intracavitary drainage for bullous
emphysematous lung disease: experience with the Brompton technique.
Thorax 1988; 43:998-1002.
10. FitzGerald MX, Keelan PJ, Cugell D W, Gaensler EA. Long-term results of
surgery for bullous emphysema. J Thorac Cardiovasc Surg, 1974; 68:566-87.
11. Schipper PH, Meyers BF, Battafarano RJ, et al. Outcomes after resection of
giant emphysematous bullae. Ann Thorac Surg 2004; 78: 976-82.
12. Palla A, Desideri M, Rossi G, et al. Elective surgery for giant bullous
emphsema: A 5-year clinical and functional follow-up. Chest 2005; 128:20432050.
394
31.
Dr.Miray Yılmaz ve Prof.Dr.Levent Elbeyli
Gaziantep Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
SOLİTER PULMONER NODÜL
Soliter pulmoner nodül (SPN) normal akciğer dokusu ile çevrili, kenarları net olarak
seçilebilen, tek bir küresel lezyondur. Soliter pulmoner nodül diyebilmek için
akciğerde başka bir lezyon olmamalıdır. Mediastinel adenopati, atelektazi, pnömoni
veya satellit lezyonlar eşlik etmez. Radyolojik olarak 3cm’nin altındaki lezyonlar
soliter pulmoner nodül, 3cm’nin üzerindekiler ise kitle olarak adlandırılırlar ve bu
lezyonların malignite olasılığı yüksektir (1).
Tüm soliter pulmoner nodüller aksi kanıtlanıncaya kadar primer akciğer kanseri
olarak düşünülmelidir. Soliter pulmoner nodüllerin ortalama %40‘ını tedavi edilebilir
maligniteler oluşturur ve bu olgular vakit kaybetmeden opere edilmelidir. Kalan
%60’ını ise cerrahi ya da invaziv işlemler gerektirmeyen benign nodüller oluşturur. Bu
nedenle ilk olarak soliter pulmoner nodül olarak tespit edilen lezyonun malign/benign
ayrımı yapılmalıdır (2) (Tablo 31.1).
Soliter pulmoner nodüller çoğu zaman akciğer grafileri ve bilgisayarlı tomografi (BT)
tetkiklerinde tesadüfen saptanmaktadır (Resim 31.1). Böyle bir nodülde en ideal
yaklaşım, benign ise gereksiz rezeksiyondan kaçınmak, malign ise kısa sürede
rezeke etmektir. Amaç en az invaziv yöntemler ile bu ayrımı yapabilmektir.
İlk olarak hastanın klinik ve radyolojik değerlendirmesi yapılmalı, varsa geçmiş
dönemlere ait grafi ve BT’leri incelenmelidir (3).
Klinik değelendirme
Hastanın yaşı ve altta yatan risk faktörleri önemlidir ve yaşla birlikte malignite olasılığı
artmaktadır. 60 yaş üzerinde malignite olasılığı %50’den fazladır. Yaş dışında sigara
kullanımı,
diğer
organlarda
malignite
varlığı
ve
hastanın
semptomları
da
değerlendirilmelidir (3). Santral lezyonlar dispne, wheezing, hemoptizi, pnömoni ve
balgam çıkarmaya yol açabilir. Periferik lezyonlarda ise kuru öksürük, künt göğüs
ağrısı olabilir.
395
Tablo 31.1: Soliter pulmoner nodül nedenleri:
Malign hastalıklar
Primer akciğer kanseri
Primer pulmoner karsinoid tümör
Primer akciğer lenfoması
Metastatik tümörler
Benign hastalıklar
Tümörler
Hamartom
Kondrom
Lipom
Teratom
Leioyomiyom
Endometriozis
İnflamatuvar hastalıklar
Wegener granülomatozis
Romatoid nodül
Sarkoidozis
Masif fibrozis
Vasküler hastalıklar
A-V malformasyonlar
Hematom
Pulmoner arter anevrizması
İnfarkt
Diğer nedenler
İntrapulmoner LAP
Mukosel- Mukoid tıkaç
Amiloid
Psödotümör (fissürde sıvı)
Silikotik nodül
Enfekte bül
Konjenital
Bronkojenik kist
Sekestrasyon
Bronşiyal atrezi
İnfeksiyonlar
Tüberküloz
Fungal
Nokardia
Round pnömoni
Apse
Ekinokok
Askaris
Pneumocysti carinii
Dirofloria
Septik emboli
Radyolojik değerlendirme
SPN saptandığında değerlendirmeye ilk olarak varsa hastanın geçmişte yapılmış
radyolojik kayıtlarının incelenmesi ile başlanmalıdır. İki yıldan önce çekilen grafilerde
aynı boyut ve özellikte lezyon olması durumunda ileri inceleme ve takip
gerekmeyebilir (3).
SPN’de benign-malign ayrımında şu radyolojik kriterler kullanılmaktadır :
Nodülün konturları, Nodülde kalsifikasyon, Nodülün büyüme hızı,
konumu, Nodülün boyutları, Nodülde kavitasyon
396
Nodülün
Resim 31.1: PA ve BT’de SPN örneği
Nodülün konturları
Benign nodüller genellikle yuvarlak ve keskin sınırlı iken, malign nodüllerin düzensiz,
lobüle, spiküler uzantılı kenarlar oluşturmaya eğilimi vardır. Soliter pulmoner
nodüllerin plevraya uzanan kuyrukları olabilir ya da nodül çentiklidir. Buna Rigler
belirtisi (tail sign) denir. Fakat bunların hiçbirisi artık malignitenin kesin kriteri olarak
sayılmamaktadır (4-5).
Nodül şekillerine göre 4 tipe ayrılmışlardır. Bunlar :
Tip 1: Keskin sınırlı ve yuvarlak
Tip 2: Lobüle konturlu
Tip 3: Düzensiz, ondülasyonlu
Tip 4: Yaygın spiküler kenarlı
Kalsifikasyon
Lezyonun büyüklüğüne göre akciğer kanserlerindeki kalsifikasyon oranı %1–16
arasında değişmektedir (6–7–8). Akciğer kanserlerinde kalsifikasyon üç mekanizma
ile oluşmaktadır (8);
1. Kalsifiye skar dokusu ya da granülomatöz hastalığın tümör içinde kalması
2. Tümör nekroz alanlarında distrofik kalsifikasyon
3. Kanserin kendisinin sekretuar fonksiyonu sonucu tümör içinde kalsiyum birikimi
Nodül kalsifikasyon sınıflaması santral, laminer, yaygın, popcorn (patlamış mısır tipi),
eksantrik ve yer yer dağınık (stippled) tipler şeklinde yapılmıştır (9). Bunlardan ilk 4’ü
sıklıkla benign, son 2’si ise sıklıkla malign lezyonlarla birlikte olurlar.
397
Büyüme Hızı
Nodülün büyümesi doubling time (hacmin iki katına çıktığı süre) tespiti ile mümkün
olup nodülün çapındaki %25 artış volümde iki kat artışı gösterir. Malign lezyonlarda
bu süre 25–450 gün, benign lezyonlarda ise 500 günden fazladır. Yirmi günden kısa
büyüme süresi ise akut bir inflamasyona işaret eder.
Nodülün Boyutları
Malignite olasılığı çap ile orantılı olarak artar. 1 cm ve altında %15, 1-2cm %42, 3 cm
ve üstünde %80-99 malignite olasılığı vardır.
Nodülde Kavitasyon
Ayırıcı tanıda güvenilir olmamakla birlikte daha çok iltihabi nodüllerde görülür.
Akciğer grafisi, 1cm’den küçük nodülleri, kot ya da kemikler ile süperpoze olan
lezyonları ve sınırları tam ayırt edilemeyen nodülleri saptamada çok duyarlı olmadığı
için BT’ye göre yetersiz kalmaktadır. Bilgisayarlı tomografi SPN’leri değerlendirmede
akciğer grafisine göre 10–20 kat daha duyarlıdır ve mediastinal lenf bezlerinin
değerlendirilmesi ve intratorasik anormalliklerin saptanmasına da olanak sağlar (10).
Pozitron emisyon tomografisi (PET) SPN ile birlikte karşı akciğer lezyonu olan
hastalarda, daha önce pulmoner ve ekstrapulmoner malignitesi olanlarda primer,
metastaz veya benign ayrımını yapmamıza yardımcıdır. Malign lezyonlarda
spesifitesi %80, sensivitesi ise %97’dir.
Soliter Pulmoner Nodül İçin Tanısal Girişimler
Soliter pulmoner nodüle biyopsi amaçlı yapılan girişimler ya bronkoskopik ya da
transtorasik yoldan olmaktadır. Cerrahi girişim hem tanısal hem de tedavi amacıyla
yapılabilir. Nodüle yapılacak girişimin seçimi nodülün yeri, boyutu, ekipman ve
cerrahın deneyimi ile ilişkilidir (3).
Balgam sitolojisi
Tanı değeri malign lezyonlarda %10-20’dir. Hızlı sonuç verir ve noninvaizvdir.
398
Bronkoskopi
Özellikle merkezi yerleşimli ve büyük lezyonlarda bronkoskopinin tanı oranı fazladır.
Küçük ve periferik nodüllerde ise daha az tercih edilmektedir. Bronkoskopi sırasında
lavaj,
fırçalama,
transbronşiyal
biyopsi
ile
lezyonlardan
tanı
için
örnek
alınabilmektedir (3).
Transtorasik iğne aspirasyon ve biyopsisi
Bronkoskopiden daha az invaziv bir yöntemdir. Periferik nodüllerde tercih
edilmektedir. Malign nodüllerde tanı değeri %64–100, benign nodüllerde ise %12–68
arasındadır (1). Çapı 2cm’den küçük SPN’de bronkoskopiden daha yüksek tanı
değerine sahip olduğu gösterilmiştir (11). Hücreden çok dokunun alındığı tru-cut
biyopsi ile sonuçlar daha başarılıdır. Genelde skopi veya BT eşliğinde yapılmaktadır.
Tek akciğeri olanlarda işlem kontrendikedir. En sık komplikasyonu pnömotorakstır ve
%25–30 oranında görülebilir. Hemoptizi, hava embolisi, tümör hücre implantasyonu
diğer komplikasyonlarıdır.
Cerrahi Girişimler
Yüksek malignite olasılığı olan nodüllerde ve PET pozitif olanlarda cerrahi rezeksiyon
endikasyonu bulunmaktadır. SPN’lerde VATS (video assisted thorasic surgery) veya
torakotomi yöntemleri kullanılmaktadır. Plevraya yakın olanlarda VATS tercih
edilmektedir. Nodülden alınacak frozen sonucuna göre rezeksiyon boyutuna karar
verilir (3). SPN’de önerilen algoritma Tablo 31.2’de verilmiştir.
399
SPN’li Hastaya Yaklaşım
<3cm
eski grafiler değerlendirilmelidir.
İki yıllık stabilite: ileri incelemeye gerek yok
Grafilerde tipik benign kalsifikasyon
Santral
Diffüz
Laminer
Patlamış mısır
İleri incelemeye gerek yok
PA akciğer grafisinde SPN saptanırsa hemen BT çekilmeli.
Yüksek riskli, >1cm
BT’de mediastende LAP yok
Operasyona uygun
Operabl hastalarda TTİİA ya da Bronkoskopi hekimin yaklaşımına bağlıdır.
Cerrahiyi reddeden ya da cerrahiye uygun olmayan hastalarda TTİİA veya
Torakotomi
Transbronşiyal İİA
Pozitif: Tedavi
Negatif: PET
Cerrahiye uygunluğu sınırda olan hastalarda PET
Negatif: Takip
negatif: Takip
pozitif: Cerrahi
zorlanmalı
Kesin doku tanısı olmayan SPN’de izlem: 2 yıl takip
3,6,12,24. aylarda PA akciğer grafi veya BT
400
Tablo 31.2: SPN’de önerilen algoritma
Tanımlanamayan SPN
Hikaye
•Sigara
•Yaş
•Daha önceki malignite
•Çevresel faktörler
•Endemik mantar
•Hemoptizi
Akc. Grafisi ve CT
•eski grafileri
•kalsifikasyon
•spiküler uzanım
•kenar karakteristiği
Kanser riskinin
yüksekliği
Hasta Faktörleri
•Cerrahi risk
•Co-morbidite
•Hasta tercihi
Pulmoner malignite
olasılığı
HAYIR
EVET
Diagnostik testler
•PET
•Biyopsi
(+)
VATS veya Açık Cerrahi
Dikkatli izlem
(-)
KAYNAKLAR
1. Tan BB, Flaherty KR, Kazerooni EA, Lannettoni MD; American College of
Chest
Physicians.
The
solitary
pulmoner
nodule.
Chest
2003;123(1
Suppl):89S-96S.
2. Cummings SR, Lillington GA, Richard Rj. Managing solitary pulmonary
nodules. The choice of strategy is a close call. Am Rev Respir Dis
1986;134:453-60
3. Kartaloğlu Z; Soliter pulmoner nodüle yaklaşım. Türk Göğüs Kalp damar
Cerrahisi Dergisi 2008;16(4):274-283
401
4. Fraser RS, Muller NL, Colman NL et al. Pulmonary carcinoma. In:Fraser RS,
Pare GAP, eds. Diagnosis of the disease of the chest. 4th ed. Philadelphia:
WB Saunders Company, 1999;1069-228.
5. Alver M. Göğüs hastalıkları tanısında röntgen ve tomografi. İstanbul : Logos
Yayıncılık Tic. A.Ş., 1990;154:153-7.
6. Zerhouni EA, Stitik FP, Siegelman SS et al. CT of the pulmonary nodule: A
cooperative study. Radiology 1986;160:319-27.
7. Mahoney MC, Shipley RT, Corcoran HL et al. CT demonstration of
calcification in carcinoma of the lung. AJR 1990;154:225-8.
8. O’Keefe ME, Good CA, Mcdonald JR. Calcification in solitary nodules of the
lung. AJR 1957;77:1023-33.
9. Liilonton GA. Management of solitary pulmonary nodules. Dis Mon
1991;156:925-9.
10. Fleischner Society. Glossery terms for thoracic radiology: Recommendations
of the nomenclature commitee of the Fleischner Society. AJR 1984;143:50917.
11. Ost D, Fein AM, Feinsilver SH. Clinical practice. The solitary pulmonary
nodule. N Engl J Med 2003;348:2535-42.
402
32.
Doç. Dr. Ş. Tuba Liman ve Prof. Dr. Salih Topçu
Kocaeli Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
İNTERSTİSİYEL AKCİĞER HASTALIKLARINDA GÖĞÜS CERRAHİSİNİN YERİ
İnterstisiyel akciğer hastalığı (İAH) geniş spektrumlu bir grup hastalığı tarif etmek için
kullanılmaktadır. Aslında etiyolojileri, tedavileri ve prognozları birbirinden oldukça
farklı bir grup hastalık olmalarına rağmen klinik görünümleri, radyolojik bulguları,
patolojik bulguları ve fizyolojik özellikleri birbirine benzer oldukları için bir grup altında
sınıflandırılmaktadırlar. İAH akut inflamatuar hastalıklardan kronik seyirli fibrozisle
giden hastalıklara kadar oldukça geniş bir grup hastalıktır. Bu hastalıkların primer
olarak tedavilerinde olmasa da kesin tanı amacıyla biyopsi alınması ya da
pnömotoraks vb gelişen komplikasyonların tedavisinde de göğüs cerrahisinin yeri
vardır (Resim 32.1).
a
b
Resim 32.1a: Histiositosis X hastalığında gelişen pnömotoraks b: Aynı hastanın toraks
kateteri takıldıktan sonraki akciğer grafisi; akciğer ekspanse (Kocaeli Üniversitesi Hastanesi
Arşivi)
Günümüzde İAH için kullanılan sınıflandırma Tablo 32.1’de görülmektedir (1). Nedeni
belli olan ve olmayan pek çok hastalık burada gruplandırılmıştır.
403
Tablo 32.1: Interstisiyel akciğer hastalıklarında sınıflama
Etiyolojisi Bilinen İAH
Maruziyet
Sistemik
Hastalıklar
Etiyolojisi Bilinmeyen İAH
Genetik
Mesleki
Kollajen Doku
Hastalıkları
Ailesel
Çevresel
Sarkoidoz
HermanskyPudlak
Sendromu
İlaçlar
İnflamatuar
Barsak
Hastalıkları
Radyasyon
İdiopatik
İnterstisiyel
Pnömoniler
İdiopatik
Pulmoner
Fibrozis
Nonspesifik
İnterstisiyel
Pnömoni
Kriptojenik
Organize
Pnömoni
Lenfositik
İnterstisiyel
Pnömoni
Spesifik Patoloji
Lenfanjioleyomyomatosis
Pulmoner Alveolar
Proteinoz
Sigara
Diğer
İAH değişik derecelerde inflamasyon ve fibrozise neden olan hastalıklardır (2).
İnterstisiyum kapiller ile alveollerin arasında gaz alışverişinin olmasını sağlayan bağ
dokusudur. İnterstisiyumda bağ dokusu matriksi, fibroblastlar ve makrofajlar gibi
inflamatuar hücreler yer alır.
İAH daha çok interstisiyumu etkilemektedir. Ancak değişen derecelerde vasküler
yapılar, alveoller ve hava yollarının da etkilenmesi söz konusu olduğundan aslında
interstisiyel akciğer hastalıkları tanımlamasında hata vardır.
Nedeni belli olanlar içerisinde en sık karşılaşılanlar: mesleki ya da çevresel
maruziyetle gelişenlerdir (organik inorganik tozlar). Nedeni bilinmeyen hastalıklar ise
sarkoidoz idiopatik pulmoner fibrozis, bağ dokusu hastalıklarında gelişen pulmoner
fibrozis
(SLE romatoid artrit, skleroderma vb) gibi hastalıklardır. Bilinen ya da
bilinmeyen
nedenlerle
akciğerde
doku
hasarlanması
oluşur,
sonrasında
interstisiyumda tamir mekanizmaları kullanılır ve interstisiyel doku artarak, kapiller
yapıların ve alveollerin yerini alır (1). Bu da ventilasyon-perfüzyon sintigrafisinde
uyumsuzluklar oluşturan yer yer gaz değişiminde bozulmalara neden olur. Sonunda
hastada egzersisle meydana gelen dispne gelişir.
404
Klinik
En belirgin semptomlar ilerleyici şekilde gelişen egzersis dispnesi ve prodüktif
olmayan öksürüktür. Ayrıca balgam, hemoptizi, wheezing, göğüs ağrısı vb
semptomlar hastalığa bağlı olarak bulunabilir ve tanıya ulaşmada yardımcı
semptomlar olabilir. Örneğin wheezing olması hastanın hava yollarının da
etkilendiğini gösterir ve sarkoidoz vb hava yolunu tutan hastalıklar ön planda
düşünülebilir. Beraberinde olan diğer sitem bulguları; kas, iskelet sisteminde ağrı
olması, ateş, güçsüzlük, eklemlerde ağrı ve şişlik fotosensitivite olması raynaud, cilt
bulguları vb ayırıcı tanıda yararlı olmaktadır.
Yaş ve cinsiyet de ayırıcı tanıda oldukça önemlidir. Sarkoidozis, histiositozis,
lenfanjiomyomatosis vb hastalıklar daha genç hastalarda gözlenirken, idiopatik
pulmoner fibrozis daha çok 50 yaşın üzerinde görülmektedir. Ayırıcı tanıda cinsiyet
de yol gösterici olabilir. Mesleksel maruziyete bağlı pnömokonyoz daha çok
erkeklerde gözlenirken, kadın hastalarda tüberoskleroz ve lenfanjiomyomatozis daha
çok saptanmaktadır (Resim 32.2).
Resim 32.2: Lenfanjioleiomyomatozis, bilateral akciğer parankiminde kistik lezyonlar
(Kocaeli Üniversitesi Hastanesi Arşivi)
Hastanın hikayesi çok dikkatli alınmalıdır. Sigara kullanımı etiyolojik faktörlerden
biridir. Semptomların ne kadar zaman önce başladığı da hastalığın seyri açısından
fikir vermesi nedeniyle önemlidir. Hastanın kullandığı ilaçların hikayesi de mutlaka
405
öğrenilmelidir. Bazı ilaçlar kullanıldıktan haftalar hatta aylar sonra İAH yol açabilirler.
Bazı
antibiyotiklere,
antiinflamatuarlara,
antiaritmiklere,
kemoterapötiklere
ve
uyuşturucu kullanımına bağlı İAH gelişebilir.
Aile hikayesi genetik yatkınlık olan bazı hastalıklarda önemlidir.
Meslek hikayesi oldukça önemlidir. Mesleki ve çevresel etkenlerle maruziyet
hikayede varsa mutlaka ortaya çıkartılması için ayrıntılı olarak sorgulanmalıdır.
İnorganik ya da organik tozlar, kimyasallar, inhale edilen gazlar, hayvan beslemek,
hayvancılıkla ilgili iş yapmak, klima kullanımı, nemlendirici sistem kullanımı, kömür
ocağında çalışma, asbest maruziyeti vb sorgulanması oldukça önemlidir.
Fizik Muayene
Bilateral inspiratuar çıtırtı sesi duyulması çoğu hastada olan bir fizik muayene
bulgusudur. Hatta bazı hastalarda radyolojik anormallikler gözlenmeden de çıtırtı sesi
alınabilir. Hastalık beraberinde hava yolunu da tutuyorsa wheezing nadir olarak
gözlenebilir.
Clubbing, siyanoz, pulmoner arteryel hipertansiyon bulguları ve
ekstratorasik bazı bulgular (cilt lezyonları, eklemlerde şişme, kızarıklık, hareket
kısıtlılığı, deformiteler) gözlenebilir. Bu bulgular ayırıcı tanıda önemlidir.
Tanı Yöntemleri
Rutinde yapılan laboratuar tetkikleri genellikle tanı için bir şey kazandırmaz. Eritrosit
sayı anormallikleri, sedimentasyon yüksekliği, bazı serolojik testler (ANCA, RF, ANA
vb) faydalı olabilir. Son zamanlarda bazı serum markerları üzerine çalışmalar vardır.
EKG- EKO
Sağ ventriküler yüklenme bulguları, pulmoner hipertansiyon bulguları vb olabilir.
Pulmoner hipertansiyon gelişmişse hastalığın ağırlığı daha fazladır ve prognozu daha
kötüdür.
Akciğer Grafisi
Oldukça önemlidir. Hastanın mutlaka eski grafileri de değerlendirilmelidir. Bu
hastalığın ilerleme hızı hakkında bilgi sahibi olunmasını sağlar. Az sayıda hastada
akciğer grafilerinde patolojik bulgu saptanmayabileceği akılda tutulmalıdır. Akciğer
406
grafisinde mikronodüler, nodüler, retiküler ve retikülonoduler patern, buzlu cam
manzarası, lineer çizgilenmeler, kistik yapılar vb gözlenebilir (3). Resim 32.3, 32.4 ve
32.5’de interstisiyel akciğer hastalıklarına örnek grafiler görülmektedir. Pnömotoraks
gelişmiş olabilir. Bazı hastalılarda daha karakteristik bulgular olabilir.
Resim 32.3: Sklerodermada akciğer tutulumu, bazallerde daha fazla olmak üzere bilateral
interstisiyel tutulum (Kocaeli Üniversitesi Hastanesi Arşivi)
Resim 32.4: Romatoid artritte akciğerde retikülonodüler görünüm. (Kocaeli Üniversitesi
Hastanesi Arşivi)
407
Resim 32.5: Akciğer grafisinde mikronodüler interstisiyel tutulum (Kocaeli Üniversitesi
Hastanesi Arşivi)
Radyolojik paternlerle hastalığın evresi arasında bir ilişki çoğu zaman kurulamaz.
Ancak bal peteği manzarası hastalığın son evrede olduğunu göstermesi açısından
önemlidir.
HRCT
En önemli bilgi HRCT ile elde edilmektedir. Akciğer grafilerindeki bulgular her
hastalıkta aynı olabilir ama HRCT ile hastalıklar hakkında daha spesifik bulgular elde
edilebilir. Hastalığın varlığının tespiti, yaygınlığının saptanması, hastalığa karakterize
paternin ortaya konması, ayırıcı tanı, cerrahi olarak alınacak biyopsinin yerinin
saptanması, klinik olarak takipte ve tedaviye yanıtı değerlendirilmesinde HRCT
bulguları oldukça değerlidir (4).
Günümüzde bazı hastalıklarda sadece HRCT ile tanı konabilmektedir ve bu şekilde
tanı için akciğer biyopsisine gerek kalmamaktadır. Örneğin idiopatik interstisiyel
fibroziste simetrik olarak özellikle alt loblarda gözlenen periferik bilateral irreguler
lineer opasiteler, kistik alanlar ve bal peteği manzarası tipiktir ve bu bulgularla tanı
konursa cerrahi biyopsi gerekmeyebilir (Resim 32.6, Resim 32.7).
408
Resim 32.6: Usual interstisiyel pnömoni, bilateral bazallerde ön planda subplevral alanda
tutulum, bal peteği görünüm, traksiyon bronşiektazisi (Kocaeli Üniversitesi Hastanesi Arşivi)
Resim 32.7: Usual interstisiyel pnömoni, bir
alt kesitte bazallerde tutulum artıyor, bal
peteği görünüm, traksiyon bronşiektazisi
(Kocaeli Üniversitesi Hastanesi Arşivi)
HRCT’de ayrıca akciğerlerde volüm kaybı da gözlenir. Lenf adenopati beklenen bir
bulgu değildir. Bazı hastalıklarda nadiren gözlenebilir. Plevral plaklar, plevral sıvı da
plevranın da etkilendiği hastalıklarda gözlenebilir. Asbest maruziyeti gibi plevranın da
etkilendiği hastalıklarda bu bulgular ayırıcı tanıda önem kazanmaktadır.
SFT
Akciğer volümleri total akciğer kapasitesi, fonksiyonel rezidüel kapasite, rezidüel
volüm azalmıştır. Akım hızlarında da FVC ve FEV1 de azalma saptanır. DLCO
oldukça düşüktür.
409
Arteryel kan gazı incelemesi
Özellikle oda havasında solurken örnek alınmalıdır. Başlarda normal değerler
saptanabilir. Özellikle dinlenme halinde değerler normal olabilir. Genellikle hipoksi
saptanır. Karbondioksit retansiyonu hastalığın son evrede olduğunu gösterir.
Bronkoskopi
Bronkoalveolar lavaj almak için ya da transbronşiyal akciğer biyopsisi almak için
kullanılmaktadır.
Transbronşiyal biyopsi
Transbronşiyal biyopsi yada transtorasik biyopsi ile alınan akciğer dokusu oldukça
küçük olduğundan malinite, sarkoidoz ve enfeksiyon nedeniyle gelişen İAH’da faydalı
olabilir ancak idiopatik interstisiyel pnömonilerin tanınmalarında yeterli olmaz (5,6).
BAL
Fiberoptik bronkoskopi kullanarak alınan bronş lavajında hücre araştırılması bazı
hastalıklar için önemli olabilir (7). Mikrobiyolojik incelemeler için de bu yolla örnek
alınabilir.
Akciğer Biyopsisi
İAH’da başarılı tedavi şekillerinin olmaması ve kötü prognoz nedeniyle yıllarca cerrahi
biyopsiden kaçınılmıştır. Biyopsi alınsa bile sınırlı bilgi edinilmektedir. Histopatolojik
değişiklikler nadiren spesifik olarak altta yatan patolojinin etiyolojisini aydınlatır.
Dahası bu hastalar genel anestezi ve cerrahi açısından fonksiyonel durumu daha iyi
olan diğer hastalara göre yüksek komplikasyon riski taşırlar (8-10). Cerrahi biyopsiye
karar verilirken kesin tanı konulunca elde edilecek fayda ve işlemin riskleri tartılmalı
ve elde edilecek bilgi hastanın tedavisini çok değiştirecekse biyopsi alınmalıdır (9).
Bu hastalıkların pek çoğunda steroid tedavisi uygulanmaktadır ve biyopsi sonrası
steroid tedavisinin yerine konacak daha efektif bir tedavi yoktur. Bu nedenle klinik ve
radyolojik olarak tanıya ulaşılamayan hastalarda cerrahi biyopsi endike olabilir.
410
Ayrıca tedavide kullanılmaya başlanan bazı yeni ilaçların gerçek etkinliğinin
saptanmasında da kesin patolojiye ihtiyaç duyulmaktadır.
Cerrahi biyopsi için yüksek riskli hastalar:
-
Hastanın mekanik ventilatörde olması
-
Akciğer kompliansında ileri derecede azalma
-
Ciddi hipoksi
-
Pulmoner hipertansiyon
-
İmmunsuprese hastalar
-
Koagulopati ve kanam riski
-
FEV1 1 L
-
Hastalığın akut olarak kötüleşmesi
-
DLCO’nun çok düşük olması
Mekanik ventilatördeki hastalar ve bağışıklık sistemi baskılanmış hastalar
özellikle daha fazla risk altındadır (9).
Biyopsi Yöntemleri
HRCT bulgularına göre biyopsi alınacak taraf ve yer belirlenmektedir. Buzlu cam
manzarası olan alanlar genellikle aktif hastalığı gösterir ve örneklenmelidir. Lokalize
fibrotik alanlardan, end-stage hastalık olan ve bal peteği görünümü olan alanlardan
biyopsi yapılmamalıdır. Bu şekilde fibrozis olduğunun saptanması dışında bilgi
edinilemez ve yanlışlıkla yoğun fibrozisle giden hastalıklar zannedilebilir. Biyopsi
alırken akciğer mümkün olduğu kadar az hasarlanmalıdır.
Cerrahi sırasında hava kaçağı kontrolü iyi yapmalıdır. Uzamış hava kaçağından
kaçınılmalıdır.
Biyopsinin optimal boyutu, seçilecek alan ve örneklem sayısı tartışmalıdır. Fibrozis ve
vasküler değişiklikler olduğundan daha fazla görüleceğinden genelde lingula ve orta
lobun kenarlarından alınmasından kaçınılır (11). Hastalığın difüz olarak yayılım
gösterdiği kişilerde lingula dan da biyopsi alınabilir (11).
Alınan biyopsi aktif hastalık alanını temsil etmelidir. Genellikle normal akciğer
dokusuna yakın olan alanlardan biyopsi alınmalıdır. Özellikle uniform olmayan
hastalıkta cerrah, radyolog, göğüs hastalıkları uzmanı ve patolog ile görüşülerek
biyopsinin alınacağı alan belirlenmelidir (12).
411
Radyolojik olarak en fazla tutulan alandan 2 cm den büyük çapta alınan bir örnek
yeterli olabilir. Ancak histolojik değişkenlik gösteren hastalıklar düşünülüyorsa farklı
alanlardan birden fazla biyopsi alınabilir. Hem anormal hem de normal görünümlü
alanlardan biyopsi almak gerekir.
Açık ya da Torakoskopik Biyopsi
Cerrahi olarak torakotomi ile ya da torakoskopik olarak biyopsi alınabilir. Küçük
torakotomi ve torakoskopi arasında çok fazla bir fark olmamasına rağmen
torakoskopik yol daha az postoperatif analjezi ihtiyacı olması ve hastanede yatış
süresinin daha az olması ve göğüs tüplerinin daha kısa sürede alınabilmesi
nedeniyle daha çok tercih edilmektedir. Alınan biyopsinin tanısal güvenirliği açık
biyopsi ile benzerdir (11) İki yaklaşımdan hangisinin seçileceğine cerrahın
deneyimine göre karar verilir. VATS daha az invasiv olması nedeniyle daha çok tercih
edilmektedir.
Kritik derecede hasta olan ventilatör bağımlı ve tek akciğer ventilasyonunu tolere
edemeyecek hastalarda VATS yapılamaz ve bu durumda standart mini torakotomi
daha avantajlıdır (11). Ciddi hipoksisi olan, plevral hastalığı bulunan, pulmoner
hipertansiyonu olan yüksek hava yolu basıncı olan, hemoraji riski yüksek olan
hastalarda açık biyopsi tercih edilir (10).
Biyopsinin her zaman spesifik tanı sağlayamadığı ve sonuçta tedavide değişikliğe
neden olamadığı da akılda tutulmalıdır.
Tedavi
Tanı kesinleştikten sonra hastalığa spesifik olarak tedavi planlanır. Bu hastalarda
hipoksi olduğundan nazal olarak oksijen tedavisi uygulanabilir. Oksijen tedavisiyle
hayat
kalitesinin
arttığı
ve
pulmoner
arteryel
hipertansiyon
gelişmesinin
önlenebileceği bildirilmiştir. Pulmoner rehabilitasyon ve egzersis tedavileri faydalı
olabilir. Hastalar pnömokoklara karşı aşılanmalı enfeksiyondan korunmak için
önlemler hastalara anlatılmalıdır.
İnflamasyonu ve akciğer hasarını önlemek tedavide amaçlanmaktadır ve bu nedenle
kortikosteroidler ve azotiopirin siklofosfamid gibi immün sitemi baskılayan ilaçlar
yaygın
olarak
kullanılmaktadırlar.
Yeni
denenmektedir.
412
yapılan
çalışmalarda
bazı
ilaçlar
İdiopatik intestisiyel fibrozis maalesef tedavisi olmayan bir hastalıktır. Bu hastalık
tanındıktan sonra genellikle 4 yıl içerisinde kaybedilmektedirler (1). Akciğer
transplantasyonundan başka hiçbir tedavi efektif görünmemektedir.
KAYNAKLAR
1.
Chapman JT. Interstitial lung disease. Cleveland Clinic. Continuing education.
http://www.clevelandclinicmeded.com/medicalpubs/diseasemanagement/pulmonary/i
nterstitial-lung-disease/
2.
King TE, Flaherty KR, Hollingsworth H. Approach to the adult with interstitial
lung disease. http://www.uptodate.com
3.
Stark P, Muller NL, Wilson KC. Evaluation of diffuse lung disease by plain chest
radiography. http://www.uptodate.com
4.
Lynch DA, Travis WD, Müler NL, galvin JR, Hansell DM, Grenier PA, King TE.
Idiopathic interstitial pneumonias: CT features. Radiology 2005;236:10-21
5.
Raghu G. Interstitial lung disease: A diagnostic approach. Are CT scan and lung
biopsy indicated in every patient? Am J Respir Crit Care Med 1995;151:909 –14.
6.
King TE. Clinical advances in the diagnosis and theraphy of the interstitial lung
disease. Am J Respir Crit Care Med 2005;172:268-279
7.
Kılınç G, Kolsuk EA. The role of bronchoalveolar lavage in diffuse parenchymal
lung diseases. Curr Opin Pulm Med 2005;11:417-421
8.
King TE, Flaherty KR, Hollingsworth H. Role of lung biopsy in the diagnosis of
interstitial lung disease. http://www.uptodate.com
9.
Lettieri CL, Veerappan GR, Helman DL, Mulligan CR, Shorr AF. Outcomes and
Safety of Surgical Lung Biopsy for Interstitial Lung Disease. Chest 2005;127;16001605
10. Riley DJ. Risk of surgical lung biopsy in idiopathic interstitial pneumonias. Chest
2005;127:1485-86
11. Halkos ME, Gal AA, Kerendi F, Miller DL, Miller JI. Role of thoracic surgeons in
the diagnosis of idiopathic interstitial lung disease. Ann Thorac Surg 2005;79:217-9
12. Flaherty KR, King TE Jr, Raghu G, Lynch JP 3rd, Colby TV, Travis WD, Gross
BH, Kazerooni EA, Toews GB, Long Q, Murray S, Lama VN, Gay SE, Martinez FJ
Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to
diagnosis? Am J Respir Crit Care Med. 2004; 170:904-10
413
33.
Yrd. Doç. Dr. Anıl Özgür
Mersin Üniversitesi Tıp Fakültesi Radyoloji Anabilim Dalı
AKCİĞER KANSERLERİNDE SIK RASTLANAN RADYOLOJİK BULGULAR
Akciğer kanserleri sigara kullanımı ile ilgili tüm bilinçlendirme çalışmalarına rağmen
kanser ölümlerinin en sık nedeni olmaya devam etmektedir. Hastalığın belirti ve
bulgularının geç ortaya çıkması, tanı sırasında kanserin genellikle ileri evrede
olmasına ve olguların operasyon şansını kaybetmesine yol açmaktadır; gerçekten de
tanı sırasında olguların yaklaşık yarısında akciğer dışına yayılım söz konusudur.
Akciğer kanseri tanısının olabildiğince erken ve kesin olarak konulması tedavi
seçeneklerini artırmakta ve prognozu olumlu yönde etkilemektedir. Radyolojik
incelemeler, erken tanıyı invaziv olmayan yöntemlerle sağlayan değerli tanı
araçlarıdır.
Görüntüleme Yöntemleri
Akciğer kanserini görüntülemede radyogramlar, bilgisayarlı tomografi (BT), manyetik
rezonans
görüntüleme
(MRG)
ve
pozitron
emisyon
tomografisi
(PET-BT)
ilk
oluşturan
kullanılabilir.
Radyogramlar
Solunum
sistemi
hastalıklarının
değerlendirilmesinde
adımı
radyogramlar akciğer kanseri tanısında da önemli yere sahiptir. Asemptomatik bir
olguda radyogramlarda saptanan bir anormallik akciğer kanserinin habercisi olabilir.
Semptomatik olguda ise radyogramlarda kanser tanısını destekleyen bulgular
saptanabilir. Nonspesifik sistemik yakınmaları olan ya da metastatik hastalığı
destekleyen semptomları olan olgularda elde edilen radyogramlarda, olası primer
odak açısından akciğer kanserine yönelik değerlendirme yapılabilir. Posteroanterior
ve lateral radyogramlar rutin uygulamalarda en çok yararlanılan incelemeler olup,
hava hapsinin gösterilmesi gibi özel durumlarda inspiryum-ekspiryum radyogramları
da fayda sağlamaktadır.
Bilgisayarlı Tomografi (BT)
Radyogramlarda patoloji saptanan ya da belirgin bulgusu olmasa da klinik olarak
akciğer kanserinden şüphelenilen olgular BT ile değerlendirilmelidir. BT akciğer
kanserinin tanısında, evrelendirilmesinde ve izleminde temel radyolojik yöntem olup
414
mediasten ve parankim penceresi ile elde edilen görüntülerde gerek parankime ait
gerekse de mediastene ait patolojiler gösterilebilir. Özellikle son yıllarda çok kesitli
bilgisayarlı tomografi (ÇKBT) teknolojisinin gelişmesi ile BT’nin akciğer kanserini
değerlendirmedeki rolü daha da artmıştır. ÇKBT ile, solunum artefaktlarından
etkilenmeden çok daha hızlı, ince kesit kalınlığında, yüksek kalitede görüntüler elde
edilmekte ve bu görüntülerden sagital-koronal planda ve üç boyutlu yeni görüntüler
(reformat
görüntü)
oluşturulabilmektedir (Resim
33.1).
Yüksek
çözünürlüklü
bilgisayarlı tomografi (YÇBT) ise lenfanjitis karsinomatoza tanısında faydalı olan bir
görüntüleme yöntemidir.
Resim 33.1: ÇKBT incelemede, aksiyel görüntülere ek olarak sagital, koronal planda ve ek
olarak 3 boyutlu reformat görüntüler elde edilebilir.
Manyetik Rezonans Görüntüleme (MRG)
Akciğer kanserinin değerlendirilmesinde rutin kullanılan bir yöntem olmayıp daha çok
BT ile şüphede kalınan durumlarda sorunu çözmek için başvurulan bir görüntüleme
aracıdır. Multiplanar görüntülemeye olanak tanıması ve yüksek yumuşak doku
rezolüsyonu sağlaması nedeniyle tümörün toraks duvarına, vasküler yapılara,
vertebral
kolona
ve
spinal
kanala
invazyonunu
metastazlarını saptamada faydalıdır.
415
göstermede
ve
vertebra
Pozitron Emisyon Tomografisi-BT (PET-BT)
Kanser değerlendirmesinde kullanımı giderek yaygınlaşan bir yöntem olan PET-BT
incelemenin, anatomik bilgi sağlayan diğer görüntüleme araçlarından en önemli farkı
fonksiyonel bir görüntüleme yöntemi olmasıdır. 18-Florodeoksiglukoz (FDG)
kullanılarak gerçekleştirilen bir yöntem olan PET-BT görüntülemenin temeli, kanser
hücrelerinde metabolizma hızının ve buna bağlı olarak glukoz kullanımının artmasına
dayanır. PET-BT; soliter pulmoner nodülde malign/benign ayrımı gibi özel durumlar
dışında tanısal olarak sınırlı kullanım alanına sahip olmakla birlikte gerek lenf nodu
tutulumu ve uzak metastazları saptamadaki duyarlılığı gerekse de tedaviye yanıtın
değerlendirilmesinde
sağladığı
avantajlar
nedeniyle
akciğer
kanserlerinin
evrelendirilmesinde ve izleminde ihtiyaç duyulan bir yöntemdir.
Genel Radyolojik Özellikler
Akciğer kanserlerinde radyolojik bulgular tümörün kendisine veya tümörün etkisiyle
oluşmuş sekonder değişikliklere bağlı ortaya çıkabilir. Pek çok olguda ise lenf nodu
tutulumu ve metastazlara ait bulgular eşlik edebilir.
Tümörün kendisine ait radyolojik bulgular hücre tipine, tümör lokalizasyonuna, tümör
boyutuna ve tümörün radyolojik görünümüne göre farklılıklar gösterebilir.
Akciğer kanserleri lokalizasyonlarına göre santral ya da periferal yerleşimli olarak
sınıflandırılabilirler. Skuamöz hücreli kanser ve küçük hücreli kanser daha çok santral
yerleşimli iken, adenokanser ve büyük hücreli kanser ise periferal yerleşimlidir.
Akciğer kanserleri boyut ve radyolojik görünümlerine göre nodül, kitle, kaviter kitle ya
da infiltrasyon şeklinde tanımlanabilirler. Çapı 3 cm ya da daha küçük olan yuvarlak
lezyonlar nodül olarak tanımlanırken 3 cm’den büyük olanlar ise kitle olarak
adlandırılırlar. Bazen, skuamöz hücreli kanserlerde daha sık olmak üzere, kitle
içerisinde kavitasyon görülebilir. Tümör nekrozuna bağlı gelişen bu kavite kalın
duvarlı olup iç kenarları düzensizdir (Resim 33.2a,b). Adenokanserin bir alt tipi olarak
kabul edilen bronkoalveolar kanser ise infiltrasyon (konsolidasyon) şeklinde izlenebilir
ve bundan dolayı pnömoni görünümünde akciğer kanseri olarak da tanımlanır.
Akciğer kanserlerinde sıklıkla tümörün etkisiyle ortaya çıkan sekonder bulgulara da
rastlanılır. Bronşiyal daralma ya da tıkanma, mukus plakları, hava hapsi, atelektazi,
sekonder pnömoni gibi bulgular santral yerleşimli tümörün havayollarını etkilemesiyle
ortaya çıkan sekonder değişiklikler arasında sayılabilir (Resim 33.3).
416
Resim 33.2a: Mediasten penceresindeki BT kesitinde, sağ akciğerde kaviter kitle.2b:
Parankim penceresindeki BT kesitinde, kaviter kitleye eşlik eden
Resim 33.3: ÇKBT incelemede, solda santral yerleşimli spiküle konturlu kitlenin uzanımının,
çevresel lenfanjitis karsinomatozanın ve distal parankimdeki post-obstrüktif değişikliklerin
optimum değerlendirilmesine olanak sağlayan koronal ve sagital reformat görüntüler.
Radyolojik tetkiklerde tümörün lenfatik yayılımına bağlı hiler ve mediastinel büyümüş
lenf nodları da saptanabilir (Resim 33.4). Toraks bölgesine yönelik gerçekleştirilen
incelemelerde, tümörün uzak yayılımına bağlı, özellikle kemik yapılarda ve sürrenal
glandlarda metastazlar da izlenebilir (Resim 33.5, Resim 33.6).
417
Resim 33.4: BT incelemede, sağda santral yerleşimli kitle ile eşlik eden mediastinel multipl
büyümüş lenf nodları (büyük ok); sağ akciğer alt lobda konsolidasyon (siyah ok), sağda
plevral sıvı (beyaz ok).
Resim 33.5: BT incelemede, sol akciğer alt lobda kitle. Sağ atriumda ve inferior vena
kavada trombüs (siyah ok). Her iki sürrenal glandda metastaz ile uyumlu kitlesel lezyonlar
(beyaz ok).
418
Resim 33.6: BT incelemede, her iki akciğer parankiminde lenfanjitis karsinomatoza ile
uyumlu görünüm; sağ hemitoraksta hidropnömotoraks (ok) ile sağ akciğerde volüm kaybı.
Plevral sıvı komşuluğunda kotta metastaz ile uyumlu skleroz artışı.
Bazı olgularda plevra metastazı, bazı olgularda ise tümörün kitle etkisine sekonder
lenfatik drenaj ve/veya venöz dönüşün bozulması nedeniyle plevral sıvı izlenebilir
(Resim 33.4). Pnömotoraks ya da hidropnömotoraks da nadiren saptanabilecek
plevral anormallikler arasındadır (Resim 33.6).
Gerek tümörün kendisine bağlı değişiklikler ile tümöre sekonder oluşmuş
değişikliklerin, gerekse de lenf nodu tutulumu ile uzak metastazlara ait bulguların pek
çok olguda bir arada bulunabileceği akılda tutulmalıdır (Resim 33.4, Resim 33.6).
Akciğer kanserinde en sık rastlanan bulgular ve bazı özel patolojiler daha ayrıntılı
olarak ele alınacaktır.
Sık Rastlanan Bulgular/Özel Patolojiler
Hiler genişleme
Akciğer kanserli olguların %10-15’inde hiler genişleme ilk saptanan radyolojik
bulgudur (Resim 33.7a,b,c). Hiler genişlemeden santral yerleşimli bir kitle sorumlu
olabileceği gibi santral ya da periferal yerleşimli bir tümörün metastazlarına bağlı
büyümüş lenf nodları da bu bulguya yol açabilir. Skuamöz hücreli karsinom sıklıkla
hiler kitle olarak bulgu verir (Resim 33.8 a,b). Küçük hücreli kanserde ise santral bir
kitle ve eşlik eden hiler büyümüş lenf nodlarının birlikte bulunması karakteristiktir.
Bazı olgularda santral yerleşimli kitle ve eşlik edebilecek büyümüş lenf nodları
419
mediastinal ana vasküler yapıları çevreleyip daraltabilir ya da invaze edebilir (Resim
33.9 a,b) ve acil tedavi gerektiren bir durum olan süperior vena kava sendromuna
neden olabilir (Resim 33.10). Santral bir kitle hilusta genişlemeye yol açabileceği gibi
havayollarına olan etkisine bağlı oluşmuş sekonder bulgular ile de kendisini
gösterebilir.
Resim 33.7a: PA radyogramda, her iki hilusta hafif genişleme ile perihiler retiküler izlerde
belirginleşme. b: Bir yıl sonra çekilen PA radyogramda, sol hilusta belirgin genişleme ile sol
perihiler alanda spiküler radyoopasiteler.c: 9 ay sonraki PA radyogramda, daha da
belirginleşen hiler kitle ve eşlik eden sol akciğer alt lob atelektazisi ile uyumlu görünüm.
Atelektaziye sekonder sol hemidiyaframın seçilemediğine dikkat ediniz. Tanı: Skuamöz
hücreli karsinom.
Resim 33.8 a: PA radyogramda, sağ hilus üst kesiminde belirginleşme ve suprahiler alanda
hilus ile devamlılık gösteren radyoopasiteler. b: BT incelemede, sağ akciğer üst lob bronşunu
daraltan santral yerleşimli kitle (ince ok) ve devamında atelektazi/konsolidasyon (kalın ok).
Histopatolojik tanı: Skuamöz hücreli karsinom.
420
Resim 33.9 a: Mediasten penceresindeki BT kesitlerinde, sağ ana bronşu oblitere eden ve
sağ ana pulmoner arteri çevreleyip daraltan santral yerleşimli kitlesel lezyon. b: Parankim
penceresindeki BT kesitlerinde, kitle ve eşlik eden parankim değişiklikleri. Beyaz ok, sigara
ile akciğer kanserinin birlikteliğini bir kez daha gözler önüne seriyor.
Resim 33.10: BT incelemede, sağ akciğer üst lobda paramediastinel lokalizasyonda süperior
vena kavayı invaze/oblitere eden kitlesel lezyon (kalın ok), apeks düzeyinden geçen
kesitlerde yaygın kollateral vasküler yapılar (ince oklar): Akciğer kanserine sekonder süperior
vena kava sendromu.
Havayolu anormallikleri
Bronşiyal anormallikler
421
Bronşiyal anormallikler bazen radyogramlar ile saptanabilirse de, BT ve MRG bu
konuda çok daha etkindir. Santral yerleşimli bir tümör bronşiyal lümende daralmaya,
tıkanmaya veya bronş duvarında kalınlaşmaya yol açabilir (Resim 33.8a,b, Resim
33.9 a,b; Resim 33.11 a,b). Bazen endobronşiyal yerleşimli sessil, düzensiz ya da
polipoid bir kitle saptanabilir. Havayolunun daralması ve tıkanması atelektaziye,
sekonder pnömoniye, hava hapsine ve mukus plaklarına yol açabilir.
35.11 a,b
Resim 33.11 a: PA radyogramda, sağ akciğer üst lobda atelektazi ile uyumlu görünüm.
B: BT incelemede, sağ akciğer üst lobda atelektazi ile sağ ana bronşu daraltan ve sağ üst
lob bronşunu oblitere eden santral yerleşimli kitle. Histopatolojik tanı: Küçük hücre dışı
karsinom.
Atelektazi
Atelektazi, sekonder pnömoni ile birlikte akciğer kanserli olguların yaklaşık yarısında
saptanan bir bulgu olup tümörün lokalizasyonuna göre segmental veya lobar olabilir
ya da tüm akciğeri tutabilir (Resim 33.7, Resim 33.8, Resim 33.11 a,b). Etkilenen
akciğerde belirgin kollaps olabileceği gibi bazı durumlarda biriken hücre, mukus ve
sıvı nedeniyle volüm kaybı minimal de olabilir. Her iki durumda da hava
bronkogramlarının olmaması obstrüktif atelektaziyi desteklemektedir.
Radyogramlarda atelektazi ile uyumlu bulgular saptanabilir; santral yerleşimli kitle ve
akciğer parankiminde eşlik eden atelektazinin oluşturduğu ‘Golden’in S bulgusu’
olarak tanımlanan tipik bir radyolojik görünüm de izlenebilir. Ancak atelektazi ile
422
tümör kitlesinin ayrılmasında radyogramlar yetersizdir. İntravenöz kontrast madde
kullanılarak gerçekleştirilen BT ve MRG inceleme bu ayrımın yapılmasında oldukça
başarılıdır.
Sekonder Pnömoni
Bronş obstrüksiyonu sonucu biriken sekresyonun enfekte olması pnömonik
konsolidasyona neden olabilir (Resim 33.2, Resim 33.4, Resim 33.8 a,b).
Radyogramlarda yama tarzında konsolidasyon izlenir. Bazı santral yerleşimli tümörler
çok küçük boyutta olduklarından radyogramlar ile tespit edilemezler ve tek radyolojik
bulgu obstrüksiyona bağlı gelişmiş konsolidasyon olabilir. Bu nedenle tedaviye
dirençli ve tekrarlayıcı pnömoni varlığında bronş obstrüksiyonundan şüphelenilmeli
ve santral yerleşimli kitlenin araştırılması için BT inceleme yapılmalıdır. BT’de bronşu
tıkayan ya da daraltan tümörün yanısıra, sıvı-mukus ile dolu geniş bronşlar içeren
(mukus bronkogramı), yamalı, birleşme eğiliminde konsolidasyon alanları saptanır.
Hava bronkogramları da bu tabloya eşlik edebilir.
Hava hapsi
Bronş lümeninde daralma olduğunda check valve mekanizması ile hava hapsi
oluşabilir. Hasta nefes aldığında akciğere giren havanın nefes verdiğinde geri
çıkamaması sonucu oluşan bu bulgu, inspirium-ekspirium radyogramları ile daha
kolay farkedilir. Hava hapsinin olduğu tarafta akciğer parankimi daha radyolüsen,
hilus daha küçük, periferik vasküler yapılar daha incedir (Resim 33.12). Volüm
artışına bağlı mediasten karşı tarafa, diyafram ise aşağıya doğru itilir.
423
Resim 33.12: BT incelemede, solda santral yerleşimli kitle; sol akciğer alt lobda hava hapsi
(ok).
Mukus plakları
Bronşu daraltan ya da tıkayan tümör varlığında obstrüksiyonun distalinde mukus
retansiyonu oluşabilir. Parankim havalanması kollateral ventilasyon nedeniyle
genellikle korunmuş olup bazı olgularda hava hapsi izlenebilir (Resim 33.13).
Radyogramlarda ya da BT’de içleri mukus ile dolu dallanan bronşlara ait ‘eldiven
içerisinde parmak’ görünümü oldukça tipiktir. Akciğer kanseri dışında benin tümörler,
konjenital bronşial atrezi, astım, alerjik bronkopulmoner aspergillozis ve kistik fibrozis
de mukus plaklarına yol açabilir.
Resim 33.13: BT incelemede, sol akciğer alt lob apikal segmentte mukus plakları ve eşlik
eden çevresel hava hapsi (ok).
424
Soliter pulmoner nodül (SPN) veya kitle (periferal akciğer kanseri)
Soliter pulmoner nodül pek çok benign ya da malign nedene bağlı olabilir (Resim
33.14). Malign soliter pulmoner nodülün en sık nedeni ise akciğer kanseridir. Akciğer
kanserlerinin yaklaşık 1/3’ü soliter pulmoner nodül ya da kitle olarak ortaya çıkarlar.
Tümör ne kadar küçük boyutta yakalanırsa hastanın prognozu o kadar iyi
olacağından radyogramların çok dikkatle değerlendirilmesi gerekmektedir. Özellikle 1
cm’den küçük boyuttaki ve düşük dansitedeki nodüllerin kemik, kalp, mediastinal ve
hiler yapılar ile süperpozisyon nedeniyle atlanabileceği, apekslerdeki ve paratrakeal
bölgelerdeki nodüllerin ise daha kolay gözden kaçabileceği bilinmelidir. Nodül
saptandığı zaman ikinci aşamada benign/malign ayrımının yapılması gerekir.
Radyogramlar ve BT ile nodülün boyutu, şekli, konturu, heterojenite, kalsifikasyon,
kavitasyon, hava bronkogramı gibi içyapı özellikleri, kontrastlanma paterni, takip
tetkiklerinde hacminin iki katına çıkma süresi (ikilenme zamanı) değerlendirilerek bu
ayrım yapılmaktadır. Nodül çapının 2 cm’den büyük olması, nodülün kötü sınırlı,
düzensiz ya da spiküle konturlu olması, hava bronkogramı, kavitasyon ya da malign
tip kalsifikasyon içermesi, kontrast tutulumu göstermesi, ikilenme zamanının 30-450
gün arasında olması malignite lehinedir.
Resim 33.14: BT incelemede, sol akciğer alt lobda subplevral yerleşimli milimetrik boyutta
nodül.
425
Pnömoni görünümünde akciğer kanseri
Sıklıkla bronkoalveolar kanserde görülen bu tip tutulumda, tümörün kendisi akciğer
parankimini radyolojik olarak pnömoniye benzer şekilde infiltre edebilir. Radyolojik
olarak hava bronkogramı içerebilen, yama şeklinde, lobar ya da yaygın, bazen
belirsiz sınırlı konsolidasyon alanları izlenir (Resim 33.15 a,b). Bu görünümün
enfeksiyon nedeniyle oluşmuş pnömoniden ayrımı çok kolay olmadığından tedaviye
rağmen gerilemeyen pnömoni olgularında akciğer kanseri olasılığı düşünülmelidir.
Resim 33.15 a: Akciğer kanseri (bronkoalveolar karsinom) nedeniyle opere olan olgunun
kontrol BT incelemesinde sağ akciğer üst lobda milimetrik boyutta nodül. b: Bir yıl sonra
yapılan BT tetkikinde aynı lokalizasyonda konsolidasyon ile uyumlu görünüm. Histopatolojik
tanı: Nüks bronkoalveolar karsinom.
Lenfanjitis karsinomatoza
Akciğer kanseri sıklıkla lenfatik sistem yoluyla yayılım gösterir. Lenfanjitis
karsinomatoza pulmoner lenfatik sistemin tümör ile infiltrasyonunu gösteren bir bulgu
olup beraberinde hiler büyümüş lenf nodları ve plevral sıvı da bulunabilir. Kitleden
perifere doğru uzanan retiküler ya da retikülonodüler izlerde (pulmoner interstisyel
izler) belirginleşme saptanması tanı koydurucudur (Resim 33.6, Resim 33.16).
Pulmoner interstisyum en iyi YÇBT ile değerlendirildiğinden lenfanjitis karsinomatoza
tanısında YÇBT, BT’ye üstündür.
426
Resim 33.16: BT incelemede, sağda santral yerleşimli kitle ve kitle çevresinde lenfanjitis
karsinomatoza ile uyumlu görünüm.
Pancoast (superior sulkus) tümörü
Pancoast tümörleri akciğer apeksinden köken alırlar. En sık rastlanan radyolojik
bulgular apikal kitle, tek taraflı ya da asimetrik apikal plevral kalınlaşma ve kemik
destrüksiyonudur. Apikal kitle şeklinde izlendiklerinde brakiyal pleksus, servikotorasik
sempatik ganglion, subklavian arter ve ven ile vertebral kolon invazyonu yapabilirler
ve bunlarla ilişkili semptomlara yol açabilirler (Resim 33.17). Bu nedenle, Pancoast
tümörlerini kitle haline gelmeden önce plevral kalınlaşma aşamasında tanımak
önemlidir; radyogramlarda tek taraflı ya da asimetrik plevral kalınlaşma saptanan
olgulara tümör açısından şüpheyle yaklaşılmalıdır. Bu olgular mutlaka eski tetkikleri
ile karşılaştırılarak değerlendirilmeli ve gerekirse ileri inceleme yapılmalıdır. MRG,
tümörün toraks duvarına, brakiyal pleksusa ve vasküler yapılara invazyonunu daha
iyi gösterdiğinden, Pancoast tümörünün tanısında ve evrelemesinde BT’ye üstün
olarak kabul edilmektedir.
427
Resim 33.17: BT incelemede, sağ akciğer apeksinde Pancoast tümörü ile uyumlu
lezyon.
SONUÇ
Akciğer kanserlerinin değerlendirilmesinde görüntüleme yöntemleri kritik öneme
sahiptir. Olgular farklı radyolojik görünümlerle kendilerini belli edebileceğinden, sık
rastlanan radyolojik bulguların iyi bilinmesi olguların atlanmasını önleyecek ve uygun
şekilde değerlendirilmelerine olanak sağlayacaktır.
KAYNAKLAR
1. Osma E. Solunum sistemi radyolojisi Normal ve patolojik. 2. baskı İzmir: Güven ve
Nobel Tıp Kitabevi; 2004; 247–262.
2. Akman C. Akciğer kanserinde radyolojik bulgular. İ.Ü. Cerrahpaşa Tıp Fakültesi
Sürekli Tıp Eğitimi Etkinlikleri. Sempozyum dizisi no:58. Kasım 2007; 129–132.
3. Webb W.R, Higgins C.B. Thoracic Imaging. Lipincott Williams and Wilkins;
2005;75–84.
4. Mohammed TLH, White CS, Pugatch RD. The imaging manifestations of lung
cancer. Semin Roentgenol. 2005; 40: 98–108.
5. Karabulut N. Soliter pulmoner nodulun modern radyolojik değerlendirmesi. 27.
Ulusal Radyoloji Kongresi Kurs Kitabı. 2006; 131–136.
6. Laurent F, Montaudon M, Corneloup O. CT and MRI of lung cancer. Respiration
2006; 73(2): 133–142.
428
7. Park CM, Goo JM, Lee HJ, Kim MA, Lee CH, Kang MJ. Tumors in the
tracheabronchial tree: CT and FDG PET features. Radiographics 2009 JanFeb;29(1): 55–71.
8. Kostakoglu L, Agress H Jr, Goldsmith SJ. Clinical role of FDG-PET in evaluation of
cancer patients. Radiographics 2003 Mar-Apr;23(2): 315–340.
9. Bruzzi JF, Komaki R, Walsh GL ve ark. Imaging of non-small cell lung cancer of
the superior sulcus: Part 1: anatomy, clinical manifestation, and management.
Radiographics 2008 Mar-Apr;28(2): 551–560.
10. Bruzzi JF, Komaki R, Walsh GL ve ark. Imaging of non-small cell lung cancer of
the superior sulcus: Part 2: initial staging and asessment of resectability and
therapeutic response. Radiographics 2008 Mar-Apr;28(2): 561–572.
429
34.
Yrd. Doç. Dr. Ufuk Çobanoğlu
Yüzüncü yıl Üniversitesi Tıp Fakültesi Göğüs Cerrahisi AD
KONJENİTAL AKCİĞER ANOMALİLERİ
Konjenital akciğer hastalıkları, basit bir bronşial fazlalıktan bir akciğerin tamamının
olmamasına kadar, geniş bir spektrumda yer alır (1,2).
Bu anomalilerin etyolojisinde, esas rolü genetik faktörler oynarken bazılarında
akciğerin gelişimi sırasındaki embriyonel aşamalardaki duraklamalar veya aşırı
proliferasyonlar etkendir (1,2).
Embriyoloji
Doğum öncesi dönem
Embriyonik dönem (26.gün-32.gün)
İntrauterin hayatın 4. haftasında primitif tübün ön kesesi veya düvertikülünden
gelişmeye başlar. 5. haftasının sonunda trakea, ana bronşlar ve lob bronşları ortaya
çıkmıştır (3). Bu dönem içerisinde meydana gelen duraklamalar veya etkileşimler
sonucu trakeal atrezi, bronşiyal atreziler, bronkus veya trakeal divertikül oluşur (1, 3).
Psödoglandüler dönem ( 5-16. hafta)
Bu dönem tüm hava yollarının hızlı dallanması ve şekillenmesi ile karakterizedir.
Gelişim çok hızlı olup 34-36. günler arasında segmenter bronşlar, 38-40. günlerde
arasında subsegmenter bronşlar ortaya çıkmıştır (3,4). Bu dönemde gelişimin
duraklaması sonucu konjenital kistik adenomatöz malformasyon (KKAM) meydana
gelir (1, 4).
Kanaliküler dönem ( 16-25. hafta)
Asinüsler öncesi hava yolları, yani terminal bronşiollerde dahil olmak üzere dallanma
17. hafta sonunda tamamlanmıştır. Bu arada respiratuar bronşiollere komşu akciğer
dokusunda kapiller seviyeye kadar vaskülarizasyonda tamamlanır (3,4).
Terminal kese dönemi ( 25-40. hafta)
28. gebelik haftasında respiratuar bronşioller değişik sayıda saklar ve keseler içeren
transisyonel kanallara açılmıştır. Erişkin hayatta primer lobun içinde kalan bu kanallar
duktus alveolaris adını alır. Bu devrede tüm asiner yol yassı epitel ile kaplanır ve gaz
değişimine izin veren kan-gaz bariyeri oluşur (3,4). Terminal kese dönemi sakküler
proliferasyonun
ve
progressif
vaskülarizasyonun
430
olduğu
bir
dönemdir.
Bu
proliferasyonun aşırı olması ve vaskülarizasyonun olmaması sonucunda konjenital
lober amfizem (KLA) meydana gelir (1).
Doğum sonrası dönem
Doğumda respiratuar bronşioller üç jenerasyonu, transisyonel kanallardan birisi ve üç
sakkülüs şekillenmiştir. Ancak alveoller gerçek şeklinde değil sakkülüs duvarında
yüzlek çıkıntılar şeklindedir. Doğumla birlikte alveol sayısı hızla arttığı gibi alveoller
gerçek şeklini alır, asinüslerde büyür. Erken postnatal dönemde 24 milyon alveol
vardır. Sekiz yaşına kadar bunların sayısı giderek artar ve 300 milyona ulaşır.
Yetişkin döneme kadar alveol genişlemesi devam ederken, alveol sayısında artış
olmaz (3,4).
Trakeobronşiyal Anomaliler
Trakeal Agenezi ve Atrezi
İlk kez 1900 yılında Payne tarafından tanımlanmıştır (1). Trakeanın embriyonel fazda
gelişememesinden (agenezi) veya hatalı (atrezi) gelişmesinde kaynaklanır. Floyd ve
arkadaşları (5) bu anomaliyi üç tipe ayırmışlardır (Resim 34.1).
Resim 34.1: Floyd’a göre Trekeal Agenezi Tipleri
Tip-I: Olguların %10’nu bu tiptedir. Trakeanın parsiyel atrezisi söz konusu
olup, trakea kısa ancak normaldir ve özofagusun anterior duvarından çıkar.
Tip-II: %59 oranında görülür. Trakeanın total agenezisi söz konusudur. Karina,
bifurkasyon ve bronşlar normaldir. Karina özofagus ile iştiraktedir.
Tip-III: Bu tip %31 oranında görülür. Trakea tümüyle agenetik olup bronşlar
özofagustan çıkarlar.
Trakeal agenezili bebeklerde maternal polihidroamniyoz ve prematürite vardır. Bu
bebekler doğduklarında bir çığlık sesi duyulur, sonra ağlamaları beklenirken
progressif siyanoz ve bradikardi gelişir ve arest olurlar (1,6). Acil entübe edilmeye
431
çalışırken laringoskopide vokal kordlar normaldir ancak endotrakeal tüp ilerletilemez
ve bebekler kaybedilir (1,5,6). Özofagusun entübasyonu hayat kurtarıcı olabilir.
Bu olguların %90’ında diğer konjenital anomaliler eşlik eder (6). Trakeal agenezi
VACTERL (vertebral, anal, cardiac, tracheal, renal ve limb) konjenital anomalileri
veya kompleks kongenital kalp defektleriyle birlikte olabilir (7).
Tedavilerinde özofageal entübasyonu takiben distal özofagus ekskülüzyon yapılıp,
beslenmenin gastrostomi ya da feeding jejunostomi ile sağlanması gerekir. Daha
sonra proksimalde yapılacak bir özofago-gastrostomi ile pasajın devamlılığı
sağlanabilir (1).
Trakeomalazi
Normalde infantlarda trakeal kartilaj yumuşaktır ve bu nedenle ekspirasyon sırasında
trakea dışındaki basınç trakea içindeki basıncı aştığında belli bir dereceye kadar
dinamik
kollaps
görülür.
Trakeomalazide
obstrüksiyonuna yol açar (8,9).
ise
dinamik
kollaps
hava
yolu
Çünkü trakeomalazide, kıkırdak dokunun yapısı
bozulduğu için trakeanın ihtiyacı olan elastik rijidite kaybolmuştur ( 2).
Primer trakeomalazi trakeal kartilajın konjenital immatüritesine bağlı gelişirken,
sekonder trakeomalazi normal kartilaj yapısının dejenerasyonuna bağlı olarak
meydana gelir (8) (Resim 34.2). Konjenital tipteki trakeomalazi vasküler ring veya
trakeoözofageal fistül gibi diğer gelişimsel defektlerle birlikte olabilir (8,9).
Semptomlar doğumdan hemen sonra başlayabilir ya da 3-4 ay içerisinde belirginleşir.
Beslenmeyi takiben gelişen apne, havlar tarzda öksürük, sık tekrarlayan pnömoniler
görülür (2).
Resim 34.2: Trakeomalazi
432
Tanısı radyolojik ve endoskopik olarak konulabilir (Resim 34.3). Bronkoskopide
trakeal lümenin enine doğru geliştiği, solunum hareketleri sırasında “kılıç kını” şeklini
aldığı görülür. Ayrıca spiral tomografi ve MRI’de tanıda kullanılır.
Tedavisinde konservatif yöntemler uygulanabilir. Trekeomalazi hastanın büyümesi ve
2 yaşından sonra trakeanın daha sağlam bir hal alması ile düzelebilir. Siyanotik
bayılmalar ve apneler ise kesin cerrahi endikasyonudur. Cerrahi tedavide malazik
ksımların çıkarılması ve uç-uca anastomoz esastır. Son yıllarda yenidoğan
döneminde de rahatlıkla uygulanabilen intraluminal stentler kullanılmaktadır. Metalik
stentlerin çıkarılmasındaki zorluklar ve hastanın büyüme ve gelişmesi göz önüne
alındığında intraluminal absorbe olan stentler [Vicryl (polyglactin 910)] geliştirilmiştir
(2,9).
Resim 34.3: Trakeomalazili hastanın lateral grafisi ( Özofagus önünde malazik trakea)
Trakeal Stenoz
Trakeanın konjenital stenozu 3 şekilde tarif edilmiştir; I) Generalize hipoplazi, II) Huni
şeklinde daralma, III) Segmental stenoz (Resim 34.4). Generalize tip, olguların
%30’unu oluşturur ve krikoid kıkırdağın 1 veya 2 halka altından başlayarak karinaya
kadar uzanır. Huni şeklinde stenoz olguların %20’sini oluşturur ve trakea normal çap
ile başlayıp, huni şeklinde bir daralma göstermektedir. Segmenter tip en sık görülen
(%50) stenoz tipidir (10,11).
433
Resim 34.4: Trakeal stenoz tipleri
Resim 34.5: Trakeal stenoz (Servikal lateral grafi)
Enstrümantasyon hava yolunun durumunu tehlikeye atabildiği için radyografi daha
önceden bize stenoz hakkında bilgi verebilir (Resim 34.5) (11). Eğer düz filmlerde
stenotik bölge görülmezse, konvensiyonel tomografi, bilgisayarlı tomografi (BT) ve
MRI yapılabilir. Eğer anatomi detaylı incelenecekse kontrast bronkografi yapılır.
Mansfield’e göre, bronkoskopi hipoksik arreste neden olduğundan yapılması
önerilmez. Bronkoskopi entübe, paralize ve ventile edilen olguda yapılabilir ve
stenozun
değerlendirilmesi,
yani
seviyesi,
trakeal
sekresyonların olup olmamasına sınırlı kalmalıdır (12).
434
duvarın
kompliyansı
ve
Bu lezyonların tedavisinde 1980 yılına kadar daha çok konservatif yaklaşılmış, ancak
hastaların %60’ı kaybedilmiştir (1). Bu yıldan sonra trakea cerrahisindeki gelişmeler
bu lezyonların başarı ile tedavi edilebilmesini sağlamıştır. Bu tür lezyonların
tedavisinde dilatasyon, T-tüp, stent, ablasyon, rezeksiyon ve graft implantasyonu gibi
teknikler kullanılır. Kısa segment stenozlarında ( 5 halkadan az) rezeksiyon ve uç-uca
anastomoz yapılırken, daha uzun segment stenozlarında trakeoplasti teknikleri
kullanılır. Bu tekniklerde; kostal kartilaj, özofagus ön duvarı, perikardiyal yama, dura,
tantalyum mesh, cilt, perikard ve stent gibi elemanlardan yararlanılır (1).
Trakeal Bronkus ve Divertikül
Trakeal tomurcuklanma anomalileri embriyonal hayatın 26. gününde, trakeal
bifurkasyonun gelişimi sırasında ortaya çıkar (13).
Trakeal bronkus, trakeadan çıkan ve kendisine ait bir lobu olan veya pulmoner
parankim içerisinde sonlanan bir bronştur (Resim 34.6). Trakeal divertikül ise
trakeanın servikal veya torakal kısmından köken alan kör bir poş şeklinde yada
rudimenter bir akciğerle sonlanan bir yapıdır (Resim 34.7) (1,2).
Trakeal bronkus daima sağ tarafta olur ve sıklıkla karinanın 2 cm yakınından çıkar.
Bazen intermedier bronşun medial kısmından çıkar ve “aksesuar kardiyak bronkus”
adını alır.
Bu anomali hayat boyunca hiçbir semptom vermeden kalabilir. Semptomlar trakeal
bronkusta stenoz mevcutsa bronşun distalindeki parankimde yeterince drenaj
sağlanmamasına bağlı gelişir.
Tanısı bronkoskopi, bronkografi ve CT ile konulur. Başka konjenital anomaliler
(Down sendromu, trakeal stenoz, hipoplastik veya kaynamış 1. ve 2. kosta, bilateral
lumbal kotsalar gibi) ile birlikteliği sıktır.
435
Resim 34.7: Trakeal divertikül
Resim 34.6: Trakeal bronkus
(Servikal MRI)
Semptomatik olmayan hastalarda tedavi gerekmez. Sık enfeksiyon ve bronşektazi
gelişen olgularda rezeksiyon uygulanır. İleri yaşlarda trakeal bronkus içerisinde
“karsinoid tümör “ gelişen vakalar rapor edilmiştir.
Trakeal divertikülde aynı şekilde teşhis edilir. Sık enfeksiyon, perforasyon ve
zemininde malignite gelişme riski olduğu için tanı konulduğunda cerrahi olarak
çıkarılmalıdır (1,2).
Bronşial Atrezi
Bronş atrezisi, bronşial ağacın nadir bir anomalisidir. Etkilenen bronş atreziktir ve santral
havayolları ile bağlantısı kesilmiştir; ancak distalindeki akciğer gelişimi normaldir.
Erkeklerde daha sık görülen bu anomali çoğunlukla segmental bronşları etkiler (1,2).
Sol üst lobda %64, sol alt lobda %14, sağ orta ve alt lobda %8 oranında izlenir ( 15).
Olguların büyük bir çoğunluğu asemptomatik olduğu için insidansı bilinmemekte ve
raslantısal olarak tespit edilmektedir. Semptomatik olanlarda ise sık enfeksiyon ve
öksürük yakınmaları vardır. Erken çocukluk döneminde, hiperinfle segment veya lobun
basısı nedeniyle solunum sıkıntısı görülebilir (16).
Bronş atrezisinin oluşumunda öne sürülen teoriye göre bronşial ağacın gelişimi
tamamlandıktan (16.hafta) sonra bronşial arterin bir dalında tıkanma sonucu, bu
damarın beslediği segmentte nekroz ve daha sonra fibrozis gelişir. Etkilenen
segment atreziye uğrar ve proksimalle bağlantısı kesilir. Distal bronşial ağaç
normaldir ve mukus sekresyonu devam eder (16). Sekresyonun dışarı ile bağlantısı
olmadığı için doğumdan ikinci-üçüncü dekata kadar bronş içinde mukus b irikir
(mukosel; bronkosel) (15,16). Bronştaki kesintinin distalinde kalan akciğer, Lambert
436
kanalları ve Kohn porları aracılığıyla havalanmasını sağlar. Buraya giren havanın
tekrar dışarı çıkamaması hava birikimine neden olur ve hiperinflasyon izlenir (15,16)
(Resim 34.8).
Bronş atrezisi eğer çocukluk döneminde saptanırsa, çevredeki akciğerin normal
gelişimini tamamlaması için ameliyat önerilir, yetişkinlerde ise ameliyat semptomatik
olgularda tercih edilir (16). Etkilenen lobda dönüşü olmayan hiperinflasyon olduğu
için olgulara segmentektomiden çok lobektomi yapılır.
Bronkojenik Kistler
Bronkojenik
kist,
ağacın
trakeobronşial
gelişimi
sırasında
anormal
tomurcuklanmasıyla oluşur. Bu tomurcuğun trakeobronşial ağaçla bağlantısı kesilirse
içerisinde biriken sekresyon nedeniyle genişlemeye devam eder ve kist oluşur.
Resim 34.8: Bronşial atreziye bağlı sağ üst lobta havalanması artmış segment (Toraks BT)
Bağlantısı kesilmezse solunumla birlikte içine hava girer; aynı zamanda genişlemesi
de sürer (17). Kistlerin duvarı solunum sistemi epiteliyle döşelidir. Duvarında kıkırdak,
bronş bezleri ve düz kaslar bulunabilir.
Sekretuar hücreler nedeniyle mukoid bir
materyalle doludur (17,18).
Erken embriyolojik dönemde gelişenler mediastende yerleşirler ve daha çok trakea
boyunca ve karina çevresinde yer alırlar. Daha geç embriyolojik dönemde, bronşların
dallanma sürecinde gelişenler ise akciğer parenkimi içinde yer alır ve daha sıklıkla
437
bronşiyal sistemle bağlantıları mevcuttur. Bronkojenik kistlerin daha sıklıkla akciğer
parenkim içinde yerleştiği kabul edilmekle birlikte, bazı yayınlarda mediastinal
yerleşimin daha sık görüldüğü bildirilmiştir (19).
Bronkojenik kistler herhangi bir yaşta görülebilir. Ancak hastaların çoğunluğunu 30
yaş civarı yetişkinler oluşturur (20,21). Yenidoğan ve çocuklarda daha çok çevre
yapılarda oluşturduğu bası bulgularıyla ortaya çıkar. Bası sonucu beslenme ve
solunum güçlüğüne ya da hava yollarında sübaplı tıkanmaya yol açabilir (20,21).
Yetişkinlerde de bası bulguları yanında, hemoptizi veya enfeksiyona bağlı
yakınmalarla ortaya çıkabilir. Mediastinal yerleşimli kistin enfekte olması ve plevra,
perikard ya da bronşa açılması oldukça nadirdir.
Göğüs grafilerinde mediastinal kistler,
düzgün konturlu, keskin sınırlı, homojen
yoğunlukta kitleler olarak izlenir (Resim 34.9) (20,21). Boyutları 2-5 cm arasında
değişebilir. Tipik olarak, sağ paratrakeal veya subkarinal bölgeye yerleşirler (20,21).
Parankimde yerleşenler ise bronşla bağlantılarının açık olup olmamasına göre
radyolojik bulgu oluştururlar (Resim 34.10). Bronşla bağlantısı olmayan kistler
homojen içerikli, yuvarlak, düzgün kenarlı kitleler, bronşla bağlantılı olanlar ise
tamamen hava dolu, ince duvarlı kistler şeklinde izlenir (1,2,20,21). Bazen kistlerin
içinde hava-sıvı seviyesi görülür (1,2,21). BT’de oval veya yuvarlak, düzgün sınırlı, su
veya yumuşak doku yoğunluğunda, homojen lezyonlar olarak izlenirler.
Bronkojenik kistlerin nadir de olsa bildirilen bir diğer komplikasyonu malignite gelişme
riskidir (22). Parenkim içinde yerleşen bronkojenik kistlere bu nedenle anatomik
rezekiyon yapılmalıdır (22). Segmental rezeksiyon, uygun vakalarda lobektomiye
alternatif olabilir. Mediastinal yerleşen kistlerin, kist duvarıyla birlikte bütünüyle
eksizyonu mümkündür.
Resim 34.9: Mediastinal yerleşimli
Bronkojenik Kist
Resim 34.10: İntrapulmoner yerleşimli
Bronkojenik Kist
438
Pulmoner Anomaliler
Pulmoner Agenezi-Aplazi-Hipoplazi
Pulmoner gelişimsel anomaliler 3 grupta kategorize edilmektedir (23, 24).
Grup 1: Akciğer, bronş ve pulmoner arter/ven komplet yokluğu (Agenezi)
(Resim 34.11)
Grup 2: Akciğer dokusu olmadan rudimenter bronş (Aplazi) (Resim 34.12)
Grup 3: Değişik derecelerde akciğer parankimi ile birlikte hipoplazik bronş
(Hipoplazi) (Resim 34.13).
Resim 34.11: Pulmoner agenezi
Resim 34.12: Pulmoner aplazi
Resim 34.13: Pulmoner hipoplazi
Komplikasyonsuz bir agenezi hali, belirti vermeden erişkin yaşlara kadar farkına
varılmıyabilir veya hafif şikayetler meydana gelebilir (1,2). Sol akciğer agenezisi sağ
tarafa göre daha sık görülmektedir (1,2,25). Ortalama yaşam süresinin sağ taraf
agenezileri için 6 yıl, sol taraf agenezileri için 16 yıl olduğu bildirilmiştir (12).
Akciğer agenezileri özofagus atrezisi,
trakeoözefagial fistül, iskelet anomalileri,
patent duktus arteriozus, damar anomalileri, konjenital diyafragma hernisi ve
dekstrokardi gibi akciğer dışı anomaliler ile birlikte sık görülür (12,25).
Etyolojisi hala bilinmemekle birlikte deneysel çalışmalar vitamin A, folik asit eksikliği
ve salisilatların pulmoner ageneziyi geliştirdiğini göstermektedir. İkiz çalışmalarında
da pulmoner agenezin görülmesi genetik orijini veya simultane fetal vasküler
hadiseleri düşündürmekte olup bir olguda 2. kromozomun kısa kolunda anormallik
bildirilmiştir (1,2,12,25).
Akciğer agenezi’li olgular akciğer dışı anomaliler olmadığı durumlarda tekrarlayan
enfeksiyonlardan şikayetçi olurlar.
Kardiak ve vasküler defektler olduğunda veya
439
tekrarlayan hemoptizi veya pnömonide akciğer rezeksiyonu ve eşlik eden anomalileri
düzeltme operasyonu yapılır.
Aplazi de bronş ya yoktur ya da rudimenter güdük şeklinde kalmıştır. Bu güdük
sekresyonların burada birikmesi nedeniyle infeksiyon kaynağı olup diğer akciğere de
yayılmasına neden olur. Tek taraflı aplazide kalan akciğer normalin iki katı alveol
içerir ancak bronşları normaldir (23, 24).
Aplazik hastalar genellikle asemptomatiktir, klinik bulgular eşlik eden pulmoner
anomaliler ve konjenital malformasyonların (özellikle böbrek, diyafragma ve göğüs
duvarı) derecesine bağlı olarak değişir. Bazı olgularda vital kapasitede belirgin
azalma ve egzersiz intoleransı görülür. Erişkinlerde kronik solunum yetmezliği ve
buna bağlı olarak respiratuar infeksiyonlar gelişebilir (23,25).
Hipoplazide ise akciğer küçük fakat normal yapıdadır. Alveollerin sayısı ya da boyutu
azalmıştır. Hipoplazi; kan damarlarının anomalisi (Scimitar sendromu), akciğere
göğüs içi kitlelerin basısı (herniasyonlar), toraks deformiteleri, nöromusküler
anormallikler, oligohidroamniöz gibi nedenler sonucunda gelişebilir (23, 24). Hipoplazi
ve aplazi sıklıkla başka malformasyonlarla (diyafragma defekti, böbrek anomalileri,
ekstrapulmoner sekestrasyon, kas iskelet sistemi bozuklukları) birlikte görülür (24).
Hastaların yaklaşık 1/3’ünde konjenital kalp hastalıkları bulunur. En sık atrial septal
defekt görülürken ventriküler septal defekt, patent duktus arteriyozus ve aorta
koarktasyonu da görülebilir (1,23).
Pulmoner Sekestrasyonlar
Pulmoner sekestrasyon nadir görülen bir konjenital malformasyondur. Genel nüfusta
beklenen
insidans›
intrapulmoner
%2’nin
sekestrasyonlar
altındadır.
(İS)
Pulmoner
(Resim
34.14),
sekestrasyonlar (ES) oluşturur (Resim 34.15) ( 2,27,28).
440
sekestrasyonların
%25’ini
%75’ini
ekstrapulmoner
Resim 34.14: İntrapulmoner sekestrasyon
Resim 34.15: Ekstrapulmoner sekestrasyon
İntrapulmoner sekestrasyon, viseral plevra ile çevrili, parankim içinde işlevsiz akciğer
dokusudur. Damarlanmasının %70’i desenden torasik aortadan veya abdominal
aortadan çıkan bir dal aracılığı ile olur. Anormal arterleri genellikle akciğere pulmoner
ligamentten girer. Venöz drenajı pulmoner venlere olur ve soldan sağa şant
gelişir buna bağlı hastalar konjestif kalp yetmezliğine girer. Sırtta pansistolik
üfürüm duyulur. Kitle kistiktir, içi mukus veya püy doludur. Normalde bronş ile ilişkisi
olmamasına rağmen infekte olduklarında ya da içine kanama olduğunda parankimi
nekroza uğratıp en yakın bronşa açılırlar. İntrapulmoner sekestrasyonlar en sık (%60)
akciğer alt loblarında lokalize olurlar (2,27).
Ekstrapulmoner sekestrasyon ise akciğerden ayrı, üzeri viseral plevra ile örtülü sanki
aksesuvar lob gibi bir oluşumdur. Olguların %90’ı sol tarafta diyafragma ile
komşudur. Genellikle arka kostafrenik sulkusta bulunur. Venöz drenajı azigos,
hemiazigos ve portal venlere olur. Sistemik arteri çoğunlukla abdominal aortadan
çıkar. İnfekte olmadığı sürece asemptomatiktir. Tanı diğer diyagnostik işlemler
esnasında veya cerrahi esnasında tesadüfen konabilir.
İnferior lokalizasyonlu
olanlar %20 oranında konjenital diyafragma hernisi ile birliktedir (Tablo 34.1)
(2,27).
441
Tablo 34.1: İntrapulmoner ve ekstrapulmoner sekertrasyonların özellikleri
Cinsiyet
Yaş
Yerleşim yeri
Ayrı plevra
Arteriyel kanlanma
Venöz drenaj
Diğer anomaliler
Semptomlar
Radyoloji
Patoloji
İntrapulmoner sekestrasyon
Ekstrapulmoner sekestrasyon
Kadın/Erkek=1
Ergen, genç erişkin
Sol
Yok
Torasik/abdominal aorta
Pulmoner ven
Nadir
Öksürük, ateş
Alt lob apseleri
Abse kavitesi
>Erkek
Yenidoğan
Sol
Var
Torasik/abdominal aorta
Azigos/hemiazigos
Sık
Solunum sıkıntısı
Üçgen kitle lezyon
Süngerimsi, kistik
Anjiyografi ile kesin tanı konulabilmesine rağmen, çoğu zaman ultrasonografi ve
BT’de lezyon doğru olarak tanımlanabilir. Manyetik rezonans görüntüleme (MR), MR
anjiyografi de noninvaziv tanı yöntemleri olarak kullanılabilmektedir (26-29). Standart
göğüs grafilerinde alt loblarda izlenen lezyonlar, bronkojenik kist, bronşektazi,
akciğer apsesi, kaviter akciğer hastalığı, pnömoni, Bochdalek hernisi ve pulmoner
neoplazmlarla karışabilir (26-29).
Bronkoskopi ve bronkografinin tanısal yararı oldukça azdır. Bronkografide kullanılan
opak madde genelde patolojik bölgeye girmez. Bronkoskopide ise normal bronş
ağacı ile bağlantısı olmadığından tanı koydurmaz ancak ayırıcı tanıda diğer
patolojileri ekarte etmede faydalıdır (27,28).
Sekestrasyonlu olgularda klinik olarak bronşektazi tablosu vardır. Sıkça tekrarlayan
alt
lob
pnömonisi
veya
kronik
akciğer
apsesi
olgularında
intrapulmoner
sekestrasyondan şüphenilmelidir. Semptomatik olan İS olgularıda genelde pulmoner
infeksiyon bulguları mevcut olup en sık ateş yüksekliği, pürülan balgam, öksürük, sık
tekrarlayan infeksiyonlar ve hemoptizi görülmektedir (2,27-29).
Sekestrasyonların kesin tedavisi cerrahi rezeksiyondur. Olgular asemptomatik olsa
da hastayı sık infeksiyon, hemorajik komplikasyonlar ve malignite gelişme riskinden
korumak için elektif şartlarda operasyon önerilmektedir (2,30).
Cerrahi
tedavideki
çıkarılmasıdır.Ancak
temel
bildirilen
esas
sekestrasyonun
serilerde
çoğunlukla
bulunduğu
lobektomi
segmentin
yapıldığı
göze
çapmaktadır (2,27). ES dokusu plevra ile tamamen sarılı olduğundan rezeksiyon
işlemi
daha
kolaydır. İS’nin tedavisi sekestrasyonun segmental rezeksiyonudur,
442
ancak infeksiyona bağlı değişiklikler çoğu kez lobektomiyi zorunlu kılar. Çoğunlukla
aorta gibi önemli bir damardan köken aldığından bu aberan arterlerin diseksiyonu
dikkatli yapılmalıdır.
Konjenital Lober Amfizem
Konjenital lober amfizem (KLA), akciğerin bir lobunda hiperekspansiyon, kalan
akciğerde kompresyon, mediastenin karşı tarafa kayması ve bazen de ön
mediastenden karşı tarafa hemiasyonla karekterizedir (Resim 34.16).
Resim 34.16: Konjenital lober amfizem
Hastaların %50’sinde bronşiyal bir anomali gösterilemezken, %2’sinde vasküler
halka, hilar adenopati veya bronkojenik kist gibi ekstrensek bası yapan nedenler,
%48’inde ise intraluminal bronşiyal obstrüksiyon görülmektedir (1,2,31,32). Anormal
mukozal katlantılar, bronşiyal stenoz, bronkomalazi, bronş kıkırdağının olmaması,
hipoplastik, flask ya da immatür olması, KLA’ye yol açan diğer anomalilerdir (31).
Olguların % 15'ine patent duktus arteriozus, ventriküler septal defekt ve fallot
tetralojisi gibi konjenital kalp hastalıkları da eşlik edebilir (1,2,31).
Konjenital lober amfizem en çok sol akciğer üst lobda görülür (%43), bunu takiben
sağ akciğer orta lob ve üst lobda görülmektedir. Nadiren bilateraldir (31,32).
Etkilenmiş lobun fazla havalanması, etraftaki akciğer dokusuna basısı ve mediastenin
karşı tarafa yer değiitirmesi akciğer grafi bulgularıdır (Resim 34.17). KLA olan
hastalar, genellikle yenidoğan döneminde ilerleyici, ağır solunum sıkıntısı şeklinde
kliniğe başvururlar. Daha büyük çocuklarda da hışıltılı öksürük veya tekrar eden
akciğer infeksiyonları görülür. Hastalığın bulguları ne kadar erken ortaya çıkarsa
semptomları daha ağır olmaktadır (32). Erişkin çağda tanı konulan KLA vakalarında
443
ise solunum sistemi bulguları daha hafiftir ve hastalar başka bir nedenle çekilen
akciğer grafileri ile tesadüfen tanı alabilirler (1,2,32).
Resim 34.17: Sol üst lobta konjenital lober amfizeme bağlı mediastinal itilme
Tanıda bronkoskopi ve bronkografi genellikle gereksizdir ve hatta morbidite ve
mortaliteyi
artırabilir.
Ayırıcı
tanıda
bronkoskopi,
obstrüktif
amfizeme
veya
atelektaziye bağlı kompansatris amfizeme sebep olabilecek endobronşial yabancı
cisim ayırımında yardımcı olabilir. Ancak, bronkoskopi, ameliyathanede, dikkatli ve
hızlı bir şekilde ve acil torakotomi yapılabilecek şartlar altında yapılmalıdır (31).
Ağır semptomları olan KLA hastalarında tedavi genellikle lobektomidir. Özellikle ağır
solunum sıkıntısı olan yenidoğan ve bebeklerde acil torakotomi hayat kurtarıcı
olabilir. Daha hafif semptomu olan daha büyük çocuklar, cerrahi olarak tedavi
edilmeden konservatif tedavi ile izlenebilmektedirler (32). Lobektomi yapılan
hastaların uzun süreli izlemlerinde kompensatuar akciğer gelişimi olduğu görülmüştür
(33). Diğer çalışmalarda ise fonksiyonel rezidüel hacimde artış, total akciğer
kapasitesinde artış ve midekspiratuar akım hızlarında azalma gibi bazı bozukluklar
saptanmıştır (1,2,33). Solunum fonksiyon testlerindeki bozukluklara rağmen cerrahi
olarak tedavi edilen birçok hasta asemptomatiktir (1,2,32).
Konjenital Pulmoner Kistler
Konjenital pulmoner kistler, akciğerin gelişim bozukluğu sonucu ortaya çıkarlar ve
pulmoner parenkim içerisinde yer alırlar. Kist duvarı alveol epitelyumu veya mukus
salgılayan yalancı çok sıralı silyalı silindirik epitelyumla döşenmiştir. Kist cidarında
düz kas, fibröz doku ve kıkırdak elamanları bulunabilir (1,2) Tek veya multipl
olabilirler. Multipl kistler nadiren konjenital olup büyük olasılıkla edinseldir ve genelde
444
stafilokoksik pnömoniye veya kistik fibrozise sekonder gelişirler (1,2). Sıklıkla alt
loblarda bulunur. Doğumdan itibaren varolan bu kistlerin spontan kaybolma ihtimali
vardır, ancak 1 yıldan daha fazla devam eden kistlerde bu ihtimal azalır.
Bu kistler ekspansiyon ile solunum sıkıntısı yaparken, enfekte olduklarında ateş,
öksürük ve sepsise yol açarlar.
Tedavisinde; enfekte kistlerde öncelikle antibiyoterapi uyugulanır. Operasyon
enfeksiyonsuz periyotta tercih edilir (1,2). Soliter konjenital kistler kistektomi veya
gerekiyorsa lobektomi ile tedavi edilirler. Multipl kistler altta yatan hastalığa göre
tedavi edilmelidir. Normal akciğere bası ile solunum fonksiyonunu bozan büyük çaplı
kistlerde acil lobektomi gerekebilir. İntrauterin mediastinal şift yapan pulmoner
kistlerde fetal torasentez ile kistin dekompresyonu yapılabilir (1,2).
Konjenital Kistik Adenomatoid Malformasyon (KKAM)
Kistik adenomatoid malformasyon, terminal respiratuar bronşiollerin aşırı büyümesine
bağlı oluşan bir akciğer gelişim anomalisidir (35).
Konjenital kistik adenomatoid malformasyon, değişen hacimlerde olan ve birbirleri ile
anastomozlar gösteren
prolifere terminal bronşioller ve kistler ile karakterli
disembriyogenetik bir lezyondur (Resim 34.18 ve 34.19) (36,37).
Hastalık %18 oranında başlıca renal ve kardiyak olmak üzere çeşitli konjenital
anomalilerle birlikte görülebilir (37-39). Olguların büyük çoğunluğu (%90) hayatın ilk
iki yılı içinde tespit edilir (40,41).
Resim 34. 18: Sağ akciğerde konjenital kistik adenomatoid malformasyon (Toraks BT)
445
Resim 34.19: Konjenital kistik adenomatoid malformasyon ( Makroskopik kesit)
KKAM genellikle ünilateral olup tek bir lobla sınırlıdır. Tek lobun tutulma riski %95
iken, bilateral olarak görülme sıklığı %2’dir (2). Stocker ve arkadaşları tarafından
1977’de klinik, makroskobik ve mikroskobik ölçütler doğrultusunda 3 alt gruba
ayrılmıştır (42).
Tip I formu % 50 oranında görülür. tek veya çok sayıda 2,5 cm den büyük kistlerden
oluşur. Kistler silyalı stratifiye silendirik epitelle döşeli olup duvarlarında bol miktarda
düz kas ve elastik lif içerirler. Kistler arasında normal parankim yapısı mevcut olabilir.
En sık bu tip görülür ve sadece erişkinlerde bildirilmiştir. Nefes darlığı geç dönemde
ortaya çıkar ve prognozu oldukça iyidir (31,35-39).
Tip II formuna
%40 oranında rastlanır. Genellikle tek katlı silyalı küboidal epitel ile
döşeli olmakla birlikte seyrek olarak silyalı stratifıye silendirik epitel ile döşeli
olabilirler. Kist duvarı muköz hücreler veya kartilajinöz yapıları barındırmaz. Kistler 12 cm büyüklüğündedir. Sıklıkla diğer bazı konjenital anomalilerle (renal agenesis,
konjenital diafragma hernisi ve santral sinir sistemi anomalileri gibi) birlikte bulunur.
Prognozları Tip I’den daha kötüdür. Solunum sıkıntısı yaşamın ilk günlerinde başlar
ve sıklıkla fatal seyreder (1,31,35-39).
Tip III formu ise %10 oranında bildirilmiştir. Prolifere bronşiol benzeri nonkistik
yapılardan oluşur ve silyasız küboidal epitel ile döşelidirler. Kistler 0,5 cm den
küçüktür. Elastik lif ve düz kas lifleri içermezler. Prognozları belirgin olarak kötüdür.
Mediastinal şifte neden olan büyük bir kitle etkisi gösterirler. Polihidramnios,
anazarka tarzında ödem ve fetal asit mevcuttur. Bu grupta görülen mediastinal şiftin
nedeni doğumu takibeden ilk saatlerde kistlerin hava ile dolarak kitle etkisi
göstermesidir. Hava ile dolu kistler barsak ansları ile karışır ve konjenital diafragma
hernisi ile ayrımı yapılmalıdır (43,44).
446
Bildirilen çocukluk ve genç erişkin çağındaki olguların yaklaşık yarısı ateş ve pnömoni
semptomları ile başvurmuştur. Pnömoni tedavisini takiben radyolojik iyileşmenin
olmaması önemlidir.
KKAM'da rekürren akciğer enfeksiyonu önemli bir bulgudur
(31,45).
KKAM’nin tedavisi tanı zamanına göre değişmektedir. Prenatal tanı konan olgular
seri USG’ler ile takip edilerek doğum beklenir. Takip anında fetusun ve annenin
hayatını tehdit edecek bir durum geliştiğinde fetal cerrahi uygulanır (45). Kistik
akciğer lezyonları asemptomatik kalabileceği gibi bazen de rezorbe olabilirler. Eğer
lezyon neonatal dönemde solunum sıkıntısına sebep olmuşsa acilen cerrahi
uygulanmalıdır. Ancak daha geç başvuran ve asemptomatik olan olgularda kesin
olarak tanı koymak, ileride gelişebilecek rekürren infeksiyonları önlemek ve malignite
riskini bertaraf etmek için önerilen tedavi cerrahidir (39,40). Cerrahide seçilecek
tedavi lobektomi olup, multilober tutulum mevcutsa parankim koruyucu metodlar
tercih edilebilir (35-39).
KAYNAKLAR
1) Kaptanoğlu M.Konjenital Akciğer Hastalıkları. In Yüksel M, Kaptanoğlu M. eds.
Pediatrik Göğüs Cerrahisi; 1. st ed. İstanbul: Turgut Yayıncılık; 200. p.165–96.
2). Yüksel M, Kalaycı G. Konjenital akciğer hastalıkları. In: Yüksel M, Kalaycı G, eds.
Göğüs cerrahisi. 1st ed. İstanbul: Bilmedya grup; 2001. p. 773-88.
3.Haris KS, Zhang Z,McManus MT, Harfe BD et al. Dicer function is essential for
lung epithelium morphogenesis. Proc Natl Acad Sci U S A. 2006; 103:2208-13.
4.Langston C, Kida K, Reed M, Thurlbeck WM. Human lung growth in late gestation
and in the neonate. Am Rev Respir Dis 1984; 129: 607-13.
5.Floyd J. Camphell DC, Dominy DE. Agenesis of the trachea. Am. Rev. Respir.Dis.
1962;86:557-60.
6. Evans JA, Geenberg CR, Erdile L. Tracheal agenesis revisited: Analysis of
associated anomalies. Am J Med Genet 1999; 82:415.
7. Evans JA,
Reggin J, Geenberg CR. Tracheal agenesis and associated
malformations: A Comparison with tracheoesophagial fistula and the VACTERL
association. Am J Med Genet 1985; 21: 21-38.
8.Berdon WE. Ring, sling, and other things: vascular compression of the infant
trachea updated from the mid century to the millenium—the legacy of Robert E.
Gross, MD, and Edward B. D. Neuchauser, MD. Radiology 2000; 216: 624-32.
447
9. Lee KH, Lee KH, Yoon CS, et al. Use of imaging for assessing anatomical
relationships of tracheobronchial anomalies associated with left pulmonary artery
sling. Pediatr Radiol 2001; 31: 269-78.
10. Holinger PH, Johnston KC: Benign Stenosis of the Trachea. Ann Otol Rhinol
Laryngol1950; 59:837.
11. Lobe TE: Congenital tracheal stenosis. Chest Surg North Am 1993; 3: 495-528,
12. Mardini MK, Nyhan WL: Agenesis of the lung. Report of four patients with
unusual anomalies. Chest 1985;87:522.
13. Azizkhan RG. Congenital pulmonary lesions in childhood. Chest Surg Clin North
Am 1993;3:547-68.
14.Ghaye B, Szapiro D, Fanchmps JM, Dondelinger RF. Congenital bronchial
abnormalities revisited. RadioGraphics 2001; 21: 105-9.
15. Matsushima H, Takayanagi N, Satoh M, et al. Congenital bronchial atresia:
Radiologic findings in nine patients. J Comput Assist Tomogr 2002; 26: 860-4.
16.Kinsella D, Sissons 6, Mlliams M.P. The Radiological imaging of bronchial atresia.
Br ] Radiol 1992; 65: 681-5.
17. Magnussen JR, Thompson JN, Dickinson JT. Presternal bronchogenic cysts.
Arch Otol. 1977;103:52-4.
18. Dubois P, Belanger R, Wellington JL. Bronchogenic cyst presenting as a
supraclavicular mass. Can J Surg 1981;24:530-1.
19.St-Georges R, Deslauriers J, Duranceau A et al. Clinical spectrum of
bronchogenic cysts of the mediastinum and lung in the adult. Ann Thorac Surg. 1991;
52:6-13.
20. McAdams HP,
Kirejczyk WM,
Rosadode-Christenson ML, Matsumoto S.
Bronchogenic cyst: Imaging features with clinical and histopathologic correlation.
Radiology 2000; 217:441-6.
21. Suen HC, Mathisen DJ, Grillo HC, et al. Surgical and radiological characteristics
of bronchogenic cysts. Ann Thorac Surg 1993; 55:476-81.
22. Chiaki E, Tadashi I, Hideyuki N et al. Bronchioalveolar carcinoma arising in a
bronchogenic cyst. Ann Thorac Surg. 2000;69:933-5.
23.Roque AS, Burton EM, Boedy F: Unilateral pulmonary agenesis without
mediastinal displacement. South Med J 1997; 90: 335-7.
24. Oran O, Çağlar M, Kale G, et al: Unilateral pulmonary agenesis - presentation of
two new cases. The Turkish Journal of Pediatrics 1979;21:16-20.
448
25.Hoffman MA, Superina R, Wesson DE: Unilateral pulmonary agenesis with
esophageal atresia and distal tracheoesophageal fistula: report of two cases. J
Pediatr Surg 1989; 24:1084-5.
26. Felker RE, Tankin ILD. Imaging of pulmonary sequestration. AJR 1990;154:2419.
27. Reynolds M. Congenital lesions of the lung. In:Shields TW, Lo Cicero III J,
Ponn RP, editors. General thoracic surgery.
5th
ed.
Philedelphia:
Lippincott
Williams&Wilkins; 2000. p. 937-54.
28.Yuncu G, Gülle A, Ceyhan K. Akciğer sekestrasyonu. Heybeliada Tıp Bülteni
2001;7:58-61.
29.Safa N, Çakan A, Çağırıcı U ve ark. İntralober akciğer sekestrasyonu. İzmir
Göğüs Hastanesi Dergisi 1997;11:109-15.
30.Sipahi S, Gürsu RU, Köksal C. ‹ntralober pulmoner sekestrasyon vakası ve
literatürlerin gözden geçirilmesi. Cerrahpafla J Med 2000;31:168-71.
31. Michelson E. Clinical spectrum of infantile lobar emhysema. Ann Thorac Surg
1977; 24: 182-96.
32. Man DW, Hamdy MH, Hendry GM et al. Congenital lobar emphysema: problems
in diagnosis and management. Arch Dis Child 1983;58:709-12.
33. Tapper D, Schuster S, Mc Bride J et al. Polyalveolar lobe: Anatomic and
physiologic parameters and their relationship to congenital lobar emphysema. J
Pediatr Surg 1980;15:931-7.
34.Zach MS, Eber E. Adult outcome of congenital lower respiratory tract
malformations. Thorax 2001;56:65-72.
35.Jamet F, Deschamps F, Giacalone PL, Sadra P, Boulot P. Congenital
adenomatoid cystic malformation of the lung and renal polycystosis. A fetal case
report and review of the literature. J Gynecol Obstet Biol Reprod 1997;26: 193-6
36.Gürsoy S, Yaldız S, Usluer O ve ark. Erişkin yaşa ulaşmış akciğerin konjenital
kistik adenomatoid malformasyonu. Archives of Lung 2004;5:147-9.
37. Lerullo AM, Ganapathy R, Crowley S, et al Thilaganathan. Neonatal outcome of
antenatally diagnosed congenital cystic adenomatoid malformations. Ultrasound
Obstet Gynecol 2005;26:150-3.
38. Oh BJ, Lee JS, Kim JS, et al Congenital cystic adenomatoid malformation of the
lung in adults: Clinical and CT evaluation of seven patients. Respirology
2006;11:496-501.
449
39.Kacar M, Ünlübay D, Uysal S, Cömert DO: Konjenital kistik adenomatoid
malformasyonda klinik tanı. Tanısal ve Girişimsel Radyoloji 2002;8:506-9.
40. Wilson RD, Hedrick HL, Liechty KW, et al. Cystic adenomatoid malformation of
the lung: Review of genetics, prenatal diagnosis, and in utero treatment. Am J Med
Genet A 2006;140:151-5.
41.Parikh D, Samuel M. Congenital cystic lung lesions: Is surgical Resection
essential? Pediatr Pulmonol 2005;40:533-7.
42. Stocker JT, Madwell JE, Drake RM: Congenital cystic adenomatoid malformation
of the lung. Classification and morphologic spectrum. Hum Pathol 1977; 8:155-71.
43.Laberge JM, Flageole H, Pugash D, Khalife
Outcome of
S, Blair G, Filiatrault D, et
al:
the prenatally diagnosed congenital cystic adenomatoid lung
malformation: a Canadian experience. Fetal Diagn Ther 2001;16:178-86.
44.Khun C, West WW, Craighead JE, Gibss AR: Lung, In: Anderson's Pathology.
Edited by Damyanov I, Linder J. St-Louis, Baltimore, Mosby, 1996, pp:1470- 501.
45.Conran RM, Stocker JT. Extralobar sequestration with frequently associated
congenital cystic adenomatoid malformation, type 2: Report of 50 cases. Pediatr Dev
Pathol 1999;2:454-63.
450
35.
Yrd. Doç. Dr. Makbule Ergin
Gaziosmanpaşa Üniversitesi, Tıp Fakültesi Göğüs Cerrahi Anabilim Dalı
AKCİĞERİN BENİGN TÜMÖRLERİ
Akciğerin iyi huylu (benign) tümörleri oldukça nadir görülen tümörler olup tüm akciğer
tümörleri içinde görülme sıklığı % 2-5’tir (1). Genellikle asemptomatik olup tesadüfen
tanı koyulur (2). Semptom vermeye başlaması genellikle tümörün büyümesi ile
ilişkilidir. En sık pnömoni, atelektazi gibi tıkayıcı bulgularla karşımıza çıkar (2,3).
Görüntüleme yöntemleri ile genellikle yuvarlak, düzgün sınırlı, periferik soliter (tek)
nodül olarak karşımıza çıkar. Pozitron emisyon tomografi (PET) pulmoner nodüler
lezyonların benign ya da malign dejenerasyonu, metastaz ve lenf nodu tutulumu
açısından değerli bilgiler verir (4,5). Bilgisayarlı tomografi (BT) ve manyetik rezonans
(MR) inceleme kıymetli bilgiler vermesine karşın genellikle tanısal değildir (6,7).
Benign akciğer lezyonlarının kesin tanısı histopatolojik inceleme ile koyulur.
Bronkoskopik biyopsi ve transtorasik ince iğne aspirasyon biyosisi (İİAB) uygun
olgularda tanısal amaçlı olarak uygulanabilir (2).
Cerrahi rezeksiyon tercih edilen tedavi yöntemi olup genellikle küratiftir. Torakoskopik
veya bronkoskopik rezeksiyon uygun vakalarda tercih edilmelidir ancak benign
lezyonların zemininde gelişebilecek bir malignite ihtimali de her zaman akılda
tutulmalıdır. Malign dejenerasyon saptandığında daha geniş rezeksiyonlara ihtiyaç
duyulur.
Standart bir sınıflandırılması olmamasına rağmen tümör orijinini köken alan
sınıflandırma Dünya Sağlık Örgütü (WHO) tarafından genel kabul görmüştür. Bu
sınıflandırmaya göre akciğerin iyi huylu tümörleri soliter tümörler (Tablo 35.1) ve
multipl tümörler (Tablo 35.2) olarak ikiye ayrılmıştır (1). Bu sınıflandırmada birçok
tümör yer almasına rağmen burada yalnızca en sık görülen ve özelliği olan
tümörlerden bahsedilecektir.
451
Tablo 35.1 Akciğerin benign soliter tümörleri
1.Epitelyal tümörler
I.Papillom (Skuamöz hücreli papillom, glandüler papillom, miks papillom)
II.Adenom (Alveoler adenom, papiller adenom, tükrük bezi türünde adenom,
pleomorfik adenom, musinöz kistadenom)
2.Yumuşak doku tümörleri
I.Anjiomiyolipom
II.Lipom
III.Fibromiksoma
IV.İnflamatuar fibröz polip
V.İnflamatuar miyofibroblastik tümör (inflamatuar psödotümör)
VI.Soliter fibröz tümör (lokalize fibröz mezotelyoma)
VII.Leiyomiyom
VIII.Glomus tümörü
IX.Hemanjiom
X.Lenfatik lezyonlar (soliter intrapulmoner lenfanjiom)
XI.Kondrom
XII.Osteom
XIII.Granüler hücreli tümör
XIV.Menenjiom
XV.Nörofibrom
XVI.Schwannom
XVII.Psammamatöz melanotik schwannom
XVIII.Paragangliom
XIX.Gangliositik paragangliom
3.Diğer tümörler
I.Berrak hücreli tümör (sugar tümör)
II.Hamartom
III.Miyelolipom
IV.Noduler amiloid
V.Sklerozan hemanjiom
VI.Teratom
VII.Timoma
452
Tablo 35.2 Akciğerin benign multipl tümörleri
1.Metastaz yapan benign leiyomiyom
2.Kistik fibrohistiositik tümör
3.Pulmoner kapiller hemanjiomatozis
4.Pulmoner hiyalinizan granülom
5.Pulmoner lenfanjioleiyomiyomatozis
Hamartom
Hamartom akciğerin en sık görülen benign tümörü olup, tüm soliter pulmoner
nodüllerin %4’ünü oluşturur (1,3). Genel populasyonda görülme sıklığı %0.25 olup
genellikle tesadüfen tanı konur (8). Erkeklerde kadınlardan iki kat fazla görülmekte
olup en sık orta yaş grubunda ortaya çıkar. İçerisinde solunum epiteli ile beraber en
sık kıkırdak dokusu bulunur, bu nedenle kondrom ve kondromiksoid hamartom olarak
da bilinir. Hamartomun içinde yağ, konnektif doku ve düz kasta bulunabilir (1).
Radyolojik olarak %90 periferik soliter periferik kitle olarak görülse de nadiren kistik
akciğer hamartomu olarak multipl formda da ortaya çıkar (9). Periferik lezyonlar
genellikle alt zonlarda yerleşir ve radyolojik olarak düzgün, yuvarlak, lobule 1-2cm’lik
kitleler şeklinde görülür (8). Kalsifikasyon %10–30 oranında görülür, çoğu kez yaygın
ve patlamış mısır tarzındadır (1,3,10,11) (Resim 35.1). Hamartom sıkça yağlı doku
içerdiği için periferik bir lezyonda tespit edilmesi kuvvetle hamartomu düşündürür.
İkiye katlanma zamanı oldukça uzun olup, yılda ortalama 3.2±2.6 mm büyüme
gösterir (1,3).
Periferik lezyonlar genellikle asemptomatik olmasına karşın, olguların %1.4-8’i
endobronşiyal olarak lokalize olur ve bunlar genellikle semptomatiktir, bu nedenle
erken tanı konur. Öksürük, hemoptizi, atelektazi ve tekrarlayan akciğer enfeksiyonu
varlığında bronkoskopi ve biyopsi gerekir. Periferik lezyonu olan hastalarda ise (İİAB)
ince iğne aspirasyon biyopsisi ile tanı koyulabilir (1). Histopatolojik olarak kıkırdak
parçalarının izlenmesi hamartom için tanısaldır.
Gastrik epiteloid leiyomiyosarkom, fonksiyonel ekstra-adrenal paragangliom ve
akciğer hamartomunun bir arada bulunduğu ve Carney triadı olarak bilinen bir
sendrom tanımlanmıştır (8,12). Hamartomlar genellikle multipl olma eğilimindedir.
Aynı zamanda multipl hamartomlar Cowden hastalığında da bulunabilir, beraberinde
mukokutanöz lezyonlar, multipl benign iç organ tümörleri ile meme, triod, ürogenital
ve sindirim sistemi kanserlerine artan bir yatkınlık vardır (1,9).
453
Akciğer hamartomları az da olsa malignite riski taşıdığı için cerrahi olarak
çıkartılmalıdır. Ancak periferik lezyonu olan genç hastada kanser riski yoksa ve kitle
2.5 cm’in altında ise takip önerilir (1,2,8,11). Cerrahi tedavi sonrası nüks görülmez.
Resim 35.1: Akciğer hamartomunda izlenen kalsifikasyon görünümü
Papillom
Papillomlar trakeobronşiyal ağacı ve akciğerleri tutabilir. Skuamoz papillomlar soliter
veya rekürren respiratuar papillomatozis formunda görülür (13). Rekürren respiratuar
papillomatozis çocuk ve erişkin olarak iki grupta incelenir ve sıklıkla human papilloma
virus (HPV) 6 ve 11 ile enfeksiyon sonrası vokal kord ve trakeada multipl papillom
olarak izlenir (1,3,14). Tedavisi endoskopik veya cerrahi rezeksiyondur.
Lipom
Lipomlar tüm akciğer tümörlerin % 0.1-0.5’ini, benign tümörlerin %13’ünü oluşturur ve
malignite ile ayırımının yapılması gerekir (15,16). %80 bronşun kartilaj halkalarının
arasındaki submukozal yağ dokusundan köken alır (1,2,3). Erkeklerde daha sık olup
genellikle 5 ve 6. dekatlarda tanı konur. Astım ve kronik tıkayıcı akciğer hastalığı
454
(KOAH) bulguları görülebilir (15,16). Üzeri solunum yolu epiteli ile örtülü olup dar bir
boynu vardır (2). Tedavisi cerrahi rezeksiyondur.
İnflamatuar Psödotümör
İnflamasyon sonrası oluşabilen ve baskın olan hücre tipine göre değişik isimlerle
anılan tümörlerdir (3,17). Son sınıflamada inflamatuar miyofibroblastik tümör adı
daha uygun görülmüştür (1). Tüm akciğer tümörlerinin %0.7’sini oluşturur (3).
Ortalama 30 yaş altında asemptomatik kitle olarak ortaya çıkar. Benign bir tümör
olmasına rağmen lokal agresif davranış gösterip nüks ve uzak yayılım gösterebilir,
bundan dolayı bazı yazarlar tarafından gerçek bir neoplazm olarak kabul edilir
(1,17,18,19). Tedavisi cerrahi rezeksiyon olup tam rezeksiyon uygulanamayan
hastalarda radyoterapi ve steroid kullanımı da bir tedavi seçeneğidir (18,19).
Leiyomiyom
Oldukça nadir olmasına rağmen akciğerin benign tümörlerinin %2’sini oluşturur ve
akciğerin en sık rastlanan yumuşak doku tümörüdür (1,3). Trakea, bronş veya
akciğer parankimi içerisinde bulunabilir. En sık kadınlarda, 35 yaş civarında görülür
(20). Genellikle asemptomatik olup tesadüfen tanınır. Sıklıkla periferik soliter
pulmoner nodül şeklindedir.
Endobronşiyal olanlar tıkanma bulgusu verebilir.
Endobronşiyal olanlar bronkoskopik olarak çıkartılırken diğerleri için cerrahi
rezeksiyon gerekir, cerrahi sonrası prognoz mükemmeldir.
Glomus tümörü
Glomus tümörü tırnak yatakları ya da parmak uçlarında bulunan, ısı ve kan akımı
kontrolünü sağlayan arteriyovenöz şant (Sucquet-Hoyel kanalı) hücrelerinden köken
alır (1,3,21). Yumuşak doku tümörlerinin %2’sini oluşturur (21). Ortalama 45 yaş
civarında görülür. Akciğerde nadir görülmekle beraber genellikle asemptomatik
periferik soliter nodül şeklinde ortaya çıkar. Hemanjioperistom, karsinoid, düz kas
tümörleri ve paragangliomalar ile sık karışır (1,3,22). Tedavisi cerrahi rezeksiyondur.
Granüler Hücreli Tümörler (Miyoblastom)
Schwann hücrelerinden köken aldığı için schwannom olarak da adlandırılır (1,2).
Genellikle soliter pulmoner nodül olarak görülmesine rağmen trakea ve bronşta
multipl lezyonlar olarak ta ortaya çıkabilir (2,3). Kadın ve erkekte eşit olarak görülür
455
ve genellikle orta yaş grubunda ortaya çıkar. Tedavisi cerrahi rezeksiyon olup nüks
görülebilir.
Berrak Hücreli Tümör
Clara hücreleri ya da seröz epitelyum hücrelerinden köken alır ve sitoplazmasında
glikojen granülleri olduğu için Sugar tümör olarakta bilinir (1,3,23). Hastalar genellikle
asemptomatik olup tesadüfen tanı konur. Kadın erkek dağılımı eşit olup genellikle
40–50 yaş civarında görülür. Radyolojik olarak 1,5–3 cm çaplı, periferik, soliter
lezyonlar şeklindedir (2,23). Metastatik renal hücreli karsinom ve akciğerin primer
berrak hücreli karsinomu ile ayırımının yapılması güçtür (1,3). Tedavisi cerrahi
rezeksiyondur.
Nodüler Amiloid
Nodüler akciğer amiloidozisi parankim içinde, etrafı dev hücre reaksiyonu ile çevrili
bölgesel amiloid birikimidir (3). Laringeal, trakeobronşiyal, nodüler parankimal ve
diffüz alvaolar septal parankimal olarak 4 grupta incelenir (1). Her iki cinste eşit
olarak ortaya çıkar ve en sık 60–70 yaş civarında görülür. Hastalar multipl miyelom
ve Sjögren sendromu açısından incelenmelidir (24,25). Hastaların uzun süreli
takiplerinde lenfoma ve makroglobulinemi gelişimi de bildirilmiştir (1,3,25). Cerrahi
rezeksiyon küratiftir.
Sklerozan Hemanjiom
Histogenezi tam olarak belirlenmemiştir ancak tip II pnömositlerden köken aldığı
düşünülmektedir (1,2). Hamartomdan sonraki 2. en sık benign akciğer tümörüdür
(26). Kadınlarda sık rastlanır ve ortalama 42 yaş cıvarında ortaya çıkar, genellikle
asemptomaktir. Radyolojik olarak akciğerin genellikle alt loblarında soliter, periferik,
bazen kalsifiye düzgün sınırlı nodül olarak izlenir (27). MR görüntüleme tümörün
morfolojisi hakkında ayrıntılı bilgi verir (3). Histolojik olarak papiller, sklerotik, solit ve
hemorajik olmak üzere 4 komponentte ortaya çıkar (1,2,26,27). Cerrahi rezeksiyon
küratiftir.
Metastaz Yapan Benign Leiyomiyom
Metastaz yapan benign leiyomiyomların gerçek natürü henüz aydınlanmamıştır.
Düzgün sınırlı, sayısız nodüllerle karakterize olan bu tümörler genellikle genç
456
kadınlarda görülür ve uterus leiyomiyomları ile ilişkilidir (1,2,28). Kimi yazarlar
tarafından benign histolojiye sahip ancak malign davranışlı border line (sınırda) tümör
olarak kabul edilirler (28,29). Genellikle bilateral olarak görülür (29). Tümörde
öströjen ve progesteron reseptörleri bulunur, ooferektomi sonrası tümörde gerileme
görülür (1,29). Tedavisinde cerrahi rezeksiyon, kemoterapi ve hormon tedavisi
kombine olarak uygulanabilir (29).
Pulmoner Kapiller Hemanjiomatozis
Kapiller hemanjiomatozis alveoler septa, bronş ve ven duvarları, plevra ve bölgesel
lenf bezlerinin
kapillerlerin interstisyel alana doğru diffüz proliferasyonu sonucu
gelişen agresif nitelikteki benign tümörlerdir (1,3). Pulmoner hipertansiyon, hemoptizi,
kor pulmonale ve sağ kalp yetmezliği görülebilir (1). Radyolojik incelemede
retikülonodüler patern görünümü mevcuttur (30). Tedavisinde başarılı sonuçlar ancak
bilateral akciğer transplantasyonu ile elde edilir (1,3). Pulmoner tıkayıcı ven hastalığı
ile beraber görülürse prognoz kötü olup, erişkin hastalar 2 yıl içinde, çocuk hastalar
birkaç ay içinde kaybedilir (31).
Pulmoner lenfanjioleiyomiyomatozis
Doğurganlık çağındaki kadınlarda ve çoğu kez tuberoskleroz ile beraber görülür
(1,3,32,33). Hastalık milyonda bir oranında görülür ancak tuberosklerozlu hastaların
%40’ında lenfanjiomiyomatozis bulguları vardır (1,32). Hormonal kökenli bir hastalık
olduğu düşünülmektedir (32). Akciğerdeki düz kasların proliferasyonu ile venler ve
lenfatiklerde sekonder tıkanmalar ortaya çıkar. Bu değişiklikler sonucu dispne,
wheezing, spontan pnömotoraks, hemoptizi, plevral effüzyon, şilotoraks ve böbrekte
anjiomiyolipom ortaya çıkabilir (1,3,32,33,34). Radyolojik olarak retikülonodüler veya
bal peteği görünümü ile akciğerin özellikle tabanında 0.2-2 cm çaplı kistler izlenir
(1,33). Tedavi edilmezse yavaş bir şekilde ilerler ve 10 yıl içinde solunum yetmezliği
ile ölüme neden olur (3). Tedavisinde hormonal tedavi esas olup ooferektomi, antiöstrojen tedavi ve progesteron tedavisi denenir. Hormonal tedavi ile sonuç
alınamayan hastalarda interferon-α2b, rapamisin, doksisiklin ve tamoksifen denenir
(1,3,34). Hastalara gebe kalmamaları ve pnömotoraks riskinden dolayı uçağa
binmemeleri önerilir (1,32,34,35). Medikal tedaviler başarısız olduğu takdirde
seçilecek tedavi akciğer transplantasyonudur (32,34).
457
KAYNAKLAR
1.Robinson PG, Shields TW. Benign tumors of the lung. In Shields TW, Locicero J,
Reed CE, Feins RH, ed. General Thoracic Surgery, vol 2, 7th ed. Philadelphia:
Lippincott Williams and Wilkins; 2009;1565-1590.
2.Yüksel M, Akgül A. Akciğerin iyi huylu tümörleri. In Yüksel M, Kalaycı NG, ed.
Göğüs Cerrahisi. 2001;221-224.
3.Çağırıcı U. Akciğerin benign ve ender görülen malign tümörleri. In Ökten İ, Güngör
A, ed. Göğüs Cerrahisi 2003;1039-1052.
4.Krajicek BJ, Ryu JH, Hartman TE, et al. Abnormal fluorodeoxyglucose PET in
pulmonary Langerhans cell histiocytosis. Chest. 2009;135:1542-9.
5.Khalaf M, Abdel-Nabi H, Baker J, et al. Relation between nodule size and 18FFDG-PET SUV for malignant and benign pulmonary nodules. 2008;22:1-13.
6.Khan AN, Al-Jahdali HH, Allen CM, et al. The calcified lung nodule: What does it
mean? Ann Thorac Med. 2010;5:67-79.
7.Kanauchi N, Oizumi H, Honma T, et al. Role of diffusion-weighted magnetic
resonance imaging for predicting of tumor invasiveness for clinical stage IA non-small
cell lung cancer. Eur J Cardiothorac Surg. 2009;35:706-10.
8.Guo W, Zhao YP, Jiang YG, Wang RW, et al. Surgical treatment and outcome of
pulmonary hamartoma: a retrospective study of 20-year experience. J Exp Clin
Cancer Res. 2008;31:27-8.
9.Bini A, Grazia M, Petrella F, Chittolini M. Multiple chondromatous hamartomas of
the lung. Interact Cardiovasc Thorac Surg. 2002;1:78-80.
10.Sodhi KS, Virmani V, Jindal SK, Khandelwal N. Pulmonary hamartoma. Ann Acad
Med Singapore. 2009;35:1110.
11.Tözüm H, Üçvet A, Gürsoy S, ve ark. Akciğer hamartomu: 15 olguluk bir analiz
Turkish J Thorac Cardiovasc Surg 2009;17:186-190.
12.Carney JA. Carney triad: a syndrome featuring paraganglionic, adrenocortical,
and possibly other endocrine tumors. J Clin Endocrinol Metab. 2009;94(10):3656-62.
13.Kuruvilla S, Saldanha R, Joseph LD. Recurrent respiratory papillomatosis
complicated by aspergillosis: A case report with review of literature. J Postgrad Med
2008;54:32-4.
14.Ağgünlü L, Erbaş G. Recurrent respiratory papillomatosis with lung involvement.
Diagn Interv Radiol. 2009;15:93-5.
458
15. Irani F, Kumar B, Reddy P, et al. An endobronchial lipoma mimicking asthma and
malignancy. Prim Care Respir J. 2010;19:281-3.
16.Mota VT, Maia JG, Barbosa AT, et al. Tracheal lipoma mimicking obstructive lung
disease. J Bras Pneumol. 2010;36:152-5.
17.Yano Y, Mori M, Kagami S, et al. Inflammatory pseudotumor of the lung with rapid
growth. Intern Med. 2009;48:1279-82.
18.Sanchez PG, Madke GR, Pilla ES, et al. Endobronchial inflammatory
pseudotumor: a case report. J Bras Pneumol 2007;33:484-6.
19.Çobanoğlu U, Kırgın HÖ, Uğurluer G. Akciğerin İnflamatuar Psödotümörü: Olgu
Sunumu. Van Tıp Dergisi 2008;15:90-94.
20.Vercillo MS, Kim AW, Pitelka L, et al. Right middle lobectomy for a primary
pulmonary leiomyoma: a case report. Cases J 2009;8:8673.
21.Barbareschi PM, Dalfior D, Alice Parisi A, et al. Pulmonary Glomus Tumor. Int J
Surg Pathol 2008;16: 81.
22.Cockera J, Messaoudia N, Waelputb W, Schila PEYV. Intrapulmonary glomus
tumor in a young woman. Inter CardioVasc Thor Surg 2008;7:1191–1193.
23.Han B, Jiang G, Wang H, et al. Benign clear cell tumor of the lung. Ann Thorac
Surg. 2010;89:2012-4.
24.Sakai T, Tsushima T, Kimura D, et al. Multiple nodular pulmonary amyloidosis
complicated with Sjögren syndrome. Kyobu Geka. 2010;63:818-21.
25.Rajagopala S, Singh N, Gupta K, Gupta D. Pulmonary amyloidosis in Sjogren's
syndrome: a case report and systematic review of the literature. Respirology
2010;15:860-6.
26.Jungraithmayr W, Eggeling S, Ludwig C, et al. Sclerosing hemangioma of the
lung: a benign tumour with potential for malignancy? Ann Thorac Cardiovasc Surg
2006;12:352-4.
27.Maeda R, Isowa N, Miura H, et al. Bilateral multiple sclerosing hemangiomas of
the lung. Gen Thorac Cardiovasc Surg. 2009;57:667-70.
28.Tatebe S, Oka K, Kuraoka S, Yatabe Y. Benign metastasizing leiomyoma of the
lung: potential role of low-grade malignancy. Thorac Cardiovasc Surg 2009;57:180-3.
29.Sapmaz F, Ergin M, Katrancioglu O, et al. Benign metastasizing leiomyoma. Lung
2008;186:271-3.
459
30.Kadowaki T, Yano S, Kobayashi K, et al. Pulmonary capillary hemangiomatosislike foci detected by high resolution computed tomography. Intern Med 2010;49:1758.
31.Karakurt Z. Other causes of pulmonary arterial hypertension: pulmonary venoocclusive
disease,
pulmonary
capillary
hemangiomatosis,
porto-pulmonary
hypertension, HIV- associated pulmonary arterial hypertension. Anadolu Kardiyol
Derg 2010;10:63-8.
32.Hohman DW, Noghrehkar D, Ratnayake S. Lymphangioleiomyomatosis: A review.
Eur J Intern Med. 2008;19:319-24.
33.Park HY, Nam HS, Chung MP, Jeong SH. A nationwide survey of
lymphangioleiomyomatosis in Korea: recent increase in newly diagnosed patients. J
Korean Med Sci 2010;25:1182-6.
34.McCormack
FX.
Lymphangioleiomyomatosis:
a
clinical
update.
Chest
2008;133:507-16.
35.Taveira-DaSilva AM, Burstein D, Hathaway OM, et al. Pneumothorax after air
travel in lymphangioleiomyomatosis, idiopathic pulmonary fibrosis, and sarcoidosis
Chest 2009;136:665-70.
460
36.
Doç. Dr. Aydın Nadir
Cumhuriyet Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
ÖZOFAGUS ANATOMİ VE FİZYOLOJİSİ
Anatomi
Embriyo gelişiminin 4. haftasında özofagus mide ve farinks arasında şekillenmeye
başlar. Çalışmalar özofagusun retrofaringeal keseden gelişen üst trakeal kısım ve
bağırsağın pregastrik segmentinden gelişen infratrakeal bölüm olmak üzere çift orijinli
olduğunu göstermiştir. Bu iki bölüm karina (bifurcatio trachea) seviyesinde birleşir.
Üst sınırı faringeyal konstrüktörün inferior krikofaringeyal parçası, alt sınırını ise mide
girişi belirler. Bu kısım mide içeriğinin özofagusa reflü olmasını engelleyecek biçimde
şekillenir (1).
Özofagusun anatomik seyrine bakıldığında boyunda hipofarinksin devamı olarak
başlar ve mide ile sonlandığı görülür. Normal anatomik pozisyonda 6. servikal
vertebra hizasında başlar ve torakal 11–12. vertebra hizasında mideye ulaşır.
Özofagus boyunda ve üst toraksta orta hattın solunda, orta torasik bölümde orta
hatta ve alt torasik bölümde ise yine orta hattan sola deviye şekilde seyreder. Lateral
grafide alt torasik bölge hariç vertebra korpuslarının önünde yer alır (2-4).
Özofagus yerleşim yerine göre servikal, torasik ve abdominal olmak üzere 3 bölümde
irdelenir. Yaklaşık 5cm’lik bölümü servikaldedir. Trakea arka duvar ile kolumna
vertebralis arasında seyreder. Toraksa girdikten sonra karinaya kadar aynı şekilde
trakea arka duvarı ve kolumna vertebralis arasında devam eder. Bifurkasyo trakeanın
hemen üzerinde aortanın sağına geçer. Distale ilerlerken sola deviye olur ve
perikardla sol atriyum lokalizasyonunda komşuluk yapar. Sola doğru yönelen
özofagus inen aortanın önünde diyafragmadaki özofageal hiatustan geçer. Bu geçiş
esnasında özofageal hiatusta ilk üç lomber vertebraların ön yüzünden başlayan ve
özofagusu önden ve arkadan sağ ve sol kruslar sarar. Özofagus abdomene geçince
subdiyafragmatik
ve
endotorasik
aponevrozların
birleşerek
oluşturduğu
frenoözofageal membran tarafından sarılır. Bu bağa Laimer bağı da denir (2,4). Bu
bağ gastroözofagiyal bileşkenin oluşturduğu alt sfinkter basıncının ayarlanmasında
önemli rol oynar. Abdominal bölümde özofagus sola kıvrılarak mideye ulaşır.
Özofagusun dış longitudinal kas lifleri midenin de dış longitüdinal lifleri olarak devam
461
eder. İçteki dairesel kas lifleri ise midede oblik kas lifleri olarak devam eder ve
fundusa ulaşır.
Özofagusun üç darlığı vardır. Birinci darlık özofagusun başlangıcındadır ve m.
krikofaringeus kası tarafından oluşturulur. Sindirim sisteminin en dar yeridir. İkinci
darlık arkus aortayı çaprazladığı yerdir. En alttaki darlık diyafragmayı geçtiği,
hiatustadır.
Endoskopik incelemelerde özofagus boyu hesaplanırken çoğu zaman üst kesici
dişlerden itibaren ölçümler referans alınır (Resim 36.1). Özofaugusun boyu
38±3cm’dir. Kadınlarda 2-3cm daha kısadır. Doğumda 18cm olan özofagus, 3
yaşında 22, 10 yaşında 27cm’dir. Krikofaringeus kasından mideye olan mesafe
erkeklerde 23–30, kadınlarda 20–26cm’dir. Üst kesici dişlerden krikofaringeal
seviyeye uzaklık 15-16cm.dir. Özofagus yine 18–20.cm’lerde toraksa girer. Karina
seviyesi yaklaşık 24.cm’dir (2-4).
Resim 36.1: Özofagoskopi esnasında üst kesici dişler referans noktası alınarak lezyonların
yerleşim yeri belirtilir. Resimde özofagusun darlıkları ve komşulukları görülmektedir.
Özofagusun Yapısı
Özofagusun diğer sindirim sistemi organlarından farklı olarak serozası yoktur.
Özofagusun yapısına dıştan lümene doğru bakıldığında en dış tabakası olan tunica
adventia gevşek bir bağ dokusudur ve özofagusu sarar ve komşu yapılara bağlar
462
(Resim 36.2). Tunica muscularis olarak adlandırılan kas tabakası hem çizgili hem de
düz kas içerir. Sfinkteri oluşturan m.krikofaringeus kası ve ilk 2–6cm’lik servikal
özofagus sadece çizgili kas içerir. Buradan itibaren düz kas lifleri artmaya başlar. Alt
kısımlarda ise düz kas çizgili kasın yerini alır. Karina seviyesinin altında erişkinde
hemen hemen hiç çizgili kas bulunmaz. Özofagusun kas tabakası dışta longitüdinal,
içte sirküler olarak seyreder. Sirküler kas tabakası longitudinal tabakadan daha
kalındır.
Kas tabakasının altında tunika submukoza vardır. Gevşek bağ dokusundan
oluşmuştur. Kollajen lifler, kan damarları, lenf kanal ağları, sinirler ve derin müköz
glandlar içerir. En içte ise tunika mukoza yer alır. Tunika mukoza muskularis mukoza
(tamamen düz kastır), lamina propriya (bağ doku) ve skuamöz epitel (çok katlı yassı
epitel) den oluşmuştur (4).
Resim 36.2: Resimde özofagusun tüm katmanları görülmektedir. En dışta serozasının
olmamasına dikkat edilmelidir.
Özofagusun Damarlanması
Özofagusun servikal, torasik ve abdominal parçaları farklı arteriyel beslenme gösterir.
Servikal bölgede sağ ve sol superior ve inferior tyroidal arterden gelen dallar farinksi,
463
özofagusu ve trakeayı besler. Torasik özofagusun beslenmesi daha çok inen
aortadan çıkan bronşiyal arterden olur. Alt torasik bölgede ise direkt aortadan çıkan
perforan dallarla beslenir. Abdominal özofagus ise sol gastrik arterin dallarından
kanlanır. Venöz direnajı servikal bölgede inferior tiroidal vene, torasik bölgede
bronşiyal venlere, azigos ve hemiazigos sistemine, abdominal bölgede de sol gastrik
vene olur. Burada önemli olan nokta distal özofagus bölgesinde sistemik dolaşım ile
portal sistem arasında anostomozların varlığıdır. Portal venöz obstrüksiyonlarda bu
ilişki sayesinde vena kava superior sistemi arasında kollateral yol önemli rol üstlenir
(2).
Özofagusun Lenfatik Drenajı
Özofagusun lenfatik drenajı özellik arz eder. Hem segmental hem de longitudinaldir.
Lenfatik akım mukozadan başlayarak submukozaya doğru olur. Buradan sonra
kraniyo-kaudal yönde devam eder. Bununla birlikte üst 2/3 özofagusta akım daha çok
kraniyal yönde iken, alt 1/3 de ise kaudal yöndedir (2,4). Özellikle torasik bölgede
lenfatik akım kas tabakasına ulaşmadan önce submukozal olarak uzun bir segment
boyunca devam eder. Bu bir tümörün tüm özofagus katlarını tutmadan önce uzun bir
segment boyunca yayılabileceğini göstermektedir.
Servikal ve üst torasik özofagus lenfatikleri paratrakeal ve derin servikal lenf
nodlarına drene olur. Alt torasik özofagustan ise drenaj subkarinal ve inferior
pulmoner ligament lenf nodlarına doğrudur. Abdominal özofagus ve alt torasik
özofagustan ise drenaj superior gastrik lenf nodlarına doğru olur.
Özofagusun İnnervasyonu
Özofagus sempatik ve parasempatik innervasyona sahiptir. Hem efferent hem de
afferent
lifler
içerir.
Parasempatik
innervasyonu
n.vagus
sağlar.
Sempatik
innervasyonu ise servikal ve torasik sempatik ganglionlardan çıkan sempatik liflerden
alır. Myenterik pleksus (Auerbach) longitüdinal ve sirküler kas tabakaları arasında yer
alır. Bununla birlikte submukozal pleksus (Meissner) da görülebilir.
Özofagusun bu innervasyonu sayesinde; çizgili ve düz kaslar, salgı bezlerinin
fonksiyonları düzenlenir. Parasempatik innervasyon kas tabakalarına motor, salgı
bezlerine ise sekretuar etki gösterir. Sempatik innervasyon ise, sfinkterlerin
kasılmasını, kas duvarının gevşemesi, peristaltik ve salgısal aktivite artışı ve
vazokonstrüksiyon yapar.
464
Özofagusun Fizyolojisi
Yutma işlemi son derece karmaşık sensorimotor bir olay olup, orofarinks ve
özofagustaki kasların koordinasyonlu bir şekilde kasılması ve gevşemesi ile oluşur.
Üç aşamada meydana gelen yutma işlemi istemli olan oral faz, istemsiz olan
faringeal ve özofageal fazı içerir. Oral ve faringeal fazlarda çizgili kaslar, özofageal
fazda hem çizgili hem de düz kaslar işlev görür. Oral fazda katı gıdalar küçük
parçalara ayrılır, tükrük ile karıştırılır yutmaya hazır hale getirilir. Faringeal fazda
farinks kasları kasılır, özofagus sfinkteri gevşer. Üst sfinkterin kapanması ile
özofageal faz başlar. Özetle; yutma işlemi merkezi sinir sisteminde programlandıktan
sonra, orofarenkste başlar ve alt özofagus sfinkterinin gevşemesine kadar devam
eder (4,5).
Özofagusun üst ve alt ucunda özofagusun kapalı durmasına yardımcı olabilecek
özelleşmiş sfinkterler bulunur. Bu sfinkterler tonik kasılmalar sayesinde 3-4cm’lik
özofagus segmentini oklüde ederler. Çiğneme esnasında primer peristaltik dalganın
sfinkter bölgesine gelmesi ile sfinkterler kasılıp gevşerler. Bu sfinkterlerin amacı
özofagusun her iki bölgesinde basınç bariyeri oluşturmaktır (5).
Üst özofagus sfinkteri m. krikofaringeus kası tarafından oluşturulur. Yaklaşık 23cm’lik segmenti içerir ve normal şartlarda 20–80mmHg istirahat basıncına sahiptir.
Alt uçta ise fizyolojik bir sfinkter varlığı konusunda araştırmacılar hemfikir olmasına
rağmen, özelleşmiş bir anatomik yapı olmamasından dolayı anatomik bir sfinkterin
varlığı konusunda tartışma vardır. Bu sfinkterin 2/3’ü diyafragma altındadır. Alt
sfinkter basıncı 3-4cm’lik segmentte, 15-35mmHg arasında, ortalama 28 mmHg
olarak ölçülür (4-6).
Özofagusun fizyolojisi kısaca iki yüksek basınç alanı ve gövdenin peristaltik
hareketlerini içerir. Bu iki yüksek basınç alanı sayesinde farenksten hava aspire
edilmez, mide içeriği özofagusa reflü olmaz. Ayrıca üst sfinkter sayesinde özofagusa
reflü olan mide içeriğinin farenkse regürjitasyonunu engeller. Özofagus gövdesinin
dinlenme esnasında motor aktivitesi yoktur. Temelde iki peristaltik hareket gözlenir.
Primer peristaltik hareketler 2-5cm/sn hızla ve 60-140mmHg basınçla yutma sonrası
gıdaların mideye ulaşmasını sağlar. Sekonder peristaltik hareketler ise lokmanın
mideye iletilmesinden sonra ortaya çıkar. Daha düşük basınçlıdır. Özofagusa reflü
olan mide içeriğinin ve geride kalan gıda atıklarının temizliğini sağladığı bilinmektedir.
Monometrik çalışmalarda kaydı yapılan ve tersiyer dalgalar olarak bilinen dalgaların
465
ne işe yaradığı tam bilinmemektedir. Motor bozukluklarda gözlenirler. İletici özellikleri
yoktur (4,5).
Özofagus gövdesinin kas yapısında yer alan longitüdinal kasların fizyolojik
aktivitelerini
ölçmek
zordur.
Sugarbaker
ve
arkadaşlarına
göre
lokmanın
transportunda mekanik rol oynar. Fakat sirküler kaslar ise lümende yer alan lokmanın
etkisi ile segmental kontraksiyon yaparak lokmanın alt segmente, ileriye iletilmesini
sağlar. Primer peristaltik hareket farenksten gelen lokmanın sayesinde tetiklenerek
istemli başlar. Sonra istemsiz olarak devam eder.
Özetle özofagus sadece besinlerin mideye iletilmesinde değil aynı zamanda hem üst
hem de alt sfinkterler sayesinde besinlerin ve mide içeriğinin geriye kaçmasını
önlemede önemli rol oynar.
KAYNAKLAR
1- Blevins CE. The esophagus. Embryology of the esophagus. In Shields TW,
LoCicero J, Ponn RB, ed. General Thoracic Surgery, vol 2, 5th ed. Philadelphia:
Lippincott Williams and Wilkins; 2002:1595-1598.
2- Hagen JA, DeMeester TR. The esophagus. Anatomy of the esophagus. In Shields
TW, LoCicero J, Ponn RB, ed. General Thoracic Surgery, vol 2, 5th ed. Philadelphia:
Lippincott Williams and Wilkins; 2000:1425-1441
3- - Michels NA, Mitchell GA, Som ML. Anatomy of the esophagus.In Netter FH. The
Netter collection of medical illustrations. vol 3, 9 New York, RR Donnelley&Sons
Company; 2000;34-46
4- Yüksel M, Akgül AG. Özofagus embriyoloji,-damarlanma, innervasyon-anatomi.In
Yüksel M, Başoğlu A. ed. Özogaus hastalıklarının tıbbi ve cerrahi tedavisi; 2002:1-19.
5- Andre C, Ferraro D, Ferraro P. The esophagus. Physiology and Physiologic
studieas of the esophagus. In Shields TW, LoCicero J, Ponn RB, ed. General
Thoracic Surgery, vol 2, 5th ed. Philadelphia: Lippincott Williams and Wilkins;
2000:1619-1634.
6- Arıbaş OK. Özogausun motilite hastalıkları. Ökten İ, Güngör A. ed. Göğüs
Cerrahisi. Cilt 2, 2003:1217-1226.
466
37.
Doç. Dr. Atilla Eroğlu
Atatürk Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
ÖZOFAGUS HASTALIKLARINDA TANISAL TEKNİKLER
Giriş
Özofagus hastalıklarının başarılı tedavisi için hastanın altta yatan anatomik ve
fonksiyonel bozukluklarının anlaşılması gerekmektedir. Özofagusun değerlendirilmesi
için diagnostik testler; yapısal bozuklukların gösterilmesi, fonksiyonel anomalilerin
belirlenmesi ve özofagusun mide suyuna maruziyetinin ölçülmesinden oluşmaktadır.
Radyolojik Değerlendirme
I. Düz göğüs radyografisi
Düz grafilerin özofagus incelemesinde tanı değeri oldukça düşüktür. Standart
posteroanterior ve lateral göğüs radyografilerinde, hava, sıvı veya gıda partiküllerinin
veya içilen radyoopak maddelerin birikintilerinin özofagus lümeninde bulunması altta
yatan patolojinin teşhisi için önemli bir ipucu verebilir. Dahası göğüs filmleri hava-sıvı
seviyesi
ile
retrokardiyak
bir
yumuşak
doku
kitlesini
gösterebilir.
Böylece
şüphelenilmeyen bir hiatal herni akla gelebilir (1).
Özofagusta
hava
başlangıçta
sklerodermanın
özofagusu
tuttuğu
hastalarda
gözlenmiştir. Bununla beraber aynı bulgu inflamasyon veya radyasyona sekonder
mediastinal fibrozis, torasik cerrahi sonrası veya özofagial motilite ve intralüminal
basıncın pulmoner infiltrasyonla bozulduğu durumlarda da görülebilmektedir (2).
Göğüs radyografisinde gastrik fundusta normal gaz birikimi görülmeksizin yaygın
mediastinal genişleme özofagus dilatasyonunun bir belirtisi olabilir. Genellikle hava,
yiyecek veya sekresyonların köpüksü karışımı bulunur. Bu bulgular akalazya için
oldukça anlamlıdır. Ancak peptik striktür veya gastroözofagial bileşkenin infiltratif bir
tümörü de aynı bulguları verebilir. Özofagus kanseri özofagoplevral alanda yumuşak
doku kitlesi olarak, trakeal bası yaparak veya mediastinal adenopati ve akciğer
metastazına neden olarak göğüs filminde görülebilir. Ayrıca düz göğüs ve boyun
467
radyografileri yutulan yabancı cisimlerin teşhisinde ve özofagus perforasyonundan
şüphelenildiği durumlarda oldukça önemlidir (Resim 37.1-2)(2–5).
Resim 37.1: PA akciğer ve lateral grafide özofagustaki yabancı cisim görünümü
Resim 37.2: Özofagus perforasyonu gelişen olguda direkt grafilerde mediastinal
amfizem görünümü
Baryumlu özofagografi
Özofagusun morfolojisi ve motor fonksiyonlarının değerlendirilmesinde ilk tercih
edilen radyolojik tetkiktir (6). Yutma güçlüğü, boğazda yanma, ağrılı yutma, göğüs
ağrısı, globus, tedavi öncesi ve sonrası değerlendirme baryumlu özofagografinin
468
başlıca endikasyonlarıdır. Baryumlu grafiyle kombine floroskopik değerlendirme bu
hastalıkların teşhisinde daha etkilidir.
Özofagial bir hastalıktan şüphelenildiğinde hastalarda tanıya yönelik ilk test mide ve
duodenumun da tam değerlendirmesini içeren baryumlu görüntüleme olmalıdır
(Resim 37.3-8) (7). Bolus transportun gerçek zamanı ve hiatal herninin büyüklüğü
hakkında bilgi elde edilir. Ayrıca baryumlu özofagografi obstruktif lezyonların varlığı
ve foregutun yapısal anomalileri gibi anatomik bilgi sağlar.
Resim 37.4:Baryumlu özofagus-mide
grafilerinde geniş hiatal herni görünümü
Resim 37.3: Baryumlu özofagus-mide
grafilerinde hiatal herni görünümü
hali
Resim 37.5: Kontrastlı özofagus grafisinde
özofagus fistülü ve stent konulmuş
469
Resim 37.6: Schatzki halkası
Resim 37.7: Baryumlu özofagus grafisinde akalazya görünümü
Resim 37.8: Baryumlu grafide özofagus divertikülü
Bir video özofagogramda peristaltizmin değerlendirilmesi özofagial manometreden
elde edilen bilgiye katkı sağlar. Özofagial motilite en iyi, hastalara hem ayakta hem
de supin pozisyonda baryum içirilip gözlemlenerek değerlendirilir. Çalışma hem sıvı
hem de solid bolus materyalle yapılmalıdır. Normal yutma esnasında primer
peristaltik dalga üretilip bolus şeklinde özofagustan mideye geçiş olur. Kalan materyal
nadiren sekonder peristaltik bir dalga uyarıp genellikle ilave bir faringial yutma
gerektirir. Motilite değerlendirilirken hasta sağ pron oblik pozisyonda yatırılır. Tek
yudum baryum içirilip tüm özofagus boyunca geçişi takip edilir. Komplet peristaltik
aktivite insidansını saptamak için en az 5 baryum yudumu gereklidir. İki veya daha
fazla yudumda anormal dalga saptanması motilite bozukluğuna işaret etmektedir (6).
Baryumlu tek-kontrast özofagogram: Opak madde hızlı bir şekilde içirilerek tüm
özofagus lümenini doldurması sağlanır. Hasta yatar pozisyondadır. Bu metotla
kanser, büyük ülserler ve webler tanımlanıp özofagus konturu, motilitesi ve
genişleme yeteneği etkin bir biçimde değerlendirilir.
Sürekli dinamik kayıt faringial ve özofagial motilitenin değerlendirilmesinde tercih
edilen bir tekniktir. Normal bir erişkinde bolus geçiş 20–24 cm uzunluğundaki
özofagustan 6–8 saniyede tamamlanır. Özofagus motilitesi bozuk olan hastalarda
baryumun retansiyonu ve gecikmiş boşalması önemli bir görüntüdür. Yutma sonrası
peristaltik dalgaların insidans ve amplitüdünde azalma, distale ilerleyen başlangıç
470
kontraksiyonunun yetersizliği ve tekrarlayan itici olamayan dalgalar floroskopide
gözlenebilen diğer anormal bulgulardır (2).
Suda çözünebilen iyotlu kontrast madde ile özofagogram : Özofagus perforasyonu ve
anastomoz kaçağından şüphelenilen durumlarda kullanmak için Gastrograffin veya
Hypaque gibi suda çözünebilen iyotlu kontrast maddeler geliştirilmiştir (2,3,8). Bu
sulu kontrast maddeler mediastinal yumuşak dokular, plevra veya peritoneal aralığa
geçtikten sonra kolayca absorbe olurlar (9). Araştırmalar özofagial perforasyonun
%25-50’sinde düşük yoğunluklu ve çevre dokulara hızlıca yayılmaları nedeniyle suda
eriyen ajanlarla ilk değerlendirmede teşhis konulamayacağını belirtmektedir (2).
Çift-kontrast Özofagografi : Küçük mukozal anomalilerin gösterilmesinde en uygun
yöntemdir (6). Mukozal kabartma veya çift kontrast filmler küçük neoplazmlar, özofajit
ve varislerin saptanmasını arttırmak için kullanılabilir. İnceleme hasta ayakta iken
yapılır. Herhangi bir alanda daralma veya rijidite esnek özofagial duvarın aksine
maksimum gerginlikte daha iyi tanınır (2). Bir halka, striktür veya obstruktif lezyondan
kaynaklanan daralmanın tespit edilebilmesi için özofagogastrik bölgenin tam olarak
genişlemesi gerekmektedir.
Solid Bolus Test : Dar alanların semptomatik olduğu alt özofagus halkalarında 12,5
mm çaplı baryum tabletleri veya krema değerlendirme amacıyla kullanılabilir. Bu
metodun dar lümenin daha doğru ölçülmesinde etkin olduğu gösterilmiştir (10,11).
Gastroözofagial reflülü hastalarda yüksek oranda bir hiatal herni bulunmaktadır (12).
Bu herniler en iyi pron pozisyonda görülür. Bu pozisyonda artmış karın içi basınç
herninin diafragma üzerinde yerleşimine katkıda bulunur. Bir hiatal herni varlığı
reflünün altta yatan patofizyolojisinde önemli bir etkendir. Büyük (>5 cm) veya
düzeltilemeyen
bir
hiatal
herni
özofagusta
kısalmaya
neden
olur.
Video
özofagogramda reflü kolayca görülemez. Klasik gastroözofagial reflü (GÖR)
semptomları bulunan çok az hastada mideye gelen baryumun retrograd özofagusa
gelmesiyle spontan reflü görülebilmektedir. Radyolog tarafından spontan reflünün
görülmesi gastroözofagial reflü hastalığının (GÖRH) çok güvenilir bir bulgusudur.
Bununla birlikte reflünün gözlemlenmemesi hastalığın olmadığı anlamına gelmez.
471
Barret
özofagusun
baryumlu
grafide
klasik
bulguları
sliding
hiatal
herni,
gastroözofagial reflü veya her ikisiyle de ilişkili olan aşırı özofagial striktür veya
ülserdir. Özofagial mukozada sayısız ufak baryum dolu oluklar veya çatlaklarla
karakterize retiküler patern de görülebilir (2).
Baryumlu özofagografi özofagus kanserinde özofagoskopiden sonra en önemli tanı
yöntemidir. Özofagus kanserinde yüksek sensitiviteye sahip olup hastaların
%59’unda hastalığı doğru bir şekilde teşhis etmektedir (13). Servikal bölge
tümörlerinde tanı güçtür. Polipoid ve stenotik tümörler düz, geniş kaideli lezyonlardan
daha kolay görülmektedir (2). Kardiyaya yakın tümörler disfajiye neden olan diğer
lezyonlarla karıştırılabilir. Radyolojik olarak lümende darlık, dilatasyon, dolma defekti
ve dantelasyon (4D bulgusu) görülebilir (14).
II. Bilgisayarlı Tomografi (BT)
BT özofagus lezyonu ile mediastinal yapılar arasındaki ilişkiyi değerlendirmede
kullanılır. Hava sıvı seviyesi, sıvı dolu lümen veya 10 mm’den daha fazla olan lümen
çapı obstruksiyon veya ciddi özofagus motilite bozukluğu olduğunu gösterir (Resim
37.9 a,b ve Resim 37.10) (2). Literatürde çeşitli özofagus hastalıklarının teşhisinde
BT’nin önemi belirtilmiştir. Örneğin özofagus duvarı veya perözofagial bölgedeki
varislerde endoskopik olarak kanıtlanan vakaların %85’i BT’de görülebilmektedir.
Özellikle özofagusun aksidental veya iatrojenik perforasyonun değerlendirilmesinde
BT oldukça kullanışlıdır (3,15).
Resim 37.9 a, b: Toraks BT’de hiatal herni görünümleri
472
Resim 37.10: Toraks BT’de özofagus divertikülü
Özofagus kanserinin tanısında bir tarama metodu değildir. Ancak özofagus
kanserinin değerlendirilmesinde ve preoperatif evrelendirilmesinde standart radyolojik
yöntemdir (Resim 37.11) (6). BT ile özofagial malignitenin intraluminal ve
ekstraluminal yayılımı hakkında fikir edinilir. İnvazyon varsa tesbit edilir. Lenf nodları,
akciğer, karaciğer ve sürrenal metastazları tespit etmede, özofagus duvar kalınlığı ve
tümör uzunluğunu belirlemede oldukça faydalıdır (14). Asimetrik duvar kalınlaşması
özofagus kanserinin major BT bulgusu olup nonspesifiktir. Çünkü BT özofagus
duvarını tanımlayamaz. Tis, T1 ve T2 tümörler arasında ayrım yapamaz.
Paraözofagial yağ dokusu görülemiyorsa T3 hastalıktan şüphelenilir. Endoskopik
ultrasonografi özofagus kanserinde T evresini belirlemede BT’den daha üstündür.
Bununla birlikte T4 hastalığı saptamada BT biraz daha başarılıdır (16).
Resim 37.11: Toraks BT’de özofagus alt uç tümörüne ait görünüm
473
Özofagus boyunca zengin lenfatik ağ bulunması ve bu organın serozasının
bulunmaması nedeniyle özofagus kanserinin teşhisinde %60-80 gibi büyük oranda
mediastinal ve ekstratorasik lenf nodu metastazı tespit edilmektedir. Supraklavikular
5 mm, retrokrural 6 mm, gastrohepatik ligamantta 8 mm ve periözofagial, diğer
mediastinal bölgeler veya üst abdomen bölgesinde 1 cm veya daha büyük lenf
nodlarında metastazdan şüphelenilir (17).
Özofagus kanserinde uzak metastazlar en sık karaciğer ikinci sıklıkta ise akciğere
olmaktadır (18,19). BT’nin hepatik metastazları saptamada sensitivitesi %76, pozitif
prediktif değeri ise %90 olarak bildirilmiştir (2).Yassı hücreli kanserli hastalarda
primer kanserin teşhisi esnasında soliter akciğer metastazlarının saptanması nadirdir.
Asit, plevral effüzyon ve omentum veya plevrada noduller varlığında bu mezotelyal
yüzeylere metastazdan şüphelenilir. Bu bulgular minimal invaziv laparoskopi ve
torakoskopi ile doğrulanabilir.
III. Magnetik Rezonans Görüntüleme (MRG)
Özofagus hastalıklarında spesifik bir endikasyonu bulunmamaktadır. MRG özofagus
görüntülenmesi için primer bir teknik olmamasına rağmen BT’ye alternatif bir teknik
olarak düşünülmelidir (14).
MRG ileri evre malignensilerin bölgesel rezektabilitesini değerlendirmede fayda
sağlar (Resim 37.12 a,b,c). Sonradan kombine kemoradyoterapi planlanmasında
yardımcı olur. Multiplanar MRG ile tümörün lonjitudinal uzanımı BT’den daha iyi
görülür (20). BT ve MRG görüntülemenin aort, trakeobronşial ağaç ve kalbe
invazyonu saptama kabiliyetleri göreceli olarak aynıdır. Standart MRG görüntüleme,
BT’ye benzer şekilde duvar katlarını ayırt edemediğinden dolayı duvar invazyonunun
derinliğini göstermez. MRG submukozadan (T1) muskularis tabakayı (T2) tutan
lezyonları ayırt edemez. Ancak çoğunlukla adventisyayı tutan tümörleri ayırt edebilir.
MR karaciğer metastazlarını saptamada BT’den daha hassastır (21).
474
Resim 37.12 a,b,c : Toraks MRI’de özofagus alt uç tümörüne ait görünümler
IV. Pozitron Emisyon Tomografi (PET)
Yaklaşık üç dekat önce onkoloji hastalarının görüntülenmesi için geliştirilen PET
günümüzde birçok kanserin görüntülenmesi ve evrelendirilmesinde başarı ile
kullanılmaktadır. Son zamanlarda özofagus kanserinde PET’in etkinliği saptanmıştır
(22).
Özofagus
kanserinde
Floro-2-deoksiglukoz
(FDG)
birikimi
%92-100
olarak
bildirilmiştir (23). Yapılan bir çalışmada FDG standard uptake değeri (SUV) 3’ten
büyük olan hastalarda sağ kalım oranı 3’ten küçük hastalardan daha düşük olarak
saptanmıştır (24). PET’in özofagial duvar veya paraözofagial dokuyu belirleyememesi
nedeniyle özofagus kanserinde T durumunu saptamada rolü sınırlıdır. PET ile T1b
veya daha büyük invazyon derinliği olan primer özofagus neoplazmları saptanabilir.
Ancak Tis ve T1a tümörler belirlenemez (25).
PET bitişik N1 hastalıktan primer tümörü ayırt edemez. Özofagus neoplazmları ile
karşılaştırıldığında akciğer kanserinde lenf nodu metastazlarını saptamada PET daha
üstündür. Özofagus kanserinde lenf nodu metastazını doğru saptama oranı %83 ile
%92,2 arasında bildirilmiştir (25–27).
PET uzak metastazları saptamada BT’den daha üstündür (28). Kolorektal, mide ve
özofagus kanserli hastalarda karaciğer metastazını saptamada PET, MRG, BT ve
ultrasonografi ile görüntülemede duyarlılık oranları sırasıyla; %90, %76, %72 ve %55
olarak bildirilmiştir (29).
Lokal olarak ilerlemiş özofagus kanserli hastalarda indüksiyon kemoterapi ve
radyoterapisine cevabı değerlendirmede PET anlamlı bulunmuştur (30–32).
475
Resim 37.13 a,b: PET-CT de özofagus alt uç tümörüne ait görünüm
V. Pozitron Emisyon Tomografi/Bilgisayarlı Tomografi (PET/BT)
Son zamanlardaki teknik ilerlemeler kombine PET ve BT geliştirilmesine yol açmıştır.
Bu metotla metabolik bozuklukların daha kesin lokalizasyonları mümkün olmaktadır
(Resim 13a,b). PET/BT’in maliyet problemi çözüldükten sonra tümörün evreleme
işleminde ilk basamak olacağı söylenebilir (22).
VI. Endoskopik Ultrasonografi (EUS)
EUS ile özofagusun normal katmanları kolayca görülür. Aorta görüntülerin uygun
yönlendirilmesi için kullanılır. İlgili lezyona odaklanmak için rutin üst endoskopi
gereklidir (33). Özofagus hastalıklarında esas uygulama alanı özofagus kanserinin
evrelendirilmesidir.
Tümör
infiltrasyon
derinliği
ve
lenf
nodu
tutulumlarını
belirlemesindeki üstünlüğü nedeniyle tümör evrelemesinde en güvenilir metottur (6).
Ayrıca mediasten ve komşu yapıların değerlendirilmesinde EUS faydalı bilgiler
vermektedir. EUS’de özofagus kanseri özofagusun normal 5 tabaka duvar katının
bozulmasıyla hipoekoik kitle olarak belirir. EUS duvar penetrasyon derinliği ve
tümörün periözofagial dokuya invazyonunu iyi bir şekilde saptar. EUS çevre yapılara
tümör invazyonunu gösterdiklerinden dolayı tedavi planlamasında da önemlidir (2).
EUS özofagus kanserinin lokal evrelendirilmesinde BT, MR veya PET’ten üstün
476
bulunmuştur. T evresini belirlemede EUS’nin doğruluk oranı %84 olarak bulunmuştur
(34).
EUS her zaman malign nodülleri benign nodüllerden ayıramamaktadır. N
evrelemesinde doğruluk oranı yaklaşık %77’dir (33). İnce iğne aspirasyon biyopsisi
ile EUS’nin klinik kullanımı genişlemiştir. Özofagus kanserinde bölgesel lenf
nodlarında EUS’nin ince iğne aspirasyon biyopsisi ile sensitivite, spesifite ve doğru
teşhis oranı %85’in üzerindedir. Benzer şekilde aynı işlemin çölyak lenf nodlarında da
sensitivitesi %85’in üzerindedir (33).
Özofagus kanserinin teşhisinde EUS için birkaç kısıtlama bulunmaktadır. Havanın
indüklediği akustik artefaktlar nedeniyle olası trakeobronşial ağacın invazyonu çok iyi
değerlendirilemez. Ayrıca alet, ilerlemiş malign stenozlarda pasajı geçemeyebilir. Bu
durumda
rutin
diagnostik
endoskopun
biyopsi
kanalından
yerleştirilebilen
mikroproblar (3-mm çaplı, 20 MHz) kullanışlıdır. Penetrasyon derinliğinin sınırlı
olması
nedeniyle
EUS
uzak
metastazların
saptanmasında
etkin
değildir.
Endosonografi kanserin lokal evrelemesi için BT’den oldukça üstündür. Ancak BT
karaciğer metastazlarının saptanmasında daha üstündür. EUS ile kemoradyoterapi
sonrası yeniden evreleme başarılı değildir. Tedavi sonrası fibrozis, inflamasyon ve
rezidüal tümör arasındaki net ayrımı yapamamaktadır (35).
Özofagus kanserinin yanında EUS’nin diğer özofagus hastalılarındaki rolleri de
gelişmektedir. Leiomyoma, lipoma, özofagusun duplikasyon kistleri, metastatik
kanser, lenfoma, bronşial karsinoma veya özofagusa dıştan bası yapan kitleler de
endosonografi ile belirlenebilmektedir (33).
VII. Sintigrafi
Gastroözofagial reflü 300-500 ml asidik portakal suyu içinde teknesyum 99m sulfur
kolloid karışımının oral alınmasından sonra sintigrafi ile tespit edilip kantitatif olarak
analiz edilebilir. Bu teknik özofagus motilite bozuklukları ve postoperatif özofagus
transit zamanının değerlendirilmesinde de kullanışlıdır (2).
VIII. Anjiografi ve girişimsel radyoloji
Özofagusun arterial ve venöz dolaşım kaynaklarının çeşitliliği bu organa anjiografik
metotların uygulanmasını kısıtlamaktadır. Sol gastrik veya splenik arterlerin seçilmiş
kataterizasyonu özofagial varisler veya Mallory-Weiss yırtıklarında kanamanın yerini
gösterebilir (36). Ayrıca kanama, vazokonstruktif ajanların transkatater infüzyonu
477
veya kontrollü embolizasyonla tedavi edilebilir. Portal venin ve dallarının perkütan
transhepatik kataterizasyonu kanayan gastroözofagial varislerin emboloterapisinde
yaygın olarak kullanılmaktadır. Transjugular intrahepatik portosistemik şant (TIPS)
rekürren varis hemorajilerinin tedavisinde yaygın olarak kullanılmaktadır (2).
Özofagoskopik inceleme
Endoskopiden önce elde edilen bir baryum grafisi endoskopist tarafından küçük
değişiklik olan lokalizasyonların dikkatli bir şekilde değerlendirilmesine imkân tanır.
Ayrıca servikal vertebral osteofit, özofagial divertikül, derin penetre ülser veya kanser
gibi potansiyel olarak tehlikeli noktalar için endoskopisti uyarır.
Değişik iç ve dış çaplarda endoskoplar rutin olarak kullanılmaktadır. Özofagoskopi
için en yaygın endikasyonlar; nonkardiyak göğüs ağrısı, ısrar eden GÖR
semptomları, tekrarlayan aspirasyon pnömonisi, disfaji, odinofaji ve anormal
özofagial radyografidir. Endoskopi için rölatif kontrendikasyonlar medikal unstabil
hastalar, unstabil servikal omurga, ciddi koagülopati ve bilinen veya şüphelenilen
gastrointestinal traktın perforasyonudur (33).
Elektif özofagoskopi rutin olarak ayaktan hastalara yapılmaktadır. İşlemden önce
genellikle 6-8 saatlik bir açlık peryodu gereklidir. Hasta şuuru açık olarak midazolam
veya diazepam ve fentanil ile sedatize edilir. Bazı endoskopistler ise hızla elimine
olmaları ve işlem sonrası iyileşme dönemini kısalttıklarından dolayı bilinçli
sedasyonda propofol kullanmayı savunmaktadır. Lidokain sprey genellikle lokal
orofaringial anestezi için kullanılmaktadır (37).
Endoskopi, GÖRH’nin tanı ve katman uzunluğunun belirlenmesinde çok önemlidir.
Bununla birlikte hastaların yarısında endoskopik özelliklere rastlanılmamaktadır. Son
zamanlarda GÖRH tedavisi için birkaç minimal invaziv endoskopik teknik
geliştirilmiştir.
Kontrollü
radyofrekans
enerjisi
uygulanması
ile
alt
özofagus
sfinkterinde kollajen kontraksiyonunda azalma tespit edilmiştir. Bu işlemle GÖRH’de
semptomların iyileştiği ve özofagusun asite maruziyetinin azaldığı gösterilmiştir (38).
Submukozal sütür veya plikasyonu içeren birkaç endoskopik teknik tanımlanmıştır.
Endoskopik özofagial endolüminal plikasyonun seçilmiş hastalarda güvenli ve faydalı
bir teknik olduğu gösterilmiştir (39). Tüm bu endoskopik tekniklerin GÖRH
tedavisinde faydalarına kesin hüküm verebilmek için daha fazla bilgi, daha uzun takip
478
ve randomize çalışmalara ihtiyaç bulunmaktadır. GÖRH’den şüphelenildiğinde
özofajit ve Barrett’in kolumnar hattı saptanmaya çalışılmalıdır. Gastroözefageal
bileşkenin proksimalinde en az 3 cm’lik bir squamöz epitelin kolumnar epitel ile yer
değiştirmesi veya gastroözofaeal bileşkenin yukarısında metaplastik epitelin varlığı
barret özofagus olarak tanımlanır (37–42). Barrett özofagusun kesin tanısı
endoskopik biyopsi ile konulur. Metaplastik mukozanın uzunluğu boyunca multipl
biyopsiler yapılmalıdır. Barrett özofagus ülserasyon, kanama, striktür oluşumu ve
malign dejenerasyona duyarlıdır (43). Erken histolojik bulgulardan sonra displazi
veya intramukozal adenokarsinom meydana gelebilmektedir (44). Kanser gelişme
riskinden dolayı periyodik takip ve biyopsi gereklidir.
Endoskopik biyopsi özofagus kanserinin kesin tanısı için gereklidir. Barrett özofagus
veya
tümörün
teşhisini
artırmak
için
çeşitli
boyalar
kullanılabilmektedir.
Kromoendoskopik teknikler düşük maliyete sahiptir. Ancak klinik uygulamada çok
fazla tercih edilmemektedir. En sık kullanılan boya %1 ve %2’lik Lugol solusyonları
olup nonkeratinize squamoz epitelyumda glikojene bağlanır. Ektopik mukoza, ülser,
kanser
ve
ciddi
displaziyi
içeren
glikojenin
tüketildiği
durumlarda
boya
tutulmayacaktır. Erken evre yassı hücreli özofagus kanserinin teşhisinde Lugol
boyamanın faydası gösterilmiştir (45). Metilen mavisi intestinal metaplazi geçiren
epitelde bulunup squamoz epiteli boyamamaktadır. Endoskopi esnasında metilen
mavisi püskürtülmesi Barrett mukozayı boyayacak ve yüksek grade displazinin
teşhisine imkân tanıyacaktır (46).
Özofagus kanseri riskinin yüksek olduğu bölgelerde tarama programları ile lezyonlar
erken dönemde tespit edilebilmektedir. Yassı hücreli özofagus kanseri erken
dönemde hastaların %50’sinde erozyon şeklinde, %25’inde mukozal kabartı şeklinde,
%13’ünde lokal eritem, konjesyon, mukozal düzensizlik ve %9’unda beyaz plaklar
şeklinde görülebilir (47).
Endoskopi akalazyanın teşhis ve tedavisinde temel teşkil etmektedir. Dikkat çeken
endoskopik özellikler genellikle gıda ve debrisle birlikte özofagial dilatasyondur. Alt
özofagus sfinkteri tipik olarak kapalıdır. Ancak hafif basınçla squamokolumnar
bileşkenin normal görünümüne izin verecek şekilde açılır. Endoskopi akalazyanın
klinik bulgularını taklit eden mide kardiya kanserinin dışlanmasında kritik öneme
sahiptir. Alt özofagus sfinkterinin pnömotik balon dilatasyonu akalazya tedavisinde
oldukça etkilidir. Yine endoskopik olarak alt özofagus sfinkterine botulinum toksin
479
enjeksiyonu akalazyalı hastaların çoğunda semptomların kısa süreli rahatlaması
sağlamaktadır (48,49).
Mallory-Weiss yırtığı, hiatal herni içindeki bir lezyon veya tümör gibi kardiyadaki
lezyonları görüntüleyebilmek için mide proksimalinde endoskop aleti %180 derece
retrofleksiyona getirilmelidir (33).
Özofagus varisleri en iyi endoskopi ile tanınır. Portal hipertansiyon ve özofagus varisi
olan hastalarda özofagoskopi hem teşhis hem de tedavide kullanılır. Özofagus
lümenine uzanan damarların yüzdesi ile endoskopik olarak varislerin büyüklüğünün
saptanması mümkündür. Varislerdeki kızarıklığın kanama için bir işaret olduğu
gösterilmiştir (50).
Alkali veya asidik madde içimine bağlı gelişen koroziv özofajitte ilk 6-12 saat içinde
özofagus, mide
ve
duodenumun
küçük çaplı endoskopla değerlendirilmesi
önerilmektedir. Perforasyona ait bulgular varsa endoskopi yapılmamalıdır (47).
Teşhis yanında birçok olguda tedavi amacıyla endoskopi kullanılmaktadır. Bunlar;
striktür ve akalazya dilatasyonu, botulinium toksin enjeksiyonu,
yabancı cisim
çıkartılması, stent yerleştirilmesi, varis skleroterapisi, lazer tedavi, varis dışı
kanamaların kontrolü ve yüzeyel tümörlerin mukozal rezeksiyonudur. Endoskopik
büyütme, optik uyumlu tomografi ve çeşitli spektroskopik teknikler özofagus
kanserinin teşhisinde gelişmelere yol açmıştır (4,5,8,33,51,52).
Diagnostik özofagoskopide önemli komplikasyon riski 1/1000, mortalite riski ise
1/10000’ dir. Tecrübe yetersizliği, uyumsuzluk ve aşırı sedasyon komplikasyona en
sık neden olan faktörlerdir. Görülebilen başlıca komplikasyonlar; ilaç reaksiyonu,
vazovagal reaksiyon, aritmi, kardiyak iskemi, pulmoner aspirasyon, kanama,
perforasyon, enfeksiyon ve mortalitedir (47).
Bronkoskopi
Trakea ve ana bronşlarla komşuluğu olan özellikle rezeksiyon planlanan özofagus
kanserli bütün hastalarda bronkoskopik muayene gereklidir. Bronkoskopide hava yolu
invazyonunun erken bulguları ödem, mukozanın kabarıklığı ve frajil yapıdır (14).
Ayrıca ileri evre özofagus kanserinin trakebronşial sisteme fistülü bronkoskopi ile net
bir şekilde değerlendirilebilir (52).
480
Özofagial manometre
Benign özofagial bir hastanın değerlendirilmesinde özofagusun kontraktabilite ve
sfinkter
fonksiyonunun
incelenmesi
esas
teşkil
etmektedir.
Sabit
özofagial
manometre; kontraksiyon basıncı, özofagus gövdesinin dalga formu ve istirahat
basıncını ölçmek ve sfinkterlerin yutmaya cevabını değerlendirmek amacıyla
özofagus içine genellikle 5 cm aralıklı olarak basınç algılayıcı portları içeren bir
kataterin yerleştirilmesiyle oluşturulur (53). Manometre ile üst ve alt özofagus
sfinkterlerinin basıncı, birbirini izleyen kasılmaların koordinasyonu, etkinliği ve
anormal kontraksiyonlar kaydedilir.
Manometre disfaji, odinofaji, mide ekşimesi, göğüs ağrısı ve regürjitasyon
semptomları ile özofagun motor bozukluğundan şüphelenildiğinde endikedir.
Özofagial manometre özellikle akalazya, diffüz özofagial spazm, nutcracker özofagus
ve hipertansif alt özofagus sfinkteri gibi spesifik primer özofagus motilite
bozukluklarının
teşhisinin
doğrulanması
için
gereklidir
(54).
Ayrıca
GÖRH,
skleroderma, dermatomyozit, polimyozit, miks konnektif doku hastalığı gibi sistemik
hastalıklardan kaynaklanan inefektif özofagial motilitenin belirlenmesinde de
kullanılabilir. Semptomatik GÖRH’li hastalarda özofagial manometre mekanik olarak
defektif alt özofagus sfinkterini belirleyip özofagus gövde kontraksiyonlarının
genişliğini ve dalga formunun yeterince değerlendirilmesini sağlayabilir (53).
Özofagial manometri özofagusun sfinkter tonusu hakkında bilgi vermesine rağmen bu
basıncın reflüye neden olup olmadığını göstermede yetersizdir (55).
481
24-saatlik pH monitorizasyonu
GÖR teşhisinde; baryumlu özofagografi, Bernstein’in asid infüzyon testi, endoskopi,
24 saatlik pH ölçümü ve radionüklid sintigrafi kullanılan yöntemlerdir. GÖR tanısında
pH monitorizasyonu altın standart olarak kabul edilmekte olup sensitivitesi %90,
spesifitesi ise %98’dir (55–57).
Manometri, endoskopi ve biyopsi reflünün indirekt bulgularını gösterirken baryumlu
özofagografi,
pH
monitorizasyonu
ve
sintigrafi
reflüyü
direkt
olarak
saptayabilmektedir (58). 24 saatlik pH monitörizasyonunun diğer bütün tanı testlerine
karşı üstünlüğü, reflüyü
kantitatif olarak ölçmesidir. Özofagusa yerleştirilen
kateterden her 3-4 saniyede bir alınan pH değerleri monitör tarafından 24 saat
boyunca kaydedilir (59). Normal bireylerde intraözofagial pH 5’ in üzerindedir. pH’ nın
4’ ten küçük olması asit sıvısının özofagusa reflüsünü gösterir (60).
24-saatlik pH monitorizasyonunun geliştirilmesi ile GÖRH’ nin patofizyolojisinin
çözülmesinde büyük ilerlemeler olmuştur. Klasik GÖR semptomları olup endoskopik
değerlendirmede reflü özofajit saptanan hastalarda, tedaviye yanıt alınmışsa pH
monitörizasyonuna gerek yoktur (61). 24-saatlik pH monitorizasyonu özellikle
antireflü cerrahi düşünülen hastalarda önem arzetmektedir. GÖRH’nin atipik
görünümlerinde dahi yaygın bir endikasyondur. Bunlar nonkardiyak göğüs ağrısı,
dispne, öksürük, nakturnal wheezing ve kronik ses kısıklığı gibi respiratuar
semptomlardan oluşmaktadır. Kronik öksürük, ses kısıklığı veya pulmoner aspirasyon
gibi semptomları olan hastalarda proksimal özofagus kısmı veya farinkse ilave bir pH
elektrodu yerleştirmek faydalı olabilir.
Bernstein testi (asit perfüzyonu)
Özofagusun asite duyarlılığını ölçen bir testtir. Göğüs ağrısının asit reflüsüne bağlı
olup olmadığını araştırmak için yapılır. İşlem esnasında distal nazogastrik sondadan
önce 15 dakika süreyle serum fizyolojik, sonra 6 ml/dakika hızda semptom oluşana
kadar veya 45 dakika süreyle 0.1 N HCI infüzyonu yapılır. Asitle birlikte retrosternal
yanma ve ağrı oluşması testin pozitif olduğunu gösterir. Spesifite ve sensitivitesi
sınırlı bir testtir (62).
KAYNAKLAR
1.
Stark P, Thordarson S, McKinney M. Manifestations of esophageal disease on
plain chest radiographs. AJR 1990; 155: 729–34.
482
2.
Gore RM, Yaghmai Y, Ghahremani GG. Radiologic Evaluation of the
Esophagus. In Shields TW, LoCicero J, Ponn RB, Rusch VW, ed. General Thoracic
Surgery, vol 2, 6th ed. Philadelphia: Lippincott Williams and Wilkins; 2005:1939–
1955.
3.
Eroglu A, Turkyilmaz A, Aydin Y, et al. Current management of esophageal
perforation: 20 years experience. Dis Esophagus. 2009; 22: 374–380.
4.
Türkyılmaz A, Aydın Y, Yılmaz Ö, et al.
Özofagus yabancı cisimleri: 188
olgunun analizi. Ulus Travma Acil Cerrahi Derg 2009; 15: 222–227.
5.
Türkyılmaz A, Aydın Y, Genç F, Eroğlu A. Çocuklarda özefagusa yabancı cisim
kaçması sıklığını artıran etken: Alkalen piller. Türk Göğüs Kalp Damar Cer Derg
2008; 16: 250-253.
6.
Tüney D. Tanısal işlemler: A) Özofagus radyolojisi. In Yüksel M, Başoğlu A. ed.
Özofagus Hastalıklarının Tıbbi ve Cerrahi Tedavisi. 2002: 21–46.
7.
Dodds WJ. Current concepts of esophageal motor function: clinical implications
for radiology. AJR Am J Roentgenol 1977; 128: 549–561.
8.
Turkyilmaz A, Eroglu A, Aydin Y, et al. The management of esophagogastric
anastomotic leak after esophagectomy for esophageal carcinoma. Dis Esophagus.
2009; 22: 119–26.
9.
Buecker A, Wein BB, Neuerburg JM, Guenther RW. Esophageal perforation:
comparison of use of aqueous and barium-containing contrast media. Radiology
1997; 202: 683–6.
10. Ghahremani GG, Weingardt JP, Curtin KR, Yaghmai V. Detection of occult
esophageal narrowing with barium tablet during chest radiography. Clin Imaging
1996; 20: 184–190.
11. Ott DJ, Kelley TF, Chen MY, Gelfand DW. Evaluation of the esophagus with a
marshmallow bolus: clarifying the cause of dysphagia. Gastrointest Radiol 1991; 16:
1–4.
12. Schwizer W, Hinder RA, DeMeester TR. Does delayed gastric emptying
contribute to gastroesophageal reflux disease? Am J Surg 1989; 157: 74–81.
13. Drudi FM, Trippa F, Cassone F, et al. Esophagogram and CT vs endoscopic
and surgical specimens in the diagnosis of esophageal carcinoma. Radiol Med
(Torino) 2002; 103: 344–52.
14. Ökten İ. Özofagus Kanserleri. In Ökten İ, Güngör A. Göğüs Cerrahisi, Cilt-II.
2003: 1247–1308.
483
15. Ghahremani GG. Esophageal trauma. Semin Roentgenol 1994; 29: 387–370.
16. Riedel M, Stein HJ, Mounyam L, et al: Predictors of tracheobronchial invasion of
suprabifurcal oesophageal cancer. Respiration 2000; 67: 630–637.
17. Wu LF, Wang BZ, Feng JL, et al. Preoperative TN staging of esophageal
cancer. Comparison of miniprobe ultrasonography, spiral CT and MRI. World J
Gastroenterol 2003; 9: 219–24.
18. Turkyilmaz A, Eroglu A, Aydin Y, Karaoglanoglu N. The relationship of serum
CEA and CA 19–9 levels to liver metastasis and pancreatic invasion in esophageal
cancer. Turk J Med Sci 2009; 39: 895–899.
19. Turkyilmaz A, Eroglu A, Aydin Y, et al. Survival in esophageal cancer patients
with hematogenous distant organ metastases. Turk J Med Sci 2009; 39: 415–421.
20. Giovagnoni A, Valeri G, Ferrara C. MRI of esophageal cancer. Abdom Imaging
2002; 27: 361–366.
21. Balzarini L, Potepan P, Musumeci RN. Diagnosis and staging of esophageal
carcinoma by magnetic resonance imaging. In Meyers MA, ed. Neoplasms of the
Digestive Tract: Imaging, Staging, and Management. Philadelphia: Lippincott-Raven.
1998: 49–59.
22. Antoch G, Freudenberg LS, Stattaus J, et al. Whole-body positron emission
tomography-CT: optimized CT using oral and IV contrast materials. AJR 2002; 179:
1555–1560.
23. Wallace MB, Nietert PJ, Earle C, et al. An analysis of multiple staging
management strategies for carcinoma of the esophagus: computed tomography,
endoscopic
ultrasound,
positron
emission
tomography,
and
thoracoscopy/laparoscopy. Ann Thorac Surg 2002; 74: 1026–1032.
24. Kato H, Kuwano H, Nakajima M, et al. Usefulness of positron emission
tomography for assessing the response of neoadjuvant chemoradiotherapy in
patients with esophageal cancer. Am J Surg 2002; 184: 279–283.
25. Himeno S, Yasuda S, Shimada H, et al. Evaluation of esophageal cancer by
positron emission tomography. Jpn J Clin Oncol 2002; 32: 337–346.
26. Choi JY, Lee KH, Shim YM, et al. Improved detection of individual nodal
involvement in squamous cell carcinoma of the esophagus by FDG-PET. J Nucl Med
2000; 41: 808–815.
484
27. Kato H, Kuwano H, Nakajima M, et al. Comparison between positron emission
tomography and computed tomography in the use of the assessment of esophageal
carcinoma. Cancer 2002; 94: 921–928.
28. Flamen P, Lerut A, Van Cutsem E, et al. Utility of positron emission tomography
for the staging of patients with potentially operable esophageal carcinoma. J Clin
Oncol 2000; 18: 3202–3210.
29. Kinkel K, Lu Y, Both M, et al. Detection of hepatic metastases from cancers of
the gastrointestinal tract by using noninvasive imaging methods (US, CT, MR
imaging, PET): a meta-analysis. Radiology 2002; 224: 748–756.
30. Brucher BL, Weber W, Bauer M, et al. Neoadjuvant therapy of esophageal
squamous cell carcinoma: response evaluation by positron emission tomography.
Ann Oncol 2001; 233: 300–309.
31. Flamen P, Lerut A, Van Cutsem E, et al. The utility of positron emission
tomography for the diagnosis and staging of recurrent esophageal cancer. J Thorac
Cardiovasc Surg 2000; 120: 1085–92.
32. Flamen P, Van Cutsem E, Lerut A, et al. Positron emission tomography for
assessment of the response to induction radiochemotherapy in locally advanced
oesophageal cancer. Ann Oncol 2002; 13: 361–368.
33. Vanagunas AD, Srivastava A. Endoscopy of the Esophagus. In Shields TW,
LoCicero J, Ponn RB, Rusch VW, ed. General Thoracic Surgery, vol 2, 6th ed.
Philadelphia: Lippincott Williams and Wilkins; 2005: 1956–1968.
34. Rosch T. Endosonographic staging of esophageal cancer: a review of literature
results. Gastrointest Endosc Clin N Am 1995; 5: 537–547.
35. Zuccaro G Jr, Rice TW, Goldblum J, et al. Endoscopic ultrasound cannot
determine suitability for esophagectomy after aggressive chemoradiotherapy for
esophageal cancer. Am J Gastroenterol 1999; 94: 906–912.
36. Nemcek AA, Vogelzang RL. Angiography and interventional radiology of the
hollow viscera. In Gore RM, Levine MS, ed. Textbook of Gastrointestinal Radiology,
2nd Ed. Philadelphia: WB Saunders, 2000: 98–143.
37. Sorbi D, Gostout CJ, Henry J, Lindor KD.
Unsedated small-caliber
esophagogastroduodenoscopy (EGD) versus conventional EGD: a comparative
study. Gastroenterology 1999; 117:1301–1307.
485
38. Triadafilopoulos G, DiBaise JK, Nostrant TT, et al. The Stretta procedure for the
treatment of GERD: 6 and 12 month follow-up of the U.S. open label trial.
Gastrointest Endosc 2002; 55: 149–156.
39. Filipi CJ, Lehman GA, Rothstein RI, et al. Transoral, flexible endoscopic
suturing for treatment of GERD: a multicenter trial. Gastrointest Endosc 2001; 51:
416–422.
40. Chandrasoma P. Norman Barrett: so close, yet 50 years away from the truth. J
Gastrointest Surg 1999; 3: 7–14.
41. Salo JA, Kivilaakso EO, Kiviluoto TA, et al. Cytokeratin profile suggests
metaplastic epithelial transformation in Barrett’s oesophagus. Ann Med 1996; 28:
305–309.
42. Sawney RA, Shields HM, Allan CH, et al. Morphological characterization of the
squamocolumnar junction of the esophagus in patients with and without Barrett’s
epithelium. Dig Dis Sci 1996; 41: 1088–1098.
43. Hameeteman
W, Tytgat
GNJ, Houthoff
HJ, et
al. Barrett’s
esophagus:
development of dysplasia and adenocarcinoma. Gastroenterology 1989; 96: 1249–
1256.
44. Zhuang Z, Vortmeyer AO, Mark EJ, et al. Barrett’s esophagus: metaplastic cells
with loss of heterozygosity at the APC gene locus are clonal precursors to invasive
adenocarcinoma. Cancer Res 1996; 56: 1961–1964.
45. Yokoyama A, Ohmori T, Makuuchi H, et al. Successful screening for early
esophageal cancer in alcoholics using endoscopy and mucosa iodine staining.
Cancer 1995; 76: 928–934.
46. Canto MIF. Esophageal cancer screening by chromoendoscopy. Techniques
Gastrointest Endosc Esophagea Neoplasm 1999; 1; 50–52.
47. Bektaş A. Tanısal işlemler: B) Özofagoskopi. In Yüksel M, Başoğlu A. ed.
Özofagus Hastalıklarının Tıbbi ve Cerrahi Tedavisi. 2002: 47–58.
48. Annese V, Bassotti G, Coccia G, et al. Comparison of two different formulations
of botulinum toxin A for the treatment of oesphageal achalasia. The Gismad
Achalasia Study Group. Aliment Pharmacol Ther 1999; 13: 1347–1350.
49. Wehrmann T, Schmitt T, Dietrich CF, et al. Manometrically-guided endoscopic
injection of botulinum toxin for esophageal achalasia: a pilot trial. Z Gastroenterol
2000; 38: 899–903.
486
50. Beppu K, Inokuchi K, Koyanagi N, et al. Prediction of variceal hemorrhage by
esophageal endoscopy. Gastrointest Endosc 1981; 37: 213–218.
51. Eroğlu A, Türkyılmaz A, Aydın Y. Özofagus Hastalıklarında Stent Uygulamaları.
Turkiye Klinikleri J Thor Surg-Special Topics 2009; 2: 95–99.
52. Turkyilmaz A, Aydin Y, Eroglu A, et al. Palliative management of
esophagorespiratory fistula in esophageal malignancy. Surg Laparosc Endosc
Percutan Tech. 2009;19: 364–367.
53. Ulusoy NB. Tanısal işlemler: C) Özofagus motilitesi ve manometrisi. Yazarlar:
Yüksel Mustafa, Başoğlu Ahmet. Özafagus Hastalıklarının Tıbbi ve Cerrahi Tedavisi.
İstanbul: Bilmedya Grup, 2002: 59–70.
54. Benjamin
SM, Richter
JE,
Cordova
CM, et
al. Prospective
manometric
evaluation with pharmacologic provocation of patients with suspected esophageal
motility dysfunction. Gastroenterology 1983; 84: 893–901.
55. Grossi l, Ciccaglione AF, Travaglini N, Marzio L. Transient lower esophageal
sphincter relaxations and gastroesophageal reflux episodes in healthy subjects and
GERD patients during 24 hours. Dig Dis Sci. 2001;46: 815–821.
56. Fass R, Hell R, Sampliner RE, et al. Effect of ambulatory 24-hour esophageal
pH monitoring on reflux-provoking activities. Dig Dis Sci 1999; 44: 2263–2269.
57. Skinner DB. Pathophysiology of gastroesophageal reflux. Ann Surg 1985; 202:
546–556.
58. Treves ST. Gastroesophageal reflux, eosophageal transit, gastric emptying, and
pulmonary aspiration. Pediatric Nuclear Medicine (2nd edition) Ed. Treves ST. New
York: 1995: 430–438.
59. Bianchi Porro G, Pace F: Comparison of three methods of intraesophageal pH
recordings in the diagnosis of gastroesophageal reflux. Scand J Gasytoenterol 1988;
23: 743–750.
60. Jhonson LF. Historical perspective on esophageal pH monitoring. Ambulatory
esophageal pH monitoring. Practical approach and clinical applications. Igakushion
Med Publ Inc. New York1991:1–12.
61. Castell DO. pH monitoring versus other test for gastroesophageal reflux
disease: is this the gold standart? Ambulatory esophageal pH monitoring. Practical
approach and clinical applications. Igakushion Med Publ Inc. New York 1991:101–
113.
487
62. Gülşen M, Dağalp K, Gürbüz AK, et al. Gaströzafageal reflü hastalığı düşünülen
kişilerde bernstein testi ile endoskopik ve histopatolojik inceleme sonuçlarının
karşılaştırılması. Gastroenteroloji 1994; 5: 49–53.
488
38.
Prof. Dr. Ahmet Başoğlu ve Yrd. Doç. Dr. Burçin Çelik
Ondokuz Mayıs Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
ÖZOFAGUSUN NÖROMUSKULER BOZUKLUKLARI
Özofagusun görevi; bir taraftan yutulan gıdaları farenksten mideye taşımak ve diğer
taraftan mide içeriğinin geri gelmesini önlemektir. Sindirim kanalının diğer
kısımlarının aksine özofagusta önemli ölçüde salgı ve absorbsiyon fonksiyonu yoktur.
Böyle olunca organın fizyolojik aktivitesi motor aktiviteden ve fonksiyonu ise yutulan
maddelerin farenksten mideye taşınmasından ibarettir.
Özofagus motilite bozuklukları uzun yıllardır bilinmesine rağmen etiyolojisi ve
fizyopatolojisi tam olarak aydınlatılmamış bir hastalık grubudur. Son yıllarda bu
hastalıkların fizyopatolojilerine yönelik oldukça fazla çalışma yapılmaktadır, çünkü bu
bozuklukların tedavisinin başarılı olunabilmesi için fizyopatolojilerinin tam olarak
anlaşılması gereklidir.
Özofageal motilite bozuklukları özofagus sfinkterlerinin veya özofagus gövdesinin
normal kas hareketlerinin bozulması sonucu meydana gelebilir. Bu durumda ortaya
çıkan semptomlar genellikle benzerdir. Bu yakınmalarla başvuran hastalarda
öncelikle yapılması gereken baryumlu özofagus mide pasaj grafisidir. Daha sonra
yapılması gereken tetkik endoskopidir, endoskopinin yeri tanıda az olsa da, tedavinin
ve sonuçlarını takibinde önemlidir. Motor hastalıkların tanısı için belki en önemli tetkik
özofagus lümeninde değişik seviyelerde yapılan manometrik basınç ölçümleridir.
Bunun dışında sintigrafik çalışmalarla özofagus geçiş zamanı ve gastroözofageal
reflü saptanabilir. Bilgisayarlı tomografi, manyetik rezonans görüntüleme, özofageal
ultrasonografi ayırıcı tanıda kullanılabilecek diğer tetkiklerdir.
Özofagus motilite bozukluklarını anatomik yapı ve fizyolojik durum dikkate alınarak
incelenmektedir (Tablo 38.1).
489
Tablo 38.1: Özofagusun primer ve sekonder motor bozuklukları
A) Primer motor bozukluklar
1. Akalazya
2. Diffüz özofajiyal spazm
3. Nutcracker özofagus
4. Hipertansif alt özofagus sfinkteri
5. Nonspesifik özofajiyal motor bozuklukları
B) Sekonder motor bozukluklar
1. Kollajen hastalıklar
Skleroderma
Sistemik lupus eritamatosus
Polimyozit ve dermatomyozit
2. Periferal nöropati
Diabetik nöropati
Alkolik nöropati
3. Enfeksiyöz özofajit
Parazitik (Chagas’ hastalığı)
Viral (Behçet hastalığı)
Faringeal ve krikofaringeal bozukluklar
Bu grup hastalıkların mekanizması oldukça karışıktır. Üst özofagus sfinkteri normal
yutma sırasında lokmanın özofagusa geçebilmesi için gevşer ve mide içeriğinin
hipofarenkse geçmesini engellemek için de diğer zamanlarda kapalı kalır. Üst
özofagus sfinkterini çizgili kas yapısındaki krikokfaringeus adelesi oluşturur. Sempatik
innervasyonu sempatik gangliondan, parasempatik innervasyonu ise N.vagus,
N.rekürrens, N.glossofaringeus’tan alır. Santral sinir sistemi hastalıkları ile orofarenks
ve tiroid ameliyatları gibi bölgenin sinirsel innervasyonunu bozan girişimler üst
sfinkterde bozukluklara neden olabilirler.
Bu bölge bozukluklarında sınıflama nörojenik, miyojenik, yapısal ve iyatrojenik
şeklinde yapılmaktadır.
Nörojenik disfaji
Beyin kanaması, enfarktüs ve emboli geçiren yaşlı hastalarda yutma güçlüğü
gelişebilir. Bunun nedeni, farenks adelelerindeki zayıflık ve/veya paralizisi nedeniyle
yutmadaki koordinasyonun bozulmasıdır. Spesifik bir tedavisi yoktur, hastalar bazen
hiçbir şeyi yutamaz hale gelirler bu durumda miyotomi uygulanabilir.
Miyojenik disfaji
Myastenia gravis miyonöronal impulsun geçişindeki yetersizlikle karakterizedir.
Özellikle bulber formunda farenks, krikofarenks ve özofagusun üst bölümündeki
490
çizgili kaslar etkilenir. Disfaji en önemli semptomdur ve sabahları daha hafif iken
günün ilerleyen saatlerinde daha fazladır. Manometrik değerlendirmenin değeri
yoktur. Medikal tedavide antikolinesterazlar kullanılır, timektomi yararlı olabilir.
Krikofaringeal disfonksiyon (Bar, akalazya)
Krikofaringeal bar, radyolojik bir terimdir ve üst özofagus sfinkterinde öne doğru
çentiklenme ve daralma gözlenir. Manometrik olarak basınç yükselmesi saptanırsa
miyotomi endikedir. Krikofaringeal akalazya ise alt özofagus akalazyasından farklıdır,
çünkü burada ganglion hücrelerinde dejenerasyon yoktur. Manometrik olarak basınç
yüksektir ve belirgin kas hipertrofisi vardır. Yutmaya karşı kas gevşeyememektedir,
bu durumdu miyotomi endikasyonu vardır.
Faringoözofageal divertikül (Zenker Divertikülü)
Özofagus divertikülleri arasında en sık görülenidir. Özofagus girişindeki fonksiyonel
bozukluk ana sebeptir. Farenksin özofagus ile birleştiği yerde, farenksin inferior
konstriktör kasının oblik lifleri ile krikofaringeal kasın transvers lifleri arasında kalan
zayıf alanda (Killian üçgeni) oluşur. Zenker divetikülü pulsiyon divertikülü tipinde olup
duvarları mukoza ve submukozdan oluşmaktadır.
Genellikle 50 ve daha ileri yaşlarda görülür. Sıklıkla erken dönemde semptom
verirler. Disfaji, faringooral ve faringonazal regürjitasyon, ağız kokusu ve beraberinde
trakeal aspirasyon başlıca semptomlardır. Divertikül bazen boyunda palpe edilebilir.
Dev divertiküllerin palpasyonunda divertikül içersindeki sıvı ve katı gıdalar nedeniyle
gurultu hissedilir.
Tanı baryumlu özofagus pasaj grafi ile konulur. Endoskopik muayene yapılabilir.
Faringozöofageal divertikülün tedavisi cerrahidir. Tanı konulduğunda aspirasyon riski
ve perforasyon riskine karşılık cerrahi müdahale hemen yapılmalıdır. Tedavide
krikofaringeal miyotomi ile birlikte divertikülektomi uygulanmalıdır.
Orofaringeal disfajiye neden olan diğer durumlar
İyatrojenik nedenler en başta gelen sebeplerdir, servikal bölgeye yapılan her türlü
cerrahi girişim (Trakeostomi, boyun diseksiyonu, larinjektomi vb.) disfajiye neden
olabilir. Gastroözofageal reflü de diğer nedenler arasındadır, diğer semptomlar
orofaringeal disfaji, astım ve göğüs ağrısıdır. Yirmi dört saatlik pH monitorizasyonu ile
tanı konulmalıdır.
491
Özofagus divertikülleri
Özofagus divertikülleri, özofagusun herhangi bir seviyesinde lümenden dışarı doğru
cep şeklinde çıkıntı yapan, iç yüzü tamamen epitelle döşeli oluşumu ifade eder.
Özofagus divertiküllerinin tamamına yakını akkizdir, konjenital divertiküller çok nadir
görülür. Fizyopatolojik mekanizmalarına göre, divertiküller genellikle traksiyon ve
pulsiyon divertikülleri şeklinde 2 grupta sınıflandırılır.
Traksiyon (Gerçek) divertikülü
Özofagusa komşu yapılardaki inflamasyon sonucu gelişen fibrozisin çekme etkisi ile
oluşmuş ve özofagus duvarının tüm katlarını içeren divertiküllerdir. En çok
trakeobronşiyal bölgede kronik granülamatöz hastalıklardaki lenfadenopatilere ait
fibrotik yapışıklıklar nedeniyle oluşur.
Pulsiyon (Psödodivertikül) divertikülü
Özofagus kas tabakasının zayıf bir noktasından, lümen içindeki artmış basıncın
itmesiyle meydana gelir ve bu nedenle divertikül duvarını sadece mukoza oluşturur.
En çok faringoözofageal ve epifrenik bölgede bulunur.
Divertiküller anatomik lokalizasyonlarına göre üç gruba ayrılırlar:
Faringoözofageal (Zenker) divertikülü
Özofagus üst ucunda faringoözofageal bileşkede bulunun pulsiyon divertikülüdür.
Parabronşiyal divertikül
Divertikül
duvarında
özofagusun
tüm
tabakalarının
bulunduğu
traksiyon
divertikülleridir, genellikle özofagus 1/3 orta bölümünde bulunur ve olguların büyük
kısmında belirti vermez. Herhangi bir nedenle yapılan radyolojik tetkik esnasında
tesadüfen saptanırlar. Genellikle tüberküloz ve histoplasmozis gibi granülamatöz
hastalıkların komplikasyonu olarak ortaya çıkar.
Semptomlar nadirdir; yutma güçlüğü, retrosternal ağrı, nefeste kokma ve dispeptik
yakınmalar olabilir. Nadiren trakeobronşiyal fistül ya da özofagus ile büyük damarlar
arasında fistül gelişebilir. Yakınmaları hafif olan hastalarda cerrahi tedavi gerekmez,
bu hastalarda diyetin düzenlenmesi ve medikal tedavi yeterlidir. Divertikülit, kanama,
abse, fistül gibi komplikasyon gelişmiş divertiküllerde cerrahi tedavi gerekir.
Epifrenik divertikül
492
Özofagusun 1/3 alt kısmında diafragmanın üzerindeki yaklaşık 10 cm’lik özofagus
segmentinde bulunan, pulsiyon tipinde divertiküllerdir. Daha çok orta ve ileri yaşlarda
görülür. Hastaların çoğu asemptomatiktir, az sayıda hastada ilerleyici yutma güçlüğü,
retrosternal ağrı ve yanma hissi, gıdaların birikmesi, regürjitasyon ve aspirasyon
belirtileri vardır. En önemli tanı yöntemi baryumlu özofagus pasaj grafisidir.
Endoskopi
beraberinde
özofajit
veya
malign
bir
durum
ihtimaline
karşın
uygulanmalıdır. Asemptomatik hastalarda cerrahi tedavi gerekmez, hafif semptomları
olan hastalara diyet düzenlenmesi ve medikal tedavi verilir. İleri derecede yakınması
olan hastalara cerrahi tedavi uygulanmalıdır, seçilecek yöntem divertikülektomi ve
gereken olgularda miyotomi de eklenmelidir.
Özofagusun primer motor bozuklukları
Darlık ya da kardiya tümörü gibi nedenlerle ilişkisi olmayan, nörolojik, kas ya da
sistemik hastalıkların yol açmadığı motilite bozukluklarına primer özofagus motor
hastalıkları denilmektedir.
Akalazya
Özofagus gövdesinin peristaltik hareketlerinde azalma ya da kaybolma, istirahat
halinde alt sfinkter basıncında yükselme ve yutmaya karşı cevapta azalma ile
karakterli bir motilite bozukluğudur. Etiyolojisi tam olarak bilinmemekle beraber, bazı
çalışmalarda Auerbach pleksusunda bulunan ganglion hücrelerinde azalma ya da
değişiklik saptanmıştır.
Bu hastalığın 3 önemli özelliği vardır:
1)Yutmaya cevap olarak alt özofagus sfinkterinin gevşeyememesi.
2)Alt özofagus sfinkterinde istirahat basıncının normalden çok yüksek olması.
3)Özofagus gövdesinde peristaltizmin kaybolması ve aşırı dilatasyonu.
Hastalarda görülen başlıca semptomlar; disfaji, regürjitasyon ve kilo kaybıdır.
Semptomlar hastalığın süresine ve özofagustaki dilatasyonun derecesine göre
değişiklik gösterir. Özofagus dilate olduğu için ve gıdaların birikerek ağırlığı ile yer
çekimi yardımıyla mekanik olarak mideye geçiş olabilir. Bu nedenle paradoksal disfaji
denilen sulu gıdaların yutma zorluğu akalazyada daha belirgindir.
493
Akalazyanın başka bir tipinde yutma güçlüğü ile birlikte spazm tarzında ağrı vardır.
Özofagusta minimal dilatasyon, alt sfinkter basıncını yenemeyen zayıf peristaltik
hareketler ve belirgin tersiyer kontraksiyonlar vardır, bu tipe “vigorous akalazya” adı
verilmektedir.
Akalazyanın şiddeti baryumlu grafide özofagus dilatasyonunun derecesi ile ölçülür ve
3 gruba ayrılır:
Evre I- (minimal) özofagusun çapı 4 cm’den küçük.
Evre II- (orta derecede) özofagus çapı 4–6 cm arasında.
Evre III- (şiddetli) özofagusun çapı 6 cm’den daha geniş.
Akalazyanın tanısında en önemli tanı yöntemleri özofagus baryumlu pasaj grafisi,
endoskopi ve manometredir. Akalazya tanısı baryumlu grafi ile kolayca konulabilirken
beraberinde olabilecek distal özofagus darlığı veya kardiya karsinomu gibi durumların
tespitinde endoskopik muayene önemlidir. Radyolojik olarak özofagusun huni
şeklinde dilate ve distalinde kuş gagası gibi daralmış olması tipiktir. Manometrik
inceleme ile alt özofagus sfinkter basıncının normalin 2 katına kadar artmış olması,
katı ve sulu gıdalarla yutmaya karşı sfinkterdeki gevşeme cevabının azalması ve
kontraksiyon şiddetinde zayıflama ile tanı kesinleştirilir.
Akalazyada başarılı bir tedavi önce doğru bir tanı konulmasına ve sonra da uygun bir
tedavi yönteminin seçilmesine bağlıdır. Akalazya tedavisi 3 bölümde incelenebilir;
medikal tedavi, bujinaj ve dilatasyon ve cerrahi tedavi. Medikal tedavide düz kas
gevşetici ajanlardan (Nifedipin, isosorbit dinitrat, nitrogliserin, aminofilin) yararlanılır.
Bu ilaçların uzun süre kullanımının gerekmesi yan etkilerinden dolayı günümüzde pek
tercih edilmemektedir. Alt özofagus sfinkter basıncını azaltabilmek için endoskopik
yolla botulinum toksin enjeksiyonu uygulanabilir.
Semptomları hafif veya orta dereceli olan akalazya olgularında esas tedavi yöntemi
olarak dilatasyon kabul edilmektedir. Dilatasyonda amaç alt özofagus sfinkterini
oluşturan sirküler kaslarda ayrılma ve yırtılma oluşturmaktır, bu bujilerle ve balon
dilatasyon yöntemi ile yapılmaktadır. Dilatasyonun başarısız kalındığı durumlarda
veya megaözofagusun bulunduğu ilerlemiş akalazya olgularında tercih edilecek
tedavi yöntemi cerrahidir. Cerrahi yöntem özofagomiyotomidir, gerekirse antireflü
prosedür eklenmelidir. Akalazyalı olgularda kanser gelişme ihtimali normale oranla 10
kat artmıştır, bu nedenle hastalar uzun dönem takip edilmelidirler (Resim 38.1
a,b,c,d).
494
Resim 38.1 a: Elli beş yaşında erkek hasta yutma güçlüğü, nefes darlığı ve öksürük
şikayetleri ile başvurdu. Kontraslı özofagus-mide-duedonum grafisinde özofagus çapı
oldukça artmış, peristaltizmi azalmış ve içersinde gıda artıkları, özofagogastrik bileşkede
düzgün kenarlı darlık izlenmekte. b,c,d) Toraks bilgisayarlı görüntülemede, tüm özofagus
boyunca en geniş yerde çapı 12 cm’e ulaşan özofagus dilatasyonu ve gastroözofageal
bileşkede daralma izlenmektedir. (klinik arşivinden: H.E., dosya no:939607)
495
Diffüz özofajiyal spazm
Diffüz özofajiyal spazm özofagusun primer nöromuskuler bozukluğudur. Özofagus
gövdesini oluşturan düz kasın motor koordinasyonunu kaybetmesi, spontan olarak
oluşan uzun süreli yüksek amplitüdlü kontraksiyonlar ile karakterizedir. Akalazyadan
farklı olarak bu hastalıkta alt özofagus sfinkterinin yutmaya cevap olarak gevşemesi
tamamen normaldir. Esas semptom katı ya da sıvı gıdaların yutulması ile başlayan
şiddetli spastik ağrıdır, ayrıca disfaji, regürjitasyon ve giderek artan bir kilo kaybı
vardır.
Tanı baryumlu özofagus grafisi ile konulur ve manometrik ölçümlerle kesinleştirilir.
Baryumlu özofagus grafisinde, özofagus alt 2/3 distal bölümünde belirgin spazm,
özofagus duvarında 5 mm ve üzerinde kalınlaşma izlenir. Bu radyolojik görünüme
“tirbuşon özofagus” adı verilir. Manometrik ölçümlerde, normal alt sfinkter basıncı
mevcutken, özofagus 2/3 distal kısmında normal peristaltik dalgalardan daha yüksek
amplitüdlü ve daha uzun süreli spastik motor kasılmalar vardır.
Tedavide birçok ilaç denemiştir, bunlardan kalsiyum kanal blokerlerinin etkili olduğu
tespit
edilmiştir.
Ancak
bu
ilaçlar
yan
etkileri
nedeniyle
uzun
süre
kullanılamamaktadır. Medikal tedaviden fayda görmeyen hastalara pnömotik
dilatasyon uygulanabilir, ancak bu tedavi geçici ve kısa süreli bir rahatlama sağlar.
Dilatasyon gibi kısa süreli rahatlama sağlayan diğer bir yöntem de endoskopik yolla
botulinum toksin uygulanmasıdır. Esas tedavi özofagusun spastik segmenti boyunca
yapılacak olan miyotomidir. Eğer hiyatal herni ya da reflü hastalığı varsa antireflü
işlemi ilave edilmelidir.
Nutcracker özofagus
Nonkardiyak göğüs ağrılı olgularda görülen özofagus distalinde aşırı şiddette ve
uzamış normal peristaltik dalgaların oluşturduğu tablodur. Hastaların %90’ında
semptom göğüs ağrısıdır. Radyolojik ve endoskopik muayeneler genellikle bu
hastalarda normaldir. Tanı manometrik çalışmalarla konulur. Manometrik olarak
ölçülen basınçlar akalazya ve diffüz özofageal spazmda ölçülenden çok daha
yüksektir (180 mmHg). Medikal tedavi ön plandadır, cerrahi tedavi tartışmalıdır.
Hipertansif alt özofagus sfinkteri
Akalazya, diffüz özofajiyal spazm ve Nutcracker özofagus gibi motor hastalıklardan
farklı olarak izole hipertansif alt özofagus sfinkteri nadirdir. Özofagusun alt 4 cm’lik
496
segmentinde 30 cmH2O’yu aşan bir basınç söz konusudur. Tedavisinde dilatasyon
geçici rahatlama sağlasa da esas tedavi miyotomidir.
Nonspesfik özofagus motor bozuklukları
Nonspesifik motor bozuklukları yukarıda açıklanan 4 ana gruba uymayan motilite
bozukluklarıdır. Önde gelen semptom göğüs ağrısıdır. Manometrik basınç traseleri
tipiktir, bu manometrik bulgular sıklıkla göğüs ağrısı, disfaji ve gastroözofajiyal reflüsü
olan
hastalarda
görülmektedir.
Tedavisinde
kalsiyum
kanal
blokerleri
kullanılmaktadır, alt sfinkter basıncı artmış olan hastalarda dilatasyonun faydası
yoktur, özel durumlarda miyotomi tercih edilebilir.
Chagas hastalığı
Hastalık Güney Amerika ülkelerinde bulunan Tripanozoma Cruzi adlı parazitin yaptığı
bir hastalıktır. Parazit, Auerbach pleksusunda dekstrüksiyon yaparak özofagus
motilitesini bozar ve bu durum özofagusta atonik dilatasyona neden olur. Hastalık
sistemik seyreder, kalp, kalın barsaklar, parotis bezi ve diğer organlar tutulabilir.
Uzun süre megaözofagus devam ederse malignite gelişme riski vardır.
Özofagusun sekonder motilite bozuklukları
Özofagusun kollajen doku hastalıkları, infeksiyon, yabancı cisim, kimyasal madde
içimi veya reflüye bağlı kimyasal irritasyonu sonucu gelişen motilite bozukluklarıdır.
Kollajen hastalıklar
Skleroderma: Skleroderma özofagusun düz kaslarını tutarak özofagus motilitesinde
bozukluğa neden olur. Esas patoloji düz kas liflerinin atrofisi, bağ dokusu içersinde
kollajen depolanması ve subintimal arteriyoler fibrozistir, Auerbach pleksusunda da
dejenerasyon vardır.
Hastalık klinikte özofagus tutulması ile kendini gösterir ve bu tutulma genellikle cilt
değişikliklerinden daha sonra ortaya çıkar. İlerleyici karakterde bir disfaji söz
konusudur, katı veya yarı katı gıdaların yutulamamasına kadar gider.
497
Yapılan radyolojik incelemede bulgu özofajiyal atonidir. Özofagoskopik incelemede;
özofagusun üst bölümündeki mukozanın ince ve parlak olduğu ve mukoza
kıvrımlarının silindiği saptanır.
Tedavide özofajit ve striktüre yönelik medikal tedavi söz konusudur. Medikal
tedavinin yanında dilatasyon gerekebilir. Eğer cerrahi tedavi gerekiyorsa özofajiyal
obstrüksiyonu ortadan kaldıran ve reflüyü önleyen bir girişim uygulanır.
Sistemik Lupus Eritematozus: Bu sistemik kollajen hastalıkta %15–20 oranında
özofagus tutulumu söz konusudur. Hastaların çoğunda disfaji ve retrosternal ağrı
mevcuttur. Hafif belirtilerin olduğu hastalarda semptomatik tedavi uygulanır.
Semptomları ağır seyreden olgular kortikosteroid tedavisinden fayda görürler.
Polimyozit ve Dermatomyozit: Her ikisi de primer olarak vücuttaki çizgili kas sistemini
etkileyen hastalıklardır. Polimyozitte farenks ve özofagusun çizgili kas tutulumu
tipiktir. Hastaların yaklaşık yarısında farengeal tipte disfaji mevcuttur, alt özofagus
sfinkter fonksiyonları normaldir. Tedavisi medikaldir.
Periferik nöropati
aa. Diabetik nöropati: Diyabeti olan hastalarda özofagus alt sfinkter basıncında
azalma ile birlikte peristaltik hareketlerin amplitüdünde azalma ve özofagus
boşalmasında gecikme olmaktadır. Klinik semptomlar genellikle insülin bağımlı, kötü
kan glukozu kontrolü olan yaşlı hastalarda görülmektedir. Tedavide reflüye yönelik
medikal tedavi verilmelidir.
bb. Alkolik nöropati: Akut alkol alımı özofagusun motor disfonksiyonuna neden olur,
alt özofagus sfinkter basıncı ve özofagus peristaltizmi azalır. Kronik alkol alımı,
özofajiyal dismotilitiye neden olur, bu durumun periferik nöropatiye bağlı olduğu
bildirilmiştir.
KAYNAKLAR
1. Duranceau A, Ferraro P. Pharyngeal and cricopharyngeal disorders. In: Pearson
FG, Cooper JD, Deslauriers J, eds. Esophageal Surgery. 2nd ed. Philedelphia:
Churchill Livingstone; 2002:477-506.
2. Lerut T, Hiebert CA. Esophageal diverticula. In: Pearson FG, Cooper JD,
Deslauriers J, eds. Esophageal Surgery. 2nd ed. Philedelphia: Churchill
Livingstone; 2002:507-514.
498
3. Deschamps C, Trastek VF. Esophageal diverticula. In: Shields TW, LoCicero J,
Ponn RB, eds. General Thoracic Surgery. 5th ed. Philedelphia: Lippincott
Williams Wilkins; 2000:1839-1849.
4. Wood MG, Hagen JA. Primary esophageal motor disorders. In: Pearson FG,
Cooper JD, Deslauriers J, eds. Esophageal Surgery. 2nd ed. Philedelphia:
Churchill Livingstone; 2002:515-535.
5. Ximenes-Netto M. Chagas’ disease. In: Pearson FG, Cooper JD, Deslauriers J,
eds. Esophageal Surgery. 2nd ed. Philedelphia: Churchill Livingstone; 2002:536550.
6. Ximenes-Netto M. Chagas’ disease of the esophagus. In: Shields TW, LoCicero
J, Ponn RB, eds. General Thoracic Surgery. 5th ed. Philedelphia: Lippincott
Williams Wilkins; 2000:1881-1891.
7. Martin J, Ferraro P, Duranceau A. Secondary esophageal motor disorders. In:
Pearson FG, Cooper JD, Deslauriers J, eds. Esophageal Surgery. 2nd ed.
Philedelphia: Churchill Livingstone; 2002:551-568.
8. Sakıncı Ü. Özofagusun kanser dışı hastalıklarında cerrahi tedavi. In: Yüksel M,
Başoğlu A, eds. Özofagus hastalıklarının tıbbi ve cerrahi tedavisi. İstanbul:
Bilmedya grup; 2002:185-215.
9.
Sakıncı Ü. Özofagusun kanser dışı cerrahi hastalıkları. In: Yüksel M, Kalaycı
NG, eds. Özofagus hastalıklarının tıbbi ve cerrahi tedavisi. İstanbul: Bilmedya
Grup; 2002:845-878.
10. Arıbaş OK. Özofagusun motilite hastalıkları. In: Ökten İ, Güngör A, eds. Göğüs
Cerrahisi. Ankara: Sim Matbaacılık; 2003:1217-1226.
499
39.
Prof. Dr. Hakan Kutlay
Ankara Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
ÖZOFAGUS KANSERİ
Özofagus kanseri sık görülmeyen bir kanser türüdür. Tüm gastrointestinal traktus
kanserlerinin %7’sini, tüm kanserlerin ise %1’ini oluşturmaktadır. Son derece
ölümcüldür ve sık görülmemesine rağmen kansere bağlı ölümlerde 6. sırada yer
almaktadır. Hastaların yarıdan fazlası tanı konulduğunda ileri evrededir ve tüm
evreler için 5 yıllık sağkalım oranları %5–15 civarındadır. İnsidansın yüksek olduğu
ülkelerde tarama programları sayesinde erken tanı oranları yüksek ve bu nedenle
sağkalım oranları yüksektir.
Epidemiyoloji ve insidans
Özofagus kanserinin özelliği görülme sıklığının dünyada bazı coğrafi bölgelerde,
hatta aynı coğrafi bölgede birbirine çok yakın yerleşim yerlerinde çok farklı oranlarda
bulunmasıdır. Yüksek riskli bölgelerle düşük riskli bölgelerdeki görülme sıklığı
arasında 300 kat fark olan tek kanserdir. Dünyada en sık görüldüğü ülkeler Çin,
Japonya, Kore, Hindistan, Singapur, Sri Lanka, Porto Riko, Güney Afrika, Rusya,
Türkmenistan, Litvanya ve İran’dır. Ülkemizde de özofagus kanseri insidansı
yüksektir. Özellikle Doğu Anadolu’da İpek Yolu olarak adlandırılan antik yol üzerinde
sık görülmektedir. En sık görüldüğü iller Erzurum, Van, Ağrı, Kars, Gümüşhane, Muş,
Hakkari, Artvin, Erzincan ve Bitlis’dir. Anılan ülkelerde ve ülkemizde en sık görülen
histolojik tip yassı hücreli karsinomdur.
Özofagus kanserindeki en önemli epidemiyolojik değişiklik son 30 yılda ortaya çıkmış
ve özofagus adenokarsinomu bu süre içinde yaklaşık % 450 artış göstermiştir. Bu
düzeyde bir artış diğer kanser türlerinde kaydedilmemiştir. Bu artış özellikle
sosyoekonomik durumu gelişmiş batı ülkelerinde görülmektedir. 1970’li yıllarda
özofagus kanseri %85–90 yassı hücreli karsinom, %10–15 adenokarsinom histolojik
tipinde iken günümüzde batı ülkelerinde adenokarsinom oranı %60-75’e yükselmiştir.
Bu değişiklik Amerika Birleşik Devletleri, Avrupa, Yeni Zelanda ve Avusturalya’da son
derece belirgindir. Bu süre içerisinde yassı hücreli karsinom sayısında bir değişiklik
olmamıştır.
500
Özofagus yassı hücreli karsinomu dünyada geniş bir coğrafi dağılım göstermektedir.
Bu dağılımda ortak özellik sosyoekonomik düzeyin düşük olmasıdır. Sık görülme
sebebi olarak kültürel alışkanlıklar, beslenme ile ilgili faktörler gösterilmektedir.
Özofagus adenokarsinomu ise sosyoekonomik düzeyi yüksek ülkelerde giderek artan
düzeylerde görülmekte ve sık görülme sebebi olarak obezite, gastroözofageal reflü
ve Barret özofagus gösterilmektedir.
Risk Faktörleri
Tütün ve alkol kullanımı
Özellikle yassı hücreli karsinom oluşumuna etkilidir. Sigara içenlerde normal
populasyona göre 10–15 kat fazla görülmektedir. Alkol alımı tek başına belirgin bir
risk olarak tanımlanmamıştır ama alkol ve sigaranın birlikte kullanımı sinerjik etki
oluşturmakta ve normal populasyona göre görülme oranını 100 kat artırmaktadır.
Risk, sigara ve alkol kullanımının süresi, miktarı ve alınan alkolün konsantrasyonu ile
de ilişkilidir.
Beslenme ile ilgili faktörler
Kültürel beslenme alışkanlıkları, özellikle de çok sıcak içeceklerin fazla miktarda ve
sık olarak alınması yassı hücreli karsinom için belirgin bir risk faktörü olarak kabul
edilmektedir. Rusya, Orta Doğu ve Asya’da bu alışkanlık görülmektedir. Besinleri
pişirme alışkanlıkları, özellikle de tütsülenmiş et ve balık tüketimi nitrozamin bileşikleri
oluşumu nedeniyle risk oluşturmaktadır. Bölgesel özellikler nedeniyle içme ve
kullanma suyunda nitrat bileşikleri bulunması suçlanan bir diğer faktördür.
Vitamin ve mineral alımındaki eksiklikler özellikle az gelişmiş ülkelerde yassı hücreli
karsinom gelişiminde önemli bir faktör olarak kabul edilmektedir. Vitamin A,B,C,E,
beta karoten, magnezyum, çinko, selenyum, molibden gibi minerallerin antioksidan
etkileri, hücre rejenerasyonu ve hücre bölünmesi üzerine düzenleyici etkileri
bilinmektedir. Bu maddelerin yetersiz alımı, özellikle buğday, pirinç ve mısırdan
zengin, taze sebze ve meyveden fakir beslenme önemli bir risk oluşturmaktadır.
Sigara, alkol ve taze sebze ve meyvenin yetersiz alımı özofagus yassı hücreli
karsinomu oluşumunda en önemli üç etken olarak kabul edilmektedir. Bu üç etken
hastaların %83’ünde saptanmıştır.
Ülkemizde Doğu Anadolu’da sigara ile birlikte çok sıcak ve fazla miktarda çay içme
alışkanlığının olması ve bu bölgeye iklim koşulları nedeniyle özellikle kış aylarında
501
taze sebze ve meyve ulaşımındaki güçlükler özofagus yassı hücreli kanserinin sık
görülmesinin nedenleri olarak düşünülebilir.
Vücut kitle indeksi/Obezite
Özofagus adenokarsinomu için bağımsız risk faktörüdür. Yassı hücreli karsinomda
ise ters orantı vardır, vücut kitle indeksi arttıkça risk azalmaktadır. Son yıllarda
populasyonda obezite artışı oldukça belirgindir. Amerika Birleşik Devletleri’nde
özellikle gençlerde epidemik bir durum haline gelmiştir. Obezite sıklığındaki artış ile
özofagus adenokarsinomundaki artış zaman aralığı olarak paralellik göstermektedir.
Obezite ile birlikte gastroözofageal reflü insidansının artması ve bunun da Barret
özofagus ile sonuçlanması, özofagus adenokarsinomundaki artışın sebebi olarak
gösterilmektedir. Bu bilgi kanıtlanmamıştır ancak Barret özofagus, özofagus
adenokarsinomu için kanıtlanmış en önemli risk faktörüdür. Barret özofagus ile
özofagus yassı hücreli karsinomu arasında ilişki yoktur.
Gastroözofageal reflü
Reflü semptomları Barret özofagusdan bağımsız olarak özofagus adenokarsinomu
için risk faktörüdür. Batı ülkelerinde gastroözofageal reflü insidansı artmaktadır.
Bunun sebebi diyet ve yaşam biçimindeki değişiklikler ile birlikte helicobacter pylori
enfeksiyonunun
azalması
olabilir.
Çünkü
helicobacter
pylori’nin
reflü
ve
komplikasyonlarını azalttığı ve buna bağlı olarak Barret özofagus ve özofagus
adenokarsinomu riskini azalttığı bilinmektedir.
Predispozan hastalıklar
Kostik özofajit, akalazya, tylosis, Plummer-Vinson Sendromu, gluten enteropatisi, baş
boyun kanserleri ve iyonize radyasyon maruziyeti, özofagus yassı hücreli karsinomu
için risk faktörüdür. Bu hastalıklarda kanser gelişiminden kronik mukozal hasar
sorumlu tutulmaktadır.
Genetik ve çevresel faktörler
Son yıllarda moleküler biyoloji alanındaki önemli gelişmelere paralel olarak özofagus
yassı hücreli kanserinde bazı genetik değişiklikler saptanmış olmakla birlikte, genetik
riskin diğer risklere oranla etkisinin henüz belirgin olmadığı söylenebilir. Çevresel
faktörlerden özellikle sulardaki karsinojen bileşikler üzerinde durulmaktadır. Petrol
bölgelerinde suların petrol ile kontaminasyonu, insidansın yüksek olduğu bazı
bölgelerde suda nitrojen bileşiklerinin gösterilmesi ve bazı bölgelerde evcil
hayvanlarda da özofagus kanseri saptanmış olması çevresel faktörlerin etkisini
desteklemektedir.
502
Patoloji
Özofagus kanserinin esas olarak iki histopatolojik tipi vardır: Yassı hücreli karsinom
ve adenokarsinom. Bunun dışında iğ (spindle) hücreli karsinom, küçük hücreli
karsinom, leiomyosarkom, Kaposi sarkomu ve malign melanom gibi malign tümörler
de nadir olarak görülürler.
Yassı hücreli karsinom
En sık torasik özofagusun 1/3 orta bölümünde lokalize olur. Özofagus yassı hücreli
karsinomu yaklaşık %50 oranında orta 1/3 torasik, %30–40 alt 1/3 torasik ve
abdominal özofagus, %10–20 üst 1/3 torasik ve servikal özofagusda yerleşir. Lezyon
üç şekilde görülür:
1. Kısa bir segmentte fakat mukozayı çepeçevre sararak daraltan skirröz tip
2. Eroziv ülsere tip
3. Papiller tip
Metastaz oluşumu
Direk yayım: Özofagus gastrointestinal traktusda serozası olmayan tek organdır. Bu
nedenle tümörün doğrudan yayımla komşu organ ve yapılara invazyonu olağandır.
Plevra, trakea, ana bronşlar, perikard, büyük damarlar, duktus torasikus ve
vertebraya komşuluk yoluyla invazyon olabilir. Üst özofagus yerleşimli olanlar
n.rekürrens, alt özofagus yerleşimli olanlar diafragma, mide ve karaciğere invaze
olabilirler.
Lenfatik yayım: Özofagusun submukozasındaki zengin lenfatik ağ nedeniyle
longitudinal olarak hem proksimale hem de distale doğru lenfatik yayım söz
konusudur. Tümörün yerleşim yerine yakın bölgesel lenf nodlarına metastatik yayım
sık olmakla birlikte, üst özofageal yerleşimli bir tümörün abdominal lenf nodlarına, alt
özofageal yerleşimli bir tümörün ise servikal lenf nodlarına metastaz yapması olağan
bir durumdur.
Uzak metastaz: En sık uzak metastaz karaciğer ve akciğerde görülür. Bunun dışında
seyrek olarak kemik, sürrenal ve beyin metastazları da saptanabilir.
503
Adenokarsinom
En sık distal özofagusda lokalize olur. Yaklaşık %79 oranında alt 1/3, %18 orta 1/3,
% 3 üst 1/3 torasik özofagusda yerleşir. Lezyon genellikle ülseratif tiptedir. Erken tanı
az sayıda hastada mümkün olmaktadır. Tanı anında genellikle yaygın lenf bezi
metastazı veya uzak metastaz vardır. En sık uzak metastaz karaciğer ve akciğere
olmaktadır.
Nadir görülen malign özofagus tümörleri
Spindle hücreli karsinom
Histolojik olarak karsinomatöz ve sarkomatöz elemanlar içerir. Klinik ve prognoz
olarak yassı hücreli karsinom gibidir.
Küçük hücreli karsinom
Agressif bir tümördür. Erken metastaz ve hızlı ölümcül seyir özelliği taşır. Yaklaşık
%75 hastada tanı anında uzak metastaz vardır ve yaşam süresi genellikle 6 aydan
kısadır.
Leiomyosarkom
Yavaş büyüyen düşük grade’li tümörlerdir. Genellikle distal 2/3 bölümde özofagus
düz kası boyunca uzanırlar. Prognoz diğerlerine göre daha iyidir ve 5 yıl sağkalım
oranı %35 civarındadır.
Kaposi sarkomu
AIDS hastalarında görülür. Yaklaşık %50 oranında mide ve ince barsak tutulumu
vardır, özofagus tutulumu seyrektir.
Malign melanom
Özofagoskopide koyu renkli pigmente kitle görülür, prognoz kötüdür. Bizim serimizde
albino bir hastada primer özofagus malign melanomu saptanmış olması oldukça
ilginçtir.
Klinik Bulgular
Özofagus kanserinde en önemli semptom disfajidir. Erken dönemde katı gıdaları
yutarken takılma hissi şeklindedir. Ancak ne yazık ki takılma hissi genellikle
hastaların hastaneye müracaatını sağlamaz. Disfaji başladığında da hasta genellikle
ileri evrededir. Hasta anmnezde önceleri katı gıdanın takıldığını, su içerek takılan
gıdayı geçirebildiğini, ancak kısa bir süre sonra su içerek de takılan gıdayı
ilerletemediğini ifade eder. Takılmanın yeri sorulduğunda hasta göğsü üzerinde eliyle
504
yerini gösterir ve bu bilgi bize tümörün seviyesi, yerleşim yeri hakkında oldukça doğru
fikir verir. Lümendeki daralmanın artmasıyla birlikte hasta önce katı gıdaları, daha
sonra sıvı gıdaları ve en sonunda da tükürüğünü yutamaz hale gelir. Bu nedenlerle
hastada ciddi kilo kaybı söz konusudur. Lümendeki obstrüksiyona bağlı olarak alınan
gıdaların regürjitasyonu sık görülen bir diğer semptomdur. Belirgin disfajisi olan
hastalarda bazen tümör nekrozuna bağlı lümende geçici bir genişleme, disfajide
azalma hatta kısa süreli düzelme olabilir, bu durum yanıltıcı olmamalıdır.
Tümörün ülsere tipte olması veya adventisiayı geçerek mediastinal yapılara
invazyonu gibi durumlarda odinofaji görülebilir. Komşu yapılara invazyon yutmadan
bağımsız olarak göğüs ağrısına sebep olabilir. Üst 1/3 torasik ve servikal özofagus
yerleşimli tümörlerde ileri evrede n. rekürrens invazyonu ve buna bağlı ses kısıklığı,
trakea invazyonu ve buna bağlı trakeoözofageal fistül görülebilir. Yine bu bölge
tümörlerinde alınan gıdanın obstrüksiyon nedeniyle ani regürjitasyonu, trakeobronşial
sisteme aspirasyonla sonuçlanabilir.
Fizik muayene erken evrelerde normaldir. İleri evre olgularda beslenme bozukluğu ve
dehidratasyona bağlı kaşektik görünüm, deride turgor ve tonus azalması saptanır.
Servikal ve supraklaviküler bölgenin palpasyonu metastatik lenf bezi saptanması için
önemlidir. Karın palpasyonu ile karaciğerde veya karında kitle aranmalıdır.
Laboratuar incelemelerinde anemi ve beslenme bozukluğuna bağlı hipoproteinemi,
hipoalbüminemi görülür. Karaciğer metastazı olan hastalarda karaciğer fonksiyon
testlerinde yükselme saptanır.
Tanı
Radyoloji
Direk akciğer grafisi :Erken evrelerde genellikle normaldir. İleri evre olgularda
mediastende genişleme, trakea deviasyonu, retrotrakeal alanda genişleme, distal
obstrüksiyona bağlı hava-sıvı seviyesi, asapirasyona bağlı pnömonik infiltrasyon,
varsa akciğer metastazları görülebilir.
Baryumlu grafi: Konvansiyonel bir yöntem olmasına rağmen özofagus kanserinde
günümüzde de halen en önemli görüntüleme yöntemlerinden biridir. Disfaji
semptomu olan tüm hastalara mutlaka uygulanmalıdır.
Erken evre özofagus yassı hücreli karsinomunun tanısında çift kontrast baryumlu
özofagus grafisi en değerli radyolojik yöntem olarak kabul edilmektedir. Bu yöntemle
küçük polipoid lezyon, plak tarzında lezyon, özofagus duvarında fokal düzensizlik
505
görülmesi özofagus kanseri için anlamlıdır ve mutlaka endoskopi ve biyopsi ile
değerlendirilmelidir.
İleri evre özofagus yassı hücreli karsinomu baryumlu grafide infiltratif, polipoid, ülsere
veya variköz lezyon şeklinde görülebilir. İnfiltratif lezyonlarda lümende düzensizlik ve
daralma, ülserasyon görülür (Resim 39.1). Bazı olgularda tümör rafı olarak
adlandırılan görüntü olabilir, bu görüntü genellikle anrezektabl tümör göstergesidir.
Resim 39.1: Özofagus orta 1/3 bölümde lümende daralma ve dolum defekti (Ankara
Üniversitesi Tıp Fakültesi Göğüs Cerrahisi ABD Arşivinden)
Erken evre özofagus adenokarsinomunda baryumlu grafi bulguları yassı hücreli
karsinomdaki gibidir. Lokalizasyon genellikle distal özofagustur; küçük polipoid
lezyon, plak tarzı lezyon veya mukozal düzensizlik özofagus kanseri için anlamlıdır.
Gastroözofageal reflü ve buna bağlı benign peptik striktürde de distal özofagusta
fokal mukozal düzensizlik ve nodülarite görülebilir. Ayrım için özofagoskopi ve biyopsi
mutlaka yapılmalıdır.
İleri evre özofagus adenokarsinomunda da baryumlu grafi bulguları yassı hücreli
karsinomla benzerdir. İnfiltratif, polipoid ve ülsere lezyon görülebilir ancak variköz
lezyon nadiren görülür. Adenokarsinoma genellikle distal özofagus yerleşimli
olduğundan baryumlu grafide gastrik kardia ve fundus tutulumu da saptanabilir
(Resim 39.2 a ve b). Bu durumda tümörün orijinini saptamak her zaman mümkün
506
olmayabilir. Çift kontrast tekniği kardia ve fundusun değerlendirilmesi için de
kullanılabilir.
Resim 39.2a: Distal özofagusda kısa bir segmentte dolum defekti 2b: Baryumlu grafide distal
özofagus ve kardiayı da içine alan dolum defekti (Ankara Üniversitesi Tıp Fakültesi Göğüs
Cerrahisi ABD Arşivinden)
Bilgisayarlı tomografi (BT): Tanı ve evreleme için toraks ve abdomen bilgisayarlı
tomografisi rutin kullanılan görüntüleme yöntemidir. BT ile primer tümör, lenf bezleri
ve uzak metastaz hakkında detaylı bilgiler elde edilir. Özofagus kanserinde en önemli
BT bulgusu özofagus duvarında kalınlaşmadır (Resim 39.3a,b). Lümen içinde kitle,
tümör proksimalinde lümen dilatasyonu görülebilir. İleri evre olgularda çevre organ ve
yapılara invazyon, trakeoözofageal fistül, tümör perforasyonuna bağlı mediastende
hava-sıvı seviyeleri, mediastinal ve abdominal lenf bezi büyümeleri, karaciğer,
akciğer ve diğer uzak organ metastazları belirlenebilir.
Resim 39.3a-b: Özofagus kanserli 2 ayrı olguda BT’de özofagus duvar kalınlaşması (Ankara
Üniversitesi Tıp Fakültesi Göğüs Cerrahisi ABD Arşivinden)
507
Magnetik rezonans görüntüleme (MRG) : Özofagus kanserinin tanı ve evrelemesinde
BT’ye üstünlüğü yoktur. Hatta özofagus duvarı, özofagus lümeni ve lenf bezlerinin
değerlendirilmesinde doğruluk oranları BT’den düşüktür. Görüntüleme alanının kalp,
solunum ve yutkunma nedeniyle hareketli olması görüntülemede dezavantaj
oluşturmaktadır. İşlem süresinin uzun olması bir diğer dezavantajıdır.
Pozitron emisyon tomografi (PET): Son yıllarda özofagus kanserinin evrelemesinde
yaygın olarak kullanıma giren önemli bir yöntemdir. Özellikle lenf bezi metastazı ve
uzak metastaz belirlenmesinde diğer yöntemlerden üstündür.
Endoskopik ultrasonografi (EUS): Primer tümörün özofagus duvarındaki derinliğini
belirlemenin
yanı
sıra
mediastinal,
perigastrik
ve
çöliak
lenf
nodlarının
değerlendirilmesinde de oldukça yüksek doğruluk oranlarına sahip bir yöntemdir. Bu
sayede T ve N durumunun değerlendirilmesinde ve doğru evrelemede önemli katkı
ve gelişme sağlamıştır.
Endoskopi
Özofagoskopi:
Özofagus
kanserinden
şüphelenilen
tüm
olgularda
mutlaka
başvurulması gereken bir yöntemdir. Tümörün yerleşim yeri, lümendeki darlığın
derecesi ve lezyonun uzunluğu net olarak saptanabilir. Histolojik tanı için lezyondan
mutlaka multipl biyopsiler alınmalıdır.
Bronkoskopi: Servikal, üst ve orta 1/3 torasik yerleşimli tümörlerde trakeobronşial
invazyonun değerlendirilmesi için mutlaka yapılması gereklidir. Trakea, karina ve ana
bronşlar değerlendirilir, şüpheli alanlardan biyopsi alınır.
Evreleme
Buraya kadar yapılan klinik, radyolojik ve endoskopik incelemeler ile hastalığın
tanısıyla birlikte aynı zamanda klinik evresi de belirlenmiş olmaktadır. Bundan sonraki
aşamada hedef, incelemelerde elde edilen sonuçlar lenf bezi veya uzak metastaz
şüphesi taşıyorsa, uygun invaziv yöntemleri kullanarak metastaz varlığını veya
yokluğunu sitopatolojik veya histopatolojik olarak kanıtlamaktır; çünkü doğru
evreleme uygun tedavi yönteminin seçiminde ve prognozun belirlenmesinde temel
koşuldur.
Fizik muayene veya görüntüleme yöntemleriyle supraklaviküler lenf bezi saptanmışsa
ultrasonografi eşliğinde iğne biyopsisi yapılarak sitopatolojik inceleme ile sonuç
508
alınabilir. Bilgisayarlı tomografide mediastende büyümüş lenf bezleri saptanmışsa
lokalizasyonuna göre BT eşliğinde veya EUS ile iğne biyopsisi yapılabilir. Batında
lenf bezi saptanan olgularda laparoskopi ile perigastrik ve çöliak lenf bezlerinden
biyopsi alınabilir, aynı zamanda periton boşluğu ve karaciğer de metastaz yönünden
değerlendirilebilir.
Özofagus kanseri evrelemesinde TNM sistemi kullanılmaktadır. Günümüzdeki
evrelemeye yönelik uygun yöntemlerin tümünü kullanarak dahi %100 doğruluk
oranında evreleme olası değildir. Ancak teknolojik gelişmeler günümüzde oldukça
yüksek doğru evreleme oranları sağlayabilmektedir.
Özofagus kanserinin TNM evrelemesi
T- Primer tümör
Tis
Yüksek grade displazi, karsinoma in situ
T1
Tümör lamina propria veya submukozaya invaze
T2
Tümör muskularis propriaya invaze
T3
Tümör adventisiaya invaze
T4a
Tümör komşu yapılara invaze ancak rezektabl (plevra, perikard,
diafragma)
T4b
Tümör komşu yapılara invaze ve anrezektabl (aorta, vertebra, trakea)
N- Regional lenf bezleri
N0
Regional lenf bezi metastazı yok
N1
1-2 adet regional lenf bezi metastazı
N2
3-6 adet regional lenf bezi metastazı
N3
7 ve daha fazla sayıda regional lenf bezi metastazı
M- Uzak metastaz
M0
Uzak metastaz yok
M1
Uzak metastaz
Tedavi
Cerrahi tedavi
Özofagus kanserinde küratif tedavi yöntemi cerrahi rezeksiyondur (Resim 39.4
a,b,c). Cerrahi rezeksiyon hastaya kür şansı vermenin yanında, son derece ızdıraplı
bir semptom olan disfajinin de düzelmesini sağlar. Özofagus kanseri cerrahisinde
oldukça çeşitli girişim yolları, rezeksiyon ve rekonstrüksiyon teknikleri vardır. Bunun
509
seçimi lezyonun lokalizasyonuna, hastanın medikal durumuna ve cerrahın tercihine
bağlıdır.
Resim 39.4a: Alt 1/3 özofagusta tümör nedeniyle ameliyat edilen olgunun rezeksiyon
materyali 4b: Özofagogastrik bileşkede başka bir nedenle özofagoskopi yapılırken 8mm
tümör saptanan olgunun rezeksiyon materyali 4c: Distal özofagus, kardia ve mide
proksimalini tutan tümörün rezeksiyon materyali (Ankara Üniversitesi Tıp Fakültesi Göğüs
Cerrahisi ABD Arşivinden)
Özofagusun
rezeksiyonu
sonrası
gastrointestinal
traktusun
devamlılığının
sağlanması yani rekonstrüksiyonu gereklidir. Özofagusdaki tümörün proksimal ve
distalden rezeksiyonu sonrası özofagusun uç uca anastomozu, özofagusun serozası
olmaması ve arteriel beslenmesinin zayıf olması nedeniyle mümkün değildir. Bu
nedenle proksimaldeki kalan özofagus bölümü, yukarı çekilen mide ile anastomoz
edilir. Bu durumda rezeksiyonun distal sınırının mide seviyesinden yapılması
gereklidir.
Özofagus rezeksiyonu sonrası rekonstrüksiyon için en sık kullanılan ve en uygun
olan organ midedir. Daha önce herhangi bir sebeple mide rezeksiyonu uygulanmış
olan hastalarda jejunum grefti veya kolon kullanılır.
Özofagus servikalden başlayıp abdomene kadar uzanan bir organ olduğu için
servikal bölge, toraks ve abdomen cerrahi girişim alanına girmektedir. Tümörün
lokalizasyonuna göre en az ikisi, bazen de üç bölge birden girişim yolu olarak
kullanılır. Rekonstrüksiyon için mide kullanılacağından ve bu amaçla midenin toraksa
veya servikal bölgeye çekilmesi gerektiğinden, abdominal girişim ve mide
510
serbestleştirilmesi yapılır. Mide serbestleştirmesi için de açık cerrahi yani laparatomi
ya da minimal invaziv cerrahi yani laparoskopi kullanılabilir.
Tümör alt 1/3 torasik özofagusda ise abdominal girişimle mide serbestleştirildikten
sonra torasik girişime geçilir. Özofagus posterior mediasten yerleşimli bir organ
olduğu için torasik girişim yolu sağ torakotomidir (Resim . Sol torakotomi ile yalnızca
özofagusun distal 7–8 cm’lık bölümüne ulaşılabilir, bunun üzerindeki bölüm kalp ve
inen aortanın arkasında kalır. Sağ torakotomide özofagus tümörün proksimalinden
yeterli
uzunlukta
serbestleştirilir,
tümör
ve
tümörün
distali
hiatusa
kadar
serbestleştirilir. Daha önce serbestleştirilmiş olan mide toraksa çekilerek rezeksiyon
(Resim 39.5) sonrası toraks içinde özofagogastrostomi gerçekleştirilir. Özofagus ile
mide arasındaki anastomoz elle veya son yıllarda kullanımı giderek yaygınlaşan
stapler kullanılarak yapılabilir.
Resim 39.5: Servikal bölgede özofagogastrostomi uygulanan olgunun postoperatif erken
dönem direk grafisinde toraks boyunca uzanan midenin görünümü (Ankara Üniversitesi Tıp
Fakültesi Göğüs Cerrahisi ABD Arşivinden)
Tümör 1/3 orta veya üst torasik özofagusda ise tümör proksimalinin üzerinde yeterli
uzunluk olmadığından ve tümör proksimaline yakın rezeksiyon yapıldığında
mikroskopik olarak tümörsüz rezeksiyon sınırı elde etmek güç olduğundan
rezeksiyonun servikal özofagus seviyesinden yapılması tercih edilir. Bunun için üç
bölgeye cerrahi girişim yapılması gereklidir. Ameliyata torasik girişim ile başlanır. Bu
amaçla sağ torakotomi veya video yardımlı torakoskopik cerrahi (VATS) kullanılabilir.
Torasik girişim torasik özofagusun tamamının tümörle birlikte serbestleştirilmesinden
ibarettir. Ardından abdominal girişim uygulanır. Laparatomi veya laparaskopi ile mide
serbestleştirilir. Son aşamada sol servikal bölge insizyonu ile servikal özofagus
511
bulunur ve daha önce serbestleştirilen torasik özofagus ve mide servikal bölgeye
çekilir (Resim 39.6 a,b,c). Rezeksiyon sonrası servikal bölgede özofagogastrostomi
uygulanır. Anastomoz elle veya sirküler stapler kullanılarak yapılabilir.
Resim 39.6a,b,c: Özofagus 1/3 orta bölümde tümör nedeniyle ameliyat edilen 3 ayrı olgunun
rezeksiyon materyalleri (Ankara Üniversitesi Tıp Fakültesi Göğüs Cerrahisi ABD Arşivinden)
Tümör servikal özofagusda veya faringoözofageal bölgeye yakın yerleşimli ise
cerrahi girişim daha kompleks bir hale gelmektedir. Tümörün proksimalinde yukarıda
güvenli rezeksiyon sınırı elde edebilmek için rezeksiyonun farinksden yapılması
gereklidir. Bunun için anatomik ve fonksiyonel zorunluluk nedeniyle total larenjektomi
de yapılması gereklidir. Önce torasik girişimle torasik özofagus serbestleştirilir,
ardından abdominal girişimle mide serbestleştirilir. Son olarak servikal girişim için
Apron kesisi adı verilen geniş kesi yapılır. Total larenjektomi ve farenjektomi sonrası
özofagus ve mide boyuna çekilerek total özofajektomi yapılır (Resim 39.7). Boyuna
çekilen mide farenkse anastomoz edilir, trakea incisura jugularis seviyesinde cilde
ağızlaştırılır (trakeal stoma). Faringogastrostomi hattı bazen dil kökünün hemen
altında olabilmektedir.
512
Resim 39.7: Servikal özofagusda tümör nedeniyle total faringolaringoözofajektomi yapılan
olgunun rezeksiyon materyali (Ankara Üniversitesi Tıp Fakültesi Göğüs Cerrahisi ABD
Arşivinden)
Cerrahi komplet rezeksiyon tümörün tamamının çıkarılması ile birlikte bölgesel lenf
bezlerinin de çıkarılmasını ifade eder. Bu nedenle cerrahi disseksiyon sırasında
bölgesel lenf bezlerinin de çıkarılması esastır.
Multimodal tedavi
Birçok kanser türünde olduğu gibi özofagus kanserinde de cerrahi tedavi ile birlikte
kemoterapi, radyoterapi veya kemoradyoterapi uygulamaları tedavide yer almaktadır.
Bu tedaviler özellikle regional lenf bezi metastazı olan olgularda cerrahi öncesi
(neoadjuvant) veya cerrahi sonrası (adjuvant) uygulanmaktadır. Bu tedaviler yaygın
olarak kullanılmaktadır, sağkalıma katkıları olduğunu gösteren çalışmalar vardır
ancak henüz kanıtlanmamıştır.
Prognoz
Özofagus kanserinde prognoz kötüdür. Tüm evreler düşünüldüğünde 5 yıl sağkalım
%5–15, ortalama sağkalım yaklaşık 2 yıldır. Erken evre olgularda ise 5 yıl sağkalım
%80 gibi oldukça yüksek oranlardadır.
Sonuç olarak belirtmek gerekir ki, özofagus kanseri hem hasta için hem de hekim için
zor ve zahmetli bir durumdur. Prognoz kötüdür. Disfaji başladıktan sonra hastalık
haftalar veya en geç birkaç ay gibi kısa süreler içinde anrezektabl veya inoperabl ileri
evreye ulaşmaktadır. Burada erken tanının çok önemli olduğu açıktır. Erken tanı ise
513
birçok kanser türüne göre çok kolaydır. Günümüzde son derece basit ve hemen her
yerde bulunan baryumlu özofagus grafisi ve özofagoskopi ile kesin tanı konulabilir.
En önemli nokta disfaji semptomu hangi yaşta ve hangi cinsiyette olursa olsun
ciddiye alınmalı, aksi kanıtlanıncaya kadar disfaji tanımlayan tüm hastalar özofagus
kanseri gibi incelenmelidir. Psikolojik sebepler, üst sfinkter spazmı, özofagus motilite
bozukluğu gibi hastanın hayatını tehdit etmeyecek tanılar düşünülerek vakit
kaybetmemeli ve hastalığın hızlı ilerlediği unutulmamalıdır. Disfajisi olan her hastaya
baryumlu özofagus grafisi ve özofagoskopi mutlaka yapılmalıdır.
KAYNAKLAR
1. CM Shahbaz Sarwar, JD Luketich, RJ Landreneau, G Abbas. Esophageal
cancer: An update. Int J Surg (2010); doi: 10.1016/j.ijsu.2010.06.011.
2. HA Cense, CHJ van Eijck, HW Tilanus. New insights in the lymphatics spread
of oesophageal cancer and its implications for the extent of surgical resection.
Best Practise & Research Clinical Gastroenterology 20(5):893-906;2006.
3. Jeanne M Lukanich. Section I: Epidemiological review. Semin Thorac
Cardiovasc Surg 15(2):158-166;2003.
4. B Kumbasar. Carcinoma of esophagus:radiologic diagnosis and staging. Eur J
Radiol 42:170-180;2002.
5. İ Ökten. Özofagus kanserleri. Güncel Gastroenteroloji 3(1):64-105;1999.
6. DC Whiteman,P Parmar,P Fahey, SP Moore,M Stark ve ark. Association of
helicobacter pylori infection with reduced risk for esophageal cancer is
independent of environmental end genetic modifiers. Gastroenterology
139:73-83;2010.
7. J Huang,M Bashir,MD Iannettoni. Carcinoma of the esophagus. General
Thoracic Surgery, Ed.TW Shields,7th ed.,Lippincott Williams & Wilkins,
Philadelphia,2009, p:1983-2012.
514
40.
Yrd. Doç. Dr. Serdar Şen
Adnan Menderes Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
MEDİASTİNUM
Anatomi
Her iki plevra boşluğunun arasında kalan anatomik bütünün adıdır. Üstte torasik giriş,
altta diafragma, önde sternum, arkada ise vertebraların yan yüzleri ve kostaların arka
uçları ile sınırlandırılmıştır.
Mediastinumun adlandırılmasında ve sınıflandırılmasında tıbbi literatürde pek çok
sınıflama ile karşılaşılmaktadır. Bu konuda klinik, radyolojik, patolojik ve anatomik
olarak tam bir fikir birliği yoktur. Mediastenin anatomik ayrımı fasia planları ya da
anatomik yapılara göre değil sadece lateral toraks grafisi kullanılarak yapılan bir
ayrımdır. Bu nedenle tanımlamada farklılıklar devam etmektedir. Sıklıkla kullanılan
tanımlamada mediasten 3 ya da 4 bölümde incelenmektedir (Şekil 40.1).
Bunlar
I:
1.Üst mediasten
2.Ön mediasten
3.Orta mediasten
4.Arka mediasten veya
II:
1.Anterosuperior mediasten
2.Orta mediasten
3.Arka mediastendir.
Kabul gören bir başka sınıflamada ise Mediastinum;
1-Ön mediasten (prevaskuler alan)
2-Visseral bölüm (orta mediasten)
3-Bilateral Paravertebral oluklar olarak bölümlere ayrılmaktadır.
515
Superior Mediasten
Posterior
Mediaste
nnn
Ön
Mediasten
Orta Mediasten
(Visseral
Kompartman)
Şekil 40.1: Mediastinumun yan görünümü.
Ön mediasten
Sternumun posterioru ile perikardın anterior yüzü arasındaki alandır. Bu bölgenin en
büyük anatomik yapısı Timus bezidir. Yağ dokusu, lenf nodları ile a.v. thoracica
interna damarsal yapıları diğerleridir. Luise açısından paralel olarak çizilen çizginin
üzerindeki alana klinikte üst mediasten denilmektedir.
Orta Mediasten
Mediastenin en geniş alanıdır. Kalp bu bölgede yerleşmiştir. Perikard, frenik sinirler
ve büyük damarlar, trakea-karina-ana bronşlar ile lenf nodülleri bulunur. Vagus siniri
posterior, frenik sinir ise anterior mediasten ile aradaki sınırı oluşturur.
Arka mediasten
Kalbin arka yüzü ile vertebral kolonun önyüzü arasındaki bölge olup her iki tarafta
paravertebral sulkus olarak tanımlanan alanları kaplar. İnen aort, özofagus, azygos
veni, ductus thoracicus, lenf nodları, yağ dokusu ile interkostal arter, ven ve sinirler ile
sempatik zincir, vagus sinirleri bu bölgede yerleşmişlerdir.
Tüm mediasten bölümlerinde bulunan lenf nodülleri zengin bir lenfatik ağ ile
mediasteni kaplamaktadır ki bu durum klinik ve radyolojik olarak çok önemlidir.
516
Özellikle onkolojik ve hematolojik olarak büyük önem taşımaktadır. Bunun yanında
inflamatuvar süreçlerde, metastatik tutulumlarda mediastinal lenf nodülleri hedef
olabilirler.
Mediastinal Tümörler
Histoloji ve embriyolojik olarak birçok değişik doku ve organın burada bulunması
nedeniyle bu bölge tümörleri çok çeşitlilik göstermektedir. Bu bakımdan insan
vücudunun en çok kist ve tümör üretebilen bölgesi mediastinumdur. Mediastinal
tümörler için pek çok sınıflamalar tanımlanmıştır; bunlardan biri aşağıda belirtilmiştir.
1-Timus lezyonları
2-Lenfoid doku neoplazmaları
3-Germ hücreli tümörler
4-Nörojenik tümörler
5-Primer kistik lezyonlar
6-Endokrin lezyonlar
7-Mezenkimal tümörler
8-Diğer lezyonlar (tümörler, metastatik tümörler, kistler vb.)
Lokalizasyon durumuna göre bakıldığında aşağıdaki sınıflama elde edilmektedir.
Ön mediastinum kitleleri
Timoma ve timik kist, lenfoma, lenfanjioma, retrosternal guatr, teratodermoid
tümörler, germ hücreli tümörler, mezenkimal tümörler, paratiroid adenomları, primer
karsinomadır.
Orta mediastinum kitleleri
Bronkojenik kist, lenfoma, perikardial kist, lenf nodu hiperplazileri, enterik kistler,
paraganglioma, feokromositoma olmaktadır.
Arka mediastinum kitleleri
Nörojenik tümörler, lenfoma, feokromositoma, gastroenterik kistlerdir.
517
Lokal Semptom Ve Bulgular
Mediastinal lezyonlar her yaşta görülmekle birlikte en çok genç ve orta yaş grubunda
görülür. Bazıları asemptomatik olup, rutin radyolojik incelemeler sırasında saptanırlar.
Hafif göğüs ağrısı, nefes darlığı, öksürük en sık olan yakınmalardır. Özellikle v. cava
superior basısı, diafragma paralizisi, ses kısıklığı, şiddetli göğüs ağrısı gibi
semptomların varlığı genellikle malign lezyonlarda saptanan bir durumdur. Çocukluk
çağındaki olguların 2/3’ü ve erişkin çağda ise 1/3’ü semptomatiktir. Malignite
potansiyelleri bu oranlara oldukça yakındır. Timus patolojilerinin %40 kadarında
yandaş semptomların olduğu paratimik sendrom denilen tablo ile karşılaşılır. Bu
sendromların en sık görüleni Myastenia gravis olup %30 olguda bulunur. Daha az
oranlarda ise immunglobulin eksikliği (%10), kırmızı hücre aplasizi (%5), sistemik
lupus eritematosus (%1–3) ile timus dışı kanser olguları ile karşılaşılmaktadır.
Tanı
Radyolojik incelemeler olarak posteroanterior akciğer grafisi ve lateral göğüs grafisi
birçok olgu için güvenilirdir. Toraks tomografisi ile kitlelerin doğası hakkında oldukça
değerli, bilgiler elde edilebilir. Toraks MRI incelemesi ile ana vaskuler ve kardiyak
yapılar daha ayrıntılı olarak tanımlanabilirler. Radyoizotop incelemeleri (Tiroid
sintigrafisi, Ga67 tarama, Positron Emisyon Tomografis-PET), Kontrast incelemeler
(Baryumlu özofagografi, anjiografi) ve ultrasonografik incelemeler tanıya yardımcı
olabilirler. Ayrıca tümörlerin biyolojik aktivasyonunu saptamak için biyokimyasal
olarak alfa-fetoprotein (AFP), beta-human korionik gonadotropin (βHCG), epinefrin,
norepinefrin,
nöron
spesifik
enolaz,
kromogranin
gibi
belirteçlerin
serum
düzeylerinden ayırıcı tanıda yararlanılabilir.
Anterior mediastinal bir kitlede tedavi kararı öncesinde biopsi gerklidir. İnce iğne veya
açık biyopsi gerekebilir. Mediastinoskopi, mediastinotomi, torakotomi yolu ile
yapılacak olan girişim sonucunda patolojik tanı elde edilir. Unresectable lezyonlar için
biyopsi
yeterli
kabul
edilirken
küratif
düşünülmemelidir.
518
rezeksiyon
için
başka
bir
seans
Mediastinal Tümör Ve Kistlerin Sınıflaması
Timoma
Timomaların %95’i anterior mediastende yerleşim gösterirler.
Ön mediastinum
kitlelerinin yaklaşık yarısı timomadır. Timomaların da yaklaşık yarısı malign
potansiyel taşımaktadırlar. Tümör timusun içermiş olduğu epitelial hücreler ya da
lenfositlerden köken alır. Yuvarlak veya oval olabilir. Büyüklüğü çok değişkendir. En
önemli özelliği tümörün kapsüllü olup olmaması ve komşu yapılara invazyonu olup
olmadığıdır.
Benign timoma düzgün kapsüllü bir yapıda olup serilerde malign timomadan biraz
daha sıktır. Kapsül dışına mikroskopik invazyon malign timoma lehine değerlendirilir.
Tümörün komşu bir yapıya invazyonu (mediastinal plevra, perikard, akciğer, lenf
bezleri, büyük damarlar, sinirler, toraks duvarı) mikroskobik olarak belirlenmelidir.
Malign timomalarda sık görülen lokal invazyonlarına rağmen uzak metastaz (akciğer,
kemik, karaciğer, santral sinir sistemi, aksiler ve supraklaviküler lenf nodülleri)
nadirdir.
Timomaların Evrelemesi (Modifiye Masoaka)
Evre I: Tamamen kapsüllü tümör, kapsül invazyonu yok.
Evre II: Lokal invazyon bulgularının olması durumudur.
A-Etraf yağ dokusu yada plevraya makroskobik invazyon
B-Kapsülde mikroskobik invazyonun bulunması.
Evre III: Komşu yapılara (kalp, büyük damar, akciğer) belirgin invazyon olması.
Evre IV-A: Plevral,perikardial metastaz gibi intratorasik yayılımın olması.
Evre IV-B: Lenfojen veya hematojen metastaz.
Timomalı olguların %30-40’ında myastenia gravis ve myastenia gravisli olguların ise
%15 kadarında timoma birlikteliği mevcuttur.
Lenfoid Doku Neoplazmaları
Primer mediastinal lenfoma, erişkinde mediastenin en sık görülen ikinci tümörüdür.
Çocuklarda en sık anterior mediastinal kitle (%45) olarak görülür. En sık anterior
mediastendeki lenf nodları tutulur. Bunun yanında lenfomalar ile mediastenin tüm
bölümlerinde karşılaşılmaktadır.
519
Olguların %20-30’u asemptomatik olup %60-70 inde lokal malign hastalığın
semptomları vardır. %30-35 sistemik belirtiler bulunur. Servikal lenf nodu biopsisi,
mediastinotomi, CT eşliğinde biopsi ile tanı konulur. İnce iğne biyopsileri yanlış sonuç
verebildiği için tercih edilmemelidir. Hodgkin ve Non-Hodgkin Lenfoma olarak
sınıflandırılmaktadırlar.
Bu grup içerisinde lenf nodu hiperplazisi olarak adlandırılan Castleman Hastalığı
bulunmaktadır. Radyolojki olarak tek ve düzgün sınırlı lenf nodu tanımlanır. Bu
lezyonda sıklıkla ön mediastende olmakla birlikte arka mediastende de yerleşim
gösterebilir.
Germ Hücreli Tümörler
Yetişkinlerde ön mediasten kaynaklı tümörlerin %10-15’ini oluştururlar. Teratom,
seminom,
embriyonel
hücreli
karsinom,
koryokarsinom,
endodermal
sinus
tümörü(yolk-sac), teratokarsinom olarak sınıflandırılabilirler.
Teratom
Bu grupta en sık görülen tümörlerdir (%80-85). Teratodermoid tümör eş anlamlı
olarak
ifade
edilmektedir.
Ön
mediasten
yerleşimlidirler.
Genellikle
benign
davranışlıdırlar. Yaklaşık 2/3 ü asemptomatik. Dispne ve öksürük görülebilir. Kıl, diş,
beyin dokusu, kıkırdak ve kemik yapılar içerebilir.
Seminom
En sık malign germ hücreli tümördür. Testis dokusunun tümörüdür. Çoğunlukla genç
erkeklerde görülür. Anterior mediastende lokalize ve olguların %80 i semptomatiktir.
Grafide
büyük
anterior
mediastinal
kitle
saptanır.
AFP,
HCG
belirteçleri
incelenmelidir. Kitleden alınan biopsi ile tanı konur. Tümörün tümü mümkün
olduğunca çıkarılmalıdır. Postop RT yapılmalıdır. KT, rezeksiyonun başarısız olduğu
olgularda uygulanmalıdır.
Nonseminomatöz germ hücreli tümörler
Heterojen bir grubu içermektedir. Yolk-sac karsinomu, embriyonel karsinom,
koryokarsinom bu gruptadır.
Nörojenik Tümörler
Primer mediastinal tümörlerin %15-30’unu oluşturun bu tümörler çocuklarda %50,
erişkinde ise %1-2 malign davranış sergilemektedir. Bazı serilerde nörojenik tümörler
tüm mediasten tümörleri arasında ilk sırada belirtilmektedir.
520
Paravertebral sulkusta sempatik zincir boyunca yerleşim gösterirler. Spinal sinirler ile
de ilişkili olabilirler. Nörofibrom, nörilemmoma, ganglionörinom, Schwann hücreli
tümör, malign Schwannoma, nöroblastom, ganglionöroblastom, paraganglioma
(feokromositoma) ve Askin tümörü bu grupta sınıflandırılmaktadır. Semptomatik
olgularda öksürük, dispne, göğüs ağrısı, Horner sendromu, spinal kord basısı(%3-6),
parapleji olabilir. Ateş, halsizlik sıklıkla malign lezyon ile birliktedir. Bu bulgular hem
benign hem de malign lezyonlu bebek ve çocuklarda görülebilir. PA Akciğer grafisi
vertebral kolona yaslanmış düzgün kenarlı, yuvarlak homojen dansite görülebilir.
Mediastenin Kistik Lezyonları
Anterior Mediasten Kistleri;
Teratodermoid kistler,
Perikardial kistler,
Lenfanjioma(kistik higromalar),
Timik kistler.
Orta Mediastinum Kistleri;
Bronkojenik Kistler,
Gastrik kistler.
Posterior Mediastinum Kistleri;
Özofagus dublikasyon kistleri,
Nöroenterik kistleri.
Diğer kistik lezyonlar
Paratiroid kistleri, duktus torasikus kistleri,
hidatik kistler.
Endokrin Lezyonlar
Bu kitleler arasında retrosternal guatr ile intratorasik ektopik yerleşimli tiroid lezyonları
tanımlanmaktadır. Gerçek intratorasik tiroid oldukça ender gözlenen bir durumdur.
Tiroid sintigrafisinden tanıda yararlanılmalıdır. Bazılarında malign dejenerasyon
gösterilmiştir.
Paratiroid
adenomları
mediastenin
diğer
endokrin
kaynaklı
tümör
grubunu
oluşturmaktadır.
Timusun karsinoid tümörleri paraneoplastik bir aktivasyon göstererek Cushing
Sendromu oluşturabilirler. Bu durumda patoloji MEN (Multiple endokrin neoplazi)
grubunda değerlendirilmelidir. Burada tümörün ACTH salgılaması söz konudur.
521
Mezenkimal Tümörler
Tüm mediasten tümörlerinin %7 kadar bir kısmını oluştururlar. Malignite potansiyeli
yüksek lezyonlardır.
Yağ dokusu kaynaklı, lipom, liposarkom; vasküler kaynaklı, hemanjiom, anjiosarkom,
hemanjioendotelioma,
hemanjioperisitoma;;
düz
kas
kökenli
leiomyom,
leiomyosarkom; lenf dokusu kaynaklı lenfanjiom; fibröz doku kaynaklı fibrom,
fibrosarkom, malign fibröz histiositom ve çizgili kas kaynaklı rabdomyom,
rabdomyosarkom bu tür tümörlerdendir. Mezotelyoma yine bu grup içerisinde
incelenen tümörüdür. Lokalize fibröz tümör, sinovyal sarkom, menenjiom, ksantom
ekstraskeletal sarkom ve primer neuroendokrin karsinom tanımlanmış ender
tümörlerdir.
Öğrenme kolaylığı açısından; ön mediastenin en sık görülen tümörleri timoma,
lenfoma, germ hücreli tümörlerdir. Orta mediastende ise en sık lenfoma gözlenirken
kistik lezyonlarda bu bölgede sıktır. Arka mediastene yerleşen lezyonlar arasında ise
baskın
tümör
tipi(%70)
nörojenik
tümördür.
Lenfoma
mediastenin
tüm
komponentlerinde yerleşebilen malignitedir.
Mediastinal Kitleleri Taklit Eden Lezyonlar
Servikal bölge lezyonları olan substernal guatr, kistik higroma; iskelet sistemine ait
kemik tümörü, paravebtebral soğuk abse; spinal kanal kaynaklı anterior meningosel.
ekstramedüller hematopoezis; talessemi, sferositoz; vasküler orijinli; sistemik ve/veya
pulmoner lezyonlar; özofagusa ait akalazya, epifrenik divertikül, leiomyom, primer
tümör; akciğer tümörleri, sekestrasyon (ekstralober) ve diafragmaya ait hiatus
hernileri, morgagni hernileri; pankreatik torasik psödokistler mediastenin primer
lezyonları ile karışabilirler.
522
41.
Doç Dr. Tamer Altınok
Selçuk Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
AKUT MEDİASTİNİTLER
Mediastinit, mediastenin infeksiyöz ve non-infeksiyoz nedenlere bağlı olarak fibrozise
kadar gidebilen inflamasyonudur. Etyolojisinde rol oynayan nedenler Tablo 41.1 de
sunulmuştur.
Tablo 41.1: Etiyolojiye göre sınıflama
I. İnfeksiyona bağlı mediastinitler
A. Akut mediastinitler
Travmatik mediastinitler; özefagus perforasyonu, median sternotomi insizyonu
sonrası, boyun cerrahisi sonrası
Nontravmatik mediastinitler; üst solunum yolu enfeksiyonları, akciğer, plevra,
subfrenik,
retrofaringeal,
dental,
paravertebral
infeksiyonlar,
vertebra
ve
sternum
osteomyelitini takiben, servikal infekte lenf bezi eksizyonu
B. Kronik mediastinitler
Tüberküloz ve histoplazmozis
II. İlaca bağlı mediastinitler
III. Radyasyona bağlı mediastinitler
IV. İdiopatik mediastinitler
Mediastinal enfeksiyonların muhtemel 4 kaynağı vardır.
1)direkt kontaminasyon,
2)hematojen veya lenfatik yayılım,
3)boyun veya retroperitoneal enfeksiyonun yayılması,
4) akciğer, plevra veya göğüs duvarından yayılım.
Tutulan organ ve dokulara göre belirtiler ve tedavi yaklaşımı değişir.
Antibiyotikten önceki devirlerde mediastinit, pulmoner veya plevral enfeksiyonun
yayılımı sonucu öncelikle baş ve boyun infeksiyonları olmak üzere komşu yapıların
infeksiyonları sonucu oluşmakta idi. Bugün ise, mediastinitin en sık nedeni cerrahi
girişimlerden sonra mediastenin direkt kontaminasyonudur.
Mediastinit tanısı için aşağıdakilerden en az bir tanesi gerekmektedir (1):
523
Mediastinal doku veya sıvı kültüründe izole edilen bir organizma,
Operasyon sırasında tesbit edilen mediastinit kanıtı,
Aşağıdaki durumlardan durumlardan birinin görülmesi:
Göğüs ağrısı, sternal instabilite veya mediastenden pürülan akıntı veya kan kültürü
veya mediastinal drenajdan izole edilen bir organizma ile birlikte ateş (>38°C) olması.
Mediastinit akut veya kronik olabilir. Her ikisinde de etiyoloji sıklıkla infeksiyozdur.
Akut mediastinit bakteriyel infeksiyonla ilişkili iken kronik mediastinit sıklıkla
histoplazmozis ve tüberküloz gibi granulomatöz infeksiyonlarla bağlantılıdır. Kronik
mediastinitler genellikle asemptomatiktir. İleri dönemde mediastinal yapılara bası ve
obstruksiyona bağlı semptom ve bulgular görülebilir. Akut mediastinitin kronikleşmesi
çok nadir görülür.
İdiopatik mediastinal fibrozisli hastaların genellikle başka organ veya
dokularında da benzer fibrotik oluşumlar (Reidel struması, retroperitoneal fibrozis,
orbitanın psödotümör gibi) gözlenmektedir.
Akut Mediastinit
Akut mediastinit interplevral aralığı dolduran ve mediastinal organları çevreleyen
mediastinal bağ dokuyu tutan ciddi bir infeksiyondur (2). Akut mediastinal
infeksiyonun büyük çoğunluğu özefagial perforasyon (posterior mediastinit) sonucu
veya transsternal kardiak girişimi takiben (anterior mediastinit) veya penetran
travmalar sonucu ortaya çıkmaktadır.
Özefagus perforasyonlarının 3/4 ü tanı veya tedavi amaçlı yapılan endoskopik
işlemler sırasında gelişir. Ayrıca Boerhave Sendromu gibi şiddetli kusma ile seyreden
intraözefagial basıncın ani ve çok fazla arttığı durumlarda da görülür. Rüptür
genellikle alt 8 cm lik bölgede ve tipik olarak vertikal ve sol posterolateral duvarda
olur. Özefagusun torasik bölümünün perforasyonu sonucu visseral mediatenin
kontaminasyonu hızlı bir şekilde olur.
Akut mediastinit, zaman zaman, orofaringeal apseye neden olan odontojenik veya
peritonsiller apse gibi ciddi servikal bölge infeksiyonlarının fasiyal planlar boyunca
mediastinuma doğru yayılması sonucu olur (3). Ayrıca, iatrojenik orofaringeal
perforasyon, servikal travma, epiglottit, parotit, sinuzit, sternoklavikuler eklem
infeksiyonu ve intravenöz ilaç kullanımı da akut mediastinit nedenleri arasındadır.
Bundan başka, çok nadir de olsa lenf nodu biopsisi, troidektomi, trakeostomi ve
524
mediastinoskopi gibi boyunda yapılan herhangi bir cerrahi girişimi takiben de
mediastinit gelişebilir. Boyun fasyal planların mediastinal planlarla devam etmesi
infeksiyonun boyundan yayılımını kolaylaştırır. Retrovisseral alan, pretrakeal alan ve
karotid kılıf boşlukları aşağı doğru direkt ilerlemeye izin verir. Yerçekimi, solunum ve
intratorasik negatif basınç, intratorasik yayılımda etkindir (4). Bunların hepsinin
sonucu
oluşan
mediastinit
“desendan
nekrotizan
mediastinit”
olarak
tanımlanmaktadır ve bu tanının doğrulanması için aşağıdaki kriterler ileri sürülmüştür
(5):
Şiddetli orofaringeal infeksiyonun klinik belirtileri
Mediastinitin karakteristik radyolojik görünümünün gösterilmesi
Operasyonda veya postmortem araştırmada veya her ikisinde de
nekrotizan mediastinitin kanıtlanması
Orofaringeal infeksiyon ile nekrotizan mediastinit gelişim süreci
arasında bağlantı tesbit edilmesi
İnfeksiyonun retroperitoneal veya subfrenik alanlardan mediastene yayılımı, akut
mediastinitin nadir nedeni olmasına karşın önemini korumaktadır (5).
Mikrobiyoloji
Özefagus perforasyonu sonucu veya odontojenik infeksiyonun yayılımına sekonder
olan infeksiyonlarda etken hem gram negatif aerob hem de anaerob organizmalar
olabilir. En yaygın anaerob organizmalar, anaerob Streptokoklar ve Bakteriodes spp.
dir (4). Akut mediastinitte infeksiyon sıklıkla polimikrobialdir. Desoryante veya debil
hastalarda sıklıkla normal orofaringeal florada bulunan kandida ve aspergillus neden
olabilir (6). Vertebral veya kot osteomyelitine sekonder mediastinit oldukça nadirdir,
ama tüberkuloz veya fungal infeksiyonlu hastalarda bildirilmiştir (7).
Klinik
Akut mediastinitli hastalar sıklıkla, ateş, lökositoz, göğüs ağrısı, disfaji ve solunum
sıkıntısı gibi semptomlarla başvururlar. Semptomlar servikal infeksiyonun tesbitinden
ortalama 48 saat sonra başlar. Servikal infeksiyonda ödem, boyun ağrısı, disfaji ve
odinofaji erken dönemde ortaya çıktığı için kolaylıkla farkedilebilir (8). Solunum
sıkıntısı, özellikle erişkinlerde, plevral tutuluma bağlı plevral efüzyon veya
pnömotoraksı düşündürürken, disfaji özefagus perforasyonu için karakteristiktir.
525
Radyolojik Bulgular
Göğüs grafisinde esas bulgu, mediastende diffüz genişlemedir. Buna hava
kabarcıkları veya sıvı seviyesi gibi mediastinal apse bulguları eşlik edebilir (9).
Pnömomediastinum ve pnömotoraks sıklıkla özefagus perforasyonuyla ilişkilidir ve
genellikle diğer nedenlerle oluşan mediastinitlerde görülmez. Aynı zamanda plevral
veya perikardiyal efüzyon olabilir.
Radyografik bulgular;
Retrofaringeal alanda hava-sıvı seviyesi ile birlikte olan veya olmayan
genişleme
Trakeal hava sütünunda anteriora yer değiştirme,
Mediastinal amfizem
Normal servikal lordozun kaybolması şeklinde özetlenebilir (5)
Özefagus perforasyonlu olgularda, gastrografin ile yapılan özefagogram tanının
doğrulanmasında kullanılır (10).
(perforasyon
mevcut
olduğu
Ancak %10-%25 oranında yanlış negatif
halde
özefagusun
sağlam
görünmesi)
sonuç
verebilmektedir. Ayrıca suda çözünen kontrast maddelerle küçük kaçakların tesbiti
zordur ve aspire edildiklerinde pulmoner ödem gelişebilir. Bu nedenle, baryum,
mediastinal inflamasyon riski yüksek olsa bile gerektiğinde kullanılabilir (11).
Kontrast maddenin oral alımı sonrası mediastene ya da plevral boşluğa kaçışı
gözlenerek özefagus perforasyon tanısı konabilir. Distal özefagus perforasyonunda
sol hidrotoraks veya hidropnömotoraks saptanırken orta özefagus perforasyonunda
sağ plevral değişiklikler görülür
Toraks bilgisayarlı tomografisi (BT), mediastinal tutulumun derecesini belirlemede
diğer tanı araçlarından daha duyarlıdır. BT bulguları, apse formasyonu, normal yağ
planlarını silecek şekilde doku kaybı ile birlikte yumuşak doku infiltrasyonu, daha
önce olan lenfadenopatinin kaybolması şeklinde özetlenebilir (12). BT, mediastinal
sıvı birikimini ve genişliğini, extraluminal havayı, perikardiyal ve plevral efüzyon
varlığını ve yumuşak doku ödemini gösterebilir. Ek olarak, sıvı koleksiyonunun
intratorasik ve extratorasik komşu yapılarla bağlantısını değerlendirebilir (9).
Desenden nekrotizan mediastinitli olgularda infeksiyon nedeninin erken tesbiti ve
tedavisi için servikal BT de gereklidir.
BT ayrıca rehber eşliğinde perkutan biopsi ve drenaj yapılmasında da yardımcı olur
(13). Perioperatif periyodda cerrahi drenajın ve muhtemel reoperasyon zamanının
526
hesaplanmasında BT önemli bir değere sahiptir. Servikotorasik BT genellikle,
herhangi bir cerrahi drenaj-debridman sonrası ve hastanın klinik durumunun
bozulması durumunda tekrarlanır. Hastanın klinik durumunda düzelme olmaması
veya normal servikotorasik BT ile uyumsuz bir klinik olması veya hastada intraabdominal infeksiyonu düşündüren semptomlar olması halinde değerlendirme
abdominal BT ile tamamlanabilir (14).
Tedavi
Tedavinin ana prensipleri uygun antibiyotik ve cerrahi drenajdır. Tedavi primer
patoloji ve klinik duruma göre yönlendirilmelidir. Kültür antibiogram sonuçları
belirlenene kadar Piperasillin-tazobactam gibi ıntravenöz geniş spektrumlu antibiyotik
ile başlanmalıdır. Sepsise ve mediastine olan üçüncü boşluk kayıplarına sekonder
gelişen hipovolemi ıntravnöz uygun sıvılarla düzeltilmelidir (7).
Cerrahi drenaj altın standart olmaya devam etmektedir, ama mediastene cerrahi
yaklaşım ve özellikle mediastinal drenajın optimal şekli konusunda tartışma devam
etmektedir ve yalnız başına servikal drenajdan, torakotomi veya torakoskopi ile
birlikte servikal drenaja kadar değişmektedir (3-5,7,8,15). Oluş mekanizması,
semptomları ve servikal infeksiyonun komplikasyonlarını anlamak için servikal fasyal
planları bilmek gereklidir (3,4,7).
Bütün işlemler, baş-boyun cerrahı ve göğüs cerrahından oluşan multidisipliner bir
takım
ile
uygulanmalıdır.
Odontogenik
apsenin
neden
olduğu
olgularda
maksillofasyal cerrah da bu takıma dahil olmalıdır. Agresiv servikal yaklaşım
(servikotomi) kabul gören bir uygulamadır. Boyuna sıklıkla, ya sternokleidomastoid
kasın anterior kenarı boyunca longitudinal bir insizyonla veya transvers collar bilateral
insizyonla veya her ikisiyle yaklaşılır. Tutulan servikal alanlar açılır, drene edilir ve
nekrotik dokular debride edilir ve servikal yara açık bırakılarak sekonder iyileşmeye
bırakılır. Üst anterior mediastinuma, pretrakeal alan boyunca transservikal olarak
girilebilir ve künt parmak diseksiyonu ile trakeal bifurkasyon seviyesine kadar
açılabilir. Üst posteriora ise retrofaringeal alan diseksiyonunun aşağı doğru
genişletilmesi ile girilir (4,5,7).
Mediastinal infeksiyon karina veya T4 vertebra altına ilerliyorsa transtorasik yaklaşım
gereklidir (4,5); işlem mediastinal plevranın longitudinal olarak açılması, mediastenin
debridmanı
ve
nekrotik
dokunun
komplet
eksizyonunu
içermektedir.
Eğer
gerekiyorsa, plevral kavitenin drenajı ile birlikte dekortikasyon veya mediastinoplevral
527
irrigasyon için göğüs tüpü yerleştirilir. Nekrotik dokunun debridmanı mutlak
gereklidir.Başlangıçta sadece servikotomi
ile tedavi edilen hastaların yaklaşık
yarısında infeksiyonun alt mediastene ilerlemesi nedeniyle takiben torakotomi
gerekmektedir (16).
Göğüsün optimal drenajı ve debridmanı için bazı araştırmacılar son zamanlarda
torakoskopik drenaj veya minitorakotomili veya minitorakotomisiz debridmanı
bildirmekte iken, subksifoid yaklaşım, clamshell insizyon ve median sternotomi gibi
değişik yaklaşımlar da sunulmaktadır (4,5,17-21).
Sadece boyun drenajı yapılan hastalar ile boyun ve torasik drenajın birlikte yapıldığı
hastalar arasında mortalite yönünden anlamlı fark vardır (sırasıyla %47, %19) (22).
Bunun yanı sıra median sternotomi ile komplet torasik drenaj da yapılabilmektedir
(17). Sternotomi ile toraksın özellikle posterobasal kompartmanlarına erişimi zorluğu
nedeni ile clamshell insizyonu önerilmektedir. Clamshell insizyonu, bilateral
dekortikasyon ve perikardiyektomi ile birlikte mediastinal debridmana da izin verdiği,
aynı
zamanda
sternal
dehisens
(yarılma)
ve
osteomyelit
gibi
potansiyel
komplikasyonlara engel olduğu için tercih edilmektedir (19). Bütün bu metodların
kendine göre hem avantajları hem de dezavantajları bulunmaktadır.
Video yardımlı torakoskopik cerrahinin (VATS) çok büyük katkısı vardır. Yeterince
erken uygulandığında VATS seçilmiş olgularda kolay eksplorasyon (cerrahi alanın
incelenebilirliği) ve drenaj sağlar (23). Ayrıca video-yardımlı mediastinoskopi de
karinanın üstündeki mediastinal apselerde bir seçenek olarak sunulmaktadır (24).
Şimdilerde posterolateral torakotomi en iyi yaklaşım gibi görünmektedir. Prevertebral
ve paraözefagial alanları ortaya çıkarır ve infeksiyonun trakeal bifurkasyonun altına
doğru ilerlediği olgularda ipsilateral mediastinum ve perikardiyuma ulaşılmasına izin
verir.
Aynı zamanda, sternotomi ve clemshell insizyonun aksine posterolateral
torakotomi sternal osteomyelit riski taşımaz. Operasyon tarafının seçimi koleksiyon
tarafına bağlıdır. Trakeostomi sıklıkla gerekebilir ancak çok seçici uygulanmalıdır.
Prognoz
Ne yazık ki modern antimikrobiyal tedavi ve BT görüntülemeye karşın yüksek
mortalite oranları (%25-50) bildirilmektedir (13,19,25). Yüksek mortalite oranının ana
nedenleri gecikmiş tanı ve mediastenin gecikmiş veya uygun olmayan drenajıdır.
Primer infeksiyonun başlangıcı ile hastaneye yatış arasında geçen süre 5 ile 22 gün
arasında değişmekte ve mortalite ile ilgili önemli bir faktör olmaktadır (2).
528
İnfeksiyonun mediastene doğru derin servikal planlar boyunca yayılımı sonucu geniş
selülit, nekroz, apse formasyonu ve sepsis oluşabilir (6). Komplikasyonlar ise ARDS,
akut böbrek yetmezliği, pnömoni ve şilotoraksdır.
Derin alan infeksiyonlu hastalar için bir algoritm belirtilmekte (14). Bu algortimde
erken desendan nekrotizan mediastinitin tesbiti için kontrastlı servikotorasik BT ile
birlikte geniş spektrumlu antibiyotiklerin başlangıçta kullanımı vurgulanmakta.
İnfeksiyon mevcut ise debridmanı takiben boyun ve torasik drenaj esansiyeldir.
Herhangi bir infeksiyon progresyonunu tesbit etmek için 48-72 saat içinde BT tekrarı
yararlıdır. Progresyon saptanan olgularda ileri cerrahi tedavi gereklidir
Özefagus perforasyonu sonucu negatif torasik ve pozitif gastrik basınçların etkisiyle
mediastene ve plevral alana gastrik içeriğin drenajı artar. Konservatif tedavi,
parenteral
ve
enteral
beslenmeyi,
antibiyotik
uygulanmasını,
nasogastrik
aspirasyonu, H2 reseptör antogonisti uygulamasını ve plevral drenajı içerir (26).
Özefagus rüptürünün erken döneminde cerrahi girişim endikasyonu vardır. Seçilecek
metod, laserasyonun tamiri ve iyi vaskulerize doku flebi ile destek ve mediastinal
debridmandır. Rekonstruksiyonlu veya rekonstruksiyonsuz rezeksiyon işlemleri,
sadece altta yatan özefagus hastalıkları veya malignitesi olan olgularda yapılmalıdır
(26). Gecikmiş olgularda en iyi yaklaşım şekli ile ilgili tartışma devam etmektedir.
Bazıları özefagektomiyi önerirken diğerleri, başvuru zamanından bağımsız olarak
primer tamirde ısrar etmektedirler (26-28). İleri mediastinitli ve özefagus duvar
nekrozlu hastalarda servikal özefagostomi ve gastrostomi ile özefagial dışa
ağızlaştırma teknikleri kullanılabilir (27).
Malign özefagial perforasyon ve fistüllerin palyasyonunda kaplı kendi kendine
genişleyebilen (self-expandable) stentlerin kullanılabilirliği kanıtlanmıştır. Stentin
komplikasyonları ise, migrasyon, basınca bağlı iskemi, ülserasyon, perforasyon ve
endoprotezin ucunda reaktif stenoz, ve çıkarım sırasında kanama, zedelenme, veya
çıkarmada başarısızlıkdır (29). Her ne kadar deneyim gerektiren bir uygulama olsa
da gecikmiş tanılı veya genel durum bozukluğu olan hastalarda self-expandable
stentler mediastinal bulaşı etkili bir şekilde kontrol altına alabilmesi nedeniyle
uygulanmalıdır.
Akut mediastinitte hastalık süreci uniform olmadığı ve hala yaşamı tehdit edici bir
infeksiyon olduğu için tedavi her hasta için ayrı düşünülmeli ve bireyselleştirilmelidir.
Hastalığın doğal sürecini ve anatomik dağılımını iyi bilmek, erken tanı, uygun ve
529
yeterli antimikrobiyal tedavi ile birlikte yeterli mediastinal drenaj ve debridman
sağlanması mortaliteyi düşürürken tedavi başarısını arttıracaktır.
Poststernotomi Mediastinit
Poststernotomi mediastinit kardiak cerrahide nadir görülen ancak kalbi, sutur
hatlarını, prostetik malzemeleri veya kapakları etkileyen ciddi bir problemdir (30).
Poststernotomi mediastinit için risk faktörleri, obesite, DM, KOAH, periferal vaskuler
hastalıkların varlığı ve bilateral internal mammarian arter kullanımıdır (31).
Günümüzde cerrahi tedavi uygulanan daha yaşlı ve immün baskılanması olan hasta
sayısının artması mediastinit insidansını arttırmaktadır. Mortalite oranı %16.5 ile %47
arasında değişmektedir (32). Mortalite nedeni generalize sepsis, endokarditis, fatal
hemoraji veya sekonder multiple organ disfonksiyonudur
Genellikle gr(-) ve gr(+) yanında fungal etkenler infeksiyona neden olur. Deri
florasında bulunan Staph aureus en sık etkendir.
Tedavi antibiotikli irrigasyon, debridman ve sternumun tekrar kapatılmasını
içermektedir. Omentum gibi iyi kanlanan dokuların transpozisyonu ve kas flebleri
primer kapatmada kullanılabilir. Günümüzde en sık kullanılan doku pektoralis major
kasıdır. Daha sonra bunu rektus abdominis ve büyük omentum flepleri veya her
ikisinin kombinasyonu izler (33).
KAYNAKLAR
1. Mangram AJ, Horan TC, Pearson ML, et al. Guidline for prevention of surgical
site infection, 1999. Centers for Disease Control and Prevention (CDC)
Hospital Infection Control Practices Advisory Committee. Am J Infect Control
1999;27:97-132.
2. Papalia E, Rena O, Oliaro A, et al. Descending necrotizing mediastinitis:
surgical management. Eur J Cardiothorac Surg 2001;20:739-42.
3. Fry WA, Shields TW. Acute and chronic mediastinal infections. In Shields TW,
editor. Mediastinal surgery. Philadelphia: Lea&Febiger; 1991:101-8.
4. Marty-Ane Ch-H, Berthet J-P, Alric P, et al. Management of descending
necrotizing mediastinitis: an agressive treatment for an agressive disease. Ann
Thorac Surg 1999;68:212-7.
5. Estrera AS, Lanay MJ, Grisham JM, et al. Descending necrotizing
mediastinitis. Surg Gynecol Obstet 1983;157:545-52.
6. Kiernan PD, Hernandez A, Byrne WD, et al. Descending cervical mediastinitis.
Ann Thorac Surg 1998;65:1483-8.
530
7. Ewing HP, Hardy ID. The mediastinum. In: Baue AE, Geha AS, Hammond GI,
et al, editors. 5th edition, Glenn’s thoracic & cardiovascular surgery, vol. I.
Norwalk (CT): Appleton & Lang; 1991:584-7.
8. Van Nata TL, Lannetoni MD, et al. Acute necrotizing mediastinitis. In:
Patterson GA, Cooper JD, Deslauriers J, et al, editors. 3rd edition, Pearson’s
thoracic & esophageal surgery, vol. I. Philadelphia: Churchill Livingstone;
2008:1521-8.
9. Boisella PhM. Diffuse mediastinal abnormalities. In: McLoud ThC, editor.
Thoracic radiology, the requisites. St Louis (MO): Mosby; 1998: 464-7.
10. Goldstein LA, Thompson WR. Esophageal perforations: a 15-year experince.
Am J Surg 1992;143:495-503.
11. Gollup MJ, Bains MS. Barium sulfate: A new (old) contrast agent for diagnosis
of postoperative esophageal leaks. Radiology 1997;202:360-2
12. Carrol CL, Jeffrey BJr, Federle MP, et al. CT evaluation of mediastinal
infections. J Comput Assist Tomo 1987;11:449-54.
13. Gobien RP, Stanley JH, Gobien BS, et al. Percutaneous catheter aspiration
and drainage of suspected mediastinal abscesses. Radiology 1984;151:69-71.
14. Freeman RK, Vallieres E, Verrier ED, et al. Descending necrotizing
mediastinitis: an analysis of the effects of serial surgical debridement on
patient mortality. J Thorac Cardiovasc Surg 2000;119(2):260-7.
15. Marty-Ane CH, Alauzen M, Alric P, et al. Descending necrotizing mediastinitis:
advantage of mediastinal drainage with thoracotomy. J Thorac Cardiovasc
Surg 1994;107:55-61.
16. Wheatley MJ, Kirsch S, Ggo O, et al. Descending necrotizing mediastinitis:
Transcervical drainage is not enough. Ann Thorac Surg 1990;49:780-4.
17. Casanova J, Bastos P, Barreiros F, et al. Descending necrotizing mediastinitis
– successful treatment using a radical approach. Eur J Cardiothorac Surg
1997;12:494-6.
18. Gorlitzer M, Grabenwoeger M, Meinhart J, et al. Descending necrotizing
mediastinitis treated with rapid sternotomy followed by vacuum-assisted
therapy. Ann Thorac Surg 2007;83:393-6.
19. Ris HB, Banj A, Furrer M, et al. Descending necrotizing mediastinitis: surgical
treatment via clamshell approach. Ann Thorac Surg 1996;62:1650-4.
531
20. Isowa N, Yamada T, Kijima T, et al. Successful thoracoscopic debridment of
descending necrotizing mediastinitis. Ann Thorac Surg 2004;77:1834-7.
21. Nagayasu T, Sh Akamine, Tadayuki O, et al. Thoracoscopic drainage with
wound edge protector for decending necrotizing mediastinitis. Inter Cardivasc
Thorac Surg 2003;2:58-60.
22. Corsten MJ, Shamji FM, Odell PF. Optimal management of descending
necrotizing mediastiniis. Thorax 1997;52:702-8.
23. Min H-K, Choi YC, Shim YM, et al. Descending necrotizing mediastinitis: a
minimally invasive approach using video-assisted thoracoscopic surgery. Ann
Thorac Surg 2004;77:306-10.
24. Shimizu
K,
Otani
Y,
Nakano
T,
et
al.
Successful
video-assisted
mediastinoscopic drainage of descending necrotizing mediastinitis. Ann
Thorac Surg 2006;81:2279-81.
25. Sancho LMM, Minamoto H, Fernadez A, et al. Descending necrotizing
mediastinitis: a retrospective surgical experience. Eur J Cardiothorac Surg
1999;16:200-5.
26. Eroğlu A, Kurkcuoğlu IC, Karaoglanoglu N. et al. Esophageal perforation: the
importance of early diagnosis and primary repair. Dis Esofagus 2004;17:91-4.
27. Salo JA, Seppala KMY, Pitkaranta PP, et al. Spontaneous rupture and
functional status of the esophagus. Surgery 1992;112(5):897-900.
28. Port JL, Kent MS, Korst RJ, et al. Thoracic esophageal perforations: a decade
of experience. Ann Thorac Surg 2003;75:1071-4.
29. Yuasa N, Hattori T, Kobayashi Y, et al. Treatment of spontaneous esophageal
rupture with a covered self-expanding metal stent. Gastrointest Endosc
1999;49(6):777-80.
30. El Oakley RM, Wright JE. Postoperative mediastinitis: classification and
management. Ann Thorac Surg 1996;61:1030-6.
31. Borger MA, Rao V, Weisel RD, et al. Deep sternal wound infection: risk
factors and outcomes. Ann Thorac Surg 1998;65:1050-6.
32. De Feo M, Renzulli A, Ismeno G, et al. Variables predicting adverse outcome
in patients with deep sternal wound infection. Ann Thorac Surg 2001;71:32431.
33. Jurkiewicz MJ, Bostwick J, Hester TR, et al. Infected median sternotomy
wound. Successful treatment with muscle flaps. Ann Surg 1980;191:738-44.
532
42.
Prof. Dr. Alper Toker ve Dr. Berker Özkan
İstanbul Üniversitesi İstanbul Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
MYASTHENİA GRAVİS TEMEL BİLGİLER
Myasthenia Gravis, istemli kaslarda aktivite ile artan ve dinlenmekle iyileşen anormal
kas yorgunluğu ile karakterize otoimmun kökenli postsinaptik bir nöromuskuler
kavşak hastalığıdır. Tek fiberli elektromiyografik incelemede ardışık uyarılara karşı
azalmış yanıtla karakterizedir. Antikolinesteraz uygulanması ile belirgin iyileşme
izlenir. Hastaların çoğunda timus anomalileri görülür.
Kısa Tarihçe
Myasthenia Gravis hastalığı 17. yüzyılda olgu sunumu şeklinde literatüre girmiştir. İlk
olarak 1893’de Erb ve Goldflam tarafından bulbar semptomlar, pitozis ve servikal kas
zayıflığı semptomlar kompleksi olarak adlandırılmıştır (1). Jolly 1895’te etkilenen
kaslardaki tekrarlanan uyarıyla azalan cevabı elektromyografik olarak göstermiş,
tedavide fizostigmin kullanımını ve hastalığın Myasthenia Gravis Pseudoparalytica
olarak adlandırılmasını önermiştir (2). Berlin Nöroloji ve Psikyatri Birliği 1899 yılında
hastalığın
isminin
kısaltılarak
Myasthenia
Gravis
olmasına
karar
vermiştir.
Neostigmin 1934’te antikolinesteraz ajan olarak tedavideki yerini almış (3), Osserman
ise 1954’te günümüz myasteni tedavisinin temel ilacı olan pridostigmin bromid
(Mestinon) kullanımını bildirmiştir (4).
Timektomi operasyonu ise, Zürih’te 1911 yılında Sauerbruch’un hipertiroidisi olan
myastenik genç bir kadın hastaya tiroidektomi sırasında uyguladığı timus rezeksiyonu
sonrasında hastanın myastenia gravis şikayetlerinin de yok olmasıyla literatüre
girmiştir (5). Blalock MG hastalarında timus dokusunun cerrahi olarak çıkarılmasıyla
semptomlardaki düzelmeyi rapor etmiş ve 1944 yılında yayınladığı 20 vakalık
serisiyle timektomi operasyonunun parsiyal sternotomi yoluyla yapılarak MG
tedavisindeki yerini almasını sağlamıştır (6-8).
533
Epidemiyoloji
Nadir bir hastalık olan myasthenia gravisin prevalansı 1 milyonda 50–150, insidansı
ise 1 milyonda 4-15 arasında değişmektedir. Kadınlarda daha sık görülür. Kadınlarda
2-3. dekatta erkeklerde ise 5. dekattan sonra daha sık ortaya çıkar.
Klinik Belirti ve Bulgular
Hastalığın en önemli özelliği yorulunca artan dinlenince iyileşen kas zayıflığıdır.
Hastalar sabahları iyi olup gün içinde giderek kötüleştiklerinden yakınırlar.
MG
sıklıkla oküler semptomlarla (pitozis ve diplopi) başlar. Pitoz sıklıkla unilateraldir,
bilateral olduğunda asimetrik izlenir. Ekstraoküler kas tutulumu genellikle bilateraldir.
Orbicularis oculi kas zayıflığı en önemli bulgu olup, remisyondaki hastalarda bile
saptanır. MG %10-15 hastada oküler kaslarla sınırlı kalır. İki yıldan fazla jenaralize
hale gelmeyen hastalık oküler myasteni olarak adlandırılır. Diğer hastaların çoğunda
kısa sürede bulber ve ekstremite kaslarında semptomlar oluşarak jenaralize myasteni
ortaya çıkar. Bulber belirtiler; nazone konuşma, yutma ve çiğneme güçlüğü, ağır
hastalarda ise solunum zorluğudur. Sıklıkla bilateral oluşan fasyal kas güçsüzlüğü
tipik bir myastenik gülümseme görüntüsüne neden olur. Ekstremite tutulumu kollarda
proksimal ve distal, bacaklarda ise sıklıkla proksimaldedir. En sık tutulan kaslar; el
parmak
ekstansörleri,
triceps,
iliopsoas,
deltoid
ve
Hamstring
grubu
(Semimembronozus, semitendinozus ve biceps femoris) kaslarıdır. Hastalarda
sadece anormal motor muayene bulguları mevcut olup kemik veter refleksleri normalcanlanmış ve duyu muayenesi tümüyle normaldir. Enfeksiyonlar ve ağır stres
oluşturacak tüm durumlar hastalığı ağırlaştırır. MG birkaç günden birkaç yıla kadar
değişen remisyon ve alevlenmeler şeklinde sürer. Myastenik hastalardaki klinik
bulgular Osserman (9) tarafından sınıflanmıştır (Tablo 42.1).
Tablo 42.1: Modifiye Osserman sınıflaması
Evre I
Evre II A
Evre II B
Evre III
Evre IV
Oküler MG
Hafif jenaralize MG
Orta düzeyde jenaralize MG
Fulminan (ciddi jenaralize) MG
Myastenik kriz, hayatı tehdit eden solunum sıkıntısı
534
Etyopatogenez
Myasthenia Gravis hastalarında çizgili kaslardaki postsinaptik yerleşimli nikotinik asetil kolin
reseptörlerine karşı otoantikorlar oluşur. Antiasetilkolinesteraz reseptör (Anti-AchR)
antikorları kompleman aracılığı ile postsnaptik membran harabiyetine neden olur. Ayrıca
antikorların birleştiği reseptörler daha hızlı yıkılır ve sayıları azalır. Bazı hastalarda ayrıca
anti MuSK (kasa spesifik tirozin kinaza karşı antikor) adı verilen antikorlar bulunmuştur.
Anti-AchR antikorları B lenfositleri tarafından üretilse de, otoimmün cevabın oluşumu
yardımcı T hücreleri ile olur. Otoimmün yanıtın nasıl başladığı bilinmemektedir.
Myasteniklerin %10’unda timoma, %70 kadarında timik hiperplazi tespit edilir ve hastaların
çoğu timektomiden yarar görür. Timusta immunolojik olarak kendi antijenlerine cevap veren
zararlı T hücreleri yıkılmaktadır, timus yüzeyinde AchR taşıyan myoid hücreler bulunur.
Timik lenfositler anti AchR antikoru üretebilmektedir, ancak timusun etyopatogenezin hangi
evresinden sorumlu olduğu halen kesinleşmemiştir.
Myastenik bir nöromuskuler bileşkede çok sayıda reseptörün zarar görmesi ve birleşen AchAchR miktarının azalmasıyla son plak potansiyeli düşer ve aksiyon potansiyeli
oluşturabilecek amplitüde ulaşamaz. Birçok kavşakta aksiyon potansiyeli oluşamazsa kas
zaafı ortaya çıkar. Gelen ilk impuslarda yeterli asetil kolin salgılanacağından, birçok reseptör
yıkılmış olsa da salgılanan asetil kolinin sağlam kalan reseptörler ile birleşme oranı yüksektir.
Yeterli sayıda kas lifinde aksiyon potansiyeli oluştuğundan ilk impuslarda kas zaafı oluşmaz.
Her yeni gelen impulsta serbest kalan asetil kolin miktarı azalacağından son plak potansiyel
amplitüdü giderek azalır ve aksiyon potansiyeli oluşturamaz, tekrarlanan impulslar sonrası kas
zaafı ortaya çıkar (9-11).
Tanı
İlerlemiş okülobulber semptomları olan ve tipik myastenik yüzlü hastada tanı kolaylıkla
konabilir. Ancak sadece pitozis, diplopi, çiğneme veya konuşma güçlüğü ile başvuran
hastalarda myasthenia gravis tanısı gecikebilir. Myasthenia gravis’de ayırıcı tanı ve eşlik eden
hastalıklar Tablo 42.2 ve Tablo 42.3’de belirtilmiştir.
Tanı Basamakları
1. Anamnez: Aktivite ile artan şikayetlerin varlığı ve spontan remisyonlar
2.Asetilkolin esteraz ile kas gücünde düzelme (Edrofonyum testi)
3. Tekrarlayan sinir uyarı testi: Sinire saniyede 3 uyarı verilerek aksiyon potansiyelleri
kaydedilir. Yanıtta % 15 üzerinde azalma pozitif kabul edilir.
535
4. Tek lif EMG
5. Antiasetilkolin reseptör antikor tayini: Radyoimmunassey yöntemiyle bakılabilir.
MG için spesifiktir. Jenaralize hastalıkta %85 pozitiftir, ancak okuler myasthenilerde
pozitiflik %50’den azdır.
Tablo 42.2: Myasthenia gravis’de Ayırıcı Tanı
Konjenital Myasthenik Sendromlar (KMS)
Mitokondriyal Hastalıklar (Progresif Eksternal Oftalmopleji)
Multipl Skleroz
İlaca Bağlı Myasteni
Hipertiroidizm
Graves Hastalığı
Lambert Eaton Myastenik Sendromu
Konjenital Myopatiler
Miller Fisher Sendromu
Guillain Barre Sendromu
Botulizm
İntrakranial Kitle Lezyonları
Major Depresyon
Tablo 42.3: Myasthenia Gravis Eşlik Eden Hastalıklar
Tiroid Hastalıkları
Romatoid Artrit
Psöriazis
Pernisiyöz Anemi
Otoimmun Aplastik Anemi
Tablo 42.4: Myasthenia Graviste İlaç
Kullanımı
Kullanılmaması Gereken İlaçlar
Aminoglikozidler
(Gentamisin,
Streptomisin,
Tobramisin,
Amikasin,
Kanamisin,Neomisin…vb)
Linkomisin
Sulfonamidler (Bactrim)
Tetrasiklin
Kloramfenikol
Polimiksin
Kinin
Antiaritmik ve beta blokerler
536
(Prokainamid,
propranolol,
lidokain…)
Bazı antiepileptikler (Fenitoin)
Kürar ve türevleri
Morfin ve narkotik analjezikler
Trankilizan ve barbitüratlar
Bazı antidepresanlar
Lityum
Magnezyumlu laksatifler ve
antiasitler
D-Penisilamin
Östrojen içeren preparatlar
Kullanımında Genellikle Sakınca
Olmayan İlaçlar
Penisilinler (AMPİSİLİN hariç)
Sefalosporinler
Parasetamol, NSAİİ
Myastenik Kriz
Gelişen solunum güçlüğü mekanik ventilasyon gerektirecek düzeydedir. Pridostigmin
(Mestinon) dozu arttırılmalıdır. Myastenik hastalarda kullanılmaması gereken ilaçların listesi
Tablo 42.4’de verilmiştir.
Kolinerjik Kriz
Gereğinden fazla Mestinon alımına bağlı ortaya çıkan kas zayıflığı, fasikülasyon, kolik,
lakrimasyon, terleme, solunum yetmezliği durumudur. Myastenik krizden ayrımı oldukça
güçtür. Destek tedavi ve gereğinde atropin ile düzelir.
Myasthenia gravis’de Tedavi
1. Antikolinesteraz Ajanlar
Pridostigmin(Mestinon) en sık kullanılan ilaçtır. Etkisi 30 dakikada başlayıp 2 saatte
maksimum düzeye ulaşır.
2. İmmünosupresif Tedavi:
Kortikosteroidler: Sıklıkla Prednizon tercih edilir. Tedavi başlangıcında ilk haftalarda
myastenik şikayetleri alevlendirebileceği bilinmeli, doz yavaş yavaş arttırılmalı ve ortaciddi jenaralize hastalar yatırılarak tedavi edilmelidir. İyileşme haftalar içinde başlar, aylar
içinde istenen düzeye ulaşılınca doz düşülerek ayarlanmalıdır.
Azathioprine(İmuran): Steroid alamayan, steroide yanıtsız, steroid dozu düşülmeye
çalışılan hastalarda kullanılır. Asetilkolin reseptör antikoru üreten T hücrelerine etkilidir.
537
Siklosporin(Sandimmune): Yardımcı T hücrelerinden IL-2 salınımını durduran kuvvetli
bir immunsupresiftir. Nefrotoksisite ve hipertansiyon yan etkileri göz önüne alınmalıdır.
3. Kısa Dönem İmmunoterapiler
Plazmaferez ve İntravenöz İmmunglobulin (IVIg): Myastenik kriz ya da timektomi
operasyonuna hazırlık gibi hızlı düzelme gerektiren durumlarda kullanılır.
4. Timektomi
Timektomi Endikasyonları
Timektomi endikasyonları tartışılmakla birlikte timoması olan tüm MG hastalarında ve
timoma saptanmasa dahi medikal tedaviye dirençli jeneralize MG hastalarında
timektomi uygulanması önerilmektedir. Operasyonun amacı myastenide remisyonu
başlatma, klinikte iyileşme sağlama veya en azından immunsüpresif ilaç dozlarının
azaltılmasının sağlanmasıdır.
Timektomi, nontimomatöz otoimmün MG olan hastalarda remisyon şansını arttırmak
için tavsiye edilen bir tedavi yöntemi olarak kabul edilmiştir (12). Araştırmaların
çoğunda erken cerrahinin başarısının daha yüksek olduğu belirtilmektedir. Timektomi
operasyonunun uygulanacağı alt ve üst yaş limitleri, hafif oküler myastenide
timektomi endikasyonları ve timektominin erken-geç uygulanması arasındaki
sağaltım farkları ise halen tartışılan konulardır. On ile elli yaş arası yeni teşhis
konulan MG hastalarında, özellikle hastalığın ilk 5 yılı içinde, timektomi önerilmesi
kabul görmektedir. Altı-on yaş arası timektomi uygulamaları ise halen tartışmalıdır.
Oküler MG hastalarında ise timektomi etkili bir tedavi yöntemi olabilme ihtimaline
rağmen önerilmemektedir (13). Altmışbeş yaş üzerinde hastalarda da timoma varlığı
dışında genellikle timektomi uygulanması önerilmez, timoma varlığında ise her yaşta
mutlak timektomi endikasyonu vardır.
İnsizyonlar ve Cerrahi Teknikler
Timektomi operasyonu servikal insizyonla, parsiyel üst sternotomi ile, total sternotomi
ile, servikal insizyon ve total sternotomi ile ve video yardımlı torakoskopik (VATS)
yöntemlerle uygulanır. İnsizyonun dışında timus ve çevresindeki yağlı dokuya olan
yaklaşım farklılık gösterir.
538
Komplet Timektomi
Timus bezinin kapsülü korunarak çıkarılmasına verilen isimdir. Servikal, VATS ve
parsiyel üst sternotomi insizyonlarıyla uygulanan operasyon tipi bu tip bir
timektomidir.
Extended Timektomi (Genişletilmiş Timektomi:
Median sternotomi ya da bilateral submamarian insizyon ile bilateral plevralar
açılarak spesimen üzerinde her iki plevra da bırakılır. Tüm peritimik ve lenfoid doku,
diyaframdan boyuna kadar, perikardiyal yağlı doku ile birlikte bir hilustan diğerine,
diyafragma, perikard ve frenik sinirden diseke edilerek çıkarılır (14,15). Tirotimik
ligaman düzeyindeki timik doku eksize edilir. Sol brakiosefalik ven arkasına inmiş
timus, lenfoid ve yağlı dokular temizlenir. Boyun diseksiyonu için ayrı insizyon
önerilmez. Aortikopulmoner pencerede aberran timik dokusu bulunma insidansı çok
düşük olduğu için sinir yaralanması riski taşıyan bu bölge eksplorasyonu
yapılmayabilir. Myastenik hastalarda timoma varlığında, frenik sinir invazyonu
durumunda dahi,
frenik sinirin rezeksiyonunun yapılması önerilmemektedir.
Gereğinde geride tümör dokusu bırakılarak, bölgenin postoperatif radyoterapi
uygulaması için metalik klip ile işaretlenmesi myastenik hastalarda yaygın görüş
olmuştur. Bununla birlikte, biz hastalarımızda eğer myastenik durumu iyi ise frenik
siniri de tümör dokusu ile birlikte çıkararak aynı taraf diyafragmasına plikasyon
yapıyoruz.
Maksimal Timektomi
Uygulamaları transsternal-transservikal yaklaşım ile uygulanır. Timus dokusunun
ekstraanatomik olarak boyun veya mediastinel yağlı doku içerisinde tespit edilmesine
dayalı olarak ortaya çıkarılmış bir girişimdir. Gereğinde insizyonlar T şeklinde
birleştirilebilir.
Timus
dokusuna
habis
bir
tümör
gibi
muamele
edilerek
servikomediastinel yağlı dokuyla birlikte hiç zedelenmeden en bloc olarak çıkartılması
prensibine dayanır (16).
Transservikal Timektomi
Operasyonunda amaç hastayı erken taburcu etmek ve hastanın solunum
fonksiyonlarını korumaktır.
Beş cm servikal insizyon ile suprasternal çentiğin
üstünden girilerek tiroid dokusunun altından sternal çukurun arkasına girilir.
İnterklavikuler ligaman divize edilir. Timus üst kutupları ekstrakapsüler planda
prepare edilerek tirotimik ligaman seviyesinde ayrı ayrı divize edilir. Özel bir servikal
timektomi ekartörü yerleştirilerek manibrium askıya alınır. Timik ven divize edilir.
539
Timus künt diseksiyonla perikarddan ayrılır, bilateral frenik sinirler korunarak
mediastinel
plevradan
serbestlenerek
alt
kutupların
perikardiyal
dokudan
sıyrılmasıyla operasyon tamamlanır (17,18).
VATS Timektomi (VATT)
Uygulamaları sağ, sol, servikal ve sol ya da servikal ve sağ olarak uygulanabilir
(19,20,21). Bu operasyonda amaç komplet timektomi operasyonu uygulamaktır.
Servikal insizyon ve bilateral VATS ile maksimal timektomi tekniği Zielinski tarafından
bildirilmiş olsa da endoskopik yöntemlerle maksimal timektomi uygulaması halen
klinikte yaygın olarak kendisine yer bulamamıştır (22). Kliniğimizde uyguladığımız
timektomi tekniğine komplet timektomi temel alınarak 2001 yılında başlanmış,
geliştirdiğimiz ve farklılaştırdığımız teknik detaylarla timektomi operasyonumuz
genişletilmiş timektomi düzeyine yaklaştırılmıştır. Bu yüzden biz kendi tekniğimize
genişe yakın timektomi (Near Extended) adını veriyoruz (19).
Kliniğimizde sağ
hemitoraksın sola göre daha büyük olması ve vena kava superior ile sağ frenik sinire
rahat erişim nedeniyle sağdan torakoskopik yaklaşımı tercih etmekteyiz. Bu teknikte
çift lümenli tüple selektif entübasyonu takiben hasta supin pozisyonunda yatırılarak
sağ kol baş yanında ekstansiyona getirilir. Sağ hemitoraksın altı vertikal olarak silikon
yastıkla lateralden desteklendikten sonra ameliyat masası 30 derece cerraha doğru
çevrilir. Sağ meme çevresine torakoskopun yerleştirileceği 10 mm torakoportu
takiben meme glandına zarar vermeyecek şekilde ön aksiler ve midklavikuler hatlara
denk gelecek şekilde iki torakoport daha yerleştirilir (Resim 42.1).
Resim
42.1:
Portlar
yerleştirildikten
sonraki görünüm
540
Resim 42.2: Mediastende ilerlenerek timusun üst ve alt yarısında sol plevra da
koterle açılır.
Elektrokoter ve endomakas yardımıyla timus bezi kapsülüne zarar verilmeden
sternumdan ayrılır. Mediastinel plevra sağda yukarıdan aşağı timusun anterioru ve
sternumun posteriorunda total olarak açılarak karşı hemitoraksa geçilir. Mediastende
ilerlenerek timusun üst ve alt yarısında sol plevra da koterle açılır. (Resim 42.2). Bu
esnada sol akciğerin yaralanmaması için endotrakeal tüp geçici olarak tamamen
havaya açılmalı ve sol akciğer kollabe edilmelidir. Sol mediastinel plevra da
timektomi piyesine dahil edilir.
Operasyonun en önemli ve en sık komplikasyon
oluşan kısmı brakiosefalik vene dökülen venöz yapıların diseksiyonudur. Superior
vena kavanın timik glanddan ayrılmasıyla sol brakiosefalik vene ulaşılır. Superior
vena kavaya dökülen küçük timik venler diseke edilir kliplenerek divize edilir (Resim
42.3). Timus üst polü zaman içinde kazanılacak tecrübeyle makul bir kuvvetle
tutularak çekilir ve sol üst pole de aynı yöntem uygulanarak üst poller mediastene
indirilmiş olur (Resim 42.4). Bu manevraları takiben mediasten dikkatlice incelenmeli,
şüpheli mediastinel dokulardan frozen inceleme için örnekler alınmalıdır. Timektomi
tamamlandığında brakiosefalik ven, süperior vena kava ve pulmoner arterler net
görünür hale gelir (Resim 42.5). Perikardiyofrenik açılardaki yağlı dokular sağ tarafta
total, solda ise subtotal olarak rezeke edilir. Karşı plevral aralığa uzanacak şekilde
kateter veya dren konarak operasyon tamamlanır (Resim 42.6) .
541
Resim
42.3:
Superior
vena
Resim 42.4:Bu aşamada timusun
kavaya
dökülen küçük timik venler diseke edilir
görüntüsü
kliplenerek divize edilir.
Resim 42.6: Operasyon sonu
Resim 42.5:Timektomi sonrası görünüm
Hastalarımızda ortalama göğüs tüpü kalış ve hastane yatış süreleri 26,7 saat ve 2,2
gün olarak bulundu. Cerrahi sebeplerle açık operasyona geçme oranı % 2,2 olarak
tespit edildi. Hastanın vücut kitle endeksinin operasyon süresini etkileyen tek faktör
olduğu ve pyridostigmine bromide (Mestinon) dozunun postoperatif dönemde
hastane kalış süresini etkileyen tek faktör olduğu gösterildi. Bu çalışma ile VATT
güvenilir bir operasyon olarak sunuldu (19). İkiyüzbir MG hastasında uyguladığımız
operasyon
sonuçlarının
değerlendirildiği
çalışmamızda
hastaların
%30’undan
fazlasının operasyonun ertesi günü taburcu olduğunu gördük. Ertesi gün taburcu
olabilen hastaları multivariate analizlerle incelediğimizde operasyon süresinin ertesi
gün taburculukta etkili tek faktör olduğunu gözlemledik (23).
Videotorakoskopik genişletilmiş timektomi (VATET) ve servikal eksplorasyonu da
içine alan teknikle yapılan timektomi operasyonuyla tam stabil remisyon oranıyla
542
ekstended transsternal timektomi uygulanan hastaların tam stabil remisyon
oranlarının yaklaşık olarak aynı olduğu gösterilmiştir (24).
Halen hastaların tamamında uygulanmayan, maksimal ve minimal yöntemlerle % 50
oranında başarı beklenen timektomi girişiminde, operasyon tipi seçiminde, hasta için
en az invazif, en estetik yöntemin göz önüne alınması gerektiğini düşünüyoruz.
Çünkü minimal invazif yöntem, doğru ellerde, en az doku rezeke edilen değil; en fazla
doku rezeke edilen yöntem olabilir.
KAYNAKLAR
1. Goldflam S. Über einen scheinbar heilbaren bulbar paralytischen symptomen
Complex mit Beteiligung der Extremitaten. Dtsch Z Nervenheilkd 4:312, 1893.
2. Jolly F. Über Myasthenia gravis pseudoparalytica . Klin Wochenschr 32:1,
1895.
3. Walker MB: Treatment of myasthenia gravis with physostigmine. Lancet
1:1200, 1934.
4. Osserman KE, Teng P, Kaplan PI. Studies in myasthenia gravis: Preliminary
report on therapy with MEstinon bromide. JAMA 155:961, 1954.
5. Schumacher R. Thymektomie bei einem Fall von Morbus Basedowi mit
Myasthenie. Mitten Grenz Med Chirg 1912;25:746.
6. Blalock A, Mason MF, Morgan HJ, Riven SS. Myasthenia gravis and tumors of
the thymic region. Ann Surg 1939;110:544.
7. Blalock A, Harvey A, Ford F. The treatment of myasthenia gravis by removal of
the thymus gland. JAMA 1941;117:1529.
8. Blalock A. Thymectomy in the treatment of myasthenia gravis: Report of 20
cases. J Thorac Surg 1944;13:316.
9. Baykan B, Gürses C, Gökyiğit A, Öge AE. Nöroloji. Nobel Tıp Kitabevi ,
İstanbul, 664-674, 2004.
10. Ropper AH, Brown RH, Phil D. Principles of Neurology, eight edition. McGrawHill, New York, 1250-1263, 2005.
11. Yüksel M, Kalaycı NG. Göğüs Cerrahisi. Bilmedya Grup, İstanbul. 2001: 633647.
12. Gronset GS, Barohn RJ. Practise parameter: thymectomy for autoimmune
myasthenia gravis (an evidence-based review)- Report of the Quality standarts
543
Subcommittee of the American Academy of Neurology. Neurology 2000;55:755
13. Hohlfeld R, Melms A, Schneider C, Toyka KV, et al. Therapy of myastenia
gravis and myasthenic syndroms In: Brandt T, Caplan LR, Dichgans J, Diener
HC, Kennard C, editors. Neurogical disorders: course and treatment.
Philedelphia: Elsevier 2003:1341-1362
14. Masaoka A, Nagaoka Y. Distribution of thymic tissue at the anterior
mediastinum. Current procedures in thymectomy. J Thorac Cardiovasc Surg
1975;70:747-754
15. Masaoka A, Monden Y. Comparison of the results of transsternal simple,
transcervical simple, and extended thymectomy. Ann NY Acad Sci
1981;377:755-765
16. Jaretzki A III, Wolf M. ‘Maximal’ thymectomy for MG. Surgical anatomy and
operative techique. J Thorac Cardiovasc Surg 1988;96:711-716
17. Keynes G. Surgery of the thymus gland. Lancet 1954;12: 1197-1202
18. Cooper JD, Al-Jilaihawa AN, Pearson FG, Humphrey JG, et al. An improved
techique to facilitate transcervical thymectomy for myastenia gravis. Ann
Thorac Surg 1988;44: 242-247
19. Toker A, Tanju S, Sungur Z, Parman Y, et al. Videothoracoscopic thymectomy
for nonthymomatous myasthenia gravis. Surg Endosc 2008; 22(4):912-6
20. Mittak M, Kretek J, Hamzik J, Guziana P. Thoracoscopic thymectomy-initial
experience. Rozhl Chir. 2008; 87(9):442-5
21. Mack MJ. Video-assisted thoracoscopy thymectomy for myasthenia gravis.
Chest Surg Clin N Am. 2001; 11(2): 389-405
22. Zielinski M. Technique of transcervical-subxiphoid-vats ‘maximal’ thymectomy
in treatment of myastenia gravis. Przegl Lek 2000;57:64-65
23. Toker A, Tanju S, Ziyade S, Ozkan B, et al: Early outcomes of video-assisted
thoracoscopic resection of thymus in 181 patients with myasthenia gravis: who
are the candidates for the next morning discharge? Interactive CardioVascular
and Thoracic Surgery 2009;9:995.
24. Mantegazza R, Confalonieri P, Antozzi C, Novellino L, et al. Videoassisted
thoracoscopic extended thymectomy (VATET) in myasthenia gravis two year
follow up in 101 patients and comparison with the transsternal approach. Ann
N Y Acad Sci 1998;841:749-52.
544
43.
Prof. Dr. Semih Halezeroğlu
Acıbadem Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
TİMOMA
Yerleşim
Timomalar timik epitelyal hücrelerden kaynak alan mediasten tümörleridir. Hemen her
zaman anterior mediastende yerleşirler (1). Nadir olarak boyun (2), akciğer hilusu
veya akciğer parenkiminde (3) de yerleşebilirler. Yetişkinlerdeki anterior mediastinal
tümörlerin yaklaşık yarısı timik orijinli tümörlerdir (4). Bazı serilerde yetişkinlerde
mediastinal tümör ve kistler içerisinde en sık görülen grubu oluştururlarken, diğer
serilerde nörojenik tümörlerden sonra ikinci en sık görülen lezyonlar olarak belirtilirler.
Timomaların 16 yaşın altında görülme olasılığı düşüktür.
Patolojik Özellikler
Timomlar timusun epitelyum hücrelerinden kaynak alsalar da pür epitelyal timomalar
sadece %4 oranında görülür. Diğerlerinde çeşitli oranlarda lenfosit ve diğer hücreler
yer alır. Timomlar patolojik olarak 4 farklı gruba ayrılır: a) lenfosit ağırlıklı olanlar, b)
epitelyal ağırlıklı olanlar, c) mixt lenfoepitelyal timomlar, d) Spindle hücreli timomlar
(5).
Sınıflandırma
Bugün literatürde timik tümörlerde kullanılan çok sayıda sınıflandırma yöntemi vardır.
Genel olarak kullanılan terminoloji Tablo 43.1’de belirtildiği gibidir (6).
Tablo 43.1: Timoma sınıflandırması
Benign timomalar
(Enkapsüle Timoma)
Epitelyal
Lenfositik
Mikst lenfositik ve epitelyal
Malign timomalar
(İnvaziv Timoma)
Epitelyal
Lenfositik
Mikst lenfositik ve epitelyal
Önceleri timomaların patolojik olarak malign özellikleri olmadığı, tüm timomaların
patolojik olarak selim olduğu ancak tümörün invazyonu varsa bunun malign olarak
isimlendirileceği konusunda bir düşünce mevcuttu. Daha sonraları yapılan bir çok
araştırma ise patolojik olarak da timomaların atipik veya kanseröz değişiklikler
göstermekte olduğunu ortaya koymuştur (5,7).
545
Evreleme
Timusun epitelyal hücrelerinin biyolojik çeşitliliği sebebiyle timomaların invazifliği,
metastatik karakterleri ve potansiyel sürvi durumları göz önüne alınarak birçok
evreleme sistemi oluşturulmuştur.
Masoaka ve arkadaşları tarafından hazırlanan evreleme sistemlerinin ortak özellikleri
Tablo 43.2’de gösterilmektedir (8).
Tablo 43.2: Timoma evrelemesi
Evre I
Evre II
Evre III
Evre IV: a)
Evre IV: b)
Tamamen
kapsül
içinde.
Kapsül
invazyonu yok
Kapsül içine doğru büyüme. Etraf yağlı
doku ve mediastinal plevraya invazyon
Etraf dokulara (perikard, akciğer veya
büyük damarlar) invazyon
Plevra veya perikardiyal metastaz
Lenfositik veya hematojen metastaz
Klinik Tablo
Timomalar tüm yaş gruplarında görülebilirse de hastaların büyük çoğunluğu 40-50
yaşlarındaki yetişkinlerdir. Kadın ve erkeklerde eşit oranda görülür.
Timomalı hastalar genel olarak (%50-60) asemptomatiktir. Bununla birlikte tümörün
lokal etkisi ya da timomaya eşlik eden (para-timik) durumlara bağlı olarak semptomlar
gelişmiş olabilir (9).
Lokal semptomlar
Belli belirsiz bir göğüs ağrısı, nefes darlığı ve öksürük en sık görülen lokal
semptomlardır. N.laringeus rekürrens tutulumuna bağlı ses kısıklığı, frenik sinir
tutulumuna bağlı diyafragma paralizisi ve superior vena kava sendromu malign
özellikteki timomalarda ortaya çıkabilecek durumlardır. Benzer şekilde plevral veya
perikardiyal efüzyon da malign bir oluşumu akla getiren ve önemli klinik yakınmalara
sebep olan durumlardır. Nadiren timoma spontan olarak rüptüre olup hemorajiye ve
şiddetli nefes darlığına yol açabilir.
Enfeksiyon timomalar için nadir bir durumdur. Kilo kaybı, halsizlik, gece terlemesi gibi
durumlar hastaların yaklaşık olarak %20’sinde görülür.
Eşlik Eden Sistemik Hastalık (Para-timik) Durumları
546
Timomalı hastaların %40’ında eşlik eden diğer hastalık durumları mevcuttur. Bu
hastaların yaklaşık üçte birinde ise birden çok paratimik hastalık birlikte görülür. Bu
hastalık durumları içerisinde en sık görüleni Myastenia Gravis hastalığıdır. Bunun
dışındaki diğer para-timik durumlar şunlardır: pür kırmızı hücre aplazisi, nörojenik
sendromlar, immunglobulin eksikliği, sistemik lupus erithematosus, ülseratif kolit,
erozif liken planus, non-timik kanser ve uygunsuz ADH salınımı (10).
Teşhis Yöntemleri
Radyoloji
Akciğer grafisi timomaların tespitinde güvenilir bir yöntemdir. Posteroanterior filmde
timoma, üst kısımda kalbin büyük damarları ile birleştiği yerde düzgün sınırlı, kısmen
lobüle bir kitle, yan grafide ise kalbin ön kısmında yerleşmiş olarak görülür.
Bilgisayarlı tomografi lezyonun durumunu ayrıntılı olarak ortaya koyar (Resim 43.1).
Nadiren, düz akciğer grafisinde tespit edilemeyen bir timoma BT ile tespit edilebilir.
BT, plevral veya perikardiyal tutulum, vena kava superior sendromu gibi nadir
durumlar dışında invaziv bir timomayı non-invaziv timomadan ayırt etmede tam
olarak güvenilir değildir. MR sadece ileri derecede invaziv timomlarda görülen
mediastinal invazyon varlığını tespit etmekte faydalı olabilir. PET-CT’nin timomalı bir
hastayı değerlendirmede belirgin faydası tespit edilmemiştir (11).
Resim 43.1: Timoma bilgisayarlı tomografi görüntüsü
Cerrahi Biyopsi
Şüpheli ve lokal olarak asemptomatik bir timoma için cerrahi biyopsi hem gereksiz
hem de kapsül bütünlüğünü bozduğu için kontrendikedir (12). Önceden biyopsi
yapmak, cerrahi bütünlüğün bozulmasına da yol açabilir. Ancak, Evre III bir timomada
547
eğer ameliyat öncesi bir kemoterapi/radyoterapi planlanıyor ise tam olarak hücre
tipinin belirlenmesi amacıyla cerrahi biyopsi uygulanabilir.
Ön mediastende yer alan tüm diğer tümörlerde olduğu gibi, kitle lokal semptomlara
yol açıyorsa, anterior mediastenin diğer tümörlerinden (örn: lenfoma, malign germ
hücreli tümör veya metastatik tümörler) ayırt edilemiyorsa cerrahi biyopsi alarak tanıyı
tam olarak kesinleştirdikten sonra tedaviyi planlamak gerekir.
aspirasyonu,
iğne
biyopsisi,
anterior
mediastinotomi,
Bu amaçla, iğne
mediastinoskopi,
videotorakoskopi veya açık torakotomi yöntemleri kullanılabilir.
Tedavi
Timoma tedavisi evrelerine göre farklılıklar gösterir. Kemoterapi, radyoterapi ve
cerrahi yöntemler kullanılır.
Toraks dışına metastaz yapmamış, belirgin şekilde inrezektabl olarak görülmeyenler
hariç, timomaların rezeke edilmesi gerekir (12, 13). Evre I ve II’de ve bazı seçilmiş
Evre III timomalarda cerrahi tedavi uygulanır. Cerrahi tedavide timomanın bütün
olarak çıkartılması, parçalanmaması gerekir (Resim 43.2). İlerlemiş Evre III ve bazı
Evre IVa hastalık durumunda ise preoperatif kemoterapi sonrası cerrahi eksizyon
tercih edilebilir. Tam olmayan rezeksiyonun tedavi başarısızlığına sebep olmasından
dolayı bazı araştırmacılar 5 cm’den büyük her hücre tipindeki timomaların önce
kemoterapi uygulandıktan sonra cerrahiye gitmesi gerektiğini belirtmişlerdir.
Resim 43.2: Rezeke edilmiş bir timoma piyesi görüntüsü
Cerrahi yöntem olarak tercih edilen yaklaşım median sternotomi insizyonudur. Tümör
herhangi bir hemitoraksa belirgin derecede uzamış veya eş zamanlı plevral işlemler
548
uygulanacak ise postero-lateral torakotomi gerekebilir. Video-yardımlı torakoskopi
veya robotik yöntemle küçük ve non-invaziv timomalar çıkartılabilir.
Kemoterapi bazı Evre III hastalık durumunda ameliyattan önce ya da cerrahi olarak
rezeke edilemeyen timomaların tedavisinde kullanılır (14). Tam olarak uygulanmış bir
rezeksiyondan sonra radyoterapi uygulamanın faydası gösterilmemiştir. Radyoterapi
cerrahi uygulanamayan hastalarda kemoterapiye ilave olarak kullanılır.
Prognoz
Timomalı hastalarda prognoz üzerine etkili olan bazı faktörler vardır. Hastalarda eşlik
eden miyastenia gravis hastalığının bulunması sürviye etki etmez. Sürvi için en
önemli kriterler tümörün invaziv veya non-invaziv oluşu ve operasyonun tam
(komplet) veya eksik (inkomplet) yapılmış olmasıdır. Tümörün çapı ve hücre tipi de
bir oranda sürvi üzerine etkilidir.
Evre I timomalarda 5 yıllık sürvi %95-97 ve 10 yıllık sürvi %80-95 arasındadır. Evre II
e III (invaziv) timomalarda 5 yıllık sürvi %60-70 ve 10-15 yıllık sürvi %40-50’dir (9).
KAYNAKLAR
1. Marchevsky AM, Kaneko M. Surgical Pathology of the Mediastinum, 2nd ed. New
York: Raven Press, 1992.
2. Ridenhour CE, Henzel, JH, Deweese, MS, Kerr SE. Thymoma arising from
undescended cervical thymus. Surgery 1970;67:614.
3. Cosio-Pascal M, Gonzales-Mendez A. Left hilar thymoma. Report of a case. Dis
Chest 1967;51:647
4. Mullen B, Richardson JD. Primary anterior mediastinal tumors in children and
adults. Ann Thorac Surg 1986;42:338.
5. Lewis JE, Wick MR, Scheithauer BW, et al. Thymoma: a clinicopathologic review.
Cancer 1987;60:2727.
6. Rosai J, Levin GD. Tumors of the thymus. In Fuminger HI, ed. Atlas of Tumor
Pathology. Washington, DC: Armed Forces Institute of Pathology, 1976.
7. Shimosato Y. Controversies surrounding the subclassification of thymoma. Cancer
1994;74:542.
8. Masaoka A, Monden Y, Nakahara K. et al. Follow-up study of thymomas with
special reference to their clinical stages. Cancer 1981;48:2485.
9. Detterbeck CF, Parsons AM. Thymic tumors. Ann Thorac Surg 2004;77:1860.
549
10. Rosenow EC III, Hurley BT. Disorders of the thymus. A review. Arch Intern Med
1984;144:763.
11. Liu RS, Yeh SH, Huan MH, et al. Use of fluorine-18 fluorodeoxyglucose positron
emission tomography in the detection of thymoma: a preliminary report. Eur J Nucl
Med 1995;22:1402.
12. Patterson GA. Thymomas. Semin Thorac Cardiovasc Surg 1992;4:39.
13. Port JL, Ginsberg RJ. Surgery for thymoma. Chest Surg Clin North Am
2001;11:421
14. Lucchi M, Ambrogi MC, Duranti L, et al. Advanced stage thymomas and thymic
carcinomas: results of multimodality treatment. Ann Thorac Surg 2005;79:1840.
550
44.
Prof. Dr. Alpay Sarper
Akdeniz Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
MEDİASTİNAL KİST ve DUPLİKASYONLAR
Mediastinal kistik lezyonların çoğu konjenital olup tüm mediastinal kitlelerin yaklaşık
% 20-30’ unu oluşturmaktadır. İnfantlarda ve çocuklarda saptanan kistik lezyonlar
erişkinlere göre daha azdır (%11-18). Ancak özellikle bası sonucu gelişen
komplikasyonlar küçük yaşlarda daha ciddi seyreder. Mediastinal kistlerin sınıflaması
etiyolojiye
göre
olup
isimlendirme
yapılırken
histolojik yapısı göz önünde
bulundurulur. En sık görülen mediastinal kistler foregut kistleridir. Edinsel kistler
olarak inflamatuvar kistler, timik kistler, nekrotik lenf nodlarının oluşturduğu kistler ve
hatta hidatik kistleride sayabiliriz. (1-3).
Foregut Kistleri
Foregut kistleri, trakeobronşial ağacı ve özofagusu oluşturacak olan primitiv foregut
tan köken alan respiratuvar ve gastrointestinal sistemin benign kistik lezyonlarıdır. Bu
tanımlama içerisinde bronkojenik kistler, özofageal kistler, gastroenterik ve
nöroenterik kistler yer almaktadır. Bu gruba pulmoner sekestrasyonlar, konjenital
kistik adenomatoid malformasyonlar, konjenital akciğer kistleri ve konjenital lober
amfizemi de içeren sınıflamalarda vardır. Bazı foregut kistlerinden bahsedilirken
dublikasyon
terimi
kullanılsa
da
kistin
orijinini
tanımlamadığından
yetersiz
kalmaktadır. Foregut kistleri antenatal dönemde yapılan ultrasonografi ile de
tanınabilir. Böylece erken dönemde tedavi edilip önemli komplikasyonların önüne
geçilmiş olunur (2).
Bronkojenik Kistler
En sık görülen mediastinal kisttir. Tüm mediastinal kitlelerin % 15 ini oluşturur.
Embriyolojik
olarak
bronkojenik
kistler
trakeobronşial
ağacın
tomurcuklanması ile oluştuğu düşünülmektedir. Kistin lokalizasyonu
anormal
anormal
tomurcuklanmanın trakeobronşial ağaçtan ayrılma sürecine bağlıdır. Eğer erken
dönemde ayrılma olursa mediasten lokalizasyonunda olur. Trakeobronşial sistem ile
de nadiren ilişkilidir. Geç dönemdeki ayrılmalarında ise kist akciğer parankiminde yer
551
alır ve sıklıkla bronşial sistem ile ilişkisi vardır. Bronkojenik kistin en sık görülen
lokalizasyonları subkarinal ve sağ hiler bölgedir. Bu lokalizasyonlardaki kistler
trakeobronşial ağaç ile bazen direk ilişkide bulunabildiği gibi bronş veya karinaya
fibröz bir bant ile de bağlı olabilirler. Bazı paratrakeal kistler özofagus ile yakın
komşulukta olabilir. Erişkinde saptanan kistlerin % 25’i parankim içerisinde yer
almaktadır. Kistin bağlı olduğu bir traktı yoksa akciğerin gelişimi sırasında kist
perikardial, paravertebral ve subplevral gibi toraksın diğer lokalizasyonlarına göç
edebilir. Nadiren boyunda veya üst abdomende de yer alır. İzole lezyon şeklinde
olabileceği gibi ender olarak aksesuar pulmoner lob, Down sendromu ve pulmoner
sekestrasyon ile birlikte de görülebilir (1,2,4).
Bronkojenik kistler genellikle yuvarlak, uniloküler, lezyonlardır. İçerisindeki sıvı berrak
veya mukoid olsa da bazen sarı, bulanık ve hemorajik yapıda olabilir (Resim 44.1).
Mikroskopik olarak kistin içi respiratuvar epitel ile döşelidir. Kist duvarı glandlar ve
nadirende kartilaj, düz kas ve elastik ve fibröz doku içerebilir.
Resim 44.1: Bronkojenik kistin (ok ile gösterilmiş) operasyon sırasında mediastinal plevra ile
örtülü görüntüsü. Sağ üstte bronkojenik kist çıkarıldıktan sonraki resmi. Sağ alttaki resimde
ise bronkojenik kistin içerisindeki koyu mukoid sıvı izlenmektedir.
Klinik
Hastalar genelde semptomatiktirler (% 70). Başlangıçta asemptomatik olsa da takipte
bir süre sonra semptomlar ortaya çıkmaktadır. Çocukluk çağında ise semptomlar
daha azdır. Ancak daha ciddi seyredebilir. Semptomlar kistin çevre dokulara
552
basısına, enfeksiyonuna ve inflamatuvar etkilerine bağlı olur. Bası paratrakeal ve
hiler kistlerde daha fazladır.
Basıya bağlı oluşan semptomlar öksürük, dispne, ağrı, tekrarlayan enfeksiyonlar ve
disfajidir. İnfantlarda ve çocuklarda büyük hava yollarında basıya bağlı olan ve hızlı
progresyon gösteren semptomlar (wheezing, stridor ve öksürük) olabilir. Hatta
infantlarda plevral gerilime ve mediastinal şift ile hayatı tehdit eden respiratuvar
distrese yol açabilir ve acil girişim gerektirir. Nadiren VCS sendromu veya sol atrium
bası bulguları da görülebilir. Özellikle büyük kistlerde semptomlar hastanın pozisyonu
ile bağlantılı olabilir.
Bronkojenik kistler enfekte olup semptomatik hale gelebilirler. Enfeksiyon bronşial
ağaç ile ilişkili olduğunu akla getirir. Enfekte bronkojenik kistlerde halsizlik, göğüs
ağrısı, ateş ve diğer pnömoni bulguları görülür. Bronş ile geniş bir bağ varsa hasta
öksürük ile kist içeriğini boşaltabilir. Eğer enfekte kist plevraya açılırsa ampiyem ve
hemotoraks oluşur.
Ağrı basıya veya enfeksiyona bağlı olabilir. Özellikle periferik plevra ile komşu
kistlerde görülür. Bazı kistler mediastenden boyuna, toraksa veya abdominal kaviteye
uzanır.
Hastaların fizik muayenesi nonspesifiktir. Enfeksiyon varsa ateş ve taşikardi vardır.
Hava yolu kompresyonu varsa wheezing olabilir.
Radyoloji
Direk grafilerde mediastende düzgün kenarlı lezyon şeklinde görülebilir (Resim 44.2).
Değişik boyutlarda olabileceği gibi tüm hemitoraksı da doldurabilir. Kist duvarında
bazen kalsifikasyon olabilir. Hava sıvı seviyesi varsa trakeobronşial sistemle ilişkisi
olduğu
düşünülür
(Resim 44.3). Toraksın
bilgisayarlı tomografisi
lezyonun
lokalizasyonu ve gerçek karakteristiği hakkında ayrıntılı bilgi verir. Düzgün kenarlı,
homojen ve yumuşak doku dansitesinde (30-130 HU - Hounsfield Ünitesi) bir lezyon
olarak izlenir. Enfeksiyon varsa heterojen ve daha yoğun içerik gözlenir. Yüksek
dansiteli lezyonlarda solid kitlelerden ayırt etmek için MRI kullanılabilir. Ultrasonografi
ve trans özofageal eko ile de kistik yapı gösterilir. Yine transözofageal eko ile
perikardial kist ile ayırıcı tanısı yapılır. Özofagogramda özofagusa komşu kistlerde
bası bulguları izlenir. Bronkoskopi genelde normal olmasına rağmen, bası bulguları,
enfekte sekresyon ve nadiren de direk kist ile ilişki gözlenir.
553
Resim 44.2: Direk grefide sağ parakardiak yerleşimli bronkojenik kistin görüntüsü
Resim 44.3: Hava yolu ile iştirakli, hava-sıvı seviyesi veren bronkojenik kistin direk
radyografileri ve tomografik görüntüsü.
Tedavi
Kesin tanı konulamadığından mediastinal kitlesi olan hemen hemen tüm hastalarda
cerrahi eksplorasyon önerilir. Bu yaklaşım doğru tanının konulması için gereklidir.
Bronkojenik kistlerin malignite riski düşüktür. Minimal malignite riskinden daha fazla
554
önemli olan kistin komplikasyonlarıdır. Semptomatik kistlerde cerrahi endikasyon
koymak kolaydır. Ancak hastalar asemptomatik olsalar dahi daha sonra semptomatik
olabileceğinden tüm kistlerin rezeke edilmesi çoğu merkezde kabul görmüştür.
Özellikle küçük yaştaki hastalarda komplikasyonlar daha ciddidir. (1-4)
Cerrahi girişim olarak çoğunlukla torakotomi tercih edilir. Kistin komplet rezeksiyonu
ile tam başarı sağlanır. İnkomplet rezeksiyonlarda rekürrens ve enfeksiyon riski
vardır. Paratrakeal, hiler ve subkarinal kistlerin cerrahisi kolay olmakla birlikte
parankimal kistlerde parankim rezeksiyonuna gerek duyulabilir. Eğer kist enfekte
olmuş ise yapışıklıkları minimale indirmek ve postoperatif enfeksiyon riskini azaltmak
için enfeksiyon operasyondan önce tedavi edilmelidir. Respiratuvar distresin olduğu
hastalarda da preoperatif olarak hastaların pulmoner durumu düzeltilir.
Son yıllarda VATS ile tedavi daha çok tercih edilmektedir. Mediastinal kistlerde
servikal yaklaşım veya median sternotomi uygulanabilir. VATS ile rezeksiyonda önce
kist içeriğinin boşaltılması rezeksiyonu kolaylaştırır. Ancak bazen ileri derecedeki
perikistik yapışıklıklar cerrahide sorun yaratmaktadır. Rezeke edilemeyen bölgenin
koterizasyonu ile sekresyon oluşturacak mukozanın ortadan kalkması sağlanır. Açık
cerrahide de en büyük sorun bu yapışıklıklardır. (2,3)
Mediastinal bronkojenik kistlerde transbronşial veya perkutan iğne aspirasyonları
alternatif tedavi yöntemleri olarak kullanılmaktadır. Mukoid materyalin aspirasyonu ve
sitolojik incelemede silyalı kolumnar epitel hücrelerinin görülmesi tanıyı koydurur.
Bununla birlikte aspirasyon sonrası rekürrens sorunu vardır. Aspirasyon ancak
operasyonu kabul etmeyen veya torasik girişimin yüksek risk taşıyan olgularda
uygulanmalıdır. Mediastinoskopik eksizyonun küçük ve uygun lokalizasyondaki
bronkojenik kistlerde denenebilir. Diğer tüm kistlere VATS veya torakotomi daha
uygundur.
Eski serilerde bronkojenik kistlerde anlamlı mortaliteden bahsedilirdi. Bunun nedeni
tanınamayan hava yolu obstrüksiyonu ve enfeksiyondur. Gelişen cerrahi tekniklerle
kistin rezeksiyonu veya parankim rezeksiyon sonuçları çok başarılı olmaktadır.
Postoperatif komplikasyonlar ender olarak infeksiyon, sinir yaralanmalar, sütür
yetmezliği, uzamış hava kaçağı olmaktadır. İnkomplet rezeksiyonda uzun sürede
rekürrensler görülebilir. Bundan dolayı komplet rezeksiyon önerilir (1-4).
555
Özofageal Kistler
Özofageal kistler bronkojenik kistlere çok benzerler. Özofageal kistler için aranan
özellikler; özofagus ile ilişkisinin olması, aynı seviyedeki gastrointestinal sistem ile
aynı epitelyal özellik taşıması, iki kat muskularis propriasının olmasıdır. Bronkojenik
kistlerin hava yolu ile ilişkisinin olması, respiratuvar epitel ve kartilaj doku içermesi
ayırıcı tanı için yeterli olmaktadır. Ancak bronkojenik kistin özofagus ile ilişkisinin
olması ve squamoz epitel içermesi ayırıcı tanıda zorluk yaratabilir. Bununla birlikte
benzer davranışlarının olması ve aynı tedavi yöntemlerinin gerekliliği nedeni ile
pratikte ayırımın pek önemi yoktur. (2,3)
Bronkojenik kistlerden daha az görülseler de leiomyomalar ve benign poliplerden
sonra en sık görülen özofageal kitlelerdir. Tüm mediastinal kistlerin % 5-14’ü
özofageal orijinlidir. Özofagusun herhangi bir yerinde yer alsa da en sık alt 1/3
lokalizasyonunda görülmektedir. Genellikle lümen ile bir ilişkisi yoktur. Ancak
olguların % 94’ü özofageal komşuluktadır. Erkeklerde iki kat daha fazladır. Olguların
% 70-75’i 16 yaşın altındadır. Bazen diğer intestinal kistler, özofageal atrezi,
trakeoözofageal fistül ve skolyoz, hemivertebra ve füzyon gibi spinal anomalilerle
birlikte bulunabilir. Bu durumlar daha çok çocuklarda tespit edilir. (3)
Özofageal kistler genellikle unilokülerdir ve mukoid materyal içerir. İçini örten epitel
skuamöz, kolumnar, silialı kolumnar veya kombine yapı taşıyabilir. Kistin duvarı bez
içerebilir ve belirgin infeksiyon olmadan inflamatuvar reaksiyon bulguları içerir.
Duvarında myenterik pleksus içeren iki katlı kas yapısı bulunur. Özofageal kistlerin
%50-60’ı mide mukozası ve pankreatik doku içerir.
Klinik
Özofageal kistler çoğunlukla asemptomatiktir ve tesadüfen ortaya çıkar. Ancak tedavi
edilmeyen olgular semptomatik hale gelirler. Erişkinlerdeki en sık semptom disfaji ve
ağrıdır. Bulantı, kusma, kilo kaybı, anoreksia, wheezing, nonspesifik prekordial
hassasiyet ve ritim bozuklukları da bildirilmiştir. Çocuklarda çevre dokulara bası ile
olan respiratuvar semptomlar baskındır. Öksürük wheezing, stridor olabildiği gibi yeni
doğanda respiratuvar distres sendromuna da yol açabilir. Bronkojenik kistlerde
olduğu gibi enfekte olabilirler. Bazen tehlikeli semptomlara yol açabilirler. Kist içine
spontan kanama olabilir. Kist özofagusa veya trakeobronşial sisteme rüptüre olursa
hematemez veya hemoptizi ile birlikte seyredebilir. Ek olarak kistin spontan rüptürü
plevral kaviteye olursa ampiyem veya hemotoraks olabilir. Malign dejenerasyon
556
oldukça nadirdir. Kist içerisinde ektopik mide mukozası varlığında ağrı, kanama
bazende perforasyon olabilir. Servikal kistlerde boyunda kitle hissedilir.
Radyoloji
Genellikle direk grafide izlenebilen lezyonlar tipik olarak düzgün kenarlı yuvarlak kitle
şeklinde görülür. CT daha ayrıntılı bilgi verir ve tipik görüntüsü yuvarlak, düzgün
kenarlı, homojen, düşük dansiteli lezyon şeklindedir. Leiomyomalar ise kas dokusu ile
aynı dansitede görülürler. CT ve MRI bulguları bronkojenik kistler ile benzerlik
gösterseler bile özofageal kistler özofagus ile ilişkisi olup inferior madistende bulunur
ve ince bir duvara sahiptir. Özofageal lümen ile ilişki varlığında ayrıca hava sıvı
seviyesi izlenir. Baryumlu grafide lümene doğru uzanan düzgün kenarlı intramural
kitle şeklinde görülür. Yaklaşık % 50 sinde mide mukozası bulunduğundan
Technetium-99m pertechnetate sintigrafisi ile pozitif sonuç verir. Özofagoskopi ile
lümenin düzgün olarak daraldığı ve mukozanın normal olduğu izlenir. Kistin
aspirasyonundan
enfeksiyon
riski
ve
rezeksiyonu
zorlaştırdığından
dolayı
kaçınılmalıdır. Endosonografi kistik yapının solid lezyonlardan ayırımını sağlar.
Tedavi
Bronkojenik kistlerle benzer olarak kistin komplet eksizyonu kabul edilen tedavi
yöntemidir. Tüm semptomatik olgularda eksizyon endikasyon vardır. Tesadüfen
saptanan hastalara da içeriğindeki mide mukozası ülserasyona, perforasyona ve
enfeksiyona yol açabileceğinden dolayı cerrahi tedavi tüm olgularda düşünülmelidir.
Cerrahi yaklaşım olarak VATS veya torakotomi tercih edilir. Kistin enükleasyonu ve
özofageal kas dokusunun kapatılması VATS ile olanaklıdır. Bu sırada mukozanın
açılma
olasılığının
çok
iyi
değerlendirilmesi
gerekmektedir.
Gerekirse
açık
torakotomiye geçilir. Bronkojenik kistler de olduğu gibi morbidite ve mortalitesi
düşüktür. Bronkoskopik veya Özofagoskopik olarak kistin aspirasyonu rapor edilse de
kist duvarının çıkarılamaması nedeni ile rekürrens ve infeksiyon riski taşımaktadır
(1,2).
Nöroenterik Kistler
Bu kistler gelişimin erken evresinde, notokordun etrafındaki vertebral yapıda
endodermin aberrant şekilde hapsolması ile oluşur. Nöroenterik kistleri diğer foregut
kistlerinden ayıran özelliği vertebra anomalileri ile birlikte olmasıdır. Bunlar minimal
557
spinal anomalilerden kistin tamamen intradural lokalizasyonunda olmasına kadar
birçok şeklinde olabilir. (5)
Nörojenik kistin epiteli squamoz, kolumnar pseudostratifiye veya kuboidal epitel
olabilir. Mide veya ince bağırsak mukozası içerebilir. İntraspinal komponent ince
duvarlı ve tek katlı kolumnar epiteli vardır. Buna karşılık ekstraspinal bölümünde ise
kalın duvarlı ve dışında düz kas bulunur. Proksimal gastrointestinal sistem ve
nöroenterik kistin intratorasik bölümü arasında ilişkinin olması ender değildir.
Klinik
Genellikle semptomatiktir ve nadiren erişkin yaşa kadar sessiz kalırlar. Çoğu vakada
yaşamın ilk yılında ortaya çıkarlar. Semptomlar kistin boyutuna, lokalizasyonuna ve
çevre mediastinal ve spinal yapılara olan basısına bağlıdır. Öksürük, wheezing ve
dispne en sık semptomlardır. Hastaların çoğunda üç klasik bulgu olan mediastinal
kitle, respiratuvar semptomlar ve vertebral anomalileri bulunur. Özofageal bası
sonucunda disfaji, bulantı ve kusma olur. Epiteldeki potansiyel gland varlığında peçtik
ülser veya hemorajik görülebilir. Nörolojik semptom olarak sırt ağrısı, parestezi, motor
semptomlar ve parapleji olabilir.
Radyoloji
Direk grafide bazen mediastinal kist ve birlikte vertebra anomalileri görülse de kesin
tanı için CT ye ihtiyaç vardır. Gelişim sırasında özofagus aşağıya doğru yer
değiştirirken vertebral anomali genellikle kistin üst kesiminde yer alır. Genelde alt
servikal veya üst torasik vertebrada lokalize olur. MR vertebra anomalilerinin özellikle
intraspinal komponenti hakkında daha uygun tanımlama yapar.
Tedavi
Komplet eksizyon tercih edilen tedavi yöntemidir. Preoperatif tanı yöntemleri ile
intraspinal yayılım saptanmamışsa VATS ile eksizyon olası olabilir. Vertebral tutulum
varsa posterolateral torakotomi tercih edilir. Diyaframı geçen nöroenterik kistlerde
torakoabdominal insizyona ihtiyaç duyulur. Eğer ciddi spinal veya vertebral anomalisi
varsa öncelikle nöroşiruryen veya ortopedist tarafından bu bölüm rezeke edilir. Daha
sonra kistin geri kalan kısmı çıkarılır. Bazı nöroenterik kistlerde posterior yaklaşımla
laminektomi ile total eksizyonu gerekebilir. Komplet rezeksiyon çoğu vakada iyi tolere
558
edilir. Ancak marsupializasyon ve parsiyel rezeksiyondan sonra skolyoz, göğüs
duvarı deformitesi ve rekürrens görülebilir (1-3,5).
Mediastinal Gastroenterik Kistler
Her yaşta görülebilse de daha çok hayatın ilk yılında ortaya çıkar. Genellikle
mediastenden hemitoraksa doğru retroplevral alandan uzanım gösterir. Toraks
içerisindeki kistin abdominal yapılarla özofageal hiatus veya diafragmadaki ayrı bir
defekten bağlantısı olabilir. En çok midenin büyük ve küçük kurvaturu, duedonum,
ince bağırsağın proksimal bölümü ve pankreatik duct ile ilişkilidir. Patolojik olarak
kistin içi tipik olarak gastrik mukoza örter. Kistin duvarı da mide duvarı gibi muskularis
mukoza, submukoza ve iki veya bazen üç kat kas dokusunu içerir. Seroza yoktur.
İntratorasik gastrik kistlerde hemivertebra, vertebral füzyon ve spina bifida gibi
vertebral anomaliler eşlik edebilir. Kistin vertebra ile ilişkisinin olmaması nöroenterik
kistlerden ayırır (5).
Klinik
Semptomlar kistin boyutuna, çevre dokuya basısına ve içerdiği ektopik mide
mukozasının oluşturduğu peptik komplikasyonlara bağlı oluşur. En sık görülen
semptomlar öksürük, dispne, ağrı, disfaji ve kusmadır. İnfantlarda daha çok
respiratuvar semptomlar varken ileri yaştaki çocuklarda ağrı ve melana daha sıktır.
Gastrointestinal sistemle ilişkili kistlerde peptik ülserasyona bağlı kanama olursa
gastrointestinal sistemden izlenir. Kist bronşa perfore olursa hemoptizi, parankime
perfore olursa pulmoner hemoraji oluşur.
Radyoloji
Standart toraks grafilerinde görülebilir. Posterior mediastende trakeayı ve kalbi iten
yuvarlak lezyon şeklinde izlenir. Sıklıkla sağ taraftadır. Özofagusun baryumlu
grafisinde özofageal bası bulgusu izlenirken lümen ile bir ilişki saptanmaz. Ancak tüm
üst abdomen incelendiğinde retrograt dolum sayesinde kist ile infradiafragmatik
intestinal sistem lümeni arasındaki trakt izlenebilir. Tomografi ile kistin lokalizasyonu
ve çevre dokular ile ilişkisi ortaya konulur. Mide mukozasının tespiti için sintigrafik
(99mTc pertechnetate) yöntemlere başvurulur.
559
Tedavi
Gastrik kistlerin tedavisi cerrahidir. Torakotomi ile kist total olarak çıkarılır. Ayrıca
kistin infradiafragmatik kesiminin de eksizyonu gerekmektedir.
Mezotelyal Kistler
Plevral Kistler
Uniloküler mezoteliyel kistler mediastenin genellikle anterior kompartmanında lokalize
olurlar. Sıklıkla asemptomatik olup tesadüfen ortaya çıkarlar. Tomografik ve
ultrasonik incelemelerde kistik yapı ortaya çıkar. Asemptomatik küçük lezyonlarda
periyodik radyolojik takipler yapılsa da kesin tanı ve tedavi için cerrahi girişime ihtiyaç
vardır. Cerrahi olarak total rezeksiyon küratiftir (1,6).
Perikardiak Kistler
Perikardiak kistler toplumda 1/100.000 oranında görülür ve tüm mediastinal kistlerin
%26-36 sını oluşturur. Yaklaşık % 70 i sağ, %22 si sol kardiofrenik açıda, % 8’i ise
diğer lokalizasyonlarda (posterior mediastinum, sağ ve sol hiler, sağ paratrakeal ya
da arkus aorta) lokalize olur. Boyutları 3-30 cm arasında değişmektedir (6).
Çoğu perikardial kistler asemptomatiktir ve direk radyografi, CT veya ekografi ile
tesadüfen rastlanmaktadır. Bununla beraber hastaların % 20 sinde semptom vardır.
Bunlar basıya bağlı dispne, sağ kalp yetmezliği, infeksiyon, hemorajidir.
Radyografik olarak düzgün kenarlı yuvarlak veya gözyaşı şeklinde ve karakteristik
olarak kalp, anterior toraks duvarı ve diyafragma arasında lokalizedir. CT de
uniloküler şekilde görülür. Bazen radyolojik olarak Morgagni hernisi ile karışabilir.
Ekokardiyografi ventriküler anevrizma ve perikardial yağ dokusundan ayrımında
yardımcı olur.
Cerrahi rezeksiyon özellikle büyüyen veya semptomatik olgularda tercih edilen tedavi
yöntemidir. Ancak kesin tanı için yine cerrahi girişime ihtiyaç vardır. Cerrahi girişim
olarak torakotomi ve VATS tercih edilir. Kist total olarak eksize edilir. Sadece
aspirasyon ile tedavi denemesinin rekürrens ve komplikasyon riski vardır.
Timik Kistler
Timik kistler nadirdir ve tüm mediastinal kitlelerin % 4 ünü oluşturur. Timik kistler
timusun gelişimi sırasındaki yol aldığı tüm lokalizasyonlarda olabildiği gibi en sık
560
anterior mediastende yer alır (Resim 44.4). Genellikle uniloküler, küçük ve ince
duvarlıdır. Uniloküler olması konjenital olduğunu düşündürür. Edinsel kistler
multiloküler olup inflamasyon ve fibrozis eşlik eder. Multiloküler kistler infeksiyon,
immünolojik hastalık, neoplazi veya travma ile ilişkilidir. Mediastinal timik kistler
asemptomatik olabildiği gibi servikal kistlerde sıklıkla boyunda büyüyen kitle ve ağrı
vardır. Semptom olarak göğüs ağrısı, öksürük, disfaji, dispne, perikarditis veya
tamponat görülebilir. Konjenital timik kistler CT de homojen ve düşük dansitede
görülür. Edinsel multiloküler timik kistler CT de kalın duvarlı, multikistik lezyon ve
yumuşak doku dansitesinde görülür. Timik kistlerde malignite gelişimi olabilir.
Timoma veya lenfomanın kistik varyasyonları ile de karışabileceğinden dolayı
çoğunlukla cerrahi müdahale gerektirir. Cerrahi yöntem olarak median sternotomi,
VATS ve hatta robotik cerrahi teknikler uygulanır (6).
Resim 44.4: Ön mediastendeki timikl kistin tomografik ve operasyon sonrası görüntüsü.
Duktus Torasikus Kistleri
Torasik duct kistleri oldukça nadir ve çoğunlukla posterior mediastende yer alan
kistlerdir. Diğer asemptomatik olan mediastinal kistlerden farklı olarak genellikle
semptomatiktir. Supraklavikuler kitle şeklinde görülebilir ve sıklıkla trakea veya
özofagusa bası bulgusu vardır. Semptomlar yağlı bir yemekten sonra şilöz akımın
artıp kistin büyümesi ile birlikte artabilir. Eğer preoperatif olarak bu kistlerden
şüphelenilirse lenfanjiografi ile tanı doğrulanabilir. Tanı ve tedavi için rezeksiyon
561
uygulanır. Cerrahi komplikasyon şilotoraks olup duktus torasikus ile olan ilişkisinin
bağlanması ile tedavi edilir (1,6).
Pankreatik Psödokistler
Pankreatik psödokistler aorta ve özofageal hiatus yolu ile veya diyafragmanın direk
erozyonu ile bazen toraksta yer alabilir. En sık lokalizasyon posterior mediastendir.
Eğer Morgagni hernisi varsa kist bu aralıktan geçip kalbin anteriorunda yer alabilir.
Tanı CT ile veya retrograt kolanjiopankreatografi ile konulur. Pankreatik psödokistleri
rüptüre olup yüksek amilaz içeren plevral efüzyona neden olabilir. Cerrahi yaklaşım
olarak torasik değil trans abdominal yol tercih edilir (1,6).
Paratiroid Kistleri
Mediastinal paratroid kistler çok nadirdir. Daha çok anterosuperior mediastende
görülür. Birlikte hiperparatroidizm ve hiperkalsemik kriz de izlenebilir. Görülen
semptom ve bulgular boyunda kitle, respiratuvar distres, bazen disfaji, göğüs ağrısı,
rekürren larengeal sinir paralizisi, trakeal ve venöz basıdır. Boyutları 0,5-12 cm
arasında değişmektedir. Kistler ince duvarlı, uniloküler ve şeffaf içeriği bulunur.
Duvarda paratroid dokusu bulunabilir. Tanı kistin aspire edilmesi sonucu içeriğinde
paratroid hormonun bulunması ile konulur. Tedavisi cerrahidir. Transservikal, VATS,
median sternotomi veya torakotomi tercih edilir. Aspirasyon uygun tedavi yöntemi
değildir (1,6).
KAYNAKLAR
1. Nichols FC, Harrison KP. Mediastinal cysts and duplications in adults. In Patterson
GA, Cooper JD, Deslauriers J, Lerut AEMR, et al. ed. Pearson’s Thoracic and
Esophageal Surgery, vol 1, 3rd ed. Philadelphia: Churchill Livingstone; 2008:15811588.
2. Ferraro P, Martin J, Duranceau ACH. Foregut cysts of the mediastinum. In Shields
TW, LoCicero J, Reed CE, Feins RH, ed. General Thoracic Surgery, vol 2, 7th ed.
Philadelphia: Lippincott Williams and Wilkins; 2009:2519-2530.
3. Chiu P, Langer JC. Mediastinal cysts and duplications in infants and children. In
Patterson GA, Cooper JD, Deslauriers J, Lerut AEMR, et al. ed. Pearson’s Thoracic
and Esophageal Surgery, vol 1, 3rd ed. Philadelphia: Churchill Livingstone;
2008:1563-1580.
562
4. Alpay Sarper, Arife Ayten, Ilhan Golbasi, Abid Demircan, et al. Bronchogenic Cyst.
Tex Heart Inst J, 2003; 30: 105-8.
5. Ladd AP, Touloukian RJ, Rescorla FJ, Grosfeld JL. Gastroenteric cysts and
neuroenteric cysts in infants and children. In Shields TW, LoCicero J, Reed CE,
Feins RH, ed. General Thoracic Surgery, vol 2, 7th ed. Philadelphia: Lippincott
Williams and Wilkins; 2009:2531-2538.
6. Rocco G, Shields TW. Mesotheliel and other less common cysts of the
mediastinum. In Shields TW, LoCicero J, Reed CE, Feins RH, ed. General Thoracic
Surgery, vol 2, 7th ed. Philadelphia: Lippincott Williams and Wilkins; 2009:25392552.
563
45.
Dr. Ahmet Demirkaya ve Prof. Dr. Kamil Kaynak
İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
MEDİASTEN CERRAHİSİ TEMEL PRENSİPLER
Mediasten kitlelerinde cerrahi tedavi planlanırken öncelikle mediasten anatomisine ve
organlarına hakim olmak gerekmektedir. Mediasten, anatomik olarak üstte torasik
inlet, altta diafragma, önde sternum, arkada vertebra ve kot arkuslarının oluşturduğu
mediastinal plevralar arası boşluktur. Klinik değerlendirme yapılırken mediasten üç
anatomik bölgeye ayrılmıştır. Bunlar ön, orta ve arka mediastendir (Şekil 45.1). Ön
mediasten, sternum ve perikardın ön yüzü ile sınırlı kalan bölümdür. Bu bölgede
timus, lenf bezleri ve yağlı dokular yer almaktadır. Orta mediasten, ön sınırını
perikard ve brakiosefalik ven, arka sınırını ise vertebra korpusunun ön yüzü
oluşturmaktadır. Bu bölgede kalp ve büyük damarlar, trakea, ana bronşlar, özofagus,
vagus ve frenik sinirler, duktus torasikus ve lenf bezleri yer almaktadır. Arka
mediasten ise kolumna vertebralisin heriki yanında, önde vertebra korpusunun ön
kenarı ile arkada kot kavisleri arasında kalan bölgedir.
Burada sempatik zincir,
interkostal sinirler ve spinal sinir kökleri yer almaktadır.
Şekil 45.1: Mediasten bölümlerinin görüntüsü
Ön Mediasten Kitlelerinde Cerrahi
Erişkinlerde ön mediastinal kitlelerinin %45'sini, tüm mediastinal lezyonların %20'sini
timik lezyonların oluşturulduğu bildirilmektedir (1,2). Timik tümörler daima anterior
mediastende yerleşirler, nadiren başka yerlerde görülebilirler. Histolojik olarak
değerlendirildiklerinde Timoma, Timik Karsinoma ve Timik Nöroendokrin orijinli
tümörler olmak üzere 3 ana gruba ayrılırlar.
564
Anterior mediastinal tümörler ve timus ile ilgili araştırmalar Myasthenia Gravis (MG)
nedeniyle yapılan araştırmalara paralellik göstermektedir. Timus cerrahisinin gelişimi
MG ile timus dokusu arasındaki bağlantının ilk işaretleri ile başlamış ve Sauerbruch
1911 yılında ilk timektomiyi uygulamıştır. Blalock 1936’da radyoterapiye cevapsız
mediastinal kitlesi olan MG’li bir olguda median sternotomi ile kitle ekstirpasyonu
yaparak hastayı tedavi etmiştir (1-4). Geçmişten bugüne timus cerrahisi MG’li
olguların dışında timusun iyi ve kötü huylu tümörlerine de uygulanmaktadır.
Timus dokusu ön mediastende genellikle sağ ve sol lob olmak üzere iki lobdan
oluşmaktadır. Anatomik olarak kabaca "H" harfi şeklindedir. Ağırlığı ergenlikte
yaklaşık 30-40 gr, yetişkinlerde 10-15 gr arasındadır. Alt uçları perikard üzerine
uzanır, üst uçları ise boyuna uzanarak tirotimik ligamana tutunur. Timus dokusu
değişik boyutlarda ve şekillerde boyundan diafragmaya kadar bütün mediastinal doku
içinde saptanabilir. MG'in cerrahi tedavisinde başarı için ektopik dağılımın dikkate
alınması şarttır.
Arteryel beslenmesi çoğunlukla internal meme arterin bir dalı ile olmakta iken inferior
tiroid arter ve perikardiyofrenik arterden de ufak dallar alabilir. Venöz drenaj arterlere
eşlik eden ince venler yanında tek bir venle sol innominat vene olmaktadır. Bazen
superior vena kavaya da bir dal verebilir. Lenfatik drenaj ön mediastinal, hiler ve
internal meme lenf nodlarınadır (1,3,5).
Ön mediastinal kitlenin diğer ön mediastinal kitlelerden (lenfoma, malign germ hücreli
tümör, metastatik akciğer kanseri gibi) ayrılamadığı durumlarda ve cerrahi olarak
çıkarılması mümkün olmayan lezyonlarda tedaviye karar vermeden önce bir biyopsi
ile tanı kesinleştirilmelidir. İnce iğne biyopsisi yeterli gelebilir fakat 18 G punch biyopsi
veya açık biyopsi prosedürüne ihtiyaç duyulabilir. Kitlenin anatomik lokalizasyonuna
bağlı olarak substernal mediastinoskopi, anterior mediastinotomi, lateral torakotomi
gerekebilir. Plevral veya perikardiyal effüzyon varlığında iğne aspirasyonu veya
VATS (Video Assisted Thoracoscopic Surgery) ile biyopsi de kullanılabilir (1-6).
Timoma
Timomaların yaklaşık % 95'i ön mediastende yerleşir. Bunun dışında nadiren
boyunda, hiler bölgede, akciğer parankiminin içinde ve diğer intratorasik alanlarda da
yerleşebilir. Erişkinlerin en sık mediastinal lezyonudur. Çocuklarda nadir görülür
(1,2).Olguların yaklaşık yarısı tesadüfen tespit edilir, yavaş büyürler fakat lokal olarak
tekrarlama eğilimindedirler. Tam rezeksiyon tedavinin temelini oluşturur.
565
Makro
veya
mikroskobik
invazyon
timomalı
olgularda
%
30–60
oranında
bildirilmektedir. Bu lezyonlar tümörün histolojik yapısına bakılmaksızın malign kabul
edilmektedir. Az sayıda oİguda kapsüllü timoma mikroskobik invazyon olmasa da
çevre dokuya yapışık olabilir (Mediastinal plevra, perikard, akciğerler, lenf nodları,
göğüs duvarı, büyük damarlar ve sinirler). Bu tip lezyonlar non invaziv kabul edilir.
Ancak Lewis 1987’de bu tip timomalı olgularda prognozun yapışık olmayanlara göre
daha kötü olduğunu bildirmişdir (1,3).
Lokal invazyon dışında timomaların benign histolojik görünümlerine karşın uzak
organ metastazları sık olmamakla birlikte mevcuttur. Plevral ve perikardiyal tutulum,
akciğer ve mediastinal lenf nodları tutulumu, kemikler, karaciğer, santral sinir sistemi,
aksiller ve supraklavikuler lenf nodları tutulumu görülebilmektedir (Resim 45.1).
Diafragmatik
invazyon
olabileceği
gibi,
her
iki
taraftaki
Larey
aralığından
subdiafragmatik alana invazyon da görülmektedir. Tüm olgularda uzak metastaz veya
tutulum oranı %3-7 arasında, invaziv timomalarda ise % 26-30 oranında
görülmektedir (3).
Resim 45.1: Akciğer ve perikarda invazyon yapmış ve cerrahi olarak çıkarılmış bir
timoma olgusu
Tedavi yöntemlerini ve sonuçlarını değerlendirmek için evrelerneye ihtiyaç vardır.
Lokal invazyon ve uzak metastaz dikkate alınarak çok çeşitli evrelerneler yapılmıştır.
Timoma için standart bir evreleme sistemi yoktur günümüzde en sık kullanılan
Masoaka evreleme sistemidir (1,2,3,5).
Yaygın metastatik hastalık haricinde tedavi cerrahidir, invazif tümörlerde bile tam
rezeksiyon, uzun dönem sağkalıma önemli katkı sağlamaktadır. Timomaların %4070’i kapsüllü tümörlerdir ve tam rezeksiyonu ile şifa sağlanır. Kapsüllü tümörlerin
%20’sinde mikroskopik invazyon vardır, hem makroskopik hem de mikroskopik
566
invazyonun olmadığı saptanan olgularda bile lokal olarak invazyon %12 oranında
bildirilmektedir. Bu nedenle hastaların çoğu bölgesel ve sistemik tedaviden yarar
görür. İleri evre tümörlerde kombine tedavilerin yaşama olumlu katkıları olmaktadır
(1,5,7).
Wilkins ve arkadaşları 1991 yılında operasyon uyguladıkları 85 timoma olgusunun
%53'ünün kapsüllü ve mikroinvazyon içermediğini, %27 olgunun ise kapsüllü
olmasına rağmen mikroskobik invazyon varlığını tespit etmişlerdir. Bu olgularda 5 ve
10 yıllık yaşam sürelerinde farklılık olmasa da invazyon olmayanlarda nüks
olmazken, mikroinvazyonu olan grupta %22 nüks saptadıklarını bildirmektedirler (1).
Cerrahi tedavide başarının temel prensipleri:
Komplet median sternotomi ile rezeksiyonun yapılması
Her iki plevral boşluğun tamamen açılması
Bütün normal timik dokuyu içeren total timektomi
İnvazif (Evre III) tümörleri enblok çıkarmak için perikardı, akciğeri
brakiosefalik ven veya süperior vena kavayı da içeren extended
rezeksiyon
Bütün plevral implantların(Evre IV) ve akciğer metastazın çıkartılması
Anterior mediastene lokalize tümöre, frenik sinirden-frenik sinire ve
brakiosefalik venden diafragmaya kadar geniş eksizyon yapılmalı (2,3).
Timomalarda uzun dönem (10 yıl) sağkalım tam rezeksiyon sonrası Evre I tümörde
%80-90, Evre II tümörde %70-80 dir. Evre III ve IV tümörlü hastalarda tam rezeksiyon
ya zordur ya da imkansızdır. 307 olguluk bir seride 10 yıllık sağkalım total rezeksiyon
yapılanlarda %76, tam olmayan rezeksiyon yapılanlarda %28 olarak bildirilmiştir.
Tam rezeksiyon önemli bir prognostik faktördür (2).
Timomalar radyosensitiftir. Parsiyel rezeksiyon veya biyopsi sonrası rezeke
edilemeyen hastalıklar (Evre III,IV),
rezidüel hastalıklar, cerrahi tedaviyi kabul
etmeyen veya tolere edemeyen hastalar için endikedir. Radyoterapinin preoperatif
kullanımı ile bulky tümörlerin çıkarılmasında yarar göreceği de belirtilmiştir.
İndüksiyon kemoterapisinin radyoterapiden daha efektif olduğunu ve radyoterapinin
postoperatif döneme saklanması gerektiği de önerilmektedir. Evre III veya IV
hastalarda adjuvan RT alanlarda 5 yıllık sağkalım %67, RT almayanlarda ise %24
tespit edilmiştir (2,3,4,7,8,9).
567
Anterior mediastende sınırlı bir tümörün geniş eksizyonu uygulanmalıdır. Frenik
sinirler arası ve brakosefalik venden diafragmaya uzanacak şekilde geniş eksize
edilmelidir. Daha az rezeksiyonlar küçük ve kapsüllü tümörlerde bile uygun değildir.
Büyük ve invazyon yapmış tümörlerde preoperatif kemoterapi, komplet rezeksiyonu
kolaylaştırabilir. Akciğere ve plevraya metastazı olan hastalar metastazektomi ile
birlikte rezeksiyon için uygundurlar.
Timik cerrahi için uygun olan birçok insizyon mevcuttur. Sadece servikal yaklaşım
yetenekli ellerde timoma dışı lezyonlarda uygun görülse de timik tümörlerin
cerrahisinde yeri yoktur. Tümör, tüm boyuna tamamen yayılmadıkça sternotomi ile
yeterli yaklaşım sağlanmaktadır.
Parsiyel sternotomi, Myastenia Gravis için yapılan timoma dışı timektomiler için
yeterli görüş sağlasa bile timomanın posterolateral yayılımını, trans-plevral yayılımını
veya fnrenik sinir tutulumunun değerlendirilmesinde yeterli değildir. Medyan
sternotomi,
parsiyel sternotomi ile karşılaştırıldığında çok az morbidite artışı
taşımasına rağmen iki plevraların açılması ile maksimum görüş sağlamaktadır.
Lateral torakotomi timusun tek lobunda bulunan enkapsüle bir tümöre kolay
ulaşılmasına izin verse de tam timektomiyi daha da zorlaştırmaktadır. Aksine
transvers sternotomiye ilave bilateral subkostal insizyon (clamshell) tüm mediastene
ve heriki plevral kaviteye geniş bir eksplorasyon sağlar. Bu yolların hiç birisi olguların
büyük çoğunluğu için uygun değildir. Tümör posterior mediastene yayılmış ve tümör
nüksü mevcut ise reoperasyon için kullanılmalıdır.
Torakoskopik timektomi, median sternotomiye göre daha fazla zaman almaktadır.
Morbidite ve hastanede kalma süreleri açısından da bir avantaj sağlamaktadır.
Torokoskopinin en önemli avantajı ise kozmetiktir. Torokoskopi tüm mediastenin
görüntülenmesini mükemmel sağlasa da komplet rezeksiyon için lokal invazyonları
değerlendirmede
büyüdüklerinden
yetersiz
olduğu
torakoskopinin
düşünülmektedir.
gerçek
başarısı
uzun
Timomalar
dönem
yavaş
takiplerinde
anlaşılcaktır (1,2,3,4,7,8).
Cerrahinin hedefi, invazif ve metastazik hastalığı da içeren tüm tümörün tam
rezeksiyonudur. Cerrahiden önce tümörün timüsu aştığı belli olmayabilir ve cerrah
rezeksiyonun genişliğine bağlı olarak intraoperatif kararlar vermeye hazırlıklı olmalıdır
(3).
568
Perikardiyum
Anteriyor perikardiyumun çıkarılması rutin değildir fakat timus ve perikardiyum
arasındaki adezyonlar, enkapsüle bir tümör varlığında bile direkt invazyonu ekarte
etmeyi zorlaştırabilir. Anterior perikardiyumun eksizyonu güvenle yapılmalıdır ve
herhangi bir yapışık bölge rezeke edilmelidir. Oluşan defektin rekonstrüksiyonu
primer veya yama ile kapatılabilir (3,4).
Frenik sinir: Her ikisi olmasa da tek bir frenik sinirin feda edilmesi tam rezeksiyonu
sağlayacak ise yapılmalıdır. Bu durum kısıtlı pulmoner fonksiyonu olan hastalarda
kontrendikedir ve myastenik hastalarda sadece aşırı dikkat göstererek yapılmalıdır.
Eğer her iki frenik sinir tutulmuş ise veya sadece biri tutulmuş fakat tam rezeksiyon
başka sebeplerden dolayı mümkün değil ise, bu durumda debulking, her iki frenik
sinir korunarak yapılmalıdır (3,4).
Vasküler yapılar: Eğer rezeke edilmeleri ile tam rezeksiyon sağlanabilecek ise hem
superiyor vena kava, hem de brakiyosefalik ven rezeke edilebilir ve rekonstrükte
edilebilir (3).
Akciğer, plevra ve diyafram: Akciğere direkt invazyon, pulmoner fonksiyonların izin
verdiği ölçüde rezeke edilmelidir. Stapler ile kama eksizyon genellikle uygundur,
bununla birlikte segment rezeksiyonu veya anatomik lobektomi gerekli olabilir.
Nadiren pulmoner hilus veya plevrayı tutan hastalığı tamamen rezeke etmek için
pnömonektomi veya ekstraplevral pnömonektomi gerekir. Bu prosedür sadece genç,
başka açıdan sağlıklı ve fizyolojik olarak uygun hastada yapılmalıdır. Pariyetal plevral
implantlar
plevral
stripping
ile
çıkarılabilir.
Diyafragmatik
implantlar
en
iyi
diyafragmanın tam kat eksizyonu ile çıkarılırlar (3,4).
Lenfoma
Mediastinal kitlelerinin
% 10-14’ünü oluşturur ve ön mediastenin ikinci sıklıkta
görülen patolojileridir. Sıklıkla ön mediastende görülmelerine karşın, lenf dokusu
içerdiklerinden diğer mediastinal alanlarda da lenfomalar saptanabilmektedir.
Lenfomalar genellikle yüzeyel lenf bezlerinden başlar ve olguların 2/3’ü non-Hodgkin
lenfoma tipindedir. Primer mediastinal lenfomalar genellikle 25 – 40 yaşları arsında
genç erişkinlerde saptanır. Her iki cinste de eşit sıklıkta görülmektedir. Vena cava
superior sendromuna ilerlemiş olgularda rastlanmaktadır. Sistemik belirtilerin varlığı
yaygın hastalık bulguları olarak kabul edilir.
569
Tanı lenf bezi biyopsisinin histopatolojik incelemesi ile yapılmaktadır. İnce iğne
aspirasyon biyopsileri uygulansa da yeterli doku örneği alınamadığından çoğu kez
yeterli sonuç vermemektedir. Bu nedenle mediastinotomi ve mediastinoskopi gibi
açık biyosi yöntemlerinin yanında VATS ile de tanı konulabilmektedir (10,11). Tedavi
hücre tipi ve sınıflama sonucuna göre kemoterapi ile yapılmaktadır.
Germ Hücreli Tümörler
Mediastende nadir yerleşim gösteren germ hücreli tümörlere % 1- 3 oranında
rastlanılmaktadır (12). Teratomlar kadın ve erkeklerde eşit oranda görülmekte ve her
yaşta saptanabilmektedir. Çoğunlukla selim karakterdeki germ hücreli bu tümörler
erkeklerde testis kaynaklıdır.
Mediastinal germ hücreli tümörlerin %95’i ön mediastende yerleşir ve herhangi bir
boyuttta olabilir (12). Habis karakterde olanlar genellikle daha büyüktürler. Selim
germ hücreli mediastinal tümörlerde rezeksiyon yeterlidir. Habis tümörlerde ise
histolojik yapısına göre farklı tedavi modaliteleri uygulanmaktadır. Uygun kemoterapi
ve cerrahi rezeksiyon yapılan habis teratomlarda 5 yıllık sağkalım %50’dir13.
Seminomlar radyosensitif tümörler olduğu için erken evre ve küçük lezyonlarda
radyoterapi veya cerrahi rezeksiyon primer tedavidir. Büyük ve yaygın hastalık
bulgusu olan lezyonlarda ise kemoterapi uygulanmalıdır.
Non-seminomatöz
tümörlerde ise asıl tedavi cerrahi olmakla birlikte, bunun yanısıra uygulanacak
kemoterapinin sağkalımı arttırdığı bilinmektedir (14).
Timik Kistler
Timik kistler nadirdir ve tüm mediastinal lezyonların %1-3’ünü oluştururlar. Timusun
selim lezyonudur, konjenital veya akiz olarak meydana gelebilir. Kadın ve erkeklerde
eşit olarak görülürler. Olguların yaklaşık yarısı servikal yerleşimlidir. Servikal timik
kistler pediatrik yaş grubunda sık görülürken, mediasten yerleşimli olanlar sıklıkla 3-6.
dekatta görülmektedir. Genellikle asemptomatiktirler ve hiçbir bulgu vermeden büyük
boyutlara ulaşabilirler. En sık ortaya çıkan semptomlar öksürük, nefes darlığı ve
ağrıdır, oldukça büyük boyutlara ulaşabilirler. Multiloküler olabilirler. BT kesin tanıda
yardımcıdır. Tedavisi cerrahidir. Kistik lezyon tam olarak çıkartılır (1-4,15). Boyun
kökünde yerleşmiş olanlar torakotomiye gerek kalmadan transvers servikal insizyon
ile rezeke edilebilirler.
570
Lenfanjiomalar
Lenfanjiomalar lenfatik kökenli multiloküler, ince duvarlı kistik kitlelerdir. Tüm
lenfanjiomaların %1’i mediastende yer alır. Sıklıkla anterior kompartmanda daha az
olarak da visseral kompartmanda yerleşirler. Seröz bir sıvı ile doludur ve saydam
ince bir membran ile çevrilidir. Boyunda veya aksillada lenfanjioma tespit edilen
olguların yaklaşık %10’unda mediasten yerleşimli lenfanjioma tespit edildiği için direkt
grafi ile kontrolü uygundur (14,16). Tedavide cerrahi rezeksiyon yeterlidir.
Lenfanjiomalar boyun tabanına veya diyafragmaya kadar uzanım gösterebilirler.
Şilotraks
olsılığını
azaltmak
için
tüm
lenfatiklerle
ilişkisini
ligatüre
etmek
gerekmektedir (17).
Orta Mediasten Kitlelerinde Cerrahi
Bronkojenik Kistler
Bronkojenik
kist,
trakeobronşial
ağacın
gelişimi
sırasında
anormal
tomurcuklanmasıyla oluşan ve genellikle orta mediastende yerleşim gösteren kistik
lezyonlardır. Bronkojenik kistlerin büyük bir çoğunluğu trakea, ana bronşlar, karina
gibi büyük hava yollarına komşu mediastende ve hiler bölgelerde yerleşir. Kistlerin
%75’i mediasten, %25’i akciğer parankimi, plevra veya diyafragma gibi mediasten
dışı yerlerde görülür. Kistlerin yaklaşık 1/4’ü karina üzeri yerleşim gösterirken 3/4’ü
karinanın altında yerleşim gösterirler. Kistlerin duvarı solunum sistemi epiteliyle
döşelidir. Duvarında kıkırdak, bronş bezleri ve düz kaslar bulunabilir. Sekretuar
hücreler nedeniyle mukoid bir materyalle doludur ve büyüme eğilimindedirler. Eğer
kistler enfekte olursa epitel hasar görerek patolojik tanıda zorlanılabilinir (14,16,17).
Olguların çoğunda boronkojenik kistlerin tanısı göğüs grafileri ile yapılabilmektedir.
Tipik olarak, sağ paratrakeal veya subkarinal bölgeye yerleşirler. Olguların % 70’inin
sağ tarafta yerleşim gösterdiği bildirilmiştir. Parankimde yerleşenler ise bronşla
bağlantılarının açık olup olmamasına göre radyolojik bulgu oluştururlar. Bronşla
bağlantısı olmayan kistler homojen içerikli, yuvarlak, düzgün kenarlı kitleler, bronşla
bağlantılı olanlar ise tamamen hava dolu veya bazen kistlerin içinde hava-sıvı
seviyesi şeklinde görülürler (2,18,19).
Bronkojenik kistlerin tedavisi hasta hangi yaş grubunda olursa olsun cerrahi
rezeksiyondur. Çoğunlukla videotorakoskopik (VATS) rezeksiyon yapılabilmektedir.
571
VATS uygun olmayan hatalarda posterolateral torakotomi ile rezeksiyon yapılabilir
(18,20).
Gastroenterik Kistler
Gastroenterik kistler de nöroenterik kistlerde olduğu gibi yenidoğan döneminden
erişkin dönem dahil her yaş grubunda görülebilmesine rağmen en sık yaşamın ilk
yıllarında görülmektedir. Semptomlar genellikle kistin lokalizasyonu ile çevre dokulara
yaptığı bası ve ektopik gastrik doku içermesine göre çeşitlilik göstermektedir.
Gastrik kistlerle vertebral anomaliler (hemivertebra, vertebra füzyonu ve spina bifida)
sık rastlanır. Gastroenterik kistler nöroenterik kistler gibi vertebral kolon ile iştirakleri
bulunmaz ve bu özellikden dolayı kolayca ayrılırlar. Genellikle sağ taraf yerleşim
gösterirler. Tanıda drekt grafi, BT ve MR yardımcıdır.
Erken tanı ve komlet rezeksiyon sonuçları mükemmeldir. VATS seçilmiş vakalarda
yapılabilmektedir. Kistin çevre akciğerde oluşturduğu lezyonlar için wedge rezeksiyon
gerekebilir (17,21-23).
Plöroperikardiyal Kistler
Perikardiyal kistler selim ve unilokuler lezyonlardır. Tüm mediastinal kitlelerin %7’sini
oluşturular (24). Perikardiyal kese oluşumundaki yetersizlik sonucu ortaya çıkarlar.
Kardiofrenik sinüsde ve sıklıkla sağda yerleşirler. Nadiren subperikardiyal, hiler veya
anterior mediastende yerleşim gösterirler. Kist seyrek olarak bir sapla perikardın
gerçek divertikülü olarak görülebilir.
Çoğu olgu asemptomatiktir. Bu olgularda kist komplikasyonları sık olmamakla birlikte
eğer kist içi kanama veya spontan rüptür oluşursa kardiak tamponat ve ani ölüm
görülebilmektedir (24). Tanı rastlantısal olarak çekilen göğüs grafilerinde konulur.
Ayırıcı tanıda en önemlisi morgagni hernisi olup, mediastinal tümörler, ventrikül
anevrizmaları ve perikardiyal yağ yastıkçıkları ile karışabilmektedir. Semptomatik
olanlarda ağrı ve nefes darlığı gözlenebilir. Genelikle 3. dekatta sık görülürlerken
nadiren pediatrik yaş grubunda görülürler. Perikardiyal kistler, ince duvarlı, mezotel
tabakası ile çevresi kaplı ve içinde renksiz, berrak sıvı bulunan kistlerdir. Tedavi
cerrahidir. Torakotomi, medyan sternotomi veya videotorakoskopi ile kolaylıkla eksize
edilebilmektedir (16,17,21,22).
572
Plevral Kistler
Basit mesotelial kistler olarak da adlandırılırlar. Anterior kompartmanda uniloküler
olarak görülürler. Genellikle asemptomatiktirler. Direkt grafi ve BT ile tanı konulur.
Lezyon küçükse ve semptomatik değilse
takip önerilmektedir. Takiplerinde
progresyon gösteriyorsa veya semptomatik ise cerrahi önerilmektedir. Cerrahi
rezeksiyon küratifdir (14,16).
Posterior Mediasten Kitlelerinde Cerrahi
Posterior mediastinal kitlelerin çıkarılmasında klasik olarak postero-lateral torakotomi
tercih edilmektedir. Kitlenin lokalizasyonuna göre girilecek interkostal aralık(İKA)
şeçilmesi gerekirken, genellikle 5.İKA tercih edilmektedir. VATS, birçok selim
nörojenik tümörün güvenli çıkarılmasında kullanılmaktadır.
Nörilemmoma
Sıklıkla
kapsüllü,
iyi
sınırlı,
çevresinde
invazyon
oluşturmayan
Schwann
hücrelerinden kaynaklanan selim karakterdeki tümörlerdir. Periferik sinir kökenli
tümörlerin %75’ini oluşturmaktadır. Schwann hücrelerinden kaynaklanan bir tümör
olduğundan Schwannoma ismi de kullanılmaktadır (Resim 45.2) (25).
Resim 45.2: Postoperatif schwannoma görüntüsü
Bu tümörler kolumna vertebralis ve intervertebral foramende ilerleyerek kum saati
şeklinde (dumbbell) tümör oluşturarak medülla spinalis basısı yapabilirler. Cerrahi
eksizyon yeterli tedaviyi oluşturur. Ancak bu tür tümörlerin cerrahi tedavisinde
573
torakotomi ile birlikte beyin cerrahları tarafından laminektomi de uygulanmalıdır.
Uygulanmadığı takdirde yetersiz rezeksiyon veya epidural kanamalar olabilmektedir.
Nörofibroma
Homojen, düzgün sınırlı fakat kapsülü olmayan tümörlerdir. Nörofibromalı hastaların
% 30 - 45’inde von Recklinghausen hastalığı vardır. Bunların habaset oranları, soliter
olanlara göre dört kat daha fazladır. Soliter nörofibromalarda tedavi cerrahi olarak
eksizyondur.
Melanotik Schwannoma
Nörojenik tümörlerin pigmente formudur. Yüksek oranda intraspinal uzanım
gösterirler ve yaklaşık % 10 oranında habistirler. Tedavisi cerrahi eksizyondur. Lokal
nüks bildirilmiştir ancak henüz metastaz bildirilmemiştir (2).
Nörofibrosarkom
Nörojenik sarkom veya habis Schwannoma olarak da adlandırılırlar. Periferik sinir
kaynaklı en sık rastlanan habis tümördür (25). Genellikle erken yaşlarda görülürler.
Tedavide cerrahi rezeksiyon ve postoperatif radyoterapi uygulanır. Erken lokal nüks
olmaktadır.
Nöroblastoma
Bu tip tümörlerin büyük çoğunluğu toraks dışında yerleşir. Sempatik sinir dokusunun
olduğu her yerde nöroblastoma görülebilir. Oldukça invaziv bir tümördür, ancak
torasik nöroblastomalar daha az visseral invazyon yaptığından rezeksiyon olasılığı
daha yüksektir. Vazoaktif intestinal peptid salınımına bağlı diyare ve karın ağrıları,
aşırı katekolamin salınımına bağlı olarak vanil mandelik asit (VMA) ve homovanilik
asit gibi idrar metabolitlerinde artış ve feokromositoma sendromu bulguları ortaya
çıkabilir. Tam rezeksiyon sonrası hormon değerlerinde düşüş olur, bu bulgu da
tedavinin sonucu hakkında bir göstergedir (23). İyi sınırlı noninvazif ve orta hattı
geçmeyen tümörlerde cerrahi ve radyoterapi uygulanmalı, orta hattı geçen ve uzak
organ metastazı olan ileri evre tümörlerde ise cerrahi, radyoterapi ve kemoterapiyi
kapsayan multimodal tedavi uygulanmalıdır.
574
Feokromositoma
Adrenal dışı kaynaklı feokromositomalar yaklaşık % 10 oranındadır ve bunların da
intratorasik yerleşimli olanları çok nadirdir. Torasik lezyonlar sıklıkla paravertebral
olukta yerleşir. Bunun dışında nadiren aortanın civarında ve atriumda da yerleşim
gösterebilirler. İntratorasik yerleşimli feokromositomaların %10 kadarı da habis
karakterdedir. Feokromositomalar genellikle cerrahi rezeksiyon ile çıkartılmalıdır.
Cerrahi esnasında bu tümörlerin manüplasyonu ile habis hipertansiyon meydana
gelebileceğinden preoperatif dönemde bunu önleyici tedavi uygulanmalıdır(2). Ayrıca
vaskülaritesi çok yüksek tümörler olduğundan, cerrahi esnasında besleyici arterlere
dikkat etmek ve öncelikle bunların ligasyonu gerekmektedir.
Özofageal kistler
Bronkojenik kistler ile benzer özellikler gösterirler. Posterior mediastendeki kistik
lezyonların büyük bir kısmını oluştururlar. Tek lezyondurlar ve enterojenik kistler veya
özofageal duplikasyonlar olarak da adlandırılırlar. Özofageal kistler erişkin gruba göre
pediatrık yaş grubunda daha fazla görülmektedir. Bu kistler ösefagusa yapışıktır,
gastrointestinal sistem mukozası ile çevrilidir ve iki kat halinde muskularis propria
içerirler (4,7,9,17).
Özofageal kistler, bronkojenik kistlerden daha az sıklıkta rastlanmaktadır. Tüm
mediastinal kistlerin %5-14’ünü oluşturur (20). Özofagusun selim lezyonlarından
leiomyom ve selim poliplerden sonra üçüncü sıklıkta görülmektedir. Çoğunlukla
özofagusun alt üçüncü kısmında ortaya çıkarlar ve genellikle sağda yerleşim
gösterirler.
Bronkojenik kistlerde olduğu gibi özofageal kistlerde de cerrahi olarak komplet
rezeksiyon tedavide önerilmektedir. Rezeksiyon için girişim lezyonun lokalizasyon ve
ilişkisine
bağlı
olarak
torakal,
abdominal,
transabdominal
veya
VATS
ile
yapılabilmektedir. Cerrahi girişim sırasında özofagus mukozasının korunmasına
dikkat etmek gerekmektedir. Komplet rezeksiyon sonrası rekürrens nadirdir. Cerrahi
risk taşıyan semptomatik hastalarda endoskopik iğne aspirasyonu alternatif bir tedavi
olarak uygulanabilmektadir (4,5,9,22).
575
Nöroenterik kistler
Nöroenterik kistlerin genelikle yaşamın ilk yıllarında tanısı konulmakla birlikte
yaşamın yenidoğan döneminden yetişkin yaşa kadar olan aralıkta
görülebilmektedir. Mediastinal nöroenterik kistler spinal anomali veya
medullar tutulum olmaksızın spinal kanal içine doğru büyüme gösterirler.
Eşlik eden spinal anomaliler hemivertebra, vertebra füzyonu, anterior spina
bifida veya intraspinal kitleler olabilmektedir. Nöroenterik kist tanısı sıklıkla
standart akciğer grafilerinde posterior mediasten paravertebral sulkusda
görülen kistik lezyonla akla gelmektedir. BT ve MR ile nöroenterik kist ile
beraberinde vertebra ve spinal kanal anomalileri de ayırt edilebilmektedir
(17).
Geçmiş yıllarda kist aspirasyonu, marsupializasyon, ve parsiyel rezeksiyon tedavide
kullanılmış olsa da kesin tedavi kistin komplet rezeksiyonudur. Bu işlem standart
torakotomi, kistin lokalizasyonuna göre torakoabdominal insizyonla yapılabilmektedir.
VATS intraspinal yayılım göstermeyen veya minimal yayılım gösteren nöroenterik
kistlerde tercih edilmektedir (9,15,22).
Duktus Torasikus Kistleri
Oldukça nadir mediastinal kistlerdir. Duktus torasikus boyunca herhangi bir
lokalizasyonda
olabilir.
Posterior
mediastende
yerleşim
gösterir
ve
sıklıkla
unilokülerdir. Genellikle hayatın 4 ve 5. dekatlarında sık görülürler. Kist, duktus
torsikusun torasik kanaldaki konjenital zayıflığından meydana gelmektedir ve seyri
boyunca herhangi bir yerde görülebilir (16). Tedavisi cerrahi olarak rezeksiyondur.
Kist total olarak çıkarılır, postoperatif en sık komplikasyonlardan biri şilotoraksdır ve
cerrahi sırasında torasik duktusun ligasyonu gerekebilir.
Mediastinal Kitlelerde VATS
Mediastinal lezyonlarda VATS tanı ve tedavi amaçlı sık olarak kullanılmaktadır. Bu
minimal invaziv teknikle deneyimli ellerde; solunum rezervi az etkilenmekte,
kameranın büyütme özelliği sayesinde daha iyi bir eksplorasyon sağlanmakta,
576
hastanede kalış süresi azalmakta, daha kozmetik bir girişim sağlanmakta ve de en
önemlisi hasta memnuniyeti artmaktadır. Hastalar ameliyata hazırlanırken standart
göğüs cerrahisi ameliyatlarında olduğu gibi hazırlanmalıdır. Çünkü her kapalı
ameliyat açık ameliyata dönme riski taşımaktadır.
Her şeyden önce hastalar tek akciğer ventilasyonunu tolere edecek solunum
fonksiyonlarına sahip olmalıdır. Çift lümenli tüp ile entübe edilen hastalara standart
torakotomi pozisyonu olan posterolateral dekübitus pozisyonu verilir. Skapulanın
yukarı çekilebilmesi için kol abdüksiyonda tespit edilir. Genellikle aksiler üçgen, adele
içermediği için en uygun bölge olarak kullanılmaktadır. Skapula alt ucunun iki
santimetre mediali, orta aksiler hatla yakın 5-7. interkostal (İKA) aralıkların kesişme
noktasına isabet etmektedir. Bu bölge eksploratris torakoskopide kamera portu için
tercih edilmektedir. Bu lokalizasyon genel olarak hemitoraksa panoramik görüş
sağlar. Cerrahın yüzü hedef lezyona dönük olmalıdır. Diğer port giriş yerleri lezyonun
lokalizasyonuna göre rahat çalışılacak şekilde yerleştirilmelidir (Tablo 45.1)(26).
Tablo 45.1: VATS uygulamasında tercih edilen port lokalizasyonları
Lezyonların
yerleşim yerleri
Torakoskop
Retraktör/
Grasper
Disektör/
Stapler
Ek
Enstrüman
Apeks
Ant. Mediasten
Post. Mediasten
Orta-özafagus
Aorta-pulmoner/
Distal Özafagus
Perikard (Sol)
6. Mid
5 Mid-Post.
5. Mid.
5/6 Post.
4. Ant.
2/3. Mid.
4/6 Ant.
5.OÜ
4/5 Post
5/6 Post..
2.Ant
4. Ant
7.Mid.
3/4. Ant
7.Mid.
7. Mid.
7. Post.
4. Ant
9. Mid.
6/8 Post.
5. Post.
7. Ant
Ant:Anterior aksiller hat, Post: Posterior aksiller hat, Mid: Midaksiller hat, OÜ:Oskültasyon üçgeni,
Sayılar: İnterkostal aralık
VATS, anterior mediastinal kitlelerinin biopsi ve rezeksiyonlarında kullanılmaktadır.
İnce iğne aspirasyon biopsisinin yetersiz kaldığı insizyonel biopsi gerektiren
mediastinal lezyonlarda VATS ile tanı konma oranları %85-100’dür.
Anterior
mediastenin daha iyi görünebilmesi için hasta posteriora doğru çevirilerek, akciğer
söndürüldükten sonra posteriora düşmesi sağlanır. Böylece akciğer ekartmanına
gerek kalmaz. Timik lezyonlarda sağdan yaklaşımda innominate ven ile v. kava
superiorun birleşimi mükemmel olarak görülebilmesine rağmen aorta-pulmoner
pencerenin değerlendirilmesi iyi olmamaktadır. Eğer timik lezyon sola deviye veya
577
çok büyükse sol yaklaşımlı VATS tercih edilebilir. Timik venlerin innominate vene
dökülen dalları dikkatlice disseke edilmeli nadiren de olsa v. kavaya döküldükleri
unutulmamalıdır.
Posterior mediastinal kitlelerinde VATS, birçok selim nörojenik tümörün güvenli
çıkarılmasında, sempatektomilerde ve özagagus patolojilerinde tercih edilmektedir.
Anterior mediasten lezyonlarının tersine hasta öne çevrilerek akciğerin öne düşmesi
sağlanarak ekartmanı daha kolay olmaktadır. Bazı yazarlar hasta yüzüstü yatarken
özafagusa yaklaşımın daha kolay olacağını tarif etmişlerdir.
KAYNAKLAR
1. Shields TW. Thymic tumors in Shields TW, Locicero J, Ponn RB. General
Thoraeic Surgery 6th edition. Philadelphia: Lippincott Wılliams & Wilkins,
2005: 2581-2616
2. Kaynak K. Mediastenin Primer Tümörleri Göğüs Cerrahisi Cilt II Ed: Ökten İ,
Güngör A, Sim Matbaacılık, Ankara Bölüm 72 2003:1173-1182
3. Demirkaya A, Tüzün H. Timus Tümörleri ve Cerrahi Tedavisi. Türkiye Klinikleri
J Surg Med Sci 2006 2(45):11-7
4. Wright C.D. tumors of the mediastinum In Pearson G.F., Cooper J.D.,
Deslauriers J.D. eds Thoracic Surgery 2nd edition Churchill-Livingstone Ch:
63, 2002;
5. Tunçözgün B, Elbeyli L, Timusun Cerrahi Hastalıkları ve Mıyastenia Gravis
Göğüs Cerrahisi Cilt II Ed: Ökten İ, Güngör A, Sim Matbaacılık, Ankara Bölüm
73 2003:1183-1192
6. Stephen R. Hazelrigg, MD, Thoracoscopic or Video-Assisted (VATS)
Thymectomy Thoracic and Cardiovascular Surgery, Vol 9, No 2 , 2004:184192
7. Frank C. D, Alden M. P,
Thymic Tumors, (Review)- Ann Thorac Surg
2004;77:1860 –9
8. Quintessa M, Michael J,Jerry Pratt, Surgical Treatment of Thymoma Current
Surgery, Volume 59 Number 1 January/February 2002:101-105
9. Federico R, Giuseppe M, Rodolfo G, et all Long-term survival and prognostic
factors in thymic epithelial tumours European Journal of Cardio-thoracic
Surgery 26 (2004) 412–418
578
10. Allen M.S. Cysts and duplications in adults In Pearson G.F., Cooper J.D.,
Deslauriers J.D. eds Thoracic Surgery 2nd edition Churchill-Livingstone Ch:
62, 2002; 1645-1654
11. Elia S, Cecera C, Giampeglia P et al Mediastinoscopy vs anterior
mediastinotomy in the diagnosis of mediastinal lymphoma: a randomized trial
Eur J Cardio-thorac Surg 6:1992;361-365
12. Wright C.D. Germ cell tumors of the mediastinum In Pearson G.F, Cooper J.D,
Deslauriers J.D. eds Thoracic Surgery 2nd edition Churchill-Livingstone Ch:
63, 2002; 1714-1719
13. Shin-ichi Takeda, Shinichiro Miyoshi, Mitsunori Ohta, et al Primary germ cell
tumors in the mediastinum A 50-year experience at a single Japanese
institution Cancer 97: 2003; 367-376
14. Kahraman C. Mediastinum ve mediastinal kistler Göğüs Cerrahisi Ed: Yuksel
M, Kalaycı G, Nobel Tıp Kitapevi, İstanbul Bölüm 43 2002:603-615
15. Shamberger R.C., Hendren III W.H. Cysts and duplications in infants and
children In Pearson G.F., Cooper J.D., Deslauriers J.D. eds Thoracic Surgery
2nd edition Churchill-Livingstone Ch 62, 2002; 1636-1645
16. Shilds T.W. Mesothelial and other less common cysts of the mediastinum In
Shilds T.W., Lo CiceroIII J., Ronald B eds General Thoracic Surgery 6th
edition.Lippincott Williams & Wilkins Ch 190, 2005; 2852-2867
17. Demirkaya A, Kaynak K. Mediastinal Kistler. Türkiye Klinikleri J Surg Med Sci
2006 2(45):23-6
18. Jocelyne M, Jean D and Andre C.H, Foregut Cyst of the Mediastinum In Shilds
T.W., Lo CiceroIII J., Ronald B eds General Thoracic Surgery 6th
edition.Lippincott Williams & Wilkins Ch 195, 2005; 2830-2842
19. Topal U Bronkojenik kist: radyolojik görünümler Tanısal ve Girişimsel
Radyoloji 2003; 9:333-338
20. Emmanuel Martinod, Francois Pons, Jacques Azorin et all, Thoracoscopic
Excision of Mediastinal Bronchogenic Cysts: Results in 20 Cases Ann Thorac
Surg. 2000; 69:1525–1528
21. Shamberger R.C., Hendren III W.H. Cysts and duplications in infants and
children In Pearson G.F., Cooper J.D., Deslauriers J.D. eds Thoracic Surgery
2nd edition Churchill-Livingstone Ch 62, 2002; 1636-1645
579
22. Allen M.S. Cysts and duplications in adults In Pearson G.F., Cooper J.D.,
Deslauriers J.D. eds Thoracic Surgery 2nd edition Churchill-Livingstone Ch:
62, 2002; 1645-1654
23. Robert J.T, Frederick J.R and Jay L.G, Gastroenteric Cyst and Neurenteric
Cyst in Infants and Chidren In Shilds T.W., Lo CiceroIII J., Ronald B eds
General Thoracic Surgery 6th edition.Lippincott Williams & Wilkins Ch 196,
2005; 2843-2851
24. By Blakeslee E. Noyes, Thomas Weber, and Carole Vogler, Pericardial Cysts
in Children: Surgical or Conservative Approach? J Pediatr Surg 2003;
38:1263-1265
25. Bousamra M.
Neurogenic tumors of the mediastinum In Pearson G.F.,
Cooper J.D., Deslauriers J.D. eds Thoracic Surgery 2nd edition ChurchillLivingstone, 2002; 1732-1738
26. Beşirli K, Demir A. Mediastinal Tümörlere Video-Yardımlı Torakoskopik
Yaklaşım. Türkiye Klinikleri J Surg Med Sci 2006 2(45):56-9
580
46.
Yrd. Doç. Dr. Özkan Saydam
Zonguldak Karaelmas Üniversitesi Tıp Fakültesi Göğüs Cerrahisi Anabilim Dalı
TORASİK ÇIKIŞ SENDROMU
Torasik Çıkış Sendromu (TÇS), toraks üst çıkışında subklaviyan arter, ven ve
brakiyal pleksusa bası sonucu ortaya çıkan klinik tabloyu tanımlamaktadır. Hangi
yapıların bası altında kaldığına bağlı olarak, semptomlar nörolojik, vasküler veya her
ikisi birlikte olabilir. Hastalığı teşhis etmek için belirleyici tanı metodlarının kısıtlı
olması, cerrahi tedavi sonrası komplikasyon ve nüks oranlarının yüksek olması,
hastalığın teşhis ve tedavisini güçleştiren unsurlardır.
Anatomi
Toraks üst çıkışında, TÇS en önemli anatomik oluşum servikoaksiller kanaldır.
Subklaviyan arter-ven ve brakiyal pleksus bu kanaldan geçerek toraksı terk eder.
Servikoaksiller kanalın; üst kenarını klavikula, alt kenarını 1.kosta, ön kenarını
klavikula ile 1.kostayı birleştiren kostaklavikular ligaman, arka kenarını ise skalen
mediyus kası oluşturmaktadır (Resim 46.1). Servikoaksiller kanal ön skalen kas ile
ön ve arka olmak üzere iki bölüme ayrılır. Ön skalen kas ile kostaklavikular ligaman
arasında kalan ön bölümde subklaviyan ven yer alırken, arka bölümde subklaviyan
arter ve brakiyal pleksus yer alır. Servikoaksiller kanalın yapısına katılan skalen
kaslar ( skalen antikus ve mediyus) ile bu kasların yapıştığı 1.kosta, üçgen şeklinde
bir alan oluşturmaktadır. Tabanını 1.kosta, kenarlarını skalen kasların oluşturduğu bu
alan aynı zamanda servikoaksiller kanalın arka bölümüdür.
Semptomlar
Nörolojik TÇS’nda en önemli semptom ağrıdır, buna parestezi ve daha az sıklıkta
motor güçsüzlükte eşlik edebilir. Ağrı boyun, omuz, kol ve eli içerebilir. Ağrı ve
parestezi hastaların
%75’inde segmentaldir ve
bunun
%90’ıda unlar sinir
dağılımındadır (1). Bazı hastalarda göğüs ön duvarını ve paraskapular sahayı tutan
atipik bir ağrı oluşabilir, bu ağrı anjina pektorisi taklit ettiği için psödoanjina adı verilir.
Normal koroner anjiografi ve azalmış ulnar sinir iletim hızı ayrıcı tanıya varmamızı
sağlar.
581
Resim 46.1: Toraks çıkışının anatomisi
Vasküler TÇS daha az sıklıkta görülür. Arteryel kompresyon olduğunda, üst
ekstremitede soğukluk, zayıflık, yaygın bir ağrı, iskemi ve bazen tek taraflı Reynaud
Fenomeni gözlenebilir. Venöz kompresyon olduğunda, üst ekstremitede ödem, venöz
distansiyon, renk değişikliği gözlenir. Primer akut subklavyen vende tromboz
gelişmesi sonucu ortaya çıkan durum Paget-Schroetter sendromu olarak adlandırılır,
bu sendromun TÇS’na bağlı olarak da ortaya çıkabileceği bildirilmiştir (2).
Fizik Muayene
Palpasyon ile derinin yapısı ve ısı farklılıkları hakkında bilgi sahibi olunur.
Supraklavikular bölgenin palpasyonu sırasında thrill duyulabilir. Supraklavikular
bölgede skalen noktanın palpasyonu sırasında, servikal kosta özellikle zayıf kişilerde
ağrılı
bir
biçimde
ele
gelebilir.
Her
iki
ekstremitenin
arter
pulsasyonları
değerlendirilmeli, karşı taraf ve kalp tepe atımı ile karşılaştırılmalıdır. Ekstremiteler
motor ve duyu muayenesiyle karşılaştırılarak değerlendirilir. İstirahat halinde
asemptomatik olan hastaların fizik muayenesinde bir takım provakatif testler yapılarak
semptomlar ortaya çıkarılabilir.
Adson Testi
Hastanın radiyal nabzı palpe edilirken, hastaya derin inspiryum yaptırılır ve baş
ekstansiyona getirilerek muayene edilen kola doğru çevrilir. Bu eylem sırasında, derin
582
inspiryum 1.kostanın klavikulaya yaklaşmasını, başın rotasyonu ise skalen kasların
gerilerek aralarındaki boşluğun daralmasına yol açar. Palpe edilen nabzın yokolması
veya zayıflaması testin pozitifliği olarak kabul edilir. Testin pozitif tahmini değeri %85
olarak bildirilmiştir.
Hiperabduksiyon Testi
Radiyal nabız palpe edilirken, kol yavaş yavaş 180 derece abduksiyona getirilir. TÇS
varlığında pektoralis minör kasının tendonu, korokoid çıkıntı ve humerus başının
etrafındaki nörovasküler yapılar üzerine bası oluşturması sonucu radiyal nabız
kaybolacaktır. Pozitif tahmini değeri %92 olarak bildirilmiştir.
Roos Testi
Omuz abduksiyonda tutularak, kol eksternal rotasyon ile 90 derece kaldırılır. Dirsek
kırılarak 3 dakika boyunca elini açıp kapatması istenir. Semptomlar tekrarlarsa test
pozitif olarak kabul edilir.
Kostaklavikular Test (Askeri Pozisyon)
Radiyal nabız palpe edilirken, hastaya derin bir inspiryum yaptırılır, baş ekstansiyona
getirilir ve omuzlar geriye doğru itilir. Bu manevrada esas faktör 1.kosta ile klavikula
arasındaki mesafenin daraltılmasıdır. Nabzın kaybolması halinde TÇS şüphesi
kuvvetlenecektir.
Etyoloji
Konjenital
TÇS’un doğumsal nedenleri arasında servikal kosta, rudimenter 1.kosta, fibrömüsküler
bantlar, skalen kas ve omohiyoid kas hipertrofileri, bifid klavikula anomalisi, 1.kostanın
eksositozu, C-7 nin uzun transvers çıkıntısı, brakiyal pleksusun posteriorda
fiksasyonu, flat klavikula, transvers servikal arterin anormal seyri gibi patolojiler
sayılabilir.
Travmatik
Klavikula fraktürü, humerus dislokasyonu, üst toraks travması, servikal spondilozis,
servikal travma, omuz ekleminin ani hareketi gibi durumlar TÇS’a yol açabilirler.
583
Ayırıcı Tanı
Ayırıcı tanıalr arasında servikal disk, osteoartrit, spinal kord tümörü, superior sulkus
tümörü, travma, arteryel anevrizma, burger hastalığı, derin ven trombozu, mediastinal
venöz tıkanmalar, anjina pektoris, karpal tünel sendromu bulunur.
Teşhis
Nörojenik TÇS:
Anamnez ve fizik muayene teşhisde önemli yer tutar. Daha sonra göğüs ve servikal
grafilerle, kemik anomalileri araştırılır.
Ulnar sinir iletim hızı (USİH) nörojenik TÇS de önemli teşhis yöntemidir. Erb
noktasından (boyun tabanında servikal vertebralarda bulunan transvers çıkıntı çevresi,
brakiyal pleksus çıkış yeri) başlayıp aksilla (toraks çıkış yeri), brakiyal bölge, bilek ve
hipotenar bölgeye elektrotlar yerleştirilir. Hem motor hem de duyu liflerinde iletim hızı
ölçümü yapılır. Ortalama unlar sinir ileti hızı toraks çıkımında 72m/saniye dir. TÇS’nda
bu hızın ortalama 53m/saniyeye (32-65 m/saniye) düştüğü gösterilmiştir (3).
Vasküler TÇS:
Arteryel kompresyon
Hastaların çoğu genç ve orta yaş grubudur. Akut iskemi kliniği ile başvururlar. İskemik
şikayetlerin zemininde proksimal arteryel tromboz, distal emboli, parmak ucunda yara
ve gangren vardır. Adson testinin poztif olması, hiperabduksiyon supra ve
infraklavikular bölgede üfürüm duyulması ve paraklavikular bölgede pulde eden kitle
varlığı ileri tetkiki gerektirir. Arteryel TÇS’nda diagnostik yöntemler; rutin servikal ve
toraks grafileri, kolun değişik seviyelerinde basınç ölçümleri ve arteriografidir (4).
Venöz Kompresyon
Genellikle 20-40 yaş grubunda sporla uğraşan veya üst ekstremite gücüyle yapılan
işlerde çalışanlarda ortaya çıkar. Üst ekstremitenin ağrı, ödem ve siyanozuyla bulgu
veren klinik tablo aksillo-subklavyan venin trombozudur. Venin kostaklavikular
boşlukta kompresyona uğramasıyla ortaya çıkar. Omuz, boyun ve göğsün ön
duvarında kollateral damarlar belirginleşir. Semptomlar kolun kullanılmaya devam
etmesiyle artar. Kola pozisyon verilerek yapılan dupleks incelemeleri ve venografilerle
teşhis konulabilir (4).
584
Tedavi
Nörojenik TÇS
Konservatif tedavi, koruyucu önlemler ve fizik tedavi uygulamalarını içerir. Koruyucu
önlemlerde hasta eğitimi önemlidir. Hastaya uygun oturma ve uyuma pozisyonları
anlatılır, kilolu ise kilo vermesi sağlanır ve çalışırken daha sık dinlenme periyotları
uygulaması önerilir. Fizik tedavi ise sıcak masaj, aktif boyun egzersizleri, skalen
antikusu germe egzersizleri ve üst trapez kası güçlendirme egzersizlerini içerir. Ancak
agresif fizik tedavi semptomların artmasına neden olabilir.
USİH 60m/saniye den fazla olan hastaların çoğunda konservatif tedavi iyileşme
sağlarken, 60m/saniye nin altında olanlarda genellikle cerrahi tedavi gerekmektedir
(5). Cerrahi tedavide 1.kosta rezeksiyonu, klavikula rezeksiyonu, skalenektomi,
servikal kosta rezeksiyonu ya da birden fazla yöntemin kombine edildiği yöntemler
çeşitli dönemlerde gündeme gelmiştir. Günümüzde nörojenik TÇS’nda kullanılan en
yaygın metodlar Transaksiller 1.Kosta Rezeksiyonu ve skalenotomidir.
Transaksiller 1.Kosta Rezeksiyonu:
1966 yılında Roos tarafından tanımlanmıştır (6). Hasta ameliyat masasına lateral
dekübit pozisyonda yatırılır. Kol omuz ve dirsekten 90 derece fleksiyonda tespit edilir.
Aksiller çukurun ön ve arka duvarını oluşturan pektoralis majör ve latismus dorsi
kaslarının lateral kenarları arasına, tüy hattının hemen altına interkostal aralığa paralel
bir cilt kesisi yapılır (Resim 46.2). Cilt altı dokusu geçilerek toraks duvarına ulaşılır.
Nervus torasikus longus sinirinin yaralanmamasına özen gösterilir ve 1.kosta periostu
ile birlikte total olarak rezeke edilir (Resim 46.3).
Resim 46.2: Aksiller çukurun ön ve arka duvarını oluşturan pektoralis majör ve latismus dorsi
kaslarının lateral kenarları arasına, tüy hattının hemen altına interkostal aralığa paralel bir cilt
kesisi yapılır.
585
Resim 46.3: Cilt altı dokusu geçilerek toraks duvarına ulaşılır. Nervus torasikus longus
sinirinin yaralanmamasına özen gösterilir ve 1.kosta periostu ile birlikte total olarak rezeke
edilir.
Vasküler TÇS
Arteryel kompresyon olan hastalarda öncelikle kompresyonun ortadan kaldırılması
gerekmektedir. Gangren veya ülser gelişen hastalarda arteryel rekontrüksiyon ve
dorsal torasik sempatektomi operasyonları gerekmektedir.
Venöz trombozda ise en uygun tedavi seçeneği trombolitik tedavi sonrasında 3 ay
antikoagülan kullanımı ve sonrasında transaksiller 1.kosta rezeksiyonudur (7).
Sonuçlar
Birinci kosta rezeksiyonu uygulanan seçilmiş hastalarda %85 oranında iyi sonuç
bildirilmiştir (1). Sadece skalenotomi uygulanan hastaların erken dönem sonuçları
kosta rezeksiyonuna yakınken uzun dönemde bu hastaların %65’inde nüks olduğu
gösterilmiştir.
Rekürren TÇS
Opere olan hastaların %1,6’sında nüks gözlenmiştir (8). Semptomlar 1 ay ila 10 yıl
arasında ortaya çıkabilir, ancak genellikle ilk 3 ay içerisinde gözlenir. Psödonüks olan
hastalarda gereksiz ya da yetersiz operasyon söz konusudur, bu hastaların şikayetleri
operasyon sonrası hiç değişmemiştir. Bu hasta grubunda; 1.kosta yerine yanlışlıkla
2.kosta çıkarılmış olabilir, servikal kosta bırakılarak 1.kosta çıkarılmış olabilir, anormal
1.kosta bırakılarak servikal kosta çıkarılmış olabilir veya rudimenter 1.kosta bırakılarak
2.kosta çıkarılmış olabilir.
Gerçek nüks olan hastaların şikayetleri ise operasyonda sonra geçmiştir ancak aşırı
skar dokusu oluşumuna bağlı olarak semptomlar tekrarlayabilir.
586
Reoperasyonda
posterior paraskapular insizyonla torakoplasti yaklaşımı tercih edilir. Kemik kalıntıları
rezeke edilir, brakiyal pleksus ve sinir köklerine nöroliz yapılır ve dorsal sempatektomi
gerçekleştirilir (9).
KAYNAKLAR
1. Urschel HC Jr, Razzuk MA. Current concepts: management of the thoracic outlet
syndrome. N Eng J Med. 1972; 286: 1140
2. Paget J. Clinical Lectures and Essays. London. Longmans Gren. 1875
3. Urschel HC Jr, et al. Objective diagnosis (unlar nevre conduction velocity) and
current therapy of the thoracic outlet syndrome. Ann Thorac Surg.1971; 12: 608
4. Toker A, Kalaycı G. Torasik çıkış sendromu. Göğüs Cerrahisi. İstanbul; 2001: 541
5. Urschel HC Jr. Thoracic outlet syndrome: Shields TW, Locicero J, Ponn RB.
General Thoracic Surgery 6th edition. Philadelphia: Lippincott Williams & Wilkins;
2005: 693.
6. Roos DB. Transaxillary approach for first rib resection to relieve thoracic outlet
syndrome. Ann Surg. 1966; 163: 354
7. Urschel HC Jr, Razzuk MA. Paget Schroetter Syndrome: What is the best
management?. Ann Thorac Surg.2000;69:1663.
8. Urschel HC Jr, Razzuk MA. The failed operation for thoracic outlet syndrome: the
difficulty of diagnosis and management. Ann Thorac Surg. 1986; 42: 523
9. Urschel HC Jr, et al. Reoperation for recurrent thoracic outlet syndrome. Ann
Thorac Surg. 1976; 21: 19
587
47.
Prof. Dr. Turgut Işıtmangil
GATA Göğüs Cerrahisi Anabilim Dalı
HİPERHİDROZ
Hiperhidroz, sıcak veya emosyonel uyaranlara bir cevap olarak fizyolojik ihtiyacın ötesinde
olan aşırı terlemedir. Normalde vücut ısısı arttığında ter bezleri uyarılır ve ter bezlerinden
buharlaşma yoluyla cilt üzerinde serinletici etkisi bulunan sıvı birikir. Ancak hiperhidrozlu
kişiler normal sıcaklıktaki havalarda ve hatta klimalı ortamlarda dahi terleyebilir ve ciddi
psikolojik, sosyal ve mesleki sıkıntılar yaşayabilir (1).
Aşırı terleme ilk olarak 1911 yılında Meachen tarafından el ayaları,aksilla ve ayaklarda tarif
edildi ve tedavisi için topikal ajanlar, ağızdan verilen ilaçlar ve x-ışını tedavisi kullandı.
Primer hiperhidroz tedavisi için ilk sempatektomi operasyonu ise 1934 yılında Leriche
tarafından gerçekleştirildi (1). Kux 1951 yılında ilk endoskopik sempatik ablasyonu
gerçekleştirdi ve 1978 yılında palmar ve aksiller hiperhidroz nedeniyle torasik endoskopik
sempatektomi yaptığı 55 hastayı yayınladı (2). Modern optik ve video teknolojilerinin
gelişmesi ile birlikte 1990 yılından itibaren video yardımlı toraks cerrahisi (VATS) açık
cerrahi yöntemlerin yerini almaya başladı.
Hiperhidroz nadir görülen bir hastalık değildir. İsrail, Amerika Birleşik Devletleri ve Çin’de
yapılan araştırmalarda hiperhidrozun toplum içerisinde görülme sıklığının %0,6 ila %4,6
arasında olduğu belirtilmektedir. Bu nedenle hiperhidrozun toplumun % 2-4’ünü etkilediği
öngörülmektedir (1)
Hiperhidroz anatomik dağılım olarak bölgesel ve yaygın olmak üzere 2 ana grupta
değerlendirilmektedir (Tablo 47.1) (3). Bölgesel hiperhidrozun en sık rastlanan alt grubu olan
primer (idyopatik) hiperhidroz; koltukaltları, avuç içleri, ayak tabanları, kraniofasyal bölge ve
diğer spesifik alanlarda bölgesel dağılım gösterir. Sebebi bilinmeyen bu hastalıkta altta yatan
başka bir hastalık bulunmaz. Primer hiperhidroz erken çocukluk döneminde başlama
eğilimindedir, pubertede şiddeti artar ve ileri yaşlarda ise sıklığı azalır (1,3). Hastalar sıklıkla
18 ila 25 yaş aralığındadır. Öğrenci olan hastalar ıslak el ile tutulan ödevlerinin lekelendiğini
ve boyasının aktığını belirtir, bilgisayar klavyesinde ve piyano tuşlarında ter birikmesinden
yakınırlar. Hiperhidroz yaz aylarında genellikle daha şiddetlenir. Kuru bir el stres etkisiyle
dakikalar içerisinde sırılsıklam olabilir. Ellerden akan ter sıklıkla zemine damlar (4).
Genellikle geceleri bir sorun oluşturmaz. Hem erkeklerde hem de kadınlarda görülebilir ve
588
olguların % 25-50’sinde pozitif aile hikâyesi bulunmaktadır. Higashimoto ve ark. (2006) 14.
kromozom ile ilgili bir genetik geçişin bulunduğunu öne sürmüşlerdir. Sekonder hiperhidrozlu
hastalarda altta yatan bir hastalık mevcut olup, bu hastalığa sekonder olarak aşırı terleme
oluşur. Sekonder hiperhidrozlularda genellikle yaygın bir terleme mevcuttur.(1,3)
Sekonder hiperhidrozlu hastalarda tedavi altta yatan hastalığın iyileştirilmesine yönelik
olduğu için, bu bölümde primer hiperhidrozun klinik bulguları ve tedavi yaklaşımları
incelenecektir.
Tablo 47.1: Hiperhidroz etyolojisinin sınıflandırması
A. Bölgesel Hiperhidroz
1. Primer İdyopatik Hiperhidroz
a. Aksiller hiperhidroz
b. Palmar hiperhidroz
c. Plantar hiperhidroz
d. Fasyal hiperhidroz.
2. Gustatuar terleme
3. Nörolojik bölgesel terleme
a. Nöropatiler
b. Spinal
hastalığa/yaralanmaya sekonder
B.Yaygın Hiperhidroz
1. Nörolojik bozukluklar
a. Parkinson hastalığı
b. Spinal kord yaralanması
c. Serebrovasküler kazalar
2. Endokrin bozukluklar
a. Hipertiroidi
b. Hiperpituitarizm
c. Diabetes mellitus
d. Hamilelik
e. Feokromasitoma
g. Karsinoid sendrom
h. Akromegali
3. Enfeksiyöz hastalıklar
4. Kardiyovasküler hastalıklar
a. Şok
b. Kalp yetmezliği
5. Solunum yetmezliği
6. İlaçlar
a. Antidepresanlar
b. Antiemetikler
7. Toksik nedenler
a. Alkolizm
b. Madde bağımlılığı
8. Malign hastalıklar
a. Myeloproliferatif
bozukluklar
b. Hodgkin hastalığı
589
Anatomi
İnsan vücudunda 1,5 ila 4 milyon arasında apokrin ve ekrin ter bezleri mevcut olup, bunların
çoğunluğunu ekrin bezler oluşturur. Ter bezlerinin sayısı sırtta cm2’de 64 ve alında cm2’de
180 iken, avuç içlerinde daha yoğun olarak (cm2’de 700 bez) bulunur. En yoğun olarak avuç
içinde ve ayak tabanında bulunan ekrin ter bezleri asetilkolin nörotransmitterinin kontrolü
altında olup, atropin ve benzer ilaçlar ile inhibe olur. Ekrin ter bezlerinin normal şartlarda
toplam ter salgısı 0,5–1 mL/dakika olup, aşırı sıcak ortamlarda günde 10 litreye kadar
çıkabilir. Apokrin bezler ise koltukaltı ile ürogenital bölgede lokalizedir. Adrenerjik sinir
liflerinin kontrolü altında olan apokrin bezler pubertede aktifleşir. Apokrin bezlerden kıl
foliküllerinin içerisine salgılanan ter yapışkan ve kokuludur. Apokrin bezlerin hiperhidroz
oluşumu üzerine etkisi çok azdır. Yakın zamanlarda tarif edilen üçüncü bir ter bezi olan
apoekrin bezler yalnızca yetişkinlerin koltukaltında bulunur. Apoekrin bezler, ekrin bezler
gibi seröz sıvı (ter) salgılarlar ve asetilkolin kontrolündedirler. Apoekrin bezler aksiller
hiperhidroz oluşumunda önemli bir etkiye sahiptir (1).
Otonom sinir sisteminin bir parçası olan sempatik sinir sisteminde efferent sempatik lifler
santral sinir sisteminden ayrılır ve sempatik ganglionlarda sonlanır.
Spinal kordun gri
maddesindeki anterior kolonun dorsolateral bölgesinden çıkan torakolomber sempatik lifler
(preganglioner lifler) beyaz rami kominikanteslere dahil olarak sempatik turunkustaki kendi
ganglionlarına giderler. Sempatik trunkuslar vertebranın her iki yanında kafatasından
koksikse kadar uzanırlar. Sempatik trunkusun torasik kısmı 12 ganglion içerir. Preganglioner
ve postganglioner nöronlar arasındaki transmitter, parasempatik sinir sistemindeki gibi
asetilkolindir. Sempatik trunkustaki ganglionlardan çıkan postganglioner (afferent) lifler gri
rami kominikantesler yoluyla hedef organa giderek kütanöz dallarını verirler. Sempatik sinir
sisteminde postganglioner sinir ucu ile uç organ effektör hücreleri arasındaki sempatik sinir
sistemi nörotransmitter norepinefrin olup, bunun tek istisnası postganglioner lifler ile ter
bezleri arasında asetilkolin’in nörotransmitter olmasıdır.(1,3)
Fizyopatoloji
Primer bölgesel hiperhidrozun fizyopatolojisi tam olarak bilinmemektedir. Hiperhidrozlu
hastalarda hem sempatik zincir ve hem de ekrin bezler histolojik olarak normaldir. Normal
kişilerle karşılaştırıldığında, hiperhidrozlu hastalarda mental uyarılardan sonra sempatik sinir
aktivitesinin artmasının yanı sıra sempatik sudomotor cilt cevabında da artış mevcuttur.
Emosyonel terleme uykuda ve sedasyon halinde meydana gelmez (3).
590
Tanı Ve Hasta Seçimi
Aşırı terlemeyi tanımlayabilmek için öncelikle normal terlemenin ne olduğunu bilmeliyiz.
Normal ölçülerdeki terleme miktarı, dakikada 1 mL/m2’den daha az miktarda salgılanan ter
olarak tanımlanmaktadır. Ciddi hiperhidrozlu hastalarda ise bir dakikadaki ter miktarı 40
mL/m2’yi aşmaktadır. Bir koltukaltındaki terlemenin 5 dakika içerisinde 100 mg’dan fazla
olması veya 1 dakika içerisinde 50 mg’dan fazla olması aksiller hiperhidroz için eşik değer
olarak tanımlanmıştır (3).
Strutton ve arkadaşları (2004) tarafından aksiller hiperhidrozlu hastalarda kullanılmak üzere 4
basamaklı bir skala geliştirilmiştir. Tablo 47.2 olarak verilen bu skala ile hiperhidrozun
hastalar tarafından tolere edilebilmesi ve günlük yaşantılarını olumsuz yönde etkilemesi
kriterlerine göre aksiller hiperhidroz derecelendirilmesi yapılmaktadır (3,5).
Tablo 47.2: Hiperhidroz hastalık skalası olarak adlandırılan bu yöntemde hastalara
terlemeyi ne kadar tolere edebildiği ve günlük yaşantıyı etkileme derecesi sorulmakta, alınan
cevaba göre hiperhidroz ciddiyeti sınıflanmaktadır.
No.
Hiperhidroz Derecesi
1 (Hafif)
2 (Orta)
3 (Ciddi)
4 (Ciddi)
Terleme bariz değil, günlük yaşantıyı hiç etkilemiyor
Terleme tolere edilebilir, günlük yaşantıyı bazen etkiliyor
Terleme kısmen tolere edilebilir, günlük yaşantıyı sıklıkla etkiliyor
Terleme tolere edilemez, günlük yaşantıyı daima etkiliyor
Aşırı terleme ile gelen bir hastanın ayrıntılı olarak anamnezi alınmalı, fiziksel muayenesi
yapılmalıdır. Hastalığın başlangıcı ve özellikleri araştırılmalı, özgeçmişi ve soygeçmişi
incelenmeli, hastada var olan diğer yakınmalar ile hastalıklar kayıt altına alınmalıdır.
Hiperhidrozun özellikleri olarak aşırı terlemenin olduğu bölgeler, süresi, sıklığı, miktarı,
tetikleyen faktörler ve geceleri olan yakınmalar araştırılmalıdır. Doğru alınan bir anamnez ile
hekim primer bölgesel hiperhidroz ile sekonder yaygın hiperhidroz ayırımını büyük oranda
yapabilir. Bölgesel hiperhidroz için “Multi-Speciality Working Group on Hyperhidrosis”
tarafından tanı kriterleri oluşturulmuştur (Tablo 47.3) (3).
591
Tablo 47.3: Primer bölgesel hiperhidrozda tanı kriterleri
Primer Bölgesel Hiperhidroz Tanı Kriterleri
1. Sekonder bir sebep olmaksızın en az 6 aydır mevcut olan
bölgesel, gözle görülebilen aşırı terleme.
2. Aşağıdaki özelliklerin en az ikisinin varlığı:
a. Bilateral ve nispeten simetrik terleme
b. Haftada en az bir defa terleme sıklığı
c. Terleme nedeniyle günlük aktivitelerin bozulması
d. Başlangıç yaşı <25 yaş
e. Pozitif aile hikayesi
f. Terlemenin uyku esnasında kaybolması
Laboratuar Tetkikleri
Sekonder hiperhidrozu ekarte edebilmek için, hiperhidrozlu hastada mevcut olan veya
şüphelenilen hastalıklar ile ilgili laboratuar tetkikler yapılmalıdır. Primer hiperhidrozlu
hastalarda salgılanan ter miktarını ölçebilmek için gravimetrik test, minör nişasta-iyot testi ve
ninhydrin testi olmak üzere 3 farklı yöntem önerilmektedir (3).
Gravimetrik test yönteminde hastalar 21–25 °C sıcaklıktaki bir odada en az 15 dakika istirahat
ettirilir. Önceden tartılmış olan filtre kağıtları terleyen bölgeye 60 saniye temas ettirilir ve
sonra tekrar tartılarak 1 dakikalık ter üretimi miligram cinsinden ölçülür. Bu yöntemle palmar
hiperhidroz için ter miktarının dakikada 30–40 mg’dan fazla olması gereklidir. Aksiller
hiperhidroz için ter miktarının 5 dakikada erkeklerde 100 mg’dan, kadınlarda 50 mg’dan fazla
olması
gereklidir.
Rutin
klinik
uygulamada
pratik
olmayan
bu
yöntem
pek
kullanılmamaktadır.(3)
Minör nişasta iyot testinde terleme miktarının ölçülmesinin yanı sıra tedavi amaçlı botulinum
toksin enjeksiyonu öncesinde bölgesel terleme haritasını da gösterir. Temizlenen ve kurutulan
bölgeye % 1–5 iyot içeren alkol solüsyonu uygulanır. Bölge hava ile kuruduktan birkaç saniye
sonra az miktarda mısır nişastası serpiştirilir. Ter varlığında iyot ile nişasta reaksiyona girer
ve küçük mor renkli noktalar oluşur (3).
Ninhydrin testi ise terdeki amino asitler ile ninhydrin reaksiyonu prensibine dayalıdır. Bu
reaksiyon sonucu kağıt üzerinde oluşan görüntünün dijital analizi ile terleme miktarı bulunur.
(3)
592
Primer Hiperhidroz Tedavisi
Primer hiperhidroz tedavisi cerrahi dışı tedaviler ve cerrahi tedavi olarak 2 ana başlıkta
değerlendirilmektedir.
1. Cerrahi Dışı Tedaviler
a. Topikal tedavi
Hiperhidroz tedavisinde kullanılan topikal ajanlar,