Ratlarda Osteomyelit Modeli
ne
ci
of Clinic
M
ical edi
al
and Anal
yt
al
· Jour
n
Ömer Erşen, Serkan Bilgiç
Modern travma ve ortopedik cerrahide en ciddi problemlerden
biri de osteomyelittir. Osteomyelitin tedavisi kompleks ve
zor bir süreçtir ve multidisipliner çalışmayı gerektirir [1].
Staphylococcus aureus en sık hastane enfeksiyonu oluşturan
patojendir ve osteomyelitin en sık sebebidir. Bununla birlikte
implantla ilişkili enfeksiyonlarda ve protez eklemlerde
S. aureus, Staphylococcus epidermidis ile birlikte en sık
görülen etkendir. Bu bakteriler bakteriyel tutunmayı ve
biyofilm oluşmasına mediatörlük eden ekzopolisakkaritler
sentezler [2,3].
Osteomyelit modeli için kullanılan rat modeli birkaç basamak
başarısızlığın sonucunda tam olarak sağlanabilmiştir. S.
aureus enfeksiyon modeli [4] geliştirildikten sonra model
önce tavşanlarda ve daha sonra ratlarda oluşturuldu [5,6].
Bu modellerde enfeksiyon sistemik inokülasyon yoluyla veya
bakterinin solüsyon içinde ve/veya biyofilm içinde direk
sahaya inkülasyonu ile sağlanmaya çalışılıyordu [7, 8, 9,
10]. Bu modellerdeki genel problem osteomyelit oluşturma
başarısının beklenenden daha az olması ve bunun sonucunda
karşılaştırmalı çalışmalar için modelin yetersiz kalmasıydı.
Bazı modellerde enfeksiyonu tetiklemek için sklerozan ajan
kullanılması gündeme gelmesine rağmen bu model de doğal
osteomyelit sürecinin bir benzeri olmamaktaydı [11]. En
sonunda bütün bu modellerin karışımı olan bir enfeksiyon
modeli yüksek enfeksiyon oranı ile ortaya konuldu [9].
Osteomyelit modeli için kullanılan mikroorganizma yüksek
tutunma sağlayan yapışkan üreten S. aureus kolonisidir. Bu
koloniler yapışkan oluşturmayan kolonilerden laboratuar
ortamında oluşturulmaktadır. Yapışkan oluşturan ve
oluşturmayan koloniler Kongo kırmızısı agarda oluşturdukları
kolonilerin şekillerine göre birbirinden ayrılır. yapışkan
S.aureus kolonileri pürüzlü olurken diğerleri pürüzsüzdür.
Yapışkan olan koloniler doğal olmayan yüzeylere daha iyi
tutunurlar.
Ribotipleme, süspansiyondaki bakterinin antibiyotik
duyarlılığı ve Kongo kırmızısı agarda koloni morfolojisi
belirlenerek çalışma sonunda dokulardan ve kullanılan
implanttan elde edilecek enfeksiyon ajanıyla karşılaştırılması
yapılmalıdır.
Biyofilmler 1,5cm uzunluğundaki paslanmaz çelik parçalar
üzerinde oluşturulur. İmplantlar otoklav ile sterilize edildikten
sonra içinde 2 ml büyüme solüsyonu ve 50 µL bakteriyel
kültür ilave edilmiş tüplere konulur. Metal parçalar 37° de
12 saat tutularak üzerlerinde biyofilm oluşması sağlanır.
Biyofilmler steril cımbız kullanılarak metal üzerinden
ayrılır. tutunmamış bakterileri elimine etmek için parçalar
fosfat tamponlu salin (FTS) ile 3 kez yıkanır ve cerrahi
öncesi bakteri sayısının artmaması için 4°’de 1 saatten
fazla tutulmaz. İn vivo enfeksiyondan önce implantasyon
için kullanılmayan 6 kontrol parçasında biyofilm oluşturan
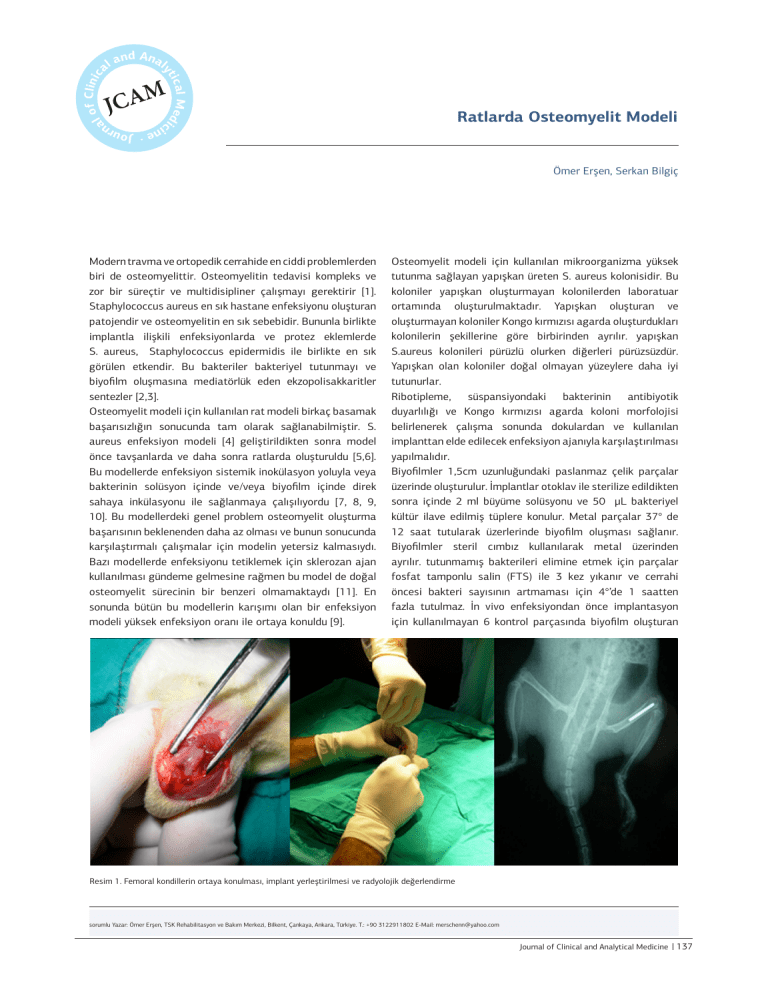
Resim 1. Femoral kondillerin ortaya konulması, implant yerleştirilmesi ve radyolojik değerlendirme
sorumlu Yazar: Ömer Erşen, TSK Rehabilitasyon ve Bakım Merkezi, Bilkent, Çankaya, Ankara, Türkiye. T.: +90 3122911802 E-Mail: [email protected]
Journal
of Clinical
and Analytical
Medicine
| 1 137
Journal
of Clinical
and Analytical
Medicine
Ratlarda Osteomyelit Modeli
Ratlarda Osteomyelit Modeli
bakteri sayısı belirlenmelidir. Bunun için implantlar 2ml fosfat
tamponlu salinde bekletilir. Bakteri kümelerini ve implanta bağlı
bakterileri ayırmak için 40 Hz’de 30 dakika sonikasyondan sonra
tripton soya agarda bakterilerin sayımı yapılabilir.
Bakterilerin inokülasyonu için bakteri kolonileri büyümeye
bırakılır. Solüsyon içindeki konsantrasyon spektofotometri ile
tespit edilir ve kullanılacak modele göre inoküle edilecek bakteri
miktarı ayarlanır.
Cerrahi işlem. Diz kapağı çevresi traş edildikten ve dezenfekte
edildikten sonra artiküler fasianın arka tarafına doğru insizyon
yapılır. Eklem kapsülü açılarak distal femur ve proksimal tibia
yüzeylerine ulaşılır. 18 G iğne ile femur distalden proksimale
doğru oyulur. Üzerinde biyofilm oluşturulmuş metalik implant
oluşturulan boşluğa yerleştirilir. Gerekli olursa bakteriyel
süspansiyonla da inokülasyon yapılabilir. Daha sonra yara
kapatıldıktan sonra cilt dezenfektanla temizlenir. Aynı işlem için
tibia da kullanılabilir.
Çalışmanın sonunda enfeksiyon radyolojik olarak, bakteriyel
analizlerde ve histolojik olarak (doku kesitlerinde 4 µm
kalınlığında) tespit edilmelidir. Histolojik incelemeden önce
örnekler 26 gün EDTA-PVP içerisinde tutularak dekalsifiye
olması sağlanır. Örnekler yıkandıktan sonra dehidrate olması
için değişik konsantrasyonlardaki alkol ve ksilol ile muamele
edildir (%70- %80- %96- %100- %100). Daha sonra örnekler
parafine yerleştirilir. Bakteriyel analizler çalışmanın sonunda
cerrahiden 9 hafta sonra yapılır. İmplant olan kemik ve karşı
ekstremitedeki aynı kemik incelenerek enfeksiyonun sistemik
olarak karşı ekstremiteye de yayılıp yayılmadığı kontrol edilir.
Ayrıca deneklerden karaciğer ve dalak örnekleri ve tam kan alınır.
Yaşayan bakteri sayımı için canlı bakteri sayısını etkilemeyen bir
yöntem olarak 22-24° de 40Hz ile 230 dakika sonikasyon işlemi
uygulanır.
Transmisyon elektron mikroskopisi (TEM) ile bakteriyel
büyümenin çeşitli aşamalarında implant üzerinde oluşan
biyofilmin homojenitesi değerlendirilebilir. Aseptik şartlarda
biyofilm oluşmadan önce bakteriyel kültürün durağan büyüme
aşamasındaki yapışkan oluşturan izolattan 500 ml ve 4,5 ml
büyüme solüsyonu paslanmaz çelik yüzeye konulur. Biyofilmler
12 ila 48 saat içerisinde oluşur. TEM analizi için FTS ile 3
kez yıkandıktan sonra %0,05 rutenyum kırmızısı içeren 0,1M
sodyum kakodilat tamponu içinde (pH 7) %5’lik gluteraldehitin
2,5 ml si ilave edilir. 22- 24 ° de 2 saat bekletildikten sonra
örnekler birkaç kez daha FTS ile yıkanır ve dehidrate olmaları
için birbirini takip eden %50, %70, %80 ve %100’lük etanolle
her biri en az 10 dakika olacak şekilde muamele edilir. Biyofilmi
ayırmak için %100 etanol eklenir ve 3X3 mm² parçalara ayrılır.
Etanol uzaklaştırılıp propilen oksit eklenir ve hafifçe çalkalanır.
Kare şeklindeki örnekler hacim olarak 1: 1 oranındaki propilen
oksit ve reçine karışımında 22- 24° de 12 saat bekletilir. Daha
sonra örnekler %100 reçineye alınır. 22-24° de 2-3 gün kaldıktan
sonra örnekler 16 saat boyunca 70 ° de yeni yapılmış reçinede
bekletilir ve son olarak TEM için hazır hale gelir.
63. günde histolojik çalışmalarla birlikte Scaning elektron
mikroskopisi (SEM) rat kemiğindeki ve çevre dokulardaki
enfeksiyonun tespiti yapılır. %4 gluteraldehitle 17 gün boyunca
tespit edilen örneğe daha sonra osmiyum tetroksitle çözülür ve
138 Journal of Clinical and Analytical Medicine
2 | Journal of Clinical and Analytical Medicine
liyofilizasyon altın uygulaması ile kurutulur.
İn vitro kolonize edilmiş implantların in vivo yerleştirilmesi ile
konakta bakteri varlığının sağlanması ve fagositler tarafından
elimine edilmemesi sağlanır. Böylece deneklerde enfeksiyonun
başlangıcında hücre sayısı olarak ve biyofilm büyüklüğü olarak
homojenite sağlanır. Bu homojenite TEM ile gösterilebilir.
Bu homojenite antimikrobiyal ajanların karşılaştırılması gibi
çalışmalarda biyofilmlerin tekrarlana uygulamalarında faydalı
olmaktadır.
Deneysel bir osteomyelit modeli uzun süren bir enfeksiyon
oluşturmanın yanı sıra deneklerde yüksek oranda enfeksiyon
oluşturabilmelidir. Ayrıca mortalite oranı da düşük olmalıdır.
Kaynaklar
1. Tiemann AH, Hofmann GO. Principles of the therapy of bone infections in
adult extremities: Are there any new develop-ments? Strat Traum Limb Recon
2009;4:57.
2. Fritz JM, McDonald JR. Osteomyelitis: Approach to diagnosis and treatment.
Phys Sportsmed 2008;36:116823.
3. Oğuz E, Ekinci Ş, Eroğlu M, Bilgic S, Koca K, et al. Evaluation and Comparison of
the Effects of Hyperbaric Oxygen and Ozonized Oxygen as Adjuvant Treatments
in an Experimental Osteomyelitis Model. Journal of Surgical Research 2011: 171,
e61–e68.
4. Rodet A. The classic. An experimental study on infectious osteomyelitis. Clin
Orthop 1973; 96: 3-4.
5. Andriole V, Nagel D A, Southwick W O. Chronic staphylo-coccal osteomyelitis:
an experimental model. Yale J Biol Med 1974; 1: 33-9.
6. Power M E, Olson M E, Domingue P A G, Costerton J W. A rat model of
Staphylococcus aureus chronic osteomyeli -tis that provides a suitable system
for studying the human infection. J Med Microbiol 1990; 33: 189-98.
7. Lasierra J M, Aznar J M, Albareda J, Palanca D, Remartínez J M, Marín J, Seral
F. Modelo de osteomielitis experi-mental con tallo metálico intramedular. Rev
Ortop Traum
1994; 38 IB: 437-45.
8. Lambe D W, Ferguson K P, Mayberry-Carson K J, Tober-Meyer B, Costerton
J W. Foreign body-associated exper-imental osteomyelitis induced with
Bacteroides fragilis
and Staphyloccus epidermidis in rabbits. Clin Orthop 1991; 266: 285-94
9. Gracia E, Laclériga A, Monzón M, Leiva J, Oteiza C, Amorena B. Application
of a rat osteomyelitis model to compare in vivo and in vitro antibiotic
efcacy against
bacteria with high capacity to form bio lms. J Surg Res 1998; 79: 146-53.
10. Ward K H, Olson M E, Lam K, Costerton J W. Mechanism of persistent infection
associated with peritoneal implants. J Med Microbiol 1992; 36: 406-13.
11. Kaarsemaker S, Walenkamp G, Vanderbogaard A E J. New model for chronic
osteomyelitis with Staphylococcus aureus in sheep. Clin Orthop Rel Res 1997;
339: 246-52.