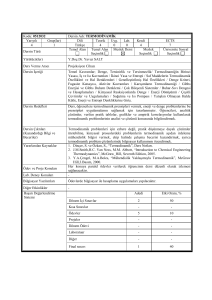
Termodinamik
Slide 1 of 37
İçindekiler
1
2
3
4
5
6
7
İstemlilik: Kendiliğinden Olan Değişmenin
Anlamı
Entropi Kavramı
Entropi ve Entropi Değişiminin Belirlenmesi
İstemli Değişme Ölçütleri:
Termodinamiğin 2. Yasası
Standart Serbest Enerji Değişimi, ΔG°
Serbest Enerji Değişimi ve Denge
ΔG° ve K nin Sıcaklıkla Değişimi
Termodinamik
Slide 2 of 37
1. İstemlilik: Kendiliğinden Olma Eğilimi
Termodinamik
Slide 3 of 37
Kendiliğinden Olan(İstemli) İşlemler
• Kendiliğinden gerçekleşmeyen değişimlere istemsiz değişim denir.
• Kendiliğinden gerçekleşen değişimlere istemli değişim denir.
4 Fe(k) + 3 O2(g) → 2 Fe2O3(k)
H2O(k) → H2O(s)
Termodinamik
Slide 4 of 37
Kendiliğinden gerçekleşen prosesler
Kendiliğinden gerçekleşen
bir reaksiyonun tersi
istemsiz bir reaksiyondur
GERÇEKTEN DOĞRU
MU ACABA???
Termodinamik
Slide 5 of 37
Suyun Erimesi İSTEMLİ ise
Peki bunun tersi reaksiyon İSTEMSİZ MİDİR????????????
Termodinamik
Slide 6 of 37
İstemli Prosesler
• Bir sıcaklık değerinde istemli olan prosesler başka bir
sıcaklıkta istemsiz olabilir. HAYDAAA!!!!
• 0C üzerinde buzun erimesi istemli bir reaksiyondur (O
halde bunun tersi reaksiyon istemsiz olmalı)
• Ama 0 C altında suyun donması (yani yukarıdakinin zıt
reaksiyonu) da İSTEMLİ dir.
Termodinamik
Slide 7 of 37
Tersinir Prosesler
Tersinir proseste sistem
ve çevre kendi içinde
orijinal hallerine
dönebilirler.
Termodinamik
Slide 8 of 37
Tersinmez Prosesler
• Tersinmez prosesler
• İstemli reaksiyonlar tersinmezdir.
Termodinamik
Slide 9 of 37
Entropi
• Entropi (S) Rudolf Clausius tarafından 19
yüzyılda ortaya atılmıştır.
• Clausius bir reaksiyon sonucu açığa çıkan ısının
salınan sıcaklık değerine oranı dikkatini çekmişti.
q
T
Termodinamik
Slide 10 of 37
Entropi
• Entropi bir sistemin düzensizliğinin veya
gelişigüzelliğinin bir ölçümüdür.
• Entropi moleküllerdeki birçok atomal hareketlerle
ilişkisi olduğu düşünülür.
Termodinamik
Slide 11 of 37
Termodinamik
Slide 12 of 37
Entropi
• Toplam iç enerji gibi, E, entropide bir hal
fonksiyonudur.
• Bu yüzden,
S = Sfinal Sinitial
Termodinamik
Slide 13 of 37
Entropi
• İzotermal bir proseste, entropideki değişim eğer proses
tersinirse transfer edilen ısının sıcaklığa bölümüyle
bulunabilir.
qter
S =
T
Termodinamik
Slide 14 of 37
Termodinamiğin İkinci Yasası
Evrenin entropisi istemli prosesler (tersinmez) için
artarken, tersinir prosesler için evrenin entropisi
değişmez.
Termodinamik
Slide 15 of 37
Termodinamiğin ikinci yasası
Bir başka deyişle;
Tersinir bir proses için:
Suniv = Ssystem + Ssurroundings = 0
Tersinmez proses için:
Suniv = Ssystem + Ssurroundings > 0
Termodinamik
Slide 16 of 37
Termodinamiğin ikinci yasası
TÜM İSTEMLİ PROSESLER EVRENİN
ENTROPİSİNİ ARTTIRIR.
Termodinamiğin ikinci yasası
Termodinamik
Slide 17 of 37
4. İstemli Değişme Ölçütleri:
Termodinamiğin 2. Yasası
ΔStoplam = ΔSevren = ΔSsistem + ΔSçevre
Termodinamiğin 2. Yasası:
ΔSevren = ΔSsistem + ΔSçevre > 0
İstemli değişmeler için tek ölçüt olarak entropi artışını ele alırsak hemen çeşitli zorluklarla
karşılaşırız. Örneğin suyun -10 C de kendiliğinden donmasını nasıl açıklayacağız ? Çünkü
kristal buz sıvı sudan daha düzenli bir yapı arzeder. Su donunca entropi azalır. O halde bu
durumu sadece sistemin entropisine bakarak karar vermek doğru değildir. Sistem ve çevrenin
entropisini ele almamız gerekir.
Eğer bir değişme de hem sistemin hem de çevrenin entropi artışı pozitifse, değişme kesinlikle
istemlidir. Eğer iki entropi değişimi negatifse değişmenin istemsiz olduğu kesindir. Sıcaklık O
0C nin altında olduğu sürece çevrenin entropisindeki artış, sistemin entropisindeki azalıştan daha
fazla olur. Sonuçta toplam entropi pozitif olacağından olay istemlidir (yani buzun donması
istemlidir).
BÜTÜN İSTEMLİ OLAYLAR EVRENİN ENTROPİSİNDE ARTMAYA NEDEN
OLURLAR
Termodinamik
Slide 18 of 37
Moleküler Düzeyde Entropi
• Ludwig Boltzmann described the concept of entropy on the
molecular level.
• Temperature is a measure of the average kinetic energy of
the molecules in a sample.
Termodinamik
Slide 19 of 37
Entropy on the Molecular Scale
• Molecules exhibit several types of motion:
– Translational: Movement of the entire molecule from one place to another.
– Vibrational: Periodic motion of atoms within a molecule.
– Rotational: Rotation of the molecule on about an axis or rotation about
bonds.
Termodinamik
Slide 20 of 37
Entropy on the Molecular Scale
• Each thermodynamic state has a specific number of microstates, W,
associated with it.
• Entropy is
S = k lnW
where k is the Boltzmann constant, 1.38 1023 J/K.
Termodinamik
Slide 21 of 37
Entropy on the Molecular Scale
• The change in entropy for a process, then, is
S = k lnWfinal k lnWinitial
lnWfinal
S = k ln
lnWinitial
• Entropy increases with the number of
microstates in theTermodinamik
system.
Slide 22 of 37
Entropy on the Molecular Scale
• The number of microstates and, therefore, the
entropy tends to increase with increases in
– Temperature.
– Volume.
– The number of independently moving molecules.
Termodinamik
Slide 23 of 37
Entropy and Physical States
• Entropy increases with the
freedom of motion of
molecules.
• Therefore,
S(g) > S(l) > S(s)
Termodinamik
Slide 24 of 37
Solutions
Generally, when a
solid is dissolved in a
solvent, entropy
increases.
Termodinamik
Slide 25 of 37
Entropy Changes
• In general, entropy increases
when
– Gases are formed from liquids and
solids.
– Liquids or solutions are formed
from solids.
– The number of gas molecules
increases.
– The number of moles increases.
Termodinamik
Slide 26 of 37
Termodinamiğin 3.Yasası
Saf bir kristalin mutlak sıcaklıktaki entropisi
0 dır
Termodinamik
Slide 27 of 37
Standart Entropi Değerleri
• Standart hallerdeki molar
entropi değerleri.
• Standart entropi değerleri
moleküler kütle arttıkça artma
eğilimindedir.
Termodinamik
Slide 28 of 37
Standart Entropi
Daha büyük ve daha kompleks moleküller daha
yüksek entropiye sahiptirler.
Termodinamik
Slide 29 of 37
Entropi Değişimleri
S° = nS°(products) - mS°(reactants)
m ve n denkleştirilmiş reaksiyondaki katsayılardır.
Termodinamik
Slide 30 of 37
Çevredeki Entropi Değişimi
• Sisteme giren veya sistemden çıkan ısı
çevrenin entropisini değiştirir.
• İzotermal bir proses için
Sçev =
qsis
T
• Sabit basınçta q sistem H eşittir.
Termodinamik
Slide 31 of 37
Evrende Entropi Değişimleri
• Evren sistem ve çevreden oluşur.
• Bu yüzden,
Sevren = Ssistem + Sçevre
• İstemli bir reaksiyon için
Sevren > 0
Termodinamik
Slide 32 of 37
Serbest Enerji ve Serbest Enerji Değişimi
Evren için:
ΔSevren = ΔSsis + ΔSçevre > 0
ΔSçevre= - ΔHsistem/T
(bu ifadeyi üstte yerine koyup her iki tarafı T ile çarparsak;
TΔSevren = TΔSsis – ΔHsis = -(ΔHsis – TΔSsis)
-TΔSevren = ΔHsis – TΔSsis
İfadenin sol tarafı tamamen sisteme ait olup sağ tarafı ise evrenle ilgilidir, ΔSevren >0 ise olay
istemlidir.
Sistem için:
G = H - TS
ΔG = ΔH - TΔS
ΔGsis = - TΔSevren
Termodinamik
Slide 33 of 37
Gibbs Serbest Enerjisi
• TSevren Gibbs serbest enerjisi olarak ifade edilir.
G.
Sevren positifse, G negatiftir.
• Dolayısıyla G negatif olduğunda, proses
istemlidir.
Termodinamik
Slide 34 of 37
İstemli Değişme Ölçütleri
ΔGsis < 0 (negatif), süreç istemlidir.
ΔGsis = 0 (sıfır), süreç dengededir.
ΔGsis > 0 (pozitif), süreç istemli değildir.
Termodinamik
Slide 35 of 37
Standart Serbest Enerji Değişimleri
G = nGf (products) mGf (reactants)
where n and m are the stoichiometric
coefficients.
Termodinamik
Slide 36 of 37
Free Energy Changes
At temperatures other than 25°C,
G° = H TS
How does G change with temperature?
Termodinamik
Slide 37 of 37
Serbest Enerji ve Sıcaklık
• Serbest enerji eşitliğinde iki kısım vardır:
H— entalpi terimi
– TS — entropi terimi
• Serbest enerji teriminin sıcaklık bağımlılığı entropi
teriminden kaynaklanmaktadır.
Termodinamik
Slide 38 of 37
Serbest Enerji ve Sıcaklık
Termodinamik
Slide 39 of 37
Serbest Enerji ve Denge
Herhangi bir koşulda (standart veya standart
olmayan) serbest enerji aşağıdaki formülden
hesaplanabilir:
G = G + RT lnQ
(Under standard conditions, all concentrations are 1 M, so Q = 1 and lnQ
= 0; the last term drops out.)
Termodinamik
Slide 40 of 37
Serbest Enerji ve Denge
• Dengede, Q = K, and G = 0.
• Eşitlik
0 = G + RT lnK
• Eşitliğin tekrar düzenlenmesiyle
G = RT lnK
veya,
K = eG/RT
Termodinamik
Slide 41 of 37
Trouton Kuralı
Pek çok sıvının normal kaynama noktasında standart
molar buharlaşma entropisinin yaklaşık 87 Jmol-1K-1
değerine sahip olduğunu belirtir.
ΔHbuh
≈ 87 kJ mol-1 K-1
ΔS =
Tk.n
Termodinamik
Slide 42 of 37
ΔG ve Denge Sabiti K
ΔG = ΔG° + RT ln Q
Eğer tepkime dengede ise:Q=Kp ya da Q=Kc olur.
ΔG = ΔG° + RT ln K= 0
ΔG° = -RT ln K
Termodinamik
Slide 43 of 37
ΔGo , Büyüklüğü ve Anlamı
∆Go
K
Termodinamik
Anlamı
Slide 44 of 37
ΔG° ve K ‘nın Sıcaklıkla Değişimi
ΔG° = ΔH° -TΔS°
ΔG° = -RT ln K
-ΔG°
-ΔH°
TΔS°
ln K =
=
+
RT
RT
RT
-ΔH°
ΔS°
ln K=
+
RT
R
ln
K2
K1
1
-ΔH°
ΔS° -ΔH°
ΔS° -ΔH° 1
=
+
+
=
RT2
R
RT1
R
R T2 T1
Termodinamik
Slide 45 of 37
2SO2(g) + O2(g)↔2SO3(g) Tepkimesinin Değişik
Sıcaklıklardaki Denge Sabitleri, Kp
T, K
800
850
900
950
1000
1050
1100
1170
1/T, K-1
12,5 x 10-4
11,8 x 10-4
11,1 x 10-4
10,5 x 10-4
10,0 x 10-4
9,52 x 10-4
9,09 x 10-4
8,55 x 10-4
Kp
9,1 x 102
1,7 x 102
4,2 x 101
1,0 x 101
3,2 x 100
1,0 x 100
3,9 x 10-1
1,2 x 10-1
Termodinamik
ln Kp
6,81
5,14
3,74
2,30
1,16
0,00
-0,94
-2,12
Slide 46 of 37
K’nın Sıcaklığa Bağlılığı
-ΔH°
ΔS°
ln K =
+
RT
R
-ΔH°
Eğim =
R
-ΔH° = R x eğim
= -8,3145 J mol-1 K-1 x 2,2 x104 K
= -1,8 x 102 kJ mol-1
Termodinamik
Slide 47 of 37
Standart serbest enerji değişikliklerinin toplanabilme
özelliği, termodinamik olarak elverişsiz (Goı pozitif,
endergonik) bir reaksiyonun yüksek olarak ekzergonik
bir reaksiyona ortak bir ara madde vasıtasıyla bağlanarak
ileri yönde yürüyebilmesini açıklar.
Termodinamik
Slide 48 of 37
Glukoz + Pi Glukoz-6-fosfat + H2O
ATP + H2O ADP + Pi
Goı= 13, 8 kJ/mol
Goı= 30, 5 kJ/mol
Glukoz + ATP Glukoz-6-fosfat + ADP
Goı= 16, 7 kJ/mol
Toplam reaksiyon ekzergoniktir.
ATP’nin bağlarında depolanmış olan enerji, glukoz ve
fosfattan oluşumu endergonik olan Glukoz-6-fosfatın
sentezini sürdürmek için kullanılabilmektedir.
Termodinamik
Slide 49 of 37
Glukozdan glukoz-6-fosfatın oluşmasındaki gibi bir
strateji, bütün canlı hücreler tarafından, metabolik ara
ürünler ve hücresel komponentlerin sentezinde kullanılır.
Termodinamik
Slide 50 of 37
Termodinamik
Slide 51 of 37