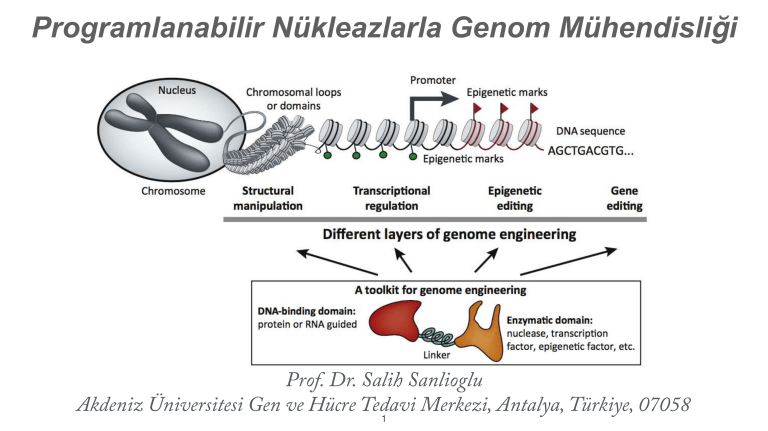
Programlanabilir Nükleazlarla Genom Mühendisliği
Prof. Dr. Salih Sanlioglu
Akdeniz Üniversitesi Gen ve Hücre Tedavi Merkezi, Antalya, Türkiye, 07058
1
Genom Modifikasyonu: Gerekçe
•
İnsan genom araştırmalarının temel amacı genlerin fonksiyonlarını ve işlevliliklerini
bütünüyle açığa çıkarmaktır. Bir insan hücresinin çekirdeğinde yaklaşık 1 metre
uzunluğunda linear bir DNA ve bunun üzerinde de 20,000’den fazla protein
kodlayan ve kodlamayan genler vardır.
•
Genetik hastalıklara karşı etkin terapötik ilaçların geliştirilmesi genlerin
fonksiyonlarının tam manasıyla anlaşılmasına bağlıdır.
•
Genetik değişiklikler ve hastalıklar arasındaki ilişki yıllardır bilinmesine rağmen bazı
hastalık fenotiplerinin ortaya çıkmasına sebebiyet veren mutasyonlar ancak
genom değişikliği yapılarak giderilebilir ve böylelikle hastalıklar tedavi edilebilir.
•
Ancak genom karmaşık bir yapıya sahip olduğundan genetik bilgiyi manipüle
etmek oldukça zordur. Bu açıdan girişimsel düzeyde genom modifikasyonu
teknolojik olarak ileri düzeyde geliştirilmiş moleküler genetik yöntemlerle
sağlanabilir.
2
Genom Modifikasyonu Başlangıç
•
1988 yılında Rudin ve Haber mayalarda çift zincirli DNA kırıkları oluşturarak (DSBs)
gen hedeflemenin (gene targeting) etkinliğinin arttırılabileceğini iddia ettiler. 1994
yılında Jasin’in araştırma grubu memeli hücrelerinde bu durumu doğruladılar. Bu amaçla
saccharomyces cerevisiae’den elde edilen I-SceI isimli restriksiyon enziminin tanıma
bölgesini fare genomuna entegre edildi. Fare hücrelerinde meganükleaz sentezlendiğinde
önce çift zincirli DNA kırıkları oluşturuldu.
•
Bu çift zincirli kırıklar verici bir homolog DNA kullanılarak ya homolog rekombinasyon (HR)
ile yada hataya meyilli homolog olmayan uç birleştirme (error-prone non-homologous endjoining (NHEJ)) yöntemleri ile memeli hücrelerinin hedeflenmiş genetik modifikasyonu
sağlandı. Böylece bu iki çalışmayla genom modifikasyonunun temellerini atılmış oldu.
•
Ancak meganükleazlar hücrelerde kromozomal DNAyı bölgeye özgü bir şekilde
kesmelerine rağmen DNA tanıma bölgeleri oldukça uzun olduğundan, bu enzimleri
genomik modifikasyon amacıyla tekrar programlanmaları (aa sekans değişikliği yaparak)
oldukça güçtür. Bu sebeble gözler genomun istenen herhangi bir bölgesini modifikasyona
uğratabilen programlanabilir ajanlara döndü.
3
Programlanabilir nükleazlarla genom mühendisliği
•
Programlanabilir nükleazlar; çift zincirli DNA kırıkları oluşturarak homolog
rekombinasyon etkinliğini en az 100 kat arttıran yada hatalı homolog olmayan uç
birleşimi sağlayarak (error-prone non-homologous end-joining (NHEJ))
hedeflendirilmiş mutasyon oluşumuna sebebiyet veren ajanlardır.
•
Birkaç yıl öncesine kadar zink finger nükleazlar (ZFNs) hedeflenmiş genom mühendisliğiyle
ilgilenen araştırmacılar için tek seçenek olmasına rağmen 2011 yılının sonunda Nature
Metod dergisi bu uygulamayı yılın uygulaması olarak seçtiğinde; ZFNlar transcription
activator-like effector nucleases (TALENs)’ların yanı başında genom düzenleyici araçlar
altında yer aldı.
•
Ocak 2013 yılında birkaç araştırmacı grubu birbirinden bağımsız olarak RNA-guided
engineered nucleases (RGENs) ismi verilen yeni bir genom düzenleyici nükleaz sınıfının
olduğunu duyurdular.
•
Bu üç nükleaz grubu da birbirinden farklı özellikleri olsa da benzer mekanizmalarla
kromozomal DNA’yı bölgeye özgün bir ş ekilde kırıp, endojen DNA tamir
mekanizmasını tetikleyerek hedeflenmiş genom modifikasyonuna yol açar.
4
Outcome of genome editing using programmable nucleases.
Nuclease-induced strand breaks (DSBs) can lead to sequence insertion, nucleotide correction or change (red box) through homology-directed repair
(HDR) in the presence of a donor DNA or a single-strand oligodeoxynucleotide (ssODN), both of which contain homology arms. DSBs can also be
repaired through error-prone non-homologous end-joining (NHEJ), which does not require donor DNA or ssODN and consequently often leads to small
insertions and deletions (indels). Typical indel sequences and the number of inserted (+3 and +1) or deleted (–2, –4 and –10) bases are shown.
5
Outcome of genome editing using programmable nucleases.
b | When two DSBs are generated in cis on a single chromosome by programmable nucleases, the flanking region can be deleted or inverted.
c | When two DSBs are generated on two different chromosomes, chromosomal translocations can be induced.
6
Genom mühendisliğinin kullanım yolakları. Genom mühendisliği yapısal manipülasyonla
kromozomal yapıyı değiştiren, transkripsiyonel kontrolle gen fonksiyonunu ayarlayan, epigenetik
değişimi tetikleyen ve DNA sekansını değiştirmek yoluyla da gen onarımı yapmaya yarayan
metodolojik bir uygulamadır.
7
Zinc Finger Nükleazlarla genom mühendisliği
•
The Johns Hopkins Üniversitesinden Srinivasan Chandrasegaran isimli bir
biyokimyacı; 1990 başlarında bir Tip IIS kesim enzimi olan FokI restriksiyon
enziminin bir proteaz yardımıyla DNA’ya bağlanan bölgesinin ve DNA kesim
nükleaz bölgelerinin birbirinden ayrılabildiğini gösterdi. Bu buluş Fok1 nükleaz
bölgesinin bir DNA bağlanma bölgesine eklenerek sekans spesifik bir nükleaz
proteini oluşturulabileceğini gösterdi. 1996 yılında Chandrasegaran ve
arkadaşları Fok1 nükleaz bölgesine zinc finger proteinleri bağlayarak
oluşturdukları ZFN ‘ların in vitro ortamda hedef DNA’yı spesifik olarak
kırdıklarını gösterdiler.
•
Chandrasegaran’nın çalışmalarından esinlenen Dana Carroll ve arkadaşları Utah
Üniversitesinde müşteri tasarımlı siparişle ZFN’ler oluşturarak ve sonrasında
bunları Drosofila embriyolarına enjekte ederek ilk kez bir canlıda in vivo ortamda
genom düzeltmeyi başardılar. Bundan sonraki çalışmalarda bitkilerde, hayvan ve
insanlarda hedeflenen genler ZFN’lar kullanılarak başarıyla modifiye edildi.
8
ZFN’ların özeti
A. ZFN’lar FokI kesim enziminin katalitik
bölgesine 3 zinc finger proteini bağlayarak
oluşturulur. Herbir zinc finger protein 3
nükleotide bağlanarak ZFN’ları genomda
hedef bölgelere yönlendirir. Genomik
DNA’nın birbirine karşı bölgelerinde iki ZFN
hedeflenen DNA sekansıyla interaksiyona
girerek DNA sekans özgünlüğü olmayan iki
FokI nükleazın dimerize olmasını sağlar.
B. FokI enzimlerinin dimerizasyonu hedef
bölgede çift zincirli DNA kırığı (DSB)
o l u ş t u r u r. H a t a l ı N H E J D N A t a m i r
mekanizması gen sekansının bozulmasına
sebebiyet verir. Alternatif olarak ortama DNA
tamir dizisi konduğunda HDR aracılı genom
modifikasyonuyla gen düzeltme veya ilavesi
gerçekleştirilir. ZF = zinc finger protein.
9
Zinc Finger Nucleazların yapısı (ZFNs). Her bir ZFN amino ucunda bir zinc finger proteini ve karboksi ucunda da FokI nükleaz
bölgesi içerir. X herhangi bir amino asidi temsil eder. ZFN çiftinin hedef sekansları ara bölgeler hariç yaklaşık 18-36 baz çifti
uzunluğundadır. Zinc fingerlarin mutasyon yoluyla DNA tanıma özellikleri değiştirilerek programlanabilir nükleazlar
oluşturulabilir.
Hücre düzeyinde in vivo olarak ZFN aracılı başarılı genom düzenlemeleri yapıldıysa da ZFN’ların hedef özgünlüğü konusunda
endişeler bir türlü giderilemedi. Modüler yöntemlerle önceden belirlenmiş Zinc Finger bölgeleri kullanılarak oluşturulan ZFN’lar
hedef hücrelerde sekans benzerliği gösteren hedef dışı sekansları kesdiğinden dolayı sitotoksik bir etki gösterdi. Bu
problemi düzeltmek için akademi ve endüstriden araştırmacılar ZFN’ların özgünlüğünü arttırabilmek için çalışmalar yaptılar.
10
TALEN genom modifikasyonu
•
ZFN’ların sitotoksizite problemine çözüm bir bakteriyel bitki patojeni olan
Xanthomonas’dan 2009 yılında geldi. Biri Iowa State Üniversitesi’nde Adam
Bogdanove’nin başını çektiği ve diğeri Martin Luther Üniversitesi’nde Ulla
Bonas and Jens Boch isimli araştırıcı grubu Xanthomonas orijinli
transkripsiyon aktivatör benzeri efektör proteinlerin (TALE) DNA ile
interaksiyon mekanizmalarını açıklaması bu proteinlerin de genom
modifikasyonun da kullanılabileceği düşüncesini doğurdu.
•
ZFN’lar ve TALEN’lar C-terminal uçlarında FokI nükleaz bölgesi olsa da DNA
bağlanma bölgeleri birbirinden farklıdır. Zinc finger proteinlerinin aksine, TALE
proteinlerinin her bir tekrarı tek bir bazı tanır. TALE proteinlerinin tekrar
dizileri birbirleriyle değiştirilerek ve FokI bölgesine bağlanarak TALEN
isimli DNA’ya bağlanan yeni bir nükleaz protein grubunu oluşturdu.
11
A. TALE proteininde bir N-terminal uç, merkezi
DNA bağlanma bölgesi ve C-terminal ucunda
da Nüklear lokalizasyon sinyali (NLS) ve
aktivasyon bölgesi (AD) vardır. Her bir tekrar
34 aa uzunluğunda ve 12. ve 13.
pozisyonlarında 2 çok değişken aa RVD
(kırmızı renkli aa’ler) içerir. Her RVD bir
spesifik DNA çiftini tanır ve herbir tekrar
spesifik DNA sekansını tanıyarak aktivasyon
bölgesi ile spesifik genlerin sentezini uyarır.
B.TALEN proteininin yapısı. Timin (kırmızı),
sitozin (yeşil), adenin (mavi) yada guanin
(sarı) nükleotidlerine bağlanan 12 özgün
tekrar içeren FokI nükleazla birleşik bir TALEN
molekülü. Bir TALEN çiftinin hedef bölgeye
karşılıklı bağlanması FokI dimerizasyonu
sağlayarak çift zincirli DNA kırıkları (DSB)
oluşturur. İstenilen genetik mutasyon NHEJ
yada HDR yolağı ile sağlanır.
12
TALEN’ların yapısı. a | Transcription activator-like effector nuclease (TALEN) çiftinin şematik
temsili resmi. Herbir TALEN amino ucunda transcription activator-like effector (TALEs)
bölgeleri ve karboksil ucunda da FokI nuclease bölgesi vardır. 33-35 aa’den oluşan TALE
tekrarları üzerlerindeki repeat variable diresidue (RVD; kırmızı) denen 12 ve 13 aa
leriyle tek bir bazı tanır. TALEN çiftinin hedef sekansı ara bölgeler hariç yaklaşık 30-40
nükleoid çifti uzunluğundadır.
13
TALEN genom modifikasyonu
•
TALE tekrar dizilerinin olduğu DNA segmentinin
oluşturulması oldukça zaman alıcıdır. Ayrıca Bu
sekansların hücrelerde birbirleriyle rekombine olma
ihtimali olduğundan bunları oluşturmak teknik açıdan
oldukça güçtür.
•
TALEN’ların insan hücrelerinde minimal toksizite
göstermesi oldukça dikkat çekici olsa da CRISPR-Cas9
sisteminin ortaya çıkması tüm ilginin bu yeni protein
grubuna dönmesine yol açmıştır.
14
15
GENOME EDITING
The new frontier of genome
engineering with CRISPR-Cas9
Jennifer A. Doudna* and Emmanuelle Charpentier*
BACKGROUND: Technologies for mak-
ing and manipulating DNA have enabled
advances in biology ever since the discovery of the DNA double helix. But introducing site-specific modifications in the
genomes of cells and organisms remained
elusive. Early approaches relied on the
principle of site-specific recognition of
DNA sequences by oligonucleotides, small
molecules, or self-splicing introns. More
recently, the site-directed zinc finger nucleases (ZFNs) and TAL effector nucleases
(TALENs) using the principles of DNAprotein recognition were developed. However, difficulties of protein design, synthesis, and validation remained a barrier to
widespread adoption of these engineered
nucleases for routine use.
ADVANCES: The field of biology is now ex-
periencing a transformative phase with the
advent of facile genome engineering in animals and plants using RNA-programmable
CRISPR-Cas9. The CRISPR-Cas9 technology
originates from type II CRISPR-Cas systems,
which provide bacteria with adaptive immunity to viruses and plasmids. The CRISPRassociated protein Cas9 is an endonuclease
that uses a guide sequence within an RNA
duplex, tracrRNA:crRNA, to form base pairs
with DNA target sequences, enabling Cas9 to
introduce a site-specific double-strand break
sgRNA
binding to
Cas9
Matching DNA
target sequence
CRISPR-Cas9 development
DNA deletion
DNA insertion
DNA replacement
DNA modification
DNA labeling
Transcription modulation
RNA targeting
...
PAM
sequence
CRISPR-Cas9 applications
Biological research
Research and development
Human medicine
Biotechnology
Agriculture
...
The Cas9 enzyme (blue) generates breaks in double-stranded DNA by using its two
catalytic centers (blades) to cleave each strand of a DNA target site (gold) next to a
PAM sequence (red) and matching the 20-nucleotide sequence (orange) of the single
guide RNA (sgRNA). The sgRNA includes a dual-RNA sequence derived from CRISPR RNA
(light green) and a separate transcript (tracrRNA, dark green) that binds and stabilizes the
Cas9 protein. Cas9-sgRNA–mediated DNA cleavage produces a blunt double-stranded break
that triggers repair enzymes to disrupt or replace DNA sequences at or near the cleavage
site. Catalytically inactive forms of Cas9 can also be used for programmable regulation of
transcription and visualization of genomic loci.
SCIENCE sciencemag.org
Corrected 25 November, 2014; see full text.
Published by AAAS
OUTLOOK: CRISPR-Cas9 has triggered a
revolution in which laboratories around
the world are using the technology for innovative applications in biology. This Review illustrates the power of the technology
to systematically analyze gene functions
in mammalian cells, study genomic rearrangements and the progression of cancers
or other diseases, and potentially correct
genetic mutations responsible for inherited
disorders. CRISPR-Cas9 is having a major
impact on functional
ON OUR WEB SITE
genomics
conducted
in
experimental
sysRead the full article
tems. Its application in
at http://dx.doi
.org/10.1126/
genome-wide
studies
science.1258096
will enable large-scale
screening for drug targets and other phenotypes and will facilitate the generation of engineered animal
models that will benefit pharmacological
studies and the understanding of human
diseases. CRISPR-Cas9 applications in plants
and fungi also promise to change the pace
and course of agricultural research. Future
research directions to improve the technology will include engineering or identifying
smaller Cas9 variants with distinct specificity that may be more amenable to delivery
in human cells. Understanding the homology-directed repair mechanisms that follow
Cas9-mediated DNA cleavage will enhance
insertion of new or corrected sequences into
genomes. The development of specific methods for efficient and safe delivery of Cas9
and its guide RNAs to cells and tissues will
also be critical for applications of the technology in human gene therapy.
Downloaded from http://science.sciencemag.org/ on December 18, 2016
REVIEW SUMMARY
in the DNA. The dual tracrRNA:crRNA was
engineered as a single guide RNA (sgRNA)
that retains two critical features: a sequence
at the 5 side that determines the DNA target site by Watson-Crick base-pairing and
a duplex RNA structure at the 3 side that
binds to Cas9. This finding created a simple
two-component system in which changes in
the guide sequence of the sgRNA program
Cas9 to target any DNA sequence of interest.
The simplicity of CRISPR-Cas9 programming, together with a unique DNA cleaving
mechanism, the capacity for multiplexed target recognition, and the existence of many
natural type II CRISPR-Cas system variants,
has enabled remarkable developments using
this cost-effective and easy-to-use technology to precisely and efficiently target, edit,
modify, regulate, and mark genomic loci of a
wide array of cells and organisms.
The list of author affiliations is available in the full article online.
*Corresponding author. E-mail: [email protected]
(J.A.D.); [email protected] (E.C.)
Cite this article as J. A. Doudna, E. Charpentier, Science 346,
1258096 (2014). DOI: 10.1126/science.1258096
28 NOVEMBER 2014 • VOL 346 ISSUE 6213
1077
16
RNA-öncülü modifiye nükleazlar RGEN
•
CRISPR/Cas proteinleri, bakteri ve arkealarda virus ve patojenlere
karşı korunma amacıyla CRISPR RNA (crRNA)-tabanlı DNA tanıma ve
Cas nükleaz-aracılı DNA kesim yoluyla bağışıklık sisteminde görev
alan proteinler olarak keşfedilmişlerdir. CRISPR/Cas sistemi sekansı
yapılan bakterilerin %40’ında arkeaların ise %90’ında tesbit edilmiştir.
•
Bakteriler kendi hücresine invaze olan fajlar yada plazmidlerden
küçük DNA parçalarını (20 baz uzunluğunda) yakalayıp bunları kendi
genomlarına integre ederek CRİSPR genom lokusu oluştururlar.
•
Tip 2 CRISPR sisteminde bu CRISPR bölgeleri pre-CRISPR RNA (precrRNA) olarak transkripte olur, işlendikten sonra da hedef spesifik crRNA
oluşturur. pre-crRNA’nın işlenmesine aynı bölgeden transkripte olan transactivating crRNA (tracrRNA)’da katkı sağlar.
17
CRISPR/Cas bacteriyel bağışıklık sisteminin özeti.
(A) CRISPR lokusunun tipik yapısı; (B) Yeni
spacer DNA kazanım ve invaze DNA kırılımının
şematik görüntüsü.
CRISPR lokusu spacer (aralık) adı verilen
birbirinden farklı tekrarlanmayan (tekrar dizisi
olmayan) aralıklı lokalize bir dizi korunmuş
genomik sekansdan oluşur. CRISPR/Cas
sisteminde, hücreye invazyon yapan yabancı
DNA, Cas nükleaz tarafından işlenerek küçük
parçalara bölünür ve spacer DNA olarak CRISPR
lokusuna integre edilir. Bu spacerlar virus ve faj
enfeksiyonlarına bir cevab olarak crRNA
üretiminde transkripsiyonel template olarak virus
ve fajların hedef sekansını Cas aracılı kırılımı için
kullanılır.
18
CRISPR/Cas9-aracılı DNA
kesimi. İşlenmiş crRNA Cas9
proteinini invaze faj DNA’sının
hedef bölgesine yönlendirir.
Cas9 bir zincirde RuvC-nükleaz
bölgesiyle, diğer zincirde ise
(crRNA komplementer bölge)
HNH nükleaz bölgesiyle hedef
sekansda çift zincirli kırık
oluşturulur.
CRISPR/Cas9-aracılı DNA
kesimi (özgünlüğü) hedef
sekansda
crRNA'ya
komplementer bir dizi ve hedef
sekansın hemen aşağısında da 3
nükleotid PAM sekansı gerektirir.
19
CRISPR/CAS9-aracılı genom modifikasyonu
•
Hem crRNA hem de tracrRNA, CRISPR-associated protein 9
(Cas9) ile komplex oluşturarak dualRNA–Cas9 denilen aktif
DNA endonükleaz oluşturur. RNA yüklemesi Cas9 proteininde
konformasyonel değişim yaparak hedef DNA’nın içeri girmesini
sağlayan bir kanal oluşturur.
•
Oluşan endonükleaz; 20 nükleotid dizisi crRNA’ya komplementer
olan (protospacer) ve 3 dizisi de protospacer bitişik motif (PAM)
olarak bilinen (5ʹ-NGG-3ʹ) özellikle Cas9 proteini tarafından tanınan
23 baz çifti uzunluğunda hedef DNA sekansını kırar.
•
crRNA ve tracrRNA RGEN’leri basitleştirmek amacıyla tek zincirli
öncül RNA (sgRNA) oluşturmak amacıyla birbirine bağlanabilir.
20
CRISPR/CAS9-aracılı genom modifikasyonu
•
CRISPR/Cas sistemi Cas proteinin yapısı ve sekansına bakıldığında
tip 1, tip 2 ve tip 3 olmak üzere sınıflandırılabilir. Tip 2 CRISPR/Cas
sisteminde HNH nucleaz bölgesi ve RuvC-benzeri nücleaz bölgesi
içeren yalnızca tek bir Cas proteinine ihtiyacı vardır.
•
Spesifik DNA bölgelerini kesebilmek için in vitro ortamda crRNA ve
tracrRNA‘nın birleştirilerek tek bir öncül RNA oluşturulması (guide
RNA sgRNA); Cas9 aracılı programlanmayı daha da
basitleştiren bu alandaki en önemli buluşlardandı.
•
CRISPR/Cas9-aracılı genom düzeltmesinde, sgRNA hedef sekansı
(protospacer) komplementer baz eşleşmesiyle tanır ve bağlanır.
21
CRISPR/Cas sisteminin çalışma Mekanizması.
A. Yabancı DNA sekansının parçalanması.
Hücrelere virus veya plazmidler girdiğinde
c r R N A l a r y a b a n c ı D N A n ı n PA M d i z i l i
protospacer sekansına bağlanır. TracrRNA
crRNAnın komplementer DNA sekansına
bağlanmasını ve Cas9 nükleazla interaksiyona
girmesini kolaylaştırarak, crRNA bağımlı çift
zincirli DNA kırığı (DSB) oluşturur. Bölgeye
özgü çift zincirli DNA kırığı PAM sekansının
hemen 3 baz çifti önünde (siyah oklar)
gerçekleşir.
B.CRISPR/Cas sisteminde genom
modifikasyonu. Tasarımı yapılmış gRNA
(crRNA ve tracrRNA kimerası-hibridi) genomik
DNA’da PAM bitişik hedef sekansı tanıyarak
Cas9 aktivasyonu sağlayıp hedef spesifik DSB
oluşturur. Akabinde genom düzeltme için DNA
tamir mekanizması devreye sokulabilir.
22
CRISPR/Cas9 systeminin çalışma mekanizması. Tek bir guide RNA (sgRNA) konakçı hücrede
komplementer baz eşleşmesiyle hedef sekansı (protospacer) tanır. Cas9 nükleaz Protospacer Adjacent
Motif (PAM) ‘in yanında (3’ pozisyonunda sekansı NGG olan) çift zincirli DNA kırığı oluşturur.
23
RGEN lerin yapısı. Resimde bir RNA-guided engineered nuclease (RGENs) ş ematize edilmiştir. RGEN
bir Cas9 ve tek zincirli öncül RNA (a single-chain guide RNA (sgRNA)) gerektirir. crRNA daki öncül sekans
(sgRNA) protospacer adjacent motifin (PAM sekansı, 5ʹ-NGG-3ʹ) yanında protospacer olarak bilinen 20
baz çiftine komplementerdir. c | RGEN tarafından kırılıp hedef DNA da küt uç oluşturması gösterilmiştir.
24
CRISPR–Cas9 ile RNA bağımlı genom modifikasyonu
•
ZFN ve TALEN sisteminde FokI nükleazların yalnızca bu enzim dimerize
olduğunda hedef DNA yı kırması bu proteinlerin hedef özgünlüğünü
arttıran bir durumdur. Bunun tersine Cas9 monomerik formda aktifdir.
Dahası CRISPR–Cas9 prokaryot orijinli olup bakteriofajlar gibi genetiği hızla
değişebilen infeksiyonlara karşı kazanılmış bağışıklık sisteminde fonksiyon
görür. Bu sebeble Cas9 proteinlerinin düşük DNA sekans özgünlüğü
farklı DNA sekanslarını tanımak ve kırabilmek için gerekir.
•
ZFN ve TALEN’ların aksine Cas9 proteininin yüksek ökaryötik hücrelerde
bilinen fonksiyonlarının olmaması ve ökaryötik hücrelerin genomun devasa
büyüklüğü Cas9 nükleazların düşük sekans özgünlüğünün bu hücrelerde
hedef dışı dizileri kırabileceği endişesini doğurdu. Bu nedenle,
araştırmacılar Cas9 proteininin genom üzerindeki muhtemel hedef
bölgelerin belirlenmesi ve bu proteinin özgünlüğünü arttıracak
yöntemler üzerine yoğunlaştılar.
25
CRISPR–Cas9 sisteminde hedef dışı (offtargeting) etkileri gidermenin yolları
•
Bu amaçla çift zincirli DNA kırıkları oluşturan nükleazların yerine tek zincirli DNA
kırıkları oluşturan (SSB) nikazların kullanılması önerilmiştir. 2 aktif bölgeli Cas9
yerine aktif bölgedeki anahtar bir aminoasidin (örneğin D10) alanine
dönüştürülmesiyle (D10A Cas9) DNA nikazlar elde edilir. SSB hatalı NHEJ ile
tamir edilmese de HR ile tamir edilebilir bu da istenilen genom modifikasyonunu
sağlayabilir. Ancak SSB tamir etkinliği DSB tamirinden 10 kat daha az olması
genom modifikasyonunda nikazların kullanımını sınırlandırmaktadır.
•
Bu sınırlandırmayı aşabilmek için her biri birbirine yakın tek bir DNA zinciri kıran
bir çift DNA nikaz kullanarak genom modifikasyonunun hem etkinliği hem de
özgünlüğü arttırılarak DSB oluşturulabilir. Hedef dışı SSB endojen olarak SSB
tamir enzimleriyle başarılı bir ş ekilde tamir edildiğinden Cas9 nükleazlar
tarafından oluşturulan hedef dışı mutasyonlar Cas9 nikazlar tarafından kolay
kolay oluşturulmazlar. Daha da önemlisi bu gelişme programlanabilir
nükleazların gen tedavisinde kullanımını sağlamıştır.
26
27
Programlanabilir nükleazlarla gensiz gen tedavisi
•
Barbas ve grubu 2012 yılında saflaştırılmış rekombinant ZFN’ların hücrelere penetre olabilen
özelliklerinin olduğunu keşfetmiş ve bu ZFN proteinlerin direk olarak hücrelere
verilmesinin (ZFN proteinlerinin yarı ömrü kısa olduğundan) genomda uygulamanın hedef
dışı etkileri (off targeting) azalttığını bulmuşlardır.
•
Bu çalışmadan esinlenen diğer araştırmacılar rekombinant Cas9 guide-RNA
ribonükleoproteinleri (RNP) olduğu gibi hayvan embriyolarına, bitkilere ve memeli
hücrelerine aktarmışlardır. Cas9 RNPlerin hücrelerde çabucak parçalanması bu proteinlerin
olası hedef dışı etkilerinin azalmasını sağlamıştır.
•
Cas9 RNPler hücrelere mikroenjeksiyon, elektroporasyon, lipofeksiyon ve protein
transdüksiyonu gibi farklı yöntemlerle verilebilir. Burada genlerin plazmid (transfeksiyon)
veya viral vektörlerle aktarılmasını içeren konvansiyonel gen tedavi denemelerinden farklı
olarak Cas9 RNP naklinde eksojen DNA aktarımı olmaz.
•
Dolayısıyla yabancı DNA’ya karşı olası bir bağışıklık yanıtının gelişmesi yada yabancı
DNA’nın konakçı genomunda istenmeyen bir bölgeye entegrasyonu söz konusu
değildir.
28
29
30
CRISPR/CAS9-aracılı genom modifikasyonu
•
PAM sekanslı herhangi bir genomik lokusu hedefleyebilmek için sgRNA’daki 20
nükleotid uzunluğundaki öncül sekansı değiştirerek nückleazlar tekrar
programlanabilir. Hatta birden fazla sgRNA kullanarak aynı anda birden fazla
genomik lokusun değiştirilmesi (multiplexing) mümkündür.
•
Diğer tasarımı yapılmış nükleazlar gibi Cas9 hedef bölgede çift zincirli DNA
kırıkları oluşturarak (DSBs) endojen DNA tamir mekanizmalarını tetikler.
Homolog bir verici DNA varlığında homology-directed repair (HDR)
mekanizmasıyla DNA tamiri gerçekleştirilir. Homolog verici DNA yokluğunda da
nonhomologous end-joining (NHEJ) mekanizmasıyla tamir mekanizmasının
doğal bir sonucu olarak rekombinasyon bölgesinde inzersiyonlar, delesyonlar
(indel) yani mutasyonlar oluşur.
•
Bu sebeble, eksojen HDR ş aplanları oluşturularak Cas9 ve sgRNA varliğında
hücrelere verildiğinde genomda istenen sekans değişimi gerçekleştirilir. Ancak
bu işlem yalnızca bölünen hücrelerde düşük miktarda gerçekleşir.
31
32
33
Cas9 proteinin fonksiyonel bölgelerinde modifikasyon ve sonuçları
•
A: The Cas9 nükleaz hedef DNA’nın komplementer veya komplementer
olmayan DNA zincirini HNH ve RuvC bölgeleriyle kırar.
•
B: RuvC bölgesinde D10A mutasyonu olduğunda Cas9 nikaz olarak
fonksiyon görür.
•
C: HNH bölgesinde H840A mutasyonu olduğunda da Cas9 yine nikaz
olarak fonksiyon görür.
•
D: Hem RuvC hem de HNH bölgelerinde mutasyon taşıyan Cas9 proteini
(dead dCas9) yalnızca RNA tarafından yönlendirilmiş DNA’ya bağlanan
bir protein olarak fonksiyon görür.
•
E: dCas9 proteinine bir aktivatör veya baskılayıcı bölgeler ekleyerek gen
ekspresyonu aktive edilebilir veya susturulabilir.
•
F: Schematic representation of double
34 nicking.
35
CRISPR/Cas9 sistemiyle yeni tasarımlar ve deneysel yaklaşımlar
•
Günümüzde Cas9 proteinin farklı formları olup bunlarla genomde çok farklı değişiklikler
yapılabilmektedir. Örnekler:
•
a) Doğal (değiştirilmemiş-orijinal) Cas9’la çift zincirli DNA kırıkları oluşturmak,
•
b) Cas9 nikazlarla tek zincirli DNA kırıkları oluşturmak. Bu durumda farklı DNA zincirini
hedefleyen birbirine yakın 2 gRNA kullanarak çift zincirli DNA kırığı oluşturmak
mümkün,
•
c) Nukleaz-yoksun Cas9 (dCas9) kullanarak CRISPR’la gen aktivasyonu. dCas9 proteinine
VP64 gibi transkripsiyon aktivasyon bölgeleri eklenerek hedef genler aktive edilebilir.
•
d) Bunun tersine dCas9 proteinine transkripsiyonu baskılayan bölgeler eklenerek (dCas9KRAB) hedef genler geçici olarak susturulabilir.
•
e) Donor plazmidlerde floresan kodlayan genler ve hedef bölgeye homoloji gösteren
sekans varlığında arzu edilen protein genleri floresan kodlayan dizilerle işaretlenebilir.
•
f) Cas9-WT yada Cas9 nikaz kullanarak HDR mekanizmasıyla hedef genlerde nokta
mutasyonları oluşturulabilir.
36
37
38
Özgünlük ve etkinlik
•
Hedefli genom modifikasyonunda en önemli sorunlardan biri
hedef özgünlüğüdür. İstenen, genomun diğer bölgelerine
dokunmadan yalnızca hedef bölgede DNA sekans değişikliğidir.
•
TALEN ve CRISPR-Cas9 sistemi yaygın olarak kullanılmalarına
rağmen herkisinin de hedefleme açısından mükemmel özgünlük
sağladığı söylenemez. Başka bir deyişle bu nükleazların
genomun diğer yerlerinde de değişiklik yaptığı saptanmıştır.
•
Bu hedef dışı etkileri hücrelerde, organlarda, organizmada hatta
çevrelerinde istenmeyen yan etkiler oluşturabilir. Bu sebeble bu
nükleazların genom modifikasyonlarında kullanılmasını sınırlayan
en önemli sebeb hedef özgünlüğüdür.
39
40
41
42
Hedef dışı bölgeleri saptamada ilk jenerasyon metodlar:
•
Hedef dışı sekanslara karşı modifiye edilmiş nükleazların (engineered nucleases-EN) özgünlüğünü
test etmek için kullanılan metodlardan biri SELEX (systematic evolution of ligands by exponential
enrichment) yöntemidir. Bu yöntemde modifiye edilmiş nükleazlar oluşturulan DNA kütüphanesiyle
birlikte karıştırılır, nükleazların bağlandığı DNA fragmentleri seçilir ve çoğaltılır. Elde edilen DNA
fragmentlerine DNA adaptörleri eklenerek gelecek jenerasyon sekanslamaya (NGS) tabi tutulur.
•
Bu yöntemde modifiye edilmiş nükleazlar normalde uzun sekansları tanıdığından içinde her muhtemel
nükleotid kombinasyonu barındıran büyük bir çift zincirli DNA kütüphanesi oluşturulmasını
gerekiyor. Örneğin 18 sekanslı bir hedef DNA dizisinde tarama için 4e18 (7 × 10e10) DNA fragmenti
içeren bir DNA kütüphanesi oluşturuldu. Ancak bu tip büyük kütüphanelerin hem üretimi hem de
herkes tarafından kullanımı pratik ve yaygınlık açısından mümkün olamadı.
•
Bu ilk jenerasyon tarama metodları yalnızca sınırlı sayıda potansiyel hedef dışı bölgeleri
tarayabildiğinden genomun tamamı yeterince tarandığında bulunandan çok daha fazla sayıda hedef
dışı değişimlerin olabileceği endişesi gündeme geldi.
43
2. jenerasyon metodlar: Nükleaz inaktif dCas9’un bağlanma
özgünlüğünü belirlemede genom çaplı tarama yöntemleri
•
Chromatin immunoprecipitation sequencing (ChIP-seq). Özgün ve inaktif
modifiye nükleazlar (EN’ler) hücrelere transfekte edilir. DNA’ya bağlanan tüm
proteinler birbirlerini bağlayan (kroslinking) ajanlarla in vivo olarak fikse edilir.
İzole edilen genomik DNA sonrasında küçük parçalara bölünür. EN’lere
bağlanan DNA parçacıkları EN’lere karşı geliştirilen antikorlarla çöktürülerek
(immunopresipitasyon) gelecek jenerasyon sekanslamaya tabi tutulur.
•
Bu teknik farklı gRNA’larla kompleks dCas9’un genom çapında
bağlanabileceği bölgeleri taramak için kullanıldı. Sonuçlara göre bazı
gRNA’lar spesifik bölgelerle interaksiyona girse de bazı gRNA’ların spesifik
olmayan 1200 kadar farklı bölgeyle interaksiyona
girdiği tesbit edildi.
44
3. Jenerasyon metodlar: Cas9 tarafından oluşturulan
çift zincirli DNA kırıklarının genom çaplı taraması
•
Pek çok canlıda çift zincirli DNA kırıkları (Double strand breaks (DSB)) DNA kırık
noktasında mutasyon oluşmasına sebebiyet veren hataya meyilli homolog olmayan uç
birleştirme yolağıyla (error-prone non-homologous end-joining pathway) tamir edilir.
•
Bu açıdan katalitik olarak aktif Cas9 proteinin genomun herhangi bir tarafında (genom
çapında) sebebiyet verdiği çift zincirli DNA kırıkları tüm genom sekanslamayla (whole
genome sequencing (WGS)) en doğru şekilde bulunabilir.
•
Ancak WGS, genomda gözlemlenen yüksek frekanslı değişimleri kolaylıkla saptasa
da, bu teknikle tüm genomu 30-60 kez sekanslamak düşük frekanslı mutasyonları
tesbit etmek için yeterli değildir. Dolayısıyla WGS tekniğinde yoğun sekans derinliği
(extensive sequencing depth) bu tekniğin etkinliğini sınırlayan bir faktördür.
•
Hele hele insan kökenli olmayan hücrelerin bu yöntemle taranmasında sekans
derinliğine ilaveten maliyet de sınırlayıcı bir faktör olarak karşımıza çıkmaktadır.
45
3. Jenerasyon metodlar:
•
İntegraz özürlü lentivirus vektörleri (Integrase-deficient lentivirus vectors IDLV) Cas9
tarafından oluşturulan çift zincirli DNA kırıklarına bir belirteç gen yerleştirerek genomda
hedef dışı bölgeleri tesbit etmede kullanıldı. Önce modifiye nükleazlar (Engineered
nucleases EN) hücrelere transfekte edilir sonra da puromisin taşıyan İDLV’lerle
hücreler transdüksiyona uğratılır. DSB’lerin NHEJ yolağıyla tamiri üzerinde puromisin
dirençlilik geni taşıyan IDLV partiküllerin genoma integrasyonuna sebebiyet verir.
•
Puromisin dirençli hücrelerden genomik DNA izole edilir. IDLV üzerinde mevcut LTR
(long terminal repeat)’lere karşı geliştirilen primerler kullanılarak linear amplification–
mediated PCR’ la (LAM-PCR) IDLV integrasyon bölgeleri tesbit edilir. Adaptör
barkodların ilavesiyle PCR ürünü gelecek jenerasyon sekanslama tekniğiyle (NGS)
46
analiz edilir.
3. Jenerasyon metodlar:
•
The GUIDE-seq approach (genome-wide, unbiased identification of DSBs enabled by
sequencing) GUIDE-seq tekniği de benzer ş ekilde çift zincirli DNA kırıklarına küçük bir barkot
ekleyerek ve bunları yüksek çıktılı sekanslamaya (high throughput sequencing) tabi tutarak
genom üzerinde hedef dışı bölgelerin belirlenmesini sağladı.
•
Bu teknikde modifiye nükleazlar özgün bir çift zincirli oligodeoksinükleotidle (dsODN) birlikte
hücrelere transfekte edilir. Çift zincirli DNA kırıkları hataya meyilli homolog olmayan uç birleştirme
yolağıyla (error-prone non-homologous end-joining pathway) tamir edildiğinde dsODN lar genoma
integre olur. Genomik DNA transfekte hücrelerden izole edilip parçalanır. Sekans adaptörleri ilave
edilerek NGS yöntemiyle integrasyon bölgeleri (çift zincirli DNA kırıkları) tesbit edilir.
•
GUIDE-seq tekniği hedef dışı çift zincirli kırık olasılığının gRNA ya bağlı olarak 0 ile 150 arasında
değiştiğini gösterdi.
47
•
Digenome-seq. Saflaştırılmış genomik DNA modifiye
endonükleazlarla in vitro ortamda inkube edilir. Genom
parçalanıp gelecek jenerasyon sekanslamayla analiz edilir.
•
Digenome-seq tekniğinin programlanabilir nükleazların hedef
dışı etkilerini belirleyebilmek için kullanılabilecek güçlü,
duyarlı, ve maliyeti düşük bir teknik olduğu ileri sürülüyor.
48
Sonuç: CRISPR/Cas9 ne kadar özgün?
•
Bu çalışmaların hepsinden çıkan ortak sonuç, CRISPR/Cas9
aracılı kırıklar; tasarımı yapılan sgRNA’a bağlı olarak yüksek veya
düşük özgünlükte olabilir. Dolayısıyla, CRISPR/Cas9 sisteminde
özgünlük tamamıyla sgRNAların spesifisitesine bağlanabilir. Bazı
sgRNAlar çok özgünken bazıları sekans özgünlüğü yetersizliği
sebebiyle yüzlerce hedef dışı sekanslara kolaylıkla bağlanabilir.
•
Şu anda araştırmacılar hangi sgRNAların en az hedef dışı etki
sergilerden hangilerinin en fazla hedef dışı etki gösterebileceğini
belirlemeye çalışıyorlar.
•
Bu bakımdan en azından CRISPR/Cas9 sisteminin ZFN ve
TALEN’lara oranla teknolojik olarak daha önde ve
kullanımlarının daha yaygın olduğunu belirtmekte yarar var.
49
Therapeutic genome editing using CRISPR-Cas9
50
51
52
Modifiye nükleazların geleceği
•
Bir zamanların gizemli prokaryotik viral savunma sisteminin günümüzde canlıların genetik
yapısını değiştirebilmek için kullanılabilecek en etkili araç olması tıbbi araştırmalarda
temel bilimlerinin rolünün açığa çıkması açısından önemlidir. Faj ve bakteriler arasındaki
savaşta temel restriksiyon enzim araştırmaları nasıl rekombinant DNA teknolojisini
geliştirdiyse, bugünün Cas9 temelli genom modifikasyon araçları da mikrobiyal antifaj savunma
sisteminin bir parçası olarak ortaya çıkıp genom mühendisliğinin en etkin yöntemleri haline
geldi.
•
Birkaç yıl öncesine kadar genom modifikasyonu dünyanın farklı köşelerinde sınırlı sayıda
laboratuvarlarda yapılan bir işlem olarak bilinirken, bugün için biyomedikal araştırmalarda
yaygın olarak herkes tarafından kolayca kullanılabilecek bir metod seviyesine çıktı.
•
Genom mühendisliği; kişilerde tıp ve biyoteknolojik araştırma açısından heyacan yaratsa da
kitlelerde de bir endişe yarattığı da bir gerçek. Gelecekte CRISPR–Cas9 kullanılarak insan,
hayvan ve bitkilerin genom modifikasyonu yoluyla en azından hastalıklara yatkınlık gibi
istenmeyen özelliklerin giderildiği istenilen özelliklerin de kalıtıldığı bir dünyada yaşamak
durumunda kalabiliriz.
•
Şu an için modifiye edilmiş nükleazların klinik denemelerde olduğunu sonuçlarını görebilmemiz
için de biraz beklememiz gerektiğini söyleyebiliriz.
53
İlgiyle dinlediğiniz
için teşekkürler
Prof. Dr. Salih Sanlioglu
Akdeniz Üniversitesi Gen ve Hücre Tedavi Merkezi, Antalya, Türkiye, 07058
54