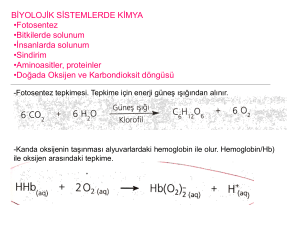
ders kitabı - files.eba.gov.tr
advertisement

ORTAÖĞRETİM KİMYA 11 DERS KİTABI M.E.B. Talim ve Terbiye Kurulunun 08.12.2011 gün ve 240 sayılı kararıyla 2012-2013 öğretim yılından itibaren 5 (beş) yıl süreyle ders kitabı olarak kabul edilmiştir. Faruk KARACA Cemal ERTAŞ Y A Y I N C I L I K L T D. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1 C Her hakkı saklıdır ve Paşa Yayıncılık Limited Şirketine aittir. Bu kitabın tümü ya da bir bölümü, Paşa Yayıncılık Limited Şirketinden önceden izin alınmaksızın hiçbir biçimde çoğaltılamaz, basılıp yayımlanamaz. 1. Baskı: Temmuz 2014 ISBN: 978-975-8119-57-8 Y A Y I N C I L I K L T D. Eskişehir Yolu, 17. km., Erler Mah. Çamlık Park Sitesi, 2365. Sok., Nu.: 7 06790 Etimesgut/ANKARA tel.: (0312) 234 20 01 belgeç: (0312) 234 18 10 www.pasayayincilik.com e-mail: [email protected] DÜZELTİ VE YAYINA HAZIRLAMA KURULU Sezer Özlem GÖKTAN : Bilgin YÜCEL : Ahmet TAYYAR : K. Figen ŞIRAMAN : Enver ÇETİN : Salih ŞATIR : Editör Dil Uzmanı Görsel Tasarımcı Rehberlik Uzmanı Ölçme ve Değerlendirme Uzmanı Program Geliştirme Uzmanı Baskı yeri ve yılı Ankara,2014 Baskı, Cilt: Özgün Matbaacılık San. ve Tic. A.Ş. Ankara-Polatlı Devlet Karayolu 52. km. Özgün Grup Sitesi, Temelli / Sincan - ANKARA Tel: 0 (312) 645 19 10 (Pbx) Belgeç: 0 (312) 645 19 19 2 ORTAÖĞRETİM KİMYA 11 DERS KİTABI İSTİKLÂL MARŞI Korkma, sönmez bu şafaklarda yüzen al sancak; Bastığın yerleri “toprak!” diyerek geçme, tanı: Sönmeden yurdumun üstünde tüten en son ocak. Düşün altındaki binlerce kefensiz yatanı. O benim milletimin yıldızıdır, parlayacak; Sen şehit oğlusun, incitme, yazıktır, atanı: O benimdir, o benim milletimindir ancak. Verme, dünyaları alsan da, bu cennet vatanı. Çatma, kurban olayım, çehreni ey nazlı hilâl! Kim bu cennet vatanın uğruna olmaz ki fedâ? Kahraman ırkıma bir gül! Ne bu şiddet, bu celâl? Şühedâ fışkıracak toprağı sıksan, şühedâ! Sana olmaz dökülen kanlarımız sonra helâl... Cânı, cânânı, bütün varımı alsın da Huda, Hakkıdır, Hakk’a tapan, milletimin istiklâl! Etmesin tek vatanımdan beni dünyada cüdâ. Ben ezelden beridir hür yaşadım, hür yaşarım. Ruhumun senden, İlâhi, şudur ancak emeli: Hangi çılgın bana zincir vuracakmış? Şaşarım! Değmesin mabedimin göğsüne nâmahrem eli. Kükremiş sel gibiyim, bendimi çiğner, aşarım. Bu ezanlar -ki şahadetleri dinin temeli- Yırtarım dağları, enginlere sığmam, taşarım. Ebedî yurdumun üstünde benim inlemeli. Garbın âfâkını sarmışsa çelik zırhlı duvar, O zaman vecd ile bin secde eder - varsa- taşım, Benim iman dolu göğsüm gibi serhaddim var. Her cerîhamdan, İlâhi, boşanıp kanlı yaşım, Ulusun, korkma! Nasıl böyle bir imanı boğar, Fışkırır ruh-ı mücerred gibi yerden na’şım; “Medeniyet!” dediğin tek dişi kalmış canavar? O zaman yükselerek arşa değer belki başım. Arkadaş! Yurduma alçakları uğratma, sakın. Dalgalan sen de şafaklar gibi ey şanlı hilâl! Siper et gövdeni, dursun bu hayâsızca akın. Olsun artık dökülen kanlarımın hepsi helâl. Doğacaktır sana va’dettiği günler Hakk’ın... Ebediyen sana yok, ırkıma yok izmihlâl: Kim bilir, belki yarın, belki yarından da yakın. Hakkıdır, hür yaşamış, bayrağımın hürriyet; Hakkıdır, Hakk’a tapan, milletimin istiklâl! Mehmet Âkif ERSOY ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3 ATATÜRK’ÜN GENÇLİĞE HİTABESİ Ey Türk gençliği! Birinci vazifen, Türk istiklâlini, Türk cumhuriyetini, ilelebet, muhafaza ve müdafaa etmektir. Mevcudiyetinin ve istikbalinin yegâne temeli budur. Bu temel, senin, en kıymetli hazinendir. İstikbalde dahi, seni, bu hazineden, mahrum etmek isteyecek, dahilî ve haricî, bedhahların olacaktır. Bir gün, istiklâl ve cumhuriyeti müdafaa mecburiyetine düşersen, vazifeye atılmak için, içinde bulunacağın vaziyetin imkân ve şeraitini düşünmeyeceksin! Bu imkân ve şerait, çok nâmüsait bir mahiyette tezahür edebilir. İstiklâl ve cumhuriyetine kastedecek düşmanlar, bütün dünyada emsali görülmemiş bir galibiyetin mümessili olabilirler. Cebren ve hile ile aziz vatanın, bütün kaleleri zapt edilmiş, bütün tersanelerine girilmiş, bütün orduları dağıtılmış ve memleketin her köşesi bilfiil işgal edilmiş olabilir. Bütün bu şeraitten daha elîm ve daha vahim olmak üzere, memleketin dahilinde, iktidara sahip olanlar gaflet ve dalâlet ve hattâ hıyanet içinde bulunabilirler. Hattâ bu iktidar sahipleri şahsî menfaatlerini, müstevlilerin siyasî emelleriyle tevhit edebilirler. Millet, fakr u zaruret içinde harap ve bîtap düşmüş olabilir. Ey Türk istikbalinin evlâdı! İşte, bu ahval ve şerait içinde dahi, vazifen; Türk istiklâl ve cumhuriyetini kurtarmaktır! Muhtaç olduğun kudret, damarlarındaki asîl kanda, mevcuttur! 4 ORTAÖĞRETİM KİMYA 11 DERS KİTABI MUSTAFA KEMAL ATATÜRK (1881-1938) ORTAÖĞRETİM KİMYA 11 DERS KİTABI 5 İÇİNDEKİLER SAĞLIK VE GÜVENLİK UYARILARI.........................................................................................................9 ORGANİZASYON ŞEMASI.............................................................................................................. 10-11 1.ÜNİTE: KİMYASAL REAKSİYONLAR VE ENERJİ......................................... 12-59 1. BÖLÜM: SİSTEMLER VE ENERJİ TÜRLERİ.............................................................................13 1. Sistem ve Ortam....................................................................................................................14 2. Madde ve Enerji.....................................................................................................................16 3. Isı ve İş...................................................................................................................................19 4. Kimyasal Değişme ve Enerji...................................................................................................22 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI......................................................................23 OKUMA METNİ: Buharın Gücü..............................................................................................24 2. BÖLÜM: SİSTEMLERDE ENTALPİ DEĞİŞİMİ...........................................................................26 1. Entalpi Değişimi.....................................................................................................................27 2. Bileşiklerin Oluşma Isıları.......................................................................................................28 3. Tepkime Isılarının Hesaplanması............................................................................................30 4. Bağ Enerjileri ve Tepkime Entalpisi........................................................................................33 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI......................................................................36 3. BÖLÜM: İSTEMLİLİK-İSTEMSİZLİK..........................................................................................37 1. İstemli ve İstemsiz Değişim....................................................................................................38 2. Kullanılamayan Termal Enerji/Entropi.....................................................................................41 3. Sistemde Entropi Değişimi.....................................................................................................44 4. Termodinamiğin Üçüncü Yasası ve Mutlak Entropi................................................................47 5. Serbest Enerji.........................................................................................................................50 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI......................................................................55 1. ÜNİTE DEĞERLENDİRME ÇALIŞMALARI........................................................................56 2.ÜNİTE: REAKSİYON HIZLARI VE KİMYASAL DENGE............................... 60-121 1. BÖLÜM: REAKSİYON HIZLARI.................................................................................................61 1. Reaksiyon Hızı........................................................................................................................62 2. Reaksiyon Hız Denklemi.........................................................................................................67 3. Reaksiyon Hızını Etkileyen Etkenler.......................................................................................77 4. Reaksiyon Derecesi ve Molekülerite......................................................................................91 OKUMA METNİ: Canlı Katalizörler: Enzimler.........................................................................90 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI......................................................................91 2. BÖLÜM: KİMYASAL DENGE.....................................................................................................93 1. Tersinmezlik ve Tersinirlik.......................................................................................................94 2. Denge Bağıntısı ve Denge Sabiti............................................................................................97 3. Kimyasal Dengeye Etki Eden Etmenler................................................................................103 4. Denge Sabitinin Sıcaklık ve Kat Sayılarla İlişkisi..................................................................110 5. Kimyasal Reaksiyonlarda Ürün Verimi..................................................................................112 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................114 2. ÜNİTE DEĞERLENDİRME ÇALIŞMALARI......................................................................116 6 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3.ÜNİTE: ÇÖZELTİLERDE DENGE............................................................... 122-187 1. BÖLÜM: SUYUN OTOİYONİZASYON DENGESİ...................................................................123 1. Suyun Otoiyonizasyonu.......................................................................................................124 2. Suyun İyonlaşma Dengesi....................................................................................................126 3. Asitler ve Bazlar...................................................................................................................127 4. Asit ve Baz Dengeleri...........................................................................................................130 5. Asitlik-Bazlık Kuvveti............................................................................................................133 6. Hidroliz.................................................................................................................................134 7. Kuvvetli Asit ve Baz Çözeltilerinin pH Değerleri...................................................................136 8. Zayıf Asit ve Baz Çözeltilerinin pH Değerleri........................................................................138 OKUMA METNİ: pH Ölçme Yöntemleri................................................................................141 9. Nötrleşme Tepkimeleri..........................................................................................................143 10.Tampon Çözeltiler................................................................................................................147 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................148 2. BÖLÜM: ÇÖZÜNÜRLÜK DENGELERİ...................................................................................150 1. Çözünme..............................................................................................................................151 2. Çözünme-Çökelme Dengesi................................................................................................155 OKUMA METNİ: Isı Torbaları................................................................................................155 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................165 3. BÖLÜM: KOMPLEKS OLUŞMA-AYRIŞMA DENGELERİ.......................................................167 1. Koordine Kovalent Bağlar....................................................................................................168 2. Kompleks Oluşum Dengeleri................................................................................................169 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................173 4. BÖLÜM: TİTRASYON...............................................................................................................175 1. Tesir Değeri..........................................................................................................................176 2. Eş Değer Kütle ve Eş Değer Sayısı......................................................................................176 3. Asit-Baz Titrasyonları...........................................................................................................177 4. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................182 3. ÜNİTE DEĞERLENDİRME ÇALIŞMALARI......................................................................184 4. ÜNİTE: ELEKTROKİMYA............................................................................ 188-243 1. BÖLÜM: MADDE VE ELEKTRİK.............................................................................................189 1. Enerji Dönüşümleri...............................................................................................................190 2. Faraday Yasaları...................................................................................................................190 3. Yükseltgenme Basamağı.....................................................................................................195 4. Denklemlerin Denkleştirilmesi..............................................................................................196 a. Değerlik (Yük) Yöntemi....................................................................................................196 b. Yarı Tepkime Yöntemi.....................................................................................................200 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................205 2. BÖLÜM: STANDART ELEKTROT POTANSİYELİ...................................................................207 1. Elementlerin Yükseltgenme-İndirgenme Eğilimleri...............................................................208 2. Galvanik Hücreler.................................................................................................................212 3. Standart Pil Potansiyeli........................................................................................................214 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................222 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 7 3. BÖLÜM: ELEKTROKİMYASAL HÜCRELER..........................................................................225 1. Elektrokimyasal Hücreler......................................................................................................226 2. Elektroliz...............................................................................................................................230 3. Endüstriyel Elektroliz............................................................................................................234 OKUMA METNİ: Endüstriyel Korozyon ve Önleme Teknikleri..............................................237 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................237 4. ÜNİTE DEĞERLENDİRME ÇALIŞMALARI......................................................................239 OKUMA METNİ: Yakıt Pilleri.................................................................................................243 5. ÜNİTE: ÇEKİRDEK KİMYASI.................................................................. 244-274 1. BÖLÜM: ATOM ÇEKİRDEĞİNİN YAPISI.................................................................................245 1. Atom Çekirdeği....................................................................................................................246 2. Kararlılık Kuşağı...................................................................................................................248 3. Doğal Radyoaktiflik..............................................................................................................251 4. Radyoaktif Bozunma Çeşitleri..............................................................................................252 OKUMA METNİ: CNO (Karbon-Azot-Oksijen) Döngüsü......................................................255 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................256 2. BÖLÜM: YAPAY ÇEKİRDEK REAKSİYONLARI.....................................................................257 1. Çekirdek Dönüşümü............................................................................................................258 2. Çekirdek Reaksiyonları.........................................................................................................258 3. Nükleer Enerji Santralleri......................................................................................................260 OKUMA METNİ: Güneş ve Yıldızlar Enerjilerini Nasıl Üretir?...............................................263 OKUMA METNİ: Nükleer Enerji İle Elektrik Üretimi..............................................................263 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................264 3. BÖLÜM: AKTİFLİK, RADYOAKTİF IŞINLARIN SAYIMI VE SAĞLIĞA ETKİSİ......................265 1. Radyoaktif Işınlar ve Özellikleri............................................................................................266 2. Radyoaktivite Ölçümleri ve Birimleri....................................................................................266 3. Radyoaktif Işınların İnsan Sağlığına Etkisi............................................................................268 4. Radyoaktif Maddelerin Kullanım Alanları.............................................................................269 5. Endüstriyel Alanda Radyoizotopların Kullanılışı...................................................................271 OKUMA METNİ: Geiger-Müller Sayacı.................................................................................272 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI....................................................................272 5. ÜNİTE DEĞERLENDİRME ÇALIŞMALARI......................................................................273 BÖLÜM VE ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI....................................275 SÖZLÜK...................................................................................................................................283 DİZİN.........................................................................................................................................288 KAYNAKÇA...............................................................................................................................290 PERİYODİK CETVEL.................................................................................................................291 8 ORTAÖĞRETİM KİMYA 11 DERS KİTABI SAĞLIK VE GÜVENLİK UYARILARI öz g ü v e nli ve sivri uçlu c i ğ Ke le s im r s kin i G Deney yaparken aşağıda verilen güvenlik uyarılarını dikkate alınız. I sı tr Elek ik Ki m y a s all a r Ca m ara ç Kimyasal maddeler ve ateşle çalışırken ya da gözünüze zarar verme olasılığı bulunan tüm çalışmalarda gözlük kullanınız. Bıçakları ve diğer keskin araçları kullanırken dikkatli olunuz. Deney tüpü içinde bir şey ısıtmak istediğinizde tüpü maşa ile tutunuz. Tüpün ağzını kendinize ve arkadaşlarınıza doğru çevirmeyiniz. Isı kaynağını ya da sıcak maddeleri kullanırken dikkatli olunuz. Elektrikli araçları kullanırken aracın fişini pirize takmadan önce düğmesinin kapalı konumda ve ellerinizin kuru olmasına dikkat ediniz. İşiniz bittiğinde aracın düğmesini kapatınız. Fişi prizden çıkarırken bir elinizle fişi çekiniz, diğer elinizle de prizi tutunuz. Eğer bilmediğiniz bir madde kullanıyorsanız tehlikeli olabileceğini düşünerek hareket etmelisiniz. Derinize ya da giysilerinize kimyasal madde sıçrarsa öğretmeninize haber veriniz. Vücudunuza maddenin sıçradığı yeri bol suyla yıkayınız. Cam araçları kullanmadan önce temiz olup olmadığından, daha sonra kırığı ve çatlağı bulunmadığından emin olunuz. Cam araçları özenle kullanınız, kırmayınız. Cam kırıklarından kendinizi koruyunuz. Kırılan cam araçlardan öğretmeninizi haberdar ediniz. Isıya dayanıklı cam araçlar kullanınız. E l d iv e n Asit, baz vb. kimyasal maddelerle çalışırken eldiven kullanınız. Ö nlü k Kimyasal maddelerin üzerinize dökülmesini ve sıçramasını önlemek için önlük giyiniz. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 9 O R G A Nİ Z A SY ON ! Ünite İçeriği 1. ÜNİTE KİMYASAL REAKSİYONLAR VE ENERJİ Ders kitabınız 2 ve 4 saatlik programları kapsamaktadır. Bu nedenle sarı zeminle işaretli bölümler 2 saatlik programa devam eden öğrenciler tarafından takip edilmeyecektir. Bu bölümde ünite içindeki konu başlıklarına yer verilmiştir. ÜNİTE İÇERİĞİ 1. SİSTEMLER VE ENERJİ TÜRLERİ 2. SİSTEMLERDE ENTALPİ DEĞİŞİMİ 3. İSTEMLİLİK-İSTEMSİZLİK Ünite Girişi Bu bölümde ünitenin amacına, hedefine ve içerdiği konulara yer verilmiştir. ☞ÖRNEK : 19 I. N2(g) + O2(g) 2NO(g) II. NO2(g) NO(g) + 1/2O2(g) Kc1 = 4 Kc2 = 2 Yukarıda iki tepkimenin belirli sıcaklıktaki denge sabitleri verilmiştir. Aynı sıcaklıkta gerçekleşen; III. N2(g) + 2O2(g) 2NO2(g) Bölüm Başlığı Bu ünitede, fiziksel ve kimyasal olaylara eşlik eden enerji değişimlerini incelemek için öncelikle sistem ve ortam kavramları tanıtılmakta; enerjinin korunumu hakkındaki “Termodinamiğin 1. Kanunu”, entalpi kavramı ile birlikte sunulmakta; Hess Kanunu ve ona ilişkin uygulamalar işlenmektedir. Ayrıca, istemli / istemsiz değişimleri ayırt etmek için gerekli entropi kavramına giriş yapılarak “Termodinamiğin 2. Kanunu” anlamlandırılmakta; Gibbs Serbest Enerjisi üzerinden istemlilik tartışmaları verilmekte, “Termodinamiğin 3. Kanunu” ile ünite bitmektedir. 12 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bu bölümde bölüm başlığına ve konuya ilginizi çekmek amacıyla konu ile ilgili bir fotoğraf ve kısa açıklamalara yer verilmiştir. tepkimesinin denge sabitinin (Kc ) sayısal değeri kaçtır? 3 ✍ÇÖZÜM III. tepkime denklemi incelendiğinde II. tepkime denkleminin tersinin iki katı ile I. tepkime denkleminin toplamına eşit olduğu görülür. Bunun için I. tepkime denklemi aynen yazılır. II. tepkime denklemi ters çevrilir. Denklemdeki kat sayılar iki katına çıkarılır. Tepkime denklemleri alt alta yazılarak toplanır. İki tepkimenin toplamı olarak yazılabilen tepkimenin denge sabiti, toplanan tepkimelerin denge sabitlerinin çarpımına eşittir. N2( g ) + O2( g ) Kc = 4 2NO( g ) 1 1 + 2NO( g ) + O2( g ) 2NO2( g ) K c′ 2 = 2 2 Toplu tepkime denklemi : N2( g ) + 2O2( g ) 2NO2( g ) 1 K c3 = 4 · 2 K c 3 = K c1· K c′ 2 2 K c 3 = 1’dir. 5. Kimyasal Reaksiyonlarda Ürün Verimi Denge sabiti Kc’ nin büyüklüğü o tepkimenin dengeye varmadan önce ne kadar ilerleyebileceğinin bir ölçüsüdür. Yüksek bir Kc değeri, dengede ürünlerin yüksek, giren maddelerin düşük derişimde bulunması anlamına gelir. Aksine düşük bir Kc değeri dengedeki giren madde derişiminin ürün derişimine kıyasla fazla olması demektir. Genel olarak aA ( g ) + bB ( g ) cC ( g ) + dD( g ) dengesinde Kc ’ nin 1 olması dengede tepkimeye giren maddelerin yarısının ürüne dönüştüğünü yani verimin % 50 olduğunu gösterir. Kc değerinin büyümesi tepkimeye giren maddelerin ürünlere dönüşümünün daha fazla tamamlanması anlamındadır. Çok büyük bir Kc değeri tepkimenin tamamlanma düzeyinde ilerleyebildiğini gösterirken çok küçük bir Kc değeri çok az ürünün oluşabildiğini gösterir. Kc > 1 olması tepkimenin tamamlanma düzeyinde ve ürün veriminin yüksek olduğunu gösterir. Kc < 1 olması tepkimede çok az ürün oluşabileceğini gösterir. Kc = 1 olması tepkimede denge hâlinde girenlerin ancak yarısının ürüne dönüştüğünü gösterir. N2( g ) + H2( g ) 2 NH3( g ) ∆H˚ = –91,8 kJ tepkimesinin 25 ˚C’ta kısmi basınçlar yönünden denge sabiti Kp = 6,2 · 105 tir. Denge sabitinin büyük olması, tepkimeye giren maddelerin ürünlere dönüşüm SİSTEMLER VE ENERJİ TÜRLERİ BÖLÜM İÇERİĞİ Bölüm İçeriği 1. Sistem ve Ortam 2. Madde ve Enerji 3. Isı ve İş 4. Kimyasal Değişme ve Enerji Bu bölümde bölüm içindeki konu başlıklarına yer verilmiştir. oranının yüksek olduğunu gösterir. Ancak tepkime 25 ˚C’ta çok yavaş olduğundan NH3 üretim hızı çok düşüktür. Sıcaklığın artırılması tepkimenin dengeye ulaşma süresini kısaltır, ancak tepkime ekzotermik olduğu için denge, girenler lehine bozulur. Bu durumda NH3 miktarı daha da düşer. Örneğin, 500 ˚C sıcaklık ve 1 atm basınçta denge karışımının kütlece % 0,1’ i NH3 ’tır. Aynı sıcaklıkta basınç 1 atm’ den 700 atm’ e çıkarıldığında NH3 oranı % 47 ’ ye ulaşır. Buna göre NH3 verimini arttırmak için düşük sıcaklık ve yüksek basınç uygulamak gerekir. Bu arada ortama katalizör olarak alüminyum oksit (Al2O3), potasyum oksit (K2O) ve magnetit (Fe3O4) eklenirse ve ortamdan NH3 uzaklaştırılırsa denge ürünler yönüne kayar. Dolayısıyla NH3 üretim verimi % 60 oranına kadar yükselir. 112 ORTAÖĞRETİM KİMYA 11 DERS KİTABI işe dönüşebilir mi? Tersine, iş ve enerji türlerinin tamamının hiçbir kayıp olmadan ısı enerjisine dönüşmesi söz konusu mudur? Bu sorulara yanıt bulmak üzere “Rüzgar Gülü Yapalım” adlı etkinliği yapınız. 1. ETKİNLİK: RÜZGÂR GÜLÜ YAPALIM Etkinlik Mısır piramitlerinin yapımında kullanılan taşların taşınmasına ait temsilî resim Ömer Seyfettin’in “Forsa” adlı hikâyesini okumuş ve forsa adı verilen kürek mahkûmlarının kürek çekişleriyle ağır kadırgaların denizlerde yol aldığını öğrenmişsinizdir. Belkide Charlton Heston (Karltın Hestın)’ın baş rolde oynadığı Ben-Hur filmini seyretmiş ve savaş gemilerinin yüzlerce kürek mahkûmunun kürek çekişleriyle hedeflerine doğru yol aldığına tanık olmuşsunuzdur. Hatta televizyonlarda yayımlanan belgesellerde tonlarca ağırlıktaki taşların yukarıda verilen resimdeki gibi yüzlerce insan tarafından piramitlerin yapıldığı alanlara taşınmasını izlemişsinizdir. Geçmişte buharlı makineler henüz keşfedilmediğinden gemilerin yüzdürülmesi, ağır yüklerin taşınması vb. ağır işlerde insan ya da hayvan gücünden yararlanıldığını biliyor olmalısınız. 18. yüzyılın başlarından itibaren sanayide meydana gelen hızlı gelişmenin sonucu olarak artan iş gücü gereksiniminin insan ve hayvan gücüyle karşılanamaması, buharlı makinelerin ortaya çıkmasına neden oldu. İngiltere’ de, 1697 yılında Thomas Savery (Tamıs Sovri) ve 1712 yılında Thomas Newcomen (Tamıs Nivkomın) tarafından yapılan ilk buhar makineleri, 1765-1766 yıllarında James Watt (Ceymis Vat)’ın bu makineleri geliştirmesi ve buharın o güne kadar bilinmeyen özellikleri üzerine yaptığı araştırmalar bu alandaki önemli adımları oluşturmuştur. Birçok araştırmacının bu alana yönelmesiyle birlikte “termodinamik” bilimi ortaya çıkmaya başlamıştır. Termodinamik terimi ilk kez, İngiliz bilim insanı Lord Kelvin (Lord Kelvin) tarafından 1849 yılında yapılan bir yayında kullanılmıştır. Termodinamik sözcüğü, Latince therme (ısı) ve dynamis (güç) sözcüklerinden türetilmiştir. Termodinamik, fiziğin enerji ve enerjinin biçim (ısı, iş, mekanik, iç enerji, kimyasal enerji, elektriksel enerji) değiştirmesi ile uğraşan kolu olarak tanımlanabilir. Termodinamik otomobil, tren, gemi, uçak ve uzay araçlarına, elektrik güç santrallerinden iklimlendirme sistemlerine ve bilgisayarlara kadar çok geniş uygulama alanına sahiptir. Bu bölümde termodinamiğin temel ilkelerini öğreneceksiniz. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 13 Güvenliğiniz için Neler Gerekli? Bu bölümde verilen etkinlikleri laboratuvar ve sınıf ortamında öğretmeninizin gözetiminde yapınız. ❏ Kâğıt ❏ Cetvel ❏ Bunzen beki ❏ Bunzen kıskacı ❏ Şişe mantarı ❏ Makas ❏ Toplu iğne ❏ Üçayak ❏ Destek çubuğu ❏ Sacayak ❏ Tel kafes ❏ Termometre ❏ Su ❏ Kibrit ❏ İkili bağlama parçası ❏ Nuçe erlenmayer ❏ Tek delikli lastik tıpa Nasıl Yapacaksınız? 3 Hayat bilgisi, fen ve teknoloji derslerinde öğrendiğiniz şekilde kâğıttan bir rüzgâr gülü yapınız. 3 Rüzgâr gülünün kanatlarını, uçları tam merkeze gelecek şekilde toplu iğne ile sabitleyiniz. Toplu iğneyi şişe mantarına batırıp mantarı da bunzen kıskacına tutturarak resimdeki etkinlik düzeneğini kurunuz. Sağlık ve Güvenlik Uyarıları Bu bölümde verilen sağlık ve güvenlik uyarılarını dikkate alınız. Talimatlara uyunuz. 3 Nuçe erlenmayerine koyduğunuz suyun sıcaklığını termometre yardımıyla ölçünüz. Bu sıcaklığın oda sıcaklığına eşit olacağını hatırlayınız. 3 Bunzen bekini yakarak nuçe erlenmayerdeki suyu ısıtınız. Suyun sıcaklığı ve buharlaşma hızı arttıkça su kaynadıkça rüzgâr gülünün dönme hızının nasıl değiştiğini gözlemleyiniz. 3 Nuçe erlenmayerdeki su bir süre kaynadıktan sonra bunzen bekini söndürünüz. Su sıcaklığı oda sıcaklığına düşünceye kadar rüzgâr gülünün dönme hareketini izleyiniz. Etkinlik Sonu Soruları 1. Nuçe erlenmayerdeki suyun sıcaklığının değişmesine bağlı olarak rüzgâr gülünün hareketi nasıl değişti? 2. Suyun sıcaklığının değişmesine bağlı olarak rüzgâr gülünün hareketindeki değişmeyi nasıl açıklarsınız? 3. Oda sıcaklığında rüzgâr gülünün hareketsiz oluşunu nasıl açıklarsınız? 42 10 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ORTAÖĞRETİM KİMYA 11 DERS KİTABI leyemediyseniz bunun nedeni miliampermetrenin yeterince hassas bir ölçü aracı olmamasıdır. Bu etkinlik çok hassas ölçü araçları (mikroampermetre) ile tekrarlanırsa saf suyun çok az da olsa elektrik akımını ilettiği gözlenir (Resim 3.1). Suyun moleküler yapılı bir bileşik olduğunu, dolayısıyla saf hâlde elektrik akımını iletmemesi gerektiğini, bu Resim 3.1: Çokhassasaletlerlesafsuyun elektrik akımını ilettiği gözlenebilir. yüzden yalıtkan madde olarak tanımlandığını biliyorsunuz. O hâlde saf su elektrik akımını nasıl iletmektedir? Serbest elektronlara mı sahiptir yoksa iyonlarına mı ayrılmaktadır? Biliyor musunuz? Eksi elektrik yüküyle yüklü balonun su moleküllerini kendine doğru çekmesi suyun polar yapıda olduğunu gösterir. ŞEM ASI Daha önce öğrendiğiniz gibi su, H2O formülü ile gösterilen polar moleküllerden oluşan polar bir bileşik olup serbest elektron içermez. Dolayısıyla saf hâlde elektrik akımını iletmemesi beklenir. Ancak saf suyun çok çok az da olsa elektrik akımını iletiyor olması iyonlaştığını gösterir. Bu olay şöyledir: Polar bir su molekülü diğer bir su molekülünden bir H+ iyonu çekerek hidronyum iyonu (H3O+) hâline gelir. Bu arada bir H+ iyonu kaybeden molekül de hidroksit iyonu (OH–) hâlini alır. Bu olay suyun otoiyonizas- − KA = [HCOO ] [H ] [HCOOH] KA = X2 [HA ] 2 . 10− 4 = yonu olarak bilinir. + Örnek [H+] = [HCOO– ] = 1 · 10–3 mol / L X2 + Bu bölümde öğrendiğiniz bilgileri pekiştirmek amacıyla örnek sorulara ve çözümlerine yer verilmiştir. – Ksu = [H ] [OH ] 5 · 10−3 1 · 10–14 = [1 · 10–3] [OH– ] X 2 = 1· 10−6 [OH– ] = 1 · 10–11 mol / L’dir. X = 1 · 10−3 mol / L’dir. 5 · 10–3 mol HCOOH ’in 1 · 10–3 mol’ ü iyonlaşırsa 100 mol HCOOH ’in X ––––––––––––––––––––––––––––––––––––––––––– 1 · 10–3 · 100 X = –––––––––––– 5 · 10–3 b. X = %20 ’si iyonlaşır. ☞ÖRNEK : 3 Metil amin (CH3NH2) baz özelliği gösteren organik bir bileşiktir. Sulu çözeltisinde %20’si iyonlaştığına göre 1 · 10–2 M’lık çözeltisinde; Biliyor musunuz? a. OH–, CH3NH+3 ve H+ iyonlarının molar derişimlerini, b. Metil aminin çözeltisinin hazırlandığı sıcaklıktaki iyonlaşma sabitini (KB) hesaplayınız. Bazik Ortam ✍ ÇÖZÜM Bazik gerçekleşen yükseltgenme-indirgenme tepkime denklemlerinin yarı tepkime yöna. Metilortamda amin sudaki çözeltisinde aşağıdaki gibi iyonlaşır: – temiyle denkleştirilmesindeki kuralları da+ aşağıdaki tepkime denklemi üzerinde uygulayalım. CH CH3NH 3(suda) + OH(suda) 3NH2(s) + H2O(s) 1 · 10–2 M → SO42– X+MI – (Bazik ortam) S2O32– + I 2 X M ® Tepkime, iki3NH yarı2’in tepkime denklemi olarak yazılır. 100 M CH 20 M’ ı iyonlaşırsa 2– 1 · 10–2 MSCH ’in SO X 42– 2O33NH2→ ––––––––––––––––––––––––––––––––––––– → I – 1 · 10–2I 2· 20 X = –––––––––– ® Yarı tepkimeler, H ve O dışındaki atomların denkliğini sağlayacak uygun kat sayılar kullanılarak 100 denkleştirilir. X = 2 · 10–3 M’ı iyonlaşır. S2O32– → 2SO42– [OH– ] = [CH3NH+3] = 2 · 10–3 mol / L I 2 → 2I¯ Ksu = [H+ ] [OH– ] ® H–14 ve O atomlarının denkliği OH¯ ve H2O eklenerek sağlanır. 1 · 10 = [H+ ] (2 · 10–3) 2– 2– –12 + 10OH¯ 3 mol/L [H+ ] = 5 · S 102O ’dir.→ 2SO4 + 5H2O Okuma Metni ® Yarı tepkime denklemlerinin gerekli tarafına yeterli sayıda elektron eklenerek yük denkliği sağX2 (2 · 10−3 )2 ⇒ KB = ⇒ K B = 4 · 10−4 ’ tür. lanır. b. K B = [CH3NH2 ] 1· 10−2 S2O32– + 10OH¯ → 2SO42– + 5H2O + 8e¯ Yukarıda ulaştığımız KA ve KB denge bağıntıları incelenirse asit çözeltisinde [H3O+]’ nin büyük I 2 + 2e¯ → 2I¯ olması hâlinde asidin KA denge sabitinin de büyük olduğu, dolayısıyla asidin kuvvetli olacağı anlaşılır. ® Alınan ve verilen elektronların sayıca eşitliğini sağlamak için yarı tepkimelerin denklemleri uyEğer asit zayıf ise [H3O+ ] ve KA küçük olacaktır. Bazik çözeltilerde ise [OH– ]’ ne kadar büyükse bazın KB gun kat sayılarla çarpılır. denge sabiti o kadar büyük olacak, dolayısıyla baz da o kadar kuvvetli olacaktır. Tersine [OH– ] küçük ise O32–o +kadar 10OH¯ → 2SO42–baz + 5H + 8e¯ KB’nin sayısal değeriS2de küçük olacak, da2O zayıf olacaktır. 4 [ I 2 + 2e¯ → 2I – ] 132 ORTAÖĞRETİM 11 toplanır. DERS KİTABI ® Yükseltgenme ve indirgenme yarı tepkimelerinin denklemleri altKİMYA alta yazılıp S2O32– + 10OH¯ → 2SO42– + 5H2O + 8e¯ 4I 2 + 8e¯ → 8I – –––––––––––––––––––––––––––––––––––––––––– S2O32– + 4I 2 + 10OH– → 2SO42– + 8I – + 5H2O Böylece tepkime denklemi denkleştirilmiş olur. Ödev 1. Asidik sulu çözeltilerde gerçekleşen aşağıdaki 2. Bazik sulu çözeltilerde gerçekleşen aşağıdaki tepkime denklemlerini denkleştiriniz. tepkime denklemlerini denkleştiriniz. ➤ I 2 + H2S → H+ + I – + S ➤ I – + H2SO4 (Sıcak, derişik) → I 2 + SO2 ➤ Al + NO–3 → Al(OH)–4 + NH3 ➤ PbO2 + Cl– → ClO– + Pb(OH)–3 ➤ CuS + NO–3 → Cu2+ + SO42– + NO ➤ N2H4 + Cu(OH)2 → N2 + Cu ➤ Zn + NO–3 → Zn2+ + NH+4 ➤ ClO¯ + Fe(OH)3 → Cl– + FeO–2 ➤ CIO–3 + As2S3 → CI – + H2AsO–4 + SO42– ➤ Cu(NH3)42+ + S2O42– → SO32– + Cu + NH3 ➤ Cr2O72– + C2H4O → C2H4O2 + Cr3+ ➤ ClO2 + OH– → ClO–2 + ClO–3 202 Bu bölümde konu ile ilgili önemli ve ilginç bilgilere yer verilmiştir. ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bu bölümde verilen konu ile ilgili okuma metnini okuyunuz. Ödev Bu bölümde konu ile ilgili verilen ödevleri farklı kaynaklardan araştırınız, edindiğiniz bilgileri arkadaşlarınızla paylaşınız. Tartışma Bu bölümde konu ile ilgili olarak sınıfınızda arkadaşlarınızla tartışma yapabileceğiniz çeşitli çalışmalar yer almaktadır. Otoiyonizasyon olayının tepkime denklemi ve iyonların oluşumu, molekül modelleri ile aşağıdaki gibi gösterilebilir: + − H2O( s ) + H2O( s ) H3O( suda ) + OH( suda ) + – dönüşümünü gerçek1919 yılında Ernest Rutherford (Örns Radırford) ilk kez çekirdek tepkimesi H H leştirmiştir. Bu amaçla radyumdan elde ettiği alfa parçacığı ile bombardıman etmiş O O O O azot-14 izotopunu H + H + ve bu izotopu oksijen-17 izotopuna dönüştürmeyi başarmıştır. Bu arada +1 yüklü hidrojen çekirdekleriH H H nin meydana geldiğini görmüştür. Bu hidrojen çekirdekleri protondan ibarettir.H Suyun otoiyonizasyon denkleminde iyon sembollerinin sağ alt köşesine yay ayraç için4 14 tepkimesi 17 1 2He + 7N → 8O + 1H de “suda” ibaresinin konmasının nedeni, iyonun su ortamında bulunduğunu belirtmek içindir. Bu da Aksi kimyacıların yapmak“suda” istedikleri, biriyon elementten başka elde etme işlemidir. Benzer belirtilmedikçe ibaresi formülünün sağbir alt elementi köşesinde bulunmaması durumunda şekilde alüminyum-27 bile ortamın su olduğuizotopu anlaşılır.nötronla bombardıman edilmiş ve sodyum-24 izotopu elde edilebilmiştir. kaybetmiş H+ iyonu bir elektronunu 27 1 24 4 hidrojen atomudur. Dolayısıyla elektron kaybıyla geride kalan 13Al + 0n → 11Na + 2He protondur. Bu anlamda H+ iyonu bir protonu ifade eder. Ancak yazım kolaylığı bakımından H+ şeklinde 1932buyılında James Chadwick (Ceyms berilyum elementini α parçacıkları ile bombardıgösterilen sembol, gerçekte hidronyum (H3Kadvik), O+) iyonudur. man ederek karbon atomu ve nötron elde etmiştir. Bu sonuç Chadwick’in nötronları keşfetmesine yol Biliyor musunuz? açmıştır. 1000 4 4 ˚C’ta 9 12 suyun 1 1 L saf kütlesi 1000 g’dır. 1000 g su n = ≈ 55, 6 mol’dür. 2He + 4Be → 6C + 0 n 18 Dolayısıyla suyun derişimi 55,6 mol/L’dir. Nötronun keşfinden önce de çekirdek ve atomun yapısı hakkında çeşitli fikirler ortaya atılmış fakat hiçbiri çekirdek ve atomun bütün özelliklerini açıklayamamıştır. Nötronun keşfi bu konuda çok önemli bir adım olmuş ve çekirdeğin pro125 3. ÜNİTE: Çözeltilerde Denge nötron ve protondan meydana geldiği, çekirdek etrafında ise ton sayısına eşit sayıda elektron bulunduğu anlaşılmıştır. CNO (KARBON - AZOT - OKSİJEN) DÖNGÜSÜ Yıldızlar enerjilerini nükleer tepkimelerden alır. Güneş gibi yıldızlar enerjilerinin çoğunu iki hidrojen atomu çekirdeğini kaynaştırarak elde eder. Daha büyük kütleli yıldızlarsa enerjileriOKUMA METNİ nin çoğunu CNO (Karbon-Azot-Oksijen) döngüsüyle elde eder. CNO döngüsü özellikle azotun üretiminde önemli role sahiptir. Karbon-Azot-Oksijen ya da CNO döngüsünde, hidrojeni helyuma dönüştüren tepkime dizileri şöyledir: Nükleer enerji santralleri çok az radyoaktif madde tüketerek çok miktarda elektrik enerjisi üreten 3 Karbon-12 izotopu 1 proton yakalar veolarak gama ışıması yapar. tesislerdir. Nükleer enerji santrallerinin genel ilk yatırım maliyetleri yüksek fakat yakıt ve işletme 12 1 13 + 00γ 6C + 1H → 7Nmaliyetleri giderleri düşüktür. Yatırım elektrik üretim maliyetinin yarıdan fazlasına denk gelir. 3 Azot-13 izotopu kararsızdiğer olup 1enerji pozitron bozunması geçirerek pozitron ışıması yapar. bozunma sıraNükleer enerji santralleri santrallerine oranla daha tehlikesiz, daha Bu yararlı ve daha nötrino tesisi ( 00υ) saçılır. 10 dakikalık sonunda izotopuna dönüşür. çevrecidir.sında Her ortama enerji üretim gibi nükleer enerjiyarılanma tesisleri ömrü de çevre içinkarbon-13 bir risk taşır. Önemli olan 13 13 0 0 enerji üretiminde riski indirebilmek ve kontrol altında tutabilmektir. + +1alt e +düzeye 7N → 6Cen 0υ Nükleer enerji izotopu petrol, 1doğal ve kömürgama gibi ışıması yenilenemeyen enerji kaynaklarının yerini alabile3 Karbon-13 protongaz yakalayarak yapar ve azot-14 izotopuna dönüşür. 1 kaynağıdır. 14 0 cek iyi bir 13enerji Nükleer enerji santralleri normal çalışma koşullarında çevreye az miktarda 6C + 1H → 7N + 0γ radyoaktivite yayarlar. Bu miktarlar çevre ve insan sağlığına zarar vermez. Kaldı ki bazı termik santraller 3 Azot-14 izotopu 1 proton yakalayarak gama ışıması yapar ve oksijen-15 izotopuna dönüşür. çevreye nükleer 14 1santrallerden 15 0daha fazla radyasyon yayabilmektedir. Bunun çarpıcı örneği Yatağan Ter7N + 1H → 8O + 0γ mik Santralidir. Ayrıca ülkemiz gibi gelişmekte olan ülkeler açısından nükleer enerji teknolojisinin kaza3 Oksijen-15 izotopu 1 pozitron bozunması geçirerek pozitron ışıması yapar ve azot-15 izotopuna dönüşür. nılmasının yanı sıra enerjide dışa bağımlılıktan kurtulmak açısından nükleer santraller büyük önem taşır. Bu bozunma sırasında ortama nötrino saçılır. Nükleer santrallerin yukarıda sayılan avantajları yanında üzerinde durulması gereken sorun, oluş15 → 157Nsıfırlanamayan + +10e + 00υ 8O zaman maları hiçbir atıklardır. En önemli atık, yakıt çubuklarının harcanmasında orta3 Uranyum-235 Azot-15 izotopuizotopunun da 1 protonreaktörün yakalayarak alfa ışıması yapar ve karbon-12 dönüşür, döngü ya çıkar. çekirdeğinde yarılması sonucu izotopuna sezyum-137 ve stronsi- yenidengibi başlar. yum-90 izotopu radyoaktif ara ürünler oluşur. Sezyum-137’nin yarı ömrü 30 yıl, stronsiyum-90’ın ise 15 4 + 11H → 126de C +anlaşılacağı 28 yıldır. Yarı gibi bu radyoaktif ürünler yaklaşık 30 yıl süresince ışın yayarak 7Nömürlerden 2He başlangıç miktarını yarıya indirecek ve bu sürede çevreye zarar vermeye devam edecektir. Çevreye Yazarlar tarafından düzenlenmiştir. yayılan radyoaktif ışınlar biosfere, toprağa, suya büyük zararlar vererek insanlarda ölüme, kansere ve genetik bozukluklara neden olabilecektir. Öyleyse nükleer atıklar şimdi olduğu gibi gelecekte de tehlikeli bir kirletici olmayı sürdürecektir. 255 5. ÜNİTE: Çekirdek Bildiğiniz gibi 11 Kimyası Mart 2011’de Japonya’da meydana gelen deprem felaketi yanında Fukuşima nükleer santralinde saklanan atıklar da büyük bir nükleer felakete neden olmuştur. Bu yüzden nükleer santrallerin ürettiği atıklar bir süre daha sorun olmaya aday gözükmektedir. Bunun içindir ki son derece tehlikeli bu maddelerin doğaya zarar vermeyecek şekilde saklanması gerekmektedir. Kömürle çalışan elektrik santralinin ürettiği zararlı maddeler zamanla çevreye yayılır ve çevreyi kirletir. Nükleer santrallerde üretilen radyoaktif atıklar da giderek artar ve bunların imha edilememesi zamanla büyük tehlikeler yaratır. Tartışma Termik ve nükleer santrallerin avantaj ve dezavantajlarını öğrendiniz. Nükleer santrallerin hangi koşullarda kabul edilebilir bir çözüm olabileceğini düşünürsünüz? Bu konuyu araştırınız ve arkadaşlarınızla tartışınız. Radyoaktif elementler sıcaklık, basınç, fiziksel hâl (katı, sıvı, gaz) ya da bileşik hâlinde bulunma gibi etkenlere bağlı olmaksızın belirli bir hızla ışıma yapar. Ancak radyoaktif çekirdeklerin ışıma yaparak bozunma hızı elementten elemente değişir. Bozunma hızı birim zamanda örneğin, saniyede bozunan çekirdek sayısıdır ve bu hız başlangıçtaki çekirdek sayısı ile doğru orantılıdır. Bir radyoaktif çekirdeğin başlangıçtaki miktarının yarısının bozunması için geçen süre radyoaktiflikte oldukça önemlidir. Bu süreye yarılanma süresi (yarı ömür) denir ve çekirdeğin başlangıç miktarına bağlı değildir. Bir radyoaktif çekirdeğin yarılanma süresi ne kadar kısa ise bozunma hızı o kadar büyüktür. Ayrıca yarılanma süresi arttıkça çekirdeğin kararlılığı da artar. Bazı radyoaktif elementlerin yarı ömürleri Tablo 5.2’de verilmiştir. t ve bozunma sonrası kalan madde Radyoaktif bir izotopun geçirdiği yarılanma sayısı n = t1/2 m miktarı m = n0 bağıntılarıyla hesaplanır. Bağıntılarda n : yarılanma sayısı, t : geçen zaman, t1/2 : yarı 2 ömür, m: kalan madde miktarı, mo: başlangıçtaki madde miktarıdır. 262 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 4.ÜNİT E D EĞE R LE NDİR M E ÇA LIŞM A LA R I 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. A. Aşağıdaki soruları yanıtlayınız. 1. Asidik ortamda gerçekleşen aşağıdaki tepkimelerin denklemlerini denkleştiriniz. 1. Aşağıdaki yarı tepkimelerde elementlerin yükseltgenme basamaklarını belirleyerek indirgenen ve Bölüm Değerlendirme Çalışmaları yükseltgenen elementleri gösteriniz. a. H2O2(suda) → H2O(s) b. Cl2(g) → ClO–3(suda) c. ç. d. OH–(suda) → O2(g) CrO2– 4(suda) → Cr(OH)3(k) NO–3(suda) → NO(g) e. H2O2(suda) → O2(g) 2– f. SO2– 3(suda) → SO 4(suda) g. ClO–(suda) → Cl–(suda) 2. FeAsS + NO–3 → H3AsO4 + NO + SO42– + Fe3+ tepkimesi asidik ortamda gerçekleşmektedir. Tepkime denklemini değerlik (yük) yöntemiyle denkleştiriniz. 3. SO32– + CrO42– + H2O → SO42– + Cr(OH)–4 + OH– tepkimesi bazik ortamda gerçekleşmektedir. Tepkime denklemini değerlik (yük) yöntemiyle denkleştiriniz. Konu ile ilgili neler öğrendiğinizi belirleyebilmek için bu bölümde verilen değerlendirme çalışmalarını yapınız. elde edilmektedir. Cıvanın nitrat tuzundaki yükseltgenme basamağı kaçtır? (Hg : 108) ( ... ) 2. Elektrik enerjisi kullanılarak bileşiklerin bileşenlerine ayrılması olayına “elektrokimyasal ( ... ) 3. Bütün çözeltiler elektrik akımını iletir. ( ... ) 4. Elektrik akımı elektrolitlerde elektronlar vasıtasıyla iletilir. ( ... ) 5. Doğru akım kaynağından elektrotlara elektrik akımı verildiğinde elektrotlar arasında ( ... ) ( ... ) 7. Bir elektroliz olayında biriken madde miktarının atom kütlesine oranının tesir değerliği ile çarpımına “eş değer sayısı” denir. ( ... ) 8. Bir redoks tepkimesinde en az bir indirgen ve bir yükseltgen maddenin olması gerekir. ( ... ) 9. Asit-baz tepkimeleri de birer redoks tepkimedir. ( ... ) 10. Asidik ortamda redoks tepkimesi denkleştirilirken oksijeni az olan tarafa yeteri kadar H2O, diğer tarafa da yeteri kadar H+ eklenir. ( ... ) 11. Redoks tepkime denklemlerinin denkleştirilmesinde en son yapılacak işlem yük denkliğini sağlamaktır. 12. Faraday Yasaları’ndan yararlanılarak elektrik yükleri hesaplanamaz. 4. ÜNİTE: Elektrokimya a. CrO42– + S2– → S + CrO–2 ç. O2 + N2H4 → H2O2 + N2 b. ClO–3 + N2H4 → NO + Cl– d. Cl2 → Cl– + ClO–3 c. Au + CN– + O2 → Au(CN)–4 + OH– e. HXeO–4 → XeO64– + Xe + O2 3. Potasyum dikromatın (K2Cr2O7) asidik ortamda oksalik asit (H2C2O4) ile yükseltgenmesinden Cr3+ iyonu ve CO2 oluştuğuna göre net iyon tepkimesini yazarak denkleştiriniz. 4. OCl– iyonu S2O32– iyonu ile tepkimeye girerek OCl– iyonu Cl– iyonuna indirgenir. S2O32– iyonu ise SO42– iyonuna yükseltgenir. Net iyon tepkime denklemini yazarak denkleştiriniz. 5. Aşağıda yarı tepkime denklemleri verilen pil tepkimesinin standart pil potansiyelini bulunuz. BrO–3 + 6H+ + 6e¯ Br – + 3 H2O B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. elektrik alanı oluşur. + HNO2 → CO2 + NO – I2 + 2e¯ 2I 5. 1200 s’de 210 mA akım uygulandığında cıvanın bir nitrat tuzunun sulu çözeltisinden 0,26 g cıva 6. Bir değerlikli 1 mol iyonun yükü 1 Faradaydır. d. Sn + NO–3 → SnO2 + NO C2O42– 2. Bazik ortamda gerçekleşen aşağıdaki tepkimelerin denklemlerini denkleştiriniz. tepkimesi denklemini yarı tepkime yöntemiyle denkleştiriniz. pil” denir. ç. PbO2 + Cl– → PbCl2 + Cl2 c. 4. Cu2S + HNO3 → CuSO4 + Cu(NO3)2 + NO + H2O 1. Pozitif yüklü iyonlara katyon, negatif yüklü iyonlara anyon adı verilir. a. I – + HSO–4 → I 2 + SO2 b. Cr3+ + BiO–3 → Cr2O72– + Bi3+ ( ... ) E˚ = 1,44 V E˚ = 0,53 V 6. H2SO3 ile HOCl arasında gerçekleşen tepkimede S2O32– iyonu ve Cl2 gazı oluşmaktadır. Aşağıda Ünite Değerlendirme Çalışmaları Ünite ile ilgili öğrendiklerinizi pekiştirmek, konu ile ilgili eksikliklerinizi belirleyebilmek için bu bölümde verilen ünite değerlendirme çalışmalarını yapınız. yarı tepkimeleri verilen net tepkimenin istemli olup olmadığını tartışınız. 2– 2H2SO3 + 2 H+ + 4e¯ S2O3 + 3H2O 2HOCl + 2 H+ + 2e¯ Cl2 + 2H2O E˚ = 0,40 V E˚= 1,63 V 7. Standart koşullarda Ag ve Fe yarı hücrelerden oluşan pilin standart pil potansiyelini bulunuz. 8. Ag+(suda) + e– → Ag˚(k) E˚ = 0,80 V Fe3+(suda) + e– → Fe2+(suda) E˚ = 0,77 V HI çözeltisinin elektrolizinde elektrotların birinde 24 cm3 H2 gazı toplanıyor. Diğer elektrotta kaç g I2 oluşur? (I : 127) 9. 1 M AgNO3 çözeltisi elektroliz edildiğinde anot ve katotta hangi maddeler toplanır? Yarı tepkime denklemlerini yazarak açıklayınız. 10. Aşağıdakilerin her birini kısaca açıklayınız. a. Standart hidrojen elektrodu ç. Ticari piller b. Katodik koruma d. Tuz köprüsü c. Yakıt pili ( ... ) 205 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 239 4. ÜNİTE: Elektrokimya 11 1. ÜNİTE KİMYASAL REAKSİYONLAR VE ENERJİ ÜNİTE İÇERİĞİ 1.SİSTEMLER VE ENERJİ TÜRLERİ 2.SİSTEMLERDE ENTALPİ DEĞİŞİMİ 3.İSTEMLİLİK-İSTEMSİZLİK Bu ünitede, fiziksel ve kimyasal olaylara eşlik eden enerji değişimlerini incelemek için öncelikle sistem ve ortam kavramları tanıtılmakta; enerjinin korunumu hakkındaki “Termodinamiğin 1. Kanunu”, entalpi kavramı ile birlikte sunulmakta; Hess Kanunu ve ona ilişkin uygulamalar işlenmektedir. Ayrıca, istemli / istemsiz değişimleri ayırt etmek için gerekli entropi kavramına giriş yapılarak “Termodinamiğin 2. Kanunu” anlamlandırılmakta; Gibbs Serbest Enerjisi üzerinden istemlilik tartışmaları verilmekte, “Termodinamiğin 3. Kanunu” ile ünite bitmektedir. 12 ORTAÖĞRETİM KİMYA 11 DERS KİTABI SİSTEMLER VE ENERJİ TÜRLERİ BÖLÜM İÇERİĞİ 1.Sistem ve Ortam 2.Madde ve Enerji 3.Isı ve İş 4. Kimyasal Değişme ve Enerji Mısır piramitlerinin yapımında kullanılan taşların taşınmasına ait temsilî resim Ömer Seyfettin’in “Forsa” adlı hikâyesini okumuş ve forsa adı verilen kürek mahkûmlarının kürek çekişleriyle ağır kadırgaların denizlerde yol aldığını öğrenmişsinizdir. Belkide Charlton Heston (Karltın Hestın)’ın baş rolde oynadığı Ben-Hur filmini seyretmiş ve savaş gemilerinin yüzlerce kürek mahkûmunun kürek çekişleriyle hedeflerine doğru yol aldığına tanık olmuşsunuzdur. Hatta televizyonlarda yayımlanan belgesellerde tonlarca ağırlıktaki taşların yukarıda verilen resimdeki gibi yüzlerce insan tarafından piramitlerin yapıldığı alanlara taşınmasını izlemişsinizdir. Geçmişte buharlı makineler henüz keşfedilmediğinden gemilerin yüzdürülmesi, ağır yüklerin taşınması vb. ağır işlerde insan ya da hayvan gücünden yararlanıldığını biliyor olmalısınız. 18. yüzyılın başlarından itibaren sanayide meydana gelen hızlı gelişmenin sonucu olarak artan iş gücü gereksiniminin insan ve hayvan gücüyle karşılanamaması, buharlı makinelerin ortaya çıkmasına neden oldu. İngiltere’de, 1697 yılında Thomas Savery (Tamıs Sovri) ve 1712 yılında Thomas Newcomen (Tamıs Nivkomın) tarafından yapılan ilk buhar makineleri, 1765-1766 yıllarında James Watt (Ceymis Vat)’ın bu makineleri geliştirmesi ve buharın o güne kadar bilinmeyen özellikleri üzerine yaptığı araştırmalar bu alandaki önemli adımları oluşturmuştur. Birçok araştırmacının bu alana yönelmesiyle birlikte “termodinamik” bilimi ortaya çıkmaya başlamıştır. Termodinamik terimi ilk kez, İngiliz bilim insanı Lord Kelvin (Lord Kelvin) tarafından 1849 yılında yapılan bir yayında kullanılmıştır. Termodinamik sözcüğü, Latince therme (ısı) ve dynamis (güç) sözcüklerinden türetilmiştir. Termodinamik, fiziğin enerji ve enerjinin biçim (ısı, iş, mekanik, iç enerji, kimyasal enerji, elektriksel enerji) değiştirmesi ile uğraşan kolu olarak tanımlanabilir. Termodinamik otomobil, tren, gemi, uçak ve uzay araçlarına, elektrik güç santrallerinden iklimlendirme sistemlerine ve bilgisayarlara kadar çok geniş uygulama alanına sahiptir. Bu bölümde termodinamiğin temel ilkelerini öğreneceksiniz. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 13 1. Sistem ve Ortam Buzdolabının buzluğundan çıkardığınız buzu bir su bardağına koyup bir süre beklettiğinizde eridiğini günlük gözlemlerinizden bilirsiniz. Buzun neden eridiğini, buzu neyin erittiğini hiç düşündünüz mü? Buzun erimesine neden olan etken ısı enerjisi olabilir mi? Bir çaydanlığa su koyup ısıttığınızda bir süre sonra suyun kaynayarak buharlaştığına birçok kez tanık olmuşsunuzdur. Suyun neden kaynayarak buharlaştığını biliyor musunuz? Bir erlenmayere koyduğunuz bir miktar su üzerine birkaç damla sülfürik asit (H2SO4) damlatıp ağzını bir lastik tıpa ile kapatarak hafifçe çalkaladığınızda suyun ısındığına tanık olursunuz. Yine erlenmayerdeki su içine bir spatül dolusu amonyum nitrat (NH4NO3) kristali atıp ağzını lastik tıpa ile kapatarak çalkaladığınızda ise suyun hissedilir ölçüde soğuduğunu görürsünüz. Bu iki olayda suyun neden ısındığını ya da soğuduğunu tahmin edebilir misiniz? Bir termosa konan suyun sıcaklığının 3-5 saat sonra bile pek değişmediğini bilirsiniz. Termosa konan suyun sıcaklığının geçen süre içinde hemen hemen hiç değişmemesinin nedeni size göre ne olabilir, hiç merak ettiniz mi? Yukarıdaki örnek olaylar fiziksel ve kimyasal değişimleri ve bu değişmelerdeki enerji alış verişini içermektedir. Örneklerden de anlaşılacağı gibi fiziksel ve kimyasal değişmeler enerji alış verişi ile yürür. Bu tür değişmeler sırasındaki enerji dönüşümlerini inceleyen bilim dalı termodinamik olarak adlandırılır. “Termo” ısı, “dinamik” ise hareket anlamına gelmektedir. Termodinamik ısıdan hareket, başka bir deyişle iş elde etmek için yapılan çalışmalar sonucu doğmuştur. Gök cisimlerini barındıran yere uzay, uzayda bulunan bütün madde ve enerji biçimlerini içeren bütünün adına evren, evrenin incelenmek üzere seçilen bölümüne sistem, evrenin sistem dışında kalan ve sistemle ilişkili olan bölümüne ise ortam denir. Buna göre evren, sistem ve ortamdan oluşur (Resim 1.1). Evren Sistem Ortam Resim 1.1: Termodinamikte evren, ortam ve sistemden oluşur. Yukarıda örnek aldığımız olaylarda kullandığımız su bardağı, çaydanlık, erlenmayer ve termos içindekilerle birlikte bir sistemdir. Bu sistemlerin dışında kalan ve sistemin üzerinde etkisi olan oda ya da laboratuvar, ortamdır. Sistemi ortamdan ayıran yüzeyler sistem sınırıdır. Ortamın dışı ise evrendir. 14 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Sistemler; sıcaklıkları, hacimleri, basınçları ve bulundukları ortamla yaptıkları madde ve enerji alış verişleri dikkate alınarak açık, kapalı, izole, sıcaklığın sabit olduğu (izotermal), hacmin sabit olduğu (izokorik) ve basıncın sabit olduğu (izobarik) sistemler olarak gruplandırılır. Açık sistem: Sistem ile ortam arasında hem madde hem de enerji alış verişi vardır. Bu anlamda örnek olarak aldığımız su bardağı, çaydanlık, Resim 1.2.a’da verilen beherglas ve içindekiler açık bir sistemdir. Kapalı sistem: Sistem, ortamdan yalnızca madde alış verişine karşı yalıtılmış olup enerji alış verişine karşı yalıtılmamıştır. Sistemde madde miktarı sabit, enerjisi ise değişebilmektedir. Bu anlamda Resim 1.2.b’de verilen ağzı tıpa ile kapatılmış erlenmayer ve içindekiler kapalı bir sistem oluşturur. İzole sistem: Ortamla madde alış verişinin olmadığı ısı alış verişinin ihmal edilebilir düzeyde olduğu sistemdir (Resim 1.2.c). Her izole sistem, yapımında kullanılan izolasyon maddelerinin geçirgenlik/ yalıtkanlık özelliğine bağlı olarak çok az da olsa ısı geçişine izin verir. Bu da çoğu kez ihmal edilir. a. Açık sistem b. Kapalı sistem c. İzole sistem Resim 1.2: Bazı sistem örnekleri Sıcaklığın sabit olduğu (izotermal) sistem: Her tür enerji ve madde alış verişinin gerçekleştiği ancak sıcaklığın sabit tutulduğu sistemlerdir. İnsanlar, sıcakkanlı hayvanlar ve içinde saf bir sıvının kaynamakta olduğu bir kap sıcaklığı sabit olan sistemlere örnek verilebilir. Sabit hacimli (izokorik) sistem: Madde alış verişi olmadan hacmi sabit tutulan sistemlerdir. Hacmin sabit tutulduğu bu tür bir sisteme ısı (enerji) verildiğinde basınç ve sıcaklık yükselişi görülür. Düdüklü tencere gibi basınçlı kaplar hacmin sabit olduğu sistemlere örnek verilebilir. Sabit basınçlı (izobarik) sistem: Madde alış verişi olmadan basıncın sabit tutulduğu sistemlerdir. Bu tür sistemlerde enerji alış verişi söz konusu olmakla birlikte basınç değişimi yaşanmaz. Örneğin, bir buhar makinesi kazanındaki su, ısıtıldığında buharlaşır. Isıtma sürdürülürse buhar aşırı derecede ısınır ancak bu işlemler sırasında basıncın sabit kalması sistemdeki pistonun hareketiyle sağlanır. Bir sistemin sıcaklık, hacim, basınç, mol sayısı, kütle yoğunluk vb. bazı özellikleri sabit tutulursa sistemin bu hâldeki nitel (hâli, rengi, tadı, kokusu vb.) ve nicel (sıcaklık, yoğunluk, hacim vb.) özellikleri belirlenebilir. Örneğin, açık bir sistem içinde, 1 atm basınç altında ve 10 ˚C’ta 10 g su bulunsun. Sıcaklık dışındaki koşulları sabit tutarak sistemdeki suyu 20 ˚C’a kadar ısıtalım, sistemin son hâldeki nitel ve nicel özelliklerini belirleyelim. Sistemin ilk ve son hâli için belirlediğimiz özellikleri dikkate alırsak sistemin, dolayısıyla bu sistemdeki suyun son hâldeki enerjisinin ilk hâlindekinden büyük olduğunu söyleyebiliriz. Şimdi akla gelen soru şudur: “10 ˚C ’tan 20 ˚C’a kadar ısıtılan suyun enerjisi arttığına göre suyun ya da daha genel bir ifade ile maddelerin enerjisi nereden ileri gelmektedir, maddelerin enerjisi nasıl artmakta ya da azalmaktadır?” 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 15 2. Madde ve Enerji Bir maddenin kütlesinden, yer çekiminden ve durumundan kaynaklanan enerjiye potansiyel enerji denildiğini, potansiyel enerjiye sahip bir maddenin durumunda bir değişme başladığında söz gelimi gerilmiş yay serbest bırakıldığında yerden yüksekte duran bir cisim serbest düşmeye başladığında sahip olduğu potansiyel enerjinin Ek = 1/2 m · v2 bağıntısıyla hesaplanabilen kinetik enerjiye dönüşmeye başladığını biliyorsunuz. Bu durum maddelerin hem potansiyel hem de kinetik enerjiye birlikte sahip olduklarını gösterir. Maddelerin sahip oldukları potansiyel ve kinetik enerjileri toplamına mekanik enerji denir. Şimdi yer düzleminde durmakta olan bir bardak suyu ele alalım. Bu durumda suyun potansiyel ve kinetik enerjilerinin toplamı (mekanik enerjisi) sıfırdır. Bu su ısıtılıp sıcaklığı 10 ˚C’tan 11 ˚C’a çıkarılırsa suyun konumu değişmediğinden mekanik enerjisi de değişmeyecektir. Ancak suya dışarıdan ısı enerjisi verildiğinde sıcaklığı ve toplam enerjisi arttığına göre suyun, potansiyel ve kinetik enerji dışında farklı bir enerji türüne daha sahip olması gerekir. Maddelerin sahip olduğu bu enerji türü, iç enerjidir. O hâlde bir maddenin ya da genel anlamıyla bir sistemin sahip olduğu enerji, o madde ya da sistemin mekanik (potansiyel + kinetik) ve iç enerjileri toplamına eşittir. Bir sistemin iç enerjisi, o sistemdeki taneciklerin elektronik, dönme, titreşim, öteleme (yer değiştirme), çekirdek ve bağ enerjilerin toplamından ileri gelir. İç enerji U sembolü ile gösterilir. Elektronik enerji: Elektronların kendi atom çekirdekleri etrafında dönmesinden ileri gelen kinetik enerjileri ile başka atomların çekirdekleriyle olan etkileşmelerinden doğan potansiyel enerjilerin tümü elektronik enerjisi olarak adlandırılır (Şekil 1.1.a). Dönme enerjisi: Bir molekül, kütle merkezinden geçtiği varsayılan bir eksen boyunca dönerse bu dönme sonucu bir enerjiye sahip olur. Bu enerji dönme enerjisi olarak bilinir (Şekil 1.1.b). Titreşim enerjisi: Bir molekülde yer alan atomlar çekim kuvvetlerinin etkisiyle birbirlerini çeker. Aralarındaki uzaklık belirli bir değere ulaştığında itme kuvvetleri etkin olmaya başlar ve itme kuvvetleri atomları mümkün olduğunca birbirinden uzaklaştırır. Böylece çekme ve itme kuvvetleri bir titreşim hareketine, bu titreşim hareketi de kinetik enerjinin ortaya çıkmasına neden olur. Ortaya çıkan bu kinetik enerji titreşim enerjisi olarak adlandırılır (Şekil 1.1.c). Öteleme (yer değiştirme) enerjisi: Taneciklerin (atom ya da moleküllerin) bir noktadan diğer bir noktaya yaptıkları düzgün doğrusal hareketler sonucu kazandıkları kinetik enerji öteleme enerjisi olarak bilinir (Şekil 1.1.ç). Çekirdek enerjisi: Atomun çekirdeğindeki protonlar ve nötronlar arasındaki etkileşimlerden oluşan enerji çekirdek enerjisi olarak adlandırılır. z Ar Ar Karbon Oksijen y a b x Ar c Ar ç Şekil 1.1: İç enerjiyi oluşturan hareketler a. Elektron-proton itme ve çekme hareketleri, b. Bir molekülün kütle merkezinden geçtiği varsayılan bir eksen boyunca yaptığı dönme hareketi, c. Bir molekülde yer alan atomların birbirlerini itmesi ve çekmesi ile ortaya çıkan titreşim hareketi, ç. Gaz taneciklerinin öteleme hareketleri 16 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bağ enerjisi: Atomlar herhangi bir molekülü oluşturmak üzere bir araya geldiklerinde aralarındaki itme çekme kuvvetleri dengelenerek birbirine bağlanırlar. Dolayısıyla kimyasal bir bağ, bu bağı oluşturan atomlar arasındaki itme ve çekme kuvvetlerinden kaynaklanan belirli bir enerjiye sahip olur. Kimyasal bir bağın sahip olduğu bu enerji bağ enerjisi olarak nitelendirilir. Maddelerin mekanik ve iç enerjiye sahip olduklarını, iç enerjinin elektronik, dönme, titreşim, öteleme, çekirdek ve bağ enerjisinden kaynaklandığını öğrendiniz. Maddenin katı, sıvı ve gaz hâllerinde bu enerjilerin nasıl değiştiğini hiç düşündünüz mü? Katı hâlde madde moleküllerinin titreşim hareketleri kısıtlıdır (Şekil 1.2.a). Sıvı hâlde ise moleküller katı hâle göre oldukça serbest titreşim ve dönme hareketleri yapar. Bu nedenle sıvıların ısıtılmaları sırasında moleküllerinin enerjileri, dolayısıyla titreşim ve dönme hareketleri de artar (Şekil 1.2.b). Sıvıdaki moleküllerin titreşim kinetik enerjileri yeterli ise bu enerji moleküller arası çekim kuvvetini yenerek sıvının gaz hâline geçmesine neden olur. Gaz hâlinde moleküller sıvı hâldekine göre birbirinden daha uzak konum alır (Şekil 1.2.c). Moleküller arası çekim kuvvetleri daha da azalır. Bu nedenle moleküllerin potansiyel enerjileri gaz hâlinde daha büyük olur. Suyun katı, sıvı ve gaz hâlinde moleküllerinin konumları Şekil 1.2’de şematik olarak gösterilmiştir. İnceleyiniz. a. Katı b. Sıvı c. Gaz Şekil 1.2: Suyun üç hâli ve bu hâllerde moleküllerinin konumları Gaz hâlindeki bir maddede tanecikler (atom ya da molekül) “öteleme”, “dönme” ve “titreşim hareketi” olmak üzere üç tür hareket yapabilir ve bu nedenle de tanecikler üç tür kinetik enerjiye sahip olabilir. Gaz hâlindeki bir madde taneciği uzayda bir yerden başka bir yere hareket ederse öteleme hareketi yaptığı söylenir. Bununla ilgili olarak bir öteleme kinetik enerjisi vardır. Eğer tanecik kütle merkezi etrafında dönme hareketi yapıyorsa bir dönme kinetik enerjisi bulunur. Gaz tanecikleri moleküler yapıda ve molekülü oluşturan atomlar, molekülün kütle merkezine göre yaklaşma ve uzaklaşma hareketleri yapıyorsa burada bir titreşim hareketi ve titreşim kinetik enerjisi söz konusudur. Eğer gaz hâlindeki tanecik asal gazlardaki gibi (He, Ne, Ar) tek atomlu ise sadece öteleme hareketi yapacağından iç enerjisini öteleme enerjisi belirler. Bu tanecik, iki atomdan oluşmuşsa bir moleküldür ve 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 17 molekül geometrisi çizgiseldir. Dolayısıyla böyle bir molekül Şekil 1.3.a, b, c’ de gösterildiği gibi öteleme, dönme ve titreşim hareketleri yapabilir ve bu hareketlerden dolayı da kinetik enerjisi vardır. y z a. Öteleme x b. Dönme c. Titreşim Şekil 1.3: İki atomlu çizgisel bir molekülün a. Öteleme: Molekül bir doğrultuda hareket eder. b. Dönme: Molekül y ve z eksenleri etrafında dönebilir (x ekseni bağ doğrultusudur.). c. Titreşim: Kimyasal bağlar atomların hareketi ile bir yay gibi gerilip sıkışabilir. Eğer molekül CO2, N2O ve C2H2 gibi üç ya da daha çok atomlu olup molekül geometrisi çizgisel ise iki atomlu moleküller gibi üç tür hareket yapabilir; öteleme, dönme ve titreşim kinetik enerjilerine sahip olabilir (Şekil 1.4). Ancak üç ya da daha fazla atomlu çizgisel molekül geometrisine sahip bir molekül üç tip titreşim hareketi yapabildiğinden aynı mol kütlesine sahip iki atomlu molekülden daha fazla enerjiye sahiptir. z z z x x y x y y Şekil 1.4: CO2 moleküllerindeki titreşim hareketlerinin top-yay modeli ile şematik gösterimi H2O, H2S ve SCl2 gibi üç atomlu ve açısal moleküller üç ayrı eksende öteleme, titreşim ve dönme hareketi yapar (Şekil 1.5). Bu hereketlerden dolayı kinetik enerjiye sahiptirler. Ayrıca bu molekülleri oluşturan atomlar da üç ayrı eksen üzerinde üç ayrı hareket yapabildiklerinden bu tür moleküllerin iç enerjileri üç eksen üzerinde hareket yapabildiklerinden aynı mol kütleli ve çizgisel geometrideki (tek eksen) üç ya da daha çok atomlu moleküllerinkinden daha büyüktür. z z y y y y y x z z y z z x x x a. Öteleme x x b. Dönme z z z y y x y x x c. Titreşim Şekil 1.5: Açısal geometriye sahip moleküllerin öteleme, dönme ve titreşim gibi bazı hareketlerinin topçubuk modeli ile şematik gösterimi 18 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. Isı ve İş Bir cisim, uygulanan kuvvet doğrultusunda yer değiştirirse bu eylemin “iş” olarak tanımlandığını 7. sınıf fen ve teknoloji, 9. sınıf fizik derslerinde öğrenmiştiniz. İş yapabilmek için kuvvet kullanmanın gerekli olduğunu biliyorsunuz. Kuvvetin ana kaynağı enerji olduğuna göre enerji ile iş arasında nasıl bir ilişki olabileceğini tahmin edersiniz? Enerji ile iş arasında bir ilişki kurmak üzere size, içinde belirli miktarda su bulunan ve bu suyun karıştırılabilmesini sağlayan bir çark düzeneğinin yer aldığı Şekil 1.6 ’daki gibi sabit hacim ve basınca sahip yalıtılmış bir sistem verildiğini düşününüz. Çark yardımıyla sistemdeki suyu bir m F ∆x Şekil 1.6:Isı ile iş arasındaki ilişkiyi araştırmak için deney düzeneği süre karıştırdığınızı farz ediniz. Suda, diğer bir ifadeyle sistemde hangi değişikliklerin meydana gelmesini beklersiniz? Hem birbirine hem de çarkın kanatlarına sürten moleküllerinden dolayı suyun ısınabileceğini düşünür müsünüz? James Joule (Ceymis Jul) Şekil 1.6’ da şematik yapısı verilen böyle bir sistemi düşünmüş, çarkı çevirmek üzere kas kuvveti yerine bir makara sistemine bağlı kütlenin düşmesinden doğan mekanik işten yararlanmıştır. Bu amaçla makara sistemine bağlı kütleyi düşürerek w = F · ΔX bağıntısıyla hesaplanabilen mekanik işin sistemde oluşturduğu sıcaklık değişiminden yararlanarak işin enerjiye (ısıya) dönüşümünü hesaplamıştır. Böylece mekanik işin enerjiye (ısıya), enerjinin de mekanik işe dönüşebildiğini deneysel olarak göstermiştir. Ayrıca yaptığı deneylerden aynı miktardaki mekanik işin hep aynı miktarda ısıya dönüştüğü sonucuna varmıştır. P atm Enerji ya iş ya da ısı şeklinde sistemle orP atm tam arasında aktarılır. Isı, sistemle ortam arasında sıcaklık farkından dolayı, iş ise sıcaklıktan bağımsız başka yollarla aktarılan enerjidir. Mekanik işe örnek olarak gazların genleşmesi ya da sıkışması ∆V sonucu yapılan işi verebiliriz Şekil 1.7’ de görüldüğü gibi sabit basınçta silindirdeki bir gaz ısıtılırsa iç basıncı dış basınca eşit olana kadar gaz genleşir yani hacmi artar. Gaz bu durumda sabit dış basınca karşı hacim değişimi işi yapar. BuIsıtma öncesi Isıtma sonrası rada sisteme verilen ısının (Qp) bir kısmı işe (w) Şekil 1.7: Piston hareketi ile iş yapılır. dönüşmüş bir kısmı da sistemin iç enerjisini (U) artırmıştır (Sıcaklıktaki değişim iç enerjisinin arttığını gösterir.). Sabit basınçta sisteme ısı verilerek sistemin ortama iş yapmasının sağlandığı yukarıdaki gibi olaylarda iş, ısı ve iç enerjisi arasındaki ilişkiyi; Qp = ∆U + w şeklinde gösterebiliriz. Eşitlikte ısı, sabit basınçta alındığından Qp , iç enerji ise değeri doğrudan ölçülemediğinden ∆U (iç enerji değişimi olarak) şeklinde simgelenmiştir. Basıncın sabit tutulduğu kapalı bir sistemde ısı ile iş arasındaki ilişkiyi inceledik. Şimdi de bu sistemde basınç yerine hacmi sabit tutarsak ısı ile iş arasında nasıl bir ilişki ortaya çıkacağını örnek bir olay üzerinde irdeleyelim. Bu amaçla bir miktar gazı bir silindir içinde hapsederek kapalı bir sistem oluşturalım. Bu sisteme ortamdan ısı verelim veya sistemi soğutalım. Her iki durumda da sistemin hacmi değişmeyeceğinden (∆V = 0) hem sistem tarafından hem de sisteme iş yapılamayacaktır. Yani iş sıfır 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 19 olacaktır (w = 0). Ancak sisteme verilen ısı ile iş yapılmadığından bu enerji sistemde iç enerji olarak depolanacaktır. Dolayısıyla sisteme verilen ısı iç enerji değişimine (∆U) eşit olacaktır. Yani Qv = ∆U’dur. Eşitlikte Qv sabit hacimdeki ısıyı göstermektedir. Sistemden ısı alındığında da yine hacim değişmeyeceğinden iş yapılmayacak ancak sistemin iç enerjisi azalacaktır. Bu sonuca göre sabit hacim ve sabit basınç altında gerçekleşen olaylarda ısı değişimi; Qv = ∆U Qp = ∆U + w olacaktır. Bu eşitliklere göre Qv ≠ Qp’dir. Qv ve Qp değerlerinin eşitsizliği maddelerin ısınma ısılarının (c) farklılığından ileri gelir. Bu da gaz hâlindeki moleküllerin öteleme hareketi yapıyor olmalarından kaynaklanır. Bir sistem ortamla ısı ve iş olmak üzere genellikle iki yolla enerji alış verişi yapar. Bu alış verişlerde sistemin iç enerjisi değişir (İç enerji bir sistemin ısı alması ya da vermesi ile sisteme iş yapılması ya da sistemin iş yapması durumunda değişir.). Biz bu durumu; ∆U = Q + w formülüyle gösteririz. Bu eşitlikte sisteme giren enerji pozitif işaretlidir. Çünkü sistem ısı alırsa Q > 0, sisteme iş yapılırsa w > 0’dır. Buna karşın sistemden çıkan enerji negatif işaretlidir. Yani sistem ortama ısı veriyorsa Q < 0, sistem ortama iş yapıyorsa w < 0’dır (Şekil 1.8). Ortam Q>0 Sistem + + Ortam Q<0 Sistem – İç enerji ∆U (+) w>0 – İç enerji ∆U (–) w<0 Sistem ısı alır. Sistem üzerine iş yapılır. Sistem ısı verir. Sistem iş yapar. Şekil 1.8: Sisteme alınan ısının işareti pozitif, sistemden ortama verilen ısının işareti negatiftir. Q ve w için kullanılan işaretlerin anlamını öğrendikten sonra Qp = ∆U + w eşitliğinin neden böyle yazıldığını açıklayabilir misiniz? Yukarıdaki formülden ve açıklamalardan şu sonucu çıkarabiliriz. Enerji yok olmaz başka bir enerji türüne dönüşür. Enerji sistemden ortama ya da ortamdan sisteme verildiği için evrenin toplam enerjisi değişmez. Bu ifadeler Termodinamiğin Birinci Yasası olarak adlandırılır. 1 mol kükürt ile 1 mol oksijen gazının tepkimesindeki enerji değişimini Termodinamiğin Birinci Kanunu yönünden inceleyelim. S(k) + O2(g) → SO2(g) sisteminde girenlerdeki ve ürünlerdeki moleküllerin iç enerji değerlerini ölçemeyiz. Ancak iç enerjideki değişimi ∆U = ∆U(girenler)– ∆U(ürünler) bağıntısından yararlanarak hesaplayabiliriz. Bu tepkime ortama ısı verir. Öyleyse ürünlerin enerjisi girenlerin enerjisinden daha düşüktür. ∆U değeri negatiftir. Tepkimede 20 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ortama verilen ısı, sistemin enerjisinin bir bölümünün ısıya dönüştüğünü gösterir. Enerji sistemden ortama verildiğinden toplam enerji (evrenin enerjisi) değişmez (∆U(ortam) + ∆U(sistem) = 0). Toplam enerjinin değişmemesi alınan ve verilen enerjilerin eşit olduğunu gösterir. Bir sistem belirli miktarda enerji değişimine uğrarsa evrenin geri kalan kısmı yani ortam da o miktarda enerji değişimine uğrar. Bir yerde enerji kazanımı varsa bu enerji başka bir yerdeki enerji kaybından sağlanır. ☞ÖRNEK : 1 Bir depoda bulunan su, elektrik motoruyla döndürülen bir palet yardımıyla karıştırılıyor. Paleti çevirmek için 4500 kJ’lük bir enerji harcanıyor ve bu sırada depodan ortama 2000 kJ’ lük enerji salınıyor. Su ve depo bir sistem olarak düşünülürse sistemin iç enerji değişimini bulunuz. ✍ÇÖZÜM Sistemde potansiyel ve kinetik enerji değişimi olmadığından iç enerji değişimi ∆U = Q + w bağıntısıyla hesaplanır. Ancak sistem ortama iş yaptığından w’nun işareti negatif alınır. Q = 4500 kJ ∆U = Q – w ’dur. w = 2000 kJ ise ∆U = 4500 – 2000 ∆U = 2500 kJ bulunur. ☞ÖRNEK : 2 Sabit basınç altında 10 g su buharının sıcaklığı 100 ˚C ’tan 110 ˚C ’ a çıkarıldığında sistemde serbestçe hareket edebilen pistonun 12 J’lük iş yaptığı belirleniyor. Buna göre sistemdeki iç enerji değişimini bulunuz. (cp = 0,48 cal/g ˚C, 1 cal = 4,184 J) ✍ÇÖZÜM Sistemde potansiyel ve kinetik enerji değişimi olmadığından iç enerji değişimi ∆U = Q + w bağıntısıyla hesaplanır. Ancak sistem ortama iş yaptığından w’nun işareti negatif alınır. Su buharının aldığı ısı:Qp=m · cp · ∆t İç enerji değişimi:∆U=Q – w Qp=10 · 0,48 · (110 – 100)∆U=200,83 – 12 Qp=48 cal = 48 · 4,184 ∆U=188,83 J bulunur. Qp= 200,83 J’dür. ☞ÖRNEK : 3 Ortamdan sisteme 6400 J ’lük ısı verildiğinde sistemin iç enerjisi 800 J artmaktadır. Buna göre yapılan işin değerini bulunuz. ✍ÇÖZÜM Q= 6400 J ∆U= 800 J ise iç enerji değişimi; Sistemde potansiyel ve kinetik enerji değişimi olmadığından iç enerji değişimi ∆U = Q + w bağıntısıyla hesaplanır. Ancak sistem ortama iş yaptığından w’nun işareti negatif alınır. ∆U= Q – w ’dur. 800= 6400 – w ⇒ w = 5600 J olarak bulunur. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 21 ☞ÖRNEK : 4 Sabit basınç altında hareketli ve sürtünmesiz bir pistonun yer aldığı silindir içindeki karbon dioksit gazı genleşirken 72 J’lük ısı almakta, sistem ise 360 J ’lük iş yapmaktadır. Buna göre sistemin aldığı ısının ve yaptığı işin işaretini belirleyiniz, iç enerji değişimini bulunuz, sonucu yorumlayınız. ✍ÇÖZÜM Silindir içindeki karbon dioksit gazı dışarıdan ısı alarak genleştiğinden Q’nun işareti pozitif, sistem iş yaptığından w’nun işareti negatiftir. Q= +72 J w= –360 J’dür. ∆U= Q – w’dur. ∆U= +72 – 360 ⇒ ∆U = –288 J’dür. Bu sonuca göre sistemin iç enerjisi azalmış, hacmi artmış ve sistem ortama iş yapmıştır. 4. Kimyasal Değişme ve Enerji İki ya da daha fazla maddenin etkileşerek yeni madde ya da maddelere dönüşme sürecine kimyasal değişme denildiğini, kimyasal değişmenin atom ve moleküllerin birbiriyle birleşmesi ya da birbirlerinden ayrılması sonucu gerçekleştiğini biliyorsunuz. Her hareketin ve maddede meydana gelen değişmelerin enerji alış verişi ile yürüdüğünü, maddedeki değişmeler gibi kimyasal değişmelere de bir enerji değişiminin eşlik ettiğini 9. sınıf fizik ve kimya derslerinizde öğrendiniz. Örneğin; H2(g) + I2(g) + 53 kJ → 2HI(g) H2O(s) + 285,8 kJ → H2(g) + 1/2O2(g) 3/2O2(g) + hν → O3(g) tepkimeleri ortamdan enerji alarak, H2(g) + 1/2O2(g) → H2O(s) + 285,8 kJ C(k) + O2(g) → CO2(g) + 393,5 kJ Mg(k) + 1/2O2(g) → MgO(k) + hν tepkimeleri ise ortama enerji vererek gerçekleşir. Kimyasal değişmeler sırasında gerçekleşen enerji değişimleri daha öncede belirtildiği gibi Termodinamiğin Birinci Yasası’ na uyar. Bu nedenle kimyasal değişmeler, ister canlı hücresinde isterse bir fabrikadaki reaktörde gerçekleşsin ya ortamdan ısı alırlar ya da ortama ısı verirler. Sabit sıcaklık ve basınçta gerçekleşen bir kimyasal değişmede sistem ile ortamı arasında alınıp verilen ısı miktarına tepkime ısısı ya da entalpi denir. Entalpi değişimi ∆H ile gösterilir. Buraya kadar öğrendiklerinizden termodinamiğin, ısı ile iş ve enerji türleri arasındaki ilişkiyi de inceleyen, enerjinin şekil değiştirmeleriyle ilgilenen bir bilim dalı olduğu sonucuna varmışsınızdır. Temel uğraş alanı ısı, iş ve diğer enerji türleri arasındaki ilişkiyi incelemek olan termodinamik, genel anlamda güç üretimi, ısı-enerji değişimi ve maddelerin özellikleri arasındaki ilişkileri irdeler. Bu anlamda buhar ve gaz türbinleri, benzin ve dizel yakıtla çalışan motorlar, soğutma sistemleri ve ısının faydalı işe dönüştürülmesi konuları termodinamik kapsamında ağırlıklı yer alır. 22 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Termos, iç içe geçmiş ve aralarındaki hava vakumla boşaltılmış cam kaplardan oluşur. Termos yapılırken cam kaplar arasındaki havanın boşaltılmasının nedeni ne olabilir? 2. Etil alkol, suyun molar ısı kapasitesinin yaklaşık yarısına sahiptir. Eğer özdeş kaplarda bulunan eşit kütlede etil alkol ve suya aynı miktarda ısı verilirse göreceli sıcaklık değişimleri nasıl olur? 3. Silindir içindeki bir gaz 20 J ısı absorbluyor ve genleşerek 12 J iş yapıyor. Buna göre sistemin iç enerji değişimini hesaplayınız. 4. Bir sistemin iç enerjisi 125 J azalırken aynı zamanda sistem 54 J ısı alıyor. Bu durumda sistem mi iş yapar yoksa sisteme mi iş yapılır? Yapılan işin miktarı nedir? 5. 15,6 kJ ısı alan bir sisteme yapılan iş 1,4 kJ olduğuna göre sistemin iç enerji değişimi nedir? 6. Aşağıda verilenlerden her birinin iç enerji değişimini hesaplayınız. a.Q = +100 kJ,w = –65 kJ b. Q = –65 kJ, w = –20 kJ c. Q = –47 kJ, w = +88 kJç. Q = +82 kJ, w = +47 kJ d.Q = +47 kJ, w = 0 kJ B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Sabit sıcaklıkta her türlü enerji alış verişinin gerçekleştiği sistemler izotermaldir. ( ... ) 2. Moleküller; dönme, titreşim ve öteleme enerjisine sahip olabilir. ( ... ) 3. Molekül hareketlerini etkileyen ve sıcaklık değişimlerine neden olan enerji türü “ısı ( ... ) enerjisi” olarak bilinir. 4. Moleküldeki atom sayısı arttıkça molekülün iç enerjisi azalır. ( ... ) 5. Ortamdan sisteme ısı geçişi olduğunda sistemin iç enerjisi azalır. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Sabit basınç altında sürtünmesiz ve hareketli bir pistonla silindir içindeki helyum gazı sıkıştırılırken 240 J’ lük iş yapılmaktadır. Bu arada sistem ortama 60 J’lük bir enerji vermektedir. Buna göre sistemdeki iç enerji değişimi J cinsinden aşağıdaki seçeneklerin hangisinde doğru verilmiştir? A) 300 B) 180 C) 150 D) 120 E) 90 2. Kapalı bir sistemden ortama 1800 J’lük ısı verilmektedir. Ortamdan da sisteme 1500 J eş değerinde iş yapıldığına göre sistemin iç enerjisindeki değişme miktarı aşağıdakilerden hangisidir? A) –300 3. B) –900 C) –1300 D) –1500 E) –3300 Bir sistemin iş, ısı alış verişi ve enerji değişimi ile ilgili olarak; I. Bir sistemin iç enerjisi artıyorsa ∆U’nun işareti pozitif, azalıyorsa negatiftir. II. Bir sistem iş yapıyorsa w’nun işareti negatif, sisteme iş yapılıyorsa işareti pozitiftir. III. Bir sistem ortamdan ısı alıyorsa Q’nun işareti pozitif, veriyorsa negatiftir. İfadelerinden hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız III C) I ve II D) II ve III E) I, II ve III 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 23 4. Bir sistemdeki ısı ve işin giriş çıkışları aşağıdaki şekillerde verilmiştir: Q1 Q2 Sistem ısı kazanıyor. w1 Sistem ısı kaybediyor. w2 Sisteme iş yapılıyor. Sistem tarafından iş yapılıyor. Buna göre ısı ve işin işaretleri için aşağıdakilerden hangisi doğrudur? Q1 Q2 w1 w2 –––––––––––––––– A) B) C) D) E) + – + – + – + – + – + + – + – – – – + + BUHARIN GÜCÜ* Kapalı kapta kaynayan suyun buharının kabın kapağını yukarıya doğru ittiğini bilirsiniz. Çünkü kapalı bir kapta oluşan buhar genleşmesi için gerekli olan yeri bulamayınca içinde bulunduğu kabın çeperlerine bir basınç yapar. Buharın bu özelliğinden yararlanıla­rak yapılan ve buhar OKUMA METNİ kullanarak ısı enerjisin­den mekanik iş üreten makinelere buhar makinesi denir. Buhar makinelerinin başlıca iki türü vardır: 1. Pistonlu buhar makineleri 2. Buhar türbinle­ri Pistonlu buhar makinesinde buhar bir silindir içine yerleştirilmiş olan pistonu ileri geri hareket ettirir. Buhar türbininde ise bir ana mil üzerine oturtulmuş, çevresinde kanat­lar olan bir tambur vardır. Bu kanatlar üzerine püskürtülen basınçlı buhar tamburu döndürür. İlk buhar türbinini Mısır’da, İsken­deriyeli Heron (Heron) tasarlamıştır. Ancak yaklaşık 2000 yıl önce yaşamış bir Yunanlı olan Heron’un makinesinin yalnızca bir oyuncak olarak kul­lanıldığı sanılmaktadır. 1698’de İngiliz mühendisi Thomas Savery (Tamıs Savri) buharla çalışan ve madenlerdeki yer altı sula­rını dışarı pompalayan bir makine yaptı. “Yangın tulumbası” denen bu makine, soğu­duğu zaman yoğunlaşan buharın hacminin küçülmesi ilkesiyle çalışıyordu. Savery’nin makinesinde buhar, yumurta biçiminde bir kaba alınıyor; giriş musluğu kapatıldık­tan sonra, kabın dış yüzeyine püskürtülen soğuk suyla soğutuluyordu. Soğuyan buhar yoğunlaşıp hacmi küçülünce ortaya çıkan boşluk kap içinde bir vakum oluşturuyor ve madenden dışarı atılmak istenen su, hava basıncının etkisiyle kaba bağlı bir borudan bu boşluğa doluyordu. Suyun geldiği borunun musluğu kapatıldıktan sonra buhar giriş musluğundan kaba yeniden buhar veriliyor, kap içindeki su, gelen buharın basıncıyla bir başka borudan maden ocağının dışına atılıyordu. Savery’nin makinesinin verimi düşüktü, çok fazla buhar boşa gidiyordu. 1690’da Fransız Deniş Papin (Deniş Papin) farklı bir buhar makinesi tasarla­mıştı. İngiliz Thomas Newcoman (Tamıs Nivkamın) onun tasarı­ sını geliştirdi. Newcoman’in 1705’te yaptığı makinede, kazandan gelen buhar düşey bir silindir içinde bulunan pistonun altındaki boşluğa alınıyor, sonra silindirin içine soğuk su fışkırtılarak buhar yoğunlaştırılıyor, pisto­nun altındaki bölümün basıncı düşürülüyordu. Bu durumda atmosfer basıncı, daha önce buharın etkisiyle yukarı doğru hareket etmiş olan pistonu yeniden aşağıya itiyordu. Piston aşağı inince silindirin üst bölümüne dolan su, 24 ORTAÖĞRETİM KİMYA 11 DERS KİTABI pistonun yeniden yukarı çıkmasıyla başka bir borudan dışarı atılıyordu. Suyun geldiği ve gittiği borulardaki vanalar sırayla açılıp kapa­narak suyun geldiği yöne geri gitmesi engelle­niyordu. Newcoman’in makinesi 1720’den 1800’e kadar madenlerde yaygın olarak kulla­nıldı; ama çok fazla buhar boşa gidiyor, çok kömür tüketiliyordu. Hem Savery’nin hem de Newcoman’ın ma­kineleri yavaş çalışıyor ve bir işçinin sürekli olarak vanaları açıp kapaması gerekiyordu. Vana açıp kapamakta çalıştırılan çocuk işçi­lerden Humphrey Potter (Hempri Potır), gidip rahatça oyna­yabilmek için vanaları pistonun hareketiyle açıp kapayan bir düzenek geliştirdi. Piston koluna bağlanan ipler ve sürgülerden oluşan bu düzenek daha sonra basitleştirilerek bütün buhar makinelerinde kullanıldı. 1763’te İskoçya’nın Glasgow kentinde James Watt (Ceymis Vat) adlı bir alet yapımcısı bir Newcoman buhar makinesini onarırken pistonun her gidiş gelişinde silindirin ısıtılıp soğutulmasının yol açtığı enerji kaybını ön­leyebileceğini düşündü. Bu kaybı önlemek için en iyi yol, içinde buhar bulunan silindiri sürekli olarak sıcak tutmak ve sürekli olarak soğuk olacak ayrı bir bölümde buharı yoğun­laştırmaktı. Buharın yoğunlaştırıldığı bu bö­lüm (yoğunlaştırıcı) sürekli olarak suyla soğutulacaktı. İçinde buhar bulunacak silindir ise soğumaması için içinde gene buhar bulunan ikinci bir silindir içine yerleştirilecekti. Watt’ın bu buhar makinesinde, buhar kaza­nından gelen buhar bir vanadan geçerek silindire üstten giriyordu. Silindirin üst ve alt bölümlerini birleştiren bir boru üzerinde den­ge vanası denen ikinci bir vana vardı. Bu vana silindirin üst ve alt bölümleri arasında buhar geçişini denetliyordu. Silindirin alt bölümünü yoğunlaştırıcıya bağlayan boru üzerindeki üçüncü vana egzoz vanasıydı. Üç vana da açık durumda ve piston silindirin üst bölümündeyken, buhar kazanından silindire buhar verili­yor, daha sonra denge vanası kapatılıp yoğun­laştırıcıdaki buhar soğutuluyordu. Yoğunlaştırıcıdaki soğutma işlemiyle buhar yoğunlaşıyor, buharın yoğunlaşmasıyla oluşan boşluğa silin­dir pistonunun altındaki bölümden buhar gitmesi sağlanıyordu. Böylece silindir pistonunun altındaki bölümün­de basınç azalıyor ve piston, üzerindeki bu­har basıncının etkisiyle aşağı doğru iniyordu. Daha sonra buhar vanası ve egzoz vanası kapatılıp denge vanası açılıyor, böylece üs­tündeki ve altındaki basınç eşitlenerek pisto­nun eski konumuna geri dönmesi sağlanıyor­du. Sonra makineye yeniden buhar verilerek aynı süreç yineleniyordu. Sisteme eklenmiş olan bir hava pompası da yoğunlaştırıcıda biriken suyu ve içeri sızan havayı dışarı atıyordu. Watt 1781’de pistonun ileri geri gidip gelme hareketini, pompalar dışında kalan çoğu makine için gerekli olan dönme hareke­tine dönüştüren çeşitli yöntemler uyguladı. Bu yöntemlerin en basiti, bisikletlerde de uygulanan ve binicinin dizlerinin aşağı yukarı inip çıkma hareketini dönme hareketine dö­nüştüren krank düzenidir. Watt, makinenin hızını denetim altında tutmak için fırıldak gibi dönen bir regülatör (düzenleyici) kullan­dı. Regülatörün bir mil çevresinde dönen kollan makinenin hızı arttıkça dışa doğru savrularak açılıyor ve bu açılma buhar giriş vanasının kısılmasını sağlıyordu. Makine ya­vaşladığı zaman da bunun tersi oluyordu. Watt’ın makineleri Newcoman’ınkilere göre bir ilerlemeydi; çünkü Watt’ın makinelerinde enerji kaybı çok daha azdı. 1800’lerde Newcoman makinelerini kullanmanın çok pahalı bulunduğu Cornwall kalay madenlerinde, su pompalama işinde Watt’ın 40 kadar makinesi kullanılmaktaydı. *Yazarlar tarafından hazırlanmıştır. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 25 SİSTEMLERDE ENTALPİ DEĞİŞİMİ BÖLÜM İÇERİĞİ 1.Entalpi Değişimi 2.Bileşiklerin Oluşma Isıları 3.Tepkime Isılarının Hesaplanması 4. Bağ Enerjileri ve Tepkime Entalpisi Günlük yaşantımızda sürekli olarak enerji değişimleri ile karşılaşırız. Evimizi, okulumuzu ya da çayımızı ısıtmak için gereksinim duyduğumuz enerji, kömürün, hava gazının ya da doğal gazın yanmasından sağlanır. Motorlu araçlar, benzinin ya da mazotun motorda yanmasıyla açığa çıkan enerjiden yararlanarak hareket eder. Yaşamımızın sürekliliği, aldığımız besinlerin biyokimyasal tepkimelere uğraması sonucu oluşan enerjiye bağlıdır. Canlıların iş yapabilme yeteneği, yine bu enerjiden ileri gelir. Bu bölümde hangi kimyasal değişmelerde ortamdan enerji alınacağını, hangilerinde ortama enerji verileceğini neden ve niçinleriyle birlikte öğreneceksiniz. Kimyanın fiziksel ve kimyasal değişmelerdeki ısı alış verişini inceleyen dalı termokimya adıyla anılır. Kimyasal tepkimeler yürürken ortam ile sistem arasındaki ısı alış verişlerinin ölçümü ve hesaplanması termokimya konularını oluşturur. 26 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. Entalpi Değişimi Önceki bölümde hacmi sabit bir silindir içine kapatılmış bir miktar gaza (gaz hacmi sabit, piston hareketsiz) verilen enerjinin sistemin iç enerji değişimine eşit olduğunu öğrendiniz. Sistemde hacim sabit olduğundan hacim değişiminin sıfır (∆V = 0) olduğunu, hacim değişimi olmadığı için de iş yapılmadığını (w = 0), dolayısıyla enerji değişiminin iç enerji değişmesine eşit olduğunu (Qv = ∆U) biliyorsunuz. Eğer söz konusu sistemde hacim yerine gaz basıncı sabit tutulursa sistemdeki piston, sürtünmesiz hareket eder ve bir iş yapar. Dolayısıyla daha önce öğrendiğiniz gibi sistemin kazandığı ısı, iç enerji değişimi ile yapılan işin toplamına (Qp = ∆U + w) eşit olur. Buna göre iç enerjiyle ilişkili Qp ’ ye eşit yeni bir özellik tanımlanabilir. Bu özellik entalpi değişimi (∆H) adını alır. Entalpi iç enerji ile işin toplamıdır (H = U + w). Bir sistemin entalpisindeki değişim ise ∆H = ∆U + w şekilde ifade edilebilir. Bu eşitlik ile Qp = ∆U + w eşitliği karşılaştırıldığında sabit basınçta bir sistemin ortama verdiği ya da ortamdan aldığı ısının entalpi değişimine eşit olduğu görülür (Qp = ∆H). Kimyasal değişmelerde enerji değişimi genellikle ısı değişimi şeklinde olmakla beraber bazen bu değişim mekanik ya da elektrik enerjisi şeklinde de ortaya çıkabilir. Bir tepkimede enerji değişiminin hangi şekilde ortaya çıkacağı tepkime koşullarına bağlıdır. Örneğin mazot, bir sobada yakılırsa kimyasal enerji ısı enerjisine, bir dizel motorda yakılırsa mekanik ve ısı enerjisine dönüşür. Seyreltik sülfürik asit çözeltisi içine çinko ve bakır çubuklar daldırılıp birbirine bir iletkenle bağlanırsa tepkimede kimyasal enerji, ısı ve elektrik enerjisine dönüşür. Ancak çinko ve bakır çubuklar bir iletkenle birbirine bağlanmazsa bu kez tepkimede hidrojen gazı yanında ısı enerjisi elde edilir. Kimyasal tepkimelerin çoğu sabit basınç altında gerçekleştiğinden tepkimelerdeki ısı alış verişi tepkime entalpisi ya da tepkime ısısı olarak adlandırılır. Eğer bir tepkime standart koşul olarak kabul edilen 298 K sıcaklık ve 1 atm basınç koşullarında gerçekleşirse tepkimedeki ısı alış verişine standart tepkime entalpisi denir. Standart tepkime entlapisi ∆H˚ ile gösterilir. Gaz hâlindeki maddelerin yer aldığı kimyasal değişmelerde basınç genellikle sabit tutulduğundan (hacim değiştiğinden) sistemin iç enerji değişimi, tepkimede alınan ya da verilen ısıdan (tepkime entalpisinden) az da olsa (∆H = ∆U + w) farklı olur. Ancak birçok kimyasal tepkimede hacim değişimi gözlenmez. Bu nedenle ∆V = 0 olduğundan iş de sıfır olur. ∆V = 0 olduğundan iç enerji ile entalpi arasında küçük bir enerji farkı ortaya çıkar. Söz gelimi 1 mol H2 gazının yanmasından su buharı oluştuğunda iç enerji değişimi ∆U = –240,6 kJ, entalpi değişimi ∆H = –241,8 kJ olarak gerçekleşir. Kimyasal değişmelerde katı, sıvı ve gaz hâlindeki maddeler genellikle bir arada bulunduğundan hacim değişimi ihmal edilebilir ölçüde küçüktür. Bu nedenle kimyasal değişmelerdeki ısı değişimi, iç enerji değişimine, dolayısıyla tepkime entalpisine eşit (Qp = ∆U = ∆H) kabul edilir. Sabit basınçta bir sistemin ortama verdiği ya da ortamdan aldığı ısı miktarına bağlı olarak sistemin entalpisi de değişir. Sabit basınçta sistem ortamdan enerji alırsa sistemin entalpisi artar. Sistemden ortama enerji verilirse sistemin entalpisi azalır. Ortama ısı vererek gerçekleşen tepkimelere ekzotermik tepkime denir. Mg(k) + 1/2O2(g) → MgO(k)∆H˚ = –601,6 kJ C(k) + O2(g) → CO2(g)∆H˚ = –393,5 kJ MgO ve CO2 ’in oluşma tepkimelerinin denklemlerinde ∆H˚ nin işaretinin eksi olması, bu tepkimeler gerçekleşirken ortama ısı verildiğini dolayısıyla tepkimelerin ekzotermik olduğunu gösterir. Tepkimelerde entalpideki azalma, tepkimelerin ortama ısı vermesi ile gerçekleşir. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 27 Ekzotermik bir tepkime olan magnezyumun yanma tepkimesinin (Resim 1.3) bağıl entalpi diyagra- Entalpi, H mı Grafik 1.1’de verilmiştir. İnceleyiniz. Girenler Mg(k) + 1/2O2(g) ∆H˚ = –601,6 kJ Ürünler M g O(k ) Zaman Resim 1.3:Mg’un yanması ekzotermik bir tepkimedir. Grafik 1.1: Magnezyumun yanma tepkimesinin bağıl entalpi diyagramı Ortamdan ısı alarak gerçekleşen tepkimelere endotermik tepkime denir. H2(g) + I 2(k) → 2HI(g)∆H˚ = +53 kJ H2O(s) → H2(g) + 1/2O2(g)∆H˚ = +285,8 kJ HI’ün oluşum, H2O’yun elektrolizle ayrıştırılması tepkimesinin denkleminde ∆H˚ nin işaretinin artı olması, bu tepkimeler gerçekleşirken ortamdan ısı alındığını, dolayısıyla tepkimelerin endotermik olduğunu gösterir. Endotermik bir tepkime olan suyun elektrolizi tepkimesinin (Resim 1.4) bağıl entalpi diyagramı Grafik 1.2’de verilmiştir. İnceleyiniz. Entalpi, H Ürünler H2(g) + 1/2O2(g) ∆H˚ = +285,8 kJ Girenler H2O(s) Zaman Resim 1.4: Suyun elektrolizi Grafik 1.2: Suyun elektroliz tepkimesinin bağıl entalpi diyagramı 2. Bileşiklerin Oluşma Isıları Entalpi, iç enerjiye bağlı bir özelliktir ve mutlak değeri ölçülemez. Bu nedenle elementlerin standart koşullardaki [Standart koşul: 1 atm basınç ve 298 K (25 ˚C) sıcaklık; normal koşul: 1 atm basınç ve 273 K (0 ˚C) sıcaklık değerlerini ifade eder.] oluşum entalpileri keyfî olarak “sıfır” kabul edilir. Standart koşullarda birden çok allotropu olan elementlerin en kararlı allotroplarının oluşum entalpileri esas alınır. Bileşiklerin oluşum entalpileri, standart koşullarda belirlenir. Bir bileşik için belirlenen bu değere standart oluşum entalpisi (oluşma ısısı) denir. Bir bileşiğin standart oluşum entalpisi, o bileşiğin 1 mol ’ünün standart koşullarda elementlerinden oluşması sırasındaki entalpi değişimidir. Buna molar standart oluşum entalpisi de denir. Bir mol bileşiğin standart oluşum entalpisi genellikle “∆Hf̊ ” simgesiyle gösterilir. Bazı maddelerin standart oluşum entalpileri Tablo 1.1’ de verilmiştir. İnceleyiniz. 28 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tablo 1.1: Bazı maddelerin standart oluşum entalpileri (∆Hf̊ kJ/mol) Madde ∆Hf̊ kJ/mol Ag(k) 0,0 Ag2O(k) –31,1 Madde ∆Hf̊ kJ/mol Madde ∆Hf̊ kJ/mol MgO(k) –601,6 –272,0 Mg(OH)2(k) –924,5 Fe(k) FeO(k) 0,0 AgBr(k) –100,4 Fe2O3(k) –824,2 N2(g) 0,0 AgCl(k) –127,0 Fe3O4(k) –1118,4 N(g) 472,70 AgI (k) –61,8 H (suda) + 0 Na(k) 0,0 Ag2S(k) –32,6 H(g) 218 Na(g) 107,5 Al2O3(k) –1675,7 H2(g) 0,0 BaCl2(k) –855,0 HBr(g) –36,3 Na2CO3(k) –1130,7 BaSO4(k) –1473,2 HCl(g) –92,3 Na2SO4(k) –1387,1 CaCO3(k) –1207,6 HCl(suda) –167,2 NaOH(k) –273,3 NaOH(suda) –469,6 NH3(g) –45,9 CaO(k) –634,9 HF(g) Ca(OH)2(k) –985,2 HI (g) CuS(k) CuSO4(k) –53,1 H2CO3(suda) 26,5 –699,65 NaCl(k) –425,6 NH4Cl(k) –314,4 –365,6 –771,4 H2O(s) –285,8 NH4NO3(k) C(elmas) 1,9 H2O(g) –241,8 NO(g) C(grafit) 0,0 H2O2(s) 716,68 H2O(k) C(g) –411,2 91,3 –187,8 N2O(g) 81,6 –291,5 NO2(g) 33,2 –20,6 O2(g) 0,0 O(g) 249,2 142,7 CO(g) –110,5 H2S(g) CO2(g) –393,5 H2S(suda) –39,7 CH4(g) –74,6 H2SO4(s) –814,0 O3(g) C2H2(g) 227,4 H2SO4(suda) –909,27 OH–(suda) C2H4(g) 52,4 HNO3(suda) –206,6 S(rombik) 0,0 C2H6(g) –84,0 –230 KBr(k) –393,8 S(monoklinik) 0,3 C6H6(g) 82,93 KCl(k) –436,5 SO2(g) –296,8 C6H6(s) 49,0 KClO3(k) –397,7 SO3(g) –395,7 CH3OH(s) –239,2 KOH(k) –424,8 ZnO(k) –350,5 CH3OH(g) –201,0 Mg(k) ZnS(k) –206,0 C2H5OH(s) –277,6 MgCl2(k) –641,3 C12H22O11 –2226,1 MgCO3(k) 0,0 –1095,8 α-D-glikoz α–D-fruktoz –1273,3 –1265,6 H2S, HI ve CO2 bileşiklerinin oluşum tepkimelerinin denklemleri ve standart oluşum entalpileri aşağıdaki gibi gösterilir: (1) H2(g) + S(k) → H2S(g) ∆H˚ = – 20,6 kJ (2) H2(g) + I 2(k) → 2HI(g) ∆H˚ = + 53 kJ (3) C(k) + O2(g) → CO2(g) ∆H˚ = – 393,5 kJ 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 29 (1) ve (3) numaralı tepkimelerde elementlerinden 1 mol H2S(g) ve CO2 sentezlenmiş olup H2S(g) ’ün standart molar oluşum entalpisi, ∆Hf̊ H S = – 20,6 kJ/mol, CO2 ’in ise ∆Hf̊ CO = –393,5 kJ/mol ’dür. 2 (g) 2(g) (2) numaralı tepkimede elementlerinden 2 mol HI(g) sentezlendiğinden, HI’ün standart molar oluşum entalpisini bulmak için tepkimenin entalpi değerinin yarısı alınır. Buna göre HI(g) ’ün standart molar oluşum entalpisi, ∆Hf̊ HI = + 26,5 kJ/mol olarak bulunur. (g) Tablo 1.1’i incelediğimizde suyun farklı hâllerinin oluşum entalpilerinin farklı (H2O(g) = –241,8 kJ/mol ve H2O(s) = –285,8 kJ/mol) olduğu görülür. Bu farklılık neden kaynaklanır? Buharlaşma endotermik bir olay olduğundan 100 ˚C’taki su buharı 100 ˚C’taki sudan daha büyük entalpiye sahiptir. Buhar yoğunlaşırken ortama ısı verir. Bir maddenin sıvısının ve buharının entalpileri farkı buharlaşma entalpisini verir. Suyun gaz ve sıvı hâllerinin oluşum entalpileri arasındaki farktan (44 kJ/mol) buharlaşma entalpisi hesaplanabilir. Hesaplanan bu değer suyun ölçülen buharlaşma entalpisine (40,67 kJ/mol) çok yakındır. Bağ oluşması sırasında ortama enerji verilir. Maddenin sıvı hâlinde moleküller arası etkileşim gaz hâline göre daha kuvvetli olduğundan ve suyun sıvı hâlinde hidrojen bağları oluştuğundan suyun sıvı hâlinin oluşum entalpisi, gaz hâlinin oluşum entalpisinden yüksektir. 3. Tepkime Isılarının Hesaplanması Karbon elementi yeterince oksijen bulunmayan ortamda yakıldığında karbon monoksit oluşur. Karbon monoksit kararsız bir bileşik olduğundan tekrar oksijenle tepkimeye girer ve karbon diokside dönüşür. Bu iki tepkimenin denklemleri şöyledir: C(k) + 1/2O2(g) → CO(g) ∆Hf̊ CO(g) + 1/2O2(g) → CO2(g) ∆Hf̊ 1 2 = –110,5 kJ = –283 kJ Eğer karbon elementi yeterince oksijen içinde yakılarak doğrudan karbon dioksit oluşturulursa tepkimede açığa çıkan ısının –393,5 kJ olduğu görülür. C(k) + O2(g) → CO2(g)∆Hf̊ 3 = –393,5 kJ Karbon monoksit ve karbon dioksit oluşmasına ait tepkimelerin denklemleri toplanırsa toplam tepkime denkleminin karbon dioksidin doğrudan karbon ve oksijen elementlerinden elde edilmesi denklemine eşit olduğu görülür (∆Hf̊ 3 = ∆Hf̊ 1 + ∆Hf̊ 2 ). Dikkat edilirse toplam tepkime, ara tepkimelerin toplamına sadece atomlar bakımından değil, aynı zamanda tepkime ısıları bakımından da eşittir. Bu sonuç şöyle genelleştirilebilir. “Bir tepkime, iki ya da daha fazla tepkimenin cebirsel toplamı olarak ifade edilebiliyorsa toplam tepkimenin ısısı da o tepkimelerin ısılarının cebirsel toplamına eşittir.” Bu genelleştirme tepkime ısılarının toplanabilirliği ya da Hess Yasası olarak bilinir. Karbon elementinin yanma tepkimeleri yeniden irdelenirse karbon elementi yeterince oksijen bulunmayan bir ortamda yakıldığında CO oluştuğu ve ortama 110,5 kJ enerji verildiği, yeterince oksijen bulunan ortam içinde yakıldığında ise CO2 oluştuğu ve ortama 393,5 kJ enerji verildiği görülür. Her iki yanma tepkimesinden farklı miktarlarda enerji elde edilmesi kömür ve petrol gibi fosil yakıtların tam yanmaları için gerekli eş değer miktardan daha az hava ile yakılmasının neden akıllıca olmayacağını gösterir. Hess Yasası’nın uygulamasına amonyum nitrat bileşiğinin elde edilişi de örnek verilebilir. Amonyum nitrat oluşurken amonyak ve nitrik asit önce suda çözünür, sonra tepkime verir. NH3( g ) → NH 3( suda ) Hf˚1 = − 35, 4 kJ HNO3( s ) → HNO 3( suda ) + NH 3( suda ) + HNO 3( suda ) → NH4NO3( suda ) NH3( g ) + HNO3( s ) → NH4NO3( suda ) 30 , kJ Hf˚2 = − 311 + , kJ Hf˚3 = − 511 Hf˚4 = −1 117, 6 kJ ORTAÖĞRETİM KİMYA 11 DERS KİTABI Amonyum nitratın elde edilişi için bir başka yol şöyledir: Önce NH3 gazı ile sıvı HNO3’ten katı NH4NO3 elde edilir. Sonra bu katı, su ile sulu çözelti hâlinde NH4NO3 ’a dönüştürülür. NH3( g ) + HNO3( s ) → NH4 NO3(k ) + Hf˚1 = −144, 9 kJ NH 4NO3(k ) → NH4NO3( suda ) + NH3( g ) + HNO3( s ) → NH4NO3( suda ) Hf˚2 = + 26, 4 kJ Hf˚3 = −118, 5 kJ Görüldüğü gibi NH4NO3 oluşumuna ait farklı tepkimelerin toplam entalpileri, hemen hemen birbirinin aynıdır. Bu sonuç bize tepkime entalpisinin, tepkimenin izlediği yola bağlı olmadığını gösterir. Bir tepkimenin ters yönde gerçekleştirilmesi hâlinde tepkime entalpisinin nasıl değişeceği sorusu akla gelebilir. Eğer bir tepkime gerçekleşirken ortamdan ısı alıyorsa ters yöndeki tepkime ortama ısı verir. Bu duruma suyun oluşması ve ayrışması tepkimeleri örnek verilebilir. H2(g) + 1/2O2(g) → H2O(s) ∆Hf̊ 1 = –285,8 kJ H2O(s) → H2(g) + 1/2O2(g)∆Hf2 = +285,8 kJ ’ dür. Hess Yasası’nın tepkime ısılarının toplanabililirliği ilkesinden hareketle suyun elementlerinden oluşmasına ait tepkimenin ısısı, elementlerine ayrışmasına ait tepkimenin ısısı ile toplanırsa bu toplam sıfır olur. Örnekte belirtilen durum termokimyanın bir başka yasası ile ilgilidir. Bu yasa şöyle özetlenebilir: “Bir bileşiğin bileşenlerden oluşması sırasındaki tepkime entalpisi, bu bileşiğin bileşenlerine ayrışmasındaki tepkime entalpisinin ters işaretlisine eşittir.” Hess Yasası’nın tepkime entalpilerinin toplanabilirliği ilkesinden yararlanarak hem tepkimelerin ölçülemeyen entalpileri hem de tepkime entalpileri hesaplanabilir. Hesaplamalarda tepkimeye girenlerle oluşan ürünlerin standart oluşum entalpileri kullanılır. Bir tepkimenin ısısı, tepkimede oluşan ürünlerin standart oluşum entalpileri toplamı ile tepkimeye giren maddelerin standart oluşum entalpileri toplamı arasındaki farka eşittir. ∆H˚ = ∑ ∆Hf̊ ürünler – ∑ ∆Hf̊ girenler aA + bB → cC + dD genel tepkimesi için entalpi değişimi şöyle genelleştirilebilir: ∆H˚ = [c · ∆Hf̊ C + d · ∆Hf̊ D ] – [a · ∆Hf̊ A + b · ∆Hf̊ B ] Şimdi tepkime ısılarının hesaplanışını örnek problemler çözerek görelim. ☞ÖRNEK : 5 ∆Hf̊ CO2(g) = – 393,5 kJ/mol , ∆Hf̊ H2O(s) = – 285,8 kJ/mol, ∆Hf̊ CH OH 3 (s) = – 239,2 kJ/mol standart molar oluşum entalpileri bilindiğine göre CO2(g) + 2H2O(s) → CH3OH(s) + 3/2O2(g) tepkime entalpisi kaç kJ’ dür? ✍ÇÖZÜM ∆H˚ = [∑∆Hf̊ ürünler – ∑∆H˚f̊ girenler] ∆H˚ = [∆Hf̊ CH3OH ] – [(∆Hf̊ CO2 ) + 2 · (∆Hf̊ H2O)] Tepkimeden elde edilen oksijen gazı elementel hâlde olduğundan oluşum entalpisi sıfırdır. Bu nedenle oluşum entalpisi tepkime entalpisi hesaplanırken dikkate alınmaz. ∆H˚ = [(1 mol) (– 239,2 kJ/mol)] – [(1 mol) (–393,5 kJ/mol) + [( 2 mol) (–285,8 kJ/mol)] ∆H˚ = – 239,2 + 393,5 + 571,6 ∆H˚ = +725,9 kJ’dür. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 31 ☞ÖRNEK : 6 1. H2(g) + 1/2O2(g) → H2O(s)∆Hf̊ 1 = – 285,8 kJ 2. 2C(k) + H2(g) → C2H2(g)∆Hf̊ 2 = +227,4 kJ 3. C2H2(g) + H2O(s) → CH3CHO(s)∆Hf̊ 3 = – 138 kJ tepkimelerinin entalpileri bilindiğine göre CH3CHO(s)’in standart molar oluşum entalpisi kaç kJ/mol’ dür? ✍ÇÖZÜM Örnek problemde verilen üç tepkimenin toplamı dördüncü bir tepkime olarak yazılabilirse Hess Yasası’na göre toplam tepkime entalpisi, ara tepkime entalpilerinin toplamına eşit olacaktır. 1. H2( g ) + 1/2O2( g ) → H2O( s ) Hf˚1 = −285, 8 kJ 2. 2C(k ) + H2( g ) → C2H2( g ) Hf˚2 = +227, 4 kJ + 3. C2H2( g ) + H2O( s ) → CH3CHO( s ) + 4. 2H2( g ) + 2C(k ) + 1/2O2( g ) → CH3CHO( s ) Hf˚3 = − 138 kJ Hf˚4 = −196, 4 kJ Toplam tepkime (4), CH3CHO’in elementlerinden oluşum tepkimesi olduğuna ve tepkimede 1 mol CH3CHO oluştuğuna göre tepkime entalpisi, aynı zamanda CH3CHO’ in standart molar oluşum entalpisidir. ☞ÖRNEK : 7 ∆Hf̊ H S = 2 (g) – 20,6 kJ/mol,∆Hf̊ Ag2S(k)= – 32,6 kJ/mol’dür. ∆Hf̊ HNO = 3(s) – 173,2 kJ/mol,∆Hf̊ AgNO3(k)= –124,4 kJ/mol’dür. Standart molar oluşum entalpileri bilindiğine göre; 2AgNO3(k) + H2S(g) → Ag2S(k) + 2HNO3(s) tepkimesinin entalpisi kaç kJ ’dür? ✍ÇÖZÜM ∆H˚ = [ ∑∆Hf̊ ürünler – ∑∆Hf̊ girenler ] ∆H˚ = [ (∆Hf̊ Ag2S) + 2 · (∆Hf̊ HNO3)] – [2 · (∆Hf̊ AgNO3) + (∆Hf̊ H2S)] ∆H˚ = [ (–32,6) + 2 · (–173,2)] – [2 · (–124,4) + (–20,6) ] ∆H˚ = –32,6 – 346,4 + 248,8 + 20,6 ∆H˚ = – 109,6 kJ’dür. ☞ÖRNEK : 8 ∆Hf̊ CO = –393,5 kJ/mol, ∆Hf̊ H2O(g)= –241,8 kJ/mol, ∆Hf̊ C2H4(g)= +52,4 kJ/mol standart molar 2(g) oluşum entalpileri bilindiğine göre 1 mol C2H4’in yanma tepkimesine ait tepkime entalpisi kaç kJ ’dür? ✍ÇÖZÜM 1 mol C2H4 ’in yanma tepkimesi denklemi şöyledir: C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g) ∆H˚ = [∑∆Hf̊ ürünler – ∑∆Hf̊ girenler] ∆H˚= [2 · (∆Hf̊ CO2) + 2 · (∆Hf̊ H2O)] – [∆Hf̊ C2H4] ∆H˚ = [2 · (–393,5) + 2 · (–241,8)] – [52,4] ∆H˚ = – 1323 kJ’dür. 32 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 9 CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) Yukarıdaki tepkimeye 8 g O2 gazı ile normal koşullarda 2,24 L CH4 gazı sokulduğunda 80,229 kJ ısı açığa çıkıyor. ∆Hf̊ H2O(g) = – 241,8 kJ/mol, ∆Hf̊ CO2(g) = – 393,5 kJ/mol standart molar oluşum entalpileri bilindiğine göre CH4(g)’ın standart molar oluşum entalpisi kaç kJ/mol’ dür? ✍ÇÖZÜM CH4’ın standart molar oluşum entalpisini bulabilmek için öncelikle tepkime entalpisi hesaplanmalıdır. Ancak bu hesaplama yapılmadan önce tepkimeye giren maddelerin artıp artmadıkları belirlenmelidir. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) 22,4 litre 64 g 22,4 litre CH4 için 64 g O2 gerekirse 2,24 litre CH4 için X –––––––––––––––––––––––––––––– 64 · 2,24 X = –––––––– = 6,4 g O2 gerekir. 22,4 8 g O2 verildiğine ve 6,4 g gerektiğine göre ortamdaki oksijen fazladır. Hesaplama CH4 üzerinden yapılmalıdır. 2,24 L CH4’dan 80,229 kJ ısı açığa çıkarsa 22,4 L CH4’dan X ––––––––––––––––––––––––––––––––––––––––––– 22,4 · 80,229 X = ––––––––––––– 2,24 X = 802,29 kJ ısı açığa çıkar. ∆H˚=[(∆Hf̊ CO ) 2 + 2 · (∆Hf̊ H2O)] – [∆Hf̊ CH4] –802,29=[(–393,5) + 2 · (–241,8)] – [ ∆Hf̊ CH4] ∆Hf̊ CH =802,29 – 393,5 – 483,6 4 ∆Hf̊ CH =–74,81 4 kJ/mol’dür. 4. Bağ Enerjileri ve Tepkime Entalpisi Kimyasal tepkimelerde genellikle kimyasal bağlar kırılır (koparılır) ve yeni bağlar oluşur. Bağların kırılması ortamdan enerji alınarak oluşması ise ortama enerji verilerek gerçekleştiğinden sistemin enerjisinde de değişme gözlenir. Molekül yapılı gaz hâlindeki bir maddenin 1 molündeki atomları bir arada tutan bağları standart şartlarda kırabilmek için gerekli olan enerjiye bağ enerjisi veya bağ kırılma entalpisi denir. Bağ enerjisi ∆HB̊ ile gösterilir. Bağ enerjisi bir molekülün kararlılığının bir ölçüsüdür. Bir moleküldeki bağları kırmak için gerekli olan enerji ne kadar büyük ise molekül de o kadar kararlıdır. Örneğin, azot molekülünde azot atomları arasındaki bağları kırmak için mol başına 941 kJ enerji vermek gerekirken flor molekülündeki flor atomları arasındaki bağı kırmak için mol başına 154 kJ enerji vermek gerekir. N2(g) + 941 kJ → 2N(g) F2(g) + 154 kJ → 2F(g) Yukarıdaki örnekte de görüldüğü gibi azot molekülünü oluşturan azot atomları arasındaki bağları kırmak daha fazla enerji gerektirir. Bu nedenle azot molekülleri daha kararlı, tepkimeye girme eğilimleri 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 33 ise çok azdır. Flor molekülünü oluşturan flor atomları arasındaki bağı kırmak daha az bir enerji gerektirdiğinden azot molekülüne göre daha kararsız ve tepkimeye girme eğilimi ise oldukça fazladır. Bağ enerji değerleri ortalama değerlerdir. Çünkü farklı bileşiklerdeki aynı tür bağı kırmak için gereken enerji miktarları çoğu kez farklıdır. Örneğin, C—H bağını kırmak için etan (C2H6) molekülüne 423 kJ/mol, propan (C3H8) molekülüne 413 kJ/mol ve izobütan (C4H10) molekülüne 403 kJ/mol enerji vermek gerekir. Bu nedenle bağ enerjisi, bu bağı içeren değişik bileşiklerdeki bağları kırmak için verilen enerjilerin ortalamasıdır. Bağ enerjilerinin büyüklüğüne bakarak bir molekülün bağlarını kırmak için ne kadar enerji gerektiğini ya da bu bağların oluşması hâlinde ne kadar enerji açığa çıkacağını hesaplamak olanaklıdır. Bazı bağların ortalama bağ enerji değerleri Tablo 1.2’ de verilmiştir. İnceleyiniz. Tablo 1.2: Bazı bağların ortalama bağ enerjileri (kJ/mol) Tekli bağlar Çoklu bağlar Bağ kJ/mol Bağ kJ/mol Bağ kJ/mol Bağ kJ/mol C—H 413 N—N 160 S—H 339 C C 614 C—C 347 N—O 201 S—F 327 C C 839 C—N 293 N—Cl 200 S—Cl 253 C N 891 C—O 358 N—Br 243 S—Br 218 C O 745 C—F 485 N—H 391 I—I 149 N N 418 C—Cl 328 H—H 432 F—F 154 N N 941 C—Br 276 H—F 567 Cl—F 253 O—O 146 C—I 240 H—Cl 427 Cl—Cl 239 O O 495 C—S 259 H—Br 363 Br—F 237 S O 323 Si—H 323 H—I 295 Br—Cl 218 S S 418 O—H 467 Br—Br 193 Bağ enerjileri, kimyasal tepkimelerdeki enerji değişimlerinin hesaplanmasında kullanılabilir. Çünkü tepkimelerde görülen enerji değişimi, bağların kırılması ve yeni bağların oluşması sonucudur. Dolayısıyla bağ enerjilerinden tepkimelerdeki enerji değişimleri hesaplanırken standart oluşum entalpilerinin kullanımından kaynaklanan bir alışkanlıkla ürünlerin bağ enerjileri toplamından tepkimeye giren maddelerin bağ enerjileri toplamını çıkarma yanılgısı yaygındır. Bu yanılgıya düşmemek için aşağıdaki bağıntıyı incelememiz gerekir. ∆H˚ = ∑ (Kırılan bağların enerjisi) – ∑ (Oluşan bağların enerjisi) ∆H˚ = ∑Hkırılma – ∑Holuşma Bağıntıya göre kimyasal bir tepkimede, kırılan bağların enerjileri toplamı, oluşan bağların enerjileri toplamından daha az ise tepkimede ortama ısı verilir. Bu koşulda ∆H˚ nin işareti eksidir. Tersine, kırılan bağların enerjileri toplamı, oluşan bağların enerjileri toplamından fazla ise tepkimenin gerçekleşmesi için ortamdan ısı alınır. Bu koşulda ∆H˚ nin işareti artıdır. ☞ÖRNEK : 10 Bağ türlerine göre bağ enerjileri Tablo 1.2’de verilmiştir. Bu tablodan yararlanarak H H H H C C + H2 H 34 H H—C—C—H şeklinde verilen tepkimenin entalpisini hesaplayınız. H H ORTAÖĞRETİM KİMYA 11 DERS KİTABI ✍ÇÖZÜM Tepkime entalpisi, girenlere ait bağları kırmak için verilmesi gereken enerji ile ürünlerin bağlarının oluşması sırasında açığa çıkan enerji farkına eşittir. Bu nedenle tepkimeye giren maddelerin bağ oluşum enerjileri toplamı ile ürünlerin bağ oluşum enerjileri toplamı arasındaki fark bulunarak tepkime entalpisi hesaplanır. Ancak bu hesaplamada girenlere ait bağlardan ürünlerde aynen korunanlar dikkate alınmaz. Kırılan bağların enerjileri; (∑ Hkırılma) =1 · (C = C) + 1 · (H – H) ∑ Hkırılma =1· (614) + 1· (432) ∑ Hkırılma =614 + 432 ⇒ ∑ Hkırılma = 1046 kJ olur. Tepkimede giren maddelere ait bağların kırılması için mol başına ortamdan 1046 kJ ’lük bir enerji almak gerekecektir. Oluşan bağların enerjileri; (∑ Holuşma)= 2 · (C – H) + 1 · (C – C) ∑ Holuşma=2 · (413) + 1 · (347) ∑ Holuşma=826 + 347 ⇒ ∑ Holuşma = 1173 kJ Tepkimede ürünlere ait bağların oluşması sırasında ortama mol başına 1173 kJ’lük bir enerji verilecektir. Fark enerji (∆H˚); ∆H˚ = ∑ Hkırılma – ∑ Holuşma ⇒ ∆H˚ = 1046 – 1173 ⇒ ∆H˚ = –127 kJ’dür. ☞ÖRNEK : 11 Tablo 1.2’ de verilen ortalama bağ enerjileri değerlerini, Tablo 1.1’ de verilen standart oluşum entalpi değerlerini kullanarak 2HI (g) + Cl2(g) → 2HCl(g) + I 2(k) tepkimesinin standart koşullardaki entalpi değişimlerini ayrı ayrı hesaplayınız. Sonucu yorumlayınız. ✍ÇÖZÜM Tepkimede yer alan maddelerdeki bağların gösterimi şöyledir: 2H – I + Cl – Cl → 2H – Cl + I – I Ortalama bağ enerjisi değerleri kullanılarak tepkimenin standart koşullardaki entalpi değişimini hesaplarsak; ∑ Hkırılma=2 · (H – I) + (Cl – Cl) ⇒ ∑ Hkırılma = (2 · 295) + 239 ⇒ ∑ Hkırılma = 829 kJ ∑ Holuşma=2 · (H – Cl) + (I – I) ⇒ ∑ Holuşma = (2 · 427) + 149 ⇒ ∑ Holuşma = 1003 kJ ’ dür. ∆H˚=∑ Hkırılma – ∑ Holuşma ∆H˚=829 – 1003 ⇒ ∆H˚ = –174 kJ olarak bulunur. Standart oluşum entalpi değerlerini kullanarak tepkimenin standart koşullardaki entalpi değişimini hesaplarsak; ∆H˚=[2 · ∆HHCI + ∆HI2] – [2 · ∆HHI + ∆HCl2] ∆H˚=[2 · (–92,3) + 0] – [2 · 26,5 + 0] ∆H˚=–184,6 – 53 ⇒ ∆H˚ = –237,6 kJ olarak bulunur. Ortalama bağ enerjileri ve standart oluşum entalpileri ayrı ayrı kullanılarak hesaplama yapıldığında yukarıdaki tepkimenin standart entalpi değişimi değeri farklı bulunur. Bu farklılık bildiğiniz gibi iç enerji değişiminden ileri gelir. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 35 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Özdeş kaplardaki eşit kütleli sulardan birinin sıcaklığı 20 ˚C, diğerininki 25 ˚C olarak ölçülüyor. Bu kaplardaki suların sahip oldukları iç enerjileri karşılaştırınız. 2.S(k) + O2(g) → SO2(g) ΔH˚ = –296,8 kJ tepkime denklemine göre 276 g kükürdün yeterince oksijenle yanması sırasında açığa çıkan ısı kaç kJ’dür? (S : 32) 3. Sönmemiş kireçten (CaO) sönmüş kireç [Ca(OH)2] elde edilişine ait tepkime denklemi şöyledir: CaO(k) + H2O(s) → Ca(OH)2(k) ΔH˚ = –64,5 kJ ∆Hf̊ CaO : (k) –634,9 kJ/mol , ∆Hf̊ H O(s): –285,8 kJ/mol olduğuna göre Ca(OH)2 ’ in molar oluşma ental2 pisi kaç kJ/mol’dür? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Entalpi değişimi sistemdeki madde miktarından bağımsızdır. ( ... ) 2. Açık bir sistemin kaybettiği ısı ortam tarafından, ortamın kaybettiği ısı sistem ( ... ) tarafından kazanılır. 3. Isının sistemden ortama salındığı tepkimeler ekzotermiktir. ( ... ) 4. Bir molekülün kararlığının ölçüsü bağ enerjisidir. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Yandaki tabloda ortalama bağ enerjileri verilmiştir. Amonyak ile flor arasında gerçekleşen tepkimenin molar entalpi değişimi aşağıdakilerden hangisidir? NH3(g) + 3F2(g) → 3HF(g) + NF3(g) A) –1323 B) –882 N—H F—F H—F N—F Bağ türü Ortalama bağ 391 154 567 272 enerjisi (kJ / mol) C) –663 2. H2(g) + 1/2O2(g) → H2O(g) ΔH˚ = –241,8 kJ H2(g) + 1/2O2(g) → H2O(s) ΔH˚ = –285,8 kJ D) –294 E) –74 Yukarıdaki tepkime ısıları dikkate alındığında 1 mol suyun buharlaşması için gereken ısı miktarı aşağıdakilerden hangisidir? A) 60 B) 54 C) 44 D) 38 E) 26 3. Etil alkolün standart molar yanma entalpisi ΔH˚C2H5OH = –1370 kJ/mol, glikozunki ise ΔH˚C6H12O6 = –3000 kJ/mol’dür. Buna göre 1 gram etil alkolün yanmasından açığa çıkan ısı 1 gram glikozun yanmasından açığa çıkan ısının kaç katıdır? (C : 12, O : 16, H : 1) A) 1,79 B) 1,29 4. N2(g) → 2N(g) ΔH˚ = +941 kJ C) 0,95 O2(g) → 2O(g) D) 0,64 E) 0,46 ΔH˚ = +495 kJ Azot ve oksijen moleküllerinde atomlar arasındaki bağların kırılmasına ilişkin tepkime denklemleri yukarıda verilmiştir. Buna göre aşağıdaki ifadelerden hangisi doğrudur? A) Azot atomları arasındaki bağlar oksijen atomları arasındakilerden daha kuvvetlidir. B) N2 ve O2 molekülleri ortama ısı vererek atomlarına ayrılır. C) N2 ve O2 molekülleri ortamdan ısı alarak oluşur. D) O2 molekülü N2 molekülünden daha kararlıdır. E) Azot molekülleri oksijen moleküllerine göre daha kolay tepkime verir. 36 ORTAÖĞRETİM KİMYA 11 DERS KİTABI İSTEMLİLİK - İSTEMSİZLİK BÖLÜM İÇERİĞİ 1.İstemli ve İstemsiz Değişim 2. Kullanılamayan Termal Enerji / Entropi 3.Maddelerde Entropi Değişimi 4. Termodinamiğin Üçüncü Yasası ve Mutlak Entropi 5. Serbest Enerji Zaman zaman televizyonda çizgi film izliyorsunuzdur. Herhâlde Pembe Panter’in yüksekten cam eşyalar üzerine düşüp onlarla birlikte parçalara ayrıldığını daha sonra bu parçaların bir araya gelerek gerisin geriye cam eşya ve Pembe Panter hâline döndüklerini de görmüşsünüzdür. Gerçek yaşamda kırılıp etrafa dağılan parçaların bir araya gelip birleştiğine acaba hiç tanık oldunuz mu? Söz gelimi yukarıdaki resimdeki gibi kırılan kadehlerin parçalarının bir araya gelerek sağlam kadehler hâline döndüklerine hiç tanık oldunuz mu? Kırılıp etrafa dağılan parçaların tekrar bir araya gelerek neden kadehleri oluşturamadıklarını hiç merak ettiniz mi? Demir niye zamanla paslanır, buz oda sıcaklığında neden erir, su neden buharlaşır, şeker neden suda çözünür ve ahşap bir ev niye zamanla çürüyüp yıkılır biliyor musunuz? Bu bölümde bu tür soruları irdeleyecek ve bunlara yanıtlar bulacaksınız. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 37 1. İstemli ve İstemsiz Değişim Resim 1.5’te sırayla buzun erimesi, şelaleden su akışı, tırmanma hâlindeki kayakçılar, dikit ve sarkıt oluşumu, dağdan aşağıya doğru kayan bir kayakçı ve futbol topuna hareket kazandırmaya çalışan bir futbolcuya ait resimler verilmiştir. Bu resimleri inceleyiniz. Hangi olayların kendiliğinden hangilerinin bir dış etki sonucu gerçekleştiğini düşününüz? Resim 1.5: Kendiliğinden ya da bir dış etki sonucu gerçekleşen bazı olaylar Mekanik saatlerin bir yay sistemi vasıtasıyla çalıştıklarını yay boşalıncaya kadar çalışmaya devam ettiklerini ve sonra durduklarını bilirsiniz. İşte kurulmuş yayın kendiliğinden boşalması gibi dışarıdan bir etki gerektirmeyen değişmelere istemli (kendiliğinden olan) değişme, dışarıdan bir etki uygulanmadıkça gerçekleşmeyen değişmelere ise istemsiz (kendiliğinden olmayan) değişme denir. Söz gelimi bir mekanik saatin yayı hiçbir zaman kendiliğinden kurulmaz. Kurma işlemi dışarıdan yapılan bir etkidir. Dolayısıyla yayın kurulması olayı istemsiz bir değişmedir. Resim 1.5 ’te verilen buzun erimesi, şelaleden su akışı, dikit ve sarkıt oluşumu, kayakçının dağdan aşağıya doğru kayışı dışarıdan bir etki gerektirmeden gerçekleşen istemli değişmelerdir. Kayakçıların dağa tırmanışı, futbol topuna hareket kazandırılması olayları ise gerçekleşmesi için bir dış etki gerektiren istemsiz değişmelerdir. Kimyasal olaylardan demirin paslanması, asit ile bazın nötrleşmesi gibi olaylar istemli değişmelere, demir pasından ya da demir cevherinden uygun işlemler sonucu demir elde edilmesi, suyun elektroliz edilerek bileşenlerine ayrılması gibi olaylar ise istemsiz değişmelere örnek verilebilir. Daha önce de sözü edildiği gibi açıkta bırakılan demir parçasının paslanarak demir(III) oksit hâline dönüşmesi tepkimesi tek yönlü ve istemli bir değişmedir. 4Fe(k) + 3O2(g) → 2Fe2O3(k) (İstemli) Tersine bir tepkime ile demir(III) oksitten demir elde etmek mümkündür. Ancak bu tepkime kendiliğinden oluşmaz. Bu tepkimenin oluşması özel ayrıştırma tekniklerinin uygulanmasını gerektirir. Bu nedenle ters yöndeki tepkime, istemsiz bir değişmedir (Resim 1.6). 38 ORTAÖĞRETİM KİMYA 11 DERS KİTABI İstemli İstemsizlik Resim 1.6: Demirin paslanması istemli, demir pasından demir elde edilmesi istemsiz değişmedir. 9. sınıf fizik ve kimya derslerinde suyun elektroliz edilerek bileşenlerine ayrılabildiğini öğrendiniz. Suyun bileşenlerine ayrıştırılması süreci de özel ayrıştırma teknikleri uygulanmasını (elektroliz), diğer bir ifadeyle dış etken uygulanmasını gerektiren istemsiz bir değişmedir (Şekil 1.8). Elektroliz 2H2O(s) → 2H2(g) + O2(g) O2 2H2O 2H2 Şekil 1.8: Suyun elektrolizle elementlerine ayrıştırılması İstemli ve istemsiz değişmelerle ilgili olarak buraya kadar öğrendiklerimizden hareketle şu genellemeleri yapabiliriz: ® Herhangi bir değişme istemli ise bunun tersi yönündeki değişme istemsizdir. ® Doğal olaylar istemli değişmelerdir. ® İstemsiz değişmelerin gerçekleşebilmesi için özel önlemlerin alınması, özel yöntemlerin uygulanması, diğer bir ifadeyle sisteme dış etki uygulanması gerekir. Bildiğiniz gibi su yüksekten aşağıya doğru akar, kurulan saat yayı boşalır, lastik top yukarıdan aşağıya doğru yuvarlanır. Dikkat edilirse bu olaylarda değişmelerin istemli ve potansiyel enerjinin azal1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 39 dığı yönde gerçekleştiği görülür. Bu olaylarda değişmelerin potansiyel enerjinin azaldığı yönde istemli gerçekleşmesi, “Kimyasal tepkimeler de potansiyel enerjinin azalması yönünde istemli mi gerçekleşir?” sorusunu akla getirir. Bu soruya P. Berthelot (Bertolet) ve J. Thomson (Tamsın) adlı iki bilim insanı yanıt aramış ve istemli değişmelerde sistemin entalpisinin azaldığını ileri sürmüşlerdir. Bir sistemin entalpisinin azalması sistemin ortama ısı vermesi anlamına geldiğinden, ortama ısı veren (ekzotermik) tepkimelerin istemli gerçekleşeceğine karar vermişlerdir. İstemli gerçekleşen bazı tepkimelerin denklemleri şöyledir: 2H2(g) + O2(g) → 2H2O(s) ∆H˚ = –285,83 kJ H2SO4(s) + 2NaOH(k) → Na2SO4(k) + 2H2O(s)ΔH˚ = –290,89 kJ Mg(k) + 2HCl(suda) → MgCl2(k) + H2(g) ΔH˚ = –307,2 kJ 4Ag(k) + O2(g) → 2Ag2O(k) ΔH˚ = –62,2 kJ Bu tepkime denklemleri incelenirse tepkimelerin ekzotermik oluşu, diğer bir ifadeyle dışarıya enerji vermeleri (entalpi azalması) dikkat çeker. O hâlde bu tepkimeleri istemli kılan ana etken, entalpideki azalma (minimum enerjili olma) dolayısıyla iç enerjilerini azaltma eğilimi olmalıdır. Ancak bu durum, tüm ekzotermik tepkimelerin istemli olduğu anlamını içermez. Çünkü suyun oluşumu, kömürün yanması gibi tepkimeler ekzotermik olmalarına karşın kendiliğinden hiçbir şekilde gerçekleşemezler. Bu tepkimelerin başlaması için bir kıvılcım şeklinde de olsa bir enerjinin (aktivasyon enerjisinin) başlangıçta verilmesi gerekir. Diğer yandan buzun oda sıcaklığında erimesi, suyun buharlaşması, gümüş iyodürün suda çözünmesi gibi olaylar hem bu maddelerin iç enerjilerinin artıp başlangıçtakinden daha yüksek hâle geldiği hem endotermik hem de istemli olan değişmelerdir. Bu değişmeler göz önüne alındığında bir değişimin istemsiz olup olmayacağına sadece entalpi değişimine (minimum enerjili olma eğilimine) bakarak karar vermek doğru bir yöntem olamaz. Şimdi istemli değişmelerde entalpi değişimi dışında hangi etkenlerin rol aldığını araştırmak üzere Şekil 1.9.a ’da gösterildiği gibi birbirine bir muslukla bağlanmış eşit hacimli cam balonlarda A ve B ideal gazlarının bulunduğunu varsayalım. Cam balonlardaki gazların basınçları birer atmosfer olsun. Cam balonlar arasındaki musluk, sıcaklık sabit kalacak şekilde açılırsa A ve B gazları Şekil 1.9.b’ de şematik olarak gösterildiği gibi birbirine karışırlar, cam balonlar içinde her yöne doğru yayılır ve genleşirler. Yayılma ve genleşme işlemi her iki cam balondaki ideal gazların kısmi basınçları 0,5 atm olunca sonlanır. A B a 1 atm b 1 atm 0,5 atm 0,5 atm Şekil 1.9: Hacmi büyüyen ideal gazların basınçları küçülür. 10. sınıf kimya derslerinizde ideal gaz molekülleri arasında hiçbir çekim kuvveti bulunmadığını, sabit sıcaklıkta karıştırıldıklarında moleküllerinin enerjilerinin değişmediğini öğrendiniz. Bu bilgileri bu yıl edindiğiniz bilgilerle birleştirdiğinizde birbirine karıştırılan ideal gaz moleküllerinin iç enerjilerinin (ΔU), diğer bir ifadeyle entalpilerinin değişmeyeceğini (ΔU = ΔH = 0) söyleyebilirsiniz. O hâlde yukarıda örnek 40 ORTAÖĞRETİM KİMYA 11 DERS KİTABI verildiği şekilde gaz moleküllerinin birbiri içinde istemli olarak karışmalarında esas etken, entalpi azalması (minimum enerjili olma eğilimi) olmamalıdır. Bu olayda esas etken, gaz moleküllerinin birbiri içinde maksimum karışma isteği ya da maksimum düzensizliğe ulaşma eğilimi olmalıdır. Bildiğiniz gibi oda sıcaklığındaki bir ortamda buz erir, su buharlaşır, gümüş iyodür suda çözünür. Ancak bu olayların gerçekleşebilmesi için ortamdan ısı alınır. Dolayısıyla bu maddelerin iç enerjileri başlangıçtakinden daha yüksek hâle gelir. Bu durum buzun erimesini, suyun buharlaşmasını, gümüş iyodürün suda çözünmesini istemli kılan ana etkenin minimum enerjili olma eğilimi olmadığını gösterir. Çünkü buz sudan, sıvı hâldeki su kendi buharından, gümüş iyodür katısı çözeltisindeki hâlinden daha düzenli ve daha az enerjilidir. O hâlde bu değişmeleri istemli kılan minimum enerjili olma eğilimi değil, maksimum düzensiz olma eğilimi olmalıdır. Bu karşılaştırmalara göre tepkimeler enerjinin minumum, düzensizliğin maksimum olacağı yönde istemli yürümelidir. Bir sistemin düzensizliğinin ölçüsü entropi adı verilen termodinamik bir özellikle belirtilir. Bir sistem ne kadar karışık ve düzensiz ise entropisi de o kadar büyük (fazla) kabul edilir. Entropi “S” sembolüyle gösterilir. Entropi (düzensizlik) artışına örnek bazı olaylar şöyle sıralanabilir: ®Katı hâlden sıvı hâle, katı veya sıvı hâlden gaz hâline geçiş ®Katı ya da sıvı hâlde iken çözelti oluşturma ®Kimyasal tepkime sonunda gaz molekül sayısında artış ®Maddenin sıcaklığının artışına bağlı olarak taneciklerinin hareket yeteneğindeki artış ®Sabit sıcaklıkta miktar değişmeden gaz hacmindeki artış (genleşme) ☞ÖRNEK : 12 Aşağıda bazı tepkimeler verilmiştir. Bu tepkimelerden hangilerinde entropi artışı beklenir? Nedenini açıklayınız. a. I2(k) → I2(g) b. Br2(s) → Br2(g) c. CO(g) + 1/2O2(g) → CO2(g) ç. NaCl(suda) → NaCl(k) d.2NaN3(k) → 2Na(k) + 3N2(g) ✍ÇÖZÜM Düzensizlik ölçüsü entropi olduğuna göre düzensizliğin arttığı yönde entropi artışı beklenir. a, b ve d ile gösterilen değişmelerde entropi artışı (düzensizlik artışı), c ve ç ile gösterilen değişmelerde ise entropi azalması (daha düzenli hâle gelme) söz konusudur. 2. Kullanılamayan Termal Enerji / Entropi Fen ve teknoloji, kimya, fizik derslerinizde enerji ve enerji dönüşümlerini öğrendiniz. Isı enerjisinin mekanik, elektrik vb. enerji türlerine ve işe dönüşebildiğini gördünüz. Bu enerji türlerinin de ısı enerjisine dönüştüğünü biliyorsunuz. Acaba ısı enerjisinin tamamı hiçbir kayıp olmadan diğer enerji türlerine ya da 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 41 işe dönüşebilir mi? Tersine, iş ve enerji türlerinin tamamının hiçbir kayıp olmadan ısı enerjisine dönüşmesi söz konusu mudur? Bu sorulara yanıt bulmak üzere “Rüzgar Gülü Yapalım” adlı etkinliği yapınız. 1. ETKİNLİK: RÜZGÂR GÜLÜ YAPALIM Güvenliğiniz için Neler Gerekli? ❏ Kâğıt ❏ Cetvel ❏ Bunzen beki ❏ Bunzen kıskacı ❏ Şişe mantarı ❏ Makas ❏ Toplu iğne ❏ Üçayak ❏ Destek çubuğu ❏ Sacayak ❏ Tel kafes ❏ Termometre ❏ Su ❏ Kibrit ❏ İkili bağlama parçası ❏ Nuçe erlenmayer ❏ Tek delikli lastik tıpa Nasıl Yapacaksınız? 3 Hayat bilgisi, fen ve teknoloji derslerinde öğrendiğiniz şekilde kâğıttan bir rüzgâr gülü yapınız. 3 Rüzgâr gülünün kanatlarını, uçları tam merkeze gelecek şekilde toplu iğne ile sabitleyiniz. Toplu iğneyi şişe mantarına batırıp mantarı da bunzen kıskacına tutturarak resimdeki etkinlik düzeneğini kurunuz. 3 Nuçe erlenmayerine koyduğunuz suyun sıcaklığını termometre yardımıyla ölçünüz. Bu sıcaklığın oda sıcaklığına eşit olacağını hatırlayınız. 3 Bunzen bekini yakarak nuçe erlenmayerdeki suyu ısıtınız. Suyun sıcaklığı ve buharlaşma hızı arttıkça su kaynadıkça rüzgâr gülünün dönme hızının nasıl değiştiğini gözlemleyiniz. 3 Nuçe erlenmayerdeki su bir süre kaynadıktan sonra bunzen bekini söndürünüz. Su sıcaklığı oda sıcaklığına düşünceye kadar rüzgâr gülünün dönme hareketini izleyiniz. Etkinlik Sonu Soruları 1. Nuçe erlenmayerdeki suyun sıcaklığının değişmesine bağlı olarak rüzgâr gülünün hareketi nasıl değişti? 2. Suyun sıcaklığının değişmesine bağlı olarak rüzgâr gülünün hareketindeki değişmeyi nasıl açıklarsınız? 3. Oda sıcaklığında rüzgâr gülünün hareketsiz oluşunu nasıl açıklarsınız? 42 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Yaptığınız etkinlikte nuçe erlenmayerdeki suyun oda sıcaklığında belirli bir termal enerjiye sahip olmakla beraber rüzgâr gülünü döndüremediğini ancak su sıcaklığı arttırıldıkça rüzgâr gülünün dönme hızının arttığını, kaynama sıcaklığında ise rüzgâr gülünün sabit bir hızla döndüğünü gözlemlemiş olmalısınız. Sistemi soğumaya bıraktığınızda ise rüzgâr gülünün dönme hızının giderek azaldığını oda sıcaklığına gelindiğinde ise rüzgâr gülünün artık dönmediğini, dolayısıyla bulunduğu ortamla aynı sıcaklıkta olan bir sistemin (örneğimizde nuçe erlenmayere koyduğunuz suyun) termal enerjisinin mekanik işe dönüştürülemeyeceğini belirlemiş olmalısınız. Bu etkinlik sonunda enerji dönüşümlerinde mutlak bir dönüşümün söz konusu olmadığını sezmişsinizdir. Yaptığınız etkinlikte gözlemlediğiniz gibi bunzen bekinden elde ettiğiniz kimyasal enerji termal enerjiye, termal enerjinin bir kısmı da rüzgâr gülünü döndürerek mekanik enerjiye (işe) dönüşür. Yine gözlemlediğiniz gibi termal enerjinin artması ya da azalması ile elde edilen mekanik enerji (iş) de artar ya da azalır. Ancak enerji dönüşümlerinde mutlak bir dönüşümden söz edilemez. Çünkü sisteme verilen ısı enerjisinin bir kısmı su tarafından absorblanırken bir kısmı ortama dağılır. Su tarafından absorblanan enerjinin bir kısmı iç enerji olarak tutulurken bir kısmı buharlaşmaya harcanır. Oluşan su buharının sahip olduğu potansiyel enerji rüzgâr gülünü döndürerek mekanik enerjiye dönüşür. Mekanik enerjinin bir kısmı işe dönüşürken kalan kısmı termal enerji şeklinde ortama yayılır. Bu aşamada akla gelen soru şudur: “Oda sıcaklığında nuçe erlenmayere koyduğunuz su, belirli bir termal enerjiye sahip olmakla beraber bu enerji ile neden rüzgâr gülünü döndürememektedir?” Etkinlikte nuçe erlenmayere koyduğunuz suyun oda sıcaklığına eşit bir sıcaklıkta olabilmesi için belirli bir enerjiye sahip olması gerektiğini biliyor olmalısınız. Suyun sahip olduğu ancak rüzgâr gülünü döndürmeye yetmeyen yani mekanik işe dönüşmemiş bu enerji, kullanılamayan termal enerjidir. İşte entropi “kullanılamayan termal enerjisinin” bir ölçüsüdür. Şimdi aşağıdaki etkinliği yaparak entropiyi olasılık temelinde tartışalım. 2. ETKİNLİK: MÜREKKEP DAMLACIKLARINA NE OLDU? Güvenliğiniz için Neler Gerekli? ❏ Mürekkep ❏ Damlalık ❏ Beherglas (300 mL) ❏ Su Nasıl Yapacaksınız? 3 Beherglasın yarısına kadar su doldurunuz. 3 Damlalık yardımıyla beherglastaki su içine birkaç damla mürekkep damlatınız. Değişmeleri gözlemleyiniz. Etkinlik Sonu Soruları 1. Su içinde rastgele dağılan mürekkep damlacıkları ile entropi arasında nasıl bir ilişki kurulabilir? 2. Su içine dağılmış mürekkep damlacığının kendiliğinden (istemli) damla boyutuna dönmesi olası mıdır? 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 43 Yaptığınız etkinlik öncesinde mürekkebin su içinde damla hâlinde, bir bölgeye yayılmış ya da tamamen dağılmış hâlde bulunabileceğini düşünmüş olabilirsiniz. Esasen mürekkebin su içinde bu üç olası hâlden birinde bulunmaması için bir neden yok gibidir. Ancak mürekkep damlacığı sizin de gözlemlediğiniz gibi su içinde tamamen dağılmıştır. Şimdi akla gelen soru şudur: Mürekkep, damla ya da bir bölgede yayılmış hâlde bulunmak yerine neden tamamen suda dağılma eğilimi göstermiştir? Tahmin edeceğiniz gibi mürekkebin su içinde belirli bir bölgede yayılmış hâli damla hâline göre daha düzensiz bir konumdur. Bu nedenle damlacığın suyun bir bölgesine yayılması daha olasıdır. Mürekkebin su içinde tamamen dağılmış hâli ise bir bölgeye yayılmış hâlinden daha düzensizdir. Kaldı ki su molekülleri için de bu konum maksimum düzensizliği içerir. Dolayısıyla mürekkebin su içinde kendiliğinden tamamen dağılma olasılığı daha yüksektir. O hâlde istemli olaylar daima olma olasılığının daha yüksek olduğu yönde meydana gelir diyebiliriz. İrdelediğimiz olayda son olasılık, su içinde tamamen dağılan mürekkebin kendiliğinden damla boyutuna dönüp dönemeyeceğidir. Gerçekten böyle bir olasılık bulunmakla beraber istemli olarak bu olayın gerçekleştiği hiç gözlemlenmemiştir. Çünkü değişmeler daima en fazla düzensizliğin gerçekleştiği, diğer bir ifadeyle entropinin arttığı (ΔS > 0) yönde istemli olarak gerçekleşir. Ancak bununla beraber hem entalpinin hem de entropinin arttığı istemli olarak gerçekleşen olaylar da vardır. Örneğin, sıcaklığın daha yüksek olduğu sistemlerde eriyen, buharlaşan ve çözünen maddelerin miktarında artış olduğuna günlük yaşamınızda sıkça tanık olmuşsunuzdur. Tanık olduğunuz istemli gerçekleşen bu olaylarda sıcaklık artışı madde taneciklerinin hareketlerinde artışa, bu hareket artışı da düzensizliğe yani entropi de artışına neden olur. O hâlde entalpi ve entropi artışının birlikte gerçekleştiği bir olayın istemli ya da istemsiz gerçekleşmesi entalpi ya da entropi etkenlerinden hangisinin etkisinin daha yüksek olduğuna bağlıdır. 3. Sistemde Entropi Değişimi Termodinamikte iç enerji, entalpi ve entropi hâl fonksiyonu olarak ifade edilir. Hâl fonksiyonu sistemin bulunduğu hâle nasıl ulaştığını değil sistemin o andaki hâli ile ilgili bir özelliktir. Bir hâl fonksiyonu sistemin denge hâlini açıklar. Entropi değişimi (ΔS) sistemin ilk hâli ile son hâli arasındaki değişme (ΔS = Sson hâl – Silk hâl) olduğuna göre entropinin hâl fonksiyonu olarak ifade edilebileceğini, entropi değişiminin ortamdan alınan (soğurulan) ısı miktarı (Q) ile doğru, sıcaklık (T) ile ters orantılı olacağını söyleyebiliriz. Bu durumu aşağıdaki gibi formüle edebiliriz: S= Q T 9. sınıf fizik derslerinizde suyun hâllerini ve hâl değişimlerini gördünüz. Hâl değişimlerini ısı ve sıcaklık yönünden incelediniz. Şimdi benzer olayları entropi yönüyle inceleyelim. Bu amaçla oda ortamına konulan 0 ˚C sıcaklıktaki 1 mol buzun erimesini ele alarak sistemin ve ortamın entropi değişimlerini hesaplayalım (m = 18 g, Le = 80 cal/g, T = 273 + 0 = 273 K, 1 cal = 4,184 J). Qerime=m · Le Qerime=18 · 80 = 1440 cal ⇒ Qerime = 1440 · 4,184 = 6 024,96 J’dür. S= Qerime T S= 6024, 96 273 S ≈ 22, 07 J / K mol ’dür. Bu sonuca göre 1 mol buzun entropi değişimi yaklaşık 22,07 J/K’dir. Sistemin aldığı ısının işareti pozitiftir. Bu da bize sistemin entropisinin arttığını ifade eder. 44 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Görüldüğü gibi sistemin entropisinin artması aldığı ısıdan kaynaklanmaktadır. Isı ortamdan alındığına göre ortamın entropisinin azalması gerekir. Öyleyse bir sistemin entropisi artıyor ise ortamın entropisi azalıyor denilebilir. Şimdi de benzer bir hesaplamayı sıcaklığı –20 ˚C olan bir odaya konmuş 0 ˚C sıcaklıktakı 1 mol sıvı su için tekrarlayalım. Örnek aldığımız bu olayda öncelikle 0 ˚C’taki 1 mol su bu sıcaklıkta donar, daha sonra –20 ˚C’a kadar soğur. Dolayısıyla sistemde toplam ısı değişimini Qtoplam = Qdonma + Qsoğuma bağıntısıyla hesaplamak gerekir (m = 18 g, Ld = 80 cal/g, cbuz = 0,5 cal/g ˚C, Δt = (–20 – 0) = –20 ˚C). Qdonma=m · Ld Qdonma=18 · 80 = 1440 cal’dir. Qsoğuma=m · cbuz · Δt Qsoğuma=18 · 0,5 · –20 = –180 cal’dir. Qtoplam= –1440 – 180 = –1620 cal’dir. Bu sonuca göre 0 ˚C’taki 1 mol sıvı su donup –20 ˚C’taki buz hâline geldiğinde ortama 1620 cal ısı verir. Qtoplam = –1620 cal = – 1620 · 4,184 = –6778,08 J’dür. Bu veriler aşağıdaki bağıntıda yerine konulursa sistemin entropi değişimi hesaplanabilir. S= Qtoplam S= T − 6778, 08 − 6778, 08 = 273 − 20 253 S ≈ − 26, 79 J / K ’dir. Bulduğumuz bu sonuç sistemin entropisinin ( –26,79 J/K) azaldığını dolayısıyla ortamın entropisinin arttığını gösterir. Kapalı bir sistemde aynı sıcaklık ve basınçta eşit hacimleri dolduran gazların birbiri içinde homojen dağıldıklarını ve entropilerinin arttığını gördünüz. Bu olaylarda gazların birbiri içinde karışması kapalı bir sistemde gerçekleştiğinden ortam ile sistem arasında madde değişimi gerçekleşmez. Dolayısıyla bu olaylarda kapalı sistemin entropisi artar. Ortamın entropisi değişmez. Ancak çoğu değişme açık ortamlarda gerçekleştiğinden sistemin entropisi artarken ortamın entropisi azalır ya da sistemin entropisi azalırken ortamın entropisi artar. Açık bir ortamda gerçekleşen istemli bir değişmede sistem tarafından ortama ısı verilir. Dolayısıyla sistemin entropisi azalırken ortamın entropisi artar. Sabit sıcaklık ve basınçta gerçekleşen istemli bir tepkimede tepkime ısısı (Q) tepkime entalpisine (∆H) eşit (Q = –∆H, işaretin eksi olduğuna dikkat ediniz.) olduğundan ortamın entropi değişimini hesaplayabileceğimiz bir bağıntıyı yazabiliriz. Sortam = − H T ☞ÖRNEK : 13 Metalürjide antimon saf metal olarak antimon(III) sülfürün demirle indirgenmesinden elde edilebilir. Sb2S3(k) + 3Fe(k) → 2Sb(k) + 3FeS(k) ΔH˚ = –125 kJ Buna göre 1 atm basınç ve 25 ˚C sıcaklıkta gerçekleşen tepkimede ortamın entropisini bulunuz. Sonucu yorumlayınız. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 45 ✍ÇÖZÜM Sortam = − H T Sortam = − −125 298 Sortam = 0, 419 kJ / K ’dir. Ortamın entropi değişim değerinin işaretinin pozitif olması tepkimenin ekzotermik, ısı akışının ise sistemden ortama doğru olduğunu gösterir. ☞ÖRNEK : 14 Metalürjide antimon saf metal olarak antimon(III) oksidin karbon tarafından indirgenmesinden de elde edilir. Sb4O6(k) + 6C(k) → 4Sb(k) + 6CO(g) ΔH˚ = 778 kJ Buna göre 1 atm basınç ve 25 ˚C sıcaklıkta bu tepkime ortamının entropisini (∆Sortam ) bulunuz ve sonucu yorumlayınız. ✍ÇÖZÜM Sortam = − H T Sortam = − 778 298 Sortam = − 2,, 61 kJ / K ’dir. Ortamın entropi değişim değerinin işareti negatif olduğundan ısı akışı ortamdan sisteme doğrudur. İncelediğiniz örneklerde sistemin entropisinin arttığı olaylarda ortamın entropisinin azaldığını, sistemin entropisinin azaldığı olaylarda ise ortamın entropisinin arttığını öğrendiniz. O hâlde evrenin entropi değişiminin, sistem ve ortamın entropi değişimlerinin toplamına eşit olacağını söyleyebiliriz ve aşağıdaki bağıntıyı yazabiliriz. ∆Sevren = ∆Ssistem + ∆Sortam Bu bağıntıya göre herhangi bir değişmede hem sistemin hem de ortamın entropi değişimi pozitif ise evrenin entropisi (∆Sevren > 0) artar ve değişme istemli olarak gerçekleşir. Bu sonuç Termodinamiğin İkinci Yasası’nın ifadesi olup “Her istemli olayda evrenin toplam entropisi artar. Evren zaman geçtikçe bir denge hâline yaklaşır.” şeklinde özetlenebilir. Eğer hem sistemin hem de ortamın entropi değişimi negatif ise değişme kesinlikle istemsizdir. Yukarıda incelediğimiz suyun donması olayında sistemin entropi değişim değerinin işareti negatif, ortamınkinin ise pozitiftir. Bu durumda suyun donmasının istemsiz bir değişme olması beklenir. Oysa sıcaklığın 0 ˚C’un altında olduğu değişmelerde ortamın entropisindeki artış, sistemin entropisindeki azalıştan daha fazla olur. Dolayısıyla toplam entropi değişimi pozitif olacağından suyun donması istemli olarak gerçekleşir. Bir olayın istemli olup olmaması ile o olaydaki entropi değişimi arasında ilişki kurarken olayın bütününü görmek gerekir. Örneğin, AgCl tuzunun suda çözünüp çözünmeyeceğini incelerken; + – AgCl(k) Ag (suda) + Cl(suda) çözünme tepkimesi, sadece AgCl iyon örgüsünün serbest iyonlara dönüşmesi süreci olarak görülmemelidir. Öyle görülürse katı örgünün entropisi küçük, serbest iyonların entropisi büyük olduğundan entropinin çözünme yönünde artacağı tahmini yapılıp AgCl tuzunun suda çok çözünmesi gerektiği kanısına varılabilir. Oysa izole sistemde Ag+ ve Cl– iyonları serbest olmayıp su molekülleri ile sarılırlar ve olayın bu adımında sistemin entropisinde azalma olur. AgCl tuzunun çözünürlüğünün çok azalmasında çözünme denkleminde görülmeyen bu adımın büyük bir rolü vardır. 46 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 4. Termodinamiğin Üçüncü Yasası ve Mutlak Entropi Daha önce sıcaklık değişimi ile madde moleküllerinin dönme, titreşim, öteleme enerjilerinin de değiştiğini öğrendiniz. Bu kez sıcaklık değişiminin entropi değişimine etkisini, suyun ısıtılması ve soğutulması olaylarını örnek alarak inceleyelim. Su ısıtıldığında molekülleri daha hareketli ve daha düzensiz hâle gelir ve entropisi artar. Eğer su buharlaştırılırsa molekülleri arasındaki uzaklık ve düzensizlikleri daha da artacağından entropisi de o oranda artar. Dolayısıyla su buharının entropisi aynı sıcaklıktaki suyun entropisinden daha büyük hâle gelir. Tersine, su soğutulursa moleküllerinin hareketleri yavaşlayacağından moleküllerin düzensizliği, dolayısıyla entropileri de azalmaya başlar. Su daha da soğutularak buz hâline getirildiği zaman moleküller sıvı hâle göre daha düzenli hâle gelir yani düzensizlikleri ve entropileri daha da azalır. Kristal hâlindeki bir katı soğutulduğunda entropisi devamlı azalır. Hatasız saf kristal maddelerde, sıcaklık düştükçe entropi de azalmaya devam eder. Sıcaklık mutlak sıfıra doğru giderken entropi de sıfıra yaklaşır. Mutlak sıfır sıcaklığında kristal madde içinde bulunan bütün atomlar yerli yerine oturur. Öteleme hareketleri tamamen durur. Kristal madde en düzenli hâle gelir ve entropisi sıfır olur. Madde kristal hâlde düzenliliğin en büyük, düzensizliğin ise en küçük olduğu duruma ulaşır. Bu sonuç Termodinamiğin Üçüncü Yasası olarak bilinir ve şöyle tanımlanır: “Mutlak sıfır sıcaklığında, bütün saf element ve bileşiklerin hatasız kristallerinin entropileri sıfırdır.” Termodinamiğin Üçüncü Yasası mutlak sıcaklık T = 0 ve entropi S0(hatasız kristal) = 0 şeklinde ifade edilir. Termodinamiğin Üçüncü Yasası saf element ve bileşiklerin hatasız kristalleri için geçerli olmakla beraber bazı kristal maddelerin mutlak sıfır noktasındaki entropileri sıfırdan biraz büyüktür. Sıfırdan biraz büyük değerlerin 0 kabul edilmesi entropi hesaplarında dikkate değer bir hataya yol açmaz. Bunun için Termodinamiğin Üçüncü Yasası’nın bütün kristal maddeler için geçerli sayılması ciddi bir problem yaratmaz. İç enerji ve entalpinin mutlak değerlerini hesaplayamadığımız hâlde termodinamiğin üçüncü yasası herhangi bir sıcaklıkta her bir element ve bileşiğin entropisini hesaplama olanağı verir. Bu hesaplama, entropinin sıcaklıkla değişimini veren ısınma ısısının ölçümüne dayanır. Bir element ya da bileşiğin 1 atm basınç ve 298 K sıcaklıktaki entropisi, standart mutlak entropi olarak adlandırılır. Elementlerin ve bazı bileşiklerin hesaplanan standart mutlak entropileri Tablo 1.3’te verilmiştir. İnceleyiniz. Tablo incelenirse katı bileşiklerin entropilerinin katı elementlerinkine göre sıvı bileşiklerin entropilerinin ise katı bileşiklerinkine göre daha büyük olduğu, gazlarda ise moleküldeki atom sayısı arttıkça entropilerinin de arttığı görülür. Standart mutlak entropileri veren tablolardan yararlanarak bir kimyasal tepkimenin entropi değişimi hesaplanabilir. Bir kimyasal tepkimenin entropi değişimi, tepkime entropisi olarak adlandırılır. Genel olarak bir tepkimenin standart tepkime entropisi, tepkimeye giren ve oluşan ürünlerin standart mutlak entropileri arasındaki farka eşittir. Bu eşitlik aşağıdaki gibi ifade edilebilir: ∆S˚ = ∑S˚(ürünler) – ∑S˚(girenler) Bu bağıntı aA + bB → cC + dD genel tepkimesi için aşağıdaki gibi genelleştirilebilir: ∆S˚ = [c S˚ (C) + d S˚ (D)] – [a S˚ (A) + b S˚ (B)] 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 47 Tablo 1.3: 25 ˚C’ta bazı maddelerin molar standart mutlak entropileri (S˚, J/mol K) Madde Formül S˚ J/molK Madde Gaz Formül S˚ J/molK Sıvı Asetilen C2H2(g) 200,9 Asetik asit CH3COOH(s) 159,8 Karbon dioksit CO2(g) 213,8 Etanol CH3CH2OH(s) 160,7 Karbon monoksit CO(g) 197,7 Su H2O(s) Etilen C2H4(g) 219,5 Metanol CH3OH(s) 126,8 Metan CH4(g) 186,3 Benzen C6H6(s) 173,4 Azot dioksit NO2(g) 240,1 Diazot tetraoksit N2O4(g) 304,4 Amonyum klorür NH4Cl(k) 94,6 Hidrojen H2(g) 130,7 Kalsiyum karbonat CaCO3(k) 91,7 Azot N2(g) 191,6 Kalsiyum oksit CaO(k) 38,1 Oksijen O2(g) 205,2 Elmas C (k) 2,4 Su H2O(g) 188,8 Grafit C (k) 5,7 Amonyak NH3(g) 192,8 Demir(III) oksit Fe2O3(k) 87,4 Metanol CH3OH(g) 239,9 Sodyum Na(k) 51,3 Benzen C6H6(g) 269,2 Demir Fe(k) 27,3 Hidrojen klorür HCl(g) 186,9 Sodyum klorür NaCl(k) 72,1 70,0 Katı ☞ÖRNEK : 15 1 atm basınç ve 25 ˚C sıcaklıkta elementlerinden amonyak (NH3) sentezi tepkimesinin standart entropi değişimini hesaplayınız. Sonucunu yorumlayınız. (S˚N2(g) = 191,6 J/mol K, S˚H2(g) = 130,7 J/mol K, S˚NH3(g) = 192,8 J/mol K) ✍ÇÖZÜM N2(g) + 3H2(g) → 2NH3(g) ΔS˚ = [2 . S˚NH3 ] – [S˚N2 + 3S˚H2 ] ΔS˚ = [(2 mol) (192,8 J/mol K)] – [(1 mol) (191,6 J/mol K)] + [(3 mol) (130,7 J/mol K)] ΔS˚ = 385,6 – 583,7 ⇒ ΔS˚ = –198,1 J/K’dir. Sistemin entropi değişimin işareti negatiftir. Dolayısıyla tepkime sonunda sistemin entropisi azalmıştır. ☞ÖRNEK : 16 1 atm basınç ve 25 ˚C sıcaklıkta grafit ile oksijen tepkimesinden karbon dioksit (CO2) elde ediliyor. Bu tepkimenin entropisi 2,9 J/K’dir. Bu tepkimeden yararlanarak karbon dioksidin standart molar entropisini hesaplayınız. Sonucu yorumlayınız. (S˚C(grafit) = 5,7 J/mol K, S˚O2 = 205,2 J/mol K) ✍ÇÖZÜM C(grafit) + O2(g) → CO2(g) ΔS˚ = [S˚CO2 ] – [S˚C(grafit) + S˚O2 ] ⇒ 2,9 = S˚CO2 – [5,7 + 205,2) ⇒ 2,9 = S˚CO2 – 210,9 = 213,8 J/K mol’dür. Karbon dioksidin standart molar entropisinin işareti pozitiftir. Dolayısıyla karbon dioksidin entpopisi, karbon ve oksijen elementlerininkinden daha büyüktür. 48 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 17 Standart koşullarda demir(III) oksidin elementlerinden oluşumuna ait tepkimenin denklemi aşağıda verilmiştir. 4Fe(k) + 3O2(g) → 2Fe2O3(k) Tepkimenin standart koşullarda istemli ya da istemsiz oluşunu tartışınız. (SF̊e (k) = 27,3 J/mol K, S˚O2(g) = 205,2 J/mol K, ∆SF̊e2O3(k) = 87,4 J/mol K, ∆HF̊e2O3(k) = –824,2 kJ/mol) ✍ÇÖZÜM Örnek alınan tepkimenin istemli mi yoksa istemsiz mi gerçekleşeceğine karar verebilmek için evrenin entropi değişimini bilmek gerekir. Evrenin entropi değişimini bilebilmek için de sırasıyla ortamın ve sistemin entropi değişimlerini hesaplamak gerekir. Ortamın entropi değişimi ∆Sortam = –∆H/T bağıntısı ile hesaplanabileceğinden öncelikle tepkimedeki entalpi değişimi hesaplanmalıdır. Tepkimede Fe2O3(k) elementlerinden sentezlendiğinden tepkimenin entalpi değişimi Fe2O3 ’in oluşum entalpisine eşittir. Tepkimede 2 mol Fe2O3 elde edilmiştir. Buna göre; ∆H˚ = 2∆HF̊e2O3(k) ∆H˚ = 2 · (–824,2) ⇒ ∆H˚ = –1648,4 kJ = –1648,4 · 103 J ’dür. Sortam = − H T Sortam = − −1648, 4 · 103 J 273 + 25 K Sortam ≈ 5, 53 · 103 J / K ’dir. Bu aşamada sistemdeki entropi değişimini hesaplamak gerekir. ΔSs̊istem = ∑Sü̊rünler – ∑Sg̊irenler ΔSs̊istem = [2SF̊e2O3 ] – [4SF̊e + 3S˚O2] ⇒ ΔS˚ = [2 · 87,4] – [4 . 27,3 + 3 · 205,2] ΔSs̊istem = 174,8 – [109,2 + 615,6] ⇒ ΔS˚ = 174,8 – 724,8 ΔSs̊istem = –550,0 J/K’ dir. Hesapladığımız sistem ve ortam entropi değerlerinden yararlanarak evrenin (toplam) entropi değişimini hesaplayabiliriz. ΔSevren = ΔSortam + ΔSsistem ΔSevren = 5,53 · 103 + (–550,0) ⇒ ΔSevren = 5530 – 550,0 ΔSevren = 4980,0 J/K’dir. Bu sonuca göre evrenin entropisi artmaktadır. O hâlde tepkime standart koşullarda istemli gerçekleşir. ☞ÖRNEK : 18 Standart koşullarda CaCO3 ’tan CaO ve CO2 oluşumuna ait tepkime denklemi aşağıda verilmiştir: CaCO3(k) → CaO(k) + CO2(g) Tepkimenin standart koşullarda istemli ya da istemsizliğini irdeleyiniz. (S˚CaCO3(k) = 91,7 J/mol K, S˚CaO(k) = 38,1 J/mol K, S˚CO2(g) = 213,8 J/mol K, ΔH˚CaCO3(k) = –1207,6 kJ/ mol, ΔH˚CaO(k) = –634,9 kJ/ mol, ΔH˚CO2(g) = –393,5 kJ/mol) 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 49 ✍ÇÖZÜM Çözüm için bir önceki örnekte verilen işlem sırasını izleyebiliriz. ΔH˚ = ∑ΔHü̊rünler – ∑ΔHg̊irenler ΔH˚ = [ΔH˚CO2 + ΔH˚CaO ] – [ΔH˚CaCO3 ] ΔH˚ = [–393,5 – 634,9] – [1207,6] ΔH˚ = –1028,4 + 1207,6 ΔH˚ = +179,2 kJ = +179,2 · 103 J H T 179, 2 · 103 =− 273 + 25 Sortam = − Sortam Sortam = – 601, 34 J / K ’dir. ΔSs̊istem = ∑Sü̊rünler – ∑Sg̊irenler ΔSs̊istem = [S˚CO2 + S˚CaO ] – [S˚CaCO3 ] ΔS˚ = [213,8 + 38,1] – [91,7] ΔSs̊istem = 251,9 – 91,7 ΔS˚ = 160,2 J’dür. ΔSevren = ΔSortam + ΔSsistem ΔSevren = –601,34 + 160,2 ΔSevren = –441,14 J/K’dir. Bu sonuca göre evrenin entropisi azalmaktadır. Evrenin entropisinin azaldığı bu tepkime standart koşullarda istemsizdir. 5. Serbest Enerji Bir olayın istemli gerçekleşmesinin daha düşük enerjili ve daha düzensiz olma eğilimlerine bağlı olduğunu öğrendiniz. Ancak doğa olaylarının pek çoğunda bu iki eğilim birbirinin karşıtıdır. Söz gelimi buzun erimesi olayında sistem daha yüksek enerjili hâle geldiğinden bu değişmenin istemli gerçekleşmemesi gerekir. Ancak buz eriyerek daha düzensiz bir yapı kazanır. Dolayısıyla bu olayda daha düzensiz olma eğilimi, daha az enerjili olma eğiliminden daha büyüktür. Ancak bu olayda düzensizlik eğilimini daha etkin kılan ana etken sıcaklıktır. Bu nedenledir ki sıcaklık 0 ˚C’un üzerinde olduğunda erime, altında olduğunda ise donma olayı istemli olarak gerçekleşir. Bu sonuca göre olayların istemli mi yoksa istemsiz mi gerçekleşeceğine, en az enerji ve en fazla düzensizlik eğilimlerine bakarak karar vermek olanaklı değildir. Değişmenin istemli olup olmayacağına karar verebilmemiz için başka bir ölçüt bulmak gerekir. Daha önce ortam ve sistemin entropilerinin toplamının (∆Sevren = ∆Sortam + ∆Ssistem ) evrenin entropisine eşit olduğunu, zaman geçtikçe evrenin entopisinin bir denge hâline yaklaştığını öğrenmiştiniz. − H˚ Yukarıdaki bağıntıda ∆Sortam yerine ’yi alabileceğimizi biliyorsunuz. Bağıntıyı buna göre yeniden T düzenlersek aşağıdaki bağıntıyı elde ederiz: Sevren = 50 − H˚ + Ssistem T ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bu bağıntının her iki yanını –T ile çarparsak aşağıdaki eşitliği elde ederiz. –T∆Sevren = ∆H˚ – T∆S Bu eşitliğin sağındaki terimler sisteme ait olup ∆H˚ alınan ya da verilen ısıyı (entalpiyi), T∆S kullanılmayan termal enerjiyi, soldaki terim ise evrenin entropi değişimini ifade eder. Evrenin entropi değişimi Gibbs serbest enerjisi (G) olarak adlandırılan bir hâl fonksiyonu olup kullanılabilir (iş yapmaya hazır) enerjiyi gösterir. Buna göre eşitliği yeniden düzenlersek; ∆G = ∆H˚ – T∆S bağıntısını elde ederiz [Bağıntıda kullandığımız G ifadesi termodinamiğin anlamlı bir hâle dönüştürülmesini sağlayan Josiah Willard Gibbs (Resim 1.7, Caşua Vilırd Gibs)’e izafeten verilmiştir.]. Bu bağıntıya göre değişmenin istemli olup olmayacağı ile ilgili tahminleri serbest enerji değişmesini dikkate alarak yapabiliriz. Sabit basınç ve sıcaklıkta gerçekleşen bir olayda; ®∆G < 0 (negatif) ise değişme istemlidir. ®∆G > 0 (pozitif) ise değişme istemsizdir. ®∆G = 0 (sıfır) ise sistem dengededir. İstemli değişmede ∆G < 0, istemsiz değişmede ∆G > 0 olduğuna göre ∆G = 0 durumunda ileri ve geri yöndeki (istemli, istemsiz) değişmeler eşit olma eğilimindedir. Bu bize ∆G = 0 durumunun tersinir (denge) olaylara karşılık geldiğini gösterir. Neden? Resim 1.7: J. W. Gibbs Gibbs serbest enerji bağıntısını dikkate alarak olayların hangi koşullarda istemli/istemsiz gerçekleşebileceğini ya da denge durumunda kalacağını gördünüz. Ancak herhangi bir enerji değişimi olmaksızın gerçekleşen olaylar da vardır. Söz gelimi aynı sıcaklık ve basınç altındaki iki ideal gazın birbiri içinde tamamen dağılması olayı (gaz moleküllerinin ideal davrandığı ve molekülleri arasında bir etkileşim olmadığı varsayılırsa) enerji değişimi olmaksızın gerçekleşen olaylara örnek verilebilir. Bu örnek olayda enerji alış verişi olmadığından ortamın entropisi (∆Sortam) değişmezken her iki gazın hacminin büyümesi, moleküllerin dağılma olasılığının artması, sistemin entropisini (∆Ssistem > 0) artırır. Bu artış evrenin entropisinin de artmasını gerektirir. Dolayısıyla bir enerji değişimi olmaksızın gazların kendiliğinden birbiri içinde rastgele dağılması olayı, evrenin entropisinin de artmasına neden olur. Bu sonuç “Enerji değişimi olmayan hiçbir istemli olayda entropi azalması olamaz.” şeklinde genelleştirilebilir. Bu genelleme Termodinamiğin İkinci Yasası’nın başka bir ifadesidir. Herhangi bir sistemde olaylar gerçekleştiği hıza eşit bir hızla geri dönüyorsa sistemde bir denge hâlinin bulunduğu kabul edilir. Dolayısıyla bir sistemde denge hâli, tersinir (iki yönlü) olayların birbirine eşit hızla gerçekleştiği durumdur. Bu sonuç ∆G sıfıra çok yakın olduğu durumlarda dengenin hangi yönde bozulacağı sorusunu akla getirir. Söz gelimi ∆G = –0,5 kJ/mol ise sistemde denge hangi yönde bozulmalıdır? Bildiğiniz gibi ∆G = 0 ise sistemde denge hâli söz konusudur. ∆G = –0,5 kJ/mol durumda ise sistem dengeye çok yakın olmakla beraber değişme, ürünler yönünde istemlidir. Tersine, ∆G = + 0,5 kJ/mol ise sistem yine dengeye çok yakın olmakla beraber istemli değişme girenler yönündedir. 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 51 1 atm basınç, 0 ˚C sıcaklıkta su ve buzun bir arada ve dengede bulunduğunu bilirsiniz. O hâlde bu olaydaki denge durumunu Gibbs serbest enerjisi ile açıklayabilmemiz gerekir. Ancak bu açıklamayı yapabilmek için öncelikle suyun molar entalpi ve entropi değerlerine ihtiyaç duyarız. Bu değerler şöyledir: ∆Hdonma= –∆Herime = –6,025 kJ/mol (–6025 J/mol) ∆Sdonma = –∆Serime = –22,07 J/mol K’dir. Bu değerler; ∆G= ∆H – T∆S bağıntısında yerine yazılırsa; ∆G= –6025 – 273 · (–22,07) ⇒ ∆G = –6025 + 6025 ∆G = 0 bulunur. Bu sonuç 1 atm basınç ve 0 ˚C sıcaklık koşulunda suyun neden buzu ile dengede bulunduğunu gösterir. Gibbs serbest enerjisiyle ilgili bağıntıdan hareketle standart koşullarda istemli değişme tahminleri Tablo 1.4’te örnekleriyle verilmiştir. İnceleyiniz. Tablo 1.4: Gibbs serbest enerjisine göre standart koşullarda gerçekleşen tepkimelerde istem tahminleri Durum ∆H ∆S ∆G Sonuç 1 – + – 2 + – + Tepkime bütün sıcaklıklarda istemlidir. Tepkime hiçbir sıcaklıkta istemli değildir. Örnek C6H12O6(k) → 2C2H5OH(s) + 2CO2(g) 3O2(g) → 2O3(g) Şimdi örnek problemleri çözerek hangi olayların istemli ya da istemsiz gerçekleşeceğini, hangi olaylarda sistemin denge hâlinde bulunacağını tahmin etmeye çalışalım. ☞ÖRNEK : 19 Aşağıda bazı tepkime denklemleri verilmiştir. Gibbs serbest enerji bağıntısı göz önüne alındığında bu tepkimelerin istemli ya da istemsiz gerçekleşmesi hakkında ne söylenebilir? a. 2O3(g) → 3O2(g) tepkimesi için ∆H < 0 ve ∆S > 0 b. 2Ag(k) + 3N2(g) → 2AgN3(k) tepkimesi için ∆H > 0 ve ∆S < 0 ✍ÇÖZÜM Gibbs serbest enerji bağıntısını göz önüne alarak aşağıdaki tahminlerde bulunabiliriz. a.2O3(g) → 3O2(g) ∆H < 0, ∆S > 0 ise ∆G < 0’dır. Tepkime bütün sıcaklıklarda istemli gerçekleşir. b. 2Ag(k) + 3N2(g) → 2AgN3(k) 52 ∆H > 0, ∆S < 0 ise ∆G > 0’dır. Tepkime hiçbir sıcaklıkta kendiliğinden oluşmaz. ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 20 25 ˚C’ta gerçekleşen ve aşağıda denklemi verilen tepkimenin serbest enerji değişimini (∆G) hesaplayınız. 2H2O2(s) → 2H2O(s) + O2(g) Bileşik ∆Hf̊ H2O2(s) –187,8 109,6 H2O(s) –285,8 70,0 –––– 205,2 O2(g) (kJ/mol) S˚ (J/K · mol) ✍ÇÖZÜM Öncelikle tepkimenin entalpi ve entropi değişimleri hesaplanır. ΔH˚ = ∑∆Hü̊rünler – ∑∆Hg̊irenler ΔH˚ = [2 · ∆Hf̊H2O(s) + ∆Hf̊O2(g)] – [2 · ∆Hf̊H2O2(s)] ΔH˚ = [2 · (–285,8) + 0] – [2 · (–187,8)] ΔH˚ = –571,6 + 375,6 ΔH˚ = –196 kJ ΔS˚ = ∑Sü̊rünler – ∑Sg̊irenler ΔS˚ = [2 · S˚H2O(s) + S˚O2(g)] – [2 · S˚H2O2(s)] ΔS˚ = [2.70,0 + 205,2] – [2 · 109,6] ΔS˚ = [140,0 + 205,2] – 219,2 ΔS˚ = 345,2 – 219,2 ΔS˚ = 126,0 J/K bulunur. Tepkimenin entalpi ve entropi değişim değerlerinden yararlanarak tepkimenin serbest enerji değişimi bulunur. ΔG˚ = ∆H˚ – TΔS˚ ΔG˚ = –196 · 1000 – 298 · (126,0) ΔG˚ = –196 000 – 37 548 ΔG˚ = –233 548 J ΔG˚ = –233,548 kJ bulunur. ☞ÖRNEK : 21 Demir metali sanayide, demir cevherinin içindeki demir(III) oksidin karbon monoksitle indirgenmesinden elde edilir. Fe2O3(k) + 3CO(g) → 2Fe(k) + 3CO2(g) Fe2O3(k) CO(g) Fe(k) CO2(g) ∆H˚f (kJ/mol) –824,2 –110,5 0 –393,5 S˚ (J/mol K) 87,4 197,7 27,3 213,8 a. Tepkimenin 1 atm basınç ve 25 ˚C sıcaklıktaki standart serbest enerji değişimini hesaplayınız. b. Tepkime standart koşullarda istemli midir? c. Geri yöndeki tepkime yüksek sıcaklıklarda istemli midir? 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji 53 ✍ÇÖZÜM a. ∆H˚=[2∆Hf̊ (Fe) + 3 ∆Hf̊ (CO2 )] – [∆Hf̊ (Fe2O3) + 3 ∆Hf̊ (CO)] ∆H˚=[2 · 0 + 3 · (–393,5)] – [–824,2 + 3 · (–110,5)] ∆H˚ = –1180,5 + 824,2 + 331,5 ∆H˚=–1180,5 + 1155,7 ∆H˚ = –24,8 kJ’dür. b. ∆S˚=[2S˚(Fe) + 3S˚(CO2)] – [S˚(Fe2O3) + 3S˚(CO)] ∆S˚=[2 · 27,3 + 3 · 213,8] – [87,4 + 3 · 197,7] ∆S˚ = [54,6 + 641,4] – [87,4 + 593,1] ∆S˚=696 – 680,5 ⇒ ∆S˚ = +15,5 J/K ∆S˚=0,0155 kJ/K olur. ∆G˚=∆H˚ – T∆S˚ ∆G˚=– 24,8 – 298 · 0,0155 ∆G˚ = –29,419 kJ elde edilir. ∆G˚< 0 olduğundan tepkime standart koşullarda istemlidir. c. ∆G˚ = ∆H˚ – T∆S˚ 0 = 24,8 – T · 0,0155 T= 24,8 5 0,0155 24,8 = T · 0,0155 T = 1600 K’dir. Ters yöndeki tepkime bu sıcaklığın üstündeki sıcaklıklarda istemlidir. ☞ÖRNEK : 22 Aşağıda verilen tepkimelerden; a. Hangisi herhangi bir sıcaklıkta kendiliğinden gerçekleşir? b. Hangisi hiçbir sıcaklıkta gerçekleşmez? ΔH˚ΔS˚ ––– ––– I. C8H18(s) + 25/2O2(g) → 8CO2(g) + 9H2O(g) – + II. 2C(k) + 2H2(g) → C2H4(g) + – ✍ÇÖZÜM a. ∆G˚ = ∆H˚ – T∆S˚ dir. I. tepkide ∆G˚ < 0 olduğundan bu tepkime her sıcaklıkta kendiliğinden gerçekleşir. b. II. tepkimede ∆H˚ ve ∆S˚ değeri pozitif çıkacağından ∆G˚ > 0’dır. Bu nedenle bu tepkime hiç bir sıcaklıkta kendiliğinden gerçekleşmez. 54 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Aşağıda verilen değişimlerde sistemin entropisi artar mı yoksa azalır mı? Neden? a. Kuru buzun (CO2) süblimleşmesi b. Kömürün yanması c. Zeytinyağının donması ç. SO3 gazının suda çözünmesi 2. Aşağıda denklemleri verilen değişmelerde entropi değişimlerini irdeleyiniz. a. (NH4)2Cr2O7(k) → Cr2O3(k) + N2(g) + 4H2O(g) b. 2NO(g) + O2(g) → 2NO2(g) c. MgSO4(suda) → MgSO4(k) ç. 2NH3(g) → N2(g) + 3H2(g) 3. Bir kimyasal tepkimenin ΔH˚ = –35,4 kJ ve ΔS˚ = –85,5 J/K olduğuna göre; a. Sistemde değişme düzenliliğe mi yoksa düzensizliğe mi doğrudur? b. 298 K’de tepkime istemli midir? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Bir sistemin enerji kazanması ya da kaybetmesi entropisini etkiler. ( ... ) 2. Sistem ve ortamın entropi değişimleri negatif ise değişme kesinlikle istemlidir. ( ... ) 3.ΔG bütün sıcaklıklarda pozitif ise değişme istemlidir. ( ... ) 4. İstemli değişmelerde evrenin entropisi artar. ( ... ) 5. Bir sistem denge konumunda ise ∆G = 0’dır. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. I.Entropi, bir sistemdeki düzensizliğin ölçüsü olarak ifade edilir. II.Sistemdeki düzensizlik arttıkça sistemin entropisi artar. III.Sistem ile ortamın entropileri toplamı daima pozitiftir. Entropi ile ilgili yukarıdaki yargılardan hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 2. Bir sistemin düzensizliği entropi ile ifade edilir. Buna göre aşağıdaki olaylardan hangisi bu ifadeyi doğrulamaz? A) Bir maddenin sıvı hâli katı hâline göre daha yüksek entropilidir. B) Sıcaklık yükseldikçe maddenin entropisi artar. C) Kimyasal tepkimelerde gaz moleküllerinin sayısı arttıkça entropi artar. D) Suda çözünmüş bir gazın gaz hâline göre entropisi daha büyüktür. E) Süblimleşen maddenin entropisi artar. 3. Demir metali, demir(III) oksidin hidrojenle indirgenmesinden elde edilebilir. Fe2O3(k) + 3H2(g) → 2Fe(k) + 3H2O(g) ΔH˚ = +98,8 kJ ; ΔS˚ = +141,5 J/K Hangi sıcaklıkta bu tepkime kendiliğinden gerçekleşir? A) 425 ˚C B) 375 ˚C C) 210 ˚C 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji D) 178 ˚C E) 65 ˚C 55 1. Ü N İ T E D E Ğ E R L E N D İ R M E Ç A L I Ş M A L A R I A. Aşağıdaki soruları yanıtlayınız. 1. Evren, sistem ve ortam kavramlarını bir örnek üzerinde açıklayınız. 2. İstemsiz bir olay nasıl istemli hâle getirilebilir? 3. Hess Yasası ile tepkime entalpisi arasında nasıl bir ilişki vardır? Açıklayınız. 4. İstemlilik ve istemsizlik ne demektir? Açıklayınız. 5. Bir olayın istemli mi yoksa istemsiz mi gerçekleşeceği nasıl anlaşılır? 6. Aşağıda verilen dört tepkimenin standart koşullarda istemliliklerini ya da istemsizliklerini tartışınız. ∆H˚ (1 atm, 298 K) kJ ∆S˚ (1 atm, 298 K) J/K a.N2(g) + 3F2(g) → 2NF3(g) –249 –277,8 b.N2(g) + 3Cl2(g) → 2NCl3(g) +460 –275 c.N2F4(g) → 2NF2(g) +93,3 +198,3 ç. C3H8(g) + 5O2(g) → 3CO2(g) + 4 H2O(g) –2044,7 +101,3 7. Yanda numaralandırılmış olarak verilen her bir şekli inceleyerek aşağıda verilen yargılarla eşleştiriniz. a. Değişim istemlidir. b. Değişimin gerçekleşmesi olanaksızdır. c. Değişim istemsizdir. ç. Sistem dengededir. 1 2 3 4 8. 6NO(g) + 4NH3(g) → 5N2(g) + 6H2O(g) ΔH˚ = –1815 kJ tepkimesinde ΔHf̊NO (g) = +91,30 kJ/mol, ΔHf̊H O 2 (g) = –241,8 kJ/mol olduğuna göre NH3(g)’ın standart molar oluşum entalpisini hesaplayınız. 9. Amonyum klorürün standart koşullarda bozunmasına ait tepkime denklemi aşağıda verilmiştir. NH4Cl(k) → NH3(g) + HCl(g) S˚NH4Cl(k) = 94,6 J/mol K, S˚NH3(g) = 192,8 J/mol K, S˚HCl(g) = 186,9 J/mol K standart molar oluşma entropi değerleri bilindiğine göre tepkimenin entropi değişimini hesaplayınız. 10. CO(NH2)2(suda) + H2O(s) → CO2(g) + 2NH3(g) Yukarıdaki tepkimeye ait standart molar oluşum entalpi ve entropi değerleri şöyledir: CO(NH2)2(suda) ∆Hf̊ (kJ/mol) –319,2 S˚ (J/mol K) 173,8 H2O(s) CO2(g) –285,8 –393,5 70,0 213,8 NH3(g) –45,9 192,8 Bu verilere göre tepkimenin serbest enerjisi kaç kJ’dür? 56 ORTAÖĞRETİM KİMYA 11 DERS KİTABI B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Kimyasal değişmelere daima enerji değişimi eşlik eder. ( ... ) 2. Isı alan tepkimeler ekzotermik tepkime olarak adlandırılır. ( ... ) 3. Tepkimelerde ısı değişimi entalpi ile ifade edilir. ( ... ) 4. Bağların kırılmasında enerji alınması, bağ oluşumunda ise enerji salınması söz konusudur. ( ... ) 5. Bir kimyasal tepkimede ΔS = 0, ΔH = 0 ise tepkime istemlidir. ( ... ) 6. Bir kimyasal tepkimede net ısı değişimi bu tepkimenin birkaç basamakta ( ... ) gerçekleşmesine bağlı değildir. C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. C(grafit) + O2(g) → CO2(g) ∆H˚= –393,50 kJ C(elmas) + O2(g) → CO2(g) ∆H˚= –395,40 kJ Tepkime ısıları bilindiğine göre C(grafit) → C(elmas) tepkimesinin tepkime entalpisi değişimi aşağıdakilerden hangisidir? A) +788,9 B) –788,9 C) +1,9 D) – 1,9 2. I. Bir kristalin entropisi, kristal en düzenli olduğu durumda sıfırdır. II. Entropi enerji gibi korunan bir özellik değildir. E) 0 III. Sistemlerdeki düzensizlik arttıkça entropisi de artar. Yukarıda verilen yargılardan hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 3. Aşağıdaki tepkimelerin hangisinde entropi değişimi azalma yönündedir? A) N2(g) + 3 H2(g) → 2NH3(g) B) CaSO4(k) → CaO(k) + SO3(g) C) I2(k) → I2(g) D) CO2(k) → CO2(g) (Kuru buzun süblimleşmesi) E) H2(g) + I2(g) → 2HI(g) 4. I. Kibritin yanması II. Yumurtanın kırılması III. Sprey kokusunun yayılması IV. Suya atılan cismin suda asılı kalması Yukarıdaki olaylardan hangilerinde entropi artmaktadır? A) I ve II B) III ve IV C) II ve IV D) I, II ve III 5. C(k) + O2(g) → CO2(g) ∆H˚ = –393,5 kJ H2(g) + 1/2O2(g) → H2O(g) ∆H˚ = –241,8 kJ CO(g) + 1/2O2(g) → CO2(g) ∆H˚ = –283 kJ CH4(g) + 2O2(g) → CO2(g) + 2H2O(s) ∆H˚ = –890 kJ C2H6(g) + 7/2O2(g) → 2CO2(g) + 3H2O(g) ∆H˚ = –1559,8 kJ E) II, III ve IV Bazı maddelerin molar yanma ısıları yukarıda verilmiştir. Bu maddelerden eşit kütlelerde alınarak yeterince O2 içinde yakıldığında hangisi en iyi yakıt olarak nitelenebilir? (C : 12, H : 1, O : 16) A) C B) H2 C) CO 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji D) CH4 E) C2H6 57 6. Bazı bileşiklerin standart molar oluşum entalpileri aşağıda verilmiştir: ∆Hf̊H S 2 (g) = –20,6 kJ/mol, ∆Hf̊H O = 2 (g) –241,8 kJ/mol, ∆H˚f̊O2(g) = –296,8 kJ/mol Buna göre 2H2S(g) + 3O2(g) → 2H2O(g) + 2SO2(g) tepkimesinin entalpisi kaç kJ’dür? A) –1118 7. ∆Hf̊NO (g) B) –1036 = +90,25 kJ/mol, ∆Hf̊NH 3(g) C) –518,8 = –45,9 kJ/mol, D) +1036 ∆Hf̊H O = 2 (g) E) +1118 –241,8 kJ/mol NO, NH3 ve H2O’yun standart molar oluşum entalpileri verilmiştir. Buna göre; 6NO(g) + 4NH3(g) → 5N2(g) + 6H2O(g) tepkime entalpisi kaç kJ’dür? A) –197,5 B) –358 8. NO2(g) → NO(g) + 1/2O2(g) C) –542 D) –1092,8 E) – 1808,7 ∆H˚ = +58,6 kJ SO2(g) + 1/2O2(g) + H2O(s) → H2SO4(s) ∆H˚ = –230 kJ tepkime ısıları bilindiğine göre; NO2(g) + SO2(g) + H2O(s) → H2SO4(s) + NO(g) tepkime entalpisi kaç kJ’dür? A) –288,7 B) –171,4 C) +171,4 D) +288,7 E) +318 9. 1/2N2(g) + O2(g) + 33,18 kJ → NO2(g) N2(g) + 3H2(g) → 2NH3(g) ∆H˚ = –92,2 kJ 2H2(g) + O2(g) → 2H2O(g) + 483,6 kJ tepkime entalpileri bilindiğine göre; 2NO2(g) + 7H2(g) → 2NH3(g) + 4H2O(g) tepkime entalpisi kaç kJ’dür? A) –993,04 B) –1096,21 C) –1125,76 D) –1966,53 E) –2033,48 10. 6KOH(suda) + 3Cl2(g) → 5KCl(k) + KClO3(k) + 3H2O(s) ∆H˚ = –862 kJ tepkimesindeki maddelerin standart oluşum entalpileri; ∆Hf̊KOH (k) = –424,8 kJ/mol, ∆Hf̊KCl(k) = –436,7 kJ/mol, ∆Hf̊H2O(s) = –285,8 kJ/mol olarak veriliyor. Buna göre KClO3(k) ’ın standart molar oluşum entalpisi kaç kJ/mol’dür? A) –192,5 B) –292,9 C) –369,9 D) +292,9 E) +369,9 11. H2(g) + S(g) → H2S(g) ∆H˚ = –20,6 kJ 2Ag(k) + S(g) → Ag2S(k) ∆H˚ = –32,6 kJ 1/2H2(g) + 1/2N2(g) + 3/2O2(g) → HNO3(s) ∆H˚ = –174,1 kJ tepkime ısıları bilinmektedir. 2AgNO3(k) + H2S(g) → Ag2S(k) + 2HNO3(s) tepkimesinin ısısı ∆H˚ = –112,1 kJ olduğuna göre AgNO3(k)’ın standart molar oluşum entalpisi kaç kJ/mol’dür? A) –124,05 12. ∆Hf̊NaOH ∆Hf̊NaClO (k) B) –158,2 = –425,6 kJ/mol, 3(k) = –365,8 kJ/mol, C) –245,4 ∆Hf̊NaCl = –411,2 kJ/mol, ∆Hf̊H O 2 (s) = –285,8 kJ/mol (k) D) –266,9 E) –379 standart molar oluşum entalpileri bilinmektedir. 6NaOH(k) + 3Cl2(g) → 5NaCl(k) + NaClO3(k) + 3H2O(s) tepkimesinin gerçekleşmesi için 400 cm3 NaOH çözeltisinden yeterince Cl2 gazı geçirilerek tepkime sonuçlandığında 36,255 kJ ısı açığa çıkmaktadır. Buna göre NaOH çözeltisinin molar derişimi kaçtır? A) 0,25 58 B) 0,50 C) 0,75 D) 1,25 E) 1,5 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 13. X2SO4 bileşiğinin standart molar oluşum entalpisi ∆Hf̊= –1431 kJ/mol’dür. X2SO4 bileşiğinin 29 g’ı oluşurken 238,5 kJ ısı açığa çıktığına göre X elementinin atom kütlesi kaçtır? (S : 32, O : 16) A) 23 B) 39 14. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) C) 64 D) 85 E) 107 ∆H˚ = –890 kJ Yukarıdaki tepkime normal koşullarda 2,24 L CH4 gazı ve 8 g oksijen gazı ile gerçekleştirildiğinde 80,33 kJ ısı açığa çıkıyor. Tepkimeden daha çok ısı elde etmek için; I. Daha çok CH4 kullanmak, II. Daha çok O2 kullanmak, III. Tepkimeyi kapalı bir sistemde gerçekleştirmek, işlemlerinden hangisi ya da hangileri uygulanmalıdır? (O: 16) A) Yalnız I B) Yalnız II C) Yalnız III 15. 2NH3(g) + 3N2O(g) → 4N2(g) + 3H2O(s) ∆H1̊ 4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(s) ∆H2̊ D) I ve III E) II ve III tepkimelerinin ısıları ∆H1̊ ve ∆H2̊ dir. Buna göre; 2N2O(g) → 2N2(g) + O2(g) tepkimesinin entalpisi ne olur? A) H1 + H2 2 D) H1 + 3 H2 2 C) 2 H1 − H2 3 B) 3 H1 + H2 2 E) 2( H1 − H2 ) 3 16. Br2(s) → Br2(g) Yukarıdaki tepkimenin entalpi değişimi ΔH˚ = +31,0 kJ ve entropi değişimi, ΔS˚ = 92,9 J/K’dir. Buna göre sıvı brom kaç ˚C’ta gaz hâline geçebilir? A) 16 B) 61 C) 78 D) 129 E) 334 17. Bir tepkimede ΔH˚ = –152 kJ, ΔS = 192 J/K ise; I. Tepkime tüm sıcaklıklarda istemlidir. II. Tepkime minimum enerjili, maksimum düzensiz olma eğilimindedir. III. Tepkimenin serbest enerji değerinin işareti pozitiftir. Yukarıdaki öncüllerden hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 18. Bir tepkimenin standart koşullarda entalpi değişimi +119,3 kJ, entropi değişimi +354,9 J/K’dir. Tepkime ile ilgili olarak; I. Tepkimede ΔG˚ < 0’dır. II. Tepkimede ΔSevren > 0’dır. III. Tepkime istemsizdir. Yukarıda verilen yargılardan hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve II 1. ÜNİTE: Kimyasal Reaksiyonlar ve Enerji D) II ve III E) I, II ve III 59 2. ÜNİTE REAKSİYON HIZLARI VE KİMYASAL DENGE ÜNİTE İÇERİĞİ 1.REAKSİYON HIZLARI 2.KİMYASAL DENGE Bu ünitede, reaksiyona giren maddelerin ve ürünlerin derişimlerinin zamanla değişimi irdelenerek anlık ve ortalama hız değerlerinin ayrımı, reaksiyon hızının bağlı olduğu etkenlerle birlikte tek ve çok basamaklı reaksiyonlarda hızın belirlenmesi işlenmektedir. Ayrıca kimyasal reaksiyonlarda denge ifadesinin türetilmesi, denge sabitlerinin sıcaklıkla ilişkisi, kimyasal dengeyi etkileyen değişkenler irdelenerek bunların ürün verimine etkisi tartışılacaktır. 60 ORTAÖĞRETİM KİMYA 11 DERS KİTABI REAKSİYON HIZLARI BÖLÜM İÇERİĞİ 1.Reaksiyon Hızı 2.Reaksiyon Hız Denklemi 3.Reaksiyon Hızını Etkileyen Etkenler 4.Reaksiyon Derecesi ve Molekülerite Otomobillerde çarpışma anında çok hızlı bir biçimde açılıp bir gaz yardımıyla şişerek yolcunun yaralanmasını önleyen, esnek bir malzemeden yapılmış hava yastıklarının bulunduğunu biliyorsunuzdur. Hava yastıklarının çarpışma sırasında saniyenin 1/10’ undan daha kısa bir sürede açılıp birkaç saniye sonra da sönerek yolcunun hareketini ve araçtan çıkmasını kolaylaştırdığını biliyor musunuz? Hava yastıkları sıkıştırılmış veya basınç altındaki bir gazın salıverilmesiyle şişmezler, kimyasal bir reaksiyon (tepkime) sonucu oluşan gazlar tarafından şişirilirler. Hava yastıkları saniyenin 1/10’u kadar bir sürede açılıp şiştiğine göre şişmeyi sağlayan gazları oluşturan tepkimenin hızını tahmin edebiliyor munuz? Kimyasal tepkimeler yaşamımızda oldukça önemli yer tuttuğundan tepkimeleri kontrol altına alabilmek için hızlarını ve bu hızları etkileyen etmenlerin neler olduğunu bilmek gerekir. Bu bölümde bir kimyasal tepkimenin zaman içinde nasıl yürüdüğünü, daha genel bir ifade ile tepkime hızlarını inceleyeceğiz. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 61 1. Reaksiyon Hızı Kimyasal tepkimelerin maddeyi oluşturan atom ve moleküllerin diziliş ve düzeninin değişimi ile gerçekleştiğini, bu değişimin bir enerji alış verişi ile birlikte yürüdüğünü biliyorsunuz. I. ünitede evrendeki enerji miktarının sabit olduğunu ve bu sabitlik korunarak enerjinin bir türden diğer türe dönüşebileceğini öğrendiniz. Bütün enerji türlerinin kendiliğinden ısı enerjisine dönüştüğünü, ısı enerjisinin diğer enerji türlerine kendiliğinden hiç dönüşmediğini, dışarıdan yapılan etki ile de tam bir dönüşme sağlanamadığını biliyorsunuz. Diğer enerji türleri gibi kimyasal enerji de ısıya tam olarak dönüşebilir ancak ısı enerjisi kimyasal enerjiye dönüşmek yerine maddelerde kimyasal değişikliklerin oluşmasına neden olur. Maddedeki kimyasal değişmenin hızına tepkime hızı denir. Maddede meydana gelen kimyasal değişikliklerin zamanla ilerleyişini, bu ilerleyişin hızını, diğer bir ifadeyle tepkimenin hızını ve mekanizmasını inceleyen bilim dalına kimyasal kinetik denir. Kimyasal kinetik, tepkimenin hangi hızla dengeye ulaştığını ve tepkimeye girenlerin hangi yolu izleyerek ürünleri oluşturduğunu inceler. Tersinmez ve tersinir olarak yürüyen homojen ya da heterojen tepkimelerin zamanla ilerleyişi yanında, katalizör ile bu ilerleme hızının değiştirilmesi, zincir, patlama, polimerleşme, hidroliz ve enzim tepkimeleri tepkime hızı konuları içinde yer alır. Kimyasal tepkimeler, tepkimeye giren maddelerin ürüne dönüşmesi sürecidir. Bu süreç içinde, gerçekleşen herhangi bir değişmeden yararlanılarak tepkimelerin hızı ölçülebilir. Örneğin; H2 HCl Fe Fe(k) + 2HCl(suda) → FeCl2(suda) + H2(g) tepkimesinde (Resim 2.1.a) hız, H2 gazı çıkış hızından; a. Gaz çıkışı – + 3+ 2+ 5Fe2+ (suda) + MnO4(suda) + 8H (suda) → 5Fe (suda) + Mn (suda) + 4H2O(s) tepkimesinde (Resim 2.1.b) hız, MnO–4 iyonunun renginin değişiminden ya da ortamın elektrik iletkenliğinin değişmesinden yararlanılarak belirlenebilir. Mn2+ AgNO3(suda) + NaI(suda) → NaNO3(suda) + AgI(k) tepkimesinde (Resim 2.1.c) hız, AgI’ün çökme ve renk değişim hızından belirlenebilir. Bir kimyasal olay, tepkimeye giren maddelerin zamanla ürünlere dönüştüğü bir süreçtir. Bu süreçte tepkimeye giren maddelerin miktarı azalırken ürünlerin miktarı artar. Dolayısıyla bir tepkimede herhangi bir anda tepkimeye giren maddelerin harcanma ya da ürünlerin oluşma hızı Fe2+ b. Renk değişimi NaI tepkimenin anlık hızı olarak bilinir. Tepkimelerde başlangıçta giren maddelerin derişimleri büyük olduğundan tepkime hızı da büyüktür. Ancak tepkimede ürünler oluştukça hem giren maddelerin derişimleri hem de tepkime hızı azalır. Bir tepkimede giren maddelerin derişimindeki değişmenin zaman aralığına oranı tepkimenin ortalama hızı olarak tanımlanır. Ortalama hızda zaman aralığı, incelenen tepkimenin niteliğine göre yıl, ay, saat, dakika, saniye vb. alınabilir. Örneğin, patlama şeklinde gerçekleşen bir tepkimede zaman aralığının “mikro saniye”, bir yanma olayında “dakika”, hamurun mayalanmasında “saat”, dikit ve sarkıtların oluşmasında “yıl” uygun olan zaman birimleridir (Resim 2.2). 62 AgNO3 AgI c. Renk değişimi ve çökelme Resim 2.1: Bazı tepkimeler ORTAÖĞRETİM KİMYA 11 DERS KİTABI a. Odunun yanması b. Hamurun mayalanması c. Dikit ve sarkıtların oluşması Resim 2.2: Farklı hızlarla gerçekleşen bazı kimyasal tepkimeler Anlık ve ortalama hız kavramlarını aşağıda denklemi verilen tepkime üzerinde irdeleyelim. CaCO3(k) + 2HCl(suda) → CaCl2(k) + CO2(g) + H2O(s) Tablo 2.1: CaCO3’ın HCl ile tepkimesinden oluşan CO2 gazının hacimleri ve geçen süreler CO2 gazının hacmi (cm3 ) 0 8 14 20 25 29 33 36 38 39 40 40 40 40 Zaman (s) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 6,5 Örnek aldığımız bu tepkimede oluşan karbon dioksit gazının hacmi kolayca ölçülebilir. Çünkü tepkimede sadece bir gaz çıkışı vardır. Oluşan karbon dioksit gazı sürtünmesiz bir pistonun yer aldığı silindir kapta toplanabilir. Kronometre ile belli zaman aralıklarında ne kadar gazın kapta biriktiği belirlenebilir. Böyle bir tepkimenin sonuçları Tablo 2.1’ de verilmiştir. Tablodaki hacim-zaman verileri grafiğe geçirildiğinde Grafik 2.1 elde edilir. Grafikten aşağıdaki sonuçlara ulaşabiliriz: ®Tepkimede ilk saniyede 14 cm3, ikinci saniyede 11 cm3 (25 – 14 = 11 cm3), üçüncü saniyede 3 8 cm (33 – 25 = 8 cm3) CO2 gazı oluşmuştur. Tepkimede farklı zaman aralıklarındaki anlık hızlar şöyledir: 0 - 1. saniye aralığında anlık tepkime hızı = 14 − 0 = 14 cm3/s 1− 0 1 - 2. saniye aralığında anlık tepkime hızı = 25 − 14 = 11 cm3 / s 2−1 2 - 3. saniye aralığında anlık 33 − 25 = 8 cm3 / s ’dir. tepkime hızı = 3−2 Bu verilere göre tepkimenin başlangıçtaki hızı büyük olup zaman ilerledikçe azalmaktadır. ®Tepkime grafiği başlangıçta hızla yükselen sonra sabit CO2 hacmi (cm3) 40 33 30 25 20 10 0 1 2 3 4 5 6 Zaman (s) Grafik 2.1: Oluşan CO2 gazının hacminin zamanla değişimi kalan bir eğri izler. Eğrideki sabitlik tepkimenin sonlandığını gösterir. Dolayısıyla 5. saniyeden sonra belirgin bir gaz oluşumu yoktur. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 63 ®Tepkimede 5. saniyede toplam 40 cm3 CO2 gazı oluşmuştur. Buna göre tepkimenin ortalama hızı şöyledir: CO2 gazının toplam hacmi 40 Tepkimenin ortalama hızı = ––––––––––––––––––––––––– = ––– = 8 cm3 /s’dir. Tepkime süresi 5 Anlık ve ortalama hız kavramlarını irdelemek üzere son bir örnek olarak demirin hidroklorik asitle tepkimesinden hidrojen gazı elde edilişini ele alalım. Fe(k) + 2HCl(suda) → FeCl2(k) + H2(g) Tepkimede oluşan hidrojen gazının hacim-zaman grafiği Grafik 2.2 gibi olsun. Tepkimenin hacim-zaman grafiğindeki eğriye çizilen teğetin eğiminden saptanan tepkime hızı, anlık hızı verir. Yani tepkimenin anlık hızı, teğetin eğriye değme noktasındaki (grafikte C noktasıdır) zamana karşılık gelen hızdır. Şimdi grafikten 3 ve 8. saniye aralığındaki anlık hızı hesaplayalım. Anlık hız = V2 − V1 t2 − t1 H2 gazının hacmi (cm3) 6 B (8; 5,2) 5 C 4 3 2 (3; 3,3) A 1 0 Grafiğe göre V2 = 5,2 cm3, V1 = 3,3 cm3, 2 4 6 8 10 12 14 Zaman (s) t2 = 8 s, t1 = 3 s’dir. Bu veriler bağıntıda yerine konulursa; Grafik 2.2: Tepkimede oluşan H2 gazının hacminin zamanla değişimi 5, 2 − 3, 3 Anlık hız = = 0, 38 cm3 / s olarak bulunur. 8−3 Ortalama hız ise oluşan hidrojen gazının toplam hacminin zamana oranıdır. Ortalama hız = Vson − Vilk 5, 2 − 0 = 0, 65 cm3/ s ’ dir. = tson − tilk 8−0 Örnek aldığımız tepkimelerde anlık ve ortalama hızı, birim zamanda oluşan maddenin hacmindeki değişme üzerinden hesapladık. Ancak, kimyasal değişmelerde hacimdeki değişmelerden yararlanarak tepkime hızını belirlemek uygun bir yol değildir. Benzer şekilde tepkime hızını maddelerin kütlesindeki değişmelerle de belirlemek uygun bir yol değildir. Çünkü kütledeki 2 g’ lık bir değişme H2 gazı için 0,1 mol’ ü, O2 gazı için 0,0625 mol’ü ifade eder. Bu yüzden, maddenin kütle ya da hacmindeki değişme yerine mol sayısındaki değişmeyi kullanmak daha uygun olur. Bu durumda aşağıdaki bağıntı yazılabilir: Maddenin mol sayısındaki değişme Tepkime hızı = –––––––––––––––––––––––––––––––– Zaman aralığı Bu bağıntı, aynı maddenin aynı koşullarda, laboratuvarda 1 g, büyük bir üretim yerinde 10 000 g elde edilmesi hâlinde tepkime hızının farklı olabileceğini düşündürebilir. Hatta ikinci durumda tepkime hızının daha büyük olması gerektiği şeklindeki bir yanılgıya düşmemize yol açabilir. O hâlde tepkime hızını, birim zamanda ve birim hacimde değişime uğrayan maddenin mol sayısındaki değişme olarak ifade etmek en uygun yol olur. Birim hacimde bulunan mol sayısındaki değişme, maddenin derişimindeki değişme olduğuna göre; Maddenin derişimindeki değişme Tepkime hızı = ––––––––––––––––––––––––––––––– eşitliği yazılabilir. Zaman aralığı Tepkime hızı “r”, molar derişim (molarite) “C” simgesiyle gösterilirse tepkimenin başlangıç ve sonlanması arasında maddenin derişimindeki değişme “∆C” şeklinde gösterilebilir. Buna göre yukarıdaki eşitlik yerine C bağıntısı yazılabilir. r= t 64 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bu bağıntıdan tepkimenin hızının derişimle doğru, zamanla ters orantılı olduğu sonucu çıkarılabilir. Bir tepkimede giren maddelerin derişimleri zamanla azalırken ürünlerin derişimleri de zamanla artacağına göre tepkime hızı hem giren maddelerin hem de ürünlerin derişimleri üzerinden ifade edilebilir. Bu durumu 2CO(g) + O2(g) → 2CO2(g) tepkimesi üzerinde inceleyelim. Örnek aldığımız tepkimede hız, tepkimeye giren CO, O2 ve ürün CO2 gazı için; ∆[CO] ∆[O2] ∆[CO2] rCO = – ––––––, rO2 = – –––––– ve rCO2 = ––––––– (Köşeli ayraç molar derişimi ifade eder.) ∆t ∆t ∆t 1 ∆ [CO] 1 ∆[O2] 1 ∆[CO2] ya da r = – –– ––––––– = – –– –––––– = –– ––––––– 2 ∆t 1 ∆t 2 ∆t şeklinde yazılabilir. Bağıntılardaki “–” işareti, hızın eksi bir değer çıkmaması için yazılır. Çünkü bir kimyasal tepkimenin hızı eksi olamaz. Tepkime denklemine göre 2 mol CO gazından 2 mol CO2 gazı oluşmaktadır. O hâlde tepkimede ne kadar CO gazı tükeniyorsa o kadar da CO2 gazı oluşur. Buna göre CO2 gazının oluşma hızı (rCO2), CO gazının tükenme hızına (rCO) eşittir. rCO2 = rCO Yine tepkime denklemine göre 2 mol CO gazı ve 1 mol O2 gazı tükenmektedir. Bu durumda O2 gazının tükenme hızı, CO gazının tükenme hızının yarısına eşittir. rO2 = 1/2rCO Buna göre tepkimede yer alan üç molekülün arasında rCO2 = 2rO2 = rCO ilişkisi vardır. ☞ÖRNEK : 1 500 mL’ lik kapalı bir kapta, 0,06 g H2 gazı yeterince N2 gazı ile 200 saniyede tamamen tepkimeye girerek NH3 gazı oluşturmaktadır. N2(g) + 3H2(g) → 2NH3(g) tepkime denklemine göre; a. H2 gazının tükenme hızını, b. NH3 gazının oluşma hızını mol/L s cinsinden hesaplayınız. (H : 1) ✍ÇÖZÜM a. Tepkimede tükenen H2 gazının mol sayısı; nH2 = H2 gazının molar derişimi; [H2 ] = 0, 03 0, 5 m MA nH2 = 0, 06 2 nH2 = 0, 03 mol ’dür. [H2 ] = 0, 06 mol / L ’dir. ∆C H2 gazının tükenme hızı; rH2 = – –––– ∆t C2 – C1 0 – 0,06 rH2 = – –––––––– ⇒ rH2 = – ––––––– ⇒ rH2 = 3 · 10–4 mol/L s’dir. t2 – t1 200 – 0 b. Tepkime denklemine göre 3 mol H2 gazı tükenirken 2 mol NH3 gazı oluşmaktadır. Buna göre; 3 mol H2 gazından 2 mol NH3 gazı oluşursa 0,03 mol H2 gazından x –––––––––––––––––––––––––––––––––––––––––––––––– 0,03 · 2 x = –––––––– ⇒ x = 2 · 10–2 mol NH3 gazı oluşur. 3 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 65 NH3 gazının molar derişimi; 2 · 10−2 0, 5 [NH3 ] = rNH3 = [NH3 ] = 4 · 10−2 mol / L ’dir. 4 · 10−2 − 0 200 − 0 rNH3 = 2 · 10−4 mol / L s ’dir. ☞ÖRNEK : 2 1 atm basınç ve 55 ˚C sıcaklıkta diazot pentaoksit gazının azot dioksit ve oksijen gazına ayrışma tepkimesi şöyledir: 2N2O5(g) → 4NO2(g) + O2(g) Tepkimede derişimlerin zamana göre değişimleri aşağıdaki tablo ve grafikte verilmiştir. Tepkimenin derişim-zaman grafiğinden yararlanarak tepkimeye giren maddenin ve ürünlerin 300-400 s aralığındaki anlık hızlarını bulunuz ve sonucu yorumlayınız. 2N2O5(g) → 4NO2(g) + O2(g) Renksiz Kahverengi Renksiz Derişim Zaman (s) N2O5 NO2 O2 0 0,0200 0 0 100 0,0169 0,0063 0,0016 200 0,0142 0,0145 0,0029 300 0,0120 0,0160 0,0040 400 0,0101 0,0197 0,0049 500 0,0086 0,0229 0,0057 600 0,0072 0,0256 0,0064 700 0,0061 0,0278 0,0070 NO2 0,03 Derişim (M) 0,02 ∆[NO2] = 0,0037 M ∆t = 100 s ∆[N2O5] = –0,0019 M 0,01 ∆t = 100 s ∆t = 100 s 0,00 0 100 200 300 O2 N2O5 ∆[O2] = 0,0009 M 400 500 600 700 Zaman (s) 66 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ✍ÇÖZÜM Grafiğe göre; – C 0, 0101 – 0, 0120 – 0, 0019 =– =– = 19 · 10− 6 M / s t 400 – 300 100 C 0, 0197 – 0, 0160 0, 0037 = = = = 37 · 10− 6 M / s t 400 – 300 100 C 0, 0049 – 0, 0040 0, 0009 = = 9 · 10− 6 M / s bulunur. = = t 400 – 300 100 rN2 O5 = rNO2 r O2 Grafikten yararlanarak yapılan hesaplama sonu bulunan anlık hızlar arasında 2rN2O5 ≈ rNO2 ≈ 4rO2 eşitliği vardır. Bulunan anlık hız değerleri tepkime denklemindeki kat sayılarla uyumludur. Anlık, ortalama hız kavramlarını ve tepkime hızının hesaplanmasını öğrendiniz. Hava yastıklarının şişmesini sağlayan tepkimenin saniyenin 1/10 ’u kadar kısa bir sürede gerçekleştiğini biliyorsunuz. Bu tepkimenin denklemi; 2NaN3(k) → 2Na(k) + 3N2(g) şeklindedir. Bu tepkime çarpışmayı algılayan bir sensörün gönderdiği sinyalle başlar. Tepkimede çok kısa süre içinde NaN3 (sodyum azotür) bozunarak yaklaşık 67 L azot gazı oluşur. Bu gaz da hava yastığının şişmesini sağlar. Olaylar dizisi saniyenin kesirleri içinde gerçekleşerek son bulur. Dolayısıyla bu tepkime, asitlerle bazlar arasındaki nötürleşme tepkimeleri, metan gazının yanma tepkimesi hızlı gerçekleşen tepkimelere örnek verilebilir. HCl(suda) + NaOH(suda) → NaCl(k) + H2O(s) (Çok hızlı) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)(Hızlı) Demirin paslanması orta yavaş, hidroliz ve polimerleşme tepkimeleri ise çok yavaş gerçekleşen tepkimelerdir. Paslanma 2Fe(k) + 3/2O(g) → Fe2O3(k) (Orta yavaş) Hidroliz C12H22O11(suda) + H2O(s) → C6H12O6(suda) + C6H12O6(suda) (Çok yavaş) Sakkoroz Glikoz Früktoz Polimerleşme n(CH2— —CHCl) → (—CH2—CHCl—)n (Çok yavaş) Vinil klorür Polivinil klorür (PVC) 2. Reaksiyon Hız Denklemi Kimyasal tepkimelerin hızları ile tepkimelere giren maddelerin derişimleri arasındaki ilişki hız denklemi denilen eşitliklerle ifade edilir. Tepkimelere giren maddelerin derişimleri ile hız arasındaki ilişkiden yararlanarak tepkimelerin hız denklemini (bağıntısını) bulabiliriz. Örnek olarak oksijen ve azot monoksit gazları arasında tek basamakta gerçekleştiği varsayılan tepkimeyi ele alalım: O2(g) + 2NOg) → 2NO2(g) Bu tepkimeye ait aynı koşullarda gerçekleştirilen üç deneyin sonuçları aşağıdaki gibidir. Deney numarası [O2 ] [NO] 1 0,020 0,020 0,057 2 0,040 0,020 0,114 3 0,020 0,040 0,228 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 67 Tablodaki verilere göre 1 ve 2. deneyde [NO] sabit tutulurken değişen [O2]’ lerinin oranı şöyledir: 0,040 2. deneyde [O2] –––––––––––––––– ⇒ –––––– = 2 1. deneyde [O2] 0,020 [O2]’ndeki değişime bağlı tepkime hızlarının oranı ise şöyledir: 2. deneyde tepkime hızı 0,114 –––––––––––––––––––– ⇒ –––––– = 2 1. deneyde tepkime hızı 0,057 1. deneye göre 2. deneyde [O2] iki katına çıkarken tepkime hızı da iki katına çıkmıştır. Yani tepkime hızı, [O2] ile doğru orantılı olarak artmıştır. r α [O2] 1 ve 3. deneylerde [O2] sabit tutulurken değişen [NO]’lerinin oranı şöyledir: 3. deneyde [NO] 0,040 ––––––––––––– ⇒ –––––– = 2 1. deneyde [NO] 0,020 [NO]’ndeki değişime bağlı olarak değişen tepkime hızlarının oranı ise şöyledir: 3. deneyde tepkime hızı 0,228 ––––––––––––––––––––– ⇒ –––––– = 4 1. deneyde tepkime hızı 0,057 Bu duruma göre [NO] iki katına çıkarken tepkime hızı dört katına çıkmıştır. Yani tepkime hızı [NO]’nin karesi ile doğru orantılıdır. r α [NO]2 Sonuç olarak tepkime hızı, [O2]’nin kendisi ile ve [NO]’nin karesi ile doğru orantılı olduğuna göre bu derişimlerin çarpımı ile de doğru orantılı olmalıdır. r α [O2] [NO]2 Orantıyı eşitliğe dönüştürmek için bir orantı kat sayısı (k) kullanılırsa bu tepkime için r = k [O2] [NO]2 bağıntısı yazılabilir. Yukarıda ulaştığımız tepkime hızı bağıntısını H2 ve I2 gazlarından HI gazı oluşması tepkimesi için de irdeleyelim. H2(g) + I2(g) → 2HI(g) Bu tepkimeye ait deney verilerinden yararlanarak tepkimenin hız bağıntısını çıkaralım. · · · · · · · · · · · · Deney sonuçlarına göre 1 ve 2. deneylerde [H2] sabit tutulurken değişen [I 2 ]’ lerinin oranı şöyledir: 2. deneyde [I 2 ] 2 · 10–3 –––––––––––––– ⇒ –––––––– =2 1. deneyde [I 2 ] 1 · 10–3 68 ORTAÖĞRETİM KİMYA 11 DERS KİTABI [I 2 ]’ndeki değişmeye bağlı olarak değişen tepkime hızlarının oranı ise şöyledir: 2. deneyde tepkime hızı 6 · 10–4 –––––––––––––––––––– ⇒ ––––––– = 2 1. deneyde tepkime hızı 3 · 10–4 1. deneye göre 2. deneyde [I 2 ] iki katına çıkarken tepkime hızı da iki katına çıkmıştır. Yani tepkime hızı [I 2 ] ile doğru orantılıdır. r α [I2] 1 ve 4. deneylerde [I 2 ] sabit tutulurken değişen [H2]’lerinin oranı şöyledir: 4. deneyde [H2] 2 · 10–2 –––––––––––––– ⇒ –––––––– =2 1. deneyde [H2] 1 · 10–2 [H2]’ndeki değişime bağlı olarak değişen tepkime hızlarının oranı ise şöyledir: 4. deneyde tepkime hızı 6 · 10–4 –––––––––––––––––––– ⇒ ––––––– =2 1. deneyde tepkime hızı 3 · 10–4 Bu duruma göre [H2] iki katına çıkarken tepkime hızı da iki katına çıkmıştır. Yani tepkime hızı [H2] ile de doğru orantılıdır. r α [H2] Buna göre tepkimenin hız bağıntısı r = k [H2] [I 2 ] şeklindedir. Örnek aldığımız her iki tepkimede de tepkime hızı, tepkimeye giren maddelerin tepkime denklemindeki mol kat sayıları üs alınmak koşuluyla tepkimeye giren maddelerin molar derişimleri ile doğru orantılıdır. O hâlde tek basamakta ve gaz fazında gerçekleştiği varsayılan aA(g) + bB(g) → cC(g) + dD(g) genel tepkimesi için genel bir tepkime hız bağıntısını aşağıdaki gibi yazabiliriz: r = k [A]a [B]b Örnek ve genel tepkimelerin hızı için yukarıda çıkardığımız bağıntılara tepkime hız denklemi, denklemlerde eşitliği sağlayan k orantı kat sayısına da tepkime hız sabiti denir. Tepkimeler için hız denklemi yazılırken yalnızca tepkime denklemindeki gazlar ile suda veya başka bir çözücüde çözünmüş maddelerin derişimleri alınır. Saf katı ve sıvı maddelerin hacimleri madde miktarı ile doğru orantılı olarak değiştiğinden derişimleri değişmez. Bu nedenle saf katı ve sıvı maddeler tepkimenin hız denkleminde yer almazlar. Tepkime hızı hakkındaki bilgilerimizi pekiştirmek amacıyla 2H2(g) +2NO(g) → 2H2O(g) + N2(g) tepkimesini irdeleyelim. Bu tepkimeye ait aynı koşullarda gerçekleştirilen 3 deneyin sonuçları yanda verilen tablodaki gibidir. Tablodaki verilere göre 1 ve 2. deneylerde [NO] sabit tutularak [H2] iki katına çıkarıldığında tepkime hızı da iki katına çıkmaktadır. Buna karşın 1 ve 3. deneyde [H2] sabit tutularak [NO] iki katına çıkarıldığında tepkime hızı dört katına 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 69 çıkmaktadır. Öyleyse tepkime hızı [H2]’nin kendisi ve [NO]’nin karesi ile doğru orantılıdır. Sonuç olarak tepkimenin hız denklemi; r = k [H2] [NO]2 şeklindedir. Verilen tepkime denklemine göre tepkimeye 2 mol H2, 2 mol NO katıldığından hıza etkilerinin de eşit olması, dolayısıyla hız denkleminin r = k [H2]2 [NO]2 şeklinde ifade edilmesi beklenir. Deneysel verilere göre yazılan hız denklemi ile tepkime denklemine göre yazılan hız denkleminin birbirinden farklı oluşu, tepkimenin tek basamakta gerçekleşmediğini, bir dizi ara basamaktan geçerek gerçekleştiğini gösterir. Gerçekte H2 ve NO gazları arasında gerçekleşen 2H2(g) + 2NO(g) → 2H2O(g) + N2(g) tepkimenin ara basamakları aşağıdaki gibidir: 1. H2(g) + 2NO(g) → H2O(s) + N2O(g) (Yavaş) 2. H2(g) + N2O(g) → H2O(s) + N2(g) (Hızlı) –––––––––––––––––––––––––––––––––––––––––––––––––––––––––– 2H2(g) + 2NO(g) → 2H2O(s) + N2(g) (Net tepkime denklemi) H2 ve NO gazları arasında gerçekleşen tepkimedeki gibi tepkimeye giren maddelerin bir dizi ara basamaktan geçerek ürünlere dönüşme sürecine tepkime mekanizması, ara basamakların toplamını ifade eden tepkime denklemine ise net tepkime denklemi denir. Tepkime mekanizmasında farklı hızda yürüyen basamaklar varsa bu basamaklardan en yavaş olanı tepkimenin hızını belirler. Çünkü diğer basamakların hızı ne kadar fazla olursa olsun tepkimenin hızı, ancak yavaş basamağındaki kadar hızlı olabilir. Bazı tepkimeler bir basamak üzerinden yürürken bazıları iki veya daha fazla basamak üzerinden yürür. Bir basamaklı tepkimelere basit, çok basamaklı tepkimelere ise karmaşık ya da kompleks tepkime denir. Tepkime hız denklemi ile ilgili olarak buraya kadar öğrendiklerinizden aşağıdaki sonuçlara varabiliriz: ® Hız denklemi, çoğu zaman net tepkime denklemlerinden çıkarılamaz. Çünkü pek çok tepkime, ara basamaklardan geçerek sonuçlanır. Bu tür tepkimelerin deneysel olarak belirlenmiş belirli bir mekanizması vardır. ® Deney sonucuna göre yazılan hız denklemi net tepkime denklemine göre yazılandan farklı ise tepkime tek basamaklı değildir ve belirli bir mekanizması vardır. ® Tepkime hızı, tepkime mekanizmasında en yavaş olan ara basamağın hızından belirlenir. ® Tepkime hızı, hızı belirleyen ara basamağın tepkime denklemindeki mol kat sayıları üs alınmak koşuluyla girenlerin molar derişimleriyle doğru orantılıdır. Tepkime hız denkleminde yer alan k orantı kat sayısının tepkimenin hız sabitini ifade ettiğini öğrendiniz. Şimdi bazı tepkimelerin hız bağıntılarını dikkate alarak tepkime hız sabitinin birimini bulmaya çalışalım. O2(g) + 2NO(g) → 2NO2(g) tepkimesi için hız bağıntısını r = k[O2] [NO]2 şeklinde yazmıştık. Bu tepkimenin hız sabitinin birimini bulabilmek için tepkimenin hız bağıntısında yer alan tepkime hızının ve maddelerin derişimlerinin birimlerini tepkime hız bağıntısındaki yerlerine yazalım. mol mol mol =k· · L·s L L 70 2 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bu eşitlikten k’nin birimi; mol L .s k= mol mol · L L Şimdi de tepkime hız sabitini; k= 2 mol L·s · L · L2 mol mol2 k= L2 mol2 · s olarak bulunur. H2(g) + I2(g) → 2HI(g) tepkimesi için irdeleyelim. Bu tepkimenin hız bağıntısı r = k [H2] [I2] şeklindedir. Bu bağıntıda yer alan tepkime hızı ve maddelerin derişimleri birimleri ile birlikte bağıntıdaki yerlerine yazılırsa; mol mol mol =k · L·s L L eşitliği elde edilir. Bu eşitlikten k’nin birimini çekersek k= mol L·s mol L 2 k= L olarak bulunur. mol · s Yukarıdaki iki örnekten birincisinde hız sabitinin birimini L2/mol2s, ikincisinde L/mol s buldunuz. Bu durum tepkime hız sabitinin (k) biriminin değişken olduğunu gösterir. Bildiğiniz gibi birimler değişken değildir. Bu nedenle tepkime hız sabitinin birimi yerine sayısal değeri esas alınır. Yine örnek tepkimelerde gördüğünüz gibi bir tepkimeye giren maddelerin derişiminin değişmesi göreceli olarak o tepkimenin hızını değiştirmekte ancak o tepkimenin hız sabitinin sayısal değerini değiştirmemektedir. Dolayısıyla bir tepkimeye giren maddelerin derişiminin değişmesinin o tepkimenin hız sabitinin sayısal değerinin değişmesine bir etkisi bulunmamaktadır. ☞ÖRNEK : 3 Sulu çözeltide oluşan bir tepkimenin mekanizması aşağıdaki gibidir: H2O2 + I¯ → H2O + IO¯ (Yavaş) + IO¯ + H3O → HIO + H2O (Çok hızlı) HIO + H3O+ + I¯ → 2H2O + I 2 (Hızlı) ––––––––––––––––––––––––––––––––––––––––––––– H2O2 + 2H3O+ + 2I ¯ → 4H2O + I 2 (Net tepkime denklemi) Bu tepkimeye ait hız denklemini yazınız. ✍ÇÖZÜM Tepkimede hızı belirleyen, tepkime mekanizmasındaki en yavaş basamaktır. Bu yüzden tepkimenin hız denklemi en yavaş basamak üzerinden yazılmalıdır. Buna göre tepkimenin hız denklemi; r = k [H2O2] [I¯ ] şeklindedir. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 71 ☞ÖRNEK : 4 Standart koşullarda gerçekleşen H2(g) + I 2(g) → 2HI (g) tepkimesine ait 3 deney sonucu yandaki tabloda verilmiştir. Tepkimenin hız sabitini ve birimini bulunuz. · · · · · · · · · ✍ÇÖZÜM Hız sabiti ve birimini bulabilmek için öncelikle tepkimenin hız denklemi bulunmalıdır. 1 ve 2. de- neylerde [H2] sabit tutulurken [I 2 ] iki katına çıkarılmış, tepkime hızı da iki katına çıkmıştır. Buna göre tepkime hızı [H2] ile doğru orantılıdır. 1 ve 3. deneylerde [I 2 ] sabit tutulurken [H2] iki katına çıkarılmış, tepkime hızı iki katına çıkmıştır. Dolayısıyla tepkime hızı [I 2 ] ile de doğru orantılıdır. Bu sonuçlara göre tepkime hız denklemi şöyledir: r = k [H2] [I 2 ] Tablodan herhangi bir deneyin derişim ve hız değerleri denklemde yerine konur. Örneğin, 1. deneydeki derişim ve hız değerleri kullanırsa tepkime hız sabitinin değeri ve birimi bulunabilir. 3 · 10–4 mol/L s = k · 1 · 10–2 mol/L · 1 · 10–3 mol/L k= 3 · 10−4 mol / L s 1· 10−5 mol2 / L2 30 L / mol s ’dir. ☞ÖRNEK : 5 25 ˚C’ta gerçekleşen 2NO(g) + O2(g) → 2NO2(g) tepkimesinden aşağıdaki tabloda verilen deney bulguları elde ediliyor. · · · · · · · · · · · · Deney bulgularına göre; a. Tepkimenin hız denklemi nasıldır? b. Tepkimenin hız sabitini ve birimini hesaplayınız. ✍ÇÖZÜM a. 1 ve 2. deneylerde [NO] sabit tutulurken [O2] derişimi iki katına çıkarılmış, tepkime hızı iki katına çıkmıştır. Bu nedenle tepkime hızı [O2] derişimi ile doğru orantılıdır. 3 ve 4. deneylerde [O2] sabit tutulurken [NO] iki katına çıkarılmış, tepkime hızı dört katına çıkmıştır. Dolayısıyla tepkime hızı [NO]’nin karesi ile doğru orantılıdır. Bu sonuçlara göre tepkimenin hız denklemi şöyledir: r = k [O2] [NO]2 72 ORTAÖĞRETİM KİMYA 11 DERS KİTABI b. Hız sabitini hesaplamak için tablodaki herhangi bir deneyin derişim ve hız değerlerinden yararlanılır. Örneğin, 1. deneydeki değerler kullanılabilir. 7 · 10–6 mol/L s = k · 1 · 10–3 mol/L · (1 · 10–3 mol/L)2 k= 7 · 10−6 mol / L s 1· 10−9 (mol / L )3 k = 700 L2 mol2 s bulunur. Yukarıdaki örneklerde gördüğünüz gibi tepkime hız sabiti (k)nin değeri, her bir tepkime için farklı olmaktadır. Ancak sabit sıcaklıkta gerçekleşen herhangi bir tepkimede tepkimeye giren maddelerin ve ürünlerin fiziksel hâlleri farklı değilse tepkime süresince hız sabitinin değeri aynı kalır. Kimyasal bir tepkimenin oluşması için tepkimeye giren maddelerin taneciklerinin çarpışması gerektiği varsayılır. Söz gelimi H2 ve I2 moleküllerinden yeni bir HI molekülü oluşacaksa tepkime öncesi belirli bir enerjiye sahip olan H2 ve I2 moleküllerinin birbirleriyle çarpışması gerekir. Çarpışma sırasında H2 ve I2 moleküllerinin atomları arasındaki bağlar zayıflar. Böylece yeni kimyasal bağların oluşumuna zemin hazırlanır. Ancak çarpışan tanecikler arasında bir tepkimenin olabilmesi, çarpışan taneciklerin uygun bir açıyla (uygun bir geometriyle) ve yeterli hızla çarpışmalarına da bağlıdır. Yetersiz hız ve uygun olmayan açılarla gerçekleşen çarpışmalar sonucunda tanecikler arasında bir tepkime oluşmaz. Böyle çarpışmalara etkin olmayan çarpışma denir. Yeterli hızla ve uygun açılarla gerçekleşen çarpışmalar sonucunda ise tanecikler arasında tepkime oluşur. Böyle çarpışmalara etkin çarpışma adı verilir. Görüldüğü gibi kimyasal bir tepkimenin oluşması için taneciklerin çarpışması yeterli değildir. Bu nedenle her çarpışma tepkimeyle sonuçlanmaz. Çarpışmanın tepkimeyle sonuçlanması için taneciklerin belirli bir enerjiye sahip olmaları gerekir. Örnek olarak CO ile NO2 molekülleri yeterli hız ve enerjiyle uygun geometride birbirleriyle çarpışırlarsa NO2 ve CO moleküllerindeki bağlar kırılır. Atomlar yeniden düzenlenir, NO ve CO2 moleküllerini vermek üzere N ile O ve C ile O atomları arasında yeni bağlar oluşur (Şekil 2.1.a). CO ve NO2 molekülleri, yeterli hıza sahip değillerse ve uygun geometride çarpışma yapmazlarsa böyle bir çarpışma tepkimeyle sonuçlanmaz (Şekil 2.1.b). O C O O O C O N O Çarpışma öncesi O N O C N Etkin çarpışma O Çarpışma sonrası Şekil 2.1.a: NO2 ve CO moleküllerinin NO ve CO2 molekülünü oluşturmak için uygun bir hızda ve geometride çarpışmaları gerekir. C O N O O N O O C O N O C Çarpışma öncesi Etkin olmayan çarpışma O O Çarpışma sonrası Şekil 2.1.b: Uygun bir hızda ve geometride gerçekleşmeyen çarpışmalar tepkimeyle sonuçlanmaz. Şimdi 1. etkinliği yaparak tepkimeye katılan taneciklerin etkin çarpışma yapabilmeleri için neden belirli bir enerjiye sahip olmaları gerektiğini araştırınız. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 73 1. ETKİNLİK: BAŞLAMA VURUŞU Neler Gerekli? Güvenliğiniz için ❏ Deney tüpü ❏ Üçayak ❏ Bunzen kıskacı ❏ Destek çubuğu ❏ İkili bağlama parçası ❏ Bunzen beki ❏ Amonyum dikromat (NH4)2Cr2O7 Nasıl Yapacaksınız? 3 İki gram amonyum dikromatı deney tüpüne koyup deney tüpünü bunzen kıskacı yardımıyla destek çubuğuna bağlayarak resimdeki etkinlik düzeneğini kurunuz. 3 Deney tüpünü ve içindekileri, bunzen beki alevi amonyum dikromatın üst kısmına gelecek şekilde yavaş yavaş ısıtınız. Amonyum dikromatın turuncu rengi yeşile dönmeye başladığında bunzen bekini söndürünüz. Deney tüpündeki değişmeleri gözlemleyiniz. Etkinlik Sonu Soruları 1. Oda koşullarında gerçekleşmeyen ve aşağıda denklemi verilen ekzotermik tepkimenin dışarıdan kısa bir süre ısı verildiğinde başlamasını nasıl açıklarsınız? (NH4)2Cr2O7(k) → N2(g) + Cr2O3(k) + 4H2O(g) Turuncu ΔH˚ = –315 kJ Yeşil 2. Kısa bir süre ısı verildikten sonra tepkimenin istemli devam etmesini nasıl açıklarsınız? Yaptığınız etkinlikte amonyum dikromatı bir miktar ısıttığınızda hızla tepkime vererek yeşil renkli krom(III) okside dönüşmeye başladığını, bunzen bekini söndürdükten sonra da tepkimenin istemli olarak devam ettiğini gözlemlemiş olmalısınız. Ekzotermik olduğu için istemli olarak başlayan bu tepkimenin oda sıcaklığında kendiliğinden başlamaması tepkimeye giren amonyum dikromat taneciklerinin uygun bir geometride de olsa etkin çarpışmalar yapamadıklarını gösterir. Dolayısıyla tepkimenin başlayabilmesi için söz konusu taneciklerin belirli bir enerjiye sahip oluncaya kadar dışarıdan enerji almaları gerektiği söylenebilir. Taneciklerin çarpışarak ürüne dönüşebilmeleri için sahip olmaları gereken en az enerjiye aktifleşme (aktivasyon) enerjisi denir. Aktifleşme enerjisi genellikle “Ea” simgesiyle gösterilir. 74 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bir tepkimenin aktifleşme enerjisi; ®Sıfırdan büyüktür (Ea > 0). ®Tepkimeye giren maddelerin türüne bağlıdır. Bazı tepkimelerin aktifleşme enerjileri büyüktür. Böyle tepkimeler yavaş gerçekleşir. Çünkü tepkimeye girenlerin taneciklerinin sadece küçük bir kısmı, gerekli aktifleşme enerjisini sağlamaya yetecek kadar kinetik enerjiye sahiptir. Bazı tepkimelerin aktifleşme enerjisi ise küçüktür. Bu tepkimeler hızlı gerçekleşir. Çünkü, tepkimeye giren maddelerin taneciklerinin büyük bir kısmı gerekli aktifleşme enerjisini aşacak kadar kinetik enerjiye sahip olduğundan etkin çarpışmalar yaparlar. Daha önce çarpışmalarını örnek aldığımız NO2 ve CO moleküllerinden NO ve CO2 moleküllerinin oluşması tepkimesini, şimdi de tepkimeye giren madde taneciklerinin sahip olmaları gereken aktifleşme enerjisi yönüyle tekrar inceleyelim: Olayı daha iyi açıklayabilmek için bir CO molekülü ile NO2 molekülünün birbirine hızla yaklaştıklarını düşünelim. Her molekül, bir elektron bulutu ile kaplı olduğuna göre aralarındaki uzaklık azaldıkça elektron bulutları birbirlerini daha çok itecek ve moleküller büyük bir ivmeyle yavaşlayacaktır. Böylece çarpışma anına kadar moleküllerin önceden sahip oldukları kinetik enerjileri azalacak, buna karşılık potansiyel enerjileri artacaktır. Çarpışma çok hızlı iki molekül arasında olduğunda, moleküllerin elektron bulutları birbiri içine girecektir. Artık bu durumda CO’e da NO2 moleküllerini ayrı ayrı tanımlamak ya da gözlemlemek mümkün değildir. Bu durumu, iki molekülün birbiri içine girmesiyle oluşmuş bir geçiş hâli olarak düşünebiliriz. Bu geçiş hâline aktiflenmiş kompleks adı verilir. Girenler Aktiflenmiş kompleks Ürünler Aktiflenmiş kompleksin potansiyel enerjisi yüksektir. Çünkü, aktiflenmiş kompleks hâlinde, elektron bulutları ve çekirdekler arası itme kuvvetleri, çekme kuvvetlerinden daha fazladır. Bu nedenle aktiflenmiş kompleks kararlı değildir ve potansiyel enerjisini düşürmek eğilimindedir. Aktiflenmiş kompleksin kararlı hâle geçebilmesi için iki yol vardır: Bunlardan biri tekrar CO ve NO2 moleküllerini, diğeri ise NO ve CO2 moleküllerini oluşturmaktır. Eğer aktiflenmiş kompleks aktifleşme enerjisi engelini aşamaz ise CO Potansiyel enerji Potansiyel enerji ve NO2 moleküllerini (Şekil 2.2.a), aşarsa NO ve CO2 moleküllerini oluşturur (Şekil 2.2.b). Ea Ea Zaman (s) Şekil 2.2.a: Aktifleşme enerjisi engelini aşabilecek potansiyel enerjiye sahip olmayan tanecikler, uygun geometri ile çarpışsalar bile çarpışmaları tepkimeyle sonuçlanmaz. : CO : NO2 : CO2 : NO : Aktiflenmiş kompleks Ea: Aktifleşme enerjisi engeli Zaman (s) Şekil 2.2.b: Uygun geometri ile çarpışan ve aktifleşme enerjisi engelini aşabilecek potansiyel enerjiye sahip tanecikler tepkime verir. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 75 Potansiyel enerji (kJ) Örnek aldığımız NO2 ve CO moleküllerinden NO ve CO2 moleküllerinin oluştuğu tepkimede zaman içinde potansiyel enerji değişmelerini Grafik 2.3 üzerinde inceleyelim. Potansiyel enerji diyagramlarında tepkimeye giren maddeler (CO ve NO2) eğrinin solunda, ürünler (CO2 ve NO) ise sağında yer alır. Aktiflenmiş kompleks Eai =134 kJ Girenler (CO + NO2) ∆H˚ = –226 kJ Eag = 360 kJ Grafikte görüldüğü gibi tepkimeye giren Ürünler maddelerin toplam potansiyel enerjisi, ürünlerin (CO2 + NO) toplam potansiyel enerjisinden daha büyüktür. Bu Zaman (s) yüzden ileri yöndeki tepkime, ısı verendir (ekzo- Grafik 2.3: Ekzotermik bir tepkimenin potansiyel termiktir). Geri yöndeki tepkime ise ısı alandır (enenerji-zaman grafiği dotermiktir). Eğrinin tepe noktasında aktiflenmiş kompleks yer alır. Aktiflenmiş kompleks, tepkime sonuçlanmadan önceki kararsız ve yüksek enerjili geçiş hâlidir. Tepkimeye giren maddelerin toplam potansiyel enerjisi ile aktiflenmiş kompleksin potansiyel enerjisi arasındaki enerji farkı, ileri yöndeki tepkimenin aktifleşme enerjisidir. İleri yöndeki tepkimenin aktifleşme enerjisi “Eai” sembolüyle gösterilir. Ürünlerle giren maddeler arasındaki enerji farkı tepkime entalpisidir (Örneğimizde ∆H˚ = –226 kJ’dür.). Ürünlerle aktiflenmiş kompleks arasındaki enerji farkı ise geri yöndeki tepkimenin aktifleşme enerjisidir. Geri yöndeki tepkimenin aktifleşme enerjisi “Eag” sembolüyle gösterilir. Grafik 2.3 incelendiğinde ileri yöndeki ekzotermik tepkimenin aktifleşme enerjisinin (Eai = 134 kJ), geri yöndeki endotermik tepkimenin aktifleşme enerjisinden (Eag = 360 kJ) küçük olduğu görülür. Aktifleşme enerjisi daha küçük olan tepkimeler aktifleşme enerjisi daha büyük olan tepkimelerden daha hızlı gerçekleşir. Bu nedenle NO2 ve CO’ten NO ve CO2 oluşması yönündeki tepkime, NO ve CO2’ten NO2 ve CO oluşması yönündeki (geri) tepkimeden daha hızlı gerçekleşir. Şimdi yukarıda ulaştığımız sonuçları şöyle genelleştirebiliriz: ®Aynı koşullarda gerçekleşen tepkimelerden, aktifleşme enerjisi daha küçük olan tepkimenin hızı daha büyüktür. ®İleri yönde ekzotermik olan bir tepkime, geri yönde ısı alarak gerçekleşeceğinden, geri yöndeki tepkimesine göre ileri yönde daha hızlı gerçekleşir. ®Ekzotermik tepkimenin aktifleşme enerjisi, geri yöndeki tepkimesinin aktifleşme enerjisinden daima küçüktür. Potansiyel enerji diyagramlarını incelerken ileri yöndeki tepkimenin aktifleşme enerjisi (Eai), geri yöndeki tepkimenin aktifleşme enerjisi (Eag) ve tepkime entalpisi (∆H˚) arasındaki ilişkiyi gördük. Bu Eag = 4,18 kJ nicelikler arasındaki bağıntıyı bulabilmek amacıyla örnek bir tepkimeyi ele alıp bu tepkimenin potansiH2(g) + 1/2O2(g) Eai = 289,98 kJ yel enerji diyagramını çizelim. Suyun elektrolizle elementlerine ayrışma tepkimesi endotermik bir tepkimedir. 1 atm, 25˚C H2O(s) → H2(g) + 1/2O2(g) ∆H˚= +285,8 kJ Elektroliz Bu tepkimenin hesaplanmış aktifleşme enerjisi 289,98 kJ’dür. Tepkimenin potansiyel enerji diyagramı, Grafik 2.4’te verilmiştir. Grafiğe göre tepkimenin ileri yöndeki aktifleşme enerjisi 289,98 kJ, geri yöndeki aktifleşme enerjisi ise 4,18 kJ’dür. 76 H2O(s) Grafik 2.4: Suyun bileşenlerine ayrılması tepkimesinin potansiyel enerji diyagramı (Aktifleşme enerjisinin kolayca görülebilmesi için grafik, ölçeklere uygun düzenlenmemiştir.) ORTAÖĞRETİM KİMYA 11 DERS KİTABI İleri yöndeki tepkimenin aktifleşme enerjisi (Eai) ile geri yöndeki tepkimenin aktifleşme enerjisi (Eag) arasındaki fark 285,8 kJ olup bu fark tepkime entalpisine eşittir. Bu sonuca göre bir tepkime entalpisi, ileri yöndeki tepkimenin aktifleşme enerjisi ile geri yöndeki tepkimenin aktifleşme enerjisi arasındaki farka eşittir. Bu eşitlikten yararlanarak aşağıdaki bağıntıyı yazabiliriz: ya da ∆H˚ = Epürünler – Epgirenler ΔH˚ = Eai – Eag 3. Reaksiyon Hızını Etkileyen Etkenler Tepkime hız denklemini çıkarırken tepkime hızının derişim ve tepkime hız sabitinin değişmesine bağlı olarak değiştiğini öğrendiniz. Acaba tepkime hızını etkileyen başkaca etmenler var mıdır? Bu soruya yanıt bulmak için aşağıdaki etkinliği yapınız. 2. ETKİNLİK: HANGİSİ DAHA HIZLI? Neler Gerekli? ❏ Sacayak ❏ 2 M H2SO4 çözeltisi ❏ 0,1 M FeSO4 çözeltisi ❏ Tüplük ❏ Tel kafes ❏ Deney tüpü (3 adet) Güvenliğiniz için ❏ 0,1 M KMnO4 çözeltisi ❏ Bunzen beki ❏ Damlalıklı şişe (2 adet) ❏ Pipet (10 mL) ❏ Beherglas (500 mL) ❏ 0,1 M Na2C2O4 çözeltisi ❏ Duvar termometresi ❏ Etiket ❏ Su ❏ Kronometre ya da saat ❏ Termometre Nasıl Yapacaksınız? 3 Deney tüplerine üzerinde 1, 2, 3 yazan etiketleri yapıştırınız. Deney tüplerini tüplüğe yerleştiriniz. 1. deney tüpüne pipet yardımıyla 0,1 M’lık FeSO4 çözeltisinden 5 mL, 2 ve 3. deney tüplerine de 0,1 M’lık Na2C2O4 çözeltisinden beşer mL koyunuz. 3 Damlalıklı şişelerden birini 2 M’lık H2SO4, diğerini 0,1 M’lık KMnO4 çözeltisi ile doldurunuz. 3 Laboratuvarın sıcaklığını ölçünüz (Maddeleriniz laboratuvarda bulunduğu için laboratuvarın sıcaklığı maddelerin sıcaklığına eşit kabul edilebilir.). 3 İçinde 0,1 M’lık FeSO4 çözeltisi bulunan 1. deney tüpüne, damlalıklı şişelere koyduğunuz 2 M’lık H2SO4 çözeltisinden 20 damla, 0,1 M’lık KMnO4 çözeltisinden de 2 damlayı yandaki resimdeki gibi aynı anda damlatınız. 3 İlk damlanın FeSO4 çözeltisine değdiği anda grup arkadaşlarınızdan birinin kronometreyi çalıştırmasını sağlayınız ve bu anı başlangıç zamanı (t1) olarak tabloya kaydediniz. 3 KMnO4’ın menekşe rengi açıldığı anda kronometreyi durdurunuz ve bu anı bitiş zamanı (t2) olarak tabloya kaydediniz. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 77 Tüp numarası I. İşlem 1 Aynı anda Sıcaklık (˚C) II. İşlem III. İşlem 5 mL 0,1 M FeSO4 20 damla 2 M H2SO4 2 damla 0,1 M KMnO4 Laboratuvar sıcaklığı 2 5 mL 0,1 M Na2C2O4 20 damla 2 M H2SO4 2 damla 0,1 M KMnO4 Laboratuvar sıcaklığı 3 5 mL 0,1 M Na2C2O4 20 damla 2 M H2SO4 2 damla 0,1 M KMnO4 50 Zaman (s) t1 t2 Δt 3 Bu kez aynı işlemi, 2. deney tüpüne koyduğunuz 5 mL 0,1 M’ lık Na2C2O4 çözeltisiyle tekrarlayınız. Bulduğunuz değerleri tabloya kaydediniz. 3 500 mL’lik beherglası yarısına kadar suyla doldurarak içine Na2C2O4 içeren 3. deney tüpü ile H2SO4 ve KMnO4 çözeltileri içeren damlalıklı şişeleri yandaki resimdeki gibi koyunuz ve 50˚C’a kadar ısıtınız. Deney tüpünü ve damlalıkları beherglastan çıkarınız. Deney tüpünü tüplüğe yerleştiriniz ve 2. deney tüpü için yapılan işlemleri aynen tekrarlayınız. Bulduğunuz değerleri tabloya kaydediniz. Etkinlik Sonu Soruları 1.FeSO4 ve Na2C2O4 çözeltileriyle laboratuvar sıcaklığında yaptığınız işlemlerde, 1 ve 2 nolu tüplerdeki KMnO4 ’ın renginin açılması için belirlediğiniz zaman aralıkları farklı mıdır? Farklıysa nedeni ne olabilir? 2. 0,1 M’lık Na2C2O4 çözeltileriyle laboratuvar sıcaklığı ve 50˚C’ta yaptığınız işlemlerde, KMnO4 ’ ın renginin açılması için belirlediğiniz zaman aralıkları farklı mıdır? Farklıysa nedeni ne olabilir? 3. 2 ve 3. tüplerde farklı sıcaklıklarda gerçekleştirdiğiniz tepkimelerde KMnO4 ’ın renginin açılması için geçen zamanlar arasındaki farktan yola çıkarak sıcaklık farkının Na2C2O4 ’ın tükenme hızını kaç kat artırdığını hesaplayınız. Yaptığınız etkinlikte aynı derişime sahip FeSO4 ve Na2C2O4 çözeltilerinin 0,1 M’ lık KMnO4 çözeltisi ile farklı hızlarda tepkime verdiğini KMnO4 ’ın renk değişim hızındaki farklılıktan anlamış olmalısınız. Aynı derişime sahip farklı maddelerin sabit derişimli KMnO4 çözeltisi ile farklı hızlarda tepkime vermeleri tepkime hızının doğrudan madde türüne bağlı olduğunu gösterir. Bir kimyasal olayda, tepkimeye giren taneciklere ait bağların kırıldığını, kırılan bağların yeniden düzenlenerek ürünlerin oluştuğunu öğrendiniz. Bu yüzden tepkimelerin hızı, kırılan ya da yeniden oluşan bağların türüne, dolayısıyla bu bağların enerjilerine bağlıdır. Tepkimede kırılacak bağ sayısı ne kadar çok ve bağ enerjisi ne kadar büyük ise tepkime de o kadar yavaş olacaktır. Örneğin, renksiz NO gazı, O2 gazı ile çok hızlı bir şekilde birleşerek kahverengi bir gaz olan NO2 gazını oluşturur. Bu tepkime oda sıcaklığında çok hızlı gerçekleşir. 25 ˚C NO(g) + 1/2O2(g) → NO2(g) 78 (Çok hızlı) ORTAÖĞRETİM KİMYA 11 DERS KİTABI Buna karşın otomobillerin egzozlarından ya da bacalardan çıkan CO gazının, O2 gazı ile birleşerek CO2 gazını oluşturması oldukça yavaştır. 25˚C CO(g) + 1/2O2(g) → CO2(g) (Çok yavaş) Mg + HCl Zn + HCl Fe + HCl Bu iki tepkimeye ait denklemlerde tepkimeye giren maddeler ile oluşan ürünlerin molekül formülleri dikkatle incelenirse tepkimeye giren maddelerin ve ürünlerin molekül formüllerinin büyük bir benzerlik gösterdiği görülür. Ancak bu iki tepkime aynı sıcaklıkta gerçekleşmelerine, giren maddelerin ve oluşan ürünlerin formüllerindeki benzerliğe rağmen farklı hızlarda tamamlanırlar. Resim 2.3: Tepkime hızının madde cinsine bağlılığı gaz kabarcıklarının yoğunluğundan anBu farklılık, NO ve CO moleküllerindeki azotlaşılabilir. oksijen, karbon-oksijen bağ enerjilerinin farklılığından ileri gelir. Resim 2.3’te eşit derişimli HCl çözeltilerine atılan eşit mol sayılarına sahip Mg, Zn ve Fe parçalarının asit çözeltileriyle verdikleri tepkimelerde oluşan H2 gazı kabarcıkları görülmektedir. Deney tüplerinde oluşan H2 gazı kabarcıklarının yoğunlukları arasındaki görsel fark tepkimelerin hızına madde cinsinin etkisini açıkça göstermektedir. Kimyasal tepkimelerde hız kavramının göreceli olduğunu öğrendiniz. Bu yüzden bir tepkimeyi hızlı ya da yavaş olarak nitelemek yerine o tepkimenin hızını başka bir tepkimenin hızıyla karşılaştırmanın daha doğru olacağını herhâlde tahmin edersiniz. Tepkime denklemine bakarak ya da iki farklı tepkimenin tepkime denklemlerini kabaca karşılaştırarak bu tepkimelerin hızı hakkında bir tahminde bulunabiliriz. Genellikle kovalent bağ içeren moleküllerin çarpışmaları sırasında atomlar arasındaki bağların zayıflatılması, koparılması ve atomların yeniden düzenlenerek yeni moleküller oluşması uzun zaman alacağından bu tepkimelerin hızı moleküldeki atom ve bağ yapısına göre orta, yavaş ya da çok yavaş olabilir. Fe(k) + 3/2O2(g) → Fe2O3(k) (Orta yavaş) 2N2O5(g) → 4NO2(g) + O2(g) (Yavaş) 3O333 C2H5OH(s) + 3O2(g) → 2CO2(g) + 3H2O(s) (Çok yavaş) Örneklerden de görüldüğü gibi atomların yeniden düzenlenmesi ile yürüyen tepkimelerin oda sıcaklığındaki hızları genellikle küçüktür. Bazı tepkimeler çok atomlu ya da basit iyonlar arasında gerçekleşebilir. Bu tür tepkimelerin hızlarını belirleyebilmek için tepkimeye giren maddelerin bağ yapılarına ve çarpışması gereken tanecik sayısına bakmak gerekir. Bağ kırılması olmayan sadece elektron alış verişine dayalı tepkimeler, oldukça hızlıdır. 4+ 3+ 3+ Fe2+ (suda) + Ce (suda) → Fe (suda) + Ce (suda) (Hızlı) Aynı anda çarpışması gereken tanecik sayısının çok olduğu tepkimeler yavaştır. Aşağıda denklemleri verilen 1. tepkimede 23 iyonun, 2. tepkimede 14 iyonun aynı anda çarpışması gerektiği kabul edilirse 1. tepkimenin 2. tepkimeden daha yavaş olması beklenir. Gerçekten de deneysel veriler 1. tepkimenin 2. tepkimeden daha yavaş olduğunu göstermiştir. – + 2+ 1. 5C2O2– 4(suda) + 2MnO4(suda) + 16H (suda) → 10CO2(g) + 2Mn (suda) + 8H2O(s) (2. den yavaş) – + 3+ 2+ 2. 5Fe2+ (suda) + MnO4(suda) + 8H (suda) → 5Fe (suda) + Mn (suda) + 4H2O(s) 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge (1. den hızlı) 79 Atomların yeniden düzenlemesine gerek olmaksızın yürüyen tepkimelerin oda sıcaklığındaki hızları genellikle büyüktür. Zıt yüklü iyonlar arasındaki tepkimeler aynı yüklü iyonlar arasındaki tepkimelerden daha hızlıdır. Örneğin, çökelme ve nötrleşme tepkimeleri zıt iyonlar arasında gerçekleştiğinden oldukça hızlıdır. H+(suda) + OH–(suda) → H2O(s) + Ag (suda) + Cl–(suda) (Çok hızlı) → AgCl(k) (Çok hızlı) 2+ 2+ 4+ 2Fe3+ (suda) + Sn (suda) →2Fe (suda) + Sn (suda) (Hızlı) 2+ Zn(suda) + Cu2+ (suda) → Zn (suda) Cu(k) (Orta hızlı) ☞ÖRNEK : 6 2– 1. Ba2+ (suda) + SO 4(suda) → BaSO4(k) + 2+ 2+ 2. Fe3+ (suda) + Cu (suda) → Fe (suda) + Cu (suda) 3. C3H8(g) + 5O2(g) 4. 3Fe2+ (suda) + → 3CO2(g) + 4H2O(g) NO–3(suda) + 4H+(suda) → 3Fe3+ (suda) + NO(g) + 2H2O(s) Yukarıdaki tepkimeleri en hızlı olandan en yavaş olana doğru sıralayınız. ✍ÇÖZÜM 1.tepkime, zıt yüklü iyonlar arasında gerçekleştiğinden en hızlıdır. 2.tepkime, bağ kırılması olmadan sadece elektron alış verişiyle gerçekleşeceğinden; zıt yüklü iyonlar arasında gerçekleşen 1. tepkimelere göre yavaş, bağ kırılması ve yeni bağların oluşmasıyla gerçekleşen 3 ve 4. tepkimelere göre daha hızlıdır. 3.tepkimede C—C, C—H ve O—O bağları kırılıp C—O ve H—O bağları oluşacağından bu tepkimenin hızı, daha az sayıda bağ kırılması ve oluşması ile gerçekleşen 4. tepkimeye göre daha yavaştır. 4.tepkimede hem elektron alış verişi olduğundan hem de sadece N—O bağları kırılarak yeniden N—O ve H—O bağları oluşacağından 3. tepkimeden daha hızlı, 1 ve 2. tepkimeden daha yavaştır. Bu duruma göre tepkimelerin hızları 1 > 2 > 4 > 3 şeklinde sıralanır. Günlük gözlemlerinizden genellikle bol havalı ortamlarda gerçekleşen yanma olaylarının parlak alevler saçarak havasız ortamlarda ise is çıkararak gerçekleştiğini bilirsiniz. Benzer iki olayın farklı alev gösterisi ile gerçekleşmiş olmasının, tepkimeye katılan madde miktarları ile ilgili olduğunu tahmin edersiniz. Kimyasal tepkimelerde tepkimeye giren maddelerin derişimlerinin artması, kimyasal tepkimelerin hızlarını arttırır. Eğer birim hacimdeki tanecik sayısı artarsa artan tanecik sayısıyla doğru orantılı olarak etkin çarpışma sayısı ve tepkime hızı da artar. Örneğin, yanmakta olan bir kibrit çöpü oksijen gazı ile dolu tüpe daldırılırsa daha parlak bir alevle yanmaya başlar (Resim 2.4). Bunun nedeni, birim hacimdeki oksijen moleküllerinin sayısının artışına bağlı Resim 2.4: Birim hacimdeki molekül sayısına bağlı olarak tepkime hızı da artar. olarak yanma tepkimesinin hızının da artmış olmasıdır. 80 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Kimyasal tepkimelerde tepkimeye giren maddelerin miktarının artırılması gibi azaltılması da tepkime hızını etkiler. Eğer kapalı bir sistemde gerçekleşen bir tepkimede birim hacimdeki tanecik sayısı azalırsa azalan tanecik sayısıyla doğru orantılı olarak etkin çarpışma sayısı ve tepkime hızı da azalır. Örneğin, kapalı bir kapta yanmakta olan mumun alevi zamanla küçülür ve parlaklığı azalır (Resim 2.5). Bunun nedeni, yanma olayını gerçekleştiren etkenlerden biri olan oksijen moleküllerinin birim haResim 2.5: Ortamdaki oksijen molekülleri azaldıkça mumun yanma hızı da azalır. cimdeki sayısının azalması ve dolayısıyla tepkime hızının da azalmış olmasıdır. Derişim değişimine bağlı olarak tepkime hızında oluşan değişme, katı-gaz fazında gerçekleşen tepkimeler gibi katı-sıvı fazında gerçekleşen tepkimelerde de olur. Örneğin, beşer santimetrelik magnezyum şeritler ile 0,5 M ve 1 M’lık HCl çözeltileri tepkimeye sokulursa 1 M’ lık HCl çözeltisi ile gerçekleştirilen tepkimeden birim zamanda daha fazla hidrojen gazı elde edilir (Resim 2.6). 0,5 M HCl 1 M HCl Resim 2.6: Eşit miktarlardaki magnezyum şeritlerin 0,5 M ve 1 M HCl çözeltileri ile verdikleri tepkimeler 0,5 ve 0,1 M ’lık HCl çözeltilerinin Mg ile tepkimelerinden elde edilen H2 gazı miktarları grafiğe geçirilirse Grafik 2.5 elde edilir. Bu grafik katı-sıvı tepkimelerinde derişim değişimine bağlı olarak tepkiBoyle-Mariotte (Boyle Maryot) Yasası ’ na göre sabit sıcaklıkta kütlesi değişmeyen bir gazın basıncı, hacmiyle ters orantılı olarak değişir. Yani bir gazın hacmi küçüldükçe basıncı ve derişimi artar. Dolayısıyla bir gazın basıncı artırıldığında derişimi de artacağından artan basınçla doğru orantılı olarak tepkime hızı da artar. Hidrojen gazının hacmi (cm3) me hızının da değiştiğini gösterir. 60 1M 50 HCl çözeltisi 40 0,5 M HCl çözeltisi 30 20 10 10 20 30 40 50 60 70 80 90 100 110 120 Zaman (s) Grafik 2.5: HCl çözeltisinin molar derişimine bağlı olarak birim zamanda açığa çıkan H2 gazının hacmi 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 81 Gaz fazında, kapalı bir kapta A ve B tanecikleri arasında gerçekleşen A(g) + B(g) → C(g) + D(g) genel tepkimesinde A taneciklerinin B taneciklerine çarpma olasılığı, bu taneciklerin sayısına bağlıdır. Örneğin, tepkime kabına bir miktar daha A eklenirse B taneciklerinin A tanecikleri ile çarpışma olasılığı artar. Kaptaki B taneciklerinin sayısı artırılırsa bu kez A taneciklerinin B tanecikleri ile çarpışma olasılığı artar. Bu yüzden tepkime kabında girenlerin tanecik sayısının artması çarpışma olasılığını, dolayısıyla tepkime hızını artırır (Şekil 2.3). Derişime bağlı olarak çarpışma sayısının artışı Şekil 2.3’te gösterilmiştir. İnceleyiniz. A B B derişiminin % 100 artması, A ile B’ nin çarpışma olasılığını % 100 arttırır. A B B 1 çarpışma olasılığı A B B 2 çarpışma olasılığı B A B A derişiminin %100 artması, A ile B’ nin çarpışma olasılığını % 100 arttırır. 2 çarpışma olasılığı A A 4 çarpışma olasılığı B A B A B B derişiminin % 50 artması, A ile B’ nin A B çarpışma olasılığını % 50 arttırır. B 4 çarpışma olasılığı A B A B 6 çarpışma olasılığı A ve B derişimleri iki katına çıkarılırsa A ile B’ nin çarpışma olasılığı dört katına çıkar. 4 çarpışma olasılığı A B A B A B A B 16 çarpışma olasılığı Şekil 2.3: Derişimin çarpışma olasılığına etkisi Yaptığınız etkinlikte 50 ˚C’taki Na2C2O4 ve KMnO4 tepkimesinin oda sıcaklığındaki tepkimesinden daha hızlı gerçekleştiğini gözlemlemiş, Na2C2O4 ’ın tükenme hızının kaç kat arttığını hesaplamış olmalısınız. Bir tepkimenin oluşabilmesi için tepkimeye giren maddelerin taneciklerinin belli bir aktifleşme enerjisine sahip olması gerektiğini biliyorsunuz. Eğer tepkimeye giren maddelerin taneciklerinin enerjileri herhangi bir yolla artırılırsa doğal olarak etkin çarpışma olasılığı da artar. Sıcaklık artırıldığında tepkimeye giren maddelerin taneciklerinin kinetik enerjileri, dolayısıyla hızları da artar. Bu yüzden tanecikler arası çarpışmalar daha sık ve şiddetli olur. Aktiflenmiş kompleks oluşturabilecek tanecik sayısı da artar. Böylece tepkimenin hızı, tepkimenin endotermik ya da ekzotermik oluşuna bağlı olmaksızın artar. 82 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Yapılan deneyler, oda sıcaklığında 10 ˚C’luk bir sıcaklık artışının, birçok tepkimenin hızını genellikle 2 ile 5 kat arasında artırdığını göstermektedir. Bu artış neden ileri gelir? Akla gelen şey, yukarıda da belirtildiği gibi sıcaklığın artmasıyla tepkimeye giren taneciklerin kinetik enerjilerinin ve dolayısıyla hızlarının arttığı, bunun sonucu olarak da etkin çarpışma sayısının arttığıdır. Fakat bu artış, gözlenen tepkime hızı artışını karşılayacak büyüklükte değildir. Örneğin, 300 K ile 310 K arasındaki 10 K’ lik bir sıcaklık artışı, çarpışma sayısını genellikle 1,02 oranında, tepkime hızını da 2 ile 5 kat arasında artırır. Öyleyse sıcaklık artışı, çarpışma sayısından daha çok, taneciklerin kinetik enerjisini dolayısıyla kinetik enerji dağılımını artırmaktadır. Tanecikler arasındaki kinetik enerji dağılımı, Maxwel-Boltzmann (Maksvel-Boltzman) dağılım eğrisi denilen eğrilerle gösterilir (Grafik 2.6). Grafik 2.6: Farklı sıcaklıklardaki taneciklerin kinetik enerji dağılımı Grafik 2.6’da 300 K sıcaklıkta, aktifleşme enerjisine erişmiş ya da daha büyük enerjiye sahip taneciklerin sayısı azdır. Dolayısıyla tanecikler arası çarpışmaların çok azı tepkimeyle sonuçlanır. Sıcaklık 310 K’e çıkarılırsa aktifleşme enerjisinden daha büyük enerjiye sahip taneciklerin sayısı da artar. Bu nedenle tanecikler arası çarpışma sayısı çok değişmemekle birlikte etkin çarpışma sayısı, etkin çarpışma sayısına paralel olarak da tepkime hızı artar. Tanecik sayısı Grafik 2.7’de de belli bir enerjiye sahip olan taneciklerin enerji dağılım eğrisi verilmiştir. Eğer tepkimenin aktivasyon enerjisi Ea′ gibi büyük bir değerde ise bundan fazla enerjili taneciklerin sayısı çok az olur. Çarpışmaların küçük bir kısmı tepkimeye neden olur. Diğer yandan aktivasyon enerjisi Ea″ gibi küçük bir değerde olursa moleküllerin büyük bir kısmı enerjili hâle geçer ve çarpışmaların büyük çoğunluğu tepkime ile sonuçlanır, tepkime hızlanır. Etkin çarpışma yapabilecek tanecik sayısı çoktur. Etkin çarpışma yapabilecek tanecik sayısı azdır. Enerji dağılımı Kinetik enerji Grafik 2.7: Farklı sıcaklıklardaki taneciklerin enerji dağılımı Sıcaklık değişikliklerinin canlı organizmalar üzerinde de önemli etkileri vardır. Ateşi yükselen bir insanın vücudundaki kimyasal tepkimelerin hızı artar, kalp atışı ve solunumu hızlanır. Sindirim ve sinir sistemlerinde anormallikler ortaya çıkar. Ateşi 1 ˚C yükselen bir insanın bazal metabolizma hızı %5 dolayında artar. Ayrıca ortam sıcaklığının yükselmesinin de canlılar üzerinde benzer etkileri vardır. Vücut sıcaklığının düşmesi durumunda ise vücuttaki tepkimelerin hızı azalır. Bu nedenle ameliyathanelerde sıcaklık düşük tutularak hastanın metabolizma hızı ve oksijen gereksinimi azaltılır. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 83 Sıcaklığa bağlı olarak tepkime hızının değişmesine en güzel ve en basit örnek Resim 2.7 ’ deki gibi buzdolabında saklanan yiyeceklerin daha uzun bir sürede, mutfakta bırakılan yiyeceklerin daha kısa bir sürede bozulmalarıdır. Yaptığınız etkinlikten ve yukarıdaki öğrendiklerinizden tepkime hızının sıcaklığa çok duyarlı olduğunu ve sıcaklık değişimine bağlı olarak tepkimelerin yavaş ya da hızlı gerçekleştiğini anlamış olmalısınız. Deneysel veriler sıcaklığın her 10 ˚C yükselmesi ya da azalması durumunda tepkime hızının da 2 ya da 5 kat arttığını ya da azaldığını ortaya koymuştur. Arrhenius (Arhenius) 1889’da sıcaklık değişiminin tepkime hızına, tepkime hız sabitine ve taneciklerin aktivasyon enerjisine etkilerini deneysel olarak göstermiştir. Arrhenius bu amaçla gaz hâlindeki etilbromürün farklı sıcaklıklarda hidrojen bromüre bozunmasını incelemiş ve sıcaklık değişiminin Resim 2.7: Buzdolabında saklanan besinler daha geç bozulur. tepkime hız sabitine etkisini deneysel olarak kanıtlamıştır. Böyle bir deneye ait veriler Tablo 2.2’ de verilmiştir. İnceleyiniz. Şimdi aşağıdaki etkinliği yapınız. Tablo 2.2: Sıcaklık değişimine bağlı olarak hız sabitinin değişimi k 0,0361 0,141 0,622 1,410 T (K) 800 833 877 900 3. ETKİNLİK: KİM HIZLANDIRDI? Güvenliğiniz için Neler Gerekli? ❏ Dereceli silindir (100 mL) ❏ Su ❏H2SO4 çözeltisi (0,01 M, 50 mL) ❏ Damlalık ❏ Beherglas (100 mL, 3 adet) ❏ Pipet (10 mL) ❏H2O2 çözeltisi (%1’lik, 50 mL) ❏ Etiket ❏ Nişasta çözeltisi (20 mL) ❏ Baget (Cam çubuk) ❏FeSO4 çözeltisi (0,01 M, 25 mL) ❏KI çözeltisi (% 5’lik, 50 mL) Nasıl Yapacaksınız? 3 Beherglaslara önceden üzerine 1, 2, 3 numaralarını yazdığınız etiketleri yapıştırınız, her birine 50 mL su koyunuz ve üzerlerine beşer damla KI çözeltisi ilave ediniz. 3 Beherglaslardaki karışımlara ikişer mL H2SO4 çözeltisi, ikişer mL taze hazırlanmış nişasta çözeltisi ve ikişer mL H2O2 çözeltisi ekleyiniz. 3 Beherglaslardaki karışımları baget ile iyice karıştırınız. 3 2 numaralı beherglastaki karışıma 5 damla, 3 numaralıdakine 10 damla FeSO4 çözeltisi ekleyiniz. Beherglaslardaki değişmeleri gözlemleyiniz. Etkinlik Sonu Soruları 1. Renk değişimi hangi beherglasta daha önce gerçekleşti? 2. Beherglaslardaki renk değişim hızlarını birbirine göre nasıl kıyaslarsınız? 84 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Yaptığınız etkinlikte her üç beherglastaki karışımın da tepkime verdiğini renk değişiminden anlamışsınızdır. Beherglaslardaki karışımların renk değişim hızlarının, dolayısıyla tepkime hızlarının da farklı olduğunu belirlemişsinizdir. Yaptığınız etkinlikte beherglaslardaki karışımlara seyreltik H2SO4 eklemeniz asidik ortam oluşturur. Asidik ortamda H2O2 ile I – iyonu arasındaki tepkimede I 2 oluşur. Oluşan I 2 ’un etkisiyle nişasta renklenir. Bu tepkime denklemi şöyledir: H2O2(s) + 2I –(suda)+ 2H+(suda) → I 2(k) + 2H2O(suda) Yaptığınız etkinlikte tepkime ortamına FeSO4 çözeltisi, diğer bir ifadeyle Fe2+ iyonu eklediğinizde sizin de gözlemlediğiniz gibi yukarıda denklemi verilen tepkimeden daha hızlı ilerleyen bir tepkime gerçekleşir. Bu tepkime iki basamaklıdır. Eğer tepkime ortamına daha fazla FeSO4 çözeltisi ilave edilirse tepkime daha hızlı oluşur. + 3+ 2Fe2+ (suda) + H2O2(s) + 2H (suda) → 2Fe (suda) + 2H2O(s) – 2+ 2Fe3+ (suda) + 2I (suda) → 2Fe (suda) +I 2(k) Bu iki tepkime taraf tarafa toplanırsa net tepkime denkleminin ilk tepkime denklemi ile aynı olduğu görülür. + + + 2Fe2( suda → 2Fe(3suda ) + H2O2( s ) + 2H( suda ) ) + 2H2O( s ) – + + + 2Fe(3suda → 2Fe(2suda ) + 2 I suda ) + I 2( k ) – + 2H+( suda ) → I2(k ) + 2H2O( s ) H2O2( s ) + 2Isuda Net tepkime denklemini veren iki basamaklı tepkime incelenirse Fe2+ iyonunun tepkimeye katılarak ara basamaklarda bozunduğu ancak tepkime sonrasında bozunmadan aynen ortaya çıktığı görülür. Demek ki FeSO4 çözeltisi dolayısıyla Fe2+ iyonu bu tepkimeyi hızlandıran temel etkendir. Örnek aldığımız H2O2 ve I – tepkimesindeki gibi tepkime hızını değiştiren ancak tepkime sonucunda oluşan maddelerin bileşimlerini değiştirmeyen maddelere (örneğimizde FeSO4) katalizör denir. Katalizörleri tepkime hızını değiştiren maddeler olarak tanımladık. Katalizörler tepkime hızını değiştirdiklerinden bazen tepkimelerin hızını artırmak, bazen azaltmak bazen de tepkimeyi tamamen durdurmak için kullanırlar. Tepkime hızını arttıran katalizörlere pozitif katalizörler denir. Örneğin, laboratuvarda O2 gazı elde etmek için ısıtılan KClO3’a bir miktar MnO2 ilave edilirse tepkime hızlanarak kısa sürede sonlanır. Bu olayda MnO2 pozitif katalizör işlevini görür. Yine laboratuvarlarda oda sıcaklığında H2O2 yavaş da olsa O2 gazı çıkararak bozunur. Ortama bir miktar K3PO4 tuzu konursa bozunma engellenir. K3PO4 gibi tepkimeyi durduran ya da yavaşlatan katalizörlere negatif katalizör veya inhibitör denir. Negatif katalizörlere son bir örnek kurşun tetraetil [Pb(C2H5)4] verilebilir. Benzine katılan kurşun tetraetil benzindeki düşük karbonlu moleküllerin erken tutuşmasını engelleyerek motorlarda vuruntuyu önler. Katalizörler tepkimenin hızını değiştiren ancak tepkime sonunda kimyasal değişikliğe uğramayan maddelerdir. Katalizörler, gerçekleşmesi mümkün olmayan tepkimelerin oluşmasını sağlayamaz. Katalizörlerin tepkimede gördüğü işleve kataliz denir. Kataliz işlemi daha çok tepkime hızını artırmak için uygulanır. Ancak tepkime hızını yavaşlatan katalizörler de vardır. Katalizörler, net tepkime denklemlerinde gösterilmez. Tepkimede kullanılan katalizörün belirtilmesi gerekirse katalizör tepkime denkleminde denklik işaretinin (okun) üzerine yazılır. MnO2 2H2O2(s) → 2H2O(s) + O2(g) 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 85 Pt ve Rh 4NH3(g) + 7O2(g) → 4NO2(g) + 6H2O(s) Potansiyel enerji (kJ) Katalizörler tepkimelerin ileri ve geri yöndeki aktifleşme enerjisini düşürerek daha düşük enerjili aktiflenmiş kompleks oluşmasını sağlar. Böylece aktifleşme enerjisini aşabilecek tanecik sayısını ve tepkimenin hızını arttırır (Grafik 2.8). Eai Eai : Katalizörsüz ileri yöndeki tepkime aktifleşme enerjisi Ekat(i) : Katalizörlü ileri yöndeki tepkime aktifleşme enerjisi Eag : Katalizörsüz geri yöndeki tepkime aktifleşme enerjisi Ekat(g) : Katalizörlü geri yöndeki tepkime aktifleşme enerjisi Ekat(i) Girenler Eag Ekat(g) ∆H˚ Ürünler Zaman (s) Grafik 2.8: Katalizör, aktifleşme enerjisini düşürerek tepkime hızını arttırır. Grafik 2.8’de kırmızı renkle çizilen eğri, katalizör kullanılmadan potansiyel enerjideki değişimi göstermektedir. Mavi renkle çizilen eğri ise aynı tepkimede katalizör kullanıldığında potansiyel enerjideki değişimi göstermektedir. Katalizör kullanılması durumunda aktifleşme enerjisi düşecek, dolayısıyla aktifleşme enerjisi engelini aşabilecek tanecik sayısı daha fazla olacağından tepkime hızı da artacaktır. Tepkime entalpisi ise değişmeyecektir. Çünkü katalizörlerin tepkime entalpisine etkileri yoktur. Endüstriyel açıdan önemli bazı kimyasal tepkimelerin hızı ekonomik bir üretim için yeteri kadar yüksek değildir. Bu nedenle bu tepkimelerde tepkime hızının uygun katalizörler kullanılarak artırılması gerekir. Ancak endüstride geniş ölçüde kullanılan NH3 ve SO3 gibi maddelerin üretiminde katalizör kullanarak tepkime sıcaklığının düşürülmesi gerekir. Bazı tepkimelerde tepkime yürürken oluşan ürünlerden birisi de tepkimenin hızını artırabilir. Bu tür kendi kendine katalizleme olayına otokataliz denir. Örneğin, okzalik asidin asidik ortamda potasyum permanganatla tepkimesinde başlangıçta karbonun yükseltgenme hızı çok yavaştır. → 2Mn2+ + 10CO2 + 8H2O 5C2O24− + 2MnO−4 + 16H+ ← Tepkime ilerledikçe oluşan Mn2+ iyonları katalizör ödevi görerek karbonun yükseltgenmesini, dolayısıyla tepkimeyi hızlandırır. Eğer tepkime kabına başlangıçta bir miktar MnO2 konulursa tepkimenin hızla yürüdüğü görülür. Katalizörler tepkime ortamında tepkimedeki maddelerle aynı fazda (homojen) ya da tepkimedeki maddelerle farklı fazda (heterojen) olarak bulunabilirler. Bu nedenle homojen ya da heterojen katalizörlerden söz edilir. Örneğin, SO2 ile O2 gazları arasında bir tepkimenin gerçekleştiği ortama, NO2 gazı gibi bir katalizör ilave edilirse NO2 gazı homojen katalizör olarak sınıflandırılır. Bu tepkimeye ait mekanizma şöyledir: → SO3( g ) + NO( g ) SO2( g ) + NO2( g ) ← → NO2( g ) + NO( g ) + 1 / 2O2( g ) ← SO2( g ) + 1 / 2O2( g ) → SO3( g ) 3. etkinlikte H2O2 ve H2SO4 çözeltileri üzerine FeSO4 çözeltisi eklediğinizde FeSO4 ın tepkime hızını etkilediğini yani tepkimede katalizör olarak görevi yaptığını belirlemişsinizdir. H2O2 ve H2SO4 çözeltileri gibi üzerine eklediğiniz FeSO4 çözeltisi de sıvı fazda olduğundan homojen katalizördür. 86 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Yapay gübre yapımında kulanılmak üzere H2 ve N2 gazlarından NH3 gazı elde edilirken tepkime hızını düşürmek amacıyla tepkime ortamına Pt ve Rh gibi katı katalizörler eklenir. Pt H2(g) + 3H2(g) → 2NH3(g) Bu tepkimede tepkimeye giren maddeler ve ürün gaz hâlinde, tepkime ortamına eklenen Pt ve Rh gibi katalizörler katı hâlde olduklarından Pt ve Rh heterojen katalizörlerdir. Yukarıda örnek tepkimedeki gibi heterojen katalizörlerin kullanıldığı tepkimelerde kataliz işlemi katalizör maddenin gözenekli iç ve dış yüzeylerinde gerçekleşir. Tepkimeye giren madde tanecikleri bu gözenekli yüzeylere tutunarak tepkime verir. 9. sınıf biyoloji derslerinde öğrendiğiniz gibi canlıların vücutlarında gerçekleşen kimyasal tepkimeleri hızlandıran katalizörlere enzim adı verilir. Örneğin, tükürükteki pityalin ile mide öz suyundaki pepsin enzimleri, protein ve nişasta gibi büyük moleküllü maddelerin daha küçük moleküllere ayrışmasını hızlandırır. Pek çok biyokimyasal olay fermentlerin, enzimlerin, hormonların, vitaminlerin ya da asitlerin katalitik etkisinde gerçekleşir. Örneğin, şeker kamışından elde edilen çay şekerinin (sakkarozun) inversiyonu ile glikoz ve früktoz elde edilir. Bu olayda inversiyon hızı ortamdaki hidrojen iyonları derişimi artırılarak sağlanır. Reçel imalatçıları reçelin zamanla şekerlenmesini istemezler. Reçeli kaynatırken karışıma limon suyu katarlar. Limon suyundaki asit, reçele hidrojen iyonları verir. Hidrojen iyonları sakkarozun (şekerin) glikoz ve früktoza ayrılması olayını katalizler. Glikoz ve früktoz monosakkarit olduklarından kolay şekerlenmez. Aşağıdaki etkinliği yaparak temas yüzeyinin tepkime hızına etkisini irdeleyiniz. 4. ETKİNLİK: TEK PARÇA MI YOKSA ÇOK PARÇA MI? Neler Gerekli? Güvenliğiniz için ❏ Saat ❏ Alüminyum levha (5 g) ❏ Alüminyum parçaları (5 g) ❏ HCl çözeltisi ❏ Dereceli silindir (10 mL) ❏ Beherglas (100 mL, 2 adet) Nasıl Yapacaksınız? 3 Beherglaslara 3/4’ne kadar asit çözeltisi doldurunuz. 3 Beherglaslardaki asit çözeltilerinden birine alüminyum levhayı, diğerine alüminyum parçalarını atınız. Bu anı başlangıç anı olarak kaydediniz. 3 Beherglaslarda gerçekleşen olaylarla ilgili gözlemlerinizi kaydediniz. Etkinlik Sonu Soruları 1. Yaptığınız etkinlikle beherglaslardaki hidrojen gaz çıkış hızları aynı mı yoksa farklı mı? Sonucu nasıl açıklarsınız? 2. Her iki beherglasta gerçekleşen tepkimeler aynı sürede mi yoksa farklı sürede mi sonlandı? Sonucu nasıl açıklarsınız? 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 87 Homojen kimyasal tepkimelerde, tepkimeler aynı fazda bulunan girenler arasında yürüdüğünden giren tanecikler her an birbiriyle etkin çarpışmalar yapabilir. Ancak ayrı fazlarda ve özellikle katı-sıvı, katı-gaz fazlarında girenlerin bulunduğu heterojen kimyasal tepkimelerde etkin çarpışmaların sayısı sıcaklığa ve etkileşmenin gerçekleşeceği temas yüzeyine bağlı olarak değişir. Örneğin, Fe metali H2SO4 çözeltisi içine atılırsa FeSO4 ve H2 gazı oluşur. Fe(k) + H2SO4(suda) → FeSO4(suda) + H2(g) Bu tepkimede tepkime hızı demir yüzeyinin büyüklüğüne bağlıdır. Eğer demir metali eğelenip toz hâlinde asit içine atılırsa temas yüzeyi artacağından tanecikler arasındaki etkin çarpışma olasılığı da artar. Tepkime de çok daha hızlı gerçekleşir. Çünkü eğeleme ile elde edilen demir tozlarının temas yüzeyi, tek bir parça demirinkinden çok daha büyük olur. Sonuç olarak demir eğelenerek toz hâline getirilip asit içine atılırsa tepkime çok daha hızlı yürür ve çok daha kısa sürede sonlanır. Bildiğiniz gibi sönmemiş kireç, kireç taşının ısıtılarak bozunmasından elde edilir. CaCO3(k) → CaO(k) + CO2(g) Tepkime denklemine göre tepkimenin hız denkleminin r = k [CaCO3] şeklinde olması gerekir. Oysa tepkimede kullanılan CaCO3 katı fazda olduğundan derişimi değişmez. Dolayısıyla tepkime hız denkleminde yer almaz. Bu durumda tepkime hız denklemi r = k şekline indirgenir. Bu da bize söz konusu tepkimenin hızını belirleyen ana etkenin tepkimenin hız sabiti olduğunu gösterir. Daha önce tepkime hız sabitinin sıcaklığa, etkin çarpışma sayısına ve aktivasyon enerjisine bağlı olarak değiştiğini öğrendiniz. Bu hız denklemine sıcaklık ve aktivasyon enerjisi sabit olduğuna göre tepkime hız sabitini, diğer bir ifadeyle tepkime hızını artıran etken temas yüzeyi olmalıdır. O hâlde CaCO3’tan daha verimli, endüstriyel anlamda daha ekonomik olarak sönmemiş kireç elde etmenin yolu CaCO3’ı küçük parçalar ya da toz hâlinde tepkimeye sokmak olmalıdır. 4. Reaksiyon Derecesi ve Molekülerite Tepkime hızının tepkimeye giren maddelerin derişimlerinin bir fonksiyonu olduğunu öğrendiniz ve aA(g) + bB(g) → cC(g) + dD(g) genel tepkimesi için tepkime hız denklemini r = k [A]a [B]b şeklinde yazdınız. Yazdığınız hız denklemine göre tepkime hızı, tepkime denklemindeki mol kat sayıları üs olarak alınmak koşuluyla A ve B maddelerinin derişimlerinin çarpımıyla doğru orantılıdır. Tepkime hız denklemindeki derişimlerin üsleri toplamına tepkimenin derecesi (reaksiyon mertebesi) denir. Örnek aldığınız genel tepkime için tepkime derecesi A ve B’nin mol kat sayıları (a, b) toplamına (n = a + b) eşittir. Tepkime derecesi n = 0, 1, 2, 3 gibi tam ya da 1/2, 2/3 gibi kesirli sayılar da olabilir. Ancak tepkimeye giren dört ayrı molekülün aynı anda etkin çarpışma yaparak ürünleri oluşturma olasılığı çok azdır. Bu nedenle n > 3 olamaz. Örneğin, tek basamakta gerçekleşen; PCl5(g) → PCl3(g) + Cl2(g) tepkimesinin hız denklemi; r = k [PCl5] şeklindedir. Hız denklemine göre tepkimenin derecesi, [PCl5]’nin üssüne (1’e) eşittir. Tepkimenin derecesi 1’dir. H2(g) + I2(g) → 2HI(g) tepkimesinin hız denklemi; r = k [H2] [I2] şeklindedir. Hız denklemine göre tepkimenin derecesi [H2] ve [I2]’nin üslerinin toplamına (n = 1 + 1)eşittir ve tepkime derecesi 2’dir. Bu tepkime hem H2e hem de I2’a göre yine 1. derecedendir. 88 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 2NO(g) + Cl2(g) → 2NOCl(g) tepkimesinin hız denklemi; r = k [NO]2 [Cl2] şeklindedir. Hız denklemine göre tepkimenin derecesi, [NO] ve [Cl2]’nin üslerinin toplamına (n = 2 + 1) eşittir. Tepkimenin derecesi 3’tür. Ancak bu tepkime NO’e göre 2., Cl2’a göre 1. derecedendir. Yukarıda örnek verdiğimiz tepkimeler için tepkime dereceleri deneysel olarak bulunmuş olup tepkime denklemine bakarak çıkarılmış değildir. Örneğin; – 2– S2O2– 8(suda) + 2I (suda) → I 2(suda) + 2SO 4(suda) tepkimesinde sadece tepkime denklemine bakılırsa tepkime 3. dereceden görünür. Oysa bu tepkimenin deneysel verilere göre bulunan derecesi 2’dir. Bu tepkimeye ait 3 deneyin sonuçları şöyledir: · · · Deneysel verilere göre tepkimenin hız denklemi – r = k [S2O2– 8 ] [I ] şeklindedir. Dolayısıyla tep- kimenin derecesi [S2O2–8 ] ve [I – ]’nin üslerinin toplamına (n = 1 + 1) eşittir. Yani 2’dir. Bir tepkimenin hızı, hız sabitine eşit ise (r = k) tepkime derecesi sıfırdır. Kimyasal tepkimelerde tepkimenin derecesi yanında moleküleritesinden de söz edilir. Kimyasal tepkimeye giren ve çarpışma olasılığı bulunan moleküllerin sayısına molekülerite denir. Bu bağlamda molekülleri arasında çarpışma olmadan gerçekleşen tepkimelerin moleküleriteleri 1’dir. Aynı ya da farklı iki molekülün çarpışmasıyla gerçekleşen tepkimelerin moleküleritesi 2, üç molekülün çarpışmasıyla gerçekleşen tepkimelerin moleküleritesi ise 3’tür. Moleküleritesi 1, 2 ya da 3 olan tepkimeler sırasıyla monomoleküler, bimoleküler ve trimoleküler tepkimeler olarak da nitelenir. Bazı tepkimeler ve moleküleriteleri şöyledir: N2O5(g) → N2O4(g) + 1/2O2(g) Monomoleküler 2HI (g) → H2(g) + I 2(g) Bimoleküler 2NO(g) + O2(g) → 2NO2(g) Trimoleküler Çoğu tepkimelerde molekülerite ile tepkime derecesi aynıdır. Ancak belirli bir mekanizması olup da birkaç basamak üzerinden gerçekleşen tepkimelerde molekülerite ve tepkime derecesi farklıdır. Bazı tepkimelerde tepkime derecesi sıfır olabildiği hâlde molekülerite sıfır olmaz. Şimdi tepkime derecesi ve moleküleriteyi iki ayrı örnek üzerinde irdeleyelim: Örneğin, tek basamakta gerçekleştiği deneysel olarak bilinen F2(g) + 2ClO2(g) → 2FClO2(g) tepkimesinde üç molekül birbiriyle çarpışarak tepkime gerçekleştiğinden moleküleritesi 3’tür. Tepkimenin hız denklemi r = k [F2] [ClO2]2 şeklinde olduğundan derişimlerin üslerinin toplamı 3’tür (r = 1 + 2 = 3). Dolayısıyla bu tepkimenin moleküleritesi derecesine eşittir. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 89 Ara basamaklardan geçerek gerçekleştiği bilinen 2NO2(g) + F2(g) → 2NO2F(g) tepkimesinin mekanizması şöyledir: NO2 + F2 → NO2F + F + F + NO2 → NO2F 2NO2( g ) + F2( g ) → 2NO2F( g ) (Yavaş) (Hızlı) (Net tepkime denklemi) Bu tepkimede üç molekül birbiriyle çarpışacağından moleküleritesi 3 ’tür. Tepkimenin hız denklemi mekanizmadaki en yavaş basamak üzerinden yazılacağından r = k [NO2] [F2] şeklindedir. Dolayısıyla tepkime derecesi 2’ dir. Bu tepkimede molekülerite ve tepkime mertebesi birbirinden farklıdır. CANLI KATALİZÖRLER: ENZİMLER Canlı organizmalardaki kimyasal tepkimelerde çeşitli biyokimyasal katalizörler kullanılır. Bu katalizörlere enzim denir. OKUMA METNİ Canlı organizmalarda enzimler etkisinde gerçekleşen tepkimelere glikozun fermantasyonu ve laktozun basit şekerlere parçalanması tepkimeleri örnek verilebilir. Glikoz, zimas enziminin katalitik etkisinde tepkime vererek etil alkol ve karbon diokside ayrışır. Sütte bulunan laktoz ise laktaz enziminin katalitik etkisinde tepkime vererek basit şekerlerden glikoz ve galaktoza ayrılır. Siz de bir krakeri yeterince uzun bir süre çiğnerseniz, tatlandığını fark edersiniz. Çünkü tükürüğünüzdeki amilaz enzimi krakerin yapısındaki nişastanın daha kolay bir şekilde hazmedilen glikoza parçalanmasını hızlandırır. Substrat Tepkime Ürün Aktif bölge Kataliz tepkimesi Enzim Enzimin tepkimelerdeki rolü genel olarak; E + S → ES → E + Ü şeklinde gösterilir. Bu gösterimde E enzimi, S enzimin üzerine etkidiği molekül olan substratı, Ü ürünleri temsil eder. Enzimler aktif (etkin) merkez denilen bir bölgesine substratı bağlayan büyük moleküllü proteinlerdir. Enzim aktif merkez denen bölgesine substratı bağlayarak bir kompleks oluşturur. Bu kompleksin bozulması sonucu ürünler oluşur ve enzim serbest kalır. Böylece enzim başka bir substrat molekülünü aktif merkezine bağlamak üzere ilk hâline gelmiş olur. Biyolojik zehirlenmenin bir şekli, katalitik dönüştürücüdeki kurşunun etkisine çok benzerdir. Bir yabancı substrat, enzimin aktif merkezine çok kuvvetli bir şekilde bağlanırsa enzimin etkinliği kaybolur çünkü bu durumda merkez, gerçek substrata kapatılmış olmaktadır. Sonuç olarak hücredeki biyokimyasal tepkimeler zinciri durur ve hücre ölür. Örneğin sinir gazlarının etkilerini, sinir sisteminde uyarı iletimini sağlayan enzim kontrollü tepkimeleri engellemek süretiyle gösterdiklerine inanılmaktadır. En çok bilinen zehirlerin başında gelen arsenik de benzer bir yolla etkisini göstermektedir. As(V), arsenat iyonları (AsO3– 4 ) şeklinde mideye girdikten sonra As(III)’e indirgenir ve As(III)’te enzimlere bağlanarak onların etkilerini engeller. Yazarlar tarafından derlenmiştir. 90 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Etkin çarpışmadan ne anlıyorsunuz? Açıklayınız. 2. Tepkime entalpisi ile aktivasyon enerjisi arasındaki ilişki nasıldır? Açıklayınız. 3. Tepkime derecesi (mertebesi) ile molekülerite arasındaki fark nedir? Açıklayınız. 4. 2NO2(g) → 2NO(g) + O2(g) Derişim A Tepkimesi için girenlerin ve ürünlerin derişiminin zamana göre değişimi yandaki grafikte verilmiştir. Grafikte O2 gazının zamana göre derişim değişimini hangi eğri gösteriyor olabilir? B C Zaman Tepkimesindeki H2 derişiminin zamana göre değişimi yandaki grafikte verilmiştir. Buna göre tepkime hızı hangi zaman aralığında en yüksektir? Derişim [H2] 5. H2 + I2 → 2HI A B C D 0 6.Yanda verilen I ve II nolu enerji diyagramlarından yararlanarak; a. İleri yöndeki tepkimelerin aktivasyon enerjilerini b. Geri yöndeki tepkimelerin aktivasyon enerjilerini c. İleri ve geri yöndeki tepkimelerin entalpilerini bulunuz. 1 2 Potansiyel enerji (kJ) I 3 200 400 150 300 100 200 50 100 Buna göre tepkimenin ortalama hızı nedir? Zaman (s) Potansiyel enerji (kJ) II Zaman (s) 7. C5H6 → 1/2C10H12 tepkimesinde C5H6’nın zamanla derişim değişimi değerleri yandaki gibidir. 4 Zaman (s) Zaman (s) 0 50 100 150 200 [C5H6] 0,0400 0,0300 0,0240 0,0200 0,0174 B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Bir tepkimede girenlerin derişiminin zamanla değişimini gösteren grafikte herhangi (…) bir noktadan eğriye çizilen teğetin eğimi ortalama hızı verir. 2. Bir tepkimede oksijen gazının derişimi iki kat artırıldığında tepkimenin hızı 4 kat (…) artıyorsa tepkimenin oksijene göre derecesi 2’dir. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 91 3. Bir tepkimenin deney sonuçlarına göre yazılan hız denkleminin, net tepkime denklemine ( … ) göre yazılandan farklı olması tepkimenin belirli bir mekanizmasının olduğunu gösterir. 4. Tepkime hız sabiti sıcaklıkla orantılı olarak artar. (…) 5. Tanecikler arasında oluşan her çarpışma bir tepkime ile sonuçlanır. (…) 6. Aktivasyon enerjisi büyük olan tepkimeler hızlı gerçekleşir. (…) 7. Kimyasal tepkimelerin hızını etkileyen etkenlerden biri de tepkimeye girenlerin bağ yapılarıdır.( … ) 8. Sıcaklığın artırılması çarpışan taneciklerin kinetik enerjilerini, dolayısıyla tepkime (…) hızını artırır. 9. Birim hacimdeki molekül sayısının artması tepkime hızını da artırır. (…) 10. Canlıların vücutlarında gerçekleşen kimyasal tepkimeleri hızlandıran katalizörlere enzim (…) adı verilir. C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Tepkime hızının birimi aşağıdakilerden hangisidir? B) s–1 A) mol / L s 2 D) mol / L s C) mol / L E) s / mol 2. Tek basamakta gerçekleşen 2NO2(g) → N2O4(g) tepkimesinde NO2’in başlangıçtaki derişimi 0,05 M’dır. Tepkime hız sabiti 0,15 mol/L s olduğuna göre 1200 s sonra NO2’in derişimi aşağıdakilerden hangisi olur? A) 0,002 M B) 0,003 M C) 0,004 M D) 0,025 M 3. Tek basamaklı basit bir tepkimenin enerji diyagramı grafiği yanda verilmiştir. Grafiğe göre ileri yöndeki tepkimenin entalpisi aşağıdakilerden hangisidir? A) 120 B) –50 D) 20 E) –20 E) 0,005 M Potansiyel enerji (kJ) 120 100 80 C) 50 Zaman (s) 4. 2H2O2 (suda) → 2H2O(s) + O2(g) tepkimesi için hız bağıntısı r = k · [H2O2 ] Buna göre tepkimenin derecesi (mertebesi) aşağıdakilerden hangisidir? A) 0 B) 1/2 C) 1 D) 3/2 şeklindedir. E) 2 – 5. 2HgCl2(suda) + C2O2– 4(suda) → 2Cl(suda) + 2CO2(g) + Hg2Cl2(k) Yukarıdaki tepkimeye ait bir seri deneyin sonucu aşağıdaki tabloda verilmiştir. Deney numarası Girenlerin derişimi [M] [HgCl2] [C2O42– ] Tepkime hızı (mol/L s) 1 0,164 0,15 3,2 · 10–5 2 0,164 0,45 2,9 · 10–4 3 0,082 0,45 1,4 · 10–4 4 0,246 0,15 4,8 · 10–5 Buna göre tepkime hız sabitinin sayısal değeri aşağıdakilerden hangisidir? A) 1,3 · 10–3 92 B) 3,97 · 10–3 C) 7,94 · 10–3 D) 8,67 · 10–3 E) 1,73 · 10–2 ORTAÖĞRETİM KİMYA 11 DERS KİTABI KİMYASAL DENGE BÖLÜM İÇERİĞİ 1.Tersinmezlik ve Tersinirlik 2. Denge Bağıntısı ve Denge Sabiti 3.Kimyasal Dengeye Etki Eden Etmenler 4.Denge Sabitinin Sıcaklık ve Kat Sayılarla İlişkisi 5. Kimyasal Reaksiyonlarda Ürün Verimi Hemoglobin, kanda oksijen taşıyan bir moleküldür. Deniz seviyesinde yaşayan insanların kanındaki homoglobin oranı yüksek dağlarda yaşayanlarınkinin yaklaşık yarısı kadardır. Bunun sebebi ne olabilir? El feneri, radyo, kasetçalar, elektronik araçların kumandaları vb. yerlerde kuru piller kullanılır. Kuru piller söz konusu araçları çalıştıramaz olduklarında “bitmiş pil” olarak nitelenir. Bitmiş kuru pil bir miktar ısıtıldığında tekrar akım vermeye başlar ve kısa bir süre sonra tekrar bitmiş hâle gelir. Bitmiş kuru pil ısıtıldığında neden tekrar akım verir hâle gelir, hiç merak ettiniz mi? Bu bölümde bu tür sorulara yanıtlar bulacaksınız. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 93 1. Tersinmezlik ve Tersinirlik Otomobil motorlarının yanma hücrelerinde (silindirlerinde) benzin, mazot, LPG gibi petrol türevleri oksijen ile yakılarak enerji elde edilir. Bu arada yanma ürünü olarak karbon dioksit ve su buharı oluşur. Oluşan karbon dioksit ve su buharı hiçbir zaman geri tepkime vererek yakıta dönüşemez. Bildiğiniz gibi hidrojen ve oksijenin tepkimesinde su oluşur. Suyun da geri tepkime vererek hidrojen ve oksijeni oluşturduğu hiçbir zaman gözlenmemiştir. Hidrojen ve oksijenden su oluşması tepkimesi gibi bazı tepkimeler başladıktan sonra geriye dönmeyecek şekilde tek yönde ilerleyerek ürünleri oluşturur. Bu tür tepkimeler tersinmez tepkime olarak nitelenir. Tersinmez olarak nitelenen benzin, mazot ve LPG’ nin yanması, hidrojen ve oksijen gazlarından su oluşması tepkimeleri gibi tek yönlü pek çok tepkimede tepkimeye giren maddelerin tamamı ürünlere dönüşmez. Ortamda miktarı ölçülemeyecek kadar küçük de olsa giren madde kalır. Bu yönüyle tepkimelerin kuramsal olarak %100 tamamlandığı kabul edilemez. Ancak tepkimeye giren maddelerin derişimlerinin ölçülemeyecek kadar az kaldığı hâllerde tepkime tamamlanmış sayılır. Bu yüzden bu tepkimelerin denklemlerinde denklik, tek yönlü ok ( → ) işareti ile gösterilir. C8H18(s) + 25/2O2(g) → 8CO2(g) + 9H2O(g) 2H2(g) + O2(g) → 2H2O(s) Yukarıda tepkime denklemleri verilen oktan ve hidrojenin yanma tepkimelerinde giren maddelerin hemen hemen tamamı ürünlere dönüşürken birçok tepkimede tepkimeye giren maddeler tam olarak ürünlere dönüşmez. Bunun nedeni oluşan ürünlerin tepkimeye giren maddeleri geri oluşturma eğilimidir. Bu eğilimin sonucu olarak tepkime hem ileri hem de geri yönde gerçekleşir. Bir tepkime hem ürünler hem de tepkimeye giren maddeler yönünde gerçekleşiyorsa bu tür tepkime tersinir tepkime olarak nitelendirilir. Tersinir tepkime denklemle ifade edilirken tepkimeye giren maddelerle oluşan ürünler arasına tepkimenin hem ürünler hem de girenler yönünde gerçekleştiğini belirtmek için çift ok ( ) işareti konur. Br2( s ) Br2( g ) H2( g ) + I2( g ) 2HI( g ) Yukarıda öğrendiklerinizden her tepkime için ileri ve geri yönde tepkimelerin söz konusu olduğunu, ancak kuramsal olarak tepkimelerin %100 tamamlanmasının olası olmadığını kavramış olmalısınız. Dolayısıyla pratikte tepkimeye giren maddelerin derişimlerinin ölçülemeyecek kadar az kaldığı hâllerde tepkimenin tamamlandığının varsayıldığını anlamışsınızdır. Şimdi manometreye bağlı kapalı bir kapta, belirli bir sıcaklığa sahip sıvı bulunduğunu ve sıvının başlangıçta buBuhar (En fazla harlaşmadığını varsayalım. Bu durumda düzensiz durum) manometrenin kollarındaki cıva seviyeleri birbirine eşittir (Şekil 2.4.a). Kapalı kapBuhar taki sıvı buharlaştırılırsa sıvı molekülleri Sıvı (En fazla Sıvı Sıvı enerjili belirli bir hızla buhar fazına geçmeye ve durum) a b manometrenin kapalı uçlu kolunda cıva yükselmeye başlar. Buhar fazına geçen moleküller başlangıçta düşük hızla daha sonra artan bir hızla yoğuşarak tekrar sıvı Şekil 2.4: Sıvı ve buhar fazları arasında fiziksel dengenin kuruluşu faza döner. Bir süre sonra buharlaşma hızı ile yoğuşma hızı eşit hâle gelir. Sıvı ile buharı arasında bir denge kurulur (Şekil 2.4.b). Kurulan bu tür dengeye fiziksel denge denir. 94 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Açık bir ortamda (örneğin, herhangi bir odada) gerçekleşen tepkimelerde tepkimeye giren maddeler tepkime hızına bağlı olarak zaman içinde tükenir ve ürünler oluşur. Bu arada tepkimenin oluşuna kanıt sayılan olaylardan biri ya da birkaçı gözlenebilir. Örneğin, birer mol C2H4 (etilen) ve Br2 gazları açık bir kapta tepkimeye sokulursa birer mol C2H4 ve Br2 tükenerek bir mol C2H4Br2 (etilen bromür) oluşur. Bu arada Br2’un koyu kırmızı rengi tamamen kaybolur. Renk değişiminin bitişi, tepkimenin tamamlandığını gösterir. Bu tepkimeye ait mol sayısı - zaman grafiği Grafik 2.9 ’ daki gibidir. C2H4(g) Br2(g) → C2H4Br2(g) + Renksiz Koyu kırmızı Renksiz Örnek aldığımız tepkime, kapalı bir kapta (örneğin, bir litrelik kapta) gerçekleştirilirse C2H4 ve Br2 ’un büyük bir kısmı tükenerek C2H4Br2 e dönüşür. Bu arada Br2 un koyu kırmızı rengi de büyük ölçüde açılır. Ancak yine de tepkime kabında açık kırmızı rengin izlenmesi, Br2 ’un bir kısmının tepkimeye girmediğini gösterir. Tepkime ortamında koşullar değiştirilmezse kapta artan Br2 ’dan kaynaklanan açık kırmızı renk de değişmez. Bu durumda gözlenebilir düzeyde tepkimenin bittiği anlaşılır. Kapta tepkimeye girmeyen C2H4 ve Br2 ile oluşan C2H4Br2 vardır ve bunların derişimleri sabittir (Grafik 2.10). Derişimlerin sabit olması, tepkimeye giren maddelerin ürünlere dönüşüm hızı ile ürünlerin giren maddelere 1 Derişim (mol /L) Mol sayısı (mol ) dönüşüm hızının eşit olmasını gerektirir ki bu duruma kimyasal denge hâli denir. C2H4Br2(g) Kimyasal denge [C2H4Br2](g) [C2H4](g) + [Br2](g) C2H4(g) + Br2(g) Zaman (s) 0 Tepkime hızı Grafik 2.9: Açık bir kapta C2H4 ve Br2 arasında gerçekleşen tepkimede, giren-ürün mol sayısının zamana göre değişimi t Zaman (s) Grafik 2.10: Kapalı bir kapta C2H4 ve Br2 arasında gerçekleşen tepkimede, giren-ürün derişimlerinin zamana göre değişimi C2H4 ve Br2 arasındaki tepkimede, denge hâlinin tepkime hızızaman grafiği Grafik 2.11 ’ deki gibidir: C2H4(g) + Br2(g) Kimyasal denge Grafik 2.10 ’da t zamanı; tepkimede gözlenebilir değişimlerin bittiği, ileri yöndeki tepkime hızının geri yöndeki tepkime hızına eşit olduğu, derişimlerin sabit hâle geldiği ve kim- C2H4Br2(g) t yasal dengenin kurulduğu andır. Zaman (s) Grafik 2.11:Kapalı bir kapta C2H4 ve Br2 arasında gerçekleşen tepkimede, tepkime hızızaman grafiği Şimdi de NO2 ve N2O4 gazları karışımını içeren kapalı bir sistemde kimyasal denge hâlini inceleyelim: Kapalı bir sistemde yer alan bu gazlardan N2O4 gazı renksiz, NO2 gazının rengi koyu kahverengidir. Oda sıcaklığı- nın üzerinde kapalı sistemde renksiz N2O4 molekülleri kendi aralarında çarpışır. Çarpışan N2O4 molekülleri kısmen ayrışarak NO2 moleküllerini oluşturur. Bu arada kapalı sistemde renk, tepkime hızına bağlı olarak giderek koyu kahverengiye dönüşür. N2 O 4( g) Renksiz 2NO2( g) Koyu kahverengi Kapalı bir sistemde oda sıcaklığının üzerinde N2O4 moleküllerinden NO2 ’in oluşması yönünde gerçekleşen tepkimenin hızı oldukça büyüktür. Çünkü başlangıçta kapalı sistemde N2O4 derişiminin 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 95 büyük olması bu moleküllerin kendi aralarındaki çarpışma olasılığını artırır. Kapalı sistemde NO2 molekülleri bulunmadığından NO2 ’ten N2O4 oluşma tepkimesinin hızı sıfırdır. Ancak zaman içinde kapalı sistemde NO2 derişimi giderek artar, kapalı sistemde renk koyu kahverengiye dönüşür. NO2 derişiminin artması bu taneciklerin kendi aralarındaki çarpışmaların sayısını, dolayısıyla NO2 ’ten N2O4 oluşması yönündeki tepkimenin hızını da artırır. Kapalı sistemde renk açılmaya başlar. Bir süre sonra da N2O4 ’ten NO2 oluşması yönündeki tepkimenin hızı ile NO2 ’ten N2O4 oluşması yönündeki tepkimenin hızı eşitlenir; dinamik denge kurulur. Sistem dengeye ulaştıktan sonra herhangi bir renk değişimi gözlenmez (Resim 2.8). Dengedeki gaz karışımının rengi, karışımı oluşturan gazların mol sayıları, diğer bir ifade ile kısmi basınçları ile doğru orantılı olarak değişir. a b c Resim 2.8: a. N2O4 gazı renksizdir. b. NO2 gazının rengi koyu kahverengidir. c. Sistemde renk değişimi durduğunda gaz karışımının rengi açık kahverengidir. Gaz karışımının renginin açık kahverengiye dönmesi dengenin kurulduğunu gösterir. Yukarıdaki öğrendiklerimizden kimyasal denge hâli için aşağıdaki sonuçları çıkarabiliriz. ® Kapalı bir sistemde kurulan, ® Sıcaklık, basınç vb. koşullar değişmediği sürece tepkimeye girenlerin ve ürünlerin derişimlerinin değişmediği, ® İleri yöndeki tepkime hızının, geri yöndeki tepkime hızına eşit olduğu, ® Tepkimede en az enerjili olma eğilimi ile en fazla düzensiz olma eğiliminin uzlaştığı, ® Gözlenebilir değişimlerin bittiği fakat gözlenemeyen değişimlerin devam ettiği, ® Tepkimenin mekanizmasına bağlı olmayan dinamik bir olaydır. Kimyasal denge homojen ve heterojen denge olmak üzere ikiye ayrılır: Homojen Denge Tepkimeye giren maddelerin ve ürünlerin aynı fazda bulunduğu kimyasal tepkimelerde kurulan dengeye homojen denge denir. Örneğin; CO(g) + 1/2O2(g) CO2(g) tepkimesinde tepkimeye giren maddeler ve ürün aynı fazdadır. Kurulan denge homojendir. Homojen dengelere, gaz hâlindeki iyot ile hidrojen karışımının yüksek sıcaklıklarda etkileşerek hidrojen iyodürü oluşturması; I2(g) + H2(g) 2HI(g) ve çözelti ortamında gerçekleşen; – 2+ Fe3+ (suda) + SCN(suda) FeSCN (suda) tepkimeleri örnek olarak verilebilir. 96 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Heterojen Denge Tepkimeye giren maddeler ve ürünlerin farklı fazlarda bulunduğu kimyasal tepkimelerde kurulan dengeye heterojen denge denir. Örneğin; FeO(k) + CO(g) Fe(k) + CO2(g) tepkimesinin oluştuğu kapalı sistemde hem katı hem de gaz maddeler beraberce bulunmaktadır. Bu yüzden kurulan denge heterojendir. Saf CaCO3 kapalı bir kaba konup (Şekil 2.5.a) yüksek sıcaklığa kadar ısıtılırsa CaCO3 ’ın bir kısmı ayrışır, CaO ve CO2 gazı oluşur (Şekil 2.5.b). CaCO3(k) CaO(k) + CO2(g) 25 ˚C 900 ˚C 900 ˚C 900 ˚C CaCO3 CaO CaCO3 a CaCO3 b CaO CaO CaCO3 c ç Şekil 2.5:Kapalı bir kapta CaCO3’ın CO2 ve CaO’e ayrışması tepkimesinde heterojen denge ve dengenin bozuluşu Kapta ayrışmadan kalan CaCO3 ile oluşan katı CaO ve CO2 gazı arasında bir denge kurulur (Şekil 2.5.c). Kapta katı ve gaz maddeler beraberce bulunur. Bu yüzden kurulan denge heterojendir. Eğer tepkime kabının kapağı açılırsa sistemden CO2 gazı hızla uzaklaşır. Denge hâli ortadan kalkar (Şekil 2.5.ç). Bu nedenle dengenin söz konusu olabilmesi için tepkimenin kapalı bir kapta gerçekleşmesi bir ön koşuldur. 2. Denge Bağıntısı ve Denge Sabiti Sabit sıcaklıkta ve kapalı kapta gerçekleşen, aA(g) + bB(g) cC(g) + dD(g) genel tepkimede, denge anında ileri yöndeki tepkime hızı r1, geri yöndeki tepkime hızı r2 ile simgelenirse ileri yöndeki tepkimenin hız denklemi; r1 = k1 [A]a [B]b geri yöndeki tepkimenin hız denklemi; r2 = k2 [C]c [D]d olur. Denge kurulduğunda ileri yöndeki tepkime hızı geri yöndeki tepkime hızına eşittir. r1 = r2 Bu eşitlik aşağıdaki gibi de yazılabilir: k1 [A]a [B]b = k2 [C]c [D]d Hız sabitleri birbirine oranlanırsa eşitlik; k1 [C ]c [D ]d = k 2 [ A ]a [B ]b şekline dönüşür. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 97 k1 ve k2 sırasıyla ileri ve geri yöndeki tepkimelerin hız sabitleridir ve koşullar değişmediği sürece k1 /k2 oranı da sabittir. Bu sabit değer, tepkimenin denge sabitidir ve “Kc” ile gösterilir. Sabit sıcaklıkta denge hâlindeki bir sistemde, tepkime denklemindeki kat sayılar, üs alınmak koşuluyla ürünlerin molar derişimlerinin çarpımının, tepkimeye giren maddelerin molar derişimlerinin çarpımına oranı sabittir. Bu sabit değere denge sabiti denir. Denge sabitiyle dengedeki maddelerin derişimleri arasındaki bağıntıya ise denge bağıntısı adı verilir. k1 = Kc k2 K denge = K c = [C ]c [D ]d [ A ]a [B ]b Gaz fazında gerçekleşen bir tepkimeden yararlanarak çıkardığımız denge bağıntısı oldukça geneldir. Eğer tepkimeye giren maddeler ya da tepkimede oluşan ürünler saf sıvı ya da saf katı hâldeyse bu maddeler denge bağıntılarında ifade edilmez. Çünkü saf sıvı ve katı maddelerin mol sayılarıyla doğru orantılı olarak hacimleri de değişeceğinden molar derişimleri değişmez. Saf katı maddelerin derişimlerinin değişmezliğini NaHCO3 örneği üzerinde inceleyelim. Bu amaçla aynı sıcaklıkta önce 1 mol, sonra 2 mol NaHCO3 alalım. 1 mol NaHCO3 ’tın hacmi 38,9 cm3 ise 1 mol NaHCO3 ile aynı sıcaklığa sahip 2 mol NaHCO3’tın hacmi 77,8 cm3 olacaktır. Dolayısıyla molar derişimleri Şekil 2.6’ daki gibi bulunacaktır. 1 mol NaHCO3’ın hacmi 38,9 cm3 tür. [M] = 2 mol NaHCO3’ın hacmi 77,8 cm3 tür. 1 = 25, 7 mol / L ’dir. 0, 0389 [M] = 2 = 25, 7 mol / L ’dir. 0, 0778 Şekil 2.6: Katı NaHCO3’ın derişimi sabittir. Saf sıvı maddelerin derişimlerinin değişmezliğini de H2O örneği üzerinde inceleyelim. Bu amaçla 1 ve 2 mol su alalım. 1 mol suyun hacmi 18 cm3, 2 mol suyun hacmi ise 36 cm3 tür. Dolayısıyla suyun mol sayısı ya da hacmi ne olursa olsun molar derişimi daima 55,6 mol/L MH 2O 1 = –––––––– ≈ 55,6 M ’ dir. 18 · 10–3 H2 ve S’ten, değişik sıcaklıklarda H2S oluşmasına ait tepkimeler ve bu tepkimelere ait denge bağıntıları aşağıda verilmiştir. Bu bağıntılarda saf sıvı ve katı maddelerin yer almadığına dikkat ediniz. Çünkü denge ifadelerinde saf katı ve sıvı maddelerin derişimi 1’ den farklı fakat sabittir ve sabit olan bu değerler, denge sabitine katılmıştır. 200 ˚ C ’ ta H2( g ) + S( g ) H2S( g ) Kc = [H2S ] [H2 ] [S ] 100 ˚ C ’ ta H2( g ) + S( s ) H2S( g ) Kc = [H2S ] [H2 ] (Heterojen denge) −100 ˚ C ’ ta H2( g ) + S(k ) H2S( s ) Kc = 1 [H2 ] (Heterojen denge) (Homojen denge) ☞ÖRNEK : 7 N2(g) + 3H2(g) 2NH3(g) tepkimesinin denge bağıntısını yazınız. ✍ÇÖZÜM Tepkimenin denge bağıntısı, [NH3 ]2 Kc = şeklindedir. [N2 ] [H2 ]3 98 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 8 2NH3(g) N2(g) + 3H2(g) tepkimesinin denge bağıntısını yazınız. ✍ÇÖZÜM [N2 ] [H2 ] 3 şeklindedir. [NH3 ] 2 Örnek 7’ de H2 ve N2 gazlarından NH3 , örnek 8’ de ise NH3 gazından N2 ve H2 gazlarının elde ediliş tepkimelerinin denge bağıntılarını buldunuz. Bu tepkimelerin birbirinin tersi olduğu, geri yöndeki tepkimenin denge bağıntısının ileri yöndeki tepkimenin denge bağıntısının tersi olduğu dikkatinizden kaçmamıştır. Bu durumu “İleri yöndeki bir tepkimenin geri yöndeki tepkimesine ait denge bağıntısı, ileri yöndeki tepkimenin denge bağıntısının tersine eşittir.” şeklinde genelleyebiliriz. Kc = ☞ÖRNEK : 9 CO2(g) + NH3(suda) + NaCl(suda) + H2O(s) NH4Cl(suda) + NaHCO3(k) tepkimesinin denge bağıntısını yazınız. ✍ÇÖZÜM Saf sıvı ve katılar denge bağıntısında gösterilmez. Tepkimenin denge bağıntısı, Kc = [NH4 Cl] şeklindedir. [CO2 ] [NH3 ] [NaCl] ☞ÖRNEK : 10 2SO2(g) + O2(g) 2SO3(g) tepkimesi belirli bir sıcaklıkta dengeye ulaştığında 1 L’ lik kapta 0,4 mol SO2, 0,2 mol O2 ve 1,2 mol SO3 gazlarının olduğu belirleniyor. Tepkimenin denge sabitinin (Kc) değeri kaçtır? ✍ÇÖZÜM Tepkimenin denge bağıntısı, Kc = [SO3 ]2 şeklindedir. [SO2 ]2 [O2 ] Kc = (1,2 mol/ L)2 (0,4 mol/ L)2 · (0,2 mol/ L) K c = 45 ’tir. ☞ÖRNEK : 11 Belirli sıcaklıkta 1 L’lik kapta SO3 gazından SO2 ve O2 gazlarının oluşmasına ait tepkimenin mol sayısı-zaman grafiği yanda verilmiştir. Tepkimenin denge sabitinin (Kc) değeri kaçtır? ✍ÇÖZÜM Mol sayısı (mol) Tepkime kabı 1 L’lik olduğundan dengedeki mol sayıları aynı zamanda bu maddelerin derişimleridir. 4 Kimyasal denge 3,6 SO2 1,8 O2 Tepkimenin denklemi şöyledir: SO3 0,8 2SO3(g) 2SO2(g) + O2(g) Denge bağıntısı K c = [SO2 ]2 [O2 ] 2 [SO3 ] şeklindedir. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 0 t Zaman (s) 99 Grafikte denge anında (t) tepkimeye giren maddelerin ve ürünlerin mol sayıları, tepkime kabının hacmi 1 L olduğundan giren maddelerin ve ürünlerin derişimlerine eşittir. Kc = (3,6 mol/ L)2 · (1,8 mol/ L) K c = 36,45 mol/ L’dir. (0,8 mol/ L)2 Örnek 10 ve Örnek 11’de tepkimelerin denge sabitlerinin birimlerinin her bir tepkime için farklı olduğu dikkatinizden kaçmamıştır. Örnek tepkimelerde olduğu gibi tepkimelerin denge sabitlerinin birimi, tepkimenin denge bağıntısında yer alan girenler ile ürünlerin denkleştirilmiş tepkime denklemindeki mol katsayılarına bağlı olarak değişir. Bu nedenle tepkimelerin denge sabitleri birimleriyle değil sayısal değerleriyle ifade edilir. ☞ÖRNEK : 12 4Ag(k) + 2H2S(g) + O2(g) 2Ag2S(k) + 2H2O(g) Belirli sıcaklıkta 1 L’ lik kapta gerçekleşen yukarıdaki tepkimede, heterojen denge karışımında 0,6 mol Ag; 0,4 mol H2S; 0,2 mol O2; 0,8 mol Ag2S ve 0,8 mol H2O olduğu belirleniyor. Tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? ✍ÇÖZÜM Tepkimenin denge bağıntısı K c = [H2O]2 [H2S ]2 [O2 ] şeklindedir. Tepkime kabı 1 L’ lik olduğundan maddelerin mol sayısı aynı zamanda derişimlerine eşittir. Kc = (0, 8)2 (0, 4 )2 · (0, 2) K c = 20 ’dir. ☞ÖRNEK : 13 2NO(g) + 2H2(g) N2(g) + 2H2O(g) Belirli bir sıcaklıkta 2 L’lik tepkime kabına 2 mol NO, 3,2 mol H2 gazı konularak başlatılan yukarıdaki tepkime dengeye ulaştığında kapta 0,8 mol N2 olduğu belirleniyor. Buna göre bu sıcaklıkta tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? ✍ÇÖZÜM Denge anında tepkime kabında 0,8 mol N2’un olduğu belirleniyorsa tepkime denklemine göre N2’un 2 katı kadar (0,8 · 2 = 1,6 mol) H2O olmalıdır. Ayrıca denkleme göre 0,8 mol N2 gazının oluşması için NO ve H2 gazı miktarının N2’un iki katı kadar (1,6 mol) azalması gerekir. 2NO(g) + 2H2O(g) Başlangıç : 2 mol 3,2 mol 0 0 Azalma : –1,6 mol –1,6 mol –– –– Artma : –– –– +0,8 mol +1,6 mol Denge : 2–1,6 = 0,4 mol 3,2–1,6 = 1,6 mol 0,8 mol 1,6 mol Denge derişimi : 0, 4 = 0, 2 M 2 [N ] [H2O]2 Kc = 2 [NO]2 [H2 ]2 100 2H2(g) N2(g) + 1, 6 = 0, 8 M 2 Kc = (0,4) · (0,8)2 (0,2)2 · (0,8)2 0, 8 = 0, 4 M 2 1, 6 = 0, 8 M 2 K c = 10 ’dur. ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 14 CO2(g) + SO2(g) CO(g) + SO3(g) tepkimesinin belirli bir sıcaklıkta denge sabitinin sayısal değeri Kc = 8’dir. 1 L’ lik kaptaki denge karışımında 1,6 mol CO, 1,6 mol SO3 ve 0,4 mol CO2 gazı bulunduğuna göre SO2 gazı kaç mol’ dür? ✍ÇÖZÜM Kc = [CO] [SO3 ] [CO2 ] [SO2 ] 8= (1,6) · (1,6) (0,4) · (SO2 ) [SO2 ] = 0,8 mol / L’dir. Tepkime kabının hacmi 1 L olduğundan SO2’in derişimi aynı zamanda mol sayısına eşittir. 10. sınıf kimya derslerinde gazların kısmî basınçlarının mol sayıları ile doğru orantılı olarak değiştiğini öğrenmiştiniz. O hâlde Kapalı bir sistemde gaz fazında gerçekleşen tepkimelerde kimyasal dengeyi molar derişimler yerine kısmi basınçlar türünden de ifade edebiliriz. Örneğin; aA ( g ) + bB ( g ) cC( g ) + dD( g ) genel tepkimesi için denge hâlinde belirli hacimde; nA mol A, nB mol B, nC mol C ve nD mol D’nin bulunduğunu düşünebiliriz. Bu gazların kısmi basınçları PA, PB, PC ve PD olsun. İdeal Gaz Yasası’ na göre bu gazların kısmi basınçları için A gazını örnek alarak aşağıdaki eşitlikleri yazabiliriz: nA RT V Bu bağıntılara göre A’nın molar derişimi nA / V’dir. A’nın molar derişimini daha önce [A] ile gösterdik. Bu nedenle; PA V = nART PA = PA = [ A ] RT ya da [ A ] = PA yazılabilir. RT Bu bağıntılar aynı şekilde diğer gazlar için de yazılabilir. Sabit sıcaklıkta RT ifadesi sabit ve gazların kısmi basınçları, molar derişimleri ile doğru orantılı olduğuna göre gaz fazında gerçekleşen tepkimeler için denge bağıntısını kısmi basınçlar türünden yazabiliriz. Yukarıda örnek aldığımız genel tepkime için kısmi basınçlar türünden denge bağıntısını KP = (PC )c (PD )d (PA )a (PB )b şeklinde yazabiliriz. Bağıntıda “KP” kısmi basınçlar cinsinden denge sabitini ifade eder. Yukarıda örnek aldığımız gaz fazında gerçekleşen aA ( g ) + bB ( g ) cC( g ) + dD( g ) genel tepkimesinin molar derişimler türünden denge bağıntısında tepkimeye giren maddelerin ve ürünlerin molar derişimleri yerine kısmi basınçlarını yazarsak; Kc = (PC / RT )c (PD / RT )d (PA / RT )a (PB / RT )b c (PC ) (PD )d (1 / RT )c + d K c= (PA )a (PB )b (1 / RT )a + b 1 Kc = Kp RT ( c + d) − ( a + b ) eşitliği bulunur. Ürünlerin mol sayıları toplamı ile giren maddelerin mol sayıları toplamının farkını (∆n); ∆n= nürün – ngiren ya da ∆n = (c + d) – (a + b) şeklinde gösterirsek Kc ile Kp arasındaki bağıntı aşağıdaki gibi olur: 1 Kc = Kp RT n 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 101 Bu bağıntıdan da Kp çekilirse Kp = Kc (RT)∆n eşitliği bulunur. Şimdi bu bağıntılarda yer alan ∆n’nin nasıl hesaplanacağını NH3 tepkimeleri üzerinde gösterelim. 2NH3( g ) N2( g ) + 3H2( g ) ↓ ↓ ↓ 2 mol 1 mol 3 mol 4 mol Tepkimede ürünler ile tepkimeye giren maddelerin mol sayıları arasındaki fark 2 mol’dür. Yani ∆n = 4 – 2 = 2’dir. Buna göre bağıntıda ∆n yerine 2 yazılmalıdır. 1 Kc = Kp RT 2 ya da K p = K c (RT )2 Bu tepkime ile aynı sıcaklıkta gerçekleşen geri yöndeki (ters) tepkime içinde tepkimeye giren maddelerin mol sayıları toplamı ile ürün mol sayısı arasındaki farkı bulalım. ∆n = 2 – 4 = –2’dir. Bu sonuca göre ürün ile tepkimeye giren maddelerin mol sayıları arasındaki fark –2’ dir. Buna göre bağıntıda ∆n yerine –2 yazılmalıdır. N2( g ) + 3H2( g ) 2NH3( g ) ↓ ↓ ↓ mol mol 1mol 2 3 4 mol 1 Kc = Kp RT −2 ya da K p = K c (RT )− 2 Gaz hâlinde tepkimeye giren maddelerin ve ürünlerin mol sayıları eşitse bir gazın kısmi basıncı mol sayısıyla doğru orantılı olduğundan tepkimenin derişimler türünden denge sabitinin sayısal değeri, kısmi basınçlar türünden denge sabitinin sayısal değerine eşittir. Başka bir deyişle Kc = Kp ’dir. ☞ÖRNEK : 15 N2( g ) + 3H2( g ) 2NH3( g ) tepkimesinin 400 K’ de kısmi basınçlar türünden denge sabitinin (Kp) değeri 55 atm–2 dir. Aynı sıcaklıkta tepkimenin molar derişimler türünden denge sabitinin (Kc) sayısal değeri kaçtır? (R = 0,082 atm L/mol K) ✍ÇÖZÜM T = 400 K R = 0,082 atm L/mol K Kp = 55 atm–2 ∆n = 2 – 4 = –2 Kc = ? 1 Kc = Kp RT n 1 K c = 55 0, 082 · 400 0, 082 · 400 )2 K c = 55 · (0 102 −2 K c = 5, 9 · 104 tür. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. Kimyasal Dengeye Etki Eden Etmenler Kapalı bir kapta gerçekleşen bir tepkimede kimyasal dengeyi, ileri yöndeki tepkime hızının geri yöndeki tepkime hızına eşit olduğu, gözlenebilir değişimlerin bittiği fakat gözlenemeyen değişimlerin devam ettiği dinamik bir olay olarak öğrendiniz. Ancak kimyasal dengenin nelerden etkilenebileceğinden söz etmedik. Şimdi bir etkinlik yaparak kimyasal dengeyi etkileyen etmenleri belirlemeye çalışalım. 5. ETKİNLİK: DENGEYİ KİM BOZDU? Neler Gerekli? ❏ Etiket ❏ Dereceli silindir (50 mL) ❏ Deney tüpü (5 adet) ❏ KSCN kristalleri ❏ 0,2 M Fe(NO3)3 çözeltisi ❏ Damlalık ❏ Baget ❏Na2HPO4 kristalleri ❏ Tüplük Güvenliğiniz için ❏ 0,002 M KSCN çözeltisi ❏ Saf su ❏ 0,1 M KNO3 çözeltisi ❏ Beherglas (250 mL, 2 adet) Nasıl Yapacaksınız? 3 Beherglaslardan birine 25 mL KNO3 çözeltisi koyup karşılaştırma amacıyla saklayınız. 3 Diğer beherglasa 50 mL KSCN çözeltisi ve 50 mL saf su koyunuz. Üzerine 10-15 damla Fe(NO3)3 çözeltisi ekleyiniz. 3 Renk değişimini izleyiniz ve oluşan rengi karşılaştırma amacıyla sakladığınız KNO3 çözeltisinin rengiyle karşılaştırınız. 3 Şimdi de beherglastaki karışımı aşağıdaki resimdeki gibi etiketleyip numara verdiğiniz dört deney tüpüne eşit olarak paylaştırınız. Bunlardan birincisini karşılaştırma amacıyla saklayınız. Sonra sırasıyla şu işlemleri yapınız ve renk değişimlerini dikkatle gözleyiniz: 3 İkinci deney tüpüne birkaç tane KSCN kristali atıp cam çubuk ile karıştırınız. 3 Üçüncü deney tüpüne birkaç damla Fe(NO3)3 çözeltisi damlatınız. 3 Dördüncü deney tüpüne birkaç tane Na2HPO4 kristali atıp cam çubukla karıştırınız. 3 Deney tüplerinde oluşan renk değişimlerini birinci deney tüpündeki çözeltinin rengi ile karşılaştırınız. Etkinlik Sonu Soruları 1. Beherglastaki KSCN çözeltisi üzerine Fe(NO3)3 çözeltisi damlattığınızda görülen renk değişiminin oluşma nedenini nasıl açıklayabilirsiniz? 2. İkinci deney tüpüne KSCN kristalleri eklendiğinde gerçekleşen renk değişikliğinin nedenini nasıl açıklarsınız? 3. Üçüncü deney tüpüne Fe(NO3)3 çözeltisi eklendiğinde gerçekleşen renk değişikliğinin nedenini ve dengeye Fe3+ iyonlarının etkisini nasıl açıklarsınız? 4. Dördüncü deney tüpüne Na2HPO4 kristali eklenmesiyle gerçekleşen renk değişimini nasıl açıklarsınız? 5. Deney tüplerine KSCN kristali, Fe(NO3)3 çözeltisi ve Na2HPO4 kristali eklenmesiyle oluşan renk değişiklikleri, bu maddelerin eklenmesiyle kimyasal dengenin etkilendiğini düşündürür mü? 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 103 Dengedeki (kimyasal ya da fiziksel dengedeki) bir sisteme yapılan bir etki karşısında sistemin nasıl davranacağının temel ilkesi 19. yüzyıl Fransız kimyacılarından Henri Le Chatelier (Henri Lö Şatölye) tarafından 1888’de açıklanmıştır. Bu ilke şöyledir: Dengedeki bir sisteme dışarıdan bir etki yapılırsa sistem bu etkiyi azaltacak yönde tepki gösterir ve dengenin yeniden kurulmasını sağlar. Yaptığınız etkinlikte deney tüplerine KSCN kristalleri, Fe(NO3)3 çözeltisi ya da Na2HPO4 kristalleri eklediğinizde tüplerde renk değişimi izlemiş olmalısınız. Bir tepkime denge hâlindeyken tepkime kabına tepkimeye girenlerden ya da ürünlerden biri ilave edilir ya da bunlardan biri tepkime kabından uzaklaştırılırsa denge derişimleri değişir. Derişim değişikliği dengede oluşan derişimler oranın artık Kc’ye eşit olmadığı ve sistemde dengenin bozulduğu anlamına gelir. Bu yüzden sistem, tepkimeye giren maddelerin ve ürünlerin derişimleri oranını yeniden Kc’ye eşit olacak şekilde değiştirerek tekrar dengeye ulaşılmasını sağlar. Sonuçta derişim değişikliği denge sabitinin sayısal değerini değiştirmez. Denge, tepkimenin ileri ya da geri yönde kaymasıyla sağlanır. Le Chatelier İlkesi de böyle bir durumda dengenin hangi yönde değişeceğini tahmin etmemize yardımcı olur. 3+ 2+ − Yaptığınız etkinlikte Fe( suda ) + SCN( suda ) FeSCN( suda ) dengesi söz konusudur. İkinci deney tüpüne KSCN kristallerini attığınızda rengin koyulaştığını izlemiş olmalısınız. Çünkü KSCN kristalleri atarak denge durumuna göre sistemde daha fazla SCN– iyonları oluşturmuş, böylece sisteme bir dış etki uygulamış olursunuz. Sistem bu etkiyi en aza indirmek için SCN– iyonlarını harcamalı yani Fe3+ iyonları ile birleşmesini sağlayarak FeSCN2+ iyonları oluşturmalıdır. Dolayısıyla denge, ürünler lehine bozularak yeniden kurulmalıdır. Üçüncü deney tüpüne Fe(NO3)3 çözeltisi eklediğinizde de yine rengin koyulaştığını gözlemlemişsinizdir. Bunun nedeni sisteme Fe3+ iyonları ekleyerek bir dış etki yapmış olmanızdır. Bu kez sistem Fe3+ iyonlarının etkisini azaltmak için bu iyonların SCN– iyonları ile birleşmesini sağlayarak FeSCN2+ iyonları oluşturmalıdır. Yani denge yine ürünler lehine bozularak yeniden kurulmalıdır. Son olarak dördüncü deney tüpüne Na2HPO4 kristtalleri attığınızda rengin açıldığına tanık olmuşsunuzdur. Deney tüpüne eklediğiniz Na2HPO4 kristali çözeltide Na+ ve HPO42– iyonlarına ayrılır. Na+ iyonlarının dengeye bir etkisi olmadığından denge durumunda sisteme HPO42– iyonu eklemiş olursunuz. Bu durumda sistem bu iyonun etkisini azaltmalı yani bu iyonların Fe3+ iyonları ile birleşmesini sağlayarak Fe2(HPO4)3 oluşturmalıdır. Dolayısıyla denge, girenler lehine bozulmalı ve ortamda FeSCN2+ iyonları azalacağından renk de açılmalıdır. Kimyasal dengeye derişimin etkisini son olarak – 2– Cu(H2O)2+ CuCl 4(suda) + 4H2O(s) 4(suda) + 4Cl(suda) tepkimesinde inceleyelim. Tepkimeye ait denge karışımı Resim 2.9.a’da verilmiştir. Karışım mavi renkli Cu(H2O)42+ ve sarı renkli CuCl42– çözeltilerinden oluşur. Karışımın rengi açık mavidir. Denge karışımına derişik HCl çözeltisi eklenirse denge, ürünler lehine bozulur. Tepkimede oluşan CuCl42– iyonundan dolayı karışım a b c açık yeşil renk alır (Resim 2.9.b). Bir süre sonra tepkimede yeniden denge kurulur. Eğer denge karışımına H2O eklenirse bu kez denge, girenler lehine bozulur. Tepkimede oluşan Cu(H2O)42+ iyonundan dolayı karışım koyu yeşil renkli hâle gelir (Resim 2.9.c). 104 Resim 2.9: a. Cu(H2O)42+ ve 4Cl– tepkimesinde kimyasal denge hâli b. Dengenin ürünler lehine bozulmuş hâli c. Dengenin girenler lehine bozulmuş hâli ORTAÖĞRETİM KİMYA 11 DERS KİTABI Derişim değişiminin denge durumuna etkisini örnek tepkimeler yardımıyla genelleştirelim: N2O4(g) 2NO2(g) Giren Ürün ®Sisteme dışarıdan giren (N2O4) eklenirse denge, ürünler lehine bozulur. Bu durumda ileri yöndeki tepkime daha hızlıdır. Eklenen N2O4 ’in bir kısmı ayrışarak ürüne dönüşür. Denge tekrar kurulana kadar bu olay devam eder. ®Sisteme dışarıdan ürün (NO2) eklenirse denge, girenler lehine bozulur. Bu durumda geri yöndeki tepkime daha hızlı gerçekleşir. Eklenen NO2 ’in bir kısmı azalarak girene (N2O4) dönüşür. Denge tekrar kurulana kadar bu olay devam eder. ®Sistemden N2O4 çıkarılırsa (uzaklaştırılırsa) denge, girenler lehine bozularak tepkime geri yönde yürümeye başlar. Tıpkı ürün eklenmesinde olduğu gibi geri yöndeki tepkime daha hızlıdır. Denge tekrar kurulana kadar bu olay devam eder. ®Kimyasal bir tepkimede giren ya da ürün olarak yer almayan, girenler ve ürünlerle etkileşmeyen bir madde sisteme eklenirse sistemde denge bozulmaz. Örneğin, tepkime kabına azot gazı ya da herhangi bir asal gaz eklenirse denge bozulmaz. ®Kimyasal bir tepkimeye giren ya da ürün olarak oluşan ancak tepkimenin denge bağıntısında yer almayan maddelerin sisteme eklenmesi ya da sistemden uzaklaştırılması dengeyi etkilemez. Örneğin; tepkimesinde sisteme H2O(s) ve NaHCO3(k) eklenmesi ya da sistemden uzaklaştırılması dengeyi etkilemez. Grafik 2.12’de; dengedeki N2(g)+3H2(g) 2NH3(g) tepkimesine H2 gazı eklenmesiyle oluşan değişmeler gösterilmiştir. İnceleyiniz ve bu değişimlerin nedenlerini Le Chate- Derişim (mol/L) CO2(g) + NH3(suda) + NaCl(suda) + H2O(s) NH4Cl(suda) + NaHCO3(k) Kimyasal Eklenen H 2 denge Yeniden kurulan kimyasal denge H 2 NH3 lier İlkesi’ne göre açıklamaya çalışınız. Şimdi de kapalı bir kaptaki H2O(k) + ısı H2O(s) değişimini inceleyelim. Sistemin sıcaklığı artırırıldığında Le N2 Chatelier İlkesine göre denge bir an H2O(s) oluşturacak yönde bozulacak ve bir süre sonra yeniden denge kurulacaktır. Sıcaklık azaltılması ise dengeyi girenler yönüne bozacaktır. Görüldüğü gibi Le Chatelier İlkesi fiziksel dengelere de uygulanabilmektedir. Kimyasal dengeye derişimin etkisini inceledik. Ancak kapalı bir sistemde, herhangi bir anda, tepkimeye giren t1 t2 Zaman (s) Grafik 2.12:NH3’ın oluşma tepkimesinde denge hâli ve denge karışımına H2 gazı eklenmesi sonrası derişimlerin zamana göre değişimi maddelerin ya da ürünlerin derişimlerine bakarak tepkimenin hangi yönde devam ettiğini ya da dengede olup olmadığını nasıl anlarız? Bu sorunun yanıtını bir örnek problemle açıklayalım: ☞ÖRNEK : 16 2H2S(g) + 3O2(g) 2H2O(g) + 2SO2(g) tepkimesinin belirli sıcaklıktaki denge sabitinin sayısal değeri Kc = 2,5’tir. Bu sıcaklıkta 1 L’lik tepkime kabında 0,5 mol H2S, 0,75 mol O2, 0,75 mol H2O ve 0,75 mol SO2 gazlarının olduğu belirlendiğine göre tepkimenin dengede olup olmadığına ilişkin ne söylenebilir? 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 105 ✍ÇÖZÜM Kc = [H2O]2 [SO2 ]2 [H2S ]2 [O2 ]3 Yukarıdaki eşitlikte herhangi bir andaki derişimlerin oranına Kc yerine Q dersek; Q= ( 0, 75 )2 · (0, 75 )2 (0, 5 )2 · (0, 75 )3 Q = 3’ tür. Tepkimede verilen derişimlerle bulunan Q = 3 sayısal değeri, tepkimenin denge sabiti değerinden (Kc = 2,5) büyüktür. Yani ürün derişimi, denge hâlindeki ürün derişiminden büyüktür. Bu yüzden Kc = 2,5 sayısal değerine ulaşılması için ürün derişimi azalmalı, giren madde derişimi artmalıdır. Sonuç olarak tepkime dengede değildir ve giren maddeler lehine (geri yönde) devam etmektedir. Şimdi örnek problemden çıkan sonucu genelleştirelim : ®Kc = Q ise sistem dengededir. ®Kc < Q ise sistem dengede değildir. Tepkimede Kc = Q oluncaya kadar ürünlerin miktarı azalmalı, giren maddelerinki artmalıdır. Yani tepkime denge kuruluncaya kadar geri yönde ilerlemelidir. ®Kc > Q ise sistem dengede değildir. Tepkimede Kc = Q oluncaya kadar tepkimeye giren maddelerin miktarı azalmalı, ürünlerinki ise artmalıdır. Yani tepkime denge kuruluncaya kadar ileri yönde ilerlemelidir. ☞ÖRNEK : 17 * CH3—CH2—CH2—CH3(g) CH3—CH—CH3(g) Yukarıda denklemi verilen tepkimede belirli bir sıcaklıkta 1 L’lik kapalı kapta 0,5 mol bütan gazı ile 1,25 mol izobütan gazı dengededir. Tepkimenin denge sabitinin (Kc) sayısal değeri 2,5’tir. Denge hâlinde tepkime kabına 1,5 mol bütan gazı eklendiğinde denge bozuluyor ve bir süre sonra tekrar kuruluyor. Tepkime kabında denge tekrar kurulduğunda giren maddenin ve ürünün derişimleri kaç molar olur? ✍ÇÖZÜM Başlangıç : 0,5 mol Artma : +1,5 mol Azalma : –X mol Denge : 2,0 – X mol [İzobütan] CH3—CH—CH3(g) K c = [Bütan] (1, 25 + X ) 1,25 mol 2, 5 = (2, 0 − X ) — X = 1,07 M +X mol CH3—CH2—CH2—CH3(g) Denge derişimi : 1,25 + X mol Dengedeki derişimler : 2,0 – X M 1,25 + X M [Bütan] = 2,0 – 1,07 = 0,93 M [İzobütan]= 1,25 + 1,07 = 2,32 M ’dır. Denge sisteminde, maddelerin gaz hâlinde olması durumunda tepkime kabının hacmi ya da kaptaki basınç değiştirilerek sistemdeki tüm maddelerin derişimi değiştirilebilir. Örneğin; N2(g) + 3H2(g) 2NH3(g) tepkimesinin gerçekleşip dengenin kurulduğu bir sistemi göz önüne alalım (Şekil 2.7.a) ve sistemin hacmini yarıya indirelim (Şekil 2.7.b). Bu durumda sistemde basınç iki katına çıkar (P2 = 2P1). Le Chatelier İlkesi gereğince sistem, basınç etkisini azaltacak şekilde tepki gösterir. Tepkime, denge hâlinde bulunan maddelerin *Kaynakça: Kotz, C. J., Treichel, P., Chemistry Chemical Reactivity, sayfa 773,774 106 ORTAÖĞRETİM KİMYA 11 DERS KİTABI mol sayısının az olduğu yöne doğru (NH3 yönüne) hızlanır. Tepkime yeniden dengeye geldiğinde NH3’ ın mol sayısı artar, N2 ve H2’in mol sayıları ise azalır (Şekil 2.7.c). Toplam mol sayısındaki bu azalma P3 basıncın P2 basıncından daha düşük olmasına neden olur. Hacim küçültüldüğünde, diğer bir ifadeyle basınç artırıldığında dengenin ürünler lehine bozulduğu tepkimelerde ürün verimi artar. Dengenin girenler lehine bozulduğu tepkimelerde ise ürün verimi azalır. Basıncın, denge sabitinin sayısal değerine etkisi yoktur. a b P2 = 2P1 ve V2 = 1/2 V1 c P3 < P2 , P3 > P1 ve V3 = V2 V1 V2 V3 P1 P2 P3 N2 + 3H2 2NH3 Dengede N2 + 3H2 2NH3 Denge ürünler yönüne bozulur. N2 + 3H2 H2 N2 NH3 2NH3 Ürün verimi artar ve yeniden denge kurulur. Şekil 2.7: N2(g) + 3H2(g) 2NH3(g) tepkimesine hacim değişiminin etkisi Kimyasal dengeye basınç ya da hacmin etkisine diğer bir örnek olarak NO2’ten N2O4 oluşması tepkimesi verilebilir. Bir enjektör içinde gerçekleştirilen; 2NO2(g) N2O4(g) tepkimesinde denge hâli Resim 2.10.a’daki gibidir. Enjektör pistonu aşağıya doğru itilerek hacim küçültülürse diğer bir ifadeyle basınç artırılırsa denge bozulur ve sistemde renk açılır (Resim 2.10.b). Tepkime, Le Chatelier İlkesi’ne göre basınç etkisini azaltmak için ürünler yönünde hızlanır. Bir süre sonra dengeye ulaşır ve sistemde renk denge kurulmadan önceki renkten daha koyu hâle gelir (Resim 2.10.c). a b c Resim 2.10: a. 2NO2(g) N2O4(g) tepkimesinde denge hâli b. Hacim küçültülmesi sonucu dengenin bozulması c. Dengenin yeniden kurulmuş hâli Basınç ya da hacim değişiminin dengeye etkileri aşağıdaki gibi genelleştirilebilir: ®Gaz maddelerin yer aldığı bir denge sisteminin hacminin küçültülmesi ya da basıncın arttırılması dengenin, mol sayısı az olan gazların bulunduğu yönde bozulmasına neden olur. Hacmin artırılması ya da basıncın azaltılması dengenin mol sayısı daha çok olan gazların bulunduğu yönde bozulmasına neden olur. ®Tepkimede giren madde ve ürün mol sayılarının eşit olduğu hâllerde basınç ya da hacim değişiminin dengeye etkisi yoktur. ®Tepkime kabına bir asal gaz ya da tepkimeye giren maddelerle ve ürünlerle etkileşmeyen bir gaz eklenirse kapta toplam basınç artar. Ancak tepkimeye giren maddelerde ve ürünlerde bulunan gazların kısmi basınçları değişmeyeceğinden denge durumu bozulmaz. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 107 Bazı tepkimelerde kimyasal dengeye basınç ya da hacim değişiminin etkisi Tablo 2.3’te verilmiştir. İnceleyiniz. Tablo 2.3: Gaz fazındaki bazı tepkimelerde hacim ya da basınç değişiminin dengeye etkisi Hacim artışının (Basınç azalmasının) dengeye etkisi Sistem Hacim azalmasının (Basınç artışının) dengeye etkisi 1. N2O4(g) 2NO2(g) Denge ürünler lehine bozulur. Denge girenler lehine bozulur. 2. SO2(g) + 1/2O2(g) SO3(g) Denge girenler lehine bozulur. Denge ürünler lehine bozulur. 3. N2(g) + 3H2(g) 2NH3(g) Denge girenler lehine bozulur. Denge ürünler lehine bozulur. 4. C(k) + H2O(g) CO(g) + H2(g) Denge ürünler lehine bozulur. Denge girenler lehine bozulur. 5. N2(g) + O2(g) 2NO(g) Denge bozulmaz. Denge bozulmaz. Kimyasal tepkimelerde sıcaklık değişimi, tepkime hızı yanında hem dengeyi hem de denge sabitinin sayısal değerini değiştirir. Sıcaklık etkisiyle dengenin hangi yönde bozulacağı, tepkimenin endotermik ya da ekzotermik oluşuna bağlıdır. Endotermik tepkimelerde sıcaklık artışının dengeye etkisini aşağıdaki denge sisteminde görelim (Resim 2.11.a): N2O4(g) 2NO2(g) ∆H˚ = +55,3 kJ tepkimesinde ve diğer endotermik tepkimelerde tepkime kabının sıcaklığının yükselmesi, dengeyi ürünler lehine bozar. Çünkü Le Chatelier İlkesi’ne göre sistem, sıcaklık etkisini azaltacak şekilde davranır. Endotermik tepkimeler ısı alarak gerçekleştiğinden ele alınan tepkimenin ürünler yönündeki hızı geri yöndeki tepkime hızına göre daha fazla artar ve tepkime kabındaki gaz karışımının rengi koyulaşır (Resim 2.11.b). Tepkimenin denge sabitinin sayısal değeri artarak değişir. Isı alarak gerçekleşen tepkimelerde ortamın sıcaklığının azaldığı hatırlanırsa oluşan sıcaklık yükselmesi etkisiyle dengenin neden ürünler lehine bozulduğu anlaşılır. Eğer ele aldığımız endotermik tepkimede kabın sıcaklığı düşürülürse denge, tepkimeye giren maddeler lehine bozulur ve giren madde derişimi artar. Dolayısıyla denge kabında gaz karışımının koyu kahverengi olan rengi açılır (Resim 2.11.c). Tepkimenin denge sabitinin sayısal değeri küçülerek değişir. a b c Resim 2.11:a. Tepkimede denge hâli b. N2O4(g) 2NO2(g) sistemi ısıtılarak sıcaklık 25 ˚C’tan 50 ˚C’a yükseltilirse tepkimede denge, N2O4’in ayrışarak koyu kahverengi NO2 oluşması yönünde ürünler lehine bozulur. c. 25 ˚C’tan 0 ˚C’a kadar soğutulan sistemde denge, renksiz N2O4 oluşturacak şekilde tepkimeye giren maddeler lehine bozulur. Bu durum rengin açık kahverengiye dönüşmesiyle kendini belli eder. 108 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Sıcaklık artışının ekzotermik tepkimelerde dengeye etkisini aşağıdaki denge sisteminde görelim: 2NO2(g) N2O4(g) ∆H˚ = –55,3 kJ tepkimesinde ve diğer ekzotermik tepkimelerde sıcaklık yükselmesi dengeyi girenler lehine bozar. Çünkü ekzotermik tepkimeler dışarıya ısı vererek gerçekleşen tepkimelerdir. Tepkimenin dışarıya ısı vermesi ortamın sıcaklığının yükselmesine neden olur. Sisteme yapılan etki, sıcaklığın artırılması şeklinde olduğundan Le Chatelier İlkesi’ ne göre sistem, sıcaklığı azaltacak yönde tepki gösterir. Bir ekzotermik tepkimenin tersi endotermik olduğuna ve bu sırada sıcaklık düştüğüne göre ekzotermik tepkimeler için sıcaklık yükselmesi dengeyi girenler lehine bozar ve tepkime kabındaki gazların rengi açılır. Tepkimenin denge sabitinin sayısal değeri küçülerek değişir. Potansiyel enerji Potansiyel enerji Katalizörün aktivasyon enerjisini düşürdüğünü ve tepkime hızını artırdığını öğrenmiştiniz. Katalizörler tepkimenin Ea Ea hem ileri hem de geri yöndeki hızını aynı 2SO2(g)+O2(g) 2SO2(g)+O2(g) oranda artırdıklarından tepkimenin ileri ve geri yöndeki hız sabitlerinin oranı de2SO3(g) 2SO3(g) ğişmez. Dolayısıyla sıcaklık, sabit kaldığı Katalizörsüz Katalizörlü sürece denge ürünler ya da girenler lehine Zaman Zaman a b bozulmaz. Bu yönüyle katalizörler denge Grafik 2.13: Katalizörsüz ve katalizörlü SO3 oluşumu konumunu etkilemez ancak daha kısa sürede dengenin kurulmasını sağlar. Örneğin, kükürt dioksit (SO2) ile oksijenin (O2) kükürt trioksit (SO3) oluşturduğu tepkimede katalizör kullanılmazsa tepkime çok yavaş ilerler ve verimi de oldukça düşüktür. Yani ekonomik değildir (Grafik 2.13.a). Tepkimede V2O5 katalizör olarak kullanılırsa tepkime hızlanır, verim artar ve ekonomik hâle gelir (Grafik 2.13.b). Ancak katalizör kullanılsın ya da kullanılmasın denge sabitinin sayısal değeri değişmez. ☞ÖRNEK : 18 N2(g) + 3H2(g) 2NH3(g) ∆H˚ = –91,8 kJ tepkimesinde denge; sıcaklık, basınç, NH3 derişiminin artırılması ve katalizör eklenmesinden nasıl etkilenir? ✍ÇÖZÜM Sıcaklık arttırılması Tepkime ekzotermik olduğundan sıcaklık artışı dengeyi girenler lehine bozar. Basıncın arttırılması Basınç arttırıldığında Le Chatelier İlkesi’ne göre denge, mol sayısının azaldığı yönde (ürünler lehine) bozulur. NH3 derişiminin Ürünler derişiminin artırılması dengeyi girenler lehine arttırılması (geri yönde) bozar. Katalizör eklenmesi Katalizör eklenmesi dengeyi etkilemez. 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 109 Henry Le Chatelier İlkesi’nin kimyasal dengedeki uygulamalarını ayrıntılarıyla inceledik. Le Chatelier İlkesi kimyasal denge olayları gibi fiziksel denge olaylarına da uygulanabilir. Bu ilkenin fiziksel dengeye uygulanışını bir örnek üzerinde inceleyelim. Cam balon, içine bir miktar su doldurup ağzı sıkıca kapatıldıktan sonra kısık ateşte bir süre ısıtılırsa içindeki su kaynamaya başlar. Cam balon ateş üzerinden çekildikten kısa bir süre sonra içindeki suyun kaynaması durur. Cam balon üzerine Resim 2.12’deki gibi soğuk su dökülürse cam balon içindeki su tekrar kaynamaya başlar. Su dökmeye ara verildikten bir süre sonra kaynama durur. Ancak cam balon üzerine aralıklarla soğuk su döküldükçe içindeki su soğumakla beraber yine de kaynar. Resim 2.12: İçinde kaynama sıcaklığında su bulunan cam balona soğuk su döküldüğünde kaynama olayı başlar. Örnek aldığımız bu olayda fiziksel dengeyi ve bu dengeye Le Chatelier İlkesi’nin uygulanışını şöyle açıklayabiliriz: Kısık ateşte ısıtılan cam balon ateş üzerinden çekildikten sonra bir süre daha kaynamasını sürdürür. Ancak oluşan buhar nedeniyle cam balon içinde basınç artar. Basınç artışıyla suyun kaynama sıcaklığı yükselir. Suyun sıcaklığını yükseltecek ısı temin edilemediğinden kaynama durur. Su ile buhar arasında fiziksel denge kurulur. Cam balon üzerine soğuk su döküldüğünde ise cam balon içindeki buharın bir kısmı yoğuşur ve buhar basıncı düşer. Buhar basıncı düştükçe suyun kaynama sıcaklığı da düşer ve su soğumakla beraber buhar basıncı ile denge kuruluncaya kadar kaynamasını sürdürür. 4. Denge Sabitinin Sıcaklık ve Kat Sayılarla İlişkisi Kimyasal dengeye etki eden faktörleri incelerken sıcaklık değişiminin, dengeyi ve denge sabitinin sayısal değerini etkilediğini belirtmiştik. Sıcaklığın yükselmesi ekzotermik tepkimelerde tepkimeye giren maddelerin derişimlerinin artmasına, ürün derişimlerinin azalmasına neden olacağından, aynı zamanda denge sabitinin sayısal değerinin azalmasına da neden olur. Endotermik tepkimelerde ise ürün derişimini artırıp giren maddelerin derişimini azaltarak denge sabitinin sayısal değerinin artmasına neden olur. Bunu bir örnek üzerinde açıklayalım: N2(g) + 3H2(g) 2NH3(g) tepkimesinin farklı sıcaklıklardaki denge sabitlerinin sayısal değerleri şöyledir: Sıcaklık (K) –––––––––– 298 373 Kc –––––––– 6 · 105 4 · 102 Bu duruma göre sıcaklık yükseldikçe tepkimenin denge sabitinin sayısal değeri küçülmüş, yani tepkime girenler yönünde ilerlemiştir. O hâlde tepkime, ileri yönde ekzotermik bir tepkimedir. Son olarak tepkime denklemlerinin ve denklemlerdeki kat sayıların değişmesinin, denge sabitinin sayısal değerine etkisini örnekler üzerinde görelim: I. 2POCl3(g) + 4HCl(g) 2PCl5(g) + 2H2O(g) tepkimesinin denge bağıntısı; [PCl5]2 [H2O]2 Kc1 = –––––––––––––– şeklindedir. [POCl3]2 [HCl]4 II. 2PCl5(g) + 2H2O(g) 2POCl3(g) + 4HCl(g) tepkimesinin denge bağıntısı ise [POCl3]2 [HCl]4 Kc2 = –––––––––––––– şeklindedir. [PCl5]2 [H2O]2 110 ORTAÖĞRETİM KİMYA 11 DERS KİTABI II. tepkime I. tepkimenin tersi olup denge bağıntısı da I. tepkimenin denge bağıntısının tersidir. Dolayısıyla geri yöndeki tepkimenin denge sabiti, ileri yöndeki tepkimenin denge sabitinin çarpma işlemine göre tersine eşittir. K c2 = 1 K c2 III. POCl3(g) + 2HCl(g) PCl5(g) + H2O(g) tepkimesinin denge bağıntısı ; [PCl5] [H2O] Kc = ––––––––––––– şeklindedir. 3 [POCl3] [HCl]2 III. tepkime denklemindeki kat sayılar, I. tepkime denklemindeki kat sayıların 1/2’sine; denge sabiti ise I. tepkimenin denge sabitinin kareköküne eşittir. Dolayısıyla bir tepkimenin denge sabiti Kc1 ise sabit sıcaklıkta tepkimenin denklemindeki kat sayılar n gibi bir sayıya bölündüğünde, bu tepkimenin denge sabiti (Kc3), ilk tepkimenin denge sabitinin (Kc1) n. dereceden köküne eşit olur. K c 3 = n K c1 Benzer şekilde tepkime denkleminin kat sayıları n gibi bir sayı ile çarpılırsa bu tepkimenin denge sabiti (Kc3), ilk tepkimenin denge sabitinin (Kc1) n. kuvvetine eşit olur. Kc3 = (Kc1)n IV. PCl5(g) + H2O(g) POCl3(g) + 2HCl(g) tepkimesinin denge bağıntısı ; [POCl3] [HCl]2 Kc4 = ––––––––––––– şeklindedir. [PCl5] [H2O] IV. tepkime, I. tepkimenin ters yöndeki tepkimesidir. Ayrıca bu tepkime denklemindeki kat sayılar I. tepkime denklemindeki kat sayıların 1/2’sine eşittir. Denge sabiti ise I. tepkimenin denge sabitinin tersinin kareköküne eşittir. Bir tepkime denklemi ters çevrilerek denklemindeki kat sayılar n gibi bir sayıya bölünürse bu tepkimenin denge sabiti (Kc4), ilk tepkimenin denge sabitinin (Kc1) tersinin n. dereceden köküne eşit olur. K c4 = 1 nK c1 a.SO2(g) + 1/2O2(g) SO3(g) V. b. CO2(g) CO(g) + 1/2O2(g) –––––––––––––––––––––––––––––––––– Toplu tepkime denklemi: SO2(g) + CO2(g) SO3(g) + CO(g) a ve b tepkimelerinin denge bağıntıları şöyledir: K ca = [SO3 ] [SO2 ] [O2 ]1/ 2 K cb = [CO] [O2 ]1/ 2 [CO2 ] Kca , Kcb ile çarpılırsa K c · K cb = a [SO3 ] [SO2 ] [O2 ]1/ 2 Çarpım, toplam tepkimenin denge sabitine (Kct) eşit olur. K ct = · [CO] [O2 ]1/ 2 [CO2 ] [SO3 ] [CO] [SO2 ] [CO2 ] Bir tepkime denklemi iki ya da daha fazla tepkime denkleminin toplamı olarak yazılabiliyorsa toplam tepkimenin denge sabiti (Kct), toplamı veren tepkimelerin denge sabitlerinin (Kca , Kcb) çarpımına eşittir. Kct = Kca · Kcb 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 111 ☞ÖRNEK : 19 I. N2(g) + O2(g) 2NO(g)Kc1 = 4 II. NO2(g) NO(g) + 1/2O2(g)Kc = 2 2 Yukarıda iki tepkimenin belirli sıcaklıktaki denge sabitleri verilmiştir. Aynı sıcaklıkta gerçekleşen; III. N2(g) + 2O2(g) 2NO2(g) tepkimesinin denge sabitinin (Kc3) sayısal değeri kaçtır? ✍ÇÖZÜM III. tepkime denklemi incelendiğinde II. tepkime denkleminin tersinin iki katı ile I. tepkime denkleminin toplamına eşit olduğu görülür. Bunun için I. tepkime denklemi aynen yazılır. II. tepkime denklemi ters çevrilir. Denklemdeki kat sayılar iki katına çıkarılır. Tepkime denklemleri alt alta yazılarak toplanır. İki tepkimenin toplamı olarak yazılabilen tepkimenin denge sabiti, toplanan tepkimelerin denge sabitlerinin çarpımına eşittir. N2( g ) + O2( g ) Kc = 4 2NO( g ) 1 1 + 2NO( g ) + O2( g ) 2NO2( g ) K c′ 2 = 2 2 Toplu tepkime denklemi : N2( g ) + 2O2( g ) 2NO2( g ) 1 K c3 = 4 · 2 K c 3 = K c1· K c′ 2 2 K c 3 = 1’dir. 5. Kimyasal Reaksiyonlarda Ürün Verimi Denge sabiti Kc’nin büyüklüğü o tepkimenin dengeye varmadan önce ne kadar ilerleyebileceğinin bir ölçüsüdür. Yüksek bir Kc değeri, dengede ürünlerin yüksek, giren maddelerin düşük derişimde bulunması anlamına gelir. Aksine düşük bir Kc değeri dengedeki giren madde derişiminin ürün derişimine kıyasla fazla olması demektir. Genel olarak aA ( g ) + bB ( g ) cC ( g ) + dD( g ) dengesinde Kc ’nin 1 olması dengede tepkimeye giren maddelerin yarısının ürüne dönüştüğünü yani verimin % 50 olduğunu gösterir. Kc değerinin büyümesi tepkimeye giren maddelerin ürünlere dönüşümünün daha fazla tamamlanması anlamındadır. Çok büyük bir Kc değeri tepkimenin tamamlanma düzeyinde ilerleyebildiğini gösterirken çok küçük bir Kc değeri çok az ürünün oluşabildiğini gösterir. Kc > 1 olması tepkimenin tamamlanma düzeyinde ve ürün veriminin yüksek olduğunu gösterir. Kc < 1 olması tepkimede çok az ürün oluşabileceğini gösterir. Kc = 1 olması tepkimede denge hâlinde girenlerin ancak yarısının ürüne dönüştüğünü gösterir. N2( g ) + H2( g ) 2 NH3( g ) ΔH˚ = –91,8 kJ tepkimesinin 25 ˚C’ta kısmi basınçlar yönünden denge 5 sabiti Kp = 6,2 · 10 tir. Denge sabitinin büyük olması, tepkimeye giren maddelerin ürünlere dönüşüm oranının yüksek olduğunu gösterir. Ancak tepkime 25 ˚C’ta çok yavaş olduğundan NH3 üretim hızı çok düşüktür. Sıcaklığın artırılması tepkimenin dengeye ulaşma süresini kısaltır, ancak tepkime ekzotermik olduğu için denge, girenler lehine bozulur. Bu durumda NH3 miktarı daha da düşer. Örneğin, 500 ˚C sıcaklık ve 1 atm basınçta denge karışımının kütlece % 0,1’i NH3 ’tır. Aynı sıcaklıkta basınç 1 atm’den 700 atm’e çıkarıldığında NH3 oranı % 47 ’ye ulaşır. Buna göre NH3 verimini arttırmak için düşük sıcaklık ve yüksek basınç uygulamak gerekir. Bu arada ortama katalizör olarak alüminyum oksit (Al2O3), potasyum oksit (K2O) ve magnetit (Fe3O4) eklenirse ve ortamdan NH3 uzaklaştırılırsa denge ürünler yönüne kayar. Dolayısıyla NH3 üretim verimi % 60 oranına kadar yükselir. 112 ORTAÖĞRETİM KİMYA 11 DERS KİTABI N2( g ) + 3 H2( g ) 2 NH3( g ) H˚ = –91, 8 kJ Bir stokiyometri probleminde kuramsal olarak hesaplanan ürün miktarı gerçekte elde edilen miktar ile genellikle aynı değildir. Bu durum sadece kimyasal denge ile açıklanamaz. Çünkü tepkime sırasında yan ürünler oluşabilir, tepkime tamamlanmayabilir ya da ürünün bir miktarı deneysel koşullara bağlı olarak kaybolabilir. Bu etkenlerin hepsi sonuçta ürün miktarında azalmaya neden olur. Şimdi tepkimede ürün miktarlarında azalmaya neden olan etkenleri kısaca inceleyelim. ®Bazı tepkimelerde ana ürün yanında yan ürünler de oluşabilir. Örneğin, kömürün yanması sırasında sıcaklık ve O2 miktarına bağlı olarak ana ürün CO2 yanında yan ürün olarak CO gazı da oluşur. C(k) + O2(g) → CO2(g) ∆H˚ = –393,5 kJ/mol C(k) + 1/2O2(g) → CO(g) ∆H˚ = –110,5 kJ/mol Tepkime denklemlerinde görüldüğü gibi kömürün yanma tepkimesinde oluşan yan ürün nedeniyle hem CO2 verimi hem de ısı verimi düşer. ®Kimyasal tepkimeye giren maddeler genellikle saf değildir. Bu nedenle tepkimeden beklenen verim düşük olur. Örneğin, hematit olarak bilinen demir(III) oksit (Fe2O3) minerali CO ile indirgenerek demir metali elde edilir. Fe2O3(k) + 3CO(g) → 2Fe(k) + 3CO2(g) tepkime denklemine göre kuramsal olarak 160 gram Fe2O3’ten 112 gram Fe metali elde edilmesi beklenir. Oysa Fe2O3 saf olmadığından 160 gramından hiçbir zaman 112 gram Fe metali elde edilemez. Bir tepkime sonunda elde edilen ürün saflaştırıldıktan sonra tartılır. Bulunan değer tepkimenin gerçek verimidir. Kuramsal verim ise hesaplama ile bulunan miktardır. Kimya 10. sınıf 1. ünitede işlenen mol ve mol kütlesi kavramlarını hatırlayınız. Gerçek verimle kuramsal verim oranı verim olarak adlandırılır. % Verim = Gerçek verim . 100 Kuramsal verim ☞ÖRNEK : 20 4FeS 2(k ) + 11O2( g ) 2 Fe 2O 3(k ) + 8SO2( g ) Yukarıda denklemi verilen tepkimede % 80 prit (FeS2) içeren 10 ton pritten 200 ˚C sıcaklık ve 1,5 atm basınçta 3030 m3 SO2 gazı elde etmek için tepkimenin verimi ne olmalıdır ? (Fe: 56, S: 32, O: 16) ✍ÇÖZÜM Pritin hava ya da oksijenle kavrulması sırasında; 4FeS 2(k ) + 11O2( g ) 2 Fe 2O 3(k ) + 8SO2( g ) Fe2O3 ve SO3 oluşur. Oluşan Fe2O3 yan ürün olduğundan verimi hesaplamada dikkate alınmaz. Mol sayılarının denklemden görülen oranlarından; nFeS2 4 PV m = 2 nFeS2 = nSO2 2 · = 8 nSO2 MFeS2 RT SO 2 bağıntısı yazılabilir. Verilenler yerine yazılırsa oluşan SO2 gazının kuramsal hacmi; 2· 10 · 10 6 · 0, 8 1, 5 · VSO2 = VSO2 = 3448 · 10 3 L 120 0, 082 · 473 VSO2 = 3448 m3 olarak bulunur. Gerçekte 3030 m3 SO2 oluştuğuna göre verim; η= Vgerçek Vkuramsal · 100 = 3030 · 100 = % 87, 9 olarak bulunur. 3448 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 113 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Kapalı bir kapta gerçekleşen SO2(g) + 1/2O2(g) → SO3(g) ∆H˚ = –98,9 kJ tepkimesinde a. Sistemin sıcaklığı yükseltilirse b. Sisteme SO2 gazı ilave edilirse c. Sistemde basınç arttırılırsa kimyasal dengenin nasıl değişeceğini yorumlayınız. 2. Aşağıda verilen tepkimeler için denge bağıntılarını derişimler ve kısmi basınçlar yönünden yazınız. a. 4HCl(g) + O2(g) 2H2O(g) + 2Cl2(g) b. CuO(k) + H2(g) Cu(k) + H2O(g) – + 2+ c. 5C2O2– 10CO2(g) + 2Mn (suda) + 8H2O(s) 4(suda) + 2MnO4(suda) + 16H (suda) 3. 6HCl(g) + N2(g) 3Cl2(g) + 2NH3(g) ∆H˚ > 0 tepkimesinde ürünlerin denge derişimlerini artırmak için hangi işlemleri uygularsınız? Açıklayınız. 4. 2 L’lik kapalı tepkime kabına yüksek sıcaklık ve belirli bir basınçta 1 mol NH3 gazı konularak baş latılan; 2NH3(g) N2(g) + 3H2(g) tepkimesi dengeye ulaştığında, tepkime kabında 0,6 mol H2 gazı olduğu belirleniyor. Tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? 5.2SO2(g) + O2(g) 2SO3(g) tepkimesinin belli sıcaklıkta denge sabiti Kc = 4,5’tir. Koşullar değişmeden 1 L’lik kaba bir miktar SO3 konup sistem dengeye ulaştığında, kapalı kapta 0,2 mol O2 gazının bulunduğu belirleniyor. Kaba başlangıçta kaç mol SO3 gazı konmuştur? 6. 1 L’lik kapalı bir kapta gerçekleşen, SO2(g) + NO2(g) SO3(g) + NO(g) tepkimesinin denge karışımı 0,6 mol SO3, 0,4 mol NO, 0,1 mol NO2 ve 0,8 mol SO2 gazı içermektedir. Koşullar değişmeden, NO2 gazının mol sayısını 0,3 mol yapmak için tepkime kabına kaç mol NO gazı eklenmelidir? 7. CO2(g) + H2(g) CO(g) + H2O(g) tepkimesi 1 L’lik kapta dengeye ulaştığında, denge karışımında 0,6 mol CO2, 0,2 mol H2, 0,8 mol CO ve 0,3 mol H2O bulunuyor. Koşullar değişmeden, CO miktarını 0,6 mole düşürmek için sistemden kaç mol CO2 çekilmelidir? 8. N2(g) + O2(g) 2NO(g) NO2(g) NO(g) + 1/2O2(g) Kc1 = 0,6 Kc2 = 0,2 Belirli bir sıcaklıktaki kapalı kaplarda gerçekleşen iki tepkimeye ait denge sabitleri verilmiştir. Buna göre N2(g) + 2O2(g) 2NO2(g) tepkimesinin aynı sıcaklıkta denge sabitinin (Kc3) sayısal değerini bulunuz. B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Asit baz tepkimeleri hızlı gerçekleşen tepkimelerdir. (…) 2. Tersinir tepkimelerde tepkimeye girenlerin tamamı ürünlere dönüşür. (…) 3. Bir kimyasal tepkimede yer alan her madde denge bağıntısında yer alır. (…) 4. 2SO2( g ) + O2( g ) 2SO3( g ) ΔH˚ = –197,8 kJ tepkimesinde sıcaklık arttırıldığında Kc değeri küçülür. (…) 5. N2( g ) + 3H2( g ) 2NH3( g ) + 91, 8 kJ tepkimesinin verimini artırmak için düşük sıcaklık ve yüksek basınç uygulamak gerekir. (…) 114 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 6. Aynı fazda gerçekleşen tepkimelerin oluşturduğu dengeye “heterojen denge” denir. → CaCO3(k ) + CO( g ) tepkimesinde Kc değeri Kp değerine eşittir. 7. CaC2O4(k ) ← (…) 9. Sıcaklığın değişmesi denge sabitinin sayısal değerine etki etmez. (…) 10. CO2( g ) + H2( g ) CO( g ) + H2O( g ) sabiti birimsizdir. (…) (…) → 8. Kapalı bir sistemde gerçekleşen Na 2( g ) + O2( g ) ← 2NO( g ) tepkimesi denge hâlindeyken sisteme sıcaklık değişmeden bir miktar helyum gazı eklenirse denge, ürünler lehine kayar.( … ) ΔH˚ = –41,2 kJ/mol tepkimesinin denge C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Bir tepkimede kimyasal denge anında; I. En az enerjili durum ile en fazla düzensizlik eğilimleri uzlaşmıştır. II. İleri yöndeki tepkime hızı, geri yöndeki tepkime hızına eşittir. III. Ürünlerin derişimleri, girenlerin derişimlerine eşittir. Yukarıdaki yargılardan hangisi ya da hangileri her zaman doğrudur? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 2. CO(g) + Cl2(g) COCl2(g) tepkimesi 1 L’lik kapalı kapta dengeye ulaştığında ortamda 2,408 · 1023 CO molekülü, 28,4 g Cl2 ve 0,6 mol COCl2 gazlarının olduğu belirleniyor. Buna göre tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? ( Cl : 35,5 ) A) 0,75 B) 1 C) 1,25 D) 2,5 E) 3,75 3. 2NO2(g) + 7H2(g) 2NH3(g) + 4H2O(g) 1 L’lik kaba 1,5 mol NO2 , 2,75 mol H2 gazları konularak başlatılan yukarıdaki tepkime dengeye ulaştığında, kapalı kapta 1 mol H2O buharının olduğu belirleniyor. Buna göre tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? A) 0,25 B) 1,25 C) 2 D) 4,6 E) 6,75 4. N2(g) + O2(g) 2NO(g) tepkimesinin belirli bir sıcaklıkta denge sabitinin (Kc) sayısal değeri 9’dur. Aynı koşullarda 1 L’lik tepkime kabına bir miktar NO gazı konularak başlatılan tepkime dengeye ulaştığında, kapalı kapta 0,4 mol O2 gazı olduğu belirleniyor. Buna göre başlangıçta kaba konulan NO gazı kaç mol’dür? A) 0,4 B) 0,8 C) 1,2 D) 2 E) 2,4 5.FeO(k) + H2(g) Fe(k) + H2O(g) Belirli sıcaklıkta 1 L’lik tepkime kabına 0,4 mol FeO ve 1g H2 gazı konularak başlatılan tepkimede denge kurulduğunda kapalı kapta 7,2 g FeO kaldığı belirleniyor. Buna göre tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? (H: 1, O: 16, Fe: 56) A) 0,375 B) 0,75 C) 1 D) 1,5 E) 3,5 6.2SO2(g) + O2(g) 2SO3(g) Kapalı bir kapta gerçekleşen tepkimesinin 127 ˚C’ta denge sabitinin sayısal değeri Kc = 4,1 olduğuna göre kısmi basınçlar türünden denge sabitinin (Kp) sayısal değeri kaçtır? A) 0,125 B) 0,25 C) 4,1 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge D) 8 E) 135 115 2.ÜNİTE DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Çinkonun sülfürik asit ile verdiği tepkimeye birkaç damla bakır(II) sülfat çözeltisi eklendiğinde tepkime daha hızlı gerçekleşir. Bu olayın nedenini açıklayınız. 2. Bir elma kesilip dilimlere ayrıldığında polifenoksidaz enzimi havanın oksijeni ile yükseltgenerek dilim yüzeylerini kahverengiye boyar. Buna göre; a. Dilimlenmiş elma, buzdolabına konduğunda renklenme daha yavaş olmaktadır. Neden? b. Elma mikserde doğrandığında dilimli hâline göre daha hızlı renklenmektedir. Neden? c. Elma dilimleri üzerine limon suyu dökülürse renklenme gözlenmez. Neden? 3. Basınç altında 22 g CO2 gazının suda çözünmesiyle 250 mL gazoz çözeltisi oluşturuluyor. Daha sonra gazoz kapağı açıldığında 37,5 saniye sonunda çözeltide 16,5 g CO2 gazının kaldığı belirleniyor. Buna göre gazoz çözeltisinden CO2 gazının çıkış hızı kaç mol/L s’dir? (Gaz çıkışıyla hacmin değişmediğini kabul ediniz.) (C:12, O:16) 4. Bazı bileşiklerin standart oluşum entalpileri aşağıdaki gibidir : ∆H˚CH3OH(s) = –239,2 kJ/mol, ∆H˚CO2(g) = –393,5 kJ/mol, ∆H˚H2O(g) = –241,8 kJ/mol CH3OH(s) + 3/2O2(g) → CO2(g) + 2H2O(g) tepkimesinin aktifleşme enerjisi 60 kJ ise geri yönde tepkimenin aktifleşme enerjisi kaç kJ dür? 5. I. C6H6(g) +15/2O2(g) → 6CO2(g) + 3H2O(g) 4+ 3+ 3+ II. Fe2+ (suda) + Ce (suda) → Fe (suda) + Ce (suda) – + 2+ III. 5C2O2– 4(suda) + 2MnO4(suda) + 16H (suda) → 10CO2(g) + 2Mn (suda) + 8H2O(s) Yukarıda denklemleri verilen tepkimelerin hızlarını büyükten küçüğe doğru sıralayınız ve bu sıralamanın nedenini açıklayınız. 6. Üç farklı tepkimenin Ea ve ΔH˚ değerleri aşağıda verilmiştir: Tepkime –––––––– I. Ea (kJ)ΔH˚ (kJ) –––––––– ––––––– 75 –20 II. 110 +50 III. 50 –70 Buna göre hangi tepkimenin daha hızlı gerçekleşmesi beklenir? Neden? 7. Vücut sıcaklığında kandaki hemoglobinin (Hb) karbon monoksitle tepkimesi şöyledir: Hb( suda ) + CO( g ) HbCO( suda ) Bu tepkimeye ait bir seri deneyin sonuçları aşağıdaki gibi belirleniyor: Deney numarası Girenlerin derişimi [M] [Hb] [CO] Tepkime hızı (mol/L s) 1 2,21 1,00 0,62 2 4,42 1,00 1,24 3 4,42 3,00 3,72 Buna göre; a. Tepkime hız sabitinin sayısal değeri kaçtır? b. Tepkimenin derecesi ve moleküleritesi kaçtır? 116 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 8. 2NO( g ) + Cl2( g ) 2NOCl( g ) klor derişimini nasıl artırabilirsiniz? H˚ = – 286 kJ tepkimesi kapalı bir sistemde dengede iken 9.SO2(g) + NO2(g) → SO3(g) + NO(g) tepkimesinin belirli bir sıcaklıkta denge sabitinin sayısal değeri Kc = 2’dir. Bu sıcaklıkta 1 L’lik kapalı kapta 0,4 mol SO3, 0,4 mol NO, 0,8 mol SO2 ve 0,2 mol NO2 gazı bulunduğu belirleniyor. Buna göre tepkime dengede midir? Dengede değilse hangi yönde yürümektedir? 1 10. C(k ) + 2H2O( g ) CO2( g ) + 2H2( g ) K p = 1 4 K p = 2 · 10 –2 CO2( g ) + H2( g ) CO( g ) + H2O( g ) 2 tepkimelerinin kısmi basınçlar türünden denge sabitleri (Kp) verilmiştir. Buna göre kapalı bir sis temde aynı sıcaklıkta gerçekleşen C(k ) + CO2( g ) 2CO( g ) tepkimesinin denge sabitinin (Kc) sayısal değeri kaçtır? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Bazı yiyeceklerin bozulmadan uzun süre korunmasında inhibitörler görev alır. (…) 2. Bir tepkimenin aktivasyon enerjisi ne kadar yüksekse tepkime o denli hızlıdır. (…) 3. Birim hacimdeki molekül sayısının artması temas yüzeyini de artırır. (…) 4. Tepkime hız sabiti sıcaklığa, etkin çarpışma sayısına ve aktivasyon enerjisine bağlıdır. (…) 5. Katalizör, tepkimenin derecesini etkilemez. (…) 6. Tepkime sırasında kendi kendini katalizleyen tepkimelere “otokataliz” denir. (…) 7. Polimerleşme, hidroliz, fotosentez, mayalanma yavaş tepkimelere birer örnektir. 8.Fe2O3(k) + 3CO(g) 2Fe(k) + 3CO2(g) tepkimesinde denge konumunda tepkime (…) kabında basınç arttırıldığında denge bozulmaz. (…) 9. Katalizör tepkimenin denge sabitinin sayısal değerini değiştirir. (…) 10. Sıcaklık değişimi kapalı kapta dengedeki bir tepkimenin ürünler ya da girenler lehine bozulmasına neden olur. (…) C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. 5H2C2O4(suda) + 2MnO–4(suda) + 6H+(suda) → 10CO2(g) + 2Mn2+ (suda) + 8H2O(s) Menekşe renkli KMnO4 çözeltisinin H2C2O4 ve H+ iyonu ile tepkime denklemi yukarıda verilmiştir. Bu tepkimenin hızı; I. Elektriksel iletkenliğin azalması, II. Basıncın artması, III. Renk değişimi, özelliklerinden hangisi ya da hangileriyle belirlenebilir? A) Yalnız I B)Yalnız II C)I ve II D) II ve III E) I, II ve III 2. Aşağıda denklemleri verilen tepkimelerden hangisinin en yavaş olması beklenir? A) H+(suda) + OH–(suda) → H2O(s) 2+ 3+ + B) Fe2+ (suda) + Hg (suda) → Fe (suda) + Hg (suda) C) H2(g) + 1/2O2(g) → H2O(s) D) C4H10(g) + 13/2O2(g) → 4CO2(g) + 5H2O(g) – + 3+ E) 3Fe2+ (suda) + NO3(suda) + 4H (suda) → 3Fe (suda) +NO(g) + 2H2O(s) 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge 117 3. Açık havada bırakılan demirin paslanmasıyla ilgili olarak; I. Demiri toz hâlinde kullanmak, II. Deney ortamının sıcaklığını artırmak, III. Deney ortamındaki oksijen oranını artırmak, işlemlerinden hangisi ya da hangileri uygulanırsa tepkime hızı artar? A) Yalnız I B)Yalnız II C)I ve II D)II ve III E) I, II ve III 4. 4Ag(k) + 2H2S(g) + O2(g) → 2Ag2S(k) + 2H2O(s) tepkimesinde; Ag’ün harcanma hızı v1 , O2 in harcanma hızı v3 , H2S’ün harcanma hızı v2 , Ag2S’ün oluşma hızı v4 , H2O’yun oluşma hızı v5 , ile gösterilirse v1, v2, v3, v4 ve v5 arasındaki ilişki aşağıdakilerden hangisidir? A) v1 = v2 = v3 = v4 = v5 B)v1= 2v2 = 4v3 = 2v4= 2v5 C) 4v1 = 4v2 = 2v3 = 2v4 = v5 D)v1= 2v2= 2v3 = 4v4 = 4v5 E) 2v1 = v2 = 4v3 = 2v4 = 2v5 5. Bir tepkimeye ait iki ayrı sıcaklıktaki molekül sayısı-kinetik enerji grafiği yandaki gibidir ve T2 >T1 dir. Buna göre aşağıdakilerden hangisi yanlıştır? A) Sıcaklık arttıkça moleküllerin kinetik enerjisi artar. B) T2 sıcaklığında etkin çarpışma sayısı artar. C) T1 sıcaklığında tepkime hızı daha büyüktür. D) Her iki sıcaklıkta da Ea (aktifleşme enerjisi) aynıdır. E) T2 sıcaklığında Ea engelini aşan molekül sayısı daha fazladır. Molekül sayısı T1 T2 Ea Kinetik enerji 6. Sulu çözeltide oluşan bir tepkimenin mekanizması aşağıdaki gibi öngörülüyor: H2O2 + I – → H2O + IO– (Yavaş) IO– + H3O+ → H2O+ H2O (Çok hızlı) HIO + H3O+ + I¯ → 2H2O +I 2 (Hızlı) ––––––––––––––––––––––––––––––––––––––––––––– H2O2 + 2H3O+ + 2I– → 4H2O + I 2 Buna göre aşağıdaki değişikliklerden hangisi uygulanırsa tepkimenin hızı değişmez? A) H2O2 derişimini iki katına çıkarmak B) H2O2 derişimini sabit tutup I 2 derişimini yarıya indirmek C) Tepkime ortamına H2O eklemek D) Tepkimeye katalizör eklemek E) H3O+ derişimini iki katına çıkarıp H2O2 derişimini yarıya indirmek 7. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) Yukarıda denklemi verilen tepkimenin ileri yöndeki aktifleşme enerjisi 334,7 kJ’dür. ∆H˚CH4(g) = –74,8 kJ/mol ∆H˚CO2(g) = –393,5 kJ/mol ∆H˚H2O(g) = –241,8 kJ/mol standart oluşma entalpileri bilindiğine göre geri yöndeki tepkimenin aktifleşme enerjisi kaç kJ’dür? A) 225,9 118 B)468,6 C)803,3 D)895,3 E) 1137 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 9. C(k) + H2O(g) → CO(g) + H2(g) Ea Ek Ek Ea Molekül sayısı Ek Ea E) Molekül sayısı Ek Molekül sayısı Ea D) C) B) A) Molekül sayısı 8. Aynı sıcaklık ve basınç altında gerçekleşen 5 farklı tepkimenin molekül sayısı-kinetik enerji (Ek) grafikleri aşağıda verilmiştir. Bu tepkimelerden hangisinin en hızlı olması beklenir? Molekül sayısı Ek Ea ∆H˚ ≈ +134 kJ Yukarıda denklemi verilen tepkimenin aktifleşme enerjisi 166 kJ olarak hesaplansa tepkimenin potansiyel enerji (Ep)-zaman grafiği aşağıdakilerden hangisi olabilir? A) 320 Ep (kJ) 160 B) 320 288 C) Ep (kJ) 328 Ep (kJ) 168 154 Zaman (s) Zaman (s) 328 Ep (kJ) Ep (kJ) 40 40 Zaman (s) E) 240 160 160 40 8 D) Zaman (s) Zaman (s) 10. I. Cl2 → 2Cl II. N2O + Cl → N2 + ClO III. 2ClO → Cl2 + O2 Yukarıda mekanizması verilen tepkimede kullanılan katalizör, aşağıdakilerden hangisidir? A) N2O B)Cl C)Cl2 D)ClO E) O2 11. 4HBr(g) + O2(g) → 2H2O(g) + 2Br2(g) Yukarıda denklemi verilen tepkime için yapılan deney sonuçlarına göre hız denklemi; TH = k [HBr] [O2] şeklinde belirlenmiştir. Buna göre tepkimenin yavaş basamağı aşağıdakilerden hangisi olabilir? A) HBr(g)+ O2(g) → HOOBr(g) B)2HBr(g) + O2(g) → 2HOBr(g) C) HBr(g)+ 2O2(g) → HBrO4(g) D)2HBr(g) + O2(g) → 2HBrO(g) E) HBr(g) + 1/2O2(g) → HOBr(g) 12. 2NO(g) + O2(g) 2NO2(g) Belirli bir sıcaklıkta 1 L’lik kaba 0,2 mol NO, 0,4 mol O2 ve 1 mol NO2 gazları konularak başlatılan tepkime dengeye ulaştığında, kapalı kapta toplam 1,7 mol gaz olduğu belirleniyor. Buna göre tepkimenin denge sabitinin (Kc) sayısal değeri kaçtır? A) 10 B)8 C)6 D)4 E) 2 13.2SO2(g) + O2(g) 2SO3(g) CO(g) + 1/2O2(g) CO2(g) Kc1 = 0,25 Kc2 = 2 Yukarıdaki tepkimelerin denge sabitlerinin sayısal değerleri bilindiğine göre aynı koşullarda kapalı bir kapta gerçekleşen CO(g) + SO3(g) SO2(g) + CO2(g) tepkimesinin denge sabitinin (Kc3) sayısal değeri kaçtır? A) 0,5 B)1 C)2,5 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge D)4 E) 5 119 14. I. 3H2O(g) + 3Cl2(g) 6HCl(g) + 3/2O2(g)K1 II. 6 HCl(g) + N2(g) 3Cl2(g) + 2NH3(g)K2 Aynı sıcaklıkta gerçekleşen I. tepkimenin denge sabiti K1, II. tepkimenin denge sabiti K2 ’dir. Buna göre kapalı bir sistemde aynı sıcaklıkta gerçekleşen; 3/4O2(g) + NH3(g) 1/2N2(g) + 3/2H2O(g) tepkimesinin denge sabiti K3 nedir? A) K3 = K1 · K2 D) K 3 = 1 K1 · K 2 B) K 3 = K 1 · K 2 C)K 3 = 1 K1 · K 2 E) K3 = (K1 · K2)2 15.2SO2(g) + O2(g) 2SO3(g) ∆H = –197,8 kJ Kapalı bir kapta, belli bir sıcaklıkta SO2 , O2 ve SO3 gazları karışımı dengededir. I. Sıcaklığı yükseltmek II. Katalizör kullanmak III. Kaba O2 gazı eklemek IV. Kaptan SO3 gazı çekmek işlemlerinden hangisi ya da hangileri dengeyi ürünler lehine kaydırır? A) Yalnız II B)Yalnız IV C)III ve IV D)I, II ve III E) I, III ve IV 16. CS2(g) + 3O2(g) CO2(g) + 2SO2(g) tepkimesinin belirli sıcaklıkta denge sabitinin sayısal değeri Kc = 3’tür. Bu sıcaklıkta 1 L’lik kapalı kapta 0,25 mol CS2 , 1,5 mol O2 , 0,75 mol CO2 ve 1,5 mol SO2 gazlarının olduğu belirleniyor. Buna göre aşağıdakilerden hangisi doğrudur? A) Tepkime ürünler yönünde devam etmektedir. B) Tepkime girenler yönünde devam etmektedir. C) Tepkime dengededir. D) Tepkime devam ettikçe kapta basınç artar. E) Kabın hacmi küçültülürse tepkime girenler yönünde yürür. 17. N2O( g ) + NO( g ) N2( g ) + NO2( g ) tepkimesi kapalı bir sistemde belirli koşullarda gerçekleştirildiğinde derişim-zaman grafiği, Grafik I’deki gibi çiziliyor. Bu tepkimede aşağıdaki etkenlerden hangisi değiştirildiğinde tepkimenin derişim-zaman grafiği Grafik II’deki gibi olur? A) Basınç artırılırsa C) Katalizör kullanılırsa D) Tepkime kabının hacmi değiştirilirse E) Tepkime kabına helyum gazı konulursa 120 B) Sıcaklık artırılırsa ORTAÖĞRETİM KİMYA 11 DERS KİTABI K p = 8 · 1013 18. 2NO( g ) + O2( g ) N2O4( g ) 1 K p = 9 · 1012 2NO( g ) + O2( g ) 2NO2( g ) 2 tepkimelerinin 273 K’deki kısmi basınçlar türünden denge sabitleri verilmiştir. Aynı koşullarda kapalı bir kapta gerçekleşen N2O4( g ) 2NO 2( g ) tepkimesinin denge sabitinin (Kc) sayısal değeri aşağıdakilerden hangisidir? A) 1,86 · 10–3 B)1,125 · 10–1 C) 8,88 · 10–1 D) 7,1 · 1020 E) 7,2 · 1025 19. Bir tepkimenin denge sabiti Kc, herhangi bir andaki denge sabiti Q ise; I. Kc = Q ise sistem dengededir. II. Kc < Q ise sistem dengede değildir. Tepkime geri yönde yürümektedir. III. Kc > Q ise sistem dengede değildir. Tepkime ileri yönde yürümektedir. yargılarından hangisi ya da hangileri doğrudur? A) Yalnız I B)Yalnız II C)I ve II 20. NO2( g ) + N2( g ) N2O( g ) + NO( g ) D) II ve III E) I, II ve III H˚ > 0 [N2O] [NO] [NO2] [N2] 1 2 3 Zaman (s) Grafik I Derişim (Mol/L) Derişim (Mol/L) tepkimesine ait derişim - zaman grafiği Grafik I’ deki gibidir. [N2O] [NO] [NO2] [N2] 1 2 3 Zaman (s) Grafik II I. Katalizör kullanmak II. Tepkime kabının hacmini değiştirmek III. Sistemin sıcaklığını artırmak Yukarıdaki işlemlerinden hangisi ya da hangileri uygulanırsa Grafik II ’ deki eğriler elde edilir? A) Yalnız I B)Yalnız III C)I ve II D) I ve III E) I, II ve III 21. Aşağıdakilerden hangisinin değeri bazı tepkimelerde eksi (–) olabilir? A) Hız sabiti B)Tepkime entalpisi C) Denge sabiti D)İleri tepkimenin aktifleşme enerjisi E) Geri tepkimenin aktifleşme enerjisi 22. 2NO(g) + O2(g) ∆H < 0 N2O4(g) tepkimesinin gerçekleştiği kapalı sistemde sıcaklık ve basınç artırılırken katalizör de kullanılıyor. Bu durumda, I. Tepkime hızında artma II. Denge sabitinde büyüme III. Aktivasyon enerjisinde düşme değişimlerinden hangilerinin olması beklenir? A) Yalnız II B)Yalnız III C)I ve II 2. ÜNİTE: Reaksiyon Hızları ve Kimyasal Denge D) I ve III E) I, II ve III 121 3. ÜNİTE ÇÖZELTİLERDE DENGE ÜNİTE İÇERİĞİ 1.SUYUN OTOİYONİZASYON DENGESİ 2.ÇÖZÜNÜRLÜK DENGELERİ 3.KOMPLEKS OLUŞMA - AYRIŞMA DENGELERİ 4. TİTRASYON Bu ünitede, suyun iyonlaşma dengesi üzerinden pH ve pOH kavramları açıklanarak asit ve bazların kuvvetleri, ayrışma denge sabitleri ile ilişkilendirilecektir. Kuvvetli asit / baz ve zayıf asit / baz çözeltilerinin pH değerleri ve tampon çözeltilerin işlevleri ile tanıtımı da bu ünitede yer almaktadır. Ayrıca çözünme - çökelme olayları, çözünürlüğe etki eden etkenler ile kompleks oluşum dengeleri ve titrasyon konuları da bu ünite kapsamındadır. 122 ORTAÖĞRETİM KİMYA 11 DERS KİTABI SUYUN OTOİYONİZASYON DENGESİ BÖLÜM İÇERİĞİ 1.Suyun Otoiyonizasyonu 2.Suyun İyonlaşma Dengesi 3.Asitler ve Bazlar 4.Asit ve Baz Dengeleri 5.Asitlik-Bazlık Kuvveti 6.Hidroliz 7.Kuvvetli Asit ve Baz Çözeltilerinin pH Değerleri 8.Zayıf Asit ve Baz Çözeltilerinin pH Değerleri 9.Nötrleşme Tepkimeleri 10.Tampon Çözeltiler Limon suyunun tadının ekşi, sabun köpüğünün tadının acı olduğunu bilirsiniz. Genellikle asitlerin tadının ekşi, bazlarınkinin ise acıdır. Bu genellemeye göre limon suyu asit, sabun köpüğü baz içeriyor diyebilir miyiz? Elektrik akımını ileten maddelere iletken, iletmeyenlere yalıtkan maddeler denildiğini biliyorsunuz. Demir, bakır, alüminyum gibi metallerin elektrik akımını serbest elektronlar yardımıyla çözeltilerin ise içerdikleri iyonlar vasıtasıyla ilettiklerini öğrendiniz. Yalıtkan bir madde olarak öğrendiğiniz saf suyun üzerine uygulanan gerilim büyüdükçe iletken hâle geldiğini fizik, kimya, fen ve teknoloji derslerinde gördünüz. Bu arada ıslak zeminlerin elektrik akımını daha kolay ilettiğini de gözlemlemiş olmalısınız. O hâlde saf suyun elektrik akımını iletmesini nasıl açıklarsınız? Bu bölümde asitlik ve bazlığı, suyun hangi koşullarda, nasıl ve ne kadar elektrik akımını ilettiğini ve bu iletkenliğin nedenlerini öğreneceksiniz. 3. ÜNİTE: Çözeltilerde Denge 123 1. Suyun Otoiyonizasyonu 10. sınıf kimya derslerinizde metal atomlarının son enerji katmanlarında serbest elektronlar taşıdıklarını öğrendiniz. Bir metal parçasına, örneğin, demir bir çiviye, doğru akım verdiğinizde güç kaynağının eksi kutbundan çıkan elektronların metal atomlarındaki serbest elektronları ittiğini, hareketin bir elektrondan diğerine aktarılarak iletkenliğin sağlandığını gördünüz. Molekül yapısı bozulmadan suda çözünen maddelerin oluşturduğu çözeltilerin elektrik akımını iletmediğini, iyonlarına ayrılan maddelerin oluşturduğu çözeltilerin ise elektrik akımını ilettiğini biliyorsunuz. Dolayısıyla sulu çözeltilerde elektrik akımının iyonlar vasıtasıyla iletildiğini kavramışsınızdır. Şimdi aşağıdaki etkinliği yaparak saf suyun elektrik akımına karşı davranışını irdeleyiniz. 1. ETKİNLİK: SAF SUYUN İYONLARI MI VAR? Neler Gerekli? ❏ Güç kaynağı (12-24 V DC) ❏ Bağlantı kablosu ❏ Anahtar ❏ Saf su ❏ Beherglas (500-600 mL) ❏ Miliampermetre ❏ Çelik elektrot (2 adet) ❏ Sıvı deterjan Güvenliğiniz için Nasıl Yapacaksınız? 3 Beherglası sıvı deterjan kullanarak yıkayıp durulayınız. Daha sonra beherglası saf su ile yeniden durulayınız. 3 Beherglasın 3/4 ’üne kadar saf su doldurunuz ve resimdeki etkinlik düzeneğini kurunuz. 3 Güç kaynağını 24 V’a ayarlayıp devreye doğru akım veriniz ve bu arada miliampermetrenin göstergesini çok dikkatli gözleyiniz. En ufak sapmaları bile görmeye çalışınız. 3 Eğer miliampermetrenin göstergesinde sapma gözlemleyemezseniz çelik elektrotları birbirine değmeyecek şekilde yaklaştırınız. Miliampermetrenin göstergesinde sapma olup olmadığını belirlemeye çalışınız. Etkinlik Sonu Soruları 1. Saf suya akım verdiğinizde ne gözlemlediniz? 2. Gözlem sonuçlarınızı nasıl açıklarsınız? 124 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Yaptığınız etkinlikte saf suyun son derece az elektrik akımı ilettiğini miliampermetrenin göstergesindeki minik sapmalardan gözlemlemiş olmalısınız. Böyle bir olayı gözlemleyemediyseniz bunun nedeni miliampermetrenin yeterince hassas bir ölçü aracı olmamasıdır. Bu etkinlik çok hassas ölçü araçları (mikroampermetre) ile tekrarlanırsa saf suyun çok az da olsa elektrik akımını ilettiği gözlenir (Resim 3.1). Suyun moleküler yapılı bir bileşik olduğunu, dolayısıyla saf hâlde elektrik akımını iletmemesi gerektiğini, bu Resim 3.1: Çok hassas aletlerle saf suyun elektrik akımını ilettiği gözlenebilir. yüzden yalıtkan madde olarak tanımlandığını biliyorsunuz. O hâlde saf su elektrik akımını nasıl iletmektedir? Serbest elektronlara mı sahiptir yoksa iyonlarına mı ayrılmaktadır? Biliyor musunuz? Eksi elektrik yüküyle yüklü balonun su moleküllerini kendine doğru çekmesi suyun polar yapıda olduğunu gösterir. Daha önce öğrendiğiniz gibi su, H2O formülü ile gösterilen polar moleküllerden oluşan polar bir bileşik olup serbest elektron içermez. Dolayısıyla saf hâlde elektrik akımını iletmemesi beklenir. Ancak saf suyun çok çok az da olsa elektrik akımını iletiyor olması iyonlaştığını gösterir. Bu olay şöyledir: Polar bir su molekülü diğer bir su molekülünden bir H+ iyonu çekerek hidronyum iyonu (H3O+) hâline gelir. Bu arada bir H+ iyonu kaybeden molekül de hidroksit iyonu (OH–) hâlini alır. Bu olay suyun otoiyonizasyonu olarak bilinir. Otoiyonizasyon olayının tepkime denklemi ve iyonların oluşumu, molekül modelleri ile aşağıdaki gibi gösterilebilir: + − H2O( s ) + H2O( s ) H3O( suda ) + OH( suda ) H + H O + H O H O H H – H + O H Suyun otoiyonizasyon tepkimesi denkleminde iyon sembollerinin sağ alt köşesine yay ayraç içinde “suda” ibaresinin konmasının nedeni, iyonun su ortamında bulunduğunu belirtmek içindir. Aksi belirtilmedikçe “suda” ibaresi iyon formülünün sağ alt köşesinde bulunmaması durumunda bile ortamın su olduğu anlaşılır. H+ iyonu bir elektronunu kaybetmiş hidrojen atomudur. Dolayısıyla elektron kaybıyla geride kalan protondur. Bu anlamda H+ iyonu bir protonu ifade eder. Ancak yazım kolaylığı bakımından H+ şeklinde gösterilen bu sembol, gerçekte hidronyum (H3O+) iyonudur. Biliyor musunuz? 1000 4 ˚C’ta 1 L saf suyun kütlesi 1000 g’dır. 1000 g su n = ≈ 55, 6 mol’dür. 18 Dolayısıyla suyun derişimi 55,6 mol/L’dir. 3. ÜNİTE: Çözeltilerde Denge 125 2. Suyun İyonlaşma Dengesi + − Su otoiyonizasyon ile bir yandan H2O( s ) H( suda ) + OH( suda ) şeklinde çok az da olsa iyonlarına ayrılırken diğer yandan bu iyonlar birbiriyle birleşerek su moleküllerini oluşturmaya başlar. Otoiyonizasyonun belirli bir anında iyonların oluşma hızı ile bu iyonlardan yeniden su molekülleri oluşma hızı eşit hâle gelir ve sistemde denge kurulur. Kurulan bu dengenin bağıntısı şöyledir: Kc = [H+ ] [OH− ] [H2O] Bu eşitliğin her iki tarafı [H2O] ile çarpılırsa aşağıdaki bağıntı elde edilir: Kc · [H2O] = [H+] [OH–] Bu bağıntının solunda yer alan Kc, sayısal değeri sadece sıcaklıkla değişen denge sabitidir. [H2O] ise suyun molar derişimidir. Suyun molar derişimi 4 ˚C sıcaklıkta 55,6 mol/L’dir ve bu değer 4 ˚C sıcaklık için sabit bir değerdir. Bu bağlamda Kc [H2O] = Kc · 55,6 çarpımları da sabittir. Bu sabit değer suyun iyonlaşma sabiti olarak nitelenir ve Ksu sembolü ile gösterilir. Buna göre suyun otoiyonizasyon denge bağıntısı aşağıdaki şekilde ifade edilebilir: Ksu = [H+] [OH–] 1 atm basınç 25 ˚C sıcaklık koşullarında [H+] ve [OH–] iyon derişimleri çarpımının 1 · 10–14 e eşit olduğu deneysel olarak hesaplanmış olup bu değer Ksu sabitinin sayısal değeridir. Ksu = 1 · 10–14 = [H+] [OH–] Deneysel verilere göre 1 mol suyun iyonlarına ayrılması için 58 kJ’ lük bir enerjinin harcanması gerekir. – + H2O( s ) H( suda ) + OH( suda ) H˚ = +58 kJ / mol Suyun iyonlarına ayrılması tepkimesinde denge durumunda, sistemin sıcaklığı arttırılırsa Le Chatelier İlkesi’ne göre denge, ürünler yönünde bozulur. Dolayısıyla Ksu değeri Tablo 3.1: Sıcaklığa bağlı Ksu değerleri Sıcaklık (˚C) Ksu değerleri 0 0,114 · 10–14 10 0,295 · 10–14 20 0,676 · 10–14 25 1,00 · 10–14 60 9,55 · 10–14 değişir. Sıcaklıkla değişen Ksu değerleri Tablo 3.1’de verilmiştir. İnceleyiniz. Suyun iyonlaşma denge bağıntısında [H+]’ ni X kabul edersek [OH–]’de X’e eşit olacaktır. Buna göre; 1 · 10–14= [H+] [OH–] 1 · 10–14= X · X ⇒ 1 · 10–14 = X2 ⇒ X = 1 · 10–7 M bulunur. Bunun anlamı 1 atm basınç 25 ˚C sıcaklık koşullarında saf suda [H+] ve [OH–] derişimlerinin 1.10–7 mol/L olması demektir. Bulduğumuz bu sonuç saf suyun neden elektrik akımını çok çok az ilettiğini açıklar. Ksu sabitinin sayısal değeri olan 1 · 10–14, [H+] ile [OH–]’ nin çarpımına eşittir. Yani bu derişimler birbiri ile ters orantılıdır. Bu durum derişimlerden birinin 1,0 mol/L olması hâlinde (Örneğin, [H+] ) diğerinin ([OH– ]) derişiminin 1 · 10–14 mol/L olmasını gerektirir. 1,0 mol/L ile 1,0 · 10–14 mol/L arasındaki değişmeyi aynı grafik üstünde göstermek olanaklı değildir. Bu güçlüğü yenmek için Danimarkalı biyokimyacı Søren Sørensen (Saren Sarensen) tarafından [H+] derecesini göstermek üzere pH, [OH–] derecesini göstermek üzere pOH terimleri kullanılmıştır. 126 ORTAÖĞRETİM KİMYA 11 DERS KİTABI pH, H+ ya da H3O+ iyonlarının; pOH, OH– iyonlarının derişiminin tersinin logaritmasıdır. pH = log 1 + [H3O ] pH = log 1 + [H ] = − log [H+ ] pOH = log 1 [OH− ] = − log [H+ ] Saf suda [H+] = [OH–] = 1,0 · 10–7 molar olduğuna göre; pH = –log 1,0 · 10–7 ⇒ pH = 7’ dir. 1 atm basınç ve 25 ˚C sıcaklıkta saf suda; pH + pOH = 14’tür. pH = 7 olduğuna göre; 7 + pOH = 14 ⇒ pOH = 14 – 7 ⇒ pOH = 7’ dir. Saf suda H+ ve OH– iyonları molar derişimlerinin çarpımının sabit olması, H+ ya da OH– iyonlarından birinin molar derişiminin büyümesi hâlinde diğerinin küçülmesini gerektirir. Eğer saf suya H+ iyonu eklenirse H+ iyonu molar derişimi artar. H+ ve OH¯ iyonları molar derişimleri çarpımı 1,0 · 10–14 değerine eşit olacak şekilde OH– iyonu molar derişimi azalır. Bu da bize pH + pOH = 14 eşitliğinin her tür çözelti için geçerli olabileceğini gösterir. Ancak bu durum sulu çözeltilerde pH değerinin 0 - 14 aralığı dışına çıkamayacağı gibi yanılgıyı beraberinde taşır. Oysaki pH’ nin logaritmik tanımı gereği [H+] 1 ise pH sıfırdan küçük, [OH–] > 1 ise pH sıfırdan büyük olabilecektir. 3. Asitler ve Bazlar H+ ve OH– iyonlarının sulu çözeltilerdeki önemi, eskiden beri bilinmektedir. Kimyacılar, bu iki iyonun derişimlerindeki değişmelere göre maddeleri “asit” ve “baz” olarak sınıflandırmışlardır. Asitler ve bazlar yaşamsal olaylarda önemli görevler üstlenen, günlük yaşamın vazgeçilmez maddelerindendir (Resim 3.2). Resim 3.2: Asit ve baz içeren bazı maddeler Asit ve bazlar için çeşitli tanımlar yapılmıştır. Bu tanımlardan ilki, İsveçli bilim insanı S. Arrhenius (S. Arhenyus)’un yaptığı tanımdır. Arrhenius’ a göre; asitler, sulu çözeltilerine hidrojen iyonu (H+), bazlar ise hidroksit iyonu (OH¯) verebilen maddelerdir. Bu tanıma göre suya H+ iyonu verebilen HCl asit, OH– iyonu verebilen NaOH bazdır. HCl(g) → H+(suda) + Cl–(suda) 3. ÜNİTE: Çözeltilerde Denge NaOH(k) → Na+(suda) + OH–(suda) 127 Bu tanım kapsamına HCl, HNO3, H2SO4 gibi asitlerle NaOH, Ca(OH)2 gibi bazlar girmektedir. Ancak suda çözündüğünde asit özelliği gösteren CO2 ve SO2 ile baz özelliği gösteren NH3 gibi maddeler bu tanım kapsamına girmemektedir. Bileşiminde H+ ve OH– iyonu bulundurmayan maddeleri de kapsamına alması için Arrhenius’un tanımı şöyle düzenlenmiştir: Sulu çözeltilerde H+ iyonu derişimini artıran maddelere asit, OH– iyonu derişimini artıran maddelere de baz denir. Bu tanım kapsamına yukarıda sözünü ettiğimiz CO2, SO2 ve NH3 da girmektedir. + – CO2(g) + H2O(s) H (suda) + HCO3(suda) + – NH3(g) + H2O(s) NH 4(suda) + OH(suda) Asitlerin çözeltilerine verdikleri H+ iyonu, elektronunu kaybetmiş hidrojen atomudur. H+ iyonu, protondan ibarettir. Protonun çapı, diğer iyonların çapından çok küçüktür. Bu durum H+ iyonuna çok büyük yük yoğunluğu kazandırır. Bu nedenle sulu çözeltide H+ iyonları serbest hâlde bulunmaz. H+ iyonu su molekülü tarafından çekilerek H3O+ formülüyle ifade edilen hidronyum iyonu oluşur. Çözeltilerin asitliği H3O+ iyonundan ileri gelir. Bu görüşe göre HCl’ ün sulu çözeltisindeki asitlik özelliği tepkime denklemi ve molekül modelleri ile aşağıdaki gibi ifade edilebilir: + – HCl(g) + H2O(s) H3O (suda) + Cl(suda) + H H H O H O H H Asit ve baz tanımları, 1923 yılında Danimarkalı bilim insanı J. Brønsted (J. Brönşted) ile İngiliz bilim insanı T. Lowry (T. Lavri) tarafından geniş kapsamlı olarak yapılmıştır. Brønsted ve Lowry’ye göre; proton veren maddeler asit, proton alan maddeler bazdır. Asit - baz tepkimelerinde proton, asitten baza transfer edilir. Bu tanım çerçevesinde sulu çözeltilerinde asit ya da baz özelliği gösteren bazı maddelerin asitlik ya da bazlığını anlamak Arrhenius’ un asit ve baz tanımına göre daha olanaklı hâle gelir. + – HNO3(s) + H2O(s) H3O (suda) + NO3(suda) + – NH3(g) + H2O(s) NH 4(suda) + OH(suda) Yukarıdaki örneklerde HNO3 suya proton verdiğinden asit, NH3 ise sudan proton aldığından bazdır. Konjuge (Eşlenik) Asit - Baz Çifti HCN suda çözündüğünde sulu çözeltisine proton verir. Su ise HCN tarafından verilen protonu alır. HCN(s) + H2O(s) → H3O+(suda) + CN–(suda) Asit Baz HCN çözünürken suya H+ iyonu verdiği için asittir. Su ise HCN tarafından verilen H+ iyonunu aldığı için bazdır. Tepkimede H+ iyonu aktarımı ile H3O+ ve CN¯ iyonları oluşur. Oluşabilecek geri yöndeki bir tepkimede CN– iyonları H3O+ iyonları ile etkileşerek HCN ve H2O’ya dönüşürler. CN–(suda) + H3O+(suda) → HCN(s) + H2O(s) Baz 128 Asit ORTAÖĞRETİM KİMYA 11 DERS KİTABI Geri yöndeki tepkimede CN¯ iyonu proton aldığından baz, H3O+ iyonu proton verdiğinden asittir. Bu sonuçları birleştirirsek her asit proton verince baza, her baz proton alınca aside dönüşür diyebiliriz. HCN’ün suda iyonlarına ayrışması tepkimesi ile CN– iyonlarının H3O+ iyonlarıyla birleşerek HCN ve H2O hâline dönme tepkimesi birbirinin tersi olduğundan bu tepkimelerin denklemleri çift yönlü okla gösterilerek tek bir tepkime denklemi şeklinde de yazılabilir. Bu denklemde yer alan dört madde asit ve baz diye ayrı ayrı işaretlenebilir. + – HCN(s) + H2O(suda) H3O (suda) + CN(suda) Asit Baz Asit Baz Bir baz, bir asidin protonunu kaybetmesiyle oluşuyorsa bu baza konjuge baz, bir asit bazın proton kazanmasıyla oluşuyorsa bu aside konjuge asit denir. Yukarıda denklemi verilen tepkimede HCN/ CN¯ çifti ile H2O/H3O+ çifti konjuge (eşlenik) asit-baz çiftleridir. Yukarıdaki tepkime denklemi incelenirse su ileri yöndeki tepkimede baz, geri yöndeki tepkimede asit gibi davranmaktadır. Bu durumu iki ayrı çözünme olayında tekrar inceleyelim. + − HF( g ) + H2O( s ) H3O( suda ) + F( suda ) + − NH3( g ) + H2O( s ) NH4( suda ) + OH( suda ) Su, HF asidin sulu çözeltide iyonlaşması sırasında baz gibi, baz özelliği gösteren NH3’ın suda iyonlaşması sırasında ise asit gibi davranmaktadır. Su gibi hem asit hem de baz gibi davranan maddelere amfoter maddeler denir. Al ve Zn gibi elementler en çok bilinen amfoter maddelerdir. Bunlar asitlere karşı baz, bazlara karşı asit davranışı gösterirler. 2Al(k ) + 6HCl( suda ) 2AlCl3( suda ) + 3H2( g ) 2Al(k ) + 6NaOH( suda ) 2Na 3 AlO3(k ) + 3H2( g ) Asit ve Bazların Değerliği Sulu çözeltisine proton veren maddeleri asit, proton alanları (diğer bir ifadeyle hidroksit iyonu verenleri) baz olarak tanımladık. HCl, H2SO4, H3PO4 gibi farklı sayıda protona sahip asitler, NaOH, Ba(OH)2, Al(OH)3 gibi farklı sayıda hidroksit iyonuna sahip bazlar bulunduğuna göre bunları farklı şekilde sınıflamamız gerekir. Asit ve bazları sınıflandırmanın bir yolu da sahip oldukları proton ya da hidroksit iyonu sayısını dikkate almak olmalıdır. Sulu çözeltide molekül başına bir proton veren asitlere bir değerli (monoprotik) asit denir. Proton veren CH3COOH gibi nötr bir molekül, NH+4 gibi bir katyon ya da HCO3̄ gibi bir anyon olabilir. Bir değerli bir asidi “HA” şeklinde genel bir formülle gösterirsek bu asidin ve bir değerli bir asit olan HCN’in suda iyonlaşma tepkimelerinin denklemleri şöyle gösterilebilir: + − HA + H2O H3O + A + − HCN + H2O H3O + CN Her molekül başına iki proton verebilen asitlere iki değerli (diprotik), ikiden fazla proton verenlere ise poliprotik asit denir. İki değerli asidi “H2A” şeklinde genel bir formülle gösterirsek bu asidin ve iki değerli bir asit olan H2CO3’in suda iyonlaşma tepkimelerinin denklemleri şöyle yazılabilir: 2− + H2 A + 2H2O 2H3O + A 2− + H2CO3 + 2H2O 2H3O + CO3 3. ÜNİTE: Çözeltilerde Denge 129 Üç değerli bir asit olan H3PO4’in suda iyonlaşma tepkimesi şöyledir: 3− + H3PO4 + 3H2O 3H3O + PO4 Sulu çözeltide molekül başına bir proton alan, bir başka ifadeyle molekül başına bir hidroksit iyonu verebilen bazlara bir değerli baz denir. Proton alan, NH3 gibi nötr bir molekül veya CN– gibi bir anyon ya da Cu(OH)(H2O)+3 gibi bir katyon olabilir. Bir bazı “A– ” genel formülü ile gösterirsek A– ve CN– iyonlarının, NH3 molekülünün suda iyonlaşma tepkimelerinin denklemlerini şöyle yazabiliriz: − A − + H2O HA + OH − CN− + H2O HCN + OH + − NH3 + H2O NH4 + OH Sulu çözeltide bir molekül başına iki proton alabilen ya da iki OH– iyonu verebilen bazlara iki değerli baz denir. Örneğin, CO32– iyonu sudan iki proton alabilir. CO32– iyonunun suda iyonlaşma tepkimesi şöyle yazılabilir: − CO23− + 2H2O H2CO3 + 2OH 4. Asit ve Baz Dengeleri Bütün bir değerli hidrojenli asitleri HA ile simgelediğimizi anımsarsak zayıf asitlerin genel iyonlaşma tepkimesi denklemini aşağıdaki gibi yazabiliriz: + − HA ( suda ) H( suda ) + A ( suda ) Suda çözünerek iyonlarına ayrılan asit ile iyonları arasında bir denge kurulur. Kurulan dengenin sabiti Kc yerine KA ile gösterilirse (KA asidin iyonlaşma sabitidir.) iyonlaşma tepkimesinin denge bağıntısı aşağıdaki gibi yazılabilir: KA = [H+ ] [ A − ] [HA ] Bir asidin iyonlaşma sabiti , su moleküllerine proton verme eğiliminin (asitlik kuvvetinin) bir ölçüsüdür. Dolayısıyla bir asidin KA’nin sayısal değeri 1 ya da 1’ den büyükse bu asit orta derecede kuvvetli, 10 ya da 10’dan büyükse çok kuvvetlidir ve çözeltisinde tamamen iyonlarına ayrılmıştır. Eğer KA’nin sayısal değeri 1’den küçük ise asit zayıftır. Bir değerli bir bazı B genel formülü ile simgelersek zayıf bazlar için iyonlaşma tepkimesinin denklemi aşağıdaki gibi yazılabilir: + − B ( suda ) + H2O( s ) BH( suda ) + OH( suda ) Suda çözünerek iyonlarına ayrılan baz ile iyonları arasında bir denge kurulur. İyonlaşma tepkimesinin denge bağıntısı da aşağıdaki gibi yazılabilir: KB = [BH+ ] [OH− ] (KB bazın iyonlaşma sabitidir.) [B ] Yukarıdaki denge bağıntılarından yararlanarak zayıf asit ve bazların çözeltilerindeki H+ ya da OH– iyonları derişimleri ile iyonlaşma yüzdeleri hesaplanabilir. Bazı asit ve bazların iyonlaşma denge sabitleri Tablo 3.2’de verilmiştir. İnceleyiniz. 130 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tablo 3.2: Bazı asit ve bazların 25 ˚C’taki iyonlaşma denge sabitleri İyonlaşma denge sabiti Asit İyonlaşma denge sabiti Baz HI 1,0 · 109 CH3NH2 4,4 · 10–4 HBr 1,0 · 108 (CH3)2NH 5,2 · 10–4 HCl 1,0 · 107 (CH3)3N 5,7 · 10–5 H2SO4 1,0 · 103 NH3 1,8 · 10–5 HNO3 22 C6H5NH2 4,3 · 10–10 H2SO3 1,3 · 10–2 N2H4 8,5 · 10–7 HSO–4 1,0 · 10–2 NH2OH 6,6 · 10–9 H3PO4 7,1 · 10–3 F– 1,5 · 10–11 HF 6,8 · 10–4 Cl– 1,0 · 10–21 HCOOH 2,0 · 10–4 Br– 1,0 · 10–22 CH3COOH 1,8 · 10–5 I– 1,0 · 10–23 H2CO3 4,3 · 10–7 ☞ÖRNEK : 1 25 ˚C sıcaklıkta 0,02 M’lık çözeltisinde [H+ ] = 2 · 10–3 olan HCOOH çözeltisinin bu sıcaklıkta iyonlaşma sabiti (KA) kaçtır? ✍ÇÖZÜM + − HCOOH( suda ) H( suda ) + HCOO( suda ) KA = [H+] = 2 · 10–3 mol/L ise – –3 [HCOO ] = 2 · 10 KA = mol/L ’dir. [H+ ] [ A − ] [HA ] KA = [H+ ] [HCOO– ] [HCOOH] 2 · 10−3 · 2 · 10−3 2 · 10−2 K A = 2 · 10−4 tür. ☞ÖRNEK : 2 HCOOH’in 25 ˚C’ta iyonlaşma sabiti KA = 2 · 10–4 tür. Aynı sıcaklıkta 1 L’sinde 0,23 g formik asit bulunan çözeltide; a. H+, HCOO¯ ve OH¯ iyon molar derişimleri nedir? b. Asidin iyonlaşma yüzdesi nedir? (MHCOOH : 46 g/mol) ✍ÇÖZÜM a.mHCOOH =0,23 g V =1 L MHCOOH=46 g/mol KA=2 · 10–4 M=? m M 0, 23 nHCOOH = 46 nHCOOH = 5 · 10−3 mol n= n V 5 · 10 −3 = 1 = 5 · 10−3 mol / L ’dir. M= MHCOOH MHCOOH HCOOH sudaki çözeltisinde aşağıdaki gibi iyonlaşır. Dengedeki iyon derişimlerinden herhangi birini X kabul edersek diğeri de X kadar olur. + – HCOOH(suda) HCOO(suda) + H(suda) 5 · 10 –3 M XM 3. ÜNİTE: Çözeltilerde Denge XM 131 KA = [HCOO− ] [H+ ] [HCOOH] KA = X2 [HA ] 2 . 10 −4 = X2 [H+]=[HCOO– ] = 1 · 10–3 mol/L 5 · 10−3 Ksu=[H+] [OH– ] 1 · 10–14=[1 · 10–3] [OH– ] X 2 = 1· 10−6 X = 1 · 10−3 mol / L’dir. [OH– ]=1 · 10–11 mol/L’dir. b. 5 · 10–3 mol HCOOH ’in 1 · 10–3 mol’ü iyonlaşırsa 100 mol HCOOH ’in X ––––––––––––––––––––––––––––––––––––––––––– –3 1 · 10 · 100 X = –––––––––––– 5 · 10–3 X = %20 ’si iyonlaşır. ☞ÖRNEK : 3 Metil amin (CH3NH2) baz özelliği gösteren organik bir bileşiktir. Sulu çözeltisinde %20’si iyonlaştığına göre 1 · 10–2 M’lık çözeltisinde; a. OH–, CH3NH+3 ve H+ iyonlarının molar derişimlerini, b. Metil aminin çözeltisinin hazırlandığı sıcaklıktaki iyonlaşma sabitini (KB) hesaplayınız. ✍ÇÖZÜM a. Metil amin sudaki çözeltisinde aşağıdaki gibi iyonlaşır: + – CH3NH2(s) + H2O(s) CH3NH 3(suda) + OH(suda) 1 · 10–2 MX MX M 100 M CH3NH2’in 20 M’ı iyonlaşırsa –2 1 · 10 M CH3NH2’in X ––––––––––––––––––––––––––––––––––––– 1 · 10–2 · 20 X = –––––––––– 100 X = 2 · 10–3 M’ı iyonlaşır. [OH– ] =[CH3NH+3] = 2 · 10–3 mol/L Ksu =[H+ ] [OH– ] 1 · 10–14= [H+ ] (2 · 10–3) [H+ ] =5 · 10–12 mol/L ’dir. b. K B = X2 [CH3NH2 ] KB = (2 · 10−3 )2 1· 10−2 K B = 4 · 10−4 ’ tür. Yukarıda ulaştığımız KA ve KB denge bağıntıları incelenirse asit çözeltisinde [H3O+]’nin büyük olması hâlinde asidin KA denge sabitinin de büyük olduğu, dolayısıyla asidin kuvvetli olacağı anlaşılır. Eğer asit zayıf ise [H3O+ ] ve KA küçük olacaktır. Bazik çözeltilerde ise [OH– ]’ne kadar büyükse bazın KB denge sabiti o kadar büyük olacak, dolayısıyla baz da o kadar kuvvetli olacaktır. Tersine [OH– ] küçük ise KB’nin sayısal değeri de o kadar küçük olacak, baz da zayıf olacaktır. 132 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Asit ve bazların zayıf ya da kuvvetli olmaları iyonlaşma dereceleri ile de açıklanabilir. Sulu çözeltilerinde HCl, HNO3 ve H2SO4 gibi asitler, yaklaşık olarak %100 oranında iyonlaştıklarından kuvvetli, yaklaşık olarak %1 oranında iyonlaşan HCN ve CH3COOH gibi asitler ise zayıf asit olarak nitelendirilir. Bu bağlamda yaklaşık olarak %100 oranında iyonlaşan NaOH ve KOH kuvvetli baz, yaklaşık olarak %1 oranında iyonlaşan NH4OH ise zayıf bazdır. Suda asit ya da baz çözündüğünde suyun amfoter özellik gösterdiğini öğrendiniz. Suyun amfoter özellik gösterdiği iki ayrı tepkimeyi ele alarak suyun iyonlaşma dengesi hakkındaki bilgilerimizi derinleştirelim. Bu amaçla bir HA asidinin ve eşlenik bazının (A–) sudaki tepkimelerini ele alalım ve bunların denge bağıntılarını yazalım. Tepkimeleri taraf tarafa toplayalım. + [H3O+ ] [ A − ] [HA ] + − HA + H2O H3O + A KA = − A − + H2O HA + OH KB = + − H2O + H2O H3O + OH K su = [H3O+ ] [OH− ] [HA ] [ OH− ] [A− ] Hatırlayacağınız gibi bir tepkime iki ya da daha fazla tepkimenin toplamı olarak yazılabiliyorsa toplam tepkimenin denge sabiti (örneğimizde Ksu), toplanan tepkimelerin denge sabitlerinin çarpımına (KA · KB) eşittir. O hâlde, K su = K A · K B ’ dir. Zayıf bir asit olan HCN için KA = 4 · 10–10 dur. Bu asidin eşlenik bazı olan CN– iyonunun sudaki iyonlaşma sabiti ise KB = 2,5 · 10–5 tir. HCN ve CN– iyonunun sudaki tepkimelerini yazıp taraf tarafa toplarsak bu toplamın suyun iyonlaşma dengesine eşit olduğunu görürüz. + – HCN( suda ) + H2O( s ) H3O( suda ) + CN( suda ) – + CN(–suda ) + H2O( s ) HCN( suda ) + OH( suda ) + – 2H2O( s ) H3O( suda ) + OH( suda ) K su = K A .K B olduğundan K su = [H3O+ ] [ CN– ] [ HCN ] K su = [H3O+ ] · [OH– ] · [ HCN ] [OH– ] [ CN– ] K su = 4 · 10 –10 · 2, 5 · 10 –5 K su = 1, 0 · 10 –14 olarak bulunur. 5. Asitlik - Bazlık Kuvveti Asit ve bazları iyonlaşma yüzdelerine ve denge sabitlerine göre zayıf ya da kuvvetli olarak sınıflandırdık. Ancak asit ve bazların kuvvetli ya da zayıf oluşları moleküllerindeki bağların sağlamlığına, oksijenli asitlerde merkez atomunun yükseltgenme basamağına ya da elektronegatifliğine bağlı olarak değişir. Dolayısıyla asit ve bazların kuvvetlilik sıralamasında bu etkenlerin dikkate alınması gerekir. ® Halojenler hidrojenle tepkimeye girip hidrojen halojenür bileşiklerini (HF, HCl, HBr, HI) oluşturur. Bu bileşikler 25 ˚C sıcaklık ve 1 atm basınç altında gaz hâlinde bulunur. Bu gazlar suda çözündüklerinde çözeltileri asit özelliği gösterir. Asit özelliği gösteren bu çözeltilere halojenür asitleri denir. HCl, HBr, HI sulu çözeltileri kuvvetli asit özelliği, HF’ün sulu çözeltisi ise zayıf asit özelliği gösterir. Bunun nedeni florür iyonu ile H2O molekülleri arasında hidrojen bağlarının varlığıdır. 3. ÜNİTE: Çözeltilerde Denge 133 Halojenli asitlerin hidrojenle yaptıkları bağların kuvveti H—F, H—Cl, H—Br, H—I sırasında azalır. Dolayısıyla asitlik kuvvetleri küçükten büyüğe HF < HCl < HBr < HI şeklinde sıralanır. Diğer bir ifadeyle halojenlerin oluşturduğu halojenür asitlerin asitlik kuvveti 7A grubunda yukarıdan aşağı doğru artar. Çünkü gruplarda atom çapı yukarıdan aşağı doğru artar. ® Klor, brom ve iyot HClO3, HBrO3 ve HIO3 gibi oksijenli asitlerde merkez atomu olarak yer alırlar. Bu elementler farklı yükseltgenme basamağı değerleri alabildiklerinden merkez atomu konumunda birden çok sayıda oksijensiz asit oluşturabilirler. Örneğin klor +1, +3, +5 ve +7 yükseltgenme basamağı değerlerini alarak sırasıyla HClO, HClO2, HClO3 ve HClO4 gibi oksijenli asitleri oluşturur. Bu asitlerin asitlik kuvveti de klorun yükseltgenme basamağı değeri arttıkça artar. Bu bağlamda HClO oldukça zayıf bir asit iken HClO4 kuvvetli bir asittir. Çünkü HClO4’te klorun yükseltgenme basamağı HClO’tekinden daha büyüktür. Bu asitlerin asitlik kuvvetli ile ters orantılı olarak konjuge bazlarının bazlık kuvveti değişir. Bu bağlamda zayıf asit HClO’ in konjuge bazı olan ClO– iyonunun sulu çözeltisi kuvvetli baz özelliği gösterir. Kuvvetli asit olan HClO4’in konjuge bazı olan ClO–4 iyonunun sulu çözeltisi ise zayıf baz özelliği gösterir. Diğer yandan HClO3, HBrO3, HIO3 gibi halojenlerin merkez atomu olarak yer aldığı oksijenli asitlerde merkez atomunun elektronegatifliği azaldıkça (7A grubunda yukarıdan aşağıya inildikçe elektronegatifliğin azaldığını hatırlayınız.) asitlik kuvvetleri artar. ® Aynı periyottaki elementlerden türeyen bazların bazlık kuvveti, bazı oluşturan elementin elektronegatifliği arttıkça azalır (Aynı periyotta soldan sağa gidildikçe elektronegatiflik arttığını hatırlayınız.). Periyodik cetvelin 3. sıra elementleri olan Na, Mg ve Al’ un oluşturduğu bazların bazlık kuvveti NaOH > Mg(OH)2 > Al(OH)3 şeklinde sıralanır. Periyodik cetvelde aynı grupta sıralanan elementlerin elektronegatifliği yukarıdan aşağıya doğru inildikçe azalır. Bu nedenle bu elementlerin oluşturdukları bazların bazlık kuvveti yukarıdan aşağıya doğru artar. Söz gelimi periyodik cetvelin IIA grubunda yukarıdan aşağıya doğru Be, Mg, Ca, Sr, Ba şeklinde sıralanan elementlerin oluşturdukları bazların bazlık kuvveti Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2 sırasında artar. Asitler ve bazlar yaşamsal olaylarda önemli görevler yapan maddeleridir (Resim 3.3). Yaşam çoğu kez onlarsız tatsız ve tuzsuzdur. Bununla beraber bu maddeler sağlık açısından önemli riskler taşır. Söz gelimi CH3COOH formülü ile gösterilen ve bir zayıf asit olan asetik asidin derişik sulu çözeltisi oldukça tehlikelidir. Dolayısıyla asit ve bazların sağlık açısın- Resim 3.3: Asit, baz içeren bazı maddeler dan zararlarını asitlik kuvvetleri ile ilişkilendirmek genel bir yanılgıdır ve doğru bir davranış değildir. 6. Hidroliz Her tuz çözeltisinin nötr özellik göstereceği şeklindeki genel bir yanılgı oldukça yaygındır. Ancak bazı tuzların çözeltileri asidik, bazılarınınki ise bazik özellik gösterir. Bu duruma tuza ait iyonlardan birinin su molekülleri ile etkileşmesi yol açar. 134 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bir tuzun iyonlarından birinin, su molekülleri ile H3O+ ya da OH– oluşturmak üzere etkileşmesine hidroliz denir. ® Kuvvetli asit ile kuvvetli bazın oluşturduğu tuzlar hidrolize uğramaz. HCl + NaOH → NaCl + H2O Kuvvetli asit Kuvvetli baz Nötr tuz Kuvvetli asit HCl ile kuvvetli baz NaOH’in tepkimesinden oluşan NaCl tuzu, sulu çözeltisinde aşağıdaki gibi iyonlarına ayrılır: NaCl(k) → Na+(suda) + Cl–(suda) NaCl çözeltisinde Na+ iyonu su ile etkileşerek NaOH, Cl– iyonları suyun H+ iyonu ile etkileşerek HCl oluşturamaz. Çünkü kuvvetli asidin konjuge bazı, zayıf baz ve kuvvetli bazın konjuge asidi zayıf asittir. Suyun nötr bir madde olduğu düşünülürse bu iyonlar su ile etkileşemeyeceklerinden sudaki iyon dengesi değişmez ve tuz çözeltisi nötr özellik gösterir. Bu durum kuvvetli asit, kuvvetli baz etkileşmesi sonunda sulu çözeltide oluşan Li+, Na+, K+, Cs+, Ca2+, Sr2+, Ba2+ gibi katyonların, Cl–, Br–, I–, NO–3, ClO–4, SO42– gibi anyonların çözeltilerinin neden nötr özellik gösterdiğini açıklar. ® Zayıf asit ile kuvvetli bazın oluşturduğu tuzlar bazik özellik gösterir ve su ile etkileşerek hidrolize uğrar. NaOH → CH3COONa + H2O CH3COOH + Zayıf asit Kuvvetli baz Bazik tuz Zayıf asit CH3COOH ile kuvvetli baz NaOH’in tepkimesinden oluşan CH3COONa (sodyum asetat) tuzu, sulu çözeltisinde aşağıdaki gibi iyonlarına ayrılır: – + CH3COONa(k) CH3COO(suda) + Na (suda) Na+ iyonu su ile etkileşmez. CH3COO– iyonu ise sudan proton alır. – CH3COO¯(suda) + H2O(s) CH3COOH(suda) + OH (suda) Ortam hidrolizle oluşan OH– iyonundan dolayı baziktir. Bu durum ortamda hidrolizle oluşan CH3COO –, F –, CN–, NO2–, CO32–, PO43– gibi anyonların sulu çözeltilerinin neden bazik özellik gösterdiklerini açıklar. ® Kuvvetli asit ile zayıf bazın oluşturduğu tuzlar asidik özellik gösterir ve su ile etkileşerek hidrolize uğrar. HCl + NH3 → NH4Cl Kuvvetli asit Zayıf baz Asidik tuz Kuvvetli asit HCl ile zayıf baz NH3’ın tepkimesinden oluşan NH4Cl tuzu, sulu çözeltisinde aşağıdaki gibi iyonlarına ayrılır: + – NH4Cl(k) NH 4(suda) + Cl(suda) Cl¯ iyonu sudan proton alarak HCl oluşturamaz. NH+4 iyonu su ile etkileşerek H3O+ iyonunu oluşturur. + NH+4(suda) + H2O(s) NH3(suda) + H3O (suda) Ortam hidrolizle oluşan H3O+ iyonundan dolayı asidiktir. Zn2+, Cu2+, Al3+, Fe3+ ve Cr3+ gibi bazı metal iyonlarının çapları küçük, iyon yükleri büyük olduğundan su moleküllerini kendilerine bağlayarak hidrat oluşturabilirler. Bu hidratlar da su ile etkileştiklerinde suya proton vererek hidroliz olurlar. 2+ + [Al(H2O)6]3+ [Al(H2O)5OH] (suda) + H3O (suda) (suda) + H2O(s) Metal katyonun su ile etkileşiminden oluşan H3O+ iyonundan dolayı ortam asidik özellik gösterir. Periyodik tablonun alkali ve toprak alkali metaller gruplarında yer alan Na ve Ca gibi elementlerin katyonları ise su ile etkileşerek hidroliz olmazlar. 3. ÜNİTE: Çözeltilerde Denge 135 7. Kuvvetli Asit ve Baz Çözeltilerinin pH Değerleri Kuvvetli asit ve bazların çözünmesi ile oluşan sulu çözeltilerde [H+] ya da [OH– ]’leri 1 · 10–6 M’dan oldukça büyüktür. Bu nedenle suyun otoiyonizasyonundan gelen [H+] ve [OH–] değerleri 1 · 10–6 M değerinden oldukça küçüktür. Bu yüzden pH değerleri hesaplanırken suyun otoiyonizasyonundan kaynaklanan H+ ve OH– iyon derişimleri ihmal edilir. Kuvvetli ve bir değerli asitler ya da bazlar suda çözünerek tamamen iyonlaştıklarından çözeltilerindeki derişimleri, oluşturdukları H+ ya da OH– iyon derişimlerine eşittir ( [H+] = [HA], [OH–] = [B] ). Bu nedenle bir değerli kuvvetli asit ya da baz çözeltilerinde denge tamamen iyon derişimleri yönüne kayar. ☞ÖRNEK : 4 5 · 10–4 mol HBr ile 500 mL çözelti hazırlanıyor. Bu çözelti için; a. H+ ve OH– iyonlarının derişimlerini, b. pH ve pOH değerlerini hesaplayınız. ✍ÇÖZÜM HBr suda çözünür ve çözeltisinde tamamen iyonlarına ayrılır. Bu nedenle asidin derişimi H+ iyonu derişimine eşittir. a. nHBr = 5 · 10–4 mol V=500 mL M=? n M= –– V 5 · 10–4 MHBr= –––––––– 5 · 10–1 MHBr= 1 · 10–3 M [H+ ]= 1 · 10–3 M Suyun iyonlaşma denge bağıntısında [H+] yerine konur. Ksu = [H+] [OH– ] 1 · 1014 = (1 · 10–3) [OH– ] 1 · 10–14 [OH– ] = –––––––– 1 · 10–3 [OH– ] = 1 · 10–11 M ’dır. pH ve pOH, H+ ve OH– iyonlarının derişimlerinin eksi logaritmasına eşittir. b. pH = –log [H+] pH= –log 1 · 10–3 ⇒ pH = 3 pOH= –log [OH– ] ⇒ pOH = – log 1 · 10–11 ⇒ pOH = 11’dir. ☞ÖRNEK : 5 0,56 g KOH ile hazırlanan 100 mL çözeltide; a. OH– ve H+ iyonlarının derişimlerini, b. Çözeltinin pOH ve pH değerini hesaplayınız. (MKOH : 56 g/mol) ✍ÇÖZÜM a. mKOH = 0,56 g V = 100 mL M=? m 0,56 n = –– ⇒ nKOH = –––– ⇒ nKOH = 0,01 mol’dür. M 56 136 ORTAÖĞRETİM KİMYA 11 DERS KİTABI KOH suda çözünmesi sırasında tamamen iyonlarına ayrıldığından KOH’ in sudaki çözeltisinin derişimi aynı zamanda OH– iyonu derişimine eşittir. KOH(k) → K+(suda) + OH–(suda) n 0,01 M = ––– ⇒ MKOH = –––– ⇒ MKOH = 0,1 mol/L V 0,1 ⇒ [OH– ] = 0,1 = 1 · 10–1 M ’dır. 1 · 10–14 + – –14 + –1 + Ksu = [H ] [OH ] ⇒ 1 · 10 = [H ] (1 · 10 ) ⇒ [H ] = –––––––– ⇒ [H+ ] = 1 · 10–3 M ’dır. 1 · 10–1 b. pH = –log [H+ ] ⇒ pH = –log 1 · 10–13 ⇒ pH = 13 pOH = –log [OH– ] ⇒ pOH = –log 1 · 10–1 ⇒ pOH = 1’dir. Örnek problemlerde görüldüğü gibi çözeltilerin pH değerinin artması ya da azalması ile çözeltinin asitlik ve bazlık özelliği değişir. Bir çözeltide; pH < 7 ise çözelti asidik özellik gösterir. pH = pOH = 7 ise çözelti nötrdür. pH > 7 ise çözelti bazik özellik gösterir. pH değerine göre ortamın asidik ya da bazik karakterleri Tablo 3.3’te verilmiştir. İnceleyiniz. Tablo 3.3: pH değerlerine göre asitlik ve bazlık karakterleri, bazı maddelerin pH değerleri 1M HCl Maden suyu Limon Portakal Domates İdrar Saf su Kan Kabartma tozu Deniz suyu Amonyum hidroksit 3. ÜNİTE: Çözeltilerde Denge 137 ☞ÖRNEK : 6 0,025 mol H2SO4’in suda çözünmesiyle oluşan 500 mL çözeltinin pH’si kaçtır? Sonucu yorumlayınız. ✍ÇÖZÜM n M = –– V 0,025 M = –––––– = 0,05 mol/L’dir. 0,5 H2SO4 iki değerli kuvvetli bir asittir. Sulu çözeltisinde tamamen iyonlaşır. İyonlaşma tepkimesi şöyledir: H2SO4(suda) → 2H+(suda) + SO2– 4(suda) 0,05 M 2 · 0,05 M + pH = –log [H ] pH = –log (2 · 0,05) pH = –log 1 · 10–1 pH = 1’dir. pH = 1 değeri, asidin kuvvetli olduğunu ve çözeltisinde tamamen iyonlarına ayrıştığını gösterir. ☞ÖRNEK : 7 5,55 gram Ca(OH)2’in suda çözünmesiyle 1500 mL çözelti oluşturuluyor. Çözeltinin pOH ve pH’sini hesaplayınız. Sonucu yorumlayınız. (Ca : 40, 0 : 16, H : 1) ✍ÇÖZÜM m n n = –– M = –– MV 5,55 0,075 n = –––– M = –––––– 74 1,5 n = 0,075 mol’dür. M = 0,05 mol/L’dir. Ca(OH)2 iki değerli kuvvetli bir bazdır. Sulu çözeltisinde tamamen iyonlaşır. İyonlaşma tepkime denklemi şöyledir: Ca(OH)2(k) → Ca2+(suda) + 2OH–(suda) 0,05 M 2 · 0,05 M – pOH=–log[OH ] pKsu= pH + pOH pOH=–log(2 · 0,05) 14= pH + 1 pOH=–log 1 · 10–1 pH= 14 – 1 pOH=1’dir. pH= 13 ’tür. pH = 13 değeri, bazın kuvvetli olduğunu ve çözeltisinde tamamen iyonlarına ayrıştığını gösterir. 8. Zayıf Asit ve Baz Çözeltilerinin pH Değerleri Zayıf asit ve bazların iyonlaşma dengelerini öğrendiniz. Zayıf asit ve bazların suda tamamen çözünmediklerini, dolayısıyla tamamen iyonlarına ayrışamadıklarını biliyorsunuz. Zayıf asit ve bazlar sulu 138 ORTAÖĞRETİM KİMYA 11 DERS KİTABI çözeltilerinde tamamen iyonlarına ayrışamadıklarından başlangıç derişimleri ile iyon derişimleri birbirinden farklıdır. Bu nedenle pH ve pOH değerlerini hesaplamak için denge derişimlerinden yararlanmak gerekir. Ancak bu arada zayıf asit ve bazın KA ya da KB değerleri 10–4 ile 10–9 arasında ve başlangıç derişimleri 1,0 ile 1 · 10–3 M arasında ise suyun otoiyonizasyonundan kaynaklanan H+ ve OH– iyonları derişiminin pH’ye etkisi olmadığı kabul edilir. Zayıf asit ve bazların ayrışma dengelerinde, ayrışmamış HA asidi veya B bazının derişimi, iyonlaşmanın düşük oranda olması hesaba katılarak başlangıçtaki derişime eşit kabul edilir. Zayıf asit ya da bazın denge bağıntısından yararlanarak H+ ya da OH– derişimleri hesaplanabilir. Zayıf asit için genel bir denge bağıntısını aşağıdaki gibi çıkarabiliriz: + − HA ( suda ) H( suda ) + A ( suda ) KA = [H+ ] [ A − ] dir. Denge derişiminde [H+ ] = [A– ] olduğundan; [HA ] KA = [H+ ] [H+ ] [HA ] KA = [H+ ]2 [HA ] [H+ ] = K A · [ A ] olur. Zayıf baz için de benzer genel bir denge bağıntısını aşağıdaki gibi yazabiliriz: + − B ( suda ) + H2O( s ) BH( suda ) + OH( suda ) KB = [BH+ ] [OH− ] dir. Denge derişiminde [OH– ] = [BH+ ] olduğundan; [B ] KB = [OH− ] [OH− ] [B ] KB = [OH− ]2 [B ] [OH− ] = K B · [B ] olur. ☞ÖRNEK : 8 CH3NH2 baz özelliği gösterir ve 25 ˚C sıcaklıkta KB = 4,4.10–4 tür. Bu sıcaklıkta 0,22 M’ lık CH3NH2 çözeltisinin pH’si kaçtır? ✍ÇÖZÜM + – CH3NH2( suda ) + H2O( suda ) CH3NH3( suda ) + OH( suda ) Başlangıç 0, 22 M Değişim –x Denge 0,22 – x KB = [CH3NH+3 ] — – · [OH ] [CH3 NH2 ] – x 0 4, 4 · 10 – 4 = x2 = 4,4 · 10–4 · 0,22 x2 ≈ 1 · 10–4 x = 1 · 10–2 M’dır. 3. ÜNİTE: Çözeltilerde Denge 0 +x +x x x x·x 0, 22 – x İhmal edilir. [x]= [OH–] [OH– ]= 1 · 10–2 M pOH = –log [OH– ] pOH = –log 1 · 10–2 pOH = 2 ise pH = 12’dir. 139 ☞ÖRNEK : 9 2,5 · 10–2 mol HCN suda tamamen çözünerek 100 mL çözelti hazırlanıyor. 25 ˚C sıcaklıkta HCN için KA = 4 · 10–10 olduğuna göre çözeltinin pH’si kaçtır? ✍ÇÖZÜM + – HCN( suda ) H( suda ) + CN( suda ) HCN’in başlangıç derişimi 1,0 ile 1 · 10–3 M değerleri arasındadır. Bu nedenle suyun otoiyonizasyon dengesinin pH’ye etkisi yoktur. n M = –– V [H+ ] = K A · [HA ] pH = − log [H+ ] 2,5 · 10–2 M = –––––––– 1 · 10–1 [H+ ] = 4 · 10−10 · 2, 5 · 10−1 pH = − log 1· 10−5 [H+ ] = 1·10–5 M ’dır. pH = 5’tir. M = 2,5 · 10–1 mol/L ’dir. Bir çözeltinin pH değeri biyolojik moleküllerin aktivitesini etkilediğinden laboratuvarlarda pH değerinin ölçümü büyük önem taşır. Örneğin, birçok bakteri türü, çok dar bir pH aralığında çoğalabilir. Bunun için bakteri kültürlerinin pH’sinin çok dikkatli bir şekilde ayarlanması gerekir. pH değerinin biyolojik bakımdan diğer bir önemi enzimlerin pH = 1 – 4 aralığında çalışabiliyor olmalarıyla ilgilidir. pH değeri organizma için yaşamsal önem taşır. Çünkü biyokimyasal tepkimelerin gerçekleşmesi için ortam pH’sinin belli bir oranda tutulması gerekir. pH değerinde küçük bir değişme, biyokimyasal tepkimelerin seyrini değiştirir ve olumsuz sonuçlara yol açabilir. Örneğin, insan kanının pH’si 7,4’tür. Kanın pH’sinin 7,4’ten aşağı inmesi ya da 7,8’in üzerine çıkması ölüme neden olur. Laboratuvarlarda çözeltilerin pH değerleri pH metre denilen aygıtlar (Resim 3.4), renk indikatörleri ya da üniversal pH kâğıtları (Resim 3.5) ile belirlenir. Renk indikatörleri zayıf asit ya da baz oldukları için ortamın H+ derişimine karşı çok duyarlıdır. Bu yüzden renk indikatörleri belirli pH aralığında renk değiştirir (Resim 3.6). Örneğin, metil oranj ve metil kırmızısı asit bölgesinde, fenolftalein ve alizarin sarısı baz bölgesinde renk değiştirir. Asit Resim 3.4: Çözeltilerin asitlik ve bazlık derecesini gösteren pH metreler pH 8,2 pH 10 Fenolftalein Resim 3.5: Üniversal pH kâğıdı 140 Baz pH 6,0 pH 7,6 Bromtimol mavisi Resim 3.6: Fenolftalein, bromtimol mavisi indikatörleri ve değişik pH aralıklarında renk değişimleri ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tablo 3.4’te bazı renk indikatörleri ve renk değişimi için pH aralıkları verilmiştir. İnceleyiniz. Tablo 3.4 : Farklı pH değerlerinde bazı asit-baz indikatörlerin renk değişim aralıkları İndikatör Asitte Bazda pH aralığı Timol mavisi Kırmızı Sarı 1,2 - 2,8 Bromfenol mavisi Sarı Mor 3,0 - 4,6 Metil oranj Turuncu Sarı 3,2 - 4,4 Metil kırmızısı Kırmızı Sarı 4,8 - 6,0 Klorofenol mavisi Sarı Kırmızı 4,8 - 6,4 Bromtimol mavisi Sarı Mavi 6,0 - 7,6 Kresol kırmızısı Sarı Kırmızı 7,2 - 8,8 Fenolftalein Renksiz Pembe 8,2 - 10, 0 Metil oranj indikatörünün rengi pH’nin 4’ten yüksek olduğu çözeltilerde sarı, 4’ten düşük olduğu çözeltilerde ise turuncudur. Benzer şekilde fenolftalein indikatörü pH’sinin 8’den küçük çözeltilerde renksiz, 10’dan yüksek olduğu çözeltilerde pembedir. Ortamın asitlik, bazlık derecesini ölçmede kullanılan üniversal pH kâğıtları ortamın pH’sine göre renk alır. Bu renkler renk skalasındaki renklerle karşılaştırılarak ortamın pH değeri hakkında bilgi verir. Söz gelimi pH kâğıtları idrarın pH’sini ölçmede kullanılırsa asidik idrar pH kâğıdının rengini sarıya çevirir. Bu da ciddi bir rahatsızlığa işaret eder. Resim 3.7’de pH kâğıdı ve renk karşılaştırma skalası verilmiştir. Resim 3.7: pH kâğıdı ve renk karşılaştırma skalası pH ÖLÇME YÖNTEMLERİ Sulu çözeltilerin pH’si genellikle bir boyar madde olan ve ortamın H+ iyonu derişimini OKUMA METNİ değiştiren indikatör yardımıyla (klorometrik yöntemle) ölçülebilir. İndikatörün renk değiştirdiği noktaya eş değerlik noktası ya da dönüm noktası denir. 3. ÜNİTE: Çözeltilerde Denge 141 pH ve renk değişim aralıkları İndikatör adı Metil mavisi Timol mavisi (Asidik) Bromfenol mavisi Metil oranj Bromkresol yeşili Metil kırmızısı Bromtimol mavisi Timol mavisi (Bazik) Fenolftalein Alizarin sarısı Sarı Mor Kırmızı Sarı Sarı Mavi Turuncu Sarı Mavi Sarı Kırmızı Sarı Sarı Mavi Mavi Sarı Pembe Renksiz Sarı Kırmızı Bitkilerde pek çok doğal indikatör vardır. Örneğin, kırmızı gelinciklerin ve mavi mısır çiçeğinin renkleri aynı bileşikten ileri gelir. Bu iki bitkide bitki özlerinin pH’leri farklıdır. Yine ortancaların rengi de bitki özünün asitliği ile ilgilidir. Bitkinin yetiştiği toprağın asitliği ayarlanarak ortanca çiçeğinin rengi değiştirilebilir. Toprağı asidik olan yörelerde yetişen ortancalar mavi renklidir. Kireçli topraklarda yetişen ortancaların renkleri ise pembedir. Sulu çözeltilerin pH’si, elektrometrik yöntem denen iki elektrot arasındaki potansiyel farkının bir galvonometre ile ölçülmesi esasına dayanan yöntemle daha hassas olarak ölçülebilir. Bu tür ölçüm araçları pH metre olarak adlandırılır. Yazarlar tarafından düzenlenmiştir. 142 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Siz de 2. etkinliği yaparak değişik çözeltilerin pH değerlerini belirleyiniz. 2. ETKİNLİK: KİM HANGİ RENGE BOYADI? Neler Gerekli? Güvenliğiniz için ❏ Sirke ❏ Sabunlu su ❏ Saf su ❏ Limon suyu ❏ Makas ❏ Maden suyu ❏ Gazoz ❏ Yağmur suyu ❏ 0,1 M NaOH çözeltisi ❏ pH kâğıdı ❏ Domates suyu ❏ Beherglas (100 mL) ❏ Kireç çözücü ❏ Fırın temizleyici ❏ 0,1 M HCl çözeltisi Nasıl Yapacaksınız? 3 pH kâğıdından 2-3 cm’lik parçalar kesiniz. Kestiğiniz bu parçaları yukarıda sayılan gereçlere ya da bulabildiğiniz değişik çözeltilere daldırınız. Her defasında pH kâğıdının aldığı rengi belirleyiniz. 3 pH kâğıdının aldığı rengi renk skalasındaki renklerle karşılaştırınız. Çözeltinin asitlik ya da bazlık derecesini belirleyiniz. Etkinlik Sonu Soruları 1. pH kâğıdı kullanarak belirlediğiniz renklerin farklı olması neyi gösterir? 9. Nötrleşme Tepkimeleri Ortamın pH’si Asitler, bazlar ile tepkimeye girdiği zaman su ve bu su içinde çözünen iyonik bir bileşik oluşturur. Bu iyonik bileşiğe genellikle tuz adı verilir. Eğer eşit miktarda H+ ve OH¯ iyonları tepkimeye girerse tepkime sonrası oluşan çözelti asidik ya da bazik özellik göstermez. Bu durumda ortam nötrdür. Bu yüzden nötrleşme tepkimeleri, asidik ya da bazik çözeltilerin genellikle nötr bir çözeltiye dönüştüğü tepkimelerdir. Ancak ortamda asit ya da bazın fazlası varsa nötrleşme sonrası ortam asidik ya da bazik özellik gösterir. Grafik 3.1’de kuvvetli bir asit olan HCl ile kuvvetli bir baz olan NaOH’ in nötralleşmesi verilmiştir. Başlangıçta ortamda asit vardır ve pH < 7’dir. Nötrleşme anında pH = 7’dir. Nötrleşme sonrası ise ortamda NaOH’in fazlası bulunduğundan pH > 7’dir. 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 Fenolftalein indikatörü Nötrleşme noktası Metil kırmızısı indikatörü 10 20 30 40 50 60 70 80 Eklenen NaOH hacmi (mL) Grafik 3.1: NaOH ile HCl’in nötrleşme tepkimesi grafiği 3. ÜNİTE: Çözeltilerde Denge 143 Eşit değerlikli asit ve bazların tam nötrleşme tepkimelerinde eşit molleri tüketilir. Bir değerli asit Bir değerli baz Tuz HNO3 + NaOH → NaNO3+ H2O 1 mol 1 mol Değerlikleri farklı asit ve bazların tepkimelerinde, asit ve bazın değerliklerinin en küçük ortak katını sağlayacak mol sayılarında asit ve baz tüketilir. İki değerli asit Bir değerli baz Tuz H2SO4 + 2KOH 1 mol → K2SO4 + 2H2O 2 mol Üç değerli asit İki değerli baz Tuz 2H3PO4 + 3Ca(OH)2 2 mol → Ca3(PO4)2 + 6H2O 3 mol Şimdi 3. etkinliği yapınız. 3. ETKİNLİK: NÖTRALLEŞIYORUM Neler Gerekli? ❏Üçayak ❏ Büret (50 mL) ❏ Bunzen kıskacı ❏ pH kâğıdı ❏ Destek çubuğu ❏ Bağlama parçası ❏ Erlenmayer (250 mL) ❏ 0,1 M HCl çözeltisi ❏ 0,1 M NaOH çözeltisi ❏ Dereceli silindir (50 mL) Güvenliğiniz İçin ❏ Bromtimol mavisi indikatörü* ❏ Damlalık ❏ Saf su Nasıl Yapacaksınız? 3 Erlenmayere 50 mL HCl çözeltisi koyunuz. Üzerine 1-2 damla bromtimol mavisi damlatınız. 3 Bürete 50 mL NaOH çözeltisi koyunuz. Resimdeki etkinlik düzeneğini kurunuz. 3 Bir elinizle büretin musluğunu kullanarak NaOH çözeltisini damla damla HCl çözeltisine ekleyiniz. Bu arada diğer elinizle erlenmayeri sık sık çalkalayınız. (Bu işlemler esnasında erlenmayerde önce sarı-mavi renk oluşur, sonra kaybolur.) 3 Renk kalıcı oluncaya kadar damla damla NaOH çözeltisi eklemeye devam ediniz. Renk kalıcı olduğu anda büretin musluğunu kapatınız. 144 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3 pH kâğıdını erlenmayerdeki çözeltiye daldırarak gözlemlerinizi not ediniz. 3 Saf suya pH kâğıdını daldırınız ve pH’sini not alınız. Etkinlik Sonu Soruları 1. pH kâğıdını çözeltiye ve saf suya daldırdığınızda ne gözlemlediniz? 2. Gerçekleştirdiğiniz tepkimenin türü hakkında ne söyleyebilirsiniz? Açıklayınız. –––––––––––––––––––––– * İndikatörlerin önemli bir kullanım alanı da çözeltilerin pH’sini belirlemektir. Bromtimol mavisi indikatörü pH 6,0 ile 7,6 arasında renk değiştirir. Yaptığınız etkinlikte büretin musluğunu açarak içindeki baz çözeltisini erlenmayerdeki asit çözeltisine damla damla ilave ettiniz. Etkinlikte yaptığınız gibi bir çözeltinin diğer bir çözelti üzerine dikkatli ve kontrollü bir şekilde ilave edilmesiyle oluşturulan tepkimeye titrasyon adı verilir. Etkinlikte erlenmayere koyduğunuz indikatörün (brom timol mavisi) renginin önce sarı-maviye döndüğünü daha sonra bu rengin kalıcı hâle geldiğini, bu noktada pH’nin 7 olduğunu belirlemiş olmalısınız. Rengin kalıcı hâle geldiği noktaya titrasyonun eş değerlik noktası denir. Diğer bir ifadeyle bir nötralleşme tepkimesinin eş değerlik noktası hem asit hem de bazın tükendiği yani hiçbirinin ortamda kalmadığı noktadır. Kuvvetli asit ve bazların eş değer miktarlarının karıştırılması hâlinde tepkime sonrası oluşan çözeltinin pH’sinin 7 ya da 7’ye çok yakın olması ortamın nötr ya da nötre çok yakın olduğunu gösterir. Bu durum kuvvetli asit ve bazın tepkimesi ile oluşan tuzun iyonlarının ortamın pH’sini etkilemediğini yani suyla tepkime vermediğini kanıtlar. Yaptığınız etkinlikte titrasyon tepkimesinden yararlanarak kuvvetli asit ve bazların eş değerlik noktalarını deneysel olarak belirlediniz. Şimdi zayıf bir asitle kuvvetli bir bazı tepkimeye sokacağınız dördüncü etkinliği yapınız. 4. ETKİNLİK: KİM DAHA KUVVETLİ? Neler Gerekli? ❏ Büret (50 mL) ❏ Bağlama parçası ❏ Erlenmayer (250 mL) ❏ pH kâğıdı ❏ Fenolftalein çözeltisi ❏Üçayak ❏ Dereceli silindir (50 mL) ❏ Destek çubuğu ❏ 0,1 M NaOH çözeltisi ❏ Bunzen kıskacı Güvenliğiniz İçin ❏ 0,1 M CH3COOH çözeltisi Nasıl Yapacaksınız? 3 Erlenmayere 40 mL 0,1 M CH3COOH çözeltisi koyunuz üzerine 3-5 damla fenolftalein damlatınız. 3 Bürete 50 mL 0,1 M NaOH çözeltisini dikkatlice doldurunuz ve resimdeki etkinlik düzeneğini kurunuz. 3 Bir elinizle büretin musluğunu kullanarak NaOH çözeltisini erlenmayerdeki CH3COOH çözeltisine damla damla ekleyiniz. Bu arada diğer elinizle erlenmayeri yavaş yavaş çalkalayınız ve oluşan pembe rengin kayboluşunu izleyiniz. 3. ÜNİTE: Çözeltilerde Denge 145 3 Renk kalıcı oluncaya kadar damla damla NaOH çözeltisi eklemeye devam ediniz. 3 Renk kalıcı olduğu anda bürette kalan NaOH çözeltisi seviyesini belirleyiniz ve kullandığınız NaOH çözeltisinin hacmini bulunuz. 3 Erlenmayerdeki çözeltinin pH değerini pH kâğıdı ile ölçünüz. Etkinlik Sonu Soruları 1. Titrasyon sonucu oluşan çözeltinin pH değeri nedir? 2. Ölçtüğünüz pH değeri neyi gösterir? Yaptığınız etkinlikte eş değer miktar- pH larda NaOH ve CH3COOH çözeltileri kullan- 14 mış olmanıza rağmen ortamın pH’sini 7’den 12 büyük olarak belirlemiş olmalısınız. pH değerini 7’den büyük belirlemeniz ortamın ba- 10 zik özellik gösterdiğini kanıtlar. Bu durum eş 8,0 değer miktarlarda karıştırdığınız CH3COOH 6,0 ile NaOH çözeltilerinin oluşturduğu sodyum asetat (CH3COONa) tuzu iyonlarının su ile etkileşerek hidrolize uğradığını gösterir. Bu Dönüm noktası 4,0 2,0 tepkimeye ait NaOH çözeltisi hacmi-pH gra0 fiği Grafik 3.2’deki gibidir. 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 Zayıf asitler/bazlar ile kuvvetli bazla- NaOH çözeltisinin hacmi (mL) rın/asitlerin eş değer miktarları karıştırıldı- Grafik 3.2: NaOH ile CH3COOH’in nötrleşme tepkimesi grafiği ğında pH = 7 olacağı yanılgısı oldukça yay- gındır. Ancak eş değerlik noktasının nötral nokta anlamına gelmediği açıktır. Çünkü kuvvetli baz/asit, zayıf asit/baz etkileşmeleri nötrleşme tepkimeleri olmakla beraber bu tepkimelerde oluşan tuzlar su ile etkileşerek hidrolize uğrar. Bu yüzden ortam bazik ya da asidik özellik gösterir. Dolayısıyla ortamın pH’si 7’den büyük ya da 7’ den küçük ölçülür. Örneğin, kuvvetli bir asit olan HNO3 ile zayıf bir baz olan NH3’ın eş değer miktarları karıştırıldığında nötrleşme ürünü olarak H2O ve NH4NO3 tuzu oluşur. HNO3(suda) + NH4OH(suda) → NH4NO3(suda) + H2O(s) Oluşan NH4NO3 tuzu ortamda iyonlarına ayrılır. NH4NO3(suda) → NH+4(suda) + NO–3(suda) Bu iyonlardan NH+4 iyonu su ile etkileşerek hidrolize uğrar ve ortamı asidik hâle getirir. Ortamın pH’si 7’ den küçük ölçülür. Eğer kuvvetli baz ile zayıf asit eş değer miktarlarda tepkimeye sokulursa 146 ORTAÖĞRETİM KİMYA 11 DERS KİTABI dönüm noktasında pH değeri 7’den büyük ölçülür. Çünkü bu kez su ile zayıf asidin anyonu etkileşerek hidrolize uğrar ve ortam bazik özellik gösterir. 10. Tampon Çözeltiler Zayıf bir asidin sulu çözeltisinde iyonlaşma tepkimesinin denklemi şöyledir: + HA + H2O H3O + A¯ Asit Asitlerin KA değeri belirli sıcaklıkta sabittir. Ancak, denge durumunda iyonlardan birinin derişimi artarsa Le Chatelier İlkesi gereğince bu iyonun derişimini azaltmak için denge, girenler lehine bozulur. Bunun sonucu olarak diğer iyonun derişimi de azalır. Denge hâlinde tepkime kabına tepkimede yer alan iyonlardan birinin eklenmesiyle dengenin bozulduğunu anımsayınız. Yukarıda örnek verilen HA zayıf asidinin iyonlaşma tepkimesinin denge durumunda ortama A¯ ya da H3O+ iyonu eklenirse denge bozulur. Örneğin, zayıf asit olan asetik asit çözeltisine sodyum asetat tuzu eklenirse çözeltinin asitliği azalır. Aynı şekilde zayıf bir baz çözeltisine, bu bazın kuvvetli asitle tepkimesinden oluşan tuzu eklenirse çözeltinin bazikliği azalır. Örneğin, amonyak çözeltisine amonyum klorür tuzu eklenirse çözeltinin bazikliği azalır. Bu şekilde hazırlanarak ortamın [H+]’ni sabit bir değerde tutan çözeltilere tampon çözeltiler denir. Daha açık bir ifadeyle bir zayıf asit ve onun tuzunu ya da bir zayıf baz ve onun tuzunu içeren çözeltiler tampon çözeltilerdir. Zayıf asit olan CH3COOH’in kuvvetli baz NaOH ile oluşturduğu çözeltide CH3COO¯ iyonları bulunur. Şimdi CH3COO¯ iyonlarının bulunduğu bir çözeltiye az miktarda kuvvetli bir asit eklediğimizi varsayalım. Bu durumda CH3COOH’in eşlenik bazı olan CH3COO¯ iyonu eşlenik asidi (CH3COOH) hâline gelir. CH3COO–(suda) + H+(suda) CH3COOH(suda) Bu arada ortamda [CH3COO¯ ] biraz azalırken [CH3COOH] biraz artar. Dolayısıyla konjuge asidin konjuge baza oranı 1’den çok az büyük olduğundan [H+] ve pH hemen hemen hiç değişmez. Yani tampon çözelti az miktarda kuvvetli asit eklenmesinden ileri gelen pH değişimine direnç gösterir. Bu kez yukarıdaki denge tepkimesinde ortama bir baz eklediğimizi varsayalım. – CH3COOH(suda) + OH–(suda) CH3COO(suda) + H2O(s) Bu durumda [CH3COOH] biraz azalırken [CH3COO¯ ] biraz artar. Zayıf asidin konjuge bazına oranı 1’den küçük olduğundan [OH– ] ve pH hemen hemen hiç değişmez. Yani tampon çözelti az miktarda kuvvetli baz eklenmesinden ileri gelen pH değişimine direnç gösterir. Canlı vücudunda tampon etkiye CO2 boğulmaları örnek verilebilir. Bildiğiniz gibi CO2 zehirli bir gaz değildir, ancak solunumu engellediğinden ölüme neden olur. Aşırı solunan CO2 kan plazmasında çözünerek H2CO3 hâline dönüşür. H2CO3 kan plazmasında aşağıda gösterildiği gibi iyonlaşarak dengeye ulaşır: + – H2CO3(suda) HCO3(suda) + H (suda) Dengedeki sisteme kuvvetli bir asit ilavesi ile [H+] artırılarak tepkimenin geriye doğru yürümesi sağlanır. Ancak pH pek değişmez. H2CO3 kararsız olduğu için parçalanarak CO2 ve H2O oluşturur. Bu yolla oluşan CO2 vücuttan solunum yoluyla atılır. Tampon etki tüm karbonat ve karbon dioksit vücuttan atılıncaya kadar devam eder. H2CO3 CO2 + H2O Doğada asit yağmurlarının, deniz ve göllerde yaşayan canlılar için oluşturduğu tehdit, deniz ve göllerdeki tampon sistemler aracılığıyla giderilir. 3. ÜNİTE: Çözeltilerde Denge 147 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Nötrleşme, titrasyon, hidroliz ve tampon çözeltisi terimlerini açıklayınız. 2. Aşağıdaki denklemlerde konjuge asit - baz çiftlerini gösteriniz. + – a.H2SO4(s) + H2O(s) H3O (suda) + HSO4(suda) + – b. HCN(s) + H2O(s) H3O (suda) + CN(suda) + – c.C6H5NH2(k) + H2O(s) C6H5NH 3(suda) + OH(suda) 3. Aşağıdaki tabloda bazı kuvvetli asit ve baz çözeltilerinin suda tamamen iyonlarına ayrıldığı varsayılan çözeltileri ve çözelti derişimleri verilmiştir. Buna göre tabloyu doldurunuz. Çözelti türü Çözelti derişimi [M] a. HNO3 0,010 b. Ca(OH)2 0,0050 c. H2SO4 0,050 ç. KOH 0,001 [H+ ] pH [OH – ] pOH 4. pH’si 12 olan bir çözelti hazırlamak için 2 L suda kaç g NaOH çözülmelidir? (MNaOH : 40 g/mol) 5. 7,3 g HCl kullanılarak 20 L çözelti hazırlanıyor. Çözeltinin pH’si kaç olur? (MHCl : 36,5 g/mol) 6. Bir değerli asidin 0,01 mol’ünün çözünmesiyle oluşan 100 mL çözeltide 2 · 10–6 mol H+ iyonu belirlendiğine göre çözeltinin hazırlandığı sıcaklıkta asidin iyonlaşma sabitinin değeri kaçtır? 7. 4,6 g formik asidin (HCOOH) çözünmesiyle oluşan 200 mL çözeltide pOH = 12’dir. Buna göre formik asidin hazırlandığı sıcaklıkta iyonlaşma sabiti kaçtır? (MHCOOH : 46 g/mol) 8. Kuvvetli bir asit olan H2SO4 ile zayıf bir baz olan NH3OH’in eş değer miktarları karıştırıldığında ortamın pH’sinin ne olması beklenir? Neden? pH değeri 14 12 9. Yandaki grafikte bir değerlikli A ve B gibi iki aside ait pH değerleri 10 ve nötrleşmede kullanılan NaOH hacmine ilişkin titrasyon eğrileri 8 verilmiştir. Grafiğe göre; 6 a. Hangi asit daha kuvvetlidir? 4 b. Herbirinin yaklaşık eş değerlik (dönüm) noktası kaçtır? c. Her iki asit aynı derişimli NaOH bazı ile nötrleştirildiği hâlde A B 2 0 titrasyon eğrilerinin farklı olmasını nasıl açıklarsınız? 10 20 30 40 50 60 NaOH hacmi (mL) B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Kuvvetli asit karşısında baz, kuvvetli baz karşısında asit gibi davranan (…) maddelere “amfoter madde” denir. 2. Sarkıt ve dikitlerin oluşumunda Ca(HCO3)2 çözeltisi etkilidir. (…) 3. Zn(OH)2 hem kuvvetli asitlerde hem de kuvvetli bazlarda çözünür. (…) 148 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 4. Asit ve bazların eşit hacim ve derişimlerdeki tepkimelerinde ortamın pH’si daima 7’dir. (…) 5. NH+4 / NH3 konjuge asit baz çiftine örnektir. (…) 6. %25 oranında iyonlaşan bazların çözeltileri kuvvetli baziktir. (…) 7. Karbonik asit karbon dioksidin sudaki çözeltisidir. (…) 8. Kuvvetli asit ve bazların sadece anyonları hidroliz olur. (…) 9. [H+] = 1 · 10–4 M olan portakal suyunun pH değeri 10’dur. (…) 10. 0,1 M KOH çözeltisinin pH si 0,1 M Ca(OH)2 çözeltisininkinden daha büyüktür. (…) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. + – 1.C6H5NH2(s) + H2O(s) C6H5NH 3(suda) + OH(suda) Yukarıdaki tepkimede asit özelliği gösteren çift aşağıdakilerden hangisidir? A) C6H5NH+3 – OH¯ B) H2O – OH– D) C6H5NH2 – OH¯ E) C6H5NH2 – C6H5NH+3 C) C6H5NH+3 – H2O 2. Oda sıcaklığındaki sulu bir çözelti için aşağıdakilerden hangisi doğrudur? A) pH > 7 ise çözelti asidiktir. B) pOH > 7 ise çözelti baziktir. C) [H+ ] > [OH] ise pH > 7’dir. D) [OH¯ ] > 10–7 ise pH > 7’dir. E) Mavi turnusolu kırmızıya çevirirse bazdır. 3. Aşağıda pH değerleri verilen çözeltilerden hangisinin hidrojen iyonu derişimi en yüksektir? A) pH = 0 B) pH = 3 C) pH = 7 D) pH = 10 E) pH = 14 4. Bir su birikintisinin pH’si 9 olarak belirleniyor. Sonra su birikintisinin hacmi su eklenerek 1000 katına çıkarılıyor. Su birikintisinin yeni pH’si aşağıdakilerden hangisidir? A) 5 B) 6 C) 7 D) 9 E) 12 5. Derişimleri aynı olan asit ve bazların eşit hacimli çözeltileri aşağıda gösterildiği şekilde karıştırılıyor. Karışım ––––––– I. Zayıf asit + Kuvvetli baz Ortamın pH değeri ––––––––––––––––– pH = 12 II. Kuvvetli asit + Zayıf baz pH = 3 III. Kuvvetli asit + Kuvvetli baz pH = 7 Oluşan çözeltiler için yukarıda sıralananlardan hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II 3. ÜNİTE: Çözeltilerde Denge C) I ve II D) II ve III E) I, II ve III 149 ÇÖZÜNÜRLÜK DENGELERİ BÖLÜM İÇERİĞİ 1.Çözünme 2. Çözünme-Çökelme Dengesi Yukarıdaki fotoğraf Tokat ilimizin sınırları içindeki Ballıca mağarasından bir kesiti göstermektedir. Fotoğraftaki kesitte binlerce yılda oluşmuş dikit ve sarkıtlar dikkat çekicidir. Dikit ve sarkıtların nasıl oluştuklarını hiç merak ettiniz mi? Dikit ve sarkıtların oluşumu ile evinizde kullandığınız çaydanlığın dibinde tortu oluşması arasında bir benzerlik kurulabilir mi? Denizli ilimizin sınırları içindeki Pamukkale travertenleri nasıl oluşmuş olabilir? Bu soruların yanıtlarını bölüm konuları arasında bulacaksınız. 150 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. Çözünme 9. sınıf kimya derslerinde nitel anlamda çözünme ve çözünürlük kavramlarını, 10. sınıf kimya derslerinde ise derişim kavramını öğrenmiştiniz. Su içine bir miktar yemek tuzu atılarak (Resim 3.8) karıştırıldığında, yemek tuzu gözle görülemeyecek kadar küçük tanecikler hâlinde suyun içinde dağılır. Yemek tuzunun dağılımı suyun her yerinde aynı olup bu dağılım homojendir. İki maddenin birbiri içinde homojen bir şekilde dağılmasıyla oluşan karışımlara çözelti, çözeltinin hâlini belirleyen bileşene çözücü, çözeltide daha az bulunan bileşene ise çözünen denildiğini biliyorsunuz. Bir maddenin diğer bir madde içinde gözle görülemeyecek kadar küçük tanecikler (atomlar, moleküller ya da iyonlar) hâlinde homojen olarak dağılması olayına da çözünme denir. NaCl’ün suda çözünmesi olayında H2O moleküllerindeki oksijen atomlarıyla NaCl’deki Na+ iyonları etkileşir ve Na+ iyonları H2O içinde dağılır. Aynı zamanda H2O moleküllerindeki hidrojen atomları da Cl – iyonlarıyla etkileşir ve Cl– iyonları H2O içinde dağılır. Çözeltideki Na+ ve Cl – iyonlarının etrafı H2O molekülleriyle sarılarak bu iyonların tekrar NaCl’ü oluşturması engellenir. Böylece NaCl’ün H2O içinde çözünmesi gerçekleşmiş olur (Şekil 3.1). Resim 3.8: Yemek tuzu çözeltisinin hazırlanışı + : Na+ iyonu – + – – + – + – + + – + – + – – + + – + + – – + – – + – + – + + – + – + – – + – – : Cl– iyonu – : Su molekülü + Şekil 3.1: NaCl’ün suda çözünmesinin model gösterimi Şimdi 5. etkinliği yapınız. 5. ETKİNLİK: KAYA TUZUNA NE OLDU? Neler Gerekli? ❏ Su ❏ Kaya tuzu ❏ Eşit kollu terazi ❏ Saat ❏ Tartım takımı ❏ Beherglas (250 mL) Güvenliğiniz için Nasıl Yapacaksınız? 3 Terazide 50 gram kadar kristal hâlde kaya tuzunu tartınız. Mümkünse tek parça kaya tuzu seçiniz. 3. ÜNİTE: Çözeltilerde Denge 151 3 Kaya tuzunu beherglasa koyup üzerine beherglasın yarıdan fazlasına kadar su doldurunuz. 3 1 saat kadar kaya tuzu kristalinde meydana gelen değişmeleri gözlemleyiniz. 3 Başlangıçtaki kristal tuz kütlesi ile etkinlik süresi sonundaki tortu tuz kütlesini karşılaştırmaya çalışınız. Etkinlik Sonu Soruları 1. Kaya tuzu üzerine su döktüğünüzde kristal yapısında bir değişiklik oldu mu? Sonucu nasıl yorumlarsınız? 2. Kaya tuzu suda tamamen çözündü mü? Sonucu nasıl açıklarsınız? Belirli sıcaklık ve basınçta 100 g suda çözünen madde miktarına çözünürlük denildiğini, biriminin g çözünen / 100 g çözücü şeklinde ifade edildiğini 9 ve 10. sınıf kimya derslerinde öğrenmiştiniz. Yaptığınız etkinlikte kaya tuzunun kristal yapısının bozulması, tuzun su içinde çözündüğünü gösterir. Çözünme olayında bir süre sonra oluşan tortunun kütlesinin değişmemesi, çözünme olayının tamamlandığına yani sistemde çözücü ile çözünen arasında bir denge kurulduğuna işaret eder. Doğadaki olaylar belirli yönlerde kendiliğinden oluşur ve bu oluşum sırasında olaylar enerjide en aza, düzensizlikte en çoğa gitme eğilimindedir. Çünkü en çok düzensiz ve en az enerjili olma eğilimleri evrenseldir ve çözünme olayları da bu eğilimler çerçevesinde gerçekleşir. Şimdi çözünme olaylarında en çok düzensiz ve en az enerjili olma eğilimlerinin katı-sıvı, sıvı-sıvı, gaz-sıvı çözeltilerinin oluşumundaki etkilerini ayrı ayrı inceleyelim: I 2(k) + 24,3 kJ → I 2(CCl4 içinde) Yukarıda çözünme denklemi verilen iyot gibi katıların çoğunun bir sıvıda çözünmeleri endotermiktir. Başka bir deyişle çözünme olayında ortamdan enerji alınır. Çünkü çözünen katı taneciklerini düzgün bir geometrik yapıdan ayırmak ve onları bir arada tutan çekim kuvvetlerini yenmek için belirli bir enerji gerekir. Bu durumda çözünen katının düzensizliğinin artmasıyla beraber sistemin enerjisi de artar. Dolayısıyla katılarda düzensizlik eğilimi çözünmenin lehine, en az enerjili olma eğilimi ise aleyhinedir. + − LiCl(k) Li( suda ) + Cl( suda ) + 37 kJ * LiCl’ün çözünme denklemi incelenirse LiCl’ün suda çözünmesinin ekzotermik bir olay olduğu görülür. LiCl gibi bazı iyonik katıların da çözünürlüğü ekzotermiktir. Bu tür katıların çözünmelerinde * LiCl’ün çözünmesinin ölçülen entalpi değeridir. Hesaplanan değer ise –50 kJ/ mol’dür. 152 ORTAÖĞRETİM KİMYA 11 DERS KİTABI sistemin enerjisi azaldığından hem en az enerjili olma eğilimi hem de düzensizlik eğilimi çözünmenin lehinedir. Dolayısıyla LiCl tuzu suda çok kolay ve çok miktarda çözünür. Sıvı bir çözen içinde sıvı çözünenin dağılması olayı sistemde düzensizliği artırdığından, sıvı-sıvı çözeltilerde düzensizlik eğilimi daima çözünmenin lehinedir. En az enerjili olma eğilimi de çözünme yönünde ise bu tür sıvılar birbiriyle her oranda karışır. Etil alkolün suda çözünmesi, hem en düzensiz hem de en az enerjili olma eğilimlerinin çözünme lehine olduğu bir olaydır. Eğer sıvılar kısmen karışıyorlarsa en az enerjili olma eğilimi katıların çoğunda olduğu gibi saf sıvı lehine, çözünmenin ise aleyhinedir. Gazların sıvılarda çözünmeleri, aşağıda örnek olarak verilen oksijen gazının çözünmesinde olduğu gibi ekzotermiktir. Bu yüzden, gazların çözünürlüğünde en az enerjili olma eğilimi çözünme lehindedir. Sıcaklık artışı, bu nedenle gazların çözünürlüğünü azaltır. O2(g) O2( suda ) + 12, 55 kJ Gazların çözünme ile düzensizlikleri azaldığından düzensizlik etkeni, çözünme olayının aleyhinedir. Şimdi 6. etkinliği yapınız. 6. ETKİNLİK: NEDEN KRİSTALLENDİ? Neler Gerekli? ❏ Su ❏ Termometre ❏ Tel kafes ❏ Baget ❏ Bunzen beki ❏ Spatül ❏ Sodyum asetat kristali ❏ Sacayak ❏ Beherglas (500 mL, 2 adet) Güvenliğiniz için Nasıl Yapacaksınız? 3 Beherglasın yarısından biraz fazlasına kadar su doldurunuz. İçine sodyum asetat kristalleri atınız. Bagetle karıştırarak çözebildiğiniz kadar sodyum asetat çözünüz (Karıştırmaya rağmen sodyum asetatın daha fazla çözünmemesinin doymuş çözelti oluştuğu anlamına geldiğini hatırlayınız.). 3 İçinde sodyum asetat çözdüğünüz beherglastaki çözeltiyi 90 ˚C’a kadar ısıtınız. İçine sodyum asetat kristalleri atarak karıştırınız ve daha fazla çözemediğiniz noktada karıştırma işlemine son veriniz. 3 Sodyum asetat çözeltisini dipteki kalıntıdan ayırmak üzere diğer beherglasa aktarınız. 3 Beherglasa aktardığınız çözeltiyi soğumaya bırakınız ve değişmeleri gözlemleyiniz. 3 Oda sıcaklığına kadar soğuyan çözeltiye bir parça sodyum asetat kristali atınız ve değişmeleri gözlemleyiniz. Etkinlik Sonu Soruları 1. Sıcak suda daha çok sodyum asetatın çözünmesini nasıl yorumlarsınız? 2. Soğuttuğunuz çözeltiye sodyum asetat kristali attığınızda ne gözlemlediniz? Sonucu nasıl açıklarsınız? 3. ÜNİTE: Çözeltilerde Denge 153 Yaptığınız etkinlikte oda sıcaklığında daha fazla sodyum asetatın çözünmemesi çözeltinin doyduğunu, sıcaklık artışıyla çözünmenin devam etmesi sodyum asetatın çözünürlüğünün sıcaklıkla arttığını gösterir. Sıcaklık arttırıldıkça çözeltide yeniden madde çözünebilmesi, o sıcaklıkta çözeltinin doymadığını, daha fazla madde çözememeniz çözeltinin doygun hâle geldiğini gösterir. Ancak bu durumdaki çözelti oda sıcaklığındaki hâline göre aşırı doymuş hâldedir. Aşırı doymuş çözeltiler aynı koşullardaki doymuş çözeltilerden daha fazla madde bulunduran çözeltilerdir ve oldukça kararsızdırlar. Aşırı doymuş sodyum asetat çözeltisi bir bagetle karıştırılır ya da içine küçük bir sodyum asetat kristali katılırsa kristaller hemen oluşmaya başlar ve çözelti doymuş hâle gelir. Sodyum asetat kristalini oluşturan iyonlar belirli bir geometrik düzen içindedir. Çözelti içinde ise + Na ve CH3COO– iyonlarının her biri su molekülleri ile sarılı olup serbestçe hareket eder. Çözeltideki iyonların katı kristali oluşturabilmeleri için düzenli olarak istiflenmeleri, bunun için de iyonların uygun doğrultu ve hızda birbirine yaklaşmaları ve çarpışmaları gerekir. Aşırı doymuş çözeltilerde iyonlar uygun koşullarda çarpışmaz. Çözeltiyi karıştırmakla iyonların uygun koşullarda çarpışmaları sağlanır ve yer çekiminin etkisiyle kristallerin birbirine bağlanması kristalin büyümesine neden olur. Bundan da aşırı doymuş çözeltilerin kararsız olduğu anlaşılır. Ayrıca çözeltiye bir sodyum asetat kristali katılması kristali oluşturan Na+ ve CH3COO– iyonları çevresinde düzgün bir elektriksel alan oluşturur. Elektriksel alan yardımıyla çözeltideki Na+ ve CH3COO– iyonları düzenli bir şekilde istiflenerek kristallenmeye başlar (Resim 3.9). Yani katılan küçük kristal çözeltideki diğer iyonlar için yol gösterici olur. Bu olaya aşılama denir. İçinde katı madde bulunan doymuş bir çözeltide koşullar değişmedikçe katı maddenin miktarı değişmez. Bunun anlamı doymuş çözeltide çözünme ve çökme olaylarının devam etmesidir. Resim 3.9: Aşırı doymuş CH3COONa çözeltisine kendi kristali atıldığında hızlı bir kristallenme gözlenir. Çözeltilerde çözünmüş iyonların derişimleri yükseldikçe çökelme hızı artar. Çökelme hızının çözünme hızına eşit değere varmasıyla sistemde denge oluşur. Denge hâlindeki çözeltiye doymuş çözelti denir. Denge hâlinde çözünme ve çökelme olayı birbirini izler. Maddelerin sudaki çözünürlüğünün oldukça değişken olduğunu, bazılarının çok, bazılarının ise çok az çözündüğünü biliyorsunuz. Oda sıcaklığında çözünürlüğü 0,1 mol/L’den büyük olan maddeler çözünür, 0,1 mol/L’den küçük olan maddeler ise az çözünür olarak nitelenir. 154 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ISI TORBALARI Na+CH3COO– · 3H2O kristalleri 54 ˚C’ta kendi kristal suyunda çözünür ve doygun çözelti oluşturur. Bu çözeltinin daha düşük sıcaklıklarda aşırı doymuş hâlde kalma özelliği vardır. Çö- OKUMA METNİ zelti içine kristal atılmadıkça yıllarca kristallenmeden kalabilmektedir. Böyle bir aşırı doymuş çözeltiye çok küçük bir Na+CH3COO– · 3H2O kristali atılırsa (aşılanırsa) hemen kristallenme başlar ve bol ısı açığa çıkar. Isıtma torbaları, böyle bir çözelti ve ihtiyaç duyulduğunda çözelti içine kristal sevk eden bir düzenekten oluşur. Isıya ihtiyaç duyulduğunda aşılama yapılarak Na+CH3COO– · 3H2O kristalleri oluşturulur. Torbayı yeniden kullanmak için sadece 54 ˚C’un üzerindeki bir sıcaklığa kadar ısıtmak ve çözeltiyi yeniden soğutup aşırı doymuş hâle getirmek yeterlidir. Yazarlar tarafından düzenlenmiştir. 2. Çözünme-Çökelme Dengesi AgCl’ün suda çözünme olayı ortamdan ısı alan, yani endotermik bir olaydır. Suda çözünen AgCl kristalleri, düzgün bir geometrik yapıdan ayrılıp iyonlar oluşturarak su içinde homojen olarak dağılır. + – AgCl(k) Ag( suda ) + Cl( suda ) H = + 65, 50 kJ Ag+ ve Cl– iyonlarının suda dağılabilmesi için bu iyonları bir arada tutan çekim kuvvetlerini yenecek kadar bir enerjinin ortamdan alınması gerekir. Düzensizlik artışı enerji almayı gerektirdiğinden sistemin enerjisi de artar. Dolayısıyla düzensizlik eğilimi çözünmenin lehine, en az enerjili olma eğilimi çözünmenin aleyhine olur. AgCl’ün çözünmesinde, en az enerjili olma eğilimi ile en fazla düzensiz olma eğiliminin uzlaşma noktası, AgCl’ün çözünürlüğünü belirler. Bu durumda AgCl’ün doymuş çözeltisi oluşur. Birim zamanda, katı hâldeki AgCl’ün çözünme hızı ile Ag+ ve Cl– iyonlarının birleşerek katı AgCl hâlinde çökelme hızı birbirine eşit olur. Yani doymuş çözeltide ileri yöndeki çözünme hızı ile geri yöndeki çökelme hızı eşit hâle gelir, iyonlarına ayrılmış olan kısım ile çözünmeden kalan kısım arasında bir denge oluşur. Bu dengeye çözünme-çökelme dengesi denir. Şimdi çözünme-çökelme denge bağıntısını çıkarmak üzere genel bir çözünme denkleminden yararlanalım: b+ a– A aBb(k) aA ( suda ) + bB( suda ) AaBb katısının bir kısmı suda çözünerek Ab+ ve Ba– iyonlarına ayrılırken bir kısmı da çözünmeden ortamda kalır. Doymuş AaBb çözeltisinde çözünmeden kalan AaBb katısı ile çözünme sonucu oluşan Ab+, Ba– iyonları arasında bir çözünme-çökelme dengesi kurulur. Çözünme-çökelme dengesinin bağıntısı aşağıdaki gibidir: Kc = [ A b + ]a [B a − ]b [ A aB b ] ya da K c [ A aBb ] = [ Ab + ]a [Ba − ]b Kc denge sabiti ile sabit bir değer olan [AaBb] (Katıların derişimlerinin sabit kaldığını hatırlayınız.) çarpımı da sabit bir değer olacaktır. Bu sabite çözünürlük sabiti ya da çözünürlük çarpımı denir ve genellikle “Kçç” ile ifade edilir. Kçç = [Ab+ ]a [Ba– ]b Bağıntıda köşeli parantez içindeki ifadeler, iyonların molar derişimlerini, a ve b ise çözünme denklemindeki kat sayılarını ifade eder. Bazı maddelerin çözünürlük çarpımları Tablo 3.5’te verilmiştir. İnceleyiniz. 3. ÜNİTE: Çözeltilerde Denge 155 Tablo 3.5: 25 ˚C’ta bazı maddelerin çözünürlük çarpımları İyonik katılar Florürler BaF2 MgF2 PbF2 SrF2 CaF2 Klorürler PbCl2 AgCl CuCl Bromürler PbBr2 AgBr CuBr İyodürler PbI 2 AgI CuI Kçç 1,84 · 10–7 5,16 · 10–11 3,3 · 10–8 4,33 · 10–9 3,45 · 10–11 1,70 · 10–5 1,77 · 10–10 1,72 · 10–7 6,60 · 10–6 5,35 · 10–13 6,27 · 10–9 9,8 · 10–9 8,52 · 10–17 1,27 · 10–12 İyonik katılar İyonik katılar Kçç Sülfatlar CaSO4 SrSO4 PbSO4 BaSO4 Ag2SO4 4,93 · 10–5 3,44 · 10–7 2,53 · 10–8 1,08 · 10–10 1,20 · 10–5 Karbonatlar CaCO3 BaCO3 SrCO3 FeCO3 PbCO3 MgCO3 Hg2CO3 3,36 · 10–9 2,58 · 10–9 5,60 · 10–10 3,13 · 10–11 7,40 · 10–14 6,82 · 10–6 3,6 · 10–17 Kromatlar SrCrO4 BaCrO4 PbCrO4 Ag2CrO4 3,6 · 10–5 1,17 · 10–10 2,0 · 10–16 1,12 · 10–12 Kçç Hidroksitler Ba(OH)2 Ca(OH)2 AgOH Mg(OH)2 Pb(OH)2 Fe(OH)2 Ni(OH)2 Al(OH)3 Fe(OH)3 2,55 · 10–4 5,02 · 10–6 2,0 · 10–8 5,61 · 10–12 1,43 · 10–20 4,87 · 10–17 5,48 · 10–16 2,0 · 10–32 2,79 · 10–39 Sülfürler FeS ZnS PbS 3,7 · 10–19 2,5 · 10–22 7,0 · 10–29 CuS Ag2S 6,0 · 10–36 6,0 · 10–50 Fosfatlar Mg3(PO4)2 Ag3PO4 Ca3(PO4)2 1,04 · 10–24 1,8 · 10–18 2,07 · 10–33 Bazı bileşiklerin sudaki iyonlaşma dengeleri ve çözünürlük çarpımı bağıntıları şöyledir: + – AgCl(k) Ag(suda) + Cl(suda) K çç = [Ag+ ] [Cl– ] 2+ – 2+ – 2 Mg(OH)2(k) Mg(suda) + 2OH(suda) K çç = [Mg ] [OH ] 3+ 2– As2S 3(k) 2As(suda) + 3S (suda) K çç = [As3+ ]2 [S2– ]3 Çözünürlük Çarpımının (Kçç ) Hesaplanması ☞ÖRNEK : 10 BaF2’ün 100 mL saf suda 18 ˚C’ta çözünürlüğü 0,13125 g’dır. Buna göre BaF2’ün bu sıcaklıktaki çözünürlük çarpımını hesaplayınız. (MBaF : 175 g/mol) 2 ✍ÇÖZÜM BaF2 için; m n= ––– M n M = –– (100 mL = 1 · 10–1 L) V 0,13125 n= ––––––– ⇒ n = 7,5 · 10–4 mol 175 7,5 · 10–4 M = ––––––––– ⇒ M = 7,5 · 10–3 mol/L 1 · 10–1 156 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 2+ – BaF2(k) Ba (suda) + 2F(suda) [Ba2+ ]= 7,5 · 10–3 [F– ]= 2 [Ba2+ ] ⇒ 2 · 7,5 · 10–3 = 15 · 10–3 Kçç= [Ba2+ ] [F– ]2 Kçç= [7,5 · 10–3 ] [15 · 10–3 ]2 ⇒ Kçç ≈ 1,7 · 10–6 dır. ☞ÖRNEK : 11 25 ˚C’ta PbBr2’ün çözünürlük çarpımı Kçç = 6,6 · 10–6 dır. Buna göre aynı sıcaklıkta PbBr2’ün çözünürlüğü kaç mol/L’ dir? ✍ÇÖZÜM PbBr2 suda aşağıdaki gibi iyonlarına ayrılır: 2+ – PbBr2(k) Pb (suda) + 2Br(suda) Buna göre 1 L’lik çözeltide çözünmüş olan PbBr2’ün mol sayısı X olarak alınırsa; [Pb2+] = X , [Br – ] = 2X olur. Kçç = [Pb2+][Br – ]2 ⇒ 6,6 · 10–6 = (X)(2X)2 6,6 · 10–6 = 4X3 X 1,88 · 10–2 mol/L ’dir. 1 L’lik çözeltide 1,88 · 10–2 mol PbBr2 çözünür. ☞ÖRNEK : 12 BaCO3’ın 25 ˚C’ta çözünürlük çarpımı 2,58 · 10–9 dur. Bu sıcaklıkta doymuş BaCO3(k) çözeltisi hazırlamak için kaç gram BaCO3 gerekir? (Ba : 137, C : 12, O : 16) ✍ÇÖZÜM BaCO3 aşağıdaki gibi iyonlarına ayrılır: 2+ 2− BaCO3(k ) Ba ( suda ) + CO3( suda ) X M XM Kçç= [Ba2+] [CO32– ] Kçç= X · X [Ba2+ ]= [BaCO3] ise m M= ––––– M·V –5 m 5,08 · 10 = –––––––– 197 · 0,1 2,58 · 10–9 = X2 X ≈ 5,08 · 10–5 M’dır. m= 10,008 · 10–4 g gerekir. Çözünme-Çökelme Dengesine Sıcaklığın Etkisi Maddelerin suda çözünmelerinin ortamdan ısı alarak ya da dışarıya ısı vererek gerçekleştiğini biliyorsunuz. Örneğin; + – KCl(k) K (suda) + Cl(suda) ∆H˚(çöz) = 17,22 kJ/mol + – LiClO4(k) Li (suda) + ClO4(suda) ∆H˚(çöz) = –26,55 kJ/mol tepkimeleri ısı alarak veya ısı vererek gerçekleşen çözünme tepkimeleridir. Bu tür çözünme tepkimelerinin entalpileri çözünme entalpisi (∆H˚(çöz)) olarak adlandırılır. 3. ÜNİTE: Çözeltilerde Denge 157 Le Chatelier İlkesi’ne göre endotermik çözünmelerde sıcaklık artışı, dengeyi çözünme lehinde; ekzotermik çözünmelerde ise çözünme aleyhinde etkiler. Yani ısı alarak çözünen maddeler, sıcaklık artışıyla daha fazla çözünürken ısı vererek çözünen maddeler daha az çözünür. Sıcaklığın artması, sudaki çözünürlüğü endotermik olan amonyum nitratın çözünürlüğünü artırırken sudaki çözünürlüğü ekzotermik olan lityum klorürün çözünürlüğünü azaltır (Resim 3.10). NH4NO3’ı oda sıcaklığında su içinde çözme işlemine başlanıyor. LiCl’ü suda çözme işlemine 22 ˚C’ta başlanıyor. Su damlatılmış tahta takoz üzerine konulan beherglas içinde çözünen NH4NO3 dışarıdan ısı alır. Tahta takoz üzerindeki su bu nedenle donar ve takoz beherglasa yapışır. Bu olay NH4NO3’ın çözünmesinin endotermik bir olay olduğunu gösterir. LiCl suda çözündüğünde sıcaklık 22 ˚C’tan 46 ˚C’a çıkar. Bu da LiCl’ ün çözünmesinin ekzotermik bir olay olduğunu gösterir. Resim 3.10: NH4NO3’ın çözünmesi endotermik, LiCl’ünki ekzotermik bir olaydır. Genel olarak katıların çözünürlüğü endotermik, gazlarınki ekzotermik olduğundan sıcaklık yükselmesi ile genellikle katıların çözünürlüğü artar, gazlarınki azalır. Çoğu kez çözünme hızı ile çözünürlük birbirine karıştırılır. Örneğin, Li2SO4 tuzu sıcaklık yükseldikçe daha hızlı fakat daha az çözünür. Bu bağlamda çözünmenin hızlı gerçekleşmesi dengeye daha çabuk ulaşılmasını sağlar. Dolayısıyla çözünürlük denge anı ile değil, denge sabiti ile ilgili bir büyüklüktür. Ortamdan ısı alarak çözünen katıların çözünürlük çarpımları sıcaklık yükseldikçe artar. Ortama ısı vererek çözünen katıların çözünürlük çarpımları ise sıcaklık yükseldikçe küçülür. Bu ilkelerden hareketle çözünme tepkimesi endotermik olan katılar, çözeltinin soğutulması ya da çözenin buharlaştırılması yoluyla çözeltilerinden katı hâlde (kristal) ayrılabilir. Çözünürlük tepkimesi ekzotermik olan katılar ise çözeltinin ısıtılması ya da çözenin buharlaştırılması yoluyla çözeltilerinden katı hâlde ayrılabilir. Deniz suyundan NaCl, acı göl sularından Na2SO4 üretimi gibi endüstriyel süreçler benzer yöntemlerle yürütülür. Genellikle de çözücünün buharlaştırılması yöntemi seçilir. 158 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 13 NH4Cl’ün 20˚C sıcaklıkta, 100 gram suda çözünürlüğü 37 gramdır. 500 gram suda, 60˚C’ta 215 gram NH4Cl çözünmesiyle oluşan çözelti 20˚C sıcaklığa kadar soğutulursa kaç gram NH4Cl katısı kristallenir? ✍ÇÖZÜM 20 ˚ C 100 g suda 37 g NH4 Cl çözünürse 500 g suda x= x 500 · 37 = 185 g NH4 Cl çözünür. 100 Çökelme miktarı = 215 – 185 = 30 g NH4Cl kristallenerek çöker. ☞ÖRNEK : 14 Na2SO4’tın 30 ˚C sıcaklıktaki çözünürlüğü 50,4 g/100 mL sudur. 3 L suda Na2SO4 çözünmesiyle 2 oluşturulan çözeltinin ’si buharlaştırılırsa kaç gram Na2SO4 katısı elde edilir? 3 ✍ÇÖZÜM 100 mL suda 3000 mL suda x= 50 , 4 g çözünürse x 3000 · 50, 4 = 1512 gram çözünür. 100 Buharlaşan su miktarı 2000 mL, kalan su miktarı 1000 mL’dir. 100 mL suda 1000 mL suda 50, 4 g çözünürse x x = 504 g çözünür. Çökecek Na2SO4 miktarı = 1512 – 504 = 1008 g’dır. Gazların Çözünürlüğüne Basıncın Etkisi Katı ve sıvılar sıkıştırılamadığından basınçla çözünürlükleri değişmez. Ancak gazlar sıkıştırılabildiklerinden, uygulanan basınçla orantılı olarak çözünürlükleri de artar. Bu ifade Henry (Henri) Yasası olarak bilinir. Gazların çözünürlüğünün uygulanan basınçla doğru orantılı olarak değişimi [C] = kH P bağıntısı ile verilir. Burada [C] gazın çözündüğü çözelti derişimini, P çözelti üzerine uygulanan basıncı, kH ise Henry sabitini ifade eder. Bu sabit sıcaklığa bağlı olup birimi mol / L atm ’dir. Gazoz çözeltisi oluşturmak üzere şekerli su çözeltisinde CO2 gazı çözebilmek için basınç uygulanması, gazoz kapağı açıldığında şiddetli CO2 gazı çıkışı, basınç etkeninin gazların çözünmesine olan etkisini gösterir (Resim 3.11). 3. ÜNİTE: Çözeltilerde Denge Resim 3.11: Gazoz kapağı açıldığında gaz çıkışı gözlenir. 159 Deniz seviyesinden itibaren 3000 metrenin üzerindeki yüksekliklere tırmanan ve bu yerlerden iniş yapan dağcılar belirli yükseklikler arasında kamp kurup buralarda belirli sürelerde dinlenirler. Çünkü deniz seviyesinden itibaren 3000 metreden daha yüksek yerlere tırmandıkça dış basınç düşer. Bu düşüşe bağlı olarak kan ve dokularda çözünen oksijen miktarı azalır. Deniz seviyesinde solunuma katılmayan akciğer bölümleri çalışmaya başlar. Oksijenin hemoglobinden ayrılarak dokulara yayılması için özel enzim üretilir. Nefes alma sıklığı artar. Bu klinik tablo “aklimatizasyon Resim 3.12: Deniz dibinde inceleme yapan bir dalgıç yetersizliği” olarak anılır. Bu durumda dağcı zirveye ulaşamaz ve hastalanır. Aklimatizasyonu önlemek için belirli aralıklarla kamp kurularak dinlenilir ve vücut bu yüksekliğe alıştırılır. Derin dalış yapan dalgıçların da hem dalışları hem de yüzeye çıkışları sırasında belirli noktalarda bekleme yaptıklarını duymuşsunuzdur. Bunun nedeni şöyle açıklanabilir: Solunan hava, vücudumuzda kana ve dokulara geçip vücut sıvıları içinde çözünür. Basınç arttıkça kan ve dokulardaki çözünmüş olan azot gazının oranı da artar. Eğer dalgıç (Resim 3.12) herhangi bir nedenle hızla yüzeye çıkmaya çalışırsa basınçtaki ani azalış nedeniyle kan ve dokulardaki çözünmüş gaz, kabarcıklar oluşturarak sıvıyı terk eder ve bu da ciddi dolaşım bozukluklarına yol açar. Halk arasında “vurgun yemek” diye bilinen dalış hastalığı gazların bu özelliğinin bir sonucudur. Bu tür olumsuzlukları önleyebilmek için kan ve dokulardaki çözünmüş gaz yavaş ve tehlikesiz olarak dışarı atılmalıdır. Bu da belirli derinliklerde, belirli süreler bekleyerek yapılır. ☞ÖRNEK : 15 20 ˚C sıcaklık ve 380 mmHg basıncı altında azot gazının (N2) sudaki çözünürlüğü 0,0150 g/L’dir. Sıcaklık sabit tutulup ortamın basıncı 800 mmHg’ya çıkarılıyor. Bu basınçta azotun sudaki çözünürlüğünü hesaplayınız. ✍ÇÖZÜM T = 20 + 273 = 293 K P1 = 380 mmHg P2 = 800 mmHg Sıcaklık sabit olduğundan [C] = kH P bağıntısında kH sabiti değişmez. Buna göre; [C ] = kH P kH P1 [C1 ] = [C2 ] kH P2 0, 0150 380 = [ C2 ] 800 [C2 ] = 0,, 0316 g / L bulunur. 160 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 16 25 ˚C sıcaklık ve 150 mmHg basıncında oksijen gazının çözünürlüğü 0,44 g/100 mL sudur. Sabit sıcaklıkta 100 mL çözelti üzerindeki basınç düşürüldüğünde 0,28 g O2 gazı ortamdan ayrılıyor. Buna göre sistemdeki son basıncı mmHg cinsinden hesaplayınız. ✍ÇÖZÜM [C ] = kH P kH P1 [C1 ] = [C2 ] kH P2 0, 44 150 = (0, 44 − 0, 28) P2 P2 ≈ 54, 5 mmHg ’dır. Ortak İyon Etkisi Çözünürlüğün denge anı ile değil denge sabiti ile ilgili bir büyüklük olduğunu öğrendiniz. O hâlde çözünürlüğü ve çözünme-çökelme dengesini iyon derişimleri çarpımının belirleyeceği sonucuna varabiliriz. Bu sonuç ortak iyon içeren bileşiklerin çözeltileri birbirine karıştırıldığında sudaki çözünürlüğü az olan bileşiğin çözünürlüğünün, ortak iyondan nasıl etkileneceği sorusunu akla getirir. Örneğin, suda az çözünen AgCl’ün çözeltisi ile suda iyi çözünen NaCl’ün çözeltisi karıştırıldığında AgCl’ün çözünürlüğü bundan nasıl etkilenir? Şimdi bu sorunun yanıtını arayalım. AgCl’ün saf sudaki çözünme-çökelme dengesi; – + AgCl(k ) Ag( suda ) + Cl( suda ) şeklindedir. AgCl çözeltisine NaCl çözeltisi eklendiğinde NaCl’den gelen Cl– iyonları çözeltide AgCl’den dolayı var olan Cl– iyonlarının derişimini artırır. Çözünme-çökelme dengesi bozulur. Le Chatelier ilkesine göre Cl– iyonları derişiminin azalması gerekir. Bu nedenle Cl– iyonlarının bir bölümü Ag+ iyonları ile birleşerek AgCl(k) şeklinde çöker. Çökelme, sistemde iyon derişimleri çarpımı AgCl’ün Kçç’sine eşit oluncaya kadar devam eder. Sonuçta çözünme-çökelme dengesi yeniden kurulur. Bu olay, suda az çözünen iyonik bileşiğin oluşturduğu çözeltiye, bu iyonik bileşikle aynı (ortak) iyona (anyon ya da katyon) sahip NaCl gibi başka bir bileşiğin çözeltisi eklendiğinde ortak iyonun, suda çözünen iyonik bileşiğin çözünürlüğünü daha da azalttığını kanıtlar. Diğer bir deyişle suda az çözünen iyonik bileşiğin çözünürlüğü ortak iyonun etkisiyle daha da azalır. Suda az çözünen bir bileşiğin ortak iyon içeren başka bir bileşiğin etkisi ile çözünürlüğünün azalmasına ortak iyon etkisi denir. ☞ÖRNEK : 17 SrCrO4 ’tın 25 ˚C’ta çözünürlük çarpımı Kçç = 3,6 · 10–5 tir. SrCrO4’tın 0,1 M Na2CrO4 çözeltisindeki çözünürlüğünü hesaplayınız ve saf sudaki çözünürlüğü ile karşılaştırınız. ✍ÇÖZÜM Na2CrO4 suda iyi çözünür ve tamamen iyonlarına ayrılır. Ortak iyon olan CrO42– ın derişimi çözelti derişimine eşittir. 2– + Na 2CrO4( suda ) 2Na ( suda ) + CrO4( suda ) 0,1 M 3. ÜNİTE: Çözeltilerde Denge 0,2 M 0,1 M 161 SrCrO4 sulu çözeltisinde aşağıdaki gibi iyonlaşır. 2+ 2– SrCrO4(k ) Sr( suda ) + CrO4( suda ) Başlangıç — 0 0 Değişim –x Mx M x + 0,1 M Denge –x Mx M x +0,1 M Bu değerler çözünme-çökelme dengesi ifadesinde yerine yazılırsa; Kçç = [Sr2+] [CrO42–] Kçç = x · (x + 0,1) –5 3,6 · 10 Bu değer 0,1 M değeri yanında çok küçük olduğundan ihmal edilir. = x · 0,1 x = 3,6 · 10–4 M bulunur. Şimdi de SrCrO4’ın saf sudaki çözünürlüğünü bulalım. 2+ 2– SrCrO4(k ) Sr( suda ) + CrO4( suda ) xM Kçç = [Sr2+] [CrO42–] xM Kçç = x2 3,6 · 10–5 = x2 x = 6 · 10–3 M ’dır. Bu durumda SrCrO4’tın saf sudaki çözünürlüğü 6 · 10–3 M, 0,1 M Na2CrO4 çözeltisindeki çözünürlüğü ise 3,6 · 10–4 M ’dır. Bu sonuç ortak iyon etkisinin çözünürlüğü azalttığını gösterir. ☞ÖRNEK : 18 25 ˚C’ta 0,1 M NaBr çözeltisinin 1 L’sinde kaç mol PbBr2 çözünür? Sonucu yorumlayınız. (PbBr2 için Kçç = 6,6 · 10–6 dır.) ✍ÇÖZÜM NaBr suda tamamen çözünerek aşağıdaki gibi iyonlarına ayrılır: NaBr(k) → Na+(suda) + Br–(suda) Oluşan iyonların derişimi çözünen NaBr derişimine eşittir. [NaBr] = [Na+ ] = [Br – ] = 0,1 M’dır. Diğer taraftan PbBr2’ün 1 L sudaki çözünürlüğüne X dersek iyonlarının derişimi aşağıdaki gibi olacaktır: 2+ PbBr2(k) Pb (suda) + XM XM 2Br–(suda) 2X M Buna göre; [Pb2+] = X ise [Br – ] = 0,1 + 2X’tir. Çünkü 0,1 mol Br – iyonu NaBr’den, 2X mol ise PbBr2’den gelmektedir. PbBr2 için Kçç = [Pb2+] [Br – ]2 olduğuna göre; 6,6 · 10–6 = (X) (0,1 + 2X)2 dir. Bu bağıntıda 0,1 ile toplanan 2X değeri, PbBr2’ün çözünürlüğü çok az olduğundan çok küçüktür. Bu nedenle 2X değeri ihmal edilebilir. 6,6 · 10–6 = (X) (0,1)2 ⇒ X = [Pb2+] = 6,6 · 10–4 mol/L’dir. Çözelti hacmi 1 L olduğundan [Pb2+] aynı zamanda PbBr2 mol sayısına eşittir. 162 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Örnek 18’de 0,1 M’lık NaBr çözeltisinin 1 L’sinde PbBr2’ün çözünürlüğü 6,6 · 10–4 mol/L’dir. Oysaki Örnek 11’de 1 L saf suda 1,88 · 10–2 mol PbBr2’ün çözündüğünü hesapladık. Bu durum bize ortak iyon etkisiyle çözünürlüğün azaldığını göstermektedir. Suda çözünen tuzların doymuş çözeltilerinde çözünme-çökelme dengesi durumunda iyon derişimleri çarpımının Kçç’ye eşitliği söz konusudur. Şimdi iyon derişimleri çarpımının Kçç’ye eşit olmadığı herhangi bir andaki durumu inceleyelim. Herhangi bir andaki iyon derişimleri çarpımına Q dersek Q > Kçç ya da Q < Kçç ise sistemde çözünme-çökelme dengesi yoktur. Sistemde denge kurulabilmesi için yani Q = Kçç olması için iyon derişimleri çarpımının küçülmesi ya da büyümesi gerekir. Q < Kçç ise çözelti doymamıştır, çözünme Q = Kçç oluncaya kadar devam etmelidir. Eğer Q > Kçç ise iyon derişimleri çarpımı Kçç’ye eşit oluncaya kadar küçülmeli yani iyonlar katı hâle dönmelidir. İyonların katı hâle dönmesi çökelme olayıdır. Şimdi bu durumları örnek problemlerle inceleyelim. ☞ÖRNEK : 19 Eşit hacimlerde 2 · 10–3 M AgNO3 çözeltisi ile 8 · 10–3 M NaCl çözeltisi karıştırıldığında sistemdeki çözünme-çökelme dengesi bu durumdan nasıl etkilenir? (Kçç(AgCl) = 1,77 · 10–10 ) ✍ÇÖZÜM Söz konusu iki çözelti karıştırıldığında iyonların yer değiştirmesi ile NaNO3 ve AgCl oluşur. AgNO3(suda) + NaCl(suda) → AgCl(k) + NaNO3(suda) + – AgCl(k) Ag (suda) + Cl(suda) Oluşan NaNO3 suda iyi çözünen bir bileşiktir. Bu durumda AgCl’ün Kçç’si ile ortamdaki Ag+ ve Cl– iyon derişimlerinin çarpımını karşılaştırmamız gerekir (Kçç = [Ag+] [Cl– ]). Çözeltiler eşit hacimde karıştırıldığından hacimleri iki katına çıkar, derişimleri yarıya iner. Buna göre Ag+ ve Cl– iyon derişimleri; AgNO3’tan gelen [ Ag+ ] = 2 · 10−3 = 1· 10−3 M ’dır. 2 8 · 10−3 = 4 · 10−3 M ’dır. 2 Buna göre Q = [Ag+ ] [Cl– ] NaCl’den gelen [Cl− ] = Q = 1 · 10–3 · 4 · 10–3 = 4 · 10–6 dır. Bu durumda Q > Kçç’dir. Sistem dengede değildir. Q = Kçç oluncaya kadar Ag+ ve Cl– iyonları birleşerek AgCl hâlinde çökmelidir. Çözünürlüğün bu şekilde değişmesine ortak iyon etkisi denir. ☞ÖRNEK : 20 2 mL 0,20 M NaOH çözeltisi üzerine 0,10 M CaCl2 çözeltisi eklenerek karışımın hacmi 1 L’ye tamamlanıyor. Karışımda bir çökelme olur mu? (Ca(OH)2 için Kçç = 5,02 · 10–6 ) 3. ÜNİTE: Çözeltilerde Denge 163 ✍ÇÖZÜM İki çözelti karıştırıldığında ortamda Na+, Ca2+, OH– ve Cl– iyonları oluşur. Bu iyonlardan oluşabilecek bileşiklerden çözünürlüğü küçük olan Ca(OH)2’tir. Eğer çökelme olacaksa Ca(OH)2 çökelmelidir. Bu nedenle Ca2+ ve OH– iyonlarının derişimleri hesaplanır. [Ca 2 + ] = [OH− ] = 0,1· 1 = 0,1 M’dır. 1 0, 2 · 2 · 10−3 = 4 · 10−4 M’dır. 1 + − Ca (2suda Ca(OH)2(k ) ) + 2OH( suda ) Q = [Ca2+ ] [OH– ]2 Q = 0,1 · (4 · 10–4)2 Q = 1,6 · 10-8 bulunur. Q < Kçç olduğundan çökelme olmaz. Çözünürlük Dengesine pH Etkisi Birçok çözünme olayında pH değerinin çözünürlük üzerine doğrudan ya da ortak iyon etkisi söz konusu olabilmektedir. Çünkü çözünme ya da çökelme olaylarının olabileceği pek çok çözelti pH değerinden etkilenir. 2+ − Şimdi Mg(OH)2(k ) Mg( suda ) + 2OH( suda ) çözünmesine pH’nin etkisini inceleyelim. Mg2+ ve OH– iyonlarının bulunduğu bu çözeltide OH– iyon derişimi artırılırsa çözünürlük azalır. H+ iyonu derişimi artırılırsa H+ iyonu dengedeki OH– iyonu ile birleşip H2O’ya dönüşür. Böylece OH– iyon derişimi azalır, çözünürlük artar. Diğer yandan çözeltideki iyonlar H+ ya da OH– iyonu ile tepkime verebilir. Örneğin; 2+ − CaF2(k ) Ca ( suda ) + 2F( suda ) çözünme tepkimesinde ortama H+ iyonu eklenirse Le Chatelier İlkesi’ne göre H+ derişiminin artması H+ iyonlarının F– iyonu ile birleşerek HF oluşturmasına ve HF derişiminin artmasına neden olur. Bu da F– iyonu derişiminin azalmasına, dengenin ürünler yönüne kaymasına, CaF2’ün çözünürlüğünün artmasına yol açar (Grafik 3.3). CaCO3’ın sulu çözeltileri de ortamın pH’sinden etkilenir. CaCO3’ın sulu çözeltisinde Ca2+ ve CO32– iyonları bulunur. Bu iyonların hava ile teması olduğunda havanın CO2’in suda çözünmesiyle oluşan H2CO3 ile teması da söz konusu olur. CaF2 çözünürlüğü (M) –3 6,0 . 10 5,0 . 10–3 4,0 . 10–3 − CO23(−suda ) + H2CO3( suda ) 2HCO3( suda ) Dolayısıyla CO32– iyonları HCO–3 iyonlarına döner. Bu anlamda CaCO3’ın sudaki çözünürlüğü artar. 3,0 . 10–3 2,0 . 10–3 1,0 . 10–3 − CO23(−suda ) + H3O+( suda ) HCO3( suda ) + H2O( s ) Ortamdaki Ca2+ iyonları HCO–3 iyonları ile birleşerek CaCO3 hâlinde çöker. Bu yüzden mağaralardaki dikit ve sarkıtların oluşu- 0 7,0 5,0 3,0 1,0 pH Grafik 3.3: CaF2’ün çözünürlüğüne pH etkisi mu CaCO3’ın bu tür bir çözünme ve çökelme sistemine dayanır. 164 ORTAÖĞRETİM KİMYA 11 DERS KİTABI pH değişiminin diğer bir etkisi dişlerde görülür. Dişler arasında kalan yiyeceklerden üreyen bakteriler asit salgılar. Hidroksiapatit adı verilen diş minesi aşağıdaki tepkime denklemine göre bu asidik ortamda çözünür ve diş çürükleri oluşur. 2+ 3− Ca 5 (PO4 )3 OH(k ) + H3O+( suda ) 5Ca ( suda ) + 3PO4( suda ) + 2H2O( s ) Dişler flor iyonu içeren diş macunları ile fırçalanırsa bir kısım hidroksiapatit floroapatite dönüşür. − Ca 5 (PO4 )3 OH(k ) + F(−suda ) Ca 5 (PO4 )3 F(k ) + OH( suda ) Bu şekilde F– iyonu diş çürümelerini engeller. 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. + – 1. NH3(g) + H2O(s) NH 4(suda) + OH(suda)∆H˚ = –30,5 kJ NaCl(k) → Na+(suda) + Cl–(suda) ∆H˚ = +3,76 kJ NH3 ve NaCl’ün suda çözünmelerini en az enerjili ve en fazla düzensiz olma eğilimleri yönünden karşılaştırınız. 2. I 2(k) I 2 (CCl4 içinde) ∆H˚= +24,3 kJ I 2(k) I 2 (C2H5OH içinde) ∆H˚= +6,3 kJ İyotun iki ayrı çözücüde çözünmesine ait tepkime entalpileri verilmiştir. İyot bu iki çözücüden hangisinde daha çok çözünür? Neden? 3. Aşağıdaki maddelerin iyonlaşma denklemlerini ve çözünürlük denge bağıntılarını yazınız. a.BaF2 b. Bi(OH)3 c. BaSO4 ç. Ce2(C2O4)3 4. Belirli sıcaklıkta 50 mL saf suda 6,55 · 10–6 mol Mg(OH)2 çözününce doymuş çözelti oluştuğuna göre Mg(OH)2’in çözünürlük çarpımı kaçtır? 5. Kçç= 1,77 · 10–10 olan AgCl, 0,1 M NaCl çözeltisinin 1 L’sinde kaç mol çözünür? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Çözünme entalpisi büyük olan bileşiklerin çözünürlükleri sıcaklıkla artar. ( … ) 2. Doygun çözeltinin derişimine “çözünürlük” denir. ( … ) 3. Gazların çözünürlüğü basınç ile doğru orantılı olarak artar. ( … ) 4. Ekzotermik bir çözünme olayında sıcaklık arttıkça çözünme de artar. ( … ) 5. Çözüneni çözeltiden ayırmanın yollarından biri sıcaklığı değiştirmek, diğeri çözücüyü ( … ) buharlaştırmaktır. 6. Ortak iyon etkisi çözünürlük dengesini etkilemez. ( … ) 7. Bir gazın çözünürlüğünü artırmak için ortamın sıcaklığı artırılmalıdır. ( … ) 8. Oda sıcaklığında sudaki çözünürlüğü 0,1 mol/L’den küçük olan maddeler iyi çözünen ( … ) maddeler olarak nitelenir. 3. ÜNİTE: Çözeltilerde Denge 165 C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Gazoz şişesinin kapağı açıldığında şiddetli gaz çıkışı gözlenir. Bu olayda gaz çıkışı, aşağıda verilen genellemelerden hangisini doğrular? A) Gazların çözünürlüğünün sıcaklıkla değişimini B) Gazların çözünürlüğünün basınçla değişimini C) Gazların difüzyon hızlarının, mol kütlelerinin karekökü ile ters orantılı olduğunu D) Gazların çözünürlüğünün ekzotermik olduğunu E) Aynı sıcaklıktaki gazların kinetik enerjilerinin eşit olduğunu 2. Belli bir sıcaklıkta 3,15 · 10–2 g SrF2 çözünmesiyle 250 mL doymuş çözelti hazırlanıyor. SrF2 için çözünürlük çarpımı kaçtır? (MSrF2 : 126 g/mol) B) 3 · 10–6 C) 2 · 10–4 D) 1 · 10–3 3. İyonik bir katının belirli bir sıcaklıkta suda çözünmesiyle oluşan doymuş çözeltisindeki iyonlarının derişim-zaman grafiği yanda verilmiştir. Buna göre iyonik katının çözünürlük çarpımı kaçtır? A) 6 · 10–6 C) 9 · 10–6 Derişim (mol/L) A) 4 · 10–9 E) 2 · 10–3 3.10–3 [y-n] 2.10–3 [X+m] B) 8 · 10–6 D) 1,08 · 10–13 Zaman (s) E) 7,2 · 10–14 4. Belli bir sıcaklıkta 100 mL 5 · 10–3 M HgNO3 çözeltisi ile 2,5 · 10–4 M 400 mL KCl çözeltisi karıştırılıyor. Tepkime sonucu dengeye ulaşan çözelti için aşağıdakilerden hangisi ya da hangileri doğru olur? (Hg2Cl2 için Kçç = 1,8 · 10–9 dur.) I.Hg+ ve Cl– iyon çarpımı Kçç’den küçüktür, çökelme olmamıştır. II.Denge hâlindeki çözeltide Hg+ ve Cl– iyon çarpımı Kçç ye eşittir. III. Hg2Cl2 çökeltisi oluşmuştur. A) Yalnız I 166 B) Yalnız II C) Yalnız III D) I ve II E) II ve III ORTAÖĞRETİM KİMYA 11 DERS KİTABI KOMPLEKS OLUŞMAAYRIŞMA DENGELERİ BÖLÜM İÇERİĞİ 1.Koordine Kovalent Bağlar 2.Kompleks Oluşum Dengeleri Besin kaynakları olan böcekleri yakalayabilmek için örümceklerin kuytu köşelere ağ ördüklerini bilirsiniz. Bu ağlar son derece ince iplikçiklerden oluştuğu hâlde çelik halat kadar sağlam oldukları dikkatinizi çekmiştir. Bu iplikçikleri oluşturan atom ve moleküller arasındaki kimyasal bağların da çok kuvvetli olması gerektiğini tahmin edersiniz. Bal arılarının son derece düzgün altıgen gözler şeklinde bal petekleri oluşturduklarını bilirsiniz. Bu petekleri oluşturan atom ve moleküller arasında da kimyasal bağların bulunması gerektiğini düşünür müsünüz? Bu bölümde bazı kimyasal bağların oluşumuna farklı açılardan yaklaşımlar bulacaksınız. 3. ÜNİTE: Çözeltilerde Denge 167 1. Koordine Kovalent Bağlar 9. sınıf kimya derslerinde iyonik ve kovalent olmak üzere iki tür kimyasal bağ oluşumunu öğrendiniz. Bildiğiniz gibi atomlar elektron dizilimlerini asal gazların elektron dizilimine benzetebilmek için diğer bir ifade ile dublete/oktete varabilmek için elektron alış verişi ya da elektron ortaklığı yaparak iyonik ve kovalent bağları oluştururlar. Şimdi kovalent bağların oluşumunu NH3 ve BF3 bileşikleri üzerinde yeniden inceleyelim. Azot atomunun atom numarası 7’dir ve elektron dizilimi şöyledir: 7N : 1s22s22p3 Azot atomunun değerlik orbitallerinde 5 değerlik elektronu vardır. Kovalent bağ yapmak üzere oktete varabilmek için 3 elektron ortaklığı kurmalıdır. Hidrojen atomunun atom numarası 1’dir ve elektron dizilimi şöyledir: 1H : 1s1 Hidrojen atomunun değerlik orbitalinde 1 değerlik elektronu vardır. Kovalent bağ yapabilmek üzere dublete varabilmek için 1 elektron ortaklığı yapmalıdır. O hâlde 1 azot atomu 3 hidrojen atomu ile elektron ortaklığı kurarak 3 kovalent bağ yapmalı ve NH3 molekülü oluşturmalıdır. Bu olayı Lewis yapısı ile aşağıdaki gibi gösterebiliriz: H N +3H H N H NH3 oluşumunda azot ve hidrojen atomlarının karşılıklı birer elektronlarını ortak kullanarak 3 ko- valent bağ yaptıkları, azot atomunun bir çift elektronunun elektron ortaklığına katılmadığı dikkatinizden kaçmamıştır. Bor atomunun atom numarası 5, flor atomunun 9’dur. Bu atomların elektron dizilimleri şöyledir: 5B : 1s2 2s2 2p1 9F : 1s2 2s2 2p5 Bor atomunun değerlik orbitallerindeki değerlik elektron sayısı 3, flor atomunda ise 7’dir. Buna göre bor atomu 3 değerlik elektronunu ortak kullanarak 3 kovalent bağ, flor atomu ise 1 elektron ortaklığı yaparak 1 kovalent bağ yapabilmeli ve oktete varabilmelidir. Bu olayı Lewis yapısı ile aşağıdaki gibi gösterebiliriz: F B +3 F B F F BF3 oluşumunda bor ve flor atomlarının karşılıklı birer elektronlarını ortak kullanarak 3 kovalent bağ yaptıkları, bor atomunun oktetini tamamlayamadığı, flor atomlarının ise tamamladığı dikkatinizden kaçmamıştır. NH3 ile BF3 uygun koşullarda NH3BF3 bileşiğini oluştururlar. Bu bileşik nasıl oluşmaktadır? Yukarıda da gösterildiği gibi NH3 molekülü oluşurken azot atomunun bir çift elektronu elektron ortaklığına katılmamış, BF3 oluşumunda ise bor atomu oktetini tamamlayamamıştı. Bor atomu oktetini tamamlayabilmek için azot atomunun bağ yapmayan bir çift elektronunu ortak kullanarak azot atomu ile arasında yeni bir kovalent bağ oluşturur. Her iki elektronun bir atom tarafından sağlanmasıyla oluşturulan bu kovalent bağa koordine kovalent bağ denir. Koordine kovalent bağ farklı bir kovalent bağ olmayıp sadece oluşum mekanizması bakımından kovalent bağlardan farklılık gösterir. 168 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Koordine kovalent bağ H F H F H N B F H F H F H N + B F F H H—N—B—F H H Amerikalı bilim insanı Lewis’e göre elektron çifti veren baz, elektron çifti alan asittir. Buna göre H3N—BF3 oluşumunda NH3 bir çift elektron verdiği için baz, BF3 bir çift elektron aldığı için asittir. Bu nedenle NH3 Lewis bazı, BF3 ise Lewis asidi olarak anılır. Lewis asidi ile Lewis bazının birleşmesinden oluşan ürün (örneğimizde NH3BF3) kompleks olarak adlandırılır. Diğer bir ifade ile ürün, Lewis asidi-bazı kompleksidir. Koordine kovalent bağlara Cu2+—NH3 ve Fe3+—CN– kompleksleri de örnek verilebilir. H Cu2+ + 4 N—H NH3 H3N—Cu—NH3 NH3 H Fe3+ + 6 CN 2+ CN CN CN Fe CN 3– CN CN İlk örnekte Cu2+ iyonu oktetini tamamlamak üzere NH3 moleküllerindeki azot atomlarının birer çift elektronlarını ortak kullanarak [Cu(NH3)4]2+ kompleksini oluşturur. Cu2+ iyonu elektron çiftleri aldığı için Lewis asidi, NH3 elektron çifti verdiği için Lewis bazıdır. Cu2+ iyonu elektron çiftleri aldığından merkez atomu olarak nitelenir. NH3 molekülleri merkez atomuna bağlı olduğundan ligand adıyla anılır. Merkez atomuna bağlı ligand sayısına koordinasyon sayısı denir. İkinci örnekte de Fe3+ iyonu merkez atomu olup aynı zamanda elektron çifti alan olduğundan Lewis asididir. CN– ligandları ise elektron çifti veren olduklarından Lewis bazıdır. ☞ÖRNEK : 21 [Cu (H2O)4]2+ , [Zn (OH)4]2– , [Ag (NH3)2]+ komplekslerinde merkez atomlarını, ligandları, Lewis asit ve bazlarını gösteriniz. ✍ÇÖZÜM Örneklerimizde Cu2+ , Zn2+ , Ag+ merkez atomu olup elektron çifti aldıklarından Lewis asitleridir. H2O , OH– ve NH3 merkez atomuna bağlı olduklarından ligandlardır. Elektron çiftleri verdiklerinden Lewis bazlarıdır. 2. Kompleks Oluşum Dengeleri Zayıf asit ve bazların iyonlaşma dengelerini, suda az çözünen tuzların çözünürlük dengelerini öğrendiniz. Q’nun Kçç’den büyük ya da küçük oluşuna göre çözünme-çökelme olaylarından hangisinin gerçekleşeceğini biliyorsunuz. Ortak iyon etkisi ile çökelmenin nasıl sağlandığını gördünüz. Son olarak da komplekslerin (Lewis asidi-bazı) oluşumunu incelediniz. Şimdi “Kim Kompleks Oluşturdu?” başlıklı etkinliği yaparak komplekslerin çökelme ve çözünme olaylarını irdeleyiniz. 3. ÜNİTE: Çözeltilerde Denge 169 7. ETKİNLİK: KİM KOMPLEKS OLUŞTURDU? Neler Gerekli? ❏ Tüplük ❏ 0,1 M CuSO4 çözeltisi ❏ Damlalık ❏ Dereceli silindir (10 mL) ❏ 0,1 M NH3 çözeltisi ❏ Deney tüpü (2 adet) Güvenliğiniz için Nasıl Yapacaksınız? 3 Bir deney tüpüne 0,1 M’ lık CuSO4 çözeltisinden 5 mL koyunuz. Üzerine damlalık yardımıyla damla damla NH3 çözeltisi ekleyiniz. Damla sayısının 20’yi aşmamasına dikkat ediniz. Bu arada karışımda çökelme ve renk değişimi olup olmadığını gözlemleyiniz. 3 Aynı deney tüpüne bu kez 60 damla daha NH3 çözeltisi ekleyiniz. Değişimleri gözlemleyiniz. Etkinlik Sonu Soruları 1. CuSO4 çözeltisi üzerine 20 damla NH3 çözeltisi eklediğinizde hangi değişiklikleri gözlemlediniz? Bu değişikliklerin nedeni ne olabilir? 2. Çözeltiye 60 damla daha NH3 çözeltisi eklediğinizde hangi değişiklikleri gözlemlediniz? Değişikliklerin nedeni ne olabilir? İki farklı tuzun suda çözünmeleri ile oluşan çözeltiler birbiriyle karıştırıldığında bazen çökelme oluşur. Örneğin, Pb(NO3)2 çözeltisine KI çözeltisinden az bir miktar eklendiğinde kabın tabanından yukarıya doğru uzanan sarı renkli bir çökeleğin oluştuğu gözlenir (Şekil 3.2). Şekil 3.2: Pb(NO3)2 ve KI çözeltileri karışımında çökelek oluşumu 170 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Pb(NO3)2 ve KI çözeltilerinin karıştırılmasıyla çökelek oluşması olaylarının tepkime denklemleri şöyledir: – Pb(NO3)2(k) → Pb2+ (suda) + 2NO3(suda) KI(k) → K+(suda) + I –(suda) – – + – + Pb2+ (suda) + 2NO3(suda) + 2K (suda) + 2I (suda) → PbI 2(k) + 2K (suda) + 2NO3(suda) Oluşan bir sarı çökeleğe KI çözeltisinin aşırısı eklendiğinde çözelti içinde bir miktar çökeleğin tekrar çözündüğü gözlenir. Bu olayda ortak iyonun çözünürlüğü azaltması beklenirken çözünürlüğü artırması dikkat çekicidir. Bu olayın açıklaması şöyledir: Çökeltiye KI’ün aşırısı eklendiğinde ortak iyon olan I – iyonu Lewis bazı gibi davranır ve PbI 2’ün çözünürlüğünü artırır. PbI 2(k) + 2I –(suda) → PbI2– 4(suda) Yaptığınız etkinlikte CuSO4 çözeltisi üzerine NH3 çözeltisinden 20 damla damlattığınızda açık mavi renkli bir çökelti oluşur. Bu durum açık mavi renkli Cu(OH)2’in çökmesinden ileri gelir. Tepkimenin denklemi aşağıdaki gibidir: – + NH3(suda) + H2O(s) NH 4(suda) + OH(suda) – Cu2+ Cu(OH)2(k) (suda) + 2OH(suda) Açık mavi çökelti Cu(OH)2’e 60 damla daha amonyak çözeltisi eklendiğinde NH3, OH– iyonları ile yer değiştirerek koyu mavi renkli Cu(NH3)42+ iyonunu oluşturur. Tepkime denklemi aşağıdaki gibidir: – 2+ Cu(OH)2(k) + 4NH3(suda) Cu(NH3) 4(suda) + 2OH(suda) Açık mavi çökelti Koyu mavi çözelti Yukarıdaki iki tepkime denklemi toplanırsa kompleks oluşumuna ait net tepkime denklemi bulunur. 2+ + Cu(2suda [Cu(NH3 )4 ]( suda ) ) + 4NH3( suda ) Bu tepkime denklemine göre kompleks oluşum denge bağıntısını aşağıdaki gibi yazabiliriz: K ol = [Cu(NH3 )4 ]2 + [Cu2 + ] [NH3 ] 4 Kompleks oluşumuna ilişkin denge sabitine oluşum sabiti (Kol) denir. Bazı komplekslere ait oluşum sabitleri Tablo 3.6’da verilmiştir. İnceleyiniz. Çözünme dengesindeki bir iyonun kompleks oluşturarak çözünürlük dengesini etkilemesine ve çözünürlüğü artırmasına, AgCl tuzunun doymuş çözeltisine NH3 eklenerek Ag(NH3)+2 kompleksi oluşturması da örnek verilebilir. + − AgCl(k ) Ag( suda ) + Cl( suda ) K çç = [ Ag+ ] [Cl− ] + Ag(+suda ) + 2NH3( suda ) Ag(NH3 )2( suda ) K ol = [ Ag(NH3 )2+ ] [ Ag+ ] [NH3 ]2 AgCl çözeltisine eklenen NH3, Lewis bazı olarak davranır ve AgCl’ün çözünürlüğünü artırır. Oluşum denge bağıntısına göre NH3 derişimi arttıkça çözünürlüğün azalması beklenirken amonyaklı gümüş kompleksinin oluşması denge oluşum bağıntısında olduğu gibi iyon derişimini artırır. Bu da oluşum sabitinin (Kol) büyümesine neden olur. Benzer şekilde fotoğrafçılıkta film yüzeyine kaplı gümüş halojenürü uzaklaştırmak için kompleks oluşturmak üzere tiyosülfat (S2O32– ) iyonları kullanılır. 3. ÜNİTE: Çözeltilerde Denge 171 3− Ag+( suda ) + 2S2O23(−suda ) [ Ag(S2O3 )2 ]( suda ) Böylece gümüş halojenürün çözünürlük dengesindeki Ag+ iyonlarının bir kısmı kompleks oluşumu ile ortamdan uzaklaşırken Kçç’nin sabit kalması için gümüş halojenürün bir kısmı çözünür. Sonuç olarak kompleks oluşumu ile suda az çözünen tuzların daha çok çözünmelerinin sağlanabileceği söylenebilir. Tablo 3.6: Bazı kompleks iyonların oluşumuna ait 25 ˚C’taki denge sabitleri Kompleks iyon Kompleks oluşumunda Kompleks oluşum sabiti (Kol) denge durumu Ag(NH3) +2 + Ag+ + 2NH3 Ag(NH3 )2 1,6 · 107 Ag(CN) –2 − Ag+ + 2CN− Ag(CN)2 1,0 · 1021 Cu(CN) 2– 4 2− Cu2+ + 4CN− Cu(CN)4 1,0 · 1025 Cu(NH3) 2+ 4 2+ Cu2+ + 4NH3 Cu(NH3 )4 5,0 · 1012 Cd(CN) 2– 4 2– Cd2+ + 4CN− Cd(CN)4 7,1 · 1016 CdI 2– 4 HgCl 2– 4 2,0 · 106 2− Hg2+ + 4Cl− HgCl4 1,5 · 1016 HgI 2– 4 1,7 · 1030 Hg(CN) 2– 4 2− Hg2+ + 4CN− Hg(CN)4 2,0 · 1041 Co(NH3) 3+ 6 3+ Co3+ + 6NH3 Co(NH3 )6 5,0 · 1031 Zn(NH3)2+ 4 2+ Zn2+ + 4NH3 Zn(NH3 )4 2,9 · 109 Kompleksin ayrışması dengesi ile oluşum dengesi arasındaki ilişki, kompleksin kararlı olup olmayacağını belirler. Örneğin, [Ag(NH3)2]+ kompleksinin ayrışma dengesi şöyledir: + [ Ag(NH3 )2 ]+( suda ) Ag( suda ) + 2NH3( suda ) Ayrışma tepkimesinin denge bağıntısı aşağıdaki gibi yazılabilir: K ayrışma = [ Ag+ ] [NH3 ]2 [ Ag(NH3 )2 ]+ Bu denge durumuna ait deneysel olarak bulunan ayrışma denge sabitinin değeri Kayrışma = 6,3 · 10–8 dir. [Ag(NH3)2 ]+ kompleksinin oluşma tepkimesi ve denge bağıntısı şöyledir: + Ag+( suda ) + 2NH3( suda ) Ag(NH3 )2( suda ) 172 ORTAÖĞRETİM KİMYA 11 DERS KİTABI K ol = [ Ag(NH3 )2 ]+ [ Ag+ ] [NH3 ]2 Dikkatinizden kaçmadığı gibi Kayrışma dengesi Kol dengesinin tersidir. Bu durumda Kol ile Kayrışma 1 sabitleri için K ol = bağıntısı yazılabilir. Bu bağıntıda Kayrışma sabitinin değeri yerine yazılırsa; K ayrışma K ol = 1 6, 3 · 10−8 Kol = 1,6 · 107 değeri elde edilir. Bu sonuç kompleks oluşma denge sabitinin ayrışma denge sabitinden daha büyük olduğunu gösterir. Dolayısıyla kompleksin oluşması, ayrışmasına göre daha kararlı bir olaydır. Kana kırmızı rengini veren hemoglobin, merkez atomu durumundaki Fe2+ iyonunun dört köşesine N atomları vasıtasıyla ligand olarak bağlanan ligand konumundaki bazların oluşturduğu globin molekülü ile sudan oluşan kompleks bir molekül (protein)dür. Yapısındaki su molekülü yerine oksijen molekülünün bağlanmasıyla oksihemoglobine dönüşür. Akciğerlerde gerçekleşen bu olay şöyledir: Hemoglobin( suda ) + O2( g ) Oksihemoglobin( suda ) + H2O( s ) Oksihemoglobin kan plazması ile dokulara taşınır. Dokularda tepkime geri dönerek oksihemoglobin yeniden hemoglobin hâline dönüşür. Serbest kalan oksijen difüzyonla hücrelere geçer. CO solunduğunda oksijenden daha aktif olduğundan hemoglobine CO bağlanır ve oksihemoglobinden daha kararlı olan karboksihemoglobin kompleksi oluşur. Bu durum oksijenin dokulara taşınmasını engeller ve ölüme neden olur. Siyanür zehirlenmelerinde de benzer tepkime söz konusudur. HemoglobinO2( suda ) + CO( g ) Hemoglobin CO( suda ) + O2( g ) Metal zehirlenmelerinde de kompleks oluşumu söz konusudur. Bu tür zehirlenmelerde protein yönünden zengin olan yoğurt, sağaltımı sağlamak üzere hastaya yedirilir. Böylece metal iyonları yerine proteinlerin bağlanmasıyla daha kararlı kompleks oluşturulmaya çalışılır. 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. PtCl42– kompleksinin oluşum denge bağıntısını yazınız. 2. [Zn(C2O4)2]2– kompleksinin merkez atomunu, ligandını, Lewis asidini ve Lewis bazını yazınız. – 3. Ligandların merkez atomuna bağlanma etkinliği CN– > NO2– > NH3 > NCS > H2O > F– > Cl– şeklinde sıralanır. Buna göre aşağıdaki kompleksleri kararlılık sırasına göre sıralayınız. [Zn (NH3)4]2+ , [Zn(H2O)4]2+, [Zn(CN)4]2–, [Ag(NH3)2]+ , [Ag(CN)2]–, [Ag(NCS)2]–, [Ag(H2O)2]+ 3− 4. Ag+( suda ) + 2S2O23(−suda ) Ag(S2O3 )2( suda ) kompleksinin oluşum denge bağıntısını yazınız. B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Kompleks oluşumunda her ligand bir elektron çifti verir. ( … ) 2. Komplekslerde metal katyonlarına merkez atomu denir. ( … ) 3. Moleküller aralarında koordine kovalent bağ yaparak iyon kompleksi oluştururlar. ( … ) 2+ + 4. Cu2( suda [Cu(H2O)4 ] kompleks oluşumunda H2O Lewis asidi olarak ( … ) ) + 4H2O( s ) tepkimeye katılır. 3. ÜNİTE: Çözeltilerde Denge 173 5. H+ + NH3 → NH+4 tepkimesine göre H+ Lewis asidi, NH3 Lewis bazıdır. ( … ) + − 6. Pb(2suda PbCl2(k ) tepkimesi kompleks oluşumuna örnektir. ( … ) ) + 2Cl( suda ) 2+ 7. Açık mavi renkli Cu iyonları içeren karışıma NH3 eklendiğinde rengin koyu ( … ) maviye dönüşmesi [Cu(NH3)4]2+ kompleks iyonundan ileri gelir. C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. [Cu(NH3)4]2+ Bileşiği için; I.Cu2+ merkez atomudur. II.NH3 liganttır. III.Cu2+ Lewis bazıdır. yargılarından hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 2– 2. Zn(OH)2(k) + 2OH–(suda) Zn(OH) 4(suda) kompleksinin oluşum tepkimesinin denge bağıntısı aşağıdakilerden hangisidir? A) K ol = D) K ol = [ Zn2 + ] · [OH− ]2 [ Zn(OH)24 − ] [ Zn(OH)24 − ] − 2 [OH ] B) K ol = E) K ol = 1 [ Zn2 + ] · [OH− ]2 C) K ol = [ Zn(OH)4 ]2 − [ Zn(OH)2 ] [OH– ]2 1 [OH− ] 2 3. CuSO4 çözeltisine; I.Su eklendiğinde açık mavi renk oluşmaktadır. II.HCl asit eklendiğinde renk maviden yeşile dönmektedir. III.Amonyak eklendiğinde koyu mavi renk oluşmaktadır. Buna göre Cu2+ iyonlarının bu maddelerle oluşturduğu kompleks iyonların formülleri aşağıdakilerin hangisinde doğru verilmiştir? I ––– A) CuSO4 · 5H2O II ––– CuCl2 III ––– [Cu(NH3)2]2+ B) [Cu(H2O2]2+ CuCl–3 [Cu(NH3)4]4+ C) CuSO4 CuCl42– [Cu(NH3)2]2+ D) [Cu(H2O)4]2+ CuCl42– [Cu(NH3)4]2+ E) Cu2+ Cu2Cl2 [Cu(NH3)2H2O]2+ 4. AgCl çökeleğine aşağıdaki çözeltilerden hangisi eklendiğinde bir kompleks oluşumu gerçekleşir? A) H2O B) NH3 C) Mg(OH)2 D) KCl E) Na2CO3 5. [Cd(CN)4]2– kompleks iyonunun 25 ˚C’ta denge oluşum sabiti Kol = 2 · 1018 olarak bulunmuştur. Buna göre aynı koşullarda bu kompleksin ayrışma sabiti aşağıdakilerden hangisidir? A) 5 · 10–19 B) 4 · 10–18 C) 2 · 10-9 D) 16 · 10–6 E) 2,5 · 10-4 + − 6. AgBr(k ) Ag( suda ) + Br( suda ) dengesinde aşağıdakilerden hangisi AgBr’ ün çözünürlüğünü artırmaz? A) NH3 174 B) HBr C) SNC– D) HCN E) AgNO3 ORTAÖĞRETİM KİMYA 11 DERS KİTABI TİTRASYON BÖLÜM İÇERİĞİ 1. Tesir Değeri 2. Eş Değer Kütle ve Eş Değer Sayısı 3. Asit-Baz Titrasyonları Su kirliliğinde suyu kirleten etkenlerin, hava kirliliğinde havayı kirleten etkenlerin, gıda maddelerinde koruma ya da boyama amaçlı kullanılan maddelerin miktarlarının bilinmesi büyük önem taşır. Yukarıda saydıklarımızın dışında portakal suyundaki askorbik asit miktarının saptanmasından, çamaşır suyundaki klor miktarının belirlenmesine kadar pek çok olayda titrasyondan yararlanılır. Bu bölümde bazı titrasyon örneklerini öğrenecek ve uygulayacaksınız. 3. ÜNİTE: Çözeltilerde Denge 175 1. Tesir Değeri 1. bölümde nötrleşme tepkimelerini incelerken asit ve bazların tam nötrleşme tepkimelerinde değerliklerinden yararlanarak hangi mol sayıları oranında tüketileceklerini bulduk. Ancak birbirinden farklı pek çok tepkimede asit ve bazlar her zaman yer almadığından değerlik yerine maddelerin tesir değerini bulmak gerekir. Tesir değeri asit-baz, redoks, çözünme-çökelme tepkimeleri için farklı yöntemlerle bulunur. Tesir değerinden yararlanarak da tüketilecek ya da tepkimeye girecek madde miktarları önceden öngörülerek hesaplanabilir. Tesir değeri asit-baz tepkimelerinde alınan/verilen proton sayısı üzerinden belirlenir. Örneğin; H3PO4 + 3NaOH → Na3PO4 + 3H2O asit-baz tepkimesinde H3PO4 3 proton verdiğinden tesir değeri 3’tür. NaOH bir proton aldığından tesir değeri 1’dir. 2HCl + Ca(OH)2 → CaCl2 + 2H2O tepkimesinde ise HCl 1 proton verdiğinden tesir değeri 1’ dir. Ca(OH)2 2 proton aldığından tesir değeri 2’ dir. Tesir değeri redoks tepkimelerinde alınan/verilen elektron sayısı üzerinden belirlenir. Örneğin; +7 +2 +2 +3 KMnO4 + 5FeCl2 + 8HCl → KCl + MnCl2 + 5FeCl3 + 4H2O tepkimesinde Fe+2 iken 1e¯ vererek Fe+3 hâline yükseltgendiğinden tesir değeri 1’dir. Mn+7 iken 5e¯ alarak Mn+2 hâline indirgendiğinden tesir değeri 5’tir. Tesir değeri çözünme-çökelme tepkimelerinde tepkimeye giren türün yükü esas alınarak belirlenir. Örneğin; Ag+ + Cl– → AgCl çözünme-çökme tepkimesinde Ag+ iyonunun yükü +1 olduğundan tesir değeri 1’dir. Cl– iyonunun yükü –1 olduğundan tesir değeri 1’dir. Tesir değeri farklı tür tepkimeler için hesaplandığında farklı değerlere ulaşılabilir. Bu normaldir. Örneğin; HNO3 + KOH → KNO3 + H2O asit-baz tepkimesinde HNO3 ve KOH’in tesir değeri 1’ dir. +5 +2 +2 3Cu0 + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O redoks tepkimesinde ise HNO3’in tesir değeri, yapısındaki N+5 atomu 3e¯ alarak N+2 hâline indirgendiğinden 3’tür. Bu yüzden tesir değeri tepkimenin türü esas alınarak belirlenir ve tepkime türüne bağlı olarak farklı değerler alabilir. 2. Eş Değer Kütle ve Eş Değer Sayısı Tepkimeye giren maddelerin miktarlarının belirlenmesinde diğer bir yöntem de eş değer kütle ya da eş değer sayısından yararlanmaktır. Eş değer kütle, maddenin mol kütlesinin tesir değerine oranıdır. Eş değer kütle neş, tesir değeri z, mol kütlesi M sembolü ile gösterildiğinden eş değer kütle bağıntısı aşağıdaki gibi yazılabilir: neş = 176 M z ORTAÖĞRETİM KİMYA 11 DERS KİTABI Bir asidin eş değer kütlesi, bu asidin mol kütlesinin gireceği tepkimede vereceği proton sayısına oranına eşittir. Bir bazın eş değer kütlesi ise bu bazın mol kütlesinin gireceği tepkimede vereceği OH– iyonu sayısına oranına eşittir. Örneğin; 1 eş değer kütle HCl : neş = 36, 5 = 36, 5 g 1 1 eş değer kütle H2SO4 : neş = 98 = 49 g 2 1 eş değer kütle NaOH : neş = 40 = 40 g 1 1 eş değer kütle Ca( OH)2 : neş = 74 = 37 g ’ dır. 2 Elementlerin eş değer kütlesi atom kütlelerinin alacağı/vereceği elektron sayısı oranına eşittir. Örneğin; 27 1 eş değer kütle Al : neş = =9g 3 16 = 8 g’ dır. 2 Değişken değerlik alabilen elementler için (Cu1+ – Cu2+ , Fe2+ – Fe3+) birden fazla eş değer kütle söz konusudur. Tuzların eş değer kütlesi mol kütlelerinin tesir değeri oranına eşittir. 1 eş değer kütle O : neş = 1 eş değer kütle CuSO4 : neş = 160 = 80 g 2 1 eş değer kütle FeCl3 162, 5 = 54 ,17 g 3 : neş = 200 = 100 g ’ dır. 2 Bir maddenin gram cinsinden herhangi bir miktarının eş değer kütlesine oranı, eş değer sayısıdır. Madde kütlesi m, eş değer sayısı ε ile gösterilirse; 1 eş değer kütle CaBr2 : neş = ε= m bağıntısı yazılabilir. neş Örneğin, 49 gram H2SO4 in eş değer sayısı : 50 gram CaBr2 ün eş değer sayısı : 3. Asit-Baz Titrasyonları ε = 49 = 1’ dir. 98 2 ε= 50 = 0, 5 ’ tir. 200 2 1. Bölümde “Nötralleşiyorum” etkinliğinde HCl ve NaOH çözeltilerini tepkimeye sokarak nötrleşme anını indikatörlerin renk değişimi ile belirlediniz. Titrasyon sonunda oluşan çözeltinin pH kâğıdı yardımıyla pH’sini ölçerek çözeltinin nötr, asidik ya da bazik özellik gösterdiğini tayin ettiniz. Sizin de “Nötralleşiyorum” etkinliğinde yaptığınız gibi titrasyon deneyleri ile genel olarak derişimi bilinen asit yardımıyla derişimi bilinmeyen bazın, derişimi bilinen baz yardımıyla derişimi bilinmeyen asidin derişimleri belirlenir. Bu genel amaç yanında titrasyon kanın, mide öz sularının, idrarın pH’sini belirlemede kullanılır. Şimdi 8. etkinliği yaparak asit-baz titrasyonunun sonlanma noktasını hangi yöntemleri kullanarak gözlemleyebileceğimizi irdeleyelim. 3. ÜNİTE: Çözeltilerde Denge 177 8. ETKİNLİK: ÇÖZELTİM KAÇ MOLAR? Neler Gerekli? Güvenliğiniz için ❏Üçayak ❏ Bağlama parçası ❏ Büret (50 mL) ❏ Bunzen kıskacı ❏ Destek çubuğu ❏ Erlenmayer (250 mL) ❏ NaOH çözeltisi ❏ 0,1 M H2SO4 çözeltisi ❏ Fenolftalein çözeltisi ❏ Dereceli silindir (50 mL) ❏ pH kâğıdı Nasıl Yapacaksınız? 3 Erlenmayere 20 mL 0,1 M’lık H2SO4 çözeltisinden koyunuz. Üzerine 3-5 damla fenolftalein damlatınız. 3 Bürete derişimi bilinmeyen NaOH çözeltisinden 50 mL koyunuz. Resimdeki etkinlik düzeneğini kurunuz. 3 Bir elinizle büretin musluğunu kullanarak NaOH çözeltisini damla damla H2SO4 çözeltisine ekleyiniz. Bu arada diğer elinizle erlenmayeri sık sık çalkalayınız. 3 Erlenmayerde önce pembe renk oluşur ve kaybolur. Renk kalıcı oluncaya kadar damla damla NaOH çözeltisi eklemeye devam ediniz. Rengin kalıcı olduğu anda büretin musluğunu kapatınız ve kalan çözelti seviyesini okuyarak kullandığınız NaOH çözeltisi hacmini belirleyiniz. 3 pH kâğıdı yardımıyla erlenmayerdeki çözeltinin pH’sini belirleyiniz. Etkinlik Sonu Soruları 1. Erlenmayerde kalıcı pembe renk oluşumunu nasıl açıklarsınız? 2. Etkinlik sonu erlenmayerde oluşan çözeltinin ölçtüğünüz pH değeri neyi gösterir? Yaptığınız etkinlikte titrasyonun sonlanma noktasını (eş değerlik noktası) fenolftalein indikatörünün renk değişimi ile belirlediniz. Eş değerlik noktasındaki çözeltinin pH’sini de pH kâğıdı yardımıyla ölçtünüz. Eş değerlik noktasında hem asit hem de bazın tükendiğini yani asidin de bazın da aşırısının ortamda kalmadığını biliyorsunuz. Etkinlikte tükettiğiniz H2SO4’in derişim ve hacmini bildiğinize göre derişimini bilmediğiniz fakat hacmini belirlediğiniz (Belirlediğiniz hacim 40 mL olsun.) NaOH çözeltisinin derişimini ve eş değer sayısını bulabilirsiniz. 2NaOH + H2SO4 → Na2SO4 + 2H2O H2SO4’in eş değer sayısı, hacmi ile molar derişimi ve tesir değerinin çarpımına eşittir. εH2SO4 = V · M · z Etkinlik sonunda ortamın pH’sini 7 olarak belirlemiş olmalısınız. Bu sonuç asit ve bazın tam nötrleştiğini dolayısıyla titrasyonun eş değerlik noktasında, eş değer sayılarının birbirine eşit olduğunu gösterir (H2SO4’in tesir değerliğinin 2, NaOH’in 1 olduğunu hatırlayınız.). 178 ORTAÖĞRETİM KİMYA 11 DERS KİTABI εH2SO4= εNaOH V1 · M1 · z1= V2 · M2 · z2 20 · 0 ,1· 2 = 40 · M2 · 1 1 2 M2= 0,1 M ’dır. Bu sonuca göre titrasyonda kullandığınız NaOH çözeltisinin derişimi 0,1 M ’dır. ☞ÖRNEK : 22 400 mL 0,25 M Ca(OH)2 çözeltisi HCl çözeltisi ile titrasyona sokulduğunda eş değerlik noktasında 500 mL HCl harcandığı belirleniyor. Buna göre HCl’in derişimi kaç M ’dır? ✍ÇÖZÜM Ca(OH)2 + 2HCl → CaCl2 + 2H2O εCa(OH)2 = εHCl V1. M1. z1 = V2 · M2 · z2 400 · 0,25 · 2 = 500 · M2 · 1 M2 = 0,4 M ’ dır. Asit ve bazların titrasyonunda sonlanma noktasını bir önceki etkinlikte belirlediniz. Şimdi aşağıdaki etkinliği yaparak redoks titrasyonun sonlanma noktasını belirleyiniz. 9. ETKİNLİK: RENKLERİN DANSI Neler Gerekli? ❏ Damlalık ❏ Erlenmayer (250 mL) ❏Üçayak ❏ 0,1 M H2SO4 çözeltisi ❏ Büret (50 mL) ❏ 0,1 M KMnO4 çözeltisi Güvenliğiniz için ❏ Bunzen kıskacı ❏ Destek çubuğu ❏ Bağlama parçası ❏ H2C2O4 (oksalik asit) çözeltisi ❏ Dereceli silindir (50 mL) Nasıl Yapacaksınız? 3 Erlenmayere H2C2O4 çözeltisinden 50 mL koyunuz. Üzerine 3-5 damla H2SO4 çözeltisi ekleyiniz. 3 Bürete 0,1 M KMnO4 çözeltisinden 50 mL koyunuz. Resimdeki etkinlik düzeneğini kurunuz. 3 Bir elinizle büretin musluğunu kullanarak KMnO4 çözeltisini damla damla H2C2O4 çözeltisine ekleyiniz. Bu arada diğer elinizle erlenmayeri sık sık çalkalayınız. 3. ÜNİTE: Çözeltilerde Denge 179 3 Erlenmayerdeki çözeltinin rengi kahverengiye dönünce büretin musluğunu kapatınız. Bürette kalan çözelti seviyesini belirleyerek etkinlikte kullandığınız KMnO4 çözeltisinin hacmini hesaplayınız. Etkinlik Sonu Soruları 1. Erlenmayerdeki çözeltinin renginin kahverengiye dönmesi neyi gösterir? Yaptığınız etkinlikte asit (H2C2O4) kullanmakla birlikte KMnO4 bir baz olmadığından titrasyonun asit-baz titrasyonu olmadığını, H2SO4’in katalizör olarak ortama eklendiğini anlamışsınızdır. Gerçekten de yaptığınız etkinlik asit-baz titrasyonu olmayıp KMnO4’ın Mn’ının indirgendiği H2C2O4’in C’unun yükseltgendiği bir redoks titrasyonudur. H2C2O4 çözeltisinin renginin kahverengiye döndüğü nokta eş değerlik noktasıdır. Titrasyonda gerçekleşen tepkimenin denklemi şöyledir: +7 +3 +4 + 2+ 2MnO–4(suda) + 5C2O2– 4(suda) + 16H (suda) → 2Mn (suda) + 10CO2 + 8H2O Menekşe rengi Kahverengi Titrasyonun eş değerlik noktasında KMnO4 (Etkinlikte 25 mL KMnO4 kullanılmış olsun.) ve H2C2O4 ’in eş değer sayıları birbirine eşittir. Daha önce öğrendiğiniz gibi Mn 5e¯ alarak indirgendiğinden tesir değeri 5, C 2e¯ vererek yükseltgendiğinden tesir değeri 2’dir. Titrasyonun eş değerlik noktasında KMnO4 ’ın eş değer sayısı, H2C2O4’inkine eşittir. Bu eşitlikte tesir değerleri yerine yazılırsa H2C2O4’in derişimi; εKMnO4 = εH2C2O4 V1. M1. z1 = V2 · M2 · z2 25 · 0,1 · 5 = 50 · M2 · 2 M2 = 0,125 M olarak bulunur. ☞ÖRNEK : 23 0,32 gram CaCO3 yakıldıktan sonra asitlendirilerek suda çözülüyor ve CaC2O4 hâlinde çöktürülüyor. CaC2O4 süzülüp yıkandıktan sonra H2SO4 ile asitlendirilerek H2C2O4 hâline döndürülüyor. 0,024 M’ lık KMnO4 çözeltisi ile titrasyona sokuluyor. Eş değerlik noktasında 36,5 mL KMnO4 harcandığı belirleniyor. CaCO3’taki CaO yüzdesini bulunuz. (Ca: 40, O: 16) ✍ÇÖZÜM CaCO3 → CaO + CO2 ⇒ Ca2+ + C2O42– → CaC2O4 +7 +3 CaO + 2H+ → Ca2+ + H2O ⇒ CaC2O4 + 2H+ → Ca2+ + H2C2O4 +4 2KMnO4 + 5H2C2O4 + 16H+ → 2Mn2+ + 10CO2 + 8H2O Titrasyonun eş değerlik noktasında CaO’ in eş değer sayısı H2C2O4’in eş değer sayısına eşit olduğundan aşağıdaki eşitlik yazılabilir: εKMnO4 = εH2C2O4 V1. M1. z1 = V2 · M2 · z2 Öncelikle CaO eş değer kütlesi bulunmalıdır. neş = 180 M dir. z ORTAÖĞRETİM KİMYA 11 DERS KİTABI CaO’in mol kütlesi M = 40 + 16 = 56 g, tesir değeri z = 2 ’dir. neş = ε= 56 = 28 g ’ dır. 2 m neş V1. M1. z1 = V2 · M2 · z2 36, 5 · 10 –3 · 0 , 024 · 5 = m neş m 4, 398 · 10 –3 = 28 –1 m = 1, 23 · 10 g ’dır. 1, 23 · 10 –1 g CaO bulunursa 0, 32 g CaCO3’ ta 100 g CaCO3’ ta x –1 100 · 1, 23 · 10 = 38, 44 g CaO bulunur. 0, 32 CaCO3’taki CaO oranı ≈ %38, 44 ’ tür. x= Şimdi de aşağıdaki etkinliği yaparak çökelme ile sonuçlanan bir titrasyonun sonlanma noktasını belirleyiniz. 10. ETKİNLİK: KİM ÇÖKTÜ? Neler Gerekli? Güvenliğiniz için ❏Üçayak ❏ Bunzen kıskacı ❏ Büret (50 mL) ❏ Bağlama parçası ❏ Destek çubuğu ❏ Erlenmayer (250 mL) ❏ Dereceli silindir (50 mL) ❏ 0,1 M KCl çözeltisi ❏ 0,1 M AgNO3 çözeltisi ❏ 0,1 M K2CrO4 çözeltisi Nasıl Yapacaksınız? 3 Erlenmayere yirmibeşer mL KCl ve K2CrO4 çözeltisi koyunuz. 3 Bürete 50 mL AgNO3 çözeltisi koyunuz. Resimdeki etkinlik düzeneğini kurunuz. 3 Bir elinizle büretin musluğunu kullanarak AgNO3 çözeltisini damla damla erlenmayerdeki çözeltiye ekleyiniz. Diğer elinizle erlenmayeri çalkalayınız. Renk değişimlerini ve çökelmeyi gözleyiniz. 3 Erlenmayerdeki çözeltiye damla damla AgNO3 eklemeye devam ediniz. Kiremit rengi oluşunca büretin musluğunu kapatarak harcanan AgNO3 çözeltisi hacmini belirleyiniz. Etkinlik Sonu Soruları 1. Erlenmayerdeki çözeltide önce beyaz, daha sonra kiremit rengi çökelek oluşması neyi gösterir? 3. ÜNİTE: Çözeltilerde Denge 181 Yaptığınız etkinlik, bir çözeltide iki ya da daha fazla iyonun (Cl–, CrO42– gibi) aynı çöktürücü iyonla (Ag+) çökelek verebildiği durumlarda her bir iyonun çöktürücü iyonla ayrı ayrı çöktürülebilmesini ve birbirinden ayrılmasını sağlayan bir yöntemin uygulamasıdır. Ancak çöktürmenin başarı ile sonuçlanabilmesi çökecek bileşiklerin çözünürlük çarpımları (Kçç’leri) arasında büyük fark olmasını gerektirir. Bu nedenle etkinlikte Kçç’leri birbirinden oldukça farklı olan AgCl ve Ag2CrO4 seçilmiştir. (AgCl için Kçç=1,77.10–10, Ag2CrO4 için Kçç= 1,12 · 10–12 dir.) Etkinlikte öncelikle AgCl daha sonra Ag2CrO4 çökmüştür. Bunun nedeni Örnek 24 ile açıklanmıştır. ☞ÖRNEK : 24 Bir çöktürme titrasyonunda 0,01M K2CrO4 ve 0,01 M KCl çözeltisi karışımına damla damla AgNO3 çözeltisi ekleniyor. a. AgCl ve Ag2CrO4 tuzlarından hangisi daha önce çöker? b. Cl– ve CrO42– iyonlarının birbirinden tamamen ayrılması söz konusu mudur? ✍ÇÖZÜM a. Kçç = [Ag+ ] [Cl– ] (KCl’den gelen iyon derişimidir.) 1,77 · 10–10 = [Ag+ ] 0,01 ⇒ [Ag+ ] = 1,77 · 10–8 M’dır. Bu aşamada Ag2CrO4 çökmesini sağlayabilecek [Ag+ ] ’nin bulunması gerekir. Kçç = [Ag+ ]2 [CrO42– ] (K2CrO4’ tan gelen iyon derişimidir.) 1,12 · 10–12 = [Ag+ ]2 · 0,01 ⇒ [Ag+ ] ≈ 1,058 · 10–5 M ’dır. AgCl’ün çökmesini sağlayabilecek [Ag+], Ag2CrO4’ın çökmesini sağlayabilecek [Ag+]’nden çok küçük olduğundan öncelikle AgCl çöker. b. Ag+ iyonları AgCl hâlinde çöktüğü sürece Ag2CrO4’ın çökmesini sağlayabilecek [Ag+]’ne ulaşılamaz. Dolayısıyla Cl– ve CrO42– iyonlarının tamamen birbirinden ayrılması söz konusudur. 4. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. 0,20 M CH3COOH çözeltisi ile 0,20 M NaOH çözeltisi titrasyonunda aşağıdaki indikatörlerden hangisini kullanırsınız? Neden? (Soruyu yanıtlayabilmek için Tablo 3.4’ten yararlanınız.) a. Metil oranj b. Timol mavisi c. Fenolftalein 2. 0,20 M NH3 çözeltisi ile 0,20 M HCl çözeltisinin titrasyonunda aşağıdaki indikatörlerden hangisini kullanırsınız? Neden? (Soruyu yanıtlayabilmek için Tablo 3.4’ten yaralanınız.) a. Metil kırmızısı b. Fenolftalein c. Timol mavisi 3. 2,40 g NaOH ile hazırlanan 25,0 mL’lik çözelti 0,150 M HCl çözeltisi ile titrasyona sokuluyor. Eş değerlik noktasına ulaşmak için kaç mL HCl çözeltisi gerekir? Eş değerlik noktasında Cl– iyonlarının derişimi kaç M olur? 4. Ag(NH3)2Cl çözeltisine kuvvetli bir asit olan HNO3 çözeltisi eklenirse bir tepkime gözlenir mi? Neden? 182 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 5. Bir çözelti 0,010 M CrO42– ve 0,010 M SO42– iyonları içeriyor. Bu çözeltiye yavaş yavaş Pb(NO3)2 çözeltisi ekleniyor. PbCrO4 için Kçç = 2,0 · 10–16, PbSO4 için Kçç = 2,53 · 10–8 olduğuna göre; a. Çökecek ilk anyon hangisidir? b. İkinci iyon çökmeye başladığı anda [Pb2+ ] kaç M olur? c. Bu iki iyon birbirinden ayrılabilir mi? 6. 200 mL 0,4 M NaOH çözeltisi ile 0,6 M H2SO4 çözeltisinden kaç mL karıştıralım ki karışımın pH’si 12 olsun? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Titrasyon için standart çözeltiler uygun derişimde hazırlanmalı ve kullanılmalıdır. (…) 2. Titrasyonun yapılabilmesi için uygun indikatörlerin seçilmesi gerekir. (…) 3. Çeşme suyundaki klor miktarı tayini asit-baz titrasyonu ile yapılır. (…) 4. Redoks titrasyonlarında indikatörlerden yararlanılır. (…) 5. Çöktürme titrasyonlarında eş değerlik noktası renk değişimi ile belirlenir. (…) 6. Kompleks iyonlar renkli olduklarından titrasyonlarında eş değerlik noktaları ya da (…) sonlanma noktaları kolay belirlenir. C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. 75 mL 0,1 M HCl çözeltisine bromtimol mavisinin renk değiştirmeye başladığı noktaya kadar 37,5 mL NaOH çözeltisi ilave ediliyor. NaOH çözeltisinin M derişimi aşağıdakilerden hangisidir? A) 0,20 B) 0,45 C) 0,60 D) 0,75 E) 1,25 2. Saf olmayan 1,06 g Na2CO3 örneği tümüyle titrasyona sokulduğunda eş değerlik noktasında 40 mL 0,15 M HCl çözeltisi kullanılıyor. Buna göre Na2CO3 kütlece yüzde kaç saflıktadır? (Na : 23, C : 12, O : 16) A) 15 B) 20 C) 30 D) 45 E) 60 2– − 3. Cr (OH)3 + H2O + 5OH– CrO4 + 5H2O + 3e tepkimesinde kromun eş değer kütlesi aşağıdakilerden hangisidir? (Cr : 52) A) 52 B) 26 C) 17,3 D) 13 E) 10,4 4. 0,360 g Na2C2O4’ın titrasyonunda eş değerlik noktasında 48 mL KMnO4 çözeltisi harcandığına göre KMnO4 çözeltisinin 1 mL’si kaç gram FeSO4 · 7H2O bileşiğine eş değerdir? (Na:23, O:16, C:12, Fe:56, S:32, H:1) A) 30,06 B) 6,03 C) 3,06 D) 0,306 E) 0,03 5. Titrasyon için aşağıdakilerden hangisi doğrudur? A) Bir saflaştırma tekniğidir. B) Tepkime hızlarını artırmaya yarayan bir tekniktir. C) Asit ya da baz çözeltilerin derişimlerini saptama tekniğidir. D) Tepkime verimini arttırmaya yarayan bir tekniktir. E) Belirli bir derişimde çözelti hazırlama tekniğidir. 3. ÜNİTE: Çözeltilerde Denge 183 3. Ü N İ T E D E Ğ E R L E N D İ R M E Ç A L I Ş M A L A R I A. Aşağıdaki soruları yanıtlayınız. Çözelti pH ve tabloya not ediyor. Buna göre; Sirke 3 a. Çözeltilerden hangisi en çok asidik özellik gösterir? Neden? Fırın temizleyicisi 13 b. Çözeltilerden hangisi en çok bazik özellik gösterir? Neden? Sabun çözeltisi 8 c. Çözeltilerden hangisi mavi turnusolu kırmızıya çevirir? Mutfak temizleyicisi 11 1. Bir öğrenci pH kâğıdıyla bazı çözeltilerin pH değerlerini ölçüyor 2. Aşağıdaki tabloda verilen denge tepkimelerinin her biri için eşlenik (konjuge) asit/baz çiftlerini tablodaki ilgili bölüme yazınız. Eşlenik asit/baz çifti 1 Denge Eşlenik asit/baz çifti 2 H3O+(suda) + CN–(suda) HCN(suda) + H2O(s) – HNO2(suda) + OH–(suda) NO2(suda) + H2O(s) + – HClO(suda) + NH3(suda) NH 4(suda) + ClO(suda) + – (CH3)2NH(suda) + H2O(s) (CH3)2NH 2(suda) + OH(suda) – F–(suda) + H2O(s) HF(suda) + OH(suda) 2– – H2PO–4(suda) + SO2– HPO 4(suda) + HSO3(suda) 3(suda) 3. 25˚C sıcaklıkta 0,16 gram gümüş dikromat (Ag2Cr2O7) suda çözünerek 100 mL doymuş çözeltisi hazırlanıyor. Buna göre Ag2Cr2O7’ın Kçç’si kaçtır? (Ag : 108, Cr : 52, O : 16) 4. Diş minesinin bileşiminde bulunan kalsiyum fosfat (Ca3(PO4)2) için Kçç = 2,07 · 10–33 tür. Ca3(PO4)2’ın saf sudaki çözünürlüğünü hesaplayınız. 5. 1 gram PbCl2 1 L sıcak suda çözünerek oluşturulan çözelti 25˚C sıcaklığa kadar soğutuluyor. PbCl2’ün bir kısmı kristallenir mi? (Pb: 207 , Cl: 35,5 , PbCl2 için Kçç = 1,70 · 10–5) 6. Deniz suyunda çözünmüş hâlde bulunan magnezyum florür (MgF2) için Kçç= 5,16 · 10–11 dir. MgF2’ün a. Saf sudaki, b. 0,015 M Mg(NO3)2 çözeltisindeki çözünürlüğü bulunuz. 2+ – 7. PbCl2(k) Pb (suda) + 2Cl(suda) ∆H˚ = 23,4 kJ tepkimesinin denge konumuna aşağıdakilerden her birinin etkisini Le Chatelier İlkesi’ne göre açıklayınız. a.1 M Pb(NO3)2 çözeltisi eklemek b. Sıcaklığı artırmak c. Ag+ iyonları içeren bir çözelti eklemek ç. 1 M ’lik HCl çözeltisi eklemek 184 ORTAÖĞRETİM KİMYA 11 DERS KİTABI – 2– 8. Zn(NH3)2+ 4(suda) + 4OH(suda) Zn(OH) 4(suda) + 4NH3(suda) Tepkimesinin denge sabitini bulunuz. (Zn(OH)2 için Kçç = 4 · 10–17, [Zn(NH3)4]2+ için Kol = 3,6 · 108) 9. Oda sıcaklığında bulunan 3,2 · 10–7 M H2S çözeltisine eşit hacimde ve aynı sıcaklıktaki AgNO3 çözeltisi katıldığında çökelmenin başlaması için AgNO3 çözeltisinin derişimi en az kaç M olmalıdır? (Ag2S için Kçç = 6 · 10–50 dir.) 10. Belirli bir sıcaklıkta çözünürlük çarpımı Kçç = 5 · 10–19 olan M(OH)2 bileşiğinin doymuş çözeltisinin pH’si kaçtır? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Asidik katyon içeren tuzların sulu çözeltilerinde pH 7’ den küçüktür. (…) 2. Bazik anyon içeren tuzların sulu çözeltilerinde pH = 7’ dir. (…) 3. Kuvvetli asit-kuvvetli baz titrasyonunun eş değerlik noktasında pH = 7’ dir. (…) 4. Okyanus, göl, havuz, hücre sıvıları ve kan plazması gibi çözeltilerin pH’ lerinin kararlı (…) olması, eş değerlik noktasına yakın ve denge konumunda olmaları anlamındadır. 5. Tesir değeri çözünme-çökelme tepkimelerinde tepkimeye giren türün yükü esas (…) alınarak hesaplanır. 6. Mol kütlesinin tesir değerine oranı eş değer sayısıdır. (…) 7. Asit ve baz tepkimelerinde tesir değeri alınan / verilen proton sayısı üzerinden (…) hesaplanır. 8. Titrasyonun sonlanma noktası eş değerlik noktasıdır. (…) 9. Titrasyonun sonlanma noktasında, renk değişimi, çökelek oluşumu gibi özellikler (…) gözlenir. 10. Bir maddenin mol cinsinden herhangi bir miktarının eş değer kütlesine oranı eş değer (…) kütle sayısıdır. 11. Saf bir tuzun doymuş çözeltisinde iyonları ile arasındaki dengenin sabiti (…) pH’sini verir. 12. Bir merkez atomunun ligandlarla kompleks iyon oluşturduğu tepkimenin denge (…) sabitine “oluşma sabiti” denir. 13. Çözeltide bulunan iyonlardan birini çökelek hâlinde çöktürme, diğerini çökeltide (…) bırakma yöntemine “ayrımsal çöktürme” denir. C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Aşağıdakilerden hangisi suda hidronyum iyonu derişimini arttırır? A) NaOH C) HCl D) CH3COOC2H5 E) C2H2OH 2. pOH değeri 10 olan bir çözeltinin pH değeri aşağıdakilerden hangisidir? A) 14 B) NaCl B) 10 C) 5 D) 4 E) 2 3. Aşağıdakilerden hangi ikili kuvvetli asit-baz titrasyonu için kullanılmaz? A) HNO3 – KOH B) HF – NaOH D) HCl – KOH E) HI – NaOH 3. ÜNİTE: Çözeltilerde Denge C) HClO4 – KOH 185 4. Herhangi bir zayıf asit, kuvvetli bir baz ile titre edildiğinde titrasyonun eş değerlik noktasında ortamın pH’si aşağıdaki değerlerden hangisi olamaz? A) 7,0 E) 11,2 B) 0,35 C) 0,50 D) 0,75 E) 1,25 B) 0,25 C) 0,45 D) 0,72 E) 1,15 7. Derişimi bilinmeyen bir NH3 çözeltisi 0,1 M HNO3 ile titrasyona sokuluyor. Titrasyonun dönüm noktasındaki pH değeri aşağıdakilerden hangisi olamaz? A) 5,70 D) 10,4 6. Hidroklorik asit çözeltisi ile saf sodyum karbonat (Na2CO3) tepkimeye sokuluyor. Na2CO3’tın 0,53 gramının tepkimede tamamen tükenmesi için HCl çözeltisinden 40 mL harcandığına göre asidin derişimi kaç M ’dır? (Na : 23, C : 12, O : 16) A) 0,15 C) 9,4 5. Sodyum hidroksit çözeltisi formik asitle (HCOOH) titrasyona sokuluyor. Titrasyonda dönüm noktasına ulaşıncaya kadar 4,6 gram HCOOH örneği için 80 mL NaOH çözeltisi harcandığına göre NaOH çözeltisinin molar derişimi kaçtır? (H : 1, C : 12, O : 16) A) 0,25 B) 8,6 B) 6,40 C) 6,70 D) 6,85 E) 7,12 8. Aşağıdaki çözeltilerden hangisi zayıf baz-kuvvetli asit titrasyonunun eş değerlik noktası ürünüdür? A) CH3COONa B) KCN 9. İndikatör ––––––––– I. Metil sarısı C) Na2CO3 D) NH4NO3 E) CaSO4 Renk değişim pH aralığı ––––––––––––––––––––––– 2,9 – 4,0 II. Bromkresol yeşili 3,8 – 5,4 III. Metil kırmızısı 4,2 – 6,3 IV. Fenol kırmızısı 6,8 - 8,0 V. Fenolftalein 8,0 - 9,0 Yukarıda renk değişim pH aralıkları verilen indikatörlerden hangileri zayıf bazların kuvvetli asitlerle titrasyonunda kullanılamaz? A) I ve II B) IV ve V C) II, III ve V D) I, IV ve V E) III, IV ve V 10. İndikatörler için aşağıdakilerden hangisi doğrudur? A) Asit tepkimelerinin hızlarını arttıran maddelerdir. B) Baz tepkimelerinin hızlarını arttıran maddelerdir. C) Tepkimelerde dengeyi sağlayan maddelerdir. D) Aktivasyon enerjisini yükselten maddelerdir. E) Titrasyonda dönüm noktasını belirten maddelerdir. 11. Bir litre sulu çözeltide 1 · 10–3 mol H+ iyonu içeren çözeltinin pH değeri kaçtır? A) 0 B) 3 C) 5 D) 7 E) 11 12. I. Kuvvetli asitler suda tamamen iyonlaşır. II. Asit ve bazlar nötrleşerek tuz oluşur. III. Çözeltilerin asitlik ya da bazlık dereceleri pH ölçeği ile ölçülür. IV. Kısmen iyonlaşan asitler zayıf asitlerdir. Yukarıdaki ifadelerden hangileri doğrudur? A) I ve II 186 B) III ve IV C) I, II ve III D) II, III ve IV E) I, II, III ve IV ORTAÖĞRETİM KİMYA 11 DERS KİTABI 13. 10 ˚C’ta çözünürlük çarpımı Kçç = 4 · 10–18 olan Pb(OH)2’in aynı sıcaklıkta 200 mL doymuş çözeltisini hazırlamak için kaç g Pb(OH)2 gerekir? (MPb(OH)2: 241 g/mol) A) 7,23 · 10–3 B) 2,41 · 10–4 C) 4,82 · 10–5 D) 1 · 10–6 E) 2 · 10–7 14. 25 ˚C’ta 200 mL 0,5 M Sr(NO3)2 çözeltisi ile 800 mL 0,125 M Na2CrO4 çözeltisi karıştırılıyor. Oluşan çözeltide Sr2+ iyonlarının derişimi kaç molardır? (SrCrO4 için Kçç = 3,6 · 10–5 tir.) A) 6 · 10–7 B) 6 · 10–3 C) 2,8 · 10–3 D) 3,6 · 10–3 E) 1 · 10–2 15. 3 · 10–5 M 200 mL AgNO3 çözeltisi ile 400 mL NaCl çözeltisi sıcaklık 25 ˚C’ta sabit kalacak şekilde karıştırıldığında bir çökelme olabilmesi için NaCl çözeltisinin başlangıç derişimi en az kaç M olmalıdır? (AgCl için Kçç = 1,77 · 10–10 dur.) A) 6 · 10–3 B) 3 · 10–3 C) 2 · 10–3 D) 5 · 10–4 E) 2,655 · 10–5 16. PbBr2 ün çözünürlük çarpımı belirli sıcaklıkta 4 · 10–6 olduğuna göre 5 L 0,2 M KBr çözeltisinde en çok kaç mol PbBr2 çözünür? A) 5 · 10–4 B) 4 · 10–3 C) 2,5 · 10–4 D) 0,1 E) 0,4 17. 25 ˚C’ta Kb = 9 · 10–7 olan bir değerli zayıf bir bazın 0,1 M ’lık çözeltisinde yüzde kaçı iyonlaşmıştır? A) 0, 3 B) 0, 9 C) 3 D) 9 E) 30 18. Bir değerli asidin 0,5 M ’lık çözeltisinde %0,3 iyonlaşma olduğuna göre aynı sıcaklıkta asitlik sabitinin değeri kaçtır? A) 1,8 · 10–3 B) 3 · 10–3 C) 9 · 10–3 D) 4,5 · 10–6 E) 9 · 10–6 19. 25 ˚C’ta iyonlaşma sabiti Kb = 4 · 10–10 olan 0,25 M ’lık bir değerli baz çözeltisinde çözünürlük çarpımı Kçç = 5,9 · 10–15 olan Cd(OH)2’in çözünürlüğü kaç mol/L ’dir? A) 1 · 10–5 B) 2,5 · 10–5 C) 5,9 · 10–5 D) 1,25 · 10–6 E) 1,2 · 10–10 20. 0,1 M ’lık 100 mL H3PO4 çözeltisini tamamen nötrleştirmek için 20 g KOH çözeltisi tüketildiğine göre KOH çözeltisi kütlece yüzde kaçlıktır? (MKOH : 56 g/mol) A) 2,4 B) 4,2 C) 6,7 D) 8,4 E) 11,2 21. 0,65 g Zn ile 100 mL 0,3 M HCl tepkimeye sokuluyor. Ürünler ZnCl2 ve H2 olduğuna göre tepkime sonunda pH kaç olur? (Zn : 65) A) 0,1 B) 1 C) 2,5 D) 3 E) 7 22. X : kuvvetli asit - zayıf baz Y : kuvvetli asit - kuvvetli baz Z : kuvvetli baz - zayıf asit ile oluşturulmuş tuzlardır. Bu tuzların sulu çözeltilerindeki pH’leri için hangi seçenek doğrudur? X Y Z ––––– –––––– –––––– A) pH < 7 pH = 7 pH > 7 B) pH > 7 pH = 7 pH < 7 C) pH = 7 pH = 7 pH = 7 D) pH < 7 pH < 7 pH = 7 E) pH = 7 pH > 7 pH = 7 3. ÜNİTE: Çözeltilerde Denge 187 4. ÜNİTE ELEKTROKİMYA ÜNİTE İÇERİĞİ 1.MADDE VE ELEKTRİK 2. STANDART ELEKTROT POTANSİYELİ 3. ELEKTROKİMYASAL HÜCRELER Bu ünitede, madde-elektrik ilişkisi irdelenerek elektrot potansiyellerinin derişim ve sıcaklıkla değişimi incelenecek, yaygın pillerin ve çok kullanımlık pillerin (akü) yaygın örneklerinin çalışma ilkeleri açıklanacaktır. 188 ORTAÖĞRETİM KİMYA 11 DERS KİTABI MADDE VE ELEKTRİK BÖLÜM İÇERİĞİ 1.Enerji Dönüşümleri 2.Faraday Yasaları 3.Yükseltgenme Basamağı 4. Denklemlerin Denkleştirilmesi Radyo, teyp, hesap makinesi, saat vb. pek çok elektrikli aracı çalıştıran kuru piller nasıl elektrik enerjisi üretebilmektedir? Elektrik enerjisi, akümülatörlerde nasıl depolanabilmektedir? Elektrolit çözeltiler elektrik akımını nasıl iletmektedir? Suyun elektrolizinde nasıl bir kimyasal olay gerçekleşmektedir? Demir, rutubetin etkisiyle nasıl aşınmaktadır? Metaller, bileşiklerinden elektrik enerjisi ile (elektrolizle) nasıl ayrıştırılmakta ya da saflaştırılmaktadır? Güneş enerjisi, nasıl bir kimyasal yol izlenerek elektrik enerjisine dönüştürülebilmektedir? Resimde görüldüğü gibi gümüş nitrat çözeltisine daldırılan bakır parçasının üzeri neden gümüş ile kaplanmakta, kurşun(II) nitrat çözeltisine daldırılan bakır parçası bu çözeltiyle neden tepkime vermemektedir? Yukarıda nedenlerini sorduğumuz olaylar indirgenme ve yükseltgenme tepkimeleri sonucu oluşur. Yine yukarıda bir kısmına değinilen olaylara ait tepkimeleri gerçekleştirebilmek, bu tepkimelerin yönlerini değiştirebilmek, hatta bazılarına engel olmak, elektrokimya bilgisini gerektirir. 4. ÜNİTE: Elektrokimya 189 1. Enerji Dönüşümleri Kimyasal tepkimelerin yürüyüşüne enerji dönüşümünün eşlik ettiğini, bu dönüşümün genellikle ısı alış verişi şeklinde olduğunu biliyorsunuz. Termodinamiğin Birinci Yasası, evrendeki enerji miktarının sabit olduğunu ve bu sabitliğin korunarak enerjinin bir şekilden diğer bir şekle dönüşebileceğini ifade eder. Bu bağlamda bütün enerji türleri kendiliğinden ısı enerjisine dönüşebildikleri hâlde ısı enerjisi kendiliğinden diğer enerji türlerine tam olarak dönüşmez. Isının tümünün diğer enerji türlerine dönüştürülemeyeceği gerçeği Termodinamiğin İkinci Yasası olarak bilinir. Kimyasal enerji tam olarak ısı enerjisine dönüştürebildiği gibi mekanik, elektrik vb. enerji türlerine de dönüştürülebilmektedir. Elektrik enerjisi de kimyasal enerjiye dönüştürülerek bu yolla yeni maddeler elde edilebilmekte, kimyasal enerjinin elektrik enerjisine, elektrik enerjisinin tekrar kimyasal enerjiye dönüşebilmesi günlük yaşamımızda önemli bir yer tutmaktadır. Bildiğiniz gibi akümülatör bu dönüşümün karşılıklı olarak gerçekleştiği bir teknoloji harikasıdır. Kimyasal enerjinin elektrik enerjisine, elektrik enerjisinin kimyasal enerjiye dönüşümünü inceleyen bilim dalı elektrokimya adıyla anılır. Elektrik enerjisinin kimyasal enerjiye dönüşümü, kimyasal enerjinin elektrik enerjisine dönüşümü elektrokimyanın iki ana konusudur. Çözeltilerin ve iyonik bileşiklerin erimiş (sıvı) hâllerinin içerdikleri iyonlar vasıtasıyla elektrik akımını ilettiklerini biliyorsunuz. Elektrik akımını ileten bu tür maddelere elektrolit denir. Tersinmez olarak yürüyen tepkimeler ekzotermik ise bu tepkimelerden ısı enerjisi elde edilir. Bu ısının bir kısmı termik santrallerde yeniden elektrik enerjisine dönüştürülür. Isı enerjisinin tam olarak elektrik enerjisine dönüştürülmesi olanaklı olmadığından bu dönüşümde verim oldukça düşüktür. Ancak yine de bu yolla elde edilen enerji kullanılabilir, tasarruf edilebilir bir enerjidir. Örneğin, Bandırma Gübre Fabrikasında önce sülfürik asit ve amonyak, daha sonra bunlardan amonyum sülfat üretilir. Üretim aşamalarında açığa çıkan ısı ile su buharlaştırılır. Bu buhar, türbinlere verilerek fabrika için gerekli olan elektrik enerjisi üretilir. 2. Faraday Yasaları Elektrik akımının elektrolitlerde iyonlar vasıtasıyla iletilmesi sırasında kimyasal değişiklik meydana gelmez. Ancak elektrolit bir elektroliz hücresine konulup içine elektrotlar daldırılır, bu elektrotlar da bir doğru akım devresine bağlanırsa pozitif yüklü iyonlar negatif yüklü elektrota (katoda), negatif yüklü iyonlar ise pozitif yüklü elektroda (anoda) doğru çekilirler. Bu nedenle pozitif yüklü iyonlara katoda giden anlamında katyon, negatif yüklü iyonlara anoda giden anlamında anyon denilir. Elektrolit çözeltiye, elektrotlar yardı- – mıyla bir doğru akım kaynağından elde edilen + elektrik akımı verildiğinde elektrotlar arasında bir elektrik alanı oluşur. Elektrik alanı etkisi ile katyonlar katoda, anyonlar anoda doğru hareket ederler. Katoda gelen katyonlar katottan elektron alarak indirgenir. Anoda giden anyon- – + lar ise anoda elektron vererek yükseltgenirler. Diğer bir ifade ile katotta indirgenme yarı tepkimesi, anotta yükseltgenme yarı tepkimesi gerçekleşir (Resim 4.1). 190 Resim 4.1: Erimiş PbCl2’den doğru akım geçirilerek başlatılan iyon göçü ORTAÖĞRETİM KİMYA 11 DERS KİTABI Elektrolitlerden elektrik akımı geçişi sırasında elektrolit içinde kimyasal değişme olmaz. Kimyasal değişmeler elektrot içindeki katyon ve anyonlar ile elektrotlar arasındaki ara yüzeylerde gerçekleşir. Bu yüzden elektroliz, indirgenme ve yükseltgenme olaylarının ayrı ayrı elektrotlarda aynı anda gerçekleştiği bir redoks olayıdır. Elektrik enerjisinin kimyasal enerjiye dönüştürülerek elektrolitlerin bileşenlerine ayrılması olayına elektroliz denir. 10. sınıf I. ünitede atom altı parçacıkları keşfederken Faraday Yasalarını ve atom kavramının tarihsel gelişimini öğrenmiştiniz. Şimdi Faraday Yasalarını kısaca hatırlayalım. Biliyor musunuz? Michael Faraday (1791-1867) Elektrik motoru ve jeneratörün mucididir. Elektroliz yasaları onun ve adıyla anılır. Birinci Faraday Yasası Elektroliz sırasında katot ya da anotta yani elektrotlarda kimyasal değişikliğe uğrayarak ayrılan madde miktarları, devreden geçen elektrik yükü miktarı ile doğru orantılıdır. İkinci Faraday Yasası Farklı elektrolitlerin elektrolizi sırasında her hücreden geçen elektrik miktarı aynı ise her hücre elektrotlarında kimyasal değişikliğe uğrayarak ayrılan maddelerin eş değer sayıları da aynıdır. Bildiğiniz gibi 1 eş değer kütlenin ayrılması için gerekli elektrik yükü miktarı, 1 değerlikli 1 mol iyonun ayrılması için gerekli elektrik yükü miktarına eşittir. Çünkü değerliği 1 olan 1 mol iyon aynı zamanda 1 eş değer kütle iyon demektir. 1 değerlikli 1 mol iyonun yüküne 1 eş değer elektrik yükü ya da Faraday denir ve F ile gösterilir. 1 elektronun yükü R. A. Millikan tarafından 1,602 · 10–19 Coulomb olarak bulunduğuna ve 1 eş değer kütle içinde Avogadro sayısı kadar (6,02 · 1023 ) 1 değerlikli iyon bulunabileceğine göre 1 Faraday, Q = e · NA = 1,602 · 10–19 · 6,023 · 1023 ≈ 96 500 Coulomb olarak hesaplanır. Buna göre 1 mol e– = 96 500 C (kulon) = 1 F (Faraday) ’dır. Bir elektroliz hücresi hangi elektrolit ile dolu olursa olsun bu elektroliz hücresinden 1 Faraday yani 96500 C elektrik yükü geçtiğinde elektrotların her birinde daima eş değer kütle madde birikir (Tablo 4.1). Tablo 4.1: 1 Faraday elektrik yükü ile toplanan madde miktarları ve eş değer kütleler Elektrottaki eşitlik Ag+ + 1e¯ → Ag0 1 mol e¯ için uygulanmış eşitlik Eş değer kütle 1 F ile toplanan madde miktarı Ag+ + 1e¯ → Ag0 108 g 39 g K +1e¯ → K K +1e¯ → K 1 mol Ag atomu 1 mol K atomu Cu2+ + 2e¯ → Cu0 1/2Cu2+ + 1e¯ → Cu0 1/2 mol Cu atomu 32 g 1/2 mol Mg atomu 12 g – 0 0 1 mol Cl atomu (1/2 Cl molekülü) 2 Cl → 1/2Cl 2 + 1e¯ Cl → 1/2Cl 2 + 1e¯ 9g + 0 2+ + 0 0 2+ 0 + 2e¯ → Mg 1/2Mg + 1e¯ → Mg 1/3 mol Al atomu Al3+ + 3e¯ → Al0 1/3Al3+ + 1e¯ → Al0 Mg – 4. ÜNİTE: Elektrokimya 35,5 g 191 Faraday Yasaları’na göre elektrotlarda ayrılan maddelerin eş değer sayısı, devreden geçen eş de- ğer elektrik yükü sayısına eşittir. Eş değer elektrik yükü sayısı εF ile gösterilirse εm = εF eşitliği yazılabilir. Maddenin eş değer sayısı, m kütlesinin atom kütlesine oranının tesir değerliği ile çarpımıdır. Faraday sayısı ise devreden geçen elektrik yükü miktarının 1 eş değer elektrik yüküne oranıdır. Buna göre; Q m bağıntısı yazılabilir. ·z= M 96 500 Elektrik yükü miktarı elektroliz süresince devreden geçen akım şiddeti ile akımın geçme süresi çarpımına eşit olduğundan bağıntıdaki Q yerine eşiti olan i · t yazılabilir. i· t M · i· t m ·z= m= 96 500 96 500 · z M Eğer herhangi bir elektrotta birden fazla, örneğin, iki ayrı madde beraberce toplanıyorsa Faraday m1 denklemi; M · z1 + m2 M · z2 = i· t şeklinde yazılır. 96 500 Faraday Yasaları yardımıyla Q elektrik yükü de ölçülebilir. Bu amaçla kullanılan düzeneklere kulonometre denir. ☞ÖRNEK : 1 Bir elektroliz kabındaki çözeltiden 1 saat süreyle 0,16 amperlik akım geçiriliyor. Devreden kaç Faraday yük geçeceğini bulunuz. ✍ÇÖZÜM 1 saat = 60 · 60 = 3600 s’dir. Devreden geçen elektrik yükü miktarı Q = i · t Q = 0,16 · 3600 = 576 C olur. 96 500 C = 1 Faraday olduğuna göre; F= 576 = 0, 006 F olarak bulunur. 96 500 ☞ÖRNEK : 2 AgNO3 çözeltisinden 4825 C’ luk bir elektrik yükü geçirildiğinde açığa çıkacak gümüş kaç g’ dır? (Ag : 108) ✍ÇÖZÜM Gümüş açığa çıkaran yarı tepkime şöyledir: Ag+(suda) + e– → Ag0(k) 96 500 C 1 mol e− ise 4825 C x 4825 · 1 x= = 0, 05 mol e− dur. 96 500 192 1 mol e− 0,05 mol e x= 108 g Ag açığa çıkarırsa − x 0, 05 · 108 = 5, 4 g Ag açığa çıkarır. 1 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 3 Bakır(II) sülfat (CuSO4) çözeltisi elektroliz edildiğinde 1 mol Cu açığa çıkaran yük miktarını F cinsinden bulunuz. ✍ÇÖZÜM – 0 Cu2+ (suda) + 2e → Cu (k) Yarı tepkime denklemine göre 1 mol Cu açığa çıkaran yük miktarı 2 mol e– dur. Buna göre; 1 mol e− 2 mol e 96 500 C açığa çıkarırsa − x 2 · 96 500 x= = 193 000 C açığa çıkarır. 1 193 000 F= = 2 F ’dır. 96 500 ☞ÖRNEK : 4 Bir yüzük KAuCl4 çözelti içinden 0,20 A’ lik akım geçirilerek altınla kaplanacaktır. 197 mg altın kaplama yapabilmek için elektroliz işlemi kaç saniye sürdürülmelidir? (Au : 197) ✍ÇÖZÜM KAuCl4’de Au’ın yükseltgenme basamağı +3’tür. Altını açığa çıkaran yarı tepkime şöyledir: – 0 Au3+ (suda) + 3e → Au (k) m i· t ·z = M 96 500 0,197 0, 20 · t ·3 = 197 96 500 289, 5 = 1447, 5 s sürdürülmelidir. t= 0, 2 ☞ÖRNEK : 5 2,5 amperlik akım 3 saat süre ile bakır(II) sülfat çözeltisinden geçirildiğinde katotta kaç gram bakır birikir? (Cu : 64) ✍ÇÖZÜM Bakırın yükseltgenme basamağı +2 olup yarı tepkimesi şöyledir: – 0 Cu2+ (suda) + 2e → Cu (k) m . z = i. t M 96 500 m. 2,5 · 3 · 3600 2 = 64 96 500 m = 8, 95 g Cu birikir. ☞ÖRNEK : 6 Seri bağlı iki elektroliz kabından biri Ag+ diğeri Aln+ iyonları içermektedir. Devreden belirli miktarda elektrik akımı geçtiğinde katotta 21,6 g Ag birikirken diğerinde 1,8 g Al birikmektedir. Buna göre Al’un n ile gösterilen yükseltgenme basamağını bulunuz. (Ag : 108, Al : 27) 4. ÜNİTE: Elektrokimya 193 ✍ÇÖZÜM Her bir iyonun indirgenme yarı tepkimesi şöyledir: Ag+ + e¯ → Ag0 108 g Ag ’ü 21, 6 g Ag ’ü x= Aln+ + ne¯ → Al0 1mol e – açığa çıkarırsa x 21,6 · 1 = 0, 2 mol e− açığa çıkarır. 108 Devreden geçen elektrik akımı ve süre aynı olduğundan elektrotlarda toplanan Ag ve Al’un eş değer sayıları birbirine eşittir. Bu eşitlikten yararlanarak aşağıdaki orantı yazılabilir: 1, 8 g Al’u 27 g Al’u x= 0,2 mol e – açığa çıkarırsa x 27 · 0, 2 = 3 mol e− açığa çıkarır. 1,8 O hâlde n = +3 ’tür. Bir tepkimede, tepkimeye giren maddenin kaybettiği elektronlar mutlaka tepkimeye giren bir diğeri ya da diğerleri tarafından kazanılır. Bu nedenle elektron aktarımının olduğu tepkimelere yükseltgenmeindirgenme ya da redoks tepkimeleri denildiğini biliyorsunuz. Örneğin, magnezyum metali ısıtıldığında havada parlak bir alevle yanar. Tepkimede ısı açığa çıkar ve beyaz renkli katı magnezyum oksit bileşiği oluşur (Şekil 4.1). ➊ Oksijen bağları kırılır. Her bir O atomu oktetini tamamlamak için 2e¯ alabilir. O O Bağ kırılır. O + O Bir oksijen molekülü ikili bağa sahiptir. ➋ Magnezyum ve oksijen birleşir. Magnezyumun oksijenle tepkimesi Magnezyum atomu oksijen atomuna vermek üzere 2e¯ kaybeder. Oksijen atomu da bu elektronları kazanarak zıt yüklü iyonlar hâline gelir. Magnezyum oksit oluşumu Zıt yüklü iyonlar arasında iyonik bağ oluşur. 2+ Mg + O 2– Mg [ O ] MgO Şekil 4.1: MgO oluşumu Bu tepkimede magnezyum 2e– vererek 0’ dan +2’ ye yükseltgenir. Oksijen ise magnezyumun verdiği 2e– u alarak 0’dan –2’ye indirgenir. Bu olayın tepkime denklemi şöyledir: Yükseltgendi. 2Mg0 + O02 ⎯→ 2Mg2+O2– İndirgendi. 194 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. Yükseltgenme Basamağı Yükseltgenme-indirgenme tepkimelerinin iyi anlaşılması bakımından 9. sınıf 2. ünitede öğrendiğiniz yükseltgenme basamağı kavramını hatırlamanız gerekir. Deneysel olarak saptanamayan yükseltgenme basamağı redoks tepkimelerinde bir hesap aracı olup bir bileşikteki atomlara ait elektronları belirtme şeklidir. Redoks tepkimelerinde hem iyonik hem kovalent karakterde olan bileşiklerin bütün bileşenlerine ilişkin bir yükseltgenme basamağı olduğu kabul edilir. Yükseltgenme basamaklarının belirlenmesinde aşağıdaki kurallar uygulanır: ® Serbest hâldeki tüm element atomlarının yükseltgenme basamağı sıfırdır. Örneğin, Fe, Zn, C, H2 , O2’in yükseltgenme basamağı sıfırdır. ® IA grubu metallerinin yükseltgenme basamağı +1, IIA grubunun +2, IIIA grubunun +3’tür ve sabittir. Örneğin, Na+, Ca2+ , Al3+ yükseltgenme basamağına sahiptir. ® Hidrojenin metallerle oluşturduğu NaH, CaH2, MgH2 vb. metal hidrürlerde yükseltgenme basamağı –1, diğer bütün bileşiklerinde +1’dir. ® Oksijenin oluşturduğu Na2O, CaO, CO2 , Al2O3, N2O5 vb. pek çok bileşikte yükseltgenme basamağı –2’dir. H2O2 , Na2O2, BaO2 gibi peroksitlerde yükseltgenme basamağı –1’dir. ® Tek atomlu iyonlarda elementin yükseltgenme basamağı iyon yüküne eşittir. Örneğin, magnezyum iyonunun yükü +2, demir iyonunun yükü +3, klor iyonunun yükü –1’dir. Dolayısıyla yükseltgenme basamakları sırasıyla +2, +3 ve –1’dir. ® Bir bileşiği oluşturan elementlerin yükseltgenme basamakları toplamı sıfırdır. Çok atomlu iyonlarda ise iyonu oluşturan elementlerin yükseltgenme basamakları toplamı iyonun yüküne eşittir. Bu eşitliklerden yararlanarak bileşik ya da iyon içinde yükseltgenme basamağı bilinmeyen elementlerin yükseltgenme basamakları hesaplanabilir. Ancak bu hesaplamalar yapılırken bileşik formülündeki atom ya da iyonun formülünde alt indis ile gösterilen sayısını dikkate almak gerekir. Örneğin, H3PO4 bileşiğinin formülünde alt indis ile gösterilen 3 ve 4 sayıları molekülde 3 H, 4 O atomu bulunduğu anlamına gelir. P için belirtilmeyen sayı 1 olup molekülde 1 P atomu bulunduğu anlamındadır. Fe2(SO4)3 formülünde ise alt indis ile gösterilen 2 sayısı (Fe2) bileşikte 2 Fe atomunun, (SO4)3’taki 3 kat sayısı ise öncelikle 3 SO42– iyonunun, ikincil olarak 3 S , 12 O atomunun bulunduğunu ifade eder. Şimdi KClO3 , H2SO4 ve HNO3 bileşikleri ile C2O42– , MnO–4 , Cr2O72– ve PH+4 iyonlarında yükseltgenme basamağı bilinmeyen elementlerin yükseltgenme basamaklarının nasıl hesaplanacağını öğrenelim. Bu amaçla yükseltgenme basamağı bilinmeyen elementi bileşik ya da iyon formülünde X ile ifade edelim. KClO3’ta Cl’un yükseltgenme basamağı; KClO3 ⇒ K+ + X + 3O2¯ = 0 (+1) + X + 3 · (–2) = 0 ⇒ X = +5’tir. H2SO4’te S’ün yükseltgenme basamağı; H2SO4 ⇒ 2H+ + X + 4O2¯= 0 2 · (+1) + X + 4 · (–2)= 0 ⇒ X = +6’dır. HNO3’te N’un yükseltgenme basamağı; HNO3 ⇒ H+ + X + 3O2– = 0 1 + X + 3 · (–2) = 0 ⇒ X = +5’tir. C2O42– iyonunda C’un yükseltgenme basamağı; C2O42– ⇒ 2X + 4O2– = –2 2 · X + 4 · (–2) = –2 ⇒ X = +3’tür. 4. ÜNİTE: Elektrokimya 195 MnO–4 iyonunda Mn’ın yükseltgenme basamağı; ⇒ X + 4O2– = –1 MnO4̄ X + 4 · (–2) = –1 ⇒ X = +7’dir. Cr2O72– iyonunda Cr’un yükseltgenme basamağı; Cr2O72– ⇒ 2X + 7O2– =–2 2 · X + 7 · (–2) =–2 ⇒ X = +6’dır. PH+4 PH+4 iyonunda P’un yükseltgenme basamağı; ⇒ X + 4H+ = +1 X + 4 (+1) = +1 ⇒ X = –3’tür. Tepkimelerin pek çoğu redoks tepkimeleridir. Bu tür tepkimelerde atomların yükseltgenme basamaklarında değişmeler meydana gelir. Bir atom yükseltgendiğinde elektronlarını kaybeder ve yükseltgenme basamağı artar. Bir atom indirgendiğinde ise elektron kazanır ve yükseltgenme basamağı azalır Basamak sayısı artar. –6 –5 –4 –3–2 –1 0 +1 +2 +3 +4 +5 +6 İndirgenme Yükseltgenme Basamak sayısı azalır. 4. Denklemlerin Denkleştirilmesi Kimyasal tepkime denklemlerinin denkleştirilmesini daha önce öğrendiniz. Ancak yükseltgenmeindirgenme tepkime denklemlerinin denkleştirilmesi, farklı yöntemlerin kullanılmasını gerektirir. Bu tür tepkime denklemlerinin denkleştirilmesinde değerlik (yük) ya da yarı tepkime yöntemi olmak üzere iki ayrı yöntem kullanılır. a. Değerlik (Yük) Yöntemi Bir yükseltgenme-indirgenme tepkimesinin denkleminin denkleştirilmesinde esas, denklemin her iki yanındaki atom sayılarını ve elektrik yüklerini eşit hâle getirmektir. Değerlik (yük) yöntemi ile bu tür tepkime denklemlerinin denkleştirilmesinde uygulanan kuralları; Zn + HNO3 → Zn(NO3)2 + NO2 + H2O tepkime denkleminin denkleştirilmesi üzerinde açıklayalım ve uygulayalım. ® Elementlerin yükseltgenme basamakları sembolleri üzerine yazılır. Yükseltgenme basamağı değişenler belirlenir. Hangi elementlerin indirgendiği ya da yükseltgendiği tepkime denkleminde gösterilir. Yükseltgendi. 0 + 5+ 2+ 2– 5+ 4+ 2– 2– + 2– Zn + H N O3 → Zn (N O3 )2 + N O2 + H 2O İndirgendi. ® Yükseltgenme basamağı değişen atomlarda elektron alış verişi belirtilir. 2 elektron verir. 5+ 4+ Zn0 + HN O3 ⎯→ Zn2+(NO3)2 + N O2 + H 2O 1 elektron alır. 196 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tepkimede ürünler kısmında iki tane azot bileşiği vardır. Bunlardan Zn(NO3)2’taki N atomunun yükseltgenme basamağı değişmemiştir. NO2’teki N atomunun yükseltgenme basamağı değişmiş yani N atomu indirgenmiştir. ® Alınan ve verilen elektron sayılarını eşitlemek için indirgenen ve yükseltgenen maddelerin sembolleri uygun kat sayılarla çarpılır. Tepkimede alınan ve verilen elektron sayılarını birbirine eşitlemek için Zn’ nun kat sayısı 1, N’ unki ise 2 olarak yazılmalıdır. Zn + 2HNO3 → Zn(NO3)2 + 2NO2 + H2O ® İndirgenen ve yükseltgenen maddeler dışındaki maddelerde mol atom sayılarını denkleştirmek için bu maddelerin sembol veya formüllerinin soluna, denkliği sağlayacak uygun kat sayılar yazılır. N atomlarının eşitliğini sağlamak için HNO3’in kat sayısını 4 olarak değiştirmek gerekir. Bu durumda denklemin sol yanında H atomu sayısı 4 olur. Sağ tarafta H atomları sayısının 4 olması için H2O’yun kat sayısı 2 olmalıdır. Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O ☞ÖRNEK : 7 FeCl3 + SnCl2 → FeCl2 + SnCl4 tepkime denklemini değerlik yöntemiyle denkleştiriniz. ✍ÇÖZÜM Elemetnlerin yükseltgenme basamakları semboller üzerine yazılır. Yükseltgenme basamağı değişenler belirlenir. Hangi elementlerin indirgendiği ya da yükseltgendiği tepkime denkleminde gösterilir. Yükseltgendi. 3+ Fe2 Cl–3 2+ + Sn Cl –2 → Fe2+ Cl–2 + Sn4+Cl –4 İndirgendi. Yükseltgenme basamağı değişen atomlarda elektron alış verişi belirtilir. 2 elektron verir. 3+ 2+ 2+ 4+ Fe2 Cl–3 + Sn Cl –2 → Fe Cl–2 + Sn Cl –4 1 elektron alır. Alınan ve verilen elektron sayılarını eşitlemek için indirgenen ve yükseltgenen maddelerin sembolleri uygun kat sayılarla çarpılır. 2FeCl3 + SnCl2 → 2FeCl2 + SnCl4 ☞ÖRNEK : 8 Al + H2SO4 → Al2(SO4)3 + H2 tepkime denklemini değerlik yöntemiyle denkleştiriniz. ✍ÇÖZÜM Örnek 7’nin çözümündeki işlem basamakları takip edilir. Yükseltgendi. 0 + 6+ → Al + H 2 S O 2– 4 3+ 6+ + H02 Al 2 (S O 2– 4 )3 İndirgendi. 4. ÜNİTE: Elektrokimya 197 3 elektron verir. 0 Al + + 6+ H 2 S O 2– 4 3+ 6+ + H02 Al 2 (S O 2– 4 )3 → 2 · 1e – = 2 elektron alır. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ☞ÖRNEK : 9 H2S + HNO3 → S + NO + H2O tepkime denklemini değerlik yöntemiyle denkleştiriniz. ✍ÇÖZÜM Örnek 7’nin çözümündeki işlem basamakları takip edilir. 1+ 2– 1+ H2 2– H2 S 1+ 5+ 2– + H N O3 0 2+ 2– + H2 O 0 2+ 2– + H2 O 0 2+ 2– + H2 O → S + N O 1+ 2– 1+ 2– 1+ 2– Yükseltgendi. S 1+ 5+ 2– + H N O3 → S + N O İndirgendi. 2 elektron verdi. 2– 1+ H2 S 1+ 5+ 2– + H N O3 → S + N O 3 elektron aldı. 3H2S + 2HNO3 → 3S + 2NO + 4H2O Asidik Ortam Asidik ortamda gerçekleşen bir yükseltgenme-indirgenme tepkimesine ait denklemi değerlik (yük) yöntemiyle denkleştirmek için uygulanacak kuralları; Cr2O72– + I¯ → Cr3+ + I 2 (Asidik ortam) tepkime denklemi üzerinde açıklayalım. ® Elementlerin yükseltgenme basamakları belirlenerek hangi elementlerin indirgendiği ya da yükseltgendiği, sembolünün üzerine yazılır. Yükseltgendi. 6+ 2– Cr 2 O 7 2– + I ¯ → 2Cr 3+ I02 + İndirgendi. ® Yükseltgenme basamağı değişen atom ya da iyonlarda elektron alış verişi belirtilir. Bu arada yükseltgenme basamağı değişen atomların aldığı ya da verdiği elektron sayısının hesaplanmasında, iyon içinde sahip olduğu mol atom sayısı dikkate alınır. 2 . 1e– = 2 elektron verir. 6+ 2– Cr 2 O 7 2– + 2 I ¯ → 2Cr 3+ + I2 0 2 . 3e– = 6 elektron alır. ® Alınan ve verilen elektron sayılarını eşitlemek için indirgenen ve yükseltgenen maddelerin sembolleri uygun kat sayılarla çarpılır. 2Cr6+ + 2 · 3e– → 2Cr3+ 3/2I – → I 02 + 2 · 1e– [Cr26+ O72– ]2– + 6I ¯ → 2Cr3+ + 3I02 198 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ® Denklemin her iki yanında iyon yüklerinin toplamı ayrı ayrı belirlenir. 6 Cr 2 O2– 7 2– + 6I ¯ – → 6 · (–1) = –6 2Cr3+ + 0 3I 2 2 . (+3) = +6 ( –2) + (–6) = – 8 3·0=0 +6 + 0 = +6 ® Denklemin her iki yanındaki yüklerin eşitliğini sağlamak için tepkime denkleminin girenler ya da ürünler tarafına H+ iyonu eklenir. rnek tepkime denkleminde yük toplamı tepkimeye girenler tarafında –8, ürünler tarafında +6’dır. Ö Denklemin her iki yanında yük eşitliğini sağlamak için girenler tarafına +14 yük, yani 14 H+ iyonu eklenir. ® Denklemin her iki yanında H mol atom sayısını eşitlemek için H+ iyonu kat sayısının yarısı kadar (14/2 = 7) H2O denklemin ürünler tarafına eklenir. Böylece tepkime denklemi denkleştirilmiş olur. 14H+ + Cr2O72– + 6I¯ → 2Cr3+ + 3I2 + 7H2O Bazik Ortam Bazik ortamda gerçekleşen yükseltgenme-indirgenme tepkimelerinin denklemlerinin değerlik (yük) yöntemiyle denkleştirilmesinde de asidik ortamda gerçekleşen yükseltgenme-indirgenme tepkime denklemlerinin denkleştirilmesinde izlenen yola benzer bir yol izlenir. Bu durumu, aşağıda örnek olarak verilen ve bazik ortamda gerçekleşen tepkimenin denklemi üzerinde görelim. MnO–4 + NH3 → MnO2 + NO–3 (Bazik ortam) ® Elementlerin yükseltgenme basamağı belirlenerek hangi elementin indirgendiği ya da yükseltgendiği, sembolünün üzerine yazılır. ® Yükseltgenme basamağı değişen atom ya da iyonlarda elektron alış verişi belirtilir. ® Alınan ve verilen elektron sayısını eşitlemek için indirgenen ve yükseltgenen maddelerin sembolleri uygun kat sayılarla çarpılır. 3/ N3– → N5+ + 8e– 8/ Mn7+ + 3e– → Mn4+ Örnek tepkimede alınan ve verilen elektron sayısını eşitlemek için Mn’ ın bulunduğu madde 8, N’un bulunduğu madde 3 kat sayısı ile çarpılmalıdır. Denklemin her iki yanındaki iyon yükleri hesaplanır. 2– – 8 Mn7+ O4 –8 0 –8 4. ÜNİTE: Elektrokimya + 3NH 3 → 8MnO2 + 3 NO 3 0 – –3 –3 199 ® Denklemin her iki yanında yük eşitliğini sağlamak için tepkime denkleminin girenler ya da ürünler tarafına OH– iyonu, H atomu sayısını eşitlemek için de gerekli olan tarafa yeterli sayıda H2O eklenir. Örnek tepkime denkleminde girenler ve ürünler arasındaki yük farkı –5’tir. Denklemin her iki yanında yük eşitliğini sağlamak için denklemin sağ yanına 5OH¯ iyonu eklenir. O ya da H mol atom sayısını eşitlemek için de gerekli olan tarafa (girenler ya da ürünler tarafına) yeterli sayıda H2O eklenmesi gerektiğinden, ürünler tarafına 2H2O eklenir. Böylece tepkime denklemi denkleştirilmiş olur. 8MnO–4 + 3NH3 → 8MnO2 + 3NO–3 + 5OH– + 2H2O b. Yarı Tepkime Yöntemi Bir yükseltgeme-indirgenme tepkimesinin denkleminin denkleştirilmesinde esas olanın, denklemin her iki yanındaki atom sayılarını ve elektrik yüklerini eşit hâle getirmek olduğunu biliyorsunuz. Yükseltgenme-indirgenme tepkime denklemlerini denkleştirmenin diğer bir yöntemi de yarı tepkime yöntemidir. Bu yöntem ile ilgili kuralları; H2O2 + NaClO → NaClO3 + H2O tepkime denklemi üzerinde açıklayalım ve uygulayalım. Bu yöntemle tepkime denklemlerinin denkleştirilmesinde atomların yükseltgenme basamaklarının bilinmesine gerek yoktur. Ancak tepkime denklemi iki yarı tepkime denklemi olarak yazılır. NaClO → NaClO3 H2O2 → H2O Yarı tepkime denklemlerinde öncelikle H ve O dışındaki atomların denkliği sağlanır. Örneğimizde Na, Cl atom sayıları denk olduğu için bu işleme gerek yoktur. Yarı tepkimelerde H ve O atomlarının denkliğini sağlamak için oksijen atom sayısı küçük olan tarafa H2O, diğer tarafa da H atomlarının denkliğini sağlamak üzere H+ eklenir. 2H2O + NaClO → NaClO3 + 4H+ 2H+ + H2O2 → 2H2O Yarı tepkime denklemlerinin gerekli tarafına yeterli sayıda elektron eklenerek yük denkliği sağlanır. 2H2O + NaClO → NaClO3 + 4H+ + 4e– 2e– + 2H+ + H2O2 → 2H2O Alınan ve verilen elektronların sayıca eşitliğini sağlamak için yarı tepkime denklemleri uygun kat sayılarla çarpılır. 2 / 2H2O + NaClO → NaClO3 + 4H+ + 4e– 4 / 2e– + 2H+ + H2O2 → 2H2O Yükseltgenme-indirgenme yarı tepkimelerinin denklemleri alt alta yazılıp toplanır. 4H2O + 2NaClO → 2NaClO3 + 8H+ + 8e– 8e– + 8H+ + 4H2O2 → 8H2O ––––––––––––––––––––––––––––––––––––––––––––––– 2NaClO + 4H2O2 → 2NaClO3 + 4H2O ☞ÖRNEK : 10 Cl2 + NaOH → NaCl + NaClO + H2O tepkime denklemini yarı tepkime yöntemiyle denkleştiriniz. 200 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ✍ÇÖZÜM Yarı tepkime yönteminde anlatılan H2O2 ve NaClO arasında gerçekleşen tepkimedeki çözüm basamakları takip edilir. Cl2 + NaOH → NaClO + H2O Cl2 + NaOH → NaCl Cl2 + 2NaOH → 2NaClO + H2O Cl2 + 2NaOH → 2NaCl H2O + Cl2 + 2NaOH → 2NaClO + H2O + 2H+ 2H+ + Cl2 + 2NaOH → 2NaCl + 2H2O H2O + Cl2 + 2NaOH → 2NaClO + H2O + 2H+ + 2e– e– 2H+ + Cl2 + 2NaOH → 2NaCl + 2H2O 2 ––––––––––––––––––––––––––––––––––––––––––––––––––––––– 2Cl2 + 4NaOH → 2NaCl + 2NaClO + 2H2O Kimyasal tepkimeler nötr ortamlarda gerçekleşebildiği gibi asidik ve bazik ortamlarda da gerçekleşebilirler. Asidik veya bazik ortamlarda gerçekleşen kimyasal tepkimelerin denklemlerinin denkleştirilmesinde farklı yollar izlenir. Şimdi bu yolları öğrenelim. Asidik Ortam Asidik ortamda gerçekleşen Cu + NO–3 → Cu2+ + NO (Asidik ortam) yükseltgenme-indirgenme tepkimesine ait denklemi yarı tepkime yöntemiyle denkleştirmek için uygulanacak kurallar şöyledir: ® Bu yöntemle asidik ortam tepkime denklemlerinin denkleştirilmesinde atomların yükseltgenme basamaklarının bilinmesine gerek yoktur. Tepkime denklemi iki yarı tepkime denklemi olarak yazılır. Cu → Cu2+ NO–3 → NO ® Öncelikle H ve O dışındaki atomların denkliği sağlanır. Ancak bu örnekte Cu ve N atom sayıları denk olduğu için bu işleme gerek yoktur. ® H ve O atomlarının denkliği, ortam asidik ise H+ ve H2O ile bazik ise OH– ve H2O eklenmesi ile sağlanır. Cu → Cu2+ NO–3 + 4H+ → NO + 2H2O ® Yarı tepkime denklemlerinin gerekli tarafına yeterli sayıda elektron eklenerek yük denkliği sağlanır. Cu → Cu2+ + 2e¯ NO–3 + 4H+ + 3e¯ → NO + 2H2O ® Alınan ve verilen elektronların sayıca eşitliğini sağlamak için yarı tepkimelerin denklemleri uygun kat sayılarla çarpılır. 3 [Cu → Cu2+ + 2e¯ ] 2 [ NO–3 + 4H+ + 3e¯ → NO + 2H2O] ® Yükseltgenme ve indirgenme yarı tepkimelerinin denklemleri alt alta yazılıp toplanır. 3Cu → 3Cu2+ + 6e¯ 2NO–3 + 8H+ + 6e¯ → 2NO + 4H2O ––––––––––––––––––––––––––––––––––––––––––– 3Cu + 2NO–3 + 8H+ → 3Cu2+ + 2NO + 4H2O Böylece tepkime denklemi denkleştirilmiş olur. 4. ÜNİTE: Elektrokimya 201 Bazik Ortam Bazik ortamda gerçekleşen yükseltgenme-indirgenme tepkime denklemlerinin yarı tepkime yöntemiyle denkleştirilmesindeki kuralları da aşağıdaki tepkime denklemi üzerinde uygulayalım. S2O32– + I 2 → SO42– + I – (Bazik ortam) ® Tepkime, iki yarı tepkime denklemi olarak yazılır. S2O32– → SO42– I 2 → I – ® Yarı tepkimeler, H ve O dışındaki atomların denkliğini sağlayacak uygun kat sayılar kullanılarak denkleştirilir. S2O32– → 2SO42– I 2 → 2I¯ ® H ve O atomlarının denkliği OH¯ ve H2O eklenerek sağlanır. S2O32– + 10OH¯ → 2SO42– + 5H2O ® Yarı tepkime denklemlerinin gerekli tarafına yeterli sayıda elektron eklenerek yük denkliği sağlanır. S2O32– + 10OH¯ → 2SO42– + 5H2O + 8e¯ I 2 + 2e¯ → 2I¯ ® Alınan ve verilen elektronların sayıca eşitliğini sağlamak için yarı tepkimelerin denklemleri uygun kat sayılarla çarpılır. S2O32– + 10OH¯ → 2SO42– + 5H2O + 8e¯ 4 [ I 2 + 2e¯ → 2I – ] ® Yükseltgenme ve indirgenme yarı tepkimelerinin denklemleri alt alta yazılıp toplanır. S2O32– + 10OH¯ → 2SO42– + 5H2O + 8e¯ 4I 2 + 8e¯ → 8I – –––––––––––––––––––––––––––––––––––––––––– S2O32– + 4I 2 + 10OH– → 2SO42– + 8I – + 5H2O Böylece tepkime denklemi denkleştirilmiş olur. Ödev 1. Asidik sulu çözeltilerde gerçekleşen aşağıdaki tepkime denklemlerini denkleştiriniz. 2. Bazik sulu çözeltilerde gerçekleşen aşağıdaki tepkime denklemlerini denkleştiriniz. ➤ I 2 + H2S → H+ + I – + S ➤ Al + NO–3 → Al(OH)–4 + NH3 ➤ I – + H2SO4 (Sıcak, derişik) → I 2 + SO2 ➤ PbO2 + Cl– → ClO– + Pb(OH)–3 ➤ CuS + NO–3 → Cu2+ + SO42– + NO ➤ N2H4 + Cu(OH)2 → N2 + Cu ➤ Zn + NO–3 2+ → Zn + NH+4 ➤ ClO¯ + Fe(OH)3 → Cl– + FeO–2 ➤CIO–3 + As2S3 → CI – + H2AsO–4 + SO42– ➤ Cu(NH3)42+ + S2O42– → SO32– + Cu + NH3 ➤Cr2O72– + C2H4O → C2H4O2 + Cr3+ ➤ ClO2 + OH– → ClO–2 + ClO–3 202 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 11 CuO + NH3 → Cu + N2 + H2O (Denklem denkleşecek.) tepkimesine göre 20 g CuO’ in NH3 ile tepkimesinden oluşan Cu kaç g’ dır? Normal koşullarda kaç L N2 gazı ve kaç mol su buharı oluşur? (Cu : 64, 0 : 16) ✍ÇÖZÜM Cu2+O + N3– H3 → Cu0 + N02 + H2O tepkimesindeki yükseltgenme basamaklarına göre azot 3e– vererek –3’ten 0’a yükseltgenmiş, bakır 2e– alarak +2’den 0’a indirgenmiştir. 2 / N3– → 1/2 N02 + 3e– Yükseltgenmiş, 3e– vermiştir. 3 / Cu2+ + 2e– → Cu0 İndirgenmiş, 2e– almıştır. Tepkimede alınan verilen elektron sayısı eşit olmalıdır. Buna göre azot 2 kat sayısı ile bakır 3 kat sayısı ile çarpılmalı ve tepkime denkleminde bu kat sayılar yerlerine yazılmalıdır. 3CuO + 2NH3 → 3Cu + N2 + H2O Tepkime denkleminin sol tarafındaki 6 mol H atomuna karşılık sağ tarafta 6 mol H atomu olması için H2O’yun önüne 3 kat sayısı yazılmalıdır. 3CuO + 2NH3 → 3Cu + N2 + 3H2O MCuO = 64 + 16 = 80 g/mol m n= MCuO n= 20 = 0, 25 mol ’dür. 80 3 mol CuO ’ten 0, 25 mol CuO’ten x= 3 · 64 g Cu açığa çıkarsa x 3 · 64 · 0, 25 = 16 g Cu açığa çıkar. 3 3 mol CuO ’ten 22, 4 L N2 gazı oluşursa 0,25 mol CuO ’ten x= x 22, 4 . 25 = 1, 87 L N2 gazı oluşur. 3 3 mol CuO ’ten 0, 25 mol CuO ’ten x= 3 mol H2O oluşursa x 0, 25 · 3 = 0, 25 mol H2O oluşur. 3 ☞ÖRNEK : 12 MnO2 + KNO3 + KOH → K2MnO4 + NO + H2O (Tepkime denklemini denkleştiriniz.) Yukarıda denklemi verilen tepkimede 22,4 g KOH harcandığında açığa çıkan NO gazının 273 K sıcaklık ve 2 atm basınç altındaki hacmini bulunuz. (MKOH = 56 g/mol) ✍ÇÖZÜM Tepkimede alınan verilen elektron sayısının en küçük ortak kat sayısı 6’dır. Bu nedenle MnO2 önüne 3, KNO3 önüne 2, dolayısıyla K2MnO4 önüne 3, NO önüne 2 kat sayısı yazılmalıdır. H sayılarını eşitlemek üzere de KOH önüne 4, H2O önüne 2 kat sayısı yazılır. 3MnO2 + 2KNO3 + 4KOH → 3K2MnO4 + 2NO + 2H2O 4. ÜNİTE: Elektrokimya 203 4 · 56 g KOH ’ten 2 mol NO elde edilirse 22, 4 g KOH ’ten x= x 22 , 4 · 2 44, 8 = = 0 , 2 mol NO elde edilir. 4 · 56 224 PV = nRT V= V= 0, 2 · V= nRT P 22, 4 . 273 273 2 4, 48 = 2, 24 L ’dir. 2 ☞ÖRNEK : 13 C2O42– + MnO4– → CO2 + Mn2+ tepkimesi asidik ortamda oluşmaktadır. 100 mL 0,2 M H2C2O4 ve 100 mL 0,2 M KMnO4 çözeltilerinden normal koşullarda en çok kaç mL CO2 gazı elde edilir? ✍ÇÖZÜM Öncelikle tepkime denklemi denkleştirilir. 5 / C23+O42– → 2C4+O2 + 2e– 2 / Mn7+O–4 + 5e– → Mn2+ –––––––––––––––––––––––––––––––––––– 5C2O42– + 2MnO–4 → 10CO2 + 2Mn2+ Yük denkliğini sağlamak için tepkime denkleminin girenler tarafına 16 mol H+ iyonu, H mol atom sayısını eşitlemek üzere de ürünler tarafına 8 mol H2O eklenir. 16H+ + 5C2O42– + 2MnO–4 10CO2 + 2Mn2+ + 8H2O Bu aşamada kullanılan H2C2O4 mol sayısı belirlenmelidir. nH2C2O4=0,1 · 0,2 = 2 · 10–2 mol’dür. Tepkime denklemine göre karbon dioksidin mol sayısı okzalik asidin mol sayısının iki katıdır. 5mol H2C2O4 ’ten 2 · 10−2 mol H2C2O4 ’ten x= 10 mol CO2 oluşursa x 2 · 10−2 · 10 = 4 · 10−2 mol CO2 oluşur. 5 nRT P 22 , 4 4 · 10−2 · · 273 273 V= 1 PV = nRT V= V = 89, 6 10 –2 L V = 896 mL CO2 gazı elde edilir. 204 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Aşağıdaki yarı tepkimelerde elementlerin yükseltgenme basamaklarını belirleyerek indirgenen ve yükseltgenen elementleri gösteriniz. a.H2O2(suda) → H2O(s) b.Cl2(g) → ClO–3(suda) c. OH–(suda) → O2(g) ç. CrO2– 4(suda) → Cr(OH)3(k) d. NO–3(suda) → NO(g) e.H2O2(suda) → O2(g) 2– f. SO2– 3(suda) → SO 4(suda) g. ClO–(suda) → Cl–(suda) 2. FeAsS + NO–3 → H3AsO4 + NO + SO42– + Fe3+ tepkimesi asidik ortamda gerçekleşmektedir. Tepkime denklemini değerlik (yük) yöntemiyle denkleştiriniz. 3. SO32– + CrO42– + H2O → SO42– + Cr(OH)–4 + OH– tepkimesi bazik ortamda gerçekleşmektedir. Tepkime denklemini değerlik (yük) yöntemiyle denkleştiriniz. 4. Cu2S + HNO3 → CuSO4 + Cu(NO3)2 + NO + H2O tepkimesi denklemini yarı tepkime yöntemiyle denkleştiriniz. 5. 1200 s’de 210 mA akım uygulandığında cıvanın bir nitrat tuzunun sulu çözeltisinden 0,26 g cıva elde edilmektedir. Cıvanın nitrat tuzundaki yükseltgenme basamağı kaçtır? (Hg : 108) B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Pozitif yüklü iyonlara katyon, negatif yüklü iyonlara anyon adı verilir. ( ... ) 2. Elektrik enerjisi kullanılarak bileşiklerin bileşenlerine ayrılması olayına “elektrokimyasal pil” denir. ( ... ) 3. Bütün çözeltiler elektrik akımını iletir. ( ... ) 4. Elektrik akımı elektrolitlerde elektronlar vasıtasıyla iletilir. ( ... ) 5. Doğru akım kaynağından elektrotlara elektrik akımı verildiğinde elektrotlar arasında elektrik alanı oluşur. ( ... ) 6. Bir değerlikli 1 mol iyonun yükü 1 Faradaydır. ( ... ) 7. Bir elektroliz olayında biriken madde miktarının atom kütlesine oranının tesir değerliği ile çarpımına “eş değer sayısı” denir. ( ... ) 8. Bir redoks tepkimesinde en az bir indirgen ve bir yükseltgen maddenin olması gerekir. ( ... ) 9. Asit-baz tepkimeleri de birer redoks tepkimedir. ( ... ) 10. Asidik ortamda redoks tepkimesi denkleştirilirken oksijeni az olan tarafa yeteri kadar H2O, diğer tarafa da yeteri kadar H+ eklenir. ( ... ) 11. Redoks tepkime denklemlerinin denkleştirilmesinde en son yapılacak işlem yük denkliğini sağlamaktır. ( ... ) 12. Faraday Yasaları’ndan yararlanılarak elektrik yükleri hesaplanamaz. ( ... ) 4. ÜNİTE: Elektrokimya 205 C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. I. P2O5 II. H3PO2 III. H3PO4 IV. H3PO3 Yukarıdaki bileşiklerin hangilerinde fosforun yükseltgenme basamağı aynıdır? A) I ve II B) I ve III C) III ve IV D) I, II ve III E) II, III ve IV 2. Aşağıdaki bileşiklerin hangisinde azotun (N) yükseltgenme basamağı negatiftir? A) N2H4 B) HNO2 C) N2O D) HNO3 E) NI3 3.Fe2(SO4)3 formülünde S atomunun yükseltgenme basamağı aşağıdakilerden hangisidir? A) –3 B) –2 C) +3 D) +4 E) +6 4. Bir elektrikli ısıtıcıdan 9650 saniye süre ile 2,5 A’lik akım geçmektedir. Isınma süresince ısıtıcıdan kaç mol elektron geçer? (Q = 1,6.10–19 C, NA = 6,02.1023) A) 0,25 B) 0,75 C) 1,25 D) 1,50 E) 2,25 5. 120 mA akımla 500 s süreyle titanın bir klorür tuzu çözeltisi elektroliz edildiğinde 15,0 mg titan birikmektedir. Titanın klorürlü tuzundaki yükseltgenme basamağının değeri aşağıdakilerden hangisidir? (Ti = 48) A) –2 B) +1 C) +2 D) +3 E) +5 4+ 2+ 6. MnO–4(suda) + H+(suda) + Ce3+ (suda) → Ce (suda) + Mn (suda) + H2O(s) asidik ortam tepkimesinin denklemi tam sayılarla denkleştirildiğinde suyun en küçük kat sayısı kaç olur? A) 1 B) 2 C) 3 D) 4 E) 5 7. 6N2H4(s) + 8ClO–3(suda) → 12NO(g) + 8Cl–(suda) + 12H2O tepkimesi için aşağıdakilerden hangisi yanlıştır? A) İndirgenme ve yükseltgenmenin bir arada gerçekleştiği bir tepkimedir. B) Tepkimede klor indirgendir. C) Tepkimede azot yükseltgenmiştir. D) N2H4 bileşiğinde azotun yükseltgenme basamağı –2’dir. E) ClO–3 iyonunda klorun yükseltgenme basamağı +5’tir. 8. Aşağıdaki tepkimelerden hangisi indirgenme yarı tepkimesi değildir? A) P4(k) → PH3(g) B) NO–3 → NO C)H2SO3 → HSO–4 D) CrO42– → Cr(OH)3 E) ClO– → Cl– 206 ORTAÖĞRETİM KİMYA 11 DERS KİTABI STANDART ELEKTROT POTANSİYELİ BÖLÜM İÇERİĞİ 1.Elementlerin Yükseltgenme-İndirgenme Eğilimleri 2.Galvanik Hücreler 3.Standart Pil Potansiyeli Doğru akımla çalışan elektrikli araçlarda bazen 1 pil bazen de birbirine paralel ya da seri bağlı çok sayıda pil kullanılır. Bazı elektrikli araçları çalıştırmak için 1 kalem pil yeterli olurken bazılarını çalıştırmak için daha büyük piller gerekir. Bir motosikletin marş motorunu çalıştırmak için küçük bir akümülatör kullanılırken bir ağır vasıtanın motorunu çalıştırmak için büyük akümülatörlerden birkaç tanesi birarada kullanılır. Nedenini hiç merak ettiniz mi? Bu bölümde bu sorulara yanıt bulacaksınız. 4. ÜNİTE: Elektrokimya 207 1. Elementlerin Yükseltgenme-İndirgenme Eğilimleri Çinko sülfat çözeltisine bakır çubuk daldırıldığında hiçbir etkileşme olmaz (Resim 4.2). Ancak bakır(II) sülfat çözeltisine çinko çubuk batırılırsa (Resim 4.3) çinko çubuğun çözünerek kütlesinin azaldığı, buna karşılık çinko çubuk üzerinde bakır parçacıklarının biriktiği gözlemlenir. Resim 4.2:ZnSO4 çözeltisi ile bakır metali arasında hiçbir etkileşme olmaz. Resim 4.3:Çinko metali CuSO4 çözeltisi ile etkileşir. CuSO4 çözeltisinde ortamda Cu2+ ve SO42– iyonları bulunur. Bu çözeltiye Zn çubuk batırıldığında Zn atomları 2e¯ vererek Zn2+ iyonları hâline yükseltgenirken her bir Zn atomu tarafından verilen 2e¯ bir Cu2+ iyonu tarafından alınır ve elementel bakır atomu (Cu) hâline indirgenir (Şekil 4.2.a). Zn2+ iyonları çözeltiye geçerken elementel bakır atomları Zn çubuk üzerinde toplanmaya başlar (Şekil 4.2.b). Tepkimede Zn atomları, Cu2+ iyonlarını Cu atomları hâline indirgediğinden indirgen madde, Cu2+ iyonları ise Zn atomlarını Zn2+ iyonları hâline yükseltgediklerinden yükseltgen madde olarak nitelenir. Elektron alır. Zn (k) Yükseltgenen (İndirgen) + 2+ Cu(suda) ⎯→ + Zn 2+ (suda) Cu (k) İndirgenen (Yükseltgen) Elektron verir. a b Zn → Zn2+ Zn2+ iyon Cu 2e¯ Cu2+ → Cu Zn Zn Şekil 4.2: Çinko, CuSO4 çözeltisinden bakırı indirger. 208 ORTAÖĞRETİM KİMYA 11 DERS KİTABI CuSO4 çözeltisine çinko çubuk batırıldığında bir tepkime oluşması, çinkonun tepkimeye girme ve yükseltgenme eğiliminin bakırdan daha büyük, diğer bir ifade ile Cu2+ iyonlarının indirgenme eğiliminin Zn2+ iyonlarının indirgenme eğiliminden daha büyük olduğunu gösterir. Bu açıklamalara göre kimyasal tepkimeler, tepkimeye girme eğilimi daha büyük olan elementin yükseltgeneceği, tepkimeye girme eğilimi daha az olan elementin indirgeneceği yönde gerçekleşir. Bazı element ya da iyonların yükseltgenme–indirgenme eğilimlerindeki artış sırası Tablo 4.2’de verilmiştir. İnceleyiniz. Tablo 4.2: Bazı element ve iyonların yükseltgenmeindirgenme eğilimlerindeki artış sırası Tablo 4.2 incelendiğinde yükseltgenme ve tepkimeye girme eğilimi en büyük olan elementin en kuvvetli indirgen, indirgenme eğilimi en büyük fakat tepkimeye girme eğilimi en az olan elementin en kuvvetli yükseltgen olduğu görülür. ☞ÖRNEK : 14 2+ a. Ca(k) + Zn2+ (suda) → Ca (suda) + Zn(k) 2+ b. Sn(k) + Mg2+ (suda) → Sn (suda) + Mg(k) 2+ c. Fe(k) + Sn2+ (suda) → Fe (suda) + Sn(k) Yukarıda denklemleri verilen tepkimelerden hangilerinin kendiliğinden gerçekleşeceğini Tablo 4.2’den yararlanarak belirleyiniz. Tepkimelerin neden kendiliğinden gerçekleşeceğini ya da gerçekleşmeyeceğini açıklayınız. ✍ÇÖZÜM a.Ca’un yükseltgenme eğilimi, Zn2+ iyonunun yükseltgenme eğiliminden daha büyüktür. Bu nedenle tepkime; Ca’un yükseltgeneceği, Zn2+ iyonunun indirgeneceği yönde kendiliğinden gerçekleşir. 2+ Ca(k) + Zn2+ (suda) → Ca (suda) + Zn(k) 4. ÜNİTE: Elektrokimya 209 b. S n’ın yükseltgenme eğilimi, Mg’un yükseltgenme eğiliminden daha küçüktür. Bu nedenle tepkime kendiliğinden gerçekleşmez. Sn(k) + Mg2+ (suda) → Tepkime gerçekleşmez. c. Fe’in yükseltgenme eğilimi, Sn’ın yükseltgenme eğiliminden daha büyüktür. Bu nedenle tepkime Fe’in yükseltgeneceği, Sn2+ iyonunun indirgeneceği yönde kendiliğinden gerçekleşir. 2+ Fe(k) + Sn2+ (suda) → Fe (suda) + Sn(k) ☞ÖRNEK : 15 HCl çözeltisine Zn ve Ag metalleri daldırılıyor. Zn veya Ag metallerinden hangisi HCl çözeltisi ile tepkime verir? Bu tepkimenin denklemini yazarak gerçekleşme nedenini açıklayınız. ✍ÇÖZÜM Zn’nun yükseltgenme eğilimi, H2’in yükseltgenme eğiliminden daha büyüktür. Bu yüzden Zn(k), HCl çözeltisi ile tepkime verir. Zn(k) + 2H+(suda) → Zn2+ (suda) + H2(g) Ag’ün yükseltgenme eğilimi, H2’in yükseltgenme eğiliminden daha küçüktür. Bu nedenle tepkime kendiliğinden gerçekleşemez. Ag(k) + 2H+(suda) → Tepkime gerçekleşemez. Şimdi aşağıdaki etkinliği yapınız. 1. ETKİNLİK: KİM KİMİNLE TEPKİME VERDİ? Neler Gerekli? ❏ Deney tüpü (4 adet) ❏ Derişik HNO3 ❏ Pipet ❏ Derişik HCl ❏ Tüplük ❏Etiket ❏ Zn, Cu, Fe parçaları Güvenliğiniz için UYARI: Pipete asit alırken kesinlikle pipet içindeki havayı emmeyiniz. Laboratuvarınızda varsa puar kullanınız. Etkinliği laboratuvarın pencerelerini açarak ve pencere önünde yapınız. Tepkimede oluşan dumanları kesinlikle solumayınız. Nasıl Yapacaksınız? 3 1, 2, 3, 4 şeklinde numaralandırdığınız etiketleri deney tüplerine yapıştırınız. Deney tüplerini tüplüğe yerleştiriniz. 3 Pipet yardımıyla (solumadan, pipetin ağzını baş parmağınızla kapatarak ya da puar kullanarak) şişesinden aldığınız derişik HCl’den yirmişer damlayı 1, 2, 3 numaralı deney tüplerine koyunuz. 3 Yine pipet ya da puar yardımıyla şişesinden aldığınız derişik HNO3’ten 20 damlayı 4 numaralı tüpe koyunuz. 3 1 numaralı tüpe Zn, 2 numaralı tüpe Fe, 3 ve 4 numaralı tüplere Cu parçalarını dikkatlice atınız. Değişmeleri gözlemleyiniz. Etkinlik Sonu Soruları 1. Hangi tüplerde değişme gözlemlediniz? Değişme gerçekleşmesini ya da gerçekleşmemesini nasıl yorumlarsınız? 210 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Elementlerin yükseltgenme-indirgenme eğilimlerinin, dolayısıyla tepkimeye girme eğilimlerinin büyüklüğüne göre yapılabilecek bazı genellemeler şöyledir: ®Yükseltgenme eğilimi büyük olan bir element, yükseltgenme eğilimi küçük olan elementi bileşiğinden açığa çıkarır. Örneğin, yükseltgenme eğilimi demir ve bakırdan büyük olan magnezyum elementi, demir ve bakır elementlerini bileşiklerinden açığa çıkarır. Mg + Fe(NO3)2 → Mg(NO3)2 + Fe Mg + CuSO4 → MgSO4 + Cu ®Yükseltgenme eğilimi sıralamasında hidrojenin altında yer alan elementler ve iyonlar, oksijensiz asitlerle tepkime vermez. Örneğin, yükseltgenme eğilimi sıralamasında hidrojenin altında yer alan bakır, gümüş, platin, altın gibi elementler ile Sn2+, I–, Fe2+ gibi iyonlar oksijensiz bir asit olan HCl ile tepkime vermez. Bu maddeler (altın ve platin hariç) HNO3, H2SO4 gibi oksijenli asitlerle tepkime verir (Resim 4.4). Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O ®Yükseltgenme eğilimi sıralamasında hidrojenin üstünde yer alan elementler, oksijenli ve oksijensiz asitlerle tepkime verir. Bu tepkimelerde hidrojen gazı açığa çıkar. Örneğin, yükseltgenme eğilimi sıralamasında hidrojenin üzerinde yer alan çinko, alüminyum, demir gibi elementler, oksijensiz bir asit olan HCl ve oksijenli bir asit olan H2SO4 ile tepkime verir. Tepkimelerde hidrojen gazı açığa çıkar (Resim 4.5). Zn + 2HCl → ZnCl2 + H2 Fe + H2SO4 → FeSO4 + H2 Resim 4.4: Bakırın nitrik asit ile tepkimesi Resim 4.5: a. Çinko şeridin hidroklorik asit ile tepkimesi b.Demir çivinin hidroklorik asit ile tepkimesi Şimdi “Ampul Neden Işık Verdi?” adlı etkinliği yapınız. Gözlem sonuçlarınızı irdeleyiniz. 2. ETKİNLİK: AMPUL NEDEN IŞIK VERDİ? Neler Gerekli? ❏ Duy ❏ Bağlantı kabloları ❏ Ampul ❏ Zn elektrot ❏ Zımpara ❏ 1 M H2SO4 çözeltisi ❏ Cu elektrot ❏ Beherglas (500 mL) 4. ÜNİTE: Elektrokimya Güvenliğiniz için 211 Nasıl Yapacaksınız? 3 Çinko ve bakır elektrotları ince zımpara ile zımparalayınız. 3 Beherglasa H2SO4 çözeltisi doldurunuz. 3 Bağlantı kablolarının uçlarını duy ve elektrotlara tutturunuz ve resimdeki etkinlik düzeneğini kurunuz. 3 Elektrotları aynı anda birbirine değmeyecek şekilde H2SO4 çözeltisi içine daldırınız. Değişmeleri gözlemleyiniz. 3 Ampul söndüğünde etkinliğe son veriniz. Etkinlik Sonu Soruları 1. Elektrotları H2SO4 çözeltisine daldırdığınızda ampulün ışık vermesi ne anlama gelir? 2. Ampulün kısa bir süre ışık vermesini nasıl açıklarsınız? Yaptığınız etkinlikte sülfürik asit çözeltisi içine çinko ve bakır elektrotlar batırıldığında Zn elektrot çözünmeye başlar. Çözünen Zn2+ iyonları çözeltiye geçer. Zn elektrotta açığa çıkan elektronlar iletken üzerinden Cu elektroda doğru akar. Çözeltide bulunan H+ iyonları Cu elektroda gelen elektronları alarak H2 gazı hâlinde bakır elektrot üzerinde birikir. Cu elektrot üzerinde H2 gazı oluşumu fazlalaşınca çözeltideki H+ iyonları Cu elektroda ulaşamaz olur. Bu nedenle ampul kısa bir süre ışık verdikten sonra hemen söner. 2. Galvanik Hücreler Yükseltgenme, indirgenme tepkimelerinde tepkimeye giren maddelerin aynı ortam içinde olmaları gerekmez. Bir madde, bir kapta indirgenirken diğer madde başka bir kapta yükseltgenebilir. Öyleyse yükseltgenme indirgenme tepkimelerini birbirinden bağımsız iki ayrı tepkimeye (yükseltgenme ve indirgenme tepkimesine) ayırabiliriz. İki ayrı kapta bulunan indirgen ve yükseltgen maddeler arasındaki elektron alış verişi bir iletken tel ile (bir dış devre üzerinden) sağlanabilirse yükseltgenmenin olduğu kaptan indirgenmenin olduğu kaba doğru elektron akışı başlar. Kaplar arasında elektrik akımının geçişini (iyon hareketini) sağlamak için de iki kap, tuz köprüsü ile birbirine bağlanır. Tuz köprüsü bir U borusu içine KNO3, KCl ve NaNO3 gibi kuvvetli elektrolitlerden birinin çözeltisi konularak hazırlanır. U borusunun içindeki çözeltinin dökülmesini önlemek için uçlarına birer pamuk parçası konur ve ters çevrilerek kaplar içine daldırılır (Resim 4.6). Elektrokimyasal pilde tuz köprüsü iki çözelti ya da iki yarı pil arasında iletkenliği sağlar. Dolayısıyla bir pil oluşur ve bu pilden elektrik enerjisi elde edilir. Böyle bir sistem galvanik hücre adıyla anılır. 212 Resim 4.6: Tuz köprüsüyle oluşturulan galvanik hücre ORTAÖĞRETİM KİMYA 11 DERS KİTABI Galvanik bir hücre oluşturmak için Şekil 4.3’teki gibi bir beherglas içine 1M ZnSO4 çözeltisi (elektrolit), diğer beherglasa 1M CuSO4 çözeltisi (elektrolit) konup ZnSO4 çözeltisi içine Zn elektrot, CuSO4 çözeltisi içine Cu elektrot daldırılır. İki kap arasında iyon göçünü sağlamak amacıyla tuz köprüsü kurulur. Metal çubuklar, miliampermetrenin de yer aldığı bir iletken ile birbirine bağlandığında devreden elektrik akımının geçtiği, miliampermetrenin sapmasından anlaşılır. Bu da elektrik akımının oluşmasına neden olan bir tepkimenin gerçekleşmekte olduğunu gösterir. Miliampermetre Elektron akış yönü Tuz köprüsü Cu elektrot Zn elektrot CuSO4 çözeltisi (1M ) ZnSO4 çözeltisi (1M ) Pamuk Şekil 4.3: Çinko-bakır elektrokimyasal pilinin şematik gösterimi Zn-Cu pilinde elektrokimyasal olaylar şöyle gerçekleşir (Şekil 4.4): Şekil 4.4: Çinko-bakır elektrokimyasal pilinde iyon göçü ® Çinkonun tepkimeye girme eğilimi, bakırdan daha büyüktür. Yani yükseltgenme eğilimi fazladır. Bu yüzden çinko elektrottaki Zn atomları iki elektron vererek Zn2+ iyonu hâline yükseltgenir yani metalik çinko çözünerek Zn2+ iyonu hâlinde ZnSO4 çözeltisi içinde dağılır. Bu yüzden çinko elektrodun kütlesi 4. ÜNİTE: Elektrokimya 213 zamanla azalır. Yükseltgenmenin olduğu elektroda pilin anot kutbu, bu elektrodun daldırıldığı çözeltiye de anot çözeltisi denir. Anotta : Zn(k) → Zn2+ (suda) + 2e¯ (Yükseltgenme yarı tepkimesi) ® Anotta üretilen iki elektron, iletken tel yardımıyla Cu elektroda, oradan da CuSO4 çözeltisine geçer. CuSO4 çözeltisindeki Cu2+ iyonu, iki elektron alarak elementel Cu hâline indirgenir. İndirgenen Cu atomları, bakır elektrot üzerinde toplanır. Böylece bakır elektrodun kütlesi zamanla artar. İndirgenmenin olduğu elektroda pilin katot kutbu, bu elektrodun daldırıldığı çözeltiye de katot çözeltisi denir. Katotta : Cu2+ (suda) + 2e¯ → Cu(k) (İndirgenme yarı tepkimesi) ® Katot çözeltisi içinde bulunan SO42– iyonları tuz köprüsü aracılığıyla anot çözeltisine geçer. Böylece katot çözeltisinde CuSO4 derişimi giderek azalırken anot çözeltisinde ZnSO4 derişimi giderek artar. Yarı pil tepkimelerinin ve pil tepkimesinin denklemleri şöyledir: Yükseltgenme yarı tepkimesi , Zn(k) → Zn2+ (suda) + 2e¯ İndirgenme yarı tepkimesi , Cu2+ (suda) + 2e¯ → Cu(k) –––––––––––––––––––––––––––––––––––––––––––––––––––––––––– 2+ Pil tepkimesi , Zn(k) + Cu2+ (suda) → Zn (suda) + Cu(k) Pil tepkimesinde yukarıda belirtilen olaylar kimyasal denge kuruluncaya kadar devam eder. Denge kurulduğunda pil potansiyeli sıfır olur. Bu durum “Pil bitti.” şeklinde ifade edilir. Kimyasal tepkime sonucu elektrik akımı elde edilmesini sağlayan bu piller 1800 yılında Allessandro Volta (Alesando Volta) tarafından keşfedilmiş ve adına izafeten bu pillere volta pili denilmiştir. Sizin de 2. etkinlikte kurduğunuz düzenek ilk volta pilinin benzeridir. Elektrokimyasal bir pilin yapısında her elektrot, içinde kendi iyonlarını bulunduran çözeltiye batırılmıştır. Elektrot yüzeyi ile temas ettiği çözelti arasında bir potansiyel farkı oluşur. Bu farka elektrot potansiyeli ya da elektrot gerilimi denir ve “E” sembolü ile gösterilir. 3. Standart Pil Potansiyeli Bir pilin potansiyeli, bir elektrodun yükseltgenme eğilimi ile diğer elektrodun yükseltgenme eğilimi arasındaki farktan doğar. Dolayısıyla her pilin bir tepkimesi ve bir potansiyeli vardır. Bir pilin potansiyeli, iki elektrottaki potansiyellerin cebirsel toplamına eşittir. Pil potansiyelleri, elektrot ve elektrolitlerin türü, derişim, sıcaklık ve basınca bağlı olarak değişir. Bu nedenle pil potansiyelleri, 25˚C sıcaklıkta, anot ve katotda 1 M’lık elektrolit çözeltiler kullanılarak 1 atm basınç altında ölçülür. Bu koşullarda ölçülen pil potansiyelleri standart pil potansiyeli olarak bilinir ve Ep̊il sembolü ile gösterilir. Standart pil potansiyelinin hesaplanabilmesi için yükseltgenme (anot) ve indirgenme (katot) yarı pil tepkimelerinin potansiyellerinin bilinmesi gerekir. Yarı pil potansiyelleri mutlak olarak hiçbir zaman ölçülemez. Ancak hidrojen yarı pilinden yararlanılarak ölçülebilir. Standart koşullarda hidrojen yarı pilinde, hidrojen elektrodun potansiyeli sıfır kabul edilerek yükseltgenme ya da indirgenme yarı pil potansiyelleri belirlenebilir. Bu durumda belirlenen potansiyele standart yarı pil potansiyeli denir. Standart yarı pil potansiyelleri “Eẙük” ve “E˚ind” sembolle- riyle gösterilir. Hidrojen yarı pili, H+ iyon derişimi 1 M olan çözeltiye daldırılmış platin çubuğa 1 atm basınç altında hidrojen gazı gönderilerek hazırlanır (Şekil 4.5). Platin çubuk asit çözeltisi ile tepkimeye girmez ancak elektrik akımının iletilmesini sağlar. 214 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Pt Pt atomu H+ iyonu H3O+ iyonu H2(g) e¯ İndirgenme H2 molekülü Yükseltgenme Pt elektrot e¯ Şekil 4.5: Hidrojen yarı pili Hidrojen-bakır elektrokimyasal pil tepkimesinde hidrojenin yükseltgenme eğilimi, bakırın yükseltgenme eğiliminden daha büyüktür. Bu yüzden anoda gönderilen hidrojen gazı H+ iyonu hâline yükseltgenirken CuSO4 çözeltisindeki Cu2+ iyonları elementel bakıra indirgenerek bakır elektrot üzerinde toplanır (Şekil 4.6). Pilin standart potansiyeli 0,34 volttur. Bu değer aynı zamanda bakırın standart indirgenme potansiyel olup bakırın kütlesine dolayısıyla hacmine, yarı piller arasında alınıp verilen elektron sayısına bağlı değildir. e¯ e¯ Voltmetre Tuz köprüsü H2 Anot elektrot NO–3 Na+ Anot çözeltisi Cu Katot elektrot SO42– H+ Cu2+ Katot çözeltisi Şekil 4.6: Hidrojen-bakır pili Yarı pil tepkimelerinin ve pil tepkimesinin denklemleri şöyledir : Yükseltgenme yarı tepkimesi, H2(g) → 2H+(suda) + 2e¯ E˚ = 0,00 V (Anot) Cu2+ (suda) İndirgenme yarı tepkimesi , + 2e¯ → Cu(k) E˚ = 0,34 V (Katot) ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– + Pil tepkimesi , H2(g) + Cu2+ (suda) → 2H (suda) + Cu(k) Ep̊il = 0,34 V (Pil) Standart hidrojen yarı piline çinko yarı pili bağlandığında (Şekil 4.7), çinkonun yükseltgenme eğilimi hidrojenin yükseltgenme eğiliminden daha büyük olduğundan çinko atomları Zn2+ iyonları hâline yükseltgenir. Hidrojen yarı pilindeki çözeltide bulunan H+ iyonları da indirgenerek H2 gazı hâlinde açığa 4. ÜNİTE: Elektrokimya 215 çıkar. Pilin standart potansiyeli 0,76 V olarak ölçülür. Bu değer aynı zamanda çinkonun standart yükseltgenme potansiyelidir. e¯ e¯ Voltmetre Tuz köprüsü Zn Anot elektrot NO–3 Na+ H2(g) Katot elektrot NO3– Katot çözeltisi Zn2+ Anot çözeltisi H+ NO3– Şekil 4.7: Çinko-hidrojen pili Yarı pil tepkimelerinin ve pil tepkimesinin denklemleri aşağıdaki gibidir : Yükseltgenme yarı tepkimesi, Zn(k) → Zn2+ (suda) + 2e¯ E˚ = 0,76 V (Anot) 2H+(suda) İndirgenme yarı tepkimesi , + 2e¯ → H2(g) E˚ = 0,00 V (Katot) ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Pil tepkimesi , Zn(k) + 2H+(suda) → Zn2+ Ep̊il = 0,76 V (Pil) (suda) + H2(g) Bazı maddelerin standart indirgenme potansiyelleri Tablo 4.3’te verilmiştir. İnceleyiniz. Tablo 4.3: Standart indirgenme potansiyelleri (25˚C’ta) İndirgenme yarı tepkimeleri E˚ (volt) İndirgenme yarı tepkimeleri E˚ (volt) Li+(suda) + e¯ → Li(k) –3,05 Sn2+ (suda) + 2e¯ → Sn(k) –0,14 K+(suda) + e¯ → K(k) –2,93 Pb2+ (suda) + 2e¯ → Pb(k) –0,13 Ba2+ (suda) + 2e¯ → Ba(k) –2,90 2H+(suda) + 2e¯ → H2(g) 0,00 Ca2+ (suda) + 2e¯ → Ca(k) –2,87 Na+(suda) 0,15 → Na(k) –2,71 → Sn2+ (suda) + e¯ Sn4+ (suda) + 2e¯ Mg2+ (suda) + 2e¯ → Mg(k) –2,37 Cu2+ (suda) + 2e¯ → Cu(k) 0,34 Al3+ (suda) + 3e¯ → Al(k) –1,66 I2(k) → 2I¯(suda) 0,53 Zn2+ (suda) + 2e¯ → Zn(k) –0,76 Fe3+ (suda) + e¯ → Fe2+ (suda) 0,77 Cr3+ (suda) + 3e¯ → Cr(k) –0,74 Ag+(suda) + e¯ → Ag(k) 0,80 Fe2+ (suda) + 2e¯ → Fe(k) –0,44 Cl2(g) + 2e¯ → 2Cl¯(suda) 1,36 + 3e¯ → Au(k) 1,50 + 2e¯ → 2F¯(suda) 2,87 + 2e¯ Co2+ (suda) + 2e¯ → Co(k) –0,28 Au3+ (suda) Ni2+ (suda) + 2e¯ → Ni(k) –0,25 F2(g) 216 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tablo 4.3’teki standart indirgenme potansiyelleri, ilgili elementlerin iyonlaşma enerjileri ile karşılaştırılırsa standart indirgenme potansiyellerinin iyonlaşma enerjileri sırasına uymadığı görülür. Bu farklılık sulu ortamdaki çözünme entalpilerinin farklılığından kaynaklanır. Söz gelimi kalsiyumun indirgenme potansiyelinin sodyumunkinden küçük olması bu durumu kanıtlar. Standart indirgenme potansiyellerinin tabloda verilen sırasına elektrokimyasal potansiyel sırası ya da tepkimeye girme eğilim sırası denir. Bu sıra dikkate alındığında her element tabloda kendinden önce gelen elementlere göre daha az aktif, kendisinden sonra gelen elementlere göre ise daha aktiftir. Bu anlamda her element üst sıradaki elementleri yükseltgeyerek kendisi indirgenir. Tersine alt sıradakileri indirgeyerek kendisi yükseltgenir. Herhangi bir yarı pilin potansiyelinin belirlenmesi gerektiğinde bu yarı pil, standart hidrojen yarı piline bağlanarak elektrokimyasal pil oluşturulur (Resim 4.7). Ölçülen potansiyel, potansiyeli bilinmeyen yarı pilin potansiyeline eşittir. Standart yarı pil potansiyelleri, genellikle indirgenme tepkimeleri esas alınarak yazılır ve standart indirgenme potansiyeli olarak adlandırılır. Resim 4.7: Standart hidrojen yarı piline bir yarı pil bağlanarak bu yarı pilin standart pil potansiyeli belirlenir. Elektrokimyasal pilin standart potansiyeli, yükseltgenme ve indirgenme standart yarı pil potansiyellerinin toplamına eşittir. Bu eşitlik aşağıdaki gibi yazılabilir: Ep̊il = Eẙük + E˚ind Bir elektrokimyasal tepkimede indirgenme potansiyeli büyük olan madde (katot) indirgenirken indirgenme potansiyeli daha küçük olan madde (anot) yükseltgenir. Elektrokimyasal pilde Ep̊il > 0 ise tepkime istemli olarak gerçekleşir, pil akım verir. Eğer Ep̊il < 0 ise tepkime istemsizdir, yani gerçekleşemez. 4. ÜNİTE: Elektrokimya 217 Şimdi örnek problemlerle pil potansiyellerinin nasıl hesaplandığını öğrenelim. ☞ÖRNEK : 16 Zn2+ (suda) + 2e¯ → Zn(k) E˚ = –0,76 V Cu2+ (suda) E˚ = 0,34 V + 2e¯ → Cu(k) indirgenme potansiyelleri verilmiştir. Buna göre Zn-Cu pilinin standart potansiyeli (Ep̊il ) kaç volttur? ✍ÇÖZÜM Verilen indirgenme tepkimelerinin E˚ değerlerine bakılırsa Cu2+ indirgenme potansiyelinin Zn2+ indirgenme potansiyelinden büyük olduğu görülür. Bu durum, oluşan pilde Zn’nun yükseltgeneceğini Cu2+ iyonunun indirgeneceğini ifade eder. Bu nedenle Zn indirgenme yarı tepkimesi, yükseltgenme yarı tepkimesi olarak düzenlenir ve indirgenme potansiyelinin işareti değiştirilerek yükseltgenme potansiyeli olarak yazılır. Zn ve Cu yarı pil tepkime denklemleri toplamı, pilin tepkime denklemini verir. Yarı pil potansiyellerinin toplamı ise standart pil potansiyelidir. Zn(k) → Zn2+ (suda) + 2e¯ E˚ = 0,76 V Cu2+ E˚ = 0,34 V (suda) + 2e¯ → Cu(k) –––––––––––––––––––––––––––––––––––––––––––––– 2+ Zn(k) + Cu2+ (suda) → Zn (suda) + Cu(k) Ep̊il = 1,10 V’tur. ☞ÖRNEK : 17 Al3+ (suda) + 3e¯ → Al(k) E˚ = –1,66 V Sn2+ (suda) + 2e¯ → Sn(k) E˚ = –0,14 V indirgenme potansiyelleri verilmiştir. Buna göre Al-Sn pilinin standart pil potansiyeli (Ep̊il) kaç volttur? ✍ÇÖZÜM İndirgenme tepkimelerinin E˚ değerleri incelendiğinde Sn2+ iyonunun indirgenme potansiyelinin daha büyük olduğu görülür. Bu nedenle hazırlanan pilde Al yükseltgenmeli, Sn2+ iyonu indirgenmelidir. Yarı pil tepkime denklemleri Al yükseltgenme, Sn2+ indirgenme yönünde olacak şekilde yazılır. Yükseltgenme-indirgenme tepkimelerinde alınan elektron sayısı, verilen elektron sayısına eşit olacağından yarı tepkimeler elektron eşitliğini sağlayacak şekilde uygun kat sayılarla çarpılır. Ancak E˚ değerleri bu sayılarla çarpılamaz. Çünkü yarı pil potansiyelleri ve yarı pil potansiyellerinin toplamına eşit olan standart pil potansiyeli, kullanılan elektrodun kütlesine, hacmine, yarı piller arasında alınan/verilen elektron sayısına bağlı bir özellik değildir. 2 [Al(k) → Al3+ (suda) + 3e¯ ] E˚ = 1,66 V 3 [Sn2+ (suda) + 2e¯ → Sn(k)] E˚ = –0,14 V 2Al(k) → 2Al3+ (suda) + 6e¯ E˚ = 1,66 V 3Sn2+ (suda) + 6e¯ → 3Sn(k) E˚ = –0,14 V ––––––––––––––––––––––––––––––––––––––––––––– 3+ 2Al(k) + 3Sn2+ Ep̊il = 1,52 V’tur. (suda) → 2Al (suda) + 3Sn(k) 218 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ☞ÖRNEK : 18 Al3+ (suda) + 3e¯ → Al(k) E˚ = –1,66 V Cu2+ (suda) Au3+ (suda) + 2e¯ → Cu(k) E˚ = 0,34 V + 3e¯ → Au(k) E˚ = 1,50 V Aşağıdaki pile ait standart indirgenme potansiyelleri verilmiştir. Buna göre pilin potansiyeli kaç volttur? Voltmetre Al Au 1 M Al2(SO4) 3 I 1 M CuSO4 II Au elektrodun batırıldığı elektrolit CuSO4 çözeltisi olduğundan pil, Al-Cu pili olarak çalışır. Au elektrot sadece iletken görevi görür. 2 [Al(k) → Al3+ (suda) + 3e¯ ] 3 [Cu2+ (suda) E˚ = 1,66 V + 2e¯ → Cu( k ) ] 2Al(k) → 2Al3+ (suda) + 6e¯ E˚ = 0,34 V E˚ = 1,66 V 3Cu2+ (suda) + 6e¯ → 3Cu(k) E˚ = 0,34 V ––––––––––––––––––––––––––––––––––––––––––––––––––– 3+ 2Al(k) + 3Cu2+ (suda) → 2Al (suda) + 3Cu(k) Ep̊il = 2,00 V’tur. Derişimin Pil Potansiyeline Etkisi Piller kullanıldıkça potansiyelleri düşerek akım veremez hâle gelir. Bunun nedeni elektrokimyasal pil tepkimesinde oluşan kimyasal dengedir. Bir elektrokimyasal pil tepkimesinde, başlangıçta denge sabitinin (Kc) sayısal değeri küçüktür. Sistem dengeye ulaşmak üzere ürünler yönünde yürür. Başlangıçta molar derişimleri aynı olan anot ve katot çözeltilerinin derişimi zamanla değişir. Anot çözeltisinde derişim artarken katot çözeltisinde derişim azalır. Bu yüzden pil potansiyeli, elektrotların yükseltgenme potansiyelleri dışında anot ve katot çözeltilerinin derişimine de bağlıdır. Pilde yürüyen tepkime denge konumuna geldiğinde pil dışarıya enerji veremez hâle gelir. Ancak tepkimeye girenlerin ya da ürünlerin derişimleri değiştirilirse Le Chatelier İlkesi’ne göre tepkime, derişim değişikliğinden kaynaklanan etkiyi azaltacak yönde yeniden yürür ve kimyasal denge kuruluncaya kadar devam eder. Le Chatelier İlkesi’ne göre derişim değişikliğine bağlı olarak pil potansiyelinin değişimi şöyle özetlenebilir: ®Anot çözeltisinde derişim artırılırsa pil potansiyeli azalır. ®Anot çözeltisinde derişim düşürülürse pil potansiyeli artar. ®Katot çözeltisinde derişim artırılırsa pil potansiyeli artar. ®Katot çözeltisinde derişim düşürülürse pil potansiyeli azalır. Anot ve katot çözeltisinde derişim farklılığının, potansiyel değişimine etkisinden yararlanarak aynı elementten yapılmış elektrotların farklı derişimli çözeltilerine batırılmasıyla derişim pilleri yapılabilir. Bu piller, çözeltilerin derişimleri eşit oluncaya kadar çalışır. 4. ÜNİTE: Elektrokimya 219 Şekil 4.8’deki pilde, derişimlerin farklılığı pilin çalışmasına neden olur. Sistemin dengeye ulaşması için I. kaptaki çözeltinin derişiminin artması, II. kaptaki çözeltinin derişiminin azalması gerekir. Bunun için I. kaptaki bakır elektrodu oluşturan bakır atomu, dış devreye iki elektron vererek Cu2+ iyonu hâlinde çözeltiye geçer. Dış devreye bakır atomu tarafından verilen iki elektron, II. kapta CuSO4 çözeltisindeki Cu2+ iyonuna geçer ve bu iyon elementel bakır hâlinde indirgenir. II. kapta yalnız kalan SO42– iyonu tuz köprüsü aracılığıyla I. kaba geçer. Böylece II. kaptaki çözelti derişimi azalırken I. kaptaki Şekil 4.8: Derişim pili çözelti derişimi artar. Derişim pilinde yarı pil tepkimelerinin ve pil tepkimesinin denklemleri şöyledir: 2+ Yükseltgenme yarı tepkimesi , Cu(k) Cu (suda) (0,1 M) + 2e¯ İndirgenme yarı tepkimesi , Cu2+ Cu(k) (suda) (1M) + 2e¯ –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– 2+ Pil tepkimesi , Cu2+ Cu (suda) (0,1 M) (suda) (1M) Tepkime denkleminden de anlaşılacağı gibi derişimi büyük olan çözeltide (katot çözeltisinde) Cu 2+ iyonları azalacak, derişimi küçük olan çözeltide (anot çözeltisinde) Cu2+ iyonları artacaktır. ☞ÖRNEK : 19 Yanda şekli verilen derişim pilinde; a. I. kaba 100 mL su eklenirse, b. II. kaba 900 mL su eklenirse, c. I. kaba katı ZnSO4 eklenirse, ç. II. kaba katı ZnSO4 eklenirse, ne gibi değişmelerin gözlemlenmesi beklenir? ✍ÇÖZÜM a. I. kaba 100 mL su eklendiğinde bu kaptaki derişim azalır. Dolayısıyla pilin potansiyeli artar ve ömrü uzar. b. II. kaba 900 mL su eklendiğinde; M1V1 = M2 V2 1 · 100 = M2 · (100 + 900) ⇒ M2 = 0,1 M olur. Her iki kapta derişimler eşit hâle geleceğinden pil çalışmaz. c. I. kaba katı ZnSO4 eklenmesi, bu kapta Zn2+ iyon derişimini artırır. Tepkime zaten Zn2+ iyon derişimini I. kapta artıracak, II. kapta azaltacak yönde yürüyerek dengeye ulaşacağından, I. kapta Zn2+ iyon derişiminin artırılması dengeye daha kısa sürede ulaşılmasına neden olur. Dolayısıyla pilin ömrü kısalır. Eğer eklenen ZnSO4 miktarı derişimleri eşit hâle getirirse pil çalışmaz. 220 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ç. II. kaba katı ZnSO4 eklenmesi, bu kapta Zn2+ iyon derişimini artırır. II. kapta Zn2+ iyon derişiminin artması, I ve II. kaptaki Zn2+ iyon derişimleri arasındaki farkın büyümesine neden olur. Bu durum bir yandan pil potansiyelinin artmasına, diğer yandan tepkimenin daha uzun sürede dengeye ulaşmasına, dolayısıyla pilin ömrünün uzamasına neden olur. Standart indirgenme potansiyellerinin 25˚C sıcaklık, 1 atm basınç, anot ve katot çözelti derişimlerinin 1 M olduğu koşullarda ölçüldüğünü biliyorsunuz. Bir pil tepkimesinde anot ya da katotda çözelti derişiminin 1 M’dan farklı olabildiği durumlarda söz konusu olabilmektedir. Böyle durumlarda pil potansiyelini hesaplamak için W. Nernst (W. Nerst) tarafından bulunan ve kendi adıyla anılan denklem kullanılır. Bu denklem şöyledir: Epil = E ˚– 2 , 303 RT [Ürünler ] . log nF [Girenler ] Bu denklemde; Epil : Deney şartlarındaki pil potansiyelini, E˚ : Pilin standart koşullardaki potansiyelini 2,303 : Doğal logaritmadan 10 bazına göre logaritmaya geçiş sabitini R : İdeal gaz sabitini T : Mutlak sıcaklığı (K) n : Denkleştirilmiş denklemde alınan/verilen elektron sayısını F : Faraday’ı belirtir. Standart koşullarda 2,303 RT/F değeri sabit olup bu değer 0,059 V/mol’ dür. Buna göre sadeleştirilmiş denklem şöyledir: Epil = E ˚– 0, 059 [Ürünler ] . log n [Girenler ] ☞ÖRNEK : 20 Zn-Ag pilinin Zn2+ iyonları derişimi 0,1 M, Ag+ iyonları derişimi 10 M olduğuna göre pilin potansiyelini hesaplayınız. (E˚ = 1,56 V) ✍ÇÖZÜM 2+ 2Ag+ + Zn˚ 2Ag˚ + Zn E˚=1,56 V Tepkimede alınan/verilen elektron sayısı 2’dir. Yani n = 2’ dir. Epil = E ˚– [ Zn2+ ] 0,059 log n [ Ag+ ]2 Epil = 1, 56 – 0, 059 0,1 log 2 (10 )2 Epil = 1, 56 – 0 , 0295 · (–3) Epil = 1, 65 V ’tur. 4. ÜNİTE: Elektrokimya 221 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Bakır(II) sülfat çözeltisine toz Magnezyum hâlinde magnezyum metali eklendiğinde bakır metalinin çöktüğü gözlenmektedir. Bu değişimin nedeni nedir? Açıklayınız. Bu değişime ait tepkime denklemini yazınız. Bakır(II) sülfat çözeltisi Bakır 2. Metallerin yükseltgenme-indirgenme eğilimleri sırasını (Tablo 4.2) kullanarak aşağıdaki tepkimelerin gerçekleşip gerçekleşmeyeceğine karar veriniz. Tepkimenin gerçekleşip gerçekleşmeyeceği yönündeki kararınızın nedenini açıklayınız. a. Demir + Bakır(II) sülfat çözeltisi b. Gümüş + Kalsiyum nitrat çözeltisi c. Çinko + Kurşun(II) nitrat çözeltisi 3.Bazı elementlerin indirgenme eğilimleri birbirine göre şöyledir: Fe < Ni < Pb < H2 < Cu Buna göre aşağıdaki tepkimelerden hangilerinin gerçekleşeceğini hangilerinin gerçekleşemeyeceğini tahmin ediniz. a. Nikel + Demir(III) nitrat çözeltisi b. Demir + Bakır(II) sülfat çözeltisi c. Nikel + Hidroklorik asit çözeltisi ç. Nikel + Bakır(II) oksit çözeltisi d. Nikel + Kurşun(II) nitrat çözeltisi 4. Galvanik hücrelerde; a. Tuz köprüsünün rolü nedir? b. Elektrotların işlevi nedir? c.Devreden akım geçtiği nasıl anlaşılır? 5. Birbirine tuz köprüsüyle bağlı galvanik hücrelerden biri Zn levha ve Zn(NO3)2 çözeltisi, diğeri Ni levha ve NiCl2 çözeltisinden oluşuyor. Galvanik hücrede aşağıdaki tepkime gerçekleşiyor. + 2+ Zn(k ) + Ni2( suda Zn( suda ) + Ni(k ) ) Tablo 4.2’yi kullanarak aşağıdaki soruları yanıtlayınız. a. Hangi yarı tepkime anotta, hangi yarı tepkime katotta gerçekleşir? b. Elektron geçişi hangi yöndedir? c. Tuz köprüsünde hangi iyon, hangi yönde göçer? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Tepkimeye girme eğilimi büyük olan element yükseltgenir. ( ... ) 2. İndirgenmenin gerçekleştiği yarı hücredeki çözeltiye “anot çözeltisi” denir. ( ... ) 222 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. 25 ˚C sıcaklıkta ve 1 M ’lık elektrolit çözeltisi kullanılarak 1 atm basınçta ölçülen pil ( ... ) potansiyeline “standart pil potansiyeli” denir. 4. Kimyasal tepkimede denge kurulduğunda pil potansiyeli sıfır olur. ( ... ) 5. Elektrot yüzeyi ile temas ettiği çözelti arasında oluşan potansiyel farkına “pil potansiyeli” denir. ( ... ) 6. Tuz köprüsündeki anyonlar yükseltgenmenin olduğu yarı tepkime kabına göç eder. ( ... ) 7. Katot çözeltisinde katyon derişimi artarsa pil potansiyeli de artar. ( ... ) 8. Elektrokimyasal pilde E˚ > 0 ise tepkime istemli olarak gerçekleşir. ( ... ) 9. Derişim pilleri Le Chatelier İlkesi’ne göre çalışır. ( ... ) 10. Bir pil tepkimesinde yarı hücrelerdeki çözeltilerin derişimi 1 M’dan farklı ise bu pilin potansiyeli Nernst eşitliğinden yararlanılarak hesaplanır. ( ... ) 11. Hidrojen yarı pili standrat karşılaştırma elektrodu olarak kullanılmaz. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Bazı elementlerin tepkimeye girme eğilimleri Na > Ca > Al > Zn > H2 > Cu > Ag şeklindedir. Buna göre aşağıdaki tepkimelerden hangisi istemli değildir? A) 2AgNO3 + Cu → Cu(NO3)2 + 2Ag B) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 C) 2Ag + 2HF → 2AgF + H2 D) Ca + H2O → CaO + H2 E) Zn + 2NaOH → Na2ZnO2 + H2 2. Ca2+(suda) + 2e– → Ca(k) E˚ = –2,87 V Ni2+(suda) + 2e– E˚ = –0,25 V – Cl2(g) + 2e → Ni(k) – → Cl (suda) E˚ = 1,36 V Yukarıda indirgenme potansiyelleri verilen Ca, Ni, Cl2 elementlerinin tepkimeye girme eğilimleri arasındaki ilişki hangi seçenekte doğru verilmiştir? A) Ca < Ni < Cl2 B) Ni < Ca < Cl2 D) Cl2 < Ca < Ni E) Cl2 < Ni < Ca 3. I. Al3+(suda) + 3e– → Al(k) E˚ = –1,66 V – II. Cl2(g) + 2e – → 2Cl (suda) C) Ni < Cl2 < Ca E˚ = 1,36 V Yarı tepkimelerin standart indirgenme potansiyelleri verilmiştir. Buna göre aşağıdakilerden hangisi yanlıştır? A) Yükseltgenme yarı tepkimesinde 3e– verilmiştir. B) Cl2 yükseltgendir. C) Standart pil potansiyeli 3,02 V’tur. D) Al indirgendir. E) Elektron geçişi Cl2 dan Al’a doğrudur. 4. Mg, Mn, Co elementleri yükseltgenme eğilimlerine göre Mg > Mn > Co şeklinde sıralanmaktadır. Mn – Co pilinin standart potansiyeli 0,9 V, Mg – Co pilinin standart potansiyeli 2,09 V olduğuna göre Mg – Mn pilinin standart potansiyeli aşağıdakilerden hangisidir? A) 1,19 4. ÜNİTE: Elektrokimya B) 1,8 C) 2,38 D) 2,99 E) 3,28 223 5. I. Sıcaklık II. Derişim III. Alınan verilen elektron sayısı Yukarıdakilerden hangileri pil potansiyelini etkiler? A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III 6. Bir elektrokimyasal pil tepkimesinde zamanla; I.Anot elektrot aşınır. II.Katot çözeltisinin derişimi azalır. III.Katot elektrodun kütlesi artar. Yargılarından hangisi ya da hangileri doğrudur? A) Yalnız I B) Yalnız II C) I ve III D) II ve III E) I, II ve III 7. Ca, Mg, Co metallerinin elektron verme eğilimleri Co < Mg < Ca şeklindedir. I II III Co(NO3) Ca(NO3) 2 Mg(NO3) 2 Mg kap Ca kap 2 Co kap Ca, Mg, Co metallerinden yapılmış kaplara yukarıdaki şekillerde belirtilen çözeltiler konuyor. Bir süre sonra hangi kapta ya da kaplarda aşınma gözlemlenir? A) Yalnız I 8. B) Yalnız II C) Yalnız III D) I ve II E) II ve III I.Ag metali oksijensiz asitlerle tepkime vermiyor. II. Fe metali asitlerle tepkimesinde H2 gazı açığa çıkarıyor. III. Mg + Fe2+ → Mg2+ + Fe tepkimesi istemli gerçekleşiyor. Buna göre Ag, Fe, Mg metallerinin tepkimeye girme eğilimlerine göre büyükten küçüğe sıralanışı hangi seçenekte doğru verilmiştir? A) Ag, Fe, Mg B) Mg, Fe, Ag C) Mg, Ag, Fe 4+ – 9. Sn2+ (suda) + I 2(k) → Sn (suda) + 2I (suda) E˚ = 0,38 V – Sn4+ → Sn2+ (suda) + 2e (suda) E˚ = 0,15 V D) Ag, Mg, Fe E) Fe, Ag, Mg olduğuna göre iyodun standart indirgenme potansiyeli kaç V’tur? A) –0,53 224 B) –0,19 C) 0,19 D) 0,39 E) 0,53 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ELEKTROKİMYASAL HÜCRELER BÖLÜM İÇERİĞİ 1.Elektrokimyasal Hücreler 2.Elektroliz 3. Endüstriyel Elektroliz Limon, elma, portakal, greyfurt gibi meyvelerin suyu asidik özellik gösterir. Bu meyvelere çinko-bakır, alüminyum-bakır, magnezyum-demir çiftlerinden oluşan elektrotlar batırılıp bir devre kurulursa devredeki ampülün çok kısa bir süre cılız ışık verdiği gözlenir. Böyle bir düzeneğin bir elektrokimyasal pil olabileceğini düşünür müydünüz? Bu bölümde bu tür soruları ve yanıtlarını bulacaksınız. 4. ÜNİTE: Elektrokimya 225 1. Elektrokimyasal Hücreler Kendiliğinden yürüyen bir redoks tepkimede indirgen tarafından salınan elektronlar yükseltgen olarak davranan maddeye bir iletken üzerinden iletilirse tepkimede elektrik enerjisi oluşur. Yani tepkimede kimyasal enerjinin bir kısmı elektrik enerjisine dönüşür. Kimyasal enerjiyi elektrik enerjisine dönüştüren düzeneklere elektrokimyasal hücre ya da pil adı verilir. Pil adı verilen bu sistemlerin birer galvanik hücre olduğunu biliyorsunuz. Şekil 4.9’daki düzenekle (Bu düzenek 2. ete¯ kinlikte kurduğunuz düzenektir.) elektrik enerjisi elde V e¯ etmek olanaklıdır. Bu devrede anahtar açık konumda tutulduğu zaman çinko elektrot seyreltik sülfürik asitle tepkimeye girer ve hidrojen gazı kabarcıkları oluşur. Çinko Bakır Ancak bakır elektrodun tepkime verdiğini gösterir belirtiye rastlanmaz. Bu kez anahtar kapalı konuma getirilirse bakır elektrot etrafında hidrojen gazı kabarcıkları oluşurken çinko elektrot da seyreltik H2SO4 içinde çözünmeye başlar. Voltmetrenin göstergesindeki sapma, sistemde bir potansiyel fark oluştuğunu gösterir. Seyreltik sülfürik asit + H+ H + H H+ H+ H+ Şekil 4.9: Bir elektrokimyasal pil Devredeki anahtar bir süre daha kapalı konumda tutulursa bakır elektrot çevresinde hidrojen gazı kabarcıkları birikmeye başlar. Hidrojen gazı kabarcıkları bakır elektrodu yalıtarak sistemle temasını engeller. Bu olay kutuplanma ya da polarizasyon olarak bilinir. Kutuplanma ile elektrotlar arasındaki potansiyel fark azalır. Nihayet sistem akım üretemez hâle gelir. Şimdi akla gelen soru, sistemde neden kutuplanma olduğu ve bu kutuplanmanın nasıl giderilebileceğidir. Bildiğiniz gibi pozitif yüklü iyonlar katoda gittiklerinden katoda giden anlamında katyon, eksi yüklü iyonlar ise anoda gittiklerinden anoda giden anlamında anyon olarak adlandırılırlar. Ancak bu tanımlar negatif yüklü iyonların katoda gidemeyeceği fikrini çağrıştırır. Oysa bir anyon olan CrO42– iyonunun katotta indirgenerek Cr3+ iyonu ya da metalik Cr oluşturabildiği bilinmektedir. Bu nedenle katot ve anot kavramlarını yük temelinde değil elektron alış verişi ile gerçekleşen elektrokimyasal değişim temelinde algılamak gerekir. Hatırlayacağınız gibi pozitif yüklü iyonlar katoda göç edip katottan elektron alarak indirgenirler ve elementel hâlde açığa çıkarlar. Şekil 4.9’da gösterildiği gibi seyreltik H2SO4 çözeltisi içindeki H+ iyonları katot konumudaki bakır elektroda (katoda) göç ederler. Devre üzerinden bakır elektroda gelen elektronları alarak atomal hâle (H) indirgenirler. H atomları H2 molekülleri oluşturarak gaz kabarcıkları hâlinde bakır elektrot etrafında toplanırlar. 2H+(suda) + 2e– → H2(g) Eğer sistemde H+ iyonlarının doğrudan bakır elektroda göçleri engellenebilirse kutuplanma gerçekleşemez. İşte bu amaçla elektrotlar arasına yarı geçirgen bir zar konur ya da sistem iki yarı hücreye ayrılır. Yarı hücreler tuz köprüsü ile birbirine irtibatlanır. Böylece birbiriyle irtibatlı iki yarı hücre galvanik bir hücre hâline getirilmiş olur. Ancak bu sistemde devredeki anahtar açık konumda dahi olsa Zn elektrodun elektrolit içinde çözünmesi engellenemez. Bu nedenle elektrotların çözünüp aşınmayacağı elektrolitleri kullanmak akıllıca bir yoldur. Bu amaçla Zn elektrodun kendiliğinden tepkime verip çözünememesi için yer aldığı yarı hücreye elektrolit olarak bir çinko tuzu çözeltisi (örneğin, ZnSO4 çözeltisi), 226 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Cu elektrodun yer aldığı yarı hücreye de bir bakır tuzu çözeltisi (örneğin, CuSO4 çözeltisi) konur. Tuz köprüsü (Resim 4.8) de yarı hücrelerdeki çözeltilerle tepkime vermeyen herhangi bir tuzun (NaCl, KNO3, Na2SO4 vb.) doymuş çözeltisi ile oluşturulur. Resim 4.8: Galvanik hücrede tuz köprüsü Zn – Cu elektrokimyasal pilde elektronların dış devre aracılığı ile anottan katoda doğru akması iki kutup arasındaki potansiyel farkından kaynaklanır. Anot katoda göre daha yüksek negatif potansiyele sahip olduğundan elektron akışı anottan katoda doğru gerçekleşir. Bir elektrokimyasal pili oluşturan iki yarı hücrenin potansiyel farkı elektromotor kuvveti ya da elektrokimyasal hücre potansiyeli olarak bilinir. Standart pil potansiyeli, iki yarı hücrenin standart yarı pil potansiyellerinin toplamına eşit olduğundan standart pil potansiyelinin büyüklüğü yarı hücrelerde yer alan elektrotların cinsine bağlı olarak değişir. Söz gelimi Zn-Cu pilinin standart pil potansiyeli E˚ = 1,1 V, Zn—H pilinin 0,76 V, Zn—Ag pilinin 1,5 V’tur ve standart pil potansiyeli yarı piller arasında alınan / verilen elektron sayısına, elektrodun kütlesine dolayısıyla hacmine bağlı bir özellik değildir. Ancak elektrotların kütlelerinin dolayısıyla hacimlerinin büyüklüğü sadece pilin ömrü açısından önemlidir. Bu bağlamda kalem pil ile büyük boy pil arasındaki fark, potansiyel farkı olmayıp kullanım süresindeki, diğer bir ifadeyle pil ömründeki farktır. Volta pili taşınabilir olmadığından ve kısa süreli akım verdiğinden kullanışlı değildir. Dolayısıyla volta pilinin kullanışlı hâle getirilmesi gerekir. Volta pilinin kullanışlı hâle getirilmiş şekli kuru pildir. Kuru pillerin volta pilinden farkı, asit çözeltisi yerine peltemsi hâle getirilmiş amonyum klorür içermeleridir. Bu tür kuru piller Leclanche ́ (Löklanşe) pili olarak adlandırılır. Şimdi aşağıdaki etkinliği yaparak kuru bir pilin yapısını inceleyiniz. 3. ETKİNLİK: NASIL KURUDU? Neler Gerekli? Güvenliğiniz için ❏Pense ❏ Teneke makası ❏ Gazete sayfası ❏ Bitmiş kuru pil ❏Tornavida Nasıl Yapacaksınız? 3 Masanın üstüne gazete sayfalarını seriniz. 3 Pense, tornavida ve teneke makası yardımı ile bitmiş kuru pilin çinko kabını, aşağıda ortada yer alan resimdeki gibi boyuna kesiniz. Kestiğiniz kısımları pense yardımıyla yanlara doğru kıvırınız. Böylece pilin Zn kabını açmış olursunuz. 4. ÜNİTE: Elektrokimya 227 3 Pili oluşturan katmanları inceleyiniz. Etkinlik Sonu Soruları 1. Kuru pilde hangi katmanlar yer almaktadır? Bir kuru pilin yapısı genelde Şekil 4.10’daki gibidir. Yap- Metal başlık Plastik kapak Zift Hava boşluğu tığınız etkinlikte de gördüğünüz gibi pilin silindir biçiminde çinkodan yapılmış bir dış yüzeyi vardır. Bu yüzey pilin eksi kutbu- Dış kap dur. Bu kutupta gerçekleşen yarı tepkimenin denklemi şöyledir: Çinko kap – Zn(k) → Zn2+ (suda) + 2e Yalıtma kâğıdı Grafitten yapılmış çubuk ise pilin artı kutbudur. Grafit Peltemsi madde çubuk çevresinde siyah renkli toz hâlinde mangan(IV) oksit ve Grafit çubuk grafit tozu karışımı vardır. Mangan(IV) oksit, pil tepkimesi sonu- Mangan(IV) oksit ve grafit tozu karışımı (MnO2, C) cu açığa çıkan hidrojen gazı ile tepkimeye girerek su oluşturur. Böylece grafit çubuk çevresinde hidrojen gazının birikmesi yani pilin kutuplanması önlenir. Bu tepkime şöyledir: Şekil 4.10: Kuru pilin yapısı 2MnO2(k) + 2NH+4(suda) + 2e– → Mn2O3(k) + 2NH3(suda) + 2H2O(s) Grafit çubuğun çevresindeki siyah renkli katman ile çinko dış yüzey arasında, torba içinde peltemsi yapıda bir katman daha yer alır. Peltemsi yapı amonyum klorür, çinko klorür, nişasta, un ve su karışımından oluşur. Elektrolit işlevi görür. Kuru pillerin potansiyeli 1,5 V’tur. Ancak kullanım ile bu potansiyel 0,8 V’a kadar düşebilir. Leclanche pillerinin geliştirilmiş türleri alkali, cıva, gümüş ve nikel-kadmiyum pillerdir. Alkali pillerde NH4Cl yerine NaOH ya da KOH kullanılır. Bu pilde yarı tepkimeler şöyledir: Anot: Zn(k) + 2OH–(suda) → ZnO(k) + H2O(s) + 2e– Katot: 2MnO2(k) + H2O(s) + 2e– → Mn2O3(k) + 2OH–(suda) Alkali pillerin potansiyeli de 1,5 V olup kullanım süreleri daha uzundur. Ayrıca yüksek güç, sabit akım ve potansiyel üretirler. 228 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Cıva ve gümüş pillerinin çalışma ilkeleri Leclanche pilleri gibidir. Farklılık, kullanılan elektrolitlerden ileri gelir. Bu pillerin yarı tepkimeleri şöyledir: Cıva pili; Anot: Zn(k) + 2OH–(suda) → ZnO(k) + H2O(s) + 2e– Katot: HgO(k) + H2O(s) + 2e– → Hg(s) + 2OH–(suda) Gümüş pili; Anot: Zn(k) + 2OH–(suda) → ZnO(k) + H2O(s) + 2e– Katot: Ag2O(k) + H2O(s) + 2e– → 2Ag(k) + 2OH–(suda) Nikel-kadmiyum piller ömürleri ve kullanım süreleri uzun olan, yeniden şarj edilebilir pillerdir. Cep telefonu, baz istasyonu vb. alanlarda kullanılırlar. Anodu kadmiyum metali, katodu nikel metali üzerine sarılmış nikel(IV) oksit bileşiğinden oluşur. Bu pilin yarı tepkimeleri şöyledir: Anot: Cd(k) + 2OH–(suda) → Cd(OH)2(k) + 2e– Katot: NiO2(k) + 2H2O(s) + 2e– → Ni(OH)2(k) + 2OH–(suda) Bu pillerin potansiyeli 1,3 V’tur. Bu piller yeniden şarj edildiğinde yük boşalma (deşarj) tepkimesi tersine çevrilir. Leclanche ve alkali pillerin kapasitelerinin sınırlı, kullanım sürelerinin genellikle kısa olduğunu gördünüz. Bu mahsurların nispeten Ni-Cd pillerle giderilebildiğini öğrendiniz. Bir arada Ni-Cd pilin potansiyelinin düşük olduğu, ancak şarj edilebildiği dikkatinizden kaçmamıştır. Ni-Cd pillerinde olduğu gibi bazı pillerde kimyasal tepkimeler ve fiziksel olaylar tersine çevrilerek kesintisiz akım elde edilebilmektedir. Bu tür pillere doldurulabilir piller denir. Bunlar kurşunlu, demir-nikel akümülatörlerdir. Kurşunlu Akümülatörler Uzun süre elektrik akımı elde edebilmek için pil yerine kullanılan düzeneklerdir. Doldurulurken (şarj edilirken) aldıkları elektrik enerjisini kimyasal enerji olarak depo ederler. Boşalırken (deşarj edilirken) kimyasal enerjiyi tekrar elektrik enerjisine çevirirler. Akümülatörlerin elektrotları kurşundan yapılmıştır. Elektrodun birinin bal peteği gibi gözleri vardır ve bu petekler kurşun(IV) oksit (PbO2) ile doldurulmuştur. Diğer elektrot ise kurşundandır (Resim 4.9, Şekil 4.11). Katot Anot Bakım kapakları Gözenekli kurşun plaka Gözenekli PbO2 plaka Elektrolit Resim 4.9: Akümülatörü oluşturan plakalar 4. ÜNİTE: Elektrokimya Şekil 4.11: Akümülatör gözlerinde kurşun ve kurşun oksitli plakalar 229 Akümülatör tam dolu olduğu zaman, içindeki elektrolit işlevi gören sıvı, belirli yoğunluktaki sülfürik asit (H2SO4) çözeltisi hâlindedir. Dolu akümülatörün kutupları arasına bir ampul bağlanırsa akümülatör devreye akım vererek boşalmaya başlar. Elektrotlarda zaman içinde kurşun(II) sülfat birikir ve sülfürik asit derişimi azalır. Akümülatör deşarj olduğunda içindeki sülfürik asit tümüyle saf su hâline gelir. Akümülatörün doldurulması için kutup başları doğru akım kaynağına bağlanarak akümülatörün levhaları üzerinden akım geçmesi sağlanır. Böylece elektrotlar arasında potansiyel farkı oluşturulur. Bir süre sonra “–” kutba bağlı elektrot Pb, “+“ kutba bağlı elektrot da PbO2 hâline gelir. Bu olaylara ait yarı tepkimeler şöyledir: Yük boşaltma (Deşarj) + Anot: Pb(k ) + HSO 4– ( suda ) PbSO4(k ) + H( suda ) + 2 e ¯ Şarj Yük boşaltma (Deşarj) Katot: PbO2(k ) + 3H+suda + HSO 4– ( suda ) + 2 e ¯ PbSO4(k ) + 2H2O( s ) Şarj Doğru akımın gerekli olduğu laboratuvar deneylerinde, telefonlarda, tren, uçak ve deniz taşıtları ile otomobillerin elektrik sistemlerinde akümülatörlerden yararlanılır. 2. Elektroliz Pil potansiyeli değerinin işaretinin artı (E˚ > 0) ya da serbest enerji değişimi değerinin işaretinin eksi olduğu tepkimelerin istemli oluşacağını ve böyle sistemlerden elektrik enerjisi üretilebileceğini öğrendiniz. Pil potansiyeli değerinin işaretinin eksi olduğu (E˚ < 0) tepkimeler ise istemli olmayıp kendiliğinden gerçekleşemezler ve elektrik enerjisi üretemezler. Örneğin, Zn0 + Cu2+ 2+ 0 Zn + Cu E˚ = 1,10 V elektrokimyasal pil tepkimesi istemli olarak gerçekleşir ve elektrik enerjisi üretir. Zn2+ + Cu 2+ Zn + Cu E˚ = –1,10 V tepkimesinde ise pil potansiyeli değerinin işareti eksi (E˚ < 0) olduğundan bu tepkime kendiliğinden gerçekleşemez ve elektrik enerjisi üretemez. Acaba elektrik enerjisi üretemeyen bu elektrokimyasal pili tepkimesinde yarı hücrelerdeki elektrotlara dış kaynaktan 1,10 V’ un üstünde potansiyel farka sahip elektrik enerjisi verilirse ne olmasını beklersiniz? İstemli gerçekleşmeyen bir elektrokimyasal pilin elektrotlarına dış kaynaktan E˚ değerinin üstünde (örneğimizde 1,10 V’un üstünde) potansiyel farka sahip elektrik enerjisi verilirse tepkime gerçekleşmeye başlar. Elektrik enerjisi kullanılarak istemsiz redoks tepkimelerin istenen yönde gerçekleştirilmesi işlemi elektroliz olarak adlandırılır. Elektrokimyasal piller ile elektroliz arasındaki fark, devreye bir üreteç bağlanarak dış kaynaktan elektrik enerjisi sağlanması ve sağlanan enerji ile istemsiz bir redoks tepkimenin istenen yönde oluşturulmasıdır. Suyun elementlerinden sentezine ait tepkimenin ekzotermik bir tepkime olduğunu ve bir kıvılcım ile başlayarak istemli olarak gerçekleştiğini biliyorsunuz. Bu tepkime bir galvanik hücrede gerçekleştirilebilirse 1,23 V’ luk potansiyel üretmesi beklenir. Bu tepkime denklemi aşağıdaki gibi gösterilebilir: 2H2(g) + O2(g) 2H2O(s) E˚ = 1,23 V Tepkimede E˚ > 0’dır. Dolayısıyla tepkime ileri yönde istemlidir. 230 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 2H2O(s) O2(g) + 2H2(g) E˚ = –1,23 V tepkimesinin E˚ değerinin işareti eksidir, yani E˚ < 0’ dır. Dolayısıyla suyun bileşenlerine ayrışma tepkimesi istemsiz olup hiçbir şekilde kendiliğinden gerçekleşmez. Şekil 4.12’de verilen Hoffmann (Hofman) voltametresine su doldurulup üzerine iletkenlik sağlayacak kadar herhangi bir tuz ya da asit çözeltisi eklenip elektrotlarına 1,23 V’ un üzerinde bir doğru akım verilmesi hâlinde ne olmasını beklersiniz? Su O2 Oksijen gazı Elektrot H2O H2 Hidrojen gazı Elektrot Üreteç (DC) Şekil 4.12: Hoffmann voltametresi ile suyun elektrolizi Sisteme 1,23 V’un üzerinde akım verilmesi hâlinde istemsiz olan suyun bileşenlerine ayrılma tepkimesi gerçekleşmeye başlar. Suyun elektrolizi olarak adlandırılan bu olayda artı yüklü H+ iyonları voltametrenin katot elektroduna, eksi yüklü OH– iyonları anot elektroduna gider. Elektrolit içinde ters yönlerde hareket eden bu zıt yüklü iyonlar elektrotlara ulaşınca elektron alış verişi yaparak nötr hâle geçer. Gaz hâlinde voltametrenin kollarında toplanmaya başlar. Suyun elektrolizinde gerçekleşen yarı tepkimelerin denklemleri şöyledir: Yükseltgenme yarı tepkimesi Anot : 2H2O(s) → O2(g) + 4H+(suda) + 4e¯ İndirgenme yarı tepkimesi Katot : + 4H2O(s) + 4e¯ → 2H2(g) + 4OH–(suda) –––––––––––––––––––––––––––––––––––––– Toplam elektroliz tepkimesi : 2H2O(s) → 2H2(g) + O2(g) Tepkime denklemine göre açığa çıkacak hidrojen gazı hacminin, oksijen gazı hacminin 2 katı olması gerekir. Yapılan deneylerde Hoffmann voltametresinin kollarında toplanan hidrojen gazı hacmi oksijen gazı hacminin 2 katıdır. Eğer bu gazlar aktivasyon enerjisini sağlayabilen bir kıvılcım etkisinde tepkimeye sokulursa tepkime patlama şeklinde hızla istemli olarak sonuçlanır ve su oluşur. Bu da suyun elektrolizinin istemsiz, elementlerinden su oluşmasının ise istemli bir olay olduğunu gösterir. Hoffmann voltametresinde gerçekleştirilen suyun elektrolizi tepkimesinde hassas deney aletleri ile yapılan ölçümlerde 7,8 Coulomb (kulon)luk yük geçişinde 1 cm3 hidrojen, 0,5 cm3 oksijen gazının oluştuğu belirlenmiştir. Bu sonuçtan yararlanarak 1 Coulomb’luk yük geçişinde açığa çıkan hidrojen ve oksijen gazlarının kütlelerini, içerdikleri atom sayılarını ve eş değer kütle sayılarını bulabiliriz. 4. ÜNİTE: Elektrokimya 231 1 cm3 hidrojen gazı toplanırsa 7,8 C’luk yük geçişiyle 1 C’ luk yük geçişiyle x ––––––––––––––––––––––––––––––––––––––––––––––––––– 1·1 x = –––– ≈ 0,128 cm3 hidrojen gazı toplanır. 7,8 Hidrojen gazının öz kütlesi, yapılan deneyler sonucunda dH2 = 8,4 · 10–5 g/cm3 olarak bulunmuştur. Bu veriden yararlanarak hidrojen gazının kütlesini hesaplayabiliriz. m=dV m = d V = 8,4 · 10–5 · 0,128 ≈ 1,075 · 10–5 g’ dır. 6,02 · 1023 tane atom içerirse 1 g hidrojen 1,075 · 10–5 g hidrojen x –––––––––––––––––––––––––––––––––––––––––––––––––– 6,02 · 1023 · 1,075 · 10–5 x = –––––––––––––––––––––– ≈ 6,472 · 1018 tane atom içerir. 1 Şimdi de 1 hidrojen atomunu açığa çıkarmak için devreden kaç C’ luk elektrik yükünün geçmesi gerektiğini bulalım. Yukarıda 1 C’luk yük geçişiyle 6,472 · 1018 tane hidrojen atomunun açığa çıktığını bulmuştunuz. 6,472 · 1018 tane H atomunu 1 C’luk yük açığa çıkarırsa 1 tane H atomunu x ––––––––––––––––––––––––––––––––––––––––––––––––– 1 x = ––––––––––– = 1,545 · 10–19 C elektrik yükü açığa çıkarır. 6,472 · 1018 Öyleyse H+ iyonunun katottan aldığı 1 elektronun yükü 1,545 · 10–19 C’dur. Ulaştığımız bu sonuç, 10. sınıf 1. ünitede öğrendiğiniz Robert Millikan’ın yüklü yağ damlacıkları ile yaptığı deneyin sonuçlarına yaklaşık (Rabırt Millikan’ın bulduğu sonucun 1,6 · 10–9 C olduğunu anımsayınız.) uymaktadır. Elektrolizde elde edilen oksijen gazının kütlesini de benzer hesaplamalar ile bulabiliriz. 0,5 cm3 O2 gazı toplanırsa 7,8 C’ luk yük geçişi ile 1 C’ luk yük geçişi ile x ––––––––––––––––––––––––––––––––––––––––––––––– 0,5 · 1 x = ––––––– = 0,064 cm3 O2 gazı toplanır. 7,8 m=d·V m = 1,33 · 10–3 · 0,064 m ≈ 8,5 · 10–5 g’dır. Suyun elektrolizi ile oluşan hidrojen ve oksijenin gazlarının eş değer sayılarını hesaplayabiliriz: ε= m.z M εHidrojen = m . z = 1, 075 · 10 M 1 εOksijen = m . z = 8, 5 · 10 M 232 16 –5 –5 . 1 = 1, 075 · 10 –5 . 2 = 1, 063 · 10 –5 tir. ORTAÖĞRETİM KİMYA 11 DERS KİTABI Görüldüğü üzere suyun elektrolizinde açığa çıkan hidrojen ve oksijen gazlarının eş değer sayıları yaklaşık olarak birbirine eşittir. Bu da Faraday Yasaları’nı doğrulamaktadır. Elektroliz olayının mekanizması çoğu zaman karmaşık bir hâl gösterir. Çünkü elektroliz ortamında bulunan iyonlar ve bunların derişimleri elektroliz olayının mekanizmasına etki eder. Böyle bir etkiyi çözünmüş tuzların elektrolizinde görelim. Çözünmüş Tuzların Elektrolizi Çözünmüş tuzların elektrolizine örnek olarak sodyum klorür çözeltisinin elektrolizini inceleyelim (Resim 4.10). Sodyum klorür çözeltisinin elektrolizinde çözeltinin derişik ya da seyreltik oluşuna göre iki farklı tepkime oluşur. Sodyum klorür çözeltisi çok seyreltik ise suyun kendisi tepkimeye girer. Akımın taşınmasını sağlayan Na+ ve Cl– iyonları elektrotlarda ayrışmaz. Bu durumda yarı pil tepkimelerinin ve pil tepkimesinin denklemleri şöyle yazılabilir: Resim 4.10: Sodyum klorür çözeltisinin elektrolizi Yükseltgenme yarı tepkimesi, 2H2O(s) → O2(g) + 4H+(suda) + 4e¯ İndirgenme yarı tepkimesi , 4H2O(s) + 4e¯ → 2H2(g) + 4OH–(suda) ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Elektrolizin tepkime denklemi, 6H2O(s) → O2(g) + 2H2(g) + 4H+(suda) + 4OH–(suda) Çözelti derişiminin yüksek olması hâlinde katotta H2(g) , anotta Cl2(g) açığa çıkar. NaCl çözeltisinin elektrolizinde NaCl derişimi farklılığından dolayı anot ve katot tepkimelerinde ortaya çıkan farklılık, tepkimeye girenlerin standart indirgenme ve yükseltgenme potansiyelleri karşılaştırılarak açıklanabilir. Na+(suda) + e– → Na(k)E˚ = –2,71 V 2H2O(s) + 2e– → H2(g) + 2OH–(suda) E˚ = –0,83 V Sodyum iyonu ve suyun standart indirgenme potansiyelleri karşılaştırılırsa Na+ iyonunun standart indirgenme potansiyelinin suyunkinden daha küçük olduğu görülür. Bu nedenle derişik NaCl çözeltisinin elektrolizinde su öncelikle indirgenerek katotta H2 gazı oluşur. Klor iyonu ve suyun standart yükseltgenme potansiyelleri karşılaştırıldığında ise suyun standart yükseltgenme potansiyelinin Cl– iyonununkinden daha büyük olduğu görülür. 2Cl–(suda) → Cl2(g) + 2e–E˚ = –1,36 V 2H2O(s) → 4H+(suda) + O2(g) + 4e– E˚ = –1,23 V Bu nedenle derişik NaCl çözeltisinin elketrolizinde anotda öncelikle Cl– iyonları Cl2 hâline yükseltgenerek açığa çıkar. Derişik NaCl çözeltisinin elektrolizine ait tepkime denklemi şöyledir: Yükseltgenme yarı tepkimesi, 2Cl–(suda) → Cl2(g) + 2e– – E˚ = –1,36 V 2OH–(suda) İndirgenme yarı tepkimesi, 2H2O(s) + 2e → H2(g) + E˚ = –0,83 V –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Elektrolizin tepkime denklemi, 2Cl–(suda) + 2H2O(s) → H2(g) + Cl2(g) + 2OH–(suda) E˚ = –2,19 V Derişik NaCl çözeltisinin indirgenme tepkimesinde ortamda kalan Na+ iyonları ile yükseltgenme tepkimesinde ortamda kalan OH– iyonları birleşerek yan ürün olarak NaOH(suda) oluşturur. Sodyum klorürün sulu çözeltisinin elektrolizi ile üç ayrı ürün elde edilebildiğinden, teknikte sodyum klorürün sulu çözeltisinin elektrolizi önemli bir yer tutar. 4. ÜNİTE: Elektrokimya 233 Ödev Resim 4.11’de KI’ün sulu çözeltisinin elektrolizi verilmiştir. İnceleyiniz ve Tablo 4.3’ten yararlanarak yarı tepkime denklemlerini yazınız. Çözünmüş tuzların elektrolizinde karşılaşacağımız özel bir durum da birden fazla tuzun çözünmesiyle oluşan çözeltilerin elektrolizidir. Örneğin, KCl ve AgNO3 tuzlarının çözünmesiyle oluşan sulu bir çözeltinin elektrolizi hâlinde öncelikle hangi maddelerin elektroliz kabının anot ve katot kutuplarında toplanacağını inceleyelim. Çözeltiyi oluşturan maddeler aşağıda gösterildiği şekilde iyonlaşır ve yine aşağıda belirtilen şekilde elektroliz kabının anot ve katot kutuplarına göç eder. Resim 4.11: KI’ün sulu çözeltisinin elektrolizi Katoda Anoda gidenler gidenler ––––––– ––––––– H2O → H+ + OH– KCl →K+ AgNO3 →Ag+ + Cl– + NO–3 Elektrolizde tepkimeye girme eğilimi en az olan iyonlar, anotta yükseltgenir ya da katotta indirgenir. Tablo 4.2 dikkate alındığında örnek verdiğimiz tuz çözeltisinin elektrolizinde indirgenme eğilimi daha büyük olan Ag+ iyonu indirgenir, yükseltgenme eğilimi daha büyük olan Cl– iyonu ise yükseltgenir. Yükseltgenme yarı tepkimesi , Cl–(suda) → 1/2Cl2(g) + e¯ İndirgenme yarı tepkimesi , Ag+(suda) + e¯ → Ag(k) –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– Elektrolizin tepkime denklemi, Ag+(suda) + Cl–(suda) → Ag(k) + 1/2Cl2(g) Böylece anotta öncelikle Cl2 gazı, katotta Ag metali toplanır. 3. Endüstriyel Elektroliz Elektroliz, endüstriyel olarak bileşiklerinden ya da tuzlarından metalleri ayırt etmekte; klor, flor ve kostik olarak bilinen sodyum hidroksiti elde etmekte, bakırı saflaştırmakta, elektro kaplama ve elektro arıtma işlemlerinde kullanılır. Ayrıca elektrolizden K2Cr2O7, KMnO4, Na2S2O8 gibi kimyasal bileşiklerin üretiminde de yararlanılır. Metallerin elektro arıtımı işlemi çözeltilerinden saf metali katotta biriktirme sürecidir. Örneğin, anot olarak saf olmayan bir bakır parçası, katot olarak ise ince ve saf bakır levha alınarak bakır(II) sülfat çözeltisi içinde elektroliz edilirse elektroliz boyunca sürekli olarak anotta oluşturulan Cu2+ iyonları katoda aktarılarak burada Cu’a indirgenir. Böylece anotta saf olmayan bakır tüketilirken katotta saf bakır biriktirilir. Anotta çözünen bakır, katottaki bakır birikme hızıyla aynı hızda çözünüp çözeltiye geçerek çözeltinin derişimini sabit tutar. Bu tepkime endüstride elektrolitik bakır eldesi olarak tanımlanan çok saf bakır elde etme sürecidir. 234 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Anotta : Cu0(k) → Cu2+(suda) + 2e– Saf olmayan bakır, anotta çözünerek sulu çözeltide Cu2+ iyonları oluşturulur. – 0 Katotta : Cu2+ (suda) + 2e → Cu (k) Saf bakır metali katot elektrotta toplanır. Elektrolizle kaplama işlemi ise soy olmayan metallerin koruma ya da dekoratif amaçlarla nikel, krom, altın, gümüş gibi metallerle kaplanma işlemidir. Elektrolizle kaplama metalik kaplama yöntemlerinden birisidir (Resim 4.12). Bu yöntemle kaplanacak metalik cisim hangi metalle kaplanacaksa bu metalin iyonlarını içeren elektrolite daldırılır. Anot olarak grafit elektrot kullanılır. Örneğin, demir kaşık nikelle kaplanacaksa katoda demir kaşık asılır ve NiSO4 çözeltisi içine daldırılır (Şekil 4.13). Elektrolitteki Ni2+ iyonları elektrolizle indirgenerek katotta asılı demir kaşık üzerinde birikir. Anotta: SO2– 4 iyonları yükseltgen- Üreteç mediğinden çözeltideki OH– iyonları yükseltgenerek O2 gazı açığa çıkar. 4OH–(suda) → O02(g) + 2H2O(s) 0 Katotta : Ni2+ (suda) → Ni (k) Resim 4.12: Bir elektrolitik kaplama işlemi Nikel kaplanacak demir kaşık (Katot) Grafit (Anot) Elektrolit kaplama çözeltisi NiSO4 25 g NH4Cl 4g NiCl2 4g H3BO3 4g Su 250 cm3 Demir kaşık nikelle kaplanır. Elektroliz yöntemiyle arıtma ya da kaplama işlemleri istemsiz tepkimeler olup tepkimeleri istemli hâle getirmek ancak elektrik enerjisi kullanılarak olanaklı- Şekil 4.13: Nikel kaplama düzeneği dır. Dolayısıyla bu tepkimeler büyük miktarlarda elektrik enerjisi tüketimini gerektirir. Genellikle elektrik enerjisi yüksek maliyetlerle elde edilebildiğinden tüketim maliyeti de oldukça yüksektir. Bu nedenle elektrolizle arıtma ya da kaplama yoluyla elde edilen ürünler oldukça pahalıdır. Söz gelimi otomobil tamponu gibi nikel kaplama eşyalar oldukça pahalıdır. ☞ÖRNEK : 21 Erimiş hâldeki MgCl2 ve Al2O3 bileşikleri ayrı ayrı aynı miktarda elektrik yüküyle elektroliz ediliyor. MgCl2’ün elektrolizinde 1,2 g Mg metali toplandığında Al2O3’in elektrolizinde kaç g Al toplanır? (Mg : 24, Al : 27) ✍ÇÖZÜM Elektrotlarda toplanan maddelerin eş değer sayıları birbirine eşittir. εMg = εAl m1 M1 · z1 = m2 M2 · z2 m 1, 2 ·2= 2 ·3 24 27 m2 = 0, 9 g Al toplanır. 4. ÜNİTE: Elektrokimya 235 ☞ÖRNEK : 22 NiCl2 çözeltisinden 5 saat süreyle 0,75 amperlik bir akım geçirilirek katotta 3,785 g nikel biriktiriliyor. Buna göre tepkimede ortamdan ayrılan hidrojen gazı normal koşullarda kaç mL hacim kaplar? (Ni : 58) ✍ÇÖZÜM Nikel ve hidrojen aynı elektroliz olayında açığa çıktığından Faraday Yasası’na göre eş değer sayıları birbirine eşittir. Daha önce 1 eş değer kütle hidrojenin 1 g (1/2 mol) olduğunu öğrendiniz. Bu hidrojenin normal koşullardaki hacminin 11 200 mL olduğunu biliyorsunuz. εNi + εH2 = εQ VH m i· t 2 = ·z+ M 22 400 96 500 2 V H2 3, 785 0, 75 · 5 · 3600 = ·2+ 58 11200 96 500 VH = 105, 24 mL ’dir. 2 ☞ÖRNEK : 23 Seri bağlı iki elektroliz kabından birinde CuCl2 çözeltisi, diğerinde bir Ga elementinin klorür tuzu elektroliz ediliyor. Belirli bir süre sonra kaplardan birinde 9,6 g Cu birikirken diğerinde 7 g Ga metali birikiyor. Buna göre; a. Devreden geçen akım şiddeti 4 amper ise elekroliz süresi kaç saniyedir? b. Ga elementinin klorür tuzunun formülü nedir? (Cu: 64, Ga: 70) ✍ÇÖZÜM a. Cu2+ + 2 e¯ → Cu0 64 g bakırı 9, 6 g bakırı 2 mol e− biriktirirse x 2 · 9, 6 x= = 0, 30 mol e− biriktirir. 64 1 mol e− 96 500 C ise − 0, 30 mol e x Q= i · t 28 950= 4 · t 0, 30 · 96 500 x= = 28 950 C ’dur. 1 b. Gan+ + ne¯ → Ga0 7 g Ga metalini 70 g Ga metalini t= 7238 saniye bulunur. 0,30 mol e − biriktirirse x 70 . 0, 30 = 3 mol e− biriktirir. 7 O hâlde Ga metalinin yükseltgenme basamağı +3 ’tür. x= Ga3+ Cl– → GaCl3 bulunur. ☞ÖRNEK : 24 Erimiş bir gümüş tuzu elektroliz edilerek 10,8 g Ag açığa çıkarılmak isteniyor. Bu işlem için 2 amperlik bir akımın kaç saat süreyle elektroliz devresinden geçirilmesi gerekir? (Ag : 108) 236 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ✍ÇÖZÜM m= i· t ·M 96 500 · z 10 , 8 = 2 · t · 108 96 500 · 1 t = 4825 s t = 1, 34 4 saat süreyle elektroliz sürdürülmelidir. ENDÜSTRİYEL KOROZYON VE ÖNLEME TEKNİKLERİ Pil oluşumu bazen istenmeyen bir olay olarak karşımıza çıkar. İstenmeyen pil doğada kendiliğinden oluşur ve zararlara yol açar. Birçok eşya ve malzemenin çürümesine neden olur. Örneğin; su borularında, demir yolu raylarında, gemilerde istenmeyen pil oluşumu çürümelere neden olur. OKUMA METNİ Metallerin kimyasal olaylar sonucu madde kaybına uğrayarak aşınmalarına, paslanarak aşınma ya da korozyon adı verilir. Demir ve demirden yapılmış cisimler doğada pilin bir elektrodu gibi davranarak korozyona uğrar. Benzer olaylara günlük yaşamda sıkça rastlanır. Yağmurla nemlenen demir bölümlerin ya da toprak altına gömülen demir boruların, demir depoların paslanarak aşınması sıkça görülür. Demirin nemli ortamlarda kendiliğinden paslanması olayı bir tür pil oluşumudur. Pil oluşumuyla demir paslanarak aşınır. Böylece demir korozyona uğrar. Demir gibi korozyona uğrayan metallere kimyasal tepkimeye girme eğilimi daha büyük olan çinko, magnezyum vb. metaller bağlanarak koruma sağlanır. Bu tür korumaya katodik koruma denir. Katodik koruma sağlayarak aşınan metallere (çinko, magnezyum vb.) kurban elektrot adı verilir. Yazarlar tarafından düzenlenmiştir. 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Kuru pilin nasıl elektrik akımı oluşturduğunu açıklayınız. 2. Kurşun asit aküsünde bir hücrenin potansiyeli yaklaşık 2 V’tur. Bir otomobil akümülatöründe elektrik sistemi için gerekli olan 12 V’luk potansiyel nasıl sağlanır? Açıklayınız. 3. CrO3 çözeltisinden 12 g Cr metalini açığa çıkarmak için 6,20 A’lik bir akım, devreden kaç saat süre ile geçirilmelidir? (Cr : 52) 4. Alüminyum, erimiş kriyolit (Na3AlF6) içinde çözünmüş oksidinin elektrolizinden elde edilir. Sürekli olarak 1.105 A’de çalışan bir elektrolitik hücrede bir günde üretilebilen Al kütlesi kaç gram olur? (Al : 27) 5. İndiyum elementi erimiş halojenür tuzlarının elektrolizinden elde edilir. Elektroliz devresinden 3,20 A’lik akım 40 dakika süreyle geçirildiğinde 4,57 g indiyum biriktiğine göre indiyumun halojenür tuzundaki yükseltgenme basamağı kaçtır? (In: 115) 6. 1 M ’lık Na2SO4 çözeltisi elektroliz edildiğinde anot ve katotta hangi maddeler toplanır? Yarı tepkime denklemlerini yazarak denkleştiriniz. 4. ÜNİTE: Elektrokimya 237 B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Bir elektroliz kabında üretecin negatif kutbu elektronların çıktığı yerdir. ( ... ) 2. Bir elektroliz kabında üretecin pozitif kutbu, yükseltgenmesinin olduğu yerdir. ( ... ) 3. Bir elektrik devresinden sürekli yük geçişi sağlayan ve potansiyel oluşturan araçlara “üreteç” denir. ( ... ) 4. Bir elektroliz kabında iyonlar aynı kutba göç eder. ( ... ) 5. Elektroliz ile metaller saflaştırılabilir ve metal kaplama yapılabilir. ( ... ) 6. Elektroliz sırasında gerçekleşen tepkimenin ΔE˚ değerinin pozitif olması gerekir. ( ... ) 7. Elektrolizde indirgenme yarı tepkimesinin olduğu elektrot katottur. ( ... ) 8. Ticari piller de yükseltgenme, indirgenme temeline dayanır. ( ... ) 9. Elektroliz hücresinde oluşan tepkime istemlidir. ( ... ) 10. Bir galvanik hücre iki yarı hücreden oluşur. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1.KI çözeltisinden 1,56 A’lik akım geçirilerek anotta 3,44 g I2 oluşması için devreden kaç dakika süreyle akım geçmelidir? (I : 127) A) 41,5 B) 27,9 C) 20,8 D) 14,8 E) 5,2 2. 335 mL 0,215 M CuSO4 çözeltisinden 2,17 A’lik akım 235 s süreyle geçirildiğinde çözeltide kalan Cu2+ iyonlarının derişimi aşağıdakilerden hangisidir? A) 0,207 B) 0,154 C) 0,052 D) 0,175 E) 0,103 3. Seri bağlı iki elektroliz kabından biri Al3+ diğeri Ag+ iyonu içermektedir. Devreden 0,5 Faradaylık bir akım geçtiğinde katotlarda kaçar gram metal birikir? ( Al : 27, Ag : 108) Al ––––– A) 4,5 Ag –––––– 27 B) 2,7 45 C) 4,5 45 D) 4,5 54 E) 2,7 54 4. Şekildeki gibi seri bağlanmış elektroliz devresinden bir süre akım geçirildiğinde birinci kapta 3,2 g Cu, diğer kapta 2,8 g Fe metali toplanmıştır. Buna göre Fe metalinin karbonat iyonuyla oluşturduğu bileşiğin formülü aşağıda- Fe 2+ Fe kilerden hangisidir? (Cu : 64, Fe : 56) A) Fe2CO3 B) Fe(CO3)3 C) FeCO3 D) Fe2(CO3)3 E) Fe3(CO3)2 238 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 4.ÜNİT E D EĞE R LE NDİR M E ÇA LIŞM A LA R I A. Aşağıdaki soruları yanıtlayınız. 1. Asidik ortamda gerçekleşen aşağıdaki tepkimelerin denklemlerini denkleştiriniz. a. I – + HSO–4 → I 2 + SO2 ç. PbO2 + Cl– → PbCl2 + Cl2 b. Cr3+ + BiO–3 → Cr2O72– + Bi3+ d. Sn + NO–3 → SnO2 + NO c. C2O42– + HNO2 → CO2 + NO 2. Bazik ortamda gerçekleşen aşağıdaki tepkimelerin denklemlerini denkleştiriniz. a. CrO42– + S2– → S + CrO–2 b. ClO–3 ç.O2 + N2H4 → H2O2 + N2 – d. Cl2 → Cl– + ClO–3 + N2H4 → NO + Cl e. HXeO–4 → XeO64– + Xe + O2 c. Au + CN– + O2 → Au(CN)–4 + OH– 3. Potasyum dikromatın (K2Cr2O7) asidik ortamda oksalik asit (H2C2O4) ile yükseltgenmesinden Cr3+ iyonu ve CO2 oluştuğuna göre net iyon tepkimesini yazarak denkleştiriniz. 4. OCl– iyonu S2O32– iyonu ile tepkimeye girerek OCl– iyonu Cl– iyonuna indirgenir. S2O32– iyonu ise SO42– iyonuna yükseltgenir. Net iyon tepkime denklemini yazarak denkleştiriniz. 5. Aşağıda yarı tepkime denklemleri verilen pil tepkimesinin standart pil potansiyelini bulunuz. Br – + 3 H2O BrO–3 + 6H+ + 6e¯ I2 + 2e¯ 2I – E˚ = 1,44 V E˚ = 0,53 V 6. H2SO3 ile HOCl arasında gerçekleşen tepkimede S2O32– iyonu ve Cl2 gazı oluşmaktadır. Aşağıda yarı tepkimeleri verilen net tepkimenin istemli olup olmadığını tartışınız. 2– S2O3 + 3H2O 2HOCl + 2 H+ + 2e¯ Cl2 + 2H2O 2H2SO3 + 2 H+ + 4e¯ E˚ = 0,40 V E˚= 1,63 V 7. Standart koşullarda Ag ve Fe yarı hücrelerden oluşan pilin standart pil potansiyelini bulunuz. Ag+(suda) + e– → Ag˚(k) 3+ Fe (suda) – + e → Fe2+(suda) E˚ = 0,80 V E˚ = 0,77 V 8. HI çözeltisinin elektrolizinde elektrotların birinde 24 cm3 H2 gazı toplanıyor. Diğer elektrotta kaç g I2 oluşur? (I : 127) 9. 1 M AgNO3 çözeltisi elektroliz edildiğinde anot ve katotta hangi maddeler toplanır? Yarı tepkime denklemlerini yazarak açıklayınız. 10. Aşağıdakilerin her birini kısaca açıklayınız. a. Standart hidrojen elektrodu ç. Ticari piller b. Katodik koruma d. Tuz köprüsü c. Yakıt pili 4. ÜNİTE: Elektrokimya 239 B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Katyonlar genellikle katoda göç ederek katottan elektron alır. ( ... ) 2. Katotta yükseltgenme yarı tepkimesi gerçekleşir. ( ... ) 3. Tuz köprüsü yarı hücreler arasında iyon geçişini ve yük denkliğini sağlar. ( ... ) 4. Elektrokimyasal pilde elektronların dış devre aracılığı ile anottan katoda aktarılması ( ... ) iyon göçü ile sağlanır. 5. Bir kuru pilde grafitten yapılmış çubuk pilin artı kutbudur. ( ... ) 6. Kesintisiz akım verebilen pillere “doldurulabilir piller” denir. ( ... ) 7. Katot elektrotta açığa çıkan hidrojen gazı kabarcıklarının katot etrafında birikerek ( ... ) elektron geçişini engellemesine “polarizasyon” denir. 8. Volta pili taşınabilir olduğundan uzun ömürlüdür. ( ... ) 9. Galvanik hücrenin dış devresinden elektronların, iç devresinden iyonların göç etmesi ( ... ) ile elektrik akımının oluşması sağlanır. C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Ksenon tetraflorür (XeF4 ) bileşiğinde ksenonun yükseltgenme basamağı aşağıdakilerden hangisidir? A) –4 B) –1 C) +1 D) +2 E) +4 2. Dihidrojen fosfat (H2PO–4 ) iyonunda fosforun yükseltgenme basamağı aşağıdakilerden hangisidir? A) +5 B) +4 C) +3 D) –3 E) – 4 3. 2Ca3(PO4)2(k) + ?C(k) + 6SiO2(k) → P4 + 6CaSiO3 + ?CO tepkime denklemi tam sayılarla denkleştirildiğinde C’un ve CO’in önünde olması gereken kat sayı aşağıdakilerden hangisidir? A) 1 B) 2 C) 3 D) 7 E) 10 4. Bazik ortamda Cr(OH)3 çökeltisi IO–3 iyonları ile tepkimeye girerek I – ve CrO42– ürünlerini oluşturuyor. Tepkime denklemi denkleştirildiğinde aşağıdaki seçeneklerden hangisi doğrudur? 2– A ) Cr (OH) 3 + 5OH– CrO 4 – – B ) IO 3– + H2O I + OH 2– – C ) Cr (OH) 3 + OH– + IO 3– I + CrO 4 2– – D ) 2Cr (OH) 3 + IO 3– + 4OH– 2 CrO 4 + I + 5H2O 2– – E ) 2Cr (OH) 3 + IO 3– + OH– 2CrO 4 + I 5.Sn2+ + 2e¯ → Sn(k) 2+ Ni + 2e¯ → Ni(k) E˚ = –0,14 V E˚ = –0,25 V yarı tepkimelerine göre Sn ve Ni yarı hücrelerinden oluşan pilin standart potansiyeli aşağıdakilerden hangisidir? A) –0,39 240 B) –0,11 C) +0,11 D) +0,39 E) 0,50 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 6. Zn ve Cu yarı hücrelerinden oluşan pilin standart potansiyeli E˚ = 1,10 V ’tur. Bu pilin elektrolit derişimleri 1 · 10–2 M ZnSO4 ve 1 · 10–1 M CuSO4 şeklinde değiştirilirse pil potansiyeli aşağıdakilerden hangisi gibi olur? A) 0,34 B) 0,76 7. Cd2+(suda) + 2e– → Cd˚(k) C) 0,42 E˚ = –0,40 V D) 1,13 Cu2+(suda) + 2e– → Cu˚(k) E) 1,60 E˚ = 0,34 V yarı pil potansiyelleri bilindiğine göre Cd ve Cu yarı hücrelerinden oluşan pil için aşağıdakilerinden hangisi doğrudur? A) Bakır elektrot anottur. B) Pilin potansiyeli 0,74 V’tur. C) Pil tepkimesinde Cu indirgen, Cd yükseltgen maddedir. D) Dış devrede elektron akımı Cu elektrottan Cd elektroda doğrudur. E) Pilin ∆E˚ değeri negatiftir, pil tepkimesi istemsizdir. 8.S(k) + O2(g) → SO2(g) tepkimesi için aşağıdakilerden hangisi doğrudur? A) Kükürt atomu indirgenmiştir. B) Oksijen atomu yükseltgenmiştir. C) Kükürt yükseltgendir. D) Tepkime redoks bir tepkime değildir. E) Kükürt yükseltgenmiş, oksijen indirgenmiştir. 3+ – 9. Fe2+ (suda) + I2(suda) → Fe (suda) + 2I (suda) tepkimesi için aşağıdakilerden hangisi doğrudur? A) Fe2+ iyonları elektron vermiştir, indirgendir. B) Fe2+ iyonları elektron almıştır, yükseltgendir. C) Fe2+ iyonları Fe3+ e indirgenmiştir. D) I2 atomları I– iyonuna yükseltgenmiştir. E) I2 elektron vermiştir, indirgendir. 10. Bakır(II) nitratın sulu çözeltisinin elektrolizinde elektrotlarda hangi ürünler oluşur? A) Anotta Cu, katotta O2 B) Anotta O2, katotta Cu C) Anotta O2, katotta H2 D) Anotta H2, katotta Cu E) Anotta H2, katotta O2 11. Zn, Fe, Cu ve Ag metallerinin aktifliği Ag < Cu < Fe < Zn sırasında değişmektedir. Buna göre seçeneklerde belirtilen elektrokimyasal pillerden hangisinin potansiyeli en büyüktür? A) Zn – Cu 4. ÜNİTE: Elektrokimya B) Ag – Fe C) Zn – Ag D) Cu – Fe E) Ag – Cu 241 12. Aşağıdaki tanımlardan hangisi yanlıştır? A) İki metalin aktiflikleri arasındaki fark azaldıkça oluşturacakları pilin potansiyeli artar. B)Elektrolit içerisine daldırılan iletken çubuklara “elektrot” denir. C)Galvanik hücrelerdeki erimiş ya da çözünmüş iyonik bileşiklere “elektrolit” denir. D)Elektrik enerjisi etkisiyle bileşiklerin ayrıştırılmasına “elektroliz” denir. E) Kimyasal tepkimelerden elektrik enerjisi oluşturan araçlara “galvanik ya da voltaik pil” denir. 13. Derişik sodyum klorür çözeltisinin elektrolizi için aşağıdakilerden hangisi yanlıştır? A) Elektroliz ürünleri Cl2 ve H2’dir. NaOH yan üründür. B) Anotta Cl– yükseltgenerek Cl2 gazı oluşur. C) Katotta Na+ indirgenerek Na metali oluşur. D) Su indirgenerek H2 gazı ve OH– iyonuna dönüşür. E) Oluşan H2 ve Cl2 birbirleriyle karışırsa hızlı bir tepkimeyle HCl oluşur. 14. Endüstride bakır, elektroliz yöntemiyle saflaştırılır. Benzer bir elektroliz işlemi, 400 miliamperlik akım ve 2,0 V potansiyelle 15 saat süreyle yapılırsa katotta kaç gram bakır toplanır? (Cu : 64) A) 15,2 B) 7,16 C) 3,8 D) 1,9 E) 0,95 3+ 15.3MnO–4(suda) + 5Cr(k) + 24H+(suda) → 3Mn2+ (suda) + 5Cr (suda) + 12H2O(s) Tepkimesi için aşağıdakilerden hangisi yanlıştır? A) İleri yöndeki tepkime asidik ortamda olabilir. B) Tepkimede değişen toplam elektron sayısı 15’tir. C) Bu tepkime bir redoks tepkimesidir. D) Tepkimede Cr(k) indirgendir. E) MnO–4 iyonundaki Mn atomu beş elektron alarak Mn2+ ye indirgenmiştir. 16. Ca3(PO4)2 bileşiğinde fosforun yükseltgenme basamağı aşağıdakilerden hangisidir? A) –3 B) +1 C) +3 D) +5 E) +7 17. Cu-Ag pilinin potansiyeli 0,46 V’tur. Cu2+ + 2 e¯ → Cu˚ E˚ = 0,34 V olduğuna göre gümüşün (Ag – Ag+ ) yükseltgenme potansiyeli kaç V’tur? A) +0,80 242 B) +0,12 C) – 0,80 D) – 0,12 E) –1,20 ORTAÖĞRETİM KİMYA 11 DERS KİTABI YAKIT PİLLERİ Elektrik enerjisinden yararlanarak su, bileşenleri olan hidrojen ve oksijen gazlarına ayrıldığına göre bu gazların birleşerek suyu oluşturması olayında alınan, verilen elektronlar bir dış devreden geçirilebilirse bu tepkimeden elektrik enerjisi üretilebilmelidir. Hidrojen ya da diğer OKUMA METNİ yakıtların yakılması sonucunda ısı elde edildiğine göre bütün bu yakıtlardan ısı yerine elektrik enerjisi üretilebilmelidir. Kuramsal olarak oluşturulan bu pillere yakıt pilleri denir. Aşağıdaki şekilde de basit bir H2 – O2 yakıt pili görülmektedir. Polimer elektrolit ve KOH çözeltisi O2 Elektrik Su Isı H2 Yakıt pilinde anot ve katot olarak platin tel ya da yarı geçirgen polimer bir madde kullanılır. Çözeltinin iletkenliği KOH çözeltisiyle sağlanır. Anotta oluşan H+ iyonları çözeltideki OH– iyonları ile birleşirken katotta oksijen su ile birleşir. Anot : 2H 2 + 4OH – 4 H 2O + 4e¯ – Katot : O 2 + 2H 2O + 4e¯ 4OH Net tepkime : 2H 2 + O 2 2H 2O Bu tür yakıt pillerinin yapılabileceği 1802’den beri bilinmekte ise de ilk laboratuvar denemesi ancak 1839’da gerçekleştirilebilmiştir. Son yıllarda deniz ve uzay programlarında hava ve su kirliliği nedeniyle temiz enerji elde etme yolları aranırken yakıt pilleri konusundaki çalışmalar hızlandırılmıştır. Ancak kuramsal olarak oluşturulabileceği öngörülen yakıt pillerinin çalışabilirliğini ve üretimini sağlayacak bilgi birikimi ve teknolojik olanaklar yeterli olmadığından bu pillerin üretimi sağlanamamaktadır. Yakıt pillerinin en önemli özelliği kimyasal enerjinin büyük bir verimle doğrudan doğruya elektrik enerjisine çevrilebilmesidir. Bu nedenle yakıt pilleri konusu son yıllarda çok önem kazanmış ve H2 – O2 sistemi yanında sıvı hidrokarbonlar, metil alkol, amonyak, hidrazin gibi maddelerden yakıt pilleri yapımı çalışmaları sürdürülmektedir. Yazarlar tarafından düzenlenmiştir. 4. ÜNİTE: Elektrokimya 243 5. ÜNİTE ÇEKİRDEK KİMYASI ÜNİTE İÇERİĞİ 1.ATOM ÇEKİRDEĞİNİN YAPISI 2. YAPAY ÇEKİRDEK REAKSİYONLARI 3. AKTİFLİK, RADYOAKTİF IŞINLARIN SAYIMI VE SAĞLIĞA ETKİSİ Bu ünitede, çekirdeğin yapısı ve kararlılığı irdelenecek, devamında fisyon ve füzyon tepkimeleri incelenecek, nükleer reaktörlerin işleyişi ve nükleer enerjinin sosyal ve ekonomik yönleri sorgulanacaktır. Radyoaktiflikten kaynaklanan tehlikelerden korunmak için alınacak tedbirler ve radyoaktif izotopların kullanım alanları bu ünitede irdelenecektir. 244 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ATOM ÇEKİRDEĞİNİN YAPISI BÖLÜM İÇERİĞİ 1.Atom Çekirdeği 2.Kararlılık Kuşağı 3.Doğal Radyoaktiflik 4.Radyoaktif Bozunma Çeşitleri İnsanlık tarihinin en büyük projesinin Büyük Hadron Çarpıştırıcısı (Large Hadron Collider LHC) olduğunu ve 13,7 milyar yıl önce meydana geldiği varsayılan Büyük Patlama’dan hemen sonraki başlangıç koşullarının sır perdesinin bu proje ile aralanabileceğini duymuş ya da günlük gazetelerden okumuş olmalısınız. Bildiğiniz gibi insanoğlu asırlar boyu, maddeyi oluşturan en küçük parçacığın ne olduğunu merak etmiş ve bu sorusuna yanıt bulmaya çalışmıştır. Hâlen de maddenin bölünemeyen en küçük parçasının ne olduğuna yönelik çalışmalar devam etmektedir. Büyük Hadron Çarpıştırıcısı da bu araştırmanın bir parçasıdır. Bu bölümde atomun ve atomu oluşturdukları bilinen atom altı parçacıkların serüvenini bulacaksınız. 5. ÜNİTE: Çekirdek Kimyası 245 1. Atom Çekirdeği Bundan önceki bölümlerde “mekanik iş”, “ısı”, “entalpi”, “iç enerji”, “kinetik enerji”, “potansiyel enerji”, “Gibbs serbest enerjisi”, “enerji alış verişi”, “endotermik” ve “ekzotermik” gibi kavram ve terimleri öğrendiniz. Ayrıca kimyasal tepkimelerin enerjileri hakkında bazı bilgiler edindiniz. Örneğin, kömürün oksijenle yanması sırasında mol başına 393,5 kJ enerji açığa çıktığını biliyorsunuz. Başka kimyasal tepkimelerde de alınan ya da verilen enerjinin mol başına en çok 500 kJ kadar olduğunu anımsayınız. Bu ünitede atomların çekirdeklerinde değişiklik yapan ve büyük bir enerji değişikliğine neden olan çekirdek tepkimelerinden söz edeceğiz. Çekirdek tepkimelerinde ortaya çıkan enerji, bildiğimiz kimyasal tepkimelerde ortaya çıkan enerjiden çok daha fazladır. Bir parça bakır tel alıp bu teli küçük parçalara ayırmaya çalıştığımızı varsayalım. Küçük parçalara ayırma işlemini yeterince sürdürürsek kuramsal olarak tek bir parça elde ederiz. Bu parçaya bakır atomu denildiğini biliyorsunuz. Uzun yıllar atom, maddeyi oluşturan en küçük parçacık sanılmıştır. Zaten “atomos” sözcüğü Yunanca’da bölünemez anlamındadır. 1910’lu yıllarda atomun da bir iç yapısı olduğu, içinde çekirdek denen yoğun bir kısımla onun etrafında yörüngelerde dolanan elektronlardan ibaret olduğu anlaşılmıştır (Resim 5.1). Daha sonra dikkatler atomun çekirdeği üzerinde yoğunlaşmış ve 1930’lu yıllarda çekirdeğin içinde de nükleon (nötron, proton) denen parçacıklar olduğu sapElektron Nötron tanmıştır. Bir süre temel parçacıkların elektron, proton ve nötronÇekirdek dan ibaret olduğu sanılmış, daha sonra kütlesi, elektronun kütlesi ile protonun kütlesi arasında olan yeni parçacıklar bulunmuştur. Bunlara, kütlelerinin elektron ve proton kütleleri arasında olmasını Proton anımsatması için mezon adı verilmiştir. Mezonların elektrik yükü bakımından (+), (–) ve (0) yüklü olmak üzere üç çeşidi olduğu belirlenmiştir. Böylece keşfedilen elemanter parçacık sayısı süratle Resim 5.1: Atom ve temel parçaartmış, bugün bu tür parçacık sayısı 300 civarına ulaşmıştır. cıkları Atomların bölünmez ve yekpare olmadığı, daha temel parçacıklardan oluştuğu anlaşılınca doğal olarak bilim insanlarının aklına şu soru gelmiştir: “Acaba atom altı parçacıklar da daha temel parçacıklardan meydana gelmiş olabilir mi?” Bunu anlamanın kestirme yolu, atom altı parçacıkları çarpıştırmak ve bu çarpışmalar sonucu yeni parçacık oluşup oluşmadığını incelemektir. Atom altı parçacıkların çarpıştırılmasına ve çarpışmaların incelenmesine 1930’ların sonlarında başlanmış, 1970’lerin ortalarına kadar iki yüzün üzerinde yeni parçacığın varlığı gözlemlenmiştir. Bildiğiniz gibi iki parçacığın esnek çarpışması üçüncü bir parçacık oluşumuna yol açmaz (Şekil 5.1). Eğer nötronlar ve protonlar bölünmez taneciklerse aynı tür parçacıklar çarpışınca yeni parçacıkların oluşmaması gerekir. Çarpışma deneylerinde yeni ve farklı türler gözlemlediğine göre proton ve nötronun da kendi yapı taşları olmalıdır. Kuramsal parçacık fiziğinin atölyesi, parçacık hızlandırıcı laboŞekil 5.1:Esnek çarpışmanın ratuvarlarıdır. Parçacık hızlandırıcılarında yüklü parçacıklardan, çoğunşematik gösterimi lukla proton ve elektronlar, elektromanyetik alan içinde hızlandırılır ve yönlendirilir. Hızlandırılan parçacıklar ya sabit hedefler ile ya da birbirleri ile çarpıştırılır. Bu çarpışmalar sonucunda ortaya çıkan parçacıkların incelenmesi çeşitli dedektör sistemleri ile gerçekleştirilir. Hızlandırıcı laboratuvarları, kurulmalarının ve çalıştırılmalarının çok masraflı oluşları nedeniyle dünyada sayılı birkaç merkezde bulunmaktadır. En önemlileri CERN (Cenevre), DESY (Hamburg), Fermilab-FNAL (Chicago) ve SLAC (California) olarak sayılabilir. Yüksek enerji fizikçileri bu merkezlerde büyük gruplar hâlinde deneysel çalışmalara katılmakta, atomun sırlarını aramakta, çok önemli ve ilginç çalışmalar yapmaktadır. 246 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Kuramsal çalışmalardan ve parçacık hızlandırıcı laboratuvarlarından son 40-50 yıl içinde alınan verilerle günümüzde “Standart Model” diye adlandırdığımız bir teori geliştirilmiştir. Steven Weinberg (Stiğvın Vaynbörg) başta olmak üzere pek çok fizikçinin katkı yaptığı bu teori “Madde nelerden oluşur?” ve “Maddeyi bir arada tutan kuvvetlerin kökeni nedir?” sorularına cevap verir. 1930’lu yılların sonlarında başlayarak hızla gelişen hızlandırıcı ve dedektör teknolojileri sayesinde çok yüksek enerjili çarpışmalar gerçekleştirilmiş ve bu çarpışmaların gelişmiş dedektör sistemlerinde incelenmesi ile maddenin temeli diye bildiğimiz atom çekirdek yapısında bulunan proton ve nötronların kuark adı verilen parçacıklardan oluştuğu anlaşılmıştır. Bu arada atom çekirdeği etrafında lepton adı altında gruplanan ve en çok bilinenleri elektronlar olan parçacıkların yer aldığı saptanmıştır. Günümüzde leptonlar (elektron gibi) ve kuarklar en temel yapı olarak karşımıza çıkmaktadır. Kuark ve leptonlar üç ayrı aile içinde toplanmıştır. Ayrıca bu temel parçacıkların incelenmesi ile evrende dört temel kuvvetin varlığı anlaşılmıştır. Elektromanyetik kuvvet ve yer çekimi makro evrendeki kuvvetleri, zayıf ve güçlü nükleer kuvvetler ise mikro evrendeki kuvvetleri oluşturmaktadır. Atom altı parçacıklardan olan leptonların en çok bilinenleri elektronlardır. Elektronların başka parçacıklardan oluşmadıkları kabul edilmektedir. Leptonların spini 1/2, elektrik yükleri –1 ya da 0’dır. Yunancada lepton sözcüğü hafif parçacık anlamına gelmektedir. Şimdilik bilinen 6 tür lepton vardır. Leptonlar renk kuvvetleri ile etkileşir. Kendi antiparçacıkları antilepton olarak bilinir. Elektronun antileptonu pozitrondur. Kuark sözcüğü literatüre iki bilim insanı Gell-Mann ve George Zweig (Gel-Man, Corc Zayk) tarafından sokulmuştur. Kuark sözcüğü ilk defa Gell-Mann tarafından, İrlandalı yazar James Joyce’un (Ceyms Coys) Finnegan’ın Uyanışı [Finnegan’s Wake (Faynegans Veyk)] adlı romanından alınmıştır. Sözcüğün özel bir anlamı yoktur. Sözcük özel anlamını fizikteki bu kullanımından sonra kazanmıştır. Maddenin kütlece büyük bir yüzdesi kuarklardan oluşur. Bilim insanları, keşfettikleri kuark türlerini, yaptıkları helezonik hareketlere göre yukarı, aşağı, çekici, yabancı, tavan, taban olarak adlandırmışlardır. u up (yukarı, elektrik yükü 2/3) s strange (yabancı, elektrik yükü –1/3) d down (aşağı, elektrik yükü –1/3) t top (tavan, elektrik yükü 2/3) c charm (çekici, elektrik yükü 2/3) b bottom (taban, elektrik yükü –1/3) Listelediğimiz 6 adet kuark maddenin yapı taşları iken bunların herbirinin ikizleri sayabileceğimiz 6 adet antikuark da antimaddenin yapı taşıdır. Antikuarklar ve antimadde de bu düzeydeki çalışmalar için gerekli değildir ve konumuz dışındadır. Kuarkların, bizim için yabancı olan iki özelliğini bilmek çok önemlidir: 2 1 1. Kuarkların yükleri kesirlidir. Yukarı kuarkın (u) yükü + , aşağı kuarkın (d) yükü − ’tür. 3 3 2. Kuarkların elektriksel yükleri yanında renk yükü özellikleri de vardır. Her kuark kırmızı, yeşil ve mavi olmak üzere üç renk yükünden birini taşır. Bu renklerin bilinen renklerle hiçbir ilgisi yoktur. Bunlar sadece fizikçiler tarafından verilmiş bir addır. Kuarklarda renk yükü özelliği, elektriksel yük özelliği gibi aralarındaki çekme ve itme kuvetlerinin bir başka sebebidir. Zıt renkli kuarklar birbirini çeker. Yukarı ve aşağı kuarklar zıt renklere sahip olduklarından aralarında çok güçlü (yeğin) çekim kuvvetleri doğar. Bu kuvvetler elektriksel çekim kuvvetlerine göre çok büyük olduklarından güçlü nükleer kuvvetler adıyla anılırlar. Kuarklar arasında renk yüküne bağlı çekim kuvvetinin bizler için en tuhaf yönü, mesafe arttıkça aralarındaki çekimin artmasıdır. Bu, yay ile birbirine bağlı iki bilyenin durumuna benzer. Çekim kuvvetinin bu özelliği yüzünden kuarklar tek başına yakalanamazlar. Onları, yapısına katıldıkları bileşke parçacıkların özelliklerinden çıkarımla anlarız. Kuarklar arasındaki güçlü nükleer kuvvetler, kuarklar birbirine yaklaştıkça zayıflar. Yani kuarklar birbirine ne kadar yakınsa aralarındaki etkileşim de o kadar zayıftır. Bunun tersi olan durumda etkileşim 5. ÜNİTE: Çekirdek Kimyası 247 kuvveti de o denli artar. Aynı durum gluonlar için de söz konusudur. Bu durum günlük yaşamımızda gözlemlediğimiz kuvvetler arasındaki etkileşimin tam tersidir. Çünkü günlük yaşamımızda gözlemlediğimiz kuvvetler (yer çekimi vb.), uzaklık arttıkça azalan kuvvetlerdir. Bu yüzden kuarklar hiçbir zaman tek başlarına gözlenemezler. Renk yükleri aynı olan iki (u) kuark, birbirini iter. Buna karşılık renk yükleri farklı olduğu için (u) ve (d) kuarklar biru u birini çeker. İki adet (d) kuark, bir (u) kuark tarafından, renk u d yükleri sebebiyle güçlü nükleer kuvvetlerle çok şiddetli çekilir. Sonuçta bir nötron oluşur (Şekil 5.2). Nötron, hem elektriksel d d yük hem de renk yükü bakımından nötrdür. İki (u) kuarkın bir (d) kuark tarafından renk yükleri sebeNötron Proton Şekil 5.2:Proton ve nötronlar kuarkbiyle güçlü nükleer kuvvetlerle çok şiddetli bir şekilde çekillardan meydana gelir. mesiyle protonlar oluşur (Şekil 5.2). Protonlar hem elektriksel yük hem de renk yükünden dolayı +1 yüke sahiptir. Kuark ve leptonlarda spin, elektrik yükü en önemli özellikler arasındadır. Kuarklarla leptonların spinleri aynı olup değeri 1/2’dir. Kuarklarla leptonların ayrı ayrı kütleleri vardır ve bu kütleler birbirinden farklıdır. Ancak kuark ile antikuarkın, lepton ile antileptonun kütleleri aynıdır. Diğer yandan yukarı, aşağı, çekici, yabancı, tavan, taban kuarkların kütleleri birbirinden çok farklıdır. En hafifleri olan taban kuarkların kütleleri proton kütlesinin binde biri kadarken en ağırları olan yukarı kuarkların kütlesi proton kütlesinin 190 katı kadardır. Her kuarka karşılıklı gelen bir antikuark vardır ve her bir antikuark bir anti renk taşır. Protonlarda ve nötronlarda renkler simetrik dağılmadığı için proton ve nötronlar dipol karakterlidir. Bu dipoller arasında da çekim kuvvetleri vardır ve bu kuvvetlere zayıf nükleer kuvvetler denir. Zayıf nükleer kuvvetler, protonları ve nötronları birbirine bağlar. Kuantum renk dinamiğinde renk yükü taşıyan parçacıklar arasındaki etkileşimi gluonlar sağlar. Fotonlardan farklı olarak gluonlar da renk yükü taşır ve dolayısıyla birbirleriyle etkileşir. Gluonların birbirleriyle olan bu etkileşimi kuarkın etrafındaki alanın kuarktan uzaklaştıkça daha güçlü görünmesine neden olur. Bu da iki kuark arasındaki uzaklık arttıkça kuvvetin de artması sonucunu doğurur. Protonun var olmasının, dolayısıyla atomların ve içinde yaşadığımız evrenin bildiğimiz bu şekliyle var olmasının en temel nedenlerinden biri bu özelliktir. Kuantum renk dinamiğinin öngördüğü bir başka ilginç madde biçimi de kuark-gluon plazmasıdır. Bir protondan çok daha büyük bir hacmi kapsayan bu plazmanın içinde kuarklar ve gluonlar serbest olarak dolaşır. Büyük Patlama’dan saniyenin trilyonda biri kadar bir zaman sonra evrenin bir kuarkgluon plazması hâlinde olduğu tahmin edilmektedir. 2. Kararlılık Kuşağı Kimya derslerinde atom çekirdeklerinin son derece küçük olduğunu öğrendiniz. Atom çekirdeği çok küçük olduğundan çekirdeği oluşturan proton ve nötronlar çok sıkışık durumdadır. Protonlar aynı cins elektrik yüküyle yüklü ve aralarındaki uzaklık çok küçük olduğundan Coulomb (Kulon) Yasası’na göre birbirlerini çok büyük kuvvetlerle iterler. Ayrıca çekirdekteki proton sayısı arttıkça birbirlerine karşı uyguladıkları Coulomb itme kuvvetleri de artar. Bu durum çekirdekte kararsızlığa neden olur. Atom çekirdeğinin kararlı bir yapıya sahip olması için protonlar arası uzaklığı artıracak şekilde ve yeterli sayıda nötron, çekirdekte yer alır. Ayrıca henüz kapsamı tam bilinmeyen çekirdek kuvvetleri, Coulomb itme kuvvetlerini engeller. Atomun temel taneciklerinin bağıl kütlesini ve yüklerini incelerken atom kütlesinin, o atomun sahip olduğu proton ve nötronların kütlelerinin toplamına eşit alındığını öğrenmiştiniz. Gerçekte atomun 248 ORTAÖĞRETİM KİMYA 11 DERS KİTABI kütlesi, nükleonlarının kütlesi toplamından biraz küçüktür. İşte atom kütlesi ile nükleonların kütlesi arasındaki kütle farkı, E = m c2 bağıntısına göre bağlanma enerjisi olarak bilinir. Bağlanma enerjisi de çekirdekte nükleonları bir arada tutan enerjidir. Bu enerji, bir bakıma atom çekirdeğinin parçalanabilmesi için gereken enerji miktarıdır. Çekirdekte nükleon başına düşen bağlanma enerjisi, o çekirdeğin kararlılığının bir ölçüsüdür. Nükleon başına düşen bağlanma enerjisi ne kadar fazla ise çekirdek o kadar kararlıdır. 10 75 As 56 31 26 Fe 33 16O 15 P 90 Zr 8 39K 40 19 84 2He 19F 9 14 N 7 6 12 C 6 6 3 Li 4 3 1H 2 120 Sn 50 153 Eu 63 209Bi 83 Fizyon 238 92 U füzyon Nükleon başına bağlanma enerjisi (MeV/nükleon) Bazı elementlere ait nükleon başına bağlanma enerjileri Grafik 5.1’de verilmiştir. İnceleyiniz. 2H 1 0 Kütle numarası (A) 50 100 150 200 250 Grafik 5.1: Bazı elementlerde nükleon başına bağlanma enerjisi Grafikte en büyük bağlanma enerjisine sahip olan 56 26Fe çekirdeği en kararlıdır. Bu yüzden, 56 26Fe’den daha hafif çekirdekler birleşerek (füzyon), daha ağır çekirdekler ise bölünerek (fisyon) kararlı yapıya dönüşür. Sonuç olarak çekirdekteki proton ve nötron sayılarına, atom çekirdeğinin kararlılığının ya da kararsızlığının bir nedeni olarak bakılabilir. Atom çekirdeklerinin parçalanmaya ve nükleer bozunmaya karşı dayanıklılığı çekirdek kararlılığı olarak tanımlanır. Çekirdek kararlılığında en büyük etken, atom çekirdeklerinin bünyesinde yer alan nötron ve protonların birbirine oranıdır. Atom kütlesi küçük olan çekirdeklerin kararlı olabilmesi için nötron sayısı/proton sayısı oranının (n/p) 1 ya da 1’e yakın bir değerde olması gereklidir. Kararlı çekirdeklerde bu oran 1 dolayındadır. Bu bağlamda atom numarası 20’ye kadar olan elementlerde proton sayısının nötron sayısına oranı 1’ dir. Bu nedenle bu atomlar kararlıdır. Örneğin; 126C, 136C ve 146C izotoplarına ilişkin nötron sayılarının proton sayılarına oranı sırasıyla 1,00 , 1,16 ve 1,33’tür. Doğal karbon atomu izotoplarından 126C ve 136C kararlı, 14 6C kararsızdır. Atom kütlesi büyük olan çekirdeklerin kararlı olabilmesi için n/p oranının yaklaşık 1,5 civarında bir değerde olması gerekir. Örneğin, cıva elementi atomu ele alınırsa 200 80Hg atom çekirdeğinde 80 proton ve 120 nötron bulunduğu, n/p oranının 1,5 olduğu ve bu atom çekirdeğinin kararlı olduğu görülür. Atom çekirdeklerinin n/p oranına bağlı olarak gösterecekleri kararlılıkla ilgili bir genelleme yaparsak 40 20Ca’a kadar olan küçük kütleli atomlarda n/p oranının yaklaşık 1 olduğunu, daha büyük kütleli atomlar için bu eşitliğin bozulduğunu, dolayısıyla daha kararsız olmaya başladıklarını söyleyebiliriz. Doğal olarak atomların atom numarası arttıkça proton sayıları artmakta ve protonlar arası etkileşim de buna paralel artmaktadır. Yani çekirdeği bir arada tutan çekim kuvvetlerine kıyasla itme kuvvetleri gittikçe daha belirgin olmakta ve bir noktadan sonra ön plana geçebilmektedir. Bu durum da çekirdeklerin kararlılığının bozulmasına neden olmaktadır. Atom numarası 40 20Ca’dan büyük atom çekirdeklerinde itme kuvvetlerinin etkisini azaltmak için gittikçe artan sayıda nötrona gerek duyulur. İşte bu nedenle atom numarası yükseldikçe n/p oranı 1,5’a 5. ÜNİTE: Çekirdek Kimyası 249 doğru yükselir. Bu oran atom numarası 83 olan bizmutta 1,5 olur. Bu nedenle atom numarası 83’ten büyük elementlerde çekirdek kararsızlaşır ve bu elementlerin tüm izotopları radyoaktif özellik gösterir. Atom çekirdeklerindeki nötron sayısı ne kadar çok olursa olsun yine de kararlı bir çekirdekte bulunabilecek proton sayısı sınırlıdır. En büyük atom numarasına sahip kararlı çekirdek 209 83Bi atom çe209 kirdeğidir. 83Bi atomundan daha büyük atom numarasına sahip atom çekirdeklerinin hepsi radyoaktif özellik taşır. Radyoaktif çekirdekler kararlı bir n/p oranına ulaşıncaya kadar “radyoaktif çekirdek bozunması” olarak adlandırılan süreçle radyasyon yayarlar. Çekirdek kararlılığını etkileyen etkenlerden bir diğeri de nötron ve proton sayılarının tek ya da çift oluşudur. Tek ve çift kuralına göre nötron ya da proton sayıları çift olan atom çekirdeklerinin tek olanlara göre daha kararlı oldukları saptanmıştır. Örneğin, bilinen 264 kararlı çekirdekten 102 tanesinde nötron ya da proton sayılarının çift olduğu, 157 tanesinde hem nötron hem de proton sayılarının çift olduğu ve sadece 5 tanesinde nötron ve proton sayılarının tek olduğu anlaşılmıştır. Çekirdek kararlılığına ilişkin bir diğer ilginç durum ise sihirli sayılar olgusudur. Sihirli sayılar kuralına göre nötron ya da proton sayıları 2, 8, 20, 50, 82, 126 olan atom çekirdekleri çok kararlıdırlar. Bu nedenle söz konusu sayılara sihirli sayılar adı verilmiştir. Aynı zamanda hem proton 208 hem de nötron sayıları sihirli sayılardan birine eşit ( 42He, 168O, 40 20Ca, 82Pb gibi) atom çekirdekleri kararlı izotoplardır. Grafik 5.2’de kararlılık kuşağının dışında yer alan çekirdekler radyoaktif olup bozunmalar sonucu proton ya da nötron sayısını değiştirerek kararlılık kuşağında yer alırlar. Kararsız çekirdek yapısına sahip olan elementler, kararlı bir çekirdek yapısına ulaşmak için alfa (α), beta (β¯), pozitron (β+) bozunması ve elektron yakalanması şeklinde bozunmaya uğrayarak ışıma yapar. Kararsız atom çekirdekleri kararlı bir nötron sayısı/proton sayısı oranına ulaşana kadar bozunmaya devam eder. İlk bozunmaya uğrayan radyoaktif çekirdek ana çekirdek, ana çekirdeğin bozunmasından oluşan çekirdekler ise yavru çekirdek adıyla anılır. Bir elementin radyoaktif bozunma sonucu başka elementlere dönüşümü nükleer dönüşüm olarak adlandırılır. Nükleer dönüşüm sonucu oluşan yeni çekirdekteki nükleonlar yüksek enerjili hâldedirler. Çekirdeklerin bu şekilde yüksek enerjili olmaları ayrı bir kararsızlığa neden olur. Nötron sayısı (n) Düşey eksen nötron sayısını (n), yatay eksen atom numarasını yani proton sayısını (p) gösterecek şekilde bilinen bütün kararlı ve kararsız izotopların çekirdekleri grafik üzerinde işaretlendiğinde Grafik 5.2’deki gibi bir dağılım (kuşak) ortaya çıkar. Buna kararlılık kuşağı denir. Bu kuşağın içinde yer alan bütün çekirdekler kararlıdır. Kararlılık kuşağının çevresi kararsızlık denizi olarak adlandırılır. Kararlılık kuşağı 130 120 n = 1 olan p atomlar 110 100 90 80 70 60 50 40 30 20 10 0 I. Bölge n >1 p III. Bölge n > 1, 5 (Alfa p ışıması) (Beta ışıması) II. Bölge n > 83 n <1 p (Pozitron ışıması ya da elektron yakalaması) 10 20 30 40 50 60 70 80 90 100 Proton sayısı (p) Grafik 5.2: Nükleer kararlılığın atom ve kütle numarasına göre değişimi [Mavi noktalar kararlı, yeşil, mor ve pembe noktalar kararsız (radyoaktif) izotoplardır.] ☞ÖRNEK : 1 n/p oranına bakarak 234 90Th izotopunun kararlılığını tartışınız. Vardığınız sonucun Grafik 5.2 ile uyum gösterip göstermediğini inceleyiniz. 250 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ✍ÇÖZÜM 234 90Th n 144 = = 1, 6 ’ dır. p 90 izotopunda; = p 90 = n 144’ tür. Bu sonuç n/p kararlılık oranı olan 1 – 1,5 değerlerinden büyüktür. Dolayısıyla 234 90Th izotopu kararlılık kuşağı dışında yer alır. Grafik 5.2 incelendiğinde sonuç grafikle uyumludur. 234 90Th izotopunun kararlılık kuşağı ötesinde yer aldığı görülür. Varılan 3. Doğal Radyoaktiflik 1896 yılında Fransız bilim insanı A. H. Becquerel (A. H. Bekerel) uranyum tuzlarının özelliklerini incelerken uranyumun sürekli olarak bazı ışınlar yaydığını görmüştür. Becquerel’in bu buluşu üzerinde çalışan Marie Curie ve Pierre Curie (Meri-Pier Kuri) adlı bilginler bu olaya radyoaktivite adını vermişlerdir. Curielerin en büyük çalışması bir uranyum filizi olan pitchblend (pikbilend)den yorucu çalışmalar sonunda uranyum gibi ışınlar yayan polonyum ve radyum elementlerini elde etmiş olmalarıdır. Işın yayabilen bu gibi maddelere radyoaktif maddeler denir. Radyoaktif maddelerin yaydıkları ışınların aynı tür ışınlar olmadığı, alfa (α), beta (β), gama (γ) olmak üzere üç çeşit ışın yaydıkları anlaşılmıştır. α ışınları artı yüklü parçacıklardan, β ışınları ise eksi elektrik yüklerinden meydana gelmiştir. γ ışınları ise elektrik ve manyetik alanda sapmadıklarından belirli bir elektrik ile yüklü olmayan ışınlardır. Radyoaktif ışımaların giricilik yetenekleri ve bu ışınların oluşumu Şekil 5.3’te verilmiştir. İnceleyiniz. Kurşun blok – Manyetik alan Kâğıt Alfa ışını Tahta Beton Gama ışını Beta ışını Radyoaktif madde + Şekil 5.3: Radyoaktif ışınların manyetik alanda sapmaları ve giricilik yetenekleri Atom numarası (Z) Bir radyoaktif elementin çeşitli bileşiklerinde de aynı ışımalar gözlenir. Bu nedenle radyoaktiflik kimyasal yapıya bağlı bir özellik değildir. Dolayısıyla radyoaktif element hangi bileşiği oluşturursa oluştursun, hangi kimyasal olaya girerse girsin, ışın yayma özelliği değişmez. Ayrıca radyoaktiflik sıcaklık, basınç gibi dış etmenlere de bağlı değildir. Radyoaktiflik bir kimyasal olay değildir. Atomun çekirdeğinde olan değişmelerle ilgilidir. Radyoaktif bozunmalar sonucu oluşan yeni çekirdek, kararlı olabileceği gibi radyoaktif de olabilir. Eğer radyoaktif ise kararlı çekirdekler oluşana kadar bozunmasını sürdürür. Böylece kararlı bir çekirdek oluşması ile sonuçlanan uranyum, toryum ve aktinyum radyoaktif parçalanma serileri ortaya çıkar. Bu doğal parçalanma serilerinin hepsinde sadece α ve β ışımaları görülür. 93 92 U 91 90 89 88 87 86 85 84 83 82 81 238 α U β Pa β Th α Th α Ra α Rn α Po 234 230 Grafik 5.3: 5. ÜNİTE: Çekirdek Kimyası 226 238 92U 222 218 α Po β Bi β Pb 214 Po α β Bi β Pb α Pb Np U Pa Th Ac Ra Fr Rn At Po Bi Pb Tl 210 206 202 Kütle numarası (A) radyoaktif parçalanma serisi 251 Bu serilerden uranyum serisi, 238 92U’ den başlar ve 8α ve 6β¯ ışıması yaparak radyoaktif olmayan 206 232 82Pb izotopunda sona erer (Grafik 5.3). Toryum serisi, 90Th’den başlar ve 6α , 4β¯ ışıması yaparak 208 235 207 82Pb’de sonlanır. 92U’ten başlayan seri ve 7α ve 4β¯ ışıması yaparak 82Pb izotopuna ulaşır. 209 Atom numaraları bizmuttan ( 83Bi) büyük olan bütün elementler radyoaktif olduklarından radyoaktif parçalanma serilerinde yer alır. Bu seriler dışında kalan doğal radyoaktif elementler sonradan keşfedilmiş olup 40K, 87Rb, 123Te ve 190Pt izotopları bunlardan bazılarıdır. 4. Radyoaktif Bozunma Çeşitleri Alfa (α) bozunması: Atom numarası 83’ten büyük olan ve Grafik 5.2’de III. bölgede mor noktalarla gösterilen elementler, kararlı bir çekirdek yapısına ulaşmak üzere atom ve kütle numaralarını azaltarak n/p oranını 1’e yaklaştırmak ister. Bunun için alfa bozunmasına uğrayarak 42He çekirdeğinden 238 ibaret α tanecikleri yayınlamaları gerekir. Bu olaya alfa bozunması denir. Örnek olarak 226 88Ra ve 92U izotoplarının alfa bozunması Şekil 5.4’te verilmiştir. Bir alfa ışıması yapan elementin atom numarası iki, kütle numarası dört azalır. 226 88Ra → 222 86Rn 238 92U + 42He (α) → 234 90Th + 42He (α) Şekil 5.4: Radyum ve uranyum izotoplarında α bozunmasının modelle gösterimi Örneğin, 234 92U radyoaktif elementi bir seri radyoaktif ışıma yaparak radyoaktif olmayan Pb elementine dönüşür. 234 92U → 230 90Th + 4 2He 230 90Th → 226 88Ra + 4 2He 226 88Ra → 214 82Pb + 342He Yukarıdaki örnekte de incelediğiniz gibi tepkimeye girenlerin atom ve kütle numaralarının toplamı, ürünlerin atom ve kütle numaraları toplamına eşittir. Bu eşitlik aşağıdaki bağıntı ile gösterilebilir: A ZX → A– 4 Z–2 Y + 42He ☞ÖRNEK : 2 232 90Th izotopu 3α ışıması yaparsa oluşan elementin atom ve kütle numarası ne olur? ✍ÇÖZÜM 3a ışıması: Atom numarasını 2 · 3 = 6 , kütle numarasını 4 · 3 = 12 azaltır. 232 90Th → 220 84Po + 342He Oluşan yeni elementin atom numarası 84, kütle numarası 220’dir. Beta (β¯) bozunması: Kararlılık kuşağının üstünde sıralanan ve Grafik 5.2’de I. Bölgede yeşil noktalarla gösterilen izotopların uğradığı bozunmadır. 59 27Co izotopu radyoaktif değilken 60 27Co izotopu radyoaktiftir. İkinci izotopun radyoaktiflik özelliği göstermesinin nedeni, radyoaktif olmayan birinci izotopa göre bir fazla nötron içermesidir. İkinci izotop kararlı hâle geçebilmek, dolayısıyla n/p oranını küçültmek için nötron sayısını azaltmalı, proton sayısını artırmalıdır. Bunun için atom çekirdeğindeki bir nötron, bir proton ve bir elektrona (–10e) parçalanır (Şekil 5.5). –10e parçacıkları ışıma şeklinde çekirdekten dışarıya atılır ki bu ışımaya beta bozunması denir. 252 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 14 6C 14 7N → + 0 –1 e (β–) 3 1H → 32He + 0 –1 e (β–) Şekil 5.5: Karbon ve hidrojen izotoplarında β– bozunmasının modelle gösterimi 1 0n → 11H + 0 –1 e ( β– ışıması) Bir beta ışıması ile atom numarası bir artarken kütle numarası değişmez. Bu durum aşağıdaki bağıntı ile gösterilebilir: A ZX → A Z+1 Y + 0 –1 e (β¯) ☞ÖRNEK : 3 245 95Am izotopu art arda 4α , 2β– ışıması yaptığında oluşan elementin atom ve kütle numarası ne olur? ✍ÇÖZÜM 4α ışıması : Atom numarası 2 · 4 = 8 azalır. Kütle numarası 4 · 4 = 16 azalır. 245 95Am → 229 87Fr + 442He 2β– ışıması : Atom numarasını 1 · 2 = 2 artırırken kütle numarasını değiştirmez. 229 87Fr 0 → 229 89Ac + 2 –1 e oluşan element 229 89Ac’dir. Pozitron (β+) bozunması: Kararlılık kuşağının altında yer alan ve Grafik 5.2’de II. Bölgede pembe noktalarla gösterilen izotopların uğradığı bozunmadır. 59 27Co izotopu radyoaktif değilken 58 27Co izotopunun radyoaktiflik göstermesinin nedeni, ikinci izotopta nötron sayısının az oluşudur. Bu izotopun kararlı hâle geçmesi, dolayısıyla n/p oranının 1’e yaklaşması için proton sayısı azalmalı, nötron sayısı artmalıdır. Atom çekirdeğindeki 1 proton, 1 nötron ile + yüklü 1 elektrona ( +10e, pozitrona) dönüşür. Pozitronlar ışıma şeklinde çekirdekten dışarıya atılır. Bu ışımaya pozitron bozunması denir. 1 1H → 10n + 58 27Co 0 +1 e → 58 26Fe + 0 +1 e Pozitron bozunmasında atom numarası bir azalırken kütle numarası değişmez. Bu durum aşağıdaki bağıntı ile gösterilebilir: A ZX → A Z–1 Y + 0 +1 e (β + ) Elektron yakalaması: Pozitron bozunması ile aynı sonucu doğuran bir bozunma şekli de elektron yakalaması olayıdır. 1938 yılında A. Alverez (A. Alverez) tarafından deneysel olarak ispatlanan bu olayda çekirdeğe en yakın orbitaldeki elektron, çekirdek tarafından yakalanarak bir proton ile birleşir ve bir nötrona dönüşür. Bu olaya elektron yakalaması denir. 1 1H + 0 –1 e → 01n 58 27Co + 0 –1 e → 58 26Fe Elektron yakalaması olayında atom numarası bir azalırken atom kütle numarası değişmez. ☞ÖRNEK : 4 237 93Np radyoaktif elementi 3α, 2β–, 1β+ bozunmasına uğrarsa oluşan yeni elementin atom ve kütle numarası ne olur? 5. ÜNİTE: Çekirdek Kimyası 253 ✍ÇÖZÜM 225 4 3α ışıması : 237 93Np → 87Fr + 3 2He , 225 1β+ışıması : 225 89Ac → 88Ra + 225 0 2β¯ ışıması: 225 87Fr → 89Ac + 2 –1e 0 +1e Oluşan yeni elementin atom numarası 88, kütle numarası 225’tir. Gama (γ) Işıması Radyoaktif bozunma sonucu oluşan yeni element, temel duruma göre daha enerjilidir. Kararlı hâle gelebilmek için fazla enerjiyi gama ışınları şeklinde dışarı verir. Gama ışınları yüksek enerjili, kısa dalga boylu, elektromanyetik ışınlardır. Elektriksel ve manyetik alanda sapmazlar. α , β– ve β+ ışınları ise manyetik alanda saparlar. Gama ışınları yayan çekirdeğin atom ve kütle numarası değişmez. [125 52Te]* → 125 52Te + γ Elektronların enerjileri arttıkça daha üst enerji katmanlarındaki orbitallere çıktığını, enerji kaybettikçe de daha alt enerji katmanlarındaki orbitallere düştüğünü, bu arada iki enerji katmanı arasındaki fark kadar enerjiyi fotonlar şeklinde dışarıya yaydığını 10. sınıf kimya derslerinizden biliyorsunuz. Gama ışınlarının yüksek enerjili ışınlar oldukları dikkate alındığında bu ışımaların, elektronların katman değiştirmesinden kaynaklanmış olacağı şeklinde bir yanılgıya düşmek olasıdır. Oysa gama ışınları, radyoaktif çekirdeklerin yüksek enerjiye sahip olmasından, diğer bir ifadeyle çekirdeğin kararsızlığından kaynaklanır ve çekirdeğin temel durumuna göre sahip olduğu fazla enerjinin çekirdekten atılmasından ibarettir. Atom çekirdeğinin radyoaktif bozulmalar sonucu daha yüksek enerjili hâl alabilmesi, fazla enerjinin gama ışıması ile dışarı atılması, çekirdekteki nükleonların da elektronlar gibi belirli enerji katmanlarına dağılmış olabileceklerini düşündürür. Bu durumda çekirdeklerin temel ve uyarılmış enerji düzeylerinden söz etmek mümkündür. Ancak çekirdekteki katmanlı enerji düzeylerinin ayrıntıları henüz bilinmemektedir. ☞ÖRNEK : 5 Radyoaktif bir VIIA grubu elementi 1α , 3β– ışıması yaparsa oluşan element periyodik cetvelin hangi grubunda bulunur? ✍ÇÖZÜM 1α ışıması sonucu oluşan yeni elementin atom numarası, ana elementinkinden iki küçüktür. Bu nedenle periyodik cetveldeki yeri de ana elementin grup numarasından iki küçüktür ve VA grubudur. Yeni oluşan element 3β¯ ışıması yaptığında ise atom numarası dolayısıyla grup numarası üç artar. Periyodik cetveldeki yeri VIIIA grubu olur. Radyoaktif ışımalarla atom ve kütle numaraları arasındaki ilişkiler örnekleriyle Tablo 5.1’de verilmiştir. İnceleyiniz. Tablo 5.1: Radyoaktif ışımalar ve bu ışımaların atom ve kütle numaralarının değişimine etkileri Işıma Kütle numarasındaki değişme Atom numarasındaki değişme Alfa ışıması (α) 4 azalır. 2 azalır. 238 92U Beta ışıması (β– ) Değişmez. 1 artar. 14 6C Pozitron ışıması (β+) Değişmez. 1 azalır. 64 29Cu Elektron yakalama Değişmez. 1 azalır. 195 79Au + –10e → 195 78Pt Gama ışıması (γ) Değişmez. Değişmez. 87 38Sr* Örnek 4 → 234 90Th + 2He → 147N + 0 –1 e 0 → 64 28Ni + +1e → 87 38Sr + γ –––––––––––––––– * uyarılmış durum 254 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1919 yılında Ernest Rutherford (Örns Radırford) ilk kez çekirdek tepkimesi dönüşümünü gerçekleştirmiştir. Bu amaçla radyumdan elde ettiği alfa parçacığı ile azot-14 izotopunu bombardıman etmiş ve bu izotopu oksijen-17 izotopuna dönüştürmeyi başarmıştır. Bu arada +1 yüklü hidrojen çekirdeklerinin meydana geldiğini görmüştür. Bu hidrojen çekirdekleri protondan ibarettir. 4 2He + 147N → 178O + 11H Bu da kimyacıların yapmak istedikleri, bir elementten başka bir elementi elde etme işlemidir. Benzer şekilde alüminyum-27 izotopu nötronla bombardıman edilmiş ve sodyum-24 izotopu elde edilebilmiştir. 27 13Al 4 + 10n → 24 11Na + 2He 1932 yılında James Chadwick (Ceyms Kadvik), berilyum elementini α parçacıkları ile bombardıman ederek karbon atomu ve nötron elde etmiştir. Bu sonuç Chadwick’in nötronları keşfetmesine yol açmıştır. 4 2He + 94Be → 126C + 01n Nötronun keşfinden önce de çekirdek ve atomun yapısı hakkında çeşitli fikirler ortaya atılmış fakat hiçbiri çekirdek ve atomun bütün özelliklerini açıklayamamıştır. Nötronun keşfi bu konuda çok önemli bir adım olmuş ve çekirdeğin nötron ve protondan meydana geldiği, çekirdek etrafında ise proton sayısına eşit sayıda elektron bulunduğu anlaşılmıştır. CNO (KARBON - AZOT - OKSİJEN) DÖNGÜSÜ Yıldızlar enerjilerini nükleer tepkimelerden alır. Güneş gibi yıldızlar enerjilerinin çoğunu iki hidrojen atomu çekirdeğini kaynaştırarak elde eder. Daha büyük kütleli yıldızlarsa enerjilerinin çoğunu CNO (Karbon-Azot-Oksijen) döngüsüyle elde eder. CNO döngüsü özellikle azotun üretiminde önemli role sahiptir. OKUMA METNİ Karbon-Azot-Oksijen ya da CNO döngüsünde, hidrojeni helyuma dönüştüren tepkime dizileri şöyledir: 3 Karbon-12 izotopu 1 proton yakalar ve gama ışıması yapar. 12 6C + 11H → 137N + 00γ 3 Azot-13 izotopu kararsız olup 1 pozitron bozunması geçirerek pozitron ışıması yapar. Bu bozunma sırasında ortama nötrino ( 00υ) saçılır. 10 dakikalık yarılanma ömrü sonunda karbon-13 izotopuna dönüşür. 13 7N → 136C + +10e + 00υ 3 Karbon-13 izotopu 1 proton yakalayarak gama ışıması yapar ve azot-14 izotopuna dönüşür. 13 6C + 11H → 147N + 00γ 3 Azot-14 izotopu 1 proton yakalayarak gama ışıması yapar ve oksijen-15 izotopuna dönüşür. 14 7N + 11H → 158O + 00γ 3 Oksijen-15 izotopu 1 pozitron bozunması geçirerek pozitron ışıması yapar ve azot-15 izotopuna dönüşür. Bu bozunma sırasında ortama nötrino saçılır. 15 8O → 157N + +10e + 00υ 3 Azot-15 izotopu da 1 proton yakalayarak alfa ışıması yapar ve karbon-12 izotopuna dönüşür, döngü yeniden başlar. 15 7N + 11H → 126C + 42He Yazarlar tarafından düzenlenmiştir. 5. ÜNİTE: Çekirdek Kimyası 255 1. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Standart modele göre atom altı parçacıklar arasındaki çekme/itme kuvvetleri çok küçük parçacıkların alış verişi ile mümkündür. Etkileşen iki kuarkı bir arada tutan etkileşimin ne olduğunu açıklayınız. 2. Proton ve nötronların yapısını oluşturan kuarkların tip ve yüklerini şekille gösteriniz. 3. n/p oranı 1 – 1,5’a kadar olan atom çekirdekleri kararlıdır. Kararlılık kuşağının altında, üstünde ve ötesinde yer alan çekirdeklerin hangi ışımalar yoluyla kararlı hâle geçebileceklerini örneklerle açıklayınız. 4. Aşağıda verilen nükleer tepkime denklemlerini tamamlayınız. 1 4 a. 32 b. 74Be + –10e → X 16S + 0n → 2He + X 2 1 0 c. X → 187 ç. 98 76Os + –1 e 42Mo + 1H → X + 0n B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Yüklü tanecikler hızlandırıcıda manyetik alan etkisiyle dairesel yörüngede hareket eder. ( ... ) 2. Elektronun antileptonu pozitrondur. ( ... ) 3. Leptonlar atom çekirdeğindeki proton ve nötronları oluşturan gruplardır. ( ... ) 4. Kuarklar birbirine yaklaştıkça aralarındaki çekim kuvveti zayıflar, uzaklaştıkça artar. ( ... ) 5. Kuarklar renk yükü taşır. ( ... ) 6. İstemli olarak ışın yayan maddelere “radyoaktif maddeler” denir. ( ... ) 7. Nükleon başına düşen bağlanma enerjisi, çekirdeğin kararlılığının bir ölçüsüdür. ( ... ) 8. Nötron sayısı / protonsayısı oranı 2’ye yakın olan çekirdekler kararlıdır. ( ... ) 9. Bütün radyoaktif bozunmalar bir elementin başka bir elemente dönüşmesine neden olur. ( ... ) 10. Atom numarası 83’ten büyük olan bütün elementler radyoaktiftir. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. Co, I ve O atomları , CoI2 , CoO ve I2O5 bileşiklerini oluşturuyor. Bunlardan sadece CoO radyoaktif değildir. Co, I, O elementlerinin radyoaktiflik özelliklerine ilişkin hangi seçenek doğrudur? A) Co ile I radyoaktif elementlerdir. B) I ile O radyoaktif elementlerdir. C) Yalnız Co radyoaktif elementtir. D) Yalnız I radyoaktif elementtir. E) Co, I , O radyoaktiftir. 2. Radyoaktif bir çekirdeğin nötronlarından biri protona dönüşürse hangi tür ışıma yapmış olur? A) Beta B) Pozitron C) Gama D) Alfa E) Nötron 3. CoBr2 bileşiği radyoaktif özellik gösterir. Bu bileşiğe; I. Basınç uygulamak, II. Suda çözmek, III. Sudaki çözeltisini elektroliz etmek işlemlerinden hangisinin ya da hangilerinin uygulanması bu bileşiğin radyoaktif özelliğinin değişmesine neden olmaz? A) I ve II B) I ve III C) I , II ve III D) Yalnız I E) Yalnız III – + 4. 223 87Fr izotopu ; 3α, 2β , 1β bozunmasına uğradığında oluşan izotop aşağıdakilerden hangisidir? A) 211 B) 211 C) 211 D) 211 E) 211 81Tl 82Pb 83Bi 84Po 85At 256 ORTAÖĞRETİM KİMYA 11 DERS KİTABI YAPAY ÇEKİRDEK REAKSİYONLARI BÖLÜM İÇERİĞİ 1.Çekirdek Dönüşümü 2.Çekirdek Reaksiyonları 3.Nükleer Enerji Santralleri II. Dünya Savaşı sırasında “Manhattan (Manhattın) Projesi” adı altında ilk atom bombası çalışmalarının başlatıldığını, 3 yıl süren yoğun çalışmalardan sonra ilk atom bombasının yapımının başarıldığını “06.08.1945” sabahı bu bombanın Hiroşima üzerinde patlatıldığını duymuş olmalısınız. II. Dünya Savaşı’nın bitmesini sağlayan ancak binlerce insanın ölümüne yol açan bu olayın nasıl bir enerjiden kaynaklandığını biliyor musunuz? Bu bölümde yukarıda sözü edilen enerjiye kaynaklık eden çekirdek tepkimelerinden söz edilecektir. Ayrıca bu bölümde nükleer enerji santralleri irdelenecektir. 5. ÜNİTE: Çekirdek Kimyası 257 1. Çekirdek Dönüşümü 9. Sınıf kimya derslerinizde, insanlık tarihi boyunca simyacıların bütün maddeleri altına dönüştürebileceğine inandıkları “filozof taşı” adı verilen bir taşı bul4 17 + 147N → + 11H 2He 8O maya çalıştıklarını ve pek çok bilim insanının başkaca Şekil 5.6:Azot elementinin yapay çekirdek elementlerden altın elementini elde etmeye çalıştığını tepkimesiyle oksijen elementine öğrenmiştiniz. İnsanlık tarihinde diğer maddeleri altına dönüşmesinin modelle gösterimi dönüştüren filozof taşının bulunduğuna ait bir kayıt bulunmamaktadır. Ancak bir elementin insan elinde başka bir elemente dönüştürülmesi büyük bir düşün gerçekleşmesidir. İşte bu düşü ilk kez gerçekleştiren bilim insanı, bu ünitenin 1. bölümünde öğrendiğiniz gibi Ernest Rutherford’tur. E. Rutherford, 1915’te ilk çekirdek dönüşmesini gerçekleştirmiş, bunun için 214 84Po izotopunun bozunması sonucu oluşan α parçacıklarını azot içinden geçirerek 4 30 + 27 + 10n 2He 13Al → 15P oksijenin bir izotopunu elde etmiştir (Şekil 5.6). Şekil 5.7:Alüminyum elementinin yapay 1933’te I. Curie (I. Küri) ve F. Joliot (F. Jilyot), yine α çekirdek tepkimesiyle fosfor eleparçacıklarıyla alüminyumu fosforun bir izotopuna dönüşmentine dönüşmesinin modelle türdüler (Şekil 5.7). Bu izotop 31 15P olup yapay olarak elde gösterimi edilen ilk radyoaktif çekirdektir ve pozitron ışıması yapar. Bu önemli buluş, başka yapay radyoaktif elementlerin sentezine yol açtı. Günümüzde hemen hemen her elementin radyoaktif bir izotopu sentezlendi. Örneğin, 1967 yılında Sovyet bilim insanları neon ve amerikyum atom çekirdeklerini kaynaştırarak dubniyum elementini yapay olarak sentezlediler. 1970 yılında Kaliforniya Devlet Üniversitesinden bir grup bilim insanı ise dubniyumu, kaliforniyum ve azot atom çekirdeklerini kaynaştırarak elde ettiler. 243 1 249 15 1 22 260 260 95Am + 10 Ne → 1 0 5 Db + 5 0n , 98Cf + 7N → 1 0 5 Db + 4 0n Radyoaktif olmayan (kararlı) çekirdekler, proton, nötron ve alfa tanecikleriyle bombardıman edildiğinde yeni izotoplara ya da yeni elementlere dönüşürler ki bu tür tepkimelere yapay çekirdek reaksiyonları (tepkimeleri) denir. Tarihsel süreç içinde Rutherford’tan başlayarak California Devlet Üniversitesinden bir grup bilim insanına kadar uzanan çekirdek dönüşüm çalışmalarını gördünüz. Bu bilim insanlarının çekirdek dönüşümü yoluyla doğada bulunmayan bazı izotopları elde edebildiklerine tanık oldunuz. Günümüzde pek çok izotop değişik amaçlar için çekirdek dönüşümü yoluyla elde edilebilmektedir. Örneğin, tıp alanında radyasyon uygulamalarında (görüntü elde etme, hücre veya tümörleri yok etme) kullanılan Tc-99, Tl-201, I-131, Co-60 gibi radyoaktif izotoplar çekirdek dönüşüm yoluyla elde edilirler. Bunlardan Co-60 izotopu radyoaktif olmayan Co-59 izotopunun nötronlarla bombardımanından, 59 1 60 27Co + 0n → 27Co Tc-99 radyoaktif izotopu da Mo-97 izotopunun döteryumla bombardımanından elde edilir. 97 2 99 42Mo + 1H → 43Tc I-131 radyoaktif izotopu ise Xe-131 izotopunun elektron yakalama tepkimesinden elde edilir. 131 131 0 54X + –1 e → 53I 2. Çekirdek Reaksiyonları Bir önceki başlık altında, doğal radyoaktivite ile elementlerin kararsız izotoplarının radyoaktif ışıma sonucu genellikle farklı elementlerin kararlı izotoplarına, bazen de kendi kararlı izotoplarına dönüştüklerini öğrendiniz. Bu arada yapay çekirdek tepkimeleriyle elementlerin başka elementlere dönüştürülebildiklerini gördünüz. Yapay çekirdek tepkimeleri ya bölünme (fisyon) ya da kaynaşma (füzyon) şeklinde gerçekleşir. Çekirdek tepkimesi ister kaynaşma isterse bölünme şeklinde gerçekleşsin, bu 258 ORTAÖĞRETİM KİMYA 11 DERS KİTABI tepkimeler sonucu bir yandan yeni çekirdekler oluşurken bir yandan da büyük miktarlarda enerji açığa çıkar. Bu enerjinin kaynağı E = mc2 bağıntısına göre enerjiye dönüşen çekirdek partikülleridir. Bölünme (Fisyon) Tepkimeleri 1930’ların sonuna doğru O. Hann (O. Han), F. Strassmann (F. Sitresmen) ve L. Meitner (L. Meytnır) izotopunun nötronlarla bombardımanında 139Ba ve 94Kr izotopları yanı sıra üç nötronun da oluştuğunu gözlediler. 235 92U 1 0n 139 + 235 92U → 56Ba + 94 36Kr + 310 n + Enerji Daha sonra L. Meitner ve O. Frisch (O. Firiş), bu tepkimeyi 235 92U izotopunun parçalanması ile açıkladılar ve tepkime sırasında çok miktarda enerji açığa çıktığını belirttiler. Ağır bir çekirdeğin, hafif çekirdeklere (genellikle eşit miktarda iki hafif çekirdeğe) ve nötronlara bölünmesi olayına nükleer fisyon denir. 235 U 92 142 Ba 56 235 U 92 235 U 92 142 Ba 56 91 36 Kr 142 Ba 56 142 Ba 56 235 U 92 91 Enerji 36 Kr 142 Ba 56 Nötron 91 36 Kr 91 Her 235 142 Ba 36 Kr 92U izotopunun nükleer fisyo56 235 nunda ortama verilen üç nötron, diğer uranU 235 U 92 92 yum çekirdeklerini etkiler ve hızı gittikçe 91 36 Kr artan bir tepkime oluşur. Böyle tepkimelere 91 zincir tepkimesi denir (Şekil 5.8). Çok kısa 36 Kr sürede büyük hızlara ulaşan zincir tepkime- Şekil 5.8: 235 U izotopunun zincirleme nükleer fisyon tep92 si sonunda açığa çıkan enerjinin yıkma etkikimelerinin modelle gösterimi si çok büyüktür. –8 235 Bir tek 235 92U çekirdeğinin nükleer fisyonundan yaklaşık 3,2· 10 kJ, 235 g 92U izotopunun fisyo16 nundan yaklaşık 1,93·10 kJ enerji açığa çıkar. Bu miktar enerji yaklaşık 4,9 · 108 ton saf karbonun CO2 oluşturmak üzere oksijen gazı içinde yanmasından açığa çıkan enerji miktarına eşittir. 235 92U izotopunun nötronla bombardımanında farklı nükleer fisyon tepkimeleri de oluşabilmektedir. Bu tepkimelerin olası tepkime denklemleri şöyledir: 235 92U 144 1 + 10n → 90 38Sr + 54Xe + 2 0n + Enerji , 235 92U 135 1 + 10n → 100 40Zr + 52Te + 0n + Enerji Çekirdek tepkime denklemlerinde, tepkimeye girenler ile oluşan ürünlerin nükleonlarının toplam sayısı değişmez. Yani çekirdek tepkime denklemlerinde denklik işaretinin (okun) her iki yanındaki taneciklerin kütle numaralarının toplamı ile atom numaralarının toplamı birbirine eşittir. Nükleonların korunması çekirdek tepkimelerinde kütlenin korunduğu anlamına gelmez. Çünkü, çekirdek tepkimelerinde tartılabilen miktarlarda kütle, enerjiye dönüşür. Kaynaşma (Füzyon) Tepkimeleri Hızlandırılmış proton, nötron gibi parçacıklar küçük ve kararlılığı az olan çekirdekler tarafından yakalanırsa bu çekirdekler birleşerek yeni çekirdekler oluşturur (Şekil 5.9). Bu şekilde gerçekleşen çekirdek tepkimelerine kaynaşma tepkimeleri denir. Kaynaşma tepkimelerinde büyük bir enerji açığa çıkar. Açığa çıkan enerji, bölünme tepkimelerine göre çok daha büyüktür. 211 H + 210 n → 42He + Enerji 5. ÜNİTE: Çekirdek Kimyası 2 1H döteryum 3 1H tirityum 1n 0 4 2He helyum proton nötron Şekil 5.9: Bir kaynaşma tepkimesi örneğinin modelle gösterilmesi 259 Kaynaşma (füzyon) tepkimesi denilen bu olayla oluşan yeni çekirdekler bölünme eğilimindedir. Hidrojen bombasının, Güneş’te gelişen olayların ve güneş enerjisinin temeli füzyondur. Güneş’te gerçekleştiği varsayılan füzyon tepkimelerinin denklemleri şöyledir: 1 1H + 21H → 32He 3 2He + 32He → 42He + 211H 1 1H + 11H → 21H + +10b Kaynaşma tepkimeleri çok yüksek sıcaklıklarda (1.106 ˚C’un üstünde) gerçekleşir. Bu yüzden geleceğin enerji kaynağı olarak füzyon oldukça önemlidir. Diğer yandan çekirdekler pozitif elektrik yükü taşıdığından çekirdekler birbirlerine yaklaştırıldığında çok şiddetli bir şekilde birbirini iter. Bunların kaynaşmasını sağlamak için aralarındaki itme kuvvetini yenebilecek büyüklükte bir kuvvetin kullanılması gerekir. Bu kuvveti doğurabilecek enerji 20-30 · 106 ˚C’luk bir sıcaklığa eş değerdir. Bu olağanüstü bir sıcaklıktır ve kaynaşma tepkimesine girecek maddeyi taşıyacak hiçbir katı malzeme bu sıcaklığa dayanamaz. Bu nedenle Güneş’te süregiden bu olaylar yeryüzünde kolaylıkla gerçekleştirilemez. Bununla beraber Amerikalı kimyacı Stanley Pons (Stenli Pons) ve İngiliz kimyacı Martin Fleischmann (Martin Fleşmen) tarafından döteryum izotoplarının oda koşullarında kaynaştırılmasıyla (soğuk füzyon) helyum atomuna dönüştürülmesi olayı, bilim insanlarınca hâlen tartışılan bir konudur. ☞ÖRNEK : 6 150 62Sm + 11H → 147 61Pm +X Yukarıdaki çekirdek tepkimesinde X ile simgelenen tanecik nedir? ✍ÇÖZÜM X taneciğinin kütle numarası; 150 + 1 = 147 + X ⇒ 151 = 147 + X ⇒ 151 – 147 = X ⇒ X = 4 ’tür. X taneciğinin atom numarası; 62 + 1 = 61 + X ⇒ 63 = 61 + X ⇒ 63 – 61 = X ⇒ X = 2 ’dir. Buna göre X’in atom numarası iki, kütle numarası dörttür. Bu tanecik, 42He çekirdeğinden ibaret α taneciğidir. 3. Nükleer Enerji Santralleri Kaynaşma ya da bölünme tepkimeleri sonucunda çok miktarda enerjinin açığa çıktığını öğrendiniz. Kontrolsüz açığa çıkan enerjinin büyük bir yıkıma ve korkunç bir patlamaya neden olduğunu biliyorsunuz. Eğer nükleer enerji kontrollü bir şekilde elde edilip kullanılabilirse büyük bir enerji kaynağı olabileceğini anlamışsınızdır. İşte nükleer enerji santralleri, uranyum-235 ve plütonyum-239 gibi radyoaktif izotopları yakıt olarak kullanan, nükleer tepkimelerin kontrollü bir şekilde yürütülmesiyle elde edilen nükleer enerjiden elektrik enerjisi üreten tesislerdir. Nükleer ve termik enerji santralleri birbirine benzer özelliktedir. Her iki santral tipinde de elde edilen su buharının ısı enerjisi de jeneratörlerde elektrik enerjisine dönüştürülür. Dolayısıyla bu santraller arasındaki temel fark, su buharının elde ediliş yöntemidir. Nükleer enerji santrallerinde enerji, termik santrallerdeki gibi fosil yakıtlardan değil, çekirdek tepkimelerinden sağlanır. Bir nükleer enerji santralinin ısı kaynağı, parçalanmadan veya parçalanabilir maddelerin çekirdeklerinin (temelde uranyum-235) yarılmasından açığa çıkan enerjidir. Uranyum-235 çekirdeği ile çarpışan bir nötron uranyum-235 çekirdeğini ikiye yarar. Çekirdeği bütün hâlinde tutan enerjinin bir kısmı ısı hâlinde açığa çıkar ve çekirdekten başka nötronlar fırlatır. Diğer uranyum-235 çekirdekleri bu fırlayan nötronlar tarafından parçalanarak zincirleme bir tepkime oluşur. Reaktör göbeğindeki uranyumun parçalanması ile oluşan zincir tepkime enerjisi, buhar jenaratörünün tüplerine basınç altında pompalanan suyu ısıtır. Bu su ise elektrik üreten jeneratörde bulunan suyu buhara dönüştürerek yük260 ORTAÖĞRETİM KİMYA 11 DERS KİTABI sek basınçlı türbin rotorlarının dönmesini sağlar. Bu türbinlerden çıkan düşük enerjili buhar, düşük basınçlı diğer bir türbin Koruyucu zırh (Beton) Jeneratör Kontrol çubukları Su buharı dizisine gider. Bir elektrik jeneratörü de dönen türbin rotorundan aktarılan mekanik enerjiyi elektrik enerjisine çevirir (Şekil 5.10). Türbinlerden çıkan ve enerjiden yoksun olan buhar, bir soğutucunun bo- geri gönderilir. Buhar türbini Reaktör Kondansatör Yakıt çubukları Pompa Buhar jeneratörü rularından geçerek suya dönüşür ve yeniden ısınmak üzere buhar jeneratörüne Basınç kabı Su ya da sıvı sodyum Uranyum, radyoaktif özelliği düşük Pompa 27 ˚C Pompa 38 ˚C Su kaynağı Şekil 5.10: Bir nükleer santralin şematik yapısı olan bir elementtir. Reaktörde tepkimeye girmeden önce lastik bir eldivenle bile tutulabilir. Ancak fisyon tepkimesi sonucunda oluşan ürünlerin çoğu oldukça radyoaktiftir. Bu nedenle nükleer reaktör çalışmaya başladıktan sonra içine girilemez, reaktörden çıkan yakıt atıklarına yaklaşılamaz. Günümüzde nükleer enerji santrallerinde yakıt olarak UO2 tercih edilmektedir. Bu amaçla uranyum(IV) oksit, önce toz hâline getirilir, sonra 1 cm çap ve yüksekliğinde küçük silindirler şeklinde sıkıştırılır. Daha sonra fırında pişirilerek seramik yakıt hâline getirilen bu silindirler 4 cm uzunluğunda ince bir metal zarf içine yerleştirilerek yakıt çubukları elde edilir. Herhangi bir reaktörde bu yakıt çubuklarından yaklaşık 50 000 tane kullanılır. Nükleer reaktörlerin en önemli elemanlarından bir diğeri ise kontrol çubuklarıdır. Reaktörün kontrolü, ortamdaki nötron sayısının kontrolü ile olanaklıdır. Eğer fisyon tepkimesinden oluşan nötronların oluşma hızı uranyum yakıt tarafından yakalanma hızına eşit ise reaktör aynı güçte çalışmaya devam eder. Ortamdaki nötron sayısı arttıkça güç artar, azaldıkça güç düşer. Ortamda nötron yoksa tepkime durur. Reaktöre kadmiyum ya da bor elementinden yapılan ve nötronları soğuran kontrol çubukları yerleştirilir. Bu çubuklar reaktörde istenen derinliğe indirilerek tepkime kontrol altında tutulur. Uranyum elementi doğada uranyum-235 ve 238 olmak üzere temelde iki izotopun karışımından oluşur ve karışımın yaklaşık %0,7’si uranyum-235’ten ibarettir. Dolayısıyla uranyum-235 izotopu reaktörde bölünmeye uğradıktan sonra geride çok miktarda uranyum-238 izotopu kalır. Eğer tepkime “hızlı reaktör” olarak adlandırılan reaktörlerde gerçekleştirilirse ortamdaki uranyum-238 izotoplarının yeniden değerlendirilmesi söz konusu olur. Hızlı reaktörlerde uranyum-238 izotopu hızlı nötronlarla dövülerek aşağıdaki çekirdek tepkimesi denklemlerinde gösterildiği gibi plütonyum-239 izotopuna dönüştürülür. Plütonyum-239 izotopu kolaylıkla bölündüğünden yeniden yakıt olarak kullanılır. Dolayısıyla hızlı reaktörlerde normal reaktörlere göre 60 kat daha fazla enerji elde edilir. Hızlı reaktörlerin bu avantajı yanında diğer önemli avantajı, nükleer silah endüstrisinin temel maddesi olan plütonyum-239 izotopunu üretiyor olmasıdır. 238 92U 239 94Pu + 10n → 239 92U + 210n → → 241 95Am 239 93Np + –10e , + –10e , 239 93Np 239 94Pu → 239 94Pu + 42He → + –10e 242 96Cm + 01n Günümüzde, elektrik üretimi için kullanılan santrallerin büyük bir bölümünde Basınçlı Su Reaktörü (PWR), Kaynar Su Reaktörü (BWR) ve Basınçlı Ağır Su Reaktörü (PHWR) yer alır. Hemen hemen bütün santrallerde reaktör, basınç kabı ve soğutucu sistemi “koruma kabı” adı verilen çelik bir kabuğun içindedir. Bu çelik kabuk, betondan yapılmış ikinci bir koruyucu yapının içerisinde yer alır. Bu sistem, dış etkilerden reaktör sistemini korumak ya da kaza sonucu açığa çıkabilecek radyasyonun çevreye sızmasını önlemek için tasarlanmıştır. 5. ÜNİTE: Çekirdek Kimyası 261 Nükleer enerji santralleri çok az radyoaktif madde tüketerek çok miktarda elektrik enerjisi üreten tesislerdir. Nükleer enerji santrallerinin genel olarak ilk yatırım maliyetleri yüksek fakat yakıt ve işletme giderleri düşüktür. Yatırım maliyetleri elektrik üretim maliyetinin yarıdan fazlasına denk gelir. Nükleer enerji santralleri diğer enerji santrallerine oranla daha tehlikesiz, daha yararlı ve daha çevrecidir. Her enerji üretim tesisi gibi nükleer enerji tesisleri de çevre için bir risk taşır. Önemli olan enerji üretiminde riski en alt düzeye indirebilmek ve kontrol altında tutabilmektir. Nükleer enerji petrol, doğal gaz ve kömür gibi yenilenemeyen enerji kaynaklarının yerini alabilecek iyi bir enerji kaynağıdır. Nükleer enerji santralleri normal çalışma koşullarında çevreye az miktarda radyoaktivite yayarlar. Bu miktarlar çevre ve insan sağlığına zarar vermez. Kaldı ki bazı termik santraller çevreye nükleer santrallerden daha fazla radyasyon yayabilmektedir. Bunun çarpıcı örneği Yatağan Termik Santralidir. Ayrıca ülkemiz gibi gelişmekte olan ülkeler açısından nükleer enerji teknolojisinin kazanılmasının yanı sıra enerjide dışa bağımlılıktan kurtulmak açısından nükleer santraller büyük önem taşır. Nükleer santrallerin yukarıda sayılan avantajları yanında üzerinde durulması gereken sorun, oluşmaları hiçbir zaman sıfırlanamayan atıklardır. En önemli atık, yakıt çubuklarının harcanmasında ortaya çıkar. Uranyum-235 izotopunun reaktörün çekirdeğinde yarılması sonucu sezyum-137 ve stronsiyum-90 izotopu gibi radyoaktif ara ürünler oluşur. Sezyum-137’nin yarı ömrü 30 yıl, stronsiyum-90’ın ise 28 yıldır. Yarı ömürlerden de anlaşılacağı gibi bu radyoaktif ürünler yaklaşık 30 yıl süresince ışın yayarak başlangıç miktarını yarıya indirecek ve bu sürede çevreye zarar vermeye devam edecektir. Çevreye yayılan radyoaktif ışınlar biosfere, toprağa, suya büyük zararlar vererek insanlarda ölüme, kansere ve genetik bozukluklara neden olabilecektir. Öyleyse nükleer atıklar şimdi olduğu gibi gelecekte de tehlikeli bir kirletici olmayı sürdürecektir. Bildiğiniz gibi 11 Mart 2011’de Japonya’da meydana gelen deprem felaketi yanında Fukuşima nükleer santralinde saklanan atıklar da büyük bir nükleer felakete neden olmuştur. Bu yüzden nükleer santrallerin ürettiği atıklar bir süre daha sorun olmaya aday gözükmektedir. Bunun içindir ki son derece tehlikeli bu maddelerin doğaya zarar vermeyecek şekilde saklanması gerekmektedir. Kömürle çalışan elektrik santralinin ürettiği zararlı maddeler zamanla çevreye yayılır ve çevreyi kirletir. Nükleer santrallerde üretilen radyoaktif atıklar da giderek artar ve bunların imha edilememesi zamanla büyük tehlikeler yaratır. Tartışma Termik ve nükleer santrallerin avantaj ve dezavantajlarını öğrendiniz. Nükleer santrallerin hangi koşullarda kabul edilebilir bir çözüm olabileceğini düşünürsünüz? Bu konuyu araştırınız ve arkadaşlarınızla tartışınız. Radyoaktif elementler sıcaklık, basınç, fiziksel hâl (katı, sıvı, gaz) ya da bileşik hâlinde bulunma gibi etkenlere bağlı olmaksızın belirli bir hızla ışıma yapar. Ancak radyoaktif çekirdeklerin ışıma yaparak bozunma hızı elementten elemente değişir. Bozunma hızı birim zamanda örneğin, saniyede bozunan çekirdek sayısıdır ve bu hız başlangıçtaki çekirdek sayısı ile doğru orantılıdır. Bir radyoaktif çekirdeğin başlangıçtaki miktarının yarısının bozunması için geçen süre radyoaktiflikte oldukça önemlidir. Bu süreye yarılanma süresi (yarı ömür) denir ve çekirdeğin başlangıç miktarına bağlı değildir. Bir radyoaktif çekirdeğin yarılanma süresi ne kadar kısa ise bozunma hızı o kadar büyüktür. Ayrıca yarılanma süresi arttıkça çekirdeğin kararlılığı da artar. Bazı radyoaktif elementlerin yarı ömürleri Tablo 5.2’de verilmiştir. t ve bozunma sonrası kalan madde Radyoaktif bir izotopun geçirdiği yarılanma sayısı n = t1/2 m0 miktarı m = n bağıntılarıyla hesaplanır. Bağıntılarda n : yarılanma sayısı, t : geçen zaman, t1/2 : yarı 2 ömür, m: kalan madde miktarı, mo: başlangıçtaki madde miktarıdır. 262 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Tablo 5.2: Bazı radyoaktif izotopların bozunma türleri ve yarı ömürleri Radyoaktif Bozunma Yarı Bozunma Radyoaktif Bozunma izotop türü ömür ürünü izotop türü 238 9 234 214 α U 4,5·10 yıl Th Pb β¯ 226 Ra α 222 Rn α 212 Pb β¯ 1622 yıl 222 3,8 gün 218 11 saat 212 Yarı ömür 27 dakika 214 Bi Rn 37 e yakalama 35 gün 37 Po 14 β+ 14 Bi 215 α Ar O At – Bozunma ürünü 71 saniye –4 10 saniye Cl N 211 Bi Tartışma Yarı ömür kavramını, nükleer artıkların yarı ömürlerini öğrendiniz. Tablo 5.2’yi dikkate alarak yarı ömür çerçevesinde nükleer atıkların gelecek için bir kirletici sayılmasının nedenini arkadaşlarınızla tartışınız. GÜNEŞ VE YILDIZLAR ENERJİLERİNİ NASIL ÜRETİR? Yıldızların temel enerji kaynağı füzyon (çekirdek birleşmesi) tepkimeleridir, fakat yıldızlar yaşamlarının belli dönemlerinde farklı enerji kaynakları da kullanılabilir. Yukarıda sözünü ettiğimiz gibi kütle çekim enerjisi ile çöken bulutların merkezlerinde bir ısıl enerji üretilir. Kütle OKUMA METNİ çekim kuvvetinin etkisi ile yıldızın merkezinde sürekli artış gösteren sıcaklık 15 000 000 ˚C değerine ulaştığında çekirdeğin sıcaklık sabit kalır. Bu durumdaki bir yıldız en basit füzyon tepkimesi olan hidrojen çekirdeğini helyum çekirdeğine dönüştürme işlemini gerçekleştirir. Bu tepkimede 4 hidrojen atomu (H) birleşerek bir helyum atomunu (He) oluşturur. 4 hidrojen atomunun atom kütlesi bir helyum atomundan % 0,7 fazla olduğu için bu 0,7 oranındaki fazla kütle E = mc2 bağıntısı gereği olarak enerjiye dönüşür. Yani bir yıldız doğumundan ölümüne kadar gecen sürede toplam kütlesinin 0,7’lik kısmını enerji olarak etrafına yayar. Yaşamını hidrojen füzyonu ile sürdürmekte olan yıldızlara ana kol yıldızları adı verilir. Yıldızlar ömürlerinin çok büyük bir kısmını ana kol yıldızı olarak sürdürür. Bir yıldız başlıca yakıtı olan hidrojeni tükettikten sonra tekrar içine çökmeye başlar. Çökme devam edip yıldızın merkezindeki sıcaklık 20 000 000 ˚C olduğunda ikinci bir füzyon tepkimesi başlar. Bu sıcaklıkta helyum atomları birleşerek berilyum atomunu (Be) oluşturur, fakat bu yeni yakıtın ömrü çok kısadır, birkaç milyon yılda bu yakıt da tükenir. Tükenen her yakıtın ardından daha ağır bir atom yakıt olarak kullanılır. Yazarlar tarafından derlenmiştir. NÜKLEER ENERJİ İLE ELEKTRİK ÜRETİMİ* Bir nükleer reaktörde uranyum-238’in nötron yutması sonucu plütonyum-239 oluşur. Oluşan plütonyum-239, bir yandan nükleer fisyona uğrayarak enerji üretimine katkıda bulunurken OKUMA METNİ bir yandan da nötron yutmaya devam ederek plütonyum-240, plütonyum-241 ve plütonyum-242 izotoplarına dönüşür. 1000 MW güç üreten tipik bir hafif su soğutmalı nükleer reaktörden çıkan kullanılmış yakıt yaklaşık %95,5 uranyum, % 3,5 nükleer fisyon sonucu oluşan hafif elementler ve yalnızca % 0,9 oranında plütonyum içerir. Bu plütonyumun % 59’u plütonyum-239, gerisi diğer plütonyum izotoplarıdır. Bu izotoplardan yalnızca plütonyum-239 enerji üretiminde ya da bomba malzemesi olarak kullanılabilir. Bomba malzemesi olarak kullanılacak plütonyumu elde etmek için özel üretim reaktörleri geliştirilmiştir. İlk plütonyum üretim reaktörü, 2. Dünya Savaşı sırasında tasarlanmış ve Şubat 1945’te Hanford’da (Hanfort, ABD), günde 1 kg plütonyum üretmek üzere servise alınmıştır. Plütonyum üretim reaktöründen elde edilen malzeme, önemli miktarlarda uranyum, nükleer fisyon ürünü hafif elementler ve uranyum ötesi ağır elementler içerir. Bu karışımın içinden son derece yüksek saflıkta plütonyum elde edilmesi kimyasal ayrıştırma yöntemlerini gerektirir. 5. ÜNİTE: Çekirdek Kimyası 263 Nükleer reaktörlerin bir yandan enerji üreten bir yandan da tükettiğinden daha fazla yakıt üreten (uranyum-238, plütonyum-239) türleri de işletmeye alınmış olup bu tür reaktörlere “hızlı reaktörler” adı verilir. Normal reaktörlerde uranyum-235 tüketilirken hızlı reaktörlerde yalnızca uranyum-238 tüketilir. Hızlı reaktörlerde üretilen plütonyum-239’un, enerji üretmek üzere tekrar kullanılabilmesi için reaktörden çıkan yakıtın yine bir kimyasal ayırma tesisinde işlenerek yakıt karışımından ayrılması gerekir. *Bilim ve Teknik Dergisi, Sayı 319 ve 323. Yazarlar tarafından derlenmiştir. 2. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Aşağıdaki çekirdek tepkimelerinde a ve b ile simgelenen atom ve kütle numaralarını belirleyiniz. a. abBe + 42He → 126C + 10n 90 0 b. 90 38Sr → bY + –1 β 2. Radyum ve uranyumun yarı ömür süreleri sırası ile 1622 yıl ve 4,5 milyar yıldır. Bunlardan hangisi daha hızlı parçalanır? 3. Bir radyoaktif element bir α taneciği yayınlarsa element atomunun kütle ve atom numarası ne kadar değişir? 4. 235 92U ve 239 90Pu izotopları nötronla bombardıman edildiğinde oluşan çekirdek tepkimelerinin denk- lemlerini yazınız. B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Bir çekirdeğin kararlı olabilmesi çekirdekteki nötron/proton oranına bağlıdır. ( ... ) 2. Başlangıçtaki radyoaktif maddenin miktarının yarıya inmesi için geçen süre “yarı ömür” olarak adlandırılır. ( ... ) 3. Atom çekirdeklerinin nükleer bozunmaya karşı dayanıklılığı çekirdek kararlılığı olarak tanımlanır. ( ... ) 4. Radyoaktif çekirdeklerin sıcaklık etkisi ile yarılanma süreleri değişir. ( ... ) 5. Ağır bir çekirdeğin hafif çekirdeklere ve nötronlara bölünmesi nükleer fisyon olayıdır. ( ... ) 6. Nükleer reaktörlerde oluşan radyoizotopların tamamı tıpta kullanılabilir. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. I. Nükleer reaktörlerde genellikle zenginleştirilmiş 238 92U kullanılır. II. Nükleer reaktörün merkezinde nükleer yakıtın bozunmasıyla çeşitli radyoizotoplar oluşur. III. Nükleer atıklar çevre için önemli bir sorundur. Yukarıdaki yargılardan hangisi ya da hangileri doğrudur? A) Yalnız I 2. B) Yalnız III C) I ve II D) II ve III E) I, II ve III E) I, II ve III I. Kontrol çubukları II. Reaktör III. Maden kömürü Yukarıdakilerden hangisi ya da hangileri nükleer santralin bileşenleridir? A) Yalnız I B) Yalnız II C) I ve II 3. Protonla bombardıman edilme tepkimesi sonucunda D) II ve III 247 96Cm ve 1 α taneciği oluşturan elementin atom ve kütle numarası nedir? A) 250 97X 264 B) 251 98X C) 249 96X D) 248 95X E) 252 99X ORTAÖĞRETİM KİMYA 11 DERS KİTABI AKTİFLİK, RADYOAKTİF IŞINLARIN SAYIMI VE SAĞLIĞA ETKİSİ BÖLÜM İÇERİĞİ 1.Radyoaktif Işınlar ve Özellikleri 2.Radyoaktivite Ölçümleri ve Birimleri 3.Radyoaktif Işınların İnsan Sağlığına Etkisi 4.Radyoaktif Maddelerin Kullanım Alanları 5.Endüstriyel Alanda Radyoizotopların Kullanılışı Tanı, teşhis ya da tedavi amaçlı olarak röntgen, tomografi, sintigrafi, manyetik rezonans (MR) gibi biyomedikal görüntüleme araçlarından yararlanıldığını bilirsiniz. Bu araçlar genellikle hastanın vücudundan geçen röntgen ya da gama ışınlarının film, dedektör gibi materyalin üzerine düşürülmesiyle görüntü oluşturan cihazlardır. Bazen de bu araçların görüntü kalitesini artırmak üzere hastaya enjekte edilen radyoaktif bileşenlerden yararlanılır. Dolayısıyla radyoaktivitenin tıp alanında büyük bir önemi vardır. Bu bölümde radyoaktif ışınları, bunlardan yararlanma yollarını ya da bunların zararlı etkilerinden korunma yollarını göreceksiniz. 5. ÜNİTE: Çekirdek Kimyası 265 1. Radyoaktif Işınlar ve Özellikleri Bazı atom çekirdeklerinin kararsız yapıları nedeniyle kendiliğinden parçalanarak atom altı parçacıklar yayınladığını, bu olaya “radyoaktif ışıma” dendiğini biliyorsunuz. Kararsız çekirdeklerin α, β, γ ışınları yayarak kendi kararlı çekirdekleri hâline döndüğünü öğrendiniz. Şimdi bu parçacıkları daha yakından tanıyalım. Alfa ışınları (α): Helyum çekirdeğinden ibaret, iki nötron iki protona sahip atom altı parçacıklardır. Yükleri +2, kütleleri 4’tür. α ışınlarının hızı bu ışını yayınlayan atomun türüne bağlı olarak değişir. Ortalama hızları ışık hızının % 10’u kadardır. Kinetik enerjileri 4-8 MeV (mega electron Volt) mertebesinde değişir. İyonlaştırıcı özelliğe sahip ışınlardır. Giricilikleri azdır. Bu ışınlar birkaç cm havadan, milimetrenin 1/100’i kadar kalınlıktaki alüminyum levhadan geçebilir. Yüklü tanecikler oldukları için elektriki ve manyetik alanda saparlar. Beta ışınları (β): Bu ışınlar elektronlardan ibaret olup –1 yüklü taneciklerdir. Elektrik ve manyetik alanda saparlar. Hızları ışık hızına yakın olup α ışınlarına göre daha iyi giricidirler. İyonlaştırıcı özelliğe sahiptirler. Gama ışınları (γ): Kısa dalga boylu elektromanyetik ışınlardır. Uyarılmış hâldeki çekirdeklerin, diğer bir ifade ile α ya da β ışıması yapan çekirdeklerin yaptıkları ışımalardır. Gama ışınları yüksek enerjili olup birkaç cm kalınlığındaki kurşun levhadan geçebilir. Bu ışınlar yüksüz olduklarından elektrik ve manyetik alanda sapmazlar ve ışık hızı ile hareket ederler. Radyoaktif ışınlar katı, sıvı ve gaz maddeleri iyonlaştırır. α, β ışınları gibi g ışınları da floresansa neden olur. ZnS boyalara çok az miktarda radyum tuzu ilave edilirse devamlı ve çok az miktarda ışık veren boyalar elde edilir. α ve β ışınları düşük giricilik özelliğine sahip olduklarından α ve β ışınları yaygın radyoaktif maddeler ince alüminyum, kurşun, plastik ve tahta gibi kaplarda saklanabilir. γ ışınları ise yüksek giricilik yeteneğine sahip olduklarından γ ışını yayan radyoaktif maddeler ancak kalın kurşun bloklar içinde saklanabilir. Radyoaktif ışınların bazı özellikleri Tablo 5.3’te verilmiştir. İnceleyiniz. Tablo 5.3: Alfa, beta ve gama ışınlarının önemli özellikleri Özellik Yükü Kütlesi Göreceli gücü Doğal ışın Alfa (α) 42He Beta (β) –10e Gama (γ) 00γ +2 –1 0 6,64 · 10–24 g 9,11 · 10–28 g 0 1 100 1000 Helyum çekirdeği Elektronlar Yüksek enerjili fotonlar 2. Radyoaktivite Ölçümleri ve Birimleri Radyoaktif parçalanmanın bulunması sonrası radyoaktif ışınların şiddetinin ölçülmesi önemli hâle gelmiş ve bu amaçla değişik yöntemler ve sayaçlar geliştirilmiştir. Radyoaktif ışınlar fotoğraf filmine aynen ışık gibi etki eder. Ancak ışımanın bu yolla nitel ve nicel analizini yapmak kolay ve çabuk bir yol değildir. Herhangi bir maddeden ışınım yayılıp yayılmadığını veya ortamda ışınım olup olmadığını anlamak ve miktarını ölçmek için dedektör denilen sayaçlar kullanılır. α, β, γ ve X-ışınımlarının varlığını göstermek ve bunların şiddetini ölçmek için kullanılan araçlardan biri de Geiger-Müller (Gayger-Müller) sayacıdır. Bu sayaç radyoaktif minerallerin araştırılmasında ve tıpta geniş ölçüde kullanılır. Radyoaktif maddelerin saniyedeki bozunma sayısına aktiflik (aktivite) denir. Radyoaktif kaynağın aktifliği arttıkça birim zamanda geçireceği bozunma sayısı da artar. 266 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Radyoaktif ışıma bir madde ile karşılaştığında onunla etkileşerek iyonlaşma ve uyarılma olaylarına yol açar. Oluşacak etkiler fiziksel, kimyasal ve biyolojik olmak üzere çeşitli faktörlere bağlı olarak değişir. Bu etkilerin başında radyoaktif ışımanın enerjisi ve etkileştiği maddenin özellikleri gelir. Bu faktörlerin etki derecelerinin anlaşılması radyasyon şiddeti, dozu ve absorblanan doz kavramları üzerinde durmayı gerektirir. Radyoaktif ışıma şiddetinin dozu radyasyon dozu şiddetinin, absorblanan doz ise dozun ne kadarının madde tarafından emildiğinin bir göstergesidir. Aktiflik birimi: SI birim sisteminde radyoaktif ışımanın (radyasyonun) birimi Becquerel (BekerelBq)’dir. Becquerel saniyede bir bozunma gösteren radyoaktif maddenin aktifliğidir. Aktiflik birimi olarak Curie (Ci) de kullanılır. Curie saniyede 3,7 · 1010 bozunma gösteren radyoaktif maddenin aktifliğidir. Bozunma = 2,703 · 10 –11 Ci Saniye Absorblanmış (soğurulmuş) doz birimi: SI birim sisteminde birimi Gray (Gy)’dir. Radyasyon 1Bq = 1 alan maddenin 1 kg’ına 1 J enerji veren ışıma miktarına Gray denir. Özel birim olarak rad (R) da kullanılır. Radyasyon alan maddenin 1 kg’ına 10–2 J’lük enerji veren ışıma miktarına rad denir. 1 Gy = 1 J/kg’dır. Biyolojik eş değer doz: Radyoaktif ışınların eşit dozlarının biyolojik etkisi farklı olabilmektedir. Bu durum yeni bir birimin tanımını gerektirmiştir. Bu birim rad cinsinden soğurulan dozun biyolojik etkiyi de hesaba katacak bir faktörle çarpımından elde edilir. SI birim sistemde Sievert (Sv), özel birim olarak da rem kullanılır. Biyolojik eş değer doz birimi (rem) = Absorblanan doz (R) · Kalite faktörü Kalite faktörü ışımanın neden olduğu iyonizasyon miktarına bağlıdır. Örneğin, α ışınları için 1 R = 20 rem, proton ve nötronlar için 1 R = 10 rem, β, X ve γ ışınları için 1 R = 1 rem’dir. 1 Sv = 1 J/kg = 102 rem’dir. Uluslararası Radyasyondan Korunma Komitesi (ICRP)’nin radyasyon çalışanları ve toplum üyesi kişiler için öngördüğü biyolojik eş değer doz sınırları Tablo 5.4’te verilmiştir. İnceleyiniz. Tablo 5.4: Radyasyon çalışanları ve toplum üyesi kişiler için biyolojik eş değer doz sınırları Etkin doz sınırı Radyasyon çalışanları Toplum üyesi kişiler Ardışık beş yılın ortalaması 20 mSv 1 mSv Herhangi bir yılda 50 mSv 5 mSv 150 mSv 15 mSv 500 mSv 50 mSv 500 mSv 50 mSv Göz merceği Bazı organların yıllık eş değer doz Deri (cm2) sınırı Eller ve ayaklar Radyoaktif ışımanın insan üzerindeki etkileri: İnsan vücudu organlardan her organ da özelleşmiş hücreden oluşur. İyonlaştırıcı radyoaktif ışınlar bu hücrelerin çalışmasını etkileyebilecek potansiyele sahiptir. Biyolojik etki atomların iyonizasyonu ile başlar. Radyoaktif ışımanın insan dokusuna verdiği zarar maddenin atomlarını iyonize etmesi ile ilgilidir. İnsan dokusu tarafından emilen iyonize edici radyoaktif ışınlar, doku moleküllerini oluşturan atomlardan elektron sökecek kadar yüksek enerjiye sahiptir. Elektron ortaklaşması ile bağ yapan elektron çiftlerinden biri yerinden söküldüğünde bağ kırılır ve dolayısıyla molekül parçalanır. Bu, radyoaktif ışımanın hasarının anlaşılabileceği basit bir modeldir. İyonlaştırıcı radyoaktif ışıma, hücre ile etkileştiği zaman hücrenin kritik bir bölümüne çarpabilir. Bu durum da kromozomların genetik bilgisinin değişmesine yol açabilir. Böylece iyonizasyon olayları, hücre içinde rastlanmayan bazı yapıları oluşturabilir. Eğer hasar gören hücrenin kendini tamir etmeden önce yerine 5. ÜNİTE: Çekirdek Kimyası 267 getirmesi gereken bir görevi varsa hücre bu durumda kendini onarma işlevini yerine getirmeyecek ya da yapması gereken görevi eksik ya da hatalı olarak yerine getirecektir. Sonuçta normal işlevlerini yerine getiremeyen veya diğer hücrelere zarar veren hücreler ortaya çıkabilecektir. İşte bu hücreler radyoaktif ışımanın kansere neden oluşunun en önemli nedenidir. Bir defada yüksek dozda radyoaktif ışımaya maruz kalmanın doza göre insan vücuduna etkileri Tablo 5.5’te verilmiştir. İnceleyiniz. Tablo 5.5: Doza bağlı radyoaktif ışıma etkileri Doz miktarı Yol açtığı sonuç 10 Sv Birkaç gün ya da hafta içinde ölüm riski 1 Sv % 5 kanser riski 100 mSv % 0,5 kanser riski 50 mSv Radyasyon işçileri için yıllık eşik doz limiti 1 mSv İnsanlar için yıllık ortalama eşik doz limiti 3. Radyoaktif Işınların İnsan Sağlığına Etkisi İyonlaştırıcı radyoaktif ışımaya maruz kalmanın taşıdığı riskten tamamen kaçınabilir miyiz? Bunun mümkün olduğu, herkes tarafından kabul edilse bile radyoaktif ışımanın risklerinden kaçınmak hemen hemen olanaksızdır. Zira doğal radyasyon, çevremizde daima mevcuttur ve çevremizden alınan doğal radyasyon dozu, yıllık radyasyon dozumuzun yarısına karşılık gelir. Diğer yarısı ise başlıca iyonlaştırıcı radyasyonun tıbbi alanda hastalıkların teşhis ve tedavisi amacı ile kullanılmasından ileri gelir. Bununla birlikte gereksiz ışınlanmalardan kaçınabiliriz. Örneğin, tuğladan yapılmış binaların iyi havalandırılması, radon gazının neden olduğu radyasyonu azaltır. Dişçilikte kullanılan X-ışını cihazlarının üzerinde demet sınırlayıcıların (kolimatör) kullanılması, vücudun diğer bölümlerinin zarar görmesini önleyebilir. Basit ve hassas cihazlar ile doğal veya yapay kaynaklardan yayılan radyasyonun küçük miktarları bile ölçülebilir. Bunlara ilaveten gereksiz radyasyona karşı koruyucu önlemler olarak zaman, uzaklık, zırhlama ve dış koruma kabı gibi faktörlerden yararlanılabilir. Zaman: Bazı kişilerin sık sık radyasyona maruz kalmaları söz konusu olabilmektedir. Böyle durumlarda alınan ışıma zamanının azaltılması ile radyasyon doz miktarı ve hastalık riski minimum düzeye indirilebilir. Uzaklık: Herhangi bir ısı kaynağından uzaklaştığımız zaman, ısının şiddetini daha az hissederiz. Isı kaynağı gibi radyasyon kaynağından da uzaklaşıldıkça radyasyonun şiddeti, uzaklığın karesi ile ters orantılı olarak azalır. Bu nedenle radyasyon bölgesinde çalışan görevlilerin, radyoaktif kaynaktan güvenli uzaklıkta durmaları gerekir. Zırhlama: X-ışınları g ışınları gibi giricilik özelliği fazla olan ışınlardır. Bu nedenle; ®® Giricilik özelliği fazla olan radyasyon kaynakları, zırhlanmış kaplar içinde tutulmalıdır. ®® Hastanelerde X-ışını cihazları, duvarları zırhlanmış odalarda bulundurulmalıdır. ®® Diş tetkiklerine yönelik X-ışını cihazları, özel zırhlama kolimatörü ile birlikte kullanılmalıdır. ®® Nükleer reaktörler kalın beton duvarlarla çevrilmelidir. Dış koruma kabı: Radyoaktif maddelerin özel yapılmış koruyucu kaplarda oldukça küçük hacimler içerisinde ve çevreden yalıtılmış olarak tutulmaları gerekir. Bu amaçla; ®® Tıpta kullanılan radyoaktif izotoplar kapalı hücrelerde işleme tabi tutulmalıdır. ®® Reaktörler, radyoaktif elemanların kademeli engeller içerisinde bulunduğu kapalı bir sistem olarak çalıştırılmalıdır. ®® Endüstride, kaynak dikişlerinin kontrolünde ve diğer amaçlarda kullanılan radyoaktif maddeler kademeli bir şekilde kapsüllenmiş olarak ve zırhlanmış kaplarda korunmalıdır. 268 ORTAÖĞRETİM KİMYA 11 DERS KİTABI Radyasyondan korunmak için dikkat edilmesi gereken genel hususları şöyle sıralayabiliriz: ® Işınlama süresi mümkün olduğunca kısa olmalıdır ve gereksiz ışınlamalardan kaçınılmalıdır. ® Radyasyon yayan araçlar kapalı bir ortamda çalıştırılıyorsa bu ortamda yiyecek ve içecek bulundurulmamalı ve buralarda yemek yenmemelidir. ® Radyasyon ortamında çalışan personel, teorik ve pratik olarak çok iyi eğitilmelidir. Personel kurşun plaka ve benzeri donanımları kullanarak çok iyi zırhlama (perdeleme) içinde çalışmalıdır. ® Kullanılan tüm donanımın bakımı düzenli olarak yapılmalıdır. ® Çalışma bölgesi (40 μSv/h’lik çalışma bölgesi) uyarı işaretleri ile (Şekil 5.11.a ve b) belirlenmeli ve bu bölgeye girişler kontrol altında tutulmalıdır. ® Tüm çalışanların üzerinde kalem dozimetre, film dozimetre, uyarıcı (beeper) ve mümkünse doz hızı ölçer bulunmalıdır. a. ISO tarafından 1975 yılında kabul edilen standart radyoaktif madde sembolu b. ISO tarafından 2007 yılında standartlaştırılan ilave radyaoktivite uyarı işareti Şekil 5.11: İyonlaştırıcı radyasyon işaretleri ® Her çalışma günü sonunda kalem dozimetreden doz değeri personel defterine işlenmelidir. ® Film dozimetreler ayda bir ilgili kuruluşa gönderilerek sonuçlar kayıt altında tutulmalıdır. ® Radyoaktif izotoplar özel araçlarla ve gerekli koruma önlemleri alınarak (çelik ya da kurşun bir kutu içerisinde) taşınmalı ve aracın üzerinde radyoaktif madde taşındığına dair işaretler yapıştırılmalıdır (Bu işaret Şekil 5.11.a’da verilmiştir.). Genel ulaşım araçları kesinlikle kullanılmamalıdır. ® Bir nükleer kaza durumunda (örneğin, çekirdeğin dışarıda kalması) mümkün olan en kısa zamanda bölgeden uzaklaşılmalı, 2,5 μSv/h doz hızı sınırı işaretlenerek hiç kimsenin bu bölgeden içeri girmemesi sağlanmalı, ilgili kuruluşlara haber verilmelidir. 4. Radyoaktif Maddelerin Kullanım Alanları Radyoaktifliğin hemen hemen tüm bilimsel ve teknik çalışmalarda geniş bir uygulama alanı bulunmaktadır. Radyoaktif izotopların nükleer tepkimelerinden birçok teknik konuda kontrol aracı olarak faydalanılmaktadır. Bu kontrolde özellikle radyoaktif bir elementin radyoaktif olmayan bütün izotoplarıyla aynı özellikleri göstermesinden yararlanılır. Radyoaktif atomlar, maddelerin “etiketlenmesinde” de kullanılabilir; bunun için maddedeki bazı atomlar yerine radyoaktif izotoplar yerleştirilir ve bu izotopların yaydığı ışınımdan yararlanılarak madde izlenir. Tıpta bu yöntem, hangi maddenin vücudun hangi bölümüne gittiğini saptamak için (örneğin, yeni bir ilaç denenirken) kullanılır. Radyoaktif etiketlemeden, kimya ve biyokimyada moleküllerin kimyasal tepkimelere katılım aşamalarını ve süreçlerini izlemek için yararlanılır. Endüstriyel radyografide ise iridyum-192 ve kobalt-60 radyoizotoplarının ürettiği gama ışınları kullanılır. Bu ışınlar ile metal ve plastik levhaların kalınlıkları ölçülür, iç yapıları incelenir. Motor yağlarının verimliliğini incelemek için de radyoaktif izotoplar kullanılır. Bunun için motorun yapıldığı metale bir miktar radyoaktif izotop katılır. Motor belli bir süre çalıştırıldıktan sonra yağında radyoaktif taneciklerin bulunup bulunmadığına ve dolayısıyla da motorun aşınıp aşınmadığına bakılır. Radyoizotopların diğer bir kullanım alanı ise petrol sanayisidir. Birden fazla petrol türevinin aktarımı için bir tek boru hattı kullanıldığında, aktarılan ürünlerin son kısımlarına az miktarda radyoaktif izotop katılır ve böylece bir ürünün bitip diğerinin başladığı anlaşılır. Radyasyon burada otomatik bir vana sistemini çalıştırmak için de kullanılabilir ve bu şekilde petrol ürünlerinin farklı tanklara yönlendirilmesi sağlanır. 5. ÜNİTE: Çekirdek Kimyası 269 Radyoaktif uygulamalardan bazı bilim dallarında şu şekilde yararlanılmaktadır: Tıptaki uygulamalar: Radyoaktiflik bu alanda hem teşhis hem de tedavi amaçlı kullanılmaktadır. Radyoaktif ışınlar kullanılarak vücuttaki dokular, kemikler ve organlar incelenebilmekte, hastalıklar teşhis edilebilmektedir. Proton, nötron ya da ağır iyonlar kullanılarak kanserli hücreler öldürülebilmektedir. Bu amaçla X-ışınları uzun süreden beri kullanılmaktadır. Radyoizotop, insan kan dolaşımına da katılabilir. Radyoaktivite atomsal ölçekte bir olay olduğuna göre kana verilecek radyoaktif madde miligram veya mikrogram ölçeğine kadar azaltılarak bir yan etki (kan zehirlenmesi) yapması önlenebilir. Radyoizotopun vücuttaki hareketi dışardan, vücuda hiç temas etmeden, elektronik algılayıcılar ile izlenebilir. Böylece kalp, akciğer, böbrek gibi organların çalışmaları kontrol edilebilir. Örneğin, günümüzde yaygın olarak pozitron ışın tomografisi (PET) özellikle beyindeki bazı hastalıkların teşhisinde kullanılmaktadır. Bu amaçla hastaya eser miktarda karbon-11 izotopu içeren glikoz verilir. Kan dolaşımı ile beyne giden karbon-11 izotopunun yaptığı pozitron ışımasını belirlemek için tomografi çekilir. Tomografiden elde edilen görüntülerle beyindeki anormallikler belirlenir (Resim 5.2). Resim 5.2: Radyoaktif maddelerden yararlanarak tomografi çekimi ve görüntüleri Tiroit bezi kandaki iyodu 24 saatte toplayıp alır ve bir o kadar zaman içinde de elimine eder. Hastaya iyot-131 (yarı ömrü 8,06 gün) izotopu verilirse bu izotop dışardan izlenebilir. Şayet anılan metabolik fonksiyon uzun sürüyorsa tiroit bezinin tembel çalıştığı veya aksine çok kısa sürüyorsa hastanın hipertiroidden muzdarip olduğu deneysel olarak kanıtlanır. Fosfor-32 (yarı ömrü 14,3 gün) kanser ameliyatına hazırlanan hastaya enjekte edilir. Tümör hücreleri normal hücrelerden çok daha aktif olduklarından daha fazla kan ve dolayısıyla radyoaktif fosfor alırlar. Cerrah, tümörün en küçük kalıntılarını dahi kazıyıp aldığından emin olmak için radyasyon algılayıcı ile ameliyat ettiği bölgeyi tarar ve işinin bittiğine böylece karar verir. Altın-198 (yarı ömrü 2,7 gün), tıpta çok kullanılan bir diğer radyoizotoptur. Kan, radyoaktif altını vücudun herhangi bir yerindeki habis tümöre taşır ve böylece radyoaktif altının yayınladığı gama ışını tümöre ulaşır. Böylece başlangıç hâlindeki tümörlerin teşhisi olanaklı hâle gelir. Ksenon-133 (yarı ömrü 5,3 gün), radyoaktiftir ve bir asal gazdır. Akciğerlere az miktarda verilerek bu organının sağlığı ve işleyişi dışardan gözlenebilir ve görüntüsü alınabilir. Sodyum –24, kan akışını gözlemlemede, stronsiyum –87 kemik büyümesini araştırmada, teknesyum –99 iç organların işlevlerini araştırmada çok yaygın olarak kullanılan radyoaktif çekirdeklerdir. Nötronlar tıbbi ve bilimsel araştırmalarda kullanılan diğer atom altı parçacıklarla etkileşmezler ve yüklü parçacıklar gibi ivmelenmeye ihtiyaç duymazlar. Bu yüzden nötronlar nükleer tepkimelerde ve tıp alanında kullanılır. Örneğin, kobalt-60 nötron ışınları kanser tedavisinde kullanılır. İnsan vücuduna verilen radyoizotoplar hep kısa ömürlüdür. Çünkü radyoizotoptan beklenen görev bittikten sonra, hemen vücuttan atılması ya da kısa sürede sönümlenerek zararlı etkisinin ortadan kalkması istenir. 270 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 5. Endüstriyel Alanda Radyoizotopların Kullanılışı Endüstride basınç boruları, kaynatıcılar ve büyük metal döküm kalıpları içindeki çatlak ve yarıkların araştırılmasında radyoizotoplardan yararlanılır. Metalurjideki uygulamalar: Radyoaktiviteden çeliğin katılaşma sürecini izleme ve metalürjik tepkimelerin kinetiğini inceleme amacıyla yararlanılır. Bu yolla metallerin yayılması kolayca izlenir. Metal kaynakçılığında boşlukların belirlenmesi, korozyonda aşınmayı gözlemleme olanağı sağlar. Biyoloji ve tarımdaki uygulamalar: Radyoaktifliğin en geniş uygulaması tarım alanındadır. Bitkinin bünyesine düşük miktarda karbon–14 izotopu verildiğinde bitki bünyesinde bu izotop izlenebilir, zirai ilaçların ekosistemdeki akıbetleri konusundaki bilgilere ulaşılabilir. Ayrıca karbon–14 izotopları kullanımı ile kalite kontrol ve kalite güvence sistemi kapsamında analizler yapılabilir. Kimyada uygulamalar: Elektron spektroskopisi ile kimyasal analiz, polimerik malzemelerin incelenmesi yapılabilmektedir. İz elementi analizi tayininde, ışınım kimyası adında yeni bir kimya dalı gelişmiştir. Bu dalın konusu ışıma altında gelişen yeni kimyasal tepkimelerin incelenmesidir. Bu işlemlerde kobalt–60 izotopu gibi radyoaktiflik derecesi çok yüksek kaynaklar kullanılır. Fizik uygulamaları: Katıların elektron yapısı, yüzeylerin ve ara yüzeylerin incelenmesi gibi kullanım alanları vardır. Tarih, arkeoloji ve jeolojide uygulamalar: Willard Frank Libby (Vilard Frenk Laybi) paleontolojik devirlerden veya tarihin derinliklerinden arta kalan kalıntıların yaşlarının tayininde yeni ve şaşmaz bir yöntem olarak karbon-14’ün kullanılabileceğini kanıtlamış ve bu buluşuyla 1960 yılı Nobel Ödülü’nü kazanmıştır. Ahşap eşyanın veya kumaşların yapıldığı tarih, karbon-14 metoduyla kesin olarak bulunabilmektedir. Bu yöntem eski medeniyetlerin incelenmesinde çok yararlıdır. Ağaç, kemik, kâğıt vb. kalıntılarla karbonlaşmış tabakaların (kömür, petrol) arkeolojik ve jeolojik yaş tayinleri bu sayede mümkün olabilmektedir. Organik bileşiklerde menşe tayini (örneğin, etil alkolün sentetik mi, yoksa petrolden mi damıtıldığı) bu yöntemle saptanabilmektedir. Karbon-14 izotopu ile yaş belirlemenin temel ilkesi şöyledir: Karbon-14’ün yarı ömrü 5730 yıldır. Karbon-14 kozmik ışımalar bombardımanı sonucunda oluşur. Kozmik ışınlar uzaydan gelen radyasyonlardır ve alfa parçacıkları, protonlar ve daha ağır iyonlar içerir. Bu iyonlar atmosferin üst tabakasında çarpışarak nötron gibi değişik parçacıklar oluşturur. Nötron ile azot-14 çekirdeğinin çarpışması ile de karbon-14 çekirdeği meydana gelir. Karbon dioksit ve karbon-14 alt atmosferde karışır. Canlı organizmalar atmosferdeki O2 i kullandıklarından yapılarında karbon-12’nin yanı sıra belirli oranlarda karbon-14 de bulunur. Ancak bu canlı organizmalar öldükleri andan itibaren yapılarındaki karbon-14 ile atmosferdeki karbon-12 arasında var olan denge bozulur. karbon-14 radyoaktif bozunmaya uğrar ve karbon-14’ün karbon-12’ye olan oranı giderek düşmeye başlar. Karbon izotopları arasındaki bu oransal değişim, bir çeşit saat görevi görür. Buradan hareketle canlıların ne zaman öldükleri bilgisi elde edilir. Biliyor musunuz? Vücudumuzdaki her 10-12 trilyon karbon atomundan bir tanesi ışıma yapar. Karbon-14 izotopunun ışıması evrim ve mutasyon olayının gerçekleşme nedenlerinden biridir. Çünkü karbon-14 izotopu bir yapı taşı olarak canlının hücrelerinin derinliklerine kadar gider ve DNA’sının değişime uğramasına neden olur. Bu bakımdan karbon-14 izotopu canlının gelişiminde çok önemli bir rol oynar. 5. ÜNİTE: Çekirdek Kimyası 271 GEİGER-MÜLLER SAYACI Geiger-Müller sayacı, katot olarak görev yapan iletken bir silindir, bu silindirin ekseni boyunca uzanan ve anot olarak görev yapan iletken bir telden oluşur. Cam tüpün içindeki iyonlaş- OKUMA METNİ ma odasında, düşük basınçlı argon ve alkol karışımı gaz vardır. Silindir Cam Radyoaktif Gaz ile tel arasındaki gerilim farkı yaklaşık 1 kV kadardır. Cam pencereden ışın sayaca giren radyasyon, gaz moleküllerinin iyonlaşmasını sağlar. Bu R iyonlar elektrik alanı tarafından hızlandırılır. Hızlanan iyonlar diğer gaz – + atomlarına çarpıp onları iyonlaştırarak anotla katot arasında kısa süreli bir akımın geçişini sağlar. Bu akım anotla katot arasındaki gerilimi düşürür, iyonlaşma yavaşlar. İyonlaşma iyice yavaşlayınca akım da kesilir. Sayaca yeni bir radyasyon girince devreden yine kısa süreli akım geçer. Bu kısa süreli akım, direncin uçları arasında kısa süreli gerilim değişmelerine neden olur. Bu kısa süreli akım-gerilim değişmeleri sayaca bağlı olan elektronik araçlarla sayılabilir. Diğer bir ifade ile akım geçişi bir kulaklıkla dinlenerek ya da devreye bağlanan ışık düzeneğinin yanıp sönmesi ile maddenin radyoaktiflik derecesi ölçülür. Yazarlar tarafından düzenlenmiştir. 3. BÖLÜM DEĞERLENDİRME ÇALIŞMALARI A. Aşağıdaki soruları yanıtlayınız. 1. Radyasyonun zararlı etkilerinden korunmak için hangi önlemler alınmalıdır? 2. Radyasyon uyarı levhalarının radyasyon içeren alanlara asılmasının yararları nelerdir? 3. Bir elementin radyoaktif izotopu ile radyoaktif olmayan izotopu arasında ne fark vardır? 4. Radyoaktif izotoplardan nasıl yararlanılır? 5. Yaş tayininde hangi radyoizotopların kullanılması uygundur? Neden? 6. Hastalık türü ile radyoizotop kullanımı arasında bir ilişki var mıdır? Açıklayınız. B. Aşağıdaki ifadelerden doğru olanların karşısına “D”, yanlış olanların karşısına “Y” yazınız. 1. Radyoaktif ışıma, atom çekirdeğinin bozunması sonucu ortaya çıkar. ( ... ) 2. Her bir radyoaktif maddenin kendine özgü bozunma hızı vardır. ( ... ) 3. Radyoaktif ışımanın zararlı etkileri olduğu gibi önemli ve yararlı etkileri de vardır. ( ... ) 4. Radyoaktif etiketleme yöntemi ile tarımsal ürünlerin gelişimi izlenebilir. ( ... ) 5. Bütün radyoaktif maddeler alüminyum kaplarda saklanabilir. ( ... ) 6. Bazı radyoaktif maddeler belirli bir uzaklıktan itibaren zararlı oldukları hâlde bazıları ancak vücuda alındıklarında zararlı olur. ( ... ) 7. Radyoaktif bir elementin bileşiğinin sulu çözeltisi soğutularak radyoaktiflik özelliği giderilebilir. ( ... ) 8. SI birim sistemine göre radyoaktiflik birimi Becquerel’dir. ( ... ) 9. Radyoaktif izotoplar tehlikeli olduğundan bilimsel araştırmalarda kullanılamaz. ( ... ) C.Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. I. Çekirdek tepkimelerinde atomların atom ve kütle numarası korunur. II. Alfa ışıması yapan elementin atom numarası 2, kütle numarası 4 azalır. III. Bir beta ışıması ile atom numarası 1 artarken kütle numarası değişmez. Yukarıda verilen yargılarından hangisi ya da hangileri doğrudur? A) Yalnız I 272 B) Yalnız III C) I ve II D) II ve III E) I, II ve III ORTAÖĞRETİM KİMYA 11 DERS KİTABI 2. I. Topraktan II. Güneşten III. İlaçlardan IV. Organizmada yapı taşı görevi yapan bazı kimyasallardan Yukarıdakilerden hangileri doğal radyasyonu alma yollarından biri değildir? A) I ve II B) III ve IV C) I, II ve III D) II, III ve IV E) I, II, III ve IV D) Sievert E) Bequerel 3. Aşağıdakilerden hangisi radyoaktif ışıma birimi değildir? A) Geiger B) Ram C) Gray 4. Aşağıdakilerden hangisi radyoaktif izotopların yararlı kullanım alanlarından biri değildir? A) Tıpta teşhis ve tedavide B) Nükleer füze başlıklarında C) Arkeolojik tarihlemede D) Bitki gelişiminin incelenmesinde E) Boru kaynaklarınde 5. Ü N İ T E D E Ğ E R L E N D İ R M E Ç A L I Ş M A L A R I A. Aşağıdaki soruları yanıtlayınız. 1. Kararsız çekirdek ne demektir? Açıklayınız. 2. Radyoaktif maddelerin karakteristik özellikleri nelerdir? Açıklayınız. 3. Nükleer reaktörlerde zincirleme çekirdek tepkimesi sonucu açığa çıkan nötronlar, dolayısıyla zincirleme çekirdek tepkimesinin hızı, nötron yavaşlatıcılar (moderatörler) tarafından kontrol edilir. Bu kontrol sağlanamazsa ne gibi sonuçların ortaya çıkması beklenir? 4. Atom numarası 83’ten büyük elementler, α bozunması ya da çekirdek fisyonu yoluyla parçalanır. Bu elementlerin neden α bozunması dışındaki bozunmaları yapmadıklarını açıklayınız. 5. Periyodik cetvelin VIIA grubundaki radyoaktif bir element 1α , 2β¯ ışıması yapıyor. Oluşan yeni element hangi grupta bulunur? 6. 226 88 Ra atomu 3 α , 2β¯ ışıması yapıyor. Bu ışımalar sonucu oluşan yeni elementin atom ve kütle numarası kaçtır? 7. Bir araştırma için yarılanma süresi 30 dk. olan 5 g radyoaktif madde gereklidir. Deneyin hazırlanması ve maddenin getirilmesi 2,5 saat sürüyor. Deneyin yapılabilmesi için başlangıçta kaç gram radyoaktif madde gereklidir? B. Aşağıdaki ifadelerin sonundaki yay ayraç içine ifade doğru ise “D”, yanlış ise “Y” yazınız. 1. Atom çekirdeğindeki parçacıkların her birine “nükleon” adı verilir. ( ... ) 2. Kararsız atom çekirdekleri kararlı hâle geçebilmek için kendiliğinden ışıma yapar. ( ... ) 3. Saniyede bir bozunma gösteren radyoaktif maddenin aktivitesi 1 Curie (Ci)’dir. ( ... ) 4. Atom çekirdeğinde nükleon başına düşen bağlanma enerjisi ne kadar büyük olursa çekirdek o kadar kararsızdır. ( ... ) 5. Radyoaktif elementler kendiliğinden başka elementlere dönüşebilir. ( ... ) 6. Güneş ve yıldızlarda üretilen enerjinin kaynağı kimyasal tepkimelerdir. ( ... ) 7. Nükleer reaktörlerde enerji üretimi yanında yapay izotoplar da üretilebilmektedir. ( ... ) 8. Yapay çekirdek tepkimeleri oluşturmak için atom çekirdeklerini enerjili parçacıklarla bombardıman etmek gerekir. ( ... ) 9. Çekirdek tepkime denklemlerinde denklik işaretinin her iki tarafında atom ve kütle numaraları toplamlarının birbirine eşit olması gerekir. ( ... ) 5. ÜNİTE: Çekirdek Kimyası 273 C. Aşağıdaki çoktan seçmeli soruları yanıtlayınız. 1. 14 7N + 42He → 178O + 11H tepkimesi için aşağıdaki ifadelerden hangisi yanlıştır? A) Bir kimyasal tepkimedir. B) Tepkimede kütle numaraları toplamı korunmuştur. C) Bir çekirdek tepkimesdir. D) Tepkimede toplam nötron sayısı korunmuştur. E) Tepkimede toplam proton sayısı korunmuştur. 2. Radyoaktif bir elementin atomu, nötronla bombardıman edilerek bir nötron yakalaması sağlanırsa aşağıdakilerden hangisi doğru olur? A) Kütle numarası korunur. D) Elektron sayısı bir artar. B) Atom numarası bir artar. E) Kütle numarası bir azalır. C) Bir izotop oluşur. 3. Radyoaktif bir izotopun bozunma hızı aşağıdakilerden hangisine bağlıdır? A) Zamana D) Elektriksel alan etkisine B) Sıcaklığa E) Basınca C) Manyetik alan etkisine 4. Periyodik cetvelde IIA grubunda yer alan radyoaktif bir element, 2α, 1β¯ bozunmasına uğradığında bozunma sonucu oluşan yeni elementin grubu aşağıdakilerden hangisidir? A) Halojenler B) Asal gazlar C) Alkali metaller D) Geçiş metalleri E) Toprak alkali metaller 5. Yarılanma süresi dört gün olan radyoaktif bir elementin, başlangıçtaki miktarından bozunmadan 1/8’inin kalması için geçecek süre kaç gün olur? A) 12 B) 10 C) 8 D) 7 E) 6 6. Radyoaktif bir izotopun başlangıçtaki miktarının 9/12’sinin bozunarak başka bir elemente dönüşmesi için on iki gün geçtiğine göre bu izotopun yarılanma süresi kaç gündür? A) 1,5 B) 3 C) 4,5 D) 6 E) 9 7. 8 · 108 radyoaktif çekirdek içeren bir a kaynağı, dört dakikada 7,5 · 108 tane tanecik fırlattığına göre radyoaktif maddenin yarılanma süresi kaç saniyedir? A) 40 B) 48 C) 60 D) 80 E) 120 8. 16 g radyoaktif 240X izotopundan 8,1 · 104 yıl sonunda bozunmadan 5 · 1021 tane kaldığına göre yarılanma süresi kaç yıldır? A) 3 · 102 B) 9 · 102 C) 2,7 · 104 D) 4,05 · 104 240 X izotopu E) 8,1 · 104 9. X elementinin yarı ömrü Y ’ninkinin iki katıdır. Eşit kütlede X ve Y elementi karışımı aynı sürede m yarılandığında kütleleri arasındaki X oranı ne olur? mY A) 1/2 B) 2 C) 1/4 D) 1/3 E) 3 10. 4 2He atomunun gerçek kütlesi 6, 6466 · 10–24 g’dır. Protonun kütlesi = 1,6726 · 10–24 g nötronun kütlesi = 1,6748 · 10–24 g olduğuna göre bir 42He çekirdeğini parçalamak için gerekli enerji aşağıdakilerden hangisidir? A) 6,02 · 10–24 J B) 4,338 · 10–12 J D) 8,135 · 10–6 J E) 1,250 · 10–5 J 11. 214 82Pb izotopu bir dizi ışıma yaparak yine kendi izotopuna dönüşmüş ise yaptığı ışımalar aşağıdakilerden hangisi olabilir? A) 1α 274 C) 2,125 · 10–8 J B) 1β– C) 1α , 2β– D) 2α , 2β– E) 2α , 3β– ORTAÖĞRETİM KİMYA 11 DERS KİTABI 1. ÜNİTE BÖLÜM DEĞERLENDİRME ÇALIŞMALARININ YANITLARI 1. BÖLÜM (A) 3. ΔU = 8 J 4. w = 179 J sisteme iş yapılmaktadır. 5. ΔU= 17,0 kJ 6. a. ΔU = 35 kJ b. ΔU = –85 kJ ç. ΔU = 129 kJ d. ΔU = 47 kJ c. ΔU = 41 kJ 1. BÖLÜM (B) 1. D 2. D 3. D4. Y 5. Y 1. BÖLÜM (C) 1. B 2. A 3. E 4. A 2. BÖLÜM (A) 2. ΔH = –2559,9 kJ 3.ΔH˚Ca(OH) = –985,2 kJ/mol 2 2. BÖLÜM (B) 1. Y 2. D 3. D 4. D 3. A 4. A 2. BÖLÜM (C) 1. B 2. C 3. BÖLÜM (A) 1. a ve b’de artar. c ve ç’de azalır. 2. a. Artar. b. Azalır. c. Azalır. ç. Artar. 3. a. ΔS˚ negatif olduğundan sistem düzenliliğe doğru gider. b. ΔG˚ = –9,921 kJ’dür. Tepkime istemlidir. 3. BÖLÜM (B) 1. D 2. Y 3. Y 4. D5. D 3. BÖLÜM (C) 1. E 2. D 3. A 1. ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI (A) 6. a. ΔG˚ = –166, 216 kJ olup tepkime istemlidir. b. ΔG˚ = 541,95 kJ olup tepkime istemsizdir. c. ΔG˚ = 34,21 kJ olup tepkime istemsizdir. ç. ΔG˚ = –2074,8874 kJ olup tepkime istemlidir. 7. a. 2 b. 4 c. 1 ç. 3 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 275 8. ΔH˚NH = –45,9 kJ/mol 3 9. ΔS˚ = 285,1 J/K 10. ΔG˚ ≈ 13,73 kJ (B) 1. D 2. Y 3. D 4. D5. Y 6. D 1. C 2. E 3. A 4. D5. B 6. B 7. E 11. A 12. C 13. B 14. A15. C 16. B 17. C (C) 8. B9. C 10. C 18. D 2. ÜNİTE BÖLÜM DEĞERLENDİRME ÇALIŞMALARININ YANITLARI 1. BÖLÜM (A) 4. Tepkime denklemine göre B eğrisi O2 gazını gösteriyor. 5. Tepkime hızı derişiminin en büyük olduğu aralıkta yüksektir. Verilen grafiğe göre 0 ile 1 zaman aralığında A’da derişim en yüksektir. Dolayısıyla hız ile derişim doğru orantılıdır. 6. I numaralı enerji diyagramı a. 50 kJ/mol b. 150 kJ/mol c. İleri yöndeki tepkimenin entalpisi –100 kJ/mol, geri yöndeki tepkimenin entalpisi ise +100 kJ/mol olur. II numaralı enerji diyagramı a. 300 kJ/mol b. 100 kJ/mol c. İleri yöndeki tepkimenin entalpisi +200 kJ/mol, geri yöndeki tepkimenin entalpisi ise –200 kJ/mol olur. 7. rortalama = Derişimdeki değişme Zaman aralığı rortalama = – 0, 0174 − 0, 0400 200 − 0 rortalama = 1,13 · 10−4 mol / L s’dir. 1. BÖLÜM (B) 1. Y 2. D 3. D 4. D5. Y 3. E 4. C5. D 6. Y 7. D 8. D9. D 10. D 1. BÖLÜM (C) 1. A 2. E 2. BÖLÜM (A) = 2. a. K c = b. K c Kd c. 276 2 PH2 OPCl [H2 O ]2 [Cl2 ]2 2 2 = K p 4 PHCl PO2 [HCl]4 [O2 ] PH O [H2 O ] 2 = Kp [H2 ] PH 2 [CO2 ]10 [Mn2 + ]2 10 = Kp PCO 2 [C2 O24 − ] 5 [MnO 4− ] 2 · [H+ ]16 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. 6HCl( g) + N2( g) 3Cl2( g) + 2NH3( g) H˚ > 0 a. Tepkime endotermik olduğundan sıcaklığı artırmak b. Basıncı artırmak c. Ortamdan NH3 ya da Cl2 çekmek ç. O rtama HCl ya da N2 eklemek 4. Kc = 0,03 ’tür. 5. ≈ 0,78 mol SO3 gazı konulmuştur. 6. Sisteme 2,05 mol NO gazı eklenmelidir. 7. Sistemden 0,725 mol CO2 gazı çekilmelidir. 8. Kc = 15 ’tir. 3 2. BÖLÜM (B) 1. D 2. Y 3. Y 4. D5. D 6. D 3. A 4. D5. D 6. A 7. Y 8. Y9. Y 10. D 2. BÖLÜM (C) 1. C 2. E 2. ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI (A) 3. rCO = 1,33 · 10–2 mol / Ls ’dir. 2 4. Eag = 577,9 kJ 5. I. Tepkime nötür tanecikler arasında gerçekleştiğinden ve koparılacak bağ sayısı çok olduğundan çok yavaş, II. Tepkime sadece elektron alış verişiyle gerçekleştiğinden ve tepkimede bağ kopması olmayacağından çok hızlıdır. III. Tepkime hem elektron alış verişi hem de bağ kopması olduğundan orta hızlıdır. Buna göre; II > III > I’dir. 6. III numaralı tepkimenin aktivasyon enerjisi en küçük olduğundan hızlı gerçekleşir. 7. k = 0,2805’tir. r = k [Hb] [CO] hız denklemine göre tepkime ikinci dereceden olup aynı zamanda moleküleritesine eşittir. 8. 2NO(g) + Cl2(g) ΔH˚ = –70 kJ olduğuna göre Cl2 derişimini artırmak için 2NOCl(g) sisteme NOCl eklemek, basıncı azaltmak ve sıcaklığı artırmak gerekir. 9. Q = 1’dir. Kc > Q olduğundan sistem dengede değildir. Tepkimeye girenlerin derişimleri azalmalı, ürünlerinki ise artmalıdır. 10. Kc = 1 . 10–4 (B) 1. D 2. Y 3. Y 4. D5. D 6. Y 7. D 8. D9. Y 10. D 1. E 2. D 3. E 4. B5. C 6. B 7. E 8. E9. B 10. C 11. A 12. B 13. D 14. D15. C 16. A 17. C 18. B19. E 20. D 21. B 22. D (C) ORTAÖĞRETİM KİMYA 11 DERS KİTABI 277 3. ÜNİTE BÖLÜM DEĞERLENDİRME ÇALIŞMALARININ YANITLARI 1. BÖLÜM (A) 2. a. H2SO4 / HSO–4 , H3O+ / H2O b. HCN / CN– , H3O+ / H2O c. H2O / OH– , C6H5NH+3 / C6H5NH2 3. a. [H+] = 0,010 M pH = 2, [OH–] = 1 . 10–12 M pOH = 12 b. [H+] = 1 . 10–12 M pH = 12, [OH–] = 0,01 M pOH = 2 c. [H+] = 0,1 M pH = 1, [OH–] = 1 . 10–13 M pOH = 13 ç. [H+] = 1 . 10–11 M pH = 11, [OH–] = 0,001 M pOH = 3 6. KA = 4 . 10–9 4. 0,8 g NaOH çözülmelidir.5. pH = 2 7. KA = 2 . 10–4 8.pH < 7’dir. 9. a. Grafiğe göre başlangıçta pH’si en küçük olan asit en kuvvetli asittir. Buna göre B asidi en kuvvetli asittir. b. Grafikte her iki eğriye baktığınızda A’nın eş değerlik noktası yaklaşık 8, B’nin ise 7’dir. c. A ve B asitlerinin hacimleri eşittir. B’nin derişimi A’dan büyüktür. Bu nedenle eş değerlik noktasında onu nötrleştirmek için gerekli olan bazın hacmi daha büyüktür. 1. BÖLÜM (B) 1. D 2. D 3. D 4. Y5. D 6. Y 3. A 4. B5. E 7. D 8. Y9. Y 10. D 1. BÖLÜM (C) 1. C 2. D 2. BÖLÜM (A) 2+ – 3. a. BaF2(k) Ba (suda) + 2F(suda) 2+ –2 K = [Ba ] [F ] çç 3+ – b. Bi(OH)3(k) Bi (suda) + 3OH(suda) 2+ 2– c. BaSO4(k) Ba (suda) + SO 4(suda) Kçç = [Ba2+] [SO42–] 3+ 2– ç. Ce2(C2O4)3(k) 2Ce (suda) + 3C2O 4(suda) Kçç = [Ce3+]2 [C2O42–]3 3+ –3 K çç = [Bi ] [OH ] 4. Mg(OH)2 için Kçç = 8,99 . 10–12 5.1,77.10–9 mol çözünür. 2. BÖLÜM (B) 1. D 2. D 3. D 4. Y5. D 6. Y 3. D 4. E 7. Y 8. Y 2. BÖLÜM (C) 1. B 2. A 3. BÖLÜM (A) 2– 1. PtCl2(suda) + 2Cl–(suda) PtCl 4(suda) 2. Merkez atomu Zn ’dur. 2+ Zn Lewis asididir. Ligandı okzalat (C2O42– ) iyonudur. 2O42– C Lewis bazıdır. 3. [Zn(CN)4]2– > [Zn(NH3)4]2+ > [Zn(H2O)4]2+ [Ag(CN)2]– > [Ag(NH3)2]+ > [Ag(NCS)2]– > [Ag(H2O)2]+ 278 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 4. K = ol [ Ag(S2O3 )23 − ] [ Ag+ ] [S2O23 − ]2 3. BÖLÜM (B) 1. D 2. D 3. Y 4. Y5. D 6. Y 3. D 4. B5. A 6. E 7. D 3. BÖLÜM (C) 1. C 2. D 4. BÖLÜM (A) 1. c. Fenolftalein (pembe) kuvvetli baz, zayıf asit titrasyonu 2. c. Metil kırmızısı (sarı) kuvvetli asit, zayıf baz titrasyonu 3. V = 400 mL [Cl–] = 0,141 M 4. Kuvvetli asit komplekse etki eder. Ag(NH3)2Cl + HNO3 → AgNO3 + 2NH3 + HCl 5. a. CrO42– b. [Pb2+] = 2,53 . 10–6 M c. Evet 6. V = 64,46 mL 4. BÖLÜM (B) 1. D 2. D 3. Y 4. D5. D 3. C 4. E5. C 6. D 4. BÖLÜM (C) 1. A 2. C 3. ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI (A) 2. H3O+ / H2O, HCN / CN– ; HNO2 / NO–2, H2O / OH– ; HClO / ClO–, NH4+ / NH3; H2O / OH–, (CH3)2NH2+ / (CH3)2NH ; H2O / OH– , HF / F– ; H2PO4– / HPO42– , HSO–3 / SO32– 3. Ag2Cr2O7 için Kçç = 2,03 . 10–7 4. 1,14 . 10–7 M’dır. 5. Kristallenmez. 6. a. 3 12, 9 · 10−4 M b. 2,93 · 10–6 M 7. a. Pb2+ ortak iyon etkisi nedeni ile çözünürlüğü azalır. b. Tepkime endotermik olduğundan sıcaklığı arttırmak çözünürlüğü artırır. c. Ag+ iyonları dengedeki Cl– iyonları ile birleşeceğinden çözünürlüğü artırır. Denge, ürünler lehine kayar. ç. HCl çözeltisi çökeleği çözeceğinden denge, ürünler lehine kayar. 8. K = 8,105 9. [AgNO3] = 12,24 . 10–22 M 10. pH = 8 (B) 1. D 2. Y 3. D 11. Y 12. D 13. D 4. D5. D ORTAÖĞRETİM KİMYA 11 DERS KİTABI 6. Y 7. D 8. D9. D 10. Y 279 (C) 1. C 2. D 3. B 4. A5. E 6. B 7. E 8. D9. B 10. E 11. B 12. E 13. C 14. B15. E 16. A 17. A 18. D19. C 20. D 21. B 22. A 4. ÜNİTE BÖLÜM DEĞERLENDİRME ÇALIŞMALARININ YANITLARI 1. BÖLÜM (A) 5. 1’dir. 1. BÖLÜM (B) 1. D 11.D 2. Y 3. Y 4. Y5. D6. D 7. D8. D9. Y10. D 12. Y 1. BÖLÜM (C) 1. B 2. A3. E4. A5. C6. D 7. B8. C 2. BÖLÜM (A) 1. CuSO4(suda) + Mg(k) → MgSO4(suda) + Cu(k) 2. a.Fe + CuSO4 → FeSO4 + Cu b. Ag + Ca(NO3)2 → Tepkime vermez. c.Zn + Pb(NO3)2 → Zn(NO3)2 + Pb 3. a.Ni + Fe(NO3)3 → Tepkime vermez. b. Fe + CuSO4 → FeSO4 + Cu c.Ni + 2HCl → NiCl2 + H2 ç. Ni + CuO → NiO + Cu d. Ni + Pb(NO3)2 → Ni(NO3)2 + Pb 4. a.İki kap arasında iyon göçünü sağlar. b.Yükseltgenme ve indirgenme yarı tepkimelerini gerçekleştirir. c.Miliampermetre ya da voltmetrenin göstergesindeki sapmadan anlaşılır. 5. a.Zn yarı tepkimesi anottur. Zn → Zn2+ + 2e– Ni yarı tepkimesi katottur. Ni2+ + 2e– → Ni b.Elektron geçişi Zn elektrottan Ni elektroda doğrudur. c.Tuz köprüsünden anotta artan Zn2+ iyonlarını dengelemek için anyonlar gelir. Katotta azalan Ni2+ iyonlarını dengelemek için katyonlar gelir. 2. BÖLÜM (B) 1. D 2. Y 3. D 4. D5. Y 6. D 7. Y 8. D9. D 3. E 4. A5. E 6. C 7. A 8. B9. E 10. D 11.Y 2. BÖLÜM (C) 1. C 2. E 280 ORTAÖĞRETİM KİMYA 11 DERS KİTABI 3. BÖLÜM (A) 3. t = 5,986 saat 4. m = 8,05 . 10 g olur. 3. D 4. Y 5. D 3. D 4. C 5 5. n = 2 ’dir. 3 . BÖLÜM (B) 1. Y 2. D 6. Y 7. D 8. D9. Y 10. D 3 . BÖLÜM (C) 1. B 2. A 4. ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI (A) 5. E˚ = 0,91 V 6. E˚ = 1,23 V’tur ve istemlidir. 7. E˚ = 0,03 V 8. m = 3,152 g I 2 oluşur. 9. AgNO3 çözeltisinde NO–3 yükseltgenmez. Katot : Ag+ + e– → Ag0 Anot : 4OH– → O2 + 2H2O + 4e– (B) 1. D 2. Y 3. D 4. Y5. D 6. D 7. D8. Y 9. D 2. A 3. E 4. D 5. C 6. D 7. B8. E 9. A 12. A13. C 14. B 15. B 16. D17. C (C) 1. E 10. B 11. C 5. ÜNİTE BÖLÜM DEĞERLENDİRME ÇALIŞMALARININ YANITLARI 1. BÖLÜM (A) 7 187 99 4. a. 29 14X b. 3X c. 75X ç. 43X 1. BÖLÜM (B) 1. D 2. D 3. Y 4. D5. Y6. D 7. D8. Y9. Y10. D 1. BÖLÜM (C) 1. D 2. A3. C4. B 2. BÖLÜM (A) 1. a. a = 9, b = 4 b. b = 39 2. Radyum 3. Kütle numarası 4, atom numarası 2 azalır. 2. BÖLÜM (B) 1. D 2. D 3. D4. Y 5. D6. Y ORTAÖĞRETİM KİMYA 11 DERS KİTABI 281 2. BÖLÜM (C) 1. E 2. C3. A 3. BÖLÜM (B) 1. D 2. D 3. D 4. D5. Y6. D 7. Y8. D9. Y 3. A 4. B 3. BÖLÜM (C) 1. E 2. B 5. ÜNİTE DEĞERLENDİRME ÇALIŞMALARININ YANITLARI (A) 5. VII A grubu 6. Atom numarası 84, kütle numarası 214’tür. 7. m = 160 g (B) 1. D 2. D 3. Y 4. Y5. D 6. Y 7. D 8. D 9. D 2. C 3. A 4. A5. A 6. D 7. C 8. C9. B (C) 1. A 282 10. B 11. C ORTAÖĞRETİM KİMYA 11 DERS KİTABI SÖZLÜK –A– absorplanmış doz :Işımaya tabi tutulmuş bir numuneye depo edilen enerji. Absorplanmiş doz, rad ya da gray ile ölçülür. açık sistem :Ortam ile madde ve enerji alış verişinde bulunabilen sistem. aklimatizasyon :Yüksek irtifaya uyum. aktifleşme enerjisi :Tepkimenin oluşumu için gerekli minimum enerji. aktifleşmiş kompleks :Etkin çarpışma sonucu oluşan yüksek potansiyel enerjili atom grubu. aktiflik :Saniyedeki nükleer parçalanma sayısı. amfoterik :Hem asitlerle hem de bazlarla tepkime verme yeteneğine sahip Al, Zn, Al2O3, ZnO gibi maddeler. anot :Yükseltgenmenin olduğu elektrot. aşırı doymuş çözelti :Doymuş bir çözeltiden daha fazla çözünen içeren çözelti. –B– bazal metabolizma hızı :Dinlenme anında vücudun sadece yaşam fonksiyonlarını sürdürecek kadar gereksinim duyulan enerji. biyolojik eş değer doz :Absorplanmış dozun bağıl biyolojik etkinlik ile çarpımı. Ç– çekirdek dönüşümü :Bir atom çekirdeğinin bir başka atom çekirdeğine dönüşümü. çökelme şartı :Bir çözeltide çözünen maddenin fazlası eklenerek çöktürüp ortamdan katı hâlde ayrılması. çözünme-çökelme dengesi:Bir doygun çözeltide çözünen ve çöken iyon derişiminin dinamik dengesi. –D– denge sabiti :Kütlelerin tesiri yasasına göre yazılan ve tepkime karışımının denge bileşimini veren sayısal ifade. dinamik süreç :Bir kimyasal tepkimede ileri ve geri yöndeki tepkime hızlarının eşitlendiği konum. doğal radyoaktiflik : 238U, 234Th, 239Pu gibi elementlerin atom çekirdeklerinin kendiliğinden ışınım yapması. doymuş çözelti :Çözünen saf madde ile çözeltinin dinamik dengede olduğu çözelti. doz :Bir numunenin maruz kaldığı gerçek radyasyon miktarı. –E– ekzotermik değişme :Ortama ısı vererek gerçekleşen değişimler. elektrolitik hücre :Elektrik akımının kimyasal değişimlere neden olduğu elektrokimyasal hücre. elektroliz :Bir sıvı ya da çözeltiden elektrik akımı geçirerek kimyasal değişimlerin gerçekleştirildiği süreç. elektron yakalama :Çekirdeğe en yakın bir enerji seviyesinden bir elektronun çekirdek tarafından yakalanmasıyla oluşan radyoaktif bozunma şekli. elektron :Bir atomda çekirdeğin etrafında dolanan –1 yüklü atom altı parçacık. elektrot : Elektrokimyasal hücrede elektrolitle teması sağlayan metal iletken. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 283 endotermik değişme :Ortamdan ısı alarak gerçekleşen değişimler. entalpi değişimi :Sabit sıcaklık ve basınç altında kimyasal bir tepkimede açığa çıkan ya da alınan ısı, tepkime ısısı. entropi :Bir sistemin düzensizliğinin ölçüsü. eş değer kütle sayısı :Herhangi bir element ya da bileşiğin eş değer kütlesiyle birleşebilen ya da yer değiştirebilen miktar. eş değer kütle :Bir maddenin mol kütlesinin tesir değerlerine ya da alınan/verilen elektron sayısına bölümü. eş değerlik noktası :Titrasyonda derişimi bilinen bir çözelti ile derişimi bilinmeyen çözeltinin eş değer gram sayılarının teorik olarak eşitlendiği hacim oranları. etkin doz :Bir maddenin maruz kaldığı en çok ışın miktarı. –F– fisyon :Kendiliğinden ya da alfa, nötron gibi taneciklerle büyük atom çekirdeklerinin parçalanması. füzyon :İki atom çekirdeğinin kaynaşarak daha ağır bir çekirdek oluşturması. –G– galvanik hücre :Elektrik enerjisi üretmek için kullanılan elektrokimyasal hücre. gama ışını (γ) :Bazı atom çekirdeklerinden kaynaklanan yüksek frekanslı, kısa dalga boylu elektromanyetik ışıma. Geiger sayacı :Radyasyonların iyonlaştırıcı etkisinden yararlanarak yapılan, radyasyonu gözlemeye ve ölçmeye yarayan cihaz. Gibbs serbest enerjisi :Bir sistemin sabit sıcaklık ve basınçta iş yapmak için hazır olan enerjisi. ∆G = ∆H – T ∆S serbest enerjinin azalacağı yöndedir. Gray (Gy) :SI birim sisteminde absorplanmış doz. –H– hız yasası :Herhangi bir andaki tepkime hızını, tepkimeye giren maddelerin derişimlerini değişim hızına bağlayan eşitlik. –İ – iç enerji :Bir sistemdeki atom ya da moleküllerin sahip oldukları potansiyel ve kinetik enerjilerin toplamı. indirgenme :Bir atom, iyon ya da molekülün bir elektron kazandığı tepkime. inhibitör :Kimyasal tepkimeyi durduran ya da yavaşlatan negatif katalizör. istemli değişim :Doğal değişim, dışarıdan bir etki olmaksızın kendiliğinden gerçekleşen değişim. istemsiz değişim :Kendiliğinden gerçekleşmeyen değişim. inversiyon hızı :Sakkarozun asidik ortamda glikoz ve früktoza parçalanması olayı. izole sistem :Ortam ile madde ve enerji alış verişi olmayan sistem. izotermal sistem :Sabit sıcaklıkta olan değişim. –K– kapalı sistem :Ortam ile madde alış verişi olmayan sistem. kararlılık kuşağı :Nötron sayısının proton sayısına oranı 1 olan atom çekirdeklerinin oluşturduğu doğru. 284 ORTAÖĞRETİM KİMYA 11 DERS KİTABI katalizör :Tepkimenin dengeye gelmesini hızlandıran fakat tepkime sırasında harcanmayan madde. katot :İndirgenmenin olduğu elektrot. kimyasal denge :Bir kimyasal tepkimede tepkimeye girenler ile tepkime ürünleri arasındaki dinamik denge. kompleks oluşma-ayrışma dengesi :Bir Lewis asidi ve bir Lewis bazının koordine kovalent bağ ile birbirine bağlanmasıyla oluşan bileşiğin birleşme ve ayrışma dengesi. kompleks oluşum sabiti :Denkleştirilmiş bir kimyasal eşitliğin çözeltideki iyon karışımının birbirine oranı. kontrol çubuğu :Nükleer bir reaktörün kalbine yerleştirilen zincirleme fisyon tepkimesinin kontrol altına alınmasına yarayan bor, kadmiyom ya da zirkonyum elementlerinden yapılan ve nötronları soğurmak için kullanılan çubuk. kristallenme :Çözünenin çözeltiden kristal olarak ayrılması. kuark ve antikuark :Parçacık fiziğinde standart modele göre maddenin en küçük iki yapı taşından biri. kuvvetli asit :Sulu çözeltide tamamen iyonlaşan HCl, HNO3, HClO4 gibi asitler. kuvvetli baz :Sulu çözeltide tamamen iyonlaşan NaOH, Ba(OH)2, Ca(OH)2 gibi bazlar. –L– Le Chatelier (Lö Şatölye) ilkesi :Dinamik denge konumunda bulunan bir sisteme baskı uygulanırsa sistem bu baskının etkisini minimum yapacak yöne kayar. Etki-tepki ilkesi. lepton ve antilepton :Parçacık fiziğinde standart modele göre maddenin en küçük iki yapı taşından biri. Lewis asidi :Bir elektron çifti alan H+, Fe3+, BF3, Ag+ madde. Lewis bazı :Bir elektron çifti veren OH–, H2O, NH3, CN– madde. ligand :Bir komplekste merkez atomuna bağlanan gruplar. –M– molekülerite :Bir tepkimede tepkimeye giren molekül türünün sayısı. –N– nötralleşme reaksiyonu :Bir asidin bir bazla tepkimeye girerek bir tuz ve su molekülü oluşturması. nükleer enerji :Radyoaktif tepkimeler sonucu açığa çıkan enerji, atom enerjisi. nükleer reaktör :İçerisinde nükleer fisyon tepkimesinin kontrollü bir şekilde gerçekleştirildiği sistem. nükleer yakıt :Nükleer reaktörde enerji üretmek için kullanılan, bölünebilen izotopları içeren madde. –O– oluşum entalpisi :Bir mol bileşiğin entalpisi ile bu bileşiğin elde edildiği elementlerin en kararlı oldukları hâllerin entalpileri arasındaki fark. ortak iyon etkisi :Bir iyonu ortak olan tuzların birlikte oldukları durumda çözünürlüklerinin azalması. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 285 ortam :Sistemin dışındaki bölge. osilasyonlu reaksiyonlar :Bazı tepkimelerde ürün yeni bir tepkimeyi katalizleyebildiği için birbiriyle yarışan ardışık gerçekleşen tepkimeler. otoiyonizasyon :Bir bileşiğin kendi kendine iyonlaşması. –P– pH :Bir çözeltinin asitlik ya da bazlık derecesini tanımlayan nicel ölçü birimi. Asit ya da baz çözeltisindeki hidrojen iyonu derişiminin negatif logaritması. poliprotik asit :Çözeltide iyonlaştığında birden fazla proton (H+) verebilen H2CO3, H3PO4 gibi asitler. poliprotik baz :Sulu çözeltiden birden fazla proton alabilen N2H4 gibi bir baz. pozitron :Elektronla aynı kütleye sahip fakat zıt işaretli elektrik yükü olan temel tanecik. –R– radyoaktif ışın :Kararsız atom çekirdeklerinin kararlı hâle geçerken yaydıkları alfa, beta, gama gibi ışınlar. radyoaktif madde :Çözelti veya bileşik olarak alfa, beta, gama ışınlarından bir ya da birkaçını yayınlayarak kendiliğinden bozunmaya uğrayan çekirdeklerden meydana gelen maddeler. radyoaktif seriler :Art arda nükleer parçalanmalarla parçacıklar yayarak sonunda kararlı bir çekirdek yapısına ulaşma. radyoaktiflik :Atom çekirdeklerinin kendiliğinden radyasyon salıvermesi (ışıma yapması). reaksiyon hızı :Bir maddenin derişimindeki değişimin bu değişimin gerçekleşme süresine bölümü. reaksiyon mertebesi :Tepkime hız yasasından maddelerden birinin derişim ifadesindeki üstel sayı. redoks tepkimeleri :Yükseltgenme ve indirgenmenin olduğu bir tepkime. rotor :Döneç, pervane, yerinde dönen silindir. –S– sağaltım :Sağlığı bozulmuş olan bireyi sağlıklı duruma kavuşturma amacıyla yapılan tıbbi işlemler bütünü. sarkıt ve dikitler :Ca(HCO3)2’ın suda yavaş bozunmasıyla oluşan ve mağaralarda görülen bir çeşit kireç taşı (CaCO3) oluşumu. Sieveret (Sv) :SI sisteminde radyasyon doz birimi. sistem :Birbiriyle etkileşen ya da ilişkili olan bir bütünü oluşturan madde topluluğu. standart elektrot potansiyeli (E˚) :25 ˚C sıcaklık 1 atm basınçta 1 M’lık çözeltide indirgenen ya da yükseltgenen maddenin elektrot yüzeyinde oluşturduğu potansiyel fark. standart hidrojen elektrot (SHE) :Hidrojen iyonu derişimi 1 M ve hidrojen gazı basıncı 1 atm E˚ = 0 olarak tanımlanan standart hâldeki hidrojen elektrot. standart hücre potansiyeli:25 ˚C sıcaklıkta pil tepkimesinde tepkimeye katılan maddelerin derişimlerinin 1 M tüm gaz basınçlarının 1 atm olduğu durumdaki pil potansiyeli. standart molar entropi (S˚):298 K 1 atm basınçta saf maddenin 1 mol’ü başına düşen enerji. 286 ORTAÖĞRETİM KİMYA 11 DERS KİTABI standart oluşum entalpisi (∆H˚) :298 K sıcaklık 1 atm basınç altında 1 mol bileşiğin en kararlı hâlde bulunan elementlerinden oluşmasındaki tepkime entalpisi. standart oluşum serbest enerjisi (∆G˚) :En kararlı hâldeki elementlerinden 1 mol bileşiğin oluşumundaki tepkime standart serbest enerji değişimi. suyun iyonlaşma dengesi : Suyun kendi kendine iyonlaşmasının denge sabiti, ([H3O+ ] ve [OH– ]) iyonlarının çarpımı. suyun otoiyonizasyonu :Suyun kendi kendine iyonlaşması. tampon çözelti :Küçük miktarlarda asit ya da baz ilavelerinde pH değişimine direnen çözelti. termodinamik :Enerjinin bir şekilden başka bir şekle dönüşümlerini inceleyen bilim dalı. termonükleer patlama :Kontrolsüz nükleer füzyon sonucu oluşan patlama. tersinir tepkime :Denge ortamında bulunan bir tepkimenin her iki yönden birinde ilerleyebilmesi. tesir değeri :Tepkimede alınan ya da verilen elektron sayısı. titrasyon :Başka bir çözelti ile tepkimeye giren bir çözeltinin hacmini ölçerek yapılan bileşim analizi. titrat :Titrasyon işleminde bürete ya da erlenmayere konulan ve derişimi belli olan ayarlı çözelti. tuz köprüsü :Bir elektrokimyasal pilde iki bölme arasında birinden diğerine iyon geçişine olanak veren ve iletkenliğin sağlanmasında kullanılan doymuş potasyum nitrat, potasyum klorür vb. çözelti içeren ters U biçiminde bir cam boru. –T– –V– verim :Pratikte elde edilen verimin teorik verime oranının yüzde olarak ifadesi. volümetrik analiz :Hacim ölçümlerine dayanan analitik yöntem. vurgun :Vücut dokularında çözünmüş olarak bulunan gazların dış basınç azaldığında serbest gaz kabarcıkları hâline geçmesiyle oluşan rahatsızlığın genel adı. –Y– yarı hücre (yarı pil) :Bir elektrot ve bir çözeltiden oluşan yarı tepkime. yarı tepkime yöntemi :Redoks tepkime denklemini iki yarı tepkime denklemi şeklinde yazıp denkleştirdikten sonra iki yarı tepkime denklemini toplayarak elde edilen tepkime denklemi. yavru çekirdek :Kararsız atom çekirdeklerinin nükleer bozunma ürünü olan çekirdek. yükseltgenme :Bir atom, iyon ya da molekülün bir elektron kaybettiği tepkime. Yükseltgenme-indirgenme potansiyeli :Bir elektrokimyasal hücrede akım geçmediği durumda elektrotlar arasındaki potansiyel farkı. –Z– zayıf asit :Sulu çözeltilerinde çok az iyonlaşan HF, HCN, CH3COOH gibi asitler. zayıf baz :Sulu çözeltilerinde çok az iyonlaşan NH3, N2H4, CH3NH2 gibi bazlar. ORTAÖĞRETİM KİMYA 11 DERS KİTABI 287 DİZİN –A– açık sistem............................................................... 15 akım şiddeti............................................................ 192 aktiflenmiş kompleks................................................ 75 aktifleşme (aktivasyon) enerjisi................................. 74 aktinyum serisi........................................................ 250 aktivite............................................................ 140, 272 akümülatör...................................... 189, 190, 204, 226 alfa bozunması....................................................... 251 alfa ışınları............................................................... 271 altın......................................................... 208, 231, 258 anlık hız......................................................... 62, 63, 64 anot................................................ 190, 191, 211, 214 anot çözeltisi.......................................... 211, 216, 217 antilepton................................................................ 244 anyon.............................................. 129, 130, 161, 190 ara yüzey........................................................ 191, 277 asidik ortam................................................ 85, 86, 165 asidik tuz................................................................ 135 asit...................................................................... 67, 87 aşılama........................................................... 154, 155 atom altı parçacık........................................... 191, 241 atom kütlesi............................................ 192, 245, 247 Avogadro sayısı...................................................... 191 –B– bağ enerjisi................................................... 17, 33, 34 bağlanma enerjisi........................................... 245, 246 bakır(II) sülfat.................................................. 205, 231 baryon.................................................................... 242 baz............. 28, 34, 38, 67, 87, 127,128, 129, 130, 132 bazik ortam............................................................. 199 bazik tuz................................................................. 135 Becquerel....................................................... 249, 272 beta bozunması...................................................... 252 bileşik formül.......................................................... 195 –C– CERN...................................................................... 243 Coulomb......................................... 191, 228, 245, 246 Curie....................................................... 249, 258, 272 –Ç– çözünme......................................... 122, 129, 151, 152 çözünürlük dengesi................................ 164, 171, 172 çözünürlük sabiti.................................................... 155 –D– değerlik........................................................... 196, 197 denge bağıntısı........................................... 96, 97, 100 denge sabiti.......................................... 51, 96, 97, 100 derişim pili.............................................................. 217 deşarj...................................................................... 226 288 DESY...................................................................... 243 diprotik................................................................... 129 doldurulabilir pil...................................................... 226 dönme enerjisi.......................................................... 16 –E– ekzotermik.................................................. 27, 82, 107 ekzotermik tepkime.............................. 27, 40, 76, 108 elektrik akımı........... 123, 124, 125, 189, 190, 209, 211 elektrik alanı.................................................... 190, 269 elektrik yükü........... 125, 191, 192, 228, 242, 244, 245 elektrokimya........................................... 189, 190, 210 elektrokimyasal hücre potansiyeli.......................... 224 elektrokimyasal potansiyel sırası............................ 214 elektrolit.................. 189, 190, 191, 209, 210, 223, 226 elektron... 16,17, 75, 79, 124, 125, 168, 196, 200, 209, 217, 223, 224, 228, 242, 244, 248, 252, 254, 259, 276 elektronik enerji........................................................ 16 elektron yakalaması................................................ 253 elektrot gerilimi....................................................... 211 elektrot potansiyeli................................................. 211 element....................................... 46, 47, 195, 206, 214 endotermik tepkime.................................... 28, 76, 107 entalpi....................................... 23, 27, 40, 48, 51, 152 entropi.................................................... 12, 41, 44, 46 enzim.................................................. 62, 87, 121, 160 eş değer elektrik yükü.................................... 191, 192 eş değer kütle................................. 176, 177, 178, 180 eş değer kütle sayısı............................... 177, 178, 192 eş değerlik noktası.......................... 144, 146, 178,180 evren......................................................................... 14 –F– Faraday Yasası............................................... 191, 232 fisyon...................................................... 240, 260, 263 fiziksel denge...................................................... 92, 93 FNAL....................................................................... 243 füzyon..................................................................... 259 –G– galvanik hücre................................................ 209, 223 gama ışıması........................................... 253, 254, 255 gama ışınları................................... 253, 271, 275, 276 Geiger-Müller sayacı............................................... 269 Gibbs serbest enerjisi................................... 50, 51, 52 gluon ..................................................................... 244 Gray........................................................................ 272 –H– hacim değişmesi işi.................................................. 20 HERA...................................................................... 245 Hess Yasası.............................................................. 30 hidrojen yarı pili.............................................. 211, 212 ORTAÖĞRETİM KİMYA 11 DERS KİTABI hidroliz........................................ 62, 67, 134, 135, 146 hidronyum iyonu............................................. 125, 128 Hoffmann voltametresi .................................. 227, 228 homojen denge......................................................... 95 –İ– iç enerji........................... 16, 17, 18, 20, 27, 40, 43, 47 indirgen................................................... 205, 209, 223 indirgenme eğilimi.......................................... 206, 230 iyon göçü........................................................ 209, 210 izobarik............................................................... 14, 15 izokorik............................................................... 14, 15 izole sistem............................................................... 15 izotermal................................................................... 15 –J– James Joule............................................................. 19 –K– kapalı sistem....................................................... 15, 20 katodik koruma....................................................... 233 katot............................... 211, 223, 228, 230, 231, 239 katot çözeltisi................................................. 211, 216 katyon............................................................. 129, 130 kimyasal enerji............................ 13, 27, 223, 226, 239 konjuge asit............................................................ 129 konjuge baz.................................................... 129, 134 korozyon................................................................. 233 kurban elektrot....................................................... 233 –M– mekanik enerji.......................................................... 16 merkez atomu................................................. 133, 134 molekülerite.............................................................. 89 –O– ortak iyon etkisi...................................... 161, 163, 164 ortam............................................................... 14, 209 –Ö– öteleme enerjisi.................................................. 16, 18 –P– pil.............................. 92, 188, 209, 211, 212, 213, 214 pil potansiyeli.......................... 204, 211, 215, 216, 227 poliprotik................................................................. 129 potansiyel enerji....................... 16, 17, 39, 75, 86, 242 pozitron bozunması................................................ 252 –R– rad.......................................................................... 272 radyoaktif madde........... 249, 263, 264, 272, 273, 275 radyoaktivite................................... 249, 259, 264, 271 reaktör.............................. 23, 240, 262, 263, 268, 273 redoks..................... 176, 180, 191, 194, 196, 223, 227 rem......................................................................... 272 –S– saflaştırma.............................................................. 230 sağaltım.................................................................. 173 ORTAÖĞRETİM KİMYA 11 DERS KİTABI seri bağlı................................................................. 204 Sievert.................................................................... 272 sihirli sayılar............................................................ 247 sistem....................................................................... 14 sistem sınırı............................................................... 14 SLAC...................................................................... 243 standart indirgenme potansiyeli...................................................... 212, 214 standart model....................................................... 243 standart mutlak entropi............................................ 47 standart pil potansiyeli........................... 211, 214, 224 standart yarı pil potansiyeli...................................................... 211, 224 suyun iyonlaşma sabiti........................................... 126 –Ş– şarj.......................................................................... 225 –T– tampon çözelti................................................ 123, 147 tepkime derecesi...................................................... 88 tepkime entropisi...................................................... 47 tepkime hız denklemi.............................. 67, 69, 77, 88 tepkime hızı.................................... 62, 64, 69, 80, 107 tepkime hız sabiti.................................... 69, 71, 77, 84 tepkime ısısı............................................ 23, 27, 31, 45 tepkime mekanizması............................................... 70 termik santral.......................................... 190, 262, 264 termodinamik............................................................ 41 tersinir tepkime......................................................... 93 tersinmez tepkime.................................................... 93 tesir değeri...................................................... 176, 180 titrasyon.................................. 122, 144, 175, 177, 180 toryum serisi........................................................... 250 tuz... 134, 135, 143, 146, 151, 152, 158, 170, 171, 172 tuz köprüsü..................................... 209, 210, 212, 223 –U– uranyum serisi........................................................ 250 –V– verim................................................. 88, 105, 108, 112 volta pili.......................................................... 211, 224 vurgun..................................................................... 160 –Y– yarılanma süresi...................................................... 265 yarı tepkime.... 190, 196, 199, 211, 213, 215, 225, 228 yavru çekirdek........................................................ 248 yük denkliği............................................................ 199 yükseltgen................................ 86, 134, 205, 209, 223 yükseltgenme basamağı................. 133, 134, 195, 196 yükseltgenme eğilimi...................... 206, 208, 210, 212 –Z– zayıf asit.................................. 130, 132, 138, 140, 146 zayıf baz......................................... 130, 132, 134, 147 zincir tepkimesi....................................................... 260 289 KAYNAKÇA Atkins, P.; Jones, L.; (çev.: E., Kılıç, F., Köseoğlu, H., Yılmaz) Chemistry; Molecules, Matter and Change, W., H., Freeman and Company, New York, 1997. Brown, L., Theodore; LeMay, H., Eugene; Bursten, E., Bruce; Chemistry The Central Science, Prentice Hall, USA, 2000. Clugston, Michael; Fleming, Rosalind; Advanced Chemistry, G. Oxford University Press, Italy, 2000. Ebbing, D. Darrell; Gammon, D. Steven; General Chemistry, Houghton Mifflin Company, USA, 1999. Erdik, Dr. Ender; Sarıkaya, Dr. Yüksel; Temel Üniversite Kimyası, Cilt: 1, HÜ, Taş Kitabevi, Ankara, 1984. Fine, W., L.; Beall, H.; (çev.: Beyenal Haluk); Üniversite Kimyası, Alkım Yayınevi, Ankara, 1994. Gallagher, Marie Rose; Ingram, Paul; Complete Chemistry, Oxford University Press, China, 2001. Hart, Richard; Chemistry Matters, Oxford University Press, England, 1988. Kotz, C., John; Treichel, Paul, Chemistry Chemical Reactivity, Saunders College Publishing, USA, 1999. Mahan, Dr. Bruce; Üniversite Kimyası, Cilt: 1, 2, Hacettepe Üniversitesi Yayınları, Ankara, 1978. Masterton, L., William; Hurley, N., Cecile; Principles and Reactions, Saunders College Publishing, USA, 1993. Mortimer, Charles E.; Modern Üniversite Kimyası, (çev.: Turhan Altınata), Çağlayan Kitabevi, İstanbul, 1990. Petrucci, H., Ralph; Harwood, S., William; (Editör, Tahsin Uyar), Genel Kimya, Cilt: 1, 2, Palme Yayıncılık, Ankara,1994. Sienko, J., Michell; Plane, A., Robert; Temel Kimya, Savaş Yayınları, Ankara, 1983. Smoot, C., Robert; Price, Jack; Richard, G., Smith; Chemistry A Modern Course, Charles E. Merril Publishing Co, Ohio, 1985. Şenvar, Dr. Cemil; Temel Üniversite Kimyası, Taş Kitapçılık, Ankara, 1983. Türkçe Sözlük, Türk Dil Kurumu Yayınları, Ankara, 2005. Yazım Kılavuzu, Türk Dil Kurumu Yayınları, Ankara, 2005. Zumdahl, S., Steven; Basic Chemistry, Houghton Mifflin Company, USA, 2000. Zumdahl, S., Steven; Zumdahl, A., Susan; Chemistry, Houghton Mifflin Company, USA, 2000. 290 ORTAÖĞRETİM KİMYA 11 DERS KİTABI ELEMENTLERİN PERİYODİK TABLOSU ORTAÖĞRETİM KİMYA 11 DERS KİTABI 291