7. Bölüm: Termokimya
Termokimya: Fiziksel ve kimyasal değişimler sürecindeki enerji (ısı ve iş)
değişimlerini inceler.
sistem + çevre → evren
Enerji: İş yapabilme kapasitesi.
İş(w): Bir kuvvetin bir cismi belirli bir yol boyunca etkilemesi ile yapılır.
Hareketli bir cisim yavaşladığında ya da durduğunda iş yapar. Bir bilardo
topu diğerine çarptığında onu harekete geçirir ve bir iş yapılır.
Hareketli cismin enerjisi, kinetik enerji ’dir
Depolanmış ya da konum enerjisi ise potansiyel enerji ’dir.
ek = ½ mu2
m: kütle (kg)
u: hız (ms-1)
w= m x g x h
g: ivme (ms-2)
h: yükseklik (m)
ek = kg (ms-1)2 = kgm2s-2 (j)
w = kg.ms-2.m = kgm2s-2 (j)
ek = ½ mu2
w= m x g x h
Top düşerken potansiyel enerji → kinetik enerji’ye dönüşür.
Top yükselirken kinetik enerji → potansiyel enerji ‘ye dönüşür.
Eğer top esnek çarpışma yapsaydı KE+PE sabit kalır top sonsuza kadar
aynı seviyeye zıplamaya devam ederdi. Ancak her zıplamada potansiyel ve
kinetik enerji toplamı düşer çünkü çarpma anında sürtünme kuvvetinin
etkisiyle enerjinin bir kısmı havanın ya da yüzeyin moleküllerine aktarılır.
Aktarılan bu enerjiye ısı (termel) enerjisi denir.
ISI (q): Sistemin sahip olduğu enerji, iç enerjidir. Isı ise sıcaklık
farkının bir sonucu olarak, sistemle çevresi arasında aktarılan enerjidir.
Sıcak cismin molekülleri daha hareketlidir ve sıcak → soğuk aktarımı,
iki cismin sıcaklıkları eşitlenene kadar devam eder.
Bir maddenin sıcaklığını değiştirmek için gerekli ısı miktarı şunlara
bağlıdır;
• sıcaklık farkına
• madde miktarına
• maddenin niteliğine
Kalori (cal): 1 gr suyun sıcaklığını 1 oC yükseltmek için gerekli ısı
miktarıdır.
Isı kapasitesi (C): Bir sistemin sıcaklığını 1 oC arttırmak için gerekli ısı
miktarıdır.
1 mol maddenin ısı kapasitesi, molar ısı kapasitesi
1 gr maddenin ısı kapasitesi, özgül ısı (c) adını alır.
1 cal = 4.18 j
Isı miktarı (q) = madde kütlesi x özgül ısı x sıcaklık değişimi
q = m x c x Δt
q = C x Δt
Örnek: 237g soğuk suyun sıcaklığını 4 oC’den 37oC’ye çıkarmak için
kaç kilojoule (kj) enerji harcanır?(Suyun özgül ısısı 4.18 j g-1 oC-1’ dir)
q = m x c x Δt
q = 237 g x 4.18 j g-1 oC-1 x (37oC – 4oC)
q = 32692 j = 32.7 kj
Enerjinin korunumu yasasına göre sistem ile çevre arasındaki toplam
enerji değişimi sabittir.
qsistem + qçevre = 0
qsistem = - qçevre
Sistem tarafından verilen ısı = çevre tarafından alınan ısı
q (+) endotermik= ısı alan
q (-) ekzotermik = ısı veren
Özgül Isıların Deneysel Belirlenmesi: Kurşun İçin;
qsistem = - qçevre
qkurşun = - qsu
150 g x c x (28.8 -100)oC = - [50 g x 4.18 jg-1 oC-1 x (28.8-22) oC]
10680 c = 1421.2
c = 0.133 jg-1 oC-1
Tepkime Isısı ve Kalorimetri
Tepkime ısısı: Sabit sıcaklıkta yürüyen bir kimyasal tepkime sonucu,
sistem-çevre arasında alınıp verilen ısı miktarıdır. Kimyasal bağlar ve
moleküller arası çekimlerden ileri gelen kimyasal enerjidir. En çok
bilinen tepkime ısıları yanma reaksiyonları sonucu oluşan yanma
ısısı’dır.
Tepkime ısıları endotermik ve ekzotermik olarak ikiye ayrılır. Yalıtılmış
sistemde sıcaklık artışına neden olan ya da yalıtılmamış bir sistemde
çevreye ısı veren tepkimeye ekzotermik tepkime (qtep< 0), yalıtılmış bir
sistemde sıcaklık azalmasına neden olan ya da yalıtılmamış bir sistemde
çevreden ısı alan tepkimeye endotermik tepkime (qtep > 0) denir.
Kalorimetre bombası (sabit hacim kalorimetresi):
tepkimelerinde açığa çıkan ısıyı ölçmede kullanılır.
Yanma
qtep = -qkalorimetre
Kalorimetrenin ısı kapasitesi (C ): Kalorimetrenin sıcaklığını 1 oC
arttırmak için gerekli ısı miktarı.
qkalorimetre = kalorimetrenin ısı kapasitesi x Δt
Yalıtılmış dış ceket içinde bulunanlar
sistemi oluşturur. Yanma tepkimesi
gerçekleştiğinde kimyasal enerji ısı
enerjisine dönüşür ve sistemin yani
kalorimetrenin sıcaklığı artar.
İş: Bazı tepkimelerde sistem çevresine iş yapabilir veya sisteme karşı iş
yapılabilir. Bu durumda iş alışverişi söz konusudur. Tepkime sonucu
açığa çıkan gazın pistonu itmesi sonucu çevreye karşı iş yapılır.
Kahve fincanı kalorimetresi (sbt basınç kalorimetresi)
KClO3(k) → KCl(k) + 3/2 O2(g)
Tepkimesinde
açığa
kalorimetrenin
kapağını
çıkan
gaz
kaldırarak
atmosfer basıncına karşı genleşerek
çevreye karşı iş yapılır.
Gazların sıkışması veya genleşmesi ile
yapılan işe basınç-hacim işi denir.
Bir gazın piston – silindir düzeneğinde genleşmesi ve sıkışması işi en çok
karşılaşılan uygulamadır.
w = kuvvet x yol = - m x g x Δh
w = - (m x g/A) x Δh xA
w = - Pdış
x ΔV
w = -Pdış x (Vs-Vi)
( - ) işret kuvvet, pistonun hareket yönüne ters olduğu için
Piston sıkıştırılırsa sisteme karşı iş yapılır w (+), Vs < Vi
Piston genleşirse sistem çevreye karşı iş yapar w (-), Vs >Vi
Yapılan iş sabit basınç işi olduğundan Pdış = Piç = P
W = -P x ΔV (atm x L)
(bar x L)
1 atm.L = 101.325 j
Termodinamiğin Birinci Yasası: Enerjinin korunumu yasasıdır. Yalıtılmış
bir sistemde enerji sabit kalır yani ısı ve iş değişimi yoktur. Bir sistemde ısı
(q), iş (w) ve iç enerji değişimi (ΔU) arasındaki ilişki enerjinin korunumu
yasasına uyar.
İç enerji: Moleküllerin öteleme, titreşim, dönme enerjileri, bağ enerjilerini
içine alan kinetik ve potansiyel enerji toplamıdır. Bir sistem enerjiyi sadece
iç enerji şeklinde içerir, ısı veya iş şeklinde içermez. Isı ve iş sistemin
çevresi ile enerji değişimlerindeki bir araçtır. Isı ve iş, sistemdeki bir
değişiklik sonucu ortaya çıkar. Isı(q), iş(w) ve iç enerji(ΔU) değişimi
arasındaki ilişki aşağıdaki gibidir ;
ΔU = q + w
Termodinamiğin 1. Kanunu
• Sisteme karşı iş yapılırsa veya sisteme ısı girişi olursa q (+) ve w (+).
• Sistem çevreye iş yaparsa veya çevreye ısı verirse q (-) ve w (-).
• Yalıtılmış bir sistemde ısı ve iş değişimi olmadığından;
ΔU = 0
ΔUsis = - ΔUçev
Tersinir değişim: Sisteme dışarıdan çok küçük bir değişiklik
yapıldığında olayın tersine dönebildiği işlemlerdir. Tersinir
genleşmede yapılan iş maksimum iştir.
tersinmez değişim
w = - Pdış x (V2-V1)
w = - 2P x (3V – 1V) = - 4PV
tersinir değişim
w = -Pdış x (V2-V1)
w = - [3P x (2V-1V) + 2P x (3V-2V)]
w = - [3PV + 2PV] = - 5PV
Tepkime Isıları (∆U ve ∆H) : Bir kimyasal tepkimede, tepkenler sistemin ilk
halini ürünler ise son halini gösterdiğinde;
tepkenler → ürünler
(ilk hal)
(son hal)
Ui
Us
∆U= Us – Ui
∆U= qtep + w
(1. Yasa)
Sabit hacimdeki tepkime ısıları: Sabit hacimli
gerçekleştirilen tepkimde hacim değişmediğinden;
∆V = 0
ve dolayısıyla
bir
kalorimetrede
w= - P x ∆V = 0
∆U= qtep + (P x ∆V)
∆U= qtep (qv) sabit hacim kalorimetresinde ölçülen tepkime ısısı ∆U’ya eşittir.
Bir sistemde aynı iç enerji değişimine neden olan iki farklı yol:
Sistemin hacmi sabittir ve iç enerji
işe dönüşmez. Kalorimetrede
yanan benzin sadece ısı enerjisi
oluşturur.
Sistem iş yapar ve iç enerji
değişiminin bir kısmı iş yapmak için
harcanır. Otomobillerde yanan
benzin ısı ve iş oluşturur.
Sabit basınçtaki tepkime ısıları:
∆U= qp + w
∆U= qp - (P x ∆V)
qp = ∆U + (P x ∆V)
qp = ∆H = ∆U + (P x ∆V)
Sabit basınç altındaki tepkime ısısı Entalpi (∆H) adını alır.
İdeal gaz denklemine göre;
P x ∆V = RT ∆n
P x ∆V = RT(ns-ni)
∆n = ns-ni
Isı Miktarı İle İlgili Stokiyometrik Hesaplamalar:
Kimyasal tepkimelerde basınç-hacim işinin olabilmesi için tepkimede gaz
fazının olması gerekir. Örneğin sakkarozun yanma tepkimesini inceleyelim.
C12H22O11(k) + 12O2(g) → 12CO2(g) + 11H2O(s)
∆H = -5.65x103kj
Sabit sıcaklıkta sakkarozun yanması sırasında 12 mol O2 gazı girenlerde
12 mol CO2 gazı ürünlerde mevcuttur. Sistemin hacmini gaz fazı
belirlediğinden iki gaz da eşit hacim içerir ve bu tepkimede qv = qp olur.
Bu entalpi değeri 1 mol sakkarozun yanmasından açığa çıktığı için mol
başına entalpi değeridir ve birimi kj/mol’ dür.
Standart Haller ve Standart Entalpi Değişimi (∆Ho ):
1 bar basınç ve 298.15 K (25 oC) sıcaklıkta gerçekleşen değişimler için
ölçülen entalpi değeridir. ∆Ho sıcaklığa bağlıdır ve standart sıcaklık göz
önünde bulundurulmalıdır.
∆Ho > 0 ise endotermik → ∆Hoür > ∆Hogir .Tepkime sırasında çevreden ısı
alınır.
∆Ho < 0 ise ekzotermik → ∆Hoür < ∆Hogir .Tepkime sırasında çevreye ısı
verilir.
∆H Değerlerinin Dolaylı Yoldan Belirlenmesi: Hess Yasası
Eğer bir tepkime birden fazla ara basamaktan oluşuyorsa, toplam
tepkimenin entalpi değeri ara basamakların entalpi değerlerinin cebirsel
toplamından bulunur. Bunu yaparken Entalpi kavramının aşağıdaki
özelliklerinden faydalanırız.
•∆H bir kapasite özelliğidir.
N2(g) + O2(g) → 2 NO(g)
∆Ho = 180.50 kj
½ N2(g) + ½ O2(g) → NO(g)
∆Ho = 90.25 kj
• Tepkime tersine döndüğünde ∆H işaret değiştirir.
NO(g) → ½ N2(g) + ½ O2(g)
∆Ho = - 90.25 kj
Ör: Aşağıdaki tepkime entalpilerinden
2 SO2(g) + O2(g) → 2 SO3(g)
∆ H = – 196 kJ
2 S(s) + 3 O2(g) → 2 SO3(g)
∆ H = – 790 kJ
aşağıdaki tepkimenin entalpisini hesaplayınız.
S(s) + O2(g) → SO2(g)
∆ H = ? kJ
2 SO3(g) → 2 SO2(g) + O2(g) ∆ H = + 196 kJ
2 S(s) + 3 O2(g) → 2 SO3(g)
∆ H = – 790 kJ
2S(s) + 2O2(g) → 2SO2(g)
∆H = – 790 kJ+196 kJ = -594kJ
S(s) + O2(g) → SO2(g)
∆H = (-594kJ/2) = – 297 kJ
Standart Oluşum Entalpisi (
): Standart şartlar altında 1 mol
maddenin elementlerinden oluşumu sırasındaki entalpi değişimidir.
Saf haldeki elementlerin en kararlı hallerinde standart oluşum
entalpileri 0’dır. Bazı elementlerin en kararlı halleri aşağıdaki gibidir;
Na(k)
H2(g)
N2(g)
O2(g)
C(grafit)
Standart tepkime entalpisinin hesaplanması:
Br2(s)
Bazı bileşiklerin standart oluşum entalpileri
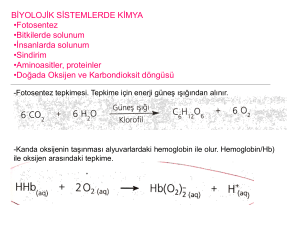
Çözeltilerde İyonik Tepkimeler: Sulu çözeltilerde gerçekleşen tepkimeler,
iyonlar arası gerçekleşen tepkimeler olduğundan bu tepkimeler için
iyonların oluşum entalpileri gereklidir.
İyonik tepkime entalpisinin hesaplanması
(iyonlar için)
Aitle bazın nötürleşme tepkimesi için;
H+(suda) + OH-(suda) → H2O(s)
∆Ho = ∆HoH2O(s) – [∆Ho OH- + ∆Ho H+ ]= -285.8 – (-230.0 + 0) = -55.8 kj