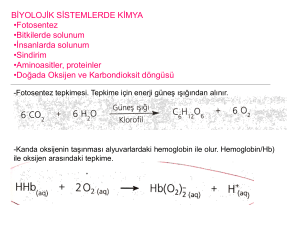
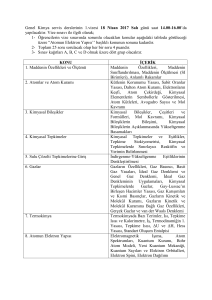
Biyolojik Reaksiyonlar
ve
Enzim Etki Mekanizmasının Moleküler
Esasları
Enzim Kinetikleri
Doç. Dr. Handan Akçakaya
Enzimler farklı amaçlarla çeşitli sektörler
tarafından kullanılmaktadır.
•
•
•
•
•
•
Deterjan sektörü (Lipazlar)
Besin sektörü (Proteazlar-papain, Karbohidrazlar)
Tekstil (Selülaz)
İlaç sektörü
Kozmatik sektörü
Tıp (tanı ve tedavi)
Enzimler farklı yönleriyle farklı bilim
dallarının ilgi alanları içine girmektedir.
*Biyokimya
*Enzimoloji
*Farmakoloji
*Biyofizik
Biyolojik olayları fiziksel ilke ve
yöntemlerle inceleyen, açıklayan bir
bilim dalı olan biyofizik; enzimleri de
yine aynı yaklaşımla ele almaktadır.
Bir başka şekilde ifade etmek
gerekirse
enzimler
biyofizik
çerçevesinde
kimyasal
kinetik
açısından incelenir.
Kinetik; enzimlerin katalizlediği reaksiyonların
hızlarını ve reaksiyon hızını etkileyen fiziksel ve
kimyasal koşulların etkisini inceler.
Reasiyon Hızı (V): Enzim etkisiyle birim zamanda
değişikliğe uğrayan substrat miktarı ya da oluşan
ürün miktarı olarak ifade edilebilir.
Enzimin
moleküler aktivitesi: Optimum
reaksiyon şartlarında 1 molekül enzim
tarafından 1 dakikada ürüne dönüşen
sustrat miktarıdır.
Spesifik
Enzim Aktivitesi: Enzimin mg
protein başına düşen ünite sayısıdır.
•Enzim Ünitesi: Optimal şartlarda
1 dakikada 1 mol substratı ürüne
dönüştüren enzim miktarıdır.
Enzim
Dönüşüm Sayısı (Turnover
sayısı):Enzim molekülü tarafından
1 saniyede ürüne çevrilen substrat
molekülü sayısıdır.
Enzimlerin Kataliz Hızını Etkileyen
Faktörler
Enzim
konsantrasyunu
Substrat
konsantrasyunu
Sıcaklık
pH
Zaman
Aktivatör ve
inhibitörler
SUBSTRAT KONSANTRASYONU
Maksimum
aktivasyon
Reaks.
Hızı
Optimum
sıcaklık
Sıcaklık
Enzimle katalize edilen reaksiyon hızı
zamanla azalır. Bunun nedeni; reaksiyon
ürünlerinin kendi aralarında birleşerek
ters yöndeki bir reaksiyonu meydana
getirmeleri, enzimin zamanla inaktive
olması, reaksiyonu önleyen maddelerin
oluşması
ve
nihayet
substratın
tükenmesidir.
Enzim etkinliğini arttıran etkenler
aktivatör;
azaltan
etkenler
ise
inhibitör olarak adlandırılır.
Enzimlerin
etki
mekanizmalarının
incelenmesinde enzim inhibitörlerinin
önemli bir rolü vardır.
[G negatif (G<0)] ise
reaksiyon ekzergoniktir ve
yazıldığı şekilde soldan sağa
doğru kendiliğinden ilerler.
[G pozitif (G>0)] ise
reaksiyon endergoniktir
ve
yazıldığı
şekilde
kendiliğinden ilerlemez.
Aktivasyon enerjisi
E+S
k1
k-1
ES
k2
V= k2 [ES]
E+Ü
Tepkime hızları
Kimyasal tepkimelerin hızı (v) zaman biriminde
dönüşüm ya da ürünün oluşum hızı olarak anlaşılır
ve mol.l-1.san-1 olarak ifade edilir. Tepkime hızı
tepken derişimine bağlı olup, bu bağlantı,
,
eşitliği ile tanımlanır. Bu eşitlikte üstel değer (n)
tepkime derecesini belirler.
Birincil derece tepkimeler;
A B
dönüşümünün gerçekleştiği basit bir örnekte,
ürün(B)nin oluşum ya da kısaca tepkime hızı tek
tepken(A)in derişimi ile orantılıdır. Bu tür
tepkimeler birincil derece tepkimeler olarak
adlandırılır:
V= k[A]
İkincil derece tepkimeler;
A ve B gibi iki farklı molekülü içeren tepkimelerde
A + B AB
Ya da aynı iki A molekülünün A ve B nin derişiminin bir
kat artması tepkime hızını bir kat artırır.
Hem A hem de B derişiminin bir kat artması ise çarpışma
olasılığını dört kat artırır. Dolayısıyla reaksiyon hızı 4
kat artar.
V= k[A] [B]
2A C
V= k[A]²
dA
- = kA
dt
• Bu eşitliğin tümlevinin (intregralinin) alınmasıyla türetilen
eşitlikler,
A
ln = -kt,
Ao
A
ya da = e-kt,
Ao
tepkenin derişimi zaman içinde üstel olarak
azalır.
Ao= tepkenin başlangıçtaki, yani (t= 0) derişimi. Bu eşitliklerden hareketle
tepkenin derişiminin yarıya indiği süre, yarılanma süresi (t1/2),
Ao
ln 2 = kt1/2
Ao
ln 2 = 0,69 = kt1/2
eşitliğine göre hesaplanabilir .
Birincil derece tepkime. Zamana göre tepken (A)derişimindeki
azalma (a) logaritmik olarak ifade edildiğinde (b) elde edilen
doğrusal bir ilişki
tepkinin birincil dereceli olduğunu ortaya koyar.
İkincil derecede tepkimelerin yarılanma sürelerinin belirlenmesinde,
eşitliği kullanılır. Bu eşitliğe göre, bu tür tepkimelerde yarılanma süresi
tepken derişimiyle ters orantılı olup, sınırlı derişimlerde tepkime
süresinin önemli ölçüde uzaması söz konusudur.
Tepkime hızı ve aktifleşme enerjisi
Moleküllerin tepkimeye girebilmeleri için bir
aktifleşme sürecinden geçmeleri gerekir.
Tepkimenin başlamasını zorlaştıran böyle bir enerji
engeli tepkime hızı üzerinde de belirleyici olur.
Birincil derecede bir tepkimede moleküllerin,
yalnızca belirli bir bölümü bir zaman diliminde
dönüşüm sürecine girebilmektedir.
İkincil derecede tepkimelerde ise iki farklı tür
molekülün aktifleşmiş temsilcilerinin karşılaşma
olasılığıyla sınırlı bir dönüşüm gerçekleşebilir.
Ortamın sıcaklığının artırılmasıyla tepkime hızlarında
gözlenen artış bu düşünceyi doğrular.
Tepkime, moleküllerin başta tabi olduğu ( ≠ simgesiyle
gösterilen) bu aktifleşme ya da geçiş sürecinden
sonra gerçekleşir.
Buna göre, tepkime, klasik termodinamiğin öngördüğü
serbest enerji değişiminin ötesinde, başlama
aşamasında aktifleşme enerjisine ( ) gereksinir.
Moleküllerin (enzimatik tepkimelerde substrat olarak
tanımlanan ligantların) tepkimeye girmeleri için gereksinilen
enerji miktarı onların enzimin aktif bölgesine geçiş yapısına
(konformasyonuna) benzeşik bir ara ürün (A*) biçiminde
bağlanmalarıyla azalır.
(A A*)
Ara ürünün bağlanma sonucu, göreli olarak, düşük enerji
düzeyli, dolayısıyla göreli kalımlı bir duruma gelmesi
aktifleşme enerjisinin azalmasında başlıca etkendir.Böylece
bir sonraki kimyasal dönüşüm olasılığı artar.
(A* B)
Katalizleyici etmenler olarak enzimlerin diğer bir özelliğini
aktif (ya da katalitik) bölgelerinde çeşitli reaktif yan gruba
sahip amino asidin bulunması belirler.
Bu grupların bazıları karbon atomu üzerinde
gerçekleştirdikleri nükleofilik etki, asidik gruplardan
ayrışan H+ iyonu ise elektron yoğun gruplar (örneğin
karboksil grubu içindeki oksijen atomu) üzerinde
elektrofilik etki yapar.
Böylece, substrat moleküllerindeki yük dağılımını bozarak,
kovalent bağların kırılmasına, ikinci aşamada ise yeni
bağların oluşumuna yol açar.
Enzimlerin katalitik bölgelerinde gerçekleşen bu tür
nükleofilik ve elektrofilik etkimelerin bir örneğini
kemotripsinin aktif bölgesinde gerçekleşen proteolitik
tepkime sürecinde görmek olasıdır.
Kemotripsin, fenilalanin ve tirosinin karboksil gruplarıyla
katıldıkları peptit bağlarını keser.
Tepkime sürecinde aktif bölgede bulunan serin kalıntısı
nükleofilik etkisiyle proteolitik kesimin gerçekleşmesinde
belirleyici rol oynar.
Kemotripsinin etki mekanizması