6 VE 7. SINIF
FEN VE TEKNOLOJİ
KİMYA KONULARI
6. SINIF KİMYA KONULARI
ELEMENTLER VE BİLEŞİKLER
FİZİKSEL VE KİMYASAL DEĞİŞİM
MADDENİN HALLERİNİN TANECİKLİ YAPISI
MADDEYİ OLUŞTURAN TANECİKLER
•
•
MADDENİN TANECİK YAPISI
Kütlesi ve hacmi olan her şeye MADDE
denir.çevremizde gördüğümüz , günlük hayatta
kullandığımız yediğimiz, içtiğimiz, soluduğumuz
kütlesi hacmi olan ve uzayda yer kaplayan her şey maddedir. Peki her şey
madde midir? -->Işık,ısı,ses,elektrik enerjisi bir madde değildir.Ölçülebilecek
bir kütleye yada hacme sahip değillerdir.
NOT: Maddelerin miktarı içerdikleri tanecik sayısına bağlıdır.Tanecik sayısı
arttığında madde miktarı da artar.Madde miktarı artarsa maddenin kütlesi de
artar.Ancak hacmi de artar diyemeyiz.Çünkü bu maddenin fiziksel haline
bağlıdır.Madde katı yada sıvı ise madde miktarı artarsa hacmi de artar eğer
gaz ise bu artış gazın bulunduğu kaba bağlıdır. MADDELERİN HACMİ DEĞİŞİR!
-->(SIKIŞMA) Kuvvet etkisi ile maddelerin hacmi değişebilir.Fakat her madde
için bu geçerli değildir.
-->Bir kitabı alalım.Elimizle kitaba bir kuvvet uygulayalım.Kitapta bir hacim
değişimi olmaz.Kitap katı bir maddedir.Tanecikleri arasındaki boşluk yok
denecek kadar azdır.Bu sebeple kuvvet uygulayarak sıkıştırmak mümkün
değildir.Ancak sünger kullanmış olsaydık süngerde hacim değişikliği meydana
gelirdi.
•
•
SONUÇ OLARAK; Katı maddeler sıkıştırılamaz.
-->İki şırınga alarak birinin içini su dolduralım diğerini ise boş
bırakalım. Boş bıraktığımız şırınganın pistonunu ittiğimizde
pistonun ileri gidebildiğini görürüz ancak içi su dolu olanın
pistonunu ittiğimizde pistonun ileri doğru gidebildiğini
gözlemleriz. Sıvı maddeler kuvvet etkisi ile sıkıştırılamazken
Gaz maddeler kuvvet etkisi ile sıkışabilmektedir.
-->(GENLEŞME) Sıcaklığın etkisi ile cisimlerin hacimleri
değişebilir.
Sıcaklık arttığında termometre içinde bulunan sıvı maddenin
yükselmesi sıvıların genleştiğini gösterir.Aynı şekilde sıcak su
içine bırakılan topun büyümesi top içindeki gazın hacminin
artmasından kaynaklanır.Bir halka içinden rahatça geçebilen bir
topun ısıtıldıktan sonra aynı halkadan geçememesi bize
katılarında genleştiğini gösterir.
MADDENIN BOŞLUKLU YAPISI
•
•
Gazlar hem kolayca sıkıştırılır hem de kolayca
genleşirler.Buna göre Maddeler kuvvet etkisi ile ya da
sıcaklık etkisi ile hacim değişimine uğrarlar. Miktarı
değişmeyen maddelerin hacminde maddenin tanecikleri
arasında boşluklar olduğu ve bu boşlukların büyüklüğünün
sıcaklık ya da kuvvet etkisi ile değiştiği sonucunu ortaya
çıkarır.
Katı ve sıvı maddeler kuvvet etkisi ile sıkışmaya ve sıcaklık
etkisi ile genleşmeye karşı, gazlara göre daha dirençlidirler
yani çık az sıkıştırılırlar ya da az genleşirler.Ancak
gazlardaki tanecikler arasındaki boşluk katı ve sıvılara göre
oldukça fazladır.
ATOM
•
•
•
•
Tüm maddeler taneciklerden oluşur.Yani tanecikler bir araya
gelerek maddeyi oluşturur.
Her maddenin bölünemez ve gözle görülemez en küçük yapı
taşına ATOM denir.
-->Tarihte maddelerin atomlardan oluştuğunu ve atomların
bölünemez olduğu fikrini ilk olarak Yunanlı filozof Demokritos
ortaya attı.Atom kelime anlamıyla “bölünemez” anlamındadır.
-->Demokritos dışında atom ile ilgili çalışmalar yapanlar;
JOHN DALTON(1819);atomların için dolu,sağlam ve
bölünmezdir.
HENRİ BECQUREL ve MADAM CURİE;Atomun daha küçük
parçacıklara bölünebileceğinin buldular.
ERNEST RUTHERFORD;Atom bölünebilir ve atomlar arasında
boşluklar olduğunu deneyle ispatladı.(1871-1937)
NİELS BOHR(1913);Kendinden önceki araştırmacıların
fikirlerini geliştirerek atomun daha da küçük parçacıklardan
oluştuğunu gösteren bir model tasarladı.
DALTON ATOM TEORİSİ
Kimyasal birleşmenin yukarıdaki iki yasasından yararlanan
John Dalton 1803 - 1808 tarihleri arasında bir atom kuramı
geliştirdi.Dalton Kütlenin Korunumu Yasası ve Sabit Oranlar
Yasasından yola çıkarak maddeyi oluşturan ve onun bütün
özelliklerini gösteren çok küçük parçacıkların olduğu yorumunu
yaparak Katlı Oranlar Kanunu’nu ortaya atmıştır:
Katlı Oranlar Kanunu, iki element birden fazla bileşik
oluşturuyorsa, birinin belli bir
miktarına karşılık, diğerinin değişken miktarları arasında küçük
ve tam sayılarla ifade edilen bir oran vardır, şeklinde
tanımlanabilir.
Katlı Oranlar Kanunu, kimyasal elementlerin atom adı verilen
parçalanamaz parçacıklardan oluştuğunu ve her elementin
atomlarının kütlesinin aynı olduğunu gösterir
Dalton’a göre:
1. Bir elementin bütün atomları şekil, büyüklük ve kütle
yönüyle aynıdır.
2. Atomlar içi dolu küreciklerdir.
3. Bilinen en küçük parçacık atomdur.
4. Atomlar parçalanamaz, yeniden oluşturulamaz.
5. Atomlar belirli oranlarda birleşerek molekülleri meydana
getirir. Elementin bütün atomları aynı olduğu gibi bir bileşiğin
de bütün atomları aynıdır.
Dalton teorisinde pek çok yanlışlık ve eksiklik olmasına
rağmen çok önemlidir.Kendisinden sonra gelen bilim
adamlarına bir kapı aralamış, fikir ortaya atarak tartışılmasını
sağlamıştır. Böylece daha doğruya ulaşma imkanı sağlamıştır
THOMSON ATOM MODELİ
Havası alınmış tüplerin iki ucuna yerleştirilen elektrotlara
(katot ve anot) yüksek gerilim uygulandığında katottan anoda
doğru ışınların yayıldığını ve bu ışınların manyetik alanda da
pozitif kutbun etkisiyle sapmaya uğradığını tespit etmiştir.
Katot ışınları adı verilen bu ışınlar negatif elektrikle
yüklüydü.Thomson, bu ışınların sapmalarından yararlanarak
yük/kütle oranlarını hesapladı. Bu oran, iyonların ölçülen
yük/kütle oranlarına göre çok büyüktü.Bu sonuca göre katot
ışını birimleri
negatif yüklü, çok küçük kütleli atom içi parçacıklardı. Atomda
negatif (-) yüklü parçacıklar olduğuna göre pozitif (+) yüklü
parçacıklarda, yani protonlarda olmalıydı.
Bu tespitlerden sonra Thomson atomda (+) ve (-) yüklü
parçacıkların var olduğunu ve bunların atomda rasgele
dağıldığını ifade etmiştir.Rasgele dağılmayı da üzümlü kek
örneğiyle izah etmiştir
RUTHERFORD ATOM TEORİSİ
Rutherford çok ince (10-6 cm) altın levhaya alfa (α) tanecikleri
(Helyum çekirdeği) göndermiştir. Bu taneciklerin çok az bir kısmı
aynen yansırken bazıları belli açılarla yansımış fakat büyük bir
bölümü aynen geçmiştir.
Yapılan deney sonucuna göre :
1. Atomdaki pozitif(+) yükler çekirdek denen çok küçük bir
bölgededir.
2. Alfa (α) taneciklerinin sapmasına yol açan yoğun kesim
çekirdekte toplanmıştır.
3. Çekirdekteki yük miktarı, bir elementin bütün atomları için
aynı, farklı atomları için farklıdır.
4. Elektronlar çekirdekten oldukça uzakta yer alırlar. Elektronların
bulunduğu hacim, çekirdeğin bulunduğu hacimden çok büyüktür.
Atomun büyük bir kısmı boşluklu yapıya sahiptir.
BOHR ATOM MODELİ
Bohr yaptığı çalışmalarda Rutherford atom modeline
göre,elektronların çekirdek etrafında dönmeleri ile enerji
yaymaları sonucunda enerjilerinin azalacağını ve çekirdek
üzerine düşeceklerini hesapladı, fakat böyle bir elektron
düşmesi gerçekleşmediği için Rutherford atom teorisinin bazı
yanlışlıklarının olması gerektiğini fark etti ve bu teoriye bazı
eklemeler yaptığı yeni bir atom modeli ortaya attı.Rutherford,
elektronların çekirdekten oldukça uzakta yer aldığını ifade
etmişti. Bohr da elektronların ne kadar uzakta yer aldıklarını,
çekirdek etrafındaki hareketlerini ve enerjilerini
incelemiştir.Araştırmaları 1H, 2He ve 3Li+ gibi küçük atom ve
iyonlar üzerinde olmuştur.Elde ettiği sonuçlar küçük atomlar
için doğru iken büyük atomlar için hatalı olmuştur.
MOLEKÜL
•
Değişik türlerde ya da aynı türlerde atomlar bir araya
gelerek “atom kümeleri” oluştururlar.
Bazen aynı tür atomlar birleşerek demir,atom gibi maddeleri
oluştururken,karbondioksit,su gibi maddelerde farklı tür
atomlar birleşmiştir. Aynı tür ve ya farklı tür en az iki
atomun birleşmesiyle oluşmuş atom kümelerine MOLEKÜL
denir.
MADDELERİN SINIFLANDIRILMASI
SAF MADDELER
Genel olarak;aynı tür taneciklerden (aynı tür atom veya aynı
tür molekül) oluşan maddelere SAF MADDE denir.
KARIŞIMLAR
Saf olmayan maddelere KARIŞIM denir.Karışımlar oluşurken
maddeler özelliklerini kaybetmezler.Tuzlu
su,limonata,hava,toprak,salata,çorba gibi.Çorba içine konan
malzemeler pişerken kimyasal yapıları değişime uğramasına
rağmen özelliğini değiştirmez.Havuç pişince de havuçtur.Belli
bir formülleri yoktur.
*Görünümleri her yerinde aynı(homojen) ya da farklı
(heterojen) olabilir.Homojen karışımlar tek bir madde gibi
görünürler.Tuzlu su,şekerli su gibi.Heterojen karışımlar ise tek
bir madde gibi görünmezler.Kumlu su yağlı su,salata gibi.
FİZİKSEL VE KİMYASAL DEĞİŞİMLER
A.FİZİKSEL DEĞİŞİM
Bir maddenin ezilme,kırılma,yırtılma,ufalanma,erime,donma
gibi olaylarla maddenin kimliğinde bir değişim olmadan
yalnızca görünümünde meydana gelen değişimlere FİZİKSEL
DEĞİŞİM denir.
Örnek:Cam kırılması,Şekerin erimesi,Kağıdın yırtılması,Mumun
erimesi,Odundan talaş elde edilmesi gibi.
B.KİMYASAL DEĞİŞİM
Yanma,çürüme,kokuşma,kömürleşme,paslanma,küflenme gibi
olayların tümünde maddenin kimliği yani cinsi değişir.Bu
şekilde gerçekleşen değişimlere KİMYASAL DEĞİŞİM denir.
Örnek:Elmanın çürümesi,mumun yanması,şekerin
pişirilmesi,kağıdın yanması,demirin paslanması gibi.
MADDELERİN HALLERİ
Tüm maddeler atom ya da moleküllerden oluşur ve bu
taneciklerin durumuna göre madde katı sıvı ve gaz halde
bulunabilir.Bu hallere ise FİZİKSEL HALLER denir.
A.MADDENİN KATI HALİ
Tahta blok,kitap,kurşun kalem,demir sopa gibi maddeler katı
maddelere örnek verilir.
Katı maddelerin özellikleri;
• Tanecikleri birbirine temas eder.
• Tanecikleri arasındaki boşluk yok denecek kadar azdır.Bu
sebeple maddenin en düzenli halidir.
• Tanecikleri yer değiştiremez.Sadece bulundukları yerde
sürekli titreşim halinde bulunurlar.Öteleme hareketi
yapamazlar.
• Belirli bir şekli vardır.Bu şekli bulundukları kabın yada
ortamın şekline göre değiştirmez.
• Sıcaklık ile genleşebilir .Sıcaklık etkisi ile tanecikler
birbirinden uzaklaşır ve hacim artar.Ama sıkıştırılamazlar
çünkü tanecikler arasındaki boşluk yok denecek kadar azdır.
NOT:Katı haldeki bir maddenin şekil almış haline CİSİM
denir.Örneğin altın bir madde iken altın bilezik bir cisimdir.
B.MADDENİN SIVI HALİ
Su,meyve suyu,süt,zeytin yağı,alkol,civa gibi maddeler sıvı
maddelere örnek verilebilir.
Sıvı maddelerin özellikleri;
• Kendilerine ait bir şekilleri yoktur.Bulundukları kabın şeklini
alırlar.(Bunun sebebi akışkanlıklarıdır)
• Akışkan halde bulunurlar.Fakat her sıvının akışkanlığı aynı
değildir.Yoğunluklarına göre değişkenlik gösterirler.
• Tanecikleri birbiri ile temas halindedir.
• Tanecikleri arasındaki boşluk katılardan daha fazla olmasına
rağmen çok azdır.
• Tanecikleri birbiri üzerinden kayarak hareket edebilirler.Yani
tanecikleri yer değiştirebilir.Bu sayede akışkan olurlar.
• Hem titreşim hem de öteleme hareketi yaparlar.
• Sıcaklık etkisi ile genleşebilir.Sıkıştırılamaz.
• Maddenin sıvı hali katı haline göre düzensizdir.
• Katı haldeki bir maddenin sıvı hale geçmesi için dışarıdan ısı
enerji alması gerekir.
C.MADDENİN GAZ HALİ
Hava,karbondioksit,oksijen birer gazdır.
Gaz maddelerin özellikleri;
• Maddenin taneciklerinin serbest hareket ettiği fiziksel hal gaz
halidir.
• Tanecikler birbirinden bağımsız sürekli hareket halindedir.
• Belirli bir şekilleri ve hacimleri yoktur.
• Tanecikleri arasındaki boşluk çok fazladır.En fazla boşluk
bulunan haldir.
• Boşluğun çok olmasından dolayı rahatlıkla
sıkıştırılabilir.Sıkışma etkisi ile sıvı hale geçebilir.Sıcaklık etkisi
ile katı ve sıvılara göre daha iyi genleşebilirler.
• Akışkan haldedir.
• Bulundukları kabın her yerine eşit oranda dağılırlar yani
bulundukları kabı doldurarak kabın şeklini alırlar.
• Hem titreşim hem de öteleme hareketi yaparlar.
Maddelerin fiziksel hallerinde meydana gelen değişimlerin
tümü fiziksel değişmedir ve meydana gelen değişimin türüne
göre farklı isimler alır.
ERİME:Maddenin katı halden sıvı hale geçmesidir.Bu sırada ısı
alır.
DONMA:Maddenin sıvı halden katı hale geçmesidir.Bu sırada
ısı verir.
BUHARLAŞMA:Maddenin sıvı halden gaz hale geçmedir.Bu
sırada ısı alır.
YOĞUNLAŞMA:Maddenin gaz halden sıvı hale geçmesidir.Bu
sırada ısı verir.
SÜBLİMLEŞME:Maddenin katı halden sıvı hale geçmeden gaz
hale geçmesidir.Bu sırada ısı alır.
7. SINIF KİMYA KONULARI
ATOMUN YAPISI
ELEMENTLER VE SEMBOLLE
FİZİKSEL VE KİMYASAL DEĞİŞİMLER
KİMYASAL BAĞ
BİLEŞİKLER VE FORMÜLLERİ
KARIŞIMLAR
ATOM
ATOMUN YAPISI
Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir.
Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif yükler ve pozitif
yüklerdir. Atomu oluşturan parçacıklar:
* Cisimden cisme elektrik yüklerini taşıyan negatif yüklü elektron,
* Elektronların yükünü dengeleyen aynı sayıda ama pozitif yüklü olan proton,
* Elektrik yükü taşımayan nötr parcacık nötron.
Atom iki kısımdan oluşur :
1-Çekirdek (merkez) ve 2-Katmanlar (yörünge; enerji düzeyi)
Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton
ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur.
Tanecik adı
Sembol
Elektrik yükü Kütle (kg)
Proton
P+
+
1,6725.10-27 kg
Elektron
e-
-
9,107.10-31 kg
Nötron
n0
0
1,6748.10-27 kg
Elektronların çekirdek etrafında dönme hızı, 2,18.108 cm/sn’dir.
Elementlerin Çekirdekte bulunan protonlar, atomun ( o elementin) tüm
kimyasal ve fiziksel özelliklerini belirler.
Proton sayısı atomlar (elementler) için ayırt edici özelliktir. Yani proton
sayısının farklı olması elementin diğerinden farklı olduğu anlamına gelir.
Elektronların bulunma olasılığının olduğu bölgelere elektron bulutu
denir.
Kimyasal olaylarda (reaksiyonlarda) yalnızca elektron sayısı değişir.
Proton ve nötron, çekirdekte bulunduğu için sayıları değişmez.
Nötr bir atom için; elektron sayısı= proton sayısı
(A.N.) Atom numarası= proton sayısı
Çekirdek yükü= proton sayısı
İyon yükü= proton sayısı – elektron sayısı (E.S.)
(K.N.) Kütle numarası= proton + (N.S)nötron sayısı (Nükleon sayısı)(atom
ağırlığı)
Atom Numarası = Proton Sayısı = Çekirdek Yükü = Elektron Sayısı
İzotop atom: Proton sayıları (atom
numaraları)aynı, nötron sayıları farklı olan
atomlara denir.
İzotop atomların kimyasal özellikleri aynı (p aynı) ,
fiziksel özellikleri farklıdır (n farklı).
Nötr halde bulunmayan, iyon halindeki hem
fiziksel kimyasal özellikleri farklıdır.
Atom Modelleri :
Atom gözle veya en gelişmiş elektron mikroskopları ile bile görülemez.
Maddenin kütlei olduğu halde maddeyi oluşturan atomların tek tek kütleleri
ölçülemez ve atomlar duyu organları tarafından algılanamaz.
Eski çağlardan günümüze kadar gözle görülemeyen atom hakkında çeşitli bilim
adamları deneyler yapmışlar, atom hakkında elde ettikleri bilgileri açıklamak
için çeşitli bilimsel modeller ortaya koymuşlardır. Atom hakkında ortaya konan
her yeni model bir önceki modelin eksikliğini gidermiştir. Atom hakkında yapılan
yeni deneyleri açıklayamayan modelin yerine de yeni bir model geliştirilmiştir.
Eski atom modellerinin bugün geçerli olmamasının nedeni, o modelleri
geliştiren bilim adamlarının iyi düşünememesinden değil, o dönemde
bilinenlerin bugün bilinenlere göre daha az olmasından kaynaklanır. (Dalton
atom modeli açıklandığında o dönemde bilinenler dikkate alındığında o modeli
geliştirmek, Bohr atom modelini geliştirmekten daha zordu).
Atom hakkında Democritus, Dalton, Thomson, Rutherford, Bohr ve De Broglie
isimli bilim adamları ve filozoflar görüşlerini ortaya koymuşlar ve günümüzdeki
atom modeli ortaya çıkmıştır. Günümüzde kullanılan atom modeli Modern Atom
Teorisi sonucu ortaya konmuştur ve bugünkü model, yeni bir model
bulununcaya kadar geçerliliğini sürdürecektir.
a)
b)
Democritus Atom Modeli (Democritus–M.Ö. 400) :
Atom hakkında ilk görüş M.Ö. 400’lü yıllarda Yunanlı filozof Democritus tarafından
ortaya konmuştur. (Teosta yaşamıştır). Democritus, maddenin taneciklerden
oluştuğunu savunmuş ve bu taneciklere atom adını vermiştir. Democritus, atom
hakkındaki görüşlerini deneylere göre değil varsayımlara göre söylemiştir.
Democritus’ a göre;
• Madde parçalara ayrıldığında en sonunda bölünemeyen bir tanecik elde edilir ve
bu tanecik atomdur.
• Bütün maddeler aynı tür atomlardan oluşur.
• Maddelerin farklı olmasının nedeni maddeyi oluşturan atomların sayı ve dizilişi
biçiminin farklı olmasıdır.
• Atom görülemez.
• Atom görülemediği için bölünemez.
b) Dalton Atom Modeli (John Dalton 1766–1844) :
Atom hakkında ilk bilimsel görüş 1803 – 1808 yılları arasında İngiliz bilim adamı
John Dalton tarafından ortaya atılmıştır. Dalton’ a göre;
• Maddenin en küçük yapı taşı atomdur. (Maddeler çok küçük, bölünemez, yok
edilemez berk taneciklerden oluşur.)
• Atom parçalanamaz.
• Atom içi dolu küre şeklindedir.
• Bütün maddeler farklı tür atomlardan oluşmuştur.
• Maddelerin birbirlerinden farklı olmasının nedeni maddeyi oluşturan atomların
farklı özellikte olmasıdır.
• Bir maddeyi oluşturan atomların tamamı birbirleriyle aynı özelliklere sahiptir.
NOT : 1- Madde fiziksel veya kimyasal değişmeye uğradığında atomlar
varlıklarını korurlar,
parçalanmaz ve yeniden oluşturulamazlar.
2- Kimyasal olaylar atomların birleşmesi veya ayrılması sonucu oluşur. Atomlar
birleşerek molekülleri oluşturur. Bir bileşiğin molekülleri tamamen birbirinin
aynısıdır.
3- Dalton İngiltereli bir kimyacı olup daha çok maddenin yapısını açıklayan atom
teorisiyle ün kazanmıştır. Bunun yanında gazların bir takım özellikleriyle ve
özellikle kısmi basınçlarıyla ilgili çalışmalarda yapmıştır.
4- Birçok elementin atomlarının ağırlıklarını kendi ilkel ortamında çalışarak
ölçmeye çalışmış ve bu ağırlıklarla ilgili bir tablo yapmıştır. Ancak daha sonra
gelişen teknik ve teknolojiyle bilim adamları tarafından atomların ağırlıklarını
yeniden ölçülmüş ve Dalton’un hazırladığı bu tablonun hatalı olduğu ortaya
çıkmıştır.
5- Sabit oranlar kanunu ve katlı oranlar kanunu olarak gördüğümüz
bileşiklerdeki kütlesel ilişkilere bakarak 1803 yılında John Dalton, maddelerin
çok çok küçük yapı taşlarının topluluğu halinde bulunduğu, fikrini ileri sürdü
Dalton atom teorisi olarak ortaya konular temel özellikler şunlardır.
• Aynı elementin atomları biçim, büyüklük, kütle ve daha başka özellikler
bakımından aynıdır. Ancak bir elementin atomları başka bir elementin
atomlarından farklıdır.
c) Thomson Atom Modeli (John Joseph Thomson
1856–1940) :
Atomun yapısı hakkında ilk model 1897 yılında
Thomson tarafından ortaya konmuştur. Thomson
atom modeli bir karpuza ya da üzümlü keke benzer.
Thomson’ a göre;
• Atom küre şeklindedir. (Çapı 10–8 cm)
• Atomda (+) ve (–) yüklü tanecikler bulunur.
• Thomson’a göre atom; dışı tamamen pozitif yüklü
bir küre olup negatif yüklü olan elektronlar kek
içerisindeki gömülü üzümler gibi bu küre içerisine
gömülmüş haldedir.
• Atomlar, daha küçük taneciklerden oluştuğu için
parçalanabilirler.
NOT : 1- İngiliz fizik âlimlerinden biri olup, elektronlar hakkındaki çalışmalardan
dolayı 1906
da Nobel fizik ödülünü almıştır. 1885’te içi boş bir cam tüp içerisinden elektrik
akımları üzerinde çalışırken ışınları tüpün negatif (katot) kutbundan geldiğini
görmüş ve ilk defa katot ışınlarını bulmuştur. Böylece elektronları da bulmuştur.
Ve sonuç olarak elektronların her atomun tabiatında var olan temel parçacıklar
olduğunu söylemiştir.
2- Dalton atom modelinde (–) yüklü elektronlardan ve (+) yüklü protonlardan
söz edilmemiştir. Yapılan deneyler yardımıyla; katot ışınlarından protonun
varlığını ortaya koymuştur. Thomson atom altı parçacıklar üzerinde çalışmalar
yaparken icat ettiği katot tüpü yardımıyla 1887 yılında elektronu keşfinden
sonra kendi atom modelini ortaya attı
3- Elektronların kütlesi pozitif yüklerin kütlesinden çok küçüktür. Bu nedenle
atomları başlıca pozitif yükler oluşturur.
4- Atomda elektriksel dengeyi sağlamak için pozitif yük sayısına eşit sayıda
elektron küre içinde dağılmıştır.
d) Rutherford Atom Modeli (Ernest Rutherford 1871–1937) :
Atomun çekirdeğini ve çekirdekle ilgili birçok özelliğin ilk defa keşfeden bir bilim
adamı Rutherforddur.
• Atom kütlesinin tamamına yakını merkezde toplanır, bu merkeze çekirdek
denir.
• Atomdaki pozitif yüklere proton denir.
• Elektronlar çekirdek etrafında gezegenlerin Güneş etrafında dolandığı gibi
dairesel yörüngelerde sürekli dolanırlar. Çekirdekle elektronlar arasında çekim
kuvveti olduğu için elektronların çekirdeğe düşmemeleri için dolanmaları
gerekir. (Yörünge daire şeklinde değil, enerji seviyesine karşılık gelen
orbitallerde dolanır).
• Elektronların bulunduğu hacim çekirdeğin hacminden çok büyüktür.
• Çekirdekteki protonların sayısı (yük miktarı) bir maddenin bütün atomlarında
aynı, fakat farklı maddenin atomlarında farklıdır.
• Çekirdekteki proton (yük) sayısı, elektron sayısına eşittir.
• Çekirdekteki pozitif yüklerin kütlesi yaklaşık atom kütlesinin yarısına eşittir.
e) Bohr Atom Modeli (Niels David Bohr 1875–1962) :
Bohr atom teorisi hidrojenin yayınma spektrumuna
dayanılarak açıklanır. Bohr’ a göre;
• Elektronlar çekirdek etrafında belirli uzaklıklardaki
katmanlarda dönerler, rasgele dolanmazlar.
• (Yüksek enerji düzeyinde bulunan elektron, düşük
enerji düzeyine geçerse fotonlar halinde ışık yayarlar).
• (Kararlı hallerin tamamında elektronlar çekirdek
etrafında dairesel yörünge izlerler).
f) Modern Atom Teorisi :
Günümüzde kullanılan atom modeli, modern atom
teorisi sonucu ortaya konmuştur. Bu teoriye göre
elektronlar çok hızlı hareket ettikleri için belirli bir
yerleri yoktur. Yani elektronların bulunduğu kabuk
kavramı yanlış bir kavramdır. Elektronların sadece
bulunma ihtimalinin olduğu bölgeler bilinebilir ve
elektronların bulunma ihtimalinin olduğu bölgelere
elektron bulutu denir. (Elektronların yörüngeleri kesin
olarak belli değildir).
NOT : 1- Bohr, elektronu hareket halinde yüklü tanecik olarak kabul edip, bir
hidrojen
atomundaki elektronun sadece bazı belirli enerjiye sahip olacağını varsayarak
teorisini ortaya attı. Bu teori hidrojen gibi tek tek elektronlu He+ , Li+2
iyonlarına da uymasına rağmen, çok elektronlu atomların ayrıntılı
spektrumlarının, kimyasal özelliklerini açıklanmasına uymamaktadır. Yine de
modern atom modelinin gelişiminde bir basamak teşkil etmiştir.
2- Modern atom teorisini kısaca şu şekilde özetleyebiliriz:
• Atomda belirli bir enerji düzeyi vardır. Elektron ancak bu düzeyden birinde
bulunabilir.
• Elektron bir enerji düzeyindeki hareketi sırasında çevreye ışık yaymazlar.
• Atoma iki düzey arasındaki fark kadar enerji verilirse elektron daha yüksek
enerji düzeyine geçer
• Atoma verilen enerji kesilirse elektron enerjili düzeyinde kalamaz daha düşük
enerji düzeyinden birine geçer. Bu sırada iki düzey arasındaki fark kadar
enerjiyi ışık şekline çevreye verir
3- Modern atom modeli dalga mekaniğimdeki gelişmelerin elektronun
hareketine uygulanmasına dayanmaktadır. Bu modelin öncüleri Werner
Heisenberg ve Erwin Schrödlinger gibi önemli bilim adamlarıdır
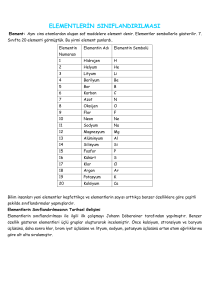
ELEMENTLER
Aynı cins atomlardan meydana gelmiş fiziksel ve kimyasal yollarla kendinden daha basit
maddelere ayrılmayan saf maddelere element denir. Şu an bilinen 115 civarı element vardır.
Fakat bunların 91 tanesi doğadan bileşik olarak elde edilirler. Geri kalanlar ise laboratuar
ortamında kimyasal yöntemlerle elde edilirler.
Yaygın Kullanılan Elementlerin Genel Özellikleri
Gümüş
Gümüş elementinin keşfi tam olarak bilinmemekle birlikte altın ve bakır elementlerinden
sonra keşfedilmiştir. Gümüşün MÖ 3100 yıllarında Mısırlılar ve MÖ 2500 yıllarında Çinliler ve
Persler tarafından kullanıldığı belirtilmiştir. Parlak, beyaz renkli katı bir maddedir.
Altın
Tarihte bilinen kayıtlara göre Mısır hükümdarları zamanında MÖ 3200 yıllarında, altın
darphanelerde eşit boyda çubuklar hâlinde çekilerek para olarak kullanıldı. Yumuşak, parlak
sarı renkte katı bir elementtir.
Cıva
Cıva elementi çok uçucu bir element olduğundan oda sıcaklığında kolayca buharlaşır.
Gümüşümsü gri renklidir ve oda koşullarında sıvı hâlde bulunur. Zehirli bir elementtir.
Herhangi bir yüzeye cıva döküldüğü zaman üzerine toz kükürt dökülmelidir.
Bakır
Turuncu renkli yumuşak bir maddedir. Normal şartlarda katı hâlde bulunur. Bakıra tarihte ilk
defa 10.000 yıl kadar önce Kıbrıs'ta rastlanmıştır.
Nikel
Nikel elementi ilk olarak 1751 yılında Axel Fredrik Cronstedt (Eksıl Fıredrik Kıronsted)
tarafından keşfedilmiştir. Gümüşümsü parlak renkte katı bir maddedir.
İyot
İyot ilk kez Barnard Courtois (Bernırd Körtis) tarafından 1811 yılında keşfedildi. Parlak
menekşe-siyah renkli katı bir maddedir.
Çinko
Çinko elementi 1746 yılında Andreas Maggrat (Andrea Magrat) tarafından keşfedilmiştir.
Mavimsi açık gri renkte, kırılgan bir maddedir. Katı hâlde bulunur.
Demir
Demir metalinin keşfi tam olarak bilinmemektedir. Grimsi parlak renkli katı bir maddedir.
Element hâldeki saf demir dövülebilir, ince levha ve tel hâline getirebilir.
Kalay
Gümüşümsü parlak gri renklidir, katı hâlde bulunur. Tarihçesi MÖ 3000 yıllarına dayanır.
Kurşun
Kurşun elementinin keşfi tam olarak bilinmemektedir. Mavimsi-beyaz renkte bulunur.
Yumuşak, ağır, zehirleyici, kolay dövülebilen katı bir maddedir.
Çok az sayıda elementin bilindiği zamanlarda, elementler, Plato'nun Eski Yunanlıların
kullandığı toprak-hava-su ve ateş sembollerinden yaptığı uyarlamalarla simgeleniyordu.
Daha sonra yeni elementler keşfedildikçe, tüm elementlerin eninde sonunda "altın"a
dönüşeceği düşüncesinden yola çıkan simyacılar tarafından, güneş (altın) merkezli
sistemdeki her gezegenin adı, bir elemente verildi. O dönemde bilinen elementlerin
bazılarının "simya" sembolleri şöyle:
Altın
Cıva
Kükürt
Sodyum
Atom kuramıyla tanıdığımız John Dalton, elementlerin simgelenmesi konusunda,
çemberlerden oluşan sembollerin kullanılmasını önerdi. Bu yönteme göre, bazı
elementlerin simgeleri şöyleydi:
Karbon
Cıva
Kükürt
Sodyum
En sonunda, 1813 yılında, Jon Jakob Berzelius isimli araştırmacı, elementlerin adları temel alınarak
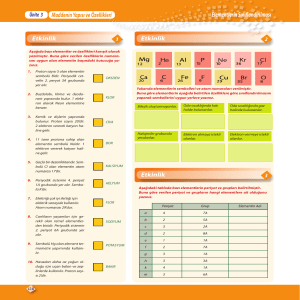
simgelenmesi fikrini ortaya attı. Hâlâ kullanılmakta olan bu yönteme göre:
1. Her element, 1 ya da 2 harften oluşan bir simgeyle ifade ediliyor ve bu simgenin ilk harfi her zaman
büyük yazılıyor.
2. Simgelerde sıklıkla, elementin İngilizce adının ilk harfi kullanılıyor.
Örneğin: H (Hidrojen: Hydrogen), C (Karbon: Carbon), N (Azot: Nitrogen)
3. Eğer elementin baş harfiyle simgelenen başka bir element varsa, bu elementin simgesinde baş harfin
yanına, İngilizce adının ikinci harfi de ekleniyor.
Örneğin: He (Helyum, Helium), Ca (Kalsiyum: Calcium), Ne (Neon: Neon)
4. Eğer elementin İngilizce adının ilk 2 harfi, bir diğer elementle aynıysa, simgesinde baş harfin yanına, bu
kez baş harften sonraki ilk ortak olmayan sessiz harf getiriliyor.
Örneğin: Cl (Klor: Chlorine) ve Cr (Krom: Chromium)
5. Bazı elementlerin simgelerinde de, bu elementlerin Latince ya da eski dillerdeki adları temel alınmış.
Bu 11 elementin simgeleri ve adları şöyle:
Na (Sodyum: Natrium)
K (Potasyum: Kalium)
Fe (Demir: Ferrum)
Cu (Bakır: Cuprum)
Ag (Gümüş: Argentum)
Sn (Kalay: Stannum)
Sb (Antimon: Stibium)
W (Tungsten: Wolfram)
Au (Altın: Aurum)
Hg (Cıva: Hydrargyrum)
Pb (Kurşun: Plumbum)
6. Çoğu yapay olarak sentezlenen yeni elementlerin simgeleriyse, atom numaralarına karşılık gelen
Latince rakamlar esas alınarak veriliyor.
Örneğin: atom numarası 116 olan Ununheksiyum elementinin simgesi olan "Uuh",
1: uni - 1: uni - 6: hexa kelimelerinin baş harflerinden oluşuyor
PERIYODIK BIZE NELER ANLATIYOR?
Periyodik tabloyu kullanarak, her element hakkında belirli bilgiler elde edebiliriz.
Örneğin, 1 kilogramlık bir karbon bloğunda kaç karbon atomu bulunduğunu tayin etmek
için, karbon atomunun bağıl atom kütlesini kullanmamız yeterli.
Bağıl Atom Kütlesi: Bir elementin, atom kütle birimi (atomic mass units: amu) cinsinden
ortalama kütlesini belirtir. Bu rakam, sıklıkla elementin izotoplarının da ortalama
kütlesini belirttiği için, ondalıklı bir sayıdır. Bir elementin bağıl atom kütlesinden atom
numarasının (proton sayısının) çıkarılmasıyla, o elementin nötron sayısı bulunabilir.
Atom Numarası: Bir atomda bulunan proton sayısı, elementi tanımlar ve atom numarası
olarak adlandırılır. Atomda bulunan proton sayısı aynı zamanda, elementin kimyasal
karakteri hakkında da bilgi verir.
Periyodik tabloda sıklıkla karşılaşılan görünüm, yandaki gibidir. Burada, element
simgesinin altında verilen "bağıl atom kütlesi", proton ve nötron sayısının toplamına
eşittir.
Element simgesinin üstünde verilen atom numarası da, proton sayısına eşit olduğuna
göre, bu iki sayının farkı bize elementin nötron sayısını verir.
Elementler benzer özelliklerine göre sınıflandırılırlar.Elementlerin benzer
özelliklerine göre sınıflandırılmasıyla oluşturulan tabloya periyodik cetvel denir.
Periyodik cetvelde, elementler artan atom numaralarına göre dizilmiş ve benzer
özellikteki elementler alt alta gelmiştir. Periyodik cetvele periyodik tablo ya da
periyodik çizelge de denir. Periyodik cetveli oluşturan yatay sıralara periyot adı
verilir.
Yatay sıralarda atom numaraları arttıkça, elementlerin fiziksel ve kimyasal
özellikleri değişir. Periyodik cetveldeki düşey sütunlara grup denir.
Aynı gruptaki elementler benzer kimyasal özellikler gösterir.Periyodik cetvelde 8
tane A ve 8 tane B olmak üzere 16 tane grup vardır. Periyodik cetvel 18
sütundan oluşur. B gruplarından üç tanesi birden 8B olarak isimlendirilir.
Periyodik cetveldeki ilk sütuna 1A grubu denir.Son sütunu ise 8A grubu
oluşturur.1 A grubu elementlerine alkali metaller adı verilir.
Hidrojen 1 A grubunda olduğu hâlde alkali metaller grubuna girmez. 7 A grubu
elementlerine halojenler, 8A grubu elementlerine soy gazlar adı verilir.
Grup ve Periyodun Bulunması
Bir elementin atom numarası biliniyorsa, bu elementin grup ve
periyodu bulunabilir.
Örneğin 7N elementinin elektronlarının dağılımı şöyledir:
7N ) )
25
Burada en son enerji seviyesindeki elektron sayısı, grup numarasını;
enerji seviyelerinin sayısı ise periyot numarasını verir.
Bu sonuçlara göre, 7N elementi 2. periyotta 5 A grubundadır.
Örnek
17Cl elementinin periyot ve grup numarasını bulunuz.
Değerlik Elektron Sayısı
Nötr bir atomun son enerji düzeyindeki elektron sayısına, değerlik elektron sayısı
denir.
Gruplara göre elementlerin değerlik elektron sayıları şöyledir:
Elementlerin Sınıflandırılması
Elementler, metaller, ametaller, yarı metaller ve soy gazlar olmak üzere sınıflara
ayrılır.
Metallerin Genel Özellikleri
Periyodik çizelgenin sol tarafında bulunurlar.
Parlak ve serttirler.
Şekil verilebilirler, tel veya levha hâline gelebilirler.
Oda sıcaklığında katı hâlde bulunurlar. Civa (Hg) hariç.
Elektriği ve ısıyı iyi iletirler.
Bileşik oluştururken elektron verirler. Elektron verince (+) pozitif yüklü olurlar.
Kendi aralarında bileşik oluşturmazlar.
Ametallerin Genel Özellikleri
Periyodik çizelgenin sağ tarafında bulunurlar.
Mat görünüşlüdürler.
Vurulunca kırılabilirler, şekil verilemezler.
Grafit hariç elektrik ve ısıyı iyi iletmezler.
Oda sıcaklığında brom sıvı, karbon, kükürt ve bor katı, diğerleri gaz hâldedir.
Metallerle yaptıkları bileşiklerde (–) negatif yüklüdürler.
Kendi aralarında bileşik oluşturabilirler.
Yarı Metaller
Periyodik çizelgede metallerle ametalleri ayıran zig-zag çizginin
sağ ve solunda bulunurlar.
Bazen metal, bazen ametal özellik gösterirler.
Bor, silisyum, germanyum, arsenik, antimon, tellür, polonyum ve
astatin yarı metallerdir.
Soy Gazlar
Kararlı yapıya sahiptirler. Elektron alma ve verme eğilimleri
yoktur.
Başka maddelerle reaksiyona girmezler.
Oda sıcaklığında gaz hâlde bulunurlar.
Periyodik çizelgenin en sağında bulunurlar.
Periyodik tabloda sıklıkla karşılaşılan görünüm, aşağıdaki gibidir.
Burada, element simgesinin altında verilen "bağıl atom kütlesi", proton
ve nötron sayısının toplamına eşittir.
Element simgesinin üstünde verilen atom numarası da, proton sayısına
eşit olduğuna göre, bu iki sayının farkı bize elementin nötron sayısını
verir.
Örnek: Kalsiyumun (Ca) nötron sayısı:
Bağıl atom kütlesi - Atom numarası = 40-20= 20'dir
Element Simgesi: Her elemente ait bir ya da iki harften oluşan
simgelerin,uluslararası geçerliliği vardır. Element simgeleri hakkında
detaylı bilgi için tıklayınız.
Elektron Dizilimi: Uyarılmamış bir atomdaki elektronların konumlarını
gösterir. Kimya bilimciler, temel fizik bilgilerine dayanarak, atomların
elektron dizilimlerine göre nasıl davranabilecekleri konusunda fikir
yürütebilirler. Elektron dizilimi, bir atomun kararlılık, kaynama noktası ve
iletkenlik gibi özellikleri hakkında bilgi verir. Atomların son enerji
düzeylerine (en dış yörüngelerine) "valans düzeyi", burada yer alan
elektronlara da "valans elektronları" adı verilir. Kimyasal tepkimelerde
birinci derecede önem taşıyan elektronlar, valans elektronlarıdır.
Bir elementin periyodik tablodaki yerine bakarak, o elementin elektron
dizilimi de anlaşılabilir. Aynı grupta (dikey sırada) yer alan elementlerin
elektron dizilimleri büyük benzerlik gösterir ve bu nedenle de kimyasal
tepkimelerde benzer şekilde davranırlar.
Yükseltgenme basamağı (sayısı): Bir elementin, bileşiklerinde
alabileceği değerliklerdir. İngilizce‘ deki "oxidation state" kullanımına
karşılık gelmektedir.
Periyodik tabloda yer alan elementler, gösterdikleri belirli ortak özelliklere göre
gruplar halinde inceleniyor. Bu gruplar hakkında kısaca bilgi vermek gerekirse:
1. Alkali Metaller:
Periyodik tablonun ilk grubunda (dikey sırasında) yer alan metallerdir.
Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir. Kolaylıkla
eriyebilir ve uçucu hale geçebilirler. Bağıl atom kütleleri arttıkça, erime ve
kaynama noktaları da düşüş gösterir. Diğer metallere kıyasla, öz kütleleri de
oldukça düşüktür. Hepsi de, tepkimelerde etkindir. En yüksek temel enerji
düzeylerinde bir tek elektron taşırlar. Bu elektronu çok kolay kaybederek +1
yüklü iyonlar oluşturabildikleri için, kuvvetli indirgendirler. Isı ve elektriği çok iyi
iletirler. Suyla etkileşimleri çok güçlüdür, suyla tepkime sonucunda hidrojen
gazı açığa çıkarırlar.
2. Toprak Alkali Metaller:
Periyodik tablonun baştan ikinci grubunda (dikey sırasında) yer alan
elementlerdir. Sıklıkla beyaz renkli olup, yumuşak ve işlenebilir yapıdadırlar.
Alkali metallerden daha az tepken (tepkimelere girmeye eğilimli) karakterde
olmalarının yanında, erime ve kaynama sıcaklıkları da daha düşüktür.
İyonlaşma enerjileri de alkali metallerden daha yüksektir. Toprak elementleri
ismi, bu gruptaki elementlerin toprakta bulunan oksitlerinin, eski kimya
bilimciler tarafından ayrı birer element olarak düşünülmesinden gelir.
3. Geçiş metalleri:
Sertlikleri, yüksek yoğunlukları, iyi ısı iletkenlikleri ve yüksek erime-kaynama
sıcaklıklarıyla tanınırlar. Özellikle sertlikleri nedeniyle, saf halde ya da alaşım
halinde yapı malzemesi olarak kullanılırlar. Geçiş elementlerinin hepsi, elektron
dizilimlerinde, en dışta her zaman d orbitalinde elektron taşırlar. Tepkimelere
giren elektronlar da, d orbitalindeki elektronlardır. Geçiş metalleri sıklıkla
birden fazla yükseltgenme basamağına sahiptir. Çoğu, asit çözeltilerinde
hidrojenle yer değiştirecek kadar elektropozitiftir. İyonları renkli olduğu için,
analizlerde kolay ayırt edilirler.
4. Lantanidler:
Geçiş metallerinin bir alt serini oluştururlar ve toprakta eser miktarda
bulunmaları nedeniyle, "nadir toprak elementleri" olarak da isimlendirilirler. En
önemli ortak özellikleri, elektron değişiminin yalnızca 4f orbitaline elektron
katılımıyla gerçekleşmesidir. Özellikle +3 değerlikli hallerinde, birbirlerine çok
benzeyen özellikler gösterirler. Kuvvetli elektropozitif olmaları nedeniyle,
üretilmeleri zordur. Çoğunun iyon hallerinin karakteristik renkleri vardır.
5. Aktinidler:
Bu elementlerin en önemli ortak özelliği, elektron katılımının 5f orbitalinde
gerçekleşmesidir. Geçiş metallerinin bir alt serisi konumundadırlar ve doğada
çok ender bulunabilirler.
ELEKTRON ALIŞVERİŞİ VE SONUÇLARI:
Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde
Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü
her üçünün de en dıştaki katmanları tamamen dolu durumdadır.
1.Katmanda en çok 2 elektron bulunması durumu dublet kuralı, 2. ve 3. katmanlarda en çok 8
elektron bulunması durumu oktet kuralı olarak adlandırılır. Helyum dublet, neon ve argon oktet
kuralına uyar. Oktet veya dublet kuralına uyan atomlar kararlı yapıya sahiptir.
Atomlar elektron alarak veya vererek kararlı yapıya
ulaştıklarında artık, iyon olarak adlandırılırlar.
Nötr bir atomun elektron almış veya vermiş haline iyon denir.
Atom elektron alarak kararlı hale geçerse elektron
sayısı>proton sayısı olur. Bu tür iyonlara negatif(-) yüklü iyon
(anyon)denir.
Atom elektron vererek kararlı hale geçerse elektron
sayısı(+)yüklü iyon (katyon)denir.
Atomlar kaybettikleri elektron sayısı kadar +yüklü, kazandıkları
elektron sayısı kadar – yüklü olurlar. Not: iyon yükü =proton
sayısı- elektron sayısı
Eğer iyon anyonsa sembolün sağ üst kısmına – işareti konur ve
aldığı elektron sayısı yazılır. Katyonsa + işareti konur ve sayısı
yazılır.
FİZİKSEL VE KİMYASAL DEĞİŞMELER
Fiziksel değişmeler:
Maddenin dış görünüşü ile ilgili, ölçülebilen hissedilebilen veya
gözlenebilen özelliklere fiziksel özellikler denir. Renk, koku, tat,
kırılganlık, öz kütle, katı,sıvı ve gaz halde olma gibi özellikler fiziksel
özelliklerdir.
Maddenin fiziksel özelliklerinde meydana gelen değişmelere fiziksel olay
denir. Örnekler:
• Kömürün toz haline gelmesi
• Demirin tel ve levha haline gelmesi
• Kağıdın yırtılması
• Suyun buharlaşması
• Şekerin suda çözünmesi
*** Bu olaylar sonunda maddenin iç yapısında değişme olmaz.
*** Bütün hal değiştirme olayları fiziksel değişmedir.
Kimyasal değişmeler:
Bütün maddeler atom veya molekül dediğimiz küçük taneciklerden oluşur.
Maddelerin atom veya molekül yapılarıyla ilgili özelliklere kimyasal özellikler
denir. Yanma, çürüme, paslanma, bileşik yapma gibi özellikler kimyasal
özelliklerdir.
Buna bağlı olarak bu özelliklerde meydana gelen değişmelere de kimyasal
değişmeler denir. Kısaca maddenin iç yapıdsında meydana gelen değişmeler
kimyasal değişmelerdir. Örnekler:
• Kağıdın yanması
• Mumun yanması
• Sütün ekşimesi
• Yumurtanın bozulup çürümesi
• Demirin paslanması
• Fotosentez olayı
• Solunum olayı
*** Kimyasal değişmeler sonucunda maddeler başka maddelere dönüşür.
*** Bütün yanma olayları kimyasal değişmedir.
KIMYASAL TEPKIMELER
Kimyasal değişmelere ya da kimyasal tepkimelere kimyasal reaksiyonlar da denir.
Kimyasal tepkime sırasında değişim geçiren maddelere reaksiyona girenler, yeni oluşan
maddelere de reaksiyondan çıkanlar ya da ürünler adı verilir.
Demirin paslanması sırasında havadaki oksijenle demir birleşerek demir oksit denilen
pası oluşturur. Burada demir ve oksijen girenler, demir oksit ise çıkan üründür.
Kimyasal tepkimeler sırasında meydana gelen değişiklikler, kimyasal denklemlerle
gösterilir.
Kimyasal denklemlerde giren ve çıkan maddeler formüllerle gösterilir. Örneğin kömür
yanarken içindeki karbon havadaki oksijenle birleşir ve karbon dioksit gazı açığa çıkar.
Bu olaya ilişkin tepkime denklemi şu şekilde yazılır:
C
+
O2 CO2
Kömür Oksijen
Karbon dioksit
Girenler
Çıkanlar (Ürün)
Denklemden de görüldüğü gibi tepkimeye giren ve çıkan maddeler arasına ok konur.
Giren maddeler okun sol tarafında, çıkanlar ise sağ tarafında bulunur.
Kimyasal denklemler tepkime hakkında bir çok bilgiyi basit bir şekilde göstermemize
yarar. Örneğin; C + O2 CO2 tepkimesi bize 1 karbon atomuyla 2 oksijen atomunun
birleşerek 1 karbon dioksit molekülü oluşturduğunu gösterir.
TEPKIME ÇEŞITLERI
Kimyasal tepkimeler gerçekleşirken bazı maddeler arasında bağlar koparken, bazı maddeler arasında yeni
bağlar oluşur. Kimyasal tepkimeler oluş şekline göre sınıflandırılabilir:
1. Sentez (Birleşme) Tepkimeleri:
Element ya da bileşiklerin birleşmesiyle yeni bir madde oluşumuna sentez (birleşme) tepkimesi adı verilir.
Örnek; karbon dioksit ve suyun oluşumu:
C + O2 CO2
2 H2 + O2 2 H2O
2. Analiz (Ayrışma) Tepkimeleri:
Bir bileşik kendini oluşturan daha basit maddelere ayrışıyorsa, buna analiz (ayrışma) tepkimesi adı verilir.
Örnek; suyun ve potasyum kloratın (KClO3) ayrışması:
2 H2O 2 H2 + O2
KClO3 KCl + 3/2O2
3. Yer Değiştirme Tepkimeleri:
Bir element ve bir bileşik arasında ya da iki farklı bileşik arasında oluşan tepkimelerde, atomlar birbiriyle
yer değiştirip yeni bileşikler oluşturabilir. Bu tip tepkimelere yer değiştirme tepkimesi adı verilir.
Örneğin magnezyum ile çinko oksit tepkimeye girdiğinde magnezyum oksit ve çinko oluşur.
Mg + ZnO MgO + Zn
Tepkime denkleminde de görüldüğü gibi elementler yer değiştirerek yeni bileşikler oluşturur.
Tepkime Denklemlerinin Denkleştirilmesi
Kimyasal tepkimelere giren maddelerle çıkan maddeleri oluşturan
atomların cinsleri ve sayıları aynıdır. Dolayısıyla bir tepkime denkleminin
sol ve sağ tarafında aynı cins ve aynı sayıda atom bulunmalıdır. Böyle
tepkime denklemlerine denkleştirilmiş tepkime denklemi adı verilir.
Eğer bir tepkime denklemi denk değilse, formül ve sembollerin önüne
uygun sayılar yazılarak tepkime denkleştirilir.
Örneğin su, oksijen ve hidrojenin birleşmesiyle oluşur. Fakat oksijen ve
hidrojen tek atom hâlinde değil, O2 ve H2 molekülleri şeklinde ve gaz
hâlde bulunur. Suyun tepkime denklemini H2 + O2 H2O şeklinde
yazarsak denk bir tepkime denklemi yazmış olmayız. Çünkü giren atom
sayısı ile çıkan atom sayısı aynı değildir. Girenler tarafında 2 tane O
atomu, çıkanlar tarafında ise 1 tane O atomu vardır.
Denklemi denkleştirmek için H2 ve H2O’nun önüne 2 yazalım;
2 H2 + O2 2 H2O
4 adet H
4 adet H
2 adet O
2 adet O
Bu durumda girenler ve çıkanlar denkleşmiş olur.
Tepkimelerde Kütlenin Korunumu
Bir kimyasal tepkimede, tepkimeye giren maddelerin
kütlelerinin toplamı, çıkan maddelerin kütlelerinin
toplamına eşittir. Demirin kükürt ile tepkimesinden
demir sülfür oluşur. Demir sülfürün tepkime
denklemi şu şekildedir.
Fe + S FeS
56 32
88 g
Giren Çıkan
kütle = 56 + 32 = 88 g kütle = 88 g
KİMYASAL BAĞLAR
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal
bağlar meydana gelir. Üç çeşit temel bağ vardır.
Bir metal bir ametalle etkileştiği zaman elektronlar metal atomundan ametal
atomuna aktarılır ve bunun sonucunda bir iyonik(veya elektrovalent) bileşik meydana
gelir. Atomlardan elektron kaybıyla oluşan pozitif iyonlara katyon denir. Atomların
elektron kazanarak oluşturdukları negatif iyonlar da anyon olarak isimlendirilir. Bu
iyonlar bir araya getirildiklerinde bir kristal oluşturmak üzere birbirlerini çekerler.
1 - İYONİK BAĞ;
A gruplarındaki elementlerin bileşikleri çoğu kez elementlerin simgeleri ile birlikte
değerlik elektronlarını gösteren noktalar kullanılarak ifade edilir. Değerlik elektronları
baş grup(A grubu) elementlerinin kimyasal tepkimelerinde kullanılan elektronlardır.
2 - KOVALENT BAĞ;
Elektronları bağlamak için girilen yarışma, iyon bağında olduğu kadar şiddetli
değilse atomların var olan dış elektronlar paylaşılır ve bir ortaklaşma bağı ya da Kovalent
Bağ oluşur.
Ametal atomları etkileştiği zaman kovalent bağlarda bir arada tutulan moleküller oluşur.
Bu atomlar elektron çekimi bakımından birbirlerine benzediklerinden, kovalent bağların
oluşması sırasında herhangi bir elektron aktarımı olmaz.
Bunun yerine elektronlar ortaklaşa kullanılırlar. Kovalent bir bağ genellikle iki atom
tarafından parçalanmış ters spinli bir elektron çifti içerir.
Kovalent bağlar yapısına göre ikiye ayrılır:
2.a -Apolar Kovalent Bağ:
Aynı cins iki ametal atomunun birleşmesiyle oluşur. Apolar kovalent bağa en iyi
örneklerden biri, iki oksijen atomunun elektronlarını ortaklaşa kullanarak
oluşturdukları bağıdır. (Şekil 2) Bu bağlarda ortaklaşa kullanılan elektronlar eşit
paylaşıldığından dolayı molekülün pozitif veya negatif kutbu yoktur.
(hidrojen), (oksijen), (klor)...
.b -Polar Kovalent Bağlar:
İki farklı cins atomun bir araya gelmesiyle oluşur. Bu bağlarda
ametallerden biri ortaklaşa kullanıldığından dolayı molekülün bir
ucu pozitif (+), diğer ucu negatif (-) yüklenir. Suyu oluşturan
Hidrojen ve Oksijen moleküllerinin son orbitallerindeki
elektronların ortak kullanılmasıyla oluşan Polar Kovalent bağ şekil
3’de görülmektedir. (su), , (karbondioksit)...
3 - METALİK BAĞLAR;
Metallerin iyonlaşma enerjileri ile elektronegatiflikleri oldukça düşüktür. Bunun
sonucu olarak metal atomlarının en dış elektronları nispeten gevşek tutulur. Metalik bir
kristalde, en dış elektronları çıkarılmış atomlardan ibaret olan pozitif iyonlar kristal
örgüde ilgili yerlerde bulunur ve en dış elektronların örgünün her tarafında serbestçe
hareket etmesiyle de kristaldeki atomlar bir arada tutulur. Diğer bir deyişle örgü
içersinde dağılan ve kristalin bütününe ait olan elektron bulutu ile pozitif iyonlar
arasındaki elektrostatik çekim metalik bağı oluşturmaktadır.
Bant kuramı bu bağlanma şeklini, tüm kristalin her tarafını kapsayan moleküler
orbitaller cinsinden açıklar.
Metalik katıların çoğunda hareketlidirler. Bunun sonucu olan artı iyonlar,genişlemiş
bir üçboyutlu diziliş içinde yer alırlar;ama elektronlar yöresizleşir. Bu maddelerin yüksek
ısı, iletkenliği, dayanıklılık, yüksek kaynama noktası, yüksek yoğunluk, renk ve elektrik
iletkenliği gibi özelliklerinin bir çoğu, hareketli elktronlardan kaynaklanır. Yalnızca birkaç
iyon yığışması şeması uygulanabilir ve X ışını çözümlemesi,metal iyonlarının genişlemiş
örgülü yapı içinde kazandığı bağ uzunlukları ve geometrik şekiller konusunda ayrıntılı
bilgi sağlar. Basit küp biçimi şekiller, ortada başka bir iyonun bulunduğu küp biçimi
şekiller ve altıgen yığışma, en sık rastlanan şekillerdir. Metal alaşımları,erimiş haldeki
metallerin karıştırıldıktan sonra dikkatlice soğutulmasıyla elde edilir. Bu yolla oluşan
gereçlerin özellikleri bileşenlerinin özelliklerinden genellikle çok farklıdır.
4 - VAN DER WAALS BAĞLARI;
Kapalı kabuklu iki kararlı molekülde ‘Van Der Waals’ güçleri ve
‘London’ güçleri adı verilen zayıf güçler aracılığıyla etkileşmeye girebilir.
İki molekülün elktron bulutları etkileştiğinde zayıf bir itme ortaya çıkar;
‘Van Der Waals gücü’ adı verilen bu dengesizleştirici etkileşme
sonucunda,elektron dağılımı kısa süre bozulabilir ve anlık(kalıcı
olmayan) bir çift kutup momenti oluşabilir.
Bu geçici çift kutuplar(London güçleri) etkileştiğinde, ‘Van Der Waals’
itmesine alt edebilen küçük çaplı bir dengesizleşme gerçekleşir ve
zayıf,kimyasal olmayan bir bağ oluşur. Bu bağlanma biçimi en
çok,kapalı kabuklu ender gaz atomlarının etkileşmelerinde ve küçük
moleküllerin düşük sıcaklıklarda birleşimsel bağlanmasında önem taşır.
Bu bağ zayıftır (gücü genellikle ortaklaşma bağının binde biri kadardır).
Sıvı azot ve helyum gibi düşük sıcaklıklı kriyojenik maddelerin yada
bunların daha da düşük sıcaklıktaki kat hallerinin özellikleri, bu tür zayıf
etkileşmelerden kaynaklanır.
5 - HİDROJEN BAĞLARI;
Bazı hidrojen içeren bileşiklerde moleküller arası çekim kuvvetleri
olağan üstü yüksektir. Bu çekim kuvvetleri, hidrojenin atom çapı küçük
ve çok elektronegatif olan elementlere kovalent bağlı olduğu bileşiklerde
görülür. Bu bileşiklerde elektronegatif element bağı elektronlarını öyle
kuvvetlice çeker ki hidrojen önemli miktarda kısmi + yük kazanır.
Aslında,hidrojen elementinin perdeleyici elektronları olmadığından
burada hidrojen hemen hemen çıplak bir protondur.
Bir molekülün hidrojen atomu ve diğer bir molekülün elektronegatif
elementinde bulunan paylaşılmamış elektron çifti birbirini çekerek bir
hidrojen bağı oluşturur. Her hidrojen atomu küçük boyutlu olduğundan
ancak bir hidrojen bağı yapabilir.
Bir çok ortaklaşma molekülünde bulunan çift kutup momentlerinin
etkileşmesinin yol açtığı zayıf çekim güçleri, kararlılaşmaya ve
birleşimsel bağlanmaya neden olabilir.
BILEŞIKLER VE FORMÜLLERI
Farklı elementlere ait atomların belirli oranlarda bir araya
gelerek bağ yapmasıyla oluşan yeni ve saf maddeye bileşik
denir.
Bileşikler kendilerini oluşturan elementlerden tamamen farklı
fiziksel ve kimyasal özelliklere sahiptir.
Bileşikler moleküler yapıda olabilecekleri gibi, olmayabilirler de.
Örneğin su, su moleküllerinden oluşur. Çünkü suyu oluşturan
hidrojen ve oksijen arasında kovalent bağ vardır.( amonyak,
karbondioksit, basit şeker, kükürtdioksit gibi.)
Bileşikler moleküler yapıda değilse, bileşiği oluşturan atomlar
arasında iyonik bağ vardır. Bu tür bileşiklere iyonik yapılı bileşik
denir. İyonlar yığınlar halinde düzgün bir örgü oluşturur.
Bileşikler içerdikleri elementlere göre adlandırılır. Bileşikleri
göstermek için element sembollerini kullanırız. Bunlara formül
denir. Bir bileşik formülünde, o bileşiği oluşturan elementlerin
sembolleri ve o elementin atomlarından kaç tane olduğu yazılır.
Örneğin:
CO de 1 karbon atomu, 2 oksijen atomu,
HCI’de 1 hidrojen atomu, 1 klor atomu,
C H O ‘da 6 karbon, 12 hidrojen, 6 oksijen atomu vardır.
BILEŞIKLERIN KIMYASAL YOLLA
AYRIŞTIRILMASI:
1.Isı ile ayrıştırma:
Bazı bileşikler ısıtıldığında kimyasal değişmeye uğrayarak daha
basit maddelere ayrışabilirler.
Örnek: Civaoksit ---> Civa + Oksijen
2. Elektrik enerjisi ile ayrıştırma (Elektroliz)
Elektroliz kaplamacılıkta yaygın olarak kullanılan bir yöntemdir.
Elektrolizle bir bileşik kendisini oluşturan elementlere ayrıştırılabilir.
Örneğin su elektrolizle ayrışabilen bir bileşiktir.
Elektroliz.Su---> Hidrojen + Oksijen
Elementlerden Bileşik Oluşturulması;
Elementlerin birleşerek bileşik oluşturmasına sentez denir. Hidrojen ve oksijenin birleşmesiyle su oluşur,
bu olaya suyun sentezi denir.
Bitki yapraklarında ışıkla gerçekleşen su ve karbondioksitin birleşmesi olayına fotosentez denir.
• Elementler bileşik haline gelirken kendi özelliklerini kaybederler. Yeni özelliklerde madde oluşur.
• Elementler bileşik oluştururken belli oranlarda birleşirler.
• Bileşikler kendilerini oluşturan elementlerin özelliklerini taşımaz.
Demir + Kükürt ısı Demir sülfür
Demirsülfür kendini oluşturan maddelerin özelliklerini taşımaz Örneğin mıknatıs demir tozlarını çekerken
demir sülfür bileşiğine etki etmez.
Kömürün yanması:
Kömür karbon içerir, kömürün oksijenle yanması sonucunda karbondioksit oluşur. Karbondioksit bir
bileşiktir.
Karbon + Oksijen Karbondioksit
KARIŞIMLAR
Karışım: Birden çok element veya bileşiğin kimyasal özelliklerini
kaybetmeden bir araya getirilmesiyle oluşan madde topluluğuna karışım
denir.
Solduğumuz hava; içtiğimiz gazoz, süt, çorba, şerbet, karışık meyve
suları, çay; yeraltındaki petrol; deniz suyu; kireçli su, zeytinyağlı su,
böcek ilaçları, deodorant, lehim, sel suyu, kolonya, çelik… günlük
hayatta karşılaştığımız birkaç karışımdır.
Karışımlarda birden çok element olabilir örneğin; hava(oksijen,
karbondioksit, azot… gazları)
Karışımlarda birden çok bileşik bulunabilir örneğin; Deniz suyu(su ve
tuz)
Karışımlarda birden çok element ve bileşik olabilir örneğin;sel(su ve
toprak)
Karışımların Özellikleri;
1) Karışımı oluşturan maddeler kendi özelliklerini kaybetmezler. Tuzlu suda su
ve tuz tadı algılanır
2) Karışımı oluşturan maddelerin miktarları arasında belirli bir oran yoktur.
İstenildiği oranda karıştırılabilirler. Az şekerli veya çok şekerli çay olur.
3) Karışımların erime ve kaynama noktaları sabit değildir.
Tuzlu su bazen 103 bazen 110 derecede kaynar,donma noktası ise -5 veya -10
derece olabilir
4) Karışımların belirli bir kimyasal formülleri yoktur.
Oksijen elementi: O ile su bileşiği H2O ile gösterilir fakat karışımlarda madde
isimleri hepsi birden söylenir.
5)Karışımlar fiziksel yollarla oluşur ve bileşenlerine fiziksel yollarla ayrılırlar.
Karışımlar görünümlerine göre iki çeşittir
1.Heterojen (Adi) karışım: Karışımı oluşturan
Maddeler karışımın her yerine eşit olarak dağılmadıysa Heterojen (Adi) karışım denir
Her yerinde aynı özellikleri göstermeyen karışımlardır
Katı katı karışımı; toprak
katı-sıvı karışımı; su-kum,su-tebeşir tozu
sıvı-sıvı karışımı: su-zeytin yağı,su-benzin karışımı,süt içindeki yağ damlacıkları örnek
verilir.
2.Homojen karışımlar:
Her tarafında aynı özelliği gösteren,tek bir madde gibi olan karışımlara denir.Homojen
karışımlara genel olarak çözeltiler de denir.
Tuzlu su,hava,kolonya,24 ayar altın örnektir.Metallerin eritilip karıştırılmasıyla oluşan
homojen karışımlara ise alaşım denir. Pirinç, lehim, tunç, bilezik, çelik
Heterojen ile Homojen karışımın farkları;
Heterojen karışımda,
- Karışan maddeler gözle görülür ve kolayca ayırt edilebilir,
- Karışımın üst tarafı ile alt tarafı arasında yoğunluk farkı görülür. örneğin
ayranını dibi daha yoğun olur,
Sel suyunun dibi daha çamurludur.
Çözeltiler(homojen karışım) ;
- Tek madde gibi görülür karışan maddeleri dışarıdan fark
edemeyiz.Örneğin çayın içindeki çözünmüş şekeri fark edemeyiz.
- Bekletilse dahi çökelti oluşmaz,
- Süzgeç kağıdından geçerler,
- Genellikle saydam ve akışkan olur,
- Çözeltiler katı,sıvı ve gaz halde olabilir
Bir çözelti oluşması sırasında çözücü ile çözünen maddenin tanecikleri arasında etkileşim olur. Çözücü
tanecikleri çözünecek maddenin tanecikleri etrafını kuşatıp en küçük yapısına kadar ayırarak çözeltiyi
meydana getirir bu olay çözünme olayı olarak da adlandırılır.
Moleküllü çözeltiler
Alkol ve şeker gibi maddeler suda çözündüklerinde tamamen parçalanma gerçekleşmez, iyonize
olmazlar.
Şeker molekülleri birbirinden ayrılır,her şeker molekülünün etrafına su molekülleri kuşatmış olarak
fiziksel değişimi görülür
Alkollü su ve şekerli su çözeltileri moleküler çözünme yapar.
İyot alkolde çözünür, çözünen madde moleküllerine ayrılır
İyonlu çözeltiler
Asit,baz ve tuzlar suda çözündüklerinde (+) ve ( – ) iyonlarına yani katyon ve anyonlarına ayrılarak suyun
her tarafına eşit dağılırlar.
Örneğin yemek tuzu su içine dökülürse tuzu oluşturan sodyum(Na) ve klor(Cl) iyonlaşır.Na+ ve Cl– halini
alarak su içinde homojen dağılırlar
ÇÖZELTI ÇEŞITLERI
Çözeltiler; fiziksel hallerine göre, çözücü ve çözünen madde miktarına göre ve çözünen maddenin azlığına,
çokluğuna göre ve elektrik akımını iletip iletmemesine göre olmak üzere dört şekilde gruplandırılabilir.
a) Fiziksel Hallerine Göre Çözeltiler :
Çözeltiler, çözücü maddenin haline göre katı–katı, sıvı–sıvı, gaz–gaz, katı–sıvı, sıvı–katı, sıvı–gaz
çözeltileri olarak gruplandırılırlar.
1- Katı – Katı Çözeltileri :
Çözücü ve çözünen katıdır.
Alaşımlar katı – katı karışımından oluşan homojen karışımlardır (çözeltilerdir).
• Bakır + Kalay → Bronz (Tunç)
• Bakır + Çinko → Pirinç
• Kurşun + Kalay → Lehim
• Nikel + Krom + Demir + Karbon → Paslanmaz Çelik
2- Sıvı – Sıvı Çözeltileri :
Çözücü ve çözünen sıvıdır.
• Su + Alkol → Kolonya
• Su + Asetik Asit → Sirke
3- Gaz – Gaz Çözeltileri :
Çözücü ve çözünen gazdır.
• N + O + CO2 + H2O Buharı → Hava
4- Sıvı – Katı Çözeltileri :
Çözücü sıvı, çözünen katıdır.
• Tuz + Su → Burun Damlası (Tuzlu Su)
• Şeker + Su → Şerbet (Şekerli Su)
5- Katı – Sıvı Çözeltileri :
Çözücü katı, çözünen sıvıdır.
• Gümüş + Cıva → Amalgam
6- Sıvı – Gaz Çözeltileri :
Çözücü sıvı, çözünen gazdır.
• Oksijen + Su → Deniz Suyu
• Karbondioksit + Su → Kola, Gazoz, Soda
b) Çözücü ve Çözünen Madde Miktarına Göre Çözeltiler :
Çözeltiler, çözücü ve çözünen madde miktarına göre doymuş, aşırı doymuş ve doymamış çözeltiler olarak
üç grupta incelenir.
1- Aşırı Doymuş Çözelti :
İçerisinde çözebileceğinden daha fazla çözünen madde bulunduran çözeltilerdir. Fazla olan madde
zamanla çözünmeden dibe çöker.
2- Doymamış Çözelti :
İçerisinde çözebileceğinden daha az çözünen madde bulunduran çözeltilerdir
3- Doymuş Çözelti :
İçerisinde çözebileceği kadar çözünen madde bulunduran çözeltilerdir.
c) Çözünen Maddenin Azlığına ve Çokluğuna Göre Çözeltiler :
Çözeltiler, çözünen maddenin azlığına veya çokluğuna göre derişik ve
seyreltik çözeltiler olarak iki grupta incelenir.
1- Derişik Çözelti :
Çözücüsü az, çözünen fazla olan çözeltilerdir.
2- Seyreltik Çözelti :
Çözücüsü fazla, çözüneni az olan çözeltilerdir.
d) Elektrik Akımını İletip İletmemesine Göre Çözeltiler :
Çözeltiler, elektrik akımını iletip iletmemesine göre elektrolit ve elektrolit
olmayan çözeltiler olarak iki grupta incelenir.
1- Elektrolit Çözeltiler :
Suda çözündüğü zaman iyonlarına ayrılan iyonik yapılı bileşiklerin suda çözünmeleri ile
oluşan çözeltiye elektrolit çözeltiler denir.
İyonik yapılı bileşikler suda çözündüklerinde ayrılan (+) ve (–) iyonlar (elektrik yüklü
tanecikler), çözeltide hareket ederek elektrik akımının iletilmesini sağlar.
Asit, baz ve tuzların sulu çözeltileri elektrik akımını iletebilir ve bu nedenle elektrolit
çözeltilerdir.
• Tuz (NaCl) bileşiği suda çözündüğünde (+) yüklü Na+ iyonu yani katyonu ile (–) yüklü
Cl– iyonu yani anyonu oluşur. Na+ ve Cl– iyonlarının tuzlu sudaki hareketi ile elektrik
akımı iletilebilir.
Tuz (NaCl) + Su → Tuzlu Su
• Asit + Su → Asitli Su (Sirke)
• Baz + Su → Bazik Su (Çamaşır Suyu)
2- Elektrolit Olmayan Çözeltiler :
Suda çözündüğü zaman iyonlarına ayrılamayıp sadece moleküllerine ayrılan kovalent
yapılı bileşiklerin suda çözünmeleri ile oluşan çözeltiye elektrolit olmayan çözeltiler denir.
Kovalent yapılı bileşikler suda çözündüklerinde moleküllerine ayrılır ve moleküller nötr
olduğu için elektrik akımını iletmez.
• Şeker + Su → Şekerli Su
• Su (Musluk Suyu)
ÇÖZÜNME OLAYI NASIL OLUR?
Çözücü ve çözünen maddelerin birbiri içerisinde iyonlarına veya moleküllerine kadar ayrılmasına çözünme denir.
Bir maddenin moleküllerinin veya iyonlarının, diğer maddenin moleküllerinin veya iyonlarının arasına girmesine
çözünme denir.
Çözünme olayında;
• Çözücü ve çözünen maddeleri oluşturan tanecikler yani moleküller veya iyonlar çözünme olayı gerçekleşmeden
önce birbirlerine çok yakındır.
• Çözücü maddelerin tanecikleri ile çözünen maddelerin tanecikleri yani molekülleri veya iyonları etkileşir.
• Çözünme olayında, çözücü ve çözünen maddenin tanecikleri yani molekülleri veya iyonları arasında elektron alış
verişi veya ortaklaşması gerçekleşmediği için çözücü ve çözünen madde sadece fiziksel değişime uğrar, kimyasal
değişime uğramaz ve maddelerin kimliklerinde değişme meydana gelmez.
• Çözünme sonrasında, çözücü ve çözünen tanecikleri birbirlerinin etrafını sardığı için çözücü ve çözünen
tanecikleri çözeltinin her tarafında eşit miktarda bulunur.
• Çözücü madde tanecikleri, çözünen madde taneciklerinin etrafını sardığı için çözücü maddenin tanecikleri de
birbirinden ayrılır.
• Çözünen madde moleküler yapılı ise, çözücü maddenin molekülleri, çözünen maddenin moleküllerinin arasına
girerek çözünen maddenin moleküllerinin etrafını sarar ve çözünen maddenin moleküllerine kadar ayrılmasını
sağlar. Ayrılan moleküller çözücünün her tarafına eşit oranda dağılır.
• Çözünen madde iyonik yapılı ise, çözücü maddenin molekülleri, çözünen maddenin (+) ve (–) iyonlarının
arasındaki iyonik bağı zayıflatır ve (+) ve (–) iyonlar birbirinden ayrılır. Çözücü maddenin molekülleri, ayrılan (+) ve
(–) iyonların arasına girerek bu iyonların etrafını sarar ve çözünen maddenin iyonlarına kadar ayrılmasını sağlar.
Ayrılan iyonlar çözücünün her tarafına eşit oranda dağılır.
Örnekler :
1- Su – sirke çözeltisinde, çözünen olan sirke, moleküler
yapılı maddedir. Çözücü olan su molekülleri, çözünen olan
sirke moleküllerinin etrafını sararak sirke moleküllerinin
birbirinden uzaklaşmasını yani çözünmesini sağlar.
2- Su – şeker çözeltisinde, çözünen olan şeker, moleküler
yapılı maddedir. Çözücü olan su molekülleri, çözünen olan
şeker moleküllerinin etrafını sararak şeker moleküllerinin
birbirinden uzaklaşmasını yani çözünmesini sağlar.
- Çözünme Hızına Etki Eden Faktörler :
Çözücünün çözünme hızının artması için, çözücü moleküllerinin birim zamanda daha fazla çözünen
molekülünün veya iyonunun etrafını sarması gerekir.
a) Sıcaklık :
Çözeltilerde, sıcaklığın arttırılması, katı ve sıvı haldeki maddelerin çözünme hızını arttırır, gaz çözünen
maddenin çözünme hızını azaltır.
Sıcaklık arttırıldığında çözücü ve çözünen maddeyi oluşturan taneciklerin hızları artar. Hızlı hareket eden
çözücü maddenin tanecikleri, çözünen maddenin taneciklerin etrafını daha hızlı sararak çözünme olayını
hızlandırır.
b) Tanecik Boyutunu Küçültme :
Çözeltilerde, çözünen maddenin tanecik boyutunun küçültülmesi, yani maddenin ufalanıp toz haline
getirilmesi katı haldeki maddelerin çözünme hızını arttırır.
Çözünen maddenin tanecik boyutu küçültüldüğünde, çözücü maddenin tanecikleri, daha fazla çözünen
maddenin taneciği ile temas eder yani etrafını sarar ve bu nedenle çözünme olayı hızlanır.
c) Sallama, Karıştırma :
Katı ve sıvıların çözünme hızını arttırır, gazlarınkini azaltır.
d) Basınç Artışı :
Katı ve sıvıların çözünme hızına etki etmez,gazların çözünme hızını arttırır.
e) Çözücü Miktarı :
Çözücü miktarı artarsa genelde çözünme hızı artar.
f) Çözünen Miktarı :
Çözünen miktarı artarsa genelde çözünme hızı azalır.
ALAŞIMLAR VE ÖZELLIKLERI
Alaşım:İki veya birkaç maddenin muhtelif oranlarda beraberce eritilerek
meydana getirilen karışıma alaşım denir.
Alaşımda cıva bulunursa malgama adını alır. Cıva yalnız demir ve platin
madenleriyle malgama yapmaz. Madenlerin çeşitli özellikleri vardır. Bazı
madenler yumuşak yalnız başına kullanılamazlar. Altın ve gümüş gibi.
Bazı madenler ise döküme elverişli değildirler. Bakır gibi, bazıları kolayca
aşınabilirler. Bazıları dayanıklı veya dayanıksızdırlar. Bazıları yüksek ve
bazıları da alçak sıcaklıkta ergirler. İşte madenlerin gösterdikleri bu
çeşitli özelliklerden ötürü teknikte layıkıyla faydalanmak için ve daha
elverişli olmalarını temin amacıyla alaşımlar yapıldı. Mesela bakır
döküme elverişli olmadığından bakırı kalayla birlikte eriterek tunç ve
çinko ile eriterek pirinç alaşımları yapıldı. Alaşımlar; kendisini meydana
getiren madenlerin erime noktalarından daha aşağı derecede eridikleri
için teknikte kullanılmaya elverişlidirler.
EN ÖNEMLI ALAŞIMLAR
Bakır alaşımları
Bakır + Kalay ---> Tunç
Bakır + Çinko ---> Pirinç
Bakır + Çinko + Nikel ---> Mayakor
Bakır + Çinko + Kalay ---> Teknik eserler tuncu
Bakır + Alüminyum ---> Fen aygıtlarında, deniz valfleri, pervaneler, dümenler.
Altın, gümüş ve altın, bakır alaşımları
Altın + Gümüş ---> Yeşil altın
Altın + Gümüş ---> Solmuş yaprak altını
Altın + Gümüş ---> Su yeşili altını
Altın + Gümüş + Bakır ---> Roz altını
Altın + Gümüş + Bakır ---> Sarı, çok beyaz, değerli İngiliz altını
Kurşun alaşımları
Kurşun + Kalay ---> Lehim
Kurşun + Arsenik ---> Saçma ve mermi
Kurşun + Antimon + Kalay ---> Matbaa harfleri
Demir alaşımları
Krom + Demir ---> Tel-silindir yatakları
Demir + Nikel ---> Fen aletleri
Demir + Nikel ---> Ampul teli
Demir + Molibden ---> Yüksek hızlı dökümde
Demir + Volfram ---> Parça dökümünde (tungsten çeliği)
Demirin fosforlu, karbonlu, silisyumlu, çelikleri de önemli alaşımlardandır.