KARIŞIMLAR
Karışım nedir?
İki ve ya da daha fazla maddenin kimyasal bağ
oluşturmadan bir arada bulunmasıyla karışımlar oluşur.
Karışımlar yeni ve saf madde değildir.
Bu nedenle karışımların belirli bir kimyasal formülü
yoktur.
Karışımlar
Heterojen
karışım
Homojen
karışım
HETEROJEN KARIŞIM: Karışımı oluşturan maddelerin
karışımın her tarafına eşit olarak dağılmamıştır.
HOMOJEN KARIŞIM: Karışımı oluşturan maddelerin
karışımın her tarafına eşit olarak dağılmasıyla oluşan
karışımdır.
Örneğin; çay içine şeker attığımızda, şeker çay içinde
çözünür. Şeker karışımın her tarafında eşit oranda
bulunduğundan bu karışım homojen karışımdır.
Örneğin; toprak heterojen bir karışımdır. Toprağı
oluşturan maddeler, toprağın her katmanında aynı
oranda olmadığından dolayı bu karışım heterojendir.
KARIŞIMLAR
HETEROJEN KARIŞIM
HOMOJEN KARIŞIM
ÇÖZELTİ
Kum+su
Tebeşir tozu+ su
Zeytinyağı + su
Toprak
Ayran
Süt
Tuz+ su
Şeker+su
Hava
Kolonya
Gazoz
Soda
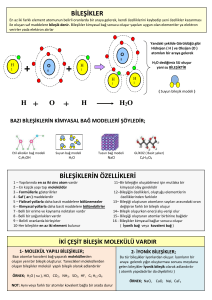
Bileşikler ve Karışımların Farkları
Nelerdir?
ÇÖZELTİLER
Bir maddenin başka bir madde içerisinde gözle
görülemeyecek şekilde dağılmasıyla oluşan homojen
karışımlara çözeltiler denir.
Katı, sıvı ve gaz halindeki maddeler bir araya gelerek çözeltileri
oluştururlar.
Çözeltiler çözücü ve çözünen maddelerden oluşurlar.
Çözeltilerde miktarı fazla olan madde yani karışımın halini
belirleyen madde çözücü, miktarı az olan madde çözünen
maddedir.
Çözeltiler fiziksel hallerine bağlı olarak
katı,sıvı,gaz halde bulunur.
SIVI ÇÖZELTİLER
SIVI _KATI
SIVI_SIVI
SIVI_GAZ
Burun damlası
(saf su+ tuz)
Kolonya
(su + alkol)
Gazoz
(su+karbondioksit)
Şerbet
(su + şeker)
Sirke
(su +asetik asit)
Deniz suyu
(su+ oksijen)
Çözünme Nedir?
Çözücü ve çözünen maddelerin birbiri içerisinde
iyonlarına veya moleküllerine kadar ayrılmasına
çözünme denir.
Çözünme Nasıl Gerçekleşir?
• Çözücü maddelerin tanecikleri ile çözünen
maddelerin tanecikleri yani molekülleri veya iyonları
etkileşir.
• Çözünme sonrasında, çözücü ve çözünen tanecikleri
birbirlerinin etrafını sardığı için çözücü ve çözünen
tanecikleri çözeltinin her tarafında eşit miktarda
bulunur.
Çözünme Nasıl Gerçekleşir?
• Çözünen madde moleküler yapılı ise, çözücü
maddenin molekülleri, çözünen maddenin
moleküllerinin arasına girerek çözünen maddenin
moleküllerinin etrafını sarar
• Çözünen madde iyonik yapılı ise, çözücü maddenin
molekülleri, çözünen maddenin (+) ve (–)
iyonlarının arasındaki iyonik bağı zayıflatır ve (+) ve
(–) iyonlar birbirinden ayrılır. Çözücü maddenin
molekülleri, ayrılan (+) ve (–) iyonların arasına
girerek bu iyonların etrafını sarar ve çözünen
maddenin iyonlarına kadar ayrılmasını sağlar.
ÖRNEKLER
Su – sirke çözeltisinde, çözünen olan sirke, moleküler
yapılı maddedir. Çözücü olan su molekülleri, çözünen
olan sirke moleküllerinin etrafını sararak sirke
moleküllerinin birbirinden uzaklaşmasını yani
çözünmesini sağlar.
Su – şeker çözeltisinde, çözünen olan şeker, moleküler
yapılı maddedir. Çözücü olan su molekülleri, çözünen
olan şeker moleküllerinin etrafını sararak şeker
moleküllerinin birbirinden uzaklaşmasını yani
çözünmesini sağlar.
Su – tuz çözeltisinde, çözünen olan tuz iyonik yapılı
maddedir. Çözücü olan su molekülleri, çözünen olan tuz
bileşiğindeki (+) ve (–) iyonlar arasındaki iyonik bağı
zayıflatır ve (+) yüklü Na iyonu ile (–) yüklü Cl
iyonlarının arasına girerek bu iyonların birbirinden
ayrılmasını yani çözünmesini sağlar.
ÇÖZÜNME HIZINA
ETKİ EDEN FAKTÖRLER
1. SICAKLIK
2. TANE BOYUTU
3. KARIŞTIRMA
Çözünme Hızı Nasıl
Artırılır?
Sıcaklık
Arttırılır
Tane Boyutu
Küçültülür
Çözelti
Karıştırılır
ÇAYINIZI KAÇ ŞEKERLİ
ALIRSINIZ?
Çözeltiler, çözünen maddenin azlığına veya çokluğuna
göre derişik ve seyreltik çözeltiler olarak iki grupta
incelenir.
1- Derişik Çözelti :
Çözücüsü az, çözünen fazla olan
çözeltilerdir.
2- Seyreltik Çözelti :
Çözücüsü fazla, çözüneni az olan
çözeltilerdir.