Mezenkimal Kök Hücre İzolasyon Teknikleri ve
İmmünolojik Parametreler
Noushin Zibandeh, Ph.D Candidate
6. Kök Hücre sempozyumu
5-6 Mayıs 2017
Marmara Üniversitesi Spor Bilimleri Fakültesi Anadolu Hisarı Yerleşkesi
İÇERİK
Mezenkimal Kök Hücre (MKH) ve İmmünmodülasyon
Adipoz, Dental Dokulardan ve Kemik İliğinden Kök Hücre
İzolasyonu
Farklı Dokulardan ve Kandan Lenfosit İzolasyon Tekniği
MKH ve Lenfosit Ko-kültürü (Hücre Kültürü)
Flowsitometri Analizleri
MKH’lerin GFP İle İşaretleme Tekniği
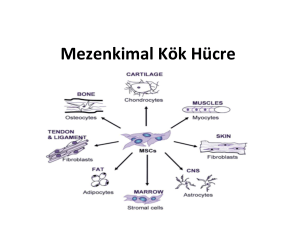
MEZENKİMAL KÖK HÜCRELER (MKH)
İlk kez Friedenstein ve arkadaşları
tarafından 1974 yılında izole
edilmişlerdir.
Fibroblastoid görünümlüdür.
Kemik iliği, yağ dokusu, tendonlar,
plasenta, kordon kanı, ve dişten
temin edilebilmektedirler.
Non-homojen bir topluluktur.
MEZENKİMAL KÖK HÜCRELER (MKH)
-
+
Uluslararası Hücresel Tedavi Derneği
Kriterleri (ISCT)
MKH
CD105, CD73 , CD90,
CD146, CD29
CD45, CD34, CD14,
CD19, CD11b
Kondrojenik, Adipojenik ve
Osteojenik
Plastik yüzeylere yapışma
özellikleri
• Yüksek farklılaşma potansiyelleri ile birlikte immünsüpresif özellikleri
DC
MKH
Hücre hücre kontağı
Mediyatörler
NK
B
T
MEZENKİMAL KÖK HÜCRELERİN
İMMÜNMODÜLASYONDAKİ ETKİSİ
MEZENKİMAL KÖK HÜCRELER ve ANTİJEN
SUNAN HÜCRELERİN ETKİLEŞİMİ
MKH kaynağının laboratuara getirilmesi ve
izolasyon yapılması
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı ve hasta bireylerden doku ve kan alınması
Adipojenik
Doku ve kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
İstatistiksel Analiz
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
MKH İZOLASYONUNDA KULLANILAN
BESİYERİ İÇERİĞİ
Minimum Essential Medium (MEM-)
Fetal Bovine Serum (FBS)
Penisilin/Streptomisin
Büyüme faktörleri (FGF, IGF,…)
%10
%1
5ng/ml
CMEM
BESİYERİ İÇERİKLERİ
– İnorganik Tuzlar
– Aminoasitler
– Vitaminler
– Glukoz, D-Glukoz, HEPES,
Piruvik asit, Phenol Red (indikatör), L-glutamin
pH: 7.3-7.6
Farklı
Oranlarda
DENTAL KÖK HÜCRELER (DKH)
ADİPOZ DOKUDAN KÖK HÜCRE
İZOLASYONU
Kollajenaz
eklenir ve 14 saat 37C
de inkübe
edilir.
%40’lık FBS
/DMEM
/P S ile
sulandırılır ve
ekilir.
%10FBS
içerir ve
800gde10d
k santrifüj
edilir.
Pellet iki
kere PBS ile
yıkanılır ve
400gde 10dk
santrifüj
edilir.
Pellet
160mM
NH4cl de
resüspanse
edilir ve
10dk oda
ısısında
bekletilir.
Pellet PBSde
resüspanse
edilir. 70µm
ve 40µm ‘lik
filtrelerden
geçirilir.
SIÇAN KEMİK İLİĞİNDEN KÖK HÜCRE
İZOLASYONU
1
2
3
4
5
6
7
8
9
MKH İZOLASYON TEKNİKLERİ
A
C
B
D
A) P0- 3.gün: 20X
B) P1- 3.gün: 20X
C) P2- 3.gün: 10X
D) P3- 3.gün: 10X
Mezenkimal kök hücrelerinin P0, P1, P2 ve P3 deki morfolojik görünümü.
PASAJLAMA
%10 FBS İLE
İNAKTİVASYON
HÜCRE DONDURMA
HÜCRE
DONDURMA
HÜCRE ÇÖZDÜRME
HÜCRE
ÇÖZDÜRME
VERİMLİ MKH İZOLASYONU İÇİN
İnokülasyon; 5x103 hücre/cm2
Doku kaynağına uygun tipte yıkım enzimi/süre
Kök hücre gelişimine uygun besiyeri seçimi
Uygun büyüme faktörleri
Kontaminasyondan koruma
MKH kaynağının laboratuara getirilmesi ve
izolasyon yapılması
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı ve hasta bireylerden doku ve kan alınması
Adipojenik
Doku ve kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
İstatistiksel Analiz
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
Farklılaşma (Differentiation)
• Osteojenik Stimülasyon
• Kondrojenik Stimülasyon
• Adipojenik Stimülasyon
Progenitör hücrelere dönüşme potansiyelleri
değerlendirilir
KÖK HÜCRELERİN FARKLILAŞMASI
MKH’lerin %10 Formaldehid fiksasyon ve boyama işlemi
sonrasında ışık mikroskobu görüntüleri
KÖK HÜCRELERİN
KARAKTERİZASYONU
MKH kaynağının laboratuvara getirilmesi
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı ve hasta bireylerden doku ve kan alınması
Adipojenik
Doku ve kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
İstatistiksel Analiz
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
Dokudan PBMC İzolasyonu
PERİFERİK KANDAN PBMC İZOLASYONU
1- Sağlıklı bireylerin veya hastalardan venöz kan alımı
2- Venöz kanın PBS ile dilüe edilmesi (1/1 v/v)
3-Dilüe edilmiş kanın fikol üzerine yayma işlemi
PERİFERİK KANDAN PBMC İZOLASYONU
4- 2000 rpm /20 dk santrifüj edilir.
5- Buffy coat toplanır.
PERİFERİK KANDAN PBMC İZOLASYONU
5- 2 kez PBS ile yıkama işlemi
6- Hücre pelletin CRPMI ile çözülmesi ve hücre sayımı.
Bireylerden venöz kan alınması
Lenfosit
Venöz kandan PBMC izolasyonu yapılması
CFSE İşaretlendi
CFSE İşaretlenmedi
Ko Kültürlerinin yapılması
Uyarım /3 gün
CD Mix* / IFN-γ
MKH
Proliferasyon analizi
Fas/FasL analizi
CD4+FoxP3+ T regülatör hücre
analizi
* CD Mix: anti CD2- anti CD3- anti CD28
** CFSE: Karboksifloresan süksinimidil ester
Sitokin analizi
proliferasyon
CFSE**
MKH kaynağının laboratuvara getirilmesi
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı bireylerden venöz kan alınması
Adipojenik
Venöz kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
İstatistiksel Analiz
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
MKH ve LENFOSİTLERİN Ko-KÜLTÜRÜ
2 gün önce 48 kuyucuklu plaklara ekilir.
MKH hücreleri üzerine izole edilen lenfosit hücreleri her kuyuda 5x105
olacak şekilde 500 μl hücre kültür solüsyonu ile birlikte eklenir.
Lenfosit
MKH
MKH kaynağının laboratuvara getirilmesi
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı bireylerden venöz kan alınması
Adipojenik
Venöz kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
İstatistiksel Analiz
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
Flow Sitometri
Hücre yüzeyinde bulunan çeşitli markerlar
Hücre içi çeşitli faktorlerin gösteriminde
Hücreler tarafından sekrete edilen sitokinler
DNA araştırmalarında
SUNULMASI ve VERİ YORUMLAMA
Tek parametreler histogram olarak görüntülenebilir
5.49%
IC
97.43%
CD146 FITC
Çift parametre verileri nokta kullanılarak iki boyutlu olarak görüntülenebilir.
Süt Dişi Kaynaklı Mezenkimal Hücreler Astım Tanısı Almış Hastaların Lenfosit
Proliferasyonunu Baskılar.
SONUÇLAR
SHED (+)
SHED (-)
Lenfosit
CFSE
Astım
64±7
SHED (-)
52±9.5
SHED (+)
Kontrol
54.±1
46±13.
P < 0.01
CFSE FITC
SONUÇLAR
Süt Dişi Kaynaklı Mezenkimal Hücreler Astım Tanısı Almış Hastaların
Lenfosit Apoptozunu Baskılar
SHED (-)
Astım
Hastası
SHED (+)
44.90
84.22
24 ±16
7.7±9
Kontrol
80.88
9.2±2
6±3
Fas
CD95
SONUÇLAR
Süt Dişi Kaynaklı Mezenkimal Hücreler Astım Tanısı Almış Hastaların
Lenfosit Apoptozunu Baskılar
SHED (+)
SHED (-)
Astım
Hastası
23.56
37.43
67±18
63±13
30.6
3
19.70
Kontrol
72±4
66±5
FasL
CD178
SONUÇLAR
Süt Dişi Kaynaklı Mezenkimal Hücreler Astım Tanısı Almış
Hastaların ve Kontrollerin CD4+ FoxP3+ Hücre Sayısını Arttırır
SHED (+)
SHED (-)
3±1
5±1
Foxp
3
Astım
Hastası
10±2
3
Kontrol
CD4
MKH kaynağının laboratuvara getirilmesi
Akım sitometrik analizlerin yapılması
CD90, CD146, CD73, CD105,
CD29
CD34, CD28, CD14, CD25,CD45
Farklılaştırılmasının yapılması
Osteojenik
Kondrojenik
Sağlıklı bireylerden venöz kan alınması
Adipojenik
Venöz kandan PBMC izolasyonu yapılması
Ko Kültürlerinin yapılması
Lenfosit hücrelerinin proliferasyon analizi
Lenfosit hücrelerinin Fas/FasL analizi
Lenfosit hücrelerinin CD4+FoxP3+ analizi
Lenfosit hücrelerinin sitokin analizi
İstatistiksel Analiz
Sitokin Analizi
MKH’ LERİN
Green Fluorescent Protein(GFP) İşaretlenmesi
MKH’ LERİN
Green Fluorescent Protein(GFP) İşaretlenmesi
1.
Hücreler GFP işaretlemeden iki gün önce 25’lik flasklara ekilir.(%70-%90
konfluent).
*5 × 104 –2 × 105 hücre her 10 µL Neon® Tip. 5 × 105
–2 × 106 hücre
her 100 µL Neon® Tip için.
2.
Flask içinde bulan besiyeri aspire edilir ve yapışan hücreler 2 kez
PBS(Ca2+ and Mg2+içermeyen) ile yıkanılır.
Hücreler Trypsin/EDTA veya TrypLE Express ile tripsine edilir.
Hücre suspansiyonu 2 kere PBS(Ca2+ and Mg2+içermeyen) ile yıkanır.
PBS aspire edilir ve hücreler R bufferda resuspanse edilir.
1*106 hücre için 1µl GFP konulur.
3.
4.
5.
6.
A
C
B
Dental Pulpa MKH
D
GFP-Dental Pulpa MKH
DENEY
• Anestezi indüksiyonu
– Ketamin ve klorpromazin
• Çekal ligasyon perforasyon
– 20G
• 0.3 cc PBS içinde 1x106 DF-MKH
• Kuyruk veni
DENEY GRUPLARI
DF-MKH DF-MKH
CLP
Sakrifikasyon
Saat
0
4
24
Deney Hayvanı: Sprague Dawley erkek sıçan n=38
Grup I. Sağlıklı n=4
Grup II. Sağlıklı+ DF-MKH n=4
Grup III. CLP* n=10
Grup IV. CLP uygulaması+ 0. saatte DF-MKH** n=10
Grup V. CLP uygulaması+ 4. saatte DF-MKH n=10
*CLP: Çekal Ligasyon ve Perforasyon 0. saat
** DF-MKH: Dental Folikül Mezenkimal Kök Hücresi
ANALİZLER:
IL-10 ve TNF-α
CD4+CD25+Foxp3+ T Hücre
ileal doku histopatolojisi
IN VIVO ÇALIŞMALARDA GFP İŞARETLİ
MKH’ LERİN KULLANIMI
Görüntüleme
KONTROL
CLP +4.SAAT
Tunç AKKOÇ
Deniz GENÇ
Muazzez GÖKALP
Yazgül DURAN
Kamil Göker