Kuantum Teorisi ve Atomların
Elektronik Yapısı
Kaynak: Fen ve Mühendislik Bilimleri için
KİMYA
Raymond CHANG
1
Dalganın Özellikleri
Dalgaboyu (l) bir dalganın ardışık iki eş noktası
arasındaki mesafedir.
Genlik dalganın tepe noktasının dalganın orta noktasına
olan dikey mesafesidir.
Frekans (n) sabit bir noktadan 1 sn de geçen dalga sayısıdır.
(Hz = 1 çevrim/s).
Dalganın Hızı (u) = l x n
2
Maxwell (1873), görünür ışığın elektromagnetik
dalgalardan oluştuğunu ileri sürmüştür.
Elektromagnetik
radyasyon enerjinin
elektromegnetik dalgalar
halinde taşınımıdır.
Işığın (vakumdaki) hızı (c) = 3.00 x 108 m/s
Tüm elektromagnetik radyasyon için
lxn=c
3
4
Bir fotonun frekansı 6.0 x 104 Hz dir. Dalgaboyunu (λ) kaç nm
dir. Bu frekans görünür bölgede midir ?
lxn=c
l = c/n
l = 3.00 x 108 m/s / 6.0 x 104 Hz
l = 5.0 x 103 m
l = 5.0 x 1012 nm
5
Enerji (ışın) kesikli birimler
halinde (kuantum)
yayılır veya absorplanır.
E=hxn
Planck sabiti (h)
h = 6.63 x 10-34 J•s
6
Bakır yüksek enerjili elektronlar ile bombardıman edildiğinde X
ışınları yayılır. X ışınlarının dalgaboyu 0,154 nm ise enerjiyi
joule cinsinden hesaplayınız.
E=hxn
E=hxc/l
E = 6.63 x 10-34 (J•s) x 3.00 x 10 8 (m/s) / 0.154 x 10-9 (m)
E = 1.29 x 10 -15 J
7
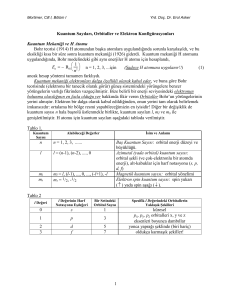
Schrodinger Dalga Denklemi
y kuantum sayıları denen 4 sayının bir fonksiyonudur.
kuantum sayıları (n, l, ml, ms)
Baş kuantum sayısı n
n = 1, 2, 3, 4, ….
e- un çekirdeğe olan uzaklığını ifade eder.
n=1
n=2
n=3
8
e- yoğunluğunun % 90 ı
1s orbital
9
Schrodinger Dalga Denklemi
kuantum sayıları: (n, l, ml, ms)
açısal momentum kuantum sayısı l
Verilen bir n değeri için , l = 0, 1, 2, 3, … n-1
n = 1, l = 0
n = 2, l = 0 veya 1
n = 3, l = 0, 1, veya 2
l=0
l=1
l=2
l=3
s orbital
p orbital
d orbital
f orbital
e- nun kapladığı “hacmin” şeklini gösterir
10
l = 0 (s orbitalleri)
l = 1 (p orbitalleri)
11
l = 2 (d orbitalleri)
12
Schrodinger Dalga Denklemi
kuantum sayıları: (n, l, ml, ms)
Manyetik kuantum sayısı ml
l nin verilen bir değeri için
ml = -l, …., 0, …. +l
Eğer l = 1 (p orbital) ise , ml = -1, 0, veya1
Eğer l = 2 (d orbital), ml = -2, -1, 0, 1, veya 2
Orbitallerin uzaydaki yönelimi
13
ml = -1, 0, veya 1
Uzaydaki 3 farklı yönelim
14
ml = -2, -1, 0, 1, veya 2
Uzaydaki 5 farklı yönelim
15
Schrodinger Dalga Denklemi
(n, l, ml, ms)
spin kuantum sayısı ms
ms = +½ veya -½
ms = +½
ms = -½
16
Schrodinger Dalga Denklemi
kuantum sayıları: (n, l, ml, ms)
Atomdaki elektronun bulunabileceği enerji seviyeleri onun
kendisine özgü Dalga fonksiyonu (Ψ) ile tanımlanır
Pauli dışarlama prensibi – bir atomdaki iki elektron aynı
dört kuantum sayısını alamaz
Wolfgang Ernst Pauli
17
18
Schrodinger Dalga Denklemi
Kuantum sayıları: (n, l, ml, ms)
Yörünge – elektronlar aynı n değerini alır.
Alt yörünge – aynı n ve l değerini alan elektronlar bulunur.
Orbital – elektronlar aynı n, l, ve ml değerlerini, alır.
Bir orbital kaç elektron barındırır ?
Eğer n, l, ve ml ise o zaman ms = ½ or - ½
y = (n, l, ml, ½) veya y = (n, l, ml, -½)
Bir orbital 2 elektron bulundurur.
19
Bir atomda kaç tane p orbitali vardır ?
n=2
Eğer l = 1, ise ml = -1, 0, veya +1
2p
3 orbital
l=1
3d alt kabuğunda kaç orbital bulunur?
n=3
3d
l=2
Eğer l = 2, ise ml = -2, -1, 0, +1, veya +2
5 adet d orbitai ve toplam 10 e- bulunur.
20
Elektronlar orbitalleri en düşük enerjili olandan
başlayarak doldururlar.
(Aufbau Prensibi)
21
Elektronların bir alt kabuktaki en kararlı dağılımı en fazla
paralel spinin olduğu haldir (Hund Kuralı).
22
Çok elektronlu bir atomda orbitallerin doldurulması
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s
23
Elektron konfigurasyonu elektronların değişik orbitallere
nasıl dağıldığını gösterir.
Alt kabuk yada orbitaldeki
elekronların sayısı
1s1
Baş kuantum sayısı, n
açısal momentum
kuantum sayısı l
Orbital diagramı
H
1s1
24
Mg un elektron konfigürasyonu nedir ?
12 Mg
1s < 2s < 2p < 3s < 3p < 4s
1s22s22p63s2
2 + 2 + 6 + 2 = 12 electron
Kısaca [Ne]3s2
[Ne] 1s22s22p6
Cl un en dış elektronunun muhtemel 4 kuantum sayısını
yazınız.
17 Cl
1s < 2s < 2p < 3s < 3p < 4s
1s22s22p63s23p5
2 + 2 + 6 + 2 + 5 = 17 elektron
En dış (son) elektron 3p orbitalinde bulunur.
n=3
l=1
ml = -1, 0, or +1
ms = ½ or -½
25
Periyodik cetvelde elementlerin, elektronler tarafından
doldurulan kabuklarına göre sınflandırılması
26
27
Paramagnetik
çiftleşmemiş elektronlar
2p
Diamagnetik
Tüm elektronlar çift
2p
28