MADDENİN YAPISI ve
ÖZELLİKLERİ
ÜNİTE : MADDENİN YAPISI ve
ÖZELLİKLERİ
• Üniteye Giriş
• Her madde kendinden küçük atomlardan oluşmuştur.
• Ancak her madde aynı atomlardan oluşmamıştır.
• Maddeyi oluşturan atomlar ve bu atomların dizilimi, sayısı v.b
gibi özellikleri farklıdır.
• Bu nedenle her madde aynı özellik göstermez ve her madde
aynı değildir.
• Tüm maddelerin yapısı farklıdır.
• Aynı kalem ile silginin şekil ve yapılarının farklı olduğu gibi.
Elementler ve Sembolleri
• Eski çağlarda tabiatta varolan her şeyin dört temel elementten
oluştuğu kabul edilmekteydi. Bu dört temel elementin ise ”
hava, su, toprak ve ateş ” olduğuna inanılmaktaydı.
• Bilim insanlarının bu kabulu Orta Çağ sonuna kadar devam
etti.
• İşte bu dönemlerde Robert Boyle ( Rabırt Boyl ) elementin
tanımını yaparak yeni bir fikir ortaya attı. Bu tanıma göre daha
basit maddelere ayrılamayan maddeler element olarak
tanımlanır.
Buna göre günümüzdeki element tanımı ve elementlerin
özellikleri şöyledir ;
Yapısında tek cins atom içeren tüm maddeler element olarak
tanımlanır.
• Bir elementin atomları birbirinin aynı iken, farklı elementin
atomları ise birbirinden farklıdır.
• Tüm elementler birbirinden farklı özelliklere sahiptir.
• Elementler saf ve homojen yapıdadır.
• Her bir element farklı sembollerle gösterilir.
• Elementler atom yapılı ve molekül yapılı olmak üzere ikiye
ayrılırlar.
• Elementler fiziksel ya da kimyasal değişimler sonucunda daha
basit maddelere ayrılmazlar.
• 1. Bazı Elementler ve Kullanım Alanları
a. Demir
• Tabiatta çok bulunan ve çok yaygın olarak kullanılan bir
elementtir. Dayanıklı ve sert olma özelliğinden dolayı
inşaatlarda yapı malzemesi olarak kullanılır. Bir çok metal
alaşımlarında demir elementi yer almaktadır.
b. Bakır
• Tabiatta bulunan önemli elementlerden biridir. Bazı mutfak
eşyalarınınn ve süs eşyalarının yapımında kullanılır. Elektrik
akımını ileten en ucuz metallerden olduğu için binaların
elektrik tesisatlarında ve elektirkli ev aletlerinin iç yapılarında
ve kablo bağlantılarında oldukça yaygın bir şekilde kullanılır.
c. Gümüş
• Tabiatta az bulunan değerli bir elementtir. Elektrik akımını iyi
ilettiğinden dolayı önceleri iletken tel yapımında kullanılmakta
olan gümüş tabiatta az bulunduğundan günümüzde daha çok
süs eşyalarının yapımında kullanılır.
• Bunun yanında gümüş, ayna yapımında fotoğrafçılıkta, ilaç
yapımında da kullanılır.
d. Kalay
• Dövülebilen, kolayca tel ve levha haline gelebilen bir metaldir.
• Paslanmaya karşı dirençli bir element olduğunda diğer
metallerin üzerinin kaplanmasında kullanılır.
• Kurşun ve kalaydan oluşan bir alaşım olan lehim bazı
metallerin birbirine perçinlenmesinde kullanılır.
e.Nikel
• Paslanmaya karşı dayanıklı bir metal olduğundan muslukların
ve araçlardaki bazı parçaların kaplanmasında kullanılır.
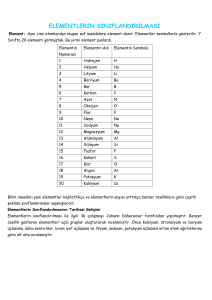
• 2. Element Numaraları ve Sembolleri
• Günümüzde bilinen yaklaşık 120 çeşit element vardır. Bu
elementlerin yaklaışk % 90 ‘ı doğada bulunmaktadır.
• Diğer elementler ise laboratuvarlarda deneysel açlışmalar
sonucunda elde edilmiştir.
• Elementler ilk bulunduklarında sahip oldukları özelliklere
uygun bir ad verilmesine özen gösterilmiştir. Örneğin
Latincede Hidrojen; su üreten, Oksijen; asit yapan ve Fosfor;
ışık veren anlamına gelmektedir.
• Ancak ülkelerin dillerine göre element isimlerinde farklılıklar
vardır. Yani elementlerin adlandırılmasında genel bir
standart yoktur.
• Bilim insanları bu elementlerin daha kolay tanınmaları,
bilimsel ve uluslararası bir standartın oluşması için her bir
elemente ayrı bir numara ve sembol tanımlamışlardır.
En sonunda, 1813 yılında , Jon Jakop Berzelius isimli araştırmacı,
elementlerin adları temel alınarak simgelenmesi fikrini ortaya
attı. Hâlâ kullanılmakta olan bu yönteme göre :
• Her element, 1 ya da 2 harften oluşan bir simgeyle ifade edilir
ve bu simgenin ilk harfi her zaman büyük yazılır.
• Simgelerde sıklıkla, elementin İngilizce adının ilk harfi
kullanılır.
Örneğin; H ( Hidrojen: Hydrogen ), C ( Karbon: Carbon ), N ( Azot:
Nitrogen ).
• Eğer elementin baş harfiyle simgelenen başka bir element
varsa, bu elementin simgesinde baş harfin yanına, İngilizce
adının ikinci harfi de eklenir.
Örneğin; He ( Helyum: Helium ), Ca ( Kalsiyum: Calcium ), Ne (
Neon: Neon ).
• Eğer elementin İngilizce adının ilk iki harfi, bir diğer elementle
aynıysa, simgesinde baş harfin yanına, bu kez baş harften
sonraki ilk ortak olmayan sessiz harf getirilir.
Örneğin; Cl ( Klor: Chlorine ) ve Cr ( Krom: Chromium ).
• Bazı elementlerin numaraları, isimleri ve sembolleri ;
• Bilim insanları elementleri numaralandırdıktan sonra bazı
benzer özelliklerine göre bir çizelgeye yerleştirmişlerdir. Bu
çizelgeye periyodik cetvel ya da periyodik tablo denir.
• Tablodaki yatay sıralar ” periyot ” olarak adlandırılır.
ATOMUN YAPISI
• Maddeleri oluşturan taneciklerin tümü hareketli taneciklerdir.
Yemek tuzunu su içerisine attığımızda çözünerek suyun her
tarafına yayılması, odaya sıkılan bir parfümün odanın her
yerine yayılması gibi özellikler bu durumu göstermektedir.
• İşte bir atomu oluşturan daha küçük birimlere alt parçacıklar
denir. Bu parçacıklar proton, nötron ve elektrondur.
a. Atom Çekirdeği
• Proton ve nötronların bulunduğu yoğun ve küçük hacimli
bölgedir.
b. Enerji Katmanları
Elektronların dağıldığı, çekirdek hacmine göre oldukça büyük
hacimli ve boşlukların çok olduğu bölgedir.
• Buna göre atomun yapısını tekrar sınıflandırırsak, atom temel
olarak iki ana bölgeden meydana gelir.
• Bunlar da atom çekirdeği ve enerji katmanları ( enerji
seviyeleri ) dir. Atom çekirdeğinde ise proton ve nötronlar
bulunur.
• Enerji katmanlarında ise sadece elektronlar yer alır diyebiliriz.
• Atomu oluşturan alt parçacıkların yükleri birbirinden farklıdır.
Protonlar pozitif ( + ) yüklü, elektronlar negatif ( – ) yüklü ve
nötronlar ise yüksüz parçacıklardır.
• 1. Atomun Temel Tanecikleri Arasındaki İlişki
• Bilinen bütün elementler birbirinden farklı bir sembole ve
numaraya sahiptir bilgisini hatırlayalım.
• Bunlar arasında bir ilişki var mıdır ? Var ise nasıl açıklanır ?
Acaba elementlere verilen numara neye göre verilir ?
• Proton sayısı atomlar (elementler) için ayırt edici özelliktir.
Yani proton sayısının farklı olması elementin diğerinden farklı
olduğu anlamına gelir. Elektronların bulunma olasılığının
olduğu bölgelere elektron bulutu denir.
• Kimyasal olaylarda (reaksiyonlarda) yalnızca elektron sayısı
değişir.
Atomdaki bazı eşitlikler ;
• Nötr bir atom için; elektron sayısı= proton sayısı
• (A.N.) Atom Numarası= proton sayısı
• Çekirdek Yükü= proton sayısı
• İyon Yükü= proton sayısı – elektron sayısı (E.S.)
• (K.N.) Kütle Numarası= proton + (N.S) nötron sayısı,(Nükleon
sayısı),(atom ağırlığı)
Her elementin atom numarası aynı zamanda proton sayısına
eşittir. ( Atom Numarası = Proton Sayısı )
• Atom Numarası = Proton Sayısı = Çekirdek Yükü = Elektron
Sayısı
• Element atomalrında çekirdekte bulunan proton sayıları, aynı
zamanda katmanlarda bulunan elektron sayılarına eşit ise nötr
atom özellik gösterir. Böyle atomlara nötr atom denir.
• Böyle bir durumda çekirdekteki pozitif yüklerin sayısı çekirdek
çevresindeki negatif yük sayısına eşittir.
• Nötr Olmayan Atom ;
• Maddelerin yapısında meydana gelen kimyasal değişimler
sırasında elementin türü değişmez.
• Bu durum kimyasal değişimler sırasında atom çekirdeğindeki
tanecik sayılarında bir değişim olmadığına işarettir.
Elektronların Katmanlara Göre Dağılımı
• Elektronların bulunduğu bu bölgeler katman adını almıştır.
• Elektronlar öncelikle çekirdeğe en yakın katmana
yerleştirilirler.
• Katmanlarda elektronlar çifter hâlde bulunur.
• Bir katmanın alabileceği elektron sayısı dolduktan sonra bir
sonraki katmana geçilir.
• Her bir katmandaki elektron sayısı farklı olabilir. Ancak birinci
katman en fazla 2 elektron alabilir.
• İkinci katmanda en fazla 8 elektron olabilir.
• İlk 20 element için üçüncü katmanda en fazla 8 elektron
olabilir.
• 3. Atom Modellerinin Serüveni
• Maddenin, küçük, bölünemez parçacıklardan oluştuğu
düşüncesini ilk olarak Yunanlı filozof Demokritos ( M.Ö.
yaklaşık 460-370 ) ortaya atarak bu parçacıklara eski Yunanca ”
bölünemez ” karşılığı olam ” atom ” adını verdi.
Dalton Atom Modeli
İngiliz Bilim insanı John Dalton ( 1819 ) atomların içi dolu ve
bölünmez olduğu fikrini ortaya attı. Atomdan daha küçük
parçacıkların bulunduğunu ise 50 yıl sonra dolaylı yoldan
kanıtladı.
Thomson Atom Modeli
1897 yılında Thomson yaptığı deneyler sonucunda atomun
yapısında pozitif ve negatif yüklü taneciklerin bulunduğu
sonucuna ulaşmıştır. Bu atom modeline göre atomdaki pozitif
ve negatif yükler atomda rastgele dağılmışlardır.
Thomson atom modeline göre atom bir üzümlü keke
benzemenktedir. Kek atomdaki pozitif yükleri, rastgele
dağılmış olan üzüm tanecikleri de elektronları ifade
etmektedir.
Rutherford Atom Modeli
Alfa ışınlarının metal bir levha üzerine gönderilmesi temeline
dayanan deneyi sonucunda elde ettiği verilere göre atomun
yapısının Thomson Modelindeki gibi olamayacağı sonucuna
ulaştı.
• Atomdaki pozitif yüklerin küçük bir hacimde olması gerektiği,
negatif yüklerin ise bu küçük hacimli çekirdeğin çevresinde ve
aralarında büyük boşluklar olacak şekilde olması gerektiği
fikrini ortaya attı.
• Ayrıca pozitif yüklü protonlar ile, negatif yüklü elektronlar
arasında bir çekim olacağından elektronların çekirdek üzerine
düşmemesi için, çekirdek çevresinde dönmesi gerektiğini
belirtti. Rutherford bu model tasarımı ile kimya nobel
ödülünü almıştır.
Bohr Atom Modeli
Rutherford Atom Modelinde elektronların çekirdek çevresinde
nasıl bulunduğu ile ilgili fikirler yoktu. Bilim insanı Niels Bohr
elektronların çekirdek çevresinde istediği gibi dönemeyeceğini
belirtti. Her elektronun belirli bir enerji katmanında dönmesi
gerektiği fikrini ortaya attı.
Modern Atom Modeli
Elektronlar atom çekirdeğinin çevresinde çok büyük bir hızla
döner. Bu nedenle gerçekte elektronun bulunduğu yerin
bilinmesi mümkün değildir.
Bir elektronun gerçekte belirli bir yörüngesi yoktur. Farklı ve kısa
zaman aralıklarında farklı bölgelerde bulunabilirler. Bu
nedenle elektronların bulunabileceği bölgeler bir elektron
bulutu olarak adlandırılırlar. Modern Atom Modeline göre
atomdaki elektronun yeri ve hızı bilinemez.