Burhaniye Anadolu Lisesi
YGS’ye Hazırlık Okula Yardımcı, LYS’ye Hazırlık Okula Yardımcı
Burhaniye - 2015
1.
Bileşikler
Burhaniye Anadolu Lisesi
BİLEŞİKLER
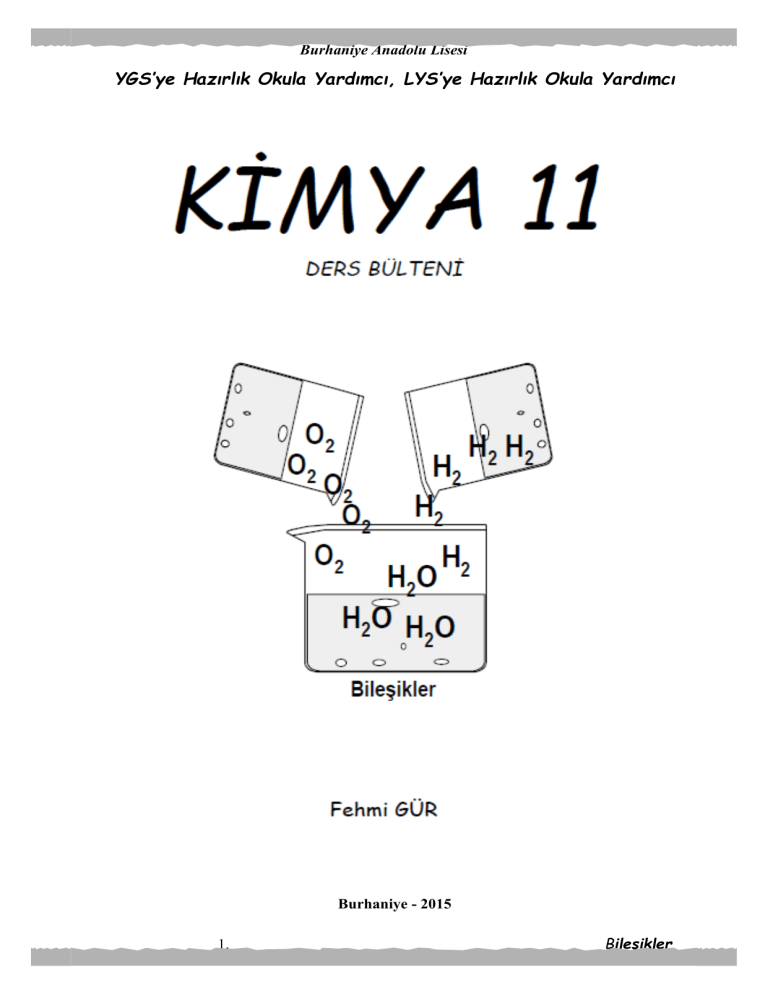
Kimyasal olarak iki ya da daha çok elementin atomlarından belirli miktarlar kullanılarak
oluşan saf maddelere denir. Bileşikler sadece kimyasal yollarla kendini oluşturan saf maddelere
ayrılabilirler.
Elementlerden bileşikler oluşurken, elementler kendi fiziksel ve kimyasal özelliklerini
kaybederler. Oluşan yeni madde kendine has fiziksel ve kimyasal özelliklere sahiptir.
Örnek:
H2
+
Yanıcı
1 mol H2
2 gr. Hidrojen +
½ O2
H2 O
yakıcı
söndürücü
0,5 mol O2
1 mol H2O
16 gr. Oksijen =
18 gr. Su
BİLEŞİKLERİN ÖZELLİKLERİ
Bileşikler oluşurken elementler kendi özelliklerini kaybederler.
Bileşikler formüllerle gösterilirler
Bir bileşiğin tüm özelliklerini gösteren en küçük birimi moleküldür.
Bileşiklerin belirli kaynama ve donma noktaları vardır.
Belirli ayırt edici özellikleri vardır.
Sıvılaştırılmış iyonik yapılı bileşikler elektrik akımını iletirler.
Bileşimleri sabit oranlar yasasına uyar.
Katı halde elektrik akımını iletmezler.
Homojendirler.
KİMYANIN TEMEL YASALARI
Dalton atom kuramı
Lavoısıer yasası
Değişmez oranlar yasası
Katlı oranlar yasası
DALTON ATOM KURAMI
J.Dalton atom kuramı, kütlenin korunumu ve sabit oranlar yasalarına ve diğer denel
gözlemlere dayanılarak önerilmiştir. Alton atom kuramı aşağıdaki maddeleri içermektedir.
Madde görünmeyen ve atom denilen parçacıklardan oluşmuştur.
Bir elementin bütün atomları aynı özellikleri taşır ve diğer elementlerin özelliklerinden
farklıdır.
Kimyasal tepkimeler, atomların düzenlenme türünün, birleşme şeklinin değişmesinden
ibarettir.
Dalton yasası henüz bulunmamış yasaları tahmin edebilme açısından başarılıdır.
Kütlenin korunumu yasasını açıklar.
Değişmez oranlar yasasını açıklar.
Katlı oranlar yasasını ortaya çıkarmıştır.
2.
Bileşikler
Burhaniye Anadolu Lisesi
LAVOISIER YASASI
Kimyanın temel yasalarından birincisi, Lavoisier yasası olarak bilinen kütlenin korunum
yasasıdır. Bir kimyasal tepkimede madde yoktan yaratılamaz ve kaybolmaz; yani bir kimyasal
tepkimeye giren maddelerin kütleleri toplamı, tepkimede oluşan maddelerin kütleleri toplamına
eşittir.
Örnek:
H2
+
½ O2
H2 O
2 gr. Hidrojen + 16 gr. Oksijen = 18 gr. Su
DEĞİŞMEZ (SABİT) ORANLAR YASASI
Değişmez oranlar yasası: Bir bileşiği oluşturan elementlerin kütleleri arasında değişmez bir
oran vardır.H2O için bu oran 1/8 ‘dir.9 gram ayrışırsa 1 gram H2 ve 8 gram O2 elde edilir.
Sabit Oranlar Kanunu’na göre bir bileşikteki elementlerin kütlece yüzdeleri de sabittir.
Örnek:
Su için bu oran; kütlece % 11,1 hidrojen ve %88,9’u oksijendir.
Bazı Bileşiklerdeki Bileşiği Oluşturan Elementlerin Kütlece Birleşme Oranları
Bileşiğin Adı
Bileşikteki Elementlerin Kütleleri
Karbondioksit
mC/mO = 3/8
Kalsiyum oksit
m Ca / m O = 5 / 2
Demir(II) sülfür
m Fe / m S = 7 / 4
Soru1:Asetilen sanayide oksijen kaynağı yapımında kullanılır. Asetilen karbon ve hidrojen
elementlerinden oluşur. 1,2 gram hidrojen ile 14,4 gram karbonun tamamen birleşmesinden
oluştuğuna göre, Bu bileşikteki elementlerin kütlece birleşme oranlarını bulunuz.
Çözüm: Verilenlere göre;
mH = 1,2 gram
mC = 14,4 gram ise, m H / m C = 1,2 / 14,4 = 1/12 dir.
Soru2: (ÖSS 1996) Formülü XY olan bir bileşiğin, çeşitli yöntemlerle elde edilen saf örnekleri
incelenmiş ve tüm örneklerde aşağıdaki bulgular elde edilmiştir.
I.
X ve Y atomlarının mol sayılarının oranı 1 dir.
II.
X in kütlece yüzdesi sabit bir değerdir.
III.
Elde edilme tepkimelerinin her birinde toplam kütle aynı kalmıştır.
Bulgularından hangileri sabit oranlar yasasının sonucudur?
A-)Yalnız I
B-)Yalnız II
C-)I ve II
D-)I ve III
E-)I, II ve III
Çözüm: Sabit oranlar yasasına göre; Bir bileşiği oluşturan elementlerin kütleleri arasında
değişmez bir oran vardır ve bu yasaya göre; bir bileşikteki elementlerin kütlece yüzdeleri de
sabittir. Buna göre, I ve II bulgular sabit oranlar yasasına uyar. III. bulgu ise kütlenin korunum
yasasıdır.
Yanıt: C
3.
Bileşikler
Burhaniye Anadolu Lisesi
KATLI ORANLAR YASASI
J.Dalton atom kuramı katlı oranlar yasasını da ortaya çıkarmıştır: Aynı iki element çeşitli
bileşikler oluşturuyorsa, bunlardan birinin sabit kütlesiyle birleşen diğer elementin artan kütleleri
arasında tamsayılarla yazılabilen basit bir oran vardır.
Örnek:
C, O2 ile CO ve CO2 bileşiklerini oluşturur. CO de 12 gr. C ile 16 gr. O2 ve CO2 de 12 gr. C ile 32
gr. O2 birleşmiştir. O halde, sabit 12 gr. C ile birleşen O2 miktarları arasında 32/16=2 oranı
vardır. Bu sonuç, atom kuramına uygundur. Çünkü CO de 1 atom C, 1 atom O ile ve CO2 de
1atom C ile 2 atom O ile birleştiğinden,CO2 de daima CO dekinin iki katı kadar O atomu
bulunacak ve sonuçta CO2 deki O kütlesi, CO deki O kütlesinin iki katı olacaktır.
Uyarı: Katlı oranlar yasası iki elementin farklı iki bileşiği için geçerlidir. Örneğin CO ve CO2
bileşiklerinde katlı orandan söz edilirken, CaO ve MgO bileşikleri arasında bir katlı orandan söz
edilemez.
Soru3: (ÖSYM 1975) Katlı oranlar kanununu doğrulamak için aşağıdaki bileşik çiftlerinden
hangisini seçersiniz?
A-)NaCl ile NaClO3
B-)CH4 ile CHCl3
D-)HClO3 ile HBrO3
C-)KNO2 ile NaNO2
E-)C2H2 ile C3H8
Çözüm: Katlı oranlar yasası iki elementin farklı iki bileşiği için geçerlidir.Karbon ve hidrojenden
oluşan C2H2 ile C3H8 bileşikleri katlı oranlar yasasını doğrular.
3/ C2H2 => C6H6
2/ C3H8 => C6H16 ise HI/HII = 6/16 =3/8
Yanıt: E
Soru4: (ÖYS 1988) X ile Y arasında iki farklı bileşik oluşmaktadır.
I.
Bileşiğin formülü XY
II.
Bileşiğin formülü X4Yn
Aynı miktar X ile birleşen I.bileşikteki Y miktarının II. Bileşikteki Y miktarına oranı 2/5 tir.Buna
göre, II. Bileşiğin formülündeki n kaçtır?
A-)1
B-)2
Çözüm:
C-)4
X miktarı
I.Bileşik:
a gram
II. Bileşik:
a gram
X/Y
a/a
=
4X/nY
=>
2/5
X
Y
.
nY
a
=
4X
a
D-)5
E-)10
Y miktarı
2 gram
5 gram
Formül
XY
X4Yn
.
5
n
=>
2
5
=
4
=>n=10 bulunur
2
Yanıt: E
4.
Bileşikler
Burhaniye Anadolu Lisesi
BİLEŞİK FORMÜLLERİ
Kimyasal olarak iki ya da daha çok elementin atomlarından belirli miktarlar kullanılarak
oluşan saf maddeleri bileşik olarak tanımlamıştık. Bileşikler kendilerini oluşturan elementlerin
fiziksel ve kimyasal özelliklerini göstermezler. Bileşikler sadece kimyasal yollarla kendini
oluşturan saf maddelere ayrılabilirler.
Atom: Kimyasal birleşmelere girebilen elementin temel birimi olarak tanımlanır.Atomlar
elektriksel olarak yüksüzdürler.(Na.Au.Xe,Ne….)
Molekül: Kimyasal kuvvetlerle (kimyasal bağlar) uygun bir düzenlemede bir arada tutulan en az
iki atomun bir araya gelmesidir. Bir molekül aynı elementin atomlarını içerdiği gibi belirli
oranlar kanununa göre sabit oranda birleşen iki veya daha fazla element atomlarını da içerir.
Örnek:
Molekül
H2
element (molekül)
H2O bileşik (molekül)
Bileşik formülleri;
Bileşiğin hangi elementlerden oluştuğunu gösterir.
Bileşikteki elementlerin atom sayıları arasındaki oranı gösterir.
Örnek:
Etil alkolün formülü CH3CH2OH dir.Bu formüle göre;
C,H,O elementleri içerir.
Formül 2 tane C atomu, 6 tane H atomu ve 1 tane O atomu içerir.
Uyarı: Bileşik formülünde element sembolünün sağ alt köşesinde rakam olmaması, o
elementin atomu sayısının bir olduğunu gösterir.
İYONİK YAPILI BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI
Elementlerin bileşik oluşturmasında elektronlar rol oynar. Elementler kendi aralarında
elektron alış verişi yaparak veya elektronlarını ortaklaşa kullanarak bileşik oluştururlar.
İyonik bileşikler oluşturan elementler, düşük iyonlaşma enerjilerine veya yüksek elektron
ilgisine sahiptirler. Bir iyonik bağ pozitif ve negatif iyonlar arasındaki elektrostatik etkileşim
kuvvetlerinin ürünüdür. Elektronlar eksi (-) yüklü parçacıklar olduklarından, elektron alan
atom (-) yüklü hale, elektron veren atom ise (+) yüklü hale geçer.
İyon Yükü: Atomların elektron alış verişi sonucunda kazandıkları yüke iyon yükü denir.
5.
Bileşikler
Burhaniye Anadolu Lisesi
İyon: Kimyasal değişim sonucu elektron kazanan veya kaybeden nötr bir atom yada
molekülden oluşan yüklü türlere denir.
Katyon: Nötr bir atomun bir veya daha fazla elektronlarını kaybetmesi sonucu katyon, net
pozitif yüklü iyon oluşur.Örneğin Na atomu bir elektron kaybederek Na+ katyonu oluşturur.
Anyon: Nötr bir atomun bir veya daha fazla elektron sayısındaki artış anyon anyon, net
negatif yüklü iyon oluşur. Örneğin Cl atomu, Cl- iyonu oluşturmak için bir elektron
kazanabilir.
Kök: İki veya daha fazla atom net pozitif veya negatif yüke sahip iyon oluşturmak üzere
birleşebilir.Hidroksit iyonu (OH-), siyanür iyonu (CN-) ve amonyum iyonu (NH4+) gibi
poliatomik iyonlar birden fazla atom içeren iyonlardır.
İyonik yapılı bir bileşiğin formülü yazılırken çaprazlama yöntemi kullanılır. Bu yöntemde
element sembollerinin sağ alt köşesine iyon yüklerinin sayısal değeri çapraz olarak yazılır.
Örnek:
X+n ile Y-m iyonlarından bileşik oluşturalım.
X
+n
m
Y
Na+ ile Cl- iyonları
NaCl
+2
Ca ile Cl iyonları
CaCl2
+3
-2
Al ile CO3 iyonları Al2(CO3)3
6.
-m
n
X mY n
bileşiğini oluşturur.
bileşiğini oluşturur.
bileşiğini oluşturur.
Bileşikler
Burhaniye Anadolu Lisesi
7.
Bileşikler
Burhaniye Anadolu Lisesi
8.
Bileşikler
Burhaniye Anadolu Lisesi
İYONİK YAPILI BİLEŞİKLERİN ADLANDIRILMASI
1.Metal – Ametal Bileşikleri
Metal ve ametalden oluşan iki atomlu bileşiklerdir. Bu bileşikler adlandırılırken, önce
metalin adı daha sonra ametal iyonun adı yazılır.
Metalin adı + Ametal iyonunun adı
Örnek:
Bileşiğin formülü
Adı
Na2O
Sodyum oksit
Mg3P2
Magnezyum fosfür
BaCl2
Baryum klorür
Al2S3
Alüminyum sülfür
NaI
Sodyum iyodür
MgBr2
Magnezyum bromür
2.Metal – Kök Bileşikleri
Metal ve kökten oluşan bileşiklerdir. Bu bileşikler adlandırılırken önce metalin adı daha
sonra kökün adı yazılır.
Metalin adı + Kökün adı
Örnek:
Bileşiğin formülü
Adı
NaOH
Sodyum hidroksit
KNO3
Potasyum nitrat
MgSO4
Magnezyum sülfat
CaC2O4
Kalsiyum oksalat
KMnO4
Potasyum permanganat
BaCO3
Baryum karbonat
Na2CrO4
Sodyum kromat
3.Değişken İyon yüklü Metal Bileşikleri
Bazı elementler, özellikle geçiş metalleri (tranzisyon metalleri) birden fazla katyon
oluşturabilirler.Örnek olarak demiri ele alalım.Demir iki katyon şeklinde olabilir.Fe+2 ve Fe+3
bu katyonlar adlandırılırken pozitif yük Romen rakamı ile yazılır.Romen rakamı ile I bir
pozitif yükü gösterir.II iki pozitif yük demektir vb. Demir (II).. Demir(III)..
Metalin adı + Metal yükünün Romen rakamıyla sayısal değeri + Anyonun adı
Örnek:
Bileşiğin formülü
CuO
Cu2O
PbCl2
PbCl4
HgS
Hg2S
Fe2O3
FeO
9.
Adı
Bakır(II) oksit
Bakır(I) oksit
kurşun(II) klorür
Kurşun(IV) klorür
Cıva(II) sülfür
Cıva(I) sülfür.
Demir(III) oksit
Demir(II) Oksit
Bileşikler
Burhaniye Anadolu Lisesi
4.Kök – Kök Bileşikleri
Pozitif ve negatif yüklü iki kökten oluşan bileşiklerdir. Bu tür bileşikler adlandırılırken
önce pozitif kökün adı sonra negatif kökün adı belirtilir.
Pozitif (+) kökün adı + Negatif (-) kökün adı
Örnek:
Bileşiğin formülü
Adı
NH4NO3
Amonyum nitrat
(NH4)2SO4
Amonyum sülfat
(NH4)3PO4
Amonyum fosfat
5.Kök – Ametal Bileşikleri
Pozitif yüklü kök ile ametal iyonlarının oluşturduğu bileşiklerdir.Bu bileşikler
adlandırılırken, önce kökün adı sonra ametal iyonunun adı belirtilir.
Kökün adı + Ametal iyonunun adı
Örnek:
Bileşiğin formülü
NH4Cl
(NH4)2S
(NH4)3P
Adı
Amonyum klorür.
Amonyum sülfür.
Amonyum fosfür.
KOVALENT (MOLEKÜLER) BİLEŞİKLERİN ADLANDIRILMASI
İyonik bileşiklere benzemeyen moleküler bileşikler ayrı moleküler birimler içerirler.
Genellikle ametalik elementlerden oluşurlar. Birçok moleküler bileşikler ikili bileşiklerdir.
İkili moleküler bileşiklerin adlandırılması ikili iyonik bileşiklerin adlandırılmasına benzer.
Birinci elementin adı + İkinci elementin adının kökü + ür
Örnek:
Bileşiğin formülü
Adı
HCl
Hidrojen klorür
HBr
Hidrojen bromür
SiC
Silisyum karbür
Bir element çifti için birkaç farklı bileşik oluşturmak oldukça yaygındır. Böyle
durumlarda, mevcut her elementin atomlarının sayısını göstermek için yunanca öntakı
kullanılarak bileşik adlandırılır.
Bileşiklerin Adlandırılmasında Kullanılan Yunanca (Latince) Öntakılar
ÖNTAKI Mono Di
Tri
Tetra Penta Hekza Hepta Okta Nona
ANLAMI 1
2
3
4
5
6
7
8
9
Deka
10
1.Ametalin Latince sayısı +1.Ametalin adı +2.Ametalin Latince sayısı +2.Ametalin adı
10.
Bileşikler
Burhaniye Anadolu Lisesi
Örnek:
Bileşiğin formülü
Adı
CO
Karbon monoksit
CO2
Karbon dioksit
NO2
Azot dioksit
SO2
Kükürt dioksit
SO3
Kükürt trioksit
N2O5
Diazot pentaoksit
P2O5
Difosfor pentaoksit
Uyarı: Mono öntakısı birinci element için kullanılmayabilir.
Hidrojen içeren moleküler bileşiklerde Latince öntakı kullanımı istisna oluşturur.
Alışılagelmiş olarak bu bileşiklerin çoğu ya onların yaygın olarak kullanılan sistematik
olmayan isimleri ile veya mevcut H atomlarının sayısını özellikle göstermeden adlandırılır.
Örnek:
Bileşiğin formülü
B2H6
CH4
SiH4
NH3
PH3
H2O
H2S
Adı
Diboran
Metan
Silan
Amonyak
Fosfin
Su
Hidrojen sülfür
HİDRATLI BİLEŞİKLERİN ADLANDIRILMASI
Hidratlar belli sayıda su moleküllerini kendilerine bağlandığı bileşiklerdir. Su molekülleri
ısıtılarak çıkarılabilir. Hidratlı bileşikler adlandırılırken yapısındaki su sayısı Latince olarak
belirtilir.
Bileşiğin adı + Suyun Latince sayısı + Hidrat
Örnek:
Bileşiğin formülü
CuSO4.5H2O
MgSO4.7H2O
Adı
Bakır(II) sülfat pentahidrat
Magnezyum sülfat heptahidrat
Soru5:(ÖSS 2004)Aşağıdakilerin hangisinde verilen bileşik doğru adlandırılmıştır?
Bileşik
Adı
A-)
Fe2O3
Demir(II) oksit
B-)
SO2
Kükürt(II) oksit
C-)
N2O3
Diazot oksit
D-)
Na2O2
Sodyum oksit
E-)
Cu2O
Bakır(I) oksit
11.
Bileşikler
Burhaniye Anadolu Lisesi
Çözüm: Cu bileşiklerinde değişken değerlik alan bir metaldir.Cu2O bileşiğinde bakır,Cu+
iyonu şeklindedir.Oksijen ise O2-2 şeklindedir.Dolayısıyla Cu2O bileşiği doğru
adlandırılmıştır.
Yanıt: E
Soru6:(Olimpiyat 1999) Aşağıdakilerden hangisi Cu(ClO4)2 bileşiğinin doğru ismidir?
A-)bakır(II) klorat
B-)bakır hipoklorit
C-)bakır(II) perklorat
D-)bakır klorit
E-)bakır diklorat
Çözüm: Cu bileşiklerinde değişken değerlik alan bir metaldir. Cu(ClO4)2 bileşiğinde bakır,
Cu+2 iyonu şeklindedir. Perklorat ise ClO4- şeklindedir.Dolayısıyla bileşiğin doğru adı
bakır(II) perklorattır.
Yanıt: C
Soru7:(Olimpiyat 1997)Aşağıdaki isimlendirmelerden hangisi yanlıştır?
A-)H2SO3
B-)HCOC-)ClO4D-)HBrO3
E-)CuSO4
sülfüröz asit
bikarbonat iyonu
hipoklorat iyonu
bromik asit
bakır(II) sülfat
Çözüm: ClO4- iyonunun doğru isimlendirilmesi perklorat olacaktır.
Yanıt: C
Soru8:(ÖYS 1993)19K, 12Mg, 13Al elementlerinin 8O ile verdikleri bileşiklerin formülleri
aşağıdakilerin hangisinde doğru olarak gösterilmiştir?
A-)KO, MgO, Al2O3
B-)K2O, MgO, Al2O3
C-)K2O2, Mg2O, Al3O2
D-)KO, MgO2, Al2O3
E-)KO2, MgO2, AlO3
Çözüm: K+ , Mg+2, Al+3, O-2 elementleri şeklinde iyonlaşırlar. Ametal – metal bileşikleri
oluşurken yükler çaprazlanır ve formülleri K2O, MgO, Al2O3 olur.
Yanıt: B
12.
Bileşikler








![C Elementi [Slayt]](http://s1.studylibtr.com/store/data/000924935_1-effe9d67aa73b7116686c4c63d62e23f-300x300.png)