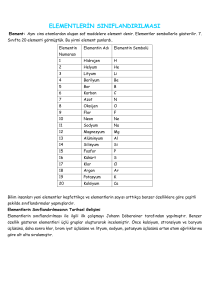
ELEMENTLERİN SINIFLANDIRILMASININ TARİHSEL GELİŞİMİ
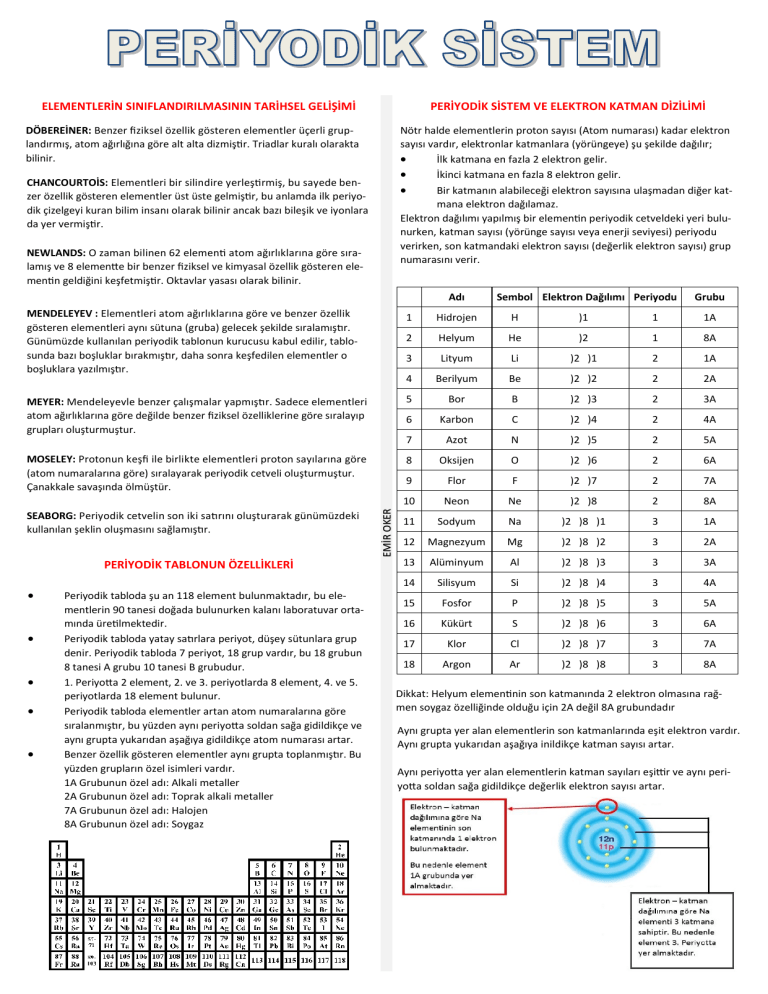
PERİYODİK SİSTEM VE ELEKTRON KATMAN DİZİLİMİ
DÖBEREİNER: Benzer fiziksel özellik gösteren elementler üçerli gruplandırmış, atom ağırlığına göre alt alta dizmiştir. Triadlar kuralı olarakta
bilinir.
Nötr halde elementlerin proton sayısı (Atom numarası) kadar elektron
sayısı vardır, elektronlar katmanlara (yörüngeye) şu şekilde dağılır;
İlk katmana en fazla 2 elektron gelir.
İkinci katmana en fazla 8 elektron gelir.
Bir katmanın alabileceği elektron sayısına ulaşmadan diğer katmana elektron dağılamaz.
Elektron dağılımı yapılmış bir elementin periyodik cetveldeki yeri bulunurken, katman sayısı (yörünge sayısı veya enerji seviyesi) periyodu
verirken, son katmandaki elektron sayısı (değerlik elektron sayısı) grup
numarasını verir.
CHANCOURTOİS: Elementleri bir silindire yerleştirmiş, bu sayede benzer özellik gösteren elementler üst üste gelmiştir, bu anlamda ilk periyodik çizelgeyi kuran bilim insanı olarak bilinir ancak bazı bileşik ve iyonlara
da yer vermiştir.
NEWLANDS: O zaman bilinen 62 elementi atom ağırlıklarına göre sıralamış ve 8 elementte bir benzer fiziksel ve kimyasal özellik gösteren elementin geldiğini keşfetmiştir. Oktavlar yasası olarak bilinir.
Adı
Sembol Elektron Dağılımı Periyodu
Grubu
1
Hidrojen
H
)1
1
1A
2
Helyum
He
)2
1
8A
3
Lityum
Li
)2 )1
2
1A
4
Berilyum
Be
)2 )2
2
2A
MEYER: Mendeleyevle benzer çalışmalar yapmıştır. Sadece elementleri
atom ağırlıklarına göre değilde benzer fiziksel özelliklerine göre sıralayıp
grupları oluşturmuştur.
5
Bor
B
)2 )3
2
3A
6
Karbon
C
)2 )4
2
4A
7
Azot
N
)2 )5
2
5A
MOSELEY: Protonun keşfi ile birlikte elementleri proton sayılarına göre
(atom numaralarına göre) sıralayarak periyodik cetveli oluşturmuştur.
Çanakkale savaşında ölmüştür.
8
Oksijen
O
)2 )6
2
6A
9
Flor
F
)2 )7
2
7A
10
Neon
Ne
)2 )8
2
8A
11
Sodyum
Na
)2 )8 )1
3
1A
12
Magnezyum
Mg
)2 )8 )2
3
2A
13
Alüminyum
Al
)2 )8 )3
3
3A
14
Silisyum
Si
)2 )8 )4
3
4A
15
Fosfor
P
)2 )8 )5
3
5A
16
Kükürt
S
)2 )8 )6
3
6A
17
Klor
Cl
)2 )8 )7
3
7A
18
Argon
Ar
)2 )8 )8
3
8A
SEABORG: Periyodik cetvelin son iki satırını oluşturarak günümüzdeki
kullanılan şeklin oluşmasını sağlamıştır.
PERİYODİK TABLONUN ÖZELLİKLERİ
Periyodik tabloda şu an 118 element bulunmaktadır, bu elementlerin 90 tanesi doğada bulunurken kalanı laboratuvar ortamında üretilmektedir.
Periyodik tabloda yatay satırlara periyot, düşey sütunlara grup
denir. Periyodik tabloda 7 periyot, 18 grup vardır, bu 18 grubun
8 tanesi A grubu 10 tanesi B grubudur.
1. Periyotta 2 element, 2. ve 3. periyotlarda 8 element, 4. ve 5.
periyotlarda 18 element bulunur.
Periyodik tabloda elementler artan atom numaralarına göre
sıralanmıştır, bu yüzden aynı periyotta soldan sağa gidildikçe ve
aynı grupta yukarıdan aşağıya gidildikçe atom numarası artar.
Benzer özellik gösteren elementler aynı grupta toplanmıştır. Bu
yüzden grupların özel isimleri vardır.
1A Grubunun özel adı: Alkali metaller
2A Grubunun özel adı: Toprak alkali metaller
7A Grubunun özel adı: Halojen
8A Grubunun özel adı: Soygaz
EMİR OKER
MENDELEYEV : Elementleri atom ağırlıklarına göre ve benzer özellik
gösteren elementleri aynı sütuna (gruba) gelecek şekilde sıralamıştır.
Günümüzde kullanılan periyodik tablonun kurucusu kabul edilir, tablosunda bazı boşluklar bırakmıştır, daha sonra keşfedilen elementler o
boşluklara yazılmıştır.
Dikkat: Helyum elementinin son katmanında 2 elektron olmasına rağmen soygaz özelliğinde olduğu için 2A değil 8A grubundadır
Aynı grupta yer alan elementlerin son katmanlarında eşit elektron vardır.
Aynı grupta yukarıdan aşağıya inildikçe katman sayısı artar.
Aynı periyotta yer alan elementlerin katman sayıları eşittir ve aynı periyotta soldan sağa gidildikçe değerlik elektron sayısı artar.