Prof. Dr Hüseyin Öztürk Jeokimya notları –Prof.Dr Miraç AKÇAY’Jeokimya kitabından yararlanılmıştır.
GENEL BAKIŞ
Evren İngilizce cosmos, sözcüğünden gelir. Evrenin oluşumu ile
ilgili en çok kabul gören kuram, İlk Patlama kuramıdır.
İLK PATLAMA KURAMI
Evrenin oluşumu hakkındaki güncel görüşler, evrenin yaklaşık
bundan 13,7 milyar yıl önce meydana gelen bir ilk patlama (Big Bang)
ile doğduğu ve o andan beri her yöne ışık hızı ile yayıldığı ilkesine
dayanmaktadır.
Buna göre tüm evren, 10-43 s’de (Plank zamanı) patlayan sonsuz
yoğunlukta, 1,417.1032 K (Plank ısısı) sıcaklığında ve 3.10-21 m
çapında (proton büyüklüğünde) bir küreden ortaya çıkmıştır.
Patlamadan 10-35 s sonra yaklaşık 3 mm çapına varan evrenin
yayılma hızı, ışık hızını aşmıştır. Bunun yaptığı yankıya Kozmik
Işınım veya Arka Plan Işıması denir ve evrenin oluşumu hakkında
elde edilen ilk belirtidir.
Bu evrede yayılan evren plazması, sadece foton ve yüklü
parçacıklardan oluşmaktaydı. Bundan ancak yaklaşık 380.000 yıl sonra
ilk atomlar ve 300.000.000 yıl sonra da ilk yıldızlar oluşmaya
başlamıştır.
Bugünkü evrenin çapı 3.1022 km’dir. Şimdi ortalama sıcaklığı
yaklaşık 2,7 K olan evrenin ortalama yoğunluğu 2,3.10-26 kg/m3’tür.
Bu, yaklaşık 1 km3’e 1 hidrojen atomuna karşılık gelir.
Bugünkü evrenin ancak % 4’ü görünen maddeden oluşmaktadır.
Teorik olarak varlığı ispatlanan, ancak şimdiye kadar örneğine
rastlanamayan karanlık madenin oranı % 19 ve karanlık enerji oranı da
% 76’dır.
Evrenin şekli ve sonsuz mu, yoksa sınırsız mı olduğu hakkında da
farklı savlar tartışılmaktadır. Bunların en kabul göreni küresel evren
modelidir. Bu geometrik şekli ile uzay, birçok madde yığışımlarını
içermektedir.
Bunların en büyük ve karmaşıklarına Voids adı verilir. Bunların
içinde büyüklük sırasına göre; süper kümeler, gökada (galaksi)
kümeleri, gökadalar, yıldız kümeleri, gezegen sistemleri, yıldızlar,
gezegenler (Yerküre), aylar (Ay), astroid, meteorit yer alır.
Evren; manyetik alan, ışın, süper kümelerden en küçük
parçacıklardan fotona kadar her şeyi içermektedir. Yani evren her yerde
vardır.
Evrenin daha ne kadar genişleyeceği ve sonunun ne olacağı
bilinmemektedir. Tahminen 30 milyar yıl sonra evren son bulacaktır.
Belki evrendeki madde miktarının kesin hesaplanması bu sorulara yanıt
getirecektir.
Saman Yolu’nun yandan (üstte) ve güneş sistemi’nin konumu ile üstten
görünüşü (altta) (Tübitak, 2000).
GÜNEŞ SİSTEMİ
Bugün izlenebilen evrenin sınırları içinde çok sayıda yıldız sistemi
yer almaktadır. Bu sistemlerden biri yerin de içinde bulunduğu Güneş
Sistemi’dir. Merkezde bir yıldız (Güneş) ile etrafında dönen 9 gök
cisminden (gezegen) oluşmaktadır. Bu sistemin içinde gezegenlerin
etrafında dönen 250 uydu (ay), çok sayıda astroid, kuyruklu yıldız,
meteorit ile toz ve gaz bulunmaktadır.
Güneş’ten dışa doğru Merkür, Venüs, Dünya ve Mars’a İç veya
Ağır Gezegenler denir. Jüpiter, Satürn, Uranüs ve Neptün de Dış veya
Hafif Gezegenler’dir. Ağır gezegenler ağırlıklı olarak kayaçlardan;
hafif gezegenler ise, gazlardan meydana gelirler ve büyüktürler. Ancak
Plüton ağırlığı nedeniyle iki gruba da girmemektedir.
Güneş sistemi’nde gezegenlerin konumu (Jacobshagen ve diğ., 1999).
Güneş Sisteminin Oluşumu
Güneş sistemi yaklaşık 5 milyar yıl önce, evrenin yaklaşık 2/3’ü
şekillendikten sonra oluşmuştur.
Güneş sisteminin oluşumu tarihi çağlardan beri insanları meşgul
etmektedir. 18. yy'dan itibaren fizik yasaları ile açıklanmaya çalışılan
oluşum savları, günümüzde de tartışmalara konu olmaktadır. Bu
konudaki savların tümü güneş sisteminin bir ilk güneşten veya bir ilk
güneş bulutundan meydana geldiğini savunmaktadır:
1. Buffon (1749) gezegenlerin yıldızların güneşe çarpması ile oluştuklarını
kabul etmiştir. Buna karşın,
2. Kant (1775), gezegenlerin oluşumunu ilk güneş bulutunda bulunan
yoğun yerlerin merkezinde madde yoğunlaşmasına bağlamıştır.
3. Laplace (1796) ise, bugünkü gezegenlerin bütün uzayı dolduran güneşin
giderek hızla dönmesi sonucu kopan gaz halkalarından meydana
geldiğini savunmuştur.
Fizik ve astronomideki gelişmeler zamanla bu savlarin inanırlıklarını
yitirmelerine neden olmuştur.
Bugün geçerli sayılabilecek görüş, Nebülar Kuramı’dır. Burada ilk
güneş hızla dönen, gaz ve katı parçacık bileşiminde bir mercek şeklinde
kabul edilmektedir. Bu bulutumsunun bazı yerlerinde oluşan
türbülanslarda madde yoğunlaşması ile gezegenler meydana gelmiştir. Bu
kuram aynı zamanda iç ve dış gezegenlerdeki yoğunluk farklarını da
açıkladığından, inandırıcı gelmektedir. Dıştaki gezegenler daha hafif ve
büyüktürler. Zira yoğunlaşma sırasında ağır maddeler merkezde, hafif
maddeler (gazlar) dışta yoğunlaşmıştır.
Güneş Sisteminin Özellikleri
Güneş sistemi evrene göre çok küçük bir birimdir. Güneş Sistemi
geometrik olarak odaklarının birinde güneşin bulunduğu bir elipsoide
benzemektedir. Güneşin etrafında 9 gezegen bulunmaktadır. Bunların
hepsi çok düzenli, içten dışa doğru sıralanmakta ve Güneş’in
ekvatorundan geçen yaklaşık aynı düzlemde yer almaktadırlar. Venüs,
Uranüs ve Plüton dışındaki gezegenlerin hepsi hem kendi eksenleri,
hem de güneş etrafında, uyduları (ayları) ile birlikte, aynı yönde
dönerler. Jüpiter’e kadar gezegenlerin yarıçapları düzenli büyür (Mars
hariç). İç gezegenler yerden küçük, dış gezegenler ise, büyüktür (Plüton
hariç).
Güneşin kendisi hidrojen ve helyumdan meydana gelir. Enerji
kaynağı, çekirdekte çekirdeksel işlevlerle hidrojenin helyuma
dönüşmesidir.
Mars ile Jüpiter arasında yukarıdaki mesafelerin düzenine göre bir
gezegenin daha bulunması gerekirdi. Ancak burada gezegen yerine bir
Astroid Kuşağı yer almaktadır. Bu astroidler ya parçalanmış bir
gezegenin artıkları, ya da gezegen haline gelememiş göktaşlarıdır.
Yeryüzüne zaman zaman düşen göktaşlarının kısmen bu kuşaktan
geldiği sanılmaktadır.
Yeryüzüne sürekli göktaşları (meteoritler) düşmektedir. Bunların
küçük olanları yerin atmosferinde sürtünmeden dolayı buharlaşarak
dağılırlar.
Güneş Sisteminin Kimyasal Bileşimi
Uzaydaki gök cisimleri, yaydıkları ışığın spektral analizi, gök
taşlarının, kozmik tozların ve gezegenlerin doğrudan incelenmesi ile
araştırılırlar. Güneş tayfı ile saptanan element derişimi ile kondritlerde
saptanan element derişim arasında doğrusal bir bağıntı mevcuttur. Bu,
farklı iki yöntemle yapılan saptamanın doğruluğunu gösterir.
Şimdiye kadarki incelemelere göre:
1. 40'tan küçük atom numaralı elementlerin derişimi, atom
numaraları ile ters orantılıdır,
2. Çift atom numaralı elementler, tek atom numaralı elementlere
göre 10 kat daha yaygındır,
3. Ni'e kadar hafif elementlerin derişimi, ağır elementlerinkine göre
daha çok değişiyor
4. Komşu elementlere göre demirin derişimi çok yüksek, Li, Be ve
B’un ise, çok düşüktür.
Ayrıca güneş sistemi’nde H ve He en çok bulunan elementlerdir.
Atom sayılarına göre He, H’in % 10’u kadardır, ancak ikisi birden
Güneş sistemi’nin % 98’ine karşılık gelmektedir. Bu sonuçlar,
elementlerin nasıl oluştuklarına işaret etmektedir.
Güneş Sistemi’nde elementlerin derişimleri (Gill, 1993).
(NTE) Nadir Toprak Elementleri
Gri alan tek ve çift sayılı atom numaralı elementlerinin derişim farkını gösteriyor.
ELEMENTLERİN OLUŞUMU
Oluşumu sırasında sürekli soğuyan evrende, hidrojen (H), ondan
türeyen helyum (He) ve lityum (Li) oluşmuştur. Ancak bir milyar yıl
sonra gökada dönemi başlayabilmiştir. Daha önce serbest halde
dağılmış parçacıklar gaz bulutlarını oluşturarak daha yoğun kitlelere
dönüşmüştür. Bunların çekirdeklerinde hafif H2 ve O2
yoğunlaşmasından yıldızlar meydana gelmiştir. Büyük kitlelere sahip
yıldızlar, oksijen rezervlerinin tükenmesi sonucu, büyük patlamalara
neden olmuşlardır. Bu patlamalar daha güçlü süpernova gibi füzyon
olaylarını doğurmuştur. Bununla tüm evrene yıldızların külleri dağılmış
ve helyumdan demire (Fe) kadar olan elementleri meydana getirmiştir
(107-109 K). Daha yüksek ısıda Fe'den ağır elementler meydana
gelmiştir. Bugün yeryüzünde bilinen doğal element sayısı 92'dir. Bu
elementlerin ve izotoplarının kombinasyonundan sayısız yıldız
meydana gelmiştir (güneş benzeri en az 1022 tane).
Uzay araştırmacıları, yukarıda belirtildiği gibi, evrenin ilk
evrelerinde bir tek elementin, sadece hidrojenin, olduğuna
inanmaktadırlar. Diğer elementler bunun türevidir. Elementleri
oluşturan işlevlere nükleon sentezi denir. Buna göre 107 K’de bir
nötron alan hidrojen atomu döteryuma, bu da trityuma dönüşür.
Trityumun bir proton alması ile helyum oluşuyor. 108 K’de He’dan C
ve O; bunlardan da 109 K’de Si’dan Fe oluşur.
Bugünkü çekirdek fiziği modellerine göre maddenin temel taşları
kuvark ve leptonlardır.
Tüm maddeler bu parçacıkların devşiriminden meydana gelir. Bu
olayların sonuçlarından biri de yaklaşık 5 milyar yıl önce oluşan Güneş
sistemi ve ~ 4,6 milyar yıl önce şekillenen Yerküre’dir.
Elektron ve periyodik sistem
Elementlerin kimyasal özellikleri ve periyodik cetveldeki konumları elektron
tarafından belirlenmiştir.
Elektron, çekirdeğin tersine, eksi yüklüdür. Buna elementer yük denir (e=1,602.10-19 Coulomb, As). Bu yük 1 elektron volta (eV) eşittir ve bir tam sayıdır.
Elektronla protonun yükleri eşittir. Elektronların yer ve yörüngelerinin saptanması
anlamsız olduğundan (Heisenberg belirsizliği), en yüksek olasılıkla elektronun
bulunduğu yer, bir küresel hacim olduğu söylenebilir.
Bu hacme orbital (elektron bulutu) denir. Bununla atomun çağdaş bulut modeli
doğmuştur. Bu elektron bulutları her biri bir dalga fonksiyonu ψ2 ile tanımlanmakta
ve en az bir kuvant sayısı ile birbirinden ayrılırlar (ana kuvant sayısı l, dönü
impulsu sayısı m, manyetik kuvant sayısı n ve spin dönü impulsu sayısı s; Şekil
3.3). Elektronlar çekirdek
etrafından dönerken aynı zamanda kendi eksenleri etrafında da dönerler. Buna
spin denir.
Elektronlar arttıkça orbitaller de geometrik dağılarak x, y ve z eksenlerine göre
dizilirler
Her atom birden fazla yörüngeye sahip olamaz (sadece
1'er yörüngesi olan H ve He gibi).
Ancak çok sayıda elektronu olan atomun birkaç elektron
yörüngesi olabilmektedir.
Bu yörüngeler K, L, M...P ve Q diye adlandırılmakta veya
1, 2...7 olarak numaralandırılmaktadır
(Şekil 3.3).
Bunlar da l=0, 1, 2...(n-1) formülüne göre her biri s, p, d ve
f alt enerji seviyelerine ayrılmaktadır.
İçten 1. yörüngenin yalnız 1 tane s alt enerji seviyesi
olabilir ve en çok 2 elektron alabilir. Bu seviye 1s2 şeklinde
gösterilir (“1 s iki” diye okunur).
2. Yörüngede en çok 2,
3. yörüngede 3 ve
4. yörüngede de en çok 4 alt enerji seviyesi bulunabilir.
4'ten sonra artan elektron sayısına rağmen alt enerji
seviyeleri 1'e doğru azalır
Yörüngelerdeki elektron sayısı, e = 2n2 formülüne göre dağılırlar (n, yörünge
sırası). Buna göre,
K yörüngesi en çok 2 = 2.12,
L yörüngesi en çok 8 = 2.22,
M yörüngesi en çok 18 = 2.32 ve
N yörüngesi de en çok 32 = 2.42
elektron bulundurabilir. Alt enerji seviyeleri de en çok,
s = 2,
p = 6,
d = 10 ve
f = 14
elektron alabilir. Örneğin, normal durumdaki bazı elementlerin elektron dağılımı
şöyledir:
H : (1s)1,
C: (1s)2 (2s)2 (2p)2,
Na: (1s)2 (2s)2 (2p)6, (3s)1 ve
As: (1s)2, (2s)2 (2p)6 (3s)2 (3p)6 (3d)10 (4s)2 (4p)3
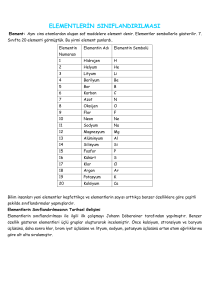
Elementlerin periyodik cetveldeki yerleri elektronlarının yasalarına göredir (
Periyodik sistemde elementler proton sayılarına (atom numaralarına) göre
sıralanmışlardır. 92 elementin yer aldığı sistemde, yeni doğal element
beklenmemektedir.
Tüm atomları eşit proton (Z) sayısından oluşan maddelere element denir.
Başka bir tanımla, demir (Fe) ve kuvarsta (Si) olduğu gibi, bir elementin
tüm atomlarının proton ve elektron sayısı eşittir.
Lavoisier 1789’da 31, Mendelejew 1869’da 67 doğal elementi
tanımlamaktadır.
Bugün bu sayı 92’ye yükselmiştir.
Uzun ömürlü yapay elementlerle 103'e,
kısa ömürlü elementler de buna eklendiğinde 115'e çıkmaktadır
Periyodik cetvelde yeni bir elemente yer bulunmamaktadır.
Bir element, 14N 7 gibi proton sayısı sol altta, parçacık sayısı
(atom ağırlığı) da sol üstte yazılarak gösterilir.
Teknetiyum (43Tc,), Promesyum (61Pm,), Astat (85At,) ve Frankiyum
(87Ft,) doğal olarak bulunmamaktadır. Bunlar
sadece atom reaktörlerinde yan ürün ve yapay izotop olarak elde edilirler.
s, p : temel grup
elementleri
d
: geçiş elementleri
f
: iç geçiş elementleri
4f : lantanitler
5f : aktinitler
1A
1
2A
2
Metaller
1B 11
6A 16
7A 17
8A 18
Alkali Metaller
Toprak Alkali
Para Metalleri
Kalkojenler
Halojenler
Soy Gazlar
Periyodik sisteme tüm elementler uymaz.
Yan grup elementleri (d bloku/geçiş metalleri) ve
lantanitler uyumsuz elementleri teşkil ederler
(Şekil 3.4). Bunlarda bazı yörüngelerinin, özellikle
N yörüngesinin, alt enerji seviyeleri tam dolmadan,
O yörüngesinin alt enerji seviyeleri dolmaya başlar.
Bu nedenle yan grup elementlerinin özellikleri
değişiyor. Örneğin, bunlar birden fazla oksidasyon
sayılı olabilir (Fe2+ ve Fe3+), ana gruptaki
elementlerden çok birbirlerine benzerler ve metalleri
teşkil ederler. Metaller, kendi aralarında alaşım
yaparlar, en iyi elektrik ve ısı iletir, kolay
şekillenirler.
Lantanit (Z=57-71) ve aktinitler (Z>88) 3+ oksidasyon sayılıdır. Bunların elektron dizilişi
esasında yan grup elementlerinkine benziyor. Lantanitlere aynı zamanda nadir toprak
elementler de denir (NTE veya İng.: rare earth elements, REE). Bunlar, jeokimyada köken
ve ortam araştırmalarında büyük önem taşır ve elektronik sanayinin temel taşlarıdır.
Periyotlar 7 tanedir. Sıra numaraları yörünge sayısını gösterir (K, L, M ...Q).
Periyotlarda sağa doğru elementlerin elektron sayısı, atom ağırlıkları ve değerliliği
artar. Ancak yarı çapı küçülür. Soldaki s blok elementleri öncelikle baz, sağdaki p blok
elementleri ise, asit yapma eğilimini gösterirler. Komşu iki elementin çift sayılı atom
numaralısı, tek sayılı atom numaralısından daha çok bulunur (Şekil 2.4). Bulucularının
adıyla anılan bu kural, kimyada Oddo-Harkins Kuralı olarak bilinmektedir.
I1 < I2 < I3 < I4
Al(g)
Al+(g) + e-
I1 = 580 kJ/mol
birinci
Al+(g)
Al2+(g) + e-
I2 = 1815 kJ/mol
ikinci
Al2+(g)
Al3+(g) + e-
I3 = 2740 kJ/mol
üçüncü
Al3+(g)
Al4+(g) + e-
I4 = 11,600 kJ/mol
dördüncü