Kanser Araştırmaları-Yeni telomeraz inhibitörlerinin, günümüzde kullanılan geleneksel
kemoterapi ilaçlarına alternatif yeni kemoterapi ilaçlarının, DNA interkelatörlerin sentezi ve
biyomakromoleküllerle (DNA, RNA gibi) etkileşim çalışmaları;
Kanser en önemli sağlık sorunlarından birisidir ve farklı toplumlarda sıklıkla görülmektedir.
2002 yılında Dünya Sağlık Örgütü’nün verdiği rakamlara göre tüm dünyada 11 milyon insana
farklı türde kanser teşhisi konulmuş, bunların 7,1 milyonu yaşamını yitirmiştir. Yine 2002
yılında, 2020 yılında 16 milyon insana çeşitli tipte kanser teşhisi konulacağı öngörülmüştür.
Fakat geçtiğimiz yıl itibariyle bu rakam 25 milyona ulaşmıştır. 2010 yılında açıklanan tahmini
rakamlara göre ise, 2030 yılında yaşayan kanser hastası sayısının 75 milyona (26 milyon yeni
tanı ile birlikte), ölenlerin sayısının ise 17 milyona çıkacağı tahmin edilmiştir. Bu rakamlar
dünyada kanser teşhisi ve tedavisinin ne kadar önemli olduğunu ortaya koymaktadır.
Ülkemizde 1970’li yıllarda sebebi bilinen ölümler sırasında dördüncü sırada yer alan kanser,
son yıllarda kardiyovasküler sistem hastalıklarından sonra ikinci sıraya yükselmiştir.
Önlenebilir ve tedavi edilebilir bir hastalık olan kanserin bu denli hızlı artış göstermesi
ülkemizde kanserin teşhisi ve tedavisi ile etkin mücadele edilmesini gerekli kılmaktadır.
Kanserle daha etkin mücadele edebilmek adına Ulusal Kanser Enstitüsü kurulması
zorunluluğu Kanserle Savaş Dairesi Başkanlığı tarafından geçtiğimiz senelerde sürekli olarak
dile getirilmiştir. Ayrıca, bu alandaki çalışmalar oldukça büyük önem kazanmış olup, kanser
teşhisi ve tedavisinde kullanılacak moleküllerin sentezi ve uygulamaları güncel araştırma
konularının içinde olmuştur.
Günümüzde, kanserin tedavisinde kemoterapi ilacı olarak kullanılan moleküllerin önemli bir
dezavantajı seçici olmamalarıdır. Bunlar, tümör hücrelerinin yanında sağlam hücrelerin DNA
yapısını bozar ve bazen sağlam hücrelerde tamiri mümkün olmayan yan etkilere sebep olur.
Yeni sentezlenen moleküllerdeki temel hedef; sadece tümör hücrelerine karşı seçicilik sonucu
düşük zehir etkisidir. Son yıllarda gelişen teknoloji ile birlikte tümör hücrelerine karşı yüksek
seçicilik gösteren bileşikler sentezlenmiştir. Bu moleküllerin büyük bir kısmının hücre içi ve
dışında tümör hücrelerine karşı aktif olduğu belirlenmiş olup farklı tedavi yöntemlerinde
kullanılmaktadır. Farklı yöntemlerin ve moleküllerin kullanımı, kanserin türüne ve oluşum
evresine bağlıdır.
Klinik olarak kullanılan birçok antikanser ilacı DNA’ya interkelasyon prosesi ile
bağlanmaktadır. Bu proses düzlemsel aromatik ya da heteroaromatik halka sistemleri içeren
bileşiklerin heliks eksenine dik ve Watson–Crick hidrojen bağının neden olduğu istiflenme
düzeninin tümünü bozmadan bitişik baz çiftlerinin arasına yerleşmesidir. Son birkaç yıldır,
interkelasyon yapan floresans moleküller oldukça önem kazanmış olup kanser tedavisinde
kemoterapi ilacı; biyofiziksel kimya ve moleküler biyolojide floresans uç ve sensör; DNAbozunma reaksiyonlarında fotosensetizer ve floresans lekeleyici olarak kullanılmaktadır.
DNA’ya kovalent olmayan etkileşmelerle bağlanan floresans interkelatörler tümör
hücrelerinin etrafında seçici olarak toplanıp tümör hücrelerinin çoğalmasını engellemektedir.
İnterkelasyon tipik olarak DNA’nın yapısal bozulmasıyla sonuçlanır ki bu da antikanser
etkisini göstermesine neden olmaktadır.
Şekil 1. a) Etidinyum Bromür (Etidinyum bromür (EB) karakteristik bağlanma özellikleri ile
en hassas floresans uçlardan biridir ve DNA’ya interkelasyon ile bağlanır) b) Etidinyum
Bromürün DNA çift sarmalına interkelasyonla bağlanması
İnterkelatörler genellikle maksimum istiflenmeyi ve baz çiftleriyle hidrofobik etkileşimleri
sağlayan polisiklik aromatik halkalardan oluşmaktadır. Ancak bu tanıma uymayan istisnai
interkelatörler de bulunmaktadır. Gerçekte birçok interkelatör ya pozitif yüklüdür ya da
fizyolojik şartlarda protonlanabilecek bazik gruplara sahiptir. Çünkü; pozitif yüklü kısımlar
DNA interkelasyonunda daha etkilidir. İlk aşamada bu kısımlar negatif yüklü DNA şekerfosfat iskeleti ile daha iyi etkileşmekte ve ayrıca interkelasyon fosfat grubu ile ilişkili olan
Na+ gibi yüklü yapıları serbest bırakmaktadır. Bu durum interkelasyon için önemli bir itici
güçtür; çünkü birbirine çok yakın olan karşıt yükler arasındaki itme kuvvetlerini azaltır.
7-Aminokumarin
Fenantiridin
Proflavin(acridine orange)
Etidinyum bromür
Thiazole orange
Metilen mavisi
(a)
(b)
Şekil 2. a) Polisiklik aromatik halkalardan oluşan bazı DNA interkelatörleri
b) İstisnai bazı DNA interkelatörleri
Çoğu interkelatör 2-4 baz çifti ile etkileşmektedir ve dizin seçimli interkelasyonla beraber
hücrede seçimli bir toksisiteye sahiptir. İnterkelasyonun başka tür DNA bağlanma türleri ile
kombine edilmesi veya sentezlenen moleküllerin sahip olacağı enzim inhibisyonu
(Topoizomeraz I ve Topoizomeraz II) özellikleri ile DNA interkelatörlerinin kullanımındaki
bu sınırlamanın üstesinden gelinebilir. Örneğin interkelatörün aynı zamanda bir topoizomeraz
inhibitörü olduğu yapılar kanserli hücrenin çoğalmasını farklı iki açıdan engellemeyi
hedeflemektedir. Mitoxantrone, daunorubicin, doxorubicin, dactinomycin gibi sıklıkla
kullanılan antikanser ajanlarının etki mekanizmalarından biri de interkelasyon yapmalarıdır.
Bu bileşiklerin topoizomeraz II enzimi üzerinde etkili olarak ya da singlet oksijen üreterek de
DNA’ya zarar verdiği bilinmektedir.
Bunun dışında yine sıklıkla kemoterapi ajanı olarak kullanılan bleomycin, bakteriden izole
edilen bir glikopeptit antibiyotik olup, yapıda bir interkelasyon bölgesi içermekte ve bununla
DNA’ya bağlanmaktadır.
H 2N
O
H
H
N
H
N
CONH 2
N
O
H 2N
CH 3 NH
O
HO
SM e2
NH 2
HO
O
H
HO
O
H
N
H
N
O
H CH
3
H
CH 3 O
H H
N
HO H
O
NH
N
NH
CH 3
N
S
S
İnterkelasyon bölgesi
H
O
N
H
O
HO
OH
OH
O
HO
O
NH 2
bleom ycin A 2
6.71
Şekil 3. Bleomycin molekülü
DNA topoizomerazları DNA’nın üç boyutlu geometrisini (topolojisini) düzenleyen, topolojik
izomerlerin birbirine dönüşmesine neden olan ve relaksasyonu sağlayan enzimlerdir. Bu
enzimler DNA’nın transkripsiyon ve replikasyonunda elzem olan DNA’nın süper
burulmasının (supercoilling) düzenlenmesi ile ilgilenmektedirler. Topoizomeraz seviyesinde
aktivite gösteren bazı anti tümör ilaçları enzimatik aktiviteyi sonlandırır ki bunlara ‘katalitik
topoizomeraz inhibitörleri’ denir. Diğer topoizomeraz hedefli ilaçlar ise (ki interkelatörler
bunlara dahildir) bölünebilir DNA kompleksini tuzaklayarak enzimin bölünme ve yeniden
katılma aktivitesine müdahale eder. Böylece geçici topoizomeraz katalizli DNA kırılmasının
yarı ömrünü uzatır. Birçok klinik çalışması yapılmış antikanser ilacı ikinci tiptedir ve bunlar
‘topoizomeraz zehirleri’ (topoisomerase poison) olarak adlandırılır; çünkü bunlar
topoizomeraz enzimini, DNA-hasar verici ajanlara dönüştürür.
Son yıllarda, sentezlenen interkelatörler tasarlanırken, genellikle kemoterapide kullanılan
mevcut interkelatörler temel alınmakta ve onların ana iskeleti korunarak onlara bir takım yan
zincirler (halkalı veya düz zincirli aminoalkil grupları) takılmakta veya hetero/karbosiklik
halkaların yapıya dahil edilmesi ile π-delokalizasyonu arttırılması sağlanmaya çalışılmaktadır.
Ayrıca interkelatörlerin, interkelasyon bölgesine ilgisini ve orada geçireceği süreyi artırmak
için tek bir molekülde iki veya daha fazla aynı (örn: bisakridinler, diterkelinyum) veya farklı
(örn: metallointerkelatörler, akridine alkil zincirleriyle bağlı cis platin) yapıda interkelatör
özelliği taşıyan grupların bağlı olduğu sinergistik interkelatörler de sentezlenmektedir. Bu
doğrultuda klinik çalışmalarda kullanılan birçok mono-interkelatörün esnek ve esnek olmayan
değişken karbon zincirleriyle birbirlerine bağlanmasıyla akridin ve fenantridin temelli çok
sayıda bis-interkelatör sentezlenmiştir. Bu bis-interkelatörlerin mono- interkelatörlerinden
daha düşük konsantrasyonda kullanıldığı ve daha yüksek sitotoksik etki gösterdiği rapor
edilmiştir.
H3CO
N
NH
N
N
H3CO
N
N
N
N
NH
Cl
Pt
Cl
N
Bisakridin
interkelatörü
NH
N
H2
Matallo (Cis platin) akridin
interkelatörü
N
H
Diterkelinyum
Şekil 4. Bazı bis ve sinergistik interkelatörlerin yapıları
İnterkelatörler ile biyomakromoleküllerin etkileşimi sonucunda ortaya çıkan bir takım fiziksel
değişimlerin ileri spektroskopik yöntemlerle (CD, floresans, NMR) kolaylıkla görüntülenmesi
bu moleküllerin yapı ve fonksiyonlarının belirlenmesine olanak sağlamaktadır. Özellikle
DNA’ya interkelasyonla bağlanan organik floresans interkelatörler DNA’yı görüntülemekte
ve interkelatör temelli ilaç tasarımında daha çok tercih edilmekte olan bileşiklerdir.
Grubumuz gelecek üç yıl içerisinde geleneksel kemoterapi ilaçlarına benzer fakat onlardan
daha seçici olacağını öngördüğümüz bileşiklerin sentezi ve uygulama çalışmaları üzerine
çalışmalar yapacaktır. Bu bileşiklerin bir kısmı 15 Kasım 2011 Tarihinde başlatılan TÜBITAK
projemizde sentezlenecektir. Bu projede şimdiye kadar sentezlenen organik interkelatörlerden
daha yüksek seçiciliğe sahip, toksik yan etkisi düşük, biyouyumlu, yüksek verimle kolay
sentezlenebilen, anti-tümör etkisi bilinen ana iskelete ve yan gruplara sahip bir seri yeni
Organik Floresans İnterkelatör sentezlenecektir. Bu amaç için ana iskelet olarak
pirazol/pirazolon gibi yüksek biyolojik aktifliği bilinen heterohalkaları seçilmiştir.
Pirazol/Pirazolon türevi bileşikleri çok geniş farmakolojik özelliğe ve kanser hücrelerine karşı
anti-tümör etkiye sahiptir. Bu amaç doğrultusunda, projede bir seri pirazol ve pirazolon
merkezli çok fonksiyonlu biyolojik aktif 1,3,4,5-pirazol ve 1,3,4-pirazolon türevleri
sentezlenecektir. Sentezlenecek hedef bileşiklerin floresans özelliğe sahip olmasından dolayı
bu bileşiklerin fotosensetizer (ışığa duyarlı molekül) olarak da kullanılma potansiyeli
araştırılacaktır. Bu çok fonksiyonlu interkelatörlerin, günümüzde kanser tedavisinde
kullanılan geleneksel organik interkelatörlerden daha üstün nitelikleri bir arada bulundurarak
çok geniş bir kullanım alanına sahip olacağı düşünülmektedir.
Günümüzde anti-kanser ilaçları olarak kullanılan piyasadaki çoğu ilaçlarda hücre
bölünmesinde DNA’ın kendini eşlemesi sırasında kullanılan topoizomeraz I ve topoizomeraz
II enzimlerinin inhibisyonu hedeflenmektedir. Ancak bu enzimler hem normal hücrelerde hem
de kanserli hücrelerde aktif olduğu için kanser tedavisi sırasında normal yaşam hücreleri de
zarar görmektedir. Bu amaçla daha etkin ve sadece kanserli hücrelerin yok edilmesine özgü
araştırmalarda DNA’ın G-dörtlü yapısı hedeflenmiş ve daha etkin ve seçici alternatif antikanser ilaçları geliştirilmiştir.
1953’de ikili DNA için çift sarmal yapısı önerildikten sonra, 1962 yılında G-dörtlüsü (Gquadruplex, G-tetrad) modeli ilk kez Davies ve arkadaşları tarafından önerilmiştir. Ancak
model önerildikten uzun zaman sonra G-dörtlü DNA yapılarının biyolojik süreçlerdeki önemi
anlaşılmaya başlanmıştır. Bir G-dörtlü yapısı dört guanin biriminden oluşur, bu yapı sekiz
Hoogsteen hidrojen bağıyla yassı bir tabaka şeklinde bir arada bulunur. Bu tabakalar birbiri
üzerinde istiflenerek kararlı bir G-dörtlüsü yapısı oluştururlar. Bu yapısıyla G-dörtlü DNA çift
sarmal DNA’dan oldukça farklıdır. Çift sarmal DNA ile G-dörtlü yapısı arasındaki denge
DNA’ya bir protein veya küçük moleküllerin bağlanması, sıcaklığın ve pH’ın değişmesi ve
moleküler kalabalıklaşma ile değişebilir. Dörtlü yapıların fizyolojik şartlardaki (pH:7,4)
kararlılığı, bazların kenarları arasındaki hidrojen bağları ve her dört bazlı birimin ortasında
yer alan bir metal iyonunun (Na+ veya K+, çoğunlukla K+) kelasyonu ile gerçekleşir.
Şekil 5. Kare şeklinde düzenlenen dört guanin molekülünün Hoogsteen hidrojen bağları ile
birbirine bağlanmış kararlı G-dörtlü yapısı ve çift sarmal DNA ile G-dörtlü yapısı arasındaki
denge
Guaninlerin sin/anti konformasyonları ve tek sarmal DNA’nın yönelimine bağlı olarak farklı
G-dörtlüsü yapıları da mevcuttur.
Şekil 6. Tek sarmal DNA’nın molekül içi toplanması sonucu “Sandalye” ve “Basket” şekli ve
alternatif olarak iki, üç veya dört DNA tek sarmalının birleşip moleküller arası G-dörtlü
yapılarını oluşturabilir.
Telomerlerin ucundaki bu düzenlenme ayrıntılı olarak incelendiğinde çok farklı G-tetrad
yapılarının olabileceği gözlemlenmiştir.
Şekil 7. Polimorfik G-dörtlü yapılar
DNA’nın G-dörtlü yapısına karşı olan ilgi, biyolojik süreçlerdeki öneminin kavranmasıyla
hızla artış göstermiştir. Son yıllarda bir çok çalışma grubunun G-dörtlüsü üzerine yaptığı
çalışmalarda, küçük moleküller ile kararlı kompleks oluşturan G-dörtlü DNA yapılarının
tümör hücrelerinin çoğalmasını durdurduğu belirlenmiştir ve bu kanser tedavisinde umut
verici bir gelişme olmuştur. Bunun için önerilen iki mekanizma vardır:
Kanser potansiyeli olan hücrelerin en önemli özelliği "onkojen" içermesi yani bulunduğu
dokudan tamamen farklı yeni bir hücre olacak şekilde bozulma potansiyelinin olmasıdır.
Alınan patoloji örneklerinde bu hücreler kanser dönüşümünü tamamladığında, hücrelerin
kökenini tanımlamak neredeyse imkansızdır. Bir kanser hücresi oluştuğunda vücudun
bağışıklık sistemi bu yabancı hücreyi tanır ve parçalar. Bu sayede vücutta oluşan binlerce
kanser hücresi bağışıklık sistemi tarafından yok edilir. Her hücrede, onkojenlerin
aktivasyonunu baskılayan antionkojenler (Tümör Baskılayıcı Gen) bulunmaktadır.
Antionkojenlerin kaybolması veya aktifliğinin durması durumunda onkojen aktivitesine
izin verilmiş olur. Bunu da kanserin oluşumu izler. G-dörtlü DNA yapısının oluşumu
biyolojik sistemde bu genlerin düzenlenmesinde önemli bir rolü olduğu görülmüştür. Bu
yapıların tümör hücrelerinin çoğalmasını durdurması kanser hücrelerinde c-Myc, c-Kit ve
KRAS benzeri proto-onkojenlerin oluşumunun durdurulması ile olur. Moleküller arası Gdörtlü yapıların (Tetrameric ve Hairpin dimer) c-Myc onkojeninin çoğalma aktivitesini
bastırdığı belirlenmiştir. Çoğalma aktivitesinin engellenmesi ile ilgili iki model vardır:
1. DNA’ın promoter bölgesinde oluşacak G-dörtlü DNA yapısı transkripsiyonunu
engeller. Böylece kanser hücresi oluşumu sağlayacak proteinlerin oluşumu
engellenmiş olur.
Şekil 8. G-dörtlü yapı ile gen aktarımının engellenmesi
2. Genetik kodlanmayan bölgede oluşan G-dörtlü DNA yapısı, kodlayan bölgenin
etkinliğini arttırır ve ardı sıra gelen genin tanınmasını sağlar.
Kanser tedavisinde G-dörtlü yapının kullanıldığı ve daha geniş bir çalışma alanına sahip
ikinci öneri de ise; Telomerik DNA’nın 3’ ucundan uzamasında katalizör görevi gören bir
ribonükleoprotein kompleksi olan telomeraz enziminin aktifliğinin durdurulması
amaçlanmaktadır.
G-dörtlü DNA yapısının oluşumu, tümör hücrelerinin ölümsüzlüğüne sebep olan (telomerin
uzamasına katkı sağlayan) telomerazın aktivitesini hücre içi ve dışında durdurduğu rapor
edilmiştir. Son yıllarda kanser araştırmalarında, anti-kanser ilaç tasarımı için önerilen Gdörtlüsü hedef olarak araştırmacılar tarafından oldukça ilgi görmektedir.
Şekil 9. Ligand ile G-dörtlüsünün kararlı hale gelmesi ile olası telomeraz aktivitesinin ve
onkojen oluşumunun durdurulmasının mekanizması.
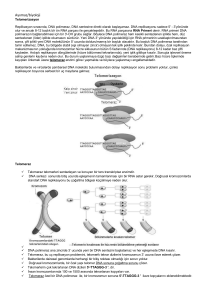
Telomerler ve Telomeraz
Telomerler doğrusal kromozomların uçlarıdır ve binlerce kez tekrarlanan kısa DNA dizileri
(insanda TTAGGG) içerirler. Telomerler, kromozom uçlarının parçalanmasını veya diğer
kromozomlarla kaynaşmasını engelleyerek, kromozomların yapısal bütünlüğünün
korunmasını sağlarlar. Telomerleri sentezleyen ve koruyan telomeraz enzimidir. RNA içeren
bu olağanüstü enzim, telomerik DNA dizilerini doğrusal kromozomların uçlarına ilave eder.
Her replikasyon (yenileme) sonrası kromozom kısalır; çünkü DNA polimeraz ana zincirinde,
3’ ucunda yeni bir DNA sentezini başlatamaz. Telomeraz, bu “uç-replikasyon” problemini de
çözmüştür. Enzim, sayısız telomerik tekrar dizilerini kromozomun 3’ ucuna takarak
kromozomun kısalmasını engeller.
Şekil 10. Ökaryotik Kromozomda Telomer ve Telomerik DNA dizisi.
Ne yazık ki, normal yaşam hücrelerinde telomeraz dinamiği negatif olup, her hücre
çevriminde kaybedilen telomerik DNA miktarı, yeniden sentezlenen telomerik DNA
miktarından fazladır. Normal bir hücrenin her bölünüşünde, telomer boyu yaklaşık 100 baz
çifti kadar kısalır. Örneğin, fibroplast, lökosit gibi yaşam hücrelerinin telomer uzunluklarının,
yaşlı hücrelerde gençlere oranla daha kısa olması telomerlerin kısalması sonucunda hücrelerin
yaşlanması hipotezini desteklemektedir.
Normal hücreler özgül sayıdaki hücre bölünmesinden sonra yaşlanırken, kanser hücrelerinde
durum böyle değildir. Bu yüzden, kanserin hücrede birkaç genetik mutasyonunun birikimi
sonucunda ortaya çıktığı düşünülmektedir. Bu mutasyonlar, normal hücre büyümesini ve
bölünmesini kontrol eden ve dengeleyen işlemleri bozar. Her hücre bölünmesinin ardından
kanser hücresinde telomerler kısalırsa, tümör hücreleri yaşlılığa yenik düşecek ve bölünmeleri
duracaktır. Ancak bu hücreler telomeraz enzimini sentezlerse, yavaşlama duracak ve
ölümsüzlük kazanacaklardır. Bugüne kadar incelenen farklı tür tümör hücrelerinin % 8590’nında telomeraz aktivitesi bulunmaktadır ve telomerleri dayanıklıdır, yani kısalmaz.
Tümör hücresinin kontrolsüz üremesi ile telomeraz aktivitesi arasında oldukça doğrusal bir
orantı olduğundan, kanserin tanı belirleyicisi olarak telomeraz aktivitesi ile ilgili yöntemler,
geliştirilmeye başlanmıştır. Son zamanlarda yapılan çalışmalarda, telomerazın aktivitesinin
durdurulmasının, tümör baskılayıcı mekanizmalardan biri olduğu ve bu enzimin tümör
hücrelerinde apoptozu (programlı hücre ölümü) düzenleyen mekanizmalarda bir bozunma
oluşturduğu görüşü giderek yaygınlaşmaktadır.
Son birkaç yıldır, telomerazın kansere karşı kullanılan ilaçlar için ideal bir hedef olabileceği
görülmüştür. Telomeraz aktivitesini engelleyen ilaçlar, telomer boylarını kısaltır ve kanser
hücrelerini yaşlandırarak öldürür. İnsan normal hücrelerinin(somatik hücreler) çoğunda
telomeraz aktivitesi bulunmadığı için böyle bir tedavi, kanser hücrelerine özgüdür.
Günümüzde kullanılan geleneksel kanser ilaçlarından daha az yan etkisinin olacağı
saptanmıştır.
Optimum telomeraz aktivitesi katlanmamış tekli telomerik DNA’da görülmüştür.
Telomerlerde G-dörtlü DNA yapılarının bulunması ve bu yapının oluşumunun telomerlerin
uzamasını engellediği kanıtlandıktan sonra, G-dörtlü DNA’yı kararlı kılan bileşikler kanser
tedavisinde ilgi çekmeye başlamıştır. Bu ilaçlarla muamele edilen tümör hücreleri telomerik
dizilerini kaybettiği ve yaklaşık 25 hücre bölünmesinden sonra öldüğü bildirilmiştir. G-dörtlü
DNA’yı hedef alan seçici (diğer tüm nükleik asitlere karşı düşük ilgisi olan) küçük
moleküllerin anti-kanser ilaç olarak kullanılma potansiyeli olması son birkaç yılda bu alanda
çalışan bilim insanlarında heyecan yaratmıştır. Bu ligandların G-dörtlüsüne karşı seçicilik ve
ilgisinin yüksek olması anti-kanser ilacı olarak kullanılmasında önemli etkendir.
Şimdiye kadar sentezlenen G-dörtlüsü ligandları, hücre içi ve dışında G-dörtlü DNA’ya
bağlandığı ve onu kararlı kıldığı bir çok araştırma grubu tarafından rapor edilmiştir. Bu
ligandlar dörtlü yapının döngüleri (loop) ve olukları (groove) ile etkileşirler. Aynı zamanda,
bu tip ligandlar G-dörtlü ile π-π istiflenmesine (stacking) girecek aromatik merkeze ve
fizyolojik şartlar altında pozitif yükle yüklenerek dörtlünün dış sarmalındaki oluklarla
etkileşecek bazik alkilamino yan zincirine sahiptir. Şimdiye kadar birçok molekül potansiyel
telomeraz inhibitörü olarak sentezlenmiştir. Antrakinonlar ve 3,6-disübstitüe akridinler
bunların ilkleridir. Sonrasında sentezlenen trisübstitüe akridinler, porfirinler ve triazinler ile
telomeraz aktivitesinin azaltılması amaçlanmıştır
Şekil 11. Bilinen en önemli G-dörtlüsü ligandları.
Telomeraz inhibitörü olarak bilinen en önemli bileşiklerden birisi BRACO19 (3,6,9trisübstitüe akridin)’dur. Bu bileşiğin hücre içi ve dışında 1 mikromolar konsantrasyonun
altında tümör büyümesini durdurduğu rapor edilmiştir. BRACO19’da akridin ana iskeletine
3,6-konumlarından bağlanan, uç amino sübstitüentlerinin büyüklükleri insanda molekül içi
telomerik DNA dörtlüsüne bağlanmada etkili bir faktördür. Ayrıca, çok yakın bir zamanda
sentezlenen bazı bileşikler, geleneksel alkilamino sübstitüentlerinin yerine esnekliği daha az
olan iki guanilhidrazon grubu içermektedir. Beklenmeyen bir şekilde bu bileşiklerin yüksek
G-dörtlü ilgisine ve kayda değer şekilde antitelomeraz aktiviteye sahip olduğu rapor
edilmiştir.
Berberin ve telomestatin gibi doğal bileşikler de insan telomeraz enziminin aktifliğinin
durdurulmasına karşı etki göstermiştir. Ayrıca, telomestatin hücre içi/dışında birçok insan
tümör hücresinin büyümesini azaltıcı bir etki göstermiştir. G-dörtlü yapılarını özellikle
piperidino-berberin türevleri daha kararlı kılmış ve daha iyi anti-telomeraz aktivitesi
göstermiştir. Perilendikarboksiimidler, G-dörtlü yapıları ile etkileşirerek farklı G-dörtlü
yapılarının oluşumu için iyi bir eğilim gösterirler. Bu yapıların telomerazın aktifliğinin
durdurması ve dörtlü yapıyı kararlı kılması imid azotuna bağlı olan yan zincirin bazikliğine ve
uzunluğuna bağlıdır. Birçok ligand şimdiye kadar literatürde G-dörtlü yapıları kararlı kılan
ligandlar olarak önerildiği halde, şimdiye kadar araştırmalarda en çok katyonik porfirin
TMPyP4 bileşiği kullanılmıştır.
KAYNAKLAR
1.Eckhardt, S., Recent progress in the development of anticancer agents, Curr. Med. Chem.Anti-Cancer Agents 2, 419–439,(2002).
2. Lee, C. W., Hong, D. H., Han, S. B., Jong, S.-H., Kim, H. C., Fine, R. L., Lee, S.-H., Kim,
H. M., A novel stereo-selective sulfonylurea, 1-[1-(4-aminobenzoyl)-2,3-dihydro-1H-indol-6sulfonyl]-4-phenyl-imidazolidin-2-one, has antitumor efficacy in in vitro and in vivo tumor
models, Biochem. Pharmacol., 64, 473–480,(2002).
3. Ihmels ,H., Otto, D., Intercalation of Organic Dye Molecules into Double-Stranded DNA–
General Principles and Recent Developments, Top Curr Chem, vol 258, (2005) Pp:161–204.
4. Thurston, D.E., Nucleic acid targeting: therapeutic strategies for the 21st century, Br J
Cancer 80, 65-85, (1999).
5. Hurley, L,H., DNA and its associated processes as targets for cancer therapy, Natl. Rev.
Cancer 2, 188-200, (2002).
6. Foye, W. O., Cancer chemotherapeutic agents. ACS, Washington, DC(ed) (1995)
7. Neidle, S., Thurston, D.E. In: Kerr DJ, Workman, P. (eds) New targets for cancer
chemotherapy. CRC Press, Boca Raton, FL, (1994), Pp: 159.
8. Propst, C.L, Perun, T. L. (eds) Nucleic acid targeted drug design. Dekker, New York,
(1992).
9. Baguley, B. C. Anti-Cancer Drug Design vol 6, 1, (1991).
10. Ihmels, H., Engels, B., Faulhaber, K., Lennarzt C., New Dyes Based on AminoSubstituted Acridizinium Salts-Synthesis and Exceptional Photochemical Properties,
Chem.Eur.J. 6,15, 2854-64, (2000).
11. Ihmels H.,Thomas L., in Materials Science of DNA Chemistry, (Ed.: J.-I. Jin), CRC
Press, Boca Raton, Chapter 4; Intercalation of Organic Ligands as a Tool to Modify the
Properties of DNA, in press.
12. Lakowicz, J.R., Principles of Fluorescence Spectroscopy, 3rd Edition, Bölüm 21, DNA
Technology, Springer Science, New York. (2006), Pp 705.
13. Wheatea, N.J., Brodiea, C.R., Collinsb, J.G., Kempa, S., Aldrich-Wrighta, J.R., MiniReviews in Medicinal Chemistry, DNA Intercalators in Cancer Therapy: Organic and
Inorganic Drugs and Their Spectroscopic Tools of Analysis 7, 627-648, (2007).
14.Martinez, R., Chacon-Garcia, L., The Search of DNA-Intercalators as Antitumoral Drugs:
What it Worked and What did not Work, Current Medicinal Chemistry, 12, 2, 127-151,
(2005).
15.Wheatea N.J, Brodiea C.R, Collins J.G, Kempa S and Aldrich-Wrighta J.R, Mini-Reviews
in Medicinal Chemistry, 2007, 7, 627.
16. T.C. Sağlık Bakanlığı Kanserle Savaş Dairesi Başkanlığı Yayınları, ULUSAL KANSER
PROGRAMI 2009-2015, Nisan 2009, Bakanlık Yayın No: 760, Editör, Murat Tuncer.
17.Wong, E.,Giandomenico, C. M. Chem. Rev., 1999, 99, 2451.
18.Barton, J. K., Odom, D. T., Erkkila, K. E. Chem. Rev., 1999, 99, 2777.
19.Biochemistry, Editör: Reginald H. Garrett and Charles M.Grisham, Saunders College
Publishing, Second Edition, 327-356.
20.J. D. Watson, F. H. C. Crick, Nature 1953, 171, 737.
21.M. Gellert, M. N. Lipsett, D. R. Davies, Proc. Natl. Acad. Sci.USA 1962, 48, 2013.
22.D. Rhodes, R. Giraldo, Curr. Opin. Struct. Biol. 1995, 5, 311.
23.J. L. Huppert, Chem. Soc. Rev. 2008, 37, 1375.
24. J. T. Davis, Angew. Chem. Int. Ed. 2004, 43, 668.
25. a) S. Burge, G. N. Parkinson, P. Hazel, A. K. Todd, S. Neidle, Nucleic Acids Res. 2006,
34, 5402; b) S. Neidle, G. N. Parkinson, Biochimie 2008, 90, 1184.
26.D. J. Patel, A. T. Phan, V. Kuryavyi, Nucleic Acids Res. 2007, 35, 7429.
27.S. Burge, G. N. Parkinson, P. Hazel, A. K.Todd, S. Neidle, Nucleic Acids Res. 2006, 34,
5402.
28. Luedtke N.W., Chimia, 2009, 134.
29.Hans J. Lipps, Rhodes D. Trends in Cell Biology 2009, 19(8), 414 (Review).
30.A. M. Zahler, J. R. Williamson, T. R. Cech, D. M. Prescott, Nature 1991, 350, 718.
31.S. Neidle, G. Parkinson, Nat. Rev. Drug Discov. 2002, 1, 383.
32.Slijepcevic P. Experimental Cell Research 1998, 244, 268.
33.Shay WJ, Wright WE. Current Opinion in Oncology 1996, 8, 66.
34.Franceschin M., Eur. J. Org. Chem. 2009, 2225.
35. Pommier Y., Cherfils J. "Interfacial inhibition of macromolecular interactions: nature's
paradigm for drug discovery." Trends Pharmacol. Sci. 26, 138-45, (2005).
36. Brana M. F., Ramos A., Curr. Med. Chem. Anticancer Agents 1: 237, (2001).
37. Avendano C., Menendez J. C., Medicinal Chemistry of anticancer drugs, Chapter 7: DNA
İntercelators and Topoisomerase Inhibitors”, Elsevier, 199-228, (2008).