HACETTEPE ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ
ELİFE KARAĞLI
GIDA MÜHENDİLİĞİ BÖLÜMÜ
NUMARA:20928753
Telomer: Ökaryotik doğrusal kromozomların uçlarında
bulunan, herhangi bir gen kodlamayan ve kromozomu
yıkımdan koruyan özelleşmiş nukleotid dizileridir.
Telomerler birçok ardışık kısa tekrardan oluşur.
İnsanda 5’-TTAGGG-3’
Tetrahymena’da TTGGGG
Schizosaccharomyces pompe’de GGTTAC(A) (C)
TELOMER
Pickett and Reddel, 2009
TELOMERLERİN GÖREVLERİ
1. Replikasyon sırasında lineer kromozomal DNA molekülünün
son kısmının tamamlanmasında rol oynar.
2. Kromozom uçlarını rekombinasyondan, birbirine birleşmeden
ve hasarlı DNA yapısı olarak tanınmasından korur.
3. Kromozomların bütünlüğünü ve stabilitesini sağlar
4. Kromozomların nukleus zarına tutunarak belirli bir pozisyonu
korumasını sağlar.
5. Fonksiyonel telomer eksikliğinde serbest DNA uçları hasarlı
DNA olarak algılanır.
TELOMERLERİN YAPISI
İnsan telomerleri üst üste gelen
basit ve kısa nükleotit dizileri
TTAGGG’lerden oluşur.
Dikkat edilmesi gereken önemli
bir
özellik telomerik ipliğin
Guanince zengin olmasıdır.
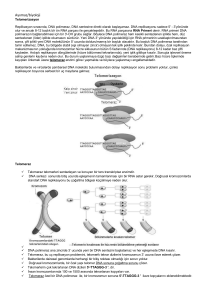
T-LOOP
Telomerlerin 3' ucunda guanince zengin tek zincirli uç, kendi üzerinde
katlanarak kement benzeri t-loop yapısı oluşturur
Guanin zengini tek iplik, çift iplikli telomerin içine girer. Bu yapı da
telomer ipliklerinden birinin yerine geçerek ikinci bir ilmek olan dloopu oluşturur.
T-loop yapısıyla birlikte telomerik uçlara bağlanan proteinler de
kromozomal uçları koruyarak, bu uçların DNA hasarı olarak
algılanmasını engeller.
T-loop yapısının oluşturulmasında ve stabilitesinde rol alan
6 telomer spesifik protein “Shelterin” kompleksini meydana getirir.
6
T-LOOP
-Telomeri hasar verici enzimlerden korur
-Kromozomu diğer kromozomlarla uç uca birleşmelerden ve
-Telomerleri DNA kırıkları olarak algılayacak hücre döngüsü kontrol
noktalarından korur.
T-loop
D-loop
TELOMER
İnsanda bütün Telomer 15 kb uzunluğundadır
TELOMERLER VE YAŞLANMA
Telomerlerin kısalmaları ilk olarak 1961 yılında, doku kültürü çalışmaları
sırasında Hayflick tarafından gözlemlenmiştir
Hayflick insan fibroblastlarıyla yaptığı çalışmalarda, hücrelerin belirli bir
bölünme sayısından sonra artık bölünemediğini fakat metabolitik
aktivitelerini devam ettirdiğini gözlemlemiştir.
Hayflick Limiti: Kültüre edilen fibroblastların yaklaşık 40-60 bölünme
sonrasında gelişme ve bölünme yeteneklerini kaybederek yaşlanmaya
başlaması.
İnsan embiyo hücreleri yaklaşık 60-80 bölünme sonrasında yaşlanmaya
başlar.
Orta yaşlı insanların hücreleri 10-20 defa bölünür.
9
TELOMERLER VE YAŞLANMA
Replikatif Hücre Yaşlanması: Somatik hücrelerde telomeraz düzeyi her
bölünmede düşer. Böyle hücrelerde her bölünme, telomerlerden 100-200
nukleotidlik eksilmelere neden olur. Yaşlı hücreler metabolik olarak aktiftir,
ancak yeni hücre meydana getirmezler ve ölürler.
Her mitotik bölünmede hücrelerin DNA’larındaki telomerler kısalır.
İnsanlarda telomer kısalması ile hücre bölünmesi azalır ve yaşlanma süreci
başlar.
Bu mekanizma canlıları genomik kararsızlık ve kanserden korur.
10
TELOMERLER VE KANSER
Normal somatik hücrelerde; hTERT geni eksprese olmaz dolayısıyla telomeraz
aktivitesi görülmez (ya da çok az görülür).
Kanser hücrelerinde ise hTERT geni çok aktiftir ve telomeraz enzim aktivitesi
çok yüksektir. Böylece telomer uzunlukları korunur ve kanser hücreleri ölümsüz
olarak yaşamlarını sürdürebilirler.
Kanser hücrelerinin sonsuz bölünme yeteneği (ölümsüzlüğü); bu geri kazanılmış
telomeraz aktivitesinden kaynaklanmaktadır.
Somatik hücrelerin çoğunda, embriyonik dönemde hTERT’in transkripsiyonu
baskılandığından, telomeraz aktivitesi izlenmemektedir. Ancak tümörlerin
%90’ında yüksek düzeyde telomeraz aktivitesi saptanmaktadır
Tümör gelişimi sürecinde, telomeraz aktivitesindeki artışta farklı mekanizmaların
rol oynadığı düşünülmektedir; ancak somatik hücrelerde inaktif durumdaki
enzimin reaktive olarak aktif forma mı geçtiği yoksa kök hücre ya da öncü
hücrelerdeki enzimin aktivitesindeki belirgin artış sonucu yüksek bir düzeye mi
ulaştığı henüz kesin olarak bilinmemektedir
11
TELOMER FONKSİYON BOZUKLUĞU
Replikatif yaşlanmaya
bağlı izlenen telomerik kısalma, t-loop
yapısı ve telomerik proteinlerin harabiyeti veya regülasyonundaki
bozukluk, telomerik disfonksiyona yol açmaktadır.
Yaşlanmanın,
genetik ve çevresel faktörlerinin telomer
disfonksiyonuna neden olduğu yeni yeni anlaşılmaktadır.
Hücreler
disfonksiyonel telomerlere cevap olarak yaşlanmaya
veya apopitozise gidebilir ya da genomik kararsızlık gelişir.
12
•Telomerik kısalma
•T-loop yapısındaki bozukluk
•Telomerik protein bozukluğu veya
•Regülasyon bozukluğu
Telomerik Disfonksiyon
Apoptozis
Genomik
kararsızlık
Yaşlanma
13
TELOMERAZ
Telomerazın birinci bileşeni :
Telomerazın birinci bileşeni
hTERT, telomerin sonunda
bulunan tek iplikli bir çıkıntıdır.
hTERT, ikinci telomeraz
bileşenine bağlanmada şablon
oluşturarak telomerin uzamasını
katalizler.
Telomerazın ikinci bileşeni :
Telomerazın ikinci bileşeni hTR,
replikasyon için kalıp oluşturmada
görevlidir. Yaklaşık olarak 445
nükleotid uzunluğundadır. 445
nükleotidin içinde 11 nükleotitlik
CAAU CCCAAU C tek temel sekans
bulunur. Bu sekans, telomerlerin
sonunda bulunan TT AG G
G nükleotid sekansı için binding-site
görevini görür.
Telomeraz hücrelerimizde telomerlerin uzamasını katlazlayan doğal bir enzimdir.
Telomeraz kendisinin hücrede aktiv olması için iki bileşen ihtiva eder. Sonuç
olarak telomeraz telomerlerin sonlarına eklenerek net telomer uzunluğunun
korunmasını sağlar.
TELOMERAZ
Telomeraz
RNA’sının
geri kalan kısmı
Telomeraz protein
“parmaklar”
Kalıp olarak
kullanılan
telomeraz
RNA’sı
mavi: hTER
yeşil: hTERT
Yeni
sentezlenen
telomer DNA’sı
Figure 5-40 Molecular Biology of the Cell (© Garland Science 2008)
“avuçiçi”
telomerazın
aktif bölgesi
“başparmak”
Alberts et al., 2008
TELOMERAZ
Germ line hücreleri (üreme hücreleri;yumurta ya da sperm
hücreleri)
Embriyonik kök hücreler,
Tek hücreli ökaryotlar,
Kanser hücrelerinde aktif olarak bulunurlar.
Telomeraz enziminin aktivitesini somatik hücrelerde kaybetmiş
olması evrimsel bir avantajdır. Bu mekanizma hücreleri kanser
hücrelerine transforme olma ve aşırı proliferasyona bağlı
bozukluklardan korumaktadır.
16
BEKLENTİLER
Telomeraz, kansere karşı kullanılan ilaçlar için ideal bir hedef
olabilir. Telomeraz etkinliğini engelleyen ilaçlar; telomer boylarını
kısaltarak ve kanser hücrelerini yaşlandırarak ölmelerini sağlayabilir.
İnsanın somatik hücrelerinde telomeraz aktivitesi bulunmadığı için
böyle bir tedavi, kanser hücrelerine özgü olabilir ve günümüzde
kullanılan kanser ilaçlarına göre de toksik etkisi daha düşük
olacaktır.
İn vitro da yapılan çalışmalarda, antitelomeraz maddeler uygulanan
tümör hücrelerinin telomer dizilerini kaybettiği ve yaklaşık 25 hücre
bölünmesinin ardından öldüğü gözlemlenmiştir.
17
SORULAR
TEŞEKKÜRLER…
KAYNAKLAR
•
Department of Oral and Maxillofacial Surgery, Ehime University School of Medicine,
Shitsukawa, Shigenobu-cho, Onsen-gun, Ehime 791-0295, Japan 10 October 2000
•
A.G. Bodnar, et al., "Extension of life-span by introduction of telomerase into
normal human cells," Science, 279(5349):349-52, 16 January 1998. [Geron Corp.,
Menlo Park, CA; U Texas Southwest. Med. Ctr., Dallas] *YT158
•
Department of Molecular Biology and Genetics, Johns Hopkins University School of
Medicine, 617 Hunterian Building, 725 N. Wolfe Street, Baltimore, MD 21205, USA.
•
Parkinson GN, Lee MPH, Neidle S, "Crystal structure of parallel quadruplexes from
human telomeric DNA," Nature 417(6891): 876-80, 20 June 2002. Source: Essential
Science Indicators from Thomson Reuters. (Interview)
•
Department of Cell Biology, The University of Texas Southwestern Medical Center,
5323 Harry Hines Boulevard, Dallas, TX 75390-9039, USA ,2 August 2001.
•
Shay JW and Wright WE. Hayflick, his limit, and cellular ageing. Nature Rev. pp. 7276; 2000.
KAYNAKLAR
Gilley D, Herbert BS, Huda N, Tanaka H, Reed T. Factors impacting
human telomere homeostasis and age-related disease. Mechanisms
of Ageing and Development 129:27-34; 2008.
Hiyama K, Hiyama E, Shay JW. Chapter 1. Telomeres and Telomerase
in Human. In: Telomeres and Telomerase in Cancer (ed by K.
Hiyama). Springer, 2009.