HÜCRE YAŞLANMASI
Prof.Dr. T. Ulutin
HÜCRE YAŞLANMASI
•
•
•
•
Hücrenin biyosentez mekanizmalarındaki
hatalar toplamıdır
Hücresel metabolizmanın yavaşlaması
sonucu geri dönüşü olmayan olaylar
toplamıdır
Yaşlılık DNA’dan bilgi akışına biyolojik
bariyer oluşturur
Biyolojik yaşlanma fizyolojik bir olaydır,
büyüme ve gelişmenin bir devamıdır.
• Yaşlanma ;
• doku ve hücrelerin kendilerini yenileme
yeteneklerinin,
• normal fonksiyon ve yapılarının devamı
için gerekli işlemlerin,
• hasara karşı direncin ve tamirin dereceli
olarak azalmasıdır.
• Yaşlanma sonucu ortaya çıkabilen
hastalıklar;
• Ateroskleroz , diyabet, kanser, inme,
miyokard enfarktüsü, hipertansiyon
•
•
•
•
YAŞLANMA TEORİLERİ
“Genetik saat teorisi”
“Telomer- telomeraz teorisi”
“Yıkıcı hatalar ve hasarlar teorisi”
GENETİK SAAT TEORİSİ
•
Yaşlanma genetik olarak programlanmış bir
işlemdir.
• Genetik saat “ replikasyon sayısı” na bağlı olarak
kurulmuştur.
Destekleyici bilgiler;
♣Farklı türlerin ve hücrelerin farklı yaşam sürelerine
sahip olmaları,
♣Neoplastik değişime uğrayan hücrede yaşlanmanın
durması, replikasyon devam etmesidir.
**Farklı yaşam sürelerine sahip olma
nedenleri;
• Genetik farklılıklar
• Beslenme farklılıkları
• Dokular arası farklılıklar
• farklı replikasyon aktivitesi
• Dr. Leonard Hayflick ve arkadaşları:
• kültürde üretilen birçok memeli hücresinin kendilerini
çoğaltma kapasitelerinin sınırlı olduğunu buldular.
• Fötal, embriyonik veya yenidoğan dokularından alınarak
incelen hücrelerde bu hücrelerin yaklaşık 40-60 hücre
bölünmesi geçirdiğini ve bundan daha fazla
bölünmediğini gösterdiler.
• Bu bölünme sınır sayısına Hayflick Limiti adı verildi.
• Hayflick limiti iki tür hücre grubunun varlığınıda açıklar
1- normal ölümlü hücreler
2- ölümsüz kanser hücreleri
Kültür ortamında;
• İnsan fibroblastının replikasyon sayısı: 50 ± 10
• Fare fibroblastının replikasyon sayısı:
15 ± 5
• Down sendromlu kişinin fibroblast r.s.: 40 ± 15
• (Metabolik hastalıklara sahip -örn.diyabet- ayrıca
genetik hastalıklara sahip kişilerde replikasyon sayısı
daha düşüktür)
YIKICI HATALAR - HASARLAR TEORİSİ
1- Serbest radikaller tarafından oluşturulan hasarlar
2- Bilgi aktarımındaki hatalar
3- Gen yapısında ve ekspresyonunda değişiklikler
1- Serbest radikaller tarafından oluşturulan hasarlar
Superoksit (O-), OH-, Peroksit, Nitrik oksit ( NO- )
• Aerobik metabolizmaya sahip memelilerde “Oksijen”
serbest radikaller için ana kaynaktır
Tüm aerobik hücreler birkısım serbest radikalleri üretir
Bunların bazısı:
• Mitokondriyumda elektron transport zincirinde
• Endoplazmik retikulum okidaz sisteminde
• Peroksizom ve lizozomun metabolik aktivasyonları
sırasında üretilir
0Doğal koruyucular (antioksidanlar):
Endojen
*Superoksit dismutaz
*Katalaz
*Glutatyon
*Peroksidaz
Eksojen
*E-vitamini
*Beta karoten
*Selenyum
*Askorbik asit (C Vit)
**Antioksidan eksikliği ve Lipofuskin pigmentinin
artışı yaşlanmayı ilerletir
2- Bilgi aktarımındaki hatalar
• DNA sentezinde hatalar
(polimeraz aktivitesinde yavaşlama ve hatalar)
( genç MRC-5 hücre hattı kültürlerinde
replikayon........... hızlı
yaşlı MRC-5 de ................. yavaş
• Mutasyonlar
• DNA tamir mekanizmasında yavaşlama ve hatalar
• Ribozomal proteinlere ait sentez enzimlerinde hatalar
• RNA sentezindeki hatalar
• Protein sentezindeki hatalar
3- Gen yapısında ve ekspresyonunda
değişiklikler
A- Nukleus DNAsındaki esas değişimler
B- Mitokondriyal DNA ve onunla ilişkili enerji
metabolizmasındaki değişiklikler
•
•
•
•
•
•
A- Nukleus DNAsındaki esas değişimler
Kaybolma (delesyon)
Transkripsiyon hataları
Gen çoğalması (amplifikasyon)
Gende yeniden düzenlenme
DNA nın yapısal düzenlenmesindeki hatalar
(Örneğin. Metilasyon; gen ekspresyonunun
açıp-kapama düğmesi gibi iş görür)
Translasyon hataları
B- Mitokondriyal DNA ve onunla ilişkili enerji
metabolizmasındaki değişiklikler
Yaşlı hücrelerde;
• MtDNA da artmış delesyonlar ve
• Glikoliz yolunda artış gözlenir
• Yaşlılıkta, fare ve sıçan karaciğer hücre
mitokondriyumlarında belirgin solunum
kapasitesinde kayıp bsaptanmış.
• Yaşlı hücre morfolojisi
Sitoplazmada
• Lipofuskin pigment granülleri
• Metabolizma son ürünleri
• Mitokondriumlarda dejenerasyonlar
Nukleusta ...
• Düzensiz (girintili- çıkıntılı) nukleus membranı
• binuklear hücrelerde artış
TELOMER- TELOMERAZ
5’
TTAGGGTTAGGGTTAGGG.... 3’
Kromozom uçlarındaki tekrarlanan
nukleotid dizileri
TELOMER
Telomerin işlevleri
1. DNA daki tek zincirli uçları korumak ve
ölümsüzlük
2. Kromozomları yeni düzenlemelerden korumak
3. Mayoz profazında eşleşme ve hareketi sağlamak
4. Kırık kromozomların yapışmasını engellemek
TELOMER
• Telomerler doğumda yaklaşık 1,000 ila
2,000 tekrarlanan TTAGGG DNA dizileri
olarak saptanır
• Her hücre bölünmesinde bir parça kısalır,
belli bir noktaya kadar kısalmaya devam
eder
• Belli noktaya gelindiğinde hücre bir daha
bölünmez.
Somatik hücrelerde Telomerler
1.Hücre kültüründe,
Her hücre döngüsü sonunda kısalırlar
2.In vivo da yaşlı kişilerin hücrelerinde
daha kısadır
3.Telomerdeki boy kısalması yaşlılık sinyalidir
ve belli noktaya kadar kısalma devam eder
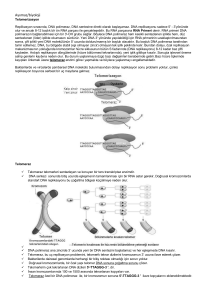
TELOMERAZ
• Kısalan telomerler (DNA uçları) özel bir enzim
tarafından uzatılır,
• Bu enzim telomeraz olarak isimlendirilir.
• Telomeraz ; ribonukleoprotein
Protein ve kısa RNA molekülünden oluşur
• RNA nukleotid dizileri telomer ucundaki
tekrarlanan dizilere komplementerdir
TELOMERAZ
~159 bç RNA bölgesi içerir
CAAUCCCAA .....telomeraz
TTAGGG............DNA
•Ters transkriptaz benzeri enzimdir
TELOMERAZ
• Telomerleri yaklaşık 10 000 nukleotid çifti kadar
uzatır.
• Telomer boyu ve telomeraz aktivitesi hücrenin kaç
kez bölüneceğini tayin eden mekanizmadır
• Bir çeşit moleküler saat = genetik saat olarak iş görür
• Tahminen doğumda telomer uzunluğu yaklaşık 15000
bç dir. Ve her bölünmeden sonra 25-200 bç kısalır
• İnsan hücrelerinde yaklaşık 100 hücre döngüsünden
sonra telomer zunluğu kritik noktaya ulaşır ve
bölünme durur
Ardından hücresel yaşlanma ve ölüm gelir
• Somatik hücreler telomerler tekrarları tam olarak
“doğarlar”
• Ancak bu hücrelerde telomeraz geni kapalıdır
• Bu nedenle her hücre bölünmesinde telomerin boyu 25200 nukleotid kadar kısalır
• Belli bir noktaya gelindiğinde bölünme durur
• Bu olay aynı zamanda replikatif hücre yaşlanması
olarakta tanımlanır
• Bu mekanizma somatik hücrelerde bölünme kontrolü gibi
çalışır ve anormal bölünmelere yani kansere karşı
korunmayı sağlar
Telomeraz aktivitesi :
• Embriyonik hücrelerde
• Germ hücrelerinde
• Sürekli çoğalan hücrelerde (Hematopetik kök hücreleri,
aktif lenfositler, intestinal hücreler)
• Kanser hücrelerinde görülür
Normal koşullarda, somatik hücreler telomeraz aktivitesi
göstermez
• Somatik hücrelerde:
Telomer kaybı ve yaşlılık arasında yakın ilişki vardır
PROGERIA da (Hızlı Yaşlanma Hastalığı), ciddi telomer
kısalması ve kaybı gözlenir
Klonlama ve Telomer uzunluğu
Dolly doğduğunda telomeri kısaydı
ve yaşlı doğmuştu
Hücre yaşlanmasında etkili olaylar
•
•
•
•
•
Oksidatif Hasar
Telomer-Telomeraz aktivitesi
DNA hasarı ve tamiri
Mitokondriyal yaşlanma
Hücresel yaşlanma (Replikatif yaşlanma)