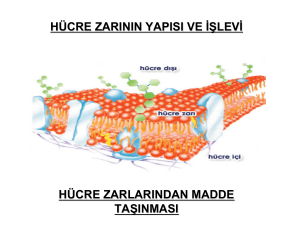
HÜCRE ZARI
(PLAZMA ZARI, HÜCRE MEMBRANI, PLAZMA MEMBRANI, PLAZMALEMMA)
Bütün hücrelerin dış taraftan bir zar ile çevrili olduğu, elektron mikroskobu kullanılmadan önce de tahmin
ediliyordu. Ancak bu zar çok ince olduğundan ışık mikroskobunda görülemiyor ve yapısı hakkında fazla
bilgi edinilemiyordu.
Hücre zarının yapısı ile ilgili ilk çalışmalar Charles Ernest Overton (1865-1933, İngiliz botanikçi) tarafından
1890’larda başlatılmıştır. Overton 1895-1902 yılları arasında yaptığı deneylerde, hücrelerin hipotonik
çözeltilere bırakıldığı zaman şiştiğini, hipertonik çözeltilerde ise büzüldüğünü gösterdi. Bu deneylerin
yapıldığı dönemlerde hücrelerin bir zarla çevrili olabileceği ve hücre zarının seçici geçirgen bir özelliğe
sahip olabileceği tahmin edilmekteydi. Overton yaptığı deneylerde lipitlerde çözünebilen maddelerin hücre
zarından daha hızlı geçtiklerini gördü. Irving Langmuir (1881-1957, Amerikalı kimyacı ve fizikçi), 1917
yılında organik bir çözücü olan benzen içerisinde çözünmüş fosfolipitleri suya ekleyerek, yapay zarlar yaptı.
Bu deneylerde, benzen buharlaştıktan sonra geriye su yüzeyini ince bir film halinde kaplayan fosfolipitler
kaldığını, bu fosfolipitlerin sadece hidrofilik başlarının su üzerinde yüzer halde olmaları nedeniyle onların
amfipatik (hem hidrofilik hem de hidrofobik kısımlar içerme) özelliğe sahip olduklarını buldu.
1925’te iki Hollandalı bilim adamı Evert Gorter (1881-1954, çocuk doktoru ve biyokimyacı) ve asistanı
François Grendel (1897-1969) insan eritrositlerinden lipitleri izole ederek ılık su yüzeyinde yüzdürdü ve
fosfolipitlerin su yüzeyinde unipolar bir tabaka oluşturabildiğini, hidrofilik baş kısımlarının suyun yüzey
kısmında, hidrofobik kuyruk kısımlarının ise havaya doğru yöneldiğini gösterdiler. Bu araştırmacılar,
kırmızı kan hücrelerinden elde edilen zarların fosfolipit içeriğini ölçtü ve hücreleri iki tabaka halinde
kaplamaya yetecek miktarda lipit buldu. Bu nedenle hücre zarlarının iki tabakalı lipit içerdiklerini öne sürdü.
Ancak izole edilen zarların yapısında fosfolipitlerden başka, proteinler de vardı. Fosfolipitlerin baş kısımları
hidrofilik olsalar bile, çift tabakalı fosfolipitten oluşan yapay bir zarın yüzeyi suya gerçek bir biyolojik
zardan daha az tutunuyordu. Hugh Davson (1909-1996, İngiliz fizyolog) ve James Frederick Danielli (19111984, İngiliz biyolog) hücre zarının her iki yüzeyinin hidrofilik proteinlerle kaplanmış olmasının, gerçek bir
biyolojik zarın suya daha güçlü bağlanmasının nedeni olabileceğini düşündüler ve 1935 yılında, hücre zarı
yapısı için iki globüler protein tabakası arasında yer alan çift tabakalı fosfolipit şeklindeki sandviç modeli
önerdiler. Bu model hücre zarının yapısıyla ilgili ilk bilimsel modeldi.
Araştırmacılar hücreleri incelemek için ilk kez 1950'lerde elektron mikroskobunu kullandıklarında, elde
edilen resimler (elektron mikrografları) Davson-Danielli modelini destekler görünümdeydi. Ağır metal
atomlarıyla boyanan hücrelerin elektron mikrograflarında hücre zarı, boyanmamış bir tabakayla
birbirlerinden ayrılmış iki koyu (boyalı) bant içeren üç tabaka halindeydi. İlk elektron mikroskobistler, ağır
metal atomlarının proteinlere ve fosfolipitlerin hidrofilik başlarına bağlandığını, ama zarın ortadaki
hidrofobik kısmını boyamadığını düşündüler. Davson-Danielli sandviç modeli 1960'larda sadece hücre
zarının değil, hücredeki bütün iç zarların yapısı olarak geniş çaplı kabul gördü. Ancak bu dönemin sonunda
birçok hücre biyologu, bu modelin iki sorunu olduğunu fark etti. Birincisi, hücrelerdeki bütün zarlar özdeş
olamazdı. Çünkü elektron mikroskobunda bütün zarlar birbirlerine benzer görünmüyordu. Örneğin, hücre
zarı 7-8 nm kalınlığında ve üç tabakalı yapıya sahipmiş gibi göründüğü halde, mitokondri iç zarı sadece 6
nm kalınlığındaydı ve boncuk dizisi gibi görünüyordu. Ayrıca biyokimyasal çalışmalar, mitokondri
zarlarının protein yüzdelerinin hücre zarlarından oldukça fazla olduğunu, özel fosfolipit ve diğer lipit
çeşitleri açısından farklılıklar bulunduğunu gösteriyordu. Sandviç modeline ilişkin daha önemli ikinci bir
sorun, proteinlerin yerleşimiydi. Sitozolde çözünmüş proteinlerin aksine, zar proteinleri suda çok fazla
çözünür değildi. Zar proteinleri hidrofilik bölgelere sahip oldukları gibi, hidrofobik bölgeler de içerir (yani
amfipatiktir). Eğer bu proteinler zar yüzeyinde yayılıyorlarsa, hidrofobik kısımlarının sıvı ortamda olmaları
gerekiyordu.
S.J. Singer ve Garth L. Nicolson (1943, Amerikalı biyokimyacı) zar modelini gözden geçirdiler ve 1972
yılında yeni bir zar modeli önerdiler. Sıvı mozaik model (akıcı mozaik model) adı verilen bu modelde
proteinler amfipatik karakterlerine uygun bir yerleşime sahipti: Zar proteinleri dağınık haldeydi ve her bir
protein sadece hidrofilik kısımları suya maruz kalacak şekilde, çift katlı fosfolipit tabakaya gömülü haldeydi.
Bu moleküler düzenlenme, protein ve fosfolipitlerin hidrofilik kısımlarının maksimum ölçüde su ile temasını
sağlarken, hidrofobik kısımlarının susuz ortamda olmasına olanak verir. Bu modele göre zar, çift katlı
fosfolipit sıvısı içerisinde aşağı yukarı hareket eden protein moleküllerinden oluşmuş bir mozaik gibidir. Sıvı
mozaik model terimi buradan kaynaklanmaktadır.
Dondurma (Dondurup)-kırma yöntemi ile hazırlanan hücreler elektron mikroskobunda incelendiğinde,
protein parçacıklarının sıvı mozaik modelde olduğu gibi, ikili fosfolipit tabakasının iç kısmına yerleşmiş
olduğu görülür. Bu düzenleniş başka kanıtlarla da desteklenir.
Sıvı Mozaik Zar Modeli
Hücre zarlarında bulunan tüm fosfolipitler amfipatik özelliğe sahip olup, polar baş kısımları (hidrofilik) suya
doğru, yağ asidinden meydana gelen hidrofobik kısımları ise zarın iç kısmına doğru yönelerek iki (çift)
tabakalı bir yapı oluşmasını sağlar. Fosfolipit tabakasının sitoplazma tarafındaki tabakasına (yaprağına)
sitoplazmik tabaka (iç tabaka, sitoplazmik yaprak, iç yaprak), hücre dışı matrikse bakan tabakasına
ektoplazmik tabaka (dış tabaka, ektoplazmik yaprak, dış yaprak) adı verilir. İki fosfolipit tabakası, özgül lipit
bileşimleri bakımından farklı olabilir.
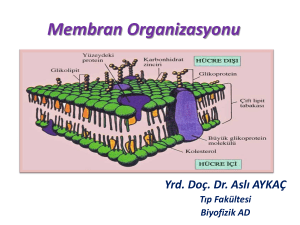
Hücre zarlarında proteinler zar yüzeyinde veya zara gömülmüş halde bulunur. Zara gömülü proteinlere
integral (intrinsik) proteinler denir. İntegral proteinlerin hidrofobik kısımları polar olmayan amino asitleri
içerir ve genellikle α heliks şeklinde kıvrılmıştır. Hidrofobik kısımlar bu proteinlerin fosfolipitlere kovalent
bağlarla bağlanmalarını sağlar. İntegral proteinlerin hidrofilik kısımları zarın her iki yüzündeki sulu
çözeltiyle temas halindedir. İntegral proteinlerin bir kısmı sadece hücrenin bir yüzeyine doğru çıkıntı
yapmalarına rağmen, bir kısım integral proteinler zarı baştanbaşa kat edip, hücrenin her iki yüzeyine de
çıkıntı yapabilir. Böyle integral proteinlere transmembran protein adı verilir. Transmembran proteinler tek
veya çok geçişli olabilir. Zar yüzeyine yerleşmiş proteinlere periferal (ekstrinsik) proteinler denir. Periferal
proteinler çoğunlukla integral proteinlerin yüzeye uzanan kısımlarına tutunur ve fosfolipitlerin polar baş
kısımları ile etkileşim halindedir.
Bu haliyle hücre zarı, içinde proteinlerden yapılmış adalar taşıyan bir lipit denizi veya üzerinde rafting
yapılan bir lipit nehri (rafting botları proteinleri simgeler) gibi görünür.
Hücresel Zarlar (Hücre Zarı ve Organel Zarları)
Hücre zarı gibi organel zarlarının yapısı da sıvı mozaik zar modelindeki gibidir. Hücre zarının kalınlığı
hücreden hücreye veya hücre üzerindeki bölgelere göre 7-12 nm arasında değişir. Organel zarları ise daha
ince olup 6-8 nm kadardır.
Zarlar, kendisini oluşturan moleküllerin sıkıca yerlerine tutunup hareketsiz kaldığı yapılar değildir.
Fosfolipitlerin çoğu zar düzlemi içerisinde yanal olarak hareket edebilir. Bu şekilde komşu fosfolipitler yer
değiştirebilir (saniyede 107-8 kere meydana gelir.). Fosfolipitlerin dikey olarak zardaki yanal hareketi
oldukça hızlı olup, ortalama olarak saniyede 2 µm kadardır. Fosfolipit molekülleri kendi uzun eksenleri
boyunca dönebilir (rotasyon; çok sık meydana gelir.) veya esneme hareketi (fleksiyon) yapabilir. Bir
fosfolipit molekülü zarın bir fosfolipit tabakasından diğerine geçemez, geçse bile takla (flip-flop) adı verilen
bu olaya oldukça seyrek rastlanır (Endoplazmik retikulum zarlarında daha sık, diğer zarlarda ayda bir veya
daha seyrek), çünkü molekülün bunu yapabilmesi için, hidrofilik kısmının zarın iç kısmındaki hidrofobik
bölgeyi geçmesi gerekir.
Zarın işlevlerini yerine getirebilmesi için akışkan olması zorunludur. Bu nedenle, hücre zarları sıvı yağ
(salata yağı) kıvamındadır. Zar katılaştığında, geçirgenliği değişir ve zardaki enzim proteinleri inaktif hale
gelir.
Hücre zarı sıcaklık azalsa bile katılaşmadan sıvı halde kalır. Yağların katılaşması fosfolipitlerin sıkı bir
paketlenme düzenine geçmesiyle olur. Hücre zarının katılaşma sıcaklığı, zardaki lipitlerin çeşidine bağlıdır.
Doymamış yağ asidi açısından zengin olan bir zar, düşük sıcaklıklarda bile sıvı halde kalır. Çift bağların yer
aldığı noktalardaki dirseklerden ötürü, doymamış yağ asitleri doymuş yağ asitleri kadar sıkı paketlenemez.
Hücre zarlarındaki fosfolipit molekülleri arasına kama gibi sokularak zarın dayanıklılığını artıran bir steroit
olan kolesterol, zarın akışkanlığını da etkiler. Nispeten ılık sıcaklıklarda, örneğin insanların vücut sıcaklığı
olan 37°C’de kolesterol fosfolipitlerin hareketini kısıtlayarak, zarı daha az akışkan yapar. Aynı zamanda
fosfolipitlerin sıkı paketlenmesini önlediğinden dolayı, zarın katılaşması için gerekli sıcaklığı da düşürür.
Zardaki kolesterol dağılımı asimetriktir. Sitoplazmaya bakan tarafta, dış tabakanın 3-7 katı fazla kolesterol
mevcuttur. Kolesterol organellerin zarında hücre zarındakine göre çok daha az bulunur. Hücre zarındaki
kolesterolün miktarı hücreden hücreye değişiklik gösterir (%4-%13). Prokaryotlarda hücre zarında kolesterol
bulunmaz. Kolesterol zarın geçirgenliğini azaltması yanında, zarın dayanıklılığını ve esnekliğini artırır.
Hücreler kendi zarlarının lipit bileşimini, değişen sıcaklığa uyum sağlamak üzere değiştirebilir. Örneğin
kışlık buğday gibi aşırı soğukları tolere edebilen bitkilerin birçoğunda, zarların kış mevsiminde katılaşmasını
önleyici bir adaptasyon (uyum) olarak sonbaharda doymamış fosfolipitlerin oranı artar. Kutuplarda yaşayan
canlılarda, zardaki doymamış yağ asidi oranı fazlalığı bu soğuk karşısında zarın katılaşmasını önler.
Sinir hücrelerinde hücre zarının %82 kadarını lipitler oluşturur, diğer hücrelerde ise zardaki moleküllerin
%40-50’si lipit olup, bu lipitlerinin dağılımı şöyledir: %24 fosfolipit, %13 kolesterol ve %3 diğer lipitler.
Organel zarlarında ise lipitlerin oranı daha düşüktür; örneğin mitokondri iç zarında %25 kadar lipit vardır.
Zar proteinlerinin bazıları hücre zarı düzleminde yanal olarak hareket edebilir. Ancak, proteinler lipitlerden
çok daha büyük oldukları için, bu hareket daha yavaştır. Bazı zar proteinleri sürüklenircesine hareket eder,
bazılarının da belirli bir yöne doğru hareket ettikleri görülür. (Bu proteinler, muhtemelen zar proteinlerinin
sitoplazmik bölgelerine bağlı haldeki motor proteinler tarafından hücre iskeleti lifleri boyunca hareket
ettirilir.) Bazı zar proteinleri ise hücre iskeleti ile bağlantı yapmasına rağmen hareketsiz durumdadır. Bu
proteinler hücreye şekil veren hücre korteksinin oluşmasından sorumludur.
Hücre zarları bir internal (iç), bir de eksternal (dış) yüzeye sahip olup, bu yüzeyler sitoplazmik ve
ektoplazmik yüzey olarak da bilinir. Ektoplazmik yüzeyde ise bazı zar proteinleri hücre dışı matriksin
liflerine tutunmuş durumdadır. (Bu bağlantılar hayvan hücrelerine hücre zarının sağladığından daha güçlü
bir dış iskelet kazandırır.)
Çift tabakalı fosfolipit zarın temel yapısını kurmakla birlikte, zarın özgül işlevlerinin birçoğu proteinler
tarafından belirlenir. Hücre zarı ve çeşitli organellerin zarlarının her biri, kendine özgü protein çeşitliliğine
sahiptir. Örneğin, bugüne kadar kırmızı kan hücrelerinin hücre zarında 50’den fazla protein çeşidi
saptanmıştır. Hücre zarında bulunan proteinlerin tümü yapısal özellikte olmayıp, bir kısmı hücresel
faaliyetlere katılır. Hücre zarındaki proteinlerin altı temel işlevi vardır:
1- Zardan bazı moleküllerin taşınması (Kanal proteinleri ve taşıyıcı proteinler)
2- Enzimatik aktivite (Hücre dışı ve hücre içi)
3- Hücre haberleşmesinde sinyal iletimi (Reseptörler)
4- Hücreler arası bağlantı, hücre iskeleti ve hücre dışı matrikse bağlanma (Adezyon molekülleri)
5- Hücrelerin birbirini tanıması (Antijenik özellik; MHC proteinleri)
Belirli bir hücre bu işlevlerin birkaçını bir arada sergileyen zar proteinlerine sahip olabildiği gibi, belirli bir
protein de birden fazla işleve sahip olabilir. Dolayısıyla zar, hem yapısal hem de işlevsel olarak bir mozaik
niteliğindedir.
Glikokaliks (Hücre Mantosu)
Hayvan hücrelerinde zarların iç ve dış yüzleri birbirlerinden farklıdır, yani asimetriktir: Zarın dış kısmında
karbonhidratlardan oluşmuş glikokaliks adı verilen bir tabaka bulunur. Kovalent bağlarla zarın protein ve
lipitlerine bağlanan glikokalikste bu karbonhidratlar, zarın glikoprotein ve glikolipitlerini meydana getirir.
Zarın glikokaliksindeki karbonhidratlar, genellikle 15’den az şeker birimi içeren, dallanmış
oligosakkaritlerdir. Bu oligosakkaritler, türden türe, türün bireyleri arasında ve hatta aynı bireyin hücre
tipine göre farklılık gösterir. Bu moleküllerin çeşitlerinin ve hücre yüzeyindeki yerleşimlerinin farklı
olmasıyla, oligosakkaritler bir hücreyi diğerinden ayırt eden işaretler olarak işlev görür. Diğer bir ifadeyle
glikokaliksteki glikoprotein ve glikolipitler hücrelere antijenik özellik kazandırır. Örneğin, insanlardaki dört
farklı kan grubu (A, B, AB ve O), kırmızı kan hücrelerinin yüzeyindeki oligosakkaritlerin farklı olmasından
kaynaklanır.
Hücrelerin birbirlerini tanıması, yani bir komşu hücre tipini diğerinden ayırt edebilme yeteneği, bir
organizmanın işleyişi açısından hayati öneme sahiptir. Örneğin, bir hayvan embriyosunda hücrelerin
dokulara ve organlara dağılımı çok önemlidir. Bu özellik, doku ve organ naklinde yabancı hücrelerin
bağışıklık sistemi tarafından reddedilmesinin de temelini oluşturur. Bağışıklık sistemi, omurgalı
hayvanlardaki önemli bir savunma yoludur. Hücrelerin diğer hücreleri tanıması, yüzeydeki moleküller ile
özellikle de, hücre zarı üzerindeki karbonhidratlar aracılığı ile mümkündür.
Hücre yüzeyinin negatif yük kazanmasının nedeni glikokaliksteki karbonhidratlardır.
Proteinlerin, lipitlerin ve karbonhidratların hücre zarındaki asimetrik dağılımı, endoplazmik retikulum
tarafından zar oluşturulurken belirlenir. ER'un iç yüzeyinden başlangıç yapan moleküller, sonuçta hücre
zarının dış yüzeyinde yer alır.
HÜCRE YÜZEYĠ VE BAĞLANTI BÖLGELERĠ
Hücre yüzeyinde önemli işlevler gören bazı ek yapılar vardır. Hücre zarı canlı hücrenin sınırı olarak
değerlendirilmekle birlikte, çok sayıda hücre, hücre zarının dışında yer alan değişik tipte kılıflar sentezler ve
salgılar.
Hücre Duvarı (Hücre Çeperi)
Prokaryotlardan bakterilerin ve arkelerin çoğu, protistlerden algler, funguslar ve bitkiler hücre duvarına
sahiptir. Mikoplazmalar (en küçük bakteriler), bazı arkeler, hayvanlar ve protozoonlarda hücre duvarı
bulunmaz.
Bakteri hücre duvarı peptidoglikanlardan yapılmıştır. Gram pozitif (Gram +) bakterilerde peptidoglikanlar
20-25 tabakadan ibaret 15-80 nm kalınlığında bir duvar oluşturur. Duvarda bazı lipit ve proteinler de
bulunur. Gram negatif (Gram _) bakterilerde hücre duvarı iki tabakadan oluşur: Dış zar (membran) olarak
isimlendirilen dıştaki tabaka 7-8 nm kalınlığındadır ve lipopolisakkarit ve mukopeptit içerir. Dış zar ile iç
zar (hücre zarı, sitoplazmik zar) arasında 12-15 nm genişliğinde bir boşluk bulunur. Periplazmik alan
(boşluk) adı verilen bu boşlukta 2-3 nm kalınlığında bir peptidoglikan tabakası vardır. Boşluk, ayrıca, çeşitli
proteinler, kemoreseptörler ve enzimleri de barındırır.
Arkelerin hücre duvarının kimyasal yapısı değişebilir; protein veya glikoprotein S tabakaları,
psödopeptidoglikan veya polisakkaritlerden oluşabilir.
Funguslarda hücre duvarı 100-200 nm kalınlığındadır. Selüloz içermeyen duvarın %80-90’ını oluşturan ana
bileşenleri polisakkaritler [β-1,3, β-1,6 ve α-1,3 glukanlar (glukoz polimeri), mannan (6C’lu mannozun
polimeri) ve kitin] ve proteinlerdir.
Alglerin hücre duvarı birçok bakımdan bitki hücre duvarına benzer: Polisakkarit, lipit ve proteinlerden ibaret
şekilsiz (amorf) bir materyal içine gömülmüş bir mikrofibril (mannoz polimeri olan mannan’dan yapılmış)
ağından oluşur. Golgi aygıtında toplanan duvar maddeleri hücre zarından hücre dışına verilir ve hücre
zarındaki enzimler mikrofibrilleri sentezler. Bazı alglerde hücre duvarının ağırlıklı bileşeni selülozdur.
Diatomlar (kabuklu algler) ise silisik asitten ibaret bir hücre duvarına sahiptir.
Bitki Hücre Duvarı: Hücre duvarı bitki hücrelerini hayvan hücrelerinden ayıran özelliklerden birisidir.
Duvar bitki hücresini korur, ona biçim verir ve aşırı su alınmasını engeller. Bitkinin bütünü, özelleşmiş
hücrelerinin güçlü duvarları sayesinde yerçekimine karşı koyar.
Bitki hücre duvarı hücre zarından çok daha kalın olup, kalınlıkları 0.1 µm ile birkaç mikrometre arasındadır.
(Genellikle genç hücreler gelişmişlere oranla daha ince duvarlıdır.) Hücre duvarının bileşimi türden türe ve
aynı bitkideki hücrelerin tipine göre değişmekle birlikte, temel duvar yapısı hepsinde aynıdır: Bir
polisakkarit olan selülozdan yapılmış mikrofibriller (Bir mikrofibrilde yaklaşık 80 selüloz molekülü vardır)
diğer polisakkaritler ve proteinden yapılmış olan bir matriks içine gömülmüştür. Bu şekildeki madde
birlikteliği, çelikle desteklenmiş betona benzetilebilir.
Genç bir bitki hücresi önce oldukça ince ve esnek bir duvar salgılar. Buna birincil (primer) hücre duvarı adı
verilir. Komşu hücrelerin birincil duvarları arasında, pektin olarak adlandırılan ve yapışkan polisakkaritler
açısından zengin olan ince bir tabaka bulunur. Orta lamel adı verilen bu tabaka, hücreleri birbirlerine
yapıştırır (Pektin, reçel ve marmelatların kıvamını artırmada kullanılır). Hücre olgunlaşıp, büyümesi
durunca, duvarını güçlendirir. Bazı bitki hücreleri bunu birincil duvar içine sertleştirici maddeler
salgılayarak yapar: Birincil duvarda, selüloz moleküllerinin bir araya gelerek oluşturduğu selüloz
mikrofibrilleri, Golgi aygıtında sentezlenen ve hücre dışına salınan hemiselüloz zincirleriyle bağlanır ve
oluşan selüloz-hemiselüloz ağı pektinden ibaret matriks içine gömülüdür. (7000-15000 glukoz molekülü
içeren ve dallanmayan selüloz molekülleri bitki hücresinin zarının dış tarafında bulunan selüloz sentaz
enzimi tarafından sentezlenir.) (Hemiselüloz 500-3000 şeker birimi içeren, dallanmış bir polisakkarittir.
Şeker birimleri çok değişiktir: Glukozdan başka ksiloz, mannoz, galaktoz, ramnoz ve arabinoz içerir.)
Bazı bitki hücreleri, hücre tamamen büyüdükten sonra hücre zarı ile birincil duvar arasına kalın bir tabaka
halinde ikincil (sekonder) hücre duvarı oluşturur. Ksilemde bulunan hücreler gibi bazı hücrelerde, hücre
duvarı lignin de içerir. Karmaşık bir fenolik polimer olan ve selüloz, hemiselüloz ve pektin arasındaki
boşluklara giren lignin duvarı güçlendirir ve suyu dışarıya atarak duvarı su geçirmez yapar. İkincil hücre
duvarındaki hemiselüloz tipi ksilandır. İkincil hücre duvarında selüloz %35-50, ksilan %20-35 ve lignin
%10-25 oranlarında bulunur. Odunun temel yapısı ikincil duvarlardan ibarettir.
Çoğu bitki hücresinin duvarında %1-5 yapısal proteinler de bulunur. Epidermis ve endodermis hücre
duvarları suberin veya kütin de içerebilir. Bu poliester benzeri iki polimer hücreyi herbivorlardan
(otçullardan) korur. (Mum yapısında bir madde olan suberin meşe ağacının mantarındaki ana bileşendir.
Kütin ise mum yapısında olup, bitkinin tüm toprak üstü kısımlarının yüzeyini kaplayan kütikulanın esas iki
bileşeninden biridir.)
Hücre duvarı hücre zarından farklı olarak tam geçirgendir. Geçirgenlik duvardaki deliklerle sağlanır. Birincil
duvardaki deliklere “primer (birincil) geçit alanları” denir. Kalınlaşmış ikincil duvardaki delikler ise “geçit”
adını alır. (Geçitler iki tiptir: Basit geçitler ve kenarlı geçitler) Hücre duvarındaki delikler komşu hücreler
arasında kanal oluşturur; bu kanallar su ve suda erimiş maddelerin alış verişini sağlayan difüzyon alanlarıdır.
Hücre duvarında bulunan selüloz dışındaki maddelerin sadece yapısal görevi yoktur. Bu maddeler
çimlenmede ve büyümede depo karbonhidratları olarak da kullanılır.
Kapsül
Bazı bakteriler hücre zarının dışında, kapsül adı verilen polisakkaritlerden yapılmış bir kılıfla çevrilidir.
Kapsül kimi bakterilerde (B. anthracis) polipeptitten, kimilerinde (Bacillus megaterium) ise polipeptit ve
polisakkaritten yapılmış olabilir. Kapsül kaygan ve kırılgan olduğu için kapsüllü bir bakteri kendisini
fagosite edecek bir fagositten kolayca kaçabilir. Kapsülün içerdiği su olumsuz çevre şartlarında bakteriyi
kurumaktan korur. Kapsül varlığı virüslerin ve deterjan gibi toksik maddelerin bakteriye bağlanmasını
engeller. Ayrıca, bakterilerin yüzeye tutunmalarına yardım eder. On dört farklı kapsül tipi vardır; her bir
tipin kendine özgü antijenitesi vardır. Bu nedenle, bir kapsül tipi için oluşan bağışıklık diğer kapsül tipini
etkilemez.
Kapsül Escherichia coli, Klebsiella pneumoniae ve Haemophilus influenzae gibi gram negatif bakterilerde
daha yaygın olarak bulunur. Bununla birlikte, bazı gram pozitif bakteriler de kapsül bulundurur. Bacillus
megaterium ve Streptococcus pyogenes kapsüllü gram pozitif bakterilere örnektir.
Kapsül çok nadir olarak bazı funguslarda da vardır. Örneğin, Cryptococcus neoformans bakterilerdekine
benzer bir kapsüle sahiptir.
Hücre Dışı Matriks (HDM) (Ekstraselüler Matriks=ECM)
Hayvan hücreleri bitki hücreleri gibi hücre duvarı içermemekle birlikte, karmaşık yapılı bir hücre dışı
matriks (HDM) içerir. HDM’in temel bileşenleri hücreler tarafından salgılanan glikoproteinlerdir. Birçok
hayvan hücresinin HDM’inde en bol bulunan glikoprotein, güçlü lifler oluşturan kollajendir. Hayvan
vücudundaki toplam proteinin hemen hemen yarısı kollajendir. Kollajen lifleri, bir glikoprotein sınıfı olan
proteoglikanlardan örülmüş ağ yapısı içine gömülmüş haldedir. Proteoglikan molekülleri karbonhidrat
açısından zengin (%95'e kadar) olup, büyük kompleksler oluşturabilir. HDM’teki bir başka glikoprotein tipi
fibronektinlerdir. Fibronektinler hücre zarına yerleşmiş olan ve integrin adı verilen reseptör proteinlere
bağlıdır. İntegrinler transmembran proteinlerdir ve sitoplazmik tarafları ile hücre iskeletinin
mikrofilamentlerine bağlanır. Dolayısıyla, integrinler HDM’teki değişiklikleri hücre iskeletine, hücre
iskeletindeki değişiklikleri ise HDM’e iletecek konumdadır.
Fibronektinler ve integrinler üzerinde yapılan son araştırmalar, hücrelerin yaşamında HDM’in etkili bir rolü
olduğunu göstermektedir. İntegrinler aracılığı ile hücreyle iletişim kuran HDM, hücrenin davranışını
düzenleyebilir. Örneğin gelişme halindeki bir embriyonun bazı hücreleri, kendi mikroflamentlerinin
konumlarını HDM’teki liflerle uyumlu hale getirerek kendilerine HDM’te özgül yollar oluşturup göç eder.
Araştırıcılar HDM’in çekirdekteki genleri etkileyebildiğini de göstermiştir. HDM’e ilişkin bilginin çekirdeğe
ulaşması büyük bir olasılıkla mekanik ve kimyasal sinyallerin karışımı halinde gerçekleşmektedir. Mekanik
sinyallerin iletimi, fibronektinler, integrinler ve hücre iskeleti aracılığı ile sağlanır. Hücre iskeletindeki
değişiklikler ise hücre içindeki kimyasal sinyal yollarını tetikleyebilir. Bu yolla belirli bir dokunun hücre dışı
matriksi, dokudaki tüm hücrelerin eşgüdümlü olarak davranmasına yardımcı olur. Hücreler arasındaki
doğrudan bağlantılar da bu eşgüdümde görev alır.
Bazal Lamina: Epitel hücrelerinin alt kısmındaki hücre dışı bir yapıdır. Epitel hücreleri tarafından
salgılanan bazal lamina 40-50 nanometre kalınlığındadır ve proteoglikanlardan meydana gelir. Bazal lamina
epitel hücrelerine mekanik dayanıklılık sağlar.
Hücrelerarası Bağlantılar
Bir hayvan ya da bitkideki birçok hücre, dokular, organlar ve organ sistemleri şeklinde organize olur. Komşu
hücreler, doğrudan fiziksel temas noktaları aracılığı ile birbirlerine tutunur, birbirleriyle etkileşir ve iletişim
kurar.
Bitkilerdeki cansız hücre duvarları, hücreleri yalıtıyormuş gibi görünebilir. Ancak daha önce belirtildiği gibi,
bitki hücre duvarları, içerdikleri kanallar nedeniyle delikli bir yapıya sahiptir. Bu kanallara plazmodezma
(çoğulu plazmodezmata; Yunanca desmos=bağlanmak) adı verilir. Sitozol plazmodezma içinden geçerek,
komşu hücrelerin sitozolüyle bağlantı kurar. Plazmodezmalar birçok bitkiyi kesintisiz bir bütün haline
getirir. Komşu hücrelerin hücre zarları da plazmodezma aracılığı ile devamlılık gösterir; yani hücre zarı
kanalların içini döşer. Su ve suda çözünmüş küçük moleküller serbestçe hücreden hücreye geçer. En son
deneyler, belirli koşullarda bazı protein (sinyal molekülü, hormon ve virüs) ve RNA moleküllerinin de bunu
yapabildiklerini göstermiştir. Komşu hücrelere aktarılacak olan makromoleküller hücre iskeletinin lifleri
tarafından plazmodezmaya taşınır.
Hayvanlarda üç temel hücrelerarası bağlantı tipi bulunur: Sıkı bağlantılar, dezmozomlar ve oluklu
bağlantılar. Bu üç bağlantı tipi de vücudun iç yüzeylerini döşeyen epitel dokuda yaygın olarak bulunur. Her
bağlantı tipi kendi işlevine uygun bir yapıya sahiptir.
Sıkı bağlantılarda komşu hücrelerin zarları kaynaşmış haldedir, yani hücreler arasında aralık (hücrelerarası
alan) yoktur. Bu bağlantılar hücrelerin çevresinde bir kemer gibi kesintisiz kuşaklar oluşturarak, hücre dışı
sıvısının epitel hücre tabakasının diğer tarafına sızmasını engeller. Örneğin bağırsak epitelinin sıkı
bağlantıları, bağırsak içeriğini epitelin diğer tarafındaki vücut sıvısından ayrı tutar.
Dezmozomlar (tutturucu, tutundurucu bağlantılar olarak da adlandırılır) perçin gibi iş görerek hücreleri
birbirlerine bağlar. Epitel hücreleri dezmozomlarla bağlanarak güçlü tabakalar oluşturur. Dayanıklı bir
protein olan keratinden yapılmış ara (intermediyer) filamentler dezmozomları destekler. Mekanik etki
altında kalan hücrelerde dezmozom daha fazladır. Dezmozom bölgelerinde komşu hücreler arasında 15-20
nm genişliğinde bir aralık vardır.
Oluklu bağlantılar (iletişim, haberleşme bağlantıları veya neksus olarak da adlandırılır) komşu hayvan
hücrelerinin birbirine yaklaştıkları bölgelerde özel zar proteinlerinin oluşturduğu borucuklardır. Bu
borucuklar ile iki hücre arasında sitoplazmik bağlantılar kurulur. Borucuklar 1000 daltona kadar
büyüklükteki iyonların, şekerlerin, amino asitlerin ve diğer moleküllerin (nükleotitler, vitaminler, steroit
hormonlar) geçmesine izin verecek genişliktedir. Elektriksel uyarımlar da diğer hücrelere bu geçit
bölgelerinden iletilir. Kalbin kas dokusundaki oluklu bağlantılardan geçen iyonlar, hücrelerin kasılmasını
eşgüdümlü hale getirir. Oluklu bağlantılar özellikle, hücreler arasındaki kimyasal haberleşmenin çok gerekli
olduğu hayvan embriyolarında yaygındır. Çünkü bir zigotun gelişerek, aralarında düzenleme ve işbölümü
oluşmuş, yapısal olarak farklılaşmış hücreleri meydana getirmesi, hücreler arasındaki iletişim ile mümkün
olmaktadır.
Yüzey Farklılaşmaları
Tek hücrelilerde veya çok hücrelilerdeki, belli bir lümene veya dış ortama bakan hücrelerde, zarın serbest
yüzeyinde bazı farklı oluşumlar görülebilir. Bu oluşumlara aşağıda kısaca değinilmiştir.
Mikrovillus: Hücre zarı dışarı doğru küçük parmaksı çıkıntılar oluşturabilir. Mikrovillus denen bu oluşumlar
hemen bütün hücrelerde az çok görülebilse de, özellikle bazı organların lümen epitelinde belirgindir.
Hücrede yüzey alanını artırır ve böylece emilimi hızlandırır. Örneğin, bağırsak epitelinin lümene bakan
hücrelerinde 3000-4000 kadar mikrovillus bulunur.
Bazal katlanma: Sıvı alış verişinin fazla olduğu hücrelerde (Örneğin böbrek tübüllerinin epitel hücreleri),
hücrenin taban kısmındaki hücre zarı hücre içine doğru birçok kıvrım ve girinti yapar.
Sil ve kamçı: Bazı protozoonlarda (Ciliata), memelilerin solunum yollarındaki epitelde ve yumurta
kanalındaki epitelde çok sayıda, küçük (5-10 mikron uzunluğunda, 0.2-0.25 mikron çapında) sil (silyum,
titrek tüy) bulunur. Protozoonlarda harekete ve beslenmeye yardımcı olan bu oluşumlar, solunum sisteminde
mukusa yapışan toz ve diğer parçacıkların süpürülmesini, yumurta kanalında oositin hareketini sağlar. Bir
epitel hücresinde 250-300 kadar sil olabilir. Hareketli sillere kinosil, hareketsiz olanlara stereosil denir.
Stereosiller, kinosillerden uzundur.
Kamçılı protozoonlarda (Mastigophora) ve spermatozoonlarda kamçı adı verilen ve yapısal olarak sile
benzeyen, ancak çok daha büyük ve uzun olan, harekette rol oynayan bir veya daha fazla sayıda oluşumlar
vardır. Uzunluğu 150 mikron kadar olabilir; insan spermatozoonun kamçısı 20-50 mikron uzunluğundadır.
Sil ve kamçıların yüzeyleri hücre zarının devamıdır. Ancak bakterilerde kamçı proteindir.