ATOMUN YAPISI VE ÖZELLİKLERİ
•
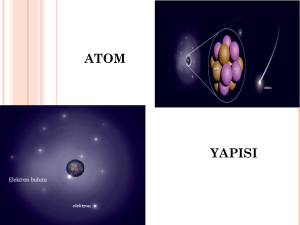
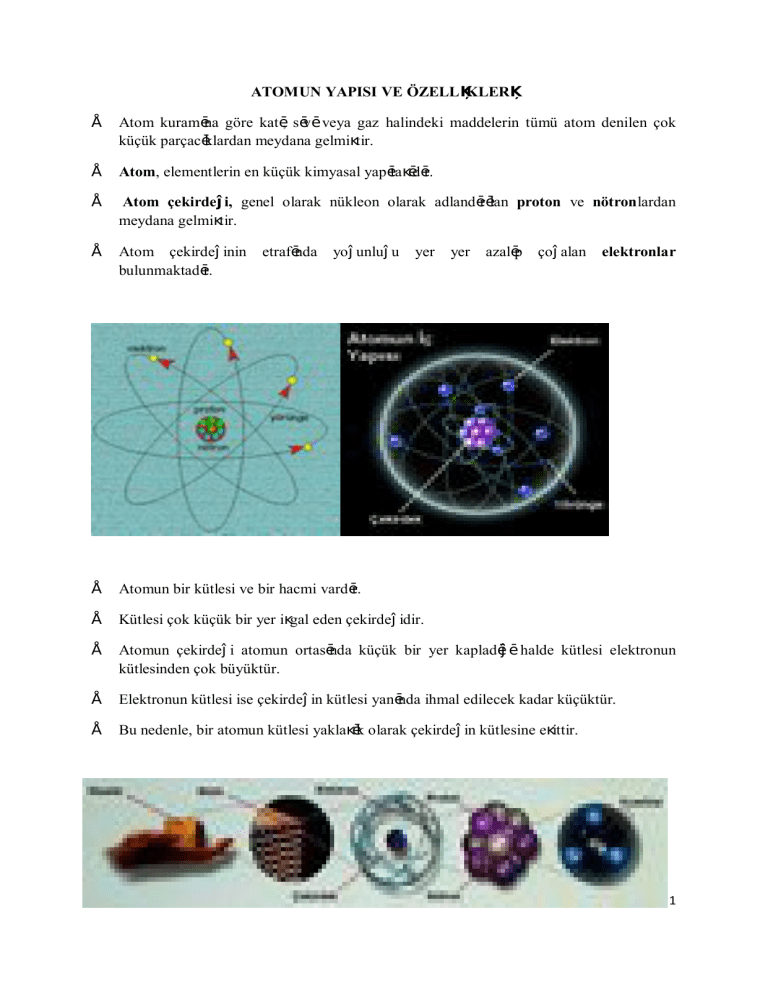
Atom kuramına göre katı, sıvı veya gaz halindeki maddelerin tümü atom denilen çok
küçük parçacıklardan meydana gelmiştir.
•
Atom, elementlerin en küçük kimyasal yapıtaşıdır.
•
Atom çekirdeği, genel olarak nükleon olarak adlandırılan proton ve nötronlardan
meydana gelmiştir.
•
Atom çekirdeğinin
bulunmaktadır.
•
Atomun bir kütlesi ve bir hacmi vardır.
•
Kütlesi çok küçük bir yer işgal eden çekirdeğidir.
•
Atomun çekirdeği atomun ortasında küçük bir yer kapladığı halde kütlesi elektronun
kütlesinden çok büyüktür.
•
Elektronun kütlesi ise çekirdeğin kütlesi yanında ihmal edilecek kadar küçüktür.
•
Bu nedenle, bir atomun kütlesi yaklaşık olarak çekirdeğin kütlesine eşittir.
etrafında
yoğunluğu
yer
yer
azalıp
çoğalan
elektronlar
1
Elektron; kütlesi 9,1094x10-31 kg olan ve elektriksel olarak eksi (-) yüklü bir parçacıktır.
Genellikle “ē” sembolü ile gösterilir.
Proton; kütlesi 1,6726x10-27 kg olan, bir elektron kütlesinin yaklaşık 1836 katı olan ve
elektriksel olarak artı (+) yüklü bir parçacıktır. Protonun sembolü “p” veya “H+” olarak
gösterilir.
Nötron; kütlesi yaklaşık olarak bir protonun kütlesine eşit ve elektriksel olarak yüksüz bir
parçacıktır. Nötronun sembolü genellikle “n” ile verilir.
Kısaca;
Nötron Kütlesi@Proton Kütlesi@1836 Elektron Kütlesi
diyebiliriz.
Örnek:
Protonun yarıçapının 1,3x10-13cm ve kütlesinin 1,67x10-24 g olduğu kabul edildiğine göre;
a)
Protonun yoğunluğu g/ cm3 cinsinden nedir? (Protonu küresel kabul ediniz)
b) Bir basketbol topunun yarıçapı 12 cm’dir. Bu basketbol topunun yoğunluğu protonun
yoğunluğuna eşit olsaydı kütlesi ne olurdu?
•
Elektronlar çekirdek etrafında çok hızlı bir şekilde hareket ederler. Elektronlar çekirdek
etrafında dönerken kapladıkları alan o atomun hacmini tayin eder. Çekirdeğin hacmi,
atomun hacmine kıyasla çok küçüktür.
•
Farklı elementlerin atomları farklı büyüklüklerde olur. Örneğin en küçük atom olan
hidrojenin yarıçapı 0,4 A0 (angstrom) en büyük atomlardan biri olan sezyumun yarıçapı
ise 2,7 A0’dur.
•
Angstrom, 10-10 m’ye karşılık gelen ve atom yarıçapını belirtmede kullanılan bir uzunluk
birimidir.
•
Aynı elementin tüm atomlarında eşit sayıda elektron ve proton bulunmaktadır. Bu
nedenle tüm atomlar elektrik yükü açısından nötrdür. Diğer bir değişle yüksüz bir atomda
proton sayısı elektron sayısına eşittir.
•
Örneğin C atomunda 6 tane elektron 6 tane proton bulunur.
•
Atom numarası elementler için ayırt edici bir özelliktir. Bir atomun çekirdeğinde
bulunan protonların sayısına o atomun atom numarası denir. Atom numarası genelde
“Z” sembolü ile gösterilir. Örneğin C atomunda 6 proton olduğuna göre atom numarası
da 6’dır.
2
Burada
X: Elementin Simgesi
A: Kütle Numarası=Proton + Nötron Sayısı
Z: Atom Numarası = Proton Sayısı
Yük = Proton Sayısı – Elektron Sayısı
Örneğin, Alüminyum atomu 2713Al şeklinde gösterilir. Bu atomun çekirdeğinde 13 proton,
14 nötron bulunmaktadır. Çekirdek dışında ise 13 elektron bulunur.(Bir atomda proton ve
elektron sayıları birbirine eşittir.)
Örnek:
Z = 17
35
17Cl’deki
proton, nötron ve elektron sayılarını belirtiniz.
A=35 ve nötr atomdur.
Buna göre; p sayısı= 17
;
e sayısı = 17 ve n sayısı = A-Z=35-17=18
Örnek: 29 proton, 34 nötron ve 27 elektron içeren taneciğin simgesini yazınız.
Kütle numarası = A= p sayısı+n sayısı=29 +34=63
e sayısı ve p sayısı farklı olduğu için bu bir iyondur.
Net yükü = p sayısı-e sayısı = 29-27 = +2’dir.
Buna göre taneciğin simgesi;
Bu Bakır (Cu) elementidir. 6329Cu+2
İzotop Kavramı
•
Aynı atom numarasına yani aynı sayıda proton ve elektrona sahip olup, farklı nötron
sayısı içeren atomlar izotop olarak adlandırılır. İzotop atomların atom numaraları aynı
kütle numaraları farklıdır.
•
Örneğin Hidrojen elementinin 3, Karbon elementinin 3, Klor elementinin 2 ve Silisyum
elementinin 3 izotopu mevcuttur.
3
•
Hidrojen elementi dışındaki (Hidrojen, Döteryum, Tridyum) tüm elementlerin izotopları
kendi isimleri ile adlandılır. Karbon-12, Karbon-13, karbon-14 gibi.
•
Karbon-12 izotopu;
12
6C
Karbon-14 izotopu;
14
6C
Şeklinde gösterilir. İlkinde 6 nötron; ikincisinde 8 nötron vardır.
•
İzotop atomların kimyasal özellikleri birbirine çok benzer, ancak fiziksel özellikleri
farklıdır.
•
Birçok element en az iki doğal izotopa sahiptir. Bu nedenle, herhangi bir elementin atom
ağırlığı, bu elementin doğal olarak bulunan izotoplarının atom kütlelerine ve bu
izotopların doğadaki dağılım oranlarına bağlıdır.
•
Buna göre bir elementin “atom ağırlığı (kütlesi)” izotopların doğada bulunma oranlarına
göre, ağırlıklı atom kütlelerinin ortalamasıdır.
•
Eğer bir element tek bir izotopa sahip ise bu elementin atom ağırlığı ile atom kütlesi
birbirine eşit olur. Eğer, element birden fazla izotopa sahip ise atom ağırlığı atom
kütlesinden farklıdır.
•
Örneğin, karbonun doğal olarak bulunan izotoplarından Karbon-12’nin atom kütlesi 12
akb (doğal oranı % 98,892); Karbon-13’ün atom kütlesi 13,00335 akb (doğal oranı %
1,108) ve Karbon-14 izotopu doğada çok az bulunduğu için (%0,0001) bunun karbonun
atom ağırlığı üzerine etkisi ihmal edilmektedir. Buna göre Karbonun atom ağırlığı;
Karbon Atom Ağırlığı = (0,98892)(12) + (0,01108)(13,00335) = 12,011 akb
olarak bulunur.
akb: Atomların kütlelerinin ölçülmesinde standart kütle birimlerinin kullanılması çok zor
olacağından bu gibi küçük maddelerin kütlelerinin ölçülmesi için yeni bir kütle birimi
oluşturulmuştur. 1 akb olarak tanımlanan bu birim Karbon-12 atomunun kütlesinin
1/12’si olarak tanımlanır.
*Çizelgede bazı elementlerin atom numaraları ve atom ağırlıkları verilmektedir.
Örnek: Magnezyumun izotoplarının yüzdeleri ve kütleleri aşağıda verilmiştir. Buna göre
Magnezyumun atom ağırlığı nedir?
Mg-24: %78,70; Kütlesi 23,99 akb
Mg-25: %10,13; Kütlesi 24,99 akb
Mg-26: %11,17; Kütlesi 25,98 akb
Mg AtomAğırlığı=(23,99)(0,7870)+(24,99)(0,1013)+(25,98)(0,1117)
= 24,31 akb
4
Element
Sembol Atom No
Atom Element
Sembol Atom No
Ağırlığı
Atom
Ağırlığı
Hidrojen
H
1
1,008 Sodyum
Na
11
22,99
Karbon
C
6
12,01 Magnezyum
Mg
12
24,31
Azot
N
7
14,01 Potasyum
K
19
39,1
Oksijen
O
8
16,00 Kalsiyum
Ca
20
40,08
Fosfor
P
15
30,97 Demir
Fe
26
55,85
Kükürt
S
16
32,06 Bakır
Cu
29
63,55
Klor
Cl
17
35,45 İyot
I
53
126,9
Örnek: Lityum’un (Li) doğada bulunan izotopları lityum-6 ve lityum-7’dir. Kütleleri sırası
ile 6,01513 ve 7,0601 akb’dir. Bu iki izotoptan hangisi doğada daha fazla bulunur?
İzobar Atomlar; Kütle numaraları aynı proton sayıları farklı olan atomlara denir. Örneğin;
36
ve 3618Ar
16S
Bu tip atomların tüm kimyasal özellikleri birbirinden farklıdır.
İzoton Atomlar; Nötron sayıları aynı, proton sayıları farklı olan atomlara denir. Örneğin;
35
ve 3618Ar
17Cl
Elektronların Düzenlenmesi
•
Bir elementin kimyasal özelliği o elementin atomlarına ait çekirdeğin etrafında yer alan
elektronların sayısına ve konumlarına bağlıdır.
•
Bir atomda çekirdekten en uzakta bulunan elektronlar o elementin kimyasal
davranışlarını belirler ve bu elektronlar valans elektronu olarak tanımlanırlar. Öyle ki
aynı sayıda valans elektronuna sahip atomlar özellikleri bakımından benzerlik gösterirler.
•
Elektronların çekirdek etrafında hızla dönmeleri ile meydana getirdikleri bulutlar, farklı
enerji seviyelerine sahiptirler.
•
Elektronlar çekirdek etrafında rastgele aralıklarla yer almazlar. Belirli ana enerji
tabakalarında bulunurlar.
•
Çekirdeğe en yakın olan elektronlar en düşük enerji durumunda, çekirdekten uzaklaştıkça
daha yüksek enerji durumunda olurlar.
5
Elektronların Düzenlenmesi
•
Atom çekirdeği etrafında elektron enerji seviyeleri, çekirdeğe en yakından itibaren K, L,
M, N, O, P ve Q gibi harfler ile ifade edilir; bunlar da elementlerin periyodik tablosundaki
1, 2, 3, 4, 5, 6, 7 periyot numaralarına uyar.
• Her bir enerji düzeyi belirli bir sayıda elektron tutabilir. Çekirdeğe en yakın ve en düşük
enerji düzeyine sahip K tabakası en fazla 2e barındırabilir. L: 8e; M:18e; N:32e
barındırmaktadır.
• Elektronlar enerji seviyelerini doldururken önce en düşük enerji seviyesini doldurur, artan
elektronlar diğer enerji seviyelerini maksimum dolduracak şekilde yerleşirler.
• Örneğin Sodyum (Na) atomu 11 elektron içerir. Bu elektronlardan 2e önce K tabakasını
doldurur. Kalan 9 elektrondan 8 tanesi L tabakasını doldurur ve kalan 1 elektron ise M
tabakasına gider.
• Çekirdek etrafındaki enerji seviyeleri kendi içinde alt enerji seviyelerine ayrılırlar. Bunlar
orbital olarak bilinip, s, p, d, f harfleri ile gösterilirler.
K enerji düzeyinde sadece; 1 adet s orbitali;
L enerji düzeyinde; 1 adet s + 3 adet p orbitali
M enerji düzeyinde; 1 adet s + 3 adet p + 5 adet d orbitali
N enerji düzeyinde; 1 adet s + 3 adet p + 5 adet d + 7 adet f orbitali
bulunur.
Alt enerji seviyesi
Orbital sayısı
Max. elektron sayıs
s
1
2
p
3
6
d
5
10
f
7
14
I
6
Örneğin Klor (Cl) atomunu ele alalım. Klor 17 elektron ve 17 protona sahiptir. Elektronların
orbitallerdeki yerleşim sırası;
17Cl: 1s2
K
2s2 2p6 3s23p5
L
M
İlk dört ana enerji seviyesindeki elektronların düzenlenmesi çizelgedeki gibidir.
Ana Enerji Seviyesi
Tabaka
1
K
2
L
3
4
M
AltEnerji Seviyesi Orbital Sayısı
1s
1
2s
1
2p
3
3s
1
3p
3
3d
5
4s
1
4p
3
4d
5
4f
7
Max. Elektron Sayısı
2
8
N
18
32
7
ATOM MODELLERİ
•
DALTON ATOM MODELİ
•
THOMSON ATOM MODELİ
•
RUTHERFORD ATOM MODELİ
•
BOHR ATOM MODELİ
DALTON ATOM MODELİ
Kimyasal birleşme yasalarından Sabit Oranlar Yasası ve Kütlenin Korunumu Yasasından
yararlanan Dalton’un atom kuramı üç varsayıma dayanır. Bunlar;
1. Her bir element atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşmuştur.
Atomlar kimyasal tepkimelerle oluşamazlar ve bölünemezler.
2. Bir elementin bütün atomlarının kütlesi ve diğer özellikleri aynıdır. Fakat bir elementin
atomları diğer bütün elementlerin atomlarından farklıdır.
3. Kimyasal bir bileşik iki ya da daha çok sayıda elementin sayısal bir oranda birleşmesiyle
oluşur.
Bileşikler atomların birleşmesiyle oluşur.
8
THOMSON ATOM MODELİ
Thomson, maddenin düzgün olarak dağıtılmış positive yükler ve aralarına serpiştirilmiş
negatif yüklerden oluştuğunu ifade etmiştir.
Bu yönüyle madde atomu üzümlü keke benzetilebilir. Kek pozitif yük, üzümler ise
elektronlardır.
RUTHERFOR D ATOM MODELİ
Rutherford’a göre; atom merkezde kütlesi çok büyük bir çekirdek ve etrafında belirli
yörüngelerde dolanan elektronlardan oluşmuştur.
Bu görüşün yetersizliği; Elektronun neden çekirdeğe düşmediği ya da atomdan fırlayıp
gitmediği sorusunun cevapsız kalmasıdır.
9
BOHR ATOM MODELİ
Bohr atom modeli, elektronların çekirdekten herhangi bir uzaklıkta bulunan tek bir yörüngede
değil, belirli yörüngede olduğunu belirtir.
Bir elektronun bulunduğu yer elektronun sahip olduğu enerjiye bağlıdır. Bu enerji düzeyleri
çekirdeğe yakın olandan uzağa doğru 1,2,3.... gibi numaralar verilerek gösterilir.
Enerji düzeylerinin enerjisi çekirdeğe yaklaştıkça azalır, uzaklaştıkça artar.
Bohr Atom Modeli, Hidrojen atomu ve tek elektronlu iyonlar için başarılı sonuçlar
getirmesine rağmen, bir çok yetersiz yönleri vardır. Örneğin; deneysel veriler çok elektronlu
atom ve iyonların yayılma spektrumlarının oldukça uğraşılmasına karşın Bohr Modeli ile
açıklanmayacağını göstermiştir.
Modern kuantum teorisi; 1926’da Bohr kuramının yerini almıştır. Ancak, Bohr kuramının
bilimsel gelişimdeki önemi küçümsenmemelidir.
KUANTUM TEORİSİNE GÖRE ATOM
•
Bohr, de Broglie, Heisenberg ve Schrödinger gibi bilim adamları atomun bugün kabul
edilen modelinin gelişmesinde temel rol oynadılar.
•
Bu toeriye göre proton ve nötronlardan oluşan atom çekirdeği atomun merkezinde
bulunur. Elektronlar ise çoğunlukla varlıkları ve şekilleri matematiksel olarak hesaplanan
orbitallerde atom çekirdeğinin etrafında dalga karakterinde bir hareketle dolaşırlar.
•
Dalga mekaniğinde, birden çok elektron içeren bir atomda elektronlar kabuklara
dağılmıştır. Kabukların bir veya daha çok alt kabuktan, alt kabukların da elektronların
işgal ettiği bir veya daha çok orbitalden oluştuğu varsayılır.
10
•
Atomlardaki elektronların dalga karakterlerinin matematik yönünden incelenmesi sonucu,
atomun her elektronu kabaca, kabuk, alt kabuk, orbital ve elektronu gösteren dört
kuantum numarası ile tanımlanır. Bunlar;
1. Baş Kuantum Sayısı (n)
•
n=1,2,3….. gibi tam sayılar olabilir. Elektronun çekirdeğe olan ortalama uzaklığını
tanımlar. Elektronun enerji seviyesi daha çok çekirdeğe olan uzaklıkla değiştiğinden baş
kuantum sayısının farklı olması enerji düzeyinde en büyük değişikliğe yol açmaktadır.
Aynı baş kuantum sayısına sahip olan elektronlar belirli bir enerji tabakasını oluştururlar.
Bu sayı elektronun ait olduğu enerji düzeyini veya kabuğunu belirler.
2. Yan Kuantum Sayısı (l)
•
l=0,1,2,3…..(n-1) değerlerini almaktadır. Her enerji düzeyi bir veya daha çok alt enerji
düzeylerinden oluşur. Alt enerji düzeyi sayısı baş kuantum sayısına eşittir. n=1 ise bir alt
enerji düzeyi; n=2 ise 2 alt enerji düzeyi bulunur. Bir enerji düzeyindeki her alt enerji
düzeyi bir yan kuantum sayısı ile tanımlanır. Hiçbir zaman (n-1)’den büyük bir değer
alamaz.
•
Buna göre;
•
n=1 ise sadece bir alt enerji düzeyi vardır ve bu da l=0’dır.
•
n=2 ise iki alt enerji düzeyi vardır. Bunlar; l=0 ve l=1’dir.
•
Alt enerji düzeylerini göstermek için harf sembolleri kullanılır.
•
l=0 (s)
l=1 (p)
l=2 (d)
l=3 (f)
3. Manyetik Kuantum Sayısı (m)
•
m= -l,.….0……,+l’ye kadar tam sayıları alabilir. Alt tabakayı oluşturan orbitaller uzayda
çeşitli doğrultulara yönelirler. Atom, bir dış manyetik alanın etkisinde kalırsa, elektronik
enerji seviyelerinin ayrılmasına neden olur.
•
Belirli bir enerji düzeyine sahip bir atomun kuantum sayıları aşağıdaki gibi gösterilir.
(n=3)
11
m= +2
m= +1
l=2 (d)
m= 0
m= -1
m= -2
n=3
m= +1
l=1 (p)
m=0
m= -1
l=0 (s)
m= 0
• Baş kabuklar n’nin değerine göre numaralanırlar. İlk baş kabuk n=1 değerine sahip
orbitallerden oluşur. Diğerleri de benzer şekilde devam eder. n’nin değeri elektronun
çekirdekten uzaklığına bağlıdır. n’nin değeri büyüdükçe enerji ve elektronun çekirdekten
ortalama uzaklığı da artar.
• Baş kabuktaki alt kabuk sayısı, yan kuantum sayısının yani l‘nin alabileceği değerle
aynıdır. n=1 değerinde birinci kabukta l sadece 0 değerini alabilir ve bu nedenle bir alt
kabuk vardır.
• Bir alt kabuktaki orbital sayısı, belirli bir l için izin verilen m sayısına eşittir. Orbital
Sayısı (m) = 2 l +1
s alt kabuğu
p alt kabuğu
d alt kabuğu
f alt kabuğu
l=0
l =1
l=2
l =3
m=0
m = -1, 0, +1
m = -2, -1, 0, +1,+2
m = -3, -2, -1, 0, +1, +2, +3
p alt kabuğunda üç
p orbitali
d alt kabuğunda beş d
orbitali
f alt kabuğunda yedi f orbitali
s alt kabuğunda
bir s orbitali
12
4. Dönme (spin) Kuantum Sayısı (s)
Bu sayı elektronların kendi etrafında dönüşü ile ilgilidir. Elktronun bu şekilde dönüşünden
manyetik alan meydana gelir. Dönüşün saat yönünde veya zıt yönde oluşuna göre spin
kuantum sayısı +1/2 veya -1/2 değerini almaktadır. Bu durum zıt yönlü oklar ile de
gösterilebilir.
Elektronların Yerleşim Düzeni
Elektron yapıları standart bir şekilde baş kuantum ve yan kuantum sayıları ile aşağıdaki gibi
verilir.
n.l x
Burada;
n= Baş kuantum sayısı
l=Yan kuantum sayısı
x= alt enerji seviyesindeki toplam elektron sayısı
Örneğin; n=3 enerji düzeyinde, l=2 alt enerji düzeyinde 5 elektron bulunur ifadesi;
3d5 şeklinde gösterilir.
Bir enerji seviyesindeki elektronların orbitallere dağılımında ve bir atomdaki enerji
seviyelerine dağıtılmasında bazı kurallar vardır.
n+l Kuralı (Aufbau Kuralı):
Elektron iki orbital seçeneğinden düşük enerjili olanı tercih edeceğinden orbitallerin göreceli
enerjileri kuantum sayılarına (n+l) bakılarak bulunur. (n+l) değeri düşük olan orbital düşük
enerjilidir ve elektron tarafından tercih edilir.
Hund Kuralı:
Elektronlar bir orbitale önce tek tek ve paralel spinli olarak yerleşirler. Çünkü elektronlar aynı
yüke sahip olduklarından birbirini iteceklerdir.
(Pauli İlkesi):
Herhangi bir atomun iki elektronu aynı dört kuantum sayısına sahip olamayacağına göre
paralel spinli elektronlar aynı orbitale yerleşemezler.
Bu kurallara göre elektron diziliş sırası;
1s2 / 2s2 2p6 / 3s2 3p6 / 4s2 3d10 4p6 / 5s2 4d10 5p6 / 6s2 4f14 5d10 6p6/…
6C: 1s2 / 2s2 2p2
7N: 1s2 / 2s2 2p3
13
Örnek: Aşağıda kuantum sayıları verilmiş olan orbitalleri simgesel olarak yazarak, bu
kuantum sayılarına sahip orbitallerin alabileceği elektron sayısını belirtiniz.
a) n=5; l = 4
b) n=4; l = 1
c) n=4; l = 0; m=0
d) n=2; l = 0; m=+2
e) n=3; l = 2; m=+1
ELEKTROMAGNETiK IŞIMA
•
Atomun yapısı hakkında daha ayrıntılı bilgi, elektromagnetik ışının (radyasyon) atomlar
tarafından yayınması (emisyonu) ve soğurulması (absorbsiyonu) üzerindeki çalışmalar ile
kazanılmıştır.
•
Elektromagnetik ışının hem dalga hem de parçacık yapısında olma özelliği vardır ve ışık
elektromagnetik ışımanın gözle görünür bölümüdür.
•
Işın enerjisinin değişik şekillerinin hepsi, boşlukta aynı hızla (ışık hızıyla, 3 x 108 m s-1)
yayılan elektromagnetik dalgalardır (Şekil 3.7.1) ve bir elektromagnetik dalga, yayılma
doğrultusunda birbirine dik düzlemler içinde elektriksel ve magnetik alanlardan oluşur.
•
Elektromagnetik dalganın yayılmasında, ard arda iki dalga tepesi arasındaki uzaklık
dalga boyu, λ' dır. Dalganın yüksekliği, genlik (veya amplitüd), A dır ve ışımanın
şiddetine bağlıdır.
•
Dalga yayılmasında bir noktadan 1 saniyede geçen dalga sayısına frekans, n denir. O
halde ışımanın frekansı, ışık hızının dalga boyuna oranı olacaktır:
n = c/λ veya c = λn
Frekans için SI birimi Hertz (Hz) dir,
1 Hz = 1 devir/s = 1/s = s-1 yazılabilir.
14
Şekil 1. Bir dalganın dalga boyu ve genliği
Örnek: Dalga boyu 1,54 x 10 –10 m olan ışımanın frekansını bulunuz.
ν = c/λ eşitliğinde,
ışık hızı, c = 3,00 x 10 8 m s-1 ve λ = 1,54 x 10-10 m yerine konursa
ν = 3,00 x 108 m Hz/1,54 x l0 -10 m = 1,95 x 1018 Hz
bulunur.
•
Şekil 2’de elektromagnetik spektrum çizilmiştir.
•
Elektromagnetik ışın türlerinin dalga boyları çok çeşitlidir.
•
Beyaz ışık (görünür ışık), dalga boyları 4xl0 -5 cm - 8 x 10-5 cm (4000 A° - 8000 A°) olan
ışımalardan ibarettir.
•
(1 A° (Angstrom) = 10-10 m) A° yerine kullanılması önerilen birim nm'dir, (1nm = 10A°)
•
O halde beyaz ışık, dalga boyları 400-800 nm olan ışımaları içerir.
15
Şekil 2. Elektromagnetik spektrum.
Planck Kuantum Kuramı
• Elektromagnetik ışımanın dalga kuramı, gözlenen pek çok özelliklerini açıklar.
• Fakat bazı özellikler, örneğin siyah cisimlerin ışıması ve fotoelektrik olayı gibi konular
ancak 1900 yılında M. Planck tarafından ortaya atılan dalganın parçacık özelliğini temel
alan ve kuantum teorisi olarak tanımlanan bir teori ile açıklanabilmiştir.
• Bu teoriye göre enerjinin ancak belli büyüklüklerde soğurulup yayımlanabileceğini, yani
kuantumlar halinde alınıp verilebileceğini ileri sürmüştür.
• Bu büyüklüklere kuantum, ışıma enerjisine (yani kuantumlardan oluşmuş enerji akımına)
ise kuantlanmış enerji denir.
• A. Einstein, 1905'te, ışımayı oluşturduğu ve ışık hızıyla hareket ettiği varsayılan bu
kuantumları foton olarak adlandırmıştır.
• Planck’a göre bir fotonun enerjisi, ışımanın frekansı, ν ile orantılıdır.
E = hv = hc/λ
Burada orantı katsayısı h, Planck sabitidir:
h = 6,626 x 10-34 Js (veya h=6,626xl0-27 erg.s).
•
Işının frekansı arttıkça kuantumun enerjisi ve kuantumlardan oluşmuş enerji akımı olarak
tanımlayabileceğimiz ışının enerjisi de artar.
16
Örnek: Oksijenin foto ayrışmasını sağlayacak en uzun dalga boylu ışımanın dalga boyu 242,4
nm’dir. Bu ışığın bir fotonunun enerjisi nedir?
•
ν = 3,00x108 m Hz / 242,4xl0 -9 m = 1,237x1015 1/s (Hz)
•
E = h. ν = 6,626 x 10-34 Js x 1/foton x 1,237x1015 1/s
•
E = 8,196 x 10-19 J/foton
Fotoelektrik Olayı ve Foton
1905’de A. Einstein fotoelektrik olayı Planck Kuantum teorisine göre açıklayabilmiştir. Belli
frekanslı bir ışının bir metal üzerine gönderilmesi halinde, metalden elektron kopmasına
“fotoelektrik olay” denir.
Böyle bir olaydan elde edilen deneysel sonuçlar şu üç noktayı göstermiştir.
1. Metal üzerine düşen ışığın frekansı ν0 (eşik frekansı) değerinin altına düştüğünde metal hiç
elektron yayımlamaz.
2. Bu (ν0 ) eşik frekansı her metal için farklı değerdedir.
17
3. Yayımlanan elektronların kinetik enerjileri ışığın frekansı arttıkça artmaktadır.
Bu veriler doğrultusunda ν frekanslı ve Efoton = h. ν enerjili bir ışın metala çarptığında
enerjisini elektrona verir. Metal yüzeyinden elektron kopartmak için gereken enerji E0 ise;
h. ν = E0 + 1/2mv2 bağıntısı bulunur. 1/2mv2 kopan elektronun kinetik enerjisidir.
Efoton = h. ν = E0 + 1/2mv2
(E0 = h. ν0 = Çıkış işi olarak da tanımlanır. Her metal için sabittir.)
Efoton = h. ν = h. ν0 + 1/2mv2 bağıntısı
ve elektronun enerjisi;
1/2mv2 = h. (ν – ν0)
olur.
Burada;
m: Elektronun kütlesi,
v = Elektronun hızı,
ν0 = Metalin cinsine bağlı olan eşik frekansıdır.
Örnek: Potasyumun çıkış işi 2,24 eV’tur. 2537 A° dalga boylu bir ışıkla oluşturulan foto
elektronların kinetik enerjisini ve hızını hesaplayınız.
Gelen fotonun enerjisi için;
E = h. ν = hc/λ = 6,626.10-27 erg.s x 3.l010 cm/s / 2537.10-8 cm
E = 7,84.l0-12 erg
1eV = 1,6.l0-12 erg ise E = 4,9 eV olur.
1/2mv2 = h. (ν – ν0)
(m elektronun kütlesi olup 9,1.l0-28 g’dır.)
1/2mv2 = 4,9 – 2,24 = 2,66 eV = 4,26.l0-12 erg
v = 9,68.l07 cm/s
bulunur.
18
Elektron Enerjileri
Bohr tarafından değişik yörüngelerdeki elektronların enerjisini belirleyen bir eşitlik
türetilmiştir. Bu eşitlik;
Eyörünge = - (2,179x10-18 J) / n2
Bir dış yörüngedeki (nd) elektronun enerjisine Ed ve bir iç yörüngedeki (ni) elektronun
enerjiside Ei olsun. Elektron dış yörüngeden iç yörüngeye geçtiğinde (Ed-Ei) kadar enerji bir
ışık fotonu şeklinde yayınlanır. Planck eşitliğine göre bir fotonun enerjisi h.ν’ye eşit
olduğundan;
h.ν = Ed-Ei
h .ν = (-2,179x10-18) / nd2 – (-2,179x10-18) / ni2
ν = 3,289x1015 x (1/ni2 - 1/nd2)
Bu durum Hidrojen atomunun spektrumunu başarıyla açıkladığı halde birden fazla elektron
içeren atomların spektrumlarını açıklamada yetersiz kalmıştır.
Örnek: Hidrojen spektrumunda n=5’den n=2’ye geçiş sırasındaki spektrum çizgisinin dalga
boyunu hesaplayınız.
DE = (2,179x10-18) (1/ 22 – 1/52)
= 2,179x10-18 (0,25 – 0,04)
= 4,576x10-19 J
DE = h. n
n = E/h = 4,576x10-19 J / 6,626x10-34 Js
n = 6,906x1014 1/s
l = c/n = 3x108 m/s / 6,906x1014 1/s
l = 4,341x 10-7 m = 434,1 nm
19