KİMYASAL BAĞLAR
Kimyasal bağlar, Moleküllerde atomları birarada tutan
kuvvettir.
Atomlar
birleştiği
zaman
elektron
dağılımındaki
değişmelerin bir sonucu olarak kimyasal bağlar meydana
gelir.
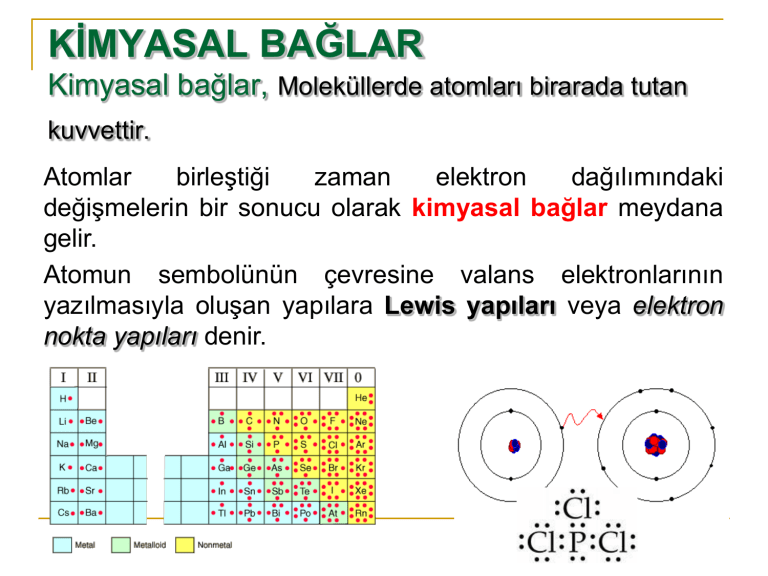
Atomun sembolünün çevresine valans elektronlarının
yazılmasıyla oluşan yapılara Lewis yapıları veya elektron
nokta yapıları denir.
Kimyasal bağlar üçe ayrılır:
Atomların elektropozitif veya elektronegatif karakterli
oluşlarına göre üç farklı cins bağ mümkündür.
1-İyonik bağ (Elektropozitif element + elektronegatif
element)
2-Kovalent bağ (Elektronegatif element + elektronegatif
element)
3-Metalik Bağlar (Elektropozitif element + elektropozitif
element)
İyonik Bağlar
Bu tip bağlar elektronlardan bir veya birkaçının bir atomdan
diğerine tamamen verilmesi ile meydana gelir. İyonik bağlar,
iyonlaşma enerjileri
birbirinden çok farklı olan atomlar
arasında (metal-ametal) olur.
Örneğin, sodyum ve klor atomlarından oluşan sodyum klorür
bileşiğinin bağ yapısı şu şekilde açıklanabilir.
a- İyonik bağlar oluşurken atomlar arasında eşit sayıda
elektron alışverişi olur.
b- Elektron alan veya veren atomlar elektron sayılarını
kendisine en yakın olan soy gaza benzetirler (Oktet kuralı).
Kovalent Bağ
İki aynı veya farklı ametal atomları
arasında bir veya daha fazla elektronun
paylaşılmasıyla oluşan bağa denir.
Bazı
kovalent
bağlarda
ortaklaşa
kullanılan
bağ
elektronlarının her ikisi de bir atoma aittir ve bağ oluşurken
diğer atomun boş orbitali kullanılır. Bu şekilde oluşan bağa
koordine kovalent bağ denir
Elektronegatiflikleri birbirine eşit olan yani aynı cins ametal
atomları (H-H, F-F gibi) arasında oluşan kovalent bağa ise
apolar kovalent bağ denir.
Atomların elektronegativitelerine göre yük yoğunlukları ile
farklı kutuplar oluşturması (Cl- Br+) sonucu oluşan bağa polar
kovalent bağ denir.
Metalik Bağ
Negatif yüklü elektron denizi ile pozitif yüklü metal iyonları
arasında oluşan bağa denir.
İyonlaşma enerjisinin küçük olması demek bir metal
atomundan bu elektronu koparmak kolay demektir.
Karşı karşıya gelen metal atomlarından birinin diğerinden
elektron alması düşünülemez. Çünkü metallerin elektron
ilgileri çok düşük olup, birbirine yakındır.
Birbiriyle kovalent bağ yapmaları ise valans elektronlarının
sayısının yetersiz olmasından dolayı imkansızdır.
Ancak valans orbitalleri sayısı fazladır.
ÖRNEK: 1
Yemek tuzu, Sodyum (Na) ve Klor (Cl) elementlerinden
oluşur.
Metaller devasa yapılardır. Metal atomlarının valans
elektronları yapı boyunca serbestçe hareket ederler.
Bu şekilde iyon katmanı elektron denizi ile
çevrelenmiş olur. İyon ve elektronların sahip olduğu
yükler sayesinde metalik yapı birarada tutulur.
Serbest
elektronlar
sayesinde
metallerin
bükülebilme, elektrik ve ısıyı iletebilme özellikleri
kazandırılmış olur.
Bağların Kuvvetliliği
Bağ
Enerji
Örnek
Kovalent
1000
Elmas
İyonik
30-100
Tuz ve Seramik
Metalik
30-150
Metaller
Hidrojen
8
Buz
Van der Waals
2
Politen
Moleküllerarası Bağlar
Dipol-Dipol Kuvveti
İki polar molekül birbirine yaklaştığı zaman zıt yüklü kutupları
arasında bir çekme kuvveti oluşur ve bu kuvvete dipol-dipol
kuvveti denir.
Bundan dolayı polar moleküllerin erime ve kaynama noktaları
apolar olanlardan daha yüksektir.
Van der Waals Kuvvetleri
Kovalent bağlı apolar moleküller arasında oluşur. London veya
Dağılma Kuvveti de denilen bu bağ türünde apolar bir molekülün
bir bölgesinde tesadüfi olarak elektronlar yoğun bir şekilde
bulunur. Bu durum molekülde geçici bir dipollenme oluşturur.
Sonrasında ise anlık çekim kuvveti meydana gelir. Bu çekim
kuvvetine de Van de Waals kuvveti denir.
Uzun zincirli polimerik yapılarda bulunur. Polimerik yapı esnetildiğinde
bağlar kolayca kırılarak yapının deformasyonuna neden olur.
Hidrojen Bağı
Bu bağ türü daha çok sıvı fazda yapısında hidrojen atomu
bulunduran çok polar moleküller arasında olur. Genellikle 5A, 6A
ve 7A grubundaki ametallerin hidrürleri polardır ve bağ yapmamış
değerlik elektronları içerirler.
Özellikle N, O ve F atomlarının hidrür bileşikleri bulundukları
grupların en polar molekülleridir.
Bu atomlarla bağ oluşturan H, kısmi pozitiflik kazanır. Diğer
molekülün bağ yapmamış elektron çifti tarafından H çekilir. Bu
çekim kuvvetine H Bağı denir.
Su molekülü hidrojen atomlarından dolayı pozitif yüklü olurken
molekülün diğer tarafında elektronlar nedeniyle negatif yüke sahiptir.
Bu dağılımdan dolayı atomlararası bağlar zayıf olup suyun
buharlaşması oldukça kolaylaşır.
HİBRİTLEŞME
Bir atomun son periyodundaki dolu ve yarı dolu
orbitallerin kaynaşarak özdeş yeni orbitaller oluşturması
olayına hibritleşme denir. Yeni oluşan orbitallere hibrit
orbitalleri denir.
Elektronlar merkez atoma en uzakta bulunacak şekilde
yerleşirler.
Hibritleşme yalnız yarı dolmuş orbitallerin değil, dolu ve
yarı dolu bütün değerlik orbitalleri arasında olur. Ancak
merkezi atomun yapabileceği bağ sayısı onun sahip
olabileceği yarı dolu orbital sayısı kadardır.
Hibritleşme, kimyasal bağ sırasında gerçekleşir. Serbest
haldeki atomlarda söz konusu değildir. Hibrit orbitalleri
uzayda belirli şekilde yönlenirler ve bu durum molekülün
geometrik biçimini belirler.
ÖZETLERSEK:
XY türü moleküller:
(1A ile 7A, 2A ile 6A, 3A ile 5A)
Moleküller ve bağlar polardır. Molekül biçimi doğrusaldır.
XY2 türü moleküller:
X: 2A Y: 7A veya hidrojen ise;
Moleküller apolar, bağlar polardır. Molekül biçimi doğrusal,
hibritleşme sp dir.
X: 4A Y: 2A veya 6A ise;
Molekül apolar, bağlar polardır. Molekül biçimi doğrusal,
hibritleşme sp dir
Problem (2-1): Atom numarası 17 olan bir X elementinin birinci
iyonlaşma enerjisi, atom numarası 35 olan Y elementinin birinci
iyonlaşma enerjisinden büyüktür. Bu durum, hangi periyodik
özelliğe dayanmaktadır? Elementlerin elektron düzenlerini
yazarak, periyodik sistemdeki yerlerine göre belirtiniz.
Çözüm :
2
2
6
2
5
17X = 1s /2s 2p /3s 3p
35Y
= 1s2/2s22p6/3s23p6/4s23d104p5
3. periyot, 7A grubu
4. periyot, 7A grubu
Periyodik sistemde aynı grupta yer alan elementlerin iyonlaşma
enerjileri aşağıdan yukarıya doğru artmaktadır.
Dolayısıyla İEx İEy olacaktır.
Problem (2-2): Atom numarası 17 olan X elementi ile atom
numarası 35 olan bir Y elementi için,
a) Elektron düzenlerini yazarak, periyodik sistemdeki
yerlerini belirtiniz ve birinci iyonlaşma enerjilerini mukayese
ediniz.
b) Elementlerin cinsini belirterek, aralarındaki bağ
oluşumunu nokta sistemiyle gösteriniz ve bağın türünü belirtiniz.
Çözüm :
a) 17X = 1s2/2s22p6/3s23p5
2
2
6
2
6
2
10
5
35Y = 1s /2s 2p /3s 3p /4s 3d 4p
3.periyot, 7A grubu
4.periyot, 7A grubu
b) Elementlerin her ikisi de halojen olup ametaldir.
Problem (2-3): Atom numarası 16 olan X elementi ile atom numarası 31
olan bir Y elementi için,
a) Elektron düzenlerini yazarak, periyodik sistemdeki yerlerini
belirtiniz ve birinci iyonlaşma enerjilerini mukayese ediniz.
b) Bu elementler bileşik oluşturur mu? Oluşturursa, bağ
oluşumunu nokta sistemiyle göstererek bağın cinsini belirtiniz.
Çözüm :
a) 16X = 1s2/2s22p6/3s23p4
3. periyot, 6A grubu
2
2
6
2
6
2
10
1
4. periyot, 3A grubu
31Y = 1s /2s 2p /3s 3p 4s 3d 4p
İEy İEx olmaktadır. Çünkü, Y elementi tabloda daha solda ve
aşağıdadır. Periyodik sistemde periyotlarda sola doğru, gruplarda ise
aşağı doğru inildikçe iyonlaşma enerjisi azalır.
b) Elementlerin bileşik oluşturması
şöyle gösterilebilir.
Problem (2-6): Aşağıdaki element atomlarının ne şekilde bağ
oluşturduklarını nokta sistemiyle (Lewis yapıları) göstererek,
bağların cinsini belirtiniz.
a) 12Mg + 9F
7N + 7N
b) 1H + 7N
4Be + 16S
Çözüm: Her bir atomun elektron düzenleri göz önüne alınarak,
değerlik elektronları bulunur. Metal ile ametal arası bağlar
iyonik, ametaller arası bağlar ise kovalenttir.
FORMAL YÜK
Formal Yük: Bir molekülde her bir atomun sahip olduğu net yüke
denir.
Formal Yük = (Grup No) – (Bağ Sayısı) – (Bağ Yapmamış e- Sayısı)
Kapalı Formülü verilen bir molekülün Lewis yapısını çizmede
gözönüne alınan kurallar:
1- En elektropozitif element genellikle merkezi atom olarak alınır.
2- Atomlar, ya formal yükleri sıfır olacak şekilde ya da daha
elektronegatif olanların formal yükleri negatif olacak şekilde
düzenlenirler.
3- Aynı formal yüke sahip olanların bitişik olmamalarına dikkat
edilmeli.
4- Atomların bağ sayısı, verebildikleri maksimum kovalent bağ
sayısından büyük olmamalıdır.
Örnek: SO2 molekülünün Lewis yapısını gösteriniz ve her bir
atomun formal yükünü hesaplayınız.
Çözüm: (a) Moleküldeki her atomun valans kabuğundaki
e- sayısının toplamı hesaplanır. “A” grubundaki
elementlerin grup numaraları valans e-’larının sayısını
verir. Nötr moleküllerde valans e- larının sayısı grup
numaraları toplanarak bulunur. İyonlarda ise iyonun
herbir negatif yükü için 1 e- fazla, herbir pozitif yük için 1
e- eksik sayılır.
S 6 e6A grubu olduğundan valans eO 2x6eları altışar tanedir.
---------------18e-
(b) Hidrojen atomu için 2, diğer atomlar için 8 e- sayılarak her
atomun dış kabuğunu sekize tamamlaması için gerekli esayısı bulunur.
SO2 için 3x8e- = 24e(c) Gerekli e- sayısından Valans e- larının sayısı çıkarılır:
(24e-) – (18e-) = 6e(d) Gerekli e- sayısı ile valans e-ları arasındaki fark ikiye
bölünür. Bu sayı moleküldeki bağ sayısını verir.
Moleküldeki atomlar arasına bağlar önce birer birer sonra
da ikişer ikişer yerleştirilir.
Bağ Sayısı = 6e-/2 = 3
(e) Formal Yüklerin Hesaplanması:
O(1) : 6-1-6 = -1
S : 6-3-2 = +1
O(2) : 6-2-4 = 0
Atomların Formal Yüklerinin Cebirsel Toplamı
Molekülün Net Yüküne Eşit Olmalıdır.
_____________________________________
Örnek: CO3-2 ‘ın Lewis yapısını gösterip herbir atomun
formal Yüklerini hesaplayınız. (4C ; 8O)
Fosfat bileşiğinin olası Lewis yapıları
YARARLANILAN KAYNAKLAR
[1] Petrucci, H.R., Harwood, S.W., Genel Kimya, Çeviri Editörleri; Uyar, T.,
Aksoy, S., Palme Yayıncılık, 1995, Ankara.
[2] Aydın, A.O., Sevinç, V., Şengil, İ. A., Temel Kimya, Aşiyan Yayınları, 2001,
Adapazarı.
[3] Erdik, E., Sarıkaya, Y., Temel Üniversite Kimyası, Gazi Kitapevi, 2009.
[4] Mortimer, C.E., Modern Üniversite Kimyası, Çağlayan Kitabevi, 1.Baskı,
2004.
[5] Alpaydın, S., Şimşek, A., Genel Kimya, 5. Baskı, Nobel Yayın Dağıtım,
2010.
22












