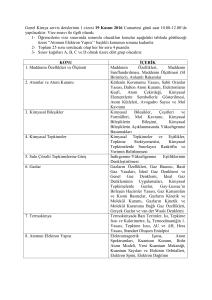
Atomda зeşitli tabakalar bulunduğu gibi,her tabakada da çeşitli alt
enerji düzeyleri veya orbitaller bulunur. Enerji düzeyleri belli sayıda
elektron içerir ve elektronların bu enerji düzeylerinde ne şekilde dizildiklerini ilgili
kuantum sayıları belirli kurallar çerçevesinde tayin eder.Başlıca dört
kuantum sayısı mevcuttur
Baş kuantum sayısı (n) : Atomda bulunan ve belirli enerji değerlerine sahip olabilen çeşitli tabakaları
göstermek için kullanılır. Yan kuantum sayısı ( I ) : Atom etrafındaki her tabaka çeşitli alt enerji düzeylerini
içerirler.Yan kuantum sayıs,herhangi bir tabakada bulunan bir elektronun,hangi enerji düzeyinde
bulunduğunu gösterir.Sıfır ile (n-1) arasında değişen değerler albilir. Magnetik kuantum sayısı(m): Ataomda
her alt enerji düzeyi (veya orbital) bir veya daha fazla orbitalden oluşmuştur. Magnetik kuantum sayısı
herhangi bir alt enerji düzeyindeki elektronun hangi orbitalde bulunduğunu açıklar. Kuantum sayısı (Enerji
düzeyi) . Elektron Dağılımı : Elektronlar çekirdeğin çevresindeki yörüngelerde bulunurlar. Elketronların
bulunma ihtimalinin fazla olduğu yerlere orbital denir.
Orbitaller s,p,d,f… gibi harflerle gösterilirler. Her hangi bir enerji düzeyindeki orbital sayısı n2 dir.(n=enerji
seviyesi olup 1,2,3,4… gibi tam sayılardır). Herhangi bir enerji seviyesinin alabileceği elektron sayısı ise 2n2
ile hesaplanır. Örneğin, 3. Enerji seviyesinde 2.32=18 orbital vardır. Bu enerji seviyesinde 18 elektron
bulunabilir. ELEKTRONLARIN ORBİTALLERE YERLEŞİM SIRASI: Şekilde görüldüğü gibi elektronlar
1s22s22p63s23p64s2 3d10 4p65s2………..sırasına göre orbitallere yerleşmektedir. Hund Kuralı : Elektronlar
orbitallere önce birer birer yerleşir. Boş orbital varken elektron çiftleşemez. Pauli Kuralı : Elektronlar
çekirdeğin çevresinde dönerken aynı zamanda kendi eksenleri etrafında da dönerler. Birisi saat ibresi
yönünde dönerken diğeri onun tersi yönünde döner.(+1/2, -1/2) Örnek : Atom numarası 17 olan X elementin
elektron dağılımını yapınız ? Çözüm : 1s22s22p63s23p5 şeklinde olur. www.teknolojiweb.net
Orbitallerin baş tarafındaki sayılar temel enerji düzeyini (baş kuant sayısını) üstündeki sayılar ise elektron
sayılarını göstermektedir. 17X: 1s2 2s2 2p6 3s2 3p5 Örnek: 10Ne, 18Ar, 36Kr soygaz atomlarının elektron
dizilişlerini yazınız ? 10Ne : 1s2 2s2 2p6 18Ar: 1S2 2S2 2P6 3S2 3P6 36Kr: 1S2 2S2 2P6 3S2 3P6 4s2 3d10
4p6 Uyarılmış Hal : Bir elektronun bulunduğu orbitalden enerji verilerek bir üst enerjili orbitale geçmesiyle
yazılan elektron dağılımına uyarılmış hal denir. Kararlılık ve Değerlik Elektron Sayısı : Soygazların son
yörüngeleri tamamen dolu olup 8 elektron içerirler. Kararlı yapıda olan bu gazlar elektron alış-verişi yada
elektron ortaklığı yapamazlar. Bu sebepten dolayı soygazlar kimyasal tepkime vermezler. Değerlik Elektron
Sayısı : Bir elementin kendinden önceki soygazdan fazla bulundurduğu veya son enerji düzeyindeki elektron
sayısıdır. Örnek : 15X = : 1s2 2s2 2p6 3s2 3p3 Son enerji düzeyinde 3+2=5 e- bulunduğundan değerlik
elektron sayısı 5 dir. Genelde değerlik elektron sayısı 1,2,3 olanlar METAL, 4,5,6,7 olanlar AMETAL 8
olanlarda SOYGAZ özelliği gösterirler. Değerlilik: Bir elementin kararlı yapıya(son yörünge Karizmatik
ulaşabilmesi için alması yada vermesi gereken elektron sayısına değerlilik denir.
Örnek : 17X: : 1s2 2s2 2p6 3s2 3p5 Bu elementin değerlik elektron sayısı 5+2=7 dir. Ya 7 elektron vererek
kendisinden önceki soygaza benzeyecek (+7) yada 1 elektron alarak (-1) son yörüngeyi 8 e tamamlayacaktır.
Bir elementin alabileceği değerliklerin mutlak değerlikleri toplamı 8 dir. Metaller elektron almadıklarından
negatif değerlik almazlar. Örnek : 11Na, 15P, 18Ar elementlerinin değerliklerini ve metal mi, ametal mi
olduğunu belirleyiniz. Çözüm : 11Na : 2 8 1 değerlik elektron sayısı 1 olup metaldir. Değerliliği +1 dir. 15P : 2
8 5 değerlik elektron sayısı 5 olup ametaldir. Değerliliği +5 ile -3 arasındadır. 18Ar: 2 8 8 değerlik elektronu 8
olup soygazdır. Değerliliği yoktur. İyon Kavramı : Elektron alış-verişi yapmış atomlara iyon denir. İyon
,katyonlar ,anyonlar: NH4+, Ca+2, K+1, Al+3 CO3-2, Cl-, SO4-2 Katyon : Pozitif yüklü atom yada atom
gruplarıdır. Katyonların özellikleri : 1. Elektron koparıldığı için elektron sayıları nötr atomlarınınkinden azdır. 2.
Atom çapı nötr atomlarınınkinden küçüktür. www.teknolojiweb.net
(elektron koparıldıkça atom çapı küçülür.) 3. Proton sayıları elektron sayılarından büyüktür. Anyon : Negatif
yüklü atom yada atom gruplarıdır. Anyonların Özellikleri : 1. Elektron aldıkları için nötr atomlarına göre
elektron sayıları fazladır. 2. Atomun çapı nötr atomlarınınkinden büyüktür.(elektron aldıkça atom çapı büyür.)
3. Elektron sayısı proton sayısından büyüktür. Bir atom verdiği elektron sayısı kadar pozitif (+) , aldığı
elektron sayısı kadar negatif (-) değerlik alır. İyonlaşma Enerjisi : Gaz halindeki nötr bir atomdan bir elektronu
koparmak için gerekli olan enerjiye iyonlaşma enerjisi denir. 1. Elektron koparılıyorsa I. İyonlaşma
enerjisi(E1), 2. Elektron koparılıyorsa II. İyonlaşma enerjisi(E2)….adını alır. Bir atomda her zaman E1X>Z
olur. Periyodik tabloda soldan sağa doğru gidildikçe atom çapı azalmakta ve Ei artmaktadır. Yukarıdan
aşağıya inildikçe atom çapı arttığından Ei azalmaktadır. Örnek : X elementinin ilk 4 iyonlaşma enerjileri : E1=
140 E2= 290 E3= 600 E4 = 3200 k.kal/mol olduğuna göre X elementinin değerlik elektron sayısı kaçtır ?
140-290-600-3200 600 den ani bir artışla 3200 kk/mol e çıkmasının sebebi 3200 kk ile soygaz elektron
düzeninden(8 den) elektronun koparıldığını gösterir. Demek ki bu atom 2 8 3 şeklinde olup ilk 3 elektron çok
az bir enerjiyle kopmuştur. Değerlik elektron sayısı 3 dür. Küresel Simetri : Bir atomun elektron dizilişindeki
en son orbital tam dolu yada yarı dolu ise atom küresel simetri özelliği gösterir. Küresel simetri gösteren
atomlarda elektronlar çekirdek tarafından simetrik çekilirler. Simetrik çekilen elektronu koparmak fazla enerji
gerektirir. Bir atomun elektron dizilişi s1,s2, p3,p6, d5.d10, f7, f14 ile bitiyorsa o atom küresel simetri özelliği
gösterir. Örnek : I- 15X II- 13Y III- 25Z atomlarından hangisi yada hangileri küresel simetri gösterir ? Çözüm :
15X: 1s2 2s2 2p6 3s2 3p3 (P3 ile bittiği için küresel simetri) 13Y : 1s2 2s2 2p6 3s2 3p1 (p1 ile bittiği için
küresel simetri değil) 25Z : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (d5 ile bittiği için küresel simetri)