MODERN ATOM TEORİSİ KONU ANLATIMI-2
1913-BOHR ATOM MODELİ
1913 yılında Niels Bohr, hidrojenin ışıma spektrumuna dayanarak ve Planck'ın kuantum kuramını göz önüne
alarak yeni bir atom modeli önermiştir. Hidrojen atomunun kesikli spektrum çizgileri oluşturmasından
hareketle atomdaki elektronların kuantlaşmış enerjilere sahip olabileceğini düşündü. Bohr atom modeline
göre;
1. Elektronlar çekirdekten belirli uzaklıklardaki dairesel yörüngelerde bulunur. Bu yörüngelere enerji
düzeyleri denir ve belirli enerjilere sahiptir. Enerji düzeyleri 1, 2, 3, 4, 5 gibi rakamlarla ya da K, L, M, N, O
gibi harflerle gösterilir.
2. Uyarılmış haldeki elektronlar kararsızdır ve temel hale geçmek ister. Elektronlar temel hale geçerken
enerji kaybederler.
3. Elektronların en düşük enerji düzeyinde bulunduğu duruma temel hal düzeyi adı verilir.
4. Madde ısıtıldığında, sahip olduğu atomlardaki elektronlar daha yüksek enerji düzeyine geçerler. Bu
duruma uyarılmış hal denir.
5. Herhangi bir enerji düzeyinin enerjisi (aynı zamanda elektronun potansiyel enerjisi) En= 2,18.10-18/n2 j
ya da En=313,6/n2 kkal bağıntısıyla hesaplanır.
6. Elektronlar yüksek enerjili düzeyden (Ey) düşük enerjili düzeye (Ed) geçtiğinde, enerji düzeylerinin
enerjileri arasındaki fark kadar enerjiye sahip ışınlar yayılır.
Bohr, hidrojen atomunun enerji düzeyleri arasında elektronun geçişleri neticesinde yayılan ışımaların
frekanslarını hesaplayacak bir formül oluşturmuştur.
Hidrojen atomundaki bir elektronun enerji düzeyleri arasındaki geçişlerde soğurulan veya yayınlanan enerji
her bir enerji düzeyinin sahip olduğu enerji arasındaki fark hesaplanarak bulunabilir.
Ayrıca ΔE = h . ν eşitliğinde, hidrojen için oluşturulan frekans (ν) eşitliği yerine yazılırsa;
denklemi ile yayınlanan veya soğurulan ışının enerjisi
hesaplanabilir.
Enerji Serileri
Hidrojen atomu uyarıldığında, uyarılan elektron daha düşük enerjili düzeylere indiğinde
çeşitli dalga boylarında ışınlar yayar. Bu ışın serileri aşağıdaki gibi özetlenebilir.
Elektron yüksek enerjili katmandan n = 1 katmanına inerse ultraviyole (mor ötesi) ışık şeklinde enerjiler
yayınlanır. Bu ışık serisine Lyman serisi adı verilir. Lyman serisinde diğer serilere göre daha fazla enerji
açığa çıkar.
Elektron yüksek enerjili katmandan n = 2 katmanına inerse yayınlanan ışıklar görünür bölgededir. Bu ışık
serisine Balmer serisi adı verilir. Balmer serisindeki çizgilerin dalga boyları Lyman serisindekilerden daha
uzundur.
Yüksek enerjili katmandan n = 3 katmanına elektron geçişinde kızılötesi (infrared) bölgede dalga
boyuna sahip ışınlar yayınlanır. Bu seri Paschen serisi olarak bilinir. Paschen serisindeki çizgiler, Balmer
serisindeki çizgilere göre daha uzun dalga boyuna sahiptir.
Yüksek enerjili katmandan n = 4 katmanına olan geçişlerde oluşan ışık serisine Brackett serisi, n = 5
katmanına olan geçişlerde oluşan ışık serisine de Pfund serisi adı verilir. n = 4 ve n = 5 katmanlarına
inişlerde yayınlanan ışıklar IR (kızılötesi) bölgededir. Bohr kuramı hidrojenin atom spektrumunu
açıklamakla birlikte, hidrojen benzeri He+ , Li2+ gibi tek elektronlu iyonlar için model oluşturabilmiştir. Bu
iyonlar için çekirdek yükünün etkisi de dikkate alınarak : En = 2.18.10-18 . Z2 / n2 denklemine göre enerji
düzeylerindeki elektronların enerjisi bulunabilir. Bağıntıdaki ''Z'' atom numarasını, ''n'' ise enerji seviyesi
numarasını göstermektedir.
1914- Moseley : Çekirdek yüklü protonlardan kaynaklanır
*Rutherford çekirdekteki proton sayısını yani çekirdek yükünü tayin edememişti.Moseley katot ışınları tüpünde anot olarak farklı elementler
kullandı.Her elementin farklı dalga boyunda x ışını yaydığını gözledi. *Yayılan x ışınlarının atomun çekirek yüküne bağlı olduğunu bununda
protonlardan kaynaklandığını söyledi. *Yapılan çalışmalar sonucu her elementin çekirdek yükünün proton sayısına eşit olduğu görüldü
Moseley yaptığı deneylerde;
Moseley; X-ışınları tayflarına dayanarak, atom numaralarını doğru olarak hesaplamayı başarmıştır.
Moseley; Kimyasal değişmelerde, çekirdek yükünün korunduğunu ispatlamıştır.
Moseley; Elemente kimyasal özelliğini kazandıran taneciğinde çekirdek yükünün olduğunu ispatladı.
Moseley; Çekirdek yüküne, atom numarası dedi.
Moseley; Nötral atomlarda çekirdek yükü, elektron sayısına eşittir.
Moseley; o güne kadar periyodik tabloda eksik olan elementlerin atom numaralarını tespit etmiştir.
PROTON: Moseley, X-ışınları tayflarına dayanarak, atom numaralarını doğru olarak hesaplamayı başarmıştır. Moseleyin deneyi yukarıda açık
biçimde verilmiştir. Moseley, atomun çekirdeğinde bulunan bu + yüklü taneciklere proton adını vermiştir. Atom numarası olarak bilinir.
Çekirdek yükünü belirler.
Atoma kimyasal özelliğini kazandıran taneciklerdir.
Nötr atomlarda proton sayısına eşittir.
Atom numarası(z)=çekirdek yükü=proton sayısıNötr bir atomda proton sayısı=elektron sayısı iyon yükü=proton sayısı-elektron sayısı
X𝑋+2 (2 e vermiştir)
X𝑋+𝑛 +n𝑒− *endotermiktir *elektron başına düşen ortalama çekim kuvveti artar *olay sırasında çekirdeğin çekim gücü değişmez. *tanecik
hacmi azalır.
1924-De Broglie Elektronun ikili doğası
*De Broglie elektron gibi atom altı parçacıkların bazen dalga özelliği taşıdığını ileri sürdü E = h.c/λ E=m. 𝐶2 bu iki eşitlik birleştirildi.
h.c/λ = m. 𝐶2 λ = h/𝑚.𝑉 Vışık hızı
*Bu denklem hareket halindeki bir taneciğin dalga gibi,dalganında tanecik gibi düşünülebileceğini ifade eder.
1
2
MODERN ATOM TEORİSİ KONU ANLATIMI-2
1925-Davison ve GermerElektron kırılımı deseni
*İnce bir nikel levha üzerine elektron demeti gönderdiklerinde X ışınları ile elde edilene benzer iç içe halkalar gördüler. *Böylece elektronların
dalga özelliğine sahip olduğu kanıtlandı.
1925-Pauli Dışlama ilkesi
*1920 li yıllarda plank’ın kuantum yaklaşımlarından bazı çıkarsamalar yapıldı çekirdeğin çevresindeki elektronların orbital denilen bir olasılık
bulutu içerisinde hareket ettiği söylendi. *Paulide bu düşünceleri geliştirerek bir orbitalde birbirine zıt spinli en çok iki elektron bulunabileceğini
söyledi.Pauli ilkesine ilerde tekrar değinilecektir.
1926- Scrhödinger Atom dalga modeliModern atom teorisi
* Scrhödinger geliştirdiği denklemle elektronun tanecik ve dalga davranışını inceledi.Kendinden önceki düşünceleri harmanlayarak atomun
dalga Mekaniğini ortaya attı. *Denklem hidrojen atomundaki elektronun tam yerini belirleyemezken elektronun nerede olduğunu
açıklıyordu.Böylece orbital kavramı gelişti. *Orbital kavramıyla elektronların yerinin belirlendiği denklemle artık atomla ilgili bir çok perde
ortadan kalkmış ve soyut kavramlarlada olsa atom açıklanabilmiştir.İnsanoğlunun kendini zamanla geliştirdiğini zaman içerisinde görmekteyiz.Bu
gelişme hiç durmadan devam edecek ve daha bilinmeyen bir çok şey açıklanmaya devam edecektir.
ORBİTAL KAVRAMI n,l ve 𝑚𝑙 kuantum sayıları hidrojen atomu için Scrhödinger denkleminin çözümünden ortaya çıkmıştır.Bir elektronun dalga
fonksiyonu bir orbitali tanımlar. Shrödinger elektronların yerlerini tesbit edebiliyor , elektronların yoğun olarak bulundukları bölgelere orbital
dedi.Yani elektronun bulunma olasılığının yüksek olduğu yerlere orbital denir.Ve bu orbitallar bildiğiniz gibi yörüngelerde bulunur.s,p,d,f gibi
orbital çeşitleri vardır. Bu bulunma olasılığı shrödinger denkleminde ψ2 olarak simgelendirilmiştir.
1927- Heisenberg belirsizlik ilkesi
* Scrhödinger dalga mekaniğinden yararlanarak belirsizlik ilkesini önerdi.
*Bir elektronun konumu belirlenirse hızının,Hızının belirlenirse konumunun belirlenemeyeceğini söyledi.
*Konumu için verilen enerji elektronun hızını,hızını belirlemek için verilen enerji konumunu değiştirecek ve bir
belirsizlik doğacaktı.
1932- James Chadwich Nötronların keşfi
*İnce berilyum levha üzerine α ışınları gönderildi. Berilyum metalinin çok yüksek enerjili elektirik yükü taşımayan ve kütlesi protonun kütlesinden
biraz daha büyük olan ışınlar yaydığını gördü. Bunlara nötron adı verdi. Kütle Numarası(a)=Proton sayısı +Nötron sayısı
şimdi bizi ilgilendiren atomla ilgili bazı kuantum ifadelerini inceleyelim.
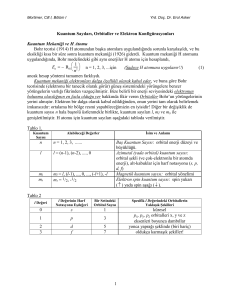
Kuantum Sayıları
Kuantum sayıları, atomdaki her bir elektronun hangi enerji düzeyinde bulunduğunu
belirlemek için kullanılan sayılardır. Bunlar,
Baş kuantum sayısı (n)
Açısal momentum (ikincil) kuantum sayısı (l )
Manyetik kuantum sayısı (ml ) dır. Bu üç kuantum sayısı elektronların bulunma olasılığının en yüksek olduğu
yerlerin ve bu yerlerdeki elektronların belirlenmesinde kullanılırken diğer bir kuantum sayısı,
Spin kuantum sayısı (ms) ise elektronun davranışını belirlemede kullanılır.
Baş Kuantum Sayısı (n)
Orbitalin çekirdeğe olan uzaklığını belirtir. n ile sembolize edilen bu sayı elektronun ait olduğu katman veya enerji düzeyini gösterir. n pozitif bir
tamsayıdır. Enerji katmanları baş kuantum sayıları ile belirtildiği gibi harflerle de gösterilir.
Açısal Momentum (İkincil) Kuantum Sayısı (l )
Elektron bulutlarının şekillerini ve bu şekil farkı ile oluşan
enerji seviyelerindeki değişimleri belirtir. l ile gösterilir ve 0
ile n–1 arasındaki tam sayılar kadar değer alabilir.
l 'nin her bir sayısal değerine karşılık s, p, d, f gibi harfler
gösterilir.
l = 0, 1, 2 ..... (n – 1)
n= 1 ise l = 0'dır.
n= 2 ise l = 0 ve l = 1'dir.
n= 3 ise l = 0 , l = 1 ve l = 2'dir.
n= 4 ise l = 0 , l = 1, l = 2 ve l = 3'tür.
l sayısı
0
1
2
3
4
Manyetik Kuantum Sayısı (ml )
Orbitalin uzaydaki yönlenmesini gösterir. (2l + 1) kadar farklı değer alır ve alt tabakadaki orbital sayısı
belirlenir. ml 'nin alabileceği değerler –l 'den +l 'ye kadardır.
ml = –l .......... 0 ........ + l
l=0
için
ml = 0 olur.
l=1
için
ml = –1, 0, +1 olur.
l=2
için
ml = –2, –1, 0, +1, +2 olur.
l=3
için
ml = –3, –2, –1, 0, +1, +2, +3 olur.
Verilen l değeri için kaç tane ml değeri olduğu ml = 2l + 1 eşitliği ile belirlenir.
Spin Kuantum Sayısı (ms)
Bir orbitaldeki elektronların kendi eksenleri etrafında dönme yönünü belirtir. Dönme hareketi birbirine zıt iki
yönde olur. Bu nedenle spin kuantum sayısı ms + ½ veya - ½ değerlerini alabilir. Spin kuantum sayısı, her
orbitalde ancak iki elektronun bulunabileceğini gösterir.
Orbital ismi
s
p
d
f
g
3
MODERN ATOM TEORİSİ KONU ANLATIMI-2
Baş
Kuantum
Sayısı
n=1
Katman
Momentum
kuantum
K
l=n-1
l=0
n=2
L
l=n-1
l=n-1
l=n-1
Magnedik
kuantum cinsi
Orbital
ismi
Orbital
sayısı
𝑚𝑙=2l +1
Magnetik
kuantum
sayısı
ml=1
Orbitalin
gösterimi
Orbital cinsi
0
1s
1
1s
l=1
𝑚𝑙=2l +1
𝑚𝑙=3
-1,0,+1
2p
3
2𝑝𝑥,2𝑝𝑦,2𝑝𝑧
l=0
𝑚𝑙=2l +1
𝑚𝑙=1
0
2s
1
2s
l=2
𝑚𝑙=2l +1
𝑚𝑙=5
-2,-1,0,+1,+2
3d
5
l=1
𝑚𝑙=2l +1
𝑚𝑙=3
-1,0,+1
3p
3
3𝑑𝑥𝑦, 3𝑑𝑥𝑧, 3𝑑𝑦𝑧,
3𝑑𝑥2−𝑦2, 3𝑑𝑧2
3𝑝𝑥,3𝑝𝑦,3𝑝𝑧
l=0
𝑚𝑙=2l +1
𝑚𝑙=1
0
3s
1
3s
l=3
𝑚𝑙=2l +1
𝑚𝑙=7
-3,-2,-1
,0,+1,+2,+3
5f
7
l=2
𝑚𝑙=2l +1
𝑚𝑙=5
-2,-1,0,+1,+2
5d
5
l=1
𝑚𝑙=2l +1
𝑚𝑙=3
-1,0,+1
5p
3
4𝑓𝑦3−3𝑦𝑥2, 4𝑓𝑦𝑧2−𝑦𝑟2,
4𝑓𝑥𝑧2−3𝑥𝑟2, 4𝑓𝑥3−3𝑥𝑦2,
4𝑓𝑦𝑧2−𝑦𝑟2, 4𝑓𝑧𝑥2−𝑧𝑦2,
4𝑓𝑧3−3𝑧𝑟2 , 4𝑓 𝑥𝑦𝑧,
5𝑑𝑥𝑦, 5𝑑𝑥𝑧, 5𝑑𝑦𝑧,
5𝑑𝑥2−𝑦2, 5𝑑𝑧2
5p𝑥 ,5 𝑝𝑦 ,5 𝑝𝑧
l=0
𝑚𝑙=2l +1
𝑚𝑙=1
0
5s
1
5s