ygs ba*arı durumu - files.eba.gov.tr
advertisement

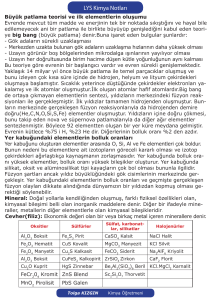
s, p, d Elementleri Hidrojen 1A Grubu: Alkali metaller 2A Grubu: Toprak Alkali Metaller 3A Grubu: Toprak Metalleri 4A Grubu 5A Grubu 6A Grubu: Kalkojenler 7A Grubu: Halojenler B Grubu: Geçiş Metalleri f Elementleri Lantanitler ve Aktinitler Asal Gazlar 8A Grubu ELEMENTLERİ TANIYALIM Hidrojen (1𝒔𝟏 ) Hidrojen için periyodik tabloda tamamıyla uygun bir yer yoktur. Geleneksel olarak 1A grubunda bulunur. Alkali Metaller gibi s orbitalinde tek bir elektron vardır. Bileşiklerinde (+1) ve (-1) değerlik alabilir. İyonik hidritler suyla reaksiyona girerek hidrojen gazı ve metal hidroksit oluştururlar. 2NaOH (k) + 2H2O (s) → 2NaOH (suda) + H2 (g) Hidrojenin en önemli bileşiği sudur. 2H2 (g) + O2 (g) → 2H2O (s) ELEMENTLERİ TANIYALIM 1A Grubu Elementleri ( ns1 , n ≥ 2 ) 1A grubu elementlerine alkali metaller de denir. Li Na Bileşiklerinde (+1) değerlik alırlar. s orbitalinde tek bir elektronu vardır. Çok aktif olduklarından suyla reaksiyona girerek hidrojen gazı ve metal hidroksitleri K oluştururlar. Rb 2M (k) + 2H2O (s) → 2MOH (suda) + H2 (g) (M: Alkali Metal) Cs Havayla etkileştiklerinde, oksijenle birleşerek oksitleri oluştururlar. Fr 4Li (k) + O2 (g) → 2Li2O (k) ELEMENTLERİ TANIYALIM 1A Grubu Elementleri ( ns1 , n ≥ 2 ) Li Na Diğer alkali metallerin hepsi oksitler ve peroksitler (O2-2 iyonu içeren) oluştururlar K 2Na (k) + O2 (s) → 2Na2O2 (k) Rb Potasyum, rubidyum ve sezyum, süperoksitler (O2- iyonu içeren) de oluştururlar. Cs Fr K (k) + O2 (g) → KO2 (k) Alkali metallerin oksitleri bazik özellik gösterirler. ELEMENTLERİ TANIYALIM 2A Grubu Elementleri ( ns2 , n ≥ 2 ) Be Mg Ca Toprak alkali metaller olarak ta adlandırılırlar. Alkali metallerden daha az reaktiftirler. Bileşiklerinde (+2) değerlik alırlar. Metalik karakterleri yukarıdan aşağıya doğru inildikçe artar. Pek çok berilyum bileşiği (BeH2, BeCl2, gibi berilyum halidler) ve bazı magnezyum Sr Ba Ra bileşikleri (MgH2 gibi) iyoniklikten çok moleküller bileşiklerdir. Be ve Mg yüksek sıcaklıkta oksijenle oksit (BeO, MgO) oluştururken, Ca, Sr ve Ba oda sıcaklığında oksit oluşturabilirler. 2Mg (k) + O2 → 2MgO ELEMENTLERİ TANIYALIM 2A Grubu Elementleri ( ns2 , n ≥ 2 ) Be Oksitleri, BeO amfoter diğer oksitler ise bazik özellik gösterirler. Be su ile reaksiyona girmezken, Mg su buharıyla çok yavaş bir tepkime vermektedir, Ca, Sr, ve Ba ise soğuk su ile tepkime vererek H2 açığa çıkarırlar. Mg Ba (k) + 2H2O (s) → Ba(OH)2 (suda) + H2 (g) Ca Sr Ba Ra Mg sulu çözeltilerde asitlerle reaksiyona girer ve hidrojen gazı açığa çıkar. Mg (k) + 2H+ (suda) → Mg2+ (suda) + H2 (g) Ca, Sr ve Ba da sulu asit çözeltilerinde tepkimeye girerek hidrojen gazı oluştururlar. Fakat, bu metaller suyla da reaksiyona girdiklerinden iki farklı reaksiyon aynı anda olur. ELEMENTLERİ TANIYALIM 3A Grubu Elementleri ( ns2np1, n ≥ 2 ) B Al Ga Grubun ilk üyesi olan bor (B) yarı-metal özellik gösterir ve ikili iyonik bileşik oluşturmaz. Suya ve oksijene karşı reaktif değildir. Diğer üyeleri ise metaldir. Al havayla temas ettiğinde alüminyum oksit oluşturur. 4Al (k) + 3O2 (g) → 2Al2O3 (k) Üzeri koruyucu alüminyum oksitle kaplanmış alüminyum, alüminyum elementinden daha az In Tl reaktiftir. Alüminyum sadece (+3) yüklü iyon oluşturur. Amfoter özellik gösterir. Asitler ve bazlarla tepkime vererek H2 gazı açığa çıkarırlar. 2Al (k) + 6HCl → AlCl3 + 3H2 (g) ………………..Asit 2Al (k) + 6NaOH → Na3AlO3 + 3H2 (g) ………………..Baz ELEMENTLERİ TANIYALIM 3A Grubu Elementleri ( ns2np1, n ≥ 2 ) Diğer 3A grubu metalleri hem (+1) ve hem de (+3) yüklü iyonlar oluştururlar. B Al Gruptan aşağıya doğru inildikçe (+1) yüklü iyonların (+3) yüklü iyonlardan daha kararlıdırlar. Gruptaki metaller pek çok moleküler bileşik de oluştururlar. Al’in hidrojenle Ga In Tl bileşiği AlH3 gibi. Periyodik tabloda soldan sağa doğru gidildikçe metalik karakterden ametalik karaktere doğru bir kayma olur. ELEMENTLERİ TANIYALIM 4A Grubu Elementleri ( ns2np2, n ≥ 2 ) C Si Grubun ilk üyesi karbon ( C) ametaldir. Karbonun grafit ve elmas olmak üzere iki allotropu vardır. Silisyum ve germanyum yarı – metaldirler ve iyonik bileşik oluşturmazlar. Bu grubun metal üyeleri Sn ve Pb amfoter özellik gösterirler, asit ve bazlarla tepkimeye Ge girerek hidrojen gazı açığa çıkarırlar. Sn (k) + HCl (suda) → SnCl2 (suda) + H2 (g) Sn Pb Sn (k) + NaOH (suda) → Na2SnO2 + H2 (g) 4A grubu elementleri, bileşiklerinde +2 ve +4 değerlik alabilirler. Karbon ve silisyum için +4 değerlik daha kararlıdır. Örneğin: CO2, CO den daha kararlıdır. SiO2 kararlı bir bileşiktir fakat SiO normal koşullarda mevcut değildir. Kalay (Sn) bileşiklerinde +4 değerlik, +2 değerlikten biraz daha fazla kararlıdır. Kurşun (Pb) bileşiklerinde +2 değerlik tartışmasız daha kararlıdır. ELEMENTLERİ TANIYALIM 5A Grubu Elementleri ( ns2np3, n ≥ 2 ) 5A grubu elementlerinden azot ve fosfor ametal, arsenik ve antimon yarı-metal bizmut ise metaldir. Azot elementi iki atomlu bir gazdır (N2). Çeşitli oksitler oluşturur. (NO, N2O, NO2, N2O4 ve N P As N2O5). Bunlar arasında sadece N2O5 katı diğerleri gazdır. Fosfor molekülü P4 halindedir. En önemli iki oksidi P4O6 ve P4O10 dur. Fosforun en önemli allotropları beyaz fosfor (P4) ve polimer yapısında olan kırmızı fosfordur Sb (P4)n . Kırmızı fosfor, beyaz fosfordan daha kararlıdır. nP4 (beyaz fosfor) → (P4)n (kırmızı fosfor) Bi Arsenik antimon ve bizmutun geniş, üç boyutlu yapıları vardır. Bizmut, kendinden önceki gruplardaki metallerden çok daha az reaktif bir metaldir. ELEMENTLERİ TANIYALIM 6A Grubu Elementleri ( ns2np4, n ≥ 2 ) O S Grubun ilk üç elementi (oksijen kükürt ve selenyum) ametaldir. Son ikisi ise (tellür ve polonyum) yarı-metaldir. Oksijen diatomik (O2) bir moleküldür. Oksijenin iki allotropu (O2 ve O3) bulunmasına karşın oksijen molekülünden söz edildiğinde O2 kastedilir. Ozon O3, O2 den daha kararsızdır. Se Te Po Ozon Oksijen üç çeşit oksit oluşturur; Oksit O-2, peroksit O2-2 ve süperoksit O2- ELEMENTLERİ TANIYALIM 6A Grubu Elementleri ( ns2np4, n ≥ 2 ) O Elementel kükürdün ve selenyumun molekül formülleri sırasıyla S8 ve Se8 dir. Kükürtün çeşitli allotropları vardır. Bunlar; Rombik kükürt (S8) ve monoklinik kükürt (S8) rombik kükürt termodinamik açıdan daha kararlıdır. S Se Te Po Kükürtün önemli bileşikleri SO2, SO3 ve H2S dir. Kükürt trioksit suyla reaksiyona girdiğinde sülfirik asit meydana gelir SO3 (g) + H2O (s) → H2SO4 (suda) ELEMENTLERİ TANIYALIM 7A Grubu Elementleri ( ns2np5, n ≥ 2 ) F Cl Br Halojenlerin hepsi genel formülleri X2 olan ametaldir. Burada X, bir halojeni temsil eder. Çok reaktif olduklarından doğada diatomik halde bulunurlar. Flor çok reaktiftir ve suyla birleşerek oksijen meydana getirir. 2F2 (g) + 2H2O (s) → 4HF (g) + O2 (g) Bileşiklerinde (-1 ve +7 ye kadar) değerlik alabilirler. Flor ise sadece (-1) değerlik alır. Oda koşullarında; flor ve klor gaz, brom sıvı ve astantin ise katı halde bulur. I At Halojenler kendi aralarında (ICl ve BrF3) veya başka gruplardaki ametallerle (NF3, PCl5 ve SF6 gibi) birçok molekülere bileşikler oluştururlar. Hidrojenle reaksiyona girerek hidrojen hallürleri meydana getirirler; H2 (g) + X2 (g) → 2HX (g) Hidrojen hallürler suda çözünerek hidrohalik asitleri oluştururlar. (HF, HCl ve HBr) ELEMENTLERİ TANIYALIM 8A Grubu Elementleri ( ns2np6, n ≥ 2 ) He Ne Bütün asal gazlar tek atomludur. İyonlaşma enerjileri bütün elementler içinde en yüksek olanlardır. Bileşik oluşturmaya yatkın değiller. Son zamanlarda ve Kr‘nun bazı bileşikleri sentezlenmiştir. (XeF6, XeO3, KrF2) Ar Kr Xe (g) + PtF6 (g) → XePtF6 (k) Asal gaz içeren bileşiklerin hiçbir ticari uygulaması yoktur ve doğada olan biyolojik olaylarda yer almazlar. Xe Rn Helyumun, neonun ve argonun bilinen hiçbir bileşiği yoktur. ELEMENTLERİ TANIYALIM B Grubu Elementleri ( ns (n-1)d, n ≥ 4 ) Sc Ti v Cr Mn Fe Co Ni Cu Zn Y Zr Nb Mo Tc Ru Rh Pd Ag Cd La Hf Ta W Re Os Ir Pt Au Hg Ac Rf Db Sg Bh Hs Mt Ds Periyodik sistemde s ve p bloklarının arasında bulunurlar. Bu elementlere geçiş elementleri denir. Tamamı metal olduğu için ayrıca geçiş metalleri olarak da bilinirler. Atom numarası 21 olan skandiyum (Sc) elementi d blokunun ilk elementi olarak önemlidir. Bu elementler bileşiklerinde (+1) ile (+7) arasında çok farklı değerlikler alabilmektedir. Geçiş metalleri saf hâlde kendi aralarında metalik bağ oluştururken ametallerle yaptıkları bileşiklerinde iyonik bağ oluştururlar. ELEMENTLERİ TANIYALIM Lantanitler ve Aktinitler( ns (n-1)d, n ≥ 5 ) Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Temel hâl elektron dizilimleri yazıldığında son orbitali f olan elementler f bloku elementleridir. Tamamı metaldir ve iç geçiş metalleri de denir. 6. periyotta lantan (La) elementinden sonra gelen 14 element (atom numarası 58’den başlayıp 71’i de kapsayan) lantanitler (nadir toprak metalleri) adını alır. 7. periyotta aktinyum (Ac) elementinden sonra gelen 14 element de (atom numarası 90’dan başlayıp 103’ü de kapsayan) aktinitler adını alır. ELEMENTLERİ TANIYALIM Lantanitler ve Aktinitler( ns (n-2)f, n ≥ 5 ) Lantan (La) elementinde 6s orbitali dolduktan sonra yeni elektronun 4f orbitaline yerleşmesi gerekir. Ancak 5d ve 4f orbitallerinin enerjileri birbirine çok yakındır. Lantanın 4f orbitalinin enerjisi 5d orbitalinden biraz daha yüksektir. Bu yüzden lantanın elektron dağılımı [Xe] 6s2 4f1 yerine [Xe] 6s2 5d1 yapısındadır. Godalinyum (Gd) elementinin elektron dağılımının [Xe] 6s2 4f8 yerine [Xe] 6s2 4f7 5d1 şeklindedir. Bunun sebebi yarı dolu orbitallere sahip küresel simetrik 4f7 orbitallerinin fazladan kararlılık sağlamasıdır. Kaynakça: CHANG, Raymond, Fen ve Mühendislik Bölümleri için Kimya, Beta Yayınları, İstanbul 2000 BADUR, Hilmi, Kimya 11Sınıf Ders Kitabı, Evrensel İletişim Yayınları, Ankara 2015