kimyali.wordpress.com
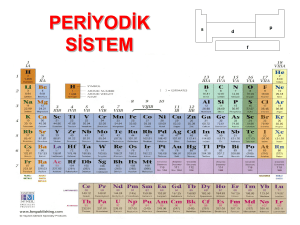
ELEMENTLERİN ÖZELLİKLERİ
8A
1A
1P
1s 2A
3A 4A 5A 6A 7A 1s
2P
2s
3P
4P
3s
d bloku
3p
4s
3d
4p
5P
5s
4d
5p
6P
6s
7P
7s
5d
6d
2p
6p
P bloku
S bloku
4f
5f
f bloku
BLOKLAR VE ÖZELLİKLER
1. s BLOĞU: 1A ve 2A grubu elementleridir.
a) 1A Grubu(Alkali Metaller)
Alkali Metaller: H, Li, Na, K, Rb, Cs ve Fr
Periyodik cetvelin birinci grubunda bulunan; Lityum, Sodyum, Potasyum, Rubidyum, Sezyum
ve Fransiyum elementleridir.
Bu grup elementlerinin hidroksitleri kuvvetli baz özelliği gösterdiğinden, bazik anlamın gelen
alkali metaller adıyla bilinirler.
Alkali metaller, en dış s orbitallerinde 1 elektron taşırlar. Bu nedenle kimyasal tepkimelere karşı
girme istekleri yüksektir.
Genel Özellikleri:
1. 1A grubu elementlerinin sem bolleri; H, Li, Na, K, Rb, Cs ve Fr şeklindedir.
2. Alkali metallerin erime ve kaynama noktaları düşük olup, grupta aşağıya doğru inildikçe
erime ve kaynama noktaları daha da düşer. Sezyumun erime noktası o kadar düşüktür ki, sıcak
günlerde sıvı halde bulunabilir.
3. Bıçakla kesilebilecek kadar yumuşaktır. İlk kesildiklerinde yüzeyleri gümüş parlaklığındadır.
4. Diğer metallerin aksine, yoğunlukları ve erime noktaları oldukça düşüktür. Lityum, sodyum ve
potasyum yoğunlukları ilginç bir şekilde sudan daha küçüktür.
5. Atom çapları aynı periyotta bulunan diğer elementlerden daha büyüktür.
6. Elektrik akımını ve ısıyı iletirler.
7. Dış orbitaldeki tek elektronu kolaylıkla verip elektron sistemlerini asal gazlara benzeterek +1
değerlikli iyon (katyon) halinde bileşikler oluştururlar.
8. Alkali metal atomlarında elektronlar, çekirdekten uzakta olduklarından koparılmaları kolay,
iyonlaşma enerjileri düşük ve dolayısıyla en kuvvetli elektropozitif elementlerdir.
9. Işıklandırıldıklarında elektron yayabilirler. Bu sebepten potasyum ve sezyum foto-elektrik
hücrelerde kullanılırlar.
10. Tabiatta en bol bulunanları sodyum ve potasyumdur. Yer kabuğunda bulunan elementler
içinde altıncı ve yedinci sırayı alırlar. Lityum daha az bulunmasına rağmen, hemen hemen bütün
kayalarda az miktarda rastlanır. Rubidyum ve sezyum çok az bulunur. Radyoaktif bir element
olan fransiyum tabiatta hiç bulunmaz. Ancak nükleer reaksiyonlarla eser miktarlarda oluşabilir.
11. Alkali metaller tabiatta serbest halde bulunmazlar ancak bileşikleri halinde bulunurlar.
12. Alkali metaller, genellikle, eritilmiş tuzların elektroliziyle elde edilirler.
13. Alkali metaller, aleve tutulduklarında çeşitli renkler oluştururlar; Li, Na ve K tuzu çözeltisine
batırılmış bir platin tel, alevi sırasıyla; kırmızı, sarı ve menekşe renge boyar.
14. Alkali metaller su ile reaksiyona girip, hidrojen gazı verirler. Alkali metallerin su ile
etkileşimi oldukça şiddetlidir. Reaksiyonun şiddeti yukarıdan aşağı inildikçe artar.
kimyali.wordpress.com
b) 2A Grubu(Toprak Alkali Metaller)
Toprak Alkali Metaller: Be, Mg, Ca, Sr, Ba, Ra
Periyodik cetvelin ikinci grubunda bulunan; Berilyum, Magnezyum, Kalsiyum, Stransiyum,
Baryum, Radyum elementleridir.
Genellikle beyaz yapıya sahip yumuşak ve işlene bilir maddelerdir.
Toprak alkali metaller, en dış s orbitallerinde 2 elektron taşırlar. Bu nedenle kimyasal
tepkimelere karşı girme istekleri yüksektir ancak 1A grubuna göre daha düşüktür.
Genel Özellikleri:
1. 2A grubu elementleri; Be, Mg, Ca, Sr, Ba, Ra şeklindedir.
2.Toprak alkali metallerin erime ve kaynama noktaları yüksek olup, grupta aşağıya doğru
inildikçe erime ve kaynama noktaları genellikle azalır.
3. 3. Toprak alkali metaller bıçakla kesilebilecek kadar yumuşaktır.
4. İlk kesildiklerinde yüzeyleri gümüş parlaklığındadır. Hızlı oksitlendiklerinden zamanla
metalik renklerini kaybederler.
5. Berilyum yerkabuğunda çok nadir bulunur.
6. Berilyum özellikle bilgisayar parçaları ve uzay teknolojisinde kullanılır.
7. Özellikle Magnezyum alaşımların yapısında kullanılır.
8. Kalsiyum dünyada en bol bulunan 5. Elementtir.
9. Yoğunlukları ve erime noktaları 1 A grubu elementlerine göre yüksek, diğer metallere göre
genelde düşüktür.
10. Atom çapları aynı periyottaki 1A grubu elementlerine göre daha küçüktür.
11. Elektrik akımını ve ısıyı iletirler.
12. Dış orbitaldeki 2 elektrondan dolayı kısmen de olsa kararlı maddelerdir. Bu sebeple
iyonlaşma enerjileri 3A grubu elementlerinden daha yüksektir.
13. Kimyasal tepkimelerinde yapılarını asal gazlara benzeterek +2 değerlikli iyon (katyon)
halinde bileşikler oluştururlar.
14. 2A grubu elementleri tabiatta bileşikleri halinde bulunurlar. Genellikle bileşiklerinde elde
edilirler.
15. Ca, Sr, Ba elementleri Be’ göre çok aktiftirler.
16. Gene Ca, Sr, Ba tuzları alev denemesinde iyi sonuç verirler. Ca tuzları portakal sarısı, Sr
tuzlarının kırmızı, Ba tuzları alev rengi ise sarı, yeşildir.
2. p BLOKU ELEMENTLERİ: 3A,4A,5A,6A,7A,8A grubu elementleri.
a)Toprak Metalleri (3A): B,Al,Ga,In,Tl
Periyodik tablonun 13.grubunda bulunan elementlere denir.
Bu grup elementleri 3A grubu elementleri ya da Toprak Metalleri diye bilinirler.
Genel Özellikleri:
1. 3A grubu elementleri; B,Al,Ga,In,Tl şeklindedir.
2.Toprak metallerin erime ve kaynama noktaları yüksek olup, grupta aşağıya doğru inildikçe
erime ve kaynama noktaları genellikle artar.
3. Toprak metallerinin, en önemlileri B ve Al dur.
4. Değerlik elektron sayıları 3 olduğu için, +3 yükseltgenme basamağına sahiptir.
5. Bor , tabiatta boraks ve borik asitler şeklinde bulunurlar.
6. Bor, füze yakıtı olarak ve ısıya dayanıklı cam yapımında kullanırlar.
7. Alüminyum, yer kabuğunda en bol bulunan maddedir.
8.Alüminyum, sanayide aklımıza gelen her yerde kullanma alanına sahiptir.
b) 4A Grubu Elementleri: C,Si,Ge,Sn,Pb
Periyodik tablonun 14.grubunda bulunan elementlere denir.
Bu grup elementleri 4A grubu elementleri ya da Karbon Grubu elementleri diye bilinirler.
Genel Özellikleri:
1. 4A grubu elementleri; C,Si,Ge,Sn,Pb şeklindedir.
2. 4A grubu elementlerinin değerlik elektron sayısı 4 olduğundan, yükseltgenme basamağı +4 tür.
3. Silisyum yarı metaller grubunda incelenir.
4. Doğada ikinci bol bulunan elementtir.
kimyali.wordpress.com
5. Karbon elementi, en önemli grup elementidir.
6. Karbon elementi, organik kimyanın temelini oluşturur.
7. Karbon elementi, doğada elmas ve grafit izotopları şeklinde bulunurlar.
c) 5A Grubu Elementleri: N,P,As,Sb,Bi
Periyodik tablonun 15.grubunda bulunan elementlere denir.
Bu grup elementleri 5A grubu elementleri ya da Azot Grubu elementleri diye bilinirler.
Genel Özellikleri:
1. 5A grubu elementleri; N,P,As,Sb,Bi şeklindedir.
2. 5A grubu elementlerinin değerlik elektron sayıları 5 tir. Dolayısıyla son yörüngesindeki elektron
sayılarını 8’e tamamlamak için en kısa yol 3 elektron almaktır. Bu sebeple metallerle
tepkimelerindeki -3 yükseltgenme basamağına sahiptir. Ancak Ametallerle tepkimelerinde -3
ten +5 e kadar değişik yükseltgenme basamaklarına sahip olabilirler.
3. En önemli üyesi N ve P dur.
4. Havanın % 78 ini azot gazı oluşturmaktadır.
5. Azot canlıların yaşamında önemli bir elementtir.
6. Fosfor elementinin, beyaz,siyah ve kırmızı olmak üzere 3 allotropu vardır.
7. Gübre, detarjan ve patlayıcı maddelerin yapımında kullanılan önemli bir maddedir.
d) 6A Grubu Elementleri: O,S,Se,Te,Po
Periyodik tablonun 16.grubunda bulunan elementlere denir.
Bu grup elementleri 6A grubu elementleri ya da Oksijen Grubu elementleri diye bilinirler.
Genel Özellikleri:
1. 6A grubu elementleri; O,S,Se,Te,Po şeklindedir.
2. 6A grubu elementlerinin değerlik elektron sayıları 6 tir. Dolayısıyla son yörüngesindeki
elektron sayılarını 8’e tamamlamak için en kısa yol 2 elektron almaktır. Bu sebeple metallerle
tepkimelerindeki -2 yükseltgenme basamağına sahiptir. Ancak Ametallerle tepkimelerinde -2
den +6 ye kadar değişik yükseltgenme basamaklarına sahip olabilirler.
3. En önemli üyesi O ve S tür.
4. Havanın % 21 ini Oksijen gazı oluşturmaktadır.
5. Oksijen, canlıların yaşamında önemli bir elementtir.
6. Kükürt elementi, sanayide ağartıcı olarak kullanılır. Ayrıca gübre, boyaların, patlayıcıların,
sülfirik asitin eldesinde kullanılır.
e) 7A Grubu Halojenler: F, Cl, Br, I, At
Periyodik tablonun 7A grubunda bulunan elementlere denir.
Bu elementler Flor, Klor, Brom, İyot ve Astetin’dir. Sembolleri: F, Cl, Br, I ve At şeklinde dir.
Halojenler, Latincede “tuz yapan” anlamına gelir.
Genel Özellikleri:
1. Halojenlerin hepsi ametaldir.
2. Oda şartlarında F2 ve Cl2 gaz, Br sıvı, I katı halde bulunur.
3. Bu gruptaki elementlerin hepsi elektronegatiftir.
4. Elektron alma eğilimi (elektron ilgileri) en yüksek olan elementlerdir.
5. Değerlik elektron sayıları 7 olduğundan -1 yükseltgenme basamağına sahiptirler. Ancak
değişik bileşiklerinde farklı yükseltgenma basamakalrına sahip olurlar.
6. Doğada serbest olarak değil, mineraller halinde bulunurlar.
7. Element halinde 2 atomlu moleküllerden (X2) oluşurlar. (F2, Cl2,Br2,I2,At2)
8. Erime ve kaynama noktaları grupta aşağıdan yukarıya doğru azalır.
9. Zehirli ve tehlikeli elementler olarak bilinirler.
10. En önemli üyeleri Flor ve Klordur.
11. Astatin radyo aktiftir ve doğada çok az miktarda bulunurlar.
f) 8A Grubu Soygazlar: He,Ne,Ar,Kr,Xe,Rn
Periyodik tabloda 8A grubu elementlerine soy gazlar denir.
Bu elementler; Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn)
gazlardır.
Havada çok nadir bulundukları için “nadir gazlar” denilmiştir.
Kimyasal tepkimelere karşı girme istekleri olmadıkları için de “asal gazlar” diye
isimlendirilmişlerdir.
kimyali.wordpress.com
Bazı Özellikleri;
1. Doğada element halinde bulunur.
2. Normal koşullarda gaz halinde bulunur.
3. Erime va kaynama noktaları son derece düşüktür.
4. He radyoaktif ışımalar sonunda oluşur.
5. He’ un donma sıcaklığı (-272 0C dir) soygazların en düşüğüdür. Bu sebeple dondurucu gaz
olarak bilinirler.
6. Metallerle, ametallerle ve birbirleriyle bileşik oluşturmaz.
7. Kararlı bir yapıya sahiptir.
8. Ancak özel şartlarda bazı soygazların bileşikleri sentez edilmiştir. ( XeF6, XeF2, XeO3, XeOF4,
XeOF2, KrF4 bileşikleri gibi.)
2. d BLOĞU ELEMENTLERİ
Geçiş Metalleri:
1. d bloku elementleridir.
2. Hepsi metaldirler.
3. Diğer metallerin özelliklerini taşırlar.
4. Özellikle Ag, Cu ve Au dur.
5. Atomik hacimleri küçük ve yoğunlukları yüksektir. Yalnız Skandiyum, İtrium ve Titanın
yoğunlukları 5 ten küçüktür.
6. Civa, çinko ve kadmiyum hariç erime ve kaynama noktaları yüksektir.
7. d bloko elementlerinin çoğu paramanyetik özellik taşırlar. Bunun nedeni d orbitalinde, çiftleşmemiş
elektronlarının olmasıdır. Bu metallerden Fe, Co, Ni diğerlerinden daha çok paramağnetiktir. Bu
duruma özel olarak ferromanyetizm denir.
8. Geçiş metalleri genellikle renkli bileşikler oluştururlar. Renklilik d orbitalinin ışığa karşı duyarlı
olmasından kaynaklanmaktadır.
9. Geçiş metallerinde son yörüngede bulunan s orbitalindeki elektronla beraber, çoğu zaman daha altta
bulunan d orbitalindeki elektronlarda devreye girer ve geçiş metalleri beklenilenin dışında yükseltgenme
basamaklarına sahip olurlar.
ÖRNEK: 30 Zn: 1s2 2s2 2p6 3s2 3p63d10 4s2 (Elektronlar katsayısı yüksek olan orbitalden en
önce kopartılır)
10. Geçiş metallerinden Cu ve Au nun kendilerine has tipik renkleri vardır.
11. Zn un soygaz elektron düzenine geçmesi için 12 elektron vermesi gerekmektedir. Ancak Zn, karlı
bileşiklerinde sadece 2 elektron vererek +2 yükle yüklenirler. Ancak bu durum her zaman böyle olmaz.
Cu+1 ve Cu+2, Cr+2 ve Cr +3, Mn+7 yükseltgenme basamaklarında bulunurlar.
12. Geçiş metalleri CN- ve NO2- gibi anyonlarla kompleks bileşikler oluştururlar.(Fe (CN)6-4,
Co (NO2)6-3, Cu(NH3)4+2)
4. f BLOĞU ELEMENTLERİ
İç Geçiş Elementleri:
1. Periyodik tablonun alt kısmında bulunan ve Lantinitler , Aktinitler olarak adlandırılan elementlerdir.
2. 6. Periyotta bulunan lantan elementini (57La) takip eden seriye, Lantanitler denir.
3. 7. Periyotta bulunan aktinyum elementini (89Ac) takip eden seriye de , Aaktinitler denir.
4. Gerçekte Lantinitler 3B grubu 6.periyot elementleri, Aktinitler 3B grubu 7.periyot elementleridir.
5. İç geçiş elementlerinin tümü metaldir.
6. Paramanyetik özellik gösteren bu elementlerin bileşikleri de paramanyetiktir ve renklidir.
kimyali.wordpress.com
.
METALLER VE ÖZELLİKLERİ
Doğada bilinen elementlerin çoğu metaldir. Metallerin kendilerine özgü ortak özellikleri şunlardır:
Metaller normal koşullarda katı halde bulunur. Yalnız cıva sıvıdır.
Bütün metaller parlaktır(Metalik parlaklık). Işığı yansıtır.
Metaller sert ve yumuşak olabilir. Sert olan metal yumuşak olanı çizer.
Metaller, tel, levha ve toz haline gelebilir. Metaller esnektir; eğilip bükülebilir.
Elektrik ve ısıyı iletir.
Soy metaller (aıtın, platin gibi) dışında diğer metaller havada paslanır.
Kendi aralarında bileşik oluşturamazlar. Alaşım denilen homojen karışımları oluştururlar. Pirinç
(Zn+Cu), Lehim (Pb+Sn) gibi
İki veya daha çok metal birbiriyle molekül oluşturmaz.
Moleküllerin öz kütleleri büyük, erime noktaları yüksektir. Örneğin, demir 1500 0C'de erir.Öz
kütlesi 7,8 g/cm3'tür.
Metaller, daima elektron vererek (+) yüklü iyon olmak ister.
Metallerin çoğuna (Na, Mg, Fe, Zn gibi) asitler etki eder. Bunun sonucunda, tuz oluşur ve hidrojen
gazı açığa çıkar.
Genellikle oksitlerinin sulu çözeltisi baz özelliği gösterir.
Metaller, kendi aralarında da sınıflandırılır:
Soy metaller (altın, gümüş, platin gibi), Soy olmayan metaller (demir, çinko, alüminyum gibi).
AMETALLER VE ÖZELLİKLERİ
Hidrojen, oksijen, azot, kükürt, klor, brom, iyot, elmas, grafit vb. elementler ametaldir.
Ametallerin kendilerine özgü özellikleri şunlardır:
Normal koşullarda katı (karbon, kükürt gibi), sıvı (brom gibi) ve gaz (hidrojen, oksijen, klor gibi)
halinde bulunurlar.
Parlak değillerdir. Renkli veya renksiz olurlar. Işığı kırar veya geçirirler.
Isıyı ve elektriği iyi iletmezler. Çoğu yalıtkandır.
Esnek değillerdir. Tel ve levha haline gelmezler.
Erime noktaları düşük, öz kütleleri küçüktür.
Doğada genel olarak molekül halinde bulunurlar.(H2, O2, N2, Cl2 gibi).
Ametaller, metallerle etkileşerek iyon bileşikleri oluşturur.(NaCl, FeS gibi)
Ametaller, kimyasal olaylarda genel olarak elektron alarak (-) yüklü iyon olur. Bazı hallerde elektron
da verebilir.
Ametaller, ametallerle elektron ortaklığı kurar.
Yarı metallerin özellikleri:
Bazı özellikleri metallere bazı özellikleri de ametallere benzeyen elementlerdir. B, Si, Ge, As, Se, Sb, Te, Po
ve Bi yarı metaldir.
Tümü oda sıcaklığında katı haldedir.
Orta derecede iletkendirler.
Erime ve kaynama sıcaklıkları yüksektir.
Kendi aralarında ve ametallerle yaptıkları bileşiklerde kovalent bağlıdırlar.