BİRİNCİ HAFTA
Termodinamik. Termodinamiğin
0. ve 1. yasaları. Hess yasası.
TERMODİNAMİK
Termo: ısı, dinamik: hareket
kelimelerinden oluşmuştur.
Termodinamik, kimyasal
reaksiyonların ısı alışverişini
inceleyen bilim koludur.
Termodinamikte sıkça kullanılan
terimler:
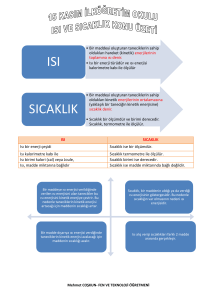
Enerji, İş yapabilme yeteneğidir.
Sıcaklık, ısının akış yönünün bir göstergesidir.
Termodinamikte olayı yaşayan maddelere sistem denir.
Reaksiyonlarda sistem bizzat reaksiyona giren kimyasal
maddelerdir.
Çevre, sistemle temas halinde olan evrenin bir parçasıdır.
İç enerji (E), bir sistemin içinde bulunan tüm atomların,
iyonların veya moleküllerin enerjilerinin toplamıdır.
Cisimlerin sahip olduğu enerji
ölçülmez. Sadece birinin diğerine
göre enerji farkı ölçülebilir.
Termodinamiğin 0. ve I. Kanunu
Sıfırıncı yasa iki ayrı cismin bir üçüncü cisimle
ısıl dengede olmaları durumunda kendi
aralarında da ısıl dengede olacaklarını bildirir.
Üçüncü cisim ile ısıl dengededirler.
Termodinamiğin I. kanunu, evrenin enerjisinin sabit
olduğunu ifade eder ve bu ifade birkaç değişik
şekillerde söylenebilir. Enerji bir halden diğerine
dönüşebilir. Fakat kaybolmaz. Enerji yoktan var
edilemez, vardan yok edilemez. Bir sistemin
enerjisindeki değişme sistem tarafından yapılan
işlem sistem tarafından alınan (yada verilen) ısıya
eşittir. Isı q, iş de w ile gösterildiğinde sistem ve çevre
arasındaki etkileşimde toplam enerji değişimi, E nin
matematik ifadesi şöyle olur:
Kimyasal sistemlerde (elektrokimyasal iş
hariç) sadece gaz sistemlerde basınç x
hacim işi vardır. Bir piston ile sıkıştırılmış
bir gaz ısındığı zaman genişler ve dış
basınca karşı bir iş yapar.
Entalpi (H)
Entalpi, sabit basınçta meydana gelen
işlemlerdeki çevre ile alınıp verilmiş ısı
miktarına eşittir.
H, sabit basınçta, genellikle açık
kaplarda atmosfer basıncında yapılan
reaksiyon ısısıdır:
E, sabit hacimde, kalorimetre
bombasında yapılan reaksiyon ısısıdır.
Reaksiyon Isıları
Bir reaksiyonun ısısı belirli bir sıcaklık
için sabittir. Değişik sıcaklıklarda
reaksiyon ısıları da değişir. Bir
reaksiyonun reaksiyon ısısı o reaksiyon
denkleminin genişletildiği sayı ile
çarpımına, bölündüğü sayı ile bölümüne
eşit olur.
Standart Oluşma Isıları (Heo)
25C (298 K) ve 1 atmosferde belirlenen entalpi
değişimine standart entalpi değişimi adı verilir ve
H ile gösterilir. Bileşiklerin 298 K de 1 atm de
elementlerinden oluşma entalpisine standart oluşma
entalpisi denir ve Heo (delta H sıfır
elementlerinden oluşma) ile gösterilir.
Bağ enerjisi
Bileşiği meydana getiren atomlar arasında çok sağlam
bağlar olduğunu biliyoruz. Bu bağların oluşumu
esnasında dışarıya verilen enerji, bağları kırmak için
verilmesi gereken enerjiye eşittir. Kimyasal bağları
kırmak için verilmesi gereken enerjiye bağ enerjisi adı
verilir. Bağ kırılması (endotermik) (+) işaretli reaksiyon
ısısına sahip bir reaksiyon, bağ oluşumu (ekzotermik)(-)
işaretli reaksiyon ısısına sahip bir reaksiyondur.
Yanma Isısı
Genellikle oksijenle olan
reaksiyonlara yanma reaksiyonları
denildiği için reaksiyon ısılarına
yanma ısısı (H) adı verilir. Bunlar
yakıt olarak kullanılan organik
maddelerde bilhassa önemlidir.
Hess Kanunu (Reaksiyon
Isılarının Hesaplanması)
Birtakım reaksiyon adımlarından geçerek yürüyen bir net
reaksiyonun ısısı, ara reaksiyon ısıları bilindiği takdirde
hesap yoluyla bulunabilir. Termo- kimyanın bu en önemli
buluşu 1840 de Hess tarafından birtakım deneyler
sonucunda ortaya konulmuştur. Hess Kanunu bir
kimyasal reaksiyonda ilk halden son hale geçişteki
reaksiyon ısısı reaksiyonun gidiş yoluna bağlı değildir der.
Reaksiyon ister bir adımda tamamlansın, ister birçok ara
adımlardan geçerek tamamlansın, reaksiyon ısısı aynıdır
şeklinde de ifade edilebilir.
Karbon ve oksijenden karbondioksit
oluşumu bir adımda veya iki adımda
olabilir.
C(grafit) +
O2 (g) , (25o C, 1 atm)
2.a
Ha = -110.5 kJ
CO (g)
1/2 O 2
(g)
1. Ho = -393.5 kJ
2.b Hb = -283 kJ
CO2 (g), (25o C, 1 atm)
Reaksiyon Isılarının Ölçülmesi
Bir ısının alındığı veya verildiği, sıcaklık
değişmesiyle anlaşılır. Sıcaklığının yükselmesi
o cismin ısı aldığını sıcaklığının düşüşü de o
cismin ısı verdiğini gösterir. Bir cismin son
durumundaki sıcaklığıyla ilk andaki sıcaklığı
arasındaki fark (T) ısı miktarının
hesaplanmasında kullanılır.
Isı kapasitesi
Faz geçişlerinin olmadığı sıcaklık aralıklarında
spesifik ısı ve molar ısı kapasitesi
olmak üzere iki türlü tanımlanır:
1) Spesifik Isı, 1 gram maddeyi 1K veya 1C yükseltmek için
gerekli olan ısı miktarıdır (J/Kg): Bu durumda bir cismin
aldığı veya verdiği ısı iki farklı şekilde hesaplanabilir:
Isı (q) = mol sayısı x molar ısı kapasitesi x T
veya
Isı(q) = kütle x spesifik ısı x T
2) Molar ısı kapasitesi, bir mol maddeyi 1K veya 1C
yükseltmek için gerekli olan ısı miktarıdır. Birimi J/K mol dür.
Kalorimetreler
Kalorimetreler reaksiyon ısılarını ölçmeye yarayan
aletlerdir. Gerek sabit hacimde (kapalı kaplarda), gerek
sabit basınçta (açık kaplarda, atmosfer basıncında)
reaksiyon ısıları ölçülerek E veya H deneysel olarak
bulunabilir. Her iki halde önce kalorimetrenin ısı
kapasitesi deneysel olarak belirlenmelidir. Bunun için
elektrikli ısıtıcı ile belirli bir süreyle kalorimetre ısıtılır
veya belirli bir sıcaklığa ısıtılmış bir metal çubuk
kalorimetreye konarak sıcaklık yükselmesi ölçülür. Bütün
mesele bilinen belirli bir miktar ısının kalorimetreye
verilerek sıcaklık yükselmesinin ölçülmesidir.
Kalorimetre bombası
Kalorimetre bombasında
reaksiyon ısıları iç enerji
değişmeleri (E) olarak
ölçülür.
Çözelti kalorimetreleri
Çözelti kalorimetrelerinde reaksiyon açık
havada (sabit basınçta) yapıldığından,
reaksiyon ısısı, H olarak ölçülür: H = qp